© Yue Pei Wang, 2019
Rôle de nouveaux marqueurs osseux dans la
physiopathologie des troubles minéraux et osseux en
insuffisance rénale chronique
Mémoire
Yue Pei Wang
Maîtrise en sciences cliniques et biomédicales - avec mémoire
Maître ès sciences (M. Sc.)
Rôle de nouveaux marqueurs osseux dans la
physiopathologie des troubles minéraux et osseux
en insuffisance rénale chronique
Mémoire
Yue Pei Wang
Sous la direction de :
Dr Fabrice Mac-Way, directeur de recherche
Dr Mohsen Agharazii, codirecteur de recherche
iii
Résumé
L’insuffisance rénale chronique (IRC) est une maladie chronique prévalente et comprenant plusieurs comorbidités. Les complications les plus importantes de l’IRC sont les fractures et la mortalité d’origine cardiovasculaire. Ces dernières ont été regroupées sous l’entité du trouble minéral et osseux en insuffisance rénale chronique (TMO-IRC). La physiopathologie du TMO-IRC revêt un intérêt particulier dans l’optique de mieux comprendre et prévenir les complications des patients IRC. Récemment, les niveaux sanguins de nouveaux marqueurs osseux [sclérostine, dickkopf-related protein 1 (DKK1),
fibroblast growth factor 23 (FGF23) et α-klotho], inhibiteurs de la voie de signalisation
Wnt, ont été associés à des issues de santé osseuse et vasculaire et pourraient donc jouer un rôle important dans le TMO-IRC.
Les objectifs de ce mémoire sont d’investiguer le rôle de ces nouveaux marqueurs osseux dans 1) le TMO-IRC chez les patients greffés et 2) le TMO-IRC chez des patients hémodialysés en lien avec le tissu adipeux de la moelle osseuse (TAM).
Les résultats de nos travaux montrent que les marqueurs osseux baissent après la transplantation rénale et suggèrent que l’évolution de la sclérostine et du FGF23 est associée à certains paramètres de rigidité artérielle (vélocité de l’onde de pouls carotide-fémorale et vélocité de l’onde de pouls carotide-radiale). De plus, nous avons montré la faisabilité de caractériser le TAM chez une cohorte de dialysés. Nos analyses suggèrent également que le TAM est corrélé de manière inverse avec le DKK1 sérique.
Bref, nos résultats suggèrent que ces nouveaux marqueurs osseux pourraient jouer un rôle important dans la physiopathologie du TMO-IRC, et ce, autant chez les patients IRC que les greffés, potentiellement par des mécanismes différents. Une meilleure compréhension des mécanismes d’action de ces marqueurs osseux pourrait ouvrir la voie à une meilleure prise en charge des patients souffrant de TMO-IRC.
iv
Abstract
Chronic kidney disease – mineral and bone disorders (CKD-MBD) leads to increased comorbidity and mortality due to heightened fractures rate and cardiovascular complications. Understanding the mechanisms of CKD-MBD’s pathophysiology is important in order to eventually propose new therapies that may prevent or treat bone and vascular complications. Recently, circulating levels of new bone markers [sclerostin, dickkopf-related protein 1 (DKK1), fibroblast growth factor 23 (FGF23) and α-klotho], which are Wnt pathway’s inhibitors, have been associated with bone and vascular health outcomes in CKD population and could therefore play an important role in CKD-MBD.
The objectives of this master thesis are to investigate the role of these new bone markers 1) in CKD-MBD among kidney transplanted patients and 2) in CKD-MBD among dialysis patients in relation to bone marrow adipose tissue (MAT).
Our results show that bone markers lower after kidney transplantation. We observe an association between circulating sclerostin and FGF23 levels evolution and arterial stiffness parameters (carotid-femoral pulse-wave velocity and carotid-radial pulse-wave velocity) after kidney transplant. Moreover, we show the feasibility to characterize MAT in a dialysis cohort and our results suggest an inverse correlation between serum DKK1 levels and MAT.
In conclusion, our results show that these new bone markers could play an important role in CKD-MBD both in kidney transplanted and hemodialysis patients likely through different mechanisms. A better understanding of the role of these Wnt inhibitors in CKD-MBD could lead to a better management approach of patients with CKD-MBD.
v
Table des matières
Résumé ... iii
Abstract ... iv
Liste des tableaux ... viii
Liste des figures ... ix
Liste des abréviations ... x
Remerciements ... xiii
Avant-propos ... xv
Introduction ... 1
Chapitre 1 Le rein et l’insuffisance rénale chronique ... 2
1.1 Les fonctions biologiques du rein ... 2
1.2 L’insuffisance rénale chronique ... 4
1.2.1 Définition de l’insuffisance rénale chronique ... 4
1.2.2 Manifestations cliniques et complications ... 5
1.3 Le traitement de l’insuffisance rénale chronique ... 6
1.3.1 La pharmacologie ... 6
1.3.2 La dialyse ... 7
1.3.3 La greffe rénale ... 7
Chapitre 2 Le TMO-IRC ... 8
2.1 La santé osseuse dans le TMO-IRC ... 9
2.1.1 La PTH et le remodelage osseux ... 13
2.1.1 L’ODR à remodelage élevé ... 13
2.1.2 L’ODR à remodelage lent ... 14
2.2 La santé vasculaire dans le TMO-IRC ... 15
2.2.1 Les paramètres de rigidité artérielle ... 16
2.2.2 Les paramètres de l’étude de l’onde de pouls... 17
2.3 Le TMO-IRC après la greffe rénale ... 19
Chapitre 3 Les inhibiteurs de la voie Wnt dans le TMO-IRC ... 21
3.1 Signalisation de la voie Wnt/β-caténine ... 21
3.2 Les inhibiteurs de la voie Wnt ... 23
3.3 Les inhibiteurs de la voie Wnt et la santé osseuse ... 23
3.3.1 La sclérostine ... 23
3.3.2 Le DKK1 ... 24
3.3.3 Le FGF23 et l’α-klotho ... 24
3.4 Les inhibiteurs de la voie Wnt et la santé vasculaire ... 25
3.4.1 L’α-klotho et la santé vasculaire... 26
vi
4.1 Les caractéristiques du tissu adipeux de la moelle osseuse ... 27
4.1.1 Le TAM se distingue des autres tissus adipeux ... 27
4.1.2 Les deux sous-types de TAM ... 28
4.2 Le TAM dans le TMO-IRC ... 28
4.3 Les inhibiteurs de la voie Wnt et le TAM ... 29
Chapitre 5 Hypothèses et objectifs de recherche ... 30
5.1 Hypothèse ... 30
5.2 Objectifs généraux et spécifiques de recherche ... 30
Chapitre 6 Méthodologies de recherche ... 31
6.1 Devis et population des projets de recherche ... 31
6.1.1 Chez les patients greffés ... 31
6.1.2 Chez les patients dialysés ... 31
6.2 Collecte de données ... 32
6.2.1 Données cliniques, démographiques et pharmacologiques ... 32
6.2.2 Données biochimiques ... 32
6.2.3 Données hémodynamiques ... 32
6.2.4 Imagerie ... 33
6.3 Analyses statistiques ... 33
Chapitre 7 Inhibiteurs de la voie Wnt en lien avec les paramètres phosphocalciques et la santé vasculaire chez les greffés rénaux ... 34
RÉSUMÉ ... 36
ABSTRACT ... 37
INTRODUCTION ... 38
MATERIAL AND METHODS... 39
Study design and population ... 39
Mineral and bone parameters ... 39
Arterial stiffness parameters ... 40
Statistical analysis ... 40
RESULTS ... 41
Population characteristics ... 41
Levels of Wnt inhibitors significantly decrease after kidney transplant ... 41
Associations between arterial stiffness parameters and Wnt inhibitors levels after KTx ... 41
Kidney transplantation modify the associations between mineral metabolism parameters and Wnt inhibitors levels ... 42
vii
ACKNOWLEDGEMENTS ... 47
REFERENCES ... 48
TABLES ... 53
FIGURES ... 55
Chapitre 8 Caractérisation du tissu adipeux de la moelle osseuse et de la densité minérale osseuse chez les patients hémodialysés avec la tomodensitométrie ... 59
RÉSUMÉ ... 61
ABSTRACT ... 62
INTRODUCTION ... 63
MATERIAL AND METHODS... 64
Study design and population ... 64
Assessment of mineral parameters and Wnt inhibitors ... 64
CT-scan imaging protocol ... 64
Statistical analyses ... 65
RESULTS ... 66
Patients’ characteristics ... 66
MAT and bone parameters ... 66
Adipose and muscular tissue composition ... 66
Correlations between MAT, bone, adipose and muscle tissue parameters, lipid profile as well as Wnt inhibitors levels ... 66
DISCUSSION ... 67 ACKNOWLEDGEMENTS ... 70 REFERENCES ... 71 LEGENDS TO FIGURES ... 75 TABLES ... 76 FIGURES ... 81
Chapitre 9 Complément de discussion ... 85
9.1 Le rôle des marqueurs osseux en santé osseuse ... 86
9.1.1 Chez les hémodialysés ... 86
9.1.2 Chez les greffés ... 86
9.2 Le rôle des marqueurs osseux en santé vasculaire ... 87
Conclusion ... 88
Bibliographie ... 89
Annexe I ... 102
viii
Liste des tableaux
Tableau 1.1 Stades de l’insuffisance rénale chronique ... 5
Tableau 1.2 Manifestations cliniques et complications les plus fréquentes de l’IRC ... 5
Tableau 2.1 Pathologie et diagnostic du remodelage osseux en IRC ... 12
ix
Liste des figures
Figure 1.1 Anatomie macroscopique du rein ... 2
Figure 1.2 Dynamique de la réabsorption tubulaire du néphron ... 3
Figure 2.1 Désordres biochimiques du métabolisme osseux en IRC ... 9
Figure 2.2 Rôle du système RANK-RANKL-OPG dans le remodelage osseux ... 10
Figure 2.3 Système de classification TMV (turnover, mineralization, volume) de l’histomorphométrie osseuse ... 12
Figure 2.4 Comparaison entre l’athérosclérose et l’artériosclérose ... 16
Figure 2.5 Physiologie des ondes de pouls artériels ... 18
Figure 2.6 Morphologie de l’onde de pouls ... 19
x
Liste des abréviations
AIx index d’augmentation
APC adenomatous polyposis coli
ARN acide ribonucléique
AVC accident vasculaire cérébral
CK1 caséine kinase 1
CSM cellule souche mésenchymateuse
DCT distal convuluted tubule
DFGe débit de filtration glomérulaire estimé
DKK1 dickkopf-related protein 1
DMO densité minérale osseuse
Dvl protéine Disheveled
DXA absorption biphotonique à rayon X
ELISA enzyme-linked immunosorbent assay
EPO érythropoïétine
FC fréquence cardiaque
FGF23 fibroblast growth factor 23
FMJ fraction de moelle jaune
Fz frizzled
GSK3β glycogène synthase kinase
HPT Hyperparathyroïdie
ICIS institut canadien d’information sur la santé
IRA insuffisance rénale aiguë
IRC insuffisance rénale chronique
KDIGO Kidney Disease: Improving Global Outcomes
LRP lipoprotein receptor-related protein
MCAS maladie cardiaque athérosclérotique
M-CSF macrophage colony-stimulating factor 1
MJ moelle jaune (ou adipeuse)
MOs marqueurs osseux
MR moelle rouge (ou hématopoïétique)
MVAS maladie vasculaire athérosclérotique
ODR ostéodystrophie rénale
OPG ostéoprotégérine
P1NP procollagen type 1 N-terminal propeptide
PA pression augmentée
PCT proximal convoluted tubule
PP pression pulsée
PPamp amplification de la pression pulsée
PPARγ-2 récepteur activé par les proliférateurs de peroxysomes gamma-2
PPC pression pulsée centrale
PPP pression pulsée périphérique
PTH parathormone
RANK récepteur activateur de NF-κB
xi
SFRPs secreted frizzled-related proteins
TA tension artérielle
TABl tissu adipeux blanc
TABr tissu adipeux brun
TAM tissu adipeux de la moelle osseuse
TAV tissu adipeux viscéral
TAS tissu adipeux sous-cutané
TDM tomodensitométrie
TMO-IRC trouble minéral et osseux en insuffisance rénale chronique
TMV Turnover, mineralization, volume
TRAP5b tartrate-resistant acid phosphatase 5b
USRDS United States Renal Disease Data System
VOP vélocité de l’onde de pouls
VOP-cf vélocité de l’onde de pouls carotide-fémorale (centrale)
xii
« Why not ? »
xiii
Remerciements
Why not? ...
Beaucoup de questions en science ont commencé par un «pourquoi» ou un «comment», et dans cette quête des réponses, certaines découvertes fortuites mèneront vers des «pourquoi pas» et ont été promises à être des découvertes encore plus grandes.
Ce cheminement académique, ce défi, cette maîtrise, a été le fruit d’un «pourquoi pas», et m’a apporté tellement plus que je l’espérais. Moi qui me lançais dans un stage d’été toute naïvement sans comprendre la signification des valeurs p, sans connaître les complications de l’insuffisance rénale et avec une phobie de lire des articles scientifiques longs et ennuyants. J’en suis ressortie en côtoyant des GEE, un mémoire sur le trouble minéral et osseux en insuffisance rénale chronique et des centaines d’articles scientifiques lus avec intérêt et désir d’apprendre. Ce mémoire est l’aboutissement d’apprentissages découlant de sentiment d’accomplissement parfois, et de découragement d’autres fois. Je désire consacrer ces deux pages de mon mémoire à souligner l’appui de ces gens qui ont transformé mes moments de découragement en sentiment d’accomplissement.
Tout d’abord, je tiens remercier le dévouement, la disponibilité et la compétence de mon directeur de recherche Dr Mac-Way. Mes accomplissements sont définitivement impossibles sans ses réponses de courriel rapides, ses relectures de mes travaux parfois même hors des jours ouvrables, ses encouragements et son initiative d’organiser des sorties dans le Vieux-Québec avec notre belle équipe de laboratoire. Je veux également remercier mon codirecteur de recherche Dr Agharazii pour ses précieux conseils, son expertise et son humour bien apprécié. Je ne peux absolument pas passer sous silence la contribution de l’équipe de recherche : Visal avec son travail minutieux et exemplaire ainsi que sa personnalité unique si agréable à côtoyer, France avec sa collaboration chaleureuse qui me fait penser à une petite maman, l’équipe de dialyse à domicile et d’hémodialyse de l’Hôtel -Dieu de Québec qui m’ont beaucoup aidée dans ma collecte de données. De plus, mes journées et mes heures de dîner n’auraient pas été aussi agréables et productives (ou pas) sans mes «colocataires de bureau» pendant les 2 dernières années : Louis-Charles, Sarah-Kim, Abou, Félix, Nada, Simon, Marie-Pier, Gabrielle, Heather, Stéphanie, Catherine,
xiv
François, Karine, Olivier, Sylvain et Dr Larivière. Une petite mention spéciale à Louis-Charles, Abou et Catherine qui m’ont dépannée tant de fois lorsque je faisais face à des questionnements par rapport à des analyses statistiques. De surcroît, je veux remercier les précieux commentaires des membres du jury qui m’ont permis de soumettre une version finale améliorée de mon mémoire.
Merci également à mes parents et amis qui m’ont soutenue tout au long de ma maîtrise ainsi qu’à ma petite sœur Julia, mon petit rayon de soleil, qui m’a divertie et parfois dérogée de ma tâche pendant cette même période.
Enfin, je tiens à souligner l’appui des organismes subventionnaires, l’Institut de recherche en santé du Canada (IRSC), l’Université Laval et la fondation du CHU de Québec, sans qui la réalisation de mes projets n’aurait pas été possible.
Merci à tout le monde qui m’a permis de faire une grande découverte fortuite et qui m’a permis de vivre cette aventure hors du commun.
xv
Avant-propos
Ce mémoire a pour objectif d’approfondir la physiopathologie du trouble minéral et osseux en insuffisance rénale chronique (TMO-IRC) en y étudiant le rôle de nouveaux marqueurs osseux (MOs). Les résultats sont présentés en deux parties par deux projets réalisés au cours de mes études de 2e cycle en sciences cliniques et biomédicales.
Le premier projet s’intéressait aux MOs dans une population de greffés rénaux, chez qui la fonction rénale est théoriquement rétablie par la greffe. Plus précisément, l’objectif principal était de décrire l’évolution des niveaux de MOs avant et après la greffe. En outre, cette étude longitudinale avait comme objectif secondaire de décrire les associations entre les niveaux de MOs à travers le temps post-greffe et l’évolution du TMO-IRC, reflétée par la rigidité artérielle, les paramètres phosphocalciques et les marqueurs de remodelage osseux. Les résultats de ces travaux sont présentés sous la forme d’un article (chapitre 7).
Dans le même ordre d’idées, le deuxième projet s’intéressait cette fois aux associations de ces MOs avec le tissu adipeux de la moelle osseuse (TAM), dont le rôle potentiel en TMO-IRC a été récemment suggéré dans la littérature. Pour ce faire, une étude pilote a été réalisée afin d’évaluer la faisabilité de caractériser le TAM et différents paramètres tissulaires (osseux, adipeux et musculaires) en une seule et courte acquisition de tomodensitométrie dans une population de dialysés. Des corrélations ont pu être faites par la suite entre les MO, le TAM et les paramètres tissulaires. Les résultats de ces travaux sont présentés sous la forme d’un article (chapitre 8).
Ayant contribué à toutes les étapes de ces deux projets, je suis première auteure sur les deux manuscrits présentés dans ce mémoire. La contribution des co-auteurs est décrite dans l’avant-propos précédant chaque chapitre concerné.
Hormis les deux articles faisant partie du présent mémoire, pendant mon cheminement dans l’équipe de recherche de Dr Mac-Way, j’ai eu l’opportunité de soumettre un autre
xvi
article en tant que première auteure et de contribuer à d'autres projets de recherche qui sont soit publiés ou en cours de soumission, et qui sont présentés ci-dessous.
I. Type of Subtotal Parathyroidectomy and Evolution of Parathyroid Hormone Levels in End-Stage Renal Disease Patients
Auteurs: Yue-Pei Wang, Aboubacar Sidibé, Octave Roussy, Louis-Charles Desbiens, Alain Gilbert, Fabrice Mac-Way
Journal: BMC Nephrology Statut de l’article : En révision
II. Fracture risk in dialysis and kidney transplanted patients: a systematic review
(annexe I)
Auteurs: Aboubacar Sidibé, David Auguste, Louis-Charles Desbiens, Catherine Fortier, Yue-Pei Wang, Sonia Jean, Lynne Moore, Fabrice Mac-Way
Journal: Journal of Bone and Mineral Research Plus (JBMRPlus) Statut de l’article : Publié en juillet 2018
III. FGF23-klotho axis, bone fractures and arterial stiffness in dialysis: a case-control study (annexe II)
Auteurs: Louis-Charles Desbiens, Aboubacar Sidibé,Roth-Visal Ung, Catherine Fortier, Michaël Munger, Yue-Pei Wang, Sarah-Kim Bisson, Mohsen
Agharazii, Karine Marquis, Fabrice Mac-Way Journal: Osteoporosis International
Statut de l’article: Publié en juin 2018
IV. Evolution of bone and mineral metabolism parameters according to the type of subtotal parathyroidectomy in kidney transplanted patients
Auteurs : Félix Lavigne, Yue-Pei Wang, Aboubacar Sidibé, Louis-Octave Roussy, Alain Gilbert, Fabrice Mac-Way
1
Introduction
Au 21e siècle, on estime que la prévalence de l’insuffisance rénale chronique (IRC) atteint 12,5% au Canada et 13,1% aux États-Unis. [1, 2] Parmi ceux-ci, selon l’institut canadien d’information sur la santé (ICIS), presque une personne IRC sur dix est en stade terminal. [3] Les fractures et les événements cardiovasculaires comptent parmi les complications les plus importantes de l’IRC. [4, 5] [Annexe I] Ces complications sont regroupées et définies sous le nom du trouble minéral et osseux de l’insuffisance rénale chronique (TMO-IRC), source de surmortalité cardiaque non expliquée par les facteurs de risques traditionnels dans la population insuffisante rénale chronique. [5-8]
Les travaux récents soulignent le rôle potentiel de certains marqueurs osseux (MOs) [sclérostine, dickkopf-related protein 1 (DKK1), fibroblast growth factor 23 (FGF23) et son corécepteur α-klotho], inhibiteurs de la voie de signalisation Wnt, dans la physiopathologie du TMO-IRC. En effet, il est maintenant connu que la diminution de la fonction rénale est associée à une augmentation de sclérostine, DKK1 et FGF23 ainsi qu’à une diminution de l’α-klotho. [9-11] De plus, les études montrent que les débalancements de ces MOs semblent associés à la fragilisation osseuse et à la calcification vasculaire qu’on retrouve chez les patients en IRC. [12-17] [Annexe II] Par ailleurs, quelques rares études montrent un niveau plus bas de sclérostine et de FGF23 post-greffe. [18-20] Dans le même ordre d’idées, on observe que le rétablissement de la fonction rénale par la greffe améliore le pronostic des patients en lien avec le TMO-IRC en diminuant le risque fracturaire de la hanche et l’incidence d’événements cardiovasculaires. Cette amélioration est toutefois loin d’être parfaite comparativement à la population en bonne santé. [21-23] [Annexe I] Ainsi, les rôles exacts de ces MOs dans la progression du TMO-IRC et le rétablissement du TMO-IRC après la greffe rénale n’est toujours pas complètement élucidé.
L’approfondissement du rôle des MOs dans le TMO-IRC est primordial si on veut prévenir et potentiellement guérir les complications morbides et mortelles de l’IRC autant chez les patients dialysés que chez les patients greffés.
2
Chapitre 1 Le rein et l’insuffisance rénale chronique
1.1
Les fonctions biologiques du rein
Le rein est un organe qui se spécialise dans l’homéostasie du corps humain en régulant le milieu intérieur (volume, tonicité, composition) et en sécrétant certaines hormones. [24] Le rein est divisé macroscopiquement en deux parties : le cortex et la médulla. La médulla est composée de 8 à 18 pyramides qui se terminent par une structure anatomique appelée la papille. La papille est quant à elle composée d’une vingtaine d’ouvertures où aboutissent des tubules collecteurs. L’urine est formée par des unités fonctionnelles appelées néphrons et passe par ces tubules collecteurs pour être collectée par les calices, puis le bassinet, et est finalement acheminée à la vessie par l’uretère (voir figure 1.1). [25]
Figure 1.1 Anatomie macroscopique du rein Figure tirée avec permission de Boer et al [26]
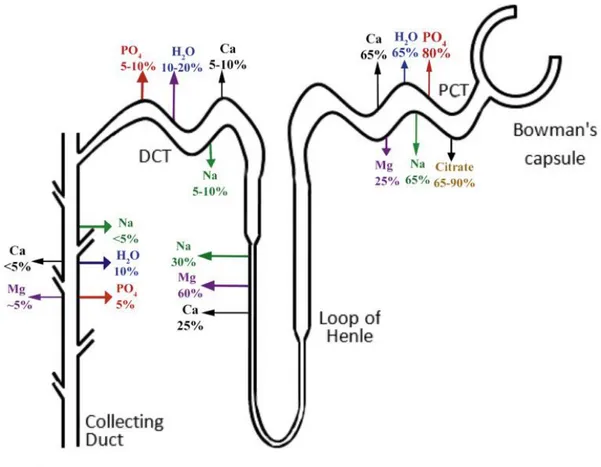
Le néphron est composé de glomérules et de tubules (tubule contourné proximal, anse de Henle, tubule contourné distal) qui terminent leur course dans des tubules collecteurs. [25] La régulation du milieu intérieur passe par la filtration du sang par les glomérules, et ce, à haut débit, soit environ 20% du flot sanguin cardiaque. [27] Tout le long des tubules du néphron (voir figure 1.2), l’eau et des électrolytes sont absorbés et/ou excrétés pour maintenir le volume et la tonicité; les déchets comme l’urée et la créatinine sont excrétés dans l’urine afin de purifier le milieu intérieur. [28]
3
Figure 1.2 Dynamique de la réabsorption tubulaire du néphron
DCT : distal convoluted tubule; PCT : proximal convoluted tubule
Figure tirée avec permission de Shafiee et al [29]
Le rein assure également plusieurs fonctions endocriniennes. En effet, certaines hormones rénales servent à réguler le débit sanguin rénal et la tension artérielle (TA) systémique. Par exemple, l’angiotensine II et l’arginine vasopressine diminuent le débit rénal et augmentent la TA; les prostaglandines et les kinines font l’inverse. De plus, les fibroblastes péritubulaires du cortex rénal sécrètent également l’érythropoïétine (EPO), une hormone qui stimule la production de globules rouges au sein de la moelle osseuse en réponse à une hypoxie tissulaire du rein. Enfin, le rein est également un organe qui participe à l’activation de la vitamine D3 par la production de la 1α-hydroxylase. De fait, la vitamine D3 provient de l’alimentation ou de sa synthèse par les rayons UV du soleil. L’activation de cette vitamine passe par une hydroxylation au niveau du foie par la 25-hydroxylase et une autre au niveau du rein par la 1α-25-hydroxylase pour finalement devenir la 1,25(OH)2 vitamine D3 (le calcitriol). [28] Une fois activée, le calcitriol favorise la réabsorption de calcium et de phosphate au niveau intestinal et peut réguler la formation et
4
résorption osseuse. De plus, le calcitriol pourrait également avoir un rôle dans la modulation de la réponse immunitaire, la reproduction, la fonction cardiovasculaire et la différentiation/prolifération cellulaire. [30]
1.2
L’insuffisance rénale chronique
L’IRC est une maladie chronique très prévalente dans le monde en plus de coexister avec plusieurs comorbidités. Selon les estimations de différentes études du 21e siècle, au Canada, elle touche environ 3 millions de personnes; aux États-Unis, environ 45 millions; et en Chine, environ 120 millions. [1, 31] Selon le United States Renal Disease Data System (USRDS), la prévalence d’IRC continue d’augmenter d’environ 20 000 cas par année aux États-Unis. [32]
1.2.1 Définition de l’insuffisance rénale chronique
Alors que l’insuffisance rénale aiguë (IRA) se présente par une diminution de la fonction rénale (augmentation de la créatinine, augmentation de l’urée, troubles électrolytiques, diminution du débit urinaire, etc.) sur quelques heures ou quelques jours [33], l’IRC résulte d’un stress plus chronique se traduisant par des dommages menant d’abord à une hyperfiltration, puis à une perte de fonction irréversible des néphrons et une atrophie rénale [34, 35]. L’IRC résulte la plupart du temps des dommages aux néphrons d’étiologies très variées. Les causes les plus fréquentes de l’IRC sont le diabète, les glomérulonéphrites (d’ordre infectieux), l’hypertension et les maladies auto-immunes. [36]
L’IRC se traduit cliniquement par une diminution du débit de filtration glomérulaire estimé (DFGe) qui se base sur la clairance de la créatinine. Plusieurs équations sont disponibles pour estimer le DFGe. La plus utilisée et validée au Canada est l’équation du CKD-EPI, qui tient compte de la créatinémie, de l’âge, du sexe et de l’ethnie. [37, 38] Les cinq stades d’IRC (tableau 1.1) sont classifiés par les guides de pratique du Kidney
Disease: Improving Global Outcomes (KDIGO) selon le DFGe. [6] Le stade terminal de
l’IRC est caractérisé par une accumulation de toxines urémiques et des débalancements électrolytiques et volémiques entraînant le décès si la fonction rénale n’est pas compensée ou remplacée par certaines thérapies détaillées à la section 1.3. [36]
5
Tableau 1.1 Stades de l’insuffisance rénale chronique
Stade Description DFGe (mL/min/1,73 m2)
1 Fonction rénale normale ≥ 90
2 Fonction rénale légèrement diminuée 60-89
3a Fonction rénale légèrement à modérément diminuée 45-59
3b Fonction rénale modérément à sévèrement diminuée 30-44
4 Fonction rénale sévèrement diminuée 15-29
5 IRC terminale < 15 ou dialyse
IRC : insuffisance rénale chronique; DFGe : débit de filtration glomérulaire estimé
Le calcul du DFGe est valide dans une population avec une forme corporelle standard, c’est-à-dire en l’absence d’état extrême de dénutrition ou d’obésité ou encore d’amputation. De plus, il y a un déclin naturel de la fonction rénale avec l’âge. En effet, à partir de la trentaine, le DFGe diminue d’environ 1 mL/min/1,73m2/an, c’est-à-dire que plusieurs personnes très âgées peuvent souffrir d’IRC légère de manière physiologique. [36]
1.2.2 Manifestations cliniques et complications
Étant donné le large éventail des fonctions du rein, l’IRC terminale peut compromettre l’équilibre d’une variété d’éléments dans le corps humain. Le tableau 1.2 résume les manifestations cliniques qu’on peut retrouver en IRC ainsi que les complications les plus fréquentes de chaque système. [36] La première cause de mortalité chez les patients IRC est d’ordre cardiovasculaire. [32] Cette complication, comprise dans l’entité du trouble minéral TMO-IRC, est détaillée dans le chapitre suivant.
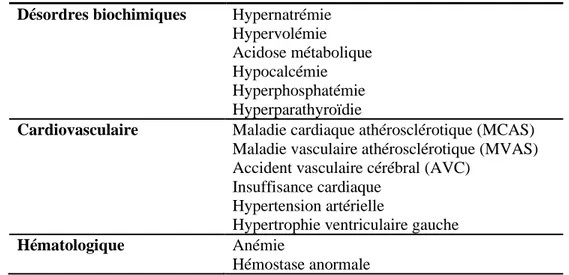
Tableau 1.2 Manifestations cliniques et complications les plus fréquentes de l’IRC Désordres biochimiques Hypernatrémie
Hypervolémie Acidose métabolique Hypocalcémie Hyperphosphatémie Hyperparathyroïdie
Cardiovasculaire Maladie cardiaque athérosclérotique (MCAS) Maladie vasculaire athérosclérotique (MVAS) Accident vasculaire cérébral (AVC)
Insuffisance cardiaque Hypertension artérielle
Hypertrophie ventriculaire gauche
Hématologique Anémie
6
Neuro-musculo-squelettique Fractures Paresthésies
Syndrome des jambes sans-repos Faiblesse musculaire
Désordres légers de concentration et de mémoire Troubles légers du sommeil
Gastrointestinal Goût métallique Ulcères
Constipation
Endocrinien Intolérance au glucose légère Hypogonadisme
Dermatologique Prurit
Hyperpigmentation
1.3
Le traitement de l’insuffisance rénale chronique
Le traitement de l’IRC se base sur la gestion des causes et des complications, comme une meilleure gestion du diabète, le traitement de lithiases urinaires ou encore la correction des troubles électrolytiques. Aucun médicament à ce jour ne peut renverser l’IRC. La dialyse peut redonner artificiellement une fonction rénale au patient, mais la greffe, chez les gens qui y répondent bien, est le seul traitement définitif de l’IRC. Encore là, le renversement des complications de l’IRC n’est pas garanti. [36] L’IRC est donc une maladie chronique lourde pour la santé publique, mais plusieurs traitements sont offerts pour réduire considérablement son impact sur la vie du patient.
1.3.1 La pharmacologie
Le traitement pharmacologique de l’IRC est avant tout symptomatique et adapté selon les complications du patient. Par exemple, le contrôle de l’hypertension doit être optimisé afin de réduire la protéinurie et diminuer la mortalité cardiovasculaire. Notons que le dosage de plusieurs médicaments doit être ajusté étant donné la modification dans le taux d’excrétion par les reins s’il y a lieu. Les anti-inflammatoires non-stéroïdiens sont à éviter en raison de leur impact néfaste sur la fonction rénale en IRC. L’anémie doit être traitée à l’aide d’une substitution de l’EPO par des composés synthétiques. Les impacts sur le métabolisme phosphocalcique doivent être contrôlés par des suppléments en calcium et vitamine D, ainsi que des chélateurs de phosphore. [36, 39]
7
1.3.2 La dialyse
Les lignes de pratique actuelles suggèrent de débuter la dialyse lorsque le patient présente des signes et symptômes sévères d’urémie, une détérioration du statut nutritionnel, un contrôle de statut hydrique réfractaire ou encore un DFGe inférieur à 6mL/min/1,73 m2. [40] Le principe général de la dialyse est de filtrer le sang de ses déchets à l’aide un système externe au corps humain. Par contre, la dialyse ne remplace pas ses fonctions endocriniennes, d’où l’importance de la pharmacologie concomitante. Il existe deux types de dialyse : l’hémodialyse et la dialyse péritonéale. L’hémodialyse est la plus répandue et nécessite des séances d’environ 4h, trois fois par semaine, alors que la dialyse péritonéale a l’avantage d’être réalisée à domicile, mais à une fréquence quotidienne et avec un plus haut risque de péritonite. L’hémodialyse nécessite la création d’une fistule artério-veineuse chez le patient, ce qui permet de filtrer le sang à l’aide de la diffusion des solutés du sang à travers une membrane semi-perméable qui sépare la circulation sanguine d’une solution de dialysat avec des concentrations de solutés ajustables. La dialyse péritonéale repose sur des principes semblables. Toutefois, le péritoine, une membrane naturelle recouvrant la cavité abdominale, sert de filtre, et la cavité abdominale sert de réservoir à dialysat. [3, 41]
1.3.3 La greffe rénale
La greffe rénale est le traitement de choix de l’IRC et permet globalement une amélioration de la qualité de vie et de l’espérance de vie comparativement aux patients en dialyse. La greffe peut provenir d’un donneur cadavérique ou vivant si le profil immunologique concorde. Or, selon le registre canadien des insuffisances et des transplantations d’organe, environ 2% des patients sur la liste d’attente de donneurs cadavériques décéderont durant l’attente. [3] De plus, une thérapie immunosuppressive à long terme est nécessaire pour éviter les rejets de greffons. [42]
8
Chapitre 2 Le TMO-IRC
En 2006, l’organisation KDIGO a regroupé un continuum de complications importantes de l’IRC sous le terme du TMO-IRC. De fait, les déséquilibres biochimiques du métabolisme osseux causés par la diminution de la fonction rénale engendrent des anomalies dans la morphologie osseuse et contribue à de la minéralisation hétérotopique comme les calcifications vasculaires et dans d’autres tissus mous. [6, 43-46] Toutefois, il faut garder en tête que les maladies osseuses et les calcifications vasculaires sont multifactorielles et que les déséquilibres biochimiques n’en sont pas les seules causes. De plus, certaines subtilités existent dans la population pédiatrique insuffisante rénale. Ce mémoire traitera seulement du TMO-IRC chez l’adulte.
Avec le déclin de la fonction rénale, diverses anomalies peuvent toucher le métabolisme du calcium, du phosphore, de la PTH, de la vitamine D ou du FGF 23 (voir figure 2.1). Les mécanismes de régulation pour pallier ces déséquilibres deviennent insuffisants au stade terminal de l’IRC. Ainsi, il y a une diminution non-compensée de la capacité du rein à réabsorber le calcium et à excréter le phosphore, engendrant une hyperphosphatémie et une hypocalcémie. [47, 48] De plus, la diminution de la capacité du rein à fabriquer la 1-α-hydroxylase engendre une déficience en vitamine D activée (calcitriol). Cela aggrave les désordres du métabolisme osseux puisque le rôle du calcitriol est de favoriser l’absorption intestinale du calcium et du phosphore. Par conséquent, il y aura une augmentation de la PTH en réponse à l’hypocalcémie, l’hyperphosphatémie et l’hypovitaminose D. [49] Ce phénomène porte le nom de l’hyperparathyroïdie (HPT) secondaire. Le rôle de l’HPT secondaire dans la physiopathologie du TMO-IRC sera détaillé plus loin dans ce chapitre, alors que celui du FGF23 sera détaillé dans le chapitre 3. Ces désordres biochimiques, sans être les seuls coupables, sont fortement associés à la mortalité en interférant avec la santé osseuse et vasculaire du patient IRC. [6, 8, 50-53]
9
Figure 2.1 Désordres biochimiques du métabolisme osseux en IRC
Figure tirée avec permission de Wesseling Perry et Salusky [54]
2.1
La santé osseuse dans le TMO-IRC
Selon le KDIGO, l’ostéodystrophie rénale (ODR) fait maintenant référence uniquement aux anomalies de la morphologie osseuse reliées à l’IRC, qui peuvent être caractérisées par l’histomorphométrie. Il est statué que l’ODR est à distinguer du TMO-IRC, qui fait référence au spectre plus large des anomalies systémiques du métabolisme minéral et osseux et qui inclut l’ODR. Dans le même document, le KDIGO propose un système de classification de l’ODR qui est maintenant bien établi : le TMV (turnover, mineralization,
volume). [46]
Le remodelage (turnover) fait référence au processus normalement couplé de formation osseuse par les ostéoblastes et de résorption osseuse par les ostéoclastes. Cet équilibre est régulé par différents mécanismes et demeure un champ d’étude d’actualité. Un mécanisme important de différentiation des cellules de remodelage osseux est le système RANK (receptor activator of NF-κB) - RANKL (RANK ligand) - OPG (ostéoprotégérine) tel qu’illustré par la figure 2.2. En bref, les ostéoclastes se différencient sous l’effet de la liaison du RANKL au RANK en présence d’un environnement favorable nécessitant la liaison du M-CSF (macrophage colony-stimulating factor 1) à son récepteur. Il est à noter que la liaison de l’OPG sur le RANK a un effet modulateur sur celui-ci. L’ostéoblaste et les cellules stromales de la moelle osseuse sont tous les deux des sources importantes d’OPG et de RANKL. L’ostéocyte (la cellule la plus abondante de l’os en laquelle peut se différencier l’ostéoblaste) peut également sécréter les RANKL. L’ostéocyte et ses
10
précurseurs sont ainsi des régulateurs importants du remodelage osseux (voir figure 2.2). [55]
Figure 2.2 Rôle du système RANK-RANKL-OPG dans le remodelage osseux
RANK : receptor activator of NF-κB; RANKL: RANK ligand; M-CSF: macrophage colony-stimulating factor 1; M-CSF-R: M-CSF receptor; OPG: osteoprotegerin; MSC: mesenchymal stem cells; BMSCs: bone marrow stromal cells
Figure tirée avec permission de Weitzmann et Ofotokun [55]
Le remodelage osseux est traditionnellement évalué par des marqueurs biochimiques comme le calcium, le phosphate, la PTH et la phosphatase alcaline, mais leur spécificité est remise en question. Malgré l’émergence de nouveaux marqueurs de formation osseuse sous étude comme le procollagen type 1 N-terminal propeptide (P1NP) ou l’ostéocalcine, et de marqueurs de résorption osseuse comme le tartrate-resistant acid
phosphatase 5b (TRAP5b), la biopsie osseuse demeure la méthode offrant la meilleure
caractérisation du remodelage osseux et est indiquée en cas de discordance entre les différents marqueurs biochimiques. [56-58] Le niveau de PTH, l’inflammation locale, la médication utilisée (chélateurs calciques, calcitriol, calcium concentrée dans le dialysat, etc.) comptent parmi les facteurs qui peuvent influencer le remodelage. [54] La
11
classification TMV, qui se base sur l’histomorphométrie découlant de la biopsie osseuse, comprend trois niveaux : lent, normal ou élevé. [46]
La minéralisation (mineralization) fait référence à la calcification du collagène de l’os par le dépôt d’hydroxyapatite lors de la formation osseuse. Ce processus est surtout tributaire du niveau sanguin de phosphate, de calcium et de l’activité ostéoblastique. La minéralisation est qualifiée de « normale » ou de « anormale » selon la classification TMV. Les anomalies de la minéralisation sont visibles à l’histomorphométrie et sont caractérisées par le volume de l’ostéoïde, la mesure dynamique du temps de maturation de l’ostéoïde ainsi que le temps de latence de la minéralisation. La carence en 25-OH-vitamine D, un métabolisme anormal de FGF23, l’acidose métabolique et un excès d’aluminium ou de fer peuvent contribuer à une minéralisation anormale. [46, 53, 54, 59]
Le volume ou la masse osseuse (volume) fait référence à la quantité d’os trabéculaire (ou spongieux) ou cortical. Tout comme le remodelage, la classification TMV a trois niveaux pour le volume : bas, normal ou élevé. [46] Le volume d’os trabéculaire réfère à la quantité d’os par volume de tissu osseux; l’os cortical peut en plus être caractérisé par son épaisseur. [53, 60] Quoique moins optimale chez la population dialysée, la densité minérale osseuse (DMO), mesurée par absorption biphotonique à rayon X (DXA), est un reflet bien connu du volume de l’os trabéculaire. L’ostéoporose, qui est une diminution à un certain seuil de la DMO, est associée à un risque augmenté de fractures et de mortalité. [61, 62] L’histomorphométrie permet également de caractériser le volume osseux. Plusieurs facteurs sont associés à la perte de volume osseux : les paramètres démographiques (âge, sexe, ethnie), le statut nutritionnel, les maladies endocriniennes, la prise de corticostéroïdes, etc. [46, 53]
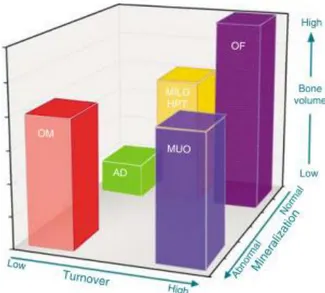
La combinaison de différentes anomalies des trois paramètres mentionnés ci-haut forme les différents phénotypes possibles de l’ODR qu’on retrouve en IRC (voir figure 2.3). Certains marqueurs biochimiques pouvant guider la reconnaissance des phénotypes sont résumés dans le tableau 2.1. Le marqueur osseux « sclérostine » présenté dans le tableau sera détaillé dans le chapitre 3. La caractérisation du phénotype est importante, car elle change grandement la conduite à tenir, surtout lorsque le remodelage est lent vs élevé. [63, 64]
12
Figure 2.3 Système de classification TMV (turnover, mineralization, volume) de l’histomorphométrie osseuse
OM: osteomalacy; AD: adynamic bone; Mild HPT: mild hyperparathyroid-related bone disease; OF: osteitis fibrosa; MUO: mixed uremic osteodystrophy
Figure tirée avec permission de Moe et al. [46]
Tableau 2.1 Pathologie et diagnostic du remodelage osseux en IRC
I. ODR à remodelage élevé ou liée à une hyperparathyroïdie prédominante a. PTH intact >500 pg/mL
b. Phosphatase alcaline ou phosphatase alcaline spécifique à l’os élevée c. Sclérostine élevée, mais peut être moins élevée que dans l’os adynamique II. ODR à remodelage lent
a. Os adynamique
1. PTH intact < 100 pg/mL
2. Phosphatase alcaline ou phosphatase alcaline spécifique à l’os normale 3. Ostéocalcine basse
4. Sclérostine élevée, surtout en IRC avant le stade 5 b. Ostéomalacie
1. PTH intact < 100 pg/mL
2. Phosphatase alcaline ou phosphatase alcaline spécifique à l’os normale 3. Ostéocalcine basse
4. Aluminium élevé III. ODR mixte urémique
a. PTH > 300 pg/mL b. Aluminium élevé
IV. ODR indéterminé ou liée à une hyperparathyroïdie modérée a. PTH entre 100 et 500 pg/mL
13
2.1.1 La PTH et le remodelage osseux
La PTH est sécrétée par les glandes parathyroïdes et agit principalement sur deux organes cibles : le rein et l’os. Au niveau rénal, la PTH augmente la réabsorption du calcium, diminue celle du phosphate et stimule l’activité de la 25(OH)D-1-α-hydroxylase, qui est l’enzyme qui active la 25-OH-vitamine D. La vitamine D activée (calcitriol), à son tour, a comme rôle de favoriser la réabsorption intestinale du calcium et du phosphore et de favoriser la résorption osseuse. Au niveau osseux, la PTH favorise le remodelage osseux en stimulant la formation osseuse, mais davantage la résorption osseuse, ce qui mène à une perte osseuse et une libération du calcium et du phosphore dans le sang. [30] Malgré une remise en question de la valeur de la PTH en tant qu’indicateur du remodelage osseux, celle-ci demeure actuellement un marqueur à doser en première ligne selon les recommandations. [46, 65, 66]
Plusieurs mécanismes régulent la sécrétion de la PTH pour maintenir l’homéostasie phosphocalcique. L’élévation du niveau de calcium et de calcitriol sont des signaux de rétroaction négative qui suppriment la PTH et leur baisse stimule la sécrétion de PTH. [30] L’élévation de phosphate stimule indirectement la sécrétion de PTH en diminuant le calcium en circulation par sa liaison à celui-ci, mais également directement en stabilisant l’ARN messager de la PTH. [67, 68] De plus, les données récentes suggèrent également un rôle du FGF23 dans la régulation de la PTH par son action via son corécepteur α-klotho exprimé dans la glande parathyroïde. [69, 70] Ce dernier point sera développé davantage dans le chapitre 3.
2.1.1 L’ODR à remodelage élevé
L’ODR à remodelage élevé, ou l’hyperparathyroïdie secondaire, est devenue l’un des deux phénotypes d’ODR les plus fréquents au fil des deux dernières décennies. [71] En IRC, l’HPT secondaire découle d’une part de la baisse de calcium et de calcitriol dans le sang, et d’autre part d’une résistance à la rétroaction négative du calcium et du calcitriol en raison d’une diminution de la sensibilité de leurs récepteurs respectifs au sein des parathyroïdes. [30]
14
L’HPT secondaire se manifeste par des douleurs au dos, à la hanche, aux jambes et parfois une faiblesse musculaire. [72] L’ODR à remodelage élevé est également associée à un risque augmenté de fractures de la hanche, donc à une mortalité augmentée. [73]
La clé du traitement de l’ODR à remodelage élevé est de réduire le niveau de PTH. [74] En effet, un niveau de PTH supérieur à 600 pg/mL est associée à une mortalité augmentée chez les patients dialysés. [75] Le traitement pharmacologique se base sur l’apport en calcitriol, qui supprime la PTH par rétroaction négative, et plusieurs études montrent un avantage de ce supplément vitaminique sur la survie des patients IRC. [76-78] Or, des données montrent également qu’une trop grande dose de calcitriol peut nuire au patient en augmentant le risque d’hypercalcémie et d’hyperphosphatémie. [79] Ainsi, un traitement alternatif est la combinaison de calcimimétiques avec des plus faibles doses de calcitriol. Les calcimimétiques, dont le plus connu est le cinacalcet, suppriment la PTH en augmentant la sensibilité du récepteur à calcium dans les glandes parathyroïdes. [80] Des études montrent une diminution de l’hyperplasie des glandes parathyroïdes, une diminution d’hypercalcémie et d’hyperphosphatémie, moins de fractures et d’hospitalisations d’origine cardiovasculaire sous cinacalcet, mais un risque plus grand d’hypocalcémie et jusqu’à maintenant, aucune démonstration d’amélioration de la mortalité. [74, 81-83] Lorsque l’HPT est sévère, réfractaire au traitement pharmacologique et associée des symptômes sévères, la parathyroïdectomie peut être indiquée, qui consiste à ablater une ou plusieurs glandes parathyroïdes. [6, 74, 84]
2.1.2 L’ODR à remodelage lent
L’ODR à remodelage lent est souvent associée à un niveau de PTH bas dû la plupart du temps à un traitement trop agressif de l’HPT. Mis à part l’HPT secondaire, l’os adynamique est l’autre phénotype d’ODR le plus fréquent chez les dialysés, mais semble être en baisse au cours des deux dernières décennies. [71] L’ostéomalacie est un phénotype plus rare et se distingue de l’os adynamique par sa minéralisation anormale et des causes plus spécifiques comme l’intoxication à l’aluminium ou encore l’administration de bisphosphonates, une classe de médicaments contre l’ostéoporose. [63]
15
Contrairement à l’ODR à remodelage élevé, peu de traitements sont disponibles et approuvés pour l’ODR à remodelage lent. Le retrait ou la réduction de doses de médicaments qui inhibent la PTH est de mise pour le patient: calcitriol, bisphosphonates, chélateurs de phosphore calciques, calcium dans le dialysat. [72] La distinction entre l’ODR à remodelage lent et à remodelage élevé est primordiale pour ne pas aggraver l’état du patient. Notons par ailleurs que le traitement trop agressif d’ODR à remodelage élevé est la principale cause de l’os adynamique, mais que l’os adynamique est associé à deux fois plus de risque fracturaire que l’ODR à remodelage élevé. [85]
2.2
La santé vasculaire dans le TMO-IRC
Il est maintenant reconnu que les patients en IRC terminale ont des taux de mortalité d’origine cardiovasculaire beaucoup plus élevés que la population générale du même âge. [86] Selon une méta-analyse regroupant environ 2 millions de personnes, une baisse de 30% du DFGe serait associée à une augmentation de 20-30% du risque d’événements cardiovasculaires et de mortalité de toutes causes confondues. [87] Les événements cardiovasculaires sont d’ailleurs la première cause de mortalité dans cette population. [32] Toutefois, cette observation ne peut être complètement expliquée par des facteurs de risques traditionnels comme le tabagisme, l’hypertension ou encore le diabète. Les études récentes ont proposé que les calcifications vasculaires, qui sont associées au produit phospho-calcique ou encore aux doses élevées de calcitriol utilisées au sein de cette population, feraient partie des facteurs de risque non-traditionnels de la surmortalité cardiaque chez les patients insuffisants rénaux. [88, 89] De surcroît, les calcifications retrouvées chez les patients IRC sont différentes de celles des patients de la population générale. En effet, alors que l’athérosclérose calcifiée qui se développe avec l’âge se retrouve dans la couche interne du vaisseau (l’intima), les calcifications vasculaires en IRC se retrouveraient en plus dans la couche intermédiaire musculaire (la média). Cette dernière forme de calcification est dénommée l’artériosclérose (voir figure 2.4). [90] De plus, il est proposé que le haut niveau de phosphate et la toxicité urémique retrouvés en IRC, ainsi que d’autres facteurs plus ou moins connus, favorisent une différenciation des cellules endothéliales et musculaires des vaisseaux en un phénotype semblable à l’ostéocyte. [91, 92] Ces calcifications engendrent une plus grande rigidité artérielle et sont associées à la
16
mortalité. [8] Dans les paragraphes 2.2.1 et 2.2.2, nous aborderons les paramètres de rigidité artérielle nécessaires à la compréhension de ce projet de maitrise.
Figure 2.4 Comparaison entre l’athérosclérose et l’artériosclérose
HCVD: hypertensive cardiovascular disease; RAAS: renal angiotensin-aldosterone system
Figure tirée avec permission de Lu et al [93]
2.2.1 Les paramètres de rigidité artérielle
La rigidité artérielle est un facteur de risque cardiovasculaire important d’origine multifactorielle, dont une partie est en lien avec les calcifications vasculaires qui découlent du TMO-IRC. La mesure de la rigidité artérielle se base sur le fait que plus un vaisseau est rigide, plus l’onde de pouls qui provient du cœur se déplace rapidement. [94] De manière physiologique, les vaisseaux sont plus rigides quand on s’éloigne du cœur. Ce phénomène s’appelle le gradient de rigidité. D’une part, les artères centrales ont un rôle important dans l’amortissement de l’onde de pouls provenant du cœur pour protéger la microcirculation (les capillaires sanguins), elles sont donc plus élastiques et moins rigides. D’autre part, les
17
artères périphériques ont un rôle prédominant dans la conduction du sang et sont par conséquent plus rigides. Avec le vieillissement, ce gradient peut s’inverser, c’est-à-dire que l’aorte peut devenir plus rigide que les vaisseaux périphériques, ce qui est dommageable pour la microcirculation. [95]
Le paramètre de rigidité aortique (ou centrale) le plus reconnu est la vélocité de l’onde de pouls carotide-fémorale (VOP-cf); celui de la rigidité périphérique est la vélocité de l’onde de pouls carotide-radiale (VOP-cr). [90, 96, 97] Toutefois, ces paramètres dépendent tous de la tension artérielle (TA). [98] Les méthodes de mesure de la rigidité artérielle sont détaillées dans le chapitre 6. De nombreuses études ont montré la valeur prédictive importante des paramètres de rigidité artérielle, surtout centrale, sur la mortalité, les événements cardiovasculaires et l’athérosclérose. [99-102] Récemment, Fortier et al ont démontré l’utilité du ratio de VOP calculé à l’aide de la formule VOP−cf
VOP−cr pour prédire la mortalité et pour tenir compte de l’inversement du gradient de rigidité avec le vieillissement. Le ratio de VOP a en plus l’avantage d’être indépendant de la TA. [95, 103, 104]
2.2.2 Les paramètres de l’étude de l’onde de pouls
La morphologie de l’onde de pouls centrale peut être dérivée à l’aide d’un capteur de pression au niveau radial. Cette méthode mathématique, qui est non-invasive contrairement à la mesure directe de l’onde de pouls centrale, est validée et largement utilisée. [105-108] La morphologie détectée est la combinaison de l’onde de pouls incidente (du cœur vers la périphérie) et de l’onde de pouls réfléchie par la périphérie à certains sites de réflexion (voir figure 2.5). Les sites de réflexion peuvent comprendre les bifurcations artérielles, les endroits de rétrécissement de calibre ou encore de changements d’élasticité. [109, 110]
18
Figure 2.5 Physiologie des ondes de pouls artériels
Figure tirée avec permission de Briet et al [90]
La figure 2.6 illustre les différents paramètres de l’étude de l’onde de pouls central. Plus précisément, la pression augmentée (PA) est l’augmentation de pression totale causée par l’onde réfléchie, enregistrée au niveau central. [111] Le rapport de PA sur la pression pulsée (PP) en pourcentage se nomme l’index d’augmentation (AIx). Ce dernier est un paramètre bien connu qui dépend du tonus de résistance des grandes artères, de la rigidité artérielle, de l’âge, et est associé à la mortalité et aux événements cardiovasculaires en IRC. [112-117] De plus, tout comme la rigidité artérielle, la PP est plus grande en périphérie qu’au niveau de l’aorte en situation physiologique. Le rapport de PP périphérique (PPP) sur la PP centrale (PPC) définit l’amplification de pression pulsée (PPamp). [112, 118] Il a été montré que la PPamp est inversement proportionnelle à la mortalité. [116] Notons que l’étude de l’onde de pouls doit toujours être interprétée avec les valeurs de TA et de fréquence cardiaque (FC). [112, 119, 120]
19
Figure 2.6 Morphologie de l’onde de pouls
Figure tirée avec permission de Stoner et al [111]
2.3
Le TMO-IRC après la greffe rénale
La greffe rénale est une intervention qui améliore plusieurs paramètres du métabolisme minéral et osseux, mais la correction du TMO-IRC est loin d’être parfaite. [54]
Après le rétablissement de la fonction rénale, la PTH tend à baisser dans les 6 mois suivant la greffe et peut remonter après un an si l’HPT secondaire était sévère pré-greffe, ce qui peut contribuer à une hypophosphatémie chez un certain nombre de patients. La calcémie tend à baisser en aigu post-greffe et remonte graduellement avec la stabilisation de la fonction rénale et possibilité d’hypercalcémie si l’HPT n’est pas complètement résolue à moyen terme. [121]
L’incidence de fractures chez les greffés rénaux demeure plus élevée que la population générale. [Annexe II] Cela peut être dû à une persistance de découplage du remodelage osseux en faveur de la résorption osseuse ainsi que des défauts de minéralisations qui peuvent apparaître. [122-124] En outre, l’ajout de fortes doses d’immunosuppresseurs contribuent à la fragilité osseuse dans cette population. En effet, les études ont largement démontré l’effet néfaste de certains immunosuppresseurs comme les corticostéroïdes et la cyclosporine sur la santé osseuse des greffés. [124-126]
20
L’effet de la greffe sur la santé vasculaire a été moins étudié à ce jour, mais une revue systématique de 2014 montre que les associations entre les paramètres de santé vasculaire et la mortalité persistent chez les greffés. [127] La calcification vasculaire ne semble pas se résorber de manière significative après la greffe rénale, mais il est suggéré que l’évolution de la calcification vasculaire ralentit après la greffe lorsque comparée à la population dialysée. [128, 129] Il est toutefois intéressant de noter que les paramètres de rigidité artérielle s’améliorent globalement post-greffe. [130]
21
Chapitre 3 Les inhibiteurs de la voie Wnt dans le TMO-IRC
Tel que mentionné précédemment, la PTH joue un rôle important dans l’ODR retrouvée dans le TMO-IRC. Or, de plus en plus d’études établissent l’existence d’une interaction entre les os et les vaisseaux dans la physiopathologie du TMO-IRC. [131, 132] Les études épidémiologiques montrent une association entre les calcifications vasculaires, les désordres du métabolisme minéral et osseux et la mortalité. [133-136] De fait, les calcifications vasculaires plus sévères sont associées à une DMO plus basse, une plus haute incidence de fractures ostéoporotiques et une perte osseuse accélérée avec la progression des calcifications. [137, 138] De plus, le phénotype des cellules semblables aux ostéocytes qui se développent dans l’artériosclérose témoigne également de l’existence d’un certain axe os-vaisseau qui ne peut être complètement expliquée par les désordres biochimiques dans l’HPT secondaire. En effet, selon une méta-analyse de 2011 regroupant 47 études, parmi les niveaux sanguins de calcium, phosphate et de PTH, seul le phosphate, et non la PTH, est associé significativement à la mortalité cardiovasculaire et de toutes causes chez les patients IRC, vraisemblablement en induisant des calcifications vasculaires. [139, 140]
Par ailleurs, l’IRC est associée à une élévation de certains inhibiteurs de la voie Wnt (sclérostine, DKK1 et FGF23) et une déficience en α-klotho, un corécepteur du FGF23. En effet, étant donné que ces protéines sont dosables dans le sang, les études récentes ont pu évaluer leur niveau de manière non-invasive chez les patients et propose leur utilité en tant que MOs [9-11, 141]. Ainsi, la voie Wnt et ses inhibiteurs ont revêtu un intérêt récemment dans la compréhension de la physiopathologie du TMO-IRC et de l’interaction qui semble exister entre les os et les vaisseaux.
3.1
Signalisation de la voie Wnt/β-caténine
Les voies de signalisation de Wnt comprennent 19 types différents de ligands Wnt, 10 types de récepteurs Frizzled (Fz) et 3 types de co-récepteurs lipoprotein receptor-related protein (LRP), des manières différentes d’activer et d’inhiber ces voies, ce qui rend les voies Wnt assez complexes. [142] Ce mémoire traitera seulement de la voie de signalisation canonique Wnt-β-caténine.
22
Brièvement, l’activation de cette voie mène à la stabilisation de la protéine β-caténine en déstabilisant le complexe qui dégrade cette protéine par phosphorylation. Ce complexe de dégradation est composé de quatre protéines : l’axine, l’adenomatous
polyposis coli (APC), la glycogène synthase kinase 3 bêta (GSK3β) et la caséine kinase 1
(CK1). La liaison d’un ligand Wnt au récepteur Fz rapproche Fz de son co-récepteur LRP, ce qui amène le recrutement de la protéine Disheveled (Dvl), qui à son tour phosphoryle le LRP. La phosphorylation du LRP recrute l’axine, ce qui ultimement déstabilise le complexe de dégradation de la β-caténine. La β-caténine peut alors s’accumuler dans le cytoplasme et être transloquée dans le noyau pour induire la transcription de certains gènes qui mènent à plusieurs actions dans le corps humain comme la formation osseuse, le développement embryogénique et la carcinogenèse. [142, 143] Les ligands Wnt1, Wnt3a et Wnt 10b ainsi que les co-récepteurs LRP5 et LRP6 semblent être les plus impliqués dans la transcription de gènes menant à la formation osseuse. [144] La figure 3.1 illustre la signalisation de la voie Wnt en lien avec la formation osseuse.
Figure 3.1 Signalisation de la voie Wnt en lien avec le remodelage osseux
23
Les mécanismes exacts de régulation du remodelage osseux par la voie Wnt ne sont pas encore complètement élucidés, mais on sait que l’activation de la voie Wnt est associée à une diminution du niveau de RANKL et une augmentation du niveau d’OPG. [145, 146] Le rôle de ces molécules a été détaillé dans la section 2.1. De plus, les études ont montré que le ratio RANKL/OPG est un bon déterminant de la formation osseuse, mais peut également devenir un paramètre important pour la calcification vasculaire. [93]
3.2
Les inhibiteurs de la voie Wnt
Les inhibiteurs de la voie Wnt les plus connus chez l’humain sont la sclérostine, le DKK1, et récemment le FGF23. Ils sont tous sécrétés par les ostéocytes, les cellules les plus abondantes de l’os. [147] La sclérostine est l’inhibiteur de la voie Wnt le plus spécifique pour l’os. Son mécanisme d’action passe par une liaison compétitive au récepteur LRP5 ou LRP6. [148] Le DKK1 a un mécanisme d’action similaire à la sclérostine. Il est produit par l’ostéocyte, mais également par l’ostéoblaste. [149] Son action est plus vaste que la sclérostine puisqu’une délétion complète de DKK1 empêche les souris d’atteindre la fin de leur développement. [150] Quant au FGF23, de concert avec son corécepteur α-klotho, son action potentiellement inhibitrice est plutôt indirecte. En effet, le FGF23 stimulerait la production du DKK1 dans des études in vitro. [13]
3.3
Les inhibiteurs de la voie Wnt et la santé osseuse
Étant donné que la voie Wnt stimule globalement la formation osseuse, les inhibiteurs de la voie Wnt, lorsque présents en trop grande quantité, sont logiquement néfastes pour la santé osseuse. La réalité est toutefois un peu plus complexe. Les paragraphes suivants résument l’état de connaissance actuel du rôle potentiel des inhibiteurs de la voie Wnt dans la santé osseuse selon des études animales ou humaines.
3.3.1 La sclérostine
La sclérostine semble être un inhibiteur de la formation osseuse au profit de la résorption osseuse. Les études animales montrent qu’une délétion du gène de la sclérostine (le gène sost) amène une augmentation de la masse osseuse; la stimulation de son expression ou son administration amène une perte osseuse, une augmentation des marqueurs de résorption et un défaut de minéralisation. [151-154] De plus, des traitements anti-sclérostine chez les
24
animaux amènent une augmentation de la masse osseuse et une réparation plus rapide des fractures. [155-157] Chez les humains, le déficit héréditaire en sclérostine comme dans la sclérostéose ou la maladie de van Buchem amène une masse osseuse et une épaisseur corticale plus élevées. [158-160] Toutefois, des niveaux plus élevés de sclérostine sont corrélés avec une DMO plus élevée chez les humains [12, 16] même s’ils corrèlent également avec des marqueurs de remodelage plus bas et des paramètres histologiques négatifs de remodelage osseux [17, 161]. Ces données suggèrent qu’un nombre plus élevé d’ostéocytes sécrètent davantage de sclérostine, mais que cette dernière pourrait alors réguler négativement le remodelage osseux en conséquence. Par ailleurs, un niveau de sclérostine plus bas a été associé à l’HPT primaire et le niveau de sclérostine est inversement corrélé avec le niveau de PTH. [162, 163] De fait, une étude animale a montré que la PTH inhibe l’expression de la sclérostine dans les ostéocytes. [164] Tous ces résultats montrent l’importance d’approfondir les relations complexes qui peuvent exister entre la santé osseuse et la sclérostine.
3.3.2 Le DKK1
Par sa nature moins spécifique pour l’os que la sclérostine, les données sur le DKK1 sont plus controversées dans son rôle en santé osseuse. Le DKK1 ne corrèle pas avec la DMO et les paramètres histomorphométriques chez l’humain. [132, 161] Or, une délétion hétérozygote du gène de DKK1 chez les rats augmente de manière significative la formation osseuse. [165] De surcroît, l’administration d’anticorps de DKK1 chez les animaux augmente la formation osseuse ainsi que la masse osseuse corticale et trabéculaire. [166, 167] Finalement, la PTH semble avoir un rôle régulateur sur le DKK1 par des mécanismes inconnus. [168] De plus, l’activation constante de DKK1 semble renverser l’effet de la PTH sur le remodelage osseux. [169] Le rôle de DKK1 sur la santé osseuse chez les humains est encore largement à étudier.
3.3.3 Le FGF23 et l’α-klotho
FGF23 a été récemment décrit comme un inhibiteur de la voie Wnt en stimulant l’expression du DKK1 et ainsi produire un effet néfaste sur l’os. [13] Il a avant tout un rôle bien connu dans le métabolisme osseux en passant par l’homéostasie du phosphate et de la vitamine D. En effet, il agit au niveau du rein pour augmenter l’excrétion de phosphore et
25
diminuer l’activation de la vitamine D en calcitriol, ce qui peut fragiliser l’os. [170] De plus, il a un effet suppresseur sur la production de PTH, donc sur le remodelage osseux. [69] Ces actions passent par le récepteur FGFR et le corécepteur α-klotho qu’on retrouve exprimés dans les reins et les parathyroïdes. De plus, la PTH semble aussi stimuler la production de FGF23 par les ostéocytes et les ostéoblastes et la production d’α-klotho par le rein. [171, 172] Il semble donc avoir un système de rétroaction intéressant au niveau de l’axe FGF23/α-klotho/PTH. [143] Plus récemment, il est suggéré que l’α-klotho pourrait avoir un rôle sur le remodelage osseux et la minéralisation, et ce, indépendamment du FGF23. [15] Les données à ce sujet sont toutefois encore peu nombreuses.
3.4
Les inhibiteurs de la voie Wnt et la santé vasculaire
Avec le concept émergent de l’axe os-vaisseau, les travaux récents se sont intéressés au rôle des inhibiteurs de la voie Wnt dans la physiopathologie des calcifications vasculaires et encore plus récemment dans la rigidité artérielle. Des données intéressantes émergent pour la sclérostine, le DKK1 et le FGF23, mais sont encore peu concluantes. Le rôle protecteur d’α-klotho est toutefois très bien décrit concernant les calcifications vasculaires.
Les associations entre la sclérostine et les calcifications semblent contradictoires : presque autant d’études décrivent des associations positives que négatives entre les niveaux de sclérostine et les calcifications vasculaires. [143] Les études qui se sont intéressés au DKK1 sont aussi controversées, mais suggèrent davantage une association négative avec les calcifications vasculaires. Les études sur l’association de ces deux inhibiteurs de la voie Wnt avec la rigidité artérielle ne permettent pas encore de conclure. [10] Quant au FGF23, il a également été associé positivement et de manière indépendante aux calcifications vasculaires. [173] Celui-ci peut avoir un rôle important dans les calcifications vasculaires par l’intermédiaire du phosphate, qui est un promoteur de calcification vasculaire indépendamment de la précipitation du produit phospho-calcique en stimulant une trans-différentiation des cellules musculaires lisses des vaisseaux. [174, 175] En effet, l’élévation du FGF23 très tôt dans l’histoire naturelle de l’IRC semble être un indicateur d’accumulation de phosphate avant que les mécanismes régulateurs du phosphore soient décompensés. [176] De plus, sachant que le calcitriol peut stimuler la minéralisation des
![Figure 1.1 Anatomie macroscopique du rein Figure tirée avec permission de Boer et al [26]](https://thumb-eu.123doks.com/thumbv2/123doknet/3184568.90923/18.918.285.631.490.775/figure-anatomie-macroscopique-rein-figure-tirée-permission-boer.webp)
![Figure 2.1 Désordres biochimiques du métabolisme osseux en IRC Figure tirée avec permission de Wesseling Perry et Salusky [54]](https://thumb-eu.123doks.com/thumbv2/123doknet/3184568.90923/25.918.148.776.121.329/figure-désordres-biochimiques-métabolisme-figure-permission-wesseling-salusky.webp)


![Figure 3.1 Signalisation de la voie Wnt en lien avec le remodelage osseux Figure tirée avec permission de Bisson et al [143]](https://thumb-eu.123doks.com/thumbv2/123doknet/3184568.90923/38.918.229.690.546.974/figure-signalisation-remodelage-osseux-figure-tirée-permission-bisson.webp)