© Olfa Haddaoui, 2020
Étude d’un concept novateur de culture du fraisier en
buttes semi-permanentes : évaluation d'un substrat
adapté
Mémoire
Olfa Haddaoui
Maîtrise en biologie végétale - avec mémoire
Maître ès sciences (M. Sc.)
i
Étude d’un concept novateur de culture du fraisier
en buttes semi-permanentes : évaluation d’un
substrat adapté
Mémoire
Olfa Haddaoui
Sous la direction de :
Yves Desjardins, directeur de recherche
Martine Dorais, codirectrice de recherche
ii
Résumé
La culture de la fraise est l’une des productions fruitières les plus répandues dans le monde. Ce petit fruit se cultive dans toutes les provinces du Canada et le Québec est considéré comme le leader canadien en matière de production de fraises. En revanche, la présence récurrente de maladies telluriques, comme le flétrissement verticilien (Verticillium
dahliae), limite la productivité des fraisiers en plein champ. Les fumigants constituent à ce
jour, la solution la plus efficace pour lutter contre cet agent pathogène. Ces biocides affectent toutefois l’équilibre biologique du sol et peuvent être nocifs pour l’environnement et les populations avoisinantes. Afin de surmonter ce problème, la production du fraisier dans des systèmes de culture hors-sol avec des substrats appropriés pourrait permettre d’éliminer l’utilisation de fumigants. Cette étude a été réalisée afin d’évaluer la performance de trois substrats tourbeux pour la culture des fraisiers remontants en hors-sol au champ et de comparer la croissance et la productivité du fraisier cultivé en hors-sol au champ à celles en plein sol après une et deux années d’utilisation du substrat. Les résultats ont démontré qu’il est possible de doubler les rendements pour tous les traitements en hors-sol comparativement au traitement témoin en hors-sol fumigé. Des différences significatives entre les traitements hors-sols et le témoin ont également été observées pour la croissance des plants de fraisiers. Cependant, aucune différence de croissance n’a été observée entre les trois substrats tourbeux. Des diminutions du rendement total, vendable ainsi que du calibre de fruits ont été mesurées pour les substrats réutilisés plus d’une fois par rapport aux substrats vierges. Cette différence s’explique principalement par des changements des propriétés physiques des substrats. Une diminution de la macroporosité et une augmentation de la capacité en contenant ont été observées avec les substrats réutilisés. Finalement, les substrats utilisés pour la culture hors-sol ont présenté une différence significative par rapport à la culture traditionnel en plein sol pour la majorité des paramètres mesurés.
iii
Table des matières
Résumé ... ii
Table des matières ... iii
Liste des tableaux ... v
Liste des figures ... vi
Remerciements ... viii
Introduction ... 1
Chapitre 1 : Revue de littérature ... 2
1.1. Les différents types de fraisiers ... 2
1.2. La culture hors-sol ... 5
1.2.1. Les différents types de substrats ... 5
1.2.1.1. Les substrats inorganiques ... 6
1.2.1.2. Les substrats organiques ... 7
1.2.2. Les propriétés des substrats ... 8
1.3. Effet de la culture hors-sol sur le rendement, la croissance et la qualité des fruits 15 1.4. Hypothèses et objectifs ... 18
Chapitre 2 : Matériel et méthodes ... 19
2.1. Site expérimental ... 19 2.2. Substrat ... 19 2.2.1. Propriétés physico-chimiques ... 20 2.3. Matériel végétal ... 24 2.4. Dispositif expérimental ... 25 2.5. Climat ... 26
2.6. Mesure des paramètres édaphiques ... 27
2.6.1. Mesure de la tension du sol ... 27
2.6.2. Analyse minérale du lixiviat ... 27
2.6.3. Caractérisation physique des substrats ... 27
2.7. Mesure de la croissance et la biomasse... 28
2.8. Rendement et qualité des fruits ... 29
iv
2.9.1. Année 2017 ... 30
2.9.2. Année 2018 ... 30
Chapitre 3 : Résultats ... 31
3.1 Année 2017 ... 31
3.1.1. Effet des substrats de culture sur le taux de lessivage, le pH et la conductivité électrique du lixiviat ... 31
3.1.2. Effet des substrats de culture sur la croissance... 31
3.1.3. Effet des substrats de culture sur la biomasse des plantes. ... 34
3.1.4. Effet des substrats de culture sur la productivité et la qualité des fruits ... 36
3.2. Année 2018 ... 39
3.2.1. Effet des substrats sur le taux de lessivage, le pH et la conductivité électrique . 39 3.2.2. Effet des substrats de culture sur la croissance ... 39
3.2.3. Effet des substrats de culture sur la biomasse ... 44
3.2.4. Effet des substrats de culture sur la productivité et la qualité des fruits ... 46
3.3. Caractéristiques physiques des substrats ... 49
3.4. Relation entre les variables mesurées ... 52
Chapitre 4 : Discussion ... 55
4.1. Effet des substrats de culture et mini-tunnel sur la croissance, la biomasse, la productivité et la qualité des fraisiers ... 55
4.2. Effet de la réutilisation des substrats de culture sur la croissance, la biomasse, la productivité et la qualité des fraisiers ... 58
4.3. Effet de la réutilisation sur les paramètres physiques de substrats ... 60
Conclusion ... 62
Bibliographie ... 64
v
Liste des tableaux
Tableau 1 : Caractéristiques des tourbes et de la fibre de coco. ... 8
Tableau 2 : Distribution des particules selon leur diamètre pour quatre substrats. ... 10
Tableau 3 : Paramètres physiques de neuf substrats de culture. ... 11
Tableau 4 : Evolution de la conductivité hydraulique saturée de la fibre de coco, de l'écorce de pin, de la tourbe et de la fibre de bois, au début (T0) et à la fin (Tfinal) de la culture. ... 13
Tableau 5: Capacité d'échange cationique (CEC) des substrats organiques et inorganiques. ... 14
Tableau 6: Propriétés physiques initiales des trois substrats tourbeux. ... 22
Tableau 7: Propriétés chimiques initiales des substrats... 23
Tableau 8 : Composition minérale des solutions nutritives utilisées en µL L-1. ... 25
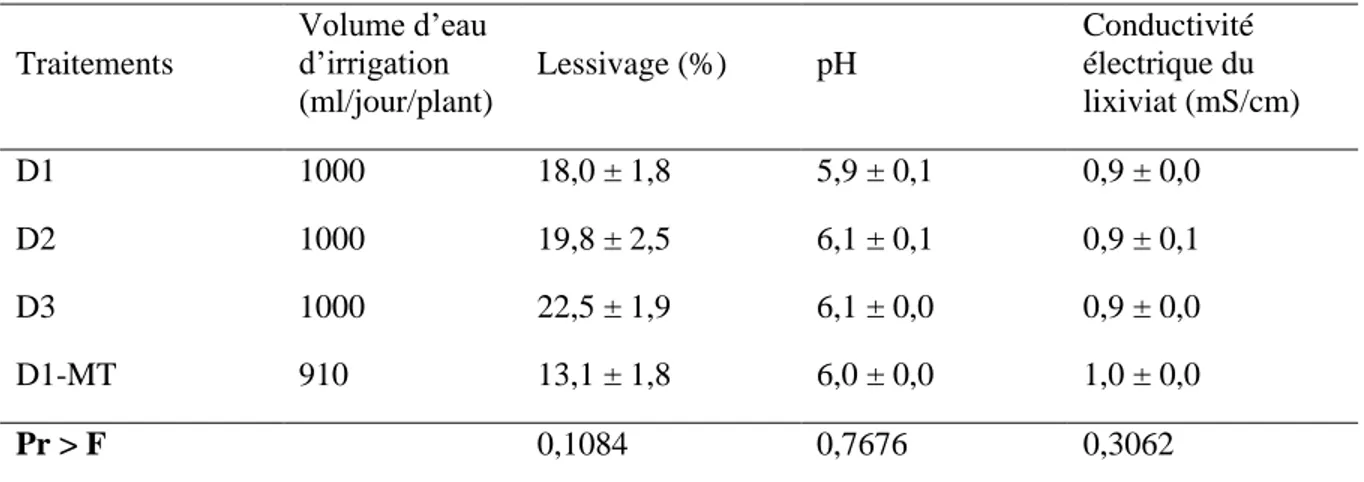
Tableau 9 : Pourcentage de lessivage, pH et conductivité électrique des différents substrats D1 avec et sans mini-tunnel, D2 et D3. ... 32
Tableau 10 : Résultats de l’ANOVA pour le nombre de feuilles, le nombre de hampes florales, le nombre et le diamètre de couronnes. ... 32
Tableau 11 : Rendement total, rendement vendable, rendement non vendable et pourcentage de fruits vendables des fraisiers cultivés sur différents substrats de culture, D1, D2, D3, D1 avec mini-tunnel et en plein sol fumigé au cours de la saison 2017. ... 37
Tableau 12 : Calibre et teneur en sucres des fruits des plants cultivés sur les substrats de culture, D1, D2, D3, D1 avec mini-tunnel et en plein sol au cours de la saison 2017. ... 38
Tableau 13 : Résultats de l’ANOVA pour le pourcentage de lessivage, le pH et la conductivité électrique (CE) du lixiviat des substrats de culture. ... 39
Tableau 14 : Pourcentage de lessivage, pH et conductivité électrique (CE) du lixiviat des trois substrats de culture, D1, D2 et D3. ... 40
Tableau 15 : Résultats de l’ANOVA pour le nombre de feuilles, le nombre de hampes florales et le nombre et diamètre de couronnes. ... 40
Tableau 16 : Résultats de l’ANOVA pour la biomasse aérienne fraîche et sèche et la biomasse racinaire fraîche et sèche. ... 44
Tableau 17 : Résultats de l’ANOVA pour le rendement total, le rendement vendable, pourcentage vendable et calibre des fruits. ... 47
Tableau 18 : Rendement total, rendement vendable, pourcentage vendable et calibre des fruits des fraisiers cultivés sur les substrats D1, D2 et D3. ... 48
Tableau 19 : Rendement total, rendement vendable, pourcentage vendable et calibre des fruits en fonction du nombre d’années d’utilisation du substrat, 1 an et 2 ans. ... 48
Tableau 20 : Résultats de l’ANOVA pour les caractéristiques physiques des substrats. ... 50
Tableau 21 : Porosité totale, eau disponible, eau facilement disponible, eau non disponible et la masse volumique apparente des substrats D1, D2 et D3. ... 52
Tableau 22 : Porosité totale, eau disponible, eau facilement disponible, eau non disponible et densité apparente pour les substrats vierges (1 an) et réutilisés (2 ans). ... 52
vi
Liste des figures
Figure 1 : Courbes de rétention d’eau au début (T0) et à la fin d’une expérience selon
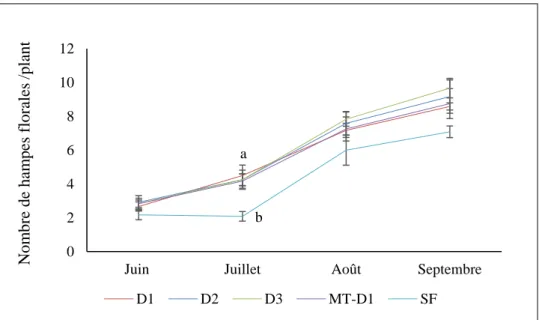
différentes stratégies d’irrigation (−1 kPa, −10 kPa, −30 kPa) pour la tourbe et la fibre de bois (Michel et Kerloch, 2017). ... 12 Figure 2 : Culture hors-sol sur butte surélevée. ... 20 Figure 3: Distribution des particules des substrats, D1, D2 et D3. ... 22 Figure 4 : Représentation schématique du dispositif expérimental en 2017 (A) et 2018 (B). ... 26 Figure 5 : Nombre de feuilles des fraisiers cultivés sur les différents substrats D1 avec et sans mini-tunnel, D2, D3 et en plein sol fumigé (SF), pour la saison 2017. Les barres représentent la moyenne ± erreur type (n = 4)... 33 Figure 6 : Nombre de hampes florales des fraisiers cultivés sur les différents substrats D1 avec et sans mini-tunnel, D2, D3 et en plein sol fumigé (SF), pour la saison 2017. Les barres représentent la moyenne ± erreur type (n = 4). ... 33 Figure 7 : Nombre de couronnes/plant de fraisiers cultivés sur les différents substrats D1 avec et sans mini-tunnel, D2, D3 et au plein sol fumigé (SF), pour la saison 2017. Les barres représentent la moyenne ± erreur type (n = 4). ... 34 Figure 8 : Diamètre de couronnes des fraisiers cultivés sur les différents substrats D1 avec et sans mini-tunnel, D2, D3 et au plein sol fumigé (SF), pour la saison 2017. Les barres représentent la moyenne ± erreur type (n = 4)... 35 Figure 9 : A) Biomasse aérienne fraîche B) Biomasse aérienne sèche des fraisiers cultivés sur les différents substrats D1 avec et sans mini-tunnel, D2, D3 et au plein sol fumigé (SF), pour la saison 2017. Les barres représentent la moyenne ± erreur type (n = 4). ... 35 Figure 10 : A) Biomasse racinaire fraîche B) Biomasse racinaire sèche des fraisiers cultivés sur les différents substrats D1 avec et sans mini-tunnel, D2, D3 et au plein sol fumigé (SF), pour la saison 2017. Les barres représentent la moyenne ± erreur type (n = 4). ... 36 Figure 11 : Effet linéaire de la porosité d’air initiale du substrat sur le rendement total en fruits, au cours de la saison 2017. ... 38 Figure 12 : Effet des années d’utilisation du substrat (1 an, 2 ans) et des trois substrats de culture D1, D2 et D3 et du témoin sol fumigé (SF) sur le nombre de feuilles. Les barres représentent la moyenne ± erreur type (n = 4)... 41 Figure 13 : Effet des années d’utilisation du substrat (1 an, 2 ans) et des trois substrats de culture D1, D2 et D3 et du témoin (SF) sur le nombre de hampes florales. Les barres représentent la moyenne ± erreur type (n = 4)... 41 Figure 14 : Effet des années d’utilisation du substrat (1 an, 2 ans) et des trois substrats de culture D1, D2 et D3 et du témoin sol fumigé (SF) sur le nombre de couronnes. Les barres représentent la moyenne ± erreur type (n = 4)... 43 Figure 15 : Effet des années d’utilisation du substrat (1 an, 2 ans) et trois des substrats de culture D1, D2 et D3 et du témoin sol fumigé (SF) sur le diamètre de couronnes. Les barres représentent la moyenne ± erreur type (n = 4)... 43
vii
Figure 16 : Effet des années d’utilisation du substrat (1an, 2ans) et des trois substrats de culture D1, D2 et D3 et le témoin sol fumigé (SF) sur la biomasse aérienne fraîche (A) et sèche (B). Les barres représentent la moyenne ± erreur type (n = 4). ... 45 Figure 17 : Effet des années d’utilisation du substrat (1 an, 2 ans) et des trois substrats de culture D1, D2 et D3 et du témoin sol fumigé (SF) sur la biomasse racinaire fraîche (A) et sèche (B). Les barres représentent la moyenne ± erreur type (n = 4). ... 46 Figure 18 : Effet des années d’utilisation du substrat (1 an, 2 ans) et des trois substrats de culture D1, D2 et D3 et du témoin (SF) sur la teneur en sucres des fruits. Les barres représentent la moyenne ± erreur type (n = 4)... 49 Figure 19 : Capacité en air des substrats D1, D2 et D3 vierges (1 an) et réutilisés (2 ans). Les barres représentent la moyenne ± erreur type (n = 4). ... 50 Figure 20 : Capacité en contenant des substrats D1, D2 et D3 vierges (1 an) et réutilisés (an 2). Les barres représentent la moyenne ± erreur type (n = 4). ... 51
viii
Remerciements
J’aimerais remercier mon directeur de recherche Yves Desjardins et ma co-directrice Martine Dorais pour vos conseils précieux, votre confiance, vos encouragements et votre disponibilité. Je veux aussi remercier André Gosselin pour être le premier à m’accepter en tant qu’étudiante de deuxième cycle.
À Linda Gaudreau, qui m’a guidé tout au long de mes expériences d’été, je transmets ma gratitude. Son enthousiasme et sa personnalité aimable ont été appréciés durant tout le long de mes études de deuxième cycle.
Je remercie également l’équipe de la ferme Fraises de l'Île d'Orléans inc. qui m’a aidé tout au long de mes expériences lors de l’été et sans laquelle je n’aurai pas été capable de faire ce projet. Je tiens à souligner mon appréciation à Annie Van Sterthem, pour son dévouement d’une rareté exceptionnelle pour les projets des étudiants. Son aide, ses conseils ont été grandement appréciés et m’ont fait davantage aimer mon expérience ici au Québec.
Je tiens à remercier les partenaires du projet, CRSNG, la ferme Fraises de l'Île d'Orléans inc, Berger. Sans leur soutien financier, ce projet n’aurait jamais eu lieu.
J’aimerais aussi exprimer ma reconnaissance à la Mission universitaire de la Tunisie en Amérique du Nord (MUTAN) pour m’avoir donné la chance de poursuivre mes études de deuxième cycle à l’Université Laval et pour leur support financier.
J'offre ce mémoire à toute ma famille, à mon amour, à mes amis et à mon pays, la Tunisie. C'est grâce à vous tous que je termine ma maîtrise avec plein de bonheur et de réussite.
1
Introduction
La production mondiale de fraise est en constante augmentation depuis 25 ans. En 1990, cette production se chiffrait à plus de deux millions de tonnes et a atteint plus de 8 millions de tonnes en 2014. Les 10 plus importants pays producteurs mondiaux représentent plus de 80 % de la production mondiale, les trois principaux pays producteurs en 2014 étant la Chine, les États-Unis et le Mexique avec respectivement une production de 3 801 865 tonnes, 1 420 570 tonnes et 468 248 tonnes de fraises (FAOSTAT, 2014). Le Canada occupe la 34e place dans la production mondiale de la fraise (FAOSTAT, 2014). En 2017, la production canadienne se chiffrait à 31 275 tonnes (Statistique Canada, 2017a). Les deux principales provinces productrices, le Québec et l’Ontario, produisent respectivement 17 600 et 7 524 tonnes annuellement soit 80 % de la production canadienne (Statistique Canada, 2017a). En 2016, la valeur à la ferme de la production de fraises était de 128,2 millions de dollars. L'utilisation croissante des fraisiers à jours neutres avec ceux produisant en juin, ainsi que l'utilisation des tunnels ont permis une hausse de la production au cours des cinq dernières années (Statistique Canada, 2017b).
La production intensive de cette culture a entraîné l’accroissement d’agents pathogènes dans le sol, comme Phytophtora spp. et Verticillium spp.. De plus, le bromure de méthyle utilisé pour traiter ces agents pathogènes est graduellement interdit à l’échelle mondiale. Pour pallier ces obstacles, les chercheurs ont développé la culture hors-sol du fraisier. L’utilisation de substrats de culture résout le problème des maladies du sol et la culture hors-sol au champ rend les opérations culturales plus agréables pour les employés, tout en réduisant de façon importante les frais de production.
2
Chapitre 1 : Revue de littérature
La fraise, fait partie de la famille des rosacées. Le genre Fragaria regroupe des espèces sauvages de différents niveaux de ploïdie, soit du diploïde (fraisier des bois, F. vesca, 2n=2x=14) à l’octoploïde (F. chiloensis, F. ovalis, F. virginiana, 2n=8x=56). Une espèce décaploïde, F. iturupensis, a très récemment été décrite (Hummer et coll., 2009). Ainsi, parmi les espèces de fraisier, on trouve des diploïdes, des tétraploïdes, des hexaploïdes, des octoploïdes et des décaploïdes. Le fraisier cultivé, F. X ananassa Duch., est un hybride interspécifique issu du croisement entre deux espèces octoploïdes F. virginiana L. et F.
chiloensis L. (Hummer et coll., 2009). La fraise était en culture en Europe, ce sont les
Français qui ont commencé à introduire la fraise des bois, Fragaria vesca, au jardin de Louvre. À cette époque, les fleurs du fraisier étaient considérées comme ornementale et ses fruits étaient comestibles (Darrow, 1966).
1.1.Les différents types de fraisiers
En fonction de leurs réponses photopériodiques à la floraison, les variétés de fraises peuvent être classées en trois groupes : les variétés de jours courts, les variétés de jours longs et les variétés aphotopériodiques ou à jours neutres.
Les variétés non-remontantes sont des plantes vivaces de jours courts dont l’induction florale se fait vers la fin de l’été et à l’automne (Darrow, 1936) lorsque la durée du jour est inférieure à un seuil critique d’environ 12 à 13 heures (Guérineau, 2003) associée à des températures fraiches n’excédant pas les 15 °C (Guttridge, 1985 ;Bradford et coll., 2010). Ces variétés fleurissent le printemps suivant en donnant une production groupée unique. Selon l’époque de floraison on distingue des variétés précoces, de saison et tardives.
3
La situation est encore assez confuse pour les cultivars qui produisent plus d’une récolte par an (Sonsteby et Heide, 2007 ; Hancock et coll., 2008). Ces cultivars sont tour à tour appelés fraises à jours neutres ou fraises à jours longs (Galletta et Bringhurst, 1990). En effet, Durner, (1984) a distingué les fraisiers dont les fleurs sont initiées en conditions de jours longs et les fraisiers à jours neutres qui fleurissent indépendamment de la longueur du jour (Darrow et Waldo, 1934). Cette classification a été largement adoptée dans la littérature (Durner, 1984 ; Nicoll et Galletta, 1987 ; Dale et coll., 2002 ; Hancock et coll., 2008 ; Taghavi et coll., 2016).
Pour les variétés remontantes à jours longs, l’induction florale se fait lorsque la photopériode est supérieure à 12 h et sous des températures modérées, comprises entre 15 et 20 °C (Guttridge, 1985). L’induction commence au mois d’août et le développement des premières hampes florales peut s’achever avant l’hiver (Guérineau, 2003). Le nombre d’inflorescences produites augmente au fur et à mesure que la durée du jour s’allonge (Darrow, 1966).
Contrairement aux fraisiers à jours courts, qui produisent leurs fruits en juin ou plus tard dans l'été, les fraisiers à jours neutres ou à production continue, produisent leurs fruits en continue au cours de l’année de la plantation. Au Québec, ce type de fraise commence à produire 6 à 7 semaines après la plantation et la production s'étale sur un minimum de 10 semaines de récolte. En effet, ces variétés à jours neutres, sont indifférentes à la longueur du jour et aux baisses de température. L’allongement de la photopériode augmente leur capacité d’initiation pour les températures intermédiaires (18/14°C jour/nuit) et elles nécessitent des jours longs à haute température (30/26°C jour/nuit) (Bosc et Bardet, 2014).
4
Le fraisier est l’une des plantes horticoles les plus cultivées et les plus répandues partout à travers le monde, notamment en Europe et en Amérique. Toutefois, cette culture fait face à des problèmes récurrents de maladies telluriques qui limitent la productivité au champ, et ce, au Canada et ailleurs dans le monde (Jordan, 1971 ; Larson et Show, 1995 ; Coulombe et coll., 2005 ; El Kaissoumi et coll., 2016). Le champignon vasculaire Verticillium dahliae, qui se trouve dans la majorité des sols, est un pathogène majeur de la fraise cultivée. Il possède une large gamme d'hôtes, et peut attaquer jusqu'à 300 espèces végétales dicotylédones, dont l'artichaut, l'aubergine, le poivron, la pomme de terre et la tomate. Ce pathogène produit différents types de symptômes, tels que des chloroses, des nécroses, des flétrissements, des dessèchements, des rabougrissements et la mort des plantes (El Kaissoumi et coll., 2016). Le champignon peut également entraîner une réduction de la croissance des plants et de la productivité des cultures (Larson et Show, 1995 ; Coulombe et coll., 2005). Les fumigants constituent à ce jour la solution la plus efficace pour lutter contre les pathogènes du sol, puisqu’ils possèdent des propriétés antimicrobiennes, herbicides, insecticides et nématicides (Klose et coll., 2007). Mais, l'utilisation de ces biocides conduit souvent à l'éradication de la plupart des microorganismes bénéfiques du sol (Wang et coll., 2014), ce qui affecte son ’équilibre biologique, en laissant une niche écologique vide pouvant être facilement occupée ultérieurement par des microorganismes pathogènes capables de causer des dommages importants (Gamliel et coll., 2000). Avec l'interdiction de l’utilisation du bromure de méthyle qui découle du protocole de Montréal signé en 2005, il devient essentiel de développer des méthodes de culture alternatives pour remplacer la fumigation du sol au bromure de méthyle ou avec tout autre pesticide.
Afin de limiter l'utilisation de produits chimiques pour lutter contre les pathogènes du sol, plusieurs alternatives ont été élaborées et testées. Ainsi, on peut procéder à des biofumigation qui consiste à réduire le taux de population pathogène dans le sol. Wang et coll. (2014) ont démontré que la biofumigation avec le tourteau de colza était efficace pour prévenir la maladie du poivron causée par Phytophthora capsici. Le contrôle de la maladie était principalement lié à l'augmentation de la diversité bactérienne du sol plutôt qu'à une
5
baisse de la population de pathogènes du sol. D'autres essais conduits à l’université Laval ont montré que l'incorporation du compost ne permettait pas de réduire l'incidence de la verticilliose du fraisier (Bernier-English, 2009 ; Martin-Lapierre, 2011), l’incorporation de différentes doses de compost, n’a pas eu d’effet significatif sur le rendement. Toutefois, la biomasse aérienne des fraisiers a été réduite avec l’incorporation d’un compost biologique.
1.2. La culture hors-sol
Pour pallier aux problèmes de maladies telluriques, la culture hors-sol avec substrat permet d’atteindre un rendement élevé de fruits de bonne qualité (Tagliavini et coll., 2005 ; Retamales et coll., 2007 ; Palencia et coll., 2016), même dans les zones où les conditions de croissance sont défavorables (Grillas et coll., 2001 ; Cecatto et coll., 2013 ; Akhatou et Recamales, 2014 ; Murthy et coll., 2017).
Ce sont les Européens qui dès la fin des années 70 ont développé la culture hors-sol pour des espèces horticoles comme la tomate et le concombre et se sont intéressés aussi à la production de fraises sur substrat (Guérineau, 2003 ; Lieten, 2013). La culture hors-sol est définie comme « une méthode de culture qui n’utilise pas le sol comme milieu d'enracinement et dans lequel les éléments nutritifs absorbés par les racines sont fournis par l'eau d’irrigation » (Savvas et coll., 2013). Les engrais contenant les nutriments à fournir à la culture sont dissous à la concentration appropriée dans l'eau d'irrigation et la solution résultante est appelée « solution nutritive » (Savvas et coll., 2013). Cette définition englobe une gamme variée de systèmes de culture sans sol. Généralement, ces systèmes sont classés selon le type de substrat servant de support à la culture (milieu de culture artificiel, minéral ou organique, ou un mélange des deux) et en culture hydroponique, où les racines sont en contact avec la solution nutritive.
1.2.1. Les différents types de substrats
Les systèmes hors-sols avec substrat ont été largement utilisés pour les cultures horticoles dans différentes formes et tailles de contenants sous des environnements protégés, en serre,
6
en tunnel (Carlile et coll., 2015 ; Martínez et coll., 2017) ou en plein champ (Thomas et coll., 2013 ; Wang et coll., 2009, 2016). Les milieux de culture sont généralement classés en matériaux organiques et inorganiques (tourbe, fibre de coco, sable, gravier, mousse de polyuréthane, polystyrène expansé, perlite, laine de roche, vermiculite, etc.) qui ont été largement utilisés pour la production de fraises (Guérineau, 2003 ; Recamales et coll., 2007 ; Carlile et coll., 2015 ; Martínez et coll., 2017). En gardant à l'esprit que les propriétés importantes des milieux de culture comprennent leurs caractéristiques physicochimiques, les substrats peuvent être classés comme actifs (par exemple la tourbe) ou inertes (par exemple la laine de roche et le sable).
1.2.1.1.Les substrats inorganiques
Les substrats d’origine inorganique, sont constitués de sable, de pouzzolane, de vermiculite, de perlite ou de laine de roche. Pour le fraisier, la laine de roche est parmi les substrats employé en Europe et dans le reste du monde (Guérineau, 2003). Il s’agit d’une roche d’origine volcanique. La laine de roche est conditionnée en pain recouvert d’une gaine de plastique et offre une grande souplesse d’utilisation. Il s’agit d’un substrat dont la masse volumique est faible (environ 0,07-0,1 g cm-3) et la porosité totale est de 92-97%. La
principale caractéristique chimique de la laine de roche est qu'elle est totalement inerte, à l'exception de quelques effets mineurs sur le pH. Le pH initial du matériau est plutôt élevé (7,0-8,0) et un ajustement du pH est donc requis (Gruda et coll., 2013). Ce milieu de culture peut être réutilisé pour une culture de fraisier après avoir porté une autre culture telle que la tomate (Guérineau, 2003).
Au cours des deux dernières décennies, la perlite est devenue un important milieu de culture hors-sol et est utilisée seule ou en mélange avec d'autres substrats. Ce matériau améliore l'aération et le drainage, tout en ayant une bonne rétention en eau (35% à 50% de son volume) (Grillas et coll., 2001). La perlite est une roche volcanique silicieuse naturelle tamisée et chauffée à 1000 °C, à ces températures, la perlite peut prendre de l’expansion de 4 jusqu’à 20 fois son volume initial (Gruda et coll., 2013).
7 1.2.1.2.Les substrats organiques
Les milieux de cultures organiques les plus répandues sont la tourbe, la fibre de coco, le compost, les écorces et les sciures de bois (Gruda et Schnitzler, 2006 ; Maher et coll., 2008).
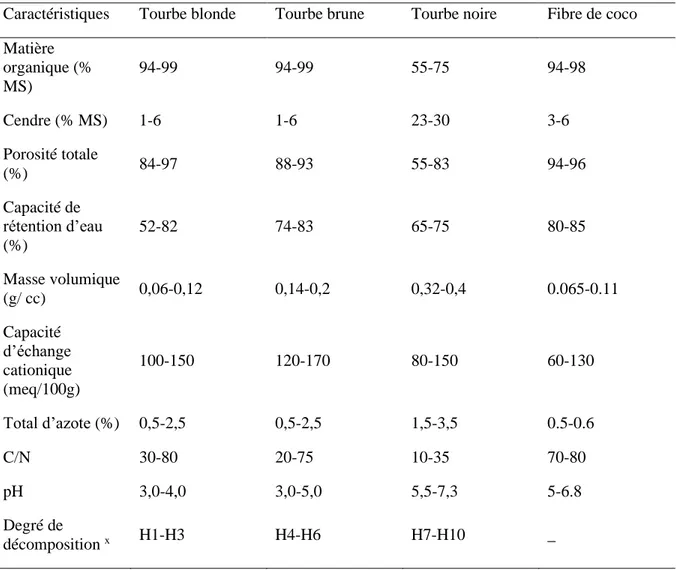
La tourbe est le substrat de culture le plus utilisé en horticulture, représentant 80 % des milieux de culture utilisés chaque année dans l'industrie horticole européenne (Gruda, 2012). Ce substrat se forme suite à la décomposition partielle de sphaignes et de la végétation. La composition des différents types de tourbe varie largement selon l'endroit où elle est prélevée et le stade de décomposition. Von Post (1937) a suggéré une classification des types de tourbe, en fonction de leur degré de décomposition. Le tableau 1 présente quelques caractéristiques des substrats, de tourbe blonde, brune, noire et de fibre de coco.
Le pH de la tourbe augmente avec son degré de décomposition, par exemple la tourbe blonde, a un faible degré de décomposition, et un pH acide de 3-4, alors que la tourbe noire a un pH de 5,5-7,3 (Tableau 1) (Gianquinto et Pimpini, 2001).
La fibre de coco est considérée comme l'un des matériaux renouvelables les plus prometteurs en tant que milieu de culture (Yau et Murphy, 2000 ; Gruda et Schnitzler, 2006; Martinez et coll., 2017) en raison de ses propriétés physicochimiques favorables à la réussite de différentes cultures horticoles, y compris les fraises (Lopez-Medina et coll., 2004 ; Recamales et coll., 2007 ; Martinez et coll., 2017). Selon Martinez et coll. (2017), un substrat de culture à base de fibres de coco augmente significativement le rendement des
8
fraises et la qualité des fruits. En général, le rendement en fruits par plante, le poids des fruits, la fermeté, la teneur en sucres solubles et la teneur en anthocyanes étaient plus élevés chez les plantes cultivées dans la fibre de coco que pour celles cultivées en plein sol. Des résultats mitigés ont été obtenus pour les cultures horticoles, y compris la culture de fraise, avec d'autres types de substrats comme le compost de blé, la sciure de bois, les déchets à base de plantes de thym et chicorée et les écorces de bois (Recamales et coll., 2007 ; Haghighi et coll., 2014 ; Prémont, 2015 ; Ghoreishy et coll., 2018).
Tableau 1 : Caractéristiques des tourbes et de la fibre de coco.
Caractéristiques Tourbe blonde Tourbe brune Tourbe noire Fibre de coco Matière organique (% MS) 94-99 94-99 55-75 94-98 Cendre (% MS) 1-6 1-6 23-30 3-6 Porosité totale (%) 84-97 88-93 55-83 94-96 Capacité de rétention d’eau (%) 52-82 74-83 65-75 80-85 Masse volumique (g/ cc) 0,06-0,12 0,14-0,2 0,32-0,4 0.065-0.11 Capacité d’échange cationique (meq/100g) 100-150 120-170 80-150 60-130 Total d’azote (%) 0,5-2,5 0,5-2,5 1,5-3,5 0.5-0.6 C/N 30-80 20-75 10-35 70-80 pH 3,0-4,0 3,0-5,0 5,5-7,3 5-6.8 Degré de décomposition x H1-H3 H4-H6 H7-H10 _
x Adapté de Gianquinto et Pimpini, 2001 ; Von Post, 1937.
1.2.2. Les propriétés des substrats
Les propriétés physiques, chimiques et biologiques des substrats sont généralement plus favorables que celles des sols, car ces milieux de culture possèdent un complexe chimique
9
plus facile à modifier pour un besoin nutritif particulier et sont généralement exemptes de ravageurs et d’agents pathogènes. Les substrats possèdent également des propriétés particulières, le drainage, l'aération, la diffusion des gaz et la rétention d’eau par rapport aux sols (Wang et coll., 2016).
1.2.2.1. Les propriétés physiques des substrats
Lors du choix d'un substrat de culture, les caractéristiques physiques ont un impact très important dans la réponse et la réussite de la culture. La distribution granulométrique des particules de substrat est un paramètre physique important qui nous permet de connaître les proportions des particules fines et grossières contenues dans chaque substrat et de mieux comprendre plusieurs de ses propriétés, comme la porosité, la rétention en eau, l’aération (Wallach, 2008) et la conductivité hydraulique (Abad et coll., 2005, Giuffrida et Consoli, 2016). Plusieurs études ont démontré que les propriétés physiques d’un substrat dépendent de la distribution et de la taille des particules. La capacité de rétention d'eau facilement disponible et la capacité de rétention d'eau totale diminuent proportionnellement à l'augmentation de la taille des particules (Abad et coll., 2005 ; Gruda et Schnitzler, 2006). De ce fait, il est possible de contrôler la capacité de rétention en eau par l’emploi de particules de taille adéquate.
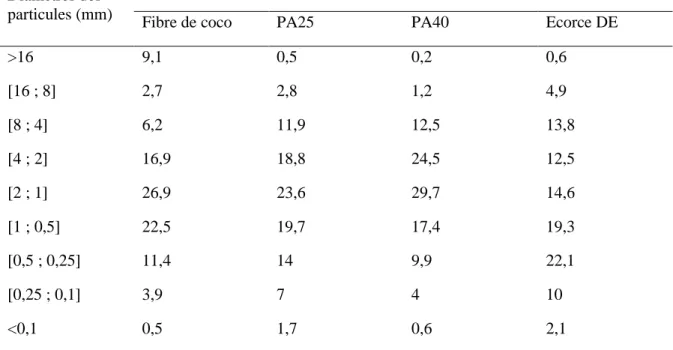
La granulométrie est la mesure de la dimension des particules du substrat de culture et s’exprime sous forme d'un rapport pondéral entre les particules élémentaires de taille différentes. Le Tableau 2 illustre la répartition des particules de quatre substrats de culture à base de 1) fibre de coco, 2) 70 % tourbe et 30 % sciure de bois (PA25), 3) 30 % tourbe +70 % sciure de bois (PA40) et 4) un substrat commercial (écorce DE).
10
Tableau 2 : Distribution des particules selon leur diamètre pour quatre substrats. Diamètres des
particules (mm)
Distribution des particules selon leur diamètre (g/100g de substrat)
Fibre de coco PA25 PA40 Ecorce DE
>16 9,1 0,5 0,2 0,6 [16 ; 8] 2,7 2,8 1,2 4,9 [8 ; 4] 6,2 11,9 12,5 13,8 [4 ; 2] 16,9 18,8 24,5 12,5 [2 ; 1] 26,9 23,6 29,7 14,6 [1 ; 0,5] 22,5 19,7 17,4 19,3 [0,5 ; 0,25] 11,4 14 9,9 22,1 [0,25 ; 0,1] 3,9 7 4 10 <0,1 0,5 1,7 0,6 2,1 Adapté de Prémont, 2015
PA25 : 70 % tourbe + 30 % sciure de bois ; PA40 :30 % tourbe + 70 % sciure de bois ; Ecorce DE : substrat commercial.
Le volume d'eau et d'air sont deux paramètres physiques importants pour le choix d’un substrat (Bilderbak, 2005 ; Wiberg et coll., 2005 ; Bunt, 1976 ; Nkongolo et Caron, 1999). La capacité de rétention d’air et d’eau d’un substrat est déterminée par la grosseur des pores entre les particules. On distingue deux types de pores. Les macropores sont des pores de grande taille qui se forment entre les grosses particules. Ces dernières libèrent rapidement l'eau, diminuant ainsi la capacité de rétention d’eau, et elles servent de réservoir d'air pour la respiration des racines. Les micropores sont les petits pores formés entre les fines particules, et avec les forces cohésives, l’eau reste dans les micropores, contribuant ainsi à la capacité de rétention d’eau (López-Galarza et coll., 2010).
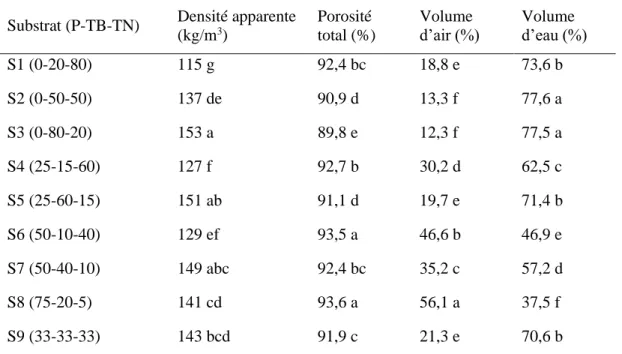
Le Tableau 3 présente les paramètres physiques, soit la densité apparente, la porosité totale, le volume d’air ainsi que le volume d’eau de 9 substrats à base de perlite disponible à un potentiel hydrique de (–1 kPa), de tourbe blonde et de tourbe noire. On peut constater que
11
l’augmentation de la proportion de perlite dans un substrat augmente le pourcentage de volume d’air et diminue la rétention d’eau.
Tableau 3 : Paramètres physiques de neuf substrats de culture.
Substrat (P-TB-TN) Densité apparente (kg/m3)
Porosité total (%)
Volume
d’air (%) Volume d’eau (%)
S1 (0-20-80) 115 g 92,4 bc 18,8 e 73,6 b S2 (0-50-50) 137 de 90,9 d 13,3 f 77,6 a S3 (0-80-20) 153 a 89,8 e 12,3 f 77,5 a S4 (25-15-60) 127 f 92,7 b 30,2 d 62,5 c S5 (25-60-15) 151 ab 91,1 d 19,7 e 71,4 b S6 (50-10-40) 129 ef 93,5 a 46,6 b 46,9 e S7 (50-40-10) 149 abc 92,4 bc 35,2 c 57,2 d S8 (75-20-5) 141 cd 93,6 a 56,1 a 37,5 f S9 (33-33-33) 143 bcd 91,9 c 21,3 e 70,6 b
Adaptée de López-Galarza et coll., 2010. P : perlite ; TB : tourbe blonde ; TN : tourbe noire
Les valeurs suivies d’une lettre différente, dans une même colonne, sont significativement différentes à P ≤ 0,05.
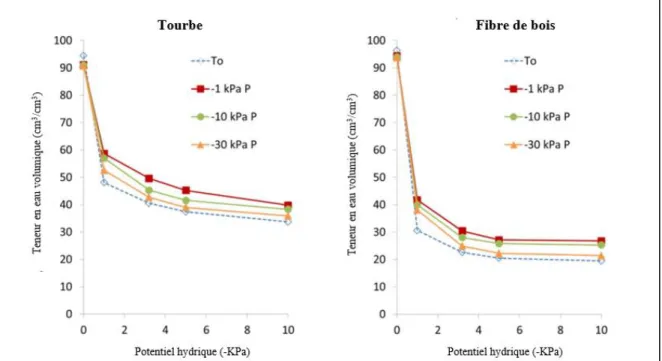
Les plantes extraient l’eau présente dans le milieu de culture grâce à leurs racines. Moins il y a d’eau dans le substrat de culture, plus l’eau est difficile à extraire par la plante. Le potentiel hydrique du sol peut être exprimé en kPa ou selon la hauteur d’une colonne d’eau, mais la notation la plus couramment utilisée par les professionnels est le pF (Michel, 1998). La valeur pF correspond au logarithme décimal du potentiel hydrique du sol (par exemple la valeur pF=1 conforme à un potentiel hydrique de -10 cm d’eau, −1KPa). La détermination de la courbe de rétention en eau, aussi appelée la courbe de pF d’un support de culture, permet de mieux connaître leurs capacités de stockage en eau. Elle indique la variation de la teneur en eau du substrat selon le potentiel matriciel. La figure 1 présente des courbes de rétention d’eau au début (T0) et
à la fin d’une expérience selon différentes stratégies d’irrigation (−1KPa, −10 KPa et −30 KPa) pour la fibre de coco, l’écorce de pin, la tourbe et la fibre de bois (Michel et Kerloch, 2017).
12
Figure 1 : Courbes de rétention d’eau au début (T0) et à la fin d’une expérience selon
différentes stratégies d’irrigation (−1 kPa, −10 kPa, −30 kPa) pour la tourbe et la fibre de bois (Michel et Kerloch, 2017).
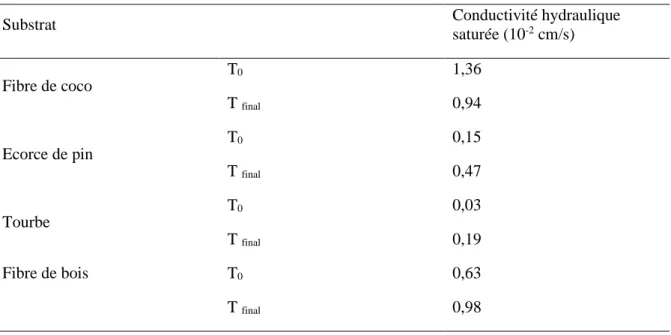
La conductivité hydraulique saturée, notée Ksat, est la capacité d’un substrat à transporter l’eau lorsqu’il est plein d’eau. C’est la taille et la distribution des particules du sol qui détermine la vitesse de déplacement de l’eau (Abad et coll., 2005). En hors-sol, ce
paramètre est calculé selon la loi de Darcy (1958) à partir de l’équation suivante : Q = 𝐾𝑠𝑎𝑡 × 𝐴 ×∆H
𝐿 Où
Q = débit (m3/s)
Ksat = conductivité hydraulique saturée (m/s) A = surface m2
ΔH = Gradient hydraulique L = hauteur de l’échantillon
En culture hors-sol, la conductivité hydraulique saturée est un indicateur de la capacité de drainage d’un substrat après une irrigation. Toutefois, chaque milieu de culture possède une conductivité hydraulique propre, qui peut varier entre le début et la fin de la culture à cause du développement racinaire et la dégradation ou la compaction du substrat. Le tableau 4
13
montre la variation de la conductivité hydraulique entre le début (28 mars) et la fin (9 septembre) de l’expérience de quatre substrats de culture.
Tableau 4 : Evolution de la conductivité hydraulique saturée de la fibre de coco, de l'écorce de pin, de la tourbe et de la fibre de bois, au début (T0) et à la fin (Tfinal) de la culture.
Substrat Conductivité hydraulique
saturée (10-2 cm/s) Fibre de coco T0 1,36 T final 0,94 Ecorce de pin T0 0,15 T final 0,47 Tourbe T0 0,03 T final 0,19 Fibre de bois T0 0,63 T final 0,98
Adapté de Kerloch et Michel (2015).
1.2.2.2. Les propriétés chimiques des substrats
En plus des propriétés physiques, un substrat de culture doit posséder des propriétés chimiques appropriées et il doit être également exempt de contaminants. Les paramètres chimiques les plus importantes sont le pH, la conductivité électrique et la capacité d’échange cationique (CEC).
Le pH du sol joue un rôle important au niveau de la disponibilité et l’absorption des éléments nutritifs (macro- et micronutriments) au niveau de la zone racinaire (Milosevic et coll., 2009 ; Gruda et coll., 2013 ; Pokhrel et coll., 2015). Bien que les plantes possèdent des exigences de pH différentes en hors-sol, le pH optimal pour la majorité des espèces végétales se situe entre 5,5 et 6,5 (Gruda et coll., 2013). Pour la culture de la fraise hors-sol, le pH optimal est de 5,8 (Coquelet et coll., 2003 ; Guérineau, 2003 ; Milosevic et coll., 2009). Un pH supérieur à 6,5 influence la croissance des racines et la disponibilité des
14
nutriments (Hargreaves et coll., 2008) et peut provoquer une diminution de la productivité (Pokhrel et coll., 2015).
La conductivité électrique (CE) d’un substrat est un indicateur de la concentration totale en ions dissous dans la solution. Souvent, les substrats de culture ayant plus de macropores permettent une lixiviation rapide et efficace, de sorte que la CE dans la solution de culture peut être contrôlée. En effet, la CE dans la zone racinaire des plantes cultivées hors-sol peut être inférieure à celle des plantes cultivées dans le sol dans des conditions d'irrigation similaires. Pour la culture hors-sol du fraisier, la CE dépend essentiellement des stades phénologiques de la plante, du climat et du substrat (Guérineau, 2003 ; Coquelet et coll., 2003). D’après Coquelet et coll. (2003), la CE de la solution d’apport doit être de 1 mS/cm en phase végétative et de 0,7 mS/cm en phase de floraison et fructification.
La capacité d'échange cationique (CEC) est une mesure de la capacité d’un milieu de croissance à adsorber les cations échangeables disponibles pour la plante et à résister à la lixiviation des nutriments pendant l'arrosage (Maher et coll., 2008). Elle est généralement exprimée en centimoles par kg de matière sèche (cmol /kg). Les CEC de certains substrats horticoles inorganiques et organiques sont présentés dans le tableau 5, ces valeurs représentent la mesure des capacités d’échanges cationiques de matériaux intacts avant utilisation (Silber, 2008).
Tableau 5: Capacité d'échange cationique (CEC) des substrats organiques et inorganiques. CEC (cmol /kg) Substrats inorganiques Perlite 25-35 Laine de roche 34 Zéolite 200-400 Substrats organiques Fibre de coco 39-60 Tourbe 90-140 Écorce de pin 98 Compost 160-180 Adapté de Silber. (2008).
15 1.2.2.3. Les propriétés biologiques des substrats
Les milieux de culture sont généralement évalués en fonction de leurs propriétés physiques et chimiques, mais aussi selon leurs propriétés biologiques. Parmi les propriétés biologiques d’un milieu de culture, on retrouve la stabilité, l’absence des agents pathogènes et des mauvaises herbes et l’immobilisation des éléments nutritifs (Prasad et Maher, 2004 ; Barrett et coll., 2016). Les milieux de culture surtout de nature organique sont souvent soumis au développement des microorganismes qui peuvent entraîner des modifications physiques indésirables (Nash et Laiche., 1981 ; Prasad et Maher, 2004). Les changements des propriétés d’un substrat sont appelés « instabilités ». Cette instabilité des milieux de culture peut être évaluée par la mesure directe de l'activité microbienne (Verhagen, 2009). Certains des problèmes majeurs de l’instabilité des milieux de culture peuvent être résolus en mélangeant les substrats de nature organiques avec des composants plus stables comme les substrats de nature inorganiques (Gruda et coll., 2000). Lorsque les microorganismes décomposent les composés carbonés dans les matériaux organiques, ils consomment les nutriments disponibles pour les plantes, ce qui peut être susceptible de nuire au développement des plantes. Finalement, un support de culture doit être exempt des agents pathogènes et des mauvaises herbes.
1.3.Effet de la culture hors-sol sur le rendement, la croissance et la qualité des fruits
L’expansion rapide de la culture hors-sol dans le monde au cours de ces dernières années peut être attribuée à leur indépendance vis-à-vis du sol et aux problèmes qui lui sont associés, à savoir la présence d’agents pathogènes du sol et son épuisement. Ce type de culture permet aussi d’augmenter la productivité, d’améliorer la croissance ainsi que la qualité des fruits (Recamales., 2007 ; Palencia et coll., 2016 ; Wang et coll., 2016 ; Martinez et coll., 2017 ; Alsmairat et coll., 2018). D’après Barrett et coll. (2016), la culture hors-sol est reconnue pour sa capacité à soutenir une production de plantes efficace et intensive. De plus, ce système de culture se caractérise par leur plus grande efficacité d'utilisation de l'eau et des éléments nutritifs et leur capacité de produire des rendements plus élevés par rapport à la culture traditionnelle en plein sol (Raviv et coll., 2002).
16
Des études ont comparé la productivité des plantes cultivées hors-sol à celle des plantes cultivées de manière plus traditionnelle et ont trouvé des différences significatives en faveur des premières. Par exemple, Martinez et coll. (2017) ont démontré que le rendement et la taille des fruits étaient plus élevés de 51 % et 6 % pour les plantes cultivées sur un substrat à base de fibre de coco par rapport aux fraisiers cultivés en plein sol. Aussi,
Palencia et coll. (2016) ont observé des rendements élevés de fraises dans des systèmes de
culture hors-sol avec des milieux de culture de fibres de coco. Selon Alsmairat et coll. (2018), les plantes de fraisiers cultivées sur un substrat coco-perlite (4 : 1 v/v) présentent un taux de photosynthèse, une transpiration, et une fermeté des fruits plus élevés, alors que celles cultivées sur le substrat tourbe-perlite (4 : 1 v/v) présentent un rendement, un nombre de fruits ainsi qu’un calibre en fruits plus élevés par rapport aux autres substrats, 1) 100% tuf, 2) coco-perlite, 3) coco-tuf et tourbe-tuf.
La croissance et le développement des plantes sont influencés par les milieux de culture et leurs caractéristiques (Alsmairat et coll., 2018). Les propriétés physiques telles que le drainage, l'aération, la diffusion des gaz et la rétention d'eau sont les composantes qui conduisent à une saine croissance des plantes. Par ailleurs, la disponibilité des éléments nutritifs dans le substrat influence le développement des racines (Leskovar et Othman, 2016). Par exemple, la disponibilité des nitrates et du phosphore dans les substrats de culture détermine l'architecture et le développement du système racinaire (Linkohr et coll., 2002). Toutefois, une forte teneur en nitrates dans un milieu de culture diminue la longueur et la surface du système racinaire (Leskovar et Othman, 2016). Plusieurs études ont montré que la croissance et la biomasse des plantes cultivées en hors-sol étaient plus élevées que les plantes cultivées en plein sol. Selon Wang et coll. (2016) la biomasse sèche des plants de fraisier cultivées sur un substrat de fibre de coco et de tourbe-écorce de riz ont été plus élevées de 33% et 48 %, respectivement, par rapport aux plantes cultivées en plein sol. De plus, Taghavi et coll. (2017) ont montré que la surface foliaire des plants cultivées sur un substrat à base d’écorce de bois était trois fois plus élevée que celle de plantes cultivées sur un substrat à base de sable.
17
La qualité des fraises dépend de leur apparence (intensité et répartition de la couleur rouge, taille et forme des fruits, absence de malformation et de pourriture), ainsi que de leur fermeté et leur goût (déterminée par la teneur en sucres, en composés aromatiques, par l’acidité) (Ke et Kader, 1990). Des recherches ont montré que certains facteurs agronomiques tels que la fertilisation azotée, le type de cultivar, l’irrigation, le stress salin et différents systèmes de culture modifient la qualité des fraises (Cantliffe et coll., 2007 ; Terry et al., 2007 ; Keutgen et Pawlzik, 2007 ; Giné Bordonaba et Terry, 2010). Recamales et coll. (2007) ont comparé la qualité des fraises de plantes issues de la culture hors-sol et de plantes cultivées en plein sol et ont montré que les fruits provenant de la culture hors-sol avaient une acidité et une teneur en solides solubles plus faibles. D’autre part, Martinez et coll. (2017) ont observé que la qualité des fruits, la fermeté, la teneur en anthocyane et la teneur en sucres étaient significativement plus élevées au début et à la fin du cycle de culture pour les fruits cultivés sur le substrat fibre de coco par rapport à ceux cultivés en sol.
18 1.4. Hypothèses et objectifs
Dans le cadre de ce projet de recherche, les hypothèses suivantes ont été émises :
✓ La culture hors-sol au champ permet une meilleure croissance et productivité des fraisiers par rapport à la culture traditionnelle en plein sol.
✓ La réutilisation des mélanges tourbeux sur plusieurs saisons n’affecte pas la performance agronomique du fraisier.
✓ Les substrats conservent des propriétés physiques et chimiques permettant la culture du fraisier sur plusieurs saisons.
L’objectif général de la présente étude étaient de déterminer la performance agronomique de différents substrats tourbeux pour la culture hors-sol des fraisiers à jours neutres cultivés au champ et d’évaluer le potentiel de réutilisation des substrats pour une deuxième année de culture.
Les objectifs spécifiques sont de déterminer l’effet des substrats de culture et leur réutilisation pour une deuxième année de culture sur :
- Les propriétés physico-chimiques des substrats - La croissance et le développement du fraisier - La productivité des cultures
19
Chapitre 2 : Matériel et méthodes
2.1. Site expérimental
Deux expériences, échelonnées sur deux saisons de culture, 2017 et 2018, ont été menées à la ferme Les Fraises de l’Île d’Orléans Inc. (FIO), située à St-Laurent de l’Île d’Orléans (latitude 46° 52′ 0″ N, longitude 71° 1′0″ W). Lors de la première expérience, quatre traitements ont été comparés, soit trois substrats tourbeux (D1, D2 et D3) et un quatrième traitement avec le substrat D1 cultivé sous muni tunnel. En 2018, les mêmes substrats (D1, D2 et D3) ont été comparés au cours d’une deuxième année d’utilisation (1 an vs 2 ans). Un témoin en plein sol a également été utilisé lors des deux années d’expérimentation.
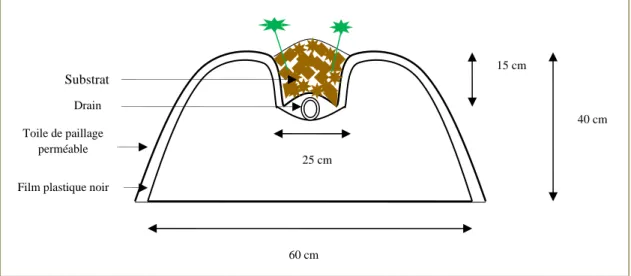
Les expériences ont été réalisées au champ en conditions hors-sol, sur des buttes surélevées supportant le substrat (figure 2) et en plein sol. Pour construire les buttes surélevées, le sol a été travaillé mécaniquement de manière à fabriquer des buttes de 40 cm de hauteur, 35 cm de largeur au sommet et 60 cm à la base. Une rigole de 25 cm de largeur et 15 cm de profondeur, a été formée sur le dessus de la butte pour recevoir les substrats. Les buttes surélevées ont été recouvertes la première fois d’un paillis de plastique noir, qui joue un rôle de barrière entre le sol et le substrat et pour éviter la croissance des mauvaises herbes. Un tuyau de drainage agricole, perforé d’un diamètre de 45 mm et 75 m de long, a été déposé au fond de la rigole sur toute sa longueur afin de récupérer la solution de drainage. Les drains ont été par la suite recouverts par une toile de paillage agro-textile perméable (en polypropylène d'une épaisseur de 100 µm et de largeur de 1,45 m x 75 m de long) afin de faciliter le drainage d’excès d’eau dans le substrat. Chaque substrat a été placé mécaniquement sur la toile de paillage, à raison de 3 litres de substrat/plant.
2.2. Substrat
Trois substrats tourbeux ont été étudiés, soit des mélanges de faible densité (D1), de moyenne densité (D2) et de densité élevée (D3) fabriqués par les Tourbières Berger (Saint-Modeste, Canada) (www.berger.ca) (Tableau 6). Le mélange de type D1 était constitué de
20
85 % de sphaigne blonde (grossière) et de 15 % de perlite horticole. Le D2 était composé de 60 % de tourbe blonde grossière et 40 % de fibre de bois alors que le troisième substrat D3, contenait 15 % de copeaux de coco (gros agrégats), 25 % de fibre de bois et 60 % de tourbe blonde grossière. Tous les substrats ont été amendés de 1,8 kg/m3 d’engrais à libération lente de types 18-6-8 (Nutricote) avec une libération de 70 jours et 100 jours, respectivement, pour l’année 2017 et 2018. Ces engrais contenaient de l’azote, du phosphore, de la potasse, du magnésium, du soufre, du bore, du cuivre, du fer, du manganèse et du molybdène sous forme enrobée (Annexe1). L’influence des différents substrats sur la croissance et la productivité du fraisier a été étudiée et les résultats obtenus ont été comparés à un témoin en plein sol.
Figure 2 : Culture hors-sol sur butte surélevée. 2.2.1. Propriétés physico-chimiques
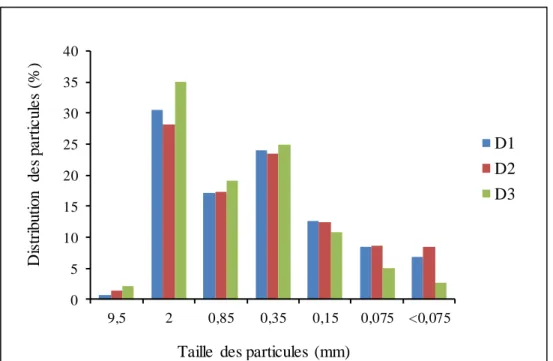
Avant le début de la culture, une caractérisation physico-chimique des substrats a été effectuée par le laboratoire de la compagnie Tourbière Berger. Les paramètres physiques mesurés étaient la masse volumique humide et sèche, la rétention hydrique, la mouillabilité, la porosité totale, la capacité en air, la capacité en contenant des substrats (Tableau 6). De plus, une analyse granulométrique a été effectuée pour chaque substrat (Figure 3).
Film plastique noir Toile de paillage perméable Drain Substrat 60 cm 25 cm 15 cm 40 cm
21
La masse volumique humide a été déterminée sur la base du volume du substrat et de la masse humide du substrat à la réception de l’échantillon :
Masse volumique humide (g/L) = masse du substrat (g) volume du substrat (L)
La masse volumique sèche a été déterminée sur la base du volume du substrat et de la masse sèche du substrat à 105 ° C pendant 24 h :
Masse volumique sèche (g/L) = masse du substrat sèchée (g) volume du substrat sèchée (L)
Afin de mesurer la rétention hydrique, une saturation d’un volume du substrat de 250 ml a été effectué, le mélange a été laissé égoutter jusqu’à ce que le temps entre 2 gouttes soit supérieur à 5 minutes, par la suite la masse humide du substrat a été mesuré. Pour la détermination de la masse sèche, le substrat a été séché pendant 24 h à 105 ° C. la rétention hydrique du substrat est calculer comme suit :
Rétention hydrique =masse du substrat humide (g) masse du substrat sèche (g)
La mouillabilité est le temps, en seconde, d’absorption d’un volume de 200 ml d’eau par 40 g de substrat non compacté. La porosité totale, la capacité en air et la capacité en contenant ont été déterminées à partir du courbe de rétention en eau. Par ailleurs, La distribution granulométrique a été obtenue par tamisage des particules (ouvertures des tamis : 9,5, 2, 0,85, 0,35, 0,15 et 0,075 mm) et en pesant le contenu retenu par chaque tamis.
22
Tableau 6: Propriétés physiques initiales des trois substrats tourbeux. Traitements Unité D1 D2 D3 Masse volumique humide (g/l) 160,5 150,4 154,4 Masse volumique sèche (g/l) 67,8 81 104,4 Porosité totale (%) 98,9 97,6 99,7 Capacité en air (%) 25,7 30,6 34 Capacité en contenant (%) 73,1 67 65,7 Rétention hydrique (g/g) 8,8 10,2 8,3 Mouillabilité (Seconde) 37 5 >=120
D1= 85 % tourbe + 15 % perlite ; D2= 60 % tourbe + 40 % fibre de bois ; D3= 60% tourbe + 15% coco chips + 25 % fibre de bois.
D1= 85 % tourbe + 15 % perlite ; D2= 60 % tourbe + 40 % fibre de bois ; D3= 60% tourbe + 15% coco chips + 25 % fibre de bois.
Figure 3: Distribution des particules des substrats, D1, D2 et D3.
Le pH, la conductivité électrique et les concentrations d'éléments minéraux des substrats ont été déterminés selon la méthode de l'extrait de milieu saturé (SME) (CPVQ, 1988) (tableau 7). Un volume de 150 ml du substrat a été mélangé à 200 ml d'eau distillé jusqu'à
0 5 10 15 20 25 30 35 40 9,5 2 0,85 0,35 0,15 0,075 <0,075 D is tri b u ti o n d e s p a rt ic u le s (% )
Taille des particules (mm)
D1 D2 D3
23
saturation, le mélange a été laissé sur le banc pendant 1 h, et le pH a ensuite été mesuré dans l'échantillon saturé. Les échantillons ont été filtrés à travers un filtre et toutes les analyses ultérieures ont été effectuées sur les filtrats. Le fer, le zinc, le manganèse, le potassium, le calcium, le magnésium, le sodium, le phosphore, le molybdène et l’aluminium ont été analysés par spectrométrie d’émission atomique au plasma ICP (Perkin Elmer, Modèle Optima 8300 DV). Le nitrate, l’ammonium et la conductivité électrique ont été quantifiés par FIA (QuickChem 8500).
Tableau 7: Propriétés chimiques initiales des substrats.
D1= 85 % tourbe + 15 % perlite ; D2= 60 % tourbe + 40 % fibre de bois ; D3= 60% tourbe + 15% coco chips + 25 % fibre de bois. D1 D2 D3 Conductivité électrique (mS cm-1) 1,12 1,15 1,03 pH 5,29 5,27 5,35 Eléments minéraux (ppm) Ammonium 11,6 5,2 0,2 Nitrate 38,9 53,1 39,9 Potassium 66,2 84 117,8 Phosphore 9,9 13,7 5,9 Calcium 124,2 126,5 73 Sulfate 341,3 294,3 226,5 Magnésium 35,4 40,4 30,6 Sodium 11,6 15,4 38,2 Fer 1,24 1,04 0,56 Manganèse 0,52 0,73 0,24 Molybdène 0,02 0,02 0,02 Zinc 0,28 0,21 0,72 Aluminium 0,13 0,14 0,95 Bore 0,12 0,46 0,12
24 2.3. Matériel végétal
La variété à jours neutres Seascape a été utilisée pendant les deux années d’expérimentation. Seascape est une variété crée par les docteurs Bringhurst et Voth à l'Université de la Californie aux États-Unis en 1983. Elle résulte du croisement entre les variétés Selva et Douglas (Bringhurst et Voth, 1991). Elle se caractérise par un potentiel de production élevée, de fruits de gros calibres, une bonne fermeté et une saveur appréciée. Par contre, elle est vulnérable au blanc, très susceptible aux tétranyques à deux-points et les fruits sont sensibles aux dommages causés par la pluie (MAAARO, 2016).
Des trayplants produits à la ferme des Fraises de l’Île d’Orléans ont été utilisés pour la première année d’expérimentation et des plants mottes fournis par l’entreprise Pépinière Lareault Inc. (Lavaltrie, Québec, Canada) ont été utilisés au cours de la deuxième année d’expérimentation. Les plants de fraisiers ont été transplantés sur des planches en plein sol et sur buttes surélevées en hors-sol. En hors-sol, la plantation a été effectuée le 5 mai 2017 et le 9 mai 2018. Les plants de fraisiers ont été disposés en quinconce et espacés de 30 cm, ce qui équivaut une densité de 7,1 plants/ mètre linéaire. En plein sol, la transplantation a été effectuée le 10 mai 2017 et le 9 mai 2018, 10 jours après la fumigation du sol avec une dose de 60 L/ha de chloropicrine 100. La même densité de plantation, 7,1 plants/ mètre linéaire, a été aussi utilisée en plein sol.
Tout au long des deux saisons, les stolons ont été coupés afin d’améliorer la production en fruits. Les solutions nutritives ont été ajustées en fonction du stade de développement des plants comme indiqué au tableau 8. La fertigation a été apportée par un système goutte-à-goutte avec un nombre d’émetteurs égal à 9 par mètre linéaire, c’est l’équivalent de 1,3 gouteurs / plante. Les irrigations ont été effectuées deux fois au courant de la journée, entre 10h00 et 16h00 et la quantité de la solution fertilisante par irrigation a été en moyenne de
25
250 mL et 350 mL par goutteur. Les tuyaux d’irrigation ont été installé au milieu de chaque rigole.
2.4. Dispositif expérimental
La première année d’expérimentation, en 2017, un dispositif en blocs complets aléatoires (figure 4A) comprenant cinq traitements (D1 sans et avec muni tunnel, D2, D3 et un témoin en sol fumigé) et 4 répétitions a été mis en place. Les unités expérimentales en hors-sol et au plein sol étaient respectivement des rangs de 72 m et de 8 m de long. Les plants de fraisiers ont été disposés en quinconce et espacés de 30 cm. La densité de plantation en hors sol est de 46 000 plants/ha et 48 000 plants/ha en plein sol.
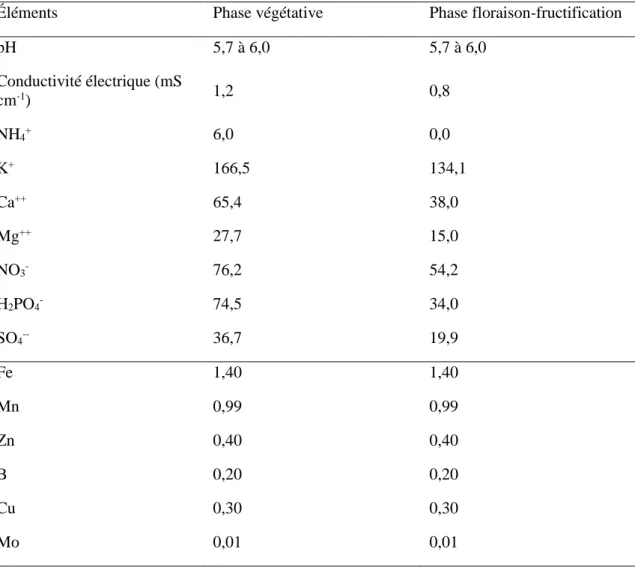
Tableau 8 : Composition minérale des solutions nutritives utilisées en µL L-1.
Éléments Phase végétative Phase floraison-fructification
pH 5,7 à 6,0 5,7 à 6,0 Conductivité électrique (mS cm-1) 1,2 0,8 NH4+ 6,0 0,0 K+ 166,5 134,1 Ca++ 65,4 38,0 Mg++ 27,7 15,0 NO3- 76,2 54,2 H2PO4- 74,5 34,0 SO4-- 36,7 19,9 Fe 1,40 1,40 Mn 0,99 0,99 Zn 0,40 0,40 B 0,20 0,20 Cu 0,30 0,30 Mo 0,01 0,01
26
Pour la deuxième année d’expérimentation, un dispositif en blocs complets aléatoires a été mis en place (figure 4B), constitué de quatre répétitions (4 blocs), avec une structure factorielle, deux années d’utilisation de substrats et trois types de substrat (2 x 3) avec l’ajout d’un témoin en plein sol. Les unités expérimentales en hors-sol et au plein sol étaient respectivement des rangs de 20 m et de 2 m de long.
D1= 85 % tourbe + 15 % perlite ; D2= 60 % tourbe + 40 % fibre de bois ; D3= 60% tourbe + 15% coco chips + 25 % fibre de bois ; D1+MT= D1 avec mini-tunnel ; SF= sol fumigé.
Figure 4 : Représentation schématique du dispositif expérimental en 2017 (A) et 2018 (B). 2.5. Climat
La température et l’humidité de l’air ont été mesurées à 15 cm au-dessus du sol et la température du sol à 10 cm de profondeur. La température et l’humidité de l’air ont été enregistrées toutes les 15 minutes pendant les expériences, avec des capteurs-enregistreurs Hobo (Onset Computer Corporation, U12-012) protégés par un écran anti-rayonnement
4,8 m 2 m D1-1an D1-2ans D2-1an D2 -2ans D3-1an D3-2ans SF 40 m Bloc 1 Bloc 2 Bloc 3 Bloc 4 G a rd e G a rd e G a rd e G a rd e A B
27
solaire. Par ailleurs, la température du sol a été mesuré à l’aide d’un fil capteur lié aux enregistreurs Hobo. Pour la première année, les capteurs ont été installés dans une seule répétition pour chacun des traitements (D1, D2, D3 et D1 avec mini-tunnel) sauf pour le témoin en plein sol, alors qu’au cours de la deuxième année d’expérimentation, les capteurs ont été installés dans les traitements D1-2 ans, D2-2 ans, D3-2 ans et D2-1 an. Au milieu du dispositif, un pluviomètre a été placé à un mètre au-dessus du sol pour mesurer la quantité de précipitations reçue au cours de deux saisons de production.
2.6. Mesure des paramètres édaphiques
2.6.1. Mesure de la tension du sol
En culture hors-sol, la gestion de l’irrigation a été effectuée par tensiométrie afin d’optimiser l’utilisation de l’eau et d’augmenter le rendement des récoltes (Lemay et coll., 2012). En 2017, quatre tensiomètres (modèle céramique) munis d’un capteur de pression (PTD25-20-VH) (ProSense, Allemagne) ont été installés dans une seule répétition de chaque traitement (D1, D2, D3 et D1 avec mini-tunnel) à une profondeur de 15 cm pour rapporter des données supplémentaires sur l’irrigation en fonction du potentiel matriciel du substrat. En 2018, chaque deux semaines deux tensiomètres ont été placés dans le même substrat d’un an et deux ans. Les données ont été enregistrées chaque 10 minutes à l’aide d’un acquisiteur de données (LabView #, Automate industriel) (États-Unis).
2.6.2. Analyse minérale du lixiviat
En fin de journée après l’irrigation, des mesures du volume, de la conductivité électrique (CE) et du pH ont été effectuées quotidiennement pour la solution d’apport et la solution de drainage, pour chaque unité expérimentale à l’aide d'un pH-mètre (Oakton Waterproof pHTestr 10 Pocket Tester 35634-10) et un conductimètre (OaktonWaterproof EcoTestr EC High Meter, WD-35462-35).
2.6.3. Caractérisation physique des substrats
A la fin d’expérience, la caractérisation physique des substrats a été effectuée en mesurant la masse volumique apparente, la porosité totale, la capacité en air, la capacité en contenant, et en mesurant l’eau disponible et l’eau facilement disponible. Pour déterminer les courbes
28
de rétention, le prélèvement d'un échantillon de sol par unité expérimentale a été effectué à l'aide d'un cylindre, en acier inoxydable de 5 cm de diamètre et 10 cm de hauteur en enfonçant manuellement le cylindre dans le milieu de culture par un mouvement de rotation. Une fois le cylindre enfoncé sur toute sa longueur, il a été retiré à la main ou avec une pelle. Le surplus de substrat a été enlevé à l’aide d’un couteau et le cylindre a été par la suite couvert d’une toile pour le protéger. Après le prélèvement de quatre échantillons par traitement, des analyses ont été effectuées au moyen d’une table de tension (Equi-pF, Streat Instrument). Les caractéristiques physiques des substrats testés ont été déterminées en utilisant la méthode décrite par De Boodt et Verdonk (1972) pour mesurer la courbe de rétention d’eau des substrats organiques. Selon cette méthode les valeurs, déterminées par les différences de niveaux sur la courbe.
- La porosité total (%) est l’espace total des pores déterminé à un potentiel matriciel égal à 0 cm d'eau.
- La capacité en air (%) est la différence de capacité entre 0 et -10 cm d'eau.
- La capacité en contenant (%) est égale à la teneur maximale en eau qu'un substrat peut atteindre après un drainage. Elle est déterminée à un potentiel matriciel égal à -10 cm d'eau.
Deux intervalles d'eau disponible couramment utilisés à des fins horticoles (De Boodt et coll., 1974) ont également été déterminés.
- Eau disponible(%) est l’eau libérée du substrat lorsque la capacité augmente de -10 à -100 cm d'eau.
- Eau facilement disponible (%) est l’eau libérée du substrat entre les potentiels matriciels -10 à -50 cm d'eau.
- Eau non disponible est déterminé lorsque le potentiel matriciel et supérieur à -100 cm d’eau.
2.7. Mesure de la croissance et la biomasse
En début de saison, 3 plants de fraisiers par unité expérimentale ont été choisis aléatoirement et identifiés. La croissance des fraisiers a été déterminée en mesurant le
29
nombre et le diamètre des couronnes, le nombre de feuilles et le nombre d’inflorescences. Ces mesures ont été effectuées 4 fois en 2017, soit le 12 juin, 11 juillet, 14 août et le 18 septembre, et à 4 reprises en 2018, soit le 26 juin, 24 juillet, 23 août et le 24 septembre.
La biomasse des fraisiers (3 plantes par unité expérimentale) a été déterminée en mesurant la masse fraiche et sèche des parties aérienne (feuilles et tiges) et racinaire. Pour la détermination de la masse sèche, les plants ont été séchés dans une étuve à 60°C durant 48 heures dans des sacs en papier. Au préalable, les racines ont été lavées soigneusement à l’eau pour enlever les résidus de substrat, puis l’eau superficielle a été enlevée en épongeant les racines à l’aide du papier absorbant. Ces mesures ont été effectuées deux fois, soit le 15 juillet et le 15 septembre, au cours de chaque saison.
2.8. Rendement et qualité des fruits
Au cours des deux années d’expérimentation, douze plants situés côte à côte au centre de chaque unité expérimentale ont été sélectionnés et identifiés pour la récolte. La récolte a débuté le 19 et le 29 juin et s’est terminée le 12 et le 1er octobre, respectivement, pour la
première et la deuxième année. Les fruits ont été récoltés trois fois par semaine, sauf durant les deux dernières semaines où deux récoltes par semaine ont été effectuées. À chaque récolte, les fraises ont été classées (fruits vendables et fruits non vendables), comptées et pesées à l’aide d’une balance OHAUS (www.ohaus.ca). Les paramètres mesurés étaient le rendement total en fruits, le rendement vendable, le calibre moyen de fruits et le pourcentage de fruits vendables. Les fruits ont été déclassés lorsqu’ils présentaient des symptômes de pourriture grise (Botrytis cinerea), d’anthracnose (Colletotrichum acutatum), ou lorsqu’ils étaient malformés ou trop petits (poids inférieur à 4 g). Pour la teneur en sucres solubles, trois fruits ont été écrasés et le jus de la fraise a été utilisé pour faire les mesures de ° Brix. Cette mesure a été effectuée chaque 2 semaines, pour les deux années d’expérimentations 2017 et 2018, à l’aide d’un réfractomètre digital ATAGO PAL-1 (Tokyo, Japon) dont l’échelle de graduation variait de 0 à 53 ° Brix.