HAL Id: dumas-01683035
https://dumas.ccsd.cnrs.fr/dumas-01683035
Submitted on 12 Jan 2018
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Chirurgie aortique dans le syndrome de Marfan : faut-il
traiter systématiquement la crosse ?
Anne-Sophie da Silva
To cite this version:
Anne-Sophie da Silva. Chirurgie aortique dans le syndrome de Marfan : faut-il traiter systématique-ment la crosse ?. Médecine humaine et pathologie. 2017. �dumas-01683035�
1
FACULTÉ MIXTE DE MÉDECINE ET DE PHARMACIE DE ROUEN
ANNÉE 2017 N°
THÈSE POUR LE
DOCTORAT EN MEDECINE
(Diplôme d’État) PARDA SILVA Anne-Sophie
NEE LE 27 FEVRIER 1988 à NOISY-LE-GRAND (93160)
PRESENTÉE ET SOUTENUE PUBLIQUEMENT LE 17 OCTOBRE 2017
CHIRURGIE AORTIQUE DANS LE SYNDROME DE MARFAN : FAUT-IL TRAITER
SYSTÉMATIQUEMENT LA CROSSE ?
PRÉSIDENTE DE JURY : Professeur H. ELTCHANINOFF
2
ANNEE UNIVERSITAIRE 2016 - 2017
U.F.R. DE MEDECINE ET DE PHARMACIE DE ROUEN ---
DOYEN : Professeur Pierre FREGER
ASSESSEURS : Professeur Michel GUERBET
Professeur Benoit VEBER Professeur Pascal JOLY Professeur Stéphane MARRET
I - MEDECINE
PROFESSEURS DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mr Frédéric ANSELME HCN Cardiologie Mme Isabelle AUQUIT AUCKBUR HCN Chirurgie plastique
Mr Fabrice BAUER HCN Cardiologie
Mme Soumeya BEKRI HCN Biochimie et biologie moléculaire
Mr Ygal BENHAMOU HCN Médecine interne
Mr Jacques BENICHOU HCN Bio statistiques et informatique médicale Mme Bouchra LAMIA Havre Pneumologie
Mr Olivier BOYER UFR Immunologie
Mr François CARON HCN Maladies infectieuses et tropicales
Mr Philippe CHASSAGNE (détachement) HCN Médecine interne (gériatrie) – Détachement Mr Vincent COMPERE HCN Anesthésiologie et réanimation chirurgicale Mr Jean-Nicolas CORNU HCN Urologie
Mr Antoine CUVELIER HB Pneumologie
Mr Pierre CZERNICHOW (surnombre) HCH Epidémiologie, économie de la santé Mr Jean-Nicolas DACHER HCN Radiologie et imagerie médicale
Mr Stéfan DARMONI HCN Informatique médicale et techniques de communication Mr Pierre DECHELOTTE HCN Nutrition
3
Mr Frédéric DI FIORE CB Cancérologie
Mr Fabien DOGUET HCN Chirurgie Cardio Vasculaire
Mr Jean DOUCET SJ Thérapeutique - Médecine interne et gériatrie
Mr Bernard DUBRAY CB Radiothérapie
Mr Philippe DUCROTTE HCN Hépato-gastro-entérologie
Mr Frank DUJARDIN HCN Chirurgie orthopédique - Traumatologique
Mr Fabrice DUPARC HCN Anatomie - Chirurgie orthopédique et traumatologique
Mr Eric DURAND HCN Cardiologie
Mr Bertrand DUREUIL HCN Anesthésiologie et réanimation chirurgicale Mme Hélène ELTCHANINOFF HCN Cardiologie
Mr Thierry FREBOURG UFR Génétique
Mr Pierre FREGER HCN Anatomie - Neurochirurgie Mr Jean François GEHANNO HCN Médecine et santé au travail Mr Emmanuel GERARDIN HCN Imagerie médicale
Mme Priscille GERARDIN HCN Pédopsychiatrie Mr Michel GODIN (surnombre) HB Néphrologie M. Guillaume GOURCEROL HCN Physiologie Mr Dominique GUERROT HCN Néphrologie Mr Olivier GUILLIN HCN Psychiatrie Adultes Mr Didier HANNEQUIN HCN Neurologie
Mr Fabrice JARDIN CB Hématologie
Mr Luc-Marie JOLY HCN Médecine d’urgence Mr Pascal JOLY HCN Dermato - Vénéréologie
Mme Annie LAQUERRIERE HCN Anatomie et cytologie pathologiques Mr Vincent LAUDENBACH HCN Anesthésie et réanimation chirurgicale Mr Joël LECHEVALLIER HCN Chirurgie infantile
Mr Hervé LEFEBVRE HB Endocrinologie et maladies métaboliques
Mr Thierry LEQUERRE HB Rhumatologie
Mme Anne-Marie LEROI HCN Physiologie
Mr Hervé LEVESQUE HB Médecine interne
Mme Agnès LIARD-ZMUDA HCN Chirurgie Infantile Mr Pierre Yves LITZLER HCN Chirurgie cardiaque
Mr Bertrand MACE HCN Histologie, embryologie, cytogénétique
4 Mr Christophe MARGUET HCN Pédiatrie Mme Isabelle MARIE HB Médecine interne Mr Jean-Paul MARIE HCN Oto-rhino-laryngologie Mr Loïc MARPEAU HCN Gynécologie - Obstétrique
Mr Stéphane MARRET HCN Pédiatrie
Mme Véronique MERLE HCN Epidémiologie
Mr Pierre MICHEL HCN Hépato-gastro-entérologie M. Benoit MISSET HCN Réanimation Médicale Mr Jean-François MUIR (surnombre) HB Pneumologie
Mr Marc MURAINE HCN Ophtalmologie
Mr Philippe MUSETTE HCN Dermatologie - Vénéréologie Mr Christophe PEILLON HCN Chirurgie générale
Mr Christian PFISTER HCN Urologie
Mr Jean-Christophe PLANTIER HCN Bactériologie - Virologie Mr Didier PLISSONNIER HCN Chirurgie vasculaire Mr Gaëtan PREVOST HCN Endocrinologie Mr Bernard PROUST HCN Médecine légale
Mr Jean-Christophe RICHARD (détachement) HCN Réanimation médicale - Médecine d’urgence Mr Vincent RICHARD UFR Pharmacologie
Mme Nathalie RIVES HCN Biologie du développement et de la reproduction Mr Horace ROMAN HCN Gynécologie - Obstétrique
Mr Jean-Christophe SABOURIN HCN Anatomie - Pathologie Mr Guillaume SAVOYE HCN Hépato-gastrologie Mme Céline SAVOYE–COLLET HCN Imagerie médicale Mme Pascale SCHNEIDER HCN Pédiatrie
Mr Michel SCOTTE HCN Chirurgie digestive Mme Fabienne TAMION HCN Thérapeutique
Mr Luc THIBERVILLE HCN Pneumologie
Mr Christian THUILLEZ (surnombre) HB Pharmacologie
Mr Hervé TILLY CB Hématologie et transfusion
M. Gilles TOURNEL HCN Médecine Légale
Mr Olivier TROST HCN Chirurgie Maxillo-Faciale Mr Jean-Jacques TUECH HCN Chirurgie digestive Mr Jean-Pierre VANNIER (surnombre) HCN Pédiatrie génétique
5
Mr Pierre VERA CB Biophysique et traitement de l’image
Mr Eric VERIN HB Service Santé Réadaptation
Mr Eric VERSPYCK HCN Gynécologie obstétrique Mr Olivier VITTECOQ HB Rhumatologie
Mr Jacques WEBER HCN Physiologie
MAITRES DE CONFERENCES DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mme Noëlle BARBIER-FREBOURG HCN Bactériologie – Virologie Mme Carole BRASSE LAGNEL HCN Biochimie
Mme Valérie BRIDOUX HUYBRECHTS HCN Chirurgie Vasculaire Mr Gérard BUCHONNET HCN Hématologie Mme Mireille CASTANET HCN Pédiatrie Mme Nathalie CHASTAN HCN Neurophysiologie
Mme Sophie CLAEYSSENS HCN Biochimie et biologie moléculaire
Mr Moïse COEFFIER HCN Nutrition
Mr Manuel ETIENNE HCN Maladies infectieuses et tropicales
Mr Serge JACQUOT UFR Immunologie
Mr Joël LADNER HCN Epidémiologie, économie de la santé Mr Jean-Baptiste LATOUCHE UFR Biologie cellulaire
Mr Thomas MOUREZ HCN Virologie
Mme Muriel QUILLARD HCN Biochimie et biologie moléculaire Mme Laëtitia ROLLIN HCN Médecine du Travail
Mr Mathieu SALAUN HCN Pneumologie
Mme Pascale SAUGIER-VEBER HCN Génétique Mme Anne-Claire TOBENAS-DUJARDIN HCN Anatomie
Mr David WALLON HCN Neurologie
PROFESSEUR AGREGE OU CERTIFIE
Mme Dominique LANIEZ UFR Anglais – retraite 01/10/2016
6
II - PHARMACIE PROFESSEURS
Mr Thierry BESSON Chimie Thérapeutique
Mr Jean-Jacques BONNET Pharmacologie
Mr Roland CAPRON (PU-PH) Biophysique
Mr Jean COSTENTIN (Professeur émérite) Pharmacologie
Mme Isabelle DUBUS Biochimie
Mr Loïc FAVENNEC (PU-PH) Parasitologie
Mr Jean Pierre GOULLE (Professeur émérite) Toxicologie
Mr Michel GUERBET Toxicologie
Mme Isabelle LEROUX - NICOLLET Physiologie
Mme Christelle MONTEIL Toxicologie
Mme Martine PESTEL-CARON (PU-PH) Microbiologie
Mme Elisabeth SEGUIN Pharmacognosie
Mr Rémi VARIN (PU-PH) Pharmacie clinique
Mr Jean-Marie VAUGEOIS Pharmacologie
Mr Philippe VERITE Chimie analytique
MAITRES DE CONFERENCES
Mme Cécile BARBOT Chimie Générale et Minérale
Mr Jérémy BELLIEN (MCU-PH) Pharmacologie
Mr Frédéric BOUNOURE Pharmacie Galénique
Mr Abdeslam CHAGRAOUI Physiologie
Mme Camille CHARBONNIER (LE CLEZIO) Statistiques
Mme Elizabeth CHOSSON Botanique
Mme Marie Catherine CONCE-CHEMTOB Législation pharmaceutique et économie de la santé
Mme Cécile CORBIERE Biochimie
Mr Eric DITTMAR Biophysique
Mme Nathalie DOURMAP Pharmacologie
7
Mme Dominique DUTERTE- BOUCHER Pharmacologie
Mr Abdelhakim ELOMRI Pharmacognosie
Mr François ESTOUR Chimie Organique
Mr Gilles GARGALA (MCU-PH) Parasitologie
Mme Nejla EL GHARBI-HAMZA Chimie analytique
Mme Marie-Laure GROULT Botanique
Mr Hervé HUE Biophysique et mathématiques
Mme Laetitia LE GOFF Parasitologie – Immunologie
Mme Hong LU Biologie
Mme Marine MALLETER Toxicologie
Mme Sabine MENAGER Chimie organique
Mme Tiphaine ROGEZ-FLORENT Chimie analytique
Mr Mohamed SKIBA Pharmacie galénique
Mme Malika SKIBA Pharmacie galénique
Mme Christine THARASSE Chimie thérapeutique
Mr Frédéric ZIEGLER Biochimie
PROFESSEURS ASSOCIES
Mme Cécile GUERARD-DETUNCQ Pharmacie officinale Mr Jean-François HOUIVET Pharmacie officinale
PROFESSEUR CERTIFIE
Mme Mathilde GUERIN Anglais
ASSISTANT HOSPITALO-UNIVERSITAIRE
Mme Sandrine DAHYOT Bactériologie
ATTACHES TEMPORAIRES D’ENSEIGNEMENT ET DE RECHERCHE
Mr Souleymane ABDOUL-AZIZE Biochimie
Mme Hanane GASMI Galénique
Mme Caroline LAUGEL Chimie organique
8
LISTE DES RESPONSABLES DES DISCIPLINES PHARMACEUTIQUES
Mme Cécile BARBOT Chimie Générale et minérale
Mr Thierry BESSON Chimie thérapeutique
Mr Roland CAPRON Biophysique
Mme Marie-Catherine CONCE-CHEMTOB Législation et économie de la santé
Mme Elisabeth CHOSSON Botanique
Mr Jean-Jacques BONNET Pharmacodynamie
Mme Isabelle DUBUS Biochimie
Mr Loïc FAVENNEC Parasitologie
Mr Michel GUERBET Toxicologie
Mr François ESTOUR Chimie organique
Mme Isabelle LEROUX-NICOLLET Physiologie
Mme Martine PESTEL-CARON Microbiologie
Mme Elisabeth SEGUIN Pharmacognosie
Mr Mohamed SKIBA Pharmacie galénique
Mr Rémi VARIN Pharmacie clinique
9
III – MEDECINE GENERALE PROFESSEUR
Mr Jean-Loup HERMIL UFR Médecine générale
PROFESSEURS ASSOCIES A MI-TEMPS
Mr Emmanuel LEFEBVRE UFR Médecine Générale
Mme Elisabeth MAUVIARD UFR Médecine générale
Mr Philippe NGUYEN THANH UFR Médecine générale
MAITRE DE CONFERENCES ASSOCIE A MI-TEMPS
Mr Pascal BOULET UFR Médecine générale
Mr Emmanuel HAZARD UFR Médecine Générale
Mme Lucile PELLERIN UFR Médecine générale
Mme Yveline SEVRIN UFR Médecine générale
10
ENSEIGNANTS MONO-APPARTENANTS PROFESSEURS
Mr Serguei FETISSOV (med) Physiologie (ADEN)
Mr Paul MULDER (phar) Sciences du Médicament
Mme Su RUAN (med) Génie Informatique
MAITRES DE CONFERENCES
Mr Sahil ADRIOUCH (med) Biochimie et biologie moléculaire (Unité Inserm 905) Mme Gaëlle BOUGEARD-DENOYELLE (med) Biochimie et biologie moléculaire (UMR 1079)
Mme Carine CLEREN (med) Neurosciences (Néovasc)
M. Sylvain FRAINEAU (phar) Physiologie (Inserm U 1096)
Mme Pascaline GAILDRAT (med) Génétique moléculaire humaine (UMR 1079) Mr Nicolas GUEROUT (med) Chirurgie Expérimentale
Mme Rachel LETELLIER (med) Physiologie
Mme Christine RONDANINO (med) Physiologie de la reproduction Mr Antoine OUVRARD-PASCAUD (med) Physiologie (Unité Inserm 1076)
Mr Frédéric PASQUET Sciences du langage, orthophonie
Mme Isabelle TOURNIER (med) Biochimie (UMR 1079)
CHEF DES SERVICES ADMINISTRATIFS : Mme Véronique DELAFONTAINE
HCN - Hôpital Charles Nicolle HB - Hôpital de BOIS GUILLAUME
CB - Centre Henri Becquerel CHS - Centre Hospitalier Spécialisé du Rouvray CRMPR - Centre Régional de Médecine Physique et de Réadaptation SJ – Saint Julien Rouen
11
Par délibération en date du 3 mars 1967, la faculté a arrêté que les opinions
émises dans les dissertations qui lui seront présentées doivent être considérées
comme propres à leurs auteurs et qu’elle n’entend leur donner aucune
12
Remerciements
Au Professeur Eltchaninoff,
Vous me faites l’honneur de présider ce jury de thèse. Je vous remercie pour votre
disponibilité auprès de vos internes. Votre passion pour la cardiologie, que vous essayez sans cesse de transmettre, est un exemple à suivre. Merci pour ces réunions semestrielles dans votre bureau à parler d’avenir et pour ces fêtes de l’été qui permettent au service de se sentir toujours plus soudé.
Au Professeur Bauer,
Je vous remercie de m’avoir fait partager vos connaissances et votre expérience pendant ces 6 mois au laboratoire d’échocardiographie et en hôpital de jour. Merci pour votre
enthousiasme à la relecture de mes échographies et votre légendaire « mais c’est génial !! ». Je suis très heureuse de revenir dans le service à partir du mois de novembre.
Au Docteur Bouchart,
Je n’ai eu l’occasion de venir au bloc opératoire avec vous qu’une seule fois mais j’en garde un souvenir impérissable. Concentrée pour ne pas tomber dans les pommes, vos gestes étaient d’une précision et d’une rapidité à couper le souffle, sous couvert de musique classique, tel un chef d’orchestre.
Au Docteur Alarçon,
Merci pour tous tes conseils tout au long de l’internat, que ce soit à l’USIC pour la prise en charge des patients, pour ton coaching pour le mémoire, la thèse et tous les dossiers à remplir en temps et en heure pour devenir enfin médecin. Je suis très heureuse que nous puissions continuer à travailler ensemble à partir de novembre.
Au Professeur Doguet,
Je vous remercie de m’avoir proposé ce sujet, d’avoir été présent et disponible tout au long de ce travail. J’ai beaucoup apprécié mon stage en chirurgie cardiaque. Vous êtes quelqu’un de très professionnel tout en restant proche et abordable par vos patients et les personnes avec qui vous travaillez. Merci de m’avoir permis de poser la main sur un vrai cœur !
13
A l’ensemble du service de cardiologie du CHU de Rouen, Au Docteur Tron et votre sens aigu de la remise en question.
Au Professeur Durand, pour votre investissement pour les séances de bibliographies. Au Docteur Bouhzam, merci pour ta confiance. Tu as un sang-froid à toute épreuve et tu as toujours la petite phrase bienveillante qui permet de rassurer n’importe qui, même une 2ème semestre lors de ses premières gardes de cardiologie seule au CHU.
Au Docteur Bettinger, nous n’avons pas beaucoup eu l’occasion de travailler ensemble et j’espère que nous apprendrons un peu plus à nous connaître à partir du mois de novembre. Au Docteur Savouré, merci pour ton encadrement aux soins continus. J’ai beaucoup appris à tes côtés. Ta rigueur et ta constance dans le travail sont pour moi des modèles.
Au Professeur Anselme, merci pour vos mémorables séances ECG et cours de rythmologie qui m’ont valu de nombreux cauchemars, mais je dois dire très riche en apprentissage. Au Docteur Godin, merci pour ta gentillesse et tes visites qui venaient égayer le fond de Lenègre.
Au Docteur Stepowski, merci pour tes visites à Laubry que j’attendais toujours comme le messie en 2ème semestre. Ton calme et ta rigueur m’ont toujours impressionnée.
Au Docteur Glinel, merci pour ton apprentissage de l’échocardiographie. Tes séances de relecture toujours très pointilleuses à modifier la FEVG de quelques points m’ont permis de progresser et j’espère devenir un jour aussi pointilleuse que toi. Merci pour tous ces
moments de rire et de commérages passés ensemble.
Au Docteur Breil, merci pour tous ces fous rires, ta bienveillance et ces longs moments de réassurance. Tu as le vrai sens du compagnonnage, merci pour tout.
A toutes les infirmièr(e)s et aides-soignant(e)s du service et surtout les filles de l’écho et du holter pour votre gentillesse.
A Annick Troniou, pour ta bienveillance, ton excentricité, toutes ces anecdotes qui nous font beaucoup rire et toutes ces photos et calendriers gardés précieusement chez toi qui valent de l’or !
A mes anciens co-internes, devenus chefs :
Guillaume Viart, merci pour ces premières gardes doublées avec toi où tu avais réussi à me faire réviser toute la cardiologie en quelques nuits, pour tous tes conseils et ta présence (à passer la tête dans le bureau de Laubry pour voir si j’allais toujours bien).
14
A Annaëlle Abisror pour m’avoir guidée dans mon choix de venir à Rouen.
A Maxime Doutriaux, Amandine Secq et Marion Dupré pour ces semestres passés ensemble.
A mes co-internes de promotion :
A Adrian, « le meilleur d’entre nous ». Ta régularité dans le travail et ta faculté à toujours être en avance sur tout et tout le monde m’ont toujours impressionnée. Un grand merci particulier pour m’avoir aidée à réaliser les statistiques de ce travail.
A Camille, mon binôme. Tu es quelqu’un sur qui on peut compter aussi bien sur le plan personnel que professionnel. J’ai adoré travailler avec toi et je suis triste que tu partes au Havre mais nous pourrons toujours continuer à travailler ensemble une fois par semaine au CHU et attends-toi à me voir débarquer souvent au Havre !
A Olivier, pour ton humour décalé et ton décalage tout court. Nous n’avons jamais pu travailler ensemble au final et je t’attends déjà avec impatience pour novembre prochain. A Guillaume, qui s’est incrusté dans notre promo ! Merci pour ta folie et ton
accompagnement lors de mon arrivée au CHU. Je suis contente que nous partagions le même bureau dès novembre.
Aux plus jeunes :
A Amandine, Florence, Victoria, Sofiène, Pierre et Thibaut. Merci pour ces moments passés ensemble : au SIRC, aux DU, à notre week-end à Lille où nous sommes sortis victorieux de cette escape game grâce au coaching aguerri d’Amandine (notre leader !). J’espère qu’il y en aura encore.
A toute l’équipe du service de chirurgie cardiaque. Au Docteur Tabley pour votre écoute, votre patience et pour être venu voir, au moindre doute, toutes les cicatrices qui coulaient et les sternums qui craquaient du service ! Au Professeur Litzler pour nous avoir donné toutes les boîtes de chocolats que vos patients vous offraient. Au Docteur Gay, pour tes visites et ton sens aigu de l’enseignement. Au Docteur Nafeh-Bizet pour vos conseils à la relecture des échographies difficiles. Au Docteur Le Guillou pour ta sympathie.
A toute l’équipe du service de cardiologie d’Elbeuf, et tout particulièrement aux Docteurs Baala, Guetlin, Haas, Rouffiac et Hamdan-Challe pour m’avoir encadrée dans mes débuts et m’avoir appris les bases de la cardiologie et de l’échocardiographie. Merci pour ce livret d’accueil magique qui n’a pas quitté ma poche de blouse pendant très longtemps.
15
A toute l’équipe du service de réanimation d’Elbeuf, aux Docteurs Delastre, Jusserand, Michot, Bouffandeau et Chauvet. Merci pour tous vos efforts consacrés à l’enseignement que ce soit pendant les cours du matin, au lit des malades ou en gardes (pour mes premières gardes à deux !). Un merci particulier au Docteur Chauvet, pour tes cours théoriques et pratiques, notamment les nombreuses ETO réalisées ensemble et pour m’avoir livré tous les secrets de la béta-modulation ! Et au Docteur Delastre pour cette dernière garde
mémorable. Merci à mon bon Vincent et mon bon Emmanuel pour votre complicité et à Wilfried pour tes histoires déjantées.
A toute l’équipe du service d’endocrinologie de Bois Guillaume, et particulièrement aux Docteurs Menon et Savouré pour leur gentillesse. Merci à Caroline, Pauline, Romain et Mélanie pour ces bons moments passés ensemble.
A toute l’équipe du Service de cardiologie de Créteil. A Annabelle pour m’avoir guidée pendant les premières semaines, à aller jusqu’à m’accompagner à ma chambre de garde pour ma première garde de « séniors », peut-être pour être sûre que je ne m’enfuis pas en courant !
A ma famille
A mon père, merci pour m’avoir toujours laissé faire mes propres choix et pour avoir
toujours eu confiance en moi. Tu es un modèle de courage, notamment dans le travail et de générosité. J’espère avoir hérité un peu de ces qualités.
A mes grands frères et sœurs, Philippe, Kati et Sylvia. J’ai été pendant longtemps la petite dernière. Merci d’avoir été toujours là pour moi et de m’avoir trimbalée partout avec vous sans jamais me faire sentir de trop. Vous m’avez en partie élevée et je ne vous remercierai jamais assez pour tous les sacrifices que vous avez fait pour moi.
A Nathalie, merci d’avoir rendu de nouveau mon père heureux et pour t’être occupé de moi comme une mère dès ton arrivée. Merci de m’avoir nourrie et blanchie pendant toutes ces années d’externat et ce semestre d’inter-CHU où je n’avais qu’à mettre les pieds sous la table pour déguster des plats toujours aussi bons, comme dans un vrai restaurant ! Grâce à toi, je ne suis plus la petite dernière de la famille et je suis très heureuse d’avoir une petite sœur, Louise, pour pouvoir enfin faire la grande sœur ! Merci aussi à ta famille, très aimante. A mes cousins, et particulièrement à Nicolas et Fred et mon beau-frère de toujours, Olivier, pour avoir été mes plus grands supporters et m’avoir toujours soutenue pendant toutes ces années de médecine.
16 A Benjamin
Merci pour tout. Je suis très heureuse de t’avoir suivi dans cette aventure rouennaise et partir juste 6 mois en inter-CHU a été encore plus difficile que je ne l’avais imaginé. Merci pour ta patience, surtout ces derniers temps.
Merci à ta famille, pour m’avoir accueillie à bras ouvert.
A mes amis
A mes amis d’enfance, Céline et Lydia. La distance géographique fait que nous ne pouvons pas nous voir tous les jours comme quand nous étions petites, mais cela n’a rien changé à notre relation et à notre complicité.
A Tatiana, pour tes côtés parfois un peu excentriques qui me font beaucoup rire, pour ton naturel et ton franc parler.
A Noémie, merci pour tous tes coups de fil et tes attentions même à distance et de ne m’en avoir jamais voulu quand j’oubliais de te répondre (je sais le téléphone, ce n’est pas trop mon truc !). Je suis triste que tu sois partie si loin, mais heureuse pour toi car tu as l’air très épanoui là-bas.
Aux filles de la fac : Armance, Jenny, Laura, les deux Del, Marion, Méré et Stéph. Pour tous ces souvenirs : ces années folles en P2 et D1, mes premières cuites, nos déguisements toujours aussi ridicules, puis ces années de travail difficiles qui nous ont encore plus soudé. Malgré nos internats, pour certaines éloignés, nous avons su rester toujours aussi proches, et cela nous a permis de visiter un peu toutes les villes de France pour nos week-ends passés ensemble. Mais Rouen restera la ville où vous êtes le plus venus, et comme dirait Del, c’est « the place to be ! ». Un merci particulier aux 2 Del et à Jérôme pour nos soirées
rouennaises.
Aux mecs de la fac, pour tous ces moments passés ensemble. J’espère que nous aurons d’autres voyages comme la Jamaïque qui nous permettent de nous retrouver.
A toutes les personnes que je n’ai pas citées, mais qui me soutiennent et qui ont contribué à faire de moi ce que je suis aujourd’hui.
17
Liste des abréviations
• AHA : American Heart Association
• ARA II : Antagoniste des Récepteurs de l’Angiotensine II
• ASE : American Society Of Echocardiography
• BB : Béta-Bloquants
• CML : Cellules musculaires lisses
• DA : Dissection Aortique
• ESC : European Society of Cardiology
• ETT : Echocardiographie TransThoracique
• IEC : Inhibiteur de l’Enzyme de Conversion
• IRAD : International Registry of Acute Dissection
• IRM : Imagerie par Résonance Magnétique
• LTBP : Protéines Ligantes du TGF-béta
• MEC : Matrice Extra-Cellulaire
• MMP : Métalloprotéinases
• TDM : Tomodensitométrie
18
Table des matières
REMERCIEMENTS...12
LISTE DES ABREVIATIONS...17
TABLE DES MATIERES...18
INTRODUCTION...20
I. Introduction...20
II. Le syndrome de Marfan...22
1. Critères diagnostiques...22
2. Atteinte cardio-vasculaire...25
a. Atteinte aortique...25
b. Atteinte valvulaire...29
c. Atteinte de l’artère pulmonaire...30
d. Atteinte rythmique...30 e. Cardiomyopathie...31 3. Atteinte extracardiaque...31 a. Atteinte ophtalmologique...31 b. Atteinte musculo-squelettique...32 c. Atteinte pulmonaire...36 d. Atteinte neuro-méningée...36 e. Atteinte cutanée...37 4. Génétique et physiopathologie...37
5. Prise en charge médicamenteuse...41
6. Prise en charge chirurgicale...46
a. Remplacement de l’aorte avec remplacement de la valve aortique...46
b. Remplacement de l’aorte avec conservation de la valve aortique...48
c. Prise en charge chirurgicale du reste de l’aorte...50
d. Indications...51
7. Pronostic et suivi...51
8. Dépistage familial...52
9. Syndromes apparentés...53
a. Atteinte cardio-vasculaire similaire...53
19
c. Atteinte systémique similaire...56
III. La dissection aortique de l’aorte ascendante...56
1. Rappels anatomiques et histologiques...56
2. Définition et physiopathologie...58 3. Classification...60 4. Epidémiologie...62 5. Présentation clinique...63 a. Signes cardio-vasculaires...63 b. Epanchement pleural...65 c. Symptômes neurologiques...65 d. Ischémie mésentérique...65 6. Confirmation diagnostique...65 7. Prise en charge...68 a. Traitement médicamenteux...68 b. Traitement chirurgical...68 8. Evolution et pronostic...72 OBJECTIFS DE L’ETUDE...75 PATIENTS ET METHODE...76 I. Population...76 II. Chirurgie...77
III. Critère de jugement...78
IV. Analyse statistique...79
RESULTATS...80
I. Caractéristiques de la population...80
1. Caractéristiques cliniques...80
2. Caractéristiques paracliniques...84
II. Résultats du critère de jugement principal...86
III. Résultats du critère de jugement secondaire...89
IV. Facteurs prédictifs de décès...91
V. Courbes de survie de la population globale...95
20
I. Validité externe...97
1. Caractéristiques cliniques de la population...97
2. Caractéristiques paracliniques de la population...99
3. Evolution des pratiques chirurgicales et des indications avec le temps...100
II. Critère de jugement principal...102
III. Critère de jugement secondaire...103
IV. Limites...104
V. Perspectives pour l’avenir...105
CONCLUSION...106
BIBLIOGRAPHIE...107
21
Introduction
I.
Introduction
Le syndrome de Marfan est une pathologie génétique, avec une transmission autosomique dominante, liée à une mutation du gène de la fibrilline de type 1 pour la plupart des cas. C’est une maladie rare mais qui reste la plus fréquente des pathologies génétiques responsable d’anévrisme de l’aorte ascendante. Sa prévalence est estimée à 3-5 cas pour 10 000 personnes, chiffre probablement sous-estimé du fait de la méconnaissance de nombreux cas avec une grande variabilité phénotypique et l’apparition des signes au cours de la vie. Il n’y a pas de distinction d’origine géographique, ethnique, ou liée au sexe. Il y aurait en France environ 12 000 personnes atteintes (1).
La pénétrance de la maladie est quasiment complète mais avec une expressivité variable. C’est-à-dire que l’un des parents d’un enfant Marfan est atteint sauf s’il s’agit d’une néo mutation, ce qui serait le cas dans près de 25% des cas.
La fibrilline de type 1 est localisée en 15q21. C’est une protéine qui s’associe en macro-agrégats et permet l’organisation des fibres d’élastine constituant de la matrice
extracellulaire du tissu conjonctif. Elle a un rôle majeur dans l’intégrité et l’homéostasie des tissus élastiques et non élastiques. On comprend bien que l’atteinte phénotypique soit multiple avec des manifestations squelettiques, oculaires et cardiovasculaires
essentiellement.
La principale cause de décès demeure les complications de l’aorte ascendante (dissection aortique (DA) ou rupture), qui surviennent en général après une période de dilatation de
22
l’aorte thoracique ascendante. Avant l’ère de la chirurgie, les patients décédaient à 80% des conséquences de la dilatation aortique, et la moitié avant l’âge de 40 ans (2). Depuis
l’avènement de la chirurgie préventive, ainsi qu’une meilleure connaissance de la maladie avec une prise en charge médicale optimale, l’espérance de vie des patients a augmenté de plus de 30 ans ces 30 dernières années (3).
La prise en charge chirurgicale consiste en un remplacement de l’aorte ascendante avec ou sans conservation de la valve aortique native qui est recommandée pour une taille de l’aorte ascendante de plus de 50 mm sans facteur de risque ou de plus de 45 mm en cas de facteur de risque de dissection aortique (4). Cependant, le syndrome de Marfan est une pathologie qui touche toute l’aorte avec des dissections observées au niveau de la crosse ou de l’aorte descendante alors même que l’aorte initiale a été opérée de façon préventive. Au CHU de Rouen, un certain nombre de patients est opéré de la crosse aortique en préventif en complément de l’aorte ascendante initiale.
Le but de notre travail est d’étudier les premiers résultats en termes d’efficacité et de sécurité de cette chirurgie complémentaire de la crosse aortique. Dans une deuxième partie nous avons également étudié les facteurs pronostics de décès sur l’ensemble de la
population de patients atteints du syndrome de Marfan, y compris chez les patients ayant présenté une dissection.
23
II.
Le syndrome de Marfan
1.
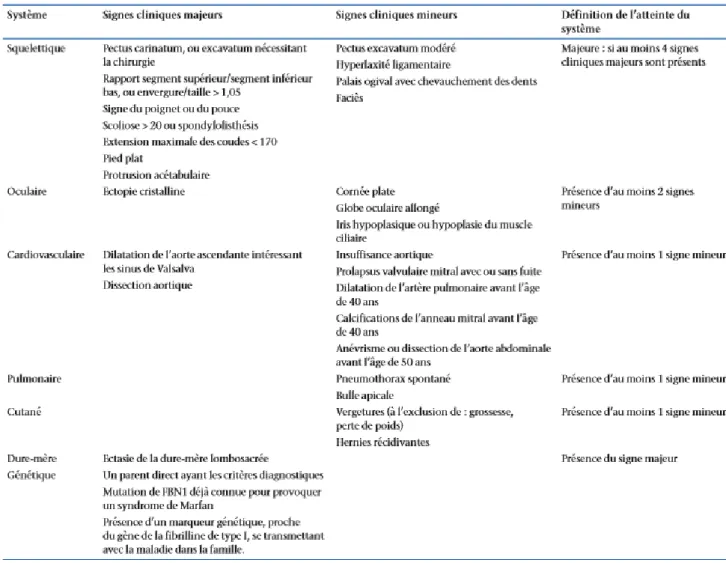
Critères diagnostiques
Le Professeur Antoine-Bernard Marfan est le premier à avoir décrit en 1896 l’atteinte
squelettique du syndrome qui porte son nom aujourd’hui, au travers du cas d’une petite fille de 5 ans, à la société médicale des hôpitaux de Paris (5). Les caractéristiques phénotypiques se sont développées grâce à l’évolution des techniques, notamment d’imagerie avec la description en 1986 de la nosologie de Berlin (6), puis des critères de Ghent en 1996 (7). Pour faire le diagnostic selon les critères de Ghent de 1996 (cf. Tableau 1), en l’absence de critère familial, il fallait une atteinte de trois systèmes parmi le cœur, l’œil, le squelette, la peau, les poumons et le système nerveux central, dont 2 critères majeurs et 1 mineur. En cas d’histoire familiale, un critère majeur et un mineur dans deux systèmes différents
suffisaient. De nombreuses limites ont été mises en exergue avec notamment une
complexité d’utilisation pour les praticiens non spécialisés dans ce domaine. Elle n’était pas adaptée au sujet pédiatrique et surtout certains critères mineurs étaient peu spécifiques et pouvaient entraîner un surdiagnostic (8).
Les derniers critères diagnostiques validés sont ceux de la nosologie de Ghent modifiés en 2010 (9). Ils donnent plus de poids à deux critères cardinaux que sont la dissection ou la dilatation de l’aorte ascendante au niveau des sinus de Valsalva et l’ectopie du cristallin ainsi qu’à la recherche génétique. La dilatation ou la dissection est retenue du fait de sa gravité potentielle et l’ectopie du cristallin en raison de sa grande spécificité. Ces deux critères cardinaux, lorsqu’ils sont associés, suffisent à eux seuls à faire le diagnostic de la maladie en l’absence d’histoire familiale. De même, une mutation du gène FBN 1 associée à une
24
qu’une dilatation ou dissection aortique associée à une atteinte systémique avec un score supérieur ou égal à 7. En présence d’une histoire familiale, un seul critère positif entre la dilatation ou la dissection aortique, l’ectopie du cristallin ou l’atteinte systémique suffit à faire le diagnostic.
Avec ces nouveaux critères, la recherche génétique prend une place plus importante mais n’est pas obligatoire pour faire le diagnostic. En effet, le dépistage génétique est très couteux et très long. Pour ces raisons, il n’est pas réalisé dans tous les pays. En cas de dépistage génétique réalisé, la recherche de mutation dans le gène FBN1 est préconisée. En cas de négativité, une recherche dans d’autres gènes est indiquée en deuxième intention, selon l’orientation clinique, comme le TGFBR1, TGFBR2, FBN2, puis d’autres gènes comme ADAMTS10, LTBP2, ADAMTSL4, CBS, ACTA2, MYH11, SLC2A10, COL3A1, COL1A2, PLOD1 à la recherche de diagnostic différentiel.
La recherche de mutation ne peut, malgré tout, être réalisée chez tous les patients même en France car elle reste longue et coûteuse. Certaines équipes préconisent un test de biologie moléculaire uniquement pour les patients qui ont des signes présents dans deux systèmes dont au moins un de façon majeur selon les anciens critères de Ghent (10).
25 Tableau 1 : Critères de Ghent de 1996 (7)
26 Tableau 2 : Critères de Ghent révisés de 2010 (9)
2.
Atteinte cardio-vasculaire
a) Atteinte aortique
L’atteinte aortique se définit par une dilatation de la racine de l’aorte ascendante,
prédominante au niveau des sinus de Valsalva, donnant un aspect en bulbe d’oignon. Elle fait partie des deux critères cardinaux en cas de dilatation avec un Z-score supérieur à 2. La raison de cette localisation préférentielle serait due d’une part au fait que cette partie est la plus riche en fibres d’élastine, et d’autre part au fait que les variations volumiques entre la systole et la diastole y sont les plus importantes et donc la plus susceptible de montrer sa fragilité (11).
27
La mesure doit être réalisée, en première intention, en échocardiographie transthoracique (ETT), en mode bidimensionnel, en télédiastole pour la mesure des sinus de Valsalva, de la jonction sino-tubulaire et de la portion tubulaire. Ces mesures doivent être bien
perpendiculaires au grand axe de l’aorte, de bord d’attaque au bord d’attaque (en incluant la paroi antérieure et en excluant la paroi postérieure), selon les recommandations de
l’American Society of Echocardiography (ASE) (12) (Figure 1).
Figure 1 : Niveau de mesure de l’aorte ascendante
Les valeurs normales ont été définies par Roman et al. en 1989 à partir d’une série de 135 adultes et de 52 enfants (13). Elles sont toujours considérées de nos jours comme les valeurs de référence. Le Z-score est le nombre de déviations standard au-dessus de la moyenne à laquelle se trouve le patient. On part du principe que la répartition des diamètres aortiques suit une loi normale et qu’un diamètre mesuré a d’autant plus de chance d’être normal s’il est proche de 0. Un Z-score à 0 correspond donc à la valeur moyenne et un Z-score à 2 est considéré comme la limite supérieure de la normale. La valeur doit être indexée à la surface
28
corporelle. Trois nomogrammes sont disponibles en fonction de l’âge : un pour les enfants et les adolescents, un pour les adultes de moins de 40 ans et un dernier pour les adultes de plus de 40 ans. Il n’y a pas de distinction en fonction du sexe vu que les valeurs sont indexées à la surface corporelle (Figure 2).
Figure 2 : Nomogrammes de Roman (12)
Aortic root growth curves normalised to body size and age The left graph is for children and adolescents, the middle graph is for adults younger than 40 years, and the right graph is for adults older than 40 years. The shaded areas represent the range of values in which 95% of the population will fall.
Ces normes ont été souvent critiquées, établies à partir d’une population de petite taille et surtout ils tendent à surestimer la dilatation chez les enfants. En effet, chez l’enfant, la dilatation aortique initiale peut régresser avec la croissance. Pour cette population, ce sont donc plutôt les nomogrammes de Gautier qui sont utilisés (14).
La dilatation aortique est donc évolutive chez les patients atteints du syndrome de Marfan, avec un risque de dissection ou de rupture proportionnel à la taille de l’aorte pouvant engager le pronostic vital. En effet, une étude de Détaint et al. montrait que le pourcentage
29
de dilatation de l’aorte ascendante augmentait avec l’âge. A 60 ans, 96% des patients mutés au niveau du gène FBN1 avait une dilatation importante. Les événements aortiques
(dissection ou nécessité d’une chirurgie préventive) atteignaient 74% à cet âge (15). La dilatation s’étend progressivement sur le reste de l’aorte ascendante avec un effacement de la JST, ce qui est associé à un risque accru de DA (16).
Les mesures de l’aorte ascendante en ETT sont donc très importantes, pour établir le diagnostic, surveiller la croissance de l’aorte au cours des âges et porter l’indication chirurgicale.
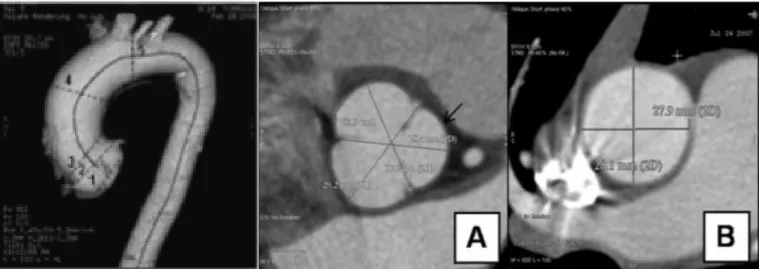
En cas de doute sur une mesure en ETT, notamment en cas d’évolutivité rapide de la dilatation aortique, une imagerie de coupe peut être réalisée (imagerie par résonance magnétique IRM ou tomodensitométrie TDM). En imagerie de coupe, une reconstruction post acquisition est réalisée sur une station 3D. Un axe sagittal est tracé au milieu de l’aorte, puis une coupe axiale oblique est réalisée, de façon perpendiculaire à la paroi de l’aorte. La mesure est réalisée sur la coupe axiale oblique au niveau des mêmes segments qu’en ETT. Au niveau des sinus de Valsalva, trois mesures sont effectuées, du milieu de la cusp au trigone opposé. Pour les autres segments de l’aorte, deux mesures sont réalisées, une en antéropostérieure et l’autre en latérale. Chaque mesure est réalisée en télédiastole, de bord interne à bord interne (Figure 3). La mesure avec le diamètre le plus élevé est celle retenue. Des nomogrammes ont été également réalisés pour les valeurs considérées comme
normales de l’aorte (17). Malgré leurs différences techniques, les mesures en ETT et en TDM au niveau de l’aorte ascendante montrent une bonne corrélation (18).
30
Figure 3 : Mesures des diamètres aortiques au scanner (17)
(A) Aortic root diameter and area measurements in aortic valve short axis plane ; (B) ascending aorta in short axis at the pulmonary artery bifurcation
b) Atteinte valvulaire
L’atteinte valvulaire aortique se caractérise par une insuffisance aortique, le plus souvent liée à une dilatation de la racine aortique. En effet, la dilatation des sinus de Valsalva entraîne un étirement passif des cusps, ainsi qu’une ascension des commissures à l’origine de la fuite. Cette fuite est généralement centrale et modérée. Elle est rare avant 40 mm et devient quasiment systématique après 60 mm. Avec le dépistage généralisé et l’indication chirurgicale préventive, la découverte d’une fuite aortique sévère par dilatation de l’anneau est exceptionnelle. Une bicuspidie aortique est retrouvée chez 4 à 5% des patients
présentant un syndrome de Marfan, ce qui reste plus élevé que dans la population générale (19).
L’atteinte valvulaire mitrale se caractérise par un épaississement bivalvulaire, une dilatation de l’anneau mitral, ainsi qu’une atteinte dystrophique de l’appareil sous valvulaire avec des cordages longs et redondants (20). A l’ETT, on retrouve un prolapsus bivalvulaire atteignant les commissures, le plus souvent, avec une fuite centrale moyenne du fait de l’atteinte
31
équilibrée. Dans l’étude de Détaint et al., la prévalence du prolapsus atteignait 77% de la population avant 60 ans, avec une fuite moyenne observée chez 61% d’entre eux. Un fuite sévère nécessitant une chirurgie demeurait rare avec seulement 13% de la population (15).
c) Atteinte de l’artère pulmonaire
Une dilatation de l’artère pulmonaire, en moyenne supérieure à 23 mm, est souvent
observée chez les patients atteints du syndrome de Marfan. Cette atteinte faisait partie des critères de Ghent de 1996, comme critère mineur. Elle a été retirée des critères révisés de 2010, car non spécifique du syndrome de Marfan et devant l’absence de norme supérieure pour la taille de l’artère pulmonaire (21).
d) Atteinte rythmique
Les patients atteints du syndrome de Marfan sont exposés aux risques d’arythmies ventriculaires et de mort subite. En effet, l’anomalie structurelle de la fibrilline de type 1, présente dans le muscle serait à l’origine d’une atteinte myocardique avec altération des propriétés électriques du cœur. Une étude de Yetman et al. retrouvait 4% de décès dans leur population dus à une arythmie ventriculaire. Les facteurs de risque retrouvés étaient une dilatation ventriculaire gauche, un prolapsus mitral et un allongement du QT à
32
e) Cardiomyopathie
L’atteinte myocardique avec dilatation du ventricule gauche, dysfonction systolique et diastolique a été étudiée dans de nombreuses études avec des données contradictoires. Dans l’étude de Meijboom et al., une dilatation du ventricule gauche a été observée chez uniquement 7% des patients atteints du syndrome de Marfan, sans atteinte valvulaire significative ou antécédent de chirurgie aortique (23). Il n’a pas été retrouvé de dysfonction ventriculaire gauche. Pour ce qui est de l’étude de Savolainen et al., il n’y avait aucune différence significative pour la taille et la fonction du ventricule gauche entre la population de sujets avec un syndrome de Marfan et la population saine. Il y avait cependant une atteinte de la fonction diastolique du ventricule gauche majoritaire dans le groupe Marfan de façon significative (24). Les mêmes résultats ont été retrouvés dans l’étude de Das et al (25).
3.
Atteinte extracardiaque
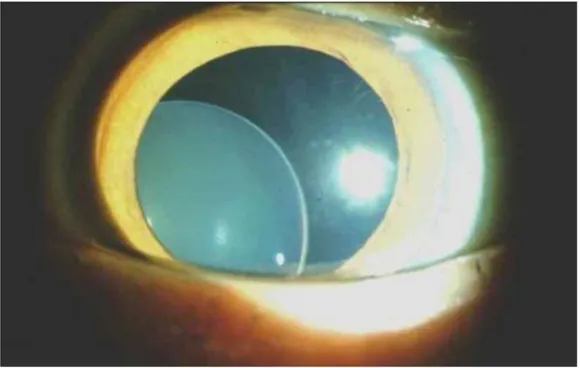
a) Atteinte ophtalmologique
L’ectopie du cristallin ou subluxation est un signe très spécifique et fait partie des deux critères cardinaux du diagnostic positif, elle est retrouvée chez 60% des patients environ. Le diagnostic est réalisé à l’aide d’une lampe à fente, après dilatation pupillaire (Figure 4). Le cristallin est une lentille biconvexe normalement centrée derrière l’iris. Ce centrage se fait grâce à des fibres appelées zonules qui permettent une accroche du cristallin sur 360°. Dans le syndrome de Marfan, la zonule se relâche progressivement jusqu’à entrainer une
subluxation qui s’aggrave très progressivement. Au stade initial de subluxation, la vision est tout à fait normale d’où l’importance du dépistage. Progressivement, une myopie ainsi qu’un astigmatisme vont apparaître, facilement corrigeables par des lunettes de vue. La myopie
33
lorsqu’elle est supérieure à 3 dioptries fait partie de l’atteinte systémique des critères de Ghent révisés. A des stades plus avancés, la baisse de la vision s’accentue, avec un risque de vision double et de forts éblouissements à la lumière, ainsi qu’une mobilité extrême du cristallin qui peut engendrer une luxation complète avec une chute du cristallin dans le vitré. A ces stades avancés, une prise en charge chirurgicale est préconisée.
D’autres signes, moins spécifiques, peuvent être retrouvés incluant une cornée plate, un globe oculaire allongé, une hypoplasie des muscles ciliaires, une enophtalmie, une hypoplasie de l’iris avec diminution du nombre de cryptes, une pupille excentrée ainsi qu’une iridodonèse, ce qui correspond à un tremblement de l’iris (26). Ces signes moins spécifiques et plus rares ne sont pas recherchés de façon systématique par les
ophtalmologues.
34
b) Atteinte musculo-squelettique
Les patients atteints du syndrome de Marfan sont reconnaissables en général de loin avec un morphotype particulier et une croissance disproportionnée des os longs. On retrouve une déformation du thorax due à une croissance des côtes qui poussent le sternum vers l’avant : pectus carinatum, ou vers l’arrière : pectus excavatum. Le pectus carinatum (Figure 5) est considéré comme étant plus spécifique, il a donc plus de points dans le score systémique. La croissance exagérée des bras et des jambes entraîne une réduction du rapport segment supérieur sur segment inférieur, inférieur à 0.85 pour la population blanche et inférieur à 0.78 pour la population afro-américaine (Figure 5), ainsi qu’une augmentation de l’envergure (distance entre l’extrémité des doigts des deux mains lorsque les bras sont ouverts à
l’horizontale) sur la taille supérieure à 1.05 en l’absence de scoliose sévère.
La croissance exagérée des doigts se définit par l’arachnodactylie. Deux signes spécifiques sont à rechercher. Le signe du poignet, qui correspond à un chevauchement complet de la dernière phalange du pouce et du cinquième doigt lorsque la main entoure le poignet
controlatéral (Figure 6). Le signe du pouce est positif lorsque le pouce mis en abduction dans la paume de la main, dépasse du rebord de la main d’au moins une phalange (Figure 6). On retrouve également des scolioses thoraco-lombaires sévères supérieures à 20°, ainsi qu’une protrusion acétabulaire définie par une protrusion de l’acétabulum d’au moins 3 mm au-delà de la ligne iléon-ischion ou ligne de Kohler sur une radiographie de hanche (Figure 7).
Les pieds plats sont fréquemment retrouvés avec une atteinte plus ou moins sévère,
pouvant aller d’une forme asymptomatique à une forme sévère avec déplacement médial de la malléole interne, entraînant des atteintes secondaires des genoux et des hanches.
35
Les manifestations cranio-faciales sont fréquentes également. On retrouve une
dolichocéphalie (visage allongé), une hypoplasie malaire, un rétrognathisme, des fentes palpébrales obliques vers le bas ainsi qu’un palais arché, ogival avec chevauchement des dents (9) (27).
Figure 5 : Forme typique de Marfan avec scoliose, pectus carinatum, grande taille et grande envergure
36
Figure 6 : Signe du poignet (à gauche) et signe du pouce (à droite)
37
c) Atteinte pulmonaire
Le pneumothorax spontané est l’atteinte pulmonaire la plus fréquente. Il survient chez environ 10 à 15% des patients (28).
L’atteinte de la fonction respiratoire avec un syndrome restrictif est le plus souvent due aux déformations thoraciques (pectus excavatum et scoliose) (29).
d) Atteinte neuro-méningée
L’ectasie durale est un signe sensible mais non spécifique du syndrome de Marfan qui est défini par un élargissement du cul de sac de la dure-mère avec un amincissement des
pédicules (Figure 8). Ce signe faisait partie des critères majeurs dans les critères de Ghent de 1996, mais son importance a été reléguée au second plan avec 2 points dans le score
systémique des critères révisés de 2012. Selon les études, ce signe est présent chez 63 à 92% des patients atteints du syndrome de Marfan (30) (31), mais il peut être également retrouvé dans le syndrome d’Ehlers-Danlos ou de Loeys-Dietz. Cette atteinte est le plus souvent asymptomatique et un dépistage par scanner ou IRM est réalisé au moins une fois dans la vie d’un patient suspect de Marfan.
38 Figure 8 : Ectasie durale
e) Atteinte cutanée
Les vergetures sont fréquentes, observées chez deux tiers des patients (32). Contrairement à la population générale, elles apparaissent sur des zones spécifiques comme la partie
antérieure des épaules, la région lombaire en excluant le fait que le ou la patient(e) soit obèse ou enceinte.
4.
Génétique et physiopathologie
La fibrilline de type 1 est une molécule codée par un ARNm codé par un seul gène, sur le chromosome 15q21, composé de 65 exons codants et de 3 exons non codants. Une mutation faux sens hétérozygote dans ce gène a été découverte pour la première fois par Dietz et al. (33) en 1991 chez deux patients atteints du syndrome de Marfan. Cette protéine composée de 2871 acides aminés est retrouvée dans différents tissus comme la peau, le poumon, les reins, les muscles, la cornée, les cartilages et les vaisseaux. Elles forment des monomères qui se polymérisent en des structures appelées microfibrilles. Elles interagissent
39
ensuite avec les composants de la matrice extra-cellulaire (MEC) comme les intégrines, les fibronectines, les protéines ligantes du TGF béta, sous forme latente (LTBP) et les fibres d’élastine et participent à l’ancrage des cellules musculaires lisses (CML) (Figure 9).
Elle contient 47 domaines EGF-like qui sont à l’origine de ponts disulfures intra domaine qui influencent la conformation tridimensionnelle de la molécule. Cette association de fibres élastiques, de la MEC composée des microfibrilles entre autres et des CML, confère à la paroi aortique son élasticité et sa force. Le défaut de synthèse de fibrilline 1 entraîne un défaut d’assemblage des fibres élastiques avec une perte de connexion avec les CML et explique la fragilité de la paroi aortique qui est plus rigide avec perte de son élasticité (34).
40
Il existe plus de 2 000 mutations répertoriées, réparties sur l’ensemble du gène. La plupart de ces mutations sont privées, c’est-à-dire spécifiques d’une famille. En effet, seulement 12% de ces mutations ont été retrouvées plus d’une fois chez deux individus non apparentés (34).
Il s’agit essentiellement de mutation faux-sens, c’est-à-dire que la mutation entraine le changement d’un acide aminé par un autre, au niveau des résidus cystéines des 47 domaines EGF-like. Il en résulte une perte des ponts disulfures qui serait à l’origine de sa perte de structure et de l’altération de sa fonction (35).
Deux théories existent pour expliquer l’effet de ces mutations. La première est celle de l’haplo-insuffisance. La synthèse de la fibrilline 1 normale n’est pas en quantité suffisante pour assurer son rôle. Le principal argument en faveur de cette hypothèse est la conception d’un modèle de souris KI, porteuses d’une mutation faux-sens, hétérozygote (C1039G) qui exprime le phénotype du syndrome de Marfan avec dilatation aortique. L’apport exogène de fibrilline 1 permet de restaurer un phénotype aortique normal (36). Ce modèle confirme que pour certaines mutations, le phénotype n’est pas secondaire à l’accumulation de la protéine mutée mais à l’insuffisance de production de la protéine normale.
La deuxième est celle du dominant-négatif. La fibrilline 1 mutée est incorporée dans le polymère de macro-agrégats avec la fibrilline 1 normale. Une seule protéine mutée peut suffire à altérer le fonctionnement du polymère tout entier. Dans un modèle expérimental de souris, l’introduction d’un allèle mutant en présence de deux allèles endogènes normaux entraîne une réduction des fibrillines normales dans la matrice extracellulaire, ainsi qu’une désorganisation des microfibrilles et reproduit un phénotype Marfan (37). Au total, il est possible que certaines mutations soient à l’origine d’une haplo-insuffisance et d’autres d’un effet dominant-négatif.
41
Plusieurs études ont essayé de montrer une corrélation entre génotype et phénotype pour essayer de comprendre les variations phénotypiques d’un patient à un autre (38) (39). La plus grande étude, rapportée sur 1013 patients atteints du syndrome de Marfan ou apparentés, retrouve une probable relation entre génotype et phénotype. Une plus forte probabilité d’ectopie du cristallin est retrouvée en cas de mutation faux sens qui altère le nombre de cystéines. Une mutation non-sens avec transcription d’un codon stop et une absence de synthèse de fibrilline est plus pourvoyeuse d’atteinte musculosquelettique et cutanée sévère. Une mutation faux sens localisée entre les exons 24 et 32 sont à l’origine des formes les plus sévères avec atteintes cardiovasculaires et pronostic plus sombre (40). Cependant, une même mutation dans un même famille peut être à l’origine d’un phénotype très différent. Il y a donc d’autres facteurs en cause à rechercher.
Un facteur possible en cours d’étude est la voie des TGF-béta. Le TGF-béta est un facteur de croissance synthétisé par les cellules musculaires lisses et présent dans la matrice extra-cellulaire et à l’origine de sécrétion de métalloprotéases. Elle est stockée via ses protéines de liaisons (LTBP) dans les microfibrilles. En cas de raréfaction de la fibrilline 1, il y a un défaut de séquestration du TGF-béta sous sa forme liée inactive. Il est donc relargué sous sa forme active et va se lier à ses récepteurs. Cela induit une phosphorylation et une activation de Smad-2. Smad-2 est ensuite transloqué dans le noyau de la CML où il modifie l’expression de certains gènes, notamment ceux codant pour la synthèse des protéines de la matrice
extracellulaire (41), comme les métalloprotéases de type 2 et 9 (MMP). Les MMP 2 et 9 entraineraient par la suite une dégradation des fibres de collagène, d’élastine et une entrée en apoptose des CML (42) (43). Dans le modèle de souris Marfan KI, le blocage de la voie de façon spécifique par un anticorps anti-TGF-béta permet de limiter la dilatation aortique des souris, avec une diminution du taux de Smad-2 phosphorylé. Le même résultat est obtenu
42
avec le losartan (44). Cependant, cette augmentation de Smad-2 est également présente chez les patients porteurs d’une mutation du récepteur 1 et 2 du TGF-béta, qui bloque la transmission du signal par ce récepteur et peut-être à l’origine du syndrome de Marfan ou d’autres syndromes apparentés (45). Certaines équipes pensent que l’augmentation de Smad-2 ne serait finalement pas due à la voie du TFG-béta mais à une voie commune
observée dans tous les anévrysmes de l’aorte. Des recherches complémentaires sont encore nécessaires pour élucider le mécanisme par lequel les patients porteurs d’une mutation sur les récepteurs de TGF-béta induisent paradoxalement une augmentation du signal de cette voie.
5.
Prise en charge médicamenteuse
Le traitement est essentiellement préventif avec l’utilisation de bêtabloquants (BB) en première intention. Shores et al. est le premier à avoir montré un bénéfice des BB, en 1994, dans une étude randomisée en ouvert en comparant 32 patients atteints du syndrome de Marfan traités par propanolol contre 38 contrôles non traités. Il était observé une
diminution du diamètre de l’aorte ascendante dans le groupe traité avec une diminution du nombre d’événements cardiovasculaires (46). Chez l’enfant, aucune étude prospective n’a été réalisée, mais une étude rétrospective sur 155 enfants âgés de moins de 12 ans
retrouvait les mêmes résultats (47).
D’un point de vue physiopathologique, les BB diminuent la fréquence cardiaque et par conséquent le nombre de distensions aortiques par minute. Il y a également une diminution de la force de contraction du ventricule gauche et donc de la vitesse d’augmentation de
43
pression et de volume dans l’aorte en systole. Ils diminuent également la pression artérielle moyenne appliquée sur la paroi aortique au repos mais également à l’effort (48).
Les BB sont donc recommandés en première intention, chez tout patient atteint du
syndrome de Marfan, quelle que soit la taille de l’aorte, y compris chez l’enfant (4). Le choix du BB se tourne maintenant plus vers des BB cardiosélectifs, afin de minimiser les effets indésirables, comme l’Aténolol, malgré l’étude princeps qui utilisait un BB non cardiosélectif. La cible tensionnelle doit être inférieure à 120 mmHg de systolique et inférieure à 110 mmHg pour les patients aux antécédents de dissection. Pour la fréquence cardiaque, la cible de repos est de moins de 70 battements par minute et inférieure à 100 par minute pour un effort sous-maximal. Le traitement doit être maintenu à vie, y compris après chirurgie de l’aorte (49). En effet, l’ensemble de l’aorte est modifié par la maladie et une dissection peut intéresser les segments de l’aorte non opérée.
En cas de contre-indication aux BB ou d’intolérance, il a été longtemps recommandé d’utiliser en deuxième intention des inhibiteurs calciques bradycardisants, pouvant mimer les effets physiologiques des BB. Cependant, une étude récente a montré son effet délétère sur les souris atteintes du syndrome de Marfan, avec une progression plus rapide des anévrysmes et la survenue de dissections aortiques plus fréquentes (50). Il a été retrouvé une augmentation du taux de Smad-2, faisant partie de la cascade de signalisation du TFG-Béta. L’examen des registres de patients traités par inhibiteurs calciques bradycardisants irait dans le même sens avec un taux de complications aortiques et de chirurgie plus élevé. D’autres études sont nécessaires, mais l’on peut penser que les inhibiteurs calciques bradycardisants ne font plus partie d’une alternative thérapeutique acceptable.
44
Une nouvelle alternative aux BB semble être possible avec les inhibiteurs du système rénine angiotensine par un inhibiteur de l’enzyme de conversion (IEC) ou un antagoniste des récepteurs de l’angiotensine II (ARA II).
L’étude expérimentale de Habashi et al. sur le modèle de souris KI a montré une
augmentation du signal de la voie du TGF-béta. Cette augmentation a été traitée par des anticorps anti-TFG-béta ou des inhibiteurs des récepteurs à l’angiotensine II (losartan) ayant comme effet similaire une diminution du signal de la voie du TGF-béta. Les ARA II, en se fixant sur ses récepteurs de type 1 au niveau des CML, inhibent la synthèse d’angiotensine II, en cause dans l’activation de la voie des TGF-béta et la synthèse des MMP. Les souris
traitées par placebo, losartan ou BB ont été comparées. Il a été observé une diminution du diamètre de l’aorte pour les souris traitées par BB et losartan (44). Cependant, seules les souris traitées par losartan avaient une diminution de l’atteinte histologique de la matrice extra cellulaire. De nombreuses études ont été ensuite réalisées pour étayer ces résultats, avec des protocoles différents et des résultats parfois contradictoires. Dans une petite étude de Brooke et al., il était comparé l’évolution de la taille de l’aorte ascendante chez 18
enfants atteints du syndrome de Marfan avant et après introduction d’un traitement par losartan en plus des BB. On retrouvait une diminution de la taille de l’aorte ascendante une fois le traitement par losartan introduit (51). Une plus grande étude, réalisée sur 604 enfants traités par aténolol ou losartan, ne montrait pas de différences significatives en terme de dilatation de l’aorte ascendante ou dissection au terme des 3 années de suivi (52). On pourrait dire que le losartan est au moins aussi efficace que les BB.
Deux études européennes randomisées de plus grande échelle ont été réalisées en comparant le losartan versus placebo. Le traitement par BB était maintenu dans les deux groupes. Une étude française, qui comportait 303 patients, ne retrouve pas de diminution
45
significative de la taille de l’aorte ascendante dans le groupe losartan (53). Une étude allemande, qui comportait 233 patients, retrouve, elle, une diminution significative de la taille de l’aorte dans le groupe losartan sans différence sur le taux de dissection aortique, de chirurgie préventive de l’aorte ou de décès cardiovasculaire (54).
Une méta-analyse est en cours de réalisation qui reprendra 11 études qui ont été réalisées sur le sujet avec un total de 2300 patients (55).
Les inhibiteurs de l’enzyme de conversion et leur effet antagoniste sur les récepteurs AT1 et AT2 qui sont tous les deux activés dans le syndrome de Marfan, font l’objet également de recherche. Une étude randomisée a été réalisée par l’équipe d’Ahimastos, en comparant le périndopril versus placebo chez des patients Marfan déjà traités par BB, sur un total de 17 patients. Ils retrouvent une diminution de la dilatation de l’aorte ainsi qu’une diminution de la rigidité et du taux de TGF-béta (56). Nagashima et al. retrouvait également une
augmentation de l’apoptose des CML de la paroi aortique chez des patients atteints du syndrome de Marfan qui serait due à une activation des récepteurs AT1. L’adjonction d’IEC en pré-opératoire permettait une diminution de cet effet (57).
Enfin, des recherches sont en cours sur l’efficacité de la doxycycline qui induirait une diminution directement de la synthèse de MMP2 et 9 (58).
46
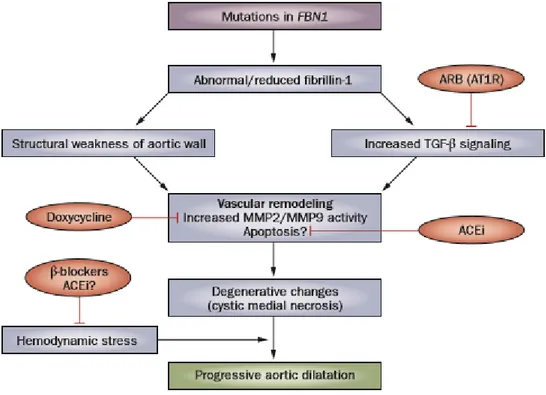
Tableau 3 : Schéma récapitulatif des différentes cibles des traitements médicamenteux (59)
Comme autres mesures préventives non médicamenteuses, l’éducation des patients à la pratique sportive est essentielle. Les patients sont contre indiqués aux efforts avec une forte contrainte isométrique pour lesquels il est observé une variation brutale de la pression artérielle et donc des contraintes appliquées à la racine de l’aorte. Les sports avec
décélérations et accélérations brutales sont également interdits, ainsi que les sports de contact pour les risques oculaires. Le sport à l’école est autorisé. En compétition, il sera autorisé uniquement la pratique des sports de classe Ia et IIa de la classification de Mitchell, en l’absence d’antécédents familiaux de mort subite, de dilatation de l’aorte et
47
6.
Prise en charge chirurgicale
a) Remplacement de l’aorte ascendante avec remplacement de la
valve aortique
Bentall et De Bono ont été les premiers, en 1968, à proposer simultanément une chirurgie de l’aorte ascendante et de la valve aortique chez un jeune patient de 33 ans chez qui était découvert un anévrysme de l’aorte ascendante ainsi qu’une insuffisance aortique sévère (61). Quelques évolutions ont été apportées à la technique initiale, notamment au niveau des sutures des coronaires et de l’anastomose distale, mais le principe reste le même. Après sternotomie médiane, une circulation extra corporelle est mise en place entre
l’oreillette droite (ou la veine cave inférieure et supérieure) et l’aorte ascendante, en général au pied du tronc artériel brachio-céphalique. Une cardioplégie est mise en place pour
permettre une protection myocardique après clampage aortique. L’aorte ascendante est ouverte de façon transversale puis retirée avec la valve aortique. Une pastille de paroi aortique est conservée autour des ostias coronaires. Un tube monté sur une valve mécanique ou biologique est implanté sur l’anneau aortique. Des orifices sont réalisés à l’emplacement habituel des deux ostias coronaires au niveau de la prothèse, puis les artères coronaires sont suturées directement à l’aide de surjets au niveau des orifices. Après
recoupe de la prothèse à la longueur désirée, l’anastomose de la prothèse avec l’aorte ascendante est réalisée (Figure 10, partie de gauche).
Chez les patients jeunes, une valve mécanique va plutôt être implantée, alors que chez les patients plus âgés ou avec une contre-indication aux anticoagulants, une bioprothèse sera préférée. Dans cette population de patients Marfan, une majorité de valve mécanique est
48
utilisée en raison du jeune âge des patients. Cette technique a été considérée pendant longtemps comme le gold standard.
49
Pour évaluer la sécurité de cette prise en charge chirurgicale, Gott et al. a réalisé une étude rétrospective multicentrique sur 675 patients atteints d’un syndrome de Marfan opérés suivant l’intervention de Bentall de 1968 à 1996 avec un suivi sur 6.7 ans. 30% des patients étaient opérés dans le cadre d’une dissection aortique. 103 patients ont été opérés en urgence (dans les 24 heures), 117 en semi-urgence (dans les 7 jours) et 455 en programmé. Le taux de mortalité à 30 jours était de 1.5% dans le groupe « chirurgie programmée », de 2.6% dans le groupe « semi-urgence » et de 11.7% dans le groupe « en urgence ». La survie au long court était significativement augmentée par rapport à l’histoire naturelle des patients atteints du syndrome de Marfan. 93.5% des patients étaient en vie à 5 ans, 91% à 10 ans et 59% à 20 ans. Les causes les plus fréquentes de décès tardif étaient la dissection ou rupture de l’aorte restante non opérée (62).
La chirurgie de l’aorte ascendante par un tube valvé a donc montré son efficacité durable avec un risque opératoire faible. Cependant, les complications liées à la valve mécanique existent avec un nombre non négligeable d’accidents hémorragiques, de thrombose de prothèse ou d’endocardite infectieuse. D’autres techniques chirurgicales ont donc été utilisées avec l’avènement des techniques préservant la valve aortique.
b) Remplacement de l’aorte ascendante avec conservation de la
valve aortique
Deux types d’intervention conservant la valve aortique existent : l’intervention de Yacoub ou de remodelage et l’intervention de Tirone David ou de réimplantation.
L’intervention de Tirone David a été décrite pour la première fois en 1992 (63). Une résection complète de l’aorte ascendante est réalisée, ne laissant aucune collerette
au-50
dessus des valves. Elle est remplacée par un tube en Dacron avec suture des commissures et de la valve dans la prothèse, puis une implantation basse de la prothèse est effectuée sous l’anneau aortique (Figure 10, partie de droite).
L’intervention de Yacoub est, elle, décrite en 1993 (64). Une résection des trois sinus de Valsalva et de la partie initiale de l’aorte ascendante est réalisée. On laisse, le long de l’insertion de chaque sigmoïde aortique, un rebord pariétal de quelques millimètres. La prothèse en Dacron va être découpée selon trois folioles qui suivent exactement l’insertion des sigmoïdes, puis suturée en suivant l’insertion des sigmoïdes (Figure 10, partie du milieu).
Plusieurs études ont été réalisées pour comparer la durabilité de ces techniques en comparaison avec l’intervention de Bentall. Toutes ont montré l’absence de différence significative en terme de mortalité précoce ou tardive (65) (66) (67). Dans une méta-analyse réalisée par l’équipe de Benedetto, regroupant 972 patients opérés selon l’intervention de Bentall et 413 selon une technique de conservation de la valve, avec un suivi moyen de 8 ans, il était retrouvé un taux de réintervention quatre fois supérieur dans le groupe préservation de la valve (1.3% par an contre 0.3% par an). Cependant, le risque
thromboembolique était significativement plus bas dans le groupe préservation de la valve (0.3% par an contre 0.7% par an). Le risque composite de réintervention, événement thromboembolique et de saignement était similaire dans les deux groupes (68). Une étude plus récente de David et al. a montré un taux de réintervention beaucoup plus bas avec moins de 5% de réintervention à 15 ans (69).