HAL Id: dumas-01348678
https://dumas.ccsd.cnrs.fr/dumas-01348678
Submitted on 25 Jul 2016
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Les greffons osseux sur mesure en chirurgie
pré-implantaire : revue systématique de la littérature
Baptiste Desobeau
To cite this version:
Baptiste Desobeau. Les greffons osseux sur mesure en chirurgie pré-implantaire : revue systématique de la littérature. Chirurgie. 2016. �dumas-01348678�
Université de Bordeaux
Collège des Sciences de la Santé
UFR des Sciences Odontologiques
Année 2016 N°45
Thèse pour l’obtention du
DIPLOME D’ETAT DE DOCTEUR EN CHIRURGIE DENTAIRE
Présentée et soutenue publiquement Par Baptiste DESOBEAU Né le 6 avril 1983 à Biarritz (64), France
Le 27 juin 2016
Les greffons osseux sur mesure en Chirurgie pré-implantaire :
Revue systématique de la littérature
Directeur de thèse Dr Sylvain CATROS
Membres du jury
Président M. Jean-Christophe FRICAIN Professeur des Universités
Directeur M. Sylvain CATROS Maître de Conférences des Universités Rapporteur M. Raphael DEVILLARD Maître de Conférences des Universités Assesseur M. Bruno ELLA NGUEMA Maître de Conférences des Universités
1
Université de Bordeaux
Collège des Sciences de la Santé
UFR des Sciences Odontologiques
Année 2016 N°45
Thèse pour l’obtention du
DIPLOME D’ETAT DE DOCTEUR EN CHIRURGIE DENTAIRE
Présentée et soutenue publiquement Par Baptiste DESOBEAU Né le 6 avril 1983 à Biarritz (64), France
Le 27 juin 2016
Les greffons osseux sur mesure en Chirurgie pré-implantaire :
Revue systématique de la littérature
Directeur de thèse Dr Sylvain CATROS
Membres du jury
Président M. Jean-Christophe FRICAIN Professeur des Universités
Directeur M. Sylvain CATROS Maître de Conférences des Universités Rapporteur M. Raphael DEVILLARD Maître de Conférences des Universités Assesseur M. Bruno ELLA NGUEMA Maître de Conférences des Universités
4
A notre Président de thèse
Monsieur le Professeur Jean-Christophe FRICAIN Professeur des Universités – Praticien Hospitalier
Sous-section Chirurgie-buccale pathologie thérapeutique 57-02
Merci pour l’honneur que vous me faites en acceptant la présidence de cette thèse. Je n’ai pas eu l’occasion de travailler avec vous en milieu hospitalier mais j’ai pu apprécier au travers de vos cours magistraux ou lors de congrès la grande qualité de votre
enseignement et de votre rigueur scientifique.
A notre Directeur de thèse
Monsieur le Docteur Sylvain CATROS
Maître de Conférences des Universités – Praticien Hospitalier
Sous-section Chirurgie-buccale pathologie thérapeutique 57-02
Vous nous avez fait l’honneur de diriger cette thèse avec rigueur et assiduité. Merci pour vos précieux conseils, votre clarté scientifique, votre disponibilité et la grande patience témoignée au cours de cette année notamment devant tous les sujets de thèse que je vous ai soumis.
5
A notre Rapporteur de thèse
Monsieur le Docteur Raphael DEVILLARD
Maître de Conférences des Universités – Praticien Hospitalier
Sous-section Odontologie Conservatrice – Endodontie 58-01
Je vous remercie d’avoir accepté d’être le rapporteur de cette thèse. Je n’ai pas eu l’occasion de travailler avec vous en milieu hospitalier mais j’ai su apprécier au travers des cours magistraux ou des travaux pratiques la qualité de vos enseignements et votre grande clarté de raisonnement.
A notre Assesseur
Monsieur le Docteur Bruno ELLA NGUEMA
Maître de Conférences des Universités – Praticien Hospitalier
Sous-section Sciences anatomiques et physiologiques 58-03
Je suis très honoré que vous ayez accepté de faire partie du jury. Ce fut un réel plaisir de travailler à vos côtés en cette année aussi bien à l’hôpital comme au laboratoire d’anatomie et je vous remercie d’avoir su partager vos compétences et votre savoir faire.
6 A ma mère, mon père, mon frère, ma sœur et ma famille
A Jean, Greg, Marie, Antoine, Jean-Mi, Manu, Edouard, Romain, Benoît, Benjamin, Aline, Cédric, Beuman, Stéphane, Chacha, Fred, Thomas, Jean Marie
A Maxime, Arthur, Pax, Théo et Julien A Christelle ou plutôt au Dr Barbet-Massin
A mes co-externes : Clément, Marina, Martin, Finnian (avec 2 n), Manon, Maeva, Melissa, Cécile, Noémie, Charlotte, Aymeric, Myriam
A mes collègues d’été : Julien, Daniel, Geoffrey A mes camarades du CREPS : Angélique et Elise
A mes camarades de promo : Vasco, Nathan, Nicolas, Marion, Manon, Marine, Alexandre, Julie, Amandine, Rahiti, Virginie, Violaine, François, Pierre-André
A tous les futurs confrères que j’ai croisés durant ces dernières années : Dr Vaillant, Dr Gourgues, Dr Leclair, Dr Inchausti, Dr Peponnet, Dr Darrieu, Dr Jacquet, Dr Dusseau, Dr Guyot, Dr Sotomayor, Dr Simion, Dr Malterre
7
TABLE DES MATIERES
1 INTRODUCTION ... 10
1.1 Matériaux utilisés pour les greffes osseuses ... 10
1.1.1 Autogreffe ... 10
1.1.2 Allogreffe ... 10
1.1.3 Xénogreffe ... 11
1.1.4 Greffe alloplastique ... 11
1.1.5 Ingénierie tissulaire osseuse ... 11
1.2 Problématique de la mise en forme des greffes osseuses en bloc ... 12
1.3 Procédure ... 12
1.3.1 Acquisition ... 12
1.3.2 Conception Assistée par Ordinateur ... 13
1.3.3 Fabrication ... 13 1.3.4 Chirurgie ... 17 1.4 Objectif de l’étude ... 17 2 MATERIEL ET METHODE ... 17 2.1 Recherche bibliographique ... 17 2.1.1 PubMed/MEDLINE ... 18
2.1.2 Dentistry and Oral Sciences Source (DOSS) ... 19
2.2 Critères de sélection ... 19
2.2.1 Critères d’inclusion ... 19
2.2.2 Critères d’exclusion ... 19
3 RESULTATS ... 19
3.1 Nombre d’études incluses ... 19
3.2 Nombre de patients – Type de procédé de fabrication ... 20
3.3 Age... 20
3.4 Nombre de GOM ... 20
8
3.5.1 Adaptation manuelle sur modèle en résine imprimé 3D ... 21
3.5.2 Fabrication soustractive ... 21 3.5.3 Fabrication additive ... 21 3.6 Défaut osseux ... 21 3.6.1 Type ... 21 3.6.2 Localisation ... 21 3.7 Nature du greffon ... 21 3.8 Logiciel de CFAO ... 22 3.9 Membrane ... 22
3.10 Evaluation de l’adaptation du greffon ... 22
3.11 Evaluation de l’intégration du greffon ... 22
3.12 Complications ... 24
3.13 Synthèse des résultats ... 24
4 DISCUSSION ... 30
4.1 Taille de l’échantillon ... 30
4.2 Sélection des patients... 30
4.3 Défaut osseux ... 30 4.3.1 Type - Sévérité ... 30 4.3.2 Localisation ... 31 4.4 Nature du greffon ... 31 4.4.1 Autogreffes ... 31 4.4.2 Allogreffes ... 31 4.4.3 Xénogreffes ... 32 4.4.4 Matériaux synthétiques ... 32
4.4.5 Substituts osseux associés à des facteurs de croissance ... 32
4.5 Conception Assistée par Ordinateur ... 33
4.6 Procédé de fabrication du greffon ... 33
4.7 Membrane ... 34
9
4.9 Evaluation de l’adaptation du greffon ... 35
4.10 Evaluation de la cicatrisation du greffon ... 35
4.11 Avantages des GOM ... 36
4.12 Inconvénients des GOM ... 36
4.13 Intégration des implants ... 37
5 CONCLUSION ... 38
BIBLIOGRAPHIE ... 39
LISTE DES ABREVIATIONS ... 44
10
1 INTRODUCTION
Actuellement, dans les pays industrialisés, plus de 60% de la population aurait besoin d’une réhabilitation implanto-prothétique (1). En Europe, environ 1,5 millions de patients bénéficient chaque année de reconstruction osseuse lors de chirurgie maxillo-faciale (2). Lorsque les déficits osseux sont supérieurs à 3 mm en largeur et/ou en hauteur, l’indication d’une greffe osseuse en apposition est généralement admise (3).
La mise en place de ces greffons osseux permet alors d’augmenter en largeur et/ou en hauteur le volume osseux résiduel afin d’obtenir un environnement osseux compatible avec un positionnement implantaire optimal qui doit être dicté par le projet prothétique.
1.1 Matériaux utilisés pour les greffes osseuses
1.1.1 Autogreffe
Un greffon est dit autogène lorsqu’il provient du même individu (4). De nos jours, l’os autologue est considéré comme le “gold standard” pour les procédures d’augmentation osseuse du fait de ses propriétés ostéogéniques, ostéoinductrices et ostéoconductrices (3). Outre la morbidité inhérente au prélèvement d’os autogène, une résorption osseuse incontrôlée et une quantité disponible limitée constituent les principales limites de cette source, d’où l’intérêt des substituts osseux (5,6).
1.1.2 Allogreffe
Un greffon allogène a pour origine un individu de la même espèce (4). Quatre grandes familles peuvent être distinguées en fonction des procédés de transformation (7–9) : os d’origine humaine congelé minéralisé (FFBA), os d’origine humaine congelé lyophilisé non déminéralisé (FDBA), os déminéralisé congelé lyophilisé (DFDBA) et os délipidé déprotéinisé.
Les greffons sont présents sous deux formes : spongieux et cortico-spongieux. Les greffons cortico-spongieux présentent le double avantage d’une corticale limitant la résorption osseuse et augmentant la résistance du greffon et d’un os trabéculaire source d’ostéoinduction (10). Les avantages des greffons allogéniques sont une absence de site de prélèvement, une quantité disponible supérieure à une autogreffe et un potentiel ostéoinducteur pour l’os déminéralisé (7). Les inconvénients sont la transmission possible d’agents infectieux ou la survenue de réactions immunitaires (4,11).
11 1.1.3 Xénogreffe
L’os xénogène provient d’une espèce différente de celle du receveur (4). Différentes familles existent en fonction de leur origine animale : corallienne (12,13), équine (14,15) ou bovine (16).
Les avantages sont une absence de site de prélèvement et une quantité disponible supérieure à une autogreffe. Les inconvénients sont une absence d’ostéoinduction, la transmission possible d’agents infectieux ou la survenue de réactions immunitaires (4,11).
1.1.4 Greffe alloplastique
Les greffons alloplastiques sont d’origine synthétique et se décomposent en deux grandes catégories (7,17,18) : les substituts osseux à base de céramiques et ceux à base de polymères. Les biocéramiques sont principalement représentées par les céramiques phosphocalciques : phosphate tricalcique (β-TCP, -TCP), hydroxyapatite (HA), phosphate de calcium biphasique (β-TCP - HA), céramiques multiphasées ou « brushite » (β-TCP – HA - DCPD). Les polymères fréquemment employés sont le polyméthylméthacrylate (PMMA), le polycaprolactone (PCL), l’acide polylactique (PLA), l’acide polyglycolique (PGA), et l’acide polylactique-co-glycolique (PLGA).
Les avantages des greffons synthétiques sont un contrôle possible de l’architecture interne (dimensions des pores, composition chimique) et de l’architecture externe dans le but d’une intégration optimale et une absence de risque de transmission d’agents infectieux (19). Leurs inconvénients sont leurs faibles propriétés mécaniques lorsqu’ils sont présents sous forme de blocs osseux (10). Les céramiques phosphocalciques bioactives présentent une adhésion spontanée au tissu osseux contrairement aux polymères biotolérés qui adhérent à l’os via une couche fibreuse (20). La résorption est faible pour l’HA et les bioverres et plus rapide pour les autres phosphates de calcium (11,21). Le β-TCP présente une résorption rapide par libération d’ions phosphate et calcium durant le remodelage permettant aux espaces ainsi vacants d’être colonisés par de l’os nouvellement formé. Il présente de faibles propriétés mécaniques, d’où l’intérêt de l’association HA-TCP (22).
1.1.5 Ingénierie tissulaire osseuse
L’ingénierie tissulaire osseuse (ITO) est définie par l’association d’une matrice tridimensionnelle (scaffold) avec des cellules autologues et des facteurs de croissance dans le but de reconstruire un nouveau tissu hybride. L’ITO a été développée pour repousser les
limites des méthodes conventionnelles de traitement des pertes de substance osseuses, en particulier la morbidité induite par les autogreffes et l’absence d’intégration des greffes de grande taille (23).
12 1.2 Problématique de la mise en forme des greffes osseuses en bloc
Toutes les techniques chirurgicales d’augmentation du volume osseux utilisent la capacité du tissu osseux à se régénérer (11). Parmi les critères déterminant la réussite du traitement, la coaptation entre le greffon et le site receveur est primordiale (10). En effet, la première étape d’intégration du greffon consiste en sa revascularisation. Les éléments vasculaires et ostéoprogéniteurs sont fournis par le lit osseux receveur et le périoste. Lors de cette première phase, l’ajustement précis du greffon sur son site et sa stabilité sont primordiaux pour l’angiogénèse (24). Grâce à cette revascularisation, un processus de résorption ostéoclastique et une néoformation osseuse se mettent en place. Un remplacement progressif du greffon par de l’os néoformé se produit (9).
Dans les techniques conventionnelles, un contact intime entre site receveur et greffon est obtenu après adaptation manuelle de ce dernier. Or, cette procédure est opérateur-dépendant, elle augmente la durée de l’acte chirurgical et majore le risque infectieux post-opératoire. Le développement des techniques de Conception et Fabrication Assistées par Ordinateur (CFAO) permet l’obtention de greffons osseux sur mesure (GOM) parfaitement adaptés. Trois grandes méthodes peuvent être distinguées : les greffons osseux adaptés manuellement sur modèles en résine imprimés 3D et les greffons osseux préfabriqués issus de CFAO soustractive ou additive.
1.3 Procédure
Préalablement, un assainissement parodontal et l’obtention d’un consentement éclairé à l’intervention au travers d’une information orale et écrite est indispensable (25).
1.3.1 Acquisition
Un examen d’imagerie 3D de la zone d’intérêt type scanner ou tomographie volumique doit être obtenu au format DICOM. Cet examen doit satisfaire à un ensemble de critères : voltage supérieur à 90 kV s’il s’agit d’une tomographie volumique, champ de 100 x 100 mm maximum centré sur la zone d’intérêt (maxillaire-mandibule), images de 500 x 500 points, épaisseur des coupes de 0,2 mm, taille des voxels de 200 μm, coupes parallèles au plan d’occlusion du maxillaire concerné et interposition d’une compresse entre les incisives pour éviter le contact entre les dents (26).
Par ailleurs, la réalisation de l’examen d’imagerie avec un montage directeur radio-opaque (27) ou avec un guide radiologique (10) permet d’évaluer de façon précise les volumes osseux disponibles en fonction des axes prothétiques idéaux à l’aide d’un logiciel de simulation implantaire (28).
13 Le praticien adresse alors à la société une prescription médicale nominative accompagnée du CD-Rom contenant les images du patient sauvegardées au format DICOM issues d’un Cone Beam ou d’un scanner (9).
1.3.2 Conception Assistée par Ordinateur
1.3.2.1 Segmentation – modélisation 3D
La première étape de la Conception Assistée par Ordinateur (CAO) est la réalisation d’un modèle osseux 3D à l’aide d’un logiciel d’analyse et de reconstruction 3D des coupes (ex : MIMICS® Materialise NV Corp.) par des moyens de seuillage des contrastes.
1.3.2.2 Modélisation du greffon
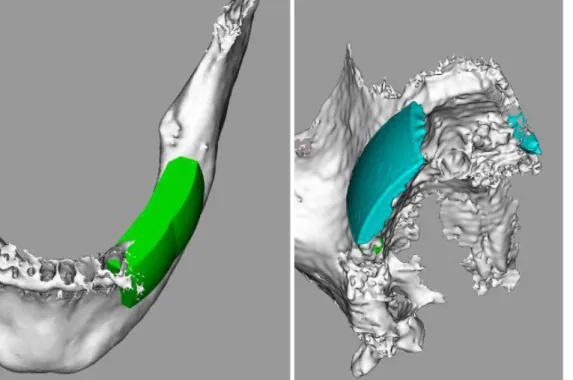
Le modèle anatomique virtuel est ensuite importé au format STL dans un logiciel d’infographie tridimensionnelle dédié à la conception et au design du greffon adapté au défaut osseux (figure 1) (26,29).
Figure 1. Conception du greffon : spongieux mandibulaire, cortico-spongieux maxillaire d’après (26).
1.3.3 Fabrication
1.3.3.1 FAO
Lors de la Fabrication Assistée par Ordinateur (FAO), le bloc est conçu sur commande individuelle par un procédé de fabrication sur mesure puis subit des procédés de
14 décontamination et de stérilisation avant son conditionnement stérile. Deux grandes méthodes existent : la fabrication soustractive et la fabrication additive.
1.3.3.1.1 Soustractive
La fabrication soustractive ou usinage est réalisée dans un centre spécifique conformément au fichier au format STL (26). Il procède à la mise en forme d’un objet par suppression de matière (figure 2) (27,30).
Figure 2. Processus d’usinage d’un bloc allogénique d’après (27).
1.3.3.1.2 Additive
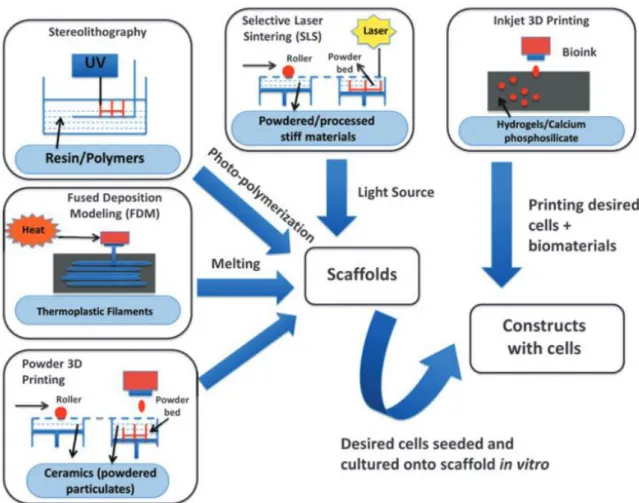
Par opposition à la fabrication soustractive, il existe de multiples procédés de fabrication additive ou impression 3D (figure 3) (34). Le principe commun est la fabrication de l’objet final par ajout de matière en empilant des couches successives (30). Les fichiers STL n’étant pas interprétés directement par les imprimantes 3D, une étape intermédiaire de « tranchage » des fichiers est nécessaire afin de redécouper l’objet à fabriquer en plusieurs couches (32).
Parmi les techniques employées, l’impression par jet d’encre procède par la superposition de couches de 0,1 mm d’épaisseur formées après mélange de poudre avec un liant ou directement par la dépose d’un liquide (31). Le frittage sélectif par laser (Selective Laser Sintering ou
15 SLS) est un procédé dans lequel une poudre est frittée au laser (33). Dans la stéréolithographie (SLA), un liquide photosensible est polymérisé après application d’un faisceau de lumière UV. Dans l’impression 3D par dépôt de matière fondue (Fused Deposition Modeling ou FDM), un filament est extrudé à travers une buse après avoir été chauffé (31).
Figure 3. Les différentes techniques d’impression 3D d’après (34).
1.3.3.2 Manuelle
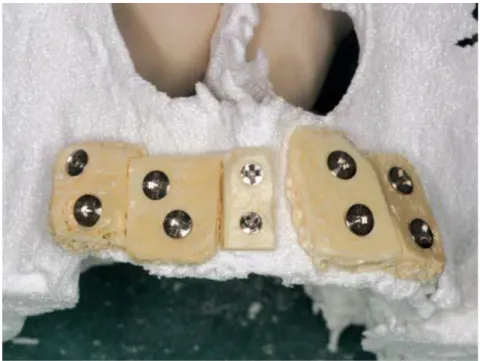
Une autre possibilité est la création, à partir des données STL de la zone à greffer, d’un modèle physique en résine autoclavable fabriqué avec une imprimante 3D. Ce dernier sera la réplique exacte de l’anatomie osseuse du patient. Le jour de l’intervention ou quelques jours avant (35), le praticien procède à l’adaptation manuelle du bloc osseux sur le modèle 3D au moyen d’une fraise à os sur pièce à main chirurgicale (figure 4) (10).
16
Figure 4. Adaptation manuelle sur modèle résine imprimé 3D d’après (35).
A ce modèle peut s’ajouter également une réplique du greffon pour la comparer par la suite au greffon sur mesure à implanter mis en forme manuellement ou par usinage (figure 5) (28).
Figure 5. Comparaison réplique en résine imprimée 3D et GOM d’HA synthétique d’après
17 1.3.4 Chirurgie
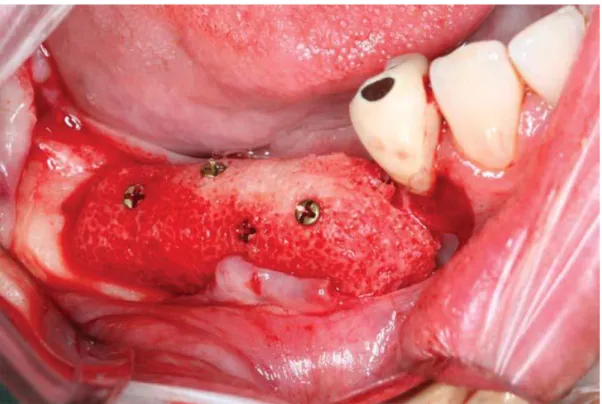
Après élévation d’un lambeau, le greffon allogénique préalablement réhydraté est mis en place et fixé par des vis d’ostéosynthèse (figure 6). Une fermeture sans tension des tissus mous doit être obtenue après sutures pour prévenir toute déhiscence et exposition du greffon.
Figure 6. Fixation d’un GOM mandibulaire d’après (27).
1.4 Objectif de l’étude
L’objectif de ce travail était d’effectuer une revue systématique de la littérature sur les applications cliniques des greffons osseux sur mesure dans les techniques chirurgicales d’augmentation osseuse en phase pré-implantaire en chirurgie orale. Les objectifs secondaires étaient de décrire les méthodes utilisées ainsi que leurs taux de succès et complications.
2 MATERIEL ET METHODE
La recherche documentaire a été menée entre décembre 2016 et mai 2016 avec l’aide d’une documentaliste de la bibliothèque universitaire d’odontologie de la faculté de Bordeaux.
2.1 Recherche bibliographique
Les bases de données bibliographiques PubMed, MEDLINE et DOSS ont été interrogées sur la période 2005-2016. De plus, une recherche manuelle sur les références des articles sélectionnés a été réalisée pour croiser les informations obtenues.
18 2.1.1 PubMed/MEDLINE
2.1.1.1 Groupes de descripteurs Mesh
Une recherche en vocabulaire contrôlé utilisant les mots clés Mesh combinée à une recherche par titre et résumé [Title/Abstract] ou [TIAB] pour tous les termes sans mots clés Mesh clairement associés a été menée. A l’intérieur de chaque groupe, les mots clés ont été reliés par l’opérateur boléen « OR ».
- Biomatériaux : autogenous [TIAB] OR transplants OR tissue scaffolds OR bone substitutes OR inlays OR onlay blocks [TIAB] OR bone blocks [TIAB] OR block allografts [TIAB] OR biocompatible materials OR bone graft [TIAB]
- Fabrication sur mesure : personalized [TIAB] OR custom-designed [TIAB] OR customized [TIAB] OR computer-aided, design OR printing, three-dimensional OR three-dimensional shape [TIAB] OR stereolithography [TIAB] OR user-computer interface OR milling [TIAB] OR custom made [TIAB]
- Augmentation du volume osseux : alveolar ridge augmentation OR alveolar bone loss OR alveolar ridge reconstruction [TIAB] OR reconstructive surgical procedures OR bone transplantation OR orthognathic surgical procedures
- Localisation maxillaire ou mandibulaire : jaw OR jaw diseases OR alveolar process OR maxillary [TIAB] OR mandibular [TIAB] OR maxillofacial abnormalities OR maxillofacial injuries OR facial bones
2.1.1.2 Equation de recherche
Chaque groupe a été associé à l’autre groupe par l’opérateur boléen « AND ». L’équation a été la suivante : (personalized [TIAB] OR custom-designed [TIAB] OR customized [TIAB] OR computer-aided, design OR printing, three-dimensional OR three-dimensional shape [TIAB] OR stereolithography [TIAB] OR user-computer interface OR milling [TIAB] OR custom made [TIAB]) AND (autogenous [TIAB] OR transplants OR tissue scaffolds OR bone substitutes OR inlays OR onlay blocks [TIAB] OR bone blocks [TIAB] OR block allografts [TIAB] OR biocompatible materials OR bone graft [TIAB]) AND (alveolar ridge augmentation OR alveolar bone loss OR alveolar ridge reconstruction [TIAB] OR reconstructive surgical procedures OR bone transplantation OR orthognathic surgical procedures) AND (jaw OR jaw diseases OR alveolar process OR maxillary [TIAB] OR mandibular [TIAB] OR maxillofacial abnormalities OR maxillofacial injuries OR facial bones).
19 2.1.2 Dentistry and Oral Sciences Source (DOSS)
Une recherche complémentaire a été menée en utilisant la nouvelle base de données bibliographiques en médecine dentaire DOSS. Le mode de recherche « trouver tous mes termes de recherche » a été choisi en utilisant l’opérateur d’expansion « appliquer les mots connexes ».
2.2 Critères de sélection
2.2.1 Critères d’inclusion
Les articles répondant aux critères suivants ont été inclus dans l’étude : - défauts osseux concernant le maxillaire et/ou la mandibule ;
- procédé de CFAO intervenant dans l’élaboration du greffon ; - évaluation clinique et/ou analyse histologique et/ou radiographique de la cicatrisation osseuse ;
- études en langue française ou anglaise ; - études cliniques prospectives.
2.2.2 Critères d’exclusion
Les articles répondant aux critères suivants ont été exclus de l’étude : - défauts osseux concernant le condyle mandibulaire et/ou l’orbite et/ou le processus
zygomatique ; - plaques ou cages en titane sur mesure.
3 RESULTATS
3.1 Nombre d’études incluses
La recherche électronique a permis d’identifier 172 articles potentiels. Sur ces 172 articles, 82 ont été exclus après lecture du titre. Sur les 90 articles potentiels restants, 45 articles ont été exclus après lecture du résumé. Enfin sur les 45 articles potentiels sélectionnés, 29 ont été exclus après lecture de l’article complet. 16 articles ont ainsi été inclus auxquels se sont rajoutés 4 études sélectionnées après une recherche manuelle effectuée sur la base des références des articles sélectionnées et 2 articles issus de la revue L’Information Dentaire. Au final, 22 articles ont été inclus (figure 7). 4 articles étaient en relation avec une adaptation manuelle du greffon sur modèle résine 3D, 14 articles avec une réalisation par CFAO soustractive et 4 articles avec une réalisation par CFAO additive.
20
Figure 7. Flow chart
3.2 Nombre de patients – Type de procédé de fabrication
Dans l’ensemble des études, 64 patients ont bénéficié de greffons osseux sur mesure. Chez 11 patients, des greffons osseux conventionnels ont été adaptés manuellement sur modèle résine 3D (10,35–37). La CFAO soustractive a été utilisée pour 29 patients (3,9,19,22,25,27,38–45) et la CFAO additive a été employée pour 24 patients (20,33,46,47).
3.3 Age
L’âge moyen des patients était de 50,1 ans avec des extrêmes de 18 (25) et 73 ans (22). Dans 4 études, l’âge des patients n’était pas communiqué (9,10,35,47).
3.4 Nombre de GOM
Au total, 90 GOM ont été implantés. Seule l’étude de Jacotti et al. (2012) (37) ne précise pas le nombre exact de greffons implantés mais nous avons pu en déduire un nombre de greffons supérieur ou égal au nombre de défauts osseux. Dans 4 études, le nombre de greffons est supérieur ou égal à 10 (20,41,42,46). Le plus grand nombre de greffons a été utilisé dans l’étude de Malmström et al. avec 24 greffons (46).
21 3.5 Procédé de fabrication
3.5.1 Adaptation manuelle sur modèle en résine imprimé 3D
15 greffons ont été adaptés manuellement sur modèle en résine imprimé 3D (10,35–37). 3.5.2 Fabrication soustractive
36 greffons ont été issus d’une CFAO soustractive (3,9,19,22,25,27,38–45). 3.5.3 Fabrication additive
39 greffons ont été issus d’une CFAO additive. 38 greffons ont été conçus par impression par jet d’encre (20,46,47) et un par frittage sélectif par laser (33).
3.6 Défaut osseux
3.6.1 Type
Sur les 86 défauts osseux recensés dans notre étude, 11 défauts étaient horizontaux (3,9,10,35,37), 2 défauts étaient verticaux (37), 49 défauts étaient mixtes (composante horizontale et verticale) (19,20,22,25,27,33,36,38–45) et 24 défauts étaient des défauts expérimentaux à 4 parois osseuses (46).
3.6.2 Localisation
3.6.2.1 Maxillaire
Une localisation maxillaire était retrouvée pour 51 défauts osseux. 10 défauts étaient localisés en région antérieure (dents 13 à 23) (10,35,39,42,43), 40 en région postérieure (dents 14 à 18 et 24 à 28) (9,20,41,42,46) et un en région antéropostérieure (44).
3.6.2.2 Mandibule
La localisation mandibulaire était retrouvée pour 27 défauts osseux. 7 défauts ont été localisés en région antérieure (dents 33 à 43) (20,25,33), 19 en région postérieure (dents 34 à 38 et 44 à 48) (3,9,19,20,22,27,36,38,40,45) et un en région antéropostérieure (47).
3.6.2.3 Non spécifiée
Seule l’étude de Jacotti et al. (2012) ne précisait pas la localisation des 8 défauts osseux (37). 3.7 Nature du greffon
Dans l’ensemble des articles, une autogreffe d’origine iliaque a été retrouvée (36), 22 allogreffes, 25 xénogreffes et 42 greffes alloplastiques. Parmi les allogreffes, il s’agissait d’os congelé et lyophilisé pour 7 greffons (3,10,27,39,45) et d’os délipidé déprotéinisé pour 15 greffons (9,35,37). Parmi les xénogreffes, 22 étaient d’origine corallienne (40–42), 2
22 d’origine bovine (38,44) et une d’origine équine (43). Parmi les greffes alloplastiques, 14 étaient constituées d’hydroxyapatite (19,22,46), 14 de TCP (20,47), 12 étaient à base de zircone (46), une de PCL (33) et une de céramique biphasée β-TCP - HA (25). L’étude de Rasperini et al. utilisait un PIT composé de deux éléments : scaffold PCL et facteur de croissance synthétique rhPDGF-BB (33). Mangano et al. (2015) ont utilisé du PRGF au contact direct du site receveur (25).
3.8 Logiciel de CFAO
Les logiciels d’infographie tridimensionnelle retrouvés dans notre travail étaient variés. Les logiciels Rhino® (Rhinoceros) et Mimics® (Materialise) ont été utilisés dans 7 études (22,25,33,40–42,44). Les autres logiciels cités étaient EBW 4.0® (Philips Medical) (36), 3D Néovision® (3D Néovision) (10), One Scan3D® (3D Med) (3), 3D-Doctor® (3D-Doctor) (38), Freeform Modeling® (SensABLE Technologies) (45), 3D SolidWorks® (SolidWorks) (46), NX 7.5® (Siemens) (33) et Magics® (Materialise) (47).
3.9 Membrane
Dans 11 études sur 22 (50%), le greffon a été recouvert par une membrane (3,9,27,35,37-39,42–45). Dans tous les cas, il s’agissait d’une membrane résorbable.
3.10 Evaluation de l’adaptation du greffon
La qualité de l’adaptation du greffon était précisée cliniquement sur site receveur dans 13 études (3,20,22,25,27,35,37,40,42–46), sur une réplique du greffon en résine imprimée 3D dans une étude (36), sur la réplique 3D du défaut osseux dans une étude (47) et sur une réplique du greffon et du défaut osseux dans une étude (9). Une vérification scannographique de l’ajustage était pratiquée dans une étude (33). Enfin, dans deux études, l’adaptation était évaluée cliniquement et radiographiquement (38,41). Dans trois études, la qualité de l’ajustage n’a pas été précisée (10,19,39).
Dans toutes les études, l’adaptation était jugée bonne à parfaite avec absence de hiatus hormis dans trois études dans lesquelles un hiatus entre greffon et os natif était présent (36,44,45) et dans une étude où une retouche manuelle minime a été nécessaire (20). Un taux d’adaptation de 82% est rapporté dans une étude (33).
3.11 Evaluation de l’intégration du greffon
L’évaluation de la qualité de l’intégration du greffon était uniquement clinique dans 4 études (10,35,44,47) et uniquement radiologique (radiographie rétroalvéolaire, panoramique dentaire, scanner ou tomographie volumique) dans 4 études (3,19,39,41). Cette évaluation était double : clinique et histologique (figure 8) dans 5 études (33,37,40,42,46), clinique et
23 radiologique dans 3 études (9,20,43) et histologique et radiologique dans 2 études (25,45). Enfin, cette appréciation était triple : clinique, histologique et radiologique dans une étude (27). Dans 3 études, l’intégration du greffon n’était pas mentionnée (22,36,38).
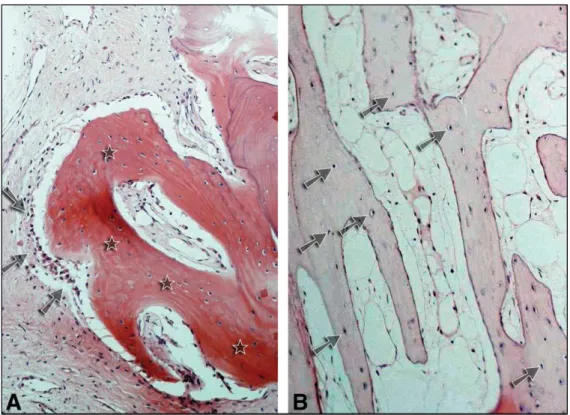
Figure 8. Coupe histologique au niveau d’une allogreffe d’os délipidé déprotéinisé à 8 mois : A, présence d’ostéoblastes (flèches) au contact avec de l’os nouvellement formé (étoiles). B, os nouvellement formé avec ostéocytes vivants (flèches) au niveau des lacunes d’après (37).
La période de cicatrisation avant évaluation de l’intégration de la greffe osseuse variait de 3 (46) à 12 mois (20,25,43,45).
Cliniquement, toutes les études montraient une intégration réussie du greffon (9,10,20,27,33,35,37,40,42-44,46,47).
Histologiquement, la présence d’os nouvellement formé était notée dans toutes les études comportant une analyse histologique (25,27,33,37,40,42,45,46). Une néoformation osseuse était décrite au centre d’un scaffold de carbonate de calcium à 8 mois dans l’étude de Mangano et al. (2014) (42). La présence d’os mature était notée à 6 (45) ,8 (37) et 12 mois (25). Les résultats des analyses histomorphométriques décrivaient des pourcentages d’os nouvellement formé de 34,5% (40) et 34,9% (42). Les taux de greffon résiduel étaient de
24 26,3% (42) et 29,9% (40). Les espaces médullaires étaient représentés à hauteur de 35,6% (40) et 38,8% (42).
Sur les examens d’imagerie, la résorption osseuse était jugée minime voire absente dans toutes les études (3,19,20,25,41,43,45). En comparant le niveau osseux en regard des têtes de vis d’ostéosynthèse 6 mois après la fixation d’une allogreffe d’os congelé lyophilisé, Schlee et al. (2013) ont constaté un niveau osseux stable sauf au niveau du greffon ayant subi une exposition partielle (27). L’étude de Rasperini et al. a montré un échec de la cicatrisation du greffon avec une régénération osseuse mineure (33). Une densité osseuse de 340 HU est mesurée au niveau d’une xénogreffe équine 8 mois après son implantation (44).
3.12 Complications
Une fracture de deux GOM est décrite lors de leur fixation dans l’étude de Mangano et al. (2014) (42). Une exposition partielle d’un greffon est survenue 2 mois après la chirurgie dans deux études (27,42). Un scaffold de PCL a été retiré 14 mois après son insertion après échec du traitement de l’exposition partielle survenue un mois auparavant. Les explications avancées étaient une vitesse de résorption trop lente du PCL, une porosité insuffisante et une surface de contact peu étendue entre le matériau et le site d’implantation. Les auteurs ont suggéré d’utiliser plutôt un matériau tel que l’acide polylacticque-co-glycolique (33).
3.13 Synthèse des résultats
Les résultats des études incluses sont résumés dans les tableaux suivants : - Adaptation manuelle du greffon sur modèle en résine imprimé 3D : tableau I
- Fabrication soustractive : usinage : tableaux II (1), II (2) et II (3) - Fabrication additive : tableau III
30
4 DISCUSSION
4.1 Taille de l’échantillon
Les échantillons étaient globalement peu nombreux puisque parmi les études incluses, 15 études ne concernaient qu’un seul patient. L’étude intéressant le plus grand nombre de cas était celle de Malmström et al. qui comportait 12 patients (46).
4.2 Sélection des patients
L’âge moyen des patients sélectionnés était relativement jeune puisqu’il était en moyenne de 50,1 ans. L’augmentation croissante de l’espérance de vie va impliquer la prise en charge de patients de plus en plus âgés. Or, la qualité de la cicatrisation osseuse diminue avec l’âge puisque la vitesse du remodelage osseux diminue (48).
Les patients présentant les antécédents suivants ont été exclus des études : motivation faible, contrôle de plaque inadéquat, tabagisme actif supérieur à 5 à 15 cigarettes par jour, pathologie sinusienne, diabète non équilibré, bruxisme, traitement par biphosphonates per os ou IV, chimiothérapie, traitement immunosuppresseur, traitement pour maladie rénale ou cardiovasculaire, maladie cardio-vasculaire récente, maladie endocrinienne, maladie systémique, radiothérapie cervico-faciale, infection active par le VHB, VHC ou VIH (25,41,42,46). Pourtant, ces états pathologiques ne représentent pas tous des contre-indications absolues à une chirurgie osseuse pré-implantaire et ne sont donc pas représentatifs de la population candidate à une chirurgie d’augmentation osseuse.
4.3 Défaut osseux
4.3.1 Type - Sévérité
Plus de la moitié des défauts osseux (57%) étaient mixtes, ce qui montre bien le souhait des auteurs d’étudier les bénéfices de cette thérapeutique dans des cas complexes : classe V et VI de la classification de Cawood et Howell (4).
La perte osseuse verticale était mesurée dans le sens vertical à 10 mm en région symphysaire dans l’étude de Mangano et al. (2015) (25). Dans deux autres études, la hauteur osseuse résiduelle était de 5,7 mm au-dessus du nerf alvéolaire inférieur (40) et de 2 à 5 mm en dessous du plancher du sinus maxillaire (41). Dans le sens horizontal, la largeur de crête mandibulaire était de 1,85 mm à 6 mm du foramen mentonnier dans l’étude de Jacotti et al. (2014) (3) et Moret et al. décrivaient un cas avec une crête en lame de couteau (9).
31 4.3.2 Localisation
La majorité des greffons ont été implantés au maxillaire : 51 contre 27 à la mandibule. Or, les études montrent des taux de complications supérieurs pour les greffes osseuses mandibulaires (49) notamment en région postérieure (50). Les explications pourraient être une vascularisation moindre et une manipulation plus délicate des lambeaux pour refermer le site sans tension en fin d’intervention.
4.4 Nature du greffon
En 1996, la conférence de consensus de Boston sur le sinus lift s’est intéressée aux résultats cliniques et radiographiques à 5 ans de 2997 implants en fonction du type de greffon utilisé. Il s’agissait de greffons conventionnels de type autogreffe, allogreffe, xénogreffe ou greffe alloplastique ne faisant pas intervenir de procédé de CFAO. Les auteurs ont observé des taux de survie implantaire similaires quelle que soit l’origine du greffon et ont conclu qu’il était impossible d’affirmer avec certitude qu’un matériau était supérieur à un autre (51).
4.4.1 Autogreffes
Dans les grandes reconstructions osseuses, la nécessité d’un volume osseux important implique un prélèvement extra oral iliaque ou pariétal. Mais outre la morbidité liée à ce type de procédure, la résorption osseuse peut aller jusqu’à 40% du volume osseux implanté après greffe en apposition d’un bloc osseux autogène en région mandibulaire postérieure (5,6).
4.4.2 Allogreffes
Dans une étude réalisée sur 48 implants posés auprès de 31 patients, Schlee et al. ont montré des taux de succès similaires à 4 ans entre autogreffes et allogreffes conventionnelles et une satisfaction significativement supérieure des patients ayant bénéficié d’une allogreffe (52). Dans une étude comparant différents types de greffons conventionnels de type allogreffe FDBA, autogreffe iliaque ou symphysaire et os natif non greffé, Al-Abedalla et al. ont observé une absence de différence significative concernant le niveau de la résorption osseuse et les taux de survie implantaire à 2-3 ans de 721 implants (53). Enfin, il a été démontré qu’il n’y avait pas de différence entre greffe autogène et allogreffe traditionnelles sur une période d’une année si ce n’est une cicatrisation précoce au bout de deux semaines pour la première (54).
Parmi les allogreffes recensées dans notre travail, seules des greffes d’os délipidé déprotéinisé ou d’os congelé et lyophilisé ont été utilisées. En France, seule la première famille a l’autorisation de l’ANSM (9). Aucune étude n’a employé d’os déminéralisé et lyophilisé
32 probablement du fait de ses propriétés mécaniques moindres liées à la déminéralisation de ces matériaux.
4.4.3 Xénogreffes
Les bons résultats de l’intégration osseuse du greffon sur mesure d’origine équine de l’étude de Pistilli et al. (2013) sont à nuancer. En effet, les auteurs font état des résultats défavorables d’une enquête multicentrique rétrospective conduite par Felice et al. qui ont observé des taux d’échecs supérieurs à 50% et des infections survenant chez 25% des greffons traditionnels d’origine équine implantés (43). Malheureusement, cette étude n’a pas été publiée.
4.4.4 Matériaux synthétiques
D’après Colombier et al., une interface directe os - HA peut être observée autour des scaffolds d’HA dense mais la majorité du matériau est entourée de tissu fibreux contrairement à ce qui peut être observé avec le TCP (55) ou avec l’HA poreuse (19). Le β-TCP présente une résorption plus rapide par rapport à l’HA. Dans de petits défauts, la cicatrisation osseuse sera donc plus rapide en cas d’utilisation de β-TCP. Au niveau de grands défauts, la résorption rapide du β-TCP ne pouvant être comblée à temps par l’os nouvellement formé, l’HA sera indiquée de préférence (19). Les scaffolds en polymères ou en bioverres présentent une perte de résistance en 1 à 2 mois d’où la nécessité d’une régénération osseuse avant ce délai et d’une indication dans les défauts osseux de taille limitée et ne subissant pas des contraintes élevées (22).
En ce qui concerne la porosité, plus elle augmente, plus l’ostéoconduction augmente mais plus la résistance mécanique diminue (19).
4.4.5 Substituts osseux associés à des facteurs de croissance
L’utilisation clinique des facteurs de croissance est essentiellement limitée par les problèmes de cinétique de libération après implantation. En effet, la méthode d’administration nécessite la mise en place directe sur le site chirurgical. Les résultats sont plus prometteurs quand les facteurs de croissance sont combinés à un substrat ou un scaffold permettant une libération contrôlée dans le temps. Les réglementations des autorités de santé vont déterminer leurs indications ; c’est le rapport coût/bénéfice qui définira finalement leur utilisation clinique (18).
Mangano et al. (2015) préconisent la mise en place de PRP au contact du site receveur (25). Le PRGF permet de délivrer un ensemble de protéines et de facteurs de croissance qui favorisent la régénération osseuse (25). Le PDGF possède une action stimulante sur la réparation de fractures en activant la multiplication ostéoblastique et permet de raccourcir la
33 durée de la néoformation osseuse. Pour certains auteurs, la libération de BMPs lors de la déminéralisation des allogreffes d’os congelé déminéralisé leur confère un potentiel d’ostéoinduction (7).
4.5 Conception Assistée par Ordinateur
Classiquement, après acquisition et reconstruction 3D de la zone d’intérêt, la conception du greffon est réalisée sur le modèle anatomique virtuel à l’aide d’un logiciel d’infographie tridimensionnelle (3,9,19,25,27,33,38-,42,44,45).
Une autre méthode consiste, après reconstruction 3D, à fabriquer par impression par jet d’encre (20,47) ou par stéréolithographie (43) une réplique en plâtre (20,47) ou en résine (43) du maxillaire et/ou de la mandibule sur laquelle le greffon est modélisé manuellement sous la forme d’un wax up radio-opaque. Deux possibilités s’offrent alors au praticien à ce stade. La première option est la polymérisation du wax up pour obtenir un greffon sur mesure en résine qui sera transmis au laboratoire de CFAO (43). La deuxième option est la réalisation d’un examen d’imagerie 3D wax up en place sur le modèle imprimé 3D. Le fichier ainsi obtenu est ensuite transmis à un logiciel d’infographie pour affiner les contours du greffon et concevoir l’architecture interne avant de passer à l’étape de fabrication (20,47).
Les avantages de cette méthode sont une modélisation réalisée par le praticien sur un modèle anatomique réel et non virtuel permettant la prise en compte de l’asymétrie du visage et facilitant la communication entre le praticien et le centre de CFAO.
4.6 Procédé de fabrication du greffon
Par rapport à la fabrication soustractive, la fabrication additive permet de contrôler à la fois l’architecture interne et externe du greffon et permet la réalisation de formes plus complexes que l’usinage (30). L’impression par jet d’encre utilise des substances biodégradables et biocompatibles à des températures non excessives et comporte un degré de précision élevé. Cependant, le frittage nécessaire pour améliorer les propriétés mécaniques du scaffold est suivi d’une rétraction de prise et donc d’un défaut d’adaptation du greffon au site receveur. Saijo et al. (2009) préconisent alors pour éviter ce frittage d’optimiser la taille des particules de poudre de -TCP (10 m), la viscosité et le pH de la solution de dilution (20). Le frittage sélectif par laser a pour inconvénient la survenue d’une rétraction de prise suite à l’utilisation de hautes températures (20,34).
Parmi les autres techniques de fabrication additive, le dépôt en phase vapeur basse température (Low temperature Deposition Manufacturing ou LDM) permet la fabrication de scaffold mixte PLGA-TCP (56). Le robocasting est un procédé de mise en forme de
34 céramiques utilisé par Cesarano et al. pour fabriquer un scaffold d’HA secondairement adapté au défaut osseux par usinage. Sa spécificité repose sur le fait que le liquide issu du micro orifice contient un solvant volatile qui permet la solidification du produit après évaporation du solvant. Les matrices d’HA obtenues par cette technique avec une microporosité de surface comprise entre 3 et 8 m et un frittage effectué à 1300°C présentent des propriétés mécaniques identiques à celle de l’os cortical (22).
L’impression 3D permet également la fabrication d’une réplique PTFE du greffon qui peut être utilisée comme guide pour le forage des puits des vis d’ostéosynthèse dans l’os du site receveur pour limiter le risque de fracture du greffon lors du forage (25).
Un contrôle de la porosité est possible sachant que la taille idéale des pores d’un scaffold de biocéramique devrait être similaire à celle de l’os spongieux (18). Une microporosité (pores inférieurs à 10 µm) est requise pour obtenir la perméabilité nécessaire à la circulation des fluides corporels (46). En revanche, seule une macroporosité (pores supérieurs à 200 m et 65% de porosité) permet la colonisation cellulaire (18,57). D’après Kühne et al., la taille idéale des pores serait d’environ 500 m pour une reconstruction osseuse interne (58).
4.7 Membrane
Dans 50% des études incluses dans notre travail, une membrane a été mise en place. Ces résultats sont conformes à ceux observés dans la littérature puisqu’on observe une absence de consensus sur l’intérêt de leur utilisation. Pour certains auteurs, les membranes différent la cicatrisation osseuse en raison d’une altération de la vascularisation du greffon (59,60), représentent un risque infectieux potentiel en cas d’exposition (49) et augmentent le coût de la procédure. En revanche, pour Dongieux et al., il n’existe pas de différence significative de volume osseux après greffe osseuse d’apposition avec et sans membrane chez le chien (61). En cas d’utilisation de particules osseuses pour combler un hiatus entre greffon et site receveur, la mise en place d’une membrane permet de garder les granules en place (62) et de diminuer la résorption osseuse (9).
Ćabov et al. recouvrent la membrane collagènique par une membrane PRF (39). Des membranes sur mesure prédécoupées sur un modèle maxillaire stérile en résine imprimé 3D sont décrites par Jacotti et al. (2012) (37).
L’utilisation d’une membrane plaquettaire recouvrant le greffon décrite dans l’étude de Mangano et al (2015) (25) peut être préférée à une membrane classique dans les cas de très faible épaisseur muqueuse (11).
35 4.8 Procédure chirurgicale
La revascularisation du greffon est l’élément clé du succès de l’intervention. Cet apport vasculaire provient du lit osseux receveur et du périoste. La rupture des ponts vasculaires par les incisions entraîne une diminution de moitié de l’apport sanguin local, d’où l’intérêt d’une incision unique à distance pour limiter cette perturbation. De plus, la réalisation d’incisions multiples lors de la préparation des lambeaux et le repositionnement de ces mêmes lambeaux sur un volume osseux augmenté par la mise en place du greffon génèrent des tensions élevées sur les zones de sutures. La mise en place du greffon par une technique de tunnelisation permet une réduction du traumatisme chirurgical et du risque d’exposition du greffon pendant la phase précoce de cicatrisation (10). Des perforations osseuses corticales au niveau du site receveur sont pratiquées afin d’accroître l’apport sanguin. Elles permettent d’accélérer la néogenèse osseuse initiale et d’augmenter la densité et le remplissage osseux (9,25,42). Cette décortication est classiquement réalisée à l’aide d’instruments rotatifs mais peut intégrer la piézochirurgie dans les techniques de tunnelisation afin de prévenir les lésions des tissus mous (10).
4.9 Evaluation de l’adaptation du greffon
Le but principal des GOM est d’obtenir une adaptation parfaite du greffon au site receveur. Il a été démontré une précision de l’ajustage supérieure pour les blocs osseux sur mesure par rapport aux greffes autogènes conventionnelles avec des valeurs respectives de 200 m et 590 m (29). Ce contact intime entre greffon et os natif est nécessaire pour une régénération osseuse optimale (42,45). Il va permettre d’accroître la stabilité de la greffe, élément crucial pour le succès de la cicatrisation osseuse (63).
Une mauvaise adaptation du greffon peut être à l’origine d’un traumatisme des tissus mous de recouvrement entrainant une déhiscence puis une sur-infection conduisant à l’échec de l’implantation (50).
Une vérification de l’adaptation du greffon sur une réplique stéréolithographique stérile du défaut osseux présente l’intérêt de valider l’adaptation du greffon à distance du site opératoire.
Des particules d’os allogénique ou autres peuvent être mises en place au niveau d’un hiatus persistant après insertion du greffon (44,45) voire même en l’absence de hiatus (27).
4.10 Evaluation de la cicatrisation du greffon
La durée d’une séquence de remodelage osseux étant de 4 à 6 mois, l’évaluation de l’intégration du greffon doit se faire après ce délai. Lors de la réouverture du site greffé,
36 l’aspect sanguinolent du greffon est un critère de bonne vascularisation et de succès de la greffe (9,52). La mesure de la résorption osseuse par l’observation clinique ou par sondage autour des têtes des vis d’ostéosynthèse est un marqueur fiable du niveau de la résorption osseuse (27).
Li et al. ont mis en évidence in vitro l’attachement et la prolifération de hBMSCs déposées à la surface d’un scaffold sur mesure de PLGA - TCP de J1 à J8 (56).
En raison de l’absence de cellules ostéogéniques dans les allogreffes, la mise en place des implants est habituellement décalée d’un ou deux mois par rapport aux autogreffes. Ce délai est nécessaire compte tenu de l’allongement de la phase de revascularisation et d’incorporation du greffon (9).
4.11 Avantages des GOM
Du fait de la plus grande précision d’adaptation des greffes osseuses sur mesure, la stabilité des greffons est maximale, leur vascularisation est augmentée et les contraintes exercées sur les tissus mous à la fermeture sont diminuées (19).
En cas d’adaptation manuelle sur modèle 3D, la précision de l’adaptation des bords reste supérieure à un réglage sur site receveur car la vision opératoire n’est pas entravée par le lambeau d’accès (35).
L’absence d’adaptation manuelle d’un greffon sur mesure issu de CFAO additive ou soustractive diminue le caractère opérateur-dépendant et rend la procédure accessible à un plus grand nombre de praticiens. Toutefois, il est essentiel de bien maîtriser les tracés d’incision et les techniques de fermeture de lambeaux sans tension.
L’utilisation de GOM permet un gain de temps et donc une diminution du risque de contamination du site ou du greffon par la salive ou des micro-organismes extra oraux. Le risque d’infection du site opératoire étant proportionnel à la durée de l’intervention chirurgicale, le risque d’infection du greffon et d’échec du traitement est moindre (64). Cette diminution du temps opératoire présente également un intérêt chez des personnes fragiles médicalement chez lesquelles la durée des séances de chirurgie doit être limitée.
Lors de l’utilisation de substituts osseux, il n’y a pas de nécessité de prélèvement intra ou extra oral. La morbidité de l’intervention est ainsi grandement diminuée avec une limitation de la douleur post opératoire ou du préjudice esthétique et des risques hémorragiques et infectieux.
4.12 Inconvénients des GOM
Les dimensions des greffons osseux sur mesure d’origine naturelle sont limitées par la taille du tissu donneur. Les allogreffes BIOBank® ont des dimensions limitées à 32 x 15 x 9 mm
37 pour les greffons spongieux et 22 x 15 x 9 mm pour les greffons cortico-spongieux du fait des diamètres des têtes fémorales (26). Pour des défauts osseux supérieurs à 25 mm, il convient d’utiliser plusieurs greffons cortico-spongieux ou un greffon spongieux prélevé dans la longueur de la tête fémorale. Cependant, le recul sur ce type de greffon est encore très limité et leur résorption est très importante lors de la phase de reminéralisation (9).
Les techniques de fabrication de GOM par impression 3D de matériaux synthétiques permettent de parer à cette limite des GOM d’origine naturelle. Cependant, la taille des greffons osseux sur mesure d’origine synthétique est limitée par la nécessité d’une diffusion des nutriments et de l’oxygène indispensables à la survie, la prolifération et la différenciation cellulaire à travers l’ensemble du scaffold (25,42). Ainsi, la taille du greffon est limitée à 12 mm de hauteur et 10 mm de largeur lorsqu’il s’agit de greffons synthétiques d’HA (19) ou de céramique biphasique β-TCP - HA (25).
Outre un coût supplémentaire de 460 euros pour une allogreffe sur mesure par rapport à un greffon osseux conventionnel BIOBank® (9), le risque de transmission virale et/ou d’agents transmissibles non conventionnels ne peut être totalement écarté pour les allogreffes. Ce risque est cependant évalué à 1 sur 2,8 milliards pour le VIH concernant l’os déminéralisé et lyophilisé (55).
Dans le cas de greffes usinées, le risque de contamination par du tungstène provenant des fraises utilisées pour l’usinage est à prendre en compte (28).
Enfin, des erreurs d’adaptation du greffon peuvent avoir comme origine la présence de restaurations métalliques à proximité du défaut osseux sources d’artéfacts radiologiques lors de la phase d’acquisition (25,42).
4.13 Intégration des implants
Dans l’étude de Garagiola et al., l’implant court (4.75 x 7 mm) mis en place au niveau du scaffold d’HA synthétique était ostéointégré à la radiographie de contrôle à 3 mois (19). 6 mois après leur mise en charge, la résorption osseuse péri-implantaire de 9 implants placés dans une allogreffe d’os congelé et lyophilisé était de 1,69 mm 3,31 mm et 1,64 1,22 mm à 12 mois soit des valeurs proches de celles observées autour d’implants placés au niveau d’un tissu osseux non greffé (27). A un an, l’intégration esthétique et fonctionnelle de la restauration implanto-portée sur 4 implants posés sur une xénogreffe Biocoral® était jugée correcte dans l’étude de Figliuzzi et al. (40). Schlee et al. ont noté une bonne intégration des 3 implants un an après leur pose avec une stabilité du niveau osseux de l’allogreffe d’os congelé et lyophilisé (45). Deux ans après la chirurgie d’augmentation osseuse, Mangano et al. (2014) ont décrit des taux de survie implantaire de 100% pour 10 implants placés au niveau d’une
38 xénogreffe corallienne (42). 2 ans après leur mise en charge, le taux de survie de 19 implants mis en place après élévation sinusienne par voie latérale et xénogreffe corallienne était de 100% avec une résorption osseuse péri-implantaire physiologique (41).
5 CONCLUSION
Lors de toute procédure chirurgicale, le succès d’une greffe osseuse quelle que soit son origine va dépendre entre autres de sa coaptation optimale au site receveur. Plus la surface de contact entre greffon et hôte sera importante, plus la revascularisation du greffon sera rapide et importante. Classiquement, le praticien procède en bouche à l’adaptation des bords du greffon sur le site opératoire le jour de l’intervention. Or, cette phase d’ajustage est opérateur dépendant, chronophage et constitue une période à risque de contamination du greffon. En effet, la complication la plus fréquente après implantation de greffons allogéniques est l’infection du greffon (3,39,49). Celle-ci survient généralement à la suite d’une exposition du greffon lors de la phase de cicatrisation ou à la suite d’une contamination au moment de l’adaptation des contours. Pour cette raison, plus la durée d’adaptation du greffon est réduite, plus le risque infectieux est faible (64).
Au cours des dernières années, l’application clinique des techniques de CFAO en chirurgie dentaire s’est largement développée. La réalisation de greffes osseuses sur mesure adaptées manuellement sur modèle résine imprimé 3D ou issues d’une CFAO additive ou soustractive permet d’augmenter la précision de l’adaptation (29) et de diminuer le temps opératoire tout en évitant la morbidité inhérente à un prélèvement d’os autogène.
Ces procédures donnent des résultats similaires aux greffes osseuses conventionnelles avec des taux de survie implantaire à 2 ans comparables (41).
Actuellement, peu d’études sont recensées sur le sujet. Mangano et al. (2013) décrivent le premier cas de greffon osseux sur mesure dans une élévation sinusienne (41). Rasperini et al. font état du premier cas de scaffold sur mesure dans le traitement d’un défaut osseux parodontal (33) et Saijo et al. (2009) présentent la première fabrication par impression par jet d’encre d’un greffon sur mesure de TCP (20).
Les études sélectionnées dans notre travail comportaient des échantillons de taille limitée et le recul clinique était faible. Des études cliniques contrôlées avec des échantillons plus nombreux seraient nécessaires pour comparer greffes osseuses autogènes et allogènes conventionnelles et greffons osseux sur mesure.
39
BIBLIOGRAPHIE
1. Petersson K, Pamenius M, Eliasson A, Narby B, Holender F, Palmqvist S, Håkansson J. 20-year follow-up of patients receiving high-cost dental care within the Swedish Dental Insurance System: 1977-1978 to 1998-2000. Swed Dent J. 2006;30(2):77-86.
2. D'Aquino R, De Rosa A, Lanza V, Tirino V, Laino L, Graziano A, Desiderio V, Laino G, Pappacio G. Human mandible bone defect repair by the grafting of dental pulp stem/progenitor cells and collagen sponge biocomplexes. Eur Cell Mater. 2009 Nov12;18:75-83.
3. Jacotti M, Barausse C, Felice P. Posterior atrophic mandible rehabilitation with onlay allograft created with CAD-CAM procedure: a case report. Implant Dent. 2014 Feb;23(1):22‑8.
4. Seban A. Greffes osseuses et implants. Issy-les-Moulineaux: Elsevier Masson; 2008 ; 502p. 5. Laviv A, Jensen OT, Tarazi E, Casap N. Alveolar sandwich osteotomy in resorbed alveolar ridge for dental implants: a 4-year prospective study. J Oral Maxillofac Surg Off J Am Assoc Oral Maxillofac Surg. 2014 Feb;72(2):292‑303.
6. Cordaro L, Amadé DS, Cordaro M. Clinical results of alveolar ridge augmentation with mandibular block bone grafts in partially edentulous patients prior to implant placement. ClinOral Implants Res. 2002 Feb;13(1):103‑11.
7. Colombier ML, Lesclous P, Tulasne JF. Bone graft healing. Rev Stomatol Chir Maxillofac. 2005 June;106(3):157‑65.
8. Al-Nawas B, Schiegnitz E. Augmentation procedures using bone substitute materials or autogenous bone - a systematic review and meta-analysis. Eur J Oral Implantol. 2014;7 (Suppl 2):S219-34.
9. Moret M, Canonica M, Henriot E, Piral T, Princ G. Greffons osseux d’apposition allogéniques BioBank « modélisés » 3D: à propos de deux cas. L’Information Dentaire. Fev 2016;2‑8.
10. Venet L, Perriat M, Jaby P, Fortin T. Intérêt de l’imagerie pour les greffes d’apposition allogéniques par tunnelisation: à propos d’un cas. L’Information Dentaire. Avr 2015;14:18‑24.
11. Seban A. Pratique clinique des greffes osseuses et implants : modalités thérapeutiques et prise en charge des complications. Issy-les-Moulineaux: Elsevier Masson; 2012. 451 p. 12. Le petitcorps Y, Fricain JC, Souillac V, Largeteau A, Schmitthaeusler R. Procédé de purification du corail, ainsi que le corail obtenu par ce procédé [Internet]. [Brevet]. Disponible sur: http://www.google.com/patents/WO2005055885A1
40 13. Damien E, Revell PA. Coralline hydroxyapatite bone graft substitute: a review of experimental studies and biomedical applications. J Appl Biomater Biomech. 2004;2(2):65‑73.
14. OsteOXenon® by BIOACTIVA®. Remodeling the future. The new GBR standard. [Internet]. 2013. Disponible sur:
http://www.bioteck.com/images/PDF/Brochures/DENT_AdvancedLine_EN.pdf
15. Felice P, Piana L, Checchi L, Corvino V, Nannmark U, Piattelli M. Vertical ridge augmentation of an atrophic posterior mandible with an inlay technique and cancellous equine bone block: a case report. Int J Periodontics Restorative Dent. 2013 Mar;33(2):158‑66.
16. Felice P, Marchetti C, Iezzi G, Piattelli A, Worthington H, Pellegrino G, Esposito M. Vertical ridge augmentation of the atrophic posterior mandible with interpositional bloc grafts: bone from the iliac crest vs. bovine anorganic bone. Clinical and histological results up to one year after loading from a randomized-controlled clinical trial. Clin Oral Implants Res. 2009 Dec;20(12):1386‑93.
17. Haute Autorité de Santé. Révision de catégories homogènes de dispositifs médicaux : Substituts osseux. Saint-Denis La Plaine. 2013. Disponible sur: http://www.has-sante.fr/portail/jcms/c_1225008/fr/evaluation-des-substituts-osseux
18. Chai F, Raoul G, Wiss A, Ferri J, Hildebrand HF. Bone substitutes: classification and concerns. Rev Stomatol Chir Maxillofac. 2011 Sep;112(4):212‑21.
19. Garagiola U, Grigolato R, Soldo R, Bacchini M, Bassi G, Roncucci R, De Nardi S. Computer-aided design/computer-aided manufacturing of hydroxyapatite scaffolds for bone reconstruction in jawbone atrophy: a systematic review and case report. Maxillofac Plast Reconstr Surg. 2016 Dec;38(1):2.
20.Saijo H, Igawa K, Kanno Y, Mori Y, Kondo K, Shimizu K, Suzuki S, Chikazu D, Iino M, Anzai M, Sasaki N, Chung UI, Takato T. Maxillofacial reconstruction using custom-made artificial bones fabricated by inkjet printing technology. J Artif Organs Off J Jpn Soc Artif Organs. 2009;12(3):200‑5.
21. Ben Slama L. Autologous bone grafts, allografts and biomaterials. Rev Stomatol Chir Maxillofac. 2005;106(3):133‑5.
22. Cesarano III J, Dellinger JG, Saavedra MP, Gill DD, Jamison RD, Grosser BA, Sinn-Hanlon JM, Goldwasser MS. Customization of load-bearing hydroxyapatite lattice scaffolds. Int J Appl Ceram Technol. 2005 May;2(3):212‑20.
23. Catros S, Guillemot F, Amédée J, Fricain J-C. Ingénierie tissulaire osseuse en chirurgie buccale et maxillo-faciale : applications cliniques. Med Buccale Chir Buccale. Nov 2010;16(4):227‑37.
24. Ella B, Laurentjoye M, Sedarat C, Coutant J-C, Masson E, Rouas A. mandibular ridge expansion using a horizontal bone-splitting technique and synthetic bone substitute: an alternative to bone block grafting? Int J Oral Maxillofac Implants. 2014 Jan;29(1):135‑40.
41 25. Mangano FG, Zecca PA, van Noort R, Apresyan S, Iezzi G, Piattelli A, Macchi A, Mangano C. Custom-Made Computer-Aided-Design/Computer-Aided-Manufacturing Biphasic Calcium-Phosphate Scaffold for Augmentation of an Atrophic Mandibular Anterior Ridge. Case Rep Dent. 2015;2015:941265.
26. BIOBank. Innovation BIOBank : le greffon osseux sur mesure. [Internet]. Août 2015. Disponible sur : http://www.biobank.fr/fr/pdf/Presentation-greffon-sur-mesure.pdf
27. Schlee M, Rothamel D. Ridge augmentation using customized allogenic bone blocks: proof of concept and histological findings. Implant Dent. 2013 June;22(3):212‑8.
28. Masahiro Nakazawa. Evaluation of HA bone graft fabricated by CAD/CAM based on CT stimulation. J Bio-Integ. 2015;51‑7.
29. Plaud A. Elaboration d’un substitut osseux par prototypage rapide [Thèse d’exercice]. Bordeaux, France. 2015.
30. Hoarau R, Zweifel D, Lanthemann E, Zrounba H, Broome M. 3D planning in maxillofacial surgery. Rev Médicale Suisse. Oct 2014;10(444):1829‑30, 1832‑3.
31. Billiet T, Vandenhaute M, Schelfhout J, Van Vlierberghe S, Dubruel P. A review of trends and limitations in hydrogel-rapid prototyping for tissue engineering. Biomaterials. 2012 Sept;33(26):6020‑41.
32. Madhav VNV, Daule R. Rapid Prototyping and its application in dentistry. J Dent Allied Sci. 2013;2(2):57.
33. Rasperini G, Pilipchuk SP, Flanagan CL, Park CH, Pagni G, Hollister SJ, Giannobile WV. 3D-printed bioresorbable scaffold for periodontal repair. J Dent Res. 2015 Sept;94(9 Suppl):153S‑7S.
34. Jariwala SH, Lewis GS, Bushman ZJ, Adair JH, Donahue HJ. 3D Printing of Personalized Artificial Bone Scaffolds. 3D Print Addit Manuf. 2015 June;2(2):56‑64.
35. Jacotti M. Simplified onlay grafting with a 3-dimensional block technique: a technical note. Int J Oral Maxillofac Implants. 2006 Aug;21(4):635‑9.
36. Cohen A, Laviv A, Berman P, Nashef R, Abu-Tair J. Mandibular reconstruction using stereolithographic 3-dimensional printing modeling technology. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009 Nov;108(5):661‑6.
37. Jacotti M, Wang H-L, Fu J-H, Zamboni G, Bernardello F. Ridge augmentation with mineralized block allografts: clinical and histological evaluation of 8 cases treated with the 3-dimensional block technique. Implant Dent. 2012 Dec;21(6):444‑8.
38. Mirković S, Budak I, Puskar T, Tadić A, Sokac M, Santosi Z, Djurdjević-Mirković T. Application of modern computer-aided technologies in the production of individual bone graft: a case report. Vojnosanit Pregl. 2015 Dec;72(12):1126‑31.