HAL Id: dumas-01873775
https://dumas.ccsd.cnrs.fr/dumas-01873775
Submitted on 13 Sep 2018
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
de terroirs aux potentialités variables et mise en place
d’une parcelle d’étude
Marine Roussel
To cite this version:
Marine Roussel. Sélection clonale privée de Cabernet-Sauvignon à partir de terroirs aux potentialités variables et mise en place d’une parcelle d’étude. Sciences du Vivant [q-bio]. 2017. �dumas-01873775�
MINISTÈRE DE L’AGRICULTURE
MÉMOIRE DE FIN D’ÉTUDES Présenté pour l’obtention du
DIPLOME D’INGÉNIEUR AGRONOME
Option : Viticulture – Œnologie
Par
Marine ROUSSEL
Année de soutenance : 2017
Organisme d’accueil :
33160 Saint Estèphe
Sélection clonale privée de Cabernet-Sauvignon à partir de terroirs
aux potentialités variables et mise en place d’une parcelle d’étude.
1
MINISTÈRE DE L’AGRICULTURE
MÉMOIRE DE FIN D’ÉTUDES Présenté pour l’obtention du
DIPLOME D’INGÉNIEUR AGRONOME
Option : Viticulture – Œnologie
Par
Marine ROUSSEL
Mémoire préparé sous la direction de : Organisme d’accueil :
Jean Michel Boursiquot
33160 Saint Estèphe
Présenté le : 6 novembre 2017 Maître de stage : Vincent Decup
Sélection clonale privée de Cabernet-Sauvignon à partir de terroirs
aux potentialités variables et mise en place d’une parcelle d’étude.
Private clonal selection of Cabernet-Sauvignon from terroirs with
3
Remerciements
Je tiens tout d’abord à remercier Messieurs Martin et Olivier Bouygues, propriétaires du Château Montrose, ainsi que Monsieur Hervé Berland, gérant du Château, pour m’avoir permis de réaliser mon stage de fin d’étude d’ingénieur agronome.
Je remercie sincèrement Monsieur Vincent Decup, maître de chai et maître de stage, pour son encadrement, ses conseils avisés, sa disponibilité même en période d’activité intense au chai mais aussi pour le temps qu’il m’a accordé pour la rédaction de ce mémoire. Tous les conseils que vous m’avez apportés me seront précieux pour ma future carrière professionnelle.
Je remercie Patricia Teynac, chef de culture, pour son encadrement lors de cette étude, le temps qu’elle a su m’accordé et pour m’avoir beaucoup appris sur la gestion d’équipe de viticulteurs et vendangeurs.
Je les remercie tous les deux pour tout ce qu’ils ont pu m’apporter. J’ai beaucoup appris à vos côtés, tant sur la viticulture que sur l’œnologie mais surtout sur la gestion de projet et d’équipe.
Je remercie Paul, assistant chef de culture, qui m’a permis de travailler en sécurité sur le vignoble.
Je remercie l’équipe des vigneronnes et vignerons et plus particulièrement Laurine, Magali, Marie-Christine, Céline, Magalie, Lydia, Chantal et Christina qui m’ont épaulé à tour de rôle toute la saison pour les mesures et observations au vignoble.
Je remercie également les ouvriers du chai qui m’ont très bien accueilli au sein de leur équipe et qui ont su m’apporter leurs conseils techniques. Je remercie Sandrine qui m’a soutenu dans la rédaction du mémoire.
Je remercie le groupe des stagiaires sans qui la vie dans le Médoc serait un peu plus morose. Je remercie Monsieur Jean-Michel Boursiquot, encadrant de ce stage, pour son suivi et les conseils apportés pour cette étude.
Je remercie enfin la formation de Bordeaux Sciences Agro et celle de viticulture-œnologie de Montpellier SupAgro pour la qualité et l’intégralité de leur enseignement, les connaissances que j’ai acquises mais aussi pour les voyages d’étude qui nous ont permis d’échanger avec les professionnels de la filière et de resserrer les liens déjà forts de cette belle formation.
5
Table des matières
Introduction ... 15
Partie 1 : Étude bibliographique ... 17
1. Origine et objectifs de la sélection clonale ... 17
1.1. La diversité intra variétale de la vigne ... 17
1.2. Historique de la sélection clonale ... 19
1.3. Les objectifs de la sélection clonale ... 19
1.2. Méthodologie de la sélection et réglementation ... 29
2. La conservation des ressources génétiques ... 33
2.1. La collection ampélographique du Domaine de Vassal ... 33
2.2. Les conservatoires, collection d’étude et parcelle de comportement... 33
2.3. Vers un retour aux sélections massales et clonales privées ... 33
2.4. La biotechnologie au service de la préservation des ressources génétiques ... 35
3. Etat des lieux de la sélection de Cabernet-Sauvignon ... 35
3.1. Description du Cabernet-Sauvignon ... 35
3.2. Les critères de sélection du Cabernet-Sauvignon ... 37
3.3. Les clones agréés et la collection de Cabernet-Sauvignon ... 37
4. Objectifs de sélection du Château Montrose ... 37
Partie 2 : Matériel et méthodes ... 41
1. Cadre de l’expérimentation ... 41
1.1. Le vignoble du Château Montrose ... 41
1.1.1. Localisation et caractéristiques pédoclimatiques ... 41
1.1.2. Surfaces, encépagement et âge du vignoble ... 43
1.1.3. Système de conduite du vignoble ... 43
1.2. Dispositif expérimental... 43
1.2.1. Une diversité parcellaire ... 43
1.2.2. Nombre de pieds en sélection ... 47
1.1.1. Création de groupes d’étude ... 47
1.1. Climatologie du millésime 2017 ... 49
2. Etat sanitaire ... 49
3. Caractérisation du potentiel agronomique ... 49
3.1. Analyse de la précocité via l’évaluation des stades phénologiques ... 49
3.2. Composante du rendement et morphologie des grappes ... 53
7
4.1. Analyse de la maturité phénolique et technologique ... 55
4.2. Teneur en IBMP ... 57
5. Traitement des résultats ... 57
6. Mise en place de la parcelle d’étude ... 57
Partie 3 : Résultats et discussions ... 61
1. Etude de la climatologie des millésimes 2016 et 2017 ... 61
1.1. Caractéristiques du millésime 2017 ... 61
1.2. Comparaison avec le millésime 2016 ... 61
2. Création de groupes d’étude par la caractérisation de l’environnement des parcelles en sélection ... 61
3. Etat sanitaire des pieds en sélection ... 63
4. Caractéristiques agronomiques des pieds et des groupes d’étude ... 63
4.1. Observation et évolution du nombre de pieds étudiés ... 63
4.2. Analyse des stades phénologiques ... 63
4.3. Composantes du rendement et morphologie des grappes ... 65
5. Caractéristiques œnologiques des pieds et des groupes d’étude ... 67
5.1. Maturité phénolique et technologique ... 67
5.2. Dosage de l’IBMP ... 69
6. Sélection des pieds ... 69
7. Mise en place de la collection d’étude ... 75
8. Discussions et perspectives ... 77 Conclusion ... 81 Bibliographie ... 83 Annexes ... 91 Résumé ... 160 Abstract ... 160
9
Table des figures
Figure 1: Symptômes du court-noué à la parcelle (Claverie, 2017) ... 22
Figure 2: Symptômes du court noué sur rameaux (à gauche) et sur l'ensemble de la plante (à droite) (Source IFV et Réussir Vigne) ... 22
Figure 3: Symptômes de l'enroulement sur Pinot meunier (Fuchs, 2010) ... 22
Figure 4: Symptômes de l'eutypiose (Source IFV, Larignon, 2016) ... 24
Figure 5: Symptômes de l'esca sur le bois à gauche et sur feuille de Cabernet-Sauvignon à droite (Larignon, 2016) ... 26
Figure 6: Symptômes du BDA sur bois à gauche et sur feuilles de Cabernet-Sauvignon à droite (Larignon, 2016) ... 26
Figure 7: Schéma de la sélection clonale (Source IFV) ... 30
Figure 8: Caractéristiques ampélographiques du Cabernet-Sauvignon : à gauche le bourgeonnement, au milieu la feuille adulte, à droite la grappe (Source Plantgrape) ... 34
Figure 9: Cartographie du vignoble du Médoc (Source : Les vins de Bordeaux) ... 40
Figure 10: Coupé géologique du vignoble du Château Montrose (Becheler, 2007) ... 40
Figure 13: Carte pédologique du vignoble de Montrose et nom des parcelles en sélection (légende de la carte en dessous) ... 44
Figure 14: Photos de bourgeons au stade 7 (© Marine Roussel) ... 48
Figure 15 : Échelle de compacité (Pestourie, 2014) ... 54
Figure 16: Carte des sols de la parcelle 45 (Becheler Conseils) ... 58
Figure 17: A gauche X.index, à droite X.diversicaudatum (Source : Vitinnov) ... 58
Figure 18: Graphique des précipitations et températures du millésime 2017 et 2016 ... 60
Figure 19: Représentation graphique du rayonnement et de l'insolation du millésime 2017 .. 60
Figure 20: Représentation graphique de l'évolution du suivi de véraison de la parcelle 48H . 64 Figure 21: Cercle de corrélation des variables (à droite) et graphe des individus (à gauche) du groupe d'étude 1 ... 68
Figure 22: Cercle de corrélation des variables (à gauche) et graphe des individus (à droite) de la parcelle 48 du groupe d'étude 2 ... 70
Figure 23: Cercle de corrélation des variables (à gauche) et graphe des individus (à droite) de la parcelle 49B du groupe d'étude 2 ... 70
Figure 24: Cercle de corrélation (à gauche) et graphe des individus (à droite) du groupe d'étude 3 ... 71
Figure 25: Cercle de corrélation (à gauche) et graphe des individus (à droite) du groupe d'étude 4 ... 72
Figure 26: Cercle de corrélation (à gauche) et graphe des individus (à droite) du groupe 5 ... 72
Figure 27: Cercle de corrélation (à gauche) et graphe des individus (à droite) du groupe d'étude 6 ... 73
Figure 28: Cercle de corrélation (à gauche) et graphe des individus (à droite) du groupe d'étude 7 ... 74
Figure 29: Proposition de plantation de la parcelle d'étude en 5 blocs de 20 souches par clone ... 76
Figure 30: Multiplication des bois de taille et plantation en pot d'un des 11 pieds sélectionnés en 2016 ... 78
11
Table des tables
Tableau 1: Résumé des principales maladies à virus et leurs vecteurs responsables ... 20
Tableau 2: Liste des parcelles en sélection (M : Montrose, FP : Fond Petite, TL : Tronquoy-Lalande) ... 42
Tableau 3: Bilan des différentes prospections et nombre de pieds à suivre en 2017 sur chaque parcelle ... 46
Tableau 4 : Évolution du nombre de pieds suivis ... 62
Tableau 5 : Résultats du test de Kruskal-Wallis ... 64
Tableau 6: Moyennes des caractéristiques agronomiques des groupes d'étude ... 66
Tableau 7: Moyennes des caractéristiques œnologiques des groupes d'étude ... 68
13
Liste des abréviations
ACP : Analyse en Composantes Principales AM : Acide Malique, exprimée en g/L
ApH1 et ApH3.2 : Anthocyanes à pH1 et pH3.2 ArMV : Arabis Mosaic Virus, virus du court noué AT : Acidité Totale, exprimée en g/L
BDA : Black Dead Arm
CAH : Classification Ascendante Hiérarchique CEC : Capacité d’échanges cationique
CTPS : Comité Technique Permanent de la sélection ELISA : Enzyme Linked Immuno Sorbent Assay
ENTAV : Établissement National Technique pour l’Amélioration de la Viticulture FP : Fond Petite
GFLV : Grapevine FanLeaf Virus, virus du court noué GLRV : Grapevine LeafRoll Virus, virus de l’enroulement IBMP : 3-isobutyl-2-méthoxypyrazine
IFV : Institut Français de la Vigne et du Vin Ipcy : Indice de précocité de cycle
Ipf : Indice de précocité de floraison Ipv : Indice de précocité de véraison M : Montrose
MP : Maturité des pépins, exprimée en % PAE : Pourcentage d’Anthocyanes Extractibles RNED : Réseau National d’Essai et de Démonstration
RT-PCR : Reverse Transcriptase Polymerase Chain Reaction UC : Unité Cartographique
TL : Tronquoy-Lalande 18 S : Parcelle 18 Sable
48H et 49H: 48 Haut et 49 Haut 49B et 51B : 49 Bas et 51 Bas
15
Introduction
La préservation du patrimoine génétique de la vigne est primordiale aujourd’hui au vu de l’utilisation des clones du commerce qui réduit les ressources génétiques. Sélectionnés et agréés, ces clones répondent aux attentes des viticulteurs que sont l’utilisation de plants sains avec des caractéristiques agronomiques diverses.
Le Château Montrose, Second Cru Classé de 1855 situé sur l’appellation Saint Estèphe, s’est lancé dans une démarche de durabilité depuis le rachat de la propriété en 2006 par Martin et Olivier Bouygues. « Le passé mérite un grand respect » dit Martin Bouygues et la rénovation du Château s’est fait sous ce credo mais aussi avec un regard sur l’avenir via ces différents axes : continuer à valoriser le terroir avec des équipements viti-vinicoles plus modernes et respectueux de l’environnement, diminuer l’empreinte carbone et la consommation d’énergies avec la mise en place de panneaux photovoltaïques et un système de géothermie, conserver l’architecture dans le style typique de la région bordelaise. Le maintien de la biodiversité du Château Montrose fait également partie de cette démarche de durabilité et la sélection clonale est au cœur de cette problématique.
Le vignoble du Château Montrose est réparti sur 95 hectares d’un seul tenant et son encépagement est typique du Médoc avec une dominante de Cabernet-Sauvignon (55%) et de Merlot (38%). Le vignoble âgé du Château Montrose est en cours de restructuration et il est important de conserver le patrimoine de la propriété qui fait la qualité des vins de Montrose, comme le souligne Hervé Berland, gérant du Château : « Un des éléments de qualité, c’est la présence de vieilles vignes de Cabernet-Sauvignon. Dans les supers-terroirs comme Montrose, c’est le Cabernet-Sauvignon qui atteint des sommets de complexité ». Ces vieilles parcelles de Cabernet-Sauvignon sont très qualitatives et produisent chaque année le grand vin. Vieilles de plus de 60 ans, ces parcelles disposent d’une ressource génétique très variée. Cependant elles sont amenées à disparaître du fait de l’important taux de mortalité des pieds et du faible potentiel de production.
Les premières prospections, effectuées par Monsieur Jean Cordeau, débutèrent sur les parcelles 52, 54 et 55 ; en 2012, la parcelle 53 avait été replantée en partie avec des pieds de Cabernet-Sauvignon issus de ces sélections massales. Le Château Montrose est aujourd’hui lancé dans une démarche de sélection clonale privée. Tout d’abord, en 2016, les pieds marqués par Monsieur Cordeau ont été soumis à des tests sanitaires puis suivis : 11 ont été retenus comme ayant un fort ou très fort potentiel. Une deuxième prospection a été effectuée à la fin de l’été 2016 sur le reste des parcelles datant d’avant 1960 : environ 1200 pieds ont été marqués. L’étude est menée sur les pieds retenus de la première prospection et sur l’ensemble des pieds de la deuxième prospection. Onze parcelles sont en sélection à ce jour et l’étude s’interroge sur la sélection des vignes mères par groupe d’étude de parcelles aux terroirs homogènes. Les parcelles ont en effet des terroirs distincts et sont réparties sur trois zones : le Château Montrose, le secteur dit de Fond Petite (racheté à une autre propriété) et le Château Tronquoy-Lalande, également propriété de Messieurs Bouygues. Les groupes d’étude seront créés tout d’abord en fonction des terroirs puis du suivi des stades phénologiques, et la sélection des pieds s’effectuera par groupe d’étude, la finalité de la sélection devant aboutir à 18 clones qui seront ensuite multipliés dans une parcelle d’étude.
Ce mémoire se divise en trois parties. La première partie comporte l’étude bibliographique sur les différentes recherches effectuées sur la sélection clonale. La deuxième partie vise à expliquer le cadre de l’étude et les différents protocoles menés pour cette étude. Enfin, la dernière partie de ce mémoire comportera les résultats et les discussions.
17
Partie 1 : Étude bibliographique
1. Origine et objectifs de la sélection clonale 1.1. La diversité intra variétale de la vigne
La vigne fait partie de la famille des Vitaceae qui comporte 17 genres, dont le genre Vitis. Le genre Vitis est divisé en deux sous-genres : Euvitis et Muscadinia, différenciés par leurs caractéristiques ampélographiques et génétiques. Muscadinia comprend deux espèces, Euvitis en comprend une soixantaine dont Vitis vinifera L (Huglin & Schneider, 1998).
À chaque reproduction sexuée, une nouvelle variété de vigne est créée. En 2015, le Catalogue français répertorie 377 variétés, plus de 1200 clones et 31 porte-greffes (Audeguin, 2015). La diversité inter-variétale est ainsi très importante.
Pour maintenir les caractéristiques et la typicité d’un cépage dans le temps, la vigne est multipliée par voie végétative ou asexuée. Après la crise phylloxérique, le marcottage et le bouturage ont été abandonnés laissant place au greffage (Carrier, 2011).
Au sein d’une même variété de vigne, les individus peuvent présenter des caractéristiques ampélographiques, agronomiques et organoleptiques différentes. Cette diversité intra-variétale est tout de même moins importante que la variabilité inter-variétale (Boursiquot, 2007). Elle augmente avec l’âge du vignoble et chez les variétés cultivées depuis de nombreuses années (Aurand, 2017). Le degré de diversité intra variétale varie en fonction du cépage (van Leeuwen, 2013).
Plusieurs hypothèses peuvent expliquer cette hétérogénéité :
L’infection par des maladies à virus telles que le court noué et l’enroulement L’accumulation de mutations
Walter et Antcliff en 1980 ont étudié l’origine sanitaire du polymorphisme de la vigne et ont montré que les variations dues au virus ne sont pas héréditaires et que seules les mutations somatiques sont transmissibles à la descendance (Carrier, 2011).
Les cycles successifs de multiplication végétative ont induit une accumulation de mutations, principale cause du polymorphisme de la vigne. Ces mutations sont en général silencieuses mais elles sont parfois non silencieuses et peuvent alors affecter le phénotype.
La variabilité interclonale peut être due à la présence ou disparition des caractères juvéniles, comme par exemple la forme et la couleur des jeunes feuilles. Ces mutations somatiques peuvent être propagées à une partie de l’organe ou à l‘organe entier. Si la mutation apparait dans l’ensemble des cellules initiales d’un bourgeon et que celui-ci est utilisé pour produire un nouveau plant, alors il pourra donner naissance à un nouveau clone.
Les mutations somatiques sont d’origine génétiques ou épigénétiques. Si elles sont d’origine génétiques, des variations dans la séquence de l’ADN sont observées, si elles sont épigénétiques, la structure de l’ADN est modifiée (Carrier, 2011). D’autres facteurs, épigénétiques notamment, peuvent être également à l’origine du polymorphisme clonal de la vigne (Yobrégat, 2011).
19
C’est cette variabilité intra variétale qui entraîna la sélection clonale ayant pour objectif primaire de sélectionner des phénotypes de variétés de vigne conformes aux demandes des producteurs. L’OIV définit un clone comme étant « une descendance végétative d’un plant de vigne unique. Aux fins de la sélection, ce plant unique est choisi pour son identité variétale, ses traits phénotypiques et son état sanitaire ». Une grande diversité de clones est présente en France, dont 1200 sont agréés (Yobrégat, 2011).
Les caractéristiques des clones varient en fonction des conditions de l’environnement (van Leeuwen R. A.-V., 2013). Ces interactions clone x environnement ont été étudiées. Mannini, en 2010, étudia les clones de Nebbiolo sur différents terroirs en Italie et montra que le clone 142 avait un meilleur profil sur un terroir mais pas sur l’autre. Barbeau, en 1999, étudia le Chenin, en Val de Loire, sur deux conservatoires. Il nota des différences entre clones notamment concernant la composition des baies. L’interaction clone x environnement influerait sur cette caractéristique par la précocité et l’alimentation en eau. Aussi, les différences de comportement du clone sur les terroirs suivant les années indiquent une plus ou moins bonne adaptation du clone au terroir où il est planté (Barbeau, 1999).
1.2. Historique de la sélection clonale
Au vu de ces différences intra variétales, les viticulteurs commencèrent par sélectionner des pieds répondants à leurs objectifs de production et exempts de symptômes de maladies à virus et à les multiplier par marcottage, bouturage ou greffage. Cette sélection, dite massale, se base seulement sur des observations visuelles et le risque de transmission de maladies à virus est élevé (Reynier, 2005).
Les premières études sur la problématique du court noué datent d’avant 1939 et aboutissent à la création en 1944 de la « Section de Sélection et de Contrôle des Bois et Plants de Vigne » sous la responsabilité du professeur Jean Bramas de l’Ecole d’Agriculture de Montpellier (Montpellier SupAgro aujourd’hui). S’en suit la mise en place du Domaine de Vassal en 1950, situé sur des sables du littoral, exempts de nématodes vecteur du virus du court-noué et indemnes de phylloxera. L’emplacement de ce domaine permet la culture de la vigne « franche de pieds » et ainsi de créer une collection ampélographique saine.
L’ANTAV (Association Nationale technique pour l’Amélioration de la viticulture) est ensuite créée (1962), en même temps que les premières serres d’indexage, puis deviendra l’ENTAV en 1986 (Etablissement National Technique pour l’Amélioration de la Viticulture). La fusion de l’ENTAV et de l’ITV (Institut Technique de la Vigne et du Vin) a donné l’IFV (Institut Français de la Vigne et du Vin) qui dispose aujourd’hui d’un pôle dédié au matériel végétal.
La sélection sanitaire, au départ basée sur des critères de reconnaissance visuelle des symptômes de maladies à virus, fût renforcée par les techniques de détection : l’indexage et les tests sérologiques (type ELISA). Divers travaux ont ensuite été menés afin de mettre en place une méthodologie rigoureuse de sélection agronomique : Huglin, en 1960, sur les variétés alsaciennes, puis l’INRA de Bordeaux. (Yobrégat, 2011).
1.3. Les objectifs de la sélection clonale 1.3.1. Une sélection sanitaire
La propagation des maladies à virus au sein du vignoble français est due en partie à la circulation intensive du matériel végétal lors de la reconstitution du vignoble après la crise du phylloxera (1865-1895) (Huglin G. V., 1980).
Tableau 1: Résumé des principales maladies à virus et leurs vecteurs responsables
Maladies virales Virus responsables Vecteur Sérologie Grapevine FanLeaf
Virus GFLV
Arabis Mosaic Virus ArMV
Enroulement Grapevine LeafRoll associated Virus Cochenilles : -Phenacoccus aceris -Heliococcus bohemicus -Parthenolecanium corni -Pulvinaria vitis GLRaV 1-3
Marbrure Grapevine Fleck Virus
Sur Vitis rupestris Pas de vecteur connu
GFkV Complexe du bois strié Grapevine virus A, B et D Grapevine rupestris stem pitting associated
virus
GVA, GVB, GVD, GRSPaV
21
Les travaux de Wagner et Antcliff (1980) montrèrent l’existence d’une variabilité due à l’infection par les viroses : les pieds virosés présentent des rendements plus faibles et la qualité des raisins est également touchée. (Carrier, 2011) Aucun traitement curatif des maladies à virus n’est possible, ce qui implique une sélection sanitaire irréprochable avant multiplication des plants.
1.3.1.1. Description des virus dangereux pour le vignoble
Les principales maladies à virus recherchées sont le court-noué et l’enroulement pour les cépages, et la marbrure pour les porte-greffes. La maladie secondaire recherchée est celle du complexe du bois strié ; les tests positifs à cette maladie n’engendrent pas une élimination obligatoire de la souche à l’inverse des principales maladies à virus. Les maladies à phytoplasmes à suivre sont la flavescence dorée et le bois noir. Le tableau 1 résume les différentes maladies à surveiller. Seules les principales maladies à virus sont détaillées ci-après.
Le court noué ou dégénérescence infectieuse
La virose du court noué est une maladie endémique touchant 60% du vignoble français. Cette maladie est due à deux types de virus (népovirus) transmis par greffage de matériel végétal virosé ou par les nématodes du sol:
Principalement due au Grapevine Fanleaf Virus GFLV, transmis par le nématode Xiphinema index.
Moins souvent due à l’Arabis Mosaïc Virus ArMV, transmis par le nématode Xiphinema diversicaudatum.
Les nématodes, par alimentation au niveau des racines de la vigne, acquièrent et transmettent le virus à la plante (Lemaire, 2013).
Les symptômes du court noué apparaissent par tâches sur la parcelle, le nématode piquant les racines des ceps voisins, comme la figure 1 l’illustre. La maladie s’étend relativement lentement, les nématodes se déplaçant d’1,50 m par an (Balue, 2013).
Le court-noué se caractérise à plusieurs niveaux, comme la figure 2 le montre : Sur le cep, par un affaiblissement de la souche pouvant conduire à sa mort.
Sur les rameaux, par des fasciations, des entre-nœuds courts, une croissance en « zigzag », des divisions du rameau.
Sur les feuilles par des panachures, des déformations ou des troubles de la nervation. Et enfin sur les grappes, par des symptômes de coulure ou millerandage entraînant des
différences de maturité, une diminution de la production et de la qualité (baisse du taux de sucre et de l’acidité).
Le diagnostic visuel de la maladie est à prendre avec précaution, les signaux pouvant être physiologiques ou confondus avec des phytotoxicités ou la chlorose ferrique (Cordeau, 1998). Des tests sanitaires sont donc nécessaires afin de confirmer la présence de la maladie. Le virus met un certain temps à se propager dans la plante entière ; il se peut donc que les tests sur la partie aérienne soient négatifs alors que le virus a été inoculé dans les racines (Bouquet & Danglot, 1983).
Figure 1: Symptômes du court-noué à la parcelle (Claverie, 2017)
Figure 2: Symptômes du court noué sur rameaux (à gauche) et sur l'ensemble de la plante (à droite) (Source IFV et Réussir Vigne)
Figure 3: Symptômes de l'enroulement sur Pinot meunier (Fuchs, 2010)
23
La virose du court noué a un fort impact économique sur le vignoble : la durée de production d’un vignoble infecté par le GFLV peut passer de 30-40 ans à 15-20 ans (Andret-Link, 2004). La perte économique est estimée entre 350 et 850 millions d’euros par an en France (Lemaire, 2013). La lutte contre cette virose est donc extrêmement importante. La diffusion d’un matériel végétal sain est ainsi primordiale.
Aucun moyen de lutte curative n’existe contre les nématodes du sol. Avant l’arrachage de la parcelle, une dévitalisation est réalisée, soit au glyphosate soit au trichlopyr, si le cahier des charges de l’appellation le permet. L’arrachage de la parcelle est effectué 4 mois après dévitalisation (Blanc, 2009). Enlever le maximum de racines présentes sur la parcelle est nécessaire, au cas où elles soient contaminées par les nématodes. Une période de repos du sol est obligatoire, l’idéal est de le laisser en repos un minimum de 7 ans. En effet, il a été observé que les nématodes peuvent survivre jusqu’à quatre ans après l’arrachage (Balue, 2013). Des essais sont actuellement en cours sur des plantes dites « nématicides » qui permettraient de diminuer sensiblement le temps de repos du sol (Laveau, 2013).
L’usage de porte-greffe résistant au court-noué semble être une piste prometteuse dans la lutte contre la maladie. La résistance aux nématodes de Vitis muscadinia a été démontrée grâce à divers travaux, notamment ceux de Boubals et Pistre (1978) (Bouquet & Danglot, 1983). Le porte-greffe Nemadex Alain Bouquet a été obtenu grâce aux travaux de l’INRA et l’ANTAV par croisement entre un hybride de Vitis vinifera, résistant au phylloxera, et de Vitis muscadinia, résistant aux nématodes, et le 140 Rugieri (Blanc, 2009). Cependant, des essais de ce porte-greffe sur des sols contaminés ont révélé une recontamination des pieds après deux ans. Aussi, le Nemadex AB confère une faible vigueur, est sensible à la sécheresse et ne s’accommode pas sur des sols calcaires. Son utilisation est intéressante pour des sols peu contaminés, avec un faible indice de pouvoir chlorosant et un régime hydrique non contraignant (Viguès, 2013).
L’enroulement
La virose de l’enroulement est une des viroses les plus répandues en France et dans le monde et a des conséquences sur le rendement et la qualité des raisins. Les vignobles septentrionaux français sont face à une sérieuse problématique.
Elle est due aux Grapevine LeafRoll associated Virus (GLRaV), virus de la famille des Closteroviridae. Huit espèces ont été identifiées mais le vignoble français est concerné seulement par trois espèces : GLRaV-1, -2 et -3. Le GLRav-2, à la différence des autres espèces d’enroulement, est transmis par inoculation mécanique sur plante herbacée (Nictoana benthamiana) (Maguet, 2012).
Les symptômes de la maladie se caractérisent par un enroulement du limbe vers l’intérieur de la feuille ainsi que par l’apparition de pigmentations. L’enroulement sur cépages rouges se manifeste par un rougissement du limbe, sur cépages blancs par un jaunissement ; les nervures des feuilles restent vertes (Fuchs, 2010). La figure 3 illustre les symptômes.
Ces colorations sont dues à un bouleversement du métabolisme des sucres : ils ne sont plus distribués à l’ensemble du végétal mais s’accumulent dans les feuilles. S’en suit une diminution du nombre de grappes, du rendement (les grappes sont plus « chétives ») et de la qualité des raisins. En effet, la maturité est retardée, les raisins sont plus acides et moins sucrés (Cordeau, 1998). L’enroulement ne conduit pas à la mort du cep mais a un fort impact économique sur le long terme (Fuchs, 2010).
25
La transmission du virus de l’enroulement se fait soit par multiplication de matériel végétal virosé soit par des insectes de l’ordre des hémiptères, les cochenilles. Deux espèces de cochenilles ont été recensées en Aquitaine : la cochenille du Cornouiller, Parthenolecanium corni et la cochenille floconneuse de l’érable, Neopulvinaria innumerabilis. Les cochenilles sont des insectes dits « piqueurs-suceurs », en se nourrissant de la sève des plantes, elles peuvent diffuser le virus de l’enroulement à la souche : le type 1 pour P.corni et le type 3 pour N.innumerabilis.
Des parasites de ces insectes existent et sont un moyen de lutter contre ces ravageurs : 25% de parasitisme a été observé en Gironde. Parmi ces prédateurs, araignées, chrysopes, coccinelles peuvent être cités. La lutte chimique, via des insecticides, est à raisonner en fonction de l’ampleur des dégâts au vignoble. La lutte alternative est nettement plus recommandée, comme le brûlage des bois de taille, le balayage des sarments au moment du pliage ou l’application d’huile qui empêche aux cochenilles de s’accrocher (Lasserre, 2014).
1.1.1.1. Vers de nouveaux critères de sélection sanitaire
La sélection sanitaire d’origine, concernant les maladies à virus et phytoplasmes, est aujourd’hui jugée incomplète. En effet, celle-ci ne prend pas en compte la sensibilité aux maladies cryptogamiques et aux maladies du bois. Ces maladies ont un fort impact économique et les viticulteurs sont en demande de pieds plus résistants. Les sélections clonales commencent donc à intégrer la tolérance à ces maladies dans les critères de sélection. Les pieds présentant des symptômes sont écartés (Roby, 2006). Cependant, des pieds ne présentant pas de symptômes peuvent tout de même être contaminés par les champignons responsables de ces maladies (Cordeau : communication personnelle ; Roby, 2006).
Aussi, les maladies du bois se manifestent sur des vignes âgées de plus de huit ans ; la prospection des vignes mères se faisant sur des parcelles âgées d’avant 1960, la probabilité de contamination par ces maladies est plus importante et il est donc primordial de « sauver » la diversité génétique des vieilles parcelles.
Les maladies du bois
Plusieurs maladies affectent le bois de la vigne : l’eutypiose, l’esca et le black dead arm (BDA). Elles sont associées à des champignons qui contaminent le cep généralement par les plaies de taille, lorsque celle-ci est effectuée par temps doux et pluvieux. L’humidité printanière favorise ensuite le développement du champignon (Carbonneau, 2015).
Ces maladies causent à plus ou moins long terme la mort du cep. Elles constituent donc un coût économique non négligeable pour le viticulteur ; qui plus est, les méthodes de lutte contre ces maladies sont toujours en recherche (Fontaine, 2014).
L’eutypiose
L’eutypiose est causée par le champignon Eutypia lata. Les symptômes sont facilement identifiables dès le stade 6-8 feuilles : rabougrissement des rameaux, entre-nœuds courts et réguliers, feuilles petites et resserrées. Des signaux de la maladie sont également visibles dans le bois par une nécrose dure de couleur brune en position sectorielle. La figure 4 montre les symptômes de la maladie.
Figure 5: Symptômes de l'esca sur le bois à gauche et sur feuille de Cabernet-Sauvignon à droite (Larignon, 2016)
Figure 6: Symptômes du BDA sur bois à gauche et sur feuilles de Cabernet-Sauvignon à droite (Larignon, 2016)
27
L’esca
Cette maladie est causée par un complexe de champignons comportant Phaeoacremonium aleophilum et Phaeomoniella chlamydospora, retrouvés dans le bois dans une nécrose brune et centrale, et Fomitiporia mediterranea, responsable de la pourriture blanche.
L’esca s’exprime sous deux formes : une forme lente et une forme foudroyante ou apoplexique. Les symptômes de la forme lente se manifestent sur feuilles par des « digitations » jaunes chez les cépages blancs, et rouges chez les cépages noirs, les nervures restant vertes. Le bord du limbe se nécrose. Sur grappes, il est possible de constater un flétrissement des baies et des retards de maturité. La forme foudroyante aboutit au dessèchement des rameaux et des fruits en quelques jours. Certains cépages sont plus sensibles que d’autres, notamment le Cabernet-Sauvignon. La figure 5 illustre les symptômes de l’esca.
Le Black Dead Arm
Le BDA est associé à plusieurs espèces de champignons Botryosphaeria. En France, Diplodia seriata et Botryosphaeria dothidea ont été identifiés.
Les symptômes du BDA sont similaires à ceux de l’Esca et la confusion est souvent faite entre les deux maladies. Des recherches ont montré que les symptômes du BDA sur feuilles seraient les mêmes que les symptômes de l’esca en phase initiale. Sur les cépages rouges, les feuilles présentent des digitations internervaires sans liseré jaune. Les tissus rouges s’éclaircissent et un jaunissement apparait à la périphérie. Aussi, dans le bois, une bande brune est située sous l’écorce (Larignon F. F., 2009).
Sensibilité aux maladies cryptogamiques
La sensibilité des cépages aux maladies cryptogamiques fluctue en fonction des conditions environnementales, de la région viticole mais aussi des techniques culturales (Sensibilité des cépages de vigne aux principales maladies fongiques, 2016).
La création variétale fait aujourd’hui son retour pour proposer aux producteurs des cépages résistants aux maladies cryptogamiques : la connaissance du génome a en effet permis l’identification de gènes de résistances, notamment au mildiou (Rousseau, 2013).
Concernant la sélection clonale, il est difficile de trouver des pieds plus résistants à l’oïdium ou au mildiou. En revanche, la morphologie de la grappe et notamment sa compacité permet de sélectionner des pieds moins sensibles au Botrytis cinerea (Pestourie, 2014). Ce champignon est responsable de la pourriture grise qui affecte à la fois le rendement et la qualité des vins. Les symptômes sur feuilles se repèrent par des tâches nécrotiques brunes en bord de limbe. Sur les inflorescences, le champignon s’installe et entraîne un desséchement ; sur les grappes, la pourriture se développe sur les blessures de la baie ou sur la baie entière.
La maladie progresse rapidement et est favorisée par un climat pluvieux. Le Cabernet-Sauvignon est peu sensible à Botrytis cinerea, mais il est important dans la sélection de choisir des pieds avec des grappes lâches, le climat bordelais étant propice au développement du champignon (Davidou, 2015).
29 1.3.2. Une sélection agronomique
La sélection massale d’origine se basait sur des critères visuels en choisissant les pieds les plus productifs. Dans les années 80, la surproduction de vin a fait prendre conscience de l’importance de choisir des pieds de qualité avant tout (Huglin G. V., 1980).
La sélection agronomique a été mise en place au fur et à mesure des études, notamment après celles de Huglin et de l’INRA de Bordeaux. Plusieurs caractères d’intérêt sont mesurés comme les composantes du rendement (taille et nombre de grappes, taille des baies, fertilité…), la vigueur, la précocité de la souche, le port de la plante, la coulure, la sensibilité au Botrytis cinerea mais encore les composantes œnologiques (Yobrégat, 2011).
D’autres caractères peuvent présenter une variabilité au sein d’un même cépage comme les différences ampélographiques, mais la difficulté est de voir et de vérifier si elles sont stables dans la descendance. En effet, ces différences peuvent être liées à des caractères juvéniles (épigénétiques), ou bien à des interactions génotype - milieu ou génotype - historique de la souche. Si elles sont stables, ce critère pourra alors être utilisé (Boursiquot, communication personnelle).
Le bilan de 10 ans de travail sur l’exploitation du protocole du Réseau National d’Essai et de Démonstration (RNED) a permis de mettre en évidence quatre classes de potentiel de production pour tous les clones :
Groupe A : les clones à faible potentiel de production, qualitatif, produisant des vins typiques du cépage et de terroir. Les clones de ce groupe pourraient être qualifiés de très fort potentiel.
Groupe B : les clones à production moyenne à élevée, élaborant des vins de terroir également, suivant les conditions du milieu. Ce groupe pourrait être nommé groupe de clones à fort potentiel.
Groupe C : les clones ayant une production élevée, et donc produisant des vins peu qualitatifs si la culture est mal maîtrisée.
Groupe D : les clones à production irrégulière ; ces clones sont recommandés seulement dans des endroits où ils ont été jugés satisfaisants (Audeguin B. B., 2000).
La régularité de cette sélection, dite aussi génétique, doit être vérifiée dans le temps. Un minimum de trois ans de suivi est requis avant demande d’agrément de la souche.
1.2. Méthodologie de la sélection et réglementation
1.2.1. Évolution des protocoles de sélection et schéma définitif de la sélection clonale
Au début de la sélection, les critères se basaient sur l’absence de viroses et sur des objectifs de production corrects. Les pieds répondant à ces caractéristiques étaient ensuite multipliés en pépinière puis distribués aux viticulteurs. Ces premiers clones agréés peuvent être qualifiés de « standard ».
La volonté de caractériser au mieux les clones a abouti à la création du protocole du RNED en 1987, comportant les étapes suivantes :
« Pré-sélection au vignoble ou dans des conservatoires de clones ;
Installation des clones en cours de sélection sanitaire à l’ENTAV et dans des collections d’étude de la région d’origine de la variété considérée ;
31
Agrément des clones les plus intéressants ;
Mise en place de parcelles de comportement dans différentes régions viticoles pour étudier de façon plus approfondie les clones agréés» (Lacombe, 2004)
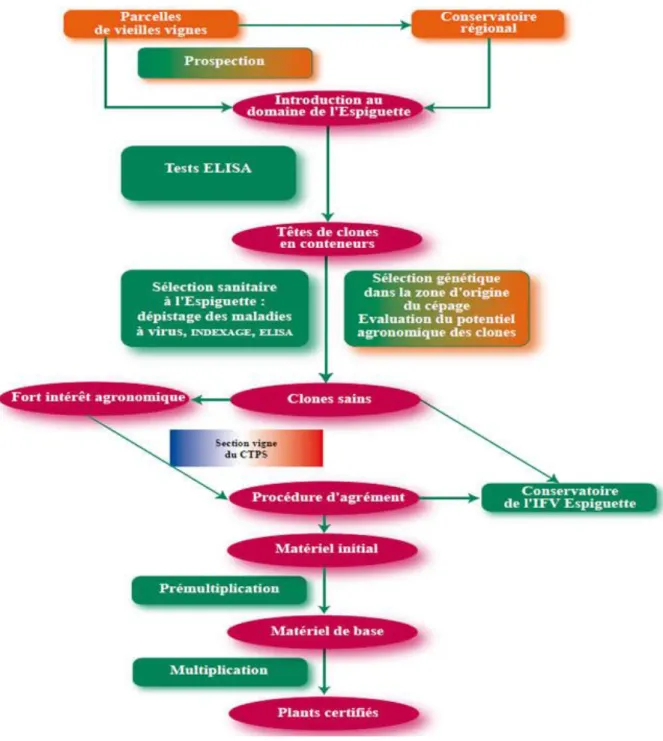
Ce protocole plutôt succinct a été remplacé par celui du Comité Technique Permanent de Sélection (CTPS) en 1998. Il contient les différentes étapes à suivre de la sélection jusqu’à la dégustation des vins issus de chaque clone. Ce protocole a ensuite été mis à jour en 2013 et suit le schéma de la figure 7.
1.2.2. Les différentes étapes de la sélection
La première étape de sélection est la prospection des vignes datant d’avant 1960, date où commença la sélection clonale, ou des conservatoires régionaux.
L’observation des pieds mère est donc, dans un premier temps, visuelle : absence de symptômes de viroses ou maladies à phytoplasmes, absence de coulure ou millerandage, morphologie du pied, composantes du rendement, etc… Le nombre de parcelles prospectées doit être le plus grand possible pour avoir le plus de diversité (Boursiquot, communication personnelle ; Lacombe, 2004). Le nombre de pieds retenus doit également être important puisqu’il diminue considérablement après les tests sanitaires.
Ces pieds sont observés pendant trois années consécutives avant que des tests sanitaires soient effectuées.
Ces tests sanitaires sont l’indexage et/ou des tests ELISA (Enzyme Linked Immuno Sorbent Assay) (Walter, 1998) :
La méthode de référence est l’indexage. Cette méthode est basée sur un diagnostic biologique. La présence ou non du virus sur le potentiel clone est vérifiée en greffant ce clone sur une variété « indicatrice ». Cette dernière exprimera les symptômes de la maladie si le virus est présent. Deux types de greffage peuvent se faire : ligneux, mais les résultats sont visibles au bout de trois ans, ou herbacé (résultats après 6 mois). Certaines viroses ne sont détectables que par cette méthode.
Les méthodes complémentaires sont des tests de dépistage : tests ELISA et/ou tests RT-PCR. Le test ELISA est un test immuno-enzymatique basé sur la réaction anticorps – antigène et permet de détecter la dégénérescence infectieuse, l’enroulement, la marbrure et le complexe du bois strié. Le test RT-PCR/PCR est basé sur l’amplification spécifique de petits fragments d’ADN ou ARN viral. Il porte sur les mêmes maladies mais peut détecter plus de virus. Le test ELISA est le plus utilisé.
Les meilleurs clones dits « têtes de clones » sont ensuite multipliés sur des parcelles de comportement afin de juger leurs performances agronomiques et œnologiques (voir Annexe I : protocole du CTPS). Afin de comparer au mieux les clones, la parcelle se doit d’être la plus homogène possible, pour éviter les possibles biais liés aux types de sols et terroirs.
Le suivi de leurs performances est réalisé pendant 3 ans au minimum : pour qu’un clone soit agréé, il faut qu’il ait obtenu les meilleures notes sur les trois millésimes. Une fois agréé, le clone est ensuite planté sur le conservatoire de l’Espiguette où il sera multiplié puis commercialisé. L’ensemble des étapes de sélection dure une quinzaine d’années (Roby, 2015).
33 2. La conservation des ressources génétiques
La conservation du patrimoine génétique de la vigne en France est répartie sur trois niveaux. En effet, de nombreux acteurs de la filière entrent en jeu à l’échelle nationale et régionale.
2.1. La collection ampélographique du Domaine de Vassal
Cette collection a été mise en place dès la découverte de la virose du court noué. Les sables du littoral étant exempts de nématodes vecteurs du virus, la création du domaine s’est faite naturellement sur ces terres.
Elle rassemble aujourd’hui plus de 7500 génotypes du monde entier : 2600 variétés de Vitis vinifera
720 variétés d’hybrides 210 porte-greffes
60 espèces de la famille des Vitacées 200 accessions de lambrusques
de très nombreuses obtentions expérimentales comme les nouvelles variétés, hybrides producteurs etc.
Cette collection, unique au monde, est une ressource de diversité génétique de par la possession de variétés rares ou disparues. Elle sert également de référence en termes d’identification ampélographique (Yobrégat, 2011).
2.2. Les conservatoires, collection d’étude et parcelle de comportement
Il existe un conservatoire national et plusieurs conservatoires régionaux. Le conservatoire national est basé au Domaine de L’Espiguette (30) et est le centre de sélection de l’IFV. Plusieurs missions lui sont accordées dont la réalisation de la sélection sanitaire, le maintien des clones agréés, l’aide aux travaux de sélection régionaux, etc. (Yobrégat, 2011).
Les conservatoires régionaux contribuent également au maintien de la diversité génétique. 130 variétés bénéficient d’un conservatoire, grâce au travail de nombreux acteurs dont 19 Chambres d’Agriculture et 3 interprofessions, réunis autour de l’INRA et l’IFV. Ils sont complémentaires aux travaux de sélection du conservatoire national. De nombreuses études sont menées chaque année pour continuer d’agréer des clones, de conserver la diversité génétique (Yobregat, 2016).
2.3. Vers un retour aux sélections massales et clonales privées
Les conservatoires régionaux et nationaux sont de véritables ressources génétiques mais ne sont pas suffisants pour maintenir la diversité génétique de la vigne, et sont également sujets à des risques climatiques, à des restrictions de budget, etc. La collection ampélographique du Domaine de Vassal est d’ailleurs actuellement menacée par les conséquences du changement climatique ; elle risque en effet d’être submergée par les eaux (Roby, 2015).
La sélection massale serait un moyen d’augmenter cette diversité génétique. Cette technique de sélection se base sur des observations visuelles de vieux pieds sur trois ans; ne sont gardés que les pieds ne présentant aucun symptôme de virus ou maladies du bois, de coulure ou millerandage et les pieds répondant aux critères de production du viticulteur. La sélection massale a souvent été décriée de par l’absence de vérification sanitaire. Aujourd’hui, ces sélections sont beaucoup plus suivies et les conseillers incitent les viticulteurs à effectuer des tests sanitaires.
Figure 8: Caractéristiques ampélographiques du Cabernet-Sauvignon : à gauche le bourgeonnement, au milieu la feuille adulte, à droite la grappe (Source Plantgrape)
35
Un autre moyen de préserver la diversité génétique est la sélection clonale privée. Plus coûteuse et plus longue qu’une simple sélection massale, elle est néanmoins plus robuste. Les pieds mères sont suivis sur 3 ans et sont ensuite multipliés et plantés sur une collection d’étude qui servira à étudier plus spécifiquement chaque clone. Une distinction existe entre parcelle de comportement et collection d’étude. Une collection d’étude est une parcelle expérimentale constituée de clones issus de prospections et ayant été soumis à des tests sanitaires ; ces clones sont suivis en vue d’un possible agrément. Une parcelle de comportement est une parcelle expérimentale constituée de clones déjà agréés : l’objectif est de comparer leurs différentes caractéristiques en fonction de l’environnement (Audeguin, 2000).
2.4. La biotechnologie au service de la préservation des ressources génétiques
Les risques biotiques et abiotiques qui menacent la collection ampélographique du Domaine de Vassal ont entrainé des recherches sur d’autres moyens de conserver la diversité génétique de la vigne.
La culture in Vitro est un moyen de conservation et une partie de la collection de Vassal est déjà en culture in Vitro. En 1994, Plessis mena des recherches sur la cryoconservation des bourgeons dans l’azote liquide et montra que 60% des bourgeons survivent à la congélation. Les recherches sur cette méthode de conservation sont toujours en cours. En effet, la résistance des bourgeons à la congélation dépend des conditions de refroidissement et des altérations peuvent survenir comme la cristallisation des sucres par exemple (Plessis, 1994).
3. Etat des lieux de la sélection de Cabernet-Sauvignon 3.1. Description du Cabernet-Sauvignon
Le Cabernet-Sauvignon est un cépage originaire de la région bordelaise. Il est issu du croisement entre le Cabernet franc et le Sauvignon. Ce cépage est emblématique de la région du Médoc, où il occupe près de la moitié des surfaces viticoles et sa notoriété a influencé sa production dans le monde entier. 330000 ha de Cabernet-Sauvignon sont aujourd’hui plantés dans le monde, dont environ 55000 ha en France.
Le Cabernet-Sauvignon est facilement identifiable par ses caractéristiques ampélographiques, illustrées dans la figure 8. Il se caractérise par des jeunes feuilles bronzées, rougeâtres. Les feuilles adultes sont orbiculaires avec des dents à côtés convexes, découpées en 5 à 7 lobes, avec des sinus latéraux secondaires à fonds plats ou en U. Le limbe est brillant, avec sur la face inférieur une densité faible de poils couchés. Les grappes et les baies de Cabernet-Sauvignon sont petites. Sa vigueur forte et ses rameaux allongés impliquent un palissage soigné.
C’est un cépage peu précoce, cultivé dans des zones tempérées et méridionales. Il s’exprime le mieux sur des terrains graveleux, drainants, acides et bien exposés, typiques des sols du Médoc : ces terres favorisent la bonne maturité des raisins.
Le Cabernet-Sauvignon est sensible aux maladies du bois, à l’oïdium, l’excoriose, l’érinose et aux acariens, mais est moins sensible à la pourriture grise.
Les vins de Cabernet-Sauvignon montrent une belle structure tannique, une bonne acidité et une complexité aromatique intéressante, mais ils manquent souvent de rondeur et de gras et sont donc généralement assemblés avec d’autres cépages (Cabernet-Sauvignon N, PlantGrape).
37
Aussi, un manque de maturité des raisins de Cabernet-Sauvignon entraîne la présence de la molécule d’IBMP (2-méthoxy-3isobutylpyrazine), responsable de l’arôme poivron vert. Cet arôme végétal n’est pas recherché, il disparait au cours de la maturation (Dufour, 2008).
3.2. Les critères de sélection du Cabernet-Sauvignon
L’aspect qualitatif et sanitaire du Cabernet-Sauvignon est recherché dans le processus de sélection. Les pieds ayant les caractéristiques suivantes sont sélectionnés :
Absence de maladies à virus et à phytoplasmes Un rendement faible à moyen
Des grappes longues et lâches aux petites baies
Absence de maladies du bois, le Cabernet-Sauvignon étant très sensible.
Dans le cadre d’une sélection massale ou clonale privée, d’autres critères de sélection peuvent rentrer en compte, en fonction de ce que recherche le viticulteur (Lusson, 2014).
3.3. Les clones agréés et la collection de Cabernet-Sauvignon
Le Cabernet-Sauvignon compte 20 clones, dont 15 originaires de la Gironde, 4 du Val de Loire et 1 des Pyrénées-Atlantiques. Entre 1972 et 1980 les clones 15, 169, 170, 191, 216, 217, 218, 219, 267, 269, 337, 338, 339, 341, 410, 411, 412 et 685 ont été agréés.
Les clones les plus plantés dans la région bordelaise sont les clones 191, 337 et 341. Il s’est avéré que les clones 191, 337, 339 et 341 sont porteurs du virus de l’enroulement, dont les caractéristiques et conséquences de cette maladie ont été décrites plus haut. De 2005 à 2010, des clones potentiellement remplaçant des 191 et 337 ont été étudiés, et en 2010 les clones 1124 et 1125 ont été agréés, 1124 en remplacement du 191 et 1125 du 337 (Lusson, 2011).
D’importants travaux ont été menés aux débuts de la sélection clonale sur le Cabernet-Sauvignon, mais il n’a pas fait l’objet de suivi précis en collection d’étude avant les années 2000. Cette collection a permis de sélectionner les clones 1124 et 1125 mais permet également d’étudier les clones peu connus et ceux non agréés. La parcelle de collection est située sur le Domaine du Grand Parc à Latresne (33) et est planifiée en six blocs de plusieurs clones (Dufour, 2009).
De nombreux clones de Cabernet-Sauvignon existent mais la volonté du Château Montrose est de disposer de sa propre collection d’étude afin de sélectionner la souche exprimant au mieux le terroir du Château et de conserver le patrimoine du vignoble.
4. Objectifs de sélection du Château Montrose
Le Château Montrose s’est lancé depuis 2006 dans une démarche environnementale globale, qui pourrait être qualifiée de permaculture, dont la notion de durabilité prend une place majeure. La sélection clonale est parfaitement ancrée dans cette trajectoire de durabilité puisque les objectifs premiers de la sélection sont de développer un matériel végétal sain et donc durable dans le temps mais aussi de préserver les ressources génétiques d’une variété.
Le vignoble du Château Montrose est en vieillissement, environ 70 % de la surface du vignoble est âgé de plus de 30 ans, mais les vieilles vignes ont toujours un potentiel qualitatif très élevé puisqu’elles entrent dans l’assemblage du premier vin du château. De ce fait, l’objectif premier du Château Montrose est de replanter le vignoble au fur et à mesure avec un matériel végétal sain issu de ses propres terroirs et de conserver ainsi la typicité de ses vins.
39
Le Cabernet-Sauvignon et le Merlot sont les deux cépages majoritaires du domaine, avec une proportion de Cabernet-Sauvignon plus importante (65%). Le Merlot suit une démarche de sélection massale. Le Cabernet-Sauvignon est engagé dans une sélection clonale privée, donc plus poussée, car les parcelles de Cabernet-Sauvignon sont plus nombreuses et il y a donc plus de matériel végétal à disposition. C’est également le cépage emblématique de la propriété. Une première prospection en 2012 de 3 parcelles (52, 54 et 55) a été réalisée mais les pieds ont été suivis seulement en 2016. Lors de ce suivi, 100 pieds étaient observés et l’objectif était de réduire l’échantillon de départ en sélectionnant seulement les pieds à très fort et fort potentiel. Les critères de sélection sont les mêmes que ceux de la sélection officielle mais une teneur en anthocyanes élevée et une faible maturité des pépins sont également recherchées. Les pieds suivis en 2016 avaient des teneurs en anthocyanes élevées mais aussi des forts degrés : la sélection a été réalisée en ne prenant que les pieds extrêmes aux forts potentiels en se disant que les valeurs obtenues ne seraient sans doute jamais aussi fortes. 11 pieds ont donc été sélectionnés sur ces critères.
Suite à une deuxième prospection réalisée en 2017, 1181 pieds ont été marqués et 586 se sont révélés sains et observés en 2017. Les pieds se trouvent sur 11 parcelles réparties sur 3 zones avec des terroirs différents. L’intérêt d’augmenter le nombre de parcelle est d’avoir une probabilité plus grande de travailler sur du matériel végétal d’origine variée. L’objectif du suivi de cette nouvelle prospection est également de réduire le nombre de pieds à étudier en sélectionnant les pieds aux meilleurs potentiels mais en les sélectionnant dans des groupes d’étude de parcelles aux terroirs similaires. Ainsi, pour chaque groupe, quelques pieds aux meilleurs potentiels seront retenus et seront à suivre une deuxième année. Ils seront également envoyés aux pépiniéristes Guillaume pour être multipliés et plantés dans une collection d’étude localisée aux alentours de Dijon.
Un autre objectif de la démarche de sélection clonale est de planter une parcelle d’étude composée des 18 meilleurs pieds ainsi que de deux clones du commerce afin de pouvoir comparer les accessions entre elles sur le terroir de Montrose.
Ainsi, les objectifs de ce mémoire sont de sélectionner moins de 80 pieds issus de la deuxième prospection sur des critères de précocité des pieds, rendement, morphologie et maturité, et également d’établir les plans de plantation de la future parcelle d’étude.
Figure 9: Cartographie du vignoble du Médoc (Source : Les vins de Bordeaux)
Figure 10: Coupe géologique du vignoble du Château Montrose (Becheler, 2007) Figure 10: Coupé géologique du vignoble du Château Montrose (Becheler, 2007)
41
Partie 2 : Matériel et méthodes
1. Cadre de l’expérimentation
1.1. Le vignoble du Château Montrose
1.1.1. Localisation et caractéristiques pédoclimatiques
Le Château Montrose, Second Cru Classé de 1855, est situé sur l’appellation Saint Estèphe dans le Médoc (figure 9). Cette région est mondialement reconnue pour la qualité de ses vins et de ses terroirs.
Les terres du Château Montrose correspondent au système des terrasses alluviales de l’axe fluviatile Garonne-Gironde. A la fin du Miocène et pendant le Pliocène, la mer s’est retirée et plusieurs nappes de sables, argiles et graviers se sont mis en place. C’est au cours du Quaternaire que les axes fluviaux s’encaissèrent et que le fleuve dériva vers l’Est, jusqu’à sa position actuelle.
Six niveaux de terrasses ont été mis en évidence par Pierre Becheler, entre le sud de la région viticole des graves (Langon) et le nord du Médoc (Bernardin, 2010). Saint Estèphe est concernée par les terrasses 3, 4 et 5, tout comme le vignoble du Château Montrose, dont la coupe géologique est représentée en figure 10.
Terrasse 3 :
Le sédiment comprend 70% de graviers et de galets et sa matrice est constituée de sables grossiers (58%), d’argiles (27%) et d’une fraction sableuse fine et limoneuse (15%).
Terrasse 4 :
La base des dépôts est constituée d’argiles jaunes. Elle se présente sous la forme de buttes, dominant l’estuaire et culminant entre 12 et 16m à Saint Estèphe. Cette terrasse est considérée comme étant la plus qualitative : elle se retrouve sur les appellations prestigieuses de Margaux, Saint Julien et Pauillac, et sur les terres des crus les plus hauts classés. Du sommet vers la base de la terrasse, des variations de faciès sont observées :
Faciès graveleux, non altéré dont le matériel est composé de 82% de graviers et de galets, et dont la matrice de ces éléments est constituée de sables grossiers (64%) avec une fraction argileuse (6%).
Faciès d’altération climatique ancienne découlant d’un climat sub-tropical de l’aire interglaciaire Mindel-Riss. Un sol de type ferralitique s’est formé comprenant deux horizons distincts : un horizon profond constitué de produits d’altération (argiles et hydroxydes de fer) et un horizon superficiel très riche en hydroxydes de fer du à des remontées d’eau chargée en fer et à l’évaporation de surface. Une cuirasse ferrugineuse se dessine localement sur certaines zones de la terrasse 4.
Terrasse 5 :
C’est la terrasse la plus proche de l’estuaire, sa base se situant sous le niveau de celui-ci. Deux faciès sont retrouvés : un formé de graves et un autre de sables argileux et d’argiles sableuses.
Tableau 2: Liste des parcelles en sélection (M : Montrose, FP : Fond Petite, TL : Tronquoy-Lalande)
Parcelle Surface (ha) Année de plantation Age Rendement 2016 hL/ha
M34 0,53 1952 65 42 M35 0,6 1947 70 44 M48H 0,97 1945 72 34 M49 1,59 1949 68 35 M51B 0.7 1944 73 44 M52 1,26 1944 73 36.5 M54 1,65 1945 72 41.5 M55 1,07 1957 60 30.5 M56 1,33 1951 66 39.5 FP132 1,02 1954 63 29 TL18S 0,5 1950 67 46 Total / Moyenne 11 12,03 1949 68
Figure11: Encépagement du Château Montrose en 2017
69.41%
18.79%
11.81%
Vignes d’âge moyen
Vignes « âgées » Vignes « jeunes »
Figure 12: Représentation du vignoble vieillissant du Château Montrose en 2017
43
D’autres ensembles géologiques constituent le terroir de Montrose tels que des talus de séparation entre les terrasses, une plaine alluviale, le substratum géologique ancien et le système des alluvions modernes.
1.1.2. Surfaces, encépagement et âge du vignoble
La particularité du Château Montrose est de posséder un vignoble de 95 ha d’un seul tenant autour du château.
Son encépagement est relativement classique pour un vignoble du Médoc, avec une majorité de Cabernet-Sauvignon (55%) et de Merlot (38%), et avec une petite quantité de Cabernet franc (5%) et de Petit Verdot (2%) (Figure 11). La proportion de chaque cépage dans l’assemblage du grand vin reflète l’encépagement du vignoble.
Les porte-greffes utilisés en majorité sont le SO4, le 101-14 MGt, le 44-53 Malègue et le Riparia Gloire de Montpellier.
Le vignoble du Château Montrose est vieillissant, d’où la volonté d‘entreprendre une démarche de sélection, afin de préserver le patrimoine génétique. La figure 12 représente la proportion de l’âge des vignes.
1.1.3. Système de conduite du vignoble
Le système de conduite du vignoble suit le cahier des charges de l’appellation Saint Estèphe. Au Château Montrose, la taille est réalisée en Guyot double ; la densité de plantation est de l’ordre de 9100 pieds par hectare, avec un écartement entre les rangs de 1.1m ou de 1m.
Le rendement moyen du Château est de 48hl/ha, ce dernier variant en fonction des millésimes.
1.2. Dispositif expérimental
1.2.1. Une diversité parcellaire
Toutes les parcelles plantées avant 1960 ont été prospectées, soit 11 parcelles (Tableau 2) et sont localisées sur trois secteurs avec des terroirs aux potentialités variables :
Une sur le secteur de Fond-Petite, acquis en 2010.
Une sur les terres du Château Tronquoy-Lalande, autre propriété de Messieurs Martin et Olivier Bouygues.
Le reste des parcelles sur la terrasse 4 du Château Montrose.
La probabilité d’avoir des origines de matériel végétal différentes est augmentée grâce à l’étude de ces 11 parcelles sur trois secteurs.
Des fosses et analyses de sol ont été effectuées entre 2007 et 2012 par le conseiller Pierre Becheler, et ont permis de mettre en évidence 26 unités cartographiques (UC) sur l’ensemble du Château Montrose, qui correspondent à différents types de sol. Chaque parcelle est caractérisée par son propre terroir. La notion de terroir prend en compte la typologie des sols, le climat, le cépage mais aussi le facteur humain (van Leeuwen S. , 2006). L’interaction de ces facteurs a une influence sur la qualité des raisins, d’où l’importance de décrire les parcelles d’étude (Ubalde, 2010).
Figure 11: Carte pédologique du vignoble de Montrose et nom des parcelles en sélection (légende de la carte en dessous)
35 34 48H 49H 49B 51B 52 54 55 132 56
Secteur de Fond Petite
45
Les trois secteurs sont décrits par l’étude de la carte pédologique et de la carte de l’indice NDVI, qui renseigne sur la vigueur, ainsi que sur la destination des parcelles dans l’assemblage des vins. La carte pédologique est disponible en figure 13.
Le secteur de Fond petite (Parcelle 132) :
La parcelle 132 se situe sur les peyrosols de la base de la terrasse 3 dont la roche mère correspond à une grave très riche en graviers et galets. La réserve utile de ce sol est de l’ordre de 40mm et la profondeur d’enracinement de 150 cm. Elle se trouve sur la partie basse de la croupe de la terrasse 3 et est plus tardive. Cette parcelle est la seule dans cette étude à être enherbée, ce qui constitue une raison de plus de la traiter à part, l’enherbement créant une compétition concernant la réserve hydrique du sol. La vigueur de la parcelle est modérée. La parcelle 132 entre dans l’assemblage du second vin du château.
La parcelle 18 Sable du Château Tronquoy-Lalande :
Cette parcelle se situe sur deux UC de la partie basale de la terrasse 3: la partie Est est caractérisée par des brunisols graveleux, peu épais, issus de graves argileuses compactes et la partie Ouest par des brunisols graveleux, lessivés, issus de graves argileuses. Elle fait partie des parcelles tardives de la zone.
Concernant l’alimentation hydrique, la parcelle reçoit un important ruissellement des zones plus hautes, évacué par la faible perméabilité de la grave. La réserve utile est de 77 mm et la vigne ne souffre pas de stress hydrique marqué ou d’excès d’eau. La vigueur de la parcelle est modérée.
Les parcelles de la terrasse 4 du Château Montrose :
Ces parcelles se trouvent le long de l’estuaire de la Gironde et sont orientées Nord-Sud. Un léger dénivelé est à noter à la fois d’Ouest en Est et de Nord en Sud. La partie haute de la parcelle 49 se trouve au point culminant de la zone. Le bas des parcelles reçoit donc un ruissellement plus important dû à la pente.
Aussi, deux grandes typologies de sols sont sur cette zone :
- les sols de la terrasse 4 sur les parcelles 34, 35 et le haut des parcelles 48, 49, 52, 54, 55 et 56.
- les sols du talus de séparation des terrasses 4 et 5 sur le bas des parcelles 49, 51, 52, 54, 55 et 56.
Les sols des parcelles 34 et 35 sont caractérisés par l’UC7, des podzosols à alios sur graves argileuses, et la texture de ces sols est sablo argileuse. La réserve utile est de 120 mm. Ce sont des sols peu contraints dont la réalimentation en eau est rapide. Ces parcelles ont une vigueur forte. Les sols du haut des parcelles 48 et 49 sont décrits par les UC 5 et 6 et ceux du haut des parcelles 52, 54, 55 et 56 par l’UC 4. Les parcelles 48 et 49 ont une vigueur modérée alors que la 52, 54, 55 et 56 ont une vigueur plus forte.
Ces parcelles entrent dans l’assemblage du grand vin du Château Montrose et sont les plus qualitatives.
Tableau 3: Bilan des différentes prospections et nombre de pieds à suivre en 2017 sur chaque parcelle Prospection 2015-2016 Prospection 2016-2017 Parcelle Nb de pieds analysés Nb de pieds sains Nb de pieds sélectionnés en 2016 Nb de pieds à suivre en 2017 Nb de pieds marqués Nb de pieds analysés Nb de pieds sains M34 81 76 43 M35 113 111 49 M48H 149 132 61 M49H+B 324 298 164 M51B 90 84 49 M52 142 54 5 11 M54 43 15 2 6 M55 72 31 4 9 M56 76 68 51 FP132 243 219 137 TL18S 105 77 32 Nb pieds / prospection 257 100 11 26 1181 1065 586 % perte / prospection 61,09 89,00 74 9,82 44,98 Total des pieds suivis 612
Pieds analysés : pieds ayant subi les tests sanitaires de type ELISA Pieds sains : pieds ayant répondu négativement aux tests sanitaires
Pieds sélectionnés : pieds sélectionnés sur les critères agronomiques et œnologiques voulus Pieds marqués : pieds prospectés et marqués par une étiquette qui seront à étudier et à sélectionner