© Marie-Josée Toulouse, 2019
Validation de la neuraminidase à titre de marqueur
enzymatique pour la détection de virus dans l'air
Mémoire
Marie-Josée Toulouse
Maîtrise en biochimie - avec mémoire
Maître ès sciences (M. Sc.)
Validation de la neuraminidase à titre de marqueur
enzymatique pour la détection de virus dans l’air
Mémoire
Marie-Josée Toulouse
Sous la direction de
Caroline Duchaine, Ph.D.
III
RÉSUMÉ
Les méthodes connues de détection des virus dans l’air sont complexes et ne permettent pas de détecter rapidement plusieurs types de virus à la fois. De plus, peu d’informations sont disponibles concernant l’efficacité des échantillonneurs à récolter et à préserver l’infectivité des virus. Ce projet avait pour objectif d’étudier la détection des virus dans l’air basée sur la présence d’un marqueur enzymatique, soit la neuraminidase. Une enzyme purifiée et des souches de virus influenza ont été utilisés comme modèles. L’efficacité de trois échantillonneurs à récolter les virus dans l’air a été comparée et les effets de l’aérosolisation et de l’échantillonnage dans deux chambres d’aérosolisation sur l’acitivité de la neuraminidase et sur l’infectivité des virus ont été étudiés. Les résultats obtenus démontent la stabilité de la neuraminidase et valident son utilisation comme marqueur enzymatique pour la détection générique, simple, rapide et abordable des virus dans des échantillons d’air.
ABSTRACT
The known methods for the detection of viruses in the air are complex and do not allow to quickly detect several types of viruses at the same time. In addition, little information is available regarding the effectiveness of samplers to collect and preserve the infectivity of the viruses. This project aimed to investigate the detection of viruses in the air based on the presence of an enzymatic label, the neuraminidase. A purified enzyme and strains of influenza viruses were used as models. The effectiveness of three samplers to collect the viruses in the air and was compared and the effects of aerosolization and sampling in two aerosolization chambers on neuraminidase activity and viruses infectivity were studied. The results obtained demonstrate the stability of the neuraminidase and validate its use as an enzymatic marker for the generic, simple, fast and affordable detection of viruses in air samples.
V
TABLE DES MATIÈRES
RÉSUMÉ ... III ABSTRACT ... IV TABLE DES MATIÈRES ... V LISTE DES TABLEAUX ... VIII LISTE DES FIGURES ... IX LISTE DES ABRÉVIATIONS ... X REMERCIEMENTS ... XII
INTRODUCTION ... 1
0.1 L’aérobiologie et la composition des bioaérosols ... 1
0.2 La transmission de maladies respiratoires par l’air ... 1
0.2.1 Les infections respiratoires causées par le virus de la grippe ... 1
0.2.2 Modes de transmission des virus par les bioaérosols ... 3
0.3 Étude des virus à l’état de bioaérosols ... 7
0.3.1 Études en chambres d’aérosolisation ... 7
0.3.2 Échantillonneurs d’air disponibles ... 7
0.4 Détection actuelle des virus dans les bioaérosols ... 9
0.4.1 Méthodes de détection existantes ... 9
0.4.2 Problématique des méthodes de détection actuelles ... 10
0.5 Détection générique des virus dans les bioaérosols ... 11
0.5.1 L’enzyme neuraminidase comme marqueur enzymatique ... 11
0.5.2 Les substrats de la neuraminidase ... 12
0.5.3 Substrat spécifique à la neuraminidase virale ... 13
0.6 But du projet ... 16
CHAPITRE 1. HYPOTHÈSE DE TRAVAIL ... 17
CHAPITRE 2. OBJECTIFS SPÉCIFIQUES ... 18
CHAPITRE 3. MÉTHODOLOGIE ... 20
3.1 Traceur Alexa fluor 555 ... 20
3.1.1 Solubilisation de la molécule ... 20
3.1.2 Lecture de la fluorescence de l’Alexa fluor 555 ... 20
3.2 Modèles d’enzyme neuraminidase ... 21
3.2.1 Neuraminidase purifiée de la bactérie Clostridium perfringens ... 21
3.2.2 Souches de virus influenza utilisées comme modèles ... 22
3.2.4 Réaction enzymatique de l’essai neuraminidase ... 25
3.3 Expériences d’aérosolisation et d’échantillonnage ... 27
3.3.1 Nettoyage du matériel d’aérosolisation et contrôles ... 27
3.3.2 Nébulisation et échantillonnage dans la chambre d’aérosolisation SCL-GenaMini ... 27
3.3.3 Nébulisation et échantillonnage dans la chambre d’aérosolisation wind tunnel . 33 3.3.4 Inoculation des échantillonneurs ... 38
3.4 Quantification des génomes viraux dans les échantillons d’air ... 40
3.4.1 Extraction de l’ARN viral ... 40
3.4.2 Transcription de l’ARN en ADNc ... 40
3.4.3 Réaction en chaîne par polymérase quantitative ... 41
3.5 Analyse des résultats ... 43
3.5.1 Caractérisation des systèmes et évaluation de l’efficacité de capture des échantillonneurs ... 43
3.5.2 Évaluation de l’activité enzymatique et de l’infectivité restantes dans les échantillons ... 44
3.5.3 Analyses statistiques ... 45
CHAPITRE 4. RÉSULTATS ... 46
4.1 Caractérisation des systèmes d’aérosolisation et comparaison de l’efficacité de capture des échantillonneurs ... 46
4.1.1 Caractérisation de la chambre SCL-GenaMini et efficacité de capture du SKC Biosampler® et des cassettes contenant des filtres en polycarbonate de porosité 0,8 µm ... 46
4.1.2 Caractérisation du wind tunnel et efficacité de capture du Coriolis µ ... 46
4.2 Résistance de l’activité enzymatique et de l’infectivité des modèles à l’aérosolisation et à l’échantillonnage dans la chambre SCL-GenaMini ... 47
4.2.1 Effets du SKC Biosampler®et des cassettes contenant des filtres en polycarbonate de porosité 0,8 µm ... 47
4.2.2 Effet d’un échantillonnage sur une longue période avec des cassettes contenant des filtres en polycarbonate de porosité 0,8 µm ... 50
4.3 Résistance de l’activité enzymatique et de l’infectivité des modèles à l’aérosolisation et à l’échantillonnage dans le wind tunnel ... 51
4.4 Effet du séjour dans les échantillonneurs sur les modèles d’enzyme ... 51
4.4.1 Effet du séchage de longue durée suite à un échantillonnage avec des cassettes contenant des filtres en polycarbonate de porosité 0,8 µm ... 51
4.4.2 Effet du séjour des modèles d’enzyme dans le SKC Biosampler® et dans le Coriolis µ ... 52
VII
CHAPITRE 5. DISCUSSION ... 55
5.1 Caractérisation des systèmes d’aérosolisation et comparaison de l’efficacité de capture des échantillonneurs ... 55
5.1.1. Caractérisation de la chambre SCL-GenaMini et efficacité de capture du SKC Biosampler® et des cassettes contenant des filtres en polycarbonate de porosité 0,8 µm ... 55
5.1.2 Caractérisation de la chambre SCL-GenaMini et efficacité de capture du SKC Biosampler® et des cassettes contenant des filtres en polycarbonate de porosité 0,8 µm ... 56
5.2 Résistance de l’Alexa fluor 555 et des modèles d’enzyme à l’aérosolisation, à l’échantillonnage et aux séjour dans les échantillonneurs ... 56
5.2.1. Résistance de l’Alexa fluor 555 et des génomes viraux ... 56
5.2.2 Résistance de la neuraminidase purifiée de Clostridium perfringens ... 57
5.2.3. Résistance de la neuraminidase des virus influenza ... 58
5.3 Résistance de l’infectivité des virus influenza ... 59
CONCLUSION ... 61
LISTE DES TABLEAUX
IX
LISTE DES FIGURES
Figure 1: Structure des virus influenza de types A et B. ... 3
Figure 2: Exemples d’aérosolisations primaire et secondaire de virus. ... 4
Figure 3: Dessication des gouttelettes en noyaux de gouttelettes et transport dans l’air. ... 6
Figure 4: Structure moléculaire des substrats de la neuraminidase. ... 13
Figure 5: Schémas réactionnels de l’essai neuraminidase avec différents substrats. ... 15
Figure 6: Structure moléculaire du sel fluorescent Alexa fluor 555. ... 20
Figure 7 : Équation du calcul de l’index par la méthode de Reed et Muench. ... 24
Figure 8 : Schéma de la chambre d’aérosolisation GenaMini et identification de ses différentes composantes. ... 30
Figure 9 : L’atomiseur de TSI. ... 30
Figure 10 : L’échantillonneur SKC BiosamplerÒ et les cassettes de 37 mm avec filtres en polycarbonate de porosité 0,8 µm. ... 32
Figure 11: Schéma de la chambre d’aérosolisation wind tunnel et identification de ses différentes composantes. ... 35
Figure 12 : Collison à 6 jets et precious fluid jar. ... 36
Figure 13: Échantillonneur Coriolis µ. ... 37
Figure 14 : Taux de récupération du traceur Alexa fluor 555 par les échantillonneurs dans les différents systèmes d’aérosolisation. ... 47
Figure 15: Comparaison des pourcentages d’activité neuraminidase et d’infectivité restants après aérosolisation et échantillonnage des modèles d’enzyme. ... 49
Figure 16 : Comparaison des taux de récupération relatifs de l’Alexa fluor 555, de l’activité neuraminidase, des génomes et de l’infectivité des modèles d’enzyme dans la chambre SCL-GenaMini les filtres en polycarbonate de porosité 0,8 µm. ... 50
Figure 17: Comparaison du taux de récupération relatif de l’Alexa fluor 555, de l’activité neuraminidase, des génomes et de l’infectivité des modèles d’enzyme dans la chambre SCL-GenaMini suite à leur échantillonnage avec des filtres en polycarbonate de porosité 0,8 µm et à leur séchage. ... 52
Figure 18 : Comparaison des pourcentages d’activité neuraminidase ou d’infectivité restants pour évaluer l’effet du séjour post-échantillonnage dans le SKC Biosampler® et dans le Coriolis µ sur les modèles d’enzyme. ... 53
LISTE DES ABRÉVIATIONS
Abréviations Significations °C Degrés centigrades
µm Micromètre
µM Micromole par litre
4-methoxy-Neu5Ac 4-O-methoxy-N-acetylneuraminic acid 4-MU 4-methylumbelliferyl
4-MU-4-methoxy-Neu5Ac 4-methylumbelliferyl-4-O-methoxy-N-acetylneuraminic acid 4-MU-NANA 4-methylumbelliferyl-N-acetylneuraminic acid
A Lignée de type A
ADN Acide désoxyribonucléique AGI-30 All glass-impinger-30 APS Aerodynamic Particle Sizer ARN Acide ribonucléique
B BTP3-Neu5Ac Lignée de type B 2-(benzothiazol-2-yl)-4-bromophenyl 5-acetamido-3,5-dideoxy-α-D-glycero-D-galacto-2-nonulpyranosidonic acid C Lignée de type C
CaCl2 Chlorure de calcium
CH3 Méthyle
cm centimètres
C.p. Clostridium perfringens EID50
GSP 50% egg infectious dose Gesamtstaubprobenahme
H Hémagglutinine
HEPA High efficiency particulate air
H1N1 Hémagglutinine sous-type 1, Neuraminidase sous-type 1 H3PO4 Acide phosphorique
H3N2 Hémagglutinine sous-type 3, Neuraminidase sous-type 2 H5N1 Hémagglutinine sous-type 5, Neuraminidase sous-type 1 KCl Chlorure de potassium
L Litre
m Mètre
MES 2-(N-morpholino)ethanesulfonic acid
ml Millilitre
mm Millimètre
XI Abréviations Significations N NA Neuraminidase Activité neuraminidase NaCl Chlorure de sodium NDV Newcastle disease virus Neu5Ac N-acetylneuraminic acid
NIOSH National Institute for Occupational Safety and Health
nm Nanomètre
nM Nanomole par litre
OMS Organisation mondiale de la santé PBS Phosphate buffered saline
PC Polycarbonate
PCR Polymerase chain reaction pH Potentiel hydrogène qPCR
REPS
Quantitative Polymerase chain reaction Rutgers Electrostatic Passive Sampler RFU Relative fluorescence units
RNases Ribonucléases
RT Reverse transcription RT-PCR
SJAC
Reverse transcription polymerase chain reaction Steam-Jet Aerosol Collector
SRAS UV VIVAS
Syndrome respiratoire aigu sévère Ultra-violets
Viable Virus Aerosol Sampler VRS Virus respiratoire syncitial
REMERCIEMENTS
Mener à terme un projet académique tel qu’un projet de maîtrise nécessite bien évidemment de la curiosité intellectuelle, le désir de développer une expertise en recherche, de la créativité, un important investissement personnel et de la persévérance, mais requiert aussi la collaboration de même que le soutien des personnes de son entourage. Ainsi, je tiens à remercier tous les gens qui ont contribué de près ou de loin à l’accomplissement de mon projet de maîtrise.
Tout d’abord ma directrice de recherche, la professeure Caroline Duchaine, pour m’avoir accueillie dans son laboratoire au Centre de recherche de l’Institut universitaire de cardiologie et de pneumologie en 2009, alors que je venais tout juste de terminer ma première année de baccalauréat. J’y ai effectué des projets de recherche aux étés 2009 et 2010 et travaillé à temps partiel en tant qu’auxiliaire de recherche pendant les sessions d’automne 2010 et d’hiver 2011, avant d’y débuter ma maîtrise à l’été 2011. Mon long séjour passé dans l’équipe du Dre Duchaine a été très formateur et m’a permis d’acquérir une expertise unique, d’effectuer deux stages de formation à l’étranger, d’avoir mon nom sur quelques articles scientifiques, ainsi que de présenter mes résultats de recherche à de nombreux congrès locaux, provinciaux et internationaux. Il m’a de plus donné envie de poursuivre ma carrière dans les domaines de la recherche scientifique et de l’enseignement.
Je tiens à remercier tous les membres de l’équipe du Dre Duchaine et les collaborateurs avec qui j’ai eu le plaisir de travailler, mais plus particulièrement certains d’entre eux qui ont grandement contribué à ma formation. La Dre Nathalie Turgeon, une professionnelle de recherche qui travaillait aussi sur ce projet, pour avoir montré de nouvelles techniques et m’avoir encadré dans mon travail. Le Dr Dongqing Li et son étudiante au doctorat Fang Zhang de l’Université de Waterloo pour avoir accepté de collaborer avec notre équipe à la miniaturisation de l’essai enzymatique que nous avons mis au point et au développement d’un appareil de détection automatisé des virus dans l’air, de même que pour l’accueil qu’ils m’ont offert lors d’un stage de formation en microfluidique, que j’ai effectué dans leur équipe à l’été 2012. Le Dr Jim Ho, un autre collaborateur de ce projet, pour avoir
XIII
apporté son expertise dans le domaine de la détection des bioaérosols et donné accès à du matériel en provenance de la Defence Research and Development Canada. Le Dr Daniel Verreault pour la formation sur les chambres environnementales qu’il m’a offerte lors d’un stage que j’ai effectué au Tulane National Primate Research Center à l’été 2011. Je remercie le biostatisticien de l’IUCPQ, monsieur Serge Simard, pour son aide dans les analyses statistiques de mes résultats.
J’aimerais ensuite remercier les membres de mon comité aviseur, la Dre Manon Couture et le Dr André Darveau, pour leur encadrement et leurs conseils tout au long de ma maîtrise. Je remercie de plus le Département de biochimie, microbiologie et bio-informatique pour la variété des cours et la qualité de l’enseignement qu’ils m’ont offert de même que pour stimuler l’intérêt et encourager les étudiants à faire carrière en recherche. Merci au Dr Avraham Liav pour la synsthèse du substrat spécifique utilisé dans ce projet et le biostatisticien Serge Simard pour son aide offerte pour les analyses statistiques de mes résultats.
J’aimerais de plus remercier le professeur Claude Simoneau du Cégep de Drummondville, qui m’a enseigné la chimie tout au long de mon parcours collégial. Passionné par la science, c’est lui qui m’a donné envie de me diriger vers le domaine de la biochimie pour mes études universitaire et qui a suscité en moi un intérêt pour la recherche académique. Je voudrais aussi remercier ma mère Johanne, de même que mes amis proches pour leurs encouragements, ainsi que pour le soutien qu’ils m’ont apporté tout au long de mes études.
Ce projet a pu être réalisé grâce à la subvention numéro 396451-10 offerte par le CRSNG Programme stratégique pour les années 2011 à 2104. Je tiens également à mentionner les diverses organisations qui mon offert un généreux soutien financier tout au cours mes études de maîtrise. J’ai en effet été détenu la bourse Alexander Graham-Bell du CRSNG ainsi que celles du FRQNT et de l’IRSST. Je remercie spécialement l’IRSST de m’avoir invitée à présenter mes résultats de recherche lors du séminaire qu’il organise et de l’intérêt que cet organisme subventionnaire témoigne à ses étudiants boursiers. J’ai de même
obtenu des bourses du Réseau en santé respiratoire du FRQS pour aller présenter mes résultats de recherche à un congrès international de même que pour aller effectuer un stage de formation chez nos collaborateurs de l’Université de Waterloo. J’aimerais de même souligner le très gratifiant Prix Acfas-Desjardins pour étudiant-chercheur à la maîtrise que j’ai obtenu à l’automne 2012 pour mon excellent dossier académique et mes recherches ainsi que mon passage à l’émission Cogito de la Chaire publique de l’AELIÉS, une expérience très enrichissante qui m’a permis de vulgariser mon sujet de recherche à la maîtrise au grand public.
Finalement, je souhaite dédier mon mémoire de maîtrise à mon défunt père, Michel Toulouse. Celui-ci s’est à mon grand regret éteint le 8 septembre 2018, des suites d’une maladie neurodégénérative qui l’affectait depuis plusieurs années. Ce grand homme m’a toujours soutenue et encouragée dans mes études et était très fier que je suive ses traces en allant, comme lui, étudier à l’Université Laval et poursuivant mes études aux cycles supérieurs. Ce professeur de carrière m’a appris à être travaillante, à persévérer et m’a enseignée l’importance de suivre mes passions dans la vie. À mon « papa Mimi » adoré, qui restera pour toujours dans ma mémoire et dans mon cœur!
1
INTRODUCTION
0.1 L’aérobiologie et la composition des bioaérosols
Les particules solides et/ou liquides que l’on retrouve en suspension dans l’air sont appelées aérosols. Les aérosols peuvent être constitués d’eau, de minéraux, de composés chimiques ou de microorganismes vivants ou morts, tels que des virus et des bactéries. Ils peuvent aussi être faits de fragments de ceux-ci, comme par exemple des protéines, des lipides, des toxines ou des acides nucléiques (40, 64). Lorsqu’un composant de nature biologique se retrouve en suspension dans l’air, celui-ci porte le nom de bioaérosol. La science qui étudie les bioaérosols se nomme l’aérobiologie.
0.2 La transmission de maladies respiratoires par l’air
La présence dans les bioaérosols de nombreux microorganismes pathogènes, qui sont responsables de maladies infectieuses des voies respiratoires chez l’homme et les animaux, tels que les virus, est bien connue et constitue un problème majeur dans le domaine de la qualité de l’air intérieur et extérieur (7, 22, 31, 52, 59, 64, 67, 89, 90, 134, 136, 166). Mentionnons par exemple les infections respiratoires chez les enfants et les nourissons causées par le virus parainfluenza (4), de même que les épidémies de grippe annuelles (33, 124), les épidémies bien connues de grippe aviaire A H5N1 (6), de Sydrôme respiratoire aigu sévère (SRAS) (71, 88, 163, 166) et de Virus respiratoire syncitial (VRS) (5, 77), ainsi que la pandémie d’influenza A H1N1 de 2009 (134, 124).
0.2.1 Les infections respiratoires causées par le virus de la grippe
Parmis les virus connus pour causer des maladies respiratoires de nature infectieuse, celui de la grippe est certainement l’un des principaux virus d’intérêt. Plus spécifiquement, le virus influenza appartient à la famille des Orthomyxoviridae. Il en existe quatre types, soit A, B, C et D. Les deux premiers types sont responsables d’épidémies. Le type A engendre aussi des pandémies, le type C ne cause que quelques cas sporadiques, c’est-à-dire isolés, et le type D découvert il y a quelques années seulement touche principalement les bovins et n’est pas connu pour infecter ou causer des maladies chez l’homme (10, 30, 68, 103, 126).
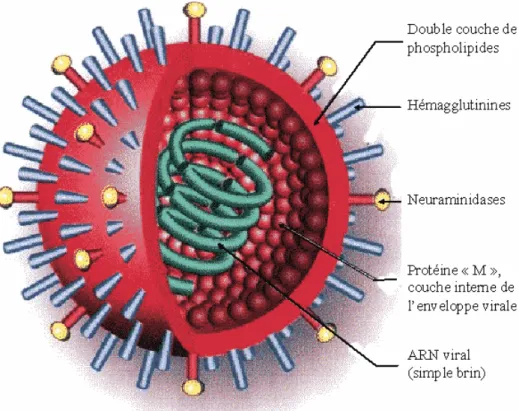
Le génome de ce virus comporte environ 14 000 nucléotides et est généralement composé de huit segments d’acide ribonucléique (ARN) simple brin à polarité négative, sauf pour le type C où il n’y en a que sept. Le virus influenza est un virus pléomorphe d’approximativement 100 nm possédant une enveloppe lipidique et des antigènes à sa surface, soit l’hémaglutinnine et la neuraminidase (Figure 1) (30, 124). Brièvement, la première molécule est une glycoprotéine responsable de la fixation de la particule virale à un acide sialique occupant la fonction de récepteur sur la cellule cible à infecter. De son côté, la neuraminidase possède une activité enzymatique qui joue un rôle dans la libération des virions de la cellule infectée, soit en clivant le lien entre l’hémagglutinine des virus et les acides sialiques des cellules (103, 157). Il existe dix-huit types d’hémagglutinines, ainsi que neuf types de neuraminidases connues (30). En raison de leurs fréquentes mutations génétiques qui modifient la nature des antigènes présents à leur surface, les virus influenza sont en constante évolution et celle-ci est difficilement prédictible (115). Il n’existe encore aucun vaccin universel de disponible sur le marché pour immuniser la population de manière préventive contre ceux-ci, bien qu’il y en ait un qui soit actuellement en développement, plus précisément en début d’études cliniques de phase 1 sur des êtres humains. Ainsi, avec l’apparition de nouvelles souches et jusqu’à ce que le vaccin universel passe au travers de toutes les étapes des cliniques, soit approuvé et commercialisé, de nouveaux vaccins doivent continuellement être mis au point et la population doit se faire vacciner annuellement (42, 140). Les principaux symptômes d’une infection par le virus influenza sont la fièvre, la toux, des frissons, des maux de gorge, des écoulements nasaux, des maux de tête, des nausées, des vomissements, de la diahrée, des douleurs musculaires, ainsi que des douleurs aux articulations (3, 64). Comme traitements en cas d’infection, différents antiviraux tels que l’oseltamivirÒ et le zanamivirÒ, dont l’efficacité a été démontrée dans certaines études, peuvent être utilisés (108). D’après les données recueillies par l’Organisation mondiale de la santé (OMS), la grippe infecte une importante partie de la population mondiale et cause des centaines de milliers de décès à chaque année (101).
3
Figure 1: Structure des virus influenza de types A et B.
Ces virus à ARN simple brin segmenté possèdent une enveloppe lipidique où se trouvent les antigènes de surface hémagglutinine et neuraminidase (figure tirée de http://influenza.h5n1.over-blog.com/article-931860.html).
0.2.2 Modes de transmission des virus par les bioaérosols
En plus d’être transmissibles par contact direct avec une personne infectée ou par contact indirect avec des surfaces contaminées appelées « fomites » (135), les virus influenza, tout comme certains autres virus respiratoires, sont hautement transmissibles par voie aérienne (7, 20, 52, 59, 64, 67, 90, 124, 134, 135, 136, 166). L’aérosolisation des virus, soit leur passage à l’état de particules liquides ou solides en suspension dans l’air (40), peut se produire de façon primaire lors que des humains ou des animaux infectés respirent, toussent ou éternuent (Figure 2A) (20, 78, 99, 76, 98, 134, 135). Elle peut aussi se produire par une aérosolisation secondaire, soit lorsqu’une surface ou un liquide contaminé est perturbé par un déplacement d'air ou par une force physique (Figure 2B) (40, 124, 155).
Figure 2: Exemples d’aérosolisations primaire et secondaire de virus.
Le mode d’aérosolisation primaire peut se produire lors de l’éternuement d’un individu infecté (A) et le secondaire lorsque les mains contaminées d’une personne sont perturbées par la force du jet d’eau d’un robinet lors de leur lavage (B) (figures tirées de http://www.auxfrontieresdelascience.com/sujet-6026 et http://actualites.sympatico.ca/wp-content/uploads/2010/02/lavage-de-mains.jpg).
5
Les virus se retrouvent dans l’air à l’état transitoire suite à leur aérosolisation, c'est-à-dire dans un état où ils ne se multiplient pas, mais où ils peuvent demeurer partiellement infectieux selon leur composition et les conditions environnementales auxquelles ils sont exposés et se transmettre par cette voie. Ces conditions environnementales sont par exemple l’humidité relative, la température, les rayons ultra-violets (UV) ainsi que la présence de poussières (82, 98, 121, 124, 132, 154, 157, 159, 167). Il a été documenté que les particules aérosolisées de taille supérieure à 200 µm sédimentent par gravité dans un rayon de deux mètres autour du lieu de leur production et que celles comprises entre 10 et 200 µm peuvent demeurer en suspension assez longtemps pour parcourir jusqu’à cinq mètres (Figure 3). On appelle gouttelettes les particules d’environ 10 µm et plus contenant de l’eau (40). Des études ont démontré que la voie aérienne promouvoie la transmission de plusieurs maladies d’origine virale sur de longues distances, soit sur plusieurs dizaines de kilomètres (7, 49), via les particules de taille inférieure à 10 µm appelées noyaux de gouttelettes (Figure 3B). Ces particules sont des gouttelettes qui ont été dessiquées, c’est-à-dire d’où l’eau s’est évaporée et où il ne reste plus qu’un amalgame des solutés qui étaient présents dans la particule initiale (Figure 3A). Il est à noter que la taille de 10 µm pour différentier ces deux types de particules est arbitraire et qu’elle varie en fonction de différents paramètres, tels que leur composition, leur vitesse d’aérosolisation, leur vélocité ainsi que la température et l’humidité relative de l’environnement ambiant (7, 40). La transmission par gouttelettes de virus comme ceux de la grippe est bien connue, toutefois celle par noyaux de gouttelettes est un sujet qui était encore controversé avant la dernière décennie (20, 115, 134, 135).
Figure 3: Dessication des gouttelettes en noyaux de gouttelettes et transport dans l’air. Les gouttelettes de plus de 200 µm se déposent dans un rayon de moins d’un mètres, alors que celles comprises entre 10 et 200 µm peuvent parcourir jusqu’à cinq mètres (B). Les noyaux de gouttelettes de taille inférieure à 10 µm, qui sont des particules dont l’eau s’est évaporée (A), peuvent demeurer en suspension quasi indéfiniment (B) (figures tirées des notes du cours Biosaérosols et aérobiologie de l’automne 2011) (40).
L’exposition aux virus aérosolisés se produit le plus fréquemment dans les endroits où l’on retrouve une importante concentration d’individus, ce qui favorise sa transmission. Ainsi, elle peut se produire dans des endroits publics tels que les hôpitaux (5, 14, 18, 22, 31, 38, 90, 97, 119, 104), les édifices à bureaux (94), les aéroports (12), les écoles (84) et les restaurants (85). Elle peut de même affecter les gens se trouvant à l’intérieur ou à proximité de bâtiments agricoles (7, 8, 29, 36, 46, 54, 67, 70, 111, 153).
7
0.3 Étude des virus à l’état de bioaérosols
0.3.1 Études en chambres d’aérosolisation
L’aérobiologie est une science relativement récente avec un nombre de spécialistes limités. Bien qu’elle soit en plein essor, il n’existe présentement qu’une quantité restreinte de moyens de prédire de manière efficace le comportement des bioaérosols lors de leur production, de leur propagation dans l’air et de leur échantillonnage (63, 93). Pour l’étude des virus plus spécifiquement, cela est aussi dû à la faible quantité de méthodes d’échantillonnage et de détection adéquates, au manque de données par rapport à celles qui existent et à l’absence de procédures standardisées (8, 9, 20, 39, 116, 143, 155). Parmi les quelques outils existants actuellement utilisés pour étudier les aérosols viraux in vitro figurent entre autres les chambres d’aérosolisation dynamiques telles que la SCL-GenaMini (44, 155), les wind tunnels (114, 137) et les drums (107), de même que les chambres de séjour de type rotating drum (150, 152, 154). Une chambre dynamique est une chambre où les aérosols qui sont générés de manière continue circulent et sont échantillonnés simultanément, tandis qu’une chambre de séjour est une chambre rotative permettant de garder les aérosols en suspension sur une période de temps déterminée suite à leur production et avant leur échantillonnage (40). Ces chambres permettent d’étudier les bioaérosols produits artificiellement par des nébuliseurs, comme par exemple l’atomiseur de TSI (53) l’Aéroneb® (168), le Air-Brush modèle 200 (80, 76), le Ink Jet (63), les Collison à 3, 6 et 24 jets (88), ainsi que les nébuliseurs par bouillonnement (107).
0.3.2 Échantillonneurs d’air disponibles
Une grande variété d’échantillonneurs utilisant diverses propriétés physiques et fonctionnant à des débits d’air variés sont disponibles commercialement pour récolter les bioaérosols produits en vue d’analyses. Parmi ceux-ci, on retrouve des appareils d’échantillonnage fonctionnant principalement par impaction sur des surfaces liquides et solides, de même que des filtres fabriqués avec divers matériaux (63, 64, 155). Le cyclone à 2 étages du National Institute of Safety and Health (NIOSH) (15, 25, 79), les filtres en polycarbonate (PC), en tétrafluoroéthylène (23, 44, 156), en nylon et en gélatine (146), le
XMX virtual impactor (65, 86), le Gesamtstaubprobenahme (GSP), le Triplex-cyclone (146), l’échantillonneur de la University of North Carolina (123), le Steam-Jet Aerosol Collector (SJAC) (75), le Coriolis µ (26, 44), le Viable Virus Aerosol Sampler (VIVAS) (69, 104), le Tish Cascade Impactor (8), le Gesundheint II (91), le SKC BioStage Impactor, le SKC Button Sampler (50), le SKC AirChek TOUCH (97), le SKC Biosampler®, l’AGI-30 et l’Andersen n’en sont que quelques exemples (57, 142, 155). Les précipitateurs électrostatiques (83), comme le Rutgers Electrostatic Passive Sampler (REPS) (137, 138), les précipitateurs thermiques et les condensateurs sont des techniques utilisant d’autres procédés (45). Une majorité des échantillonneurs de bioaérosols ont été initialement conçus pour récolter les bactéries et les moisissures et, entre 1991 et 2017, les échantillonneurs existants n’ont été utilisés que dans 26,7% des études pour l’échantillonnage et la détection de virus, souvent de l’influenza (9). Ces études ont principalement été menées au cours des dernières années (12, 16, 31, 66, 69, 75, 76, 91, 97, 98, 104, 111, 146). Il y a donc encore un manque de données scientifiques dans la littérature concernant leur effet sur l'intégrité ou l’infectivité des particules virales. Conséquemment, davantage d’études sont nécessaires pour caractériser leur effet (9, 39, 143). Il a cependant été démontré que ces échantillonneurs peuvent s’avérer extrêmement dommageables pour les virus, contrairement à ce qui se produit lors de l’échantillonnage d’autres microorganismes, puisqu’ils nécessitent que les particules qu’ils collectent entrent en contact avec des surfaces ou des solutions à des vitesses très élevées (83). De plus, peu d'informations sont disponibles au sujet de l'efficacité des méthodes d'échantillonnage pour la récolte des virus présents dans l'air et leur effet sur leurs enzymes, comme la neuraminidase, qui se trouvent à leur surface et qui jouent un rôle clé dans le mécanisme d’infection (39, 143). La faible concentration des virus dans l'air constitue de même un obstacle de taille. En effet, lorsqu’ils sont aérosolisés dans l’environnement, les aérosols viraux se dispersent et sont dilués dans l’air ambiant (52, 66, 75, 104, 105, 123, 137, 138). Il est ainsi difficile de collecter un volume d’air suffisamment grand sans endommager les virus et d’avoir une concentration récoltée assez élevée pour pouvoir les détecter dans les échantillons, avec les méthodes qui sont actuellement employés à cette fin (31, 45, 50, 63, 64, 91). Bien que quelques projets de recherche aient déjà utilisés des virus et des bactériophages à titre de modèles viraux pour vérifier l'efficacité de certains échantillonneurs à collecter les bioaérosols et étudier l’effet sur leur infectivité (16, 30, 69, 75, 76, 91, 97, 98,
9
104, 145, 146, 154, 155), davantage de virus pathogènes pour l’humain et d’autres échantillonneurs sont à tester pour améliorer les stratégies d’échantillonnage des virus présents dans l’air (9).
0.4 Détection actuelle des virus dans les bioaérosols
0.4.1 Méthodes de détection existantes
Il n’existe actuellement qu’un nombre restreint de méthodes abordables permettant la détection des virus présents dans les échantillons d’air récoltés. Jusqu’à maintenant, ce sont surtout la réaction en chaîne par polymérase (PCR) et la réaction en chaîne par polymérase (RT-PCR) en temps réel qui ont servi à révéler la présence des virus dans les échantillons d’air provenant de l’environnement (8, 12, 15, 31, 35, 70, 76, 78, 91, 102, 109, 112, 118, 140, 148, 163). Ces méthodes sont sensibles, mais se limitent toutefois aux virus dont le génome a été séquencé et dont l’information génétique est connue. En l’absence de telles informations, leur détection s’avère difficile puisqu’aucun marqueur universel spécifique aux virus n’existe (39, 143). En effet, la structure des virus est relativement simple et l’information génétique qu’ils contiennent est très peu conservée. Une détection par PCR ou RT-PCR en temps réel n’est utile que pour procéder à l’amplification d’un virus en particulier ou d’une gamme très étroite de virus. Cependant, lorsque l’on souhaite détecter une vaste gamme de virus, il faut utiliser une multitude d’amorces différentes qui reconnaissent les sites spécifiques de chaque génome viral connu. Malheureusement, cette méthode de détection produit bien souvent des réactions croisées entre les nombreuses amorces (39, 143). De plus, comme elle se déroule en laboratoire et qu’elle nécessite plusieurs étapes de traitement des échantillons, elle n’est pas pratique si l’on souhaite détecter rapidement la présence de virus dans l’air d’un environnement suspecté puisqu’il y a un délais entre l’échantillonnage de ce dernier et l’obtention des résultats (39). En effet, il faut d’abord procéder à l’extraction des acides nucléiques et, au besoin, convertir les génomes d’ARN en acide désoxyribonucléique (ADN) avant de procéder à leur amplification. Pour sa part, la détection des virus par culture comporte également des limites puisqu’elle nécessite plusieurs jours, que le bon hôte doit être sélectionné pour permettre la croissance du ou des virus recherchés, que le milieu de culture est complexe et qu’il y a possibilité de contamination par
d’autres microorganismes. Les méthodes de détection utilisant des anticorps peuvent quant à elles s’avérer problématiques, étant donné qu’elles nécessitent l’utilisation d’un grand nombre d’anticorps et que des phénomènes de mutations génétiques ont être observés chez de nombreux virus comme l’influenza (103), modifiant ainsi la nature de leurs antigènes de surface et rendant nécessaire l’utilisation de nouveaux anticorps. La cytométrie en flux (45) et des méthodes de métagénomiques faisant appel au séquençage du matériel génétique contenu dans les échantillons d’air en vue de l’identification de tous les virus qu’ils contiennent sont de même de plus en plus utilisées de nos jours (13, 51, 110, 162). Cependant, elles requièrent de l’équipement spécialisé dispendieux et nécessitent plusieurs étapes pour le traitement des échantillons de même que pour l’analyse des résultats obtenus. Pour toutes les méthodes de détection mentionnées ci-dessus, les échantillons contenant les virus sont requis en grandes quantités. Puisque les virus sont présents en faible concentration dans l’air de l’environnment, cela constitue un obstacle majeur à l’identification de leur présence (50, 52).
0.4.2 Problématique des méthodes de détection actuelles
En raison du manque de connaissances à propos de l’effet des différents échantillonneurs d’air disponibles sur l’intégrité des particules virales à l’état de bioéaérosols et du problème concernant la détection de plusieurs virus dans l’air à l’état d’aérosols en un seul essai sensible et rapide, il est difficile d’évaluer efficacement le risque que représentent certaines maladies viruales transmises par voie aérienne affectant les humains et les animaux et de les contrôler (9, 93, 124, 155). En cas d’épidémie ou de pandémie, ce manque d’information constitue un problème majeur (39, 64, 143). Les événements survenus lors de la dernière décennie, comme les épidémies de grippe aviaire A H5N1 (6) et la pandémie d’influenza A H1N1 (124, 134), ont d’ailleurs mis en évidence l’importance de développer une nouvelle méthode qui permettrait de détecter de manière générique la présence d'agents viraux dans l’air environnant, puisqu’elle serait d'une grande utilité pour identifier des menaces potentielles (38, 39). La découverte d’une méthode permettant de détecter rapidement et facilement les virus présents dans l’air aiderait à comprendre leur propagation par voie aérienne, à prendre des mesures pour limiter celle-ci et pour diminuer grandement
11
le risque d’exposition aux virus. Par le fait même, cela contribuerait à réduire le nombre de cas d’infections (41, 61, 143, 155).
0.5 Détection générique des virus dans les bioaérosols
0.5.1 L’enzyme neuraminidase comme marqueur enzymatique
Il est connu que les virus possèdent diverses enzymes à leur surface et que celles-ci jouent un rôle dans leur cycle de multiplication (32, 58, 103, 124). Une détection d’un grand nombre de virus basée sur la présence de l'un de ces marqueurs comporterait deux principaux avantages. Tout d’abord, elle permettrait de détecter en un seul essai la présence d’une grande variété de virus. De plus, elle serait beaucoup plus rapide, simple et peu coûteuse, puisque l'extraction et la détection des acides nucléiques ne serait pas nécessaire (39, 143). De précédentes études ont démontré que l’enzyme neuraminidase peut être utilisée pour la détection de virus influenza en milieux de santé (1, 2, 121). Cette enzyme appartient à la classe E.C.3.1.18 des hydrolases, soit celle des exo-α-sialidase (21). Tel que mentionné précédement, ce facteur de virulence est impliqué dans les dernières étapes de la réplication des virus, où il facilite le relâchement des particules virales, ou virions, à la surface des cellules hôtes. Il contribue au détachement de ces bourgeons viraux par l’hydrolyse des acides sialiques présents à la surface de plusieurs types de cellules, ce qui détache les hémaglutinnines et donc les virions (1, 32, 58, 103, 133, 157). De plus, la neuraminidase virale favorise l’infection des voies respiratoires inférieures, puisqu’elle lyse le mucus bronchique qui a des propriétés antivirales. La neuraminidase est présente à la surface de plusieurs virus responsables d’infections respiratoires chez les humains et les animaux. Une liste des virus connus possédant une neuraminidase se retrouve dans le Tableau 1. Parmi ceux-ci figurent plusieurs Orthomyxoviridae, dont l'influenza (48, 103, 157), la majorité des Paramyxoviridae, tels que le Newcastle Disease Virus (NDV) (33, 37, 58), les virus parainfluenza, le métapneumovirus humain et le virus causant les oreillons. La neuraminidase est aussi présente à la surface de bactéries comme Clostridium perfringens (C.p.). Toutefois, cette enzyme n’est pas présente sur certains virus tels que le VRS et le virus de la rougeole, deux Paramyxoviridae (143).
Tableau 1: Principaux groupes de virus connus possédant une enzyme neuraminidase. (Tableau adapté de Turgeon et ses collègues) (143).
Familles Virus
Orthomyxoviridae Influenza de type A Influenza de type B
Paramyxoviridae
Virus parainfluenza humain Newcastle disease virus Virus des oreillons Virus Sendai
Virus simien de type 5
Virus de la peste des petits ruminants Virus Rinderpest
Virus Murayama Togaviridae Virus de la rubéole
0.5.2 Les substrats de la neuraminidase
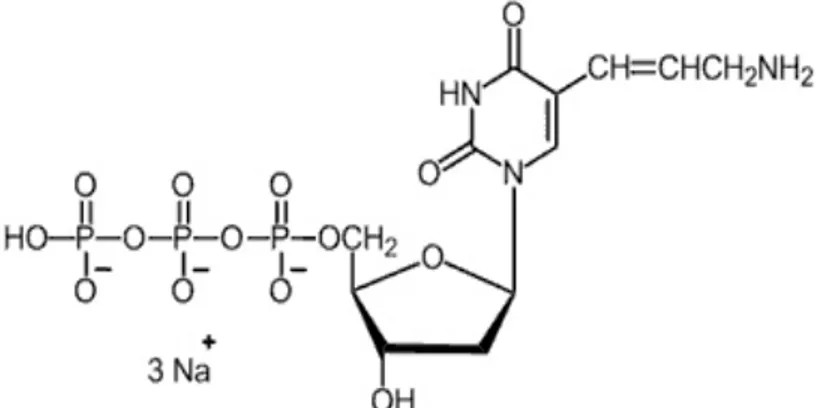
Dans la littérature, plusieurs substrats ont été décrits comme étant des marqueurs de l’activité neuraminidase. La plupart d’entre eux sont dérivés d’acides sialiques (Neu5Ac) et couplés avec des groupements chromogéniques comme le 1-acetyl-bromoindo-3-ol, le 5-bromo-4-chloro-indol-3-ol (X), le 5-bromo-4-chloro-3-indolyl-Gal (X-Gal) et le p-nitrophenolate (p-NP) (39, 56, 122), fluorogéniques comme le 4-methylumbelliferyl (4-MU) (39, 81, 86, 94, 127, 143) ou chemiluminescents tels que le spiroadamantyl-1,2-dioxetane (24, 39, 122, 143). Parmi les dérivés des Neu5Ac auxquels des groupements fluorogéniques ont été ajoutés, on retrouve aussi l’acide luciféryl N-acethylneuraminique (164), l’acide 2-(benzothiazol-2-yl)-4-bromophenyl 5-acetamido-3,5-dideoxy-α-D-glycero-D-galacto-2-nonulpyranosidonique (BTP3-Neu5Ac) (62, 128, 129, 130, 131). Le dérivé le plus connu et le plus largement utilisé dans la littérature est un substrat fluorogénique commercialisé par la compagnie Sigma-Aldrich (M8639, Sigma-Aldrich, Oakville, Ontario, Canada), l’acide 4-methylumbelliferyl-N-acetylneuraminique (4-MU-NANA) (Figure 4A). Ce substrat est un acide sialique constitué d’un acide neuraminique couplé au groupement fluorescent le 4–MU
13
(72). Lorsqu’il réagit avec la neuraminidase virale, son groupement 4-MU est hydrolysé et il y a émission d’une fluorescence que l’on peut détecter (56, 84, 94, 143) (Figure 5A). Cependant, puisque la majorité des substrats connus réagissent aussi avec les neuraminidases bactériennes comme celle de Clostridium perfringens et que des bactéries peuvent se trouver dans les échantillons d’air récoltés dans l’environnement, un substrat qui soit spécifique à celles des virus devait être trouvé.
Figure 4: Structure moléculaire des substrats de la neuraminidase.
Le NANA (A) est reconnu par l’ensemble des neuraminidases, tandis que le 4-MU-4-methoxy-Neu5Ac (B) est reconnu par les neuraminidases virales seulement.
0.5.3 Substrat spécifique à la neuraminidase virale
L’activité enzymatique de la neuraminidase virale a été identifiée comme un marqueur potentiel pour la détection d’un grand nombre de virus, à l’aide d’un substrat fluorogénique réagissant de manière spécifique avec la neuraminidase virale, l’acide luciféryl 4,7-di-O-méthyl-N-acétylneuraminique (164). Dans le cadre d’un précédent projet mené par note équipe de recherche et subventionné par la Defense Research and Development Canada (DRDC) (Suffield, Alberta, Canada), un autre substrat fluorogénique avait été identifié (143). Il s’agit de l’acide 4-O-methoxy-N-acéthylneuraminique (4-MU-4-methoxy-Neu5Ac) (Figure 4B), qui a été synthétisé par le chimiste Avraham Liav de la Colorado State University (Fort Collins, Colorado, États-Unis) (73). Ce susbtrat est identifique au 4-MU-NANA, à l’exception qu’un groupement méthyle, de formule moléculaire CH3, a été ajouté à l’atome d’oxygène situé sur le quatrième carbone du cycle. Lorsqu’il réagit avec la neuraminidase virale, tout comme dans le cas du 4-MU-NANA, son groupement 4-MU situé sur le deuxième carbone du cycle est hydrolysé et il y a émission d’une fluorescence que l’on peut détecter (72, 122) (Figure 5B). La spécificité du substrat 4-MU-4-methoxy-Neu5Ac
1 2 3 4 5 6 7 9 8 4-MU
pour les neuraminidases virales avait été testée et validée en présence de quelques virus et de nombreuses souches bactériennes possédant l’enzyme à leur surface (143). Une souche de NDV Hitchner B1 provenant d’un vaccin vivant (Wyeth Animal Health, Madison, New Jersey, États-Unis) avait été utilisée comme principal contrôle positif dans cette étude. Le NDV est un virus enveloppé à ARN monocaténaire appartenant à la famille des Paramyxoviridae et possédant une protéine hémaglutinnine-neuraminidase de surface responsable des activités neuraminidase et hémagglutinique (57). Dans les conditions expérimentales optimales de l’essai neuraminidase, il a été démontré que l’essai enzymatique basé sur l’activité de la neuraminidase est une bonne alternative à la PCR et à la RT-PCR en temps réel, puisqu’il est presqu’aussi sensible que ces dernières, qu’il permet d’obtenir un résultat plus rapidement et qu’il est moins dispendieux. De plus, les limites de détection des deux méthodes, soit les plus petites concentrations pouvant être détectées, n’ont qu’un seul logarithme de différence. Cela a pu être déterminé en comparant les valeurs de l’EID50/ml du NDV correspondant à la limite de détection de chacune des deux méthodes. Plus précisément, la EID50/ml est la dose requise pour infecter le moitié des œufs embryonnés de poule inoculés avec une certaine dilution de virus, selon la méthode développée par Reed et Muench (113). Celle-ci est détaillée dans la section « 3.2.3 Culture des virus et détermination de leur titre infectieux ». Les limites de détection des deux méthodes étaient respectivement de 3,3 x 104 EID50/ml pour l’essai neuraminidase et de 2,2 x 103 EID50/ml pour la RT-PCR en temps réel (143). Cette étude a démontré que l’essai neuraminidase constitue ainsi une méthode de détection plus rapide, plus simple et moins coûteuse que la RT-PCR en temps réel (143). Cependant, d'autres études étaient nécessaires pour évaluer si l’enzyme neuraminidase est stable et résiste aux processus d’aérosolisation et d'échantillonnage de l'air.
15
Figure 5: Schémas réactionnels de l’essai neuraminidase avec différents substrats. Réaction enzymatique de la neuraminidase avec le substrat 4-MU-NANA (A) et le substrat 4-MU-4-methoxy-Neu5Ac spécifique aux neuraminidases virales (B).
Lors de son incubation pendant quarante minutes à 37°C dans un tampon à pH 5,5, la neuraminidase hydrolyse le groupement fluorescent 4-MU des substrats qui, une fois clivé, émet de la fluorescence détectable aux longueurs d’ondes respectives d’excitation de 365 nm et d’émission de 445 nm. Lors de l’arrêt de la réaction avec un tampon basique de pH 10,7, la fluorescence du groupement est augmentée de cent fois et peut par la suite être lue au spectrophotomètre.
0.6 But du projet
Le présent projet de maîtrise avait pour but de valider l’utilisation de la neuraminidase comme marqueur enzymatique permettant la détection de virus dans l’air en un seul essai simple, rapide et abordable. Les résultats précédemment obtenus avec le NDV ont été confirmés avec d’autres modèles d’enzyme, soit une neuraminidase purifiée provenant de la bactérie Clostridium perfringens et des virus influenza A et B possédant une enzyme neuraminidase à leur surface. Le virus de l’influenza constitue un très bon modèle, puisqu’il est responsable de la grippe, une infection respiratoire très fréquente chez l’humain, et qu’il représente un problème majeur de santé publique à l’échelle planétaire (3, 20, 30, 124, 134, 163).
17
CHAPITRE 1. HYPOTHÈSE DE TRAVAIL
En se basant sur les faits exposés précédemment et d’après les résultats obtenus au cours d’une précédente étude (143), l’enzyme neuraminidase, qu’elle soit sous forme purifiée ou présente à la surface de souches de virus influenza, est résistante à l’aérosolisation et à l’échantillonnage et constitue un bon marqueur enzymatique pour la détection générique, rapide, simple et peu coûteuse d’une grande variété de virus dans des échantillons d’air, à l’aide du substrat commercial 4-MU-NANA qui reconnaît les neuraminidases bactériennes et virales.
CHAPITRE 2. OBJECTIFS SPÉCIFIQUES
1- À l’aide du traceur fluorescent Alexa fluor 555, caractériser de système de la chambre d’aérosolisation SCL-GenaMini et comparer l’efficacité de capture du SKC Biosampler® et des cassettes de 37 mm contenant des filtres en polycarbonate de porosité 0,8 µm utilisés pour échantillonner les aérosols dans cette chambre.
2- Aérosoliser la neuraminidase purifiée de Clostridium perfringens dans la chambre SCL-GenaMini et étudier l’effet de l’aérosolisation et de l’échantillonnage avec le SKC Biosampler® et des filtres en polycarbonate de porosité 0,8 µm hébergés dans des cassettes de 37 mm sur son activité enzymatique.
3- Aérosoliser une souche de virus influenza A H1N1 dans la chambre SCL-GenaMini et étudier l’effet de l’aérosolisation et de l’échantillonnage avec le SKC Biosampler® et des cassettes de 37 mm contenant des filtres en polycarbonate de porosité 0,8 µm sur l’activité de l’enzyme et l’infectivité du virus.
4- Adapter le wind tunnel aux expériences, caractériser le système et évaluer l’efficacité de capture du Corioli µ à l’aide du traceur fluorescent Alexa fluor 555.
5- Aérosoliser la neuraminidase purifiée de Clostridium perfringens dans le wind tunnel et étudier l’effet de l’aérosolisation et de l’échantillonnage avec le Coriolis µ sur l’activité de l’enzyme.
6- Aérosoliser les souches de virus influenza contenues dans le vaccin vivant FluMist® dans le wind tunnel et étudier l’effet de l’aérosolisation et de l’échantillonnage avec le Coriolis µ sur l’activité enzymatique des neuraminidases virales et l’infectivité des virus.
7- Étudier l’effet post-échantillonnage du SKC Biosampler®, des cassettes avec des filtres en polycarbonate de porosité 0,8 µm et du Coriolis µ sur l’activité enzymatique
19
de la neuraminidase purifiée de Clostridium perfringens, de la souche de virus influenza A H1N1 et des souches du vaccin FluMist®.
8- Vérifier s’il existe une corrélation entre l’activité neuraminidase et l’infectivité des virus influenza A H1N1 et des souches contenues dans le vaccin FluMist®.
CHAPITRE 3. MÉTHODOLOGIE
3.1 Traceur Alexa fluor 555
3.1.1 Solubilisation de la molécule
En raison de sa grande stabilité et de sa disponibilité commerciale, le sel fluorescent Alexa fluor 555 (Life Technologies, Burlington, Ontario, Canada) (Figure 6) a été choisi comme traceur pour caractériser les systèmes d’aérosolisation utilisés dans ce projet et étudier l’efficacité des échantillonneurs à collecter les aérosols. La molécule a été solubilisée à 10 µM dans un tampon phosphate de potassium (pH 6,0; 10 mM H2PO4; 25 mM KCl) et la solution a été entreposée à -20°C jusqu’à son utilisation, tel que recommandé par le manufacturier.
Figure 6: Structure moléculaire du sel fluorescent Alexa fluor 555. (Figure tirée de http://www.lifetechnologies.com/1/3/alexa-fluor-555).
3.1.2 Lecture de la fluorescence de l’Alexa fluor 555
La fluorescence de l’Alexa fluor 555 peut facilement et rapidement être détectée et quantifiée à l’aide d’un spectromètre réglé à une longueur d’onde d’excitation de 550 nm et à une longueur d’onde d’émission de 570 nm. Une particularité importante de cette molécule, qui justifie de plus le choix de son utilisation dans le cadre de ce projet, est que les spectres de ses longueurs d’ondes d’excitation et d’émission n’interfèrent pas avec ceux du groupement 4-MU libéré par le substrat lors de la réaction enzymatique avec la neuraminidase, qui sont respectivement de 365 et 445 nm. Ainsi, la molécule traceuse peut
21
être aérosolisée dans les systèmes en même temps que les modèles d’enzyme, puisque sa présence dans les échantillons collectés peut être détectée indépendamment de celle de la neuraminidase, et vice versa. Les mesures de fluorescence ont été effectuées en triplicata à l’aide de l’appareil Synergy H1 Hybrid Reader (BioTek, Highland Park, Vermont, États-Unis) sur chaque échantillon non dilué, ainsi que sur des dilutions de 10-1 et de 10-2, pour les échantillons provenant du nébuliseur avant et après chaque expérience. Les dilutions ont été faites dans le tampon phosphate de potassium, afin de s’assurer qu’il n’y avait pas une saturation de la fluorescence détectée dans les échantillons plus concentrés. La quantité de fluorescence détectée était donc directement proportionnelle à cette du traceur, puisqu’elle se trouvait dans la portion de linéarité de la courbe. Les données d'intensité de fluorescence relative (RFU) ont été enregistrées en utilisant la version 2.0 du logiciel Gen 5 fourni avec l'appareil. La moyenne du signal du bruit de fond provenant d’un blanc constitué de tampon phophate a été soustraite de la fluorescence moyenne détectée pour chaque échantillon.
3.2 Modèles d’enzyme neuraminidase
3.2.1 Neuraminidase purifiée de la bactérie Clostridium perfringens
Le premier modèle d’enzyme utilisé dans cette étude est une neuraminidase purifiée. Comme aucune neuraminidase virale n’est disponible commercialement, qu’il aurait été trop long et complexe d’en purifier en laboratoire puisque notre équipe ne possédait pas l’expertise nécessaire pour le faire, une neuraminidase purifiée provenant de la bactérie Clostridium perfringens et disponible commercialement sous forme lyophylisée (N2856, Sigma-Aldrich, Oakville, Ontario, Canada) a été utilisée. Étant non pathogène, il est beaucoup plus facile de travailler avec une enzyme purifiée pour l’optimisation des expériences car il n’est pas nécessaire de suivre des règles de confinement comme c’est le cas avec les virus. De plus, il était d’intérêt d’étudier l’effet de l’aérosolisation et de l’échantillonnage de l’enzyme neuraminidase seule et lorsqu’elle est présente à la surface d’un virus, puisque son comportement lors de l’aérosolisation, de son séjour dans l’air de son échantilonnage pouvent être différent dans les deux cas. L’enzyme a été remise en suspension à 250 µg/ml dans le tampon phosphate de potassium et conservée à 4°C jusqu’à son utilisation, tel que suggéré par le fabriquant. Selon celui-ci, cela favorise la conservation de
la neuraminidase à long terme, sur une période pouvant s’étendre jusqu’à 30 mois. Aucune variation de l’activité enzymatique n’a été observée suite à la resuspension et à l’entreposage de l’enzyme (expériences et résultats non montrés).
3.2.2 Souches de virus influenza utilisées comme modèles
Les autres modèles de neuraminidase choisis pour valider les résultats obtenus avec la neuraminidase purifiée sont les enzymes situées à la surface de différentes souches de virus influenza. Étant donné que seule la chambre SCL-GenaMini est de niveau de bioconfinement 2 puisqu’elle est située sous une enceinte biologique au laboratoire, que le wind tunnel est trop gros pour y entrer et qu’il est conséquemment en niveau de bioconfinement 1 seulement, des souches de niveau de biorisque correspondant aux niveaux de bioconfinement respectifs de ces deux chambres d’aérosolisation ont dû être utilisées pour les expériences réalisées. Le premier virus choisi est la souche d’influenza A H1N1 pr/8/1934 de niveau de confinement 2 (VR-95, American Type Culture Collection, Manassas, Virginie, États-Unis). Le virus a été initialement cultivé dans des œufs embryonnés de poule, tel que décrit plus loin dans la section « 3.2.3 Culture des virus et détermination de leur titre infectieux », afin d’obtenir une concentration élevée et a été entreposé à -86°C jusqu’à son utilisation. Les autres souches de virus influenza utilisées dans cette étude sont ainsi celles contenues dans le vaccin intranasal FluMist® de la saison 2012-2013 (MedImmune, Gaithersburg, Maryland, États-Unis). Ce vaccin administré en aérosols contient deux souches d’influenza A, soit H1H1 California/7/2009 et H3N2 Victoria/361/2011, ainsi qu’une souche d’influenza B Wisconin/1/2010. Ces souches sont des versions atténuées et adaptées au froid, c’est-à-dire qu’elles se multiplient à 28°C au lieu d’à 37°C. Elles sont ainsi de niveau de bioconfinement 1, puisqu’elles ne sont pas pathogènes pour l’être humain (92). Le contenu du vaccin a directement été utilisé pour ces expériences, étant donné que l’isolement d’une ou de plusieurs des souches qu’il contient s’est avéré infructueux. L’utilisation de l’influenza A H1N1 et du vaccin vivant FluMist® ont permis de comparer la résistance de la neuraminidase et de l’infectivité de différentes souches de virus influenza aux processus d’aérosolisation et d’échantillonnage.
23
3.2.3 Culture des virus et détermination de leur titre infectieux 3.2.3.1 Culture des virus dans des œufs embryonnés de poule
La souche d’influenza A H1N1 pr/8/1934 à amplifier et les échantillons d'air contenant ce virus ou les souches du vaccin vivant FluMist® immédiatement après leur échantillonnage ont été cultivés dans des œufs embryonnés de poule, qui étaient certifiés comme étant exempts de pathogènes (Agence canadienne d'inspection des aliments, Montréal, Québec, Canada). La méthode utilisée pour cultiver le NDV dans une précédente étude (143), à laquelle certaines modifications ont dû être apportées, a été employée. Pour chaque expérience d'aérosolisation et d’inoculation différente, un seul réplicat a été réalisé pour évaluer l'EID50/ml, en raison du nombre élevé d'œufs requis pour chaque culture et de la longueur de celles-ci. De plus, toutes les cultures virales ont été effectuées avec l’aide de la Dre Nathalie Turgeon. Suite à leur réception, les œufs ont d'abord été désinfectés à l'aide d'éthanol 70% et incubées dans un incubateur OVA-EASY (Brinsea Products Inc., Titusville, Floride, États-Unis) dix jours avant leur infection. La température de l'incubateur variait de 37,8°C à 38,2°C et son humidité relative était de l'ordre de 45%. Plusieurs dilutions de facteur dix ont été effectuées dans du tampon phosphate salin (PBS, pH 7,4; 137 mM NaCl; 10 mM H3PO4; 2,7 mM KCl) pour chaque échantillon et cinq œufs ont été utilisés pour chaque dilution d’un échantillon, tel que recommandé dans la littérature (113). Les dilution étaient respectivement de 10-4 à 10-7 pour les échantillons provenant du nébuliseur avant et après chaque expérience, ainsi que des tests d’inoculation des différents échantillonneurs. Elles étaient de 10-1 à 10-4 pour les échantillons recueillis suite à l’aérosolisation et à la collecte. Pour chaque culture dans les œufs embryonnés, cinq contrôles négatifs ont été réalisés avec du PBS. Après dix jours d’incubation, la cavité allantoïque des œufs a été inoculée selon les procédures de diagnostic standard de l'Union européenne (34) et ils ont été remis à l’incubation pendant trois jours supplémentaires. Les conditions de réincubation étaient les mêmes pour le virus de la grippe A H1N1 pr/8/1934, alors que pour les souches du vaccin FluMist®, la température était différente. Celle-ci devait être comprise entre 32,8°C et 33,2°C, car les souches comportent une mutation qui permet aux virus se répliquer seulement à ces températures (92). Après les trois jours supplémentaires passés à l’incubateur, le liquide amnio-allantoïque des œufs a été récolté, tel que décrit dans les procédures standard.
3.2.3.2 Calcul du titre infectieux des virus
L’EID50/ml, soit la dose requise pour infecter la moitié des œufs inoculés avec une certaine dilution de virus, a été déterminée selon la méthode de Reed et Muench décrite dans la littérature (113). Pour identifier les oeufs infectés, le dosage neuraminidase a d’abord été réalisée sur les échantillons, tel que décrit dans la section appelée « 3.2.4 Réaction enzymatique de l’essai neuraminidase », au lieu de faire un test d'hémagglutination. En effet, le test d’hémagglutination ne fonctionnait pas bien avec les souches du vaccin FluMist® et il a été observé par notre équipe que le test neuraminidase s’avère plus sensible pour détecter les virus dans le liquide amino-allantoïque infecté (expériences et résultats non montrés). Les échantillons ont également été répartis sur gélose au sang et incubées à 37°C pendant deux jours pour évaluer s’ils étaient contaminés par des bactéries ou des moisissures. Seuls les œufs pour lesquels les échantillons inoculés n’ont démontré aucune croissance de microorganismes ont été utilisées pour calculer le titre infectieux. Pour déterminer le titre infectieux de ce virus ainsi que des souches contenues dans chaque échantillon expérimental, la méthode de calcul développée par Reed et Muench a été utilisée (113). Pour ce, le pourcentage d’œufs infectés pour chaque dilution cultivée du virus ou d’un échantillon a d’abord été calculé. Puis, l’indice a été déterminé en divisant la soustraction de 50% au pourcentage des œufs infectés correspondant à la dilution immédiatement supérieure à 50% par cette même valeur à laquelle on a soustrait le pourcentage d'œufs infectés pour la dilution immédiatement inférieure à 50% à (Figure 7). Cet indice a été ajouté sous forme de décimales au facteur de dilution correspondant au taux d’infection des œufs embryonnés immédiatement supérieur à 50%. La valeur obtenue a été mise en exposant d’une base de 10 EID50/ml. Le titre infectieux obtenu pour le stock d’influenza A H1N1 pr/8/1934 utilisé dans les expériences était de 1x1010 EID50/ml (144).
Figure 7 : Équation du calcul de l’index par la méthode de Reed et Muench.
Le calcul de l’index est l’une des étapes requises pour la détermination du titre infectieux des virus cultivés dans des œufs de poule embryonnés. Pour le déterminer, une valeur de 50% est
25
d’abord soustraite au pourcentage des œufs infectés correspondant à la dilution immédiatement supérieure 50%. Ce résultat est ensuite divisé par le résultat de la soustraction du pourcentage des œufs infectés correspondant à la dilution immédiatement inférieure à 50% au pourcentage d'œufs infectés pour la dilution immédiatement supérieur à 50% (figure tirée de Reed et Muench) (113).
3.2.4 Réaction enzymatique de l’essai neuraminidase 3.2.4.1 Solubilisation du substrat 4-MU-NANA
Le substrat spécifique 4-MU-4-methoxy-Neu5Ac avait été synthétisé en laboratoire et n’est dispobile qu’en très faible quantité (73). Le substrat 4-MU-NANA a donc été utilisé pour les expériences de ce projet, en raison de sa disponibilité commerciale, de son faible coût, et puisqu’il donne des résultats équivalents au 4-MU-4-methoxy-Neu5Ac lors de l’essai neuraminidase (143). De plus, la neuraminidase purifiée de la bactérie Clostridium perfringens était utilisée comme modèle d’enzyme et celle-ci et les enzymes présentes à la surface des virus n’étaient pas étudiées en même temps dans les expériences. Le 4-MU-NANA a été solubilisé à 2 mM dans 1,022 ml de diméthylformamide et conservé à -20°C, jusqu'au moment du dosage enzymatique.
3.2.4.2 Essai neuraminidase et lecture de la fluorescence
L’essai neuraminidase a été effectué en triplicata, tel que décrit dans une précédente étude sur ce projet (143). Cependant, quelques modifications ont été apportées à la procédure (Figure 5A). D’abord, le tampon phosphate de potassium a été utilisé en remplacement du tampon MES (32 mM MES; 4 mM CaCl2; pH 5,5) précédemment utilisé. Celui-ci était recommandé par le fabriquant pour la neuraminidase de Clostridium perfringens. Il est aussi plus simple à fabriquer en grande quantité pour les expériences d’aérosolisation et d’échantillonage et se conserve à température ambiante, contrairement au tampon MES qui doit être entreposé à 4°C. Il a été vérifié que l’emploi du nouveau tampon dans l’essai neuraminidase n’affecte pas la réaction enzymatique et donne les mêmes résultats que lors de l’utilisation du tampon original (expériences et résultats non montrés). D’autres
changements ont été apportés pour augmenter d’un facteur dix la fluorescence détectée dans les échantillons, rendant conséquemment l’essai neuraminidase plus sensible (Figure 5A). Ainsi, un volume de 5 µl d’une solution fraîche de 4-MU-NANA à 100 µM dans le tampon phosphate de potassium préparée avant chaque expérience, à partir du stock conservé à -20°C, a été déposé dans chacun des puits d’une plaque 96 puits noire (7701-2350, Whatman, Piscataway, New Jersey, États-Unis). À ceux-ci, 45 µl de chacun des échantillons qui ont été ajoutés et mélangés par up and down. Par la suite, tel que décrit dans l’article, la plaque a été incubée à 37°C pendant 40 minutes. Après ce temps, la réaction enzymatique de la neuraminidase de Clostridium perfringens ou des enzymes présentes à la surface des virus avec le 4-MU-NANA a été arrêtée à l’aide d’un tampon glycine (0,1 N, pH 10,7) contenant 25% d’éthanol. Des volumes de 100 µl de ce tampon ont été ajoutés dans chaque puit avec une pipette multi-embouts et leur contenu a été mélangé par up and down. Le tampon glycine a de même permis d’augmenter de cent fois encore la fluorescence émise. Puis, la plaque a été lue avec le spectromètre Synergy H1 Hybrid Reader à des longueurs d’ondes d’excitation de 340 nm et d’émission de 460 nm. Les RFU ont été enregistrées à l’aide de la version 2.0 du logiciel Gen 5 fourni avec l’appareil et la moyenne du signal du bruit de fond provenant d’un blanc constitué de tampon phophate de potassium a été soustraite de la moyenne de la fluorescence détectée pour chaque échantillon. Trois dilutions de chacun des échantillons, soit 100, 10-1 et 10-2, ont été effectuées dans ce même tampon et ont été testées pour le contenu du nébuliseur, avant et après chaque expérience. Pour échantillons provenant de l’air échantillonné dans les chambres d’aérosolisation et des tests d’inoculation des échantillonneurs, ils ont été testés non dilués et à une dilution de 10-1. L’utilité de faire plusieurs dilutions pour chaque échantillon permettait de s’assurer que la réaction enzymatique, ainsi que la fluorescence détectée, n’étaient pas à saturation. La quantité de fluorescence détectée était donc directement proportionnelle à l’activité neuraminidase, puisqu’elle se trouvait dans la portion de linéarité de la courbe. La limite de détection de l’influenza A H1N1, soit la plus petite concentration en provenance d’un échantillon pouvant être détectée dans les trois puits lors d’un essai neuraminidase, a été évaluée à 1x105 EID50/ml par la Dre Nathalie Turgeon (expériences et résultats non montrés) (144).