Université de Sherbrooke
Caractérisation de la signature en microARN des lipoprotéines de haute densité
Par
Véronique Desgagné
Programme de doctorat en biochimie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de philosophiae doctor (Ph.D.)
en biochimie
Sherbrooke, Québec, Canada Octobre 2020
Membres du jury d’évaluation
Pre Michelle Scott, Département de biochimie et de génomique fonctionnelle, Faculté de médecine et des sciences de la santé, Université de Sherbrooke
Pr Luigi Bouchard, Département de biochimie et de génomique fonctionnelle, Faculté de médecine et des sciences de la santé, Université de Sherbrooke
Pr André C. Carpentier, Département de médecine, Service d'endocrinologie, Faculté de médecine et des sciences de la santé, Université de Sherbrooke
Pr Patrick Provost, Département de microbiologie-infectiologie et d'immunologie, Faculté de médecine, Université Laval
RÉSUMÉ
Caractérisation de la signature en microARN des lipoprotéines de haute densité Par
Véronique Desgagné
Programme de doctorat en biochimie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de philosophiae doctor (Ph.D.) en biochimie, Faculté de médecine et des sciences
de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4 Le cholestérol des lipoprotéines de haute densité (HDL-C) est un marqueur inverse et indépendant du risque cardiovasculaire. Cependant, l’échec des essais thérapeutiques visant à réduire le risque cardiovasculaire par l’augmentation du niveau de HDL-C suggère que la fonctionnalité du HDL importe davantage que son contenu en cholestérol. Le HDL exerce divers effets cardioprotecteurs, incluant la promotion du transport à rebours du cholestérol ainsi que la diminution de l’inflammation et de l’oxydation, et transporte des microARN (miARN) fonctionnels en circulation, lesquels sont transférables à des cellules cibles in vitro. Les miARN sont de courtes (~22 nucléotides) molécules d’ARN simple-brin non-codant contribuant à la régulation post-transcriptionnelle de ~60% des gènes humains en s’hybridant à la région 3’ non-traduite (3’ UTR) de l’ARNm cible; inhibant sa traduction et favorisant sa dégradation. Les objectifs de cette thèse étaient d’identifier les miARN transportés par les HDL dans différentes conditions métaboliques et leur association avec des marqueurs de risque cardiovasculaire, puis de caractériser le microtranscriptome des HDL, lequel pourrait contribuer à médier ses fonctions cardioprotectrices.
Suivant une approche par gène candidat, miR-223-3p et miR-135a-3p ont été quantifiés par RT-qPCR dans les HDL d’hommes sains ayant complété une étude nutritionnelle sur les acides gras trans (AGT). Les changements de concentration de ces miARN en réponse à la diète ont été associés aux variations de marqueurs de risque cardiovasculaire. Suivant le même devis, 87 miARN ont été quantifiés dans les HDL et le plasma, dont 7 miARN ont été trouvés enrichis dans les HDL et associés aux voies biologiques liées au métabolisme des lipides. De plus, la proportion de certains miARN plasmatiques transportés par les HDL était particulièrement sensible à la diète. Finalement, le profil en miARN des HDL a été caractérisé par séquençage de nouvelle génération chez des femmes et hommes sains et celui-ci s’est avéré distinct de celui du plasma et ne variait pas selon le sexe.
Ces résultats suggèrent que la signature en miARN des HDL est distincte de celle du plasma, indépendante du sexe et sensible aux changements métaboliques comme ceux induits par la consommation d’une diète riche en AGT. Le contenu en miARN des HDL pourrait vraisemblablement contribuer aux fonctions physiologiques de cette lipoprotéine.
Mots clés : HDL, miARN, plasma, acides gras trans, RT-qPCR, séquençage de nouvelle génération, cholestérol, cardiovasculaire.
SUMMARY
Characterization of the high-density lipoprotein microtranscriptome By
Véronique Desgagné
Doctorate program in biochemistry
Thesis presented at the Faculty of medicine and health sciences to obtain philosophiae doctor (Ph.D.) degree in biochemistry, Faculty of medicine and health sciences, Université
de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4
High-density lipoprotein cholesterol (HDL-C) levels are independent and recognized inverse marker of cardiovascular risk. However, failure of recent clinical trials to efficiently reduce the cardiovascular risk through pharmaceutical interventions increasing HDL-C levels suggests that the HDL’s cardioprotective effects are more likely due to their functionality rather than their cholesterol content. HDL has several cardioprotective effects, including its promotion of reverse cholesterol transport as well as its anti-inflammatory and anti-oxidative properties, and was found to transport microRNAs (miRNAs) in the blood stream and deliver them to recipient cells in vitro. MiRNAs are ~22 nucleotides non-coding, single-stranded RNA molecules contributing to the post-transcriptional regulation of ~60% human genes through hybridization to the mRNA 3’ untranslated region (UTR); inhibiting its translation and promoting its degradation. The objectives of this thesis were to identify HDL-carried miRNAs in diverse metabolic conditions, to assess their relationship with cardiovascular risk markers and to characterize the HDL’s microtranscriptome, which might contribute to the HDL’s cardioprotective functions.
Following a candidate gene approach, miR-223-3p and miR-135a-3p were quantified by RT-qPCR in purified HDL from healthy men who completed a nutritional trial on trans fatty acids (TFAs). Diet-induced variations in these HDL-carried miRNA concentrations were associated with variations in cardiovascular risk markers. Following the same design, 87 miRNAs were quantified (miScript RT-qPCR array), from which 7 miRNAs were found enriched in purified HDLs compared to plasma and these miRNAs were associated with biological pathways related to lipids metabolism. Moreover, the contribution of some miRNAs to the plasmatic pool was particularly affected by the consumption of a diet rich in TFAs. Finally, the HDL-carried miRNA profile was characterized by next generation sequencing in healthy women and men and was found distinct from that of plasma and similar in both sexes.
These results suggest that the HDL’s miRNA signature is distinct from that of plasma, independent of sex and sensitive to metabolic changes such as those induced by consumption of a diet rich in TFAs. The miRNA content of HDL might likely contribute to the physiological functions of this lipoprotein.
Keywords: HDL, miRNA, plasma, trans fatty acids, RT-qPCR, next generation sequencing, cholesterol, cardiovascular.
TABLE DES MATIÈRES
Résumé………..i
Summary……….…ii
Table des matières………...iii
Liste des figures………...vii
Liste des tableaux...……...……….…. ix
Liste des abréviations………...xi
1. Introduction………... 1
1.1 Maladies cardiovasculaires et leurs facteurs de risque... 1
1.2 Acides gras trans... 3
1.2.1 Caractéristiques et sources d’acides gras trans...3
1.2.2 Consommation d’AGT au Canada et recommandations actuelles...6
1.2.3 AGT et risque cardiovasculaire...7
1.2.4 AGTi vs AGTr : risque cardiovasculaire équivalent?...11
1.2.5 Effets athérogènes des AGT...12
1.2.6 Effets physiopathologiques des AGT sur le métabolisme des lipides...15
1.3 Métabolisme des lipoprotéines...19
1.3.1 Voie exogène...24
1.3.2 Voie endogène...25
1.3.3 Transport à rebours du cholestérol...26
1.4 La lipoprotéine de haute densité...31
1.4.1 HDL-C et risque cardiovasculaire...31
1.4.1.1 Données épidémiologiques...31
1.4.1.2 Données génétiques...36
1.4.1.3 Revers thérapeutiques ciblant le HDL-C et nouveaux espoirs...38
1.4.2 Propriétés physicochimiques et composition du HDL...46
1.4.3 Fonctionnalité de la lipoprotéine de haute densité...54
1.4.3.1 Efflux de cholestérol...55
1.4.3.2 Effets antioxydants des HDL...59
1.4.4 Effet du sexe sur le profil lipoprotéique et la fonctionnalité de la lipoprotéine
de haute densité...65
1.4.5 Dysfonction de la lipoprotéine de haute densité...68
1.5 Les MiARN…...70
1.5.1 Contexte génomique...71
1.5.2 Biogénèse des miARN...72
1.5.2.1 Voie canonique de la biogenèse des miARN...73
1.5.2.2 Voies non canoniques de la biogenèse des miARN...77
1.5.3 Régulation de l’expression et stabilité des miARN...80
1.5.4 Fonctions régulatrices des miARN...83
1.5.4.1 Fonction canonique...83
1.5.4.2 Fonctions non canoniques...89
1.5.4.2.1 Activation de la traduction...90
1.5.4.2.2 Fonctions nucléaires des miARN...92
1.5.4.2.2.1 Régulation des ARN non-codants...95
1.5.4.2.2.2 Régulation de la transcription génique et remodelage de la chromatine...99
1.5.4.2.3 Communication intercellulaire...104
1.5.5 Rôles biologiques des miARN dans le métabolisme des lipides...110
1.6 Les miARN transportés par les lipoprotéines...117
1.6.1 La concentration en miARN associés aux HDL est altérée par la maladie et la diète...117
1.6.2 Transfert de miARN aux lipoprotéines de haute densité...127
1.6.3 Livraison de miARN associés aux lipoprotéines de haute densité fonctionnels à des cellules cibles...132
1.6.4 miARN associés à d’autres lipoprotéines...138
2. Problématique, hypothèses et objectifs...142
3. Article 1: « Variations in HDL-carried miR-223 and miR-135a concentrations after consumption of dietary trans fat are associated with changes in blood lipid and inflammatory markers in healthy men - an exploratory study»...145
3.2 Résumé...145
3.3 Article...147
4. Article 2: « Changes in HDL-carried miRNA contribution to the plasmatic pool after consumption of dietary trans fat in healthy men »...184
4.1 Avant-propos...184
4.2 Résumé...184
4.3 Article...186
5. Article 3: «Human high-density lipoprotein microtranscriptome is unique and suggests an extended role in lipid metabolism » ...233
5.1 Avant-propos...233
5.2 Résumé...233
5.3 Article...235
6. Discussion...311
6.1 La signature en miARN des HDL est distincte de celle du plasma et un sous-ensemble de miARN plasmatiques est enrichi aux HDL...312
6.2 Les miARN préférentiellement portés par les HDL dans le plasma sont particulièrement, mais non exclusivement, sensibles à la consommation d’acides gras trans...315
6.3 Les miARN préférentiellement portés par les HDL et affectés par la consommation d’acides gras trans sont enrichis dans les voies biologiques liées au métabolisme des acides gras ...318
6.4 La variation de concentration de HDL-miARN en réponse à la consommation d’acides gras trans est associée à la variation de marqueurs de risque cardiovasculaire...322
6.5 Des miARN associés aux HDL sont affectés différemment par la consommation d’acides gras trans provenant des ruminants et de l’industrie...328
6.6 La signature en miARN des HDL est similaire entre les sexes...330
6.7 Les HDL purifiés contiennent d’autres biotypes de petits ARN...331
6.8 Les HDL purifiés contiennent des séquences ne s’alignant pas au génome humain...332
6.9 Forces et limitations...332
6.10 Conclusion...335
6.11 Perspectives...335
LISTE DES FIGURES
Figure 1 : Principales étapes impliquées dans le développement de la plaque d’athérome...2
Figure 2 : Structure moléculaire des acides gras en fonction de leur degré de saturation et de leur conformation...4
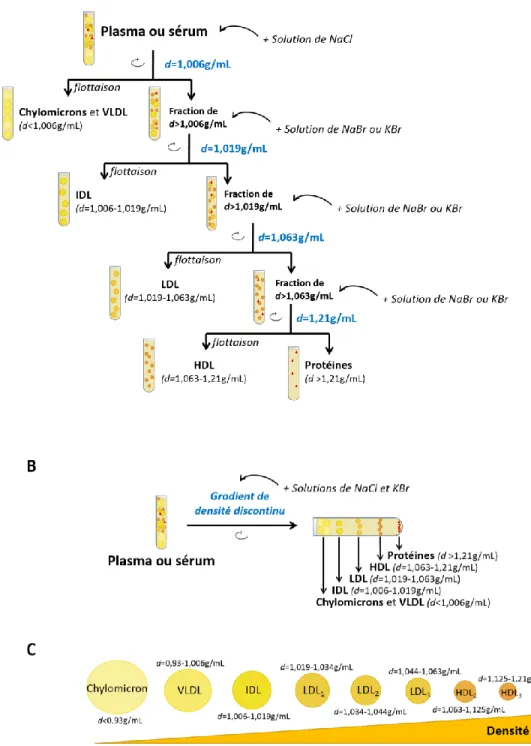
Figure 3 : Classification des lipoprotéines en fonction de leur densité...21
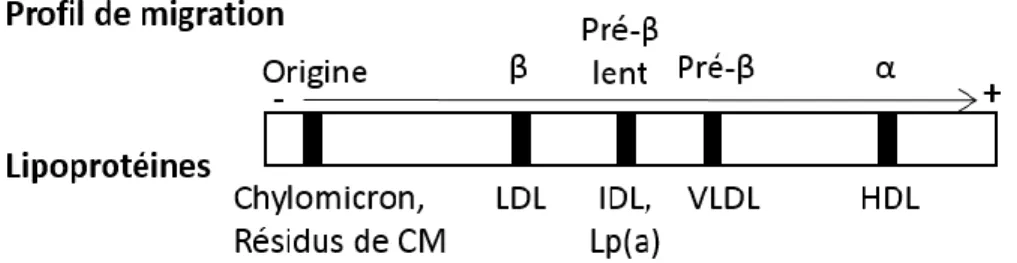
Figure 4 : Profil de migration électrophorétique des lipoprotéines...22
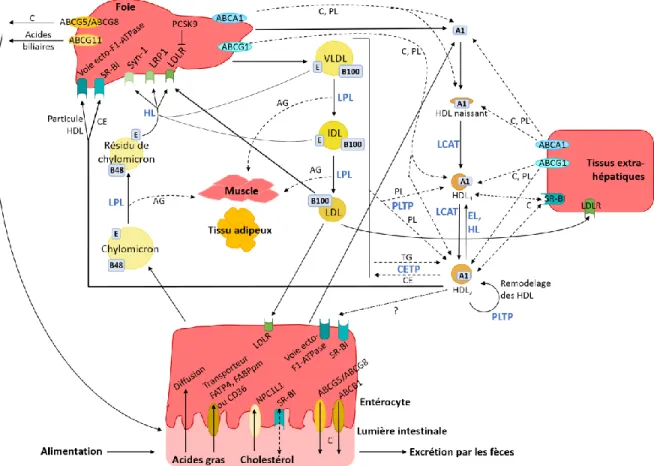
Figure 5 : Métabolisme des lipoprotéines...23
Figure 6 : Représentation de principaux lipides et protéines associés aux HDL et leur enrichissement respectif dans les sous-populations HDL2 et HDL3...53
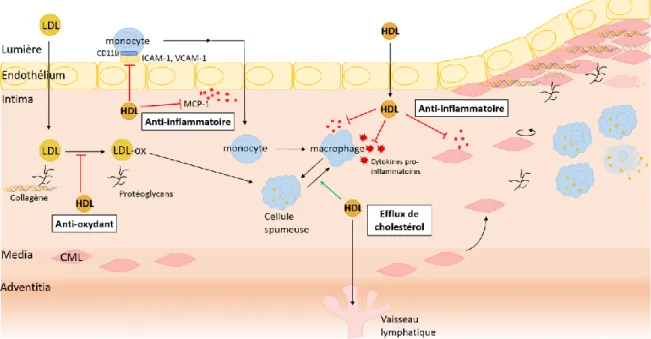
Figure 7 : Fonctions d’efflux de cholestérol, antioxydantes et anti-inflammatoires des HDL liées à la prévention de l’athérosclérose...54
Figure 8 : Contextes génomiques dans lesquels sont retrouvés les gènes codant pour des miARN...72
Figure 9 : Voies de biosynthèse canonique et non-canoniques des miARN...74
Figure 10 : Modèle canonique de l’interaction d’un miARN à son site de liaison présent au sein de son ARNm cible...85
Figure 11 : Mécanisme proposé de répression de la traduction et de déstabilisation de l’ARNm par les miARN...88
Figure 12 : Fonctions attribuables aux miARN...90
Figure 13 : Exemples illustrant la capacité des miARN à stimuler la traduction...92
Figure 14 : Voies proposées d’import nucléaire des miARN matures...94
Figure 15 : Exemples illustrant la capacité des miARN à réguler la stabilité des lncARN dans le noyau et le cytoplasme...97
Figure 16 : Exemples illustrant la capacité des miARN à réguler la stabilité des pri-miARN au noyau...98
Figure 17 : Modèles d’interaction d’un miARN mature à la région promotrice d’un gène...99
Figure 18 : Modèle de régulation de la transcription génique par les miARN...103
Figure 19 : Communication intercellulaire par les miARN...105
Figures de l’article 1: Figure 1: Spearman’s Rank Correlation between rate of change in HDL-carried miRNA concentrations and HDL-related phenotypes following a diet rich in TFAs...157
Figure 2: Spearman’s Rank Correlation between rate of change in HDL-carried has-miR-223-3p concentration and RC in inflammatory marker C-reactive protein concentration following the rTFA diet...159
Figure 3: Spearman’s Rank Correlation between rate of change (RC; %) in HDL-carried miRNA concentration and blood lipid profile (other than HDL)-related phenotypes following a diet rich in TFAs...160
Supplemental figure 1: Variation in HDL-carried hsa-miR-223-3p and hsa-miR-135a-3p relative concentrations between diets...177
Supplemental Figure 2: diagram showing the flow of participants through each stage of the study...178
Supplemental Figure 3: Demonstration of the HDL purity by electrophoretic migration of lipoproteins from plasma samples and HDL fractions on a HYDRAGEL 15 LDL/HDL CHOL Direct agarose gel...179 Supplemental Figure 4: Assessment of the co-purification of the HDLs with exosomes by anti-CD63 ExoELISA...180 Figures de l’article 2:
Figure 1: Comparison of the plasmatic and purified HDL miRNA profile...200 Figure 2: Frequency of the estimated contribution of the HDL-carried miRNAs to the plasmatic miRNA pool following the control (low TFA) diet...202 Figure 3: Effects of consumption of a diet rich in TFAs on the HDL-carried miRNA profile...203 Figure 4: Effects of consumption of a diet rich in TFAs on the contribution of HDL-carried miRNAs to the plasmatic miRNA pool...206 Figure 5: Heatmaps representing the KEGG pathways in which were enriched the genes targeted by the HDL-carried miRNAs...207 Supplemental Figure 1: Pearson’s correlation between data measured by the miScript miRNA RT-qPCR arrays and those measured by Taqman individual miRNA RT-qPCR assays for the post-diet HDL-carried miRNAs...224 Figures de l’article 3:
Figure 1: Reads alignment to the human genome...251 Figure 2: Average number of miRNAs detected in purified HDLs and plasma samples from women and men couples at detection thresholds of ≥1 RPM and ≥5 RPM...253 Figure 3: Top 20 most abundant miRNAs found in purified HDLs and plasma samples from women and men couples...254 Figure 4: Characterization of miRNA profile differences between purified HDLs and plasma...255 Supplemental Figure 1: Diagram showing the study design as well as anthropometric measurements and analyses performed in each sampled blood fractions...273 Supplemental Figure 2: Demonstration of the HDL purity by electrophoretic migration of lipoproteins from plasma samples and isolated lipoprotein fractions on a HYDRAGEL 15 LDL/HDL CHOL Direct agarose gel...274 Supplemental Figure 3: Detection of the exosomal antigen CD9 in purified HDL and plasma samples by Western blot...275 Supplemental Figure 4: Quantification of exosomes in purified HDL and plasma fractions by anti-CD9 ELISA...276 Supplemental Figure 5: Small RNA-sequencing data processing workflow...277 Supplemental Figure 6: Characterization of the reads mapping to the human genome...278 Supplemental Figure 7: Difference in HDL-carried miRNA profile between men and women...280 Supplemental Figure 8: Difference in plasmatic miRNA profile between men and women...281
LISTE DES TABLEAUX
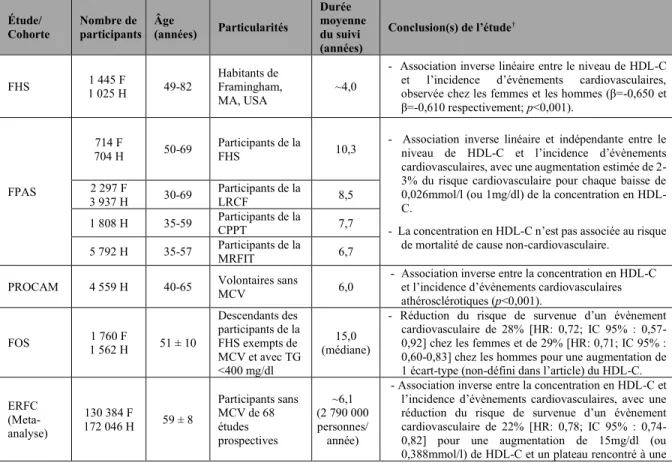
Tableau 1 : Caractéristiques générales des lipoprotéines...20 Tableau 2 : Caractéristiques d’études ayant évalué l’association entre la concentration en HDL-C et le risque cardiovasculaire...32 Tableau 3 : Exemples d’agents thérapeutiques affectant le niveau de HDL-C développés dans le but réduire le risque cardiovasculaire...39 Tableau 4 : Sous-populations de HDL isolées en fonction de leurs propriétés physicochimiques...46 Tableau 5 : miARN jouant un rôle dans la régulation du métabolisme des lipides...110 Tableau 6 : miARN associés aux HDL dont la concentration est altérée chez les patients atteints d’une maladie cardiovasculaire ou métabolique comparativement à des sujets sains...119 Tableau 7 : miARN associés aux LDL et aux IDL dont la concentration est altérée chez les patients atteints d’une maladie cardiovasculaire comparativement à des sujets sains...139
Tableaux de l’article 1:
Table 1: Differences in anthropometric characteristics, blood lipid profile, inflammatory marker and miRNA concentrations of the 9 subjects following each of the 3 experimental diets...153 Table 2: Differences in mean HDL-carried hsa-miR-223-3p and hsa-miR-135a-3p relative concentrations between the 3 experimental diets...155 Supplemental Table 1: Statistical analyses results (raw results only) before and after exclusion of the participant who reported an
infection during the control diet...181 Supplemental Table 2: Spearman’s rank correlation analysis results adjusted or not for HDL-ApoA1 concentration and multiple
testing...182 Supplemental Table 3: Ultracentrifugation parameters for lipoproteins isolation...183 Tableaux de l’article 2:
Table 1: Top-10 of the most concentrated miRNAs carried by HDL following the control diet...199 Table 2: Differentially concentrated miRNAs in purified HDLs among the 3 experimental diets, adjusted or not for multiple testing...204 Table 3: HDL-carried miRNAs differentially contributing to the total plasmatic pool among the 3 experimental diets, adjusted or not for multiple testing...205 Supplemental Table 1: Identification of the miRNAs quantified on the custom miScript miRNA PCR array and included in the statistical analysis...225 Supplemental Table 2: Coefficients of variation (CV) between replicates obtained from the miScript RT-qPCR arrays...227 Supplemental Table 3 : miScript RT-qPCR Array quality control assessment...227 Supplemental Table 4: Coefficients of variation (CV) between replicates obtained from the Taqman individual RT-qPCR assays...228 Supplemental Table 5: Top-10 of the most concentrated miRNAs in plasma following the control diet...228
Supplemental Table 6: KEGG pathways in which were enriched the genes targeted by miRNAs showing differences in their concentrations in purified HDLs or in their contribution to the plasmatic miRNA pool, as well as miRNAs enriched in HDLs...229 Tableaux de l’article 3:
Table 1: Differences in anthropometric characteristics and biochemical markers between women and men of the UNISON cohort...250 Table 2: Top 5 most differentially abundant miRNAs in purified HDLs compared to plasma...256 Table 3: Top 5 biological pathways mostly enriched for miRNAs found more and less abundant in HDLs compared to plasma as well as miRNAs abundant in purified HDLs and plasma...257 Supplemental Table 1: Ultracentrifugation parameters for lipoproteins isolation...282 Supplemental Table 2: Number of miRNAs detected in purified HDLs and plasma...283 Supplemental Table 3: miRNAs detected in all HDLs samples at a detection threshold of ≥1 RPM...283 Supplemental Table 4: miRNAs detected in all plasma samples at a detection threshold of ≥1 RPM...286 Supplemental Table 5: Top 50 most abundant miRNAs found in HDLs purified from women and men...289 Supplemental Table 6: Top 50 most abundant miRNAs found in plasma from women and men...290 Supplemental Table 7: Difference assesment in miRNA abundance in purified HDLs compared to plasma samples using the DESeq2 R package...291 Supplemental Table 8: Difference assesment in miRNA abundance in purified HDLs from men compared to those from women using the DESeq2 R package...297 Supplemental Table 9: Difference assesment in miRNA abundance in plasma samples from men compared to those from women using the DESeq2 R package...302 Supplemental Table 10: Biological pathways enriched for miRNAs abundant in purified HDLs and plasma as well as miRNAs found up-regulated and down-regulated in HDLs compared to plasma...307
LISTE DES ABRÉVIATIONS
3’ UTR 3’ non-traduite
ABCA1 ATP binding cassette subfamily A member 1 ABCB1 ATP binding cassette subfamily B member 1 ABCB11 ATP-binding cassette subfamily B member 11 ABCG1 ATP binding cassette subfamily G member 1 ABCG4 ATP binding cassette subfamily G member 4 ABCG5 ATP binding cassette subfamily G member 5 ABCG8 ATP binding cassette subfamily G member 8 ABCG11 ATP binding cassette subfamily G member 11 ACACA Acetyl-CoA carboxylase alpha
ACAT1 Acyl CoA cholesterol acyltransferase 1 ACAT2 Acyl CoA cholesterol acyltransferase 2 ADAR Adenosine deaminase RNA specific AGI Acides gras insaturés de conformation cis
AGO Argonaute
AGPAT1 1-Acylglycerol-3-Phosphate O-Acyltransferase 1 AGS Acide gras saturé
AGT Acides gras insaturés de conformation trans
AGTi Acides gras insaturés de conformation trans d'origine industrielle AGTr Acides gras insaturés de conformation trans provenant des ruminants AHR Aryl Hydrocarbon Receptor
AI Angine instable
Alix Apoptosis-Linked Gene 2-Interacting Protein X AMPc Adénosine monophosphate cyclic
ANGPTL3 Angiopoietin Like 3
AP Acide phosphatidique
Apo(a) Apolipoprotéine (a) ApoA1 Apolipoprotéine A1 ApoA2 Apolipoprotéine A2 ApoA4 Apolipoprotéine A4 ApoB100 Apolipoprotéine B100 ApoB48 Apolipoprotéines B48 ApoC1 Apolipoprotéine C1 ApoC2 Apolipoprotéine C2 ApoC3 Apolipoprotéine C3 ApoE Apolipoprotéine E ApoM Apolipoprotéine M
ARIC Atherosclerosis Risk in Communities
ATP8B1 ATPase aminophospholipid transporter class 1 type 8B member 1 AVC Accident vasculaire cérébral
BCL6 B-Cell CLL/Lymphoma 6
C/EBPα CCAAT/Enhancer Binding Protein Alpha C/EBPβ CCAAT/Enhancer Binding Protein Beta C19MC Chrmosome 19 miRNA Cluster
CCHS Copenhagen City Heart Study CCL2 Chemokine (C-C Motif) Ligand 2 CD11b CD11 Antigen-Like Family Member B CD36 Cluster determinant 36
CE Cholestérol estérifié
CETP Cholesteryl ester transfert protein CGPS Copenhagen General Population Study CIDEC Cell Death Inducing DFFA Like Effector C CLOCK Clock Circadian Regulator
CM Chylomicron
CMLV Cellules musculaires lisses vasculaires CNOT1 CCR4-NOT Transcription Complex Subunit
CPPT Lipid Research Clinics Coronary Primary Prevention Trial CPT1A Carnitine palmitoyltransferase 1A
CRAT Carnitine O-Acetyltransferase
CREB Cyclic AMP-Responsive Element-Binding Protein CROT Carnitine O-octanoyltransferase
CRP Protéine C-réactive CT Cholestérol total
CYP7A1 Cholesterol 7α-hydroxylase DBR1 Debranching RNA Lariats
DCP2 Decapping MRNA 2
DDX6 DEAD-Box Helicase 6
DGAT1 Diacylglycerol O-Acyltransferase 1 DGAT2 Diacylglycerol O-Acyltransferase 2 DGCR8 DGCR8 microprocessor complex subunit Dicer Dicer 1 Ribonuclease III
Drosha Drosha Ribonuclease III
DT1 Diabète de type 1
EDC4 Enhancer Of MRNA Decapping 4
EFNA1 Ephrin A1
eIF4E Eukaryotic Translation Initiation Factor 4E
eIF4G Eukaryotic Translation Initiation Factor 4 Gamma 1
EL Lipase endothéliale
FABPpm Fatty acid binding protein plasma membrane
FAO Organisation des Nations unies pour l'alimentation et l'agriculture FASN Fatty Acid Synthase
FATP4 Fatty acid transport protein 4
FBXW7 F-Box And WD Repeat Domain Containing 7 FHS Framingham Heart Study
FOXA2 Forkhead Box A2
FOXO3 Forkhead Box O3
FXR Farnesoid X Receptor
FXR1 Fragile-X mental retardation protein 1 G6PC Glucose-6-Phosphatase Catalytic Subunit
GPAM Glycerol-3-Phosphate Acyltransferase, Mitochondrial GW182 Glycine-tryptophan protein of 182 kDa
H3K4me3 Triméthylation de la lysine 4 de l’histone H3 H3K9me2 Diméthylation de la lysine 9 de l’histone H3
HADHB Hydroxyacyl-CoA dehydrogenase/3-ketoacyl-CoA thiolase/enoyl-CoA hydratase beta subunit HCAEC Cellules endothéliales des artères coronaires humaines
HDL Lipoprotéine de haute densité
HDL-C Cholestérol des lipoprotéines de haute densité
HDLg HDL glyqué
HDL-miARN miARN associés aux HDL
HDL-ox HDL oxydé
HIF1A Hypoxia Inducible Factor 1 Subunit Alpha
HL Lipase hépatique
HMGCR 3-hydroxy-3-methyglutaryl-CoA reductase HMGCS1 3-hydroxy-3-methylglutaryl-CoA synthase 1 HMGCS2 3-hydroxy-3-methylglutaryl-CoA synthase 2 HNF4α Hepatocyte Nuclear Factor 4 Alpha
hnRNPA2B1 Heterogeneous nuclear ribonucleoprotein A2B1 HSC70 Heat shock cognate 70
HSP90β Heat shock protein 90-beta HSPG Heparan sulfate proteoglycan
HUVEC Cellules endothéliales de la veine ombilicale humaine ICAM-1 Intercellular adhesion molecule 1
IDH1 Isocitrate Dehydrogenase (NADP(+)) 1 IDL Lipoprotéine de densité intermédiaire IDL-miARN miARN associés aux IDL
IL-1 Interleukine 1
IL-12p40 Interleukine 12 Subunit p40 IL-6 Interleukine-6
IMC Indice de masse corporelle INSIG-2 Insulin induced gene 2 INSR Insulin receptor
IRS1 Insulin receptor substrate 1 IRS2 Insulin receptor substrate 2 IsomiR Isoforme de miARN
IκB Inhibitor of NF-κB
KATP Canaux potassiques ATP-dépendants
KO Knock out
LCAT Lecithin-cholesterol acyltransferase LDL Lipoprotéine de faible densité
LDL-C Cholestérol des lipoprotéines de faible LDL-miARN miARN associés aux LDL
LDL-ox Lipoprotéine de faible densité oxydée LDLR Low density lipoprotéine receptor
LDLRAP1 Low Density Lipoprotein Receptor Adaptor Protein 1 lncARN Long ARN non-codants
Lox-1 Oxidized Low Density Lipoprotein Receptor 1 Lp(a) Lipoprotéine (a)
LPGAT1 Lysophosphatidylglycerol Acyltransferase 1 LPL Lipoprotéine lipase
LPS Lipopolysaccharides
LRCF Lipid Research Clinics Prevalence Mortality Follow-up Study LRP1 LDL receptor-related protein 1
LXR Liver X Receptor
LXRE LXR response element LXRα Liver X Receptor Alpha
MCP-1 Monocyte Chemoattractant Protein-1 MCS Maladie coronarienne stable
MCV Maladie cardiovasculaire MED13 Mediator Complex Subunit 13
miARN MicroARN
MPO Myéloperoxidase
MRFIT Multiple Risk Factor Intervention Trial
MTP Microsomal Triglyceride Transfer Protein (protein) MTTP Microsomal Triglyceride Transfer Protein (gene) nCEH Neutral cholesterol ester hydrolase
NDST1 N-Deacetylase And N-Sulfotransferase 1 NES Signal d’export nucléaire
NFYC Nuclear Transcription Factor Y Subunit Gamma NF-κB Nuclear Factor Kappa B Subunit 1
NLS Signal de localisation nucléaire
NO Oxyde nitrique
NPC1 Niemann-Pick Disease type C1
NPC1L1 NPC1 like intracellular cholesterol transporter 1
NPM1 Nucleophosmine 1
NRP1 Neuropiline-1
NSF N-Ethylmaleimide Sensitive Factor, Vesicle Fusing ATPase nSMase2 Neutral Sphingomyelinase 2
OMS Organisation Mondiale de la Santé ORP9 Oxysterol Binding Protein Like 9 OSBPL6 Oxysterol Binding Protein Like 6
p110α Phosphatidylinositol-4,5-Bisphosphate 3-Kinase Catalytic Subunit Alpha P2Y13 Purinergic Receptor P2Y13
p53 Tumor Protein P53
PABPC1 Poly(A) Binding Protein Cytoplasmic 1 PACT Protein Activator of PKR
PAF Platelet-activating factor
PAFAH Platelet-activating factor acetylhydrolase PAN2 PAN2 Poly(A) Specific Ribonuclease Subunit PAN3 PAN3 Poly(A) Specific Ribonuclease Subunit PARN Poly(A)-specific ribonuclease
PATL1 PAT1 Homolog 1, Processing Body MRNA Decay Factor PBMC Cellules mononucléées du sang périphérique
P-bodies Processing bodies
PBS Phosphate-buffered saline
PC Phosphatidylcholine
PCK1 Phosphoenolpyruvate Carboxykinase 1 PCSK9 Proprotein convertase subtilisin/kexin type 9 PCYT2 Phosphate Cytidylyltransferase 2, Ethanolamine PDK4 Pyruvate Dehydrogenase Kinase 4
PE Phosphatidyléthanolamine
PG Phosphatidylglycérol
PI Phosphatidylinositol
PL Phospholipide
PLTP Phospholipid transfer protein Pol II ARN polymérase II
Pol III ARN polymérase III
PON1 Paraoxonase 1
PPARGC1A PPARG Coactivator 1 Alpha
PPARα Peroxisome proliferator activating receptors alpha PPARβ/δ Peroxisome Proliferator Activated Receptor Delta
PPARγ Peroxisome Proliferator Activated Receptor Gamma PPRE Peroxisome proliferator response element
Pré-miARN miARN précurseur Pri-miARN miARN primaire
PRKAA1 Protein kinase AMP-activated alpha 1 catalytic subunit
PS Phosphatidylsérine
RASA1 RAS P21 Protein Activator 1
REV-ERBα Nuclear Receptor Subfamily 1 Group D Member 1 RhoA Ras homolog gene family, member A
RhoB Ras homolog gene family, member B RIP140 Nuclear Receptor Interacting Protein 1 RISC RNA-induced silencing complex RISCc RISC cytoplasmique
RISCn RISC nucléaire
ROCK1 Rho Associated Coiled-Coil Containing Protein Kinase 1 ROS Espèces réactives de l’oxygène
RT-qPCR PCR quantitatif en temps réel RXRα Retinoid X receptor
S1P Sphingosine-1-Phosphate
S1P1 Sphingosine-1-Phosphate Receptor 1 SAA1 Serum amyloïde A 1
SAA4 Serum amyloïde A 4
SC4MOL Methylsterol monooxygenase 1 SCA Syndrome coronarien aigu
SCAP Sterol regulatory element-binding protein cleavage activating protein SCARB1 Scavenger Receptor Class B Member 1 (gene)
SCD Stearoyl-CoA desaturase
SHP Protein Tyrosine Phosphatase Non-Receptor Type siARN Petit ARN interférent
SIK1 Salt Inducible Kinase 1
SIRT1 Sirtuin 1
SIRT6 Sirtuin 6
SLC25A25 Solute Carrier Family 25 Member 25
SM Sphingomyéline
SOAT1 Sterol O-Acyltransferase 1 SP3 Sp3 Transcription Factor SPC Sphingosylphosphorylcholine SR-A Scavenger Receptor A
SR-BI Scavenger receptor class B type I (protein) SRC3 Nuclear Receptor Coactivator 3
SREBF Sterol regulatory element-binding transcription factor SREBP-1a Sterol regulatory element binding protein 1a
SREBP-1c Sterol regulatory element binding protein 1c SREBP2 Sterol regulatory element binding protein 2
STAT3 Signal Transducer And Activator Of Transcription 3 sTNF-R1 Soluble tumor necrosis factor receptor 1
sTNF-R2 Soluble tumor necrosis factor receptor 2 Syn-1 Syndecan-1 receptor
TEP Tomographie par émission de positron
TG Triglycéride
TGF-β Transforming Growth Factor Beta TLR Toll-like receptors
TNF-α Tumor Necrosis Factor α
TNRC6A-C Trinucleotide Repeat Containing 6A-C
TRBP Trans-activation response RNA binding protein TUT Terminal uridylyl transferase
TWIST Twist Family BHLH Transcription Factor 1 VCAM-1 Vascular Cell Adhesion Molecule 1
VLDL Lipoprotéine de très faible densité XRN1 5'-3' Exoribonuclease 1
À ma famille, dont le soutien et les encouragements m’ont toujours permis d’aller au bout de mes ambitions
REMERCIEMENTS
Je voudrais remercier mon directeur de recherche, le Pr Luigi Bouchard, pour sa confiance, ses précieux conseils et la qualité de la formation que j’ai reçue au cours de mes études graduées. Je remercie mes collègues et amies, Valérie Gagné-Ouellet, Cécilia Légaré, Kathrine Thibeault, Andrée-Anne Clément, Carol-Ann Fortin et Stéphanie Perron, qui ont partagé mon quotidien au cours des années passées au laboratoire du Pr Bouchard et qui ont su égayer mes journées en plus de m’offrir leur soutien. Je remercie également ma famille pour leurs encouragements et leur soutien qui ont été plus qu’essentiels à la complétion de ce dernier chapitre de mon parcours académique.
J’aimerais finalement exprimer ma gratitude à tout le personnel de recherche et aux collaborateurs qui ont participé de près ou de loin à cette étude, de même qu’aux patients qui ont participé à ce projet de recherche et sans qui rien de cela n’aurait été possible.
1. INTRODUCTION
1.1 Maladies cardiovasculaires et leurs facteurs de risqueLes maladies cardiovasculaires (MCV) sont la principale cause de mortalité à l’échelle mondiale et la deuxième principale cause de mortalité au Canada, représentant respectivement 31,3% et 25% des décès en 2015 (WHO 2016). Elles regroupent un large éventail de conditions touchant la structure et le fonctionnement du cœur et des vaisseaux sanguins, incluant notamment les cardiopathies structurelles, les troubles du rythme cardiaque, l’insuffisance cardiaque ainsi que les maladies vasculaires (FMCAC 2018). La maladie coronarienne est la forme la plus commune de maladie du cœur et la principale cause de décès liée aux MCV à travers le monde ainsi qu’au Canada; expliquant respectivement 49,5% et 60,8% des décès de cause cardiovasculaire en 2015 (WHO 2016, FMCAC 2018). Elle est suivie, au second rang, par l’accident vasculaire cérébral (AVC), auquel sont attribuables 35,3% et 20,4% des décès d’origine cardiovasculaire à l’échelle mondiale et au Canada respectivement (WHO 2016). La maladie coronarienne est définie par l’obstruction d’une ou plusieurs artères (e.g., artères coronaires) alimentant normalement le cœur en oxygène, pouvant dans certains cas entraîner un évènement cardiovasculaire aigu tel l’infarctus du myocarde (FMCAC 2018). De manière similaire, l’AVC survient lorsque la circulation sanguine, et donc l’apport en oxygène, au cerveau est entravée (ischémie) (FMCAC 2018). L’une des causes sous-jacentes les plus fréquentes de maladie coronarienne et d’AVC est l’athérosclérose (Banerjee and Chimowitz 2017, ICUO 2019); une maladie multifactorielle caractérisée par l’accumulation progressive de dépôts lipidiques dans l’intima artérielle, le recrutement de cellules inflammatoires, la migration et la prolifération de cellules musculaires lisses vasculaires (CMLV), l’apoptose cellulaire, ainsi que l’apparition possible de nécrose, de fibrose et de calcification; menant à l’épaississement et à la perte d’élasticité de l’artère (Libby, Ridker et al. 2011, Bentzon, Otsuka et al. 2014) (Figure 1). Elle touche principalement les artères de moyen à gros calibre, dont les artères coronaires et carotides qui alimentent respectivement le cœur et le cerveau en oxygène, entre autres (Falk 2006). Alors que la majorité des plaques d’athérome demeureront asymptomatiques, certaines peuvent devenir obstructives ou se rompre et entraîner une thrombose (Bentzon, Otsuka et al. 2014).
Figure 1 : Principales étapes impliquées dans le développement de la plaque d’athérome. La rétention de LDL dans l’intima artérielle est l’une des étapes initiatrices de l’athérosclérose (Tabas, Williams et al. 2007). Celle-ci survient principalement au sein de régions touchées par un épaississement intimal diffus, une structure non-pathologique apparaissant particulièrement dans des artères susceptibles à l’athérosclérose (e.g., coronaires, carotides, aorte) dès les premières années de vie chez l’humain (Nakashima, Chen et al. 2002). Les régions de l’artère présentant un flux sanguin turbulent sur l’endothélium (e.g., région incurvée, embranchements) y sont particulièrement sensibles (Davies 2009, Wentzel, Chatzizisis et al. 2012). La rétention des LDL dans l’intima artérielle, par leur interaction directe (i.e., par leurs apolipoprotéines B100 (ApoB100) et E (ApoE)) ou indirecte (e.g., par l’intermédiaire de la lipoprotéine lipase) avec des composantes de la matrice extracellulaire dont principalement les protéoglycans (Pentikainen, Oorni et al. 2000, Nakashima, Fujii et al. 2007), favorise la modification de ces lipoprotéines, notamment par oxydation (i.e., LDL-ox). L’accumulation de ces lipoprotéines dans l’intima artérielle stimule l’expression de molécules d’adhésion (e.g., ICAM-1, VCAM-1) à la surface des cellules endothéliales de même que la production de molécules de chimioattraction des monocytes (i.e. MCP-1) par ces dernières; entraînant le recrutement de monocytes dans l’intima artérielle et leur maturation en macrophages; lesquels phagocytent les LDL retenus et modifiés et sont convertis en cellules spumeuses (Libby, Ridker et al. 2011). La rétention et la modification de lipoprotéines engendrent également des changements de la matrice extracellulaire (e.g., augmentation de la longueur des chaînes de glycosaminoglycan des protéoglycans) favorisant une affinité d’interaction accrue et la rétention de davantage de lipoprotéines dans l’intima artérielle (Chait and Wight 2000). La migration de CMLV de la média vers l’intima et la prolifération des CMLV résidentes de l’intima (stimulées par les LDL-ox (Liu, Ren et al. 2014)), un remodelage de la matrice extracellulaire par la synthèse de ses composantes par les CMLV (e.g., collagène, protéoglycans, élastine), de même que l’accumulation de cellules spumeuses et de CMLV dans l’intima ainsi que l’apoptose de certaines d’entre-elles sont également des réactions biologiques impliquées dans la progression de la plaque d’athérome (Libby, Ridker et al. 2011). Avec le temps, l’accumulation de lipides et de débris cellulaires résulte en la formation d’un amas lipidique (ou noyau nécrotique) au coeur de la lésion (Libby, Ridker et al. 2011). Dans le cas d’une lésion de stade avancé, une rupture de la chape fibreuse peut
survenir et provoquer la formation d’un thrombus, lequel peut obstruer le flux sanguin (non illustré) (Libby, Ridker et al. 2011). Abréviations : CMLV : Cellule musculaire lisse vasculaire; ICAM-1 : Intercellular adhesion molecule 1; LDL : lipoprotéine de faible densité; LDL-ox : lipoprotéine de faible densité oxydée; MCP-1 : Monocyte Chemoattractant Protein-1; VCAM-1 : Vascular Cell Adhesion Molecule 1.
Les facteurs de risques de MCV sont nombreux. Alors que nous sommes impuissants face à certains d’entre eux, plusieurs peuvent être modifiés par une amélioration de nos habitudes de vie. Parmi les facteurs non modifiables associés à un accroissement du risque cardiovasculaire figurent l’âge avancé, être de sexe masculin (en comparaison au sexe féminin pour un même âge, particulièrement avant la ménopause (Gorodeski 2002)), l’origine ethnique (i.e., autochtone, africaine ou sud-asiatique) ainsi que les antécédents familiaux de MCV ou d’AVC précoce (FMCAC 2018). D’un autre côté, plusieurs facteurs de risque de MCV sont modifiables, dont l’hypertension artérielle, les dyslipidémies (e.g., concentration sanguine élevée en cholestérol des lipoprotéines de faible densité (LDL-C) et en triglycérides (TG), faible concentration en HDL-C), l’inflammation systémique, le diabète, l’obésité, la sédentarité, une alimentation malsaine (e.g., riche en sel, en sucre, en acides gras saturés ou en acides gras trans), le tabagisme ainsi que la consommation excessive d’alcool (Kaplan and Frishman 2001, WHO 2011, FMCAC 2018). Selon l’Organisation Mondiale de la Santé (OMS), près de 80% des cas de maladie coronarienne et cérébrovasculaire sont attribuables à de mauvaises habitudes de vie et seraient donc évitables par la modification de ces dernières (Alwan, Armstrong et al. 2011, WHO 2011). Par leur effet bénéfique sur plusieurs facteurs de risque intermédiaires, la pratique régulière d’activité physique (Warburton, Nicol et al. 2006), de même que l’adoption d’une alimentation saine et variée, telle que décrite par les Lignes directrices canadiennes en matière d’alimentation (Santé Canada 2019), constituent des stratégies efficaces sur lesquelles il faut miser pour réduire le risque de MCV.
1.2 L’exemple des acides gras trans
1.2.1 Caractéristiques et sources d’acides gras trans
Les acides gras insaturés sont des acides gras comportant au moins une double liaison, ou insaturation, au sein de leur chaîne carbonée (Brouwer, Wanders et al. 2013). Celle-ci peut être de conformation cis (AGI), ce qui est presque toujours le cas dans les formes naturelles, ou, plus rarement, de conformation trans (AGT) (Kwon 2016). Les AGT constituent un
ensemble d’acides gras mono- ou poly-insaturés dont au moins une double liaison est en conformation trans (Brouwer, Wanders et al. 2013). Cette conformation leur confère une structure ressemblant davantage à celle d’un acide gras saturé (AGS), qui est linéaire, qu’à celle de leur isomère géométrique insaturé en conformation cis, lequel présente une forme incurvée (Figure 2) (Brouwer, Wanders et al. 2013). Contrairement aux AGI, la structure linéarisée des AGT, tout comme celle des AGS, favorise les interactions plus étroites entre les molécules par le biais d’interactions de van der Waals (Vieira, McClements et al. 2015). Ceci signifie que pour un nombre donné d’atomes de carbone, une plus grande quantité d’énergie est nécessaire à la rupture des interactions moléculaires impliquant ces types d’acides gras, lesquels possèdent par conséquent une température de fusion plus élevée que celle d’un AGI (Vieira, McClements et al. 2015). Tel que montré par l’exemple de Vieira et al (i.e., température de fusion de l’acide stéarique (18:0; 70°C) > acide élaïdique (18:1 trans-9; 45°C) > acide oléique (18:1 cis-trans-9; 13°C)), pour un nombre équivalent de carbones, les AGT présentent une température de fusion intermédiaire à celle des AGI et des AGS (Vieira, McClements et al. 2015). La conformation trans de l’acide élaïdique contribue donc à son aspect solide à température ambiante, alors que l’acide oléique est liquide et que l’acide stéarique est solide (Vieira, McClements et al. 2015). En règle générale, la température de fusion d’un acide gras augmente selon la longueur croissante de la chaîne carbonée, le nombre décroissant d’insaturations et lorsque les insaturations sont de conformation trans plutôt que cis (Berg, Tymoczko et al. 2002). De ce fait, à température ambiante, les AGS se présentent majoritairement sous forme solide, de même que les AGT, alors que les AGI sont liquides (Caballero, Allen et al. 2005).
Figure 2 : Structure moléculaire des acides gras en fonction de leur degré de saturation et de leur conformation. Exemple d’acides gras à 18 atomes de carbone incluant l’acide stéarique (saturé), l’acide élaïdique (insaturé en conformation trans) et son isomère géométrique l’acide oléique (insaturé en conformation cis). Les cercles noirs représentent des atomes de carbone, les cercles gris des atomes d’oxygène et les cercles blancs des atomes d’hydrogène. Pour des fins de simplification, seuls les atomes d’hydrogène illustrant la conformation des insaturations sont représentés.
Les AGT proviennent de deux sources distinctes : naturelle ou artificielle. En effet, on retrouve naturellement les AGT dans les viandes et les produits laitiers dérivés des ruminants (AGTr; e.g., bovins, chèvres, brebis) (Brouwer, Wanders et al. 2013). Ils sont produits dans le rumen de ces animaux au cours du processus de biohydrogénation des AGI alimentaires par le biais du métabolisme bactérien qui y tient place (Valenzuela and Morgado 1999, Buccioni, Decandia et al. 2012). D’un autre côté, les AGT peuvent aussi être produits de manière instrustrielle (AGTi) par un procédé d’hydrogénation partielle des huiles végétales (principalement) ou de poisson, lequel implique l’utilisation d’hydrogène gazeux et d’un catalyseur métallique (nickel) et s’effectue à haute température et sous haute pression (Valenzuela and Morgado 1999, Asif 2011). Au cours de ce processus et dépendamment des conditions expérimentales appliquées, une proportion des doubles liaisons des AGI seront saturées (produisant des AGS), certaines seront sujettes à une isomérisation positionnelle, alors que d’autres subiront une isomérisation géométrique (produisant des AGT) (Valenzuela and Morgado 1999, Asif 2011). L’hydrogénation partielle des AGI a initialement été utilisée par l’industrie alimentaire au milieu du siècle dernier en tant qu’alternative économique de remplacement du beurre et des graisses de source animale (matières grasses solides à température ambiante), lesquelles sont riches en AGS néfastes pour la santé (Lichtenstein 2014). La consommation d’AGT était, à l’époque, considérée un substitut plus « sain » aux AGS, en raison des propriétés nutritionnelles des huiles initialement utilisées (riches en AGI) pour les produire (Lichtenstein 2014). L’hydrogénation des AGI présente plusieurs avantages pour l’industrie alimentaire. Notamment, elle permet d’améliorer la durée de conservation des huiles sans en altérer leurs propriétés (meilleure résistance à l’oxydation) ainsi que donner une meilleure qualité organoleptique (e.g., saveur, texture) aux aliments préparés (e.g., pâtisseries plus moelleuses, viennoiseries plus feuilletées, chocolats fondants) (Vieira, McClements et al. 2015). Il y a quelques décennies à peine, les AGTi étaient abondamment retrouvés dans des produits tels les margarines hydrogénées, les shortenings,
les pâtisseries ainsi que les aliments frits (Ganguly and Pierce 2015). Aujourd’hui, les risques associés à la consommation d’AGT sur la santé cardiovasculaire sont bien connus (voir section 1.2.3) et freinent leur présence dans notre alimentation.
Qu’ils soient d’origine naturelle ou artificielle, les AGT regroupent un ensemble d’isomères variant à la fois en termes de longueur de leur chaîne carbonée ainsi qu’en emplacement de la double liaison en conformation trans au sein de celle-ci (Stender, Astrup et al. 2008, Brouwer, Wanders et al. 2010). Ils existent principalement sous forme mono-insaturée, mais peuvent dans certains cas comporter plusieurs insaturations combinant des conformations trans et/ou cis (Valenzuela and Morgado 1999). Les AGTr et les AGTi sont composés d’un ensemble relativement similaire d’isomères, lesquels sont toutefois présents en différentes proportions selon leur origine (Stender, Astrup et al. 2008, Brouwer, Wanders et al. 2010). De plus, la proportion d’isomères d’AGT issus d’une même source peut varier en fonction de la diète consommée par l’animal dans le cas des AGTr, ainsi que des conditions d’hydrogénation, incluant la nature des huiles utilisées, dans le cas des AGTi (Brouwer, Wanders et al. 2013). Tel qu’illustré par Stender et al, l’acide vaccénique (C18:1 trans-11) est l’isomère le plus abondant au sein des AGTr; constituant ~43% de leur contenu en AGT de type C18:1 (ce type représentant 80-90% des AGT présents dans l’alimentation humaine (Allison, Egan et al. 1999, Stender, Astrup et al. 2008). Parmi les AGTi, l’isomère qui prédomine est plutôt l’acide élaïdique (C18:1 trans-9); constituant ~22% de leur contenu en AGT de type C18:1, suivi de près par le C18:1 trans-10 (~20%) (Stender, Astrup et al. 2008). Il a d’ailleurs été suggéré que cette différence d’isomères constituant les AGTi et les AGTr pourrait se traduire par des effets biologiques distincts (Gebauer, Psota et al. 2007), bien que cette hypothèse ne fasse pas l’unanimité (Nestel 2014) (discuté dans la section 1.2.4).
1.2.2 Consommation d’AGT au Canada et recommandations actuelles
Au courant des années 1990, les Canadiens figuraient parmi les plus grands consommateurs de gras trans à travers le monde, avec un apport quotidien estimé à 8,4g/jour, équivalant à ~3,7% de l’apport énergétique quotidien (Ratnayake and Chen 1995). La majeure partie des AGT consommés (~81%) étaient d’origine industrielle, alors que ceux provenant des ruminants l’étaient en minorité (~19%) (Skeaff 2009). Dans son rapport conjoint avec
l’Organisation des Nations unies pour l'alimentation et l'agriculture (FAO) traitant de la prévention des maladies chroniques publié en 2003, l’OMS recommande de limiter la consommation d’AGT à <1% de l’apport énergétique quotidien (WHO 2003). Différentes mesures ont été prises par Santé Canada au cours des années suivantes afin d’atteindre cet objectif. Celles-ci incluent l’étiquetage obligatoire des AGT sur les produits emballés (instauré en 2003) et la demande à l’industrie alimentaire de réduire, de façon volontaire, les niveaux d’AGT dans les huiles végétales et les margarines à <2% du total des lipides, et à <5% des lipides pour les autres produits emballés (en 2007) (Ratnayake, Swist et al. 2014). Une diminution de l’apport moyen en AGT a ensuite été observée, passant à 4,8g/ jour (~2% de l’apport énergétique quotidien) en 2004, puis à 3,4g/ jour (~1,4% de l’apport énergétique quotidien) en 2008 (Ratnayake, L'Abbe et al. 2009) : des valeurs demeurant toutefois supérieures au seuil de <1% de l’apport énergétique quotidien visé par l’OMS. Dans un effort de respect de cette recommandation de l’OMS, une nouvelle loi interdisant l’incorporation d’huiles partiellement hydrogénées, soit la plus importante source d’AGTi, aux aliments vendus au Canada (aliments produits, importés et utilisés en restauration) entrait en vigueur en septembre 2018 (Santé Canada 2018).
1.2.3 AGT et risque cardiovasculaire
Au fil des années, la consommation d’AGT a été associée maintes fois à un risque cardiovasculaire accru (révisé par (Mozaffarian, Katan et al. 2006, Ganguly and Pierce 2012, Brouwer, Wanders et al. 2013, Nestel 2014, Wilczek, Olszewski et al. 2017, Fattore and Massa 2018)). Les premières interventions nutritionnelles réalisées ont d’abord permis d’identifier un lien entre la consommation élevée d’AGT et la présence d’un profil lipidique défavorable. Dans une étude publiée en 1961, Anderson et al ont observé, pour la première fois, une augmentation des niveaux sériques de cholestérol, triglycérides et phospholipides chez 23 hommes ayant suivi une diète dans laquelle un mélange d’huiles naturelles a été remplacé par des huiles hydrogénées riches en AGT (Anderson, Grande et al. 1961). Des résultats similaires ont été publiés une décennie plus tard par l’équipe de Vergroesen, laquelle a également observé une concentration sérique en cholestérol total accrue chez 12 volontaires (hommes et femmes) ayant consommé une diète enrichie en acide élaïdique (18:1 trans-9) pendant 4 semaines, comparativement une diète équivalente contenant son isomère géométrique : l’acide oléique (18:1 cis-9) (Vergroesen 1972). Ce n’est que plusieurs années
plus tard, en 1990, que Mensink et Katan ont rapporté l’effet de la consommation d’AGT sur les lipoprotéines plus précisément (Mensink and Katan 1990). Dans cette étude, 34 femmes et 25 hommes en santé ont suivi, dans un ordre aléatoire, 3 diètes (équivalentes du point de vue de leur composition nutritionnelle) dont 10% de l’énergie quotidienne était fournie soit par l’acide oléique (18:1 cis-9), par des AGT à 18 carbones dont l’acide élaïdique (18:1 trans-9), ou alors par des AGS (Mensink and Katan 1990). Conformément aux résultats publiés antérieurement (Anderson, Grande et al. 1961, Vergroesen 1972), la consommation d’AGT a été associée à une augmentation des niveaux de cholestérol total et de triglycérides dans le sérum des participants, comparativement l’acide oléique (Mensink and Katan 1990). De plus, les auteurs ont observé une élévation des niveaux de LDL-C ainsi qu’une diminution des niveaux de HDL-C chez les femmes et les hommes ayant complété la diète riche en acide élaïdique comparativement à la diète enrichie en acide oléique (Mensink and Katan 1990). Ces résultats suggèrent un effet au moins autant délétère des AGT sur la santé cardiovasculaire que celui des AGS (Nettleton, Brouwer et al. 2017), lesquels accroissent les niveaux de LDL-C en circulation sans toutefois affecter les niveaux de HDL-C (Mensink and Katan 1990). Depuis lors, plusieurs publications ont corroboré ces conclusions et illustrent un effet dose-réponse des AGT sur le profil lipidique, sans toutefois identifier un seuil sous lequel leur consommation n’engendre aucun effet sur celui-ci (Zock and Katan 1992, Judd, Clevidence et al. 1994, Zock, Katan et al. 1995, Mozaffarian, Katan et al. 2006, Yang, Zhang et al. 2017).
Au courant des dernières décennies, la consommation d’AGT a aussi été reliée à d’autres variables du profil lipidique. Notamment, la consommation d’acide élaïdique (18:1 trans-9) a été associée à un niveau sanguin de lipoprotéine (a) (Lp(a)) plus élevé relativement à la consommation d’AGS (18:0) et d’AGI (acide oléique (18:1 cis-9) ou acide linoléique (18:2 cis-9, cis-12)) à la fois chez des sujets normocholestérolémiques (Mensink, Zock et al. 1992) ainsi que légèrement hypercholestérolémiques (Nestel, Noakes et al. 1992). Comparativement à une faible consommation d’AGT (Yang, Zhang et al. 2017) ou alors à la substitution de 1% de l’énergie quotidienne issue d’AGS, d’AGI ou de glucides (Mensink, Zock et al. 2003, Mozaffarian, Katan et al. 2006), la consommation d’AGT a également été associée à un ratio du cholestérol total (CT) / HDL-C accru, lequel est un meilleur prédicteur du risque de maladie coronarienne que le sont les concentrations en cholestérol total ou en
LDL-C seules (Stampfer, Sacks et al. 1991, Kinosian, Glick et al. 1994). Une autre équipe s’est, quant à elle, intéressée à l’effet des AGT sur une caractéristique du LDL : sa taille. Dans une intervention nutritionnelle exposant, dans un ordre aléatoire, 18 femmes et 18 hommes à 5 diètes dont 20% de l’énergie quotidienne était fournie par différentes matières grasses (beurre comparativement à 4 types de margarines à teneur croissante en AGT), la taille des particules LDL a été inversement associée, de manière dose-dépendante, à la quantité d’AGT consommés (Mauger, Lichtenstein et al. 2003). Bien que la prépondérance de LDL petits et denses, comparativement aux LDL de plus grande taille, soit associée à un risque accru de MCV, celle-ci n’est toutefois pas considérée comme un marqueur de risque cardiovasculaire indépendant des concentrations sanguines en cholestérol total et LDL-C (Cromwell and Otvos 2004, Hoogeveen, Gaubatz et al. 2014, Allaire, Vors et al. 2017).
Plusieurs études observationnelles ont rapporté une incidence plus élevée d’évènements cardiovasculaires chez les individus ayant une consommation élevée en AGT comparativement à ceux ayant une consommation faible (révisé par (Mozaffarian, Katan et al. 2006, Fattore and Massa 2018)). La première étude à avoir investigué le risque que présentait la consommation d’AGT sur la santé cardiovasculaire a été réalisée chez 85 095 femmes âgées de 34 à 59 ans, apparemment en bonne santé, ayant complété le questionnaire alimentaire de 1980 de la Nurses’ Health Study, soit l’une des plus grandes enquêtes prospectives sur les facteurs de risque de maladies chroniques majeures chez les femmes (Belanger, Hennekens et al. 1978). Après un suivi de 8 ans, la consommation d’AGT a été associée à un risque accru de 1,5 fois d’évènement cardiovasculaire dans le quintile supérieur (5,7g/jour) de leur consommation relativement au quintile inférieur (2,4g/jour), une fois l’analyse ajustée pour l’âge et l’apport énergétique total quotidien des participantes (Willett, Stampfer et al. 1993). Cette association a également été retrouvée après un suivi de 14 ans chez 80 082 femmes avec un risque accru de 1,34 fois dans le quintile supérieur (2,9% énergie quotidienne) de consommation d’AGT relativement au quintile inférieur (1,3% énergie quotidienne) (Hu, Stampfer et al. 1997), puis de 20 ans chez 78 778 femmes avec un risque accru de 1,39 fois dans le quintile supérieur (2,8% énergie quotidienne) relativement au quintile inférieur (1,3% énergie quotidienne) de consommation d’AGT (Oh, Hu et al. 2005), et demeurait semblable à la suite de l’ajustement des analyses pour les facteurs de risque standards de MCV (e.g., hypertension, antécédents de MCV, tabagisme,
consommation d’alcool) ainsi que pour la nature des acides gras consommés. Tirant profit des données issues des questionnaires alimentaires de la Alpha-tocopherol, beta-carotene lung cancer prevention study (The ATBC cancer prevention study group 1994), Pietinen et al ont évalué le lien entre la consommation d’AGT et l’incidence d’évènements cardiovasculaires ainsi que de décès de cause cardiovasculaire chez 21 930 hommes fumeurs âgés entre 50 à 69 ans exempts de diagnostic de MCV (Pietinen, Ascherio et al. 1997). Après 6,1 ans de suivi, les auteurs ont observé un risque accru de 1,39 fois de décès de cause cardiovasculaire chez les hommes ayant consommé davantage d’AGT (quintiles supérieurs (6,2g/jour) vs inférieur (1,3 g/jour)), ainsi qu’un risque plus élevé d’évènement cardiovasculaire de 1,14 fois, lequel n’atteint toutefois pas le seuil de significativité statistique une fois le modèle ajusté pour l’ensemble des covariables(e.g., âge, tabagisme, pression artérielle) (Pietinen, Ascherio et al. 1997). Des tendances similaires ont été obtenues dans la Health Professionals follow-up study réalisée chez 43 757 hommes âgés entre 40 et 75 ans n’ayant aucun diagnostic de MCV ni de diabète. Chez ces participants, la consommation d’AGT a été associée à un risque plus élevé de survenue d’un évènement cardiovasculaire (risque augmenté de 1,4 fois dans le quintile supérieur (4,3 g/jour) relativement au quintile inférieur (1,5 g/jour) de consommation d’AGT) et de décès de cause cardiovasculaire (risque augmenté de 1,78 fois) après 6 ans, suivant un modèle d’analyse multivarié incluant plusieurs facteurs de risque cardiovasculaire (Ascherio, Rimm et al. 1996). Ces associations ont toutefois considérablement été atténuées une fois ajustées pour la consommation de fibres alimentaires (risques accrus de 1,21 et de 1,41 fois, respectivement), laquelle est inversement associée au risque cardiovasculaire (Rimm, Ascherio et al. 1996). Dans une étude de plus petite envergure publiée quelques années plus tard et réalisée chez 667 hommes âgés entre 64 et 84 ans exempts de MCV, la consommation d’AGT a également été associée à un risque de MCV accru de 2 fois dans le tertile supérieur (6,38% énergie quotidienne) relativement au tertile inférieur (2,36% énergie quotidienne) de consommation d’AGT) (Oomen, Ocke et al. 2001). Dans une méta-analyse regroupant les 140 016 participants de 4 études de cohortes prospectives, Mozaffarian et al ont estimé que chaque augmentation de 2% de l’énergie quotidienne consommée sous forme d’AGT est associée à une augmentation de 23% du risque de MCV (Mozaffarian, Katan et al. 2006). Quelques années plus tard, une autre étude a précisé qu’une augmentation de 2% de l’énergie
quotidienne consommée sous forme d’AGT est associée à un risque accru de survenue d’un évènement cardiovasculaire de 22%, mais pas au décès de cause cardiovasculaire (Skeaff and Miller 2009).
1.2.4 AGTi vs AGTr : risque cardiovasculaire équivalent?
Alors que la majorité des études susmentionnées se sont penchées sur le risque cardiovasculaire associé à la consommation des AGT totaux ou de ceux produits par l’industrie (dont principalement l’acide élaïdique), qu’en est-il des AGT naturellement présents dans la viande et le lait issus des ruminants? Bien que les effets néfastes des AGTi sur la santé cardiovasculaire soient bien établis, la littérature actuelle n’est pas aussi claire en ce qui a trait à l’effet des AGTr (Brouwer, Wanders et al. 2013, Fattore and Massa 2018). En effet, une revue systématique et méta-analyse regroupant 4 études de cohortes prospectives, totalisant 71 030 femmes et 24 434 hommes, n’a montré aucune association significative entre une consommation accrue d’AGTr (augmentation de 0,5 à 1,9 g/jour) et le risque de maladie MCV (Bendsen, Christensen et al. 2011). Des résultats similaires ont été obtenus au courant d’une seconde méta-analyse de 5 études de cohortes prospectives réalisée en 2015, dans laquelle aucune association significative entre la consommation d’AGTr et le risque de survenue d’un évènement cardiovasculaire (73 546 participants) ou de décès de cause cardiovasculaire (93 394 participants) n’a été rapportée (de Souza, Mente et al. 2015). Afin d’examiner si cette absence d’effet des AGTr est simplement due à leur relativement faible consommation, Gayet-Boyer et al ont réalisé une revue systématique et méta-analyse incluant 13 essais nutritionnels contrôlés et randomisés ayant pour objectif d’évaluer l’effet de la quantité d’AGTr consommée sur des marqueurs lipidiques du risque cardiovasculaire (Gayet-Boyer, Tenenhaus-Aziza et al. 2014). Les auteurs en sont venus à la conclusion que les AGTr ne semblent pas avoir d’effet délétère sur les ratios de CT/HDL-C et de LDL-C/HDL-C, jusqu’à un apport équivalent à 4,19% de l’énergie quotidienne (Gayet-Boyer, Tenenhaus-Aziza et al. 2014), ce qui est bien au-delà de leur niveau de consommation estimé en Amérique du Nord (0,5% énergie quotidienne (Motard-Belanger, Charest et al. 2008)). La relation différentielle des AGTi et des AGTr avec le risque cardiovasculaire pourrait s’expliquer, du moins en partie, par la nature des isomères qui les composent, lesquels pourraient avoir des effets biologiques distincts (Stender, Astrup et al. 2008).
1.2.5 Effets athérogènes des AGT
Les études réalisées à l’aide de modèles animaux démontrent l’impact des AGT dans le développement de l’athérosclérose, tel qu’en témoigne une étendue accrue des lésions athérosclérotiques présentes dans la région aortique des animaux dont l’apport en AGT alimentaires est élevé (3,2% à 6,4% énergie quotidienne) comparativement à ceux en consommant peu (Bassett, McCullough et al. 2009, Monguchi, Hara et al. 2017). Les AGT altèrent la santé cardiovasculaire par leur action sur plusieurs processus biologiques, incluant notamment l’inflammation, le stress oxydatif, la dysfonction endothéliale et le métabolisme des lipides, lesquels sont impliqués dans la pathologie de l’athérosclérose (Gimbrone and Garcia-Cardena 2016). Brièvement, des études observationnelles ont rapporté une association positive entre la consommation élevée d’AGT et les niveaux plasmatiques de marqueurs d’inflammation systémique dont la protéine C-réactive (CRP), l’interleukine-6 (IL-6) ainsi que le tumor necrosis factor α (TNF-α) et la forme soluble de ses récepteurs (i.e., sTNF-R1 et sTNF-R2) (Mozaffarian, Pischon et al. 2004, Mozaffarian, Rimm et al. 2004, Lopez-Garcia, Schulze et al. 2005, Esmaillzadeh and Azadbakht 2008, Mazidi, Gao et al. 2017), ces derniers favorisant la stabilisation du TNF-α et régulant sa biodisponibilité (Aderka, Engelmann et al. 1992). Ces observations ont été corroborées par quelques études expérimentales, dont celle de Baer et al montrant une augmentation des niveaux plasmatiques de CRP et d’IL-6 de 21% et 16%, respectivement, chez des hommes ayant consommé une diète riche en AGT (8%) d’une durée de 5 semaines, comparativement à une diète riche en acide oléique (8%) (Baer, Judd et al. 2004). Han et al ont également rapporté une production accrue de 58% et 36% respectivement de TNF-α et d’IL-6 par des cellules mononucléées du sang périphérique (PBMC) en culture isolées du sang de participants ayant complété une intervention nutritionnelle d’une durée d’un mois comparant une diète enrichie en margarine hydrogénée (AGTi; 6,7% énergie quotidienne) à une diète enrichie en huile de soya (faible en AGT) (Han, Leka et al. 2002). Il est cependant à noter que d’autres études expérimentales n’ont montré aucun lien significatif entre la consommation d’AGT et le niveau plasmatique de CRP (Lichtenstein, Erkkila et al. 2003, Motard-Belanger, Charest et al. 2008), dont celles ayant investigué les effets potentiels des AGTr (Tholstrup, Raff et al. 2006, Motard-Belanger, Charest et al. 2008), et que certaines études ayant exposé des cellules en culture à différents isomères d’AGT ont montré un effet anti-inflammatoire de