HAL Id: dumas-01891363
https://dumas.ccsd.cnrs.fr/dumas-01891363
Submitted on 9 Oct 2018
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Diagnostic des fièvres et syndromes inflammatoires
biologiques d’origine indéterminée : étude prospective
sur 39 patients au centre hospitalier universitaire de
Grenoble Alpes
Chloé Wackenheim Peilleron
To cite this version:
Chloé Wackenheim Peilleron. Diagnostic des fièvres et syndromes inflammatoires biologiques d’origine indéterminée : étude prospective sur 39 patients au centre hospitalier universitaire de Grenoble Alpes. Médecine humaine et pathologie. 2018. �dumas-01891363�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteurUNIVERSITÉ GRENOBLE ALPES
UFR DE MÉDECINE DE GRENOBLE
Année : 2017-2018
DIAGNOSTIC DES FIEVRES ET SYNDROMES INFLAMMATOIRES BIOLOGIQUES D’ORIGINE INDETERMINEE : ETUDE PROSPECTIVE SUR 39 PATIENTS AU CENTRE HOSPITALIER
UNIVERSITAIRE DE GRENOBLE ALPES THÈSE
PRÉSENTÉE POUR L’OBTENTION DU TITRE DE DOCTEUR EN MÉDECINE DIPLÔME D’ÉTAT
Chloé WACKENHEIM, Épouse PEILLERON
THÈSE SOUTENUE PUBLIQUEMENT À LA FACULTÉ DE MÉDECINE DE GRENOBLE Le : 04/10/2018
DEVANT LE JURY COMPOSÉ DE Présidente du jury :
Madame le Professeur Laurence Bouillet Membres :
Monsieur le Professeur Olivier Epaulard Monsieur le Professeur Jean- Philippe Vuillez Monsieur Maxime Lugosi (Directeur de thèse)
L’UFR de Médecine de Grenoble n’entend donner aucune approbation ni improbation aux opinions émises dans [Données à caractère personnel]
Remerciements :
A Madame le Professeur Laurence Bouillet, merci de m’avoir donné ma chance en tant
qu’interniste et de m’avoir accompagnée dans mon cursus. Peu d’internes peuvent se vanter d’avoir une chef de service si impliquée et encourageante ;
A Monsieur le Professeur Olivier Epaulard, pour m’avoir décidé à sauter le pas en me disant
un jour que « j’avais ce qu’il fallait dans le moteur » pour me lancer dans les maladies infectieuses et m’avoir guidé dans mes projets de recherche avec beaucoup, beaucoup de patience !
A Monsieur le Professeur Jean-Philippe Vuillez, d’avoir manifesté de l’intérêt pour mon
travail et d’encourager une étroite collaboration entre la médecine nucléaire et la médecine interne et infectieuses pour nous rendre meilleurs dans la prise en charge de nos patients ;
A Maxime Lugosi, c’est un immense plaisir de t’avoir rencontré et côtoyé tout au long de ses
années d’internat. Un grand MERCI de m’avoir guidé dans cette grande étape qu’est la thèse en étant si disponible et rigoureux. J’espère que malgré ton coté perfectionniste tu seras aussi satisfait que moi ;
Merci à tous ceux qui ont participé à cette étude, quitte à les citer plusieurs fois : Maxime
Lugosi, Alban Deroux, Barbara Colombe, Annick Bosseray, Charlotte Dentan, Mylène Maillet, Patricia Pavese, Léa Mairot, Claire Wintenberger, Perrine Dumanoir, Lysiane Molina, Alexandre Bellier, et tous les internes qui ont pris la peine de s’intéresser à ce sujet ;
A Patricia Pavese et Isabelle Pierre, pour votre gentillesse au quotidien, votre
accompagnement et votre talent pédagogique, j’attends beaucoup de ces deux années d’assistanat à vos côtés
A Annick Bosseray, qui m’a fait travailler ma confiance en soi (ça va y aller !) et mon
vocabulaire. Un coach de natation hors norme !
A tous les médecins que j’ai croisés de près ou de loin, qui m’ont chacun apporté beaucoup dans ma formation médicale et mon évolution personnelle : Lysiane Molina, Stéphane
Courby, Fatma Makhlouf, Alban Deroux, Barbara Colombe, Jean Paul Brion, Isabelle Pierre, Claire Wintenberger, Rebecca Hamidfar-Roy, Clémence Minet, Agnès Bonadona, Leila Potton, Claire Ara-Somohano, David Bruley, Aurélie Labbé, Mylène Maillet et Charlotte Dentan.
Table des matières
1. RESUME ... 10
2. PRESENTATION ... 13
3. OBJECTIFS ... 18
4. METHODES ... 19
4.1. Inclusion des patients : ... 19
4.2. Visite d’inclusion : ... 20
4.3. Investigations proposées : ... 20
4.4. Visites de suivi : ... 21
4.5. Diagnostic étiologique : ... 21
4.6. Analyse statistique : ... 21
4.7. Évaluation des performances diagnostiques de la TEP-FDG : ... 22
5. RESULTATS ... 23
5.1. Données à l’inclusion :... 23
5.2. Examens paracliniques et TEP-
18F
FDG: ... 245.3. Diagnostic étiologique : ... 26
5.4. Traitement : ... 27
5.5. Suivi : ... 27
5.6. Comparaison des patients FUO et IUO :... 28
6. DISCUSSION ... 29
7. REFERENCES : ... 38
1.
RESUME
Introduction : Les fièvres et syndromes inflammatoires d’origine indéterminée (FUO/IUO)
sont des entités nosologiques qui évoluent au cours du temps, des techniques diagnostiques et selon la zone géographique concernée. Le but de cette étude est d’étudier la prévalence les étiologies et l’apport diagnostique de la TEP-18F au FDG.
Méthodes : Nous avons mené une étude prospective monocentrique entre décembre 2015 et novembre 2017. Une fièvre ou un taux de CRP > 5mg/L sans fièvre depuis une semaine, sans diagnostic après un bilan minimal définissaient les FUO/IUO. Les étiologies étaient classées en infections, maladies inflammatoires non infectieuses (MINI), néoplasies, autres causes et étiologies non retrouvées. Les performances diagnostiques de la TEP-18FFDG étaient
évaluées.
Résultats : Trente-neuf patients ont été inclus, 32 FUO et 7 IUO. Le taux de diagnostic était de 67% : les MINI représentaient 50%, les néoplasies 31%, les infections 15% et les causes « autres » 4%. La TEP-18FFDG était réalisée chez 82% des patients et aidait au diagnostic dans 47% des cas. En l’absence d’orientation clinique la sensibilité était de 86% et la valeur prédictive négative de 90%. Six patients (15%) sont décédés au cours du suivi et 4 patients (10%) ont été perdus de vue. Aucun patient sans diagnostic final n’est décédé.
Conclusion : Un examen clinique rigoureux et répété permet de guider la démarche
diagnostique des FUO et IUO. La TEP-18FFDG semble tenir une place importante en l’absence d’orientation en aidant au diagnostic et en éliminant une pathologie grave en cas de normalité.
MOTS CLÉS :Fièvre – inflammation – infection – néoplasie – maladie inflammatoire – TEP-18FFDG
DIAGNOSIS OF FEVER AND INFLAMMATORY SYNDROM OF UNKNOWN ORIGIN: A PROSPECTIVE STUDY IN 39 PATIENTS AT GRENOBLE ALPES UNIVERSITY
HOSPITAL
Introduction: Our aim was to study prevalence of FUO, IUO and their etiologies, and evaluate diagnosis contribution of complementary examinations, mainly 18FFDG-PET.
Methods: We conducted a monocentric prospective study at Grenoble Alpes University Hospital between December 2015 and November 2017. Fever > 38,3°C or C-reactive Protein level > 5mg/L for more than a week, without diagnosis after minimal investigations defined FUO/IUO. The different causes were listed as infectious diseases, noninfectious inflammatory diseases (NIID), neoplasms, miscellaneous diseases and undiagnosed. Diagnostic features of 18FFDG- PET were studied.
Results: Thirty-nine patients were included, respectively 32 FUO and 7 IUO. A diagnosis was made possible in 67% cases, mainly NIID (50%) and neoplasms (31%), then infectious diseases (15%) and miscellaneous diseases (4%). Most exams, such as laboratory tests or imaging technics were mildly helpful for diagnosis. 18FFDG- PET was performed in 82% of patients, and helpful for final diagnosis in 47% of cases. Diagnostic performances of 18FFDG- PET were excellent in case there was no clinical clue (sensitivity 86% and negative predictive value 90%). Thirty-two patients received a treatment, linked with the causal disease in 64% of cases. Six patients (15%) died during follow up. Death was always related to the causal disease. None of the undiagnosed patients died.
Conclusion: Complete and repeated physical examination helps guide diagnostic approach of FUO and IUO. Without these clinical clues, 18FFDG- PET has a major place to help with final diagnosis and to exclude a potential severe disease if normal.
Liste des abréviations :
- ACG: Artérite à cellules géantes
- ANCA: anticorps anticytoplasme des polynucléaires - Anti-MPO: anti Myéloperoxidase
- CMV: Cytomégalovirus - CRP: Protéine C Réactive - EBV: Epstein Barr Virus
- ECBU: Examen Cyto-bactériologique des urines - FUO : Fever of Unknown Origin
- IUO : Inflammatory syndrome of Unknown Origin - IGRA: Interferon Gamma Release Assay
- IRM: Imagerie par resonance magnétique
- MINI: Maladies inflammatoires non inflectieuses - PCR: Polymerase Chain Reaction
- PDCs: Potential Diagnostic Clues - PDV: Perdus de vue
- PPR: Pseudopolyarthrite rhizomélique
- SAHL: Syndrome d’activation lympho-histiocytaire - SPA: Spondylarthrite ankylosante
- TDM TAP: tomodensitométrie thoraco-abdomino-pelvienne
- TEP au 18F-FDG : Tomographie par émission de Positrons au 18F] Fluorodéoxyglucose
- VIH : Virus de l’Immunodéficience Humaine - VS : Vitesse de sédimentation
2. PRESENTATION
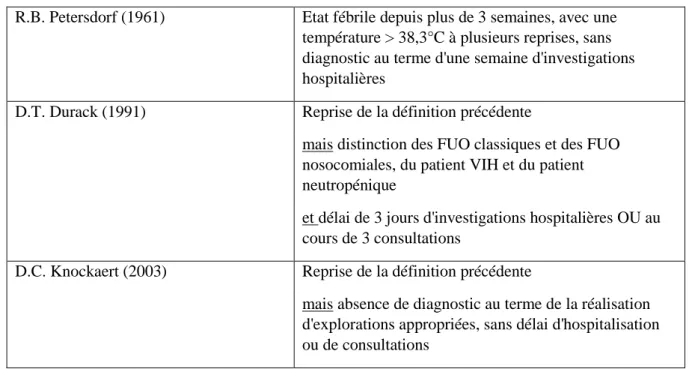
Une première définition des FUO (Fever of Unknown Origin) a été proposée par Petersdorf et Beeson en 1961 (1) (tableau 1). Ils définissaient les FUO comme une température supérieure à 38,3°C à trois reprises, continue ou récurrente, évoluant depuis plus de trois semaines, sans diagnostic après une semaine d’investigations hospitalières.
Cette définition a ensuite été révisée par Durack et Street en 1991 (2), qui distinguent les FUO classiques des FUO nosocomiales, des FUO chez le patient infecté par le VIH et chez le patient neutropénique. En effet, la démarche diagnostique et le spectre étiologique de ces catégories sont différents et la prise en charge thérapeutique des formes nosocomiales ou de l’immunodéprimé doit souvent être urgente. Durack et Street intègrent également une dimension ambulatoire en redéfinissant les modalités diagnostiques, par 3 jours d’investigations en hospitalisation complète ou lors de 3 consultations externes.
Enfin, Knockaert et al. proposent en 2003 de supprimer les 3 jours d’investigations ou les 3 consultations, jugés arbitraires (3)(4), pour se focaliser sur des critères qualitatifs, définissant ainsi comme FUO toute fièvre sans diagnostic étiologique au terme d’un bilan standard approprié. En effet, la durée initiale de 3 jours proposée par Petersdorf et al. représentait le temps nécessaire à la positivité des hémocultures, mais l’utilisation de l’imagerie, des examens immunologiques et l’apparition des PCR ont réduit les délais (3).
Presque 60 ans après leur première définition, les FUO restent un défi diagnostique avec un taux diagnostic moyen de 71% et un spectre étiologique de plus de 200 pathologies (Tableau 2). Classiquement, les FUO sont classées en 5 catégories dans la littérature : les causes infectieuses, les maladies inflammatoires non infectieuses (MINI), les causes néoplasiques, les causes « autres » (présence d’une étiologique non infectieuse, non néoplasique et non inflammatoire) et les FUO de cause inconnue pour lesquelles aucun diagnostic n’a pu être retenu au terme d’un bilan exhaustif. Le groupe des MINI inclut les maladies auto-immunes et
systémiques telles que les connectivites, vascularites, granulomatoses, rhumatismes inflammatoires et les maladies auto-inflammatoires. Les causes décrites dans la catégorie
« autres » sont généralement les pathologies endocriniennes, l’embolie pulmonaire, les fièvres factices, les fièvres iatrogènes et l’hyperthermie « physiologique » (3). La proportion de chaque catégorie est variable selon les études, avec en général une prédominance des causes infectieuses (17 à 70%), suivies par les MINI (8 à 61%), les pathologies cancéreuses (6 à 22%), les FUO de cause inconnue (6 à 51%), et enfin les causes autres (0 à 20%) (Tableau 2).
Si le spectre étiologique des FUO est vaste, certaines pathologies sont majoritaires. Par exemple, Vanderscheuren et al. constataient dans une étude de 2003 que 14 pathologies représentaient près de 60% du total des causes de FUO, avec en première place les endocardites infectieuses, la tuberculose, les primo-infections à Epstein-Barr-Virus (EBV) et Cytomégalovirus (CMV), la maladie de Still, le lupus érythémateux systémique, l’artérite à cellules géantes, la pseudo-polyarthrite rhizomélique et la sarcoïdose (4)(5).
La fréquence relative des différentes étiologies associées aux FUO tend à évoluer au cours du temps. Ces dernières décennies, une diminution de certaines infections et cancers solides a été constatée, ce grâce à des mesures de santé publique efficaces et une amélioration des techniques diagnostiques, principalement l’utilisation de l’imagerie (scanner et tomographie par émission de positons (TEP) au 18F-Fluorodéoxyglucose). Au contraire, les MINI tendent à augmenter (3). Par ailleurs, malgré les progrès des techniques diagnostics, le taux de FUO sans diagnostic reste stable voire en augmentation (tableau 2).
Il existe également une grande variation géographique des pathologies associées aux FUO. Dans certains pays du Maghreb ou d’Asie par exemple, le taux de FUO associées aux infections est important du fait de la forte prévalence de pathologies telles que la tuberculose, la brucellose, le paludisme ou encore le VIH (6). Il en va de même pour certaines maladies auto-immunes ou inflammatoires possédant un déterminisme géographique telles que la
maladie de Behcet ou la fièvre méditerranéenne familiale (6). Cette répartition peut également variée au sein d’un même territoire, par exemple dans des régions de France où certaines zoonoses sont plus présentes (Fièvre Q, Borrélioses) (5).
Outre ces variations géographiques et temporelles s’ajoute une grande hétérogénéité dans la méthodologie même des études rendant la comparaison des catégories d’étiologie et leur fréquence respective sujette à caution.
Le pronostic des patients FUO, moins décrit, est également variable, avec une mortalité allant de 6 à 18% selon les études. Les principales causes de décès rapportées dans les études sont les hémopathies malignes avec en premier lieu les lymphomes. Par ailleurs, certains auteurs affirment que le pronostic des FUO sans diagnostic final est favorable (7).
Il est fréquent que les patients FUO présentent un syndrome inflammatoire biologique. Cependant peu d’études sont consacrées aux patients présentant des IUO (Inflammatory Syndrome of Unknown Origin) sans fièvre associée. Vanderscheuren et al. sont les premiers en 2009 à comparer FUO et IUO dans une étude prospective (8). Ils proposent une définition des IUO comme étant l’association de symptômes cliniques à une élévation d’un ou plusieurs marqueurs biologiques de l’inflammation (C-Reactive Protein (CRP) plasmatique > 30mg/L ou élévation de la Vitesse de Sédimentation (VS)) depuis plus de 3 semaines, avec une température corporelle inférieure à 38,3°C, sans qu’un diagnostic ait pu être posé au terme d’une série d’investigations appropriées. Balink et al. proposent en 2014 une définition proche, en modifiant le seuil de CRP à 20 mg/L et de la VS à 20 mm à la première heure (9). Ces deux équipent concluent à un spectre étiologique identique et préconisent d’adopter la même démarche diagnostique pour les FUO.
Il n’existe à ce jour aucun protocole diagnostic consensuel des FUO et IUO, du fait à la fois de l’hétérogénéité de la présentation clinique, de l’étendue du spectre étiologique et des
différentes, durées variables des études, caractère souvent rétrospectif, absence de protocole diagnostique standardisé, critères d’inclusion changeants et plateaux techniques différents (entre pays occidentaux et en voie de développement, ou entre centres hospitaliers universitaires et non universitaires).
Le diagnostic repose sur l’association d’une démarche clinique et d’un ensemble d’examens paracliniques : examens biologiques, imagerie, anatomo-pathologie voire autopsie. Leur réalisation est guidée par un interrogatoire et un examen clinique rigoureux, permettant d’orienter la démarche diagnostique grâce à des « indices cliniques potentiels » (10–12). Ce concept d’indices cliniques potentiels (PDCs pour Potential Diagnostic Clues) est utilisé depuis les années 1990 et est la clé de voute des FUO et IUO. Il est défini par l’ensemble des symptômes rapportés par le patient et/ou les anomalies de l’examen clinique permettant de formuler une hypothèse diagnostique et de guider la démarche paraclinique, en limitant ainsi la multiplication d’examens couteux et parfois invasifs.
Selon Knockaert et al., les PDCs sont manquants dans 65% des cas de FUO, augmentant donc la complexité diagnostique. Ce dernier propose alors d’adopter 4 stratégies en fonction de l’état de gravité du patient 1) « attendre et observer », soit une surveillance simple chez les patients en bon état général pour lesquels la probabilité diagnostique est considérée comme faible par le médecin et avec un bon pronostic à long terme; 2) « scintigraphie corps entier », où la TEP au 18F-FDG trouve toute sa place (mais comporte un risque de faux positifs) ; 3) l’approche stratifiée, grâce à un arbre décisionnel guidant la démarche diagnostique ; et 4) l’introduction d’un traitement empirique, soit une antibiothérapie probabiliste pour les patients présentant des signes de gravité, soit un traitement symptomatique (corticoïdes ou anti-inflammatoires non stéroïdiens le plus souvent) (3). Pour nombre d’auteurs, une conduite attentive visant à surveiller l’apparition de PDCs est préférable à la multiplication des examens complémentaires, qui ne se justifient alors qu’en cas de détérioration de l’état du patient (3,10).
Par ailleurs, l’apport diagnostic de certains examens complémentaires est discutable. Par exemple, la rentabilité des examens biologiques tels que la sérologie ou le bilan auto-immun est faible, notamment en l’absence d’argument clinique orientant vers ce type de pathologies. L’intérêt de la Polymérase Chain Reaction (PCR) simple, multiplexe ou 16S pour le diagnostic des infections reste débattu (13)(14). L’imagerie tient cependant une place intéressante, notamment la tomodensitométrie et l’imagerie par résonnance magnétique, plus sensibles et plus spécifiques que la radiographie et l’échographie.
La scintigraphie TEP-18FFDG est utilisée en pratique courante depuis les années 1990-2000. Le principe de cet examen est la détection du 18F-Fluorodéoxyglucose par une caméra
TEP donnant une représentation du traceur radioactif dans l’organisme et notamment des foyers inflammatoires dont la consommation en glucose est accrue. La réalisation est maintenant couplée au scanner et permet, grâce aux rayons X, d’améliorer la résolution des images. La TEP-18FFDG était historiquement utilisée dans le domaine de la cancérologie pour le suivi évolutif des cancers solides et lymphomes, du fait de sa sensibilité accrue par rapport à l’imagerie conventionnelle. Ses indications se sont par la suite étendues à la détection des pathologies inflammatoires non cancéreuses et des foyers infectieux profonds. Cet examen permet d’aider au diagnostic, mais aussi un bilan de la sévérité (atteintes disséminées des lymphomes), d’extension (localisations secondaires d’un cancer solide) et d’éventuelles complications (aortite de l’artérite à cellules géantes par exemple). Ces éléments suggèrent que cet examen pourrait être d’une grande utilité pour le diagnostic des FUO et IUO. Sa contribution diagnostique a fait l’objet de plusieurs études, avec cependant une grande hétérogénéité allant de 20 à 72% (tableau 2). Sa place reste donc encore à définir.
Les FUO et IUO sont des entités nosologiques qui, bien que décrites depuis des décennies, n’en restent pas moins complexes dans leur approche diagnostique. Une évaluation régulière et locale semble donc nécessaire pour en réactualiser les connaissances.
3. OBJECTIFS
Les objectifs de notre étude sont d’étudier la prévalence des étiologies des FUO et IUO et d’évaluer la contribution diagnostique des examens complémentaires notamment la TEP-18FFDG.
4. METHODES
Nous avons mené une étude observationnelle prospective entre décembre 2015 et novembre 2018 au sein des services de médecine interne et maladies infectieuses et tropicales du Centre Hospitalier Universitaire de Grenoble Alpes (CHUGA).
4.1. Inclusion des patients
:Les patients présentant des critères de FUO ou d’IUO âgés de plus de 18 ans et adressés dans les services de médecine interne ou le service de maladies infectieuses du CHUGA étaient inclus. Les critères de FUO et IUO étaient définis de la façon suivante : tout patient présentant une température supérieure à 38.3°C et/ou un taux de CRP supérieur à 5 mg/L (norme du laboratoire) depuis plus d’une semaine, pour lesquels un bilan clinique et paraclinique de première intention n’avait pas permis d’établir un diagnostic. Les patients étaient considérés « FUO » en cas de température avec ou sans syndrome inflammatoire biologique associé, et « IUO » en cas de syndrome inflammatoire isolé.
Etaient exclus de l’étude, les patients présentant un état d’immunodépression (infection par le VIH, taux de polynucléaires neutrophiles inférieur à 1G/L, cancer en cours de chimiothérapie, traitement immunosuppresseur ou corticothérapie au long cours (plus de 10mg par jour d’équivalent prednisone pendant plus de deux semaines)), les fièvres d’origine nosocomiale (à l’exception des infections de sites opératoires), les patients ayant reçu une antibiothérapie, les femmes enceintes et les patients sous protection juridique.
Un bilan minimal de première intention était demandé à l’inclusion des patients afin d’éliminer des causes « évidentes » de fièvre ou syndrome inflammatoire : réalisation d’une ou plusieurs séries d’hémocultures aéro/anaérobies (au moment ou à distance de l’épisode fébrile), examen cytobactériologique des urines (ECBU), ainsi qu’un examen d’imagerie, comprenant
au choix la réalisation d’une tomodensitométrie (TDM) thoraco-abdomino-pelvienne ou une radiographie pulmonaire et une échographie abdominale (Figure 1).
Un accord du Comité de Protection des Personnes Sud Est V a été reçu.
4.2. Visite d’inclusion :
A l’inclusion était réalisé un entretien détaillé ainsi qu’un examen clinique complet du patient. Lors de la visite d’inclusion étaient consignés pour chaque patient : les données démographiques, les comorbidités, les constantes, les caractéristiques de la fièvre, les signes fonctionnels et l’existence de PDCs. Les PDCs étaient les symptômes permettant de formuler une hypothèse diagnostique et orienter la démarche paraclinique.
4.3. Investigations proposées :
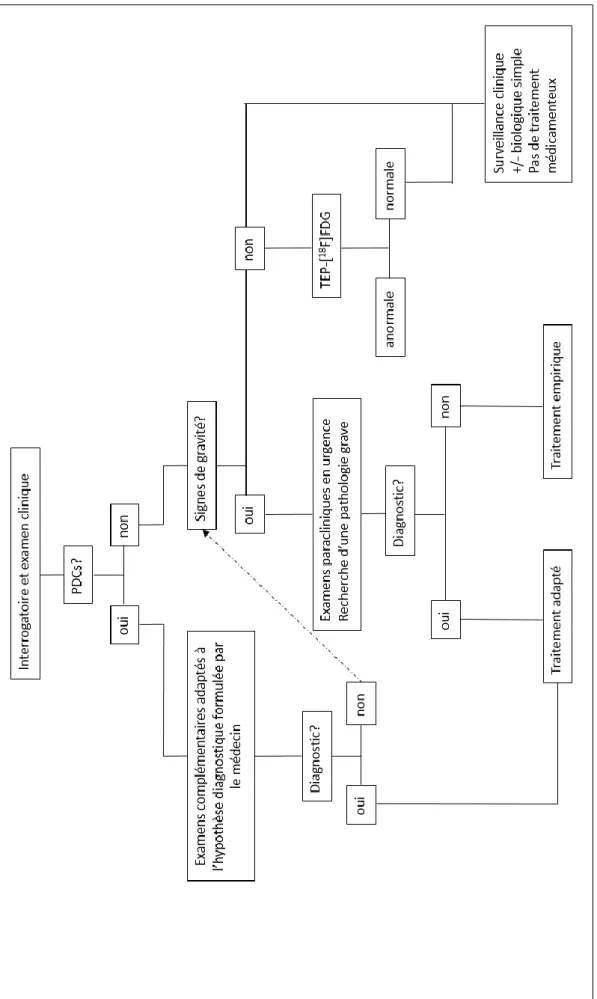
L’étude étant observationnelle, aucun protocole d’exploration n’était imposé. Les investigateurs étaient libres de réaliser les examens qui leur semblaient pertinents après la visite d’inclusion. Un arbre diagnostique était tout de même proposé (figure 2) hiérarchisant les examens complémentaires en fonction de la présence ou non de PDC, de la pertinence, du coût et du caractère invasif des examens. Ce protocole proposait notamment de réaliser en 2e
intention une TEP au 18F-FDG en cas d’absence de PDCs. L’investigateur décidait alors des examens paracliniques qu’il jugeait nécessaires, en se basant éventuellement sur l’arbre décisionnel (examens biologiques, imagerie, TEP au 18F-FDG, endoscopies et biopsies). Au décours de cette première visite et des investigations de première ligne était noté si un diagnostic était fait ou non.
La TEP au 18F-FDG était réalisée chez un sujet au repos, après un jeune de 6h et un contrôle de la glycémie capillaire. L’injection de Fluorodéoxyglucose était suivie d’une période de repos d’une heure, puis de l’acquisition des images pendant environ 30 minutes. Les résultats étaient ensuite communiqués au patient au cours d’une consultation médicale dédiée par le
médecin référent. L’appareil caméra TEP-TDM de marque Siemens modèle Biograph Horizon 16 était utilisé.
4.4. Visites de suivi :
Les patients étaient suivis en consultation ou dans le cadre d’une hospitalisation : les patients pour lesquels un diagnostic étiologique était établi dès la première visite étaient revus dans un délai de 1 à 3 mois puis un an après l’inclusion dans l’étude ; les patients sans diagnostic étaient revus dans un délai de 1 à 3mois, puis à 6 mois, et enfin à un an.
Au cours de chaque visite étaient notifiées la persistance éventuelle de la fièvre ou du syndrome inflammatoire biologique, la présence ou l’absence de diagnostic étiologique, l’introduction d’un traitement. Un nouvel interrogatoire et un nouvel examen clinique complet était réalisés. Les PDCs éventuels étaient notifiés ainsi que les explorations complémentaires jugées nécessaires par l’investigateur.
4.5. Diagnostic étiologique :
Le diagnostic final reposait soit sur un résultat biologique (microbiologique (sérologie/PCR) ou immunologique) ou anatomo-pathologique, soit sur un score diagnostique de référence pour les MINI (Classification ACR, EULAR, Chapel Hill). Chaque diagnostic étiologique était validé a posteriori par un comité d’experts (selon les critères diagnostiques inhérents à la pathologie en cause), puis répertorié selon 5 grands cadres étiologiques : infections, maladies inflammatoires non infectieuses, cancers et hémopathies, autres causes et sans cause. Le comité d’expert était composé des Drs Barbara Colombe, Maxime Lugosi et Alban Deroux.
4.6. Analyse statistique :
Nous avons réalisé une analyse descriptive de la population de l’étude. Les variables catégorielles sont décrites en fréquence avec les extrêmes. Les variables continues sont décrites
selon leur répartition normale ou non en moyenne avec écart type ou en médiane avec interquartile. Des analyses comparatives ont été faites entre les patients FUO et IUO et entre les catégories étiologiques. La contribution diagnostique des examens paracliniques biologiques, anatomo-pathologiques, d’imagerie et de la TEP-18FFDG était ensuite évaluée. Un test était considéré comme contributif s’il apportait un diagnostic ou une orientation forte.
4.7. Évaluation des performances diagnostiques de la TEP-FDG :
Nous nous sommes intéressés aux performances diagnostiques de la FDG. La
TEP-18FFDG était considérée comme contributive si elle permettait de poser le diagnostic
étiologique en association à des arguments cliniques ou paracliniques, ou encore par le biais d’une biopsie tissulaire. Un diagnostic final n’était jamais retenu sur la TEP-18FFDG seule.
Ainsi l’examen était défini comme : a) VRAI POSITIF, c’est-à-dire contributif, si la
TEP-18FFDG montrait un ou plusieurs foyers hypermétaboliques considérés a postériori en lien
direct avec le diagnostic final ; b) VRAI NEGATIF si la TEP-18FFDG était normale en l’absence de diagnostic final ; c) FAUX POSITIF si la TEP-18FFDG révélait une anomalie,
jugée a postériori non spécifique et sans lien avec le diagnostic final ; d) FAUX NEGATIF si la TEP-18FFDG était normale alors qu’un diagnostic étiologique était posé et était classiquement associé à des signes scintigraphiques, notamment de maladie inflammatoire ou de néoplasie ou hémopathie maligne. La catégorisation a été faite à postériori à partir du même groupe d’experts que la catégorisation étiologique. A partir de ces éléments, nous avons ensuite calculé la sensibilité, la spécificité, ainsi que les valeurs prédictives positive et négative de la TEP-18FFDG.
5. RESULTATS
5.1. Données à l’inclusion :
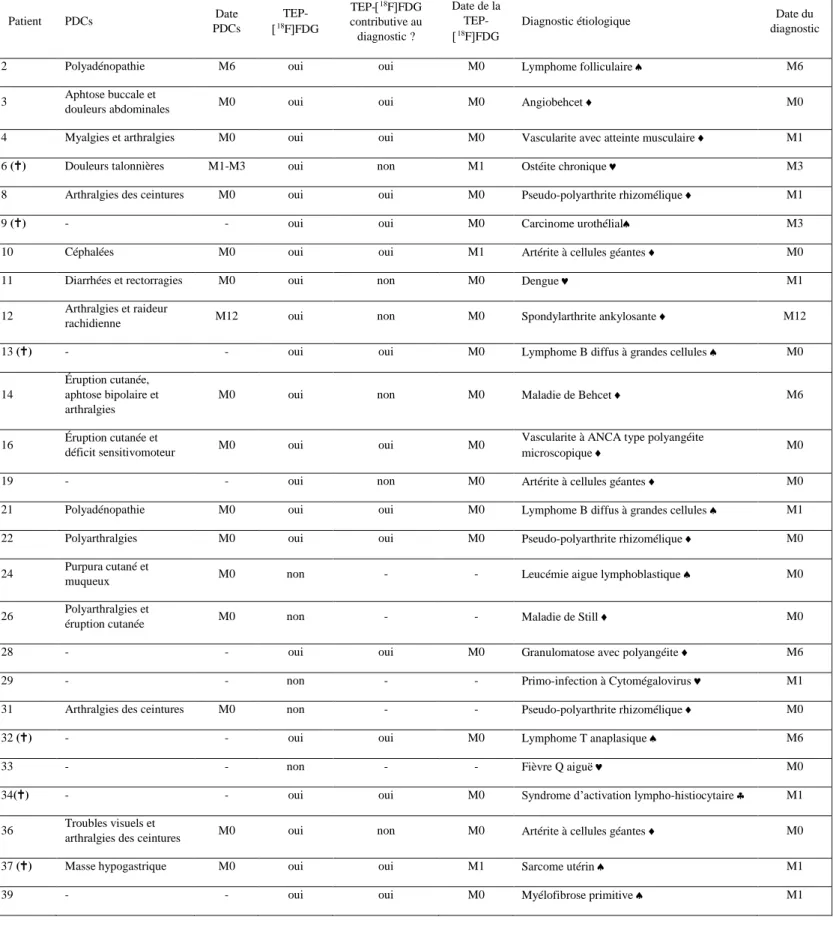
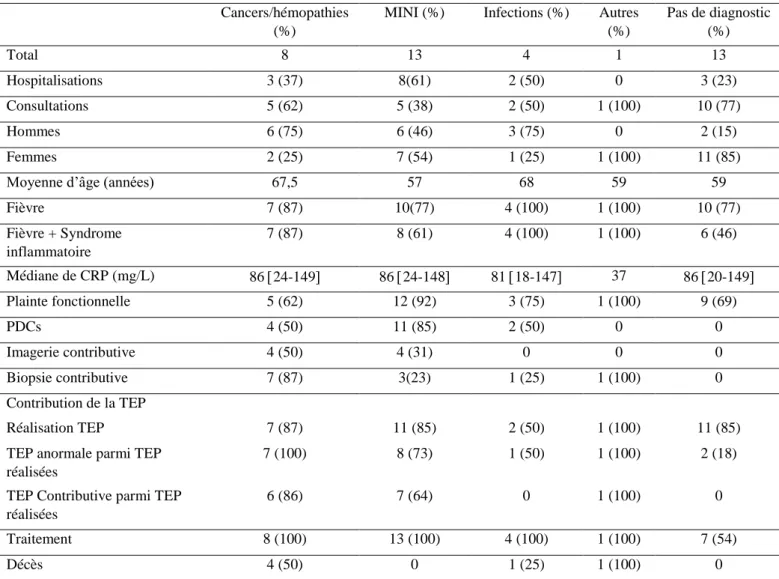
Trente-neuf patients ont été inclus entre décembre 2015 et novembre 2017, 32 (82%) patients FUO et 7 (18%) patients IUO (figure 3). Six patients du groupe FUO présentaient une fièvre sans syndrome inflammatoire. Vingt-trois patients (59%) étaient vus en consultation externe et 16 patients (41%) étaient hospitalisés. Vingt-huit patients (72%) ont été suivis en médecine interne et 11 patients (28%) en maladies infectieuses Dix-huit patients (46%) étaient des hommes et l’âge médian était de 63 ans [39-77]. Sur l’ensemble de la population, la température médiane était de 38,3°C [36.9-39] et la CRP médiane à l’inclusion de 83mg/l [20-149]. Trente-deux patients (82%) étaient fébriles depuis plus de trois semaines. Quatre patients avaient eu un contact avec un insecte ou un animal, et quatre patients avaient voyagé dans les trois mois précédents l’apparition de la fièvre ou du syndrome inflammatoire.
Une plainte fonctionnelle était manifestée par 30 patients (77%) à l’interrogatoire. Il s’agissait essentiellement d’arthralgies pour 17 patients (44%), de signes cutanés pour 15 patients (38%), et de troubles digestifs pour 13 patients (33%). L’examen clinique était anormal chez 16 patients (40%), avec principalement une éruption cutanée, une aphtose buccale ou bipolaire, une arthrite d’une ou plusieurs articulations, un déficit neurologique sensitivomoteur ou une polyadénopathie. Dix-sept patients (44%) présentaient un ou plusieurs PDCs, et tous ont eu un diagnostic final. Une éruption cutanée ou des arthralgies étaient les principaux signes orientant vers une maladie inflammatoire. Une polyadénopathie ou un syndrome de masse orientait vers un cancer ou une hémopathie (tableau 3).
5.2. Examens paracliniques et TEP-
18F
FDG:
Les examens biologiques étaient peu contributifs notamment lorsqu’ils étaient réalisés en l’absence de signes d’orientation clinique. Tous les patients ont eu un bilan biologique, et notamment un bilan infectieux comprenant des sérologies virales et bactériennes. Parmi les examens de microbiologie, la sérologie était contributive pour 3 patients (8%) et a permis un diagnostic de Dengue, de primo-infection à Cytomégalovirus et d’infection aigue à Coxiella burnetii. La culture bactérienne n’était utile que dans un cas d’ostéite chronique à Pseudomonas Aeruginosa et Entérococcus faecalis avec réalisation de prélèvements osseux profonds. La PCR bactérienne et les tests diagnostiques de la tuberculose (examen direct, culture, PCR et tests IGRA) n’ont jamais été contributifs.
Le bilan inflammatoire et immun était contributif pour 2 patients (5%). Il s’agissait d’une vascularite systémique à ANCA de type Polyangéite microscopique avec anticorps anti-MPO (Myéloperoxydase)) chez un patient présentant un tableau de neuropathie axonale associée à une insuffisance rénale aigue. Le second patient présentait des arthralgies et une éruption cutanée associée à une diminution de la fraction glycosylée de la ferritine conduisant au diagnostic de maladie de Still.
Concernant les marqueurs de néoplasie, seul l’immunophénotypage lymphocytaire sanguin a aidé au diagnostic de leucémie aigue lymphoblastique dans un cas et de lymphome B à grandes cellules dans un autre.
Tous les patients ont eu au moins un examen d’imagerie au cours du suivi, à savoir une TDM (Tomodensitométrie), une IRM (Imagerie par Résonance magnétique), un doppler ou une échographie. L’imagerie était contributive dans 8 cas (21%) respectivement 4 cas de néoplasies et 4 maladies inflammatoires non infectieuses. Seules la TDM et l’IRM étaient utiles au diagnostic.
Vingt-deux patients (56%) ont bénéficié de biopsies tissulaires. Les biopsies ont permis d’établir un diagnostic pour 12 patients (55%) : 4 lymphomes malins non Hodgkiniens, un cas de myélofibrose primitive, un cas de carcinome urothélial, un sarcome utérin, un cas d’ostéite chronique, une artérite gigantocellulaire, un syndrome d’activation lympho-histiocytaire idiopathique et 2 vascularites à ANCA. Aucun examen autopsique n’a été réalisé au cours de l’étude.
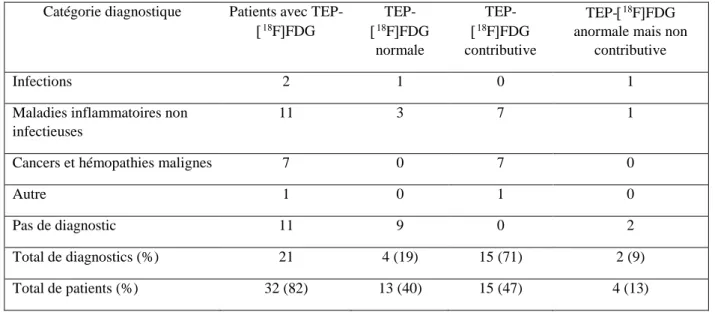
Trente-deux patients (82%) ont eu une TEP-18FFDG au cours du suivi. L’examen
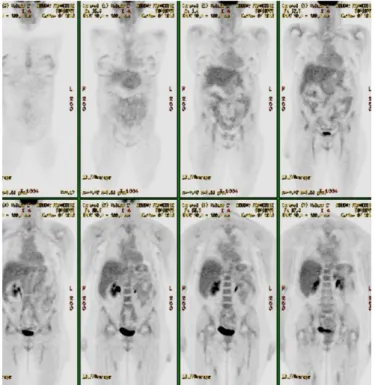
révélait une anomalie dans 19 cas (59%), et était jugé contributif (vrai positif) au diagnostic chez 15 patients (soit 47% des patients ayant bénéficié d’une TEP-18FFDG) (Tableau 4) : 7 causes malignes, (4 lymphomes malins, une myélofibrose primitive, un carcinome urothélial et un sarcome utérin), 7 maladies inflammatoires non infectieuses (5 vascularites et 2 rhumatismes inflammatoires) et une cause autre à savoir un syndrome d’activation lympho-histiocytaire dont l’origine est restée incertaine (figures 4 à 7). Onze biopsies tissulaires sur les douze conduisant au diagnostic final étaient guidées par la TEP-18FFDG. Dans 81% des cas, la TEP-18FFDG était réalisée dès l’inclusion du patient. L’examen était considéré comme un faux positif dans 4 cas (12,5%), un faux négatif dans 4 cas (12,5%) et un vrai négatif dans 9 cas (28%).
L’analyse des performances diagnostiques de la TEP-18FFDG pour la population totale
montrait une sensibilité de 74%, une spécificité de 69% et des valeurs prédictives positives et négatives respectivement de 79% et 69%. Concernant les 22 patients ne présentant pas de PDCs (56%), la sensibilité et la spécificité de la TEP-18FFDG étaient respectivement de 86% et 82% et les valeurs prédictives positives et négatives de 75% et 90%.
Parmi les 7 patients n’ayant pas eu de TEP-18FFDG, 5 ont eu un diagnostic final : un
cas d’infection aigue à Coxiella burnetii, une primo-infection à CMV, une pseudo-polyarthrite rhizomélique, une maladie de Still et une leucémie aigue lymphoblastique. Le diagnostic était posé par la clinique et/ou un examen biologique. Les 2 autres patients n’ayant pas eu de
5.3. Diagnostic étiologique :
Un diagnostic étiologique final a été posé pour 26 patients (67%). Les MINI étaient la principale étiologie (13 patients (50%) notamment l’artérite à cellules géantes et la pseudopolyarthrite rhizomélique (PPR), avec respectivement 3 et 3 patients (23%). Les causes malignes venaient ensuite (8 patients (31%)), principalement les hémopathies malignes (75%), puis les infections (4 patients (15%)), et enfin un syndrome d’activation lympho-histiocytaire (SALH) idiopathique classé dans la catégorie « autre » (4%) (Tableau 3). Aucun diagnostic de fièvre factice, iatrogène ou physiologique n’a été fait. Sur les sept patients fébriles depuis moins de 3 semaines, 4 patients avaient un diagnostic étiologique (une artérite à cellules géantes (ACG), une PPR, une fièvre Q aigue, et une maladie de Still).
Les délais nécessaires à poser un diagnostic étiologique étaient relativement courts : onze diagnostics (42% des patients avec un diagnostic final) étaient faits dès la visite d’inclusion, 10 entre 1 et 3 mois (39%), 4 à 6 mois (15%) et seulement un diagnostic à un an (4%). Le délai diagnostic moyen était de 1,25 mois pour les infections, 2 mois pour les MINI, 2,25 mois pour les cancers et hémopathies malignes, et enfin 1 mois pour le SAHL idiopathique. Les 5 patients ayant eu un diagnostic à 6 mois ou 1 an présentaient une pathologie inflammatoire systémique dans 3 cas (une maladie de Behcet, une granulomatose avec polyangéite et une spondylarthrite ankylosante (SPA)) et une hémopathie maligne dans 2 cas (un lymphome folliculaire et un lymphome T anaplasique). Parmi ces derniers, 3 présentaient des PDCs d’apparition tardive dans le suivi.
Nous avons analysé les différents éléments cliniques et paracliniques en fonction de la catégorie diagnostique (tableau 6). Les patients atteints de MINI présentaient plus de PDCs (11(85%)) principalement des arthralgies et éruptions cutanées. La TEP-18FFDG était plus
fréquemment réalisée chez les patients atteints de pathologies malignes et de MINI, et fortement contributive au diagnostic (respectivement 6 cas de néoplasie (86%) et 7 cas de MINI (64%)).
5.4. Traitement :
Un traitement a été introduit chez 32 patients (82%). Vingt-cinq patients (78%) pour lequel un diagnostic étiologique a été posé ont reçu un traitement en lien avec leur pathologie. Trois patients sans diagnostic final suivis en maladie infectieuse ont reçu une antibiothérapie d’épreuve par doxycycline, avec disparition de la fièvre dans 2 cas. Les autres patients étaient suivis en médecine interne et ont reçu respectivement une antibiothérapie d’épreuve par céphalosporine de 3ème génération dans un cas, une corticothérapie d’épreuve pour deux patients efficaces sur la fièvre et un traitement symptomatique par antalgiques et anti-inflammatoires non stéroïdiens dans le dernier cas, introduit à un an du suivi.
5.5. Suivi :
Quatre patients ont été perdus de vue (10%). Parmi eux, un patient avait un diagnostic de Dengue d’évolution favorable à un mois et trois patients étaient restés sans diagnostic étiologique. Six patients (17%) sont décédés au cours du suivi (tableau 3). Tous avaient un diagnostic étiologique et sont décédés de la pathologie responsable de la fièvre ou de l’inflammation. Il s’agissait de lymphomes ou cancers solides pour 4 cas, d’une infection osseuse et d’un SAHL idiopathique pour les deux derniers cas. Aucun patient sans diagnostic ayant eu le suivi prévu d’un an n’est décédé.
Trois patients présentaient une persistance de la fièvre au terme du suivi à un an, soit 9% des patients FUO : un patient atteint d’une SPA pour lequel le diagnostic n’a été posé qu’au bout d’un an, et deux patients sans diagnostic. Une disparition spontanée de la fièvre était constatée pour deux patients, respectivement à un mois et un an, avec cependant une persistance du syndrome inflammatoire biologique. Aucun des patients présentant une persistance de la
fièvre n’est décédé au cours du suivi. Quatre patients (11%) présentaient une persistance du syndrome inflammatoire biologique à un an, un patient atteint d’un cancer urothélial décédé au terme du suivi, un patient atteint de granulomatose avec polyangéite et 2 sans diagnostic.
5.6. Comparaison des patients FUO et IUO :
Trente-deux patients avaient de la fièvre (FUO) et 7 patients présentaient un syndrome inflammatoire biologique isolé (IUO). Le tableau 5 résume les caractéristiques de chacun des groupes. Il n’y avait pas de différence entre les deux groupes concernant l’âge et le sexe. Des éléments cliniques d’orientation étaient retrouvés à taux équivalent dans les deux groupes (44% du groupe FUO et 43% du groupe IUO). La CRP médiane était identique dans les 2 groupes (83mg/L [20-149] et [20-147,5]). La TEP-18FFDG était réalisée chez tous les patients IUO et 25 patients du groupe FUO (78%). Cependant, la contribution diagnostique était équivalente dans les deux groupes, respectivement de 43% et 44%.
Vingt-deux patients (69%) avaient un diagnostic final dans le groupe FUO, et 4 (57%) dans le groupe IUO. La répartition diagnostique était similaire dans les 2 groupes concernant les MINI et les cancers et hémopathies. Aucun patient du groupe IUO n’a présenté d’infection prouvée.
Vingt-sept patients (86%) ont reçu un traitement dans le groupe FUO. Parmi ces derniers, 7 n’avaient pas de diagnostic étiologique et ont reçu un traitement d’épreuve par antibiotiques ou corticoïdes. Dans le groupe IUO, seuls les 4 patients (57%) pour lesquels un diagnostic final était posé ont reçu un traitement. Le taux de décès était équivalent dans les deux groupes, 5 dans le groupe FUO (15%) et un dans le groupe IUO (14%).
6. DISCUSSION
Le concept de fièvre d’origine indéterminée est complexe et changeant. Les progrès de la médecine et la variation des étiologies de FUO au cours du temps sont en faveur d’une révision régulière de la définition afin de correspondre au mieux à l’évolution des pratiques médicales. Les changements de définition proposés par Petersdorf et al. , Durack et al. puis plus récemment par Knockaert et al. vont dans ce sens par une modification des frontières du cadre nosologique des FUO mais pas du concept, celui de diagnostic complexe face à un symptôme clinique ou biologique. En effet, certaines pathologies, notamment infectieuses ou cancéreuses qui pouvaient poser des problèmes diagnostiques à la fin du XXème siècle sont maintenant rapidement diagnostiquées par les techniques modernes, et pourraient sortir du champ des FUO/IUO. Dans cette étude prospective, nous avons pris le parti de reconsidérer la définition des FUO afin de mettre de côté certaines pathologies de diagnostic simple mais sans altérer le concept de FUO. Nous nous sommes ainsi focalisés sur les FUO de diagnostic difficile, plus problématiques, afin d’élaborer une stratégie pertinente et aider les cliniciens dans leur pratique. En nous rapprochant de la définition de Knockaert et al. , nous avons mis l’accent sur des critères qualitatifs, en proposant un bilan minimal complémentaire tel que réalisé dans la pratique quotidienne devant une fièvre ou un syndrome inflammatoire biologique. Ainsi, seuls les patients pour lesquels les hémocultures, l’examen cytobactériologique urinaire et la TDM TAP n’étaient pas contributifs au diagnostic étaient inclus. Ce changement a comme conséquence de modifier le spectre étiologique des FUO/IUO, mais de notre point de vue s’accorde mieux à la pratique actuelle. Nous avons également raccourci le délai d’apparition de la fièvre à une semaine au lieu de 3 semaines. En effet, le recours aux soins et aux spécialistes est de nos jours facilité et la réalisation des examens paracliniques plus rapide, rendant ainsi le délai de 3 semaines obsolète. Concernant la réduction du délai de fièvre à une semaine, 7
patients étaient fébriles depuis moins de 3 semaines, parmi lesquels 4 ont eu un diagnostic final. Il n’y avait pas de différence de répartition des étiologies associées aux FUO et IUO.
Concernant le syndrome inflammatoire, nous avons fixé un seuil de CRP à 5mg/L. En effet, il s’agit du seuil de définition du syndrome inflammatoire biologique déterminé par le laboratoire. Cependant, ce seuil est variable en fonction des études (de 20 à 30 mg/L) (8,9). Par ailleurs, contrairement à plusieurs études, nous avons choisi de ne pas utiliser la VS, car cet examen n’est plus réalisé en pratique courante du fait de nombreux biais dans son interprétation. Nos critères d’exclusion respectaient la définition des FUO de Durack et al. et les fièvres d’origine nosocomiale et de l’immunodéprimé n’étaient pas prisent en compte. De fait, ce type de FUO présente un spectre étiologique différent, notamment concernant les infections bactériennes, virales ou parasitaires. Par ailleurs, la fragilité des patients immunodéprimés nécessite souvent une prise en charge urgente incluant la mise en route rapide d’un traitement probabiliste (2,3). Étaient également exclus les patients sous antibiothérapie, du fait de risque de décapiter un prélèvement dans le cadre d’une infection bactérienne et inclure à tort le patient.
Entre décembre 2015 et décembre 2017, 39 patients ont été pris en charge au Centre Hospitalier de Grenoble Alpes pour une fièvre ou un syndrome inflammatoire inexpliqués. La répartition était homogène au sein des deux services de médecine interne et du service de maladies infectieuses (respectivement 72% et 28%). Un diagnostic étiologique était fait dans 67% des cas, avec en premier lieu les MINI (50%), suivies par les cancers et hémopathies malignes (31%), les causes infectieuses (15%) et enfin les causes autres (4%). Le taux de diagnostics dans notre centre est comparable aux données de la littérature (tableau 2). La répartition étiologique diffère cependant. En effet, dans la plupart des études les causes infectieuses (32%) et inflammatoires (30%) sont majoritaires, alors que la proportion des causes néoplasiques (12%) et des causes diverses (8%) est moindre.
Les infections bactériennes telles que l’endocardite infectieuse, une infection du tractus urinaire, un abcès profond ou encore la tuberculose pulmonaire font partie des principales causes infectieuses de FUO/IUO (4–6,12,15–17). Dans notre étude, l’exclusion des patients sur les données microbiologiques apportées par les hémocultures, l’examen bactériologique des urines et la réalisation d’une TDM TAP a fortement contribué à la diminution de la proportion des infections. Ainsi, aucune de ces pathologies n’a été diagnostiquée dans notre population. La sérologie a quant à elle une place discutée. En effet, réalisée à l’aveugle, son intérêt parait limité. Seules les sérologies CMV, EBV, toxoplasmose, Bartonella, ou encore parvovirus B19 semblent être utiles, notamment en l’absence d’orientation diagnostique (3,4). La primo-infection à CMV notamment, mal connue dans les années 60, est devenue une cause commune de FUO (3,4,12). La contribution de la sérologie est également supérieure dans certaines régions de France ou du monde, du fait d’une forte prévalence d’infections telles que la fièvre Q, la brucellose, ou encore les borrélioses (3,5,6). L’utilisation des sérologies parait adaptée selon l’épidémiologie locale et les signes cliniques d’orientation mais ne doit pas être systématique.
La recherche de tuberculose est également peu contributive dans notre étude, car la négativité de la TDM TAP limite fortement la probabilité de cette pathologie. Les tests IGRA (Quantiféron chez le sujet immunocompétent) ne devraient quant à eux pas être réalisés chez un patient avec une FUO/IUO isolée avec imagerie normale.
Le bilan auto-immun occupe une place importante lorsqu’une maladie auto-immune est suspectée, mais la présence isolée d’auto-anticorps ne permet pas de poser le diagnostic. La recherche de PDCs est donc bien plus importante qu’un bilan « systématique » pour le diagnostic de maladie auto immune. L’ACG et la PPR représentent près de la moitié de cette catégorie (46%). Ces deux étiologies sont la principale cause de FUO d’origine inflammatoire du sujet de plus de 50 ans (3–5,8,18). Le diagnostic est assez aisé lorsque le patient présente des PDCs tels que des céphalées ou des douleurs des ceintures, ce qui était le cas pour 83% des
patients atteints d’une ACG ou d’une PPR dans notre étude. Mais, il arrive qu’une fièvre isolée ou un syndrome inflammatoire biologique soit la seule manifestation clinique. C’est alors que la biopsie d’artère temporale (dont la sensibilité varie de 60 à 80%), et la TEP-18FFDG peuvent
contribuer au diagnostic. Cependant, la biopsie d’artère temporale, n’a été contributive que dans un cas d’ACG. La TEP-18FFDG a elle aidé au diagnostic dans 3 cas sur 6. Ces résultats
confirment que le diagnostic d’ACG et PPR doit reposer sur un faisceau d’arguments clinico-biologiques (recommandations diagnostiques ACR 1990 et EULAR 2009) et histologiques mais également scintigraphiques dans les cas difficiles. La maladie de Still de l’adulte est quant à elle en tête de liste des causes de FUO/IUO chez l’adulte jeune (3–6,19). La maladie de Behcet, dont la prévalence varie en fonction de la zone géographique d’étude, et les vascularites à ANCA sont des causes également classiques de FUO/IUO (4,6).
La réalisation de la TDM TAP dans le bilan d’inclusion limite la rentabilité des examens d’imagerie. Ainsi, même si tous les patients ont eu au moins un examen d’imagerie au cours du suivi, celui-ci avait souvent un but précis (TDM des sinus, TDM ou IRM cérébrale, IRM des membres, échographie cardiaque, doppler veineux) et donc une probabilité plus faible d’apporter le diagnostic.
La contribution diagnostique des biopsies tissulaires (ganglionnaire, ostéo-médullaire, artère temporale…) est plus élevée, de l’ordre de 55% et l’analyse histologique permet souvent de poser directement le diagnostic final. Les biopsies étaient utiles au diagnostic de 87,5% des cancers et hémopathies. Il faut cependant souligner que ce type de prélèvement n’est jamais réalisé à l’aveugle (sauf pour la biopsie d’artère temporale), et dépend de la découverte d’une formation tissulaire à l’examen clinique ou sur l’imagerie (4). Les hémopathies représentaient la première cause maligne de FUO/IUO avec une nette prédominance des lymphomes malins non Hodgkiniens de type B et T (50%). Ces données sont comparables à la littérature (4,5,12,18).
Un seul patient faisait partie de la catégorie « autre ». Ce dernier présentait un SALH considéré comme idiopathique et donc classé dans cette catégorie. Le SALH représente une cause émergente de FUO (3) mais pose également des problèmes diagnostiques dans la recherche de son étiologie. Dans le cas de notre série aucune pathologie causale n’a pu être mise en évidence malgré une forte suspicion de lymphome. Mais devant l’absence de confirmation histologique nous avons classé le patient comme idiopathique.
La TEP-18FFDG avait une place centrale dans notre étude. En effet, cet examen a été
réalisé chez 82% des patients, souvent de manière précoce (81% dès l’inclusion), et permettait d’aider au diagnostic dans 47% des cas. Outre l’analyse anatomopathologique, parfois guidée par la TEP-18FFDG, il s’agit de l’examen le plus rentable. Ce résultat est comparable à ceux de la littérature (tableau 2) (9,20–26). Les caractéristiques intrinsèques de la TEP-18FFDG (sensibilité de 74%, spécificité de 69%) sont proches de celles retrouvées dans la littérature (9,20–26). Il est intéressant de noter qu’en cas d’absence de PDCs la sensibilité augmente à 86% avec une valeur prédictive négative de 90%. Ces patients ont par ailleurs à 1 an une bonne évolution. Ces résultats inciteraient à réaliser précocement une scintigraphie aux patients présentant une FUO/IUO nue. En effet, la négativité de l’examen serait rassurante sur le pronostic, éviterait la réalisation d’examens supplémentaires peu rentables et ne justifierait que d’une surveillance clinique simple. La TEP-18FFDG était également plus contributive pour le
diagnostic de néoplasies ou hémopathies malignes (86%), et de maladies inflammatoires (64%). Plusieurs auteurs incitent à la prudence en soulignant la forte proportion de résultats anormaux de la TEP-18FFDG sans interprétation possible (20)(21). Néanmoins, seuls 4 faux positifs ont été trouvés dans notre étude.
Le taux de FUO et IUO sans diagnostic final à un an est relativement élevé (33%) dans notre étude. Ce résultat est superposable aux données de la littérature (tableau 2). Il souligne la complexité diagnostique des FUO/IUO, ce malgré les progrès technologiques actuels, et la
Cependant, aucun patient sans diagnostic à un an n’est décédé, ce qui tend à confirmer le pronostic favorable des FUO sans diagnostic final, comme le suggère d’autres équipes (3,4,7).
Le taux de PDCs dans notre étude était supérieur aux données de la littérature (3,11). Quarante-quatre pourcent des patients présentaient au moins un élément diagnostic clé à l’examen clinique permettant d’orienter la démarche diagnostique. Tous les patients présentant un PDCs ont eu un diagnostic final. Les diagnostics étaient posés rapidement, dès l’inclusion (42%) ou entre 1 et 3 mois (39%). Les pathologies dont le diagnostic était tardif étaient principalement les MINI et les cancers ou hémopathies malignes, dont la présentation était complexe. Par exemple, la patiente 32 a été hospitalisée pour une importante altération de l’état général fébrile. Cette dernière a eu une TEP-18FFDG dès l’inclusion montrant une hyperfixation splénique intense associée à des adénopathies médiastinales. Une splénectomie diagnostique réalisée à 1 mois est revenue normale. Une nouvelle biopsie ganglionnaire a finalement permis de faire le diagnostic de lymphome T anaplasique à 6 mois du suivi. Malgré les moyens mis en œuvre, cette patiente est décédée au cours de l’étude. Les signes de gravité comme une altération importante de l’état général associée à un résultat de TEP-18FFDG
anormal inciteraient donc à être d’avantage agressif dans la démarche diagnostique, comme le propose Knockaert dans son approche différenciée des patients FUO (3).
Trente-deux patients (82%) ont reçu un traitement, en lien avec le diagnostic final pour 25 d’entre eux (78%). En l’absence de diagnostic, un traitement symptomatique ou une antibiothérapie d’épreuve était plus volontiers introduit lorsque le patient présentait de la fièvre (26%), considérée probablement comme un symptôme gênant, que pour ceux avec un syndrome inflammatoire biologique isolé (aucun), alors que la répartition étiologique et le pronostic étaient semblables dans les deux groupes (Tableau 5). Par ailleurs, le type de traitement empirique diffère en fonction de la spécialité de prise en charge. Ainsi les patients suivis en maladies infectieuses recevaient une antibiothérapie à visée intracellulaire par tétracyclines, et les patients suivis en médecine interne une corticothérapie d’épreuve. L’antibiothérapie
d’épreuve par tétracyclines est fréquemment utilisée en pratique courante lors d’une suspicion d’infection à bactérie intracellulaire, dont la présentation peut-être une fièvre isolée et dont le diagnostic sérologique n’est pas évident (5). Il est cependant possible que la fièvre régresse spontanément, aussi certains auteurs proposent de ne pas recommander systématiquement de traitement d’épreuve (antibiothérapie ou corticothérapie) au vu du bon pronostic des patients sans diagnostic final (3,27).
Le taux de décès était de 15%, à chaque fois en lien avec la pathologie causale. Ce taux est semblable aux données de la littérature (6,7,27). Comme dans la plupart des études, la majorité des décès était liée à un cancer solide ou une hémopathie maligne (67%) (4).
Notre étude présente plusieurs avantages. Tout d’abord, le caractère prospectif sur 3 ans a permis un recueil exhaustif des données d’inclusion et de suivi des patients. Par ailleurs, comme expliqué précédemment, la réalisation préalable d’hémocultures bactériennes et la TDM TAP limitaient l’inclusion des patients aux véritables FUO/IUO de diagnostic difficile.
Cependant, certains biais sont à souligner. L’effectif réduit de patients restreint le panel de pathologies responsables de FUO/IUO et entraine un manque de puissance de l’étude. Ce manque de puissance ne nous permet qu’une description globale de la population, sans mettre en évidence de différence statistique. Il est également difficile de conclure sur l’apport diagnostique de certains examens paracliniques ou sur les performances diagnostiques extrinsèques de la TEP-18FFDG (valeurs prédictives positives et négatives). Quatre patients ont été perdus de vue au cours de l’étude (10%), dont trois sans diagnostic final, ce qui représente une proportion importante compte tenu du faible effectif de notre cohorte. Aucun de ces patients ne présentait de critère de gravité clinique. Seul le patient pour lequel un diagnostic de Dengue a été posé présentait un PDCs, à savoir des diarrhées sanglantes au retour de Thaïlande. Par ailleurs, ces 4 patients ont eu une TEP-18FFDG, mais jamais celle-ci n’a été contributive. Ainsi, au vu de l’état clinique rassurant de ces patients, de l’apport diagnostic des
PDCs et de la bonne valeur prédictive négative de la TEP-18FFDG en l’absence de PDCs, l’impact de ces PDV sur les résultats de notre étude pourrait être négligeable.
En conclusion, au vu des résultats de notre étude, nous suggérons deux modifications dans la prise en charge des FUO et IUO. Tout d’abord, la définition des FUO et IUO nécessiterait d’être modifiée pour s’adapter aux pratiques médicales actuelles. En effet, la réalisation d’un bilan initial minimum (hémocultures, ECBU, TDM TAP) permettrait d’écarter certaines étiologies de diagnostic simple.
Ensuite, nous proposons une stratégie diagnostique basée sur la présentation de la FUO ou de l’IUO (figure 8) : 1) Si le patient présente des signes fonctionnels ou symptômes cliniques permettant au médecin de formuler une ou plusieurs hypothèses diagnostiques, la réalisation d’examens paracliniques adaptés est justifiée (sérologies, bilan auto-immun, etc.). 2) En cas de négativité de ces examens ou d’absence de signe d’orientation, et en l’absence d’élément de gravité clinico-biologique, la réalisation d’une TEP-18FFDG doit-être discutée en première intention. Si l’examen est normal, une pathologie grave peut raisonnablement être écartée et une surveillance clinique et biologique simple peut-être proposée au patient. La mise en route d’un traitement d’épreuve ne parait alors pas recommandée. Dans le cas contraire, le médecin réalisera les explorations complémentaires orientées par les résultats de la TEP-18FFDG ; 3) Des signes de gravité clinico-biologiques ou une dégradation de l’état général du patient justifient la réalisation d’examens complémentaires multiples, incluant une nouvelle fois la TEP-18FFDG. En cas d’absence de diagnostic, un traitement d’épreuve doit-être discuté selon le degré d’urgence. Dans tous les cas, le recours aux examens paracliniques ne doit pas se faire au détriment d’un interrogatoire et d’un examen clinique rigoureux et répétés, qui seuls peuvent
aider le médecin dans son cheminement diagnostic. Ce protocole s’apparente à celui proposé par Knockaert et al., mais est davantage basé sur la
présentation initiale du patient (PDCs, signes de gravité) et l’intérêt précoce de la
TEP-18FFDG. Celui-ci devra faire l’objet d’une étude prospective à plus grande échelle afin d’en
7. REFERENCES :
1. Petersdorf RB, Beeson PB. Fever of unexplained origin: report on 100 cases. Medicine (Baltimore). 1961;40:1-30.
2. Durack DT, Street AC. Fever of unknown origin--reexamined and redefined. Curr Clin Top Infect Dis. 1991;11:35‑51.
3. Knockaert DC, Vanderschueren S, Blockmans D. Fever of unknown origin in adults: 40 years on. Journal of Internal Medicine. mars 2003;253(3):263‑75.
4. Vanderschueren S, Knockaert D, Adriaenssens T, Demey W, Durnez A, Blockmans D, et al. From Prolonged Febrile Illness to Fever of Unknown Origin: The Challenge Continues. Archives of Internal Medicine. 12 mai 2003;163(9):1033.
5. Zenone T. Fever of unknown origin in adults: Evaluation of 144 cases in a non-university hospital. Scandinavian Journal of Infectious Diseases. janv 2006;38(8):632‑8. 6. Saltoglu N, Tasova Y, Midikli D, Aksu HS., Sanli A, Dündar IH. Fever of unknown origin in Turkey: evaluation of 87 cases during a nine-year-period of study. Journal of Infection. janv 2004;48(1):81‑5.
7. Vanderschueren S, Eyckmans T, De Munter P, Knockaert D. Mortality in patients presenting with fever of unknown origin. Acta Clinica Belgica. févr 2014;69(1):12‑6.
8. Vanderschueren S, Del Biondo E, Ruttens D, Boxelaer IV, Wauters E, Knockaert DDC. Inflammation of unknown origin versus fever of unknown origin: Two of a kind. European Journal of Internal Medicine. juill 2009;20(4):415‑8.
9. Balink H, Bennink RJ, Veeger NJGM, van Eck-Smit BLF, Verberne HJ. Diagnostic Utility of 18F-FDG PET/CT in Inflammation of Unknown Origin: Clinical Nuclear Medicine. mai 2014;39(5):419‑25.
10. Bleeker-Rovers CP, van der Meer JWM, Oyen WJG. Fever of Unknown Origin. Seminars in Nuclear Medicine. mars 2009;39(2):81‑7.
11. Takeda R, Mizooka M, Kobayashi T, Kishikawa N, Yokobayashi K, Kanno K, et al. Key diagnostic features of fever of unknown origin: Medical history and physical findings. Journal of General and Family Medicine. juin 2017;18(3):131‑4.
12. De Kleijn E. Fever of unknown origin (FUO). I A. prospective multicenter study of 167 patients with FUO, using fixed epidemiologic entry criteria. The Netherlands FUO Study Group. :7.
13. Jolobe OMP. Molecular diagnostics in FUO. QJM: An International Journal of Medicine. 1 mars 2018;111(3):209‑209.
14. Mulders-Manders CM, Simon A, Bleeker-Rovers CP. Response to Jolobe: ‘Molecular diagnostics in FUO’. QJM: An International Journal of Medicine. 1 mars 2018;111(3):211‑211. 15. Önal İK, Cankurtaran M, Çakar M, Halil M, Ülger Z, Doğu BB, et al. Fever of unknown origin: What is remarkable in the elderly in a developing country? Journal of Infection. juin 2006;52(6):399‑404.
spectrum of diseases causing fever of unknown origin in Turkey: a multicenter study. International Journal of Infectious Diseases. janv 2008;12(1):71‑9.
17. Naito T, Mizooka M, Mitsumoto F, Kanazawa K, Torikai K, Ohno S, et al. Diagnostic workup for fever of unknown origin: a multicenter collaborative retrospective study. BMJ Open. déc 2013;3(12):e003971.
18. Yamanouchi M, Uehara Y, Yokokawa H, Hosoda T, Watanabe Y, Shiga T, et al. Analysis of 256 Cases of Classic Fever of Unknown Origin. Internal Medicine. 2014;53(21):2471‑5.
19. Robine A, Hot A, Maucort-Boulch D, Iwaz J, Broussolle C, Sève P. Fever of unknown origin in the 2000s: Evaluation of 103 cases over eleven years. La Presse Médicale. sept 2014;43(9):e233‑40.
20. Blockmans D, Knockaert D, Maes A, De Caestecker J, Stroobants S, Bobbaers H, et al. Clinical Value of [18F]fluoro-Deoxyglucose Positron Emission Tomography for Patients with Fever of Unknown Origin. Clinical Infectious Diseases. 15 janv 2001;32(2):191‑6.
21. Buysschaert I, Vanderschueren S, Blockmans D, Mortelmans L, Knockaert D. Contribution of 18fluoro-deoxyglucose positron emission tomography to the work-up of patients with fever of unknown origin. European Journal of Internal Medicine. juin 2004;15(3):151‑6.
22. Bleeker-Rovers CP, Vos FJ, Mudde AH, Dofferhoff ASM, de Geus-Oei L-F, Rijnders AJ, et al. A prospective multi-centre study of the value of FDG-PET as part of a structured diagnostic protocol in patients with fever of unknown origin. European Journal of Nuclear Medicine and Molecular Imaging. mai 2007;34(5):694‑703.
23. Keidar Z, Gurman-Balbir A, Gaitini D, Israel O. Fever of Unknown Origin: The Role of 18F-FDG PET/CT. Journal of Nuclear Medicine. 7 nov 2008;49(12):1980‑5.
24. Dong M, Zhao K, Liu Z, Wang G, Yang S, Zhou G. A meta-analysis of the value of fluorodeoxyglucose-PET/PET-CT in the evaluation of fever of unknown origin. European Journal of Radiology. déc 2011;80(3):834‑44.
25. Tokmak H, Ergonul O, Demirkol O, Cetiner M, Ferhanoglu B. Diagnostic contribution of 18F-FDG-PET/CT in fever of unknown origin. International Journal of Infectious Diseases. févr 2014;19:53‑8.
26. Hung B-T, Wang P-W, Su Y-J, Huang W-C, Chang Y-H, Huang S-H, et al. The efficacy of 18 F-FDG PET/CT and 67 Ga SPECT/CT in diagnosing fever of unknown origin. International Journal of Infectious Diseases. sept 2017;62:10‑7.
27. Bobbaers J. Long-term Follow-up of Patients With Undiagnosed Fever of Unknown Origin. :3.
8. ANNEXES
Tableau 1 : Évolution de la définition des FUO au cours du temps
R.B. Petersdorf (1961) Etat fébrile depuis plus de 3 semaines, avec une
température > 38,3°C à plusieurs reprises, sans diagnostic au terme d'une semaine d'investigations hospitalières
D.T. Durack (1991) Reprise de la définition précédente
mais distinction des FUO classiques et des FUO
nosocomiales, du patient VIH et du patient neutropénique
et délai de 3 jours d'investigations hospitalières OU au
cours de 3 consultations
D.C. Knockaert (2003) Reprise de la définition précédente
mais absence de diagnostic au terme de la réalisation
d'explorations appropriées, sans délai d'hospitalisation ou de consultations
Tableau 2 : Comparaison des données de la littérature concernant les catégories diagnostiques des FUO/IUO et des performances de la TEP-18FFDG. NB : MINI : Maladies inflammatoires non infectieuses ;
Prosp. /Rétrosp. : Prospective/ Rétrospective ; Pc FUO ; Pronostic des FUO
Auteur Pays Thème Année Effectif Type d’étude Diagnostic (%) Infection
(%) Néoplasie (%) MINI (%) Autre (%) Inconnue (%) Contribution TEP (%) De Kleijn &
Bleeker- Pays bas FUO 1997 167 Prosp. 70 26 13 24 5 30 -
Vanderscheuren Belgique FUO 2003 290 Prosp. 66 30 15 35 20 34 -
Saltoglu Turquie FUO 2004 87 Prosp. 94 59 14 18 2 6 -
Önal Turquie FUO 2006 97 Rétrosp. 65 36 16 8 5 35 -
Zenone France FUO 2006 144 Rétrosp. 74 31 13 35 20 26 -
Kucucardali Turquie FUO 2008 154 Prosp. 85 34 14 30 5 15 -
Efstathiou Grèce FUO 2009 112 Prosp. 80 30 10 33 5 20 -
Naito Japon FUO 2013 121 Rétrosp. 67 23 10 31 12 23 -
Robine - Hot France FUO 2013 103 Rétrosp. 50 23,5 6 61 10 51 21
Yamanoushi Japon FUO 2013 256 Rétrosp. 71 28 10 18 - 29 -
Takeda Japon FUO 2015 42 Rétrosp. 79 17 12 43 7 21 -
Knokaert Belgique IUO et FUO 2009 57 Prosp. 61/58 23/27 14/30 46 17 39/42 36/33
Balink Pays bas IUO et TEP 2014 140 Rétrosp. 74 25 13 31 5 26 68
Blockmans Belgique TEP 2001 58 Prosp. 64 18 10 29 9 36 41
Buysschaert Belgique TEP 2004 74 Rétrosp. 53 18 10 31 41 47 26
Bleeker-Rovers Pays bas TEP 2007 70 Prosp. 50 17 7 23 3 50 66
Keidar Israel TEP 2008 48 Prosp. 55 29 6 23 2 45 81
Pedersen Danemark TEP 2011 52 Rétrosp. 60 32 13 55 0 40 45
Tokmak Turquie TEP 2013 50 Rétrosp. 88 44 14 30 0 12 60
Balink Pays bas IUO et TEP 2014 140 Rétrosp. 74 25 13 31 5 26 68
Figure 1: Procédure d'inclusion des patients FUO/IUO