En vue de l'obtention du
DOCTORAT DE L'UNIVERSITÉ DE TOULOUSE
Délivré par :Institut National Polytechnique de Toulouse (INP Toulouse) Discipline ou spécialité :
Agrosystèmes, Écosystèmes et Environnement
Présentée et soutenue par :
Mme CLAIRE BARBET - MASSIN le vendredi 3 juillet 2015
Titre :
Unité de recherche : Ecole doctorale :
SELECTIONNER ET CULTIVER STEVIA REBAUDIANA BERTONI EN
MILIEU TEMPERE: EXPLORATION DE LA VARIABILITE DE LA TENEUR
ET DE LA COMPOSITION EN GLYCOSIDES DE STEVIOL
Sciences Ecologiques, Vétérinaires, Agronomiques et Bioingénieries (SEVAB) Ecole d'Ingénieur Purpan (EI PURPAN)
Directeur(s) de Thèse : M. JEAN DAYDE
Rapporteurs :
M. JAN GEUNS, KATHOLIEKE UNIVERSITEIT LEUVEN Mme HUGUETTE SALLANON, UNIVERSITE D'AVIGNON M. PIERRE WAFFO-TEGUO, UNIVERSITE BORDEAUX 2
Membre(s) du jury :
1 M. PHILIPPE DEBAEKE, INRA TOULOUSE, Président
2 M. JEAN DAYDE, EI PURPAN, Membre
2 M. JOEL PERRET, STEVIA NATURA SAS, Membre
2 M. LIONEL ALLETTO, EI PURPAN, Membre
1
Remerciements
Ce travail a eu lieu dans le cadre du projet STEVIANOV, Fonds Unique Interministériel labellisé par Agri Sud-Ouest Innovation et financé par BPI et la Région Midi-Pyrénées. Ce projet est le fruit d’un partenariat entre l’Epi Salvagnacois (Salvagnac, 81), la société Stevia Natura (Riom, 63), l’entreprise La Patelière (Condom, 32), le laboratoire de Chimie Agro-Industrielle (LCA) UMR 1010 INRA/INPT-ENSIACET (Toulouse, 31), et les laboratoires d’Agronomie et d’Agrophysiologie de l’INP-EI Purpan (Toulouse, 31).
J’adresse en premier lieu mes remerciements à mes encadrants, Monique Berger, qui m’a guidée au quotidien durant ces trois années et Jean Daydé, présent à chaque étape cruciale de ma thèse. J’ai beaucoup apprécié nos échanges, nourris par la culture scientifique inépuisable et la créativité de Monique et par la vision d’ensemble toujours juste de Jean.
Mes remerciements s’adressent aussi à Lionel Alletto, Enseignant Chercheur en agronomie qui a participé à l’encadrement de cette thèse, et à Simon Giuliano, Ingénieur de recherche en agronomie investi dans le projet STEVIANOV. Travailler avec eux fut un plaisir et leur réactivité, tant sur le terrain que pour les relectures et corrections, fut très appréciable.
Un grand merci à Geoffray Laurens-Lambert, François Perdrieux et John Wey, techniciens de recherche impliqués dans le projet, qui ont participé à sa mise en place et aux expérimentations, de la construction de la serre aux analyses en laboratoire, en passant par (des milliers de) boutures, rempotage, effeuillage. Cette thèse n’aurait pu avoir lieu sans eux.
Je remercie BPI et la Région Midi-Pyrénées, qui ont financé le projet STEVIANOV et ce travail de thèse. Je remercie également l’ensemble des partenaires du projet avec lesquels j’ai interagi durant ces trois années : Rémy Andrieu, gérant de l’Epi Salvagnacois, Charlotte Sohy, chargée biocombustibles et David Puggia, technicien silo et culture ; Joël Perret, président de Stevia Natura et Mathieu Penin, R&D ; Didier Cruvelier, directeur de La Patelière ; Gérard Vilarem et Marion Alignan, ingénieurs de recherche au LCA et Jean-Baptiste Jentzer, doctorant. Un grand merci aussi aux agriculteurs impliqués dans le projet, MM. Beneschi et Laur.
J’adresse ma gratitude aux membres de mon comité de thèse pour leurs conseils avisés et le temps qu’ils m’ont consacré : Jane Hubert, Pierre Maury, Joël Perret. Je remercie
REMERCIEMENTS
2 également Jan Geuns, Huguette Sallanon et Pierre Waffo-Teguo, qui ont accepté d’évaluer ce travail de thèse en tant que rapporteurs. Merci aussi à Joël Perret et Philippe Debaeke d’avoir accepté d’examiner ce travail.
J’adresse mes chaleureux remerciements à Djamila Lekhal et à Frédéric Violleau, directeurs du Département des Sciences Agronomiques et Agro-alimentaires et du laboratoire d’Agro-physiologie Agro-molécules de l’INP-EI Purpan, pour m’avoir intégrée dans leurs équipes. Je remercie ces mêmes équipes et notamment Mireille Gaucher sans qui je n’aurais pu faire toutes les analyses en laboratoire. Je remercie aussi Alban Jacques, pour sa gentillesse et ses conseils avisés lors de la rédaction.
Un grand merci aux stagiaires qui ont participé à ce travail, et s’y sont largement investis : Mathieu Giraud, Jean-Baptiste Hilaire, Dina Banjarnahor, Audrey Castaing, Bastien Fregeat, Gonzalo Garcia, Eduardo Salazar.
Je remercie toute l’équipe de la maintenance de l’EI Purpan, qui a été d’une grande aide à de multiples reprises au cours de ce travail de thèse.
Je remercie également l’ensemble des techniciens de recherche de la station expérimentale de Lamothe et tous les stagiaires qui y ont été durant ces trois années. Le fonctionnement solidaire de cette station expérimentale les a amenés à contribuer au bon déroulement des expérimentations, en particulier lors de la récolte. Merci !
Merci aussi à toute l’équipe des doctorants et associés de Purpan, pour tous ces bons moments passés ensemble : Maria, Jérôme, Sébastien, Jonas, Ana, Romain, Sophie, Marielle, Eugénie, Caroline, Antoine, Emmanuelle, Simon, Hélène et bien sûr Mickaël !
Enfin je remercie tous mes proches pour leur soutien, leurs encouragements et pour leur présence pleine d’humour et de sérénité à mes côtés.
3
Table des matières
REMERCIEMENTS ... 1
TABLE DES MATIERES ... 3
LISTE DES ABBRÉVIATIONS ... 7
RESUME ... 11
ABSTRACT ... 12
INTRODUCTION GENERALE ... 13
PARTIE 1. CONTEXTE SCIENTIFIQUE ET PROBLEMATIQUE ... 17
CHAPITRE 1 : STEVIA REBAUDIANA BERTONI, LA PLANTE ET SA CULTURE ... 19
1. DESCRIPTION GENERALE ... 21
1.1. Origine et classification ... 21
1.2. Description botanique ... 22
1.3. Cycle de développement ... 24
2. CARACTERISTIQUES AGRONOMIQUES ... 27
2.1. La plante dans son habitat d’origine ... 27
2.2. Conduite de S. rebaudiana en milieu tempéré ... 27
2.2.1. Type de sol et intrants ... 28
2.2.2. Besoins en eau ... 28
2.2.3. Implantation ... 29
2.2.4. Adventices et maladies ... 30
2.2.5. Récolte ... 32
3. DOMESTICATION DE L’ESPECE ... 33
3.1. Modes de propagation de l’espèce et sélection variétale ... 33
3.1.1. Sélection variétale en vue d’une propagation sexuée ... 33
3.1.2. Sélection variétale en vue d’une propagation asexuée ... 35
3.2. Critères de sélection ... 37
3.2.1. Teneur et composition en glycosides de stéviol ... 38
3.2.2. Critères morphologiques ... 38
CHAPITRE 2 : LES GLYCOSIDES DE STEVIOL ... 41
1. CARACTERISTIQUES ... 43
1.1. Structure chimique ... 43
1.2. Caractéristiques organoleptiques ... 47
1.3. Extraction et dosage des glycosides de stéviol ... 48
2. BIOSYNTHESE DES GLYCOSIDES DE STEVIOL ... 51
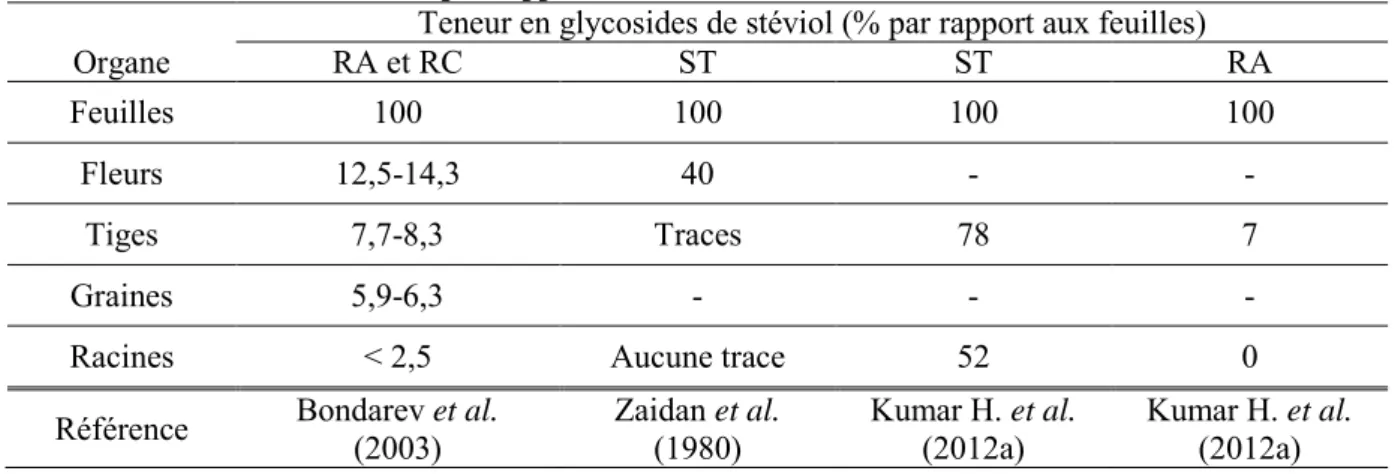
2.1. Distribution des glycosides de stéviol dans la plante ... 51
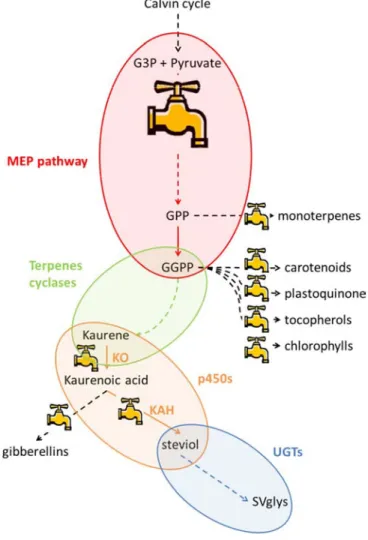
2.2. Voie de biosynthèse des glycosides de stéviol ... 51
2.2.1. Voie du MEP ... 52
2.2.2. Terpènes cyclases ... 53
2.2.3. Cytochromes p450 ... 56
2.2.4. Glycosyltransferases ... 56
TABLE DES MATIÈRES
4
2.3. Enzymes-clés pour la régulation de la voie de biosynthèse des SVglys ... 61
2.3.1. Enzymes communes aux gibbérellines et au stéviol ... 62
2.3.2. Enzymes spécifiques aux glycosides de stéviol ... 62
2.3.3. Régulation de la composition en glycosides de stéviol ... 63
3. ROLE DES GLYCOSIDES DE STEVIOL DANS LA PLANTE ... 65
3.1. Le stéviol, précurseur de gibbérellines ... 65
3.2. Une réserve d’énergie ... 66
3.3. Des osmolytes ... 67
3.4. Des pièges à espèces réactives de l’oxygène ... 68
3.5. En défense contre les ravageurs ... 69
4. VARIABILITE DE LA TENEUR ET DE LA COMPOSITION EN GLYCOSIDES DE STEVIOL DANS LES FEUILLES ... 71
4.1. Effet du génotype ... 71
4.2. Facteurs ontogéniques et environnementaux ... 73
4.2.1. Stade de développement ... 73
4.2.2. Photopériode et âge de la feuille ... 74
4.2.3. Intensité lumineuse et source de carbone ... 75
4.2.4. Température ... 76
4.2.5. Eau et éléments nutritifs ... 76
CHAPITRE 3 : OBJECTIFS DE THESE ET MOYENS MIS EN ŒUVRE ... 79
1. OBJECTIFS DE THESE ... 81
2. MATERIEL VEGETAL ... 83
2.1. Origine du matériel végétal ... 83
2.2. Mode de propagation ... 83
3. SITES EXPERIMENTAUX ... 87
PARTIE 2. VARIABILITE GENOTYPIQUE ET INTERACTIONS GENOTYPE-ENVIRONNEMENT ... 91
INTRODUCTION DE LA PARTIE 2 ... 93
CHAPITRE 4. EFFETS GENOTYPIQUES SUR LA TENEUR ET LA COMPOSITION EN GLYCOSIDES DE STEVIOL ET SUR DIVERS CARACTERES MORPHO-PHYSIOLOGIQUES ... 97
1. EVALUATION DE LA VARIABILITE GENOTYPIQUE POUR LA TENEUR ET LA COMPOSITION EN GLYCOSIDES DE STEVIOL ... 99
1.1. Introduction ... 99
1.2. Materials & Methods ... 103
1.2.1. Plant material and growth conditions ... 103
1.2.2. Steviol glycosides content and composition in leaves ... 104
1.2.3. Statistical analysis ... 104
1.3. Results ... 105
1.3.1. Genotypic variability in steviol glycosides content and composition ... 105
1.3.2. Environmental effects on steviol glycosides content and composition ... 106
1.4. Discussion ... 108
2. EVALUATION DE LA VARIABILITE DE CARACTERES MORPHO-PHYSIOLOGIQUES ... 111
2.1. Introduction ... 111
2.2. Matériels et méthodes ... 112
2.2.1. Matériel végétal et conditions de croissance ... 112
2.2.2. Mesures ... 112
2.2.3. Traitement des résultats ... 113
2.3. Résultats et discussion... 113
2.3.1. Caractéristiques morphologiques des feuilles ... 113
2.3.2. Caractéristiques morphologiques et de précocité des plantes ... 115
2.3.3. Evaluation des génotypes sur l’ensemble des caractères morpho-physiologiques ... 115
5
CHAPITRE 5. CARACTERISATION DE CLONES DANS DIFFERENTS CONTEXTES PEDOCLIMATIQUES ... 119
1. INTRODUCTION... 121
2. MATERIELS ET METHODES ... 123
2.1. Matériel végétal et conditions de croissance ... 123
2.1.1. Matériel végétal ... 123
2.1.2. Conditions de culture et prélèvements ... 124
2.2. Mesures ... 125
2.2.1. Composantes du rendement ... 125
2.2.2. Teneur et composition en glycosides de stéviol ... 125
2.2.3. Traitement des résultats ... 126
3. RESULTATS ... 127
3.1. Evaluation des génotypes au stade bouton floral ... 127
3.1.1. Symptômes foliaires de maladies ... 127
3.1.2. Evaluation du rendement ... 128
3.2. Cinétique d’accumulation des glycosides de stéviol et élaboration de la biomasse ... 129
3.2.1. Elaboration de la biomasse ... 129
3.2.2. Accumulation en glycosides de stéviol ... 130
3.2.3. Rendement en glycosides de stéviol aux différents stades de prélèvement ... 132
4. DISCUSSION ... 133
CONCLUSION DE LA PARTIE 2 ... 137
PARTIE 3. CONDUITE AGRONOMIQUE ET ANALYSE ECOPHYSIOLOGIQUE ... 139
INTRODUCTION DE LA PARTIE 3 ... 141
CHAPITRE 6. CINETIQUE D’ACCUMULATION DES GLYCOSIDES DE STEVIOL SELON LE STADE DE DEVELOPPEMENT, L’AGE DE LA FEUILLE ET LA LONGUEUR DE JOUR ... 143
1. INTRODUCTION... 145
2. MATERIELS ET METHODES ... 147
2.1. Matériel végétal ... 147
2.2. Conditions de croissance ... 147
2.3. Prélèvements et mode d’échantillonnage ... 148
2.3.1. Essai 1 ... 148
2.3.2. Essai 2 ... 149
2.4. Mesures ... 149
2.4.1. Elaboration de la biomasse ... 149
2.4.2. Teneur et composition en glycosides de stéviol ... 150
2.5. Traitement des résultats ... 150
3. RESULTATS ... 151
3.1. Accumulation en glycosides de stéviol ... 151
3.1.1. Teneur totale en glycosides de stéviol ... 151
3.1.2. Composition en glycosides de stéviol ... 153
3.2. Elaboration de la biomasse et rendement en glycosides de stéviol ... 155
3.2.1. Elaboration de la biomasse ... 155
3.2.2. Rendement en glycosides de stéviol ... 157
4. DISCUSSION ... 159
CHAPITRE 7. EFFET DE LA FERTILISATION SUR L’ELABORATION DE LA BIOMASSE, LA TENEUR ET LA COMPOSITION EN GLYCOSIDES DE STEVIOL ... 163
1. INTRODUCTION... 165
2. MATERIALS AND METHODS ... 169
TABLE DES MATIÈRES
6
2.2. Experiments and growth conditions ... 169
2.2.1. Controlled and semicontrolled conditions... 169
2.2.2. Field conditions ... 170
2.3. Sampling and harvest analysis ... 171
2.4. Nitrogen content in leaves ... 171
2.5. Steviol glycoside content and composition in leaves ... 172
2.6. Leaf gas-exchange measurements ... 172
2.7. Statistical analysis ... 173
3. RESULTS ... 175
3.1. Nitrogen content in leaves ... 175
3.2. Yield components ... 176
3.2.1. Biomass production ... 176
3.2.2. Steviol glycosides content ... 178
3.2.3. Steviol glycoside production per plant ... 178
3.3. Plant physiology and photosynthetic capacity ... 178
3.3.1. Light response curves ... 178
3.3.2. Relationship between specific leaf nitrogen and maximal rate of CO2 assimilation ... 179
3.4. Steviol glycosides composition ... 181
4. DISCUSSION ... 183
CONCLUSION DE LA PARTIE 3 ... 186
DISCUSSION GENERALE ET PERSPECTIVES ... 188
LISTE DES FIGURES ... 196
LISTE DES TABLEAUX ... 198
REFERENCES BIBLIOGRAPHIQUES ... 200
7
Liste des abbréviations
ACN: acétonitrile
Amax: maximum net rate of CO2 assimilation
B: bore
BF: bouton floral Ca: calcium
CBSC: carbon-based secondary compounds CC: controlled conditions
CDP: copalyl diphosphate
CMK: 4-diphosphocytidyl-2-C-méthyl- D-érythritol kinase CMS: 4-diphosphocytidyl-2-C-méthyl- D-érythritol synthase CNB: carbon-nutrient balance
Co: cobalt Cu: cuivre
CO2: dioxide de carbone
CPC: chromatographie de partage centrifuge CPS: copalyl diphosphate synthase
CYP450: cytochrome P450 C/N: ratio carbone/azote DA: dulcoside A
DHS: distinction-homogénéité-stabilité DM: dry matter
DMAPP: diméthylallyl diphosphate DXP:
DXR: déoxyxyulose-5-phosphate réductoisomérase DXS: déoxyxyulose-5-phosphate synthase
ETP: évapotranspiration potentielle F: floraison
FC: field conditions Fe: fer
Fru: fructose G: génotype
GA: gibberellic acid GC: growth conditions
GGDP: géranylgéranyl diphosphate
GGDPS: géranylgéranyl diphosphate synthase Glc: glucose
LISTE DES ABBRÉVIATIONS
8 GPP: géranyl diphosphate
GRAS: generally recognized as safe
G3P: glycéraldéhyde 3-phosphate
HDR: 1-hydroxy-2-méthyl-2(E)-butényl 4-diphosphate réductase HDS: 1-hydroxy-2-méthyl-2(E)-butényl 4-diphosphate synthase HI: harvest index
HILIC: Hydrophilic Liquid Interaction Chromatographic HMBPP: 4-hydroxy-3-méthylbut-2-ényl diphosphate
HPLC: chromatographie en phase liquide à haute performance HPS: high-pressure sodium
I: photosynthetic photon flux density IDI: isopentényl diphosphate isomérase IGE : interactions génotype - environnement Ik: light-saturation point
IPP: isopentényl diphosphate K: potassium
KAH: kaurénoic acid hydroxylase KAO: kaurénoic acid oxygénase KO: kaurène oxidase
KS: kaurène synthase LD: long days
LMA: leaf mass per unit leaf area LMR: leaf mass ratio
LS: location site
LSD: least significant difference
MCS: 4-diphosphocytidyl-2-C-méthyl- D-érythritol 2,4-cyclodiphosphate synthase MDWSR: midday water stress response
MEP: 2-C-méthyl-D-érythritol 4-phosphate Mg: magnésium
MH: metal-halide Mn: manganèse Mo: molybdène MO: matière organique MS: matière sèche N: azote
NO3-: nitrate
9 PA: plant age
PAR: photosynthetically active radiation PCA: principal component analysis PN: net photosynthesis rate
PPFD: photosynthetic photon flux density
PSPG: plant secondary product glycosyltransferase PY: planting year
RA : rébaudioside A
RA/ST: ratio rébaudioside A / stévioside RB: rébaudioside B
RC: rébaudioside C
RCBD: randomized completely block design Rd: dark respiration
RF: rébaudioside F RH: relative humidity Rhm: rhamnose
RMN: résonnance magnétique nucléaire ROS: reactive oxygen specie
SCC: semicontrolled conditions SD: short days
SEM: erreur standard de la moyenne SLW: specific leaf weight
SPE: solid phase extraction
SPIR: spectroscopie proche infra-rouge ST: stévioside
SV: stéviol
SVB : stéviolbioside SVgly: glycoside de stéviol T: température
UGT: UDP-dependant glycosyltransférase V: végétatif
WUE: water use efficiency Xyl: xylose
Zn: sinc
ΨMID: midday water potential
LISTE DES ABBRÉVIATIONS
11
Résumé
Sélectionner et cultiver Stevia rebaudiana Bertoni en milieu tempéré : exploration de la variabilité de la teneur et de la composition en glycosides de stéviol
Stevia rebaudiana Bertoni, une herbe vivace de la famille des Asteraceae originaire du
Paraguay, est d'un intérêt croissant en tant que source d’édulcorants naturels acoloriques, les glycosides de stéviol (SVglys). Ces diterpénoïdes sont organisés autour d’un noyau de stéviol et diffèrent par le nombre et la nature d’unités de sucre liées à ce noyau. Ils sont accumulés à des concentrations allant de 4 à 20% de la masse sèche des feuilles, selon le génotype, le stade phénologique et les conditions de croissance. S. rebaudiana apparaît comme une espèce alternative prometteuse en Europe, mais nécessite au préalable une évaluation de ses besoins en culture et un travail de sélection variétale afin d’optimiser la teneur et la composition en SVglys en milieu tempéré. L'objectif de ce travail était d'étudier les sources de variabilité génotypique et environnementale pour l’accumulation en SVglys et la production de biomasse foliaire. Une forte variabilité génotypique a été observée pour la composition en SVglys et, à un degré moindre, pour la teneur en SVglys ainsi que pour des critères morphologiques et de précocité. L’environnement (fertilisation, durée du jour, stade phénologique, âge de la plante) a également eu un effet sur l’élaboration de la biomasse foliaire et sur la teneur en SVglys, alors que la composition en SVglys a été moins affectée par ces facteurs. Ces résultats suggèrent des mécanismes biochimiques et génétiques complexes régissant la voie de biosynthèse des SVglys. Ils laissent également entrevoir des possibilités de sélection variétale et donnent des indications sur les exigences de S. rebaudiana pour sa culture sous nos climats.
Mots-clés
Stevia rebaudiana ; Glycosides de stéviol ; Accumulation en métabolites secondaires ;
ABSTRACT
12
Abstract
Breeding and cultivation of Stevia rebaudiana Bertoni in temperate areas: exploration of steviol glycoside content and composition variability
Stevia rebaudiana Bertoni, a perennial shrub of the Asteraceae family originating from
Paraguay, is of increasing interest as a source of zero-calorie natural sweeteners: the steviol glycosides (SVglys). These diterpenoids differ in the number and the nature of sugar units bound to a steviol skeleton. They accumulate in leaves at concentrations ranging from 4 to 20%, according to genotype, phenological stage, and growth conditions. S. rebaudiana appears as a promising alternative culture in Europe, but requires investigations to assess its cultivation plant requirements and a breeding effort to optimize SVgly content and composition under temperate climate. The objective of this work was to explore the sources of genotypic and environmental variability for SVglys accumulation and leaf biomass production. High genotypic variability has been observed for SVgly composition and, to a lesser extent, for SVgly content as well as for morphological criteria and precocity. Leaf biomass and SVgly content varied also with the environment (fertilization, daylength, phenological stage) and over the years in perennial culture, while SVgly composition was less affected by these factors. These results suggested complex biochemical and genetic mechanisms regulating SVglys biosynthetic pathway. In parallel they revealed breeding potentialities and gave indications on S. rebaudiana requirements for its cultivation under temperate climate.
Keywords
Stevia rebaudiana; Steviol glycoside; Secondary metabolites accumulation; Genotypic
13
I
NTRODUCTION GENERALE
INTRODUCTION GÉNÉRALE
14 INTRODUCTION GENERALE
Depuis les années 1980, les problèmes d’obésité et de diabète de type II ont été multipliés par 2 ou 3 (Capewell et Buchan, 2012). Ils ont atteint des proportions telles que l’on parle d’épidémie mondiale (OMS, 2010). On observe en parallèle un engouement pour les aliments hypocaloriques, light ou sans sucre. En réponse à cette demande, de nouvelles alternatives au sucre sont apparues ces dernières années, telles que les édulcorants intenses. Alors que le marché du sucre montre une croissance de 3-4% par an, la demande pour des agents sucrants alternatifs augmente de 8% par an. Si les édulcorants de synthèse ont été largement consommés ces 20 dernières années, des expériences ont mis en doute leur absence de nocivité pour la santé (Marti et al., 2008). Bien que de récentes évaluations aient montré que l’aspartame ne présentait pas de danger pour la santé (EFSA, 2013), la révélation d’un risque potentiel des édulcorants de synthèse a entraîné l’apparition d’un nouveau marché, celui des édulcorants intenses d’origine naturelle.
Stevia rebaudiana Bertoni est une herbe sauvage apparue aux confins de la forêt subtropicale du nord-est du Paraguay (Shock, 1982), ayant des feuilles au goût sucré. De nombreux glycosides de stéviol sont en effet accumulés dans la plante. Ils sont estimés comme ayant un pouvoir sucrant 200 à 300 fois supérieur à celui du saccharose, et sont acaloriques (Matsui et al., 1996). Ils apparaissent ainsi comme candidats potentiels pour venir en substitution aux édulcorants de synthèse. Au sein de l’Union Européenne, la consommation de S. rebaudiana a été interdite jusqu’à récemment, faute de preuves scientifiques de son absence de risques pour la santé. Le 11 novembre 2011, le texte pour l’utilisation de S. rebaudiana comme additif alimentaire a été voté par la Commission Européenne (UE, 2011).
L’utilisation de S. rebaudiana s’est développée au Japon dès la fin des années 1970 (Lewis, 1992). En 2007, elle représentait 40% du marché des édulcorants intenses dans ce pays (consommation annuelle estimée à 200 t.) (Rajasekaran et al., 2007). Au cours des décennies suivantes, la culture de S. rebaudiana s’est développée dans de nombreux pays : le Paraguay, le Brésil, l’Uruguay et l’Amérique Centrale. La Chine, la Thaïlande, l’Inde et Israël ont également lancé des cultures commerciales. Les surfaces de culture de S. rebaudiana se sont multipliées ces dernières années : elles sont estimées à 20-25 000 ha en 2008 et 67-80 000 ha en 2011 (Kienle, 2010). D’autres pays sont en expérimentation pour des cultures
15 commerciales : c’est le cas notamment du Canada, de la Nouvelle Zélande, de l’Australie et, en Europe, de la Belgique, de l’Allemagne, de l’Angleterre, de la France, de l’Italie et de la Grèce. Il n’existe néanmoins pas à ce jour de système de culture mécanisé de S. rebaudiana.
C’est dans ce contexte qu’en 2011, le FUI STEVIANOV, labellisé et financé par le pôle de compétitivité Agri Sud-Ouest Innovation, a vu le jour. L’ambition de ce projet est de développer une filière agro-industrielle française de S. rebaudiana. Il réunit pour cela cinq partenaires qui représentent l’ensemble de la filière : (1) l’Epi Salvagnacois, acteur agricole majeur dans le Tarn (81) ; (2) la société Stevia Natura, ancrée dans le Puy-de-Dôme (63) et spécialisée dans la production et la commercialisation des produits issus de S. rebaudiana ; (3) l’entreprise La Patelière, basée dans le Gers (32), spécialisée dans la fabrication, le conditionnement et la distribution de produits d’aide à la pâtisserie conventionnelle et biologique et des confiseries ; (4) le laboratoire de Chimie Agro-Industrielle (LCA) UMR 1010 INRA/INPT-ENSIACET, dont l’objectif principal est la valorisation des produits et sous-produits de l’agriculture, de la forêt et des agro-industries ; (5) les laboratoires d’Agronomie et d’Agrophysiologie de l’INP-EI Purpan, dont les compétences portent d’une part sur la conception et l’évaluation de systèmes de culture économes en intrants, et d’autre part sur les voies métaboliques d’espèces cultivées (soja, tournesol) et l’accumulation en métabolites secondaires d’intérêt, ainsi que sur des travaux de sélection variétale.
L’objectif, à l’issue de ce projet, est de pouvoir proposer des génotypes de S. rebaudiana en vue d’un travail de sélection variétale, des itinéraires techniques appropriés, des surfaces de culture adaptées aux besoins du marché, une unité de première transformation et de purification des différents produits issus de l’extraction des productions végétales et un circuit de commercialisation de ces différents produits. L’ancrage régional de STEVIANOV pour l’amont de la filière (production agricole) s’explique par le fait que la production de S.
rebaudiana serait, pour les agriculteurs locaux, une alternative à la production de tabac, en
remobilisant la plupart du matériel spécifique à cette culture.
Dans ce contexte, l’objectif général de ce travail de recherche, réalisé au sein des laboratoires d’Agronomie et d’Agrophysiologie de l’INP-EI Purpan, est d’explorer les sources de variabilité génotypique et environnementale pour l’élaboration de la biomasse foliaire et l’accumulation en glycosides de stéviol, en vue d’une culture de S. rebaudiana en milieu tempéré. Afin de mieux cerner les enjeux scientifiques de cette problématique, une revue bibliographique (Partie 1, chapitres 1 et 2) recense l’ensemble des études agronomiques,
INTRODUCTION GÉNÉRALE
16 physiologiques, biochimiques et génétiques déjà menées sur S. rebaudiana, et conduit à la formulation des objectifs spécifiques à ce travail de recherche et des moyens mis en œuvre (Partie 1, chapitre 3). Les résultats obtenus sont organisés en deux parties, divisées en chapitres. Les chapitres 4 et 5, qui constituent la Partie 2, explorent la variabilité génotypique de la teneur et de la composition en glycosides de stéviol, ainsi que de critères morphologiques et de précocité. Ces chapitres s’intéressent également aux interactions génotype x environnement. Enfin, les chapitres 6 et 7, regroupés dans la troisième partie, proposent une approche écophysiologique pour évaluer l’effet de facteurs environnementaux sur l’élaboration de la biomasse et l’accumulation en glycosides de stéviol chez S.
rebaudiana. Les facteurs étudiés sont le stade de développement de la plante, l’âge de la
17
P
ARTIE
1.
C
ONTEXTE SCIENTIFIQUE ET
PARTIE 1:CONTEXTE SCIENTIFIQUE ET PROBLÉMATIQUE
19
Chapitre 1 : Stevia rebaudiana Bertoni,
PARTIE 1,CHAPITRE 1:Stevia rebaudiana Bertoni, la plante et sa culture
21
1.
DESCRIPTION GENERALE
1.1. Origine et classification
Stevia rebaudiana Bertoni est une plante originaire du Nord-Est du Paraguay (Shock,
1982), appartenant à la famille des Asteraceae, sous-famille Asteroideae, tribu Heliantheae, genre Stevia. Le genre Stevia comprend environ 240 espèces, distribuées du Sud-Ouest des Etats-Unis au Nord de l’Argentine (Robinson et King, 1977 ; Soejarto, 2002). Les plantes appartenant au genre Stevia sont des herbes ou des arbrisseaux annuels ou pluriannuels, principalement trouvés entre 500 et 3000 mètres au-dessus du niveau de la mer, généralement dans des environnements montagneux semi-secs (Soejarto et al., 1983).
S. rebaudiana est l’espèce la mieux connue du genre Stevia. C’est une plante au goût
sucré, dû à la présence de composés au fort pouvoir sucrant dans ses feuilles, les glycosides de stéviol (SVglys). Selon l’étude de Kinghorn et al. (1984), une autre espèce, Stevia
phlebophylla, originaire du Mexique, contient des traces de stévioside, le plus commun des
SVglys, qui confèrent à la plante un goût sucré. Par ailleurs, un SVgly, le rubusoside, a été identifié dans une espèce de la famille des rosacées : Rubus chingi var suavissmus (S.K. Lee) (Tanaka et al., 1981 ; Ohtani et al., 1992).
Les propriétés sucrantes de S. rebaudiana sont connues depuis longtemps par les Guaranis, Indiens des montagnes du Paraguay, qui appellent cette plante caá-êhê, qui signifie « herbe sucrée » (Lewis, 1992). Cette plante a été révélée au reste du monde par le botaniste suisse-italien M.S. Bertoni en 1887 (Lewis, 1992). Dès 1900, le chimiste paraguayen O. Rebaudi mentionna la présence d’un composé sucrant dans la plante, comparable à l'acide glycyrrhizique (principe actif de la réglisse). Mais ce n’est qu’en 1931 que les chimistes français M. Bridel et R. Lavieille isolèrent le stévioside (Robinson, 1930 ; Bridel et Lavieille, 1931). Le stévioside fut considéré comme l’unique SVgly présent dans les feuilles de
S. rebaudiana jusqu’à l’isolement par des équipes japonaises de nouveaux SVglys à la fin des
années 1970, tels que le rébaudioside A (Kohda et al., 1976), le rébaudioside C (Sakamoto et
al., 1977a), les rébaudiosides D et E (Sakamoto et al., 1977b), le dulcoside A (Kobayashi et al., 1977). A l’heure actuelle plus de 30 SVglys ont été identifiés, dont certains sont
cependant peut-être des artefacts formés au cours de l’extraction et/ou de l’isolement (Morlock et al., 2014). Les deux SVglys majeurs sont le stévioside (ST) et le rébaudioside A
PARTIE 1,CHAPITRE 1:Stevia rebaudiana Bertoni, la plante et sa culture
22 (RA). Les caractéristiques organoleptiques de ce dernier sont plus appréciées que celles du ST (cf. chapitre 2, § 1.2).
Les premières exportations de S. rebaudiana eurent lieu pendant la Seconde Guerre Mondiale en direction du Royaume-Uni, pour venir en alternative au sucre dont les approvisionnements s’épuisaient. Sa culture ne s’est cependant pas développée, car la technologie nécessaire pour en faire une culture industrielle n’existait alors pas (Lewis, 1992). La plante a à nouveau été exportée en 1968 vers le Japon, où son exploitation commerciale s’est développée (Lewis, 1992) grâce à la recherche de procédés d’extraction et de raffinage des SVglys (Rajasekaran et al., 2007). Au cours des décennies suivantes, S. rebaudiana a été introduite dans de nombreux pays. Aux États-Unis, la Food and Drugs Administration a accordé en 2008 le statut GRAS (Generally Recognized As Safe), en tant qu’additif alimentaire, au RA (US Food and Drug Administration, 2009). En France, le RA (purifié à 97%) a été autorisé pour le même usage en 2009 (AFSSA, 2009). Par la suite, en 2011, l’Union Européenne a autorisé sous le code E960 l’ensemble des glycosides de stéviol purifiés à 95% selon les termes de la réglementation (CE) n°1333/2008 relative aux additifs alimentaires (UE, 2011).
1.2. Description botanique
S. rebaudiana est une plante pérenne. Dans son habitat naturel, c’est une plante mince,
avec peu de ramifications. Ses tiges sont ligneuses, recouvertes de fins poils laiteux. En culture, la plante produit de nombreuses ramifications, qui lui donnent l’air d’un arbrisseau dense (Soejarto, 2002) (Figure 1). Les tiges arrivées à maturité dépérissent, et de nouvelles tiges se renouvellent chaque année (Soejarto, 2002). Les feuilles sont de petite taille, allongées, droites et dentées (Dwivedi, 1999) (Figure 1). Elles sont simples, opposées, sub-sessiles, séparées par des entre-nœuds de 2 à 4 cm. Leur forme et leur taille sont variables (Soejarto, 2002).
Le système racinaire de S. rebaudiana est pivotant au début de son développement puis devient de plus en plus fasciculé, avec une distribution majeure des racines dans la couche supérieure du sol (Carneiro, 1990). S. rebaudiana produisant facilement des repousses et des racines à partir de sa base, il pourrait s’agir d’une plante chaméphyte.
23
S. rebaudiana est décrite comme auto-incompatible (Yadav et al., 2014). La majorité des
espèces de la famille des Asteraceae sont auto-incompatibles de type sporophytique (Ferrer et Good-Avila, 2007). Ce système d’incompatibilité fait appel à des gènes d’auto-incompatibilité (S), empêchant la reproduction entre individus partageant un ou plusieurs allèles au locus du gène S (S1, S2, S3…Sx). Dans ce cas, le développement du tube pollinique est bloqué et la fécondation n’a pas lieu. L’auto-incompatibilité observée chez S. rebaudiana pourrait être donc de type sporophytique. Les fleurs sont hermaphrodites, petites et généralement blanches (Figure 1). Elles sont regroupées en corymbes comprenant 2 à 6 fleurs, organisés en panicules (Dwivedi, 1999 ; Goettemoeller et Ching, 1999). La pollinisation de
S. rebaudiana est entomophile (Goettemoeller et Ching, 1999). Les graines sont contenues
dans des achènes de 3 mm de long environ surmontées d’un pappus d’une vingtaine de soies (Robinson, 1930 ; Goettemoeller et Ching, 1999). Les akènes fertiles sont de couleur foncée, alors que les non-fécondés sont clairs (Goettemoeller et Ching, 1999) (Figure 1).
Figure 1: (A) Pied en reprise de végétation à la sortie de l’hiver ; (B) Feuilles ; (C) Fleurs ; (D) Akène fertile de S. rebaudiana.
PARTIE 1,CHAPITRE 1:Stevia rebaudiana Bertoni, la plante et sa culture
24
1.3. Cycle de développement
S. rebaudiana est une plante de jours courts, avec une photopériode critique allant de 8 à
14 h selon le génotype, de 13 h en moyenne (Brandle et al., 1998). L’induction de la floraison est initiée par les jours courts. Elle peut avoir lieu dès le stade 4 feuilles. Les jours longs, quant à eux, favorisent le développement végétatif et ainsi l’élaboration de la biomasse (Brandle et al., 1998). L’initiation de la floraison n’est pas uniforme au sein d’une même plante (Carneiro, 1990). Ainsi, tous les stades de développement peuvent être présents sur une même plante au même moment. Une première description des stades de développement de la plante a été réalisée, sur la base de 5 stades végétatifs et 5 stades reproductifs (Tableau 1 et Figure 2) (Carneiro, 2007).
25
Figure 2 : Structure morphologique des plantes utilisées pour la description des stades de développement: (a) semis en cours de développement ; (b) semis normal lors d’un test de germination ; (c) semis développé avec système racinaire ; (d) plante développée conduite en jours courts ; (e) repousse de tige après taille de la plante ; (f1) panicule de corymbes avec divers capitules ; (f2) cyme détachée au hasard pour compter les
stades reproductifs ; (f3) capitule contenant cinq fleurs blanches ; (f4) capitule contenant des graines prêtes
PARTIE 1,CHAPITRE 1:Stevia rebaudiana Bertoni, la plante et sa culture
27
2.
CARACTERISTIQUES AGRONOMIQUES
2.1. La plante dans son habitat d’origine
Dans son habitat naturel, on retrouve S. rebaudiana sur les bords de marais ou dans des communautés de prairies, dans des sols aux nappes phréatiques peu profondes, continuellement humides mais n’étant pas sujet à une inondation prolongée. Il s’agit en général de sols peu fertiles - tourbes ou sables - et acides (pH ± 4,5). Le climat est subtropical, avec des températures allant de -6°C à +43°C, pour une valeur moyenne annuelle de +23°C, et avec des précipitations moyennes annuelles de 1400 mm (Shock, 1982).
A cette latitude (21-22°S), la photopériode n’excède pas 14 h et est inférieure à 13 h de mars à octobre. Les plantes fleurissent à partir de janvier-mars, ce qui équivaut à juillet-septembre dans l’hémisphère nord. Les plantes arrivées à maturité dépérissent, et leurs repousses entrent en floraison rapidement. Les floraisons se succèdent ainsi jusqu’à l’hiver en juillet. A l’état sauvage, S. rebaudiana se reproduit de manière sexuée ou asexuée, grâce à l’enracinement de tiges piétinées par le bétail. La production de graines viables est erratique et la plupart des plantes sont généralement des survivantes des années précédentes. Dans son environnement naturel, S. rebaudiana est en compétition avec d’autres adventices, de petite taille et adaptées aux sols peu fertiles (Shock, 1982).
2.2. Conduite de S. rebaudiana en milieu tempéré
S. rebaudiana étant une plante de jours courts, dans son habitat d’origine, les floraisons
se succèdent rapidement. Les jours longs favorisent quant à eux le rendement foliaire et l’accumulation des SVglys (Metivier et Viana, 1979). La culture de S. rebaudiana en milieu tempéré, avec des jours longs en été, permettrait donc d’atteindre une production en SVglys plus élevée. Les connaissances agronomiques pour la conduite de S. rebaudiana en milieu tempéré sont encore floues à l’heure actuelle. Néanmoins, grâce aux informations existantes à ce jour et à la connaissance de son milieu naturel, certains des besoins de la plante peuvent être appréhendés.
PARTIE 1,CHAPITRE 1:Stevia rebaudiana Bertoni, la plante et sa culture
28
2.2.1. Type de sol et intrants
S. rebaudiana présente une faible tolérance aux sols salins. Bien qu’elle soit présente
naturellement dans des sols acides, cette plante se développe bien sur des sols aux pH compris entre 6,5 et 7,5 (Shock, 1982). La plupart des terres agricoles est plus fertile que les terres de son habitat naturel. Les besoins nutritifs de S. rebaudiana en engrais sont donc modérés (Shock, 1982). La production de 1 t/ha de feuilles sèches nécessiterait environ 65 kg d’azote (N), 8 kg de phosphore (P) et 56 kg de potassium (K) (Lima Filho et al., 1997a), ainsi que 89 g de bore, 26 g de cuivre, 638 g de fer, 207 g de manganèse et 13g de zinc (Lima Filho et al., 1997b). Néanmoins, la littérature met en évidence une réponse, en général positive, du rendement aux apports de fertilisants (en particulier de l’azote), avec par exemple des rendements voisins de 3,5 t/ha pour des apports en NPK voisins de 100-30-45 U respectivement contre seulement 1,9 à 2,3 t/ha pour des apports de 60 à 75 U en N, 30 U en P et 45 U en K (Maheshwar, 2005). Les meilleurs résultats d’une autre étude (2,1 t/ha) ont également été obtenus avec l’apport de fertilisation le plus élevé : 275-112-172 U de NPK additionnées à 20 t/ha de fumier (Nevase et al., 2009).
L’étude de Lima Filho et Malavolta (1997) décrit les symptômes de déficience en azote (N), phosphore (P), potassium (K), calcium (Ca), magnésium (Mg) et bore (B), ainsi que les symptômes de toxicité du bore et du zinc (Zn) chez S. rebaudiana. Une déficience en azote provoque un développement réduit de la plante, des petites feuilles et un jaunissement généralisé. Une déficience en phosphore entraine une croissance réduite. Les symptômes associés à une déficience en potassium sont un recourbement des feuilles, similaire à un flétrissement, et un jaunissement puis une nécrose des feuilles les plus âgées.
2.2.2. Besoins en eau
Selon Shock (1982), S. rebaudiana présente une faible tolérance au stress hydrique et nécessite une irrigation fréquente. Sur l’ensemble du cycle de culture, un apport couvrant 100% de la consommation en eau de la culture a permis d’obtenir une biomasse totale jusqu’à 40% supérieure par rapport à des apports d’eau couvrant 66% ou 33% des besoins de la culture. Néanmoins ce fut au détriment de l’efficience d’utilisation de l’eau par la plante (WUE, Water Use Efficiency) et de l’indice de récolte (HI, Harvest Index ; proportion de la biomasse totale allouée à la biomasse foliaire) (Lavini et al., 2008). De même, une irrigation
29 couvrant 117% de l’évapotranspiration potentielle (ETP) a permis d’obtenir un rendement en feuilles de 13% supérieur à celui obtenu avec une irrigation couvrant 100% de l’ETP, mais toujours au détriment de la WUE et du HI (Fronza et Folegatti, 2002). Ainsi, à condition que les rendements restent suffisamment élevés, il pourrait être intéressant d’augmenter l’indice de récolte par une diminution de l’irrigation (Lavini et al., 2008). Il ne faut néanmoins pas négliger certains stades de la culture. Une irrigation est nécessaire immédiatement après la transplantation au champ. L’eau doit être apportée de manière constante jusqu’à ce que les jeunes plants aient passé la phase critique de transplantation et qu’ils aient repris une croissance normale (Andolfi et al., 2002).
2.2.3. Implantation
Les plantes sont semées ou bouturées en serre, avant d’être transplantées en champ (Brandle et al., 1998). Au Canada (South Western Ontario), les plantes sont transplantées en champ à partir de la deuxième quinzaine de mai. Elles sont lentes à s’établir jusqu’à la mi-juillet (Brandle et al., 1998). En Italie, la période idéale pour la transplantation des plantes au champ est le mois d’avril, compte-tenu des températures douces et des pluies fréquentes (Andolfi et al., 2002).
La densité de plantation est un paramètre essentiel pour la culture de S. rebaudiana qui affecte directement le degré de ramifications primaires et secondaires ainsi que le rendement en feuilles et en tiges de la plante. Le nombre de feuilles et la hauteur des plantes sont néanmoins moins affectés par la densité de plantation (Shu et Wang, 1988). Ce sont donc le diamètre de la tige et l’index de surface foliaire qui varient en fonction de la densité, avec un impact direct sur le rendement de la culture. De nombreux auteurs ont étudié la densité de plantation et l’écartement optimal pour l’obtention d’un rendement en poids sec de feuilles et une teneur en SVglys élevés (Shu et Wang, 1988 ; Carneiro et al., 1992 ; Espitia et al., 2009 ; Singh et al., 2011 ; Vasanthi et al., 2011). La première année, les plantes sont moins buissonnantes qu’en deuxième année de culture et suivantes. La densité au champ pourrait ainsi ne pas avoir d’influence sur le rendement en feuilles la première année (Carneiro et al., 1992). La seconde année, les meilleurs rendements ont été obtenus avec une densité de 100 000 plantes/ha, en comparaison à des densités de 50 000 et 80 000 plantes/ha (Carneiro et
PARTIE 1,CHAPITRE 1:Stevia rebaudiana Bertoni, la plante et sa culture
30
al., 1992). Une densité à 200 000 plantes/ha a entraîné une faible croissance de la culture, due
à une compétition pour la lumière et une diminution du ratio feuille/tige (Basuki et Sumaryono, 1990, cité par Ramesh et al., 2006). Douze mois après la plantation, les racines s’étendent sur 30 cm de part et d’autre de la plante. Dans le cas d’une culture en conduite pluriannuelle, l’écartement devrait alors être supérieur à 30 cm de chaque côté (Ramesh et al., 2006). Différents écartements ont été étudiés, allant de 20 à 60 cm inter-rangs et de 20 à 40 cm inter-plants (Espitia et al., 2009 ; Singh et al., 2011 ; Vasanthi et al., 2011). Les résultats sont divergents quant à l’écartement optimal.
- Il a été observé comme étant de 30 x 20 ou 30 x 30 cm sur la base du rendement en feuilles et en tiges (Singh et al., 2011).
- Un écartement de 45 x 22,5 cm pourrait permettre le plus haut rendement en feuilles et une absorption d’azote et de potasse élevée (Vasanthi et al., 2011).
- Un écartement de 20 x 20 cm permettrait d’obtenir le rendement foliaire moyen le plus élevé (1,4 t MS/ha), dépassant les résultats obtenus avec l’écartement 40*40cm d’environ 80% (Espitia et al., 2009).
2.2.4. Adventices et maladies
S. rebaudiana a une faible capacité de compétition avec les adventices pendant la
première période de croissance, compte-tenu de son démarrage lent (Figure 3). Les adventices sont ainsi les premiers freins à l’établissement de la culture et à son rendement. La culture de
S. rebaudiana nécessite par conséquent un contrôle des adventices aux premiers stades
d’établissement de la culture. Par ailleurs, la présence d’adventices rend la récolte plus difficile et augmente leur stock de graines dans le sol (Ramesh et al., 2006).
S. rebaudiana est susceptible de développer différentes maladies fongiques (Figure 3).
La Septoria steviae est l’un des champignons qui infeste S. rebaudiana. La maladie fongique qui lui est associée se traduit par des lésions vert olive sur les feuilles, qui se fondent rapidement les unes aux autres et sont généralement entourées par un halo chlorotique. Les feuilles se nécrosent rapidement et se détachent souvent de la plante (Reeleder, 1999). Certains génotypes peuvent présenter un haut niveau de résistance/tolérance à la Septoria
31
Figure 3: (A) Jeune plant de S. rebaudiana en compétition avec du liseron ; (B) et (C) Symptômes foliaires de maladies fongiques observés chez S. rebaudiana.
Une maladie de pourriture des feuilles due à l’agent pathogène Alternaria alternata a également été identifiée. Cette maladie se traduit par des petites taches circulaires marron clair sur les feuilles, qui peuvent évoluer vers des couleurs plus foncées (marron foncé, gris) et des formes plus irrégulières. Certaines de ces taches se regroupent pour former de plus grandes zones nécrotiques.
Une autre maladie foliaire, causée par le champignon Alternaria steviae, a été observée, dont les premiers symptômes se traduisent par l’apparition de petites taches sur les feuilles, similaires à celles causées par Septoria steviae. Les taches s’étendent ensuite en formes irrégulières de couleur noire, entourées d’une zone chlorotique. Ces taches apparaissent également sur les tiges et les pétioles (Ishiba et al., 1982). Parmi différentes lignées étudiées, certaines ont là-encore montré une meilleure résistance/tolérance au pathogène, laissant à nouveau entrevoir une possibilité de sélection (Ishiba et al., 1982).
Sclerotinia sclerotiorum provoque une maladie de pourriture de la tige chez S. rebaudiana. Les tiges infestées présentent des lésions marron foncé. Si les symptômes se
limitent aux ramifications, il y a un flétrissement partiel des feuilles. Quand les symptômes apparaissent à la base des tiges principales et au niveau des racines, un flétrissement de la plante entière est observé (Chang et al., 1997).
Le champignon Sclerotium rolfsii provoque quant à lui une maladie de pourriture des racines. Les premiers symptômes de cette maladie sont un jaunissement et une fanaison des feuilles, accompagnés d’un flétrissement de la plante. Des filaments blancs (mycélium du champignon) apparaissent au niveau du collet puis se développent vers les racines et la tige, entraînant leur décomposition (Kamalakannan et al., 2007).
PARTIE 1,CHAPITRE 1:Stevia rebaudiana Bertoni, la plante et sa culture
32 D’autres agents pathogènes de S. rebaudiana ont été identifiés : Erysiphe
cichoracearum, Rhizoctonia solani et Sclerotium dephinii (Maiti et al., 2007).
2.2.5. Récolte
Le rendement de S. rebaudiana s’exprime en masse de glycosides de stéviol (SVglys) produits par hectare (kg.ha-1). Il dépend donc de l’élaboration de la biomasse foliaire et de
l’accumulation en SVglys dans les feuilles. Il est généralement admis que la teneur maximale en SVglys (mg.g-1 MS) est atteinte lors de la formation des bourgeons floraux (Ceunen et
Geuns, 2013c). Les résultats divergent ensuite : lors de la floraison, la teneur en SVglys peut décroître, de 20 % (Mitsuhashi et al., 1975) à 35-50% (Bian, 1981 ; Vanidze et al., 2009 ; Ceunen et al., 2011), ou stagner (Zaidan et al., 1980 ; Ceunen et al., 2011). L’accumulation de biomasse se fait quant à elle durant toute la période végétative. L’optimum de récolte est donc défini au stade bouton floral (Brandle et al., 1998), en septembre sous nos climats. Au Canada, une récolte au stade bouton floral a permis d’obtenir un rendement de 3,1 t MS.ha-1,
avec une teneur en stévioside de 104,7 mg.g-1 (Brandle et Rosa, 1992). La récolte peut aussi être obtenue au moyen de plusieurs coupes durant la période végétative (Carneiro, 1990). En Italie, si la conduite est bien réalisée, avec des apports d’eau suffisants afin de couvrir les besoins de la plante l’été, deux coupes par année peuvent être envisagées (Andolfi et al., 2006).
S. rebaudiana peut être cultivée comme une plante annuelle, comme au Canada (Shock,
1982 ; Brandle et al., 1998), ou pluriannuelle lorsque le climat le permet. En Italie, plusieurs études en vue d’une conduite pluriannuelle de S. rebaudiana ont été réalisées. La biomasse foliaire (g.plante-1) peut augmenter jusqu’en 5ème ou 6ème année de production, avec un ratio
feuilles/plante entière relativement stable les 2 premières années, qui augmente la 3ème année et qui tend à diminuer à partir de la 4ème année, avec le nombre répété des coupes et
l’augmentation du nombre de ramifications (Andolfi et al., 2006). Dans une autre étude, le déclin du rendement a été observé à partir de la troisième année : le rendement en feuilles était de 13,3 t.ha-1 la première année et de 9 t.ha-1 la troisième année (Ruta et al., 1999). La survie
des plantes pendant l’hiver reste le premier facteur à maîtriser pour une culture pluriannuelle de S. rebaudiana : la pourriture des racines peut conduire à une grande perte des plantes au cours de l’hiver (Lavini et al., 2008).
33
3.
DOMESTICATION DE L’ESPECE
3.1. Modes de propagation de l’espèce et sélection variétale
A l’instar des plantes aromatiques ou médicinales, un enjeu pour la production de S.
rebaudiana est d’obtenir un matériel de propagation adapté à une culture à grande échelle.
Les modes et objectifs de sélection variétale ne seront pas les mêmes selon le mode de propagation choisi : propagation sexuée (semis) ou asexuée (bouturage, micropropagation).
3.1.1. Sélection variétale en vue d’une propagation sexuée
Les taux de germination des graines de S. rebaudiana sont réputés faibles (Shock, 1982). Ils présentent donc un frein à la propagation de cette plante par semis pour une culture à grande échelle. Ils peuvent néanmoins varier selon les conditions de germination.
- Le taux de germination des graines sans pappus est de 84,5%, alors qu’il est de 61,7% pour les graines avec pappus. Une élimination du pappus permettrait d’augmenter la surface de contact entre la graine et son substrat, d’accroître l’absorption de l’eau par la graine et favoriserait ainsi sa germination (Carneiro et Guedes, 1992). Une élimination mécanique du pappus peut néanmoins abîmer la graine et causer une augmentation du nombre de plantules anormales (Carneiro, 1990).
- Avec un taux de germination des graines de S. rebaudiana plus élevé en présence de lumière que dans le noir, plusieurs auteurs soutiennent une photosensibilité positive des graines de S. rebaudiana (Brandle et al., 1998 ; Goettemoeller et Ching, 1999; Abdullateef et Osman, 2011). Cependant, une étude montre un meilleur taux de germination en présence de lumière pour 3 cultivars seulement, sur les 5 étudiés (Macchia
et al., 2007).
- La gamme de température optimale pour la germination se situerait entre 15 et 30°C, en fonction du cultivar (Macchia et al., 2007).
- Le substrat dans lequel sont semées les graines influe également sur leur germination et le développement des pousses. Un sol léger, argilo-sableux et calcaire serait le meilleur substrat, quand le moins bon serait un sol lourd, argileux (Carneiro et al., 1997).
PARTIE 1,CHAPITRE 1:Stevia rebaudiana Bertoni, la plante et sa culture
34 - Le mode de conservation a aussi un effet sur la qualité germinative des graines. Une conservation des graines entre -10°C et -18°C permettrait d’assurer leur viabilité pendant plus de trois ans, quand elle n’est que de quelques mois à température ambiante (Chen et al., 1995, cité par Macchia et al., 2007).
En vue d’une propagation par semis, compte-tenu de l’auto-incompatibilité observée chez S. rebaudiana, la sélection récurrente apparaît comme la méthode la plus effective pour une augmentation du rendement foliaire et de la teneur totale en SVglys (Yadav et al., 2011). C’est une méthode de sélection utile pour l’amélioration de caractères quantitatifs héritables chez les espèces allogames. Elle consiste en la sélection de plantes issues d’une population obtenue par inter-croisement et choisies pour leur phénotype. Les plantes obtenues à l’issue d’un cycle de sélection sont apparentées, chaque plante ayant été fécondée par l’ensemble des autres plantes. On parle pour un tel schéma de sélection familiale demi-frères (Gallais, 1989).
Les variétés synthétiques sont obtenues à l’issue de plusieurs cycles de sélection récurrente. La variété commercialisée correspond toujours à la même génération, obtenue avec le même matériel de départ. Le développement de ce genre de variétés est adapté pour les plantes dont le contrôle de la pollinisation est difficile. Cela permet la création rapide de variétés pour des plantes non encore intensivement sélectionnées, en utilisant une méthode à moindres coûts. Une caractéristique des variétés synthétiques est leur aspect « aléatoire » : de nombreuses sources de variation existent d’un lot à l’autre, la non-homogénéité de pollinisation par exemple (Gallais, 1989). Dans le cas d’une propagation sexuée de S.
rebaudiana, le développement de variétés synthétiques apparaît comme la méthode la plus
adaptée pour le développement d’une variété enrichie en rébaudioside A (RA) et ayant une teneur en SVglys élevée (Yadav et al., 2011).
Une variété synthétique, « AC Blackbird », a été développée. Elle est caractérisée par une teneur totale en SVglys d’au moins 14%, et pouvant aller jusqu’à 18,8% et par un ratio RA/ST élevé, d’au moins 9,1 :1 et pouvant aller jusqu’à 11,0 :1 (Brandle, 2001). Une variété synthétique a également été développée par Morita et Yucheng (1998). Elle contient au moins 2,6 fois plus de RA que de ST.
35
3.1.2. Sélection variétale en vue d’une propagation asexuée
La propagation végétative de S. rebaudiana, réalisée par bouturage ou micropropagation, peut venir en renfort à sa propagation sexuée : des plantes obtenues par micropropagation ont montré un taux de survie de 95% après transplantation en champ (Preethi et al., 2008). Les plantes produites in vitro ne montrent pas de comportement anormal au champ (Tamura et al., 1984b ; Preethi et al., 2008). Elles ne présentent donc pas d’effets indésirables liés à l’utilisation d’hormones pour l’induction des différentes pousses in vivo (Tamura et al., 1984b).
Les boutures de S. rebaudiana s’enracinent facilement. Les meilleures boutures sont obtenues à partir de la partie supérieure de la plante (Shock, 1982). La bouture doit se faire à partir de d’une tige comportant 5 paires de feuilles opposées. Si les feuilles sont alternes, cela présage de la proximité temporelle de la floraison, ce qui diminue la qualité d’enracinement et le développement des boutures (Landázuri et al., 2009). Une fois la bouture implantée, l’irrigation est un facteur essentiel, afin de favoriser un bon enracinement de la bouture (Landázuri et al., 2009). La propagation par bouturage est limitée par le faible nombre d’individus pouvant être produits simultanément à partir d’une même plante (Jain et al., 2009). De plus elle nécessite un coût important en main d’œuvre (Tamura et al., 1984a). Elle peut donc être intéressante pour un travail à petite échelle, mais est probablement non-viable en termes économiques pour un travail à grande échelle (Brandle et al., 1998). La micropropagation peut alors venir en alternative pour une propagation de masse. La culture in
vitro de S. rebaudiana a fait l’objet de nombreuses études (Tamura et al., 1984a ; Swanson et al., 1992 ; Rajasekaran et al., 2007 ; Banerjee et Sarkar, 2008 ; Preethi et al., 2008 ; Sreedhar et al., 2008 ; Jain et al., 2009 ; Sadeak et al., 2009 ; Shatnawi et al., 2011; Zara et al., 2014).
Elle permet en effet l’obtention dans un milieu aseptisé d’un grand nombre de clones à partir d’une plante-mère.
Dans une optique de propagation asexuée de S. rebaudiana, une amélioration des plantes par sélection phénotypique de plantes individuelles présentant des caractéristiques intéressantes est adaptée. Une variabilité peut néanmoins être observée lors de la multiplication des plantes par clonage : en Chine, des clones issus d’une même plante-mère ont présenté une teneur totale en SVglys allant de 10,3% à 19,6%, avec une teneur en ST variant de 1,5 à 7,0% et une teneur en RA allant de 4,5 à 12,1% (Huang et al., 1995).
PARTIE 1,CHAPITRE 1:Stevia rebaudiana Bertoni, la plante et sa culture
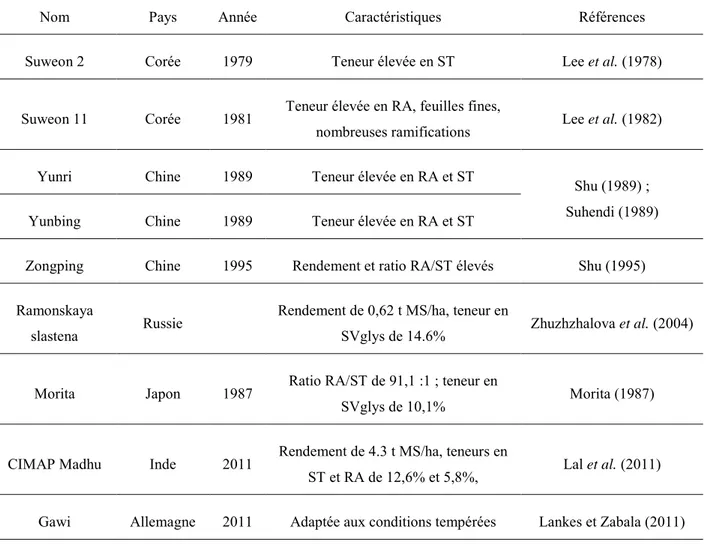
36 Plusieurs variétés, dont les caractéristiques sont présentées dans le Tableau 2, ont déjà été développées en vue d’une multiplication par clonage.
Tableau 2: Liste de quelques variétés de S. rebaudiana en vue d’une propagation par clonage.
Nom Pays Année Caractéristiques Références
Suweon 2 Corée 1979 Teneur élevée en ST Lee et al. (1978)
Suweon 11 Corée 1981 Teneur élevée en RA, feuilles fines,
nombreuses ramifications Lee et al. (1982)
Yunri Chine 1989 Teneur élevée en RA et ST Shu (1989) ;
Suhendi (1989)
Yunbing Chine 1989 Teneur élevée en RA et ST
Zongping Chine 1995 Rendement et ratio RA/ST élevés Shu (1995)
Ramonskaya
slastena Russie
Rendement de 0,62 t MS/ha, teneur en
SVglys de 14.6% Zhuzhzhalova et al. (2004)
Morita Japon 1987 Ratio RA/ST de 91,1 :1 ; teneur en
SVglys de 10,1% Morita (1987)
CIMAP Madhu Inde 2011 Rendement de 4.3 t MS/ha, teneurs en
ST et RA de 12,6% et 5,8%, Lal et al. (2011)
Gawi Allemagne 2011 Adaptée aux conditions tempérées Lankes et Zabala (2011)
Pour la production par clonage de S. rebaudiana, la qualité du système racinaire des plants revêt une importance capitale, afin de produire des plantes de qualité et homogènes. Un manque de vigueur des plants et un faible développement racinaire peuvent réduire la résistance de la plante à différentes pressions environnementales : un développement racinaire superficiel peut être défavorable à la résistance à la sécheresse, en empêchant la plante d’accéder aux réserves en eau des horizons profonds du sol. De même, il peut réduire la résistance au froid de la plante, de faibles températures entraînant le gel des eaux situées dans les horizons superficiels (Dondey, 1988). Les plants d’eucalyptus issus de boutures présentent généralement un enracinement plus faible et différent de celui des plantes obtenues par
37 semis : la majorité des racines des eucalyptus obtenus par bouturage sont situées dans les horizons superficiels du sol, alors que les plantes issues de semis développent un appareil racinaire pivotant (Dondey, 1988). Dans le cas de S. rebaudiana, le système racinaire des plantes issues de semis tend à être fasciculé, après avoir été pivotant la première année. Une attention doit être portée au système racinaire des plantes obtenues par bouturage pour une bonne implantation la première année.
Bien que génétiquement identiques, toutes les boutures issues d’une même plante-mère ne sont pas semblables. Une variabilité intra clonale existe pour des critères tels que la vigueur ou la résistance au froid. Le système racinaire et son développement pourraient être à l’origine d’une telle variabilité (Dondey, 1988). Il existe également une variabilité inter clonale : en fonction de la plante-mère considérée, sa descendance obtenue par clonage sera plus ou moins homogène (Dondey, 1988). La qualité du système racinaire est un point critique pour le développement de plantes vigoureuses et homogènes. Il est donc nécessaire de tenir compte de ce critère dans la sélection des plantes-mères en vue d’une propagation clonale. D’autres facteurs peuvent également favoriser la mise en place d’un bon développement racinaire des plants : plus les boutures sont jeunes, plus elles développent un système racinaire de qualité (Dondey, 1988). Un apport d’auxine peut également venir en aide au développement racinaire des boutures. L’auxine agit en effet sur la rhizogenèse, en favorisant l’apparition de racines sur les boutures (De Klerk et al., 1999).
3.2. Critères de sélection
Les objectifs de sélection pour S. rebaudiana concernent différents caractères, parmi lesquels ceux relatifs aux SVglys (teneur totale en SVglys, teneur en RA, ratio RA/ST). Les caractéristiques morphologiques de la plante, telles que sa hauteur, son nombre de ramifications, son nombre de feuilles, l’indice de surface foliaire sont également à prendre en compte. Compte-tenu des besoins photopériodiques de S. rebaudiana pour son développement végétatif, il est nécessaire de développer des variétés précoces, afin d’assurer une production de SVglys optimale dans nos latitudes (Andolfi et al., 2006). Enfin, des caractères tels que la sensibilité à la photopériode et la précocité de la plante, sa tolérance ou sa résistance aux maladies, à la sécheresse ou aux sols à pH élevé sont à prendre en compte (Yadav et al., 2011).
PARTIE 1,CHAPITRE 1:Stevia rebaudiana Bertoni, la plante et sa culture
38
3.2.1. Teneur et composition en glycosides de stéviol
Il existe une variabilité génétique suffisante pour obtenir des gains génétiques significatifs pour la teneur en RA et pour le ratio RA/ST (Brandle et Rosa, 1992 ; Brandle, 1999). Selon des résultats obtenus sur des familles demi-frères, l’héritabilité pour la teneur en ST est élevée (76%) (Brandle et Rosa, 1992). Un travail de sélection variétale peut donc être effectif sur ces critères.
Les teneurs totales en SVglys au stade de jeune plant et au stade bouton floral (récolte) ne sont pas corrélées (Nakamura et Tamura, 1985), ce qui suggère qu’une sélection réalisée aux premiers stades sur la teneur en SVglys n’est pas effective (Brandle et al., 1998). Cependant, une sélection sur la composition en SVglys pourrait être faite à des stades précoces : les proportions individuelles des SVglys au stade de jeune plant sont corrélées à celles obtenues au stade bouton floral (Nakamura et Tamura, 1985).
3.2.2. Critères morphologiques
La variabilité génotypique de S. rebaudiana peut permettre d’obtenir des gains génétiques significatifs pour le rendement en feuilles (Brandle et Rosa, 1992 ; Brandle, 1999). Par ailleurs, l’héritabilité pour le ratio feuilles/tiges est de 79% (Brandle et Rosa, 1992). Une variabilité et une héritabilité suffisantes ont également été observées sur l’ensemble des critères suivants : longueur et largeur des feuilles, hauteur de la plante, nombre d’inflorescences, rendement en feuilles, nombre de feuilles par plante (Gaurav et al., 2008).
Dans une étude, quatre morphologies de plante ont pu être distinguées, les facteurs discriminants étant le nombre d’axes dominants et le nombre de ramifications latérales (Figure 4). Les plantes les plus productives étaient celles n’ayant qu’une seule tige ou peu de ramifications et avec un ratio feuilles/tiges plus élevé (Tateo et al., 1998). Les plantes de taille élevée ou au nombre de ramifications important ne produiraient en effet pas un nombre de feuilles significativement supérieur à celui des autres plantes (Raji Akintunde et Mohamad, 2011).
39
Figure 4: Caractéristiques morphologiques des quatre groupes de plantes obtenus dans l’étude de Tateo et
al. (1998).
La surface des feuilles peut également être un critère intéressant, de grandes feuilles conduisant à une biomasse plus élevée que des petites. Cela pourrait permettre la production d’une plus grande quantité de SVglys (Raji Akintunde et Mohamad, 2011). Il a été démontré que la longueur des feuilles et le nombre d’inflorescences par plante sont corrélées négativement avec le rendement en feuilles, alors qu’il existe une corrélation positive entre la hauteur de la plante et le nombre de feuilles par plante (Gaurav et al., 2008).
Il existe une variabilité et une héritabilité suffisantes pour réaliser un travail de sélection variétale sur la morphologie des plantes et leur capacité productive. Dans son habitat d’origine, la teneur totale en SVglys des feuilles de S. rebaudiana varie entre 2 et 10% de la masse sèche des feuilles. Une trentaine d’années de sélection, basée sur des caractères phénotypiques, a permis d’atteindre des teneurs approchant 20% de la masse sèche des feuilles (Yadav et al., 2011).
PARTIE 1,CHAPITRE 1:Stevia rebaudiana Bertoni, la plante et sa culture
41
Chapitre 2 : Les glycosides de stéviol
PARTIE 1,CHAPITRE 2:Les glycosides de stéviol