© Laurie Isabel, 2020
Indicateurs pour l'évaluation de la condition des
communautés épibenthiques de l'estuaire et du golfe du
Saint-Laurent
Mémoire
Laurie Isabel
Maîtrise en biologie - avec mémoire
Maître ès sciences (M. Sc.)
ii
Résumé
Depuis les dernières années, les pressions anthropiques et climatiques sont en constante augmentation dans les écosystèmes marins et les invertébrés benthiques, ayant une mobilité réduite ou absente, sont particulièrement susceptibles d’en être affectés. Face à ces potentielles répercussions, le développement d’outils de gestion permettant de caractériser l’impact de ces pressions sur les communautés benthiques est essentiel. Dans ce projet, une exploration de la distribution des communautés épibenthiques et ainsi qu’une quantification de l’importance des pressions sur l’assemblage de ces espèces dans l’estuaire et le golfe du Saint-Laurent ont été menées pour parvenir à sélectionner des taxons indicateurs de la condition de cette communauté. Les données utilisées proviennent d’un relevé écosystémique mené chaque année par le ministère des Pêches et Océans Canada avec pour objectif, entre autres, d’inventorier les espèces épibenthiques. Les résultats montrent que la profondeur, la salinité, l’oxygène et la température sont les variables les plus importantes pour expliquer les variations observées dans l’assemblage des communautés. L’oxygène, plus particulièrement l’hypoxie, joue un rôle particulièrement important pour les communautés benthiques. On observe un important seuil de changement en biomasse des taxons lorsque les concentrations en oxygène s’approchent de 50-100 μmol O2 L-1, correspondant à une diminution de l’abondance des espèces sensibles à l’hypoxie vers une communauté dominée par des espèces opportunistes. Ces informations ont ainsi permis la sélection de quatre taxons indicateurs des conditions hypoxiques pour l’estuaire et le golfe du Saint-Laurent : Actinostola callosa, Actinauge cristata,
Ctenodiscus crispatus et Brisaster fragilis. Ces indicateurs traduisent la réaction des
communautés benthiques et permettront de détecter l’impact des conditions hypoxiques. Ils pourront ainsi servir d’outils aux scientifiques et aux gestionnaires qui désirent faire le suivi spatial et temporel de la condition de ces communautés.
iii
Abstract
In recent years, anthropogenic and climate pressures have been increasing constantly in marine ecosystems and benthic invertebrates, having reduced or absent mobility, are particularly likely to be affected. Faced with these potential repercussions, the development of management tools to characterize the impact of these pressures on benthic communities is increasingly necessary. In this project, I explore the distribution of epibenthic communities and quantify the importance of pressures on the assembly of epibenthic species from the estuary and Gulf of St. Lawrence in order to select indicator taxa reflecting changes of the benthic condition. The estuary and the Gulf of St. Lawrence form a vast inland sea whose conditions are changing. Benthic data come from an ecosystem survey conducted each year by Fisheries and Oceans Canada. One of the aims of this research survey is to inventory the biodiversity of benthic communities. Using these data, analyses identified depth, salinity, oxygen and temperature as the most important predictors explaining variations in community assembly. Oxygen and specifically hypoxic conditions play a major role for benthic communities. A significant threshold of community composition is observed when oxygen concentration approaches 50-100 μmol O2 L-1. These changes correspond to a modification of dominant taxa. Taxa sensitive to hypoxia decrease in abundance as concentrations get closer the threshold while opportunistic taxa increase in abundance as concentrations reach hypoxia. Thus, this enables the selection of four indicator taxa reflecting the impact of hypoxic conditions on benthic communities: Actinostola callosa, Actinauge cristata, Ctenodiscus crispatus and
Brisaster fragilis. These indicators of benthic conditions can be used to establish the impact
of hypoxia on epibenthic communities. They may also indicate the condition of epibenthic communities in the estuary and Gulf of St. Lawrence and serve as tools for scientists and managers to evaluate the spatiotemporal variation in communities’ conditions.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des tableaux ... vi
Liste des figures ... vii
Liste des abréviations ... viii
Remerciements ... ix
Avant-propos ... x
Introduction générale ... 1
1.1 Intégrité des écosystèmes marins ... 1
1.2 Pressions multiples ... 1
1.3 Communautés benthiques ... 3
1.4 Indicateurs écologiques ... 4
1.5 Le Saint-Laurent marin ... 6
1.7 Objectifs et hypothèses ... 10
Chapter 1: Detection of ecological thresholds and selection of indicator taxa for epibenthic communities exposed to multiple pressures ... 11
Résumé ... 12 Abstract ... 13 Introduction ... 14 Methods ... 18 2.2 Benthic data ... 19 2.3 Environmental data ... 19 2.4 Data analysis ... 20
2.4.1 Epibenthic communities’ structure and potential habitats ... 20
2.4.2 Random forest and gradient forest ... 21
2.4.3 Indicator taxa ... 22
Results ... 22
3.1 Communities structure ... 22
v
3.3 Detection of thresholds ... 27
3.4 Taxa reactions to oxygen thresholds ... 31
3.5 Indicator taxa ... 34
Discussion ... 35
4.1 Epibenthic communities of the EGSL ... 35
4.2 Predictors’ importance and community thresholds ... 37
4.3 Ecological indicators ... 40
Conclusion ... 42
Acknowledgement ... 42
Annexe (Supporting information) ... 44
Conclusion ... 48
vi
Liste des tableaux
Table 1. Summary statistics for six epibenthic community types identified in the Estuary and Gulf of St. Lawrence. Data includes identification and biomass of the top six dominant taxa and the total and mean number of taxa in each community type.
Table 2. Summary of habitats environmental values (mean ± sd).
Table 3. Indicative values of taxa with an indicator value > 0.5, for each community type. Tableau 4. Récapitulatif des seuils détectés et des espèces indicatrices sélectionnées dans
ce projet de recherche.
Table S1. List of taxa used in analysis with taxonomic classification extracted from WoRMS. Subgenus and subspecies are shown in parenthesis.
vii
Liste des figures
Figure 1. Carte de l’estuaire et du golfe du Saint-Laurent (EGSL) et des provinces adjacentes. Les chenaux profonds sont indiqués en bleu (profondeur > 200 m).
Figure 2. Location of sampling sites for years 2011 to 2018 covering the Estuary and Gulf of St. Lawrence (EGSL). Deep channels are shown in blue (depth > 200 m).
Figure 3. Location of the six epibenthic community types in the Estuary and Gulf of St. Lawrence identified by hierarchical cluster analysis with biomass data collected from 2011 to 2018. Deep channels are shown in blue (depth > 200 m).
Figure 4. Location of the six habitats in the Estuary and Gulf of St. Lawrence identified by k-means clustering with environmental data ranging from 2011 to 2018. Deep channels are shown in blue (depth > 200 m).
Figure 5. Overall importance, R2p, of each predictor p included in the gradient forest analysis.
Figure 6. Splits density and cumulative distributions of the standardized splits importance for each taxon scaled by R2 of the four most important predictors of the distribution of epibenthic taxa in the estuary and Gulf of St. Lawrence. Each curve of different color represents an individual taxon (ntaxa = 104).
Figure 7. Partial dependence plots of the top eight taxa with the highest R2 at the 50-100 μmol O2 L-1 threshold build from the random forest biomass regressions of taxa for oxygen.
Figure 8. Partial dependence plots of the top eight taxa with the highest R2 from oxygen concentrations of 175 to 300 μmol O2 L-1 thresholds build from the random forest biomass regressions of taxa for oxygen.
viii
Liste des abréviations
DD: Demersal destructive fisheries
DHN: Demersal non-destructive high-by-catch fisheries DFO: Department of Fisheries and Ocean Canada
EGSL: Estuaire et golfe du Saint-Laurent/Estuary and Gulf of St. Lawrence GF: Gradient forest
INREST : Institut nordique de recherche en environnement et en santé au travail posAnom: Positive temperature anomalies
PSU : Practical Salinity Unit
MPO: Ministère des Pêches et Océans Canada RF: Random forest
ix
Remerciements
Je tiens tout d’abord à remercier mon directeur, Philippe Archambault, sans qui tout ça n’aurait pas été possible. Tout d’abord, Phil, merci pour ta confiance en me proposant ce projet et en me laissant l’explorer et le concrétiser à ma façon. Ta passion pour ton métier est évidente et a été une grande source de motivation et de réflexions scientifiques tout au long de mon cheminement. Je tiens aussi à remercier mon co-directeur, Chris McKindsey dont les commentaires très précieux m’ont permis de remettre mon projet en perspectives et ont apporté de nouvelles réflexions.
Un merci particulier à Laure et Lisa pour l’aide fourni à l’identification et les connaissances taxonomiques essentielles transmissent avant mes départs sur le terrain sans oublier aussi les conseils précieux de Claude Nozères. Merci aussi à tous mes-coéquipiers du Teleost (Pierre-Marc, Chantal, Claude, Marie-Julie, Hugo, Jean-François, et j’en passe!) qui ont rendu les séjours sur le bateau encore plus agréable et rempli de péripéties. Merci à tous les membres du labo benthos!! Cindy, évidemment pour le travail essentiel que tu fais pour faire vivre ce labo, Camille, pour avoir passé un été complet à m’aider à éplucher et chercher de vieilles références, David, merci pour toute l’aide fourni autant pour l’acquisition des données, que pour des discussions sur mon projet et des discussions scientifiques plus générale. Tu as grandement contribué à faire cheminer mes réflexions! Elliot, merci pour les séances de dépannages en stats et avec R. Qu’aurais-je fait sans toi! Charlotte, Marie et Val, pour toutes les discussions, les pauses M&M et les après-midis passés à « travailler » au soleil. Un merci spécial va à vous cinq (David, Elliot, Charlotte, Marie et Val) pour votre amitié, votre support et les nombreux 5 à 7! Merci aussi à tous mes autres ami(e)s (Steph, Evelyne (et Philibert!!), Yohanna, Émilie) qui m’ont permis de décrocher quand j’en avais vraiment besoin! Finalement, un gros merci à mes parents qui m’ont toujours supporté et encouragé! Maman, Papa, merci pour tout! Je n’aurais pas fini cette maîtrise sans votre soutien. MERCI!!
x
Avant-propos
Ce projet s’inscrit dans le deuxième volet d’un projet du réseau pancanadien « Canadian Healthy Ocean Network (CHONe II) » ayant pour but d’élaborer de nouvelles stratégies de conservation pour les océans changeants du Canada. Ce projet a pour objectif de comprendre et quantifier comment les principales pressions, y compris les impacts cumulatifs, altèrent la biodiversité marine, les fonctions et les services des écosystèmes. L’objectif plus précis de mon projet de maîtrise est d’obtenir des indicateurs traduisant l’impact des pressions anthropiques et climatiques sur l’assemblage des communautés benthiques de l’estuaire et du golfe du Saint-Laurent. Ce mémoire est principalement composé de l’article « Chapter 1 : Detection of ecological thresholds and selection of indicator taxa for epibenthic communities exposed to multiple pressures ». L’article devrait être soumis à une revue scientifique au courant du printemps 2020. Les coauteurs de cet article sont monsieur Philippe Archambault, mon directeur, monsieur Chris W. McKindsey, mon codirecteur, ainsi que monsieur David Beauchesne, étudiant au doctorat à l’UQAR-ISMER.
Philippe Archambault et Chris Mckindsey ont élaboré ce projet pour la « Canadian Healthy Ocean Network (CHONe) », un programme de recherche stratégique financé par le CRSNG. Les campagnes d’échantillonnage ont été gérées par le ministère des Pêches et Océans (MPO), région du Québec, à bord du navire de recherche NGCC Teleost. Cette mission a lieu chaque année au mois d’août depuis 2004. J’ai moi-même participé aux missions en 2017 et 2018. Les données utilisées pour les analyses sont celles des missions de 2011 à 2018 et ont été fournies par Denis Bernier du MPO à l’Institut Maurice-Lamontagne. David Beauchesne a contribué à l’acquisition des données sur les variables environnementales. J’ai effectué les analyses statistiques et l’interprétation des résultats et rédigé cet article (premier auteur). Ce projet est financé par le programme Canadian Healthy Oceans Network du CRSNG et ses partenaires : le ministère de Pêches et Océans Canada et l’INREST (représentant le Port de Sept-Îles et la ville de Sept-Îles) ainsi que par le regroupement Québec-Océan.
xi
Ce projet a été présenté dans plusieurs congrès au cours de mes deux années de maîtrise qui ont donné lieu à plusieurs discussions et partages de résultats avec la communauté scientifique.
Isabel L, Mckindsey C, Archambault P (2019) Indicateurs de la condition des communautés benthiques de l’estuaire et du golfe Saint-Laurent. 10e Colloque du Département de biologie de l'Université Laval, Québec, Canada, 20-21 mars. (Présentation)
Isabel L, Mckindsey C, Archambault P (2018) Indicators of benthic condition at the Gulf-scale: megabenthic community structure. CHONe II 3rd Network Meeting, Ottawa, Canada, 29 novembre au 1 décembre. (Présentation)
Isabel L, Mckindsey C, Archambault P (2018) Indicators of benthic condition in the Gulf of St. Lawrence: ecological niche analysis of indicator species. CHONe II 3rd Network Meeting, Ottawa, Canada, 29 novembre au 1 décembre. (Affiche)
Isabel L, Mckindsey C, Archambault P (2018) Impacts des conditions océanographiques sur les communautés épibenthiques des eaux profondes du golfe du Saint-Laurent. Réunion scientifique annuelle de Québec-Océan, Rivière-du-Loup, Canada, 5-6 novembre. (Affiche)
Isabel L, Mckindsey C, Archambault P (2018) Assessing benthic health by the means of epibenthic indicators in Gulf and Estuary of St. Lawrence, Canada. 4th World Conference on Marine Biodiversity, Montreal, Canada, 13-16 mai. (Affiche)
Isabel L., P. Archambault and C. McKindsey (2017) Indicateurs de santé pour établir la condition écologique des communautés épibenthiques du nord de l’estuaire et du golfe du Saint-Laurent. Réunion scientifique annuelle de Québec-Océan, Rivière-du-Loup, Canada, 13-15 novembre. (Affiche)
1
Introduction générale
1.1 Intégrité des écosystèmes marins
Les océans procurent plusieurs bénéfices aux humains par le biais des pêcheries, de l’aquaculture, de produits naturels tels que des fertilisants ou des produits pharmaceutiques, de la protection côtière et du stockage de carbone (Daigle et al., 2017). Les interactions possibles entre les humains et les océans sont nombreuses, mais elles sont loin d’être toujours positives (Knap et al., 2002). Les populations humaines sont grandissantes et de plus en plus concentrées près des côtes (Knap et al., 2002). Aujourd’hui, près de 60 % des humains vivent en milieu côtier (GESAMP, 2001). Les façons d’utiliser les écosystèmes marins sont multiples et ont augmenté au cours des dernières décennies. Les activités anthropiques incluent, entre autres, le transport maritime, les pêcheries, le tourisme et l’exploitation pétrolière. Ces activités engendrent un afflux de pressions sur les écosystèmes marins telles que les contaminants, l’acidification, les déversements accidentels, l’hypoxie, la destruction d’habitats, le prélèvement de biomasse, les maladies, ainsi que la pollution marine (Simboura et Zenetos, 2002; Halpern et al., 2007; Boonstra et al., 2015; Beauchesne et al., 2016). S’ajoutent à cette équation déjà complexe les changements globaux, agissants sur une étendue spatiale très large, et constituant la pression dominante issue des activités humaines (Halpern et al., 2015). Ainsi, sous la forte influence des populations humaines grandissantes, les écosystèmes marins changent plus rapidement que jamais auparavant (Myers et Worm, 2003; MEA, 2005; Worm et al., 2006; Halpern et al., 2008; Halpern et al., 2015). Les activités anthropiques sont, entre autres, responsables de la dégradation des estuaires et des mers côtières, de la disparition d’espèces et de l’introduction de plusieurs espèces invasives (Lotze et al., 2006; Molnar et al., 2008).
1.2 Pressions multiples
Les activités humaines s’intensifient et s’étendent, imposant de profonds changements dans les communautés marines (Lotze et al., 2006; Butchart et al., 2010; McCauley et al., 2015). Le nombre de pressions exercées sur les océans par les humains
2
est en constante augmentation et les pressions ne cessent de prendre de l’expansion autant temporellement que spatialement (Halpern et al., 2015). Les conséquences sont multiples et dépendent du type de pression exercé. Les activités anthropiques et les pressions qui en découlent peuvent ainsi engendrer de nouvelles contraintes pour l’écosystème, telles que le prélèvement direct de biomasse par les pêcheries ou l’accumulation de contaminant synthétique, ou modifier des pressions déjà existantes. En effet, certaines pressions anthropiques, plus particulièrement celles associées aux changements climatiques, agissent souvent en modifiant les conditions océanographiques, chimiques et biologiques naturelles de l’écosystème, telles que la température, l’oxygène, le pH ou la production primaire (Walther et al., 2002; Breitburg et al., 2018). Ces pressions sont donc susceptibles d’interagir et de perturber les cycles saisonniers ou climatiques. Peu importe leur mode d’action, l’augmentation des pressions risque tôt ou tard d’entraîner leur chevauchement (Halpern et al., 2008). Les pressions qui se chevauchent peuvent alors interagir et engendrer des réponses non linéaires souvent difficiles à prédire (Beauchesne et al., 2016). Cumulée ou non, l'augmentation du nombre de pressions sur les écosystèmes marins rend la gestion de ces milieux de plus en plus complexe.
Les écosystèmes marins hébergent une importante biodiversité qui est ainsi menacée par ces pressions anthropiques. La majorité des embranchements du règne animal s’y trouve, cumulant un total de 232 256 espèces marines découvertes à ce jour (Horton et al., 2020). Ce nombre est toutefois infime comparativement au nombre réel d’espèces qui s’y trouve, car on estime que seulement 5 % des océans ont été explorés (NOAA, 2018). Les océans couvrent pourtant un peu plus des deux tiers de la surface de la Terre et constituent 99 % des habitats de la Terre (Kaiser et al., 2011). Avec les changements qui s’opèrent et qui continueront de s’opérer dans les années à venir, ces milliers d’espèces devront s’adapter et s’acclimater où elles risquent d’être vouées à l’extinction (Foo and Byrne, 2016). Cette capacité d’adaptation se fondera principalement sur un mélange entre des changements dans l’aire de répartition, de plasticité de l’organisme ainsi que d’évolution génétique (Chevin et al., 2010; García Molinos et al., 2016). À court terme toutefois, c’est la mobilité des organismes qui jouera le rôle plus important. Une réaction d’évitement peut être observée chez certains organismes lorsque les conditions deviennent défavorables à la
3
reproduction et à la survie (Wu, 2002). Certaines espèces ne possèdent toutefois pas cette capacité rapide de réaction. Plusieurs espèces marines sont sessiles ou très peu mobiles et ont donc des capacités très limitées pour fuir une pression qui réduirait leur chance de reproduction et/ou de survie. Ces espèces subiront ainsi l’impact des pressions et leur intégrité est plus à risque d’être menacée. Parmi les communautés marines les plus à risque, on retrouve les communautés benthiques, formées d’invertébrés vivant sur (épibenthique) ou dans (endobenthique) les sédiments de fond (Castro and Huber, 2013). La plupart des organismes benthiques sont sédentaires, c’est-à-dire qu’ils se déplaceront peu ou pas du tout pendant leur stade adulte, les rendant ainsi vulnérables aux pressions anthropiques (Wass, 1967; Dauer, 1993; Weisberg et al., 1997).
1.3 Communautés benthiques
Les communautés benthiques jouent un rôle majeur dans les écosystèmes marins et une dégradation de leur état risque d’affecter l’ensemble de l’écosystème. En effet, plusieurs espèces forment des structures en trois dimensions, appelées structures biogéniques, qui créent des habitats pouvant servir de lieu de protection pour plusieurs espèces vivant près du fond, telles que les juvéniles de poissons ou d’autres invertébrés vulnérables à la prédation (Buhl-Mortensen et al., 2010). Ces structures peuvent aussi créer un environnement où le courant est réduit ce qui permet à plusieurs espèces de profiter d’un environnement plus clément. Parmi les espèces pouvant former des structures biogéniques, on retrouve, entre autres, plusieurs espèces de coraux, les plumes de mer et plusieurs espèces d’éponges. Les organismes benthiques vivants dans les sédiments jouent quant à eux un rôle majeur dans le transport et la circulation de l’eau et de particules à travers les sédiments et à l’interface eaux-sédiments (Rhoads, 1974; Aller, 1982). Ce phénomène, appelé bioturbation, joue un rôle direct dans les cycles biogéochimiques du carbone et dans le recyclage des nutriments, tel que la reminéralisation de la matière organique (Mermillod-Blondin and Rosenberg, 2006). Les communautés benthiques interviennent aussi dans les cycles biogéochimiques par le biais d’espèces filtrantes, les bivalves, qui jouent un rôle crucial dans le couplage benthique pélagique (Newell, 2004). Ces espèces ingèrent de multiples particules présentes dans la colonne d’eau, telles que la
4
matière organique particulaire, le phytoplancton et les particules inorganiques, pour les transformer en fèces (Dame, 1996; Newell, 2004; Dumbauld et al., 2009). Cette fonction contribue ainsi à clarifier l’eau et à transférer les particules riches en matières organiques au fond marin.
Les invertébrés benthiques sont souvent utilisés pour faire le suivi des conditions de santé d’une communauté ou de l’ensemble de l’écosystème. Ils constituent en effet de bons indicateurs de condition écologique puisque, ayant majoritairement peu ou pas de mobilité, ils intègrent les changements et leur état reflète ainsi la condition du milieu immédiat (Engle et Summers, 1999). Plusieurs organismes ont aussi une longévité élevée, ce qui permet de faire des suivis sur plusieurs années. Les organismes benthiques sont aussi localisés à un interstice, le fond, où plusieurs pressions s’accumulent, telles que l’hypoxie, les contaminants et la matière organique, ce qui les expose à de multiples sources de pression (Engle et Summers, 1999). On observera ainsi, dans la communauté, des changements dans la diversité, la richesse spécifique, l’abondance ainsi que plusieurs autres paramètres en réponse à une pression. Ces changements peuvent être suivis, autant temporellement que spatialement, pour définir l’état de la communauté ou de l’écosystème (Engle et Summers 1999).
1.4 Indicateurs écologiques
Avec les changements rapides qui se produisent dans les écosystèmes marins, le développement d’outils de gestion permettant de déterminer la condition écologique d’une composante biologique et d’en faire le suivi est devenu une stratégie de gestion essentielle (Pinto et al., 2009). Parmi les différents outils pouvant être développés, les indicateurs ont joui d’une grande popularité dans la dernière décennie (Siddig et al., 2016). Un indicateur est une mesure quantifiable d’un paramètre écologique dont l’évolution peut être suivie au cours du temps pour permettre d’établir l’état d’une composante biologique (Jamieson et al., 2001; Large et al., 2015). Les indicateurs écologiques offrent ainsi la possibilité de faire un suivi relativement simple et peu coûteux de diverses composantes océanographiques ou biologiques (Noss, 1990). Ils fournissent des signes précurseurs de changements
5
importants dans la communauté et peuvent être utilisés comme outils de gestion dans les programmes de suivi et d'évaluation environnementales (Noss, 1990; Large et al., 2015). Une modification de l’indicateur reflétera ainsi des changements dans la condition de la composante biologique à l’étude. Les indicateurs peuvent prendre différentes formes, dépendamment de l’objectif initial du suivi, par exemple, le suivi d’une population, d’une communauté ou de l’écosystème entier (Carignan et Villard, 2002). Les indicateurs benthiques sont généralement basés sur la présence ou l’absence d’une ou quelques espèces spécifiques ou sur des changements dans les rapports d’abondance de plusieurs espèces (Carignan et Villard, 2002; Pinto et al., 2009; Siddig et al., 2016). Plusieurs techniques existent pour sélectionner ou développer des indicateurs. On pourrait penser aux espèces clés, aux espèces parapluies ou encore aux espèces associées à des caractéristiques particulières du milieu (Carignan et Villard, 2002).
Plusieurs indicateurs et mesures de suivi des communautés benthiques ont déjà été développés à travers le monde. La vaste majorité toutefois a été développée en Europe à la suite de l’adoption de la Directive-cadre sur l’eau (Borja et al., 2015). Cette directive oblige les membres de l’Union européenne à faire le suivi des conditions de santé des milieux aquatiques et d’en établir le statut écologique (European Commission, 2000). La plupart de ces indicateurs écologiques benthiques développés à ce jour se basent sur le principe d’espèces tolérantes/sensibles, soit le ratio entre les espèces favorisées par la pollution et les espèces impactées négativement par la pollution (Pinto et al., 2009). Ces indicateurs sont donc spécifiques à l’analyse de l’impact de la pollution marine par enrichissement organique sur les communautés benthiques. Comme ces indicateurs sont trouvés ou développés pour une pression spécifique, leur utilisation doit se restreindre à l’analyse de l’impact de cette pression sur la communauté. En effet, les pressions impactent différemment les espèces individuellement, transmettant ainsi des réponses écologiques différentes pour la communauté entière (Dauer, 1993; Borja et al., 2000). Considérant le contexte actuel de pressions multiples, le potentiel de sélection ou de développement de nouveaux indicateurs est très grand. Il est donc essentiel d’acquérir une bonne connaissance des pressions dominantes d’un système, c’est-à-dire les pressions influençant le plus la répartition et l’abondance des espèces, avant de sélectionner ou développer des indicateurs.
6
Plusieurs procédures et analyses ont été proposées au cours des dernières années pour développer et sélectionner des indicateurs écologiques adaptés à la communauté étudiée (Dufrêne et Legendre, 1997; Carignan et Villard, 2002; Fu et al., 2019). Ces méthodes permettent ainsi d’acquérir des connaissances du système à l’étude pour développer ou adapter des indicateurs qui correspondent aux contraintes spécifiques du milieu et sont donc adaptés à la communauté dont on veut faire le suivi (Zettler et al., 2013).
1.5 Le Saint-Laurent marin
Le Saint-Laurent s’étend de l’embouchure des Grands Lacs jusqu’aux embouchures de l’Atlantique Nord, à l’est des provinces des maritimes (Figure 1). Sa portion marine commence à la hauteur de Tadoussac et se poursuit jusqu’à Pointe-des-Monts. À partir de là, c’est le golfe du Saint-Laurent, une mer intérieure, qui prend la relève (Rossignol, 1998). La section composée de l’estuaire et le golfe du Saint-Laurent (EGSL) est semi-stratifié et sa dynamique hydrologique est fortement influencée par les différentes couches qu’on y retrouve et ses trois chenaux profonds : le chenal Laurentien, le chenal d’Anticosti et le chenal Esquiman. Trois couches sont présentes pendant l’été : la couche superficielle, la plus chaude à cette période, la couche intermédiaire froide, formée aux printemps par la fonte des glaces et qui renferme les eaux les plus froides pendant l’été, puis pour finir la couche d’eau profonde, présente toute l’année, qui ne se mélange jamais avec les deux autres couches. La formation des eaux profondes est contrôlée par deux courants en provenance de l’Atlantique. Le courant du Labrador, provenant des régions arctiques, pénètre dans le golfe par le détroit de Belle-Isle (DFO, 2005). L’autre source provient du talus continental de l’Atlantique et pénètre dans le golfe par le détroit de Cabot. Les eaux profondes voyagent donc du talus vers les têtes des chenaux s’appauvrissant en oxygène dissous sous l’effet de la respiration in situ et de l’oxydation des matières organiques à mesure qu’elles transitent (Galbraith et al., 2019). Le chenal Laurentien étant le plus long, les eaux en provenance de l’Atlantique prennent entre trois et quatre ans environ pour se rendre jusqu’à la tête (Gilbert et al., 2007). Elles arrivent donc dans l’estuaire largement appauvries en oxygène et c’est entre autres pourquoi on y retrouve les niveaux les plus bas en oxygène dissous (Galbraith et al., 2019). Le Saint-Laurent maritime reçoit un apport en
7
surface d’eau douce provenant du fleuve en amont et des nombreuses rivières qui s’y déversent (Therriault, 1991). Le golfe du Saint-Laurent est un milieu très productif comparativement à la haute mer et possède un fort gradient de salinité et de température (El-Sabh et Silverberg, 1990; Therriault, 1991). Il s’agit aussi d’un milieu très diversifié à cause de la grande diversité d’habitat (DFO, 2005).
Figure 1. Carte de l’estuaire et du golfe du Saint-Laurent (EGSL) et des provinces adjacentes. Les chenaux profonds sont indiqués en bleu (profondeur > 200 m).
Le bassin versant du Saint-Laurent est fortement peuplé avec plus de 70 % de la population de la province de Québec qui y vit, sans compter la portion très industrialisée autour des Grands Lacs (Environnement Canada, 2017). L’estuaire maritime et le golfe sont fortement utilisés par la population et permettent le déroulement de plusieurs activités générant des retombées économiques importantes chaque année (Environnement Canada, 2017). La valeur de la pêche commerciale marine dans le Saint-Laurent s’élève à plus de 260 millions
8
de dollars par année avec une cinquantaine d’espèces différentes qui sont exploitées commercialement (Alexander et al., 2010; MAPAQ, 2018). Environ 8000 mouvements de navire sont observés chaque année dans sa voie maritime navigable (SODES, 2017). Le nombre de navires de croisière étrangers venant séjourner temporairement dans les eaux du Saint-Laurent est aussi en constante augmentation depuis les dix dernières années (SODES, 2017). Cette forte présence humaine expose ainsi les communautés marines à de nombreuses pressions (Beauchesne et al., 2016; Schloss et al., 2017).
Sous l’effet des activités anthropiques et des changements climatiques qui en découlent, le Saint-Laurent marin a subi plusieurs changements au cours des dernières années, en particulier dans ses zones les plus profondes. En effet, les eaux profondes du Saint-Laurent se sont réchauffées et leur concentration en oxygène a considérablement diminué. Les causes de ces changements observées sont multiples. Comme mentionné précédemment, les eaux de la couche d’eau profonde du Saint-Laurent, situé sous les 150 m, prennent leur origine de l’embouchure du chenal Laurentien (Galbraith et al., 2019). Des modifications de la température, de la salinité et de l’oxygène dissous de cette couche profonde sont observées chaque décennie. Ces changements sont provoqués par la proportion variable dans le mélange dans l’Atlantique Nord entre l’eau du courant du Labrador, froide, peu salée et très oxygénée, et l’eau du talus continental Atlantique, chaude, salée et peu oxygénée pénétrant dans le Saint-Laurent (McLellan, 1957; Lauzier et Trites, 1958; Gilbert et al., 2005). Cette dynamique est actuellement en changement avec un ralentissement du courant du Labrador au profit des eaux du talus, ce qui a provoqué un réchauffement des eaux profondes couplé à une diminution de la concentration en oxygène (Gilbert et al., 2005; Galbraith et al., 2019). La couche d’eau profonde du Saint-Laurent s’est en effet réchauffée depuis les 10 dernières années pour atteindre des niveaux records en 2019, de 1.4°C supérieur à la moyenne des 10 dernières années (Galbraith et al., 2020). Pour ce qui est de l’oxygène, les concentrations ont diminué de moitié depuis les années 1930 (Gilbert et al., 2005). Près de la moitié jusqu’au deux tiers de la diminution de la concentration en oxygène observée dans les eaux profondes du Saint-Laurent serait expliquée par ce changement dans la dynamique des courants (Gilbert et al., 2007).
9
Les variations de la concentration en oxygène observées dans la couche d’eau profonde ne sont toutefois pas entièrement attribuables à la variabilité du climat océanique (Gilbert et al., 2005). Une augmentation du gradient d’oxygène, du détroit de Cabot vers la tête du chenal Laurentien dans l’estuaire, suggère qu’une augmentation de la demande en oxygène dans les sédiments même pourrait être responsable du reste de la diminution. Ce phénomène aurait été provoqué par la métabolisation de l’oxygène par les bactéries présentent en réponse à une augmentation de l’apport en matière organique particulaire dans la colonne d’eau et dans les sédiments (Thibodeau et al., 2006; Lehmann et al., 2009). Plusieurs évidences géochimiques et paléontologiques suggèrent que cette matière organique serait d’origine allochtone, probablement en provenance d’activités humaines en milieu terrestre (Gilbert et al., 2005; Thibodeau et al., 2006; Lehmann et al., 2009). Ces changements ont entraîné la formation d’une zone hypoxique persistante dans l’estuaire en plus d’entraîner l’acidification de ces eaux (Gilbert et al., 2005; Mucci et al., 2011). En effet, en consommant la matière organique pour leur respiration, les bactéries rejettent du CO2. Le pH des eaux profondes de l’estuaire a ainsi diminué d’environ 0.2-0.3 depuis les 75 dernières années (Mucci et al., 2011). En combinant l’augmentation de la température à l’apport en matière organique et à la diminution de l’oxygène dissous et du pH, on observe une forte concentration de pression dans l’estuaire du Saint-Laurent.
Les communautés benthiques de l’EGSL sont très diversifiées, mais aussi très à risque de subir l’impact de ces changements. La structure et la distribution des espèces sont en effet en partie contrôlées par plusieurs variables environnementales, dont la température et l’oxygène (Moritz et al., 2013). Six communautés distinctes ont ainsi été identifiées et modélisées en fonction des variables environnementales (Moritz et al., 2013). L’impact des conditions hypoxiques dans l’EGSL sur la biodiversité épibenthique et sur la bioturbation a aussi été étudié et bien qu’aucune différence significative de la richesse spécifique n’ait été observée entre les zones hypoxiques et les zones à concentration normale en oxygène, les résultats suggèrent la présence de communautés épibenthiques distinctes entre ces zones (Belley et al., 2010). Ces études fournissent un point de départ pour comprendre l’impact des pressions anthropiques sur les communautés benthiques de l’EGSL. Néanmoins, plusieurs éléments restent inconnus, tels que l’importance relative de chacune des pressions ainsi que la quantification de leurs impacts. À l’inverse de ces pressions en augmentation,
10
les pêcheries au chalut de fond ont largement diminué à la suite de l’effondrement de plusieurs stocks de poissons au début des années 90 (Ouellet et al., 2016). La pêche au chalut de fond est très dommageable pour les communautés benthiques puisqu’elle arrache de la surface une quantité importante de biomasses. Toutefois, les pêcheries au chalut actuelles dans l’EGSL ne semblent avoir que très peu d’impacts sur les communautés épibenthiques (Moritz et al., 2015). En effet, les fortes activités de pêches ayant pris place il y a plusieurs décennies auraient entraîné la disparition des taxons vulnérables. L’impact des premiers passages des engins aurait donc été irréversible et les communautés benthiques ont probablement atteint, par la suite, un état d'équilibre perturbé sur lequel la perturbation actuelle du chalutage a des impacts limités voire inexistants.
1.7 Objectifs et hypothèses
Ce projet vise à sélectionner des indicateurs de la condition des communautés épibenthiques de l’estuaire et du golfe du Saint-Laurent. Le premier sous-objectif est d’explorer la distribution des communautés épibenthiques de l’EGSL. Le deuxième sous-objectif est de quantifier l'importance des changements dans le gradient de chaque pression sur l'assemblage des communautés épibenthiques de l'ESGL. Le troisième sous-objectif est de trouver une ou des espèces indicatrices dont les réactions traduiront la réaction de la communauté face aux pressions. Ces indicateurs permettront d’établir la condition des communautés épibenthiques et d’en faire le suivi spatio-temporel.
Les hypothèses sont que les espèces épibenthiques sensibles seront affectées négativement par la présence d’une ou de plusieurs pressions, ce qui modifiera leurs paramètres d’occurrence spatiale et que l’impact des pressions sur ces espèces déprendra de l’intensité à laquelle ils sont appliqués dans le milieu. La gradation de l’intensité des impacts ainsi que la modification de la structure due à la sensibilité de certaines espèces permettront de développer des indicateurs qui indiqueront la condition écologique des communautés épibenthiques. Les prédictions sont que les espèces sensibles à une ou plusieurs pressions seront absentes des sites fortement impactés par cette ou ces pressions et présentes dans les sites où cette ou ces pressions sont absentes.
11
Chapter 1: Detection of ecological thresholds and
selection of indicator taxa for epibenthic communities
exposed to multiple pressures
Chapitre 1 : Détection des seuils écologiques et sélection de taxons indicateurs
pour des communautés épibenthiques exposées à de multiples pressions
12
Résumé
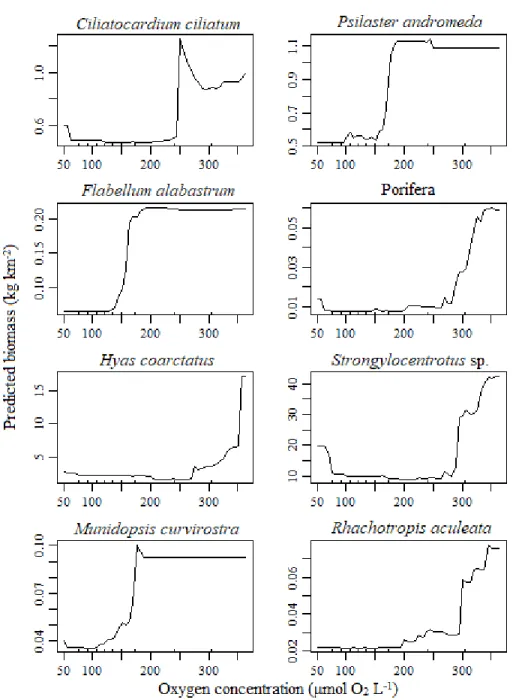
Les écosystèmes marins semi-fermés sont particulièrement affectés par l’augmentation du nombre de pressions anthropiques à cause de leur dynamique interne qui restreint l’évacuation. Face à ces répercussions, la quantification de l’impact de ces pressions et le développement d’outils de gestion permettant d’en détecter les effets sur les communautés benthiques sont maintenant nécessaires. L’objectif de cette étude est d’analyser les patrons de distribution des communautés épibenthiques et de quantifier l’impact des pressions importantes pour ces communautés dans l’estuaire et le golfe du Saint-Laurent, pour ensuite pouvoir sélectionner des espèces indicatrices. Les communautés épibenthiques ont été échantillonnées à 1314 sites couvrant l’ensemble de l’estuaire et du golfe du Saint-Laurent entre 2011 et 2018. Les analyses de groupement ont révélé la présence de quatre communautés épibenthiques distinctes qui semblent fortement influencées par la concentration en oxygène. Des analyses de seuil ont confirmé que l'oxygène est une variable très importante pour les communautés épibenthiques avec un seuil de changement de composition d’espèces important observé autour 50-100 μmol O2 L-1. À cette concentration et en dessous, les espèces opportunistes dominent la communauté alors que les espèces sensibles à l’hypoxie sont absentes ou présentent en très faible abondance. Ces dernières ne récupèrent en biomasse qu’autour de 150 μmol O2 L-1. Les taxons Actinostola callosa, Actinauge cristata, Ctenodiscus crispatus et Brisaster fragilis. ont été identifiés comme de bons indicateurs pour détecter l’impact de l’hypoxie sur la communauté épibenthique de l’EGSL. La combinaison des seuils de changements en composition et des indicateurs de la condition épibenthique permettront aux scientifiques et aux gestionnaires de l'environnement de d’établir et de suivre la condition des communautés benthiques de l’estuaire et le golfe du Saint-Laurent.
13
Abstract
Semi-enclosed marine ecosystems are particularly affected by increasing numbers of anthropogenic pressures due to their internal dynamics, which restricts flushing. Facing potential repercussions on communities, it is now necessary to quantify the impact of these pressures and develop management tools to detect their effects on benthic communities. The aims of this study are to analyse the distributional patterns of epibenthic communities and to quantify the impact of important pressures on these communities in the estuary and the Gulf of St. Lawrence, in order to select indicator taxa. Epibenthic communities were sampled at 1314 sites covering the estuary and the Gulf of St. Lawrence between 2011 and 2018. Cluster analyses revealed the presence of six distinct epibenthic communities that seem strongly influenced by oxygen concentrations. Threshold analyses confirmed that oxygen is a very important predictor of epibenthic community composition and distribution with an important community composition threshold observed around 50-100 μmol O2 L -1, i.e. around the hypoxic threshold of 62.5 μmol O2 L-1. At this concentration and below, opportunistic species dominate the community and taxa sensitive to hypoxia are absent or present in very low abundance. The latter starts to increase in abundance from oxygen concentrations around 150 μmol O2 L-1. The taxa Actinostola callosa, Actinauge cristata,
Ctenodiscus crispatus, and Brisaster fragilis were identified as good indicators for
detecting the impact of hypoxia on the epibenthic communities. The combination of thresholds and epibenthic condition indicators will allow scientists and environmental managers to establish and monitor the state of benthic communities in the estuary and the Gulf of St. Lawrence.
14
Introduction
Marine ecosystems are changing at a faster rate than ever before, causing profound changes in communities of living organisms (Walther et al., 2002; Myers and Worm, 2003; Worm et al., 2006). Increasing types and intensities of human activities over the last century have been identified as the main cause of these rapid changes (Halpern et al., 2015). Increasing human activities concomitantly increases potential pressures that may affect marine species. Moreover, Anthropocene-related climate changes are occurring and interacting with other long-term trends (Hoegh-Guldberg and Bruno, 2010), including other anthropogenic pressures. Together, these pressures dominate the human footprint on marine ecosystems (Halpern et al., 2008; Halpern et al., 2015), with the potential for spatiotemporal overlaps between the different types of pressures. Examples of impacts of human activities on marine ecosystems include acidification, sea-level rise, fish stock collapses, water temperature rise, and increasing hypoxic zones (Boonstra et al., 2015). Overlaps may lead to biological interactions and nonlinear effects that are difficult to predict and interpret (Crain et al., 2008; Côté et al., 2016). Cumulated or not, the increase of the number of pression on marine ecosystems makes ecological management more and more complex and challenging.Although the number and types of pressures has increased tremendously in recent decades, little is known about which are having the greatest impacts on communities and how they interact over space and time (Halpern et al., 2015).
The need to develop tools to reduce the complexity of our comprehension of ecological responses to pressures has become essential for environmental management (Landres et al., 1988; Meffe and Carroll, 1997). One way that has been used in recent years and is becoming increasingly common in ecology is the use of indicators and ecological thresholds (Karr, 1991; Hilty and Merender, 2000; Shin et al., 2010). Indicators are measurable variables that provide low cost and time effective monitoring options (Noss, 1990; Large et al., 2015). Combined with ecological thresholds that identifies patterns of change in a community facing multiple pressures, major ecological transition points can be identified. Ecological thresholds are particularly useful in ecosystem management as they may represent transition points where a small change in ecological conditions could greatly impact marine community diversity, structure and functioning (Toms and Lesperance,
15
2003; Huggett, 2005; Groffman et al., 2006). They provide critical information by identifying breakpoint values for pressures at which taxa or communities respond greatly and could potentially have drastic impacts on communities (Brenden et al., 2008; Andersen et al., 2009; Sonderegger et al., 2009; Baker and King, 2010). Altogether with indicators, they provide early warning signs of important changes communities and may be used as management tools for monitoring and assessment programs (Noss, 1990; Large et al., 2015).
Although coastal areas are often the most impacted marine habitat, evidence of the human footprint can be found in quite remote locations, such as the deep-seas (Halpern et al., 2008; Ramirez-Llodra et al., 2011). Coastal zones are mostly affected by human activity pressures whereas the open ocean is more affected by climatic pressures. Between these two areas are semi-enclosed marine ecosystems, such as inland seas, which may also be greatly affected by myriad pressures. Indeed, such areas often have internal dynamics that restrict flushing and are subject to a convergence of pressures from land-based and marine disturbances as well as climatic changes (MacCraken et al., 2008). This concentration of anthropogenic pressures may overlap spatio-temporally to yield complex interacting effects. It is thus essential to understand the impact of anthropogenic pressures in these marine regions and undertake sustained studies in those environments using the appropriate mathematical and conceptual models to predict ecological changes (Kroeze et al., 2008). Given the myriad potential impacts in semi-enclosed marine ecosystems, indicators to monitor major changes in community structure and functioning should be developed to inform management about potential degradations of ecological states (Kroeze et al., 2008). The estuary and Gulf of St. Lawrence (EGSL) in eastern Canada is an inland sea that is affected by a large suite of anthropogenic pressures. It is characterized by heterogenic oceanographic and geological conditions that create a high diversity of habitat, particularly for benthic communities (El-Sabh and Silverberg, 1990; Therriault, 1991; DFO, 2005; Moritz et al., 2013). The EGSL is also very productive and has attracted human settlement for centuries to the benefit of the socio-economical development of its adjacent lands (Alexander et al., 2010). Combined with global changes, this intense human use has concomitantly exposed this ecosystem to multiple environmental changes. Deep waters of the EGSL are warming, reaching new temperature records in 2019 due to altered ocean
16
circulation dynamics (Claret et al., 2018; Galbraith et al., 2019). Deep waters are formed by two water masses: the Labrador Current, which is cold and well-oxygenated and enters the Gulf through Strait of Belle Isle to the north, and Atlantic continental shelf water, which is warmer with less dissolved oxygen, entering the Gulf from the east through Cabot Strait (Galbraith et al., 2019). Recently, waters from the continental shelf entering in the Gulf are warmer which explain the observed warming and decreased bottom oxygen levels (Poitevin et al., 2019). Indeed, oxygen concentration has decreased by more than half the 1930 value over the last century (Gilbert et al., 2005). This current shift accounts for half to two-third of the decrease in oxygen levels while the remaining oxygen depletion is caused by a higher bacterial activity due to increased particulate matter in the water column and sediment (Lehmann et al., 2009). Evidence showed that land-based human activities are responsible for the increased organic matter inputs in the EGSL, resulting in the formation of a permanent hypoxic zone in the estuary (Gilbert et al., 2005; Gilbert et al., 2007; Thibodeau et al., 2006). These changes have also resulted in acidification, with the pH of these bottom waters dropping by 0.2 to 0.3 over the past 75 years (Mucci et al., 2011).
Benthic communities of the EGSL are likely to be greatly affected by these environmental changes as they are located at the convergence of these pressures - the bottom. Moreover, many benthic taxa are sessile or not very mobile and therefore have very limited ability to avoid pressures that would reduce their chances of reproduction and/or survival (Dauer, 1993; Weisberg et al., 1997). Benthic communities play a major role in marine ecosystems and their degradation could affect the entire ecosystem. Several taxa, such as corals, sea pens, and sponges, form biogenic structures that create habitats that may serve as protection for benthic and demersal taxa (Buhl-Mortensen et al., 2010). Benthic organisms living in sediments also play an important role in the transport and circulation of water and particles through sediments and at the water-sediment interface (Rhoads, 1974; Aller, 1982). This process, called bioturbation, directly affects carbon biogeochemical and nutrient cycling (Mermillod-Blondin and Rosenberg, 2006). Benthic communities are also involved in biogeochemical cycles through filtering taxa, such as bivalves, which play a crucial role in benthic-pelagic coupling (Newell, 2004). These taxa ingest various particles from the water
17
column, including organic matter, phytoplankton, and inorganic particles, which helps clarify water and transfer organic-rich particles to the seabed (Dame, 1996; Newell, 2004; Dumbauld et al., 2009).
Several studies have examined the impacts of environmental pressures on the distribution of benthic communities in the EGSL (Bourget et al., 2003; Lévesque et al., 2009; Belley et al., 2010; Moritz et al., 2013; Moritz et al., 2015). Depth, bottom current, temperature, and oxygen saturation have been shown to influence the distribution of benthic communities (Lévesque et al., 2010). Six distinct epibenthic communities, closely correlated with these environmental variables, were found, and modeled for the entire EGSL (Moritz et al., 2013). A strong relationship between oxygen and the level of bioturbation traces on the seafloor has also been observed (Belley et al., 2010), suggesting that the infaunal community may also be affected by hypoxia in the estuary. Similar taxa richness was observed between hypoxic and normoxic sites, which was likely the result of different community compositions along the studied oxygen gradient. Also, current trawl fisheries in the EGSL appear to have very little impact on epibenthic communities (Moritz et al. 2015). Notwithstanding these studies, the quantitative impacts of pressures on benthic communities remain largely unknown. In addition, indicators were not developed to monitor EGSL community’ conditions. Some studies have already tried to adapt indicators developed in European waters to the EGSL, but these indicators did not perform well for the EGSL (Callier et al., 2008; Robert et al., 2013). To this end, the present study aims to explore the spatial variation of EGSL epibenthic communities, assess changes along the pressure gradients assemblages, and select indicator species reflecting the condition of benthic communities. The hypothesis is that sensitive and tolerant epibenthic taxa will be affected respectively negatively and neutrally or positively by the presence of pressures. It is expected that the type and intensity of pressures will vary spatially in the EGSL with corresponding effects on benthic communities, and that ecologically relevant thresholds may be identified.
18
Methods
2.1 Study area
Figure 2. Location of sampling sites for years 2011 to 2018 covering the Estuary and Gulf of St. Lawrence (EGSL).Deep channels are shown in blue (depth > 200 m).
The EGSL covers an area of 116 115 km2 (Figure 2; Bourdages et al., 2018). Its topography includes three deep channels: the Laurentian, Anticosti and Esquiman channels (Saucier et al., 2003). The seabed topography of this region is complex and strongly influences water circulation (DFO, 2005). Waters are stratified with two layers being present during winter and spring and three layers in summer and fall (Galbraith et al., 2006).
19 2.2 Benthic data
Benthic taxa data were collected each august from 2011 to 2018 (survey each August) for a total of 1314 sites on board the CCGS Teleost during the Fisheries and Ocean Canada multidisciplinary research survey (Moritz et al., 2013; Bourdages et al., 2018). Sampling is done within depth-specific strata using a random sampling design (Gagnon, 1991). Samples are collected by bottom trawling with a four-sided Campelen 1800 shrimp trawl equipped with Rockhopper footgear (Walsh and McCallum, 1997). The trawl has a knotless nylon lining with 12.7 mm mesh size, allowing most of epibenthic macroinvertebrates to be collected (Bourdages et al., 2018). Trawling lasts around 15 minutes but may be shorter if a very large amount of fish is expected, to prevent overloading the trawl net or if the bottom is rocky.
The catch is sorted at each sampling site and benthic taxa identified to the lowest possible taxonomic level. Sorted invertebrates are then photographed, one taxon at a time, weighed, and counted to obtain population density and biomass. When > 30 individuals of a given taxon are collected, the mass of the total capture and of 30 random individuals is recorded to estimate the total number of individuals collected. Since trawls lengths and times are not standardized, biomass estimates were standardized relative to the catch effort (catch per unit effort (CPUE) – kg km-2).
2.3 Environmental data
Data on environmental predictors were obtained from two datasets: the fisheries multidisciplinary research survey and a driver platform. For the fisheries survey, an SBE19plusTM CTD was installed on the back on the trawl at each site to record temperature, salinity, and oxygen concentration on the bottom during the trawling (Bourdages et al., 2018). Depth is also recorded at the beginning and end of each trawl to provide a mean for each site. The second set of predictors was extracted from a drivers’ platform created by Beauchesne et al. (2020). Selected drivers were aragonite (measuring acidification), positive temperature anomalies (posAnom), as described in Galbraith et al. (2019), intensity of demersal non-destructive high-by-catch fisheries (DNH), expressed as the number of fishing events in a 1 km2 area and intensity of demersal destructive fisheries
20
(DD), expressed as the number of fishing trawls that have passed over a 1 km2 area in a year. Acidification and posAnom were normalized (0 to 1) to obtain an index of the intensity for each one.
2.4 Data analysis
2.4.1 Epibenthic communities’ structure and potential habitats
Sites were classified based on taxonomic composition similarity using hierarchical cluster analysis performed using Ward’s hierarchical agglomeration method to identify compact, spherical clusters (Ward, 1963). The analysis was applied to a Bray-Curtis dissimilarity matrix of taxa biomass to define distinct communities based on co-distributions of individual taxa (Bray and Curtis, 1957). Data on shrimp biomass were not included in the analyses. Although shrimps are considered as “benthic” organisms, they are not permanently located on the seabed, undertaking vertical migrations, and thus limiting their link to the benthic habitat (DFO, 2002; Savenkoff et al., 2017). Indeed, only 30 % of shrimp diets come from the benthos with the remaining 70 % originating from pelagic food webs (Bundy et al., 2000). Moreover, northern shrimp Pandalus borealis represents 75 % of the invertebrate catch of all EGSL surveys and its inclusion in the analyses could mask trends of other epibenthic taxa (Savenkoff et al., 2017). Similarity of sites in terms of environmental predictors was evaluated using k-means clustering to group sites characterized by similar environmental conditions. This clustering method works by creating k number of clusters with the aim to minimize the sum of residual sums-of-squares (Legendre and Legendre, 2012). The number of clusters selected was defined using the elbow method. This methodconsists of plotting the explained variation as a function of the number of clusters. To select the number of clusters to use, one shall pick the elbow of the curve. All data analyses were done using R version 3.5.1. The vegan package was used for species clustering and the function kmeans from the stats package was used for the environmental clustering (Oksanen et al., 2019; R Core Team, 2018).
21 2.4.2 Random forest and gradient forest
Thresholds of epibenthic community assemblage were evaluated by gradient forest analysis using the ‘gradientForest’ package in R (Ellis et al., 2012). A gradient forest (GF) is created by combining multiple random forests (RF) to establish the response of the whole community to environmental gradients (Ellis et al., 2012). It is an automated learning algorithm used for classification and regression problems based on Breiman’s algorithm (Breiman, 2001). The RF algorithm works by combining several (n) decision trees, each created by recursive data partitioning, with bootstrap techniques to minimize the variance of a single model. Each tree is created from a bootstrapped sample of the whole dataset. At each node during the data partitioning, a fixed number of predictors (mtry) is randomly selected from all available predictors. GF combines the cross-validated R2 and accuracy importance measures of every taxa’s RF to give a global R2 value. The overall result is a monotonic function for every predictor representing the turnover of taxa composition along the gradient of a predictor. The analysis identified where community composition changes along predictor gradients. Individual RF models of taxa were run to determine the directionality of taxa responses to variation in oxygen concentration with partial dependence plots, solely for taxa with a strong reaction at the previously identified thresholds. Partial dependence plots use the biomass regression function generated by each random forest model to show trends in biomass of a taxon as a function of oxygen concentration, while other predictors are kept at their average observed value (Murillo et al., 2016). Models were built with the ‘randomForest’ package in R (Liaw and Wiener, 2002). Default parameters were used except for mtry, which was tuned for each taxon, and ntree was fixed at 150 trees following Oshiro et al. (2012). RF and GF have many advantages for modeling taxa and community distributions. They can identify which predictors are most important for the observed patterns as multiple trees are grown with different combinations of predictors, which is very useful in ecosystems exposed to multiple pressures. In addition, there are no a priori distributional assumptions of the frequency of response variables, as opposed to other methods such as generalized linear models or generalized additive models. RF and its extensions are also good for handling non-linear patterns between predictors and the response variable (Breiman, 2001).
22 2.4.3 Indicator taxa
Indicator taxa that characterize groups of sites were identified using the IndVal method, as described by Dufrêne and Legendre (1997). This approach identifies indicator taxa by combining taxon abundance and frequency of occurrence to create an index representing the belonging of taxa to given groups, previously identified with Ward clustering method. Indicator taxa are useful to detect taxa that are characteristic of specific habitat and correspond to a certain set of environmental conditions (Dufrêne and Legendre, 1997; De Cáreres et al., 2010; Legendre and Legendre, 2012). In this analysis, an indicator value is calculated for each taxon in each previously identified community cluster based on their specificity and fidelity to each cluster. Specificity measures if a taxon is distributed across many groups (low specificity) or only present in the group of interest (high specificity) and fidelity measures the extend to which a taxon is present in all (high fidelity) or few (low fidelity) sites within the group of interest. The maximal indicator taxon, having an indicator value of 1, would be found exclusively in one group and would be present at all the sites of this group.
Results
3.1 Communities structure
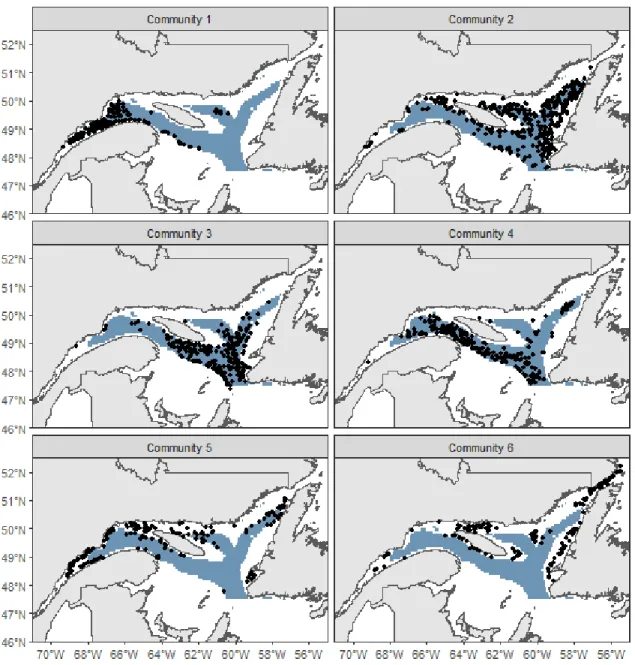
Cluster analysis on the taxa matrix revealed six, partially spatially segregated, community type in the EGSL (Figure 3). The six most dominant taxa of each community in terms of biomass and taxa richness of each community are presented in Table 1. The first community type was found almost exclusively in the St. Lawrence estuary and is composed (biomass and presence) mainly of the anemone Actinostola callosa, the sea urchin Brisaster fragilis, and the sea star Ctenodiscus crispatus. We also found large biomasses of snow crab Chionoecetes opilio and the anemone Actinauge cristata. The average total weight of invertebrates was 2190 kg km-2 and the highest mass captured was 18 905 kg km-2. It is the second most diverse community in terms of the mean number of taxa found at a single site but the least diverse in terms of total number of taxa recorded across all sites.
23
Table 1.Summary statistics for six epibenthic community types identified in the Estuary and Gulf of St. Lawrence. Data includes identification and biomass of the top six dominant taxa and the total and mean number of taxa in each community type.
Community N Total taxa richness
Mean taxa richness per site
Dominant taxa Biomass (kg km -2) 1 155 80 16 Actinostola callosa 1088.04 Brisaster fragilis 415.89 Ctenodiscus crispatus 240.68 Chionoecetes opilio 153.05 Actinauge cristata 116.14 Ophiura sp. 61.60 2 361 103 11 Ctenodiscus crispatus 25.45 Ophiura sp. 10.32 Actinostola callosa 10.15 Brisaster fragilis 8.29 Hippasterias phrygiana 6.35 Chionoecetes opilio 6.34 3 234 92 11 Lithodes maja 45.36 Bolocera tuediae 11.68 Anthoptilum grandiflorum 9.01 Actinostola callosa 6.53 Brisaster fragilis 4.62 Halipteris finmarchica 4.58 4 214 81 13 Pennatula grandis 152.09 Brisaster fragilis 107.13 Anthoptilum grandiflorum 100.42 Bolocera tuediae 73.51 Lithodes maja 34.95 Actinostola callosa 27.62 5 182 97 11 Chionoecetes opilio 312.03 Actinostola callosa 17.64 Ctenodiscus crispatus 16.51 Strongylocentrotus sp. 11.76 Gorgonocephalus sp. 8.81 Ophiura sp. 6.36 6 168 97 17 Gorgonocephalus sp. 133.79 Strongylocentrotus sp. 51.86 Boltenia ovifera 20.37 Hyas coarctatus 8.76 Chionoecetes opilio 7.58 Crossater papposus 4.72
24
The second community type was found in Esquiman and Anticosti channels and on the border of the Laurentian channel in the Gulf of St. Lawrence. It is mainly composed C.
crispatus, brittle stars Ophiura sp. and A. callosa. Top six dominant taxa are very similar
to community 1 type but with different orders of dominance. Also, average benthic biomass captured per station was ca. 87 kg km-2, about 25 times lower than that observed for community 1. It is the most diverse community in terms of total taxa recorded but among the least diverse in terms of the mean number of taxa found at a single site. The third community type was also found in deep waters but mainly near the outlets of the three channels. Dominant taxa vary from community type 1 and 2 with Norway king crab Lithodes maja, the anemone Bolocera tuediae and the sea pen Anthoptilum grandiflorum having the highest biomass. B. tuediae and A. callosa are also dominant taxa present in similar biomass as community 2. Community type 4 was found almost exclusively in Laurentian channel. This community is dominated by high biomass of sea pens Pennatula
grandis and A. grandiflorum. Some sites also contained high biomasses of B. fragilis.
The fifth community is mainly located on the edges of channels. Dominant taxa are similar to community 1 type with C. opilio, A. callosa and C. crispatus being top 3. However, this community also contains high biomass of sea urchins Strongylocentrotus sp. and brittle stars Gorgonocephalus sp. that are considered more coastal taxa. Total taxa richness ranks second (ex æquo with community 6) for this community with 97 different taxa recorded. The sixth community is scattered throughout the EGSL in sites near the coast. It is dominated by high biomass of Gorgonocephalus sp. and Strongylocentrotus sp.. Other dominant taxa are the sea potato Boltenia ovifera, the crab Hyas coarctatus and Crossaster
papposus. All these taxa are considered mainly coastal which suggest that community 6
may represent a coastal community. It also is the most diverse community in terms of mean taxa recorded at each site.
25
Figure 3. Location of the six epibenthic community types in the Estuary and Gulf of St. Lawrence identified by hierarchical cluster analysis with biomass data collected from 2011 to 2018. Deep channels are shown in blue (depth > 200 m).
3.2 Benthic habitats
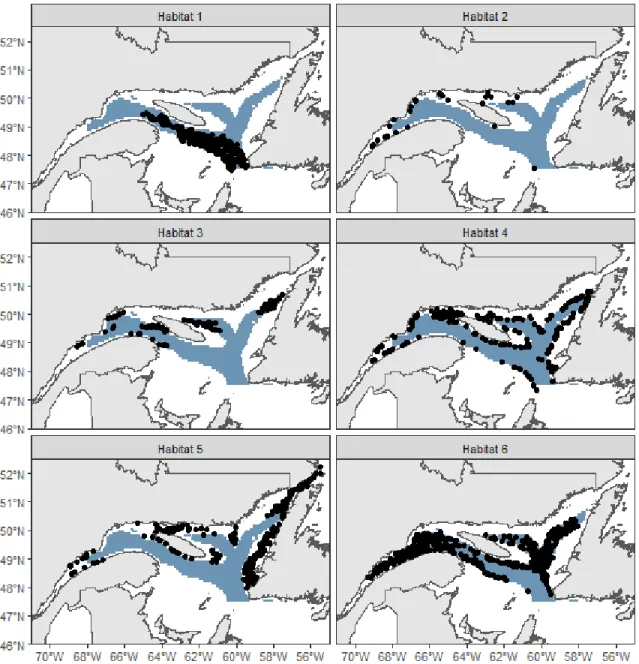
Figure 4 shows the distribution of six habitats characterized by distinct sets of environmental conditions, as detected using k-means cluster analysis. Habitats 1 and 6 are spatially segregated in the deep-water channel of the EGSL. Habitat 1, restricted to the Laurentian Channel, is characterized by low oxygen concentration and warm water. Habitat
26
6 bypasses habitat 1 on its edges in the gulf portion of the EGSL and covers the head of the Laurentian Channel in the estuary and the Anticosti and Esquiman channels in the northern EGSL. Habitat 6 displays quite similar conditions to Habitat 1 but with lower oxygen concentrations and a high aragonite index (Acidification). Habitats 3 is characterized by high levels of fisheries activities especially DNH. Other than fisheries activities, this habitat are characterized by a wide variety of other environmental conditions. Habitat 4 is concentrated along the slopes of the deep-water channels with a various range of temperature, salinity, and oxygen concentrations, but generally is characterized by warm waters and intermediate depths. Habitat 5 is concentrated along the coastline, especially in the Gulf, and is characterized by very well-oxygenated water with a mean depth of 92 m, thus being in either the surface or intermediate cold layers, as confirmed by temperatures below 0 °C in this habitat.
Table 2. Summary of habitats environmental values (mean ± sd).
Habitat 1 Habitat 2 Habitat 3 Habitat 4 Habitat 5 Habitat 6 Temperature (°C) 5.79 ± 0.29 2.61 ± 1.27 5.58 ± 0.67 4.10 ± 1.14 0.95 ± 1.03 5.80 ± 0.51 Oxygen (μmol L-1) 142.4 ± 21.7 204.9 ± 63.8 92.9 ± 18.6 160.5 ± 41.6 300.9 ± 34.7 98.9 ± 26.7 Salinity (PSU) 34.86 ± 0.07 33.05 ± 0.77 34.4 ± 0.26 33.79 ± 0.41 32.37 ± 0.40 34.56 ± 0.20 Depth (m) 395 ± 52 131 ± 50 253 ± 37 177 ± 34 92 ± 26 282 ± 40 Acidification 0.44 ± 0.06 0.49 ± 0.06 0.57 ± 0.04 0.48 ± 0.05 0.39 ± 0.07 0.59 ± 0.05 DD 20 ± 56 221 ± 756 3273 ± 1299 93 ± 251 35 ± 177 170 ± 265 DNH 5 ± 72 2262 ± 206 23 ± 117 70 ± 192 61 ± 178 3 ± 25 posAnom 3.67 ± 0.48 1.58 ± 0.42 2.27 ± 0.46 1.64 ± 0.40 0.88 ± 0.53 2.47 ± 0.53