•••
National Library 01 CanadaBibliothèque nationale du Canada
Acquisitions and Direction des acquisitions et Blbliographic Services BreJlch des services blbliograpl'Iques 395 Wellington Stree1 :ms.IlleWellington
Ottawa,0111illlO ü!l;Jwa(OnlélfIO)
K1AüN4 K1AON4
NOTICE
l',/II,I,_ N"II""'."""I',·,. AVIS
The quality of this microform is heavily dependent upon the quality of the original thesis submitted for microfilming. Every effort has been made to ensure the highest quality of reproduction possible.
If pages are missing, contact the university which granted the degree.
Some pages may have indistinct print especially if the original pages were typed with a poor typewriter ribbon or if the university sent us an inferior photocopy.
Reproduction in full or in part of this microform is governed by the Canadian Copyright Act, R.S.C. 1970, c. C-30, and subsequent amendments.
Omada
La qualité de cette microforme dépend grandement de la qualité
de la thèse soumise au
microfilmage. Nous avons tout fait pour assurer une qualité supérieure de reproduction.
S'il manque des pages, veuillez communiquer avec l'université qui a conféré le grade.
La qualité d'impression de certaines pages peut laisser
à
désirer, surtout si les pagesoriginales ont été
dactylographiées
à
l'aide d'un ruban usé ou si l'université nous a fait parvenir une photocopie de qualité inférieure.La reproduction, même partielle, de cette microforme est soumise
à
la Loi canadienne sur le droit d'auteur, SRC 1970, c. C-30, et ses amendements subséquents.•
•
•
ETUDES MICROSCOPIQUES D'HÉLICOÏDES DE SYSTÉMES CELLULOSIQUES IN VITRO
par Julie Glasson
Thèse présentée à la faculté d'études s11périeures et de recherche dans le cadre de l'obtention du
diplôme de docteur en philosophie
Département de chimie Unlversltè McGill Montréal, Quèbec, Canada
Mai 1995
1+1
National Library ot CanadaBibliothèque nationale du Canada
Acquisitions and Direction des acquisitions et Bibliographie SelVices Branch des selVices bibliographiques
395 Wellington Street Ottawa. Ontario K1A ON4 395.rueWellington Ottawa (Ontario) K1AON4
The author has granted an irrevocable non-exclusive licence allowing the National Library of Canada to reproduce, loan, distribute or sell copies of his/her thesis by any means and in any form or format, making this thesis available to interested persons.
The author retains ownership of the copyright in his/her thesis. Neither the thesis nor substantial extracts from it may be printed or otherwise reproduced without his/her permission.
L'auteur a accordé une licence irrévocable et non exclusive permettant
à
la Bibliothèquenationale du Canada de
reproduire, prêter, distribuer ou vendre des copies de sa thèse de quelque manière et sous quelque forme que ce soit pour mettre des exemplaires de cette thèse
à
la disposition des personnes intéressées.L'auteur conserve la propriété du droit d'auteur qui protège sa thèse. Ni la thèse ni des extraits substantiels de celle-ci ne doivent être imprimés ou autrement reproduits sans son autorisation.
ISBN 0-612-08104-4
•
•
•
À
mon père
- Cette coquaLe. dis-je en montrant l'objet de mon triomphe.
- Mais c'est toui simplement une olive porphyre, genre olive, ordre des pecttnibranches, classe des gastéropodes, embranchement des mollusques..
- Ou~ Conseü, mais au lieu d'ètre enrou.lée de drotteàgauche, cette oli'Je tourne de
gauche à droite!
- Est-üpossible!s'écria Consei!.
- Ou~ mon garçon. c'est une coquille sénestre!
- Unecoquillesénestre!répétait Conseil. le coeur palpitant.
- Regarde la spire!
- Ah! monsieur peut m'en croire. dit Conseli en prenant la précieuse coquille d'une
main tremblante. maisJen'atJamais éprouvé une émotion pareille! •
Et il Y aValt de quoi être ému! On salt. comme l'on falt observer les naturalistes. que la dextrosité est une loi de la nature, Les astres et leurs satellites. dans leur
mouvement de translation et de rotation. se meuvent de droite à gauche. L'homme se sert
plus souvent de sa main droite que de sa maln gauche. et. consêquemment. ses Instruments et appareils. escaliers. serrures. ressorts de montres. etc" sont combinés de
maniêre à être employês de droite àgauche. Or. la nature a généralement suivi cette101
pour l'enroulement de ses coqullles. Elles sont toutes dextres. à de rares exc:eptlons. et
quand. par hasard leur spire est sénestre. les amateurs les palent au poids de l'or.
Dialogue entre le professeur Pierre Aronnax et Conseli.
Vjngtmjl!elieuessousles mers.Jules Verne (1869)
•
•
•
RÉsUMÉ
La microscopie électronique à transmission (MET) et la microscopie à effet de force atomique (AFM) ont été utilisées pour mettre en évidence les textures nématiques chirales de différents systèmes cellulosiques anisotropes. À l'aide de ces techniques microscopiques. l'examen de coupes de films de cellulose. de cellulose d'éthyle (CEl. de cellulose d'éthyle et de méthyle (CEMl. de cellulose d'acétate (CA) ainsi que de cellulose de 6-0-trityle et de 2.3-0-hexyle (C(Tr)(He)) 1 révèle l'existence. dans ces films. de périodicités caractéristiques des arrangements nématlques chiraux. Ces périodicités sont liées au pas hélicoïdaux de telles organisations. L'observation de défauts de structures distinctifs dans la texture des films nématiques est rapportée. Ces défauts peuvent être associés à
une texture polygonale focale conique.
L'irradiation aux rayons-y de mêsophases de cellulose d'hydroxyle et de propyle (CHP) dans l'eau ou le méthanol. a conduit à la formation de gels nématiques chiraux. Le degré de réticulation des ces gels. ainsi que celui de films nématiques chiraux de CHP. a été évalué par extractions solide/liquide. La préservation de l'arrangement nématlque chiral. dans les mésophases réticulées. a été confirmée par microscopie optique. MET et AFM.
Des suspensions hélicoïdales de microfibrilles cellulosiques ont été obtenues par hydrolyse acide de différents types de pâtes de bolr.. Durant la formation de films solides par séchage de ces suspenslorls aqueuses. l'arrangement nématique chiral des mlcrofibrilles est maintenu. produisant ainsi des hélicoïdes in vitro. Les rudiments de l'analyse morphologique des films nématiques chiraux de mlcrofibrl1\es cellulosiques sont donnés dans cette thése.
L'origine des contrastes observés en MET pour les coupes de différents matériaux cellulosiques nématiques chiraux est discutée. Des techniques de préparation originales d'échantillons pour la microscopie sont également présentées.
•
•
•
ABsTRACT
The chiral nematic texture of a number of anisotropie cellulosic systems is revealed with the help of transmission electron microscopy (TEM) and atomic force microscopy (AFM). TEM and AFM examinptjon of sections of cellulose films, ethyl cellulose (EC) films, ethyl methyl cellulose (EMC) films, cellulose acetate (CA) films and (6-0-trityl 2,3-O-hexy1l cellulose (C(Tr)(He)) 1 films showed periodicities which are characteristic of chiral nematie arrangements. Those periodicities are related to the helicoidal pitch of such organisations. Furthermore, specifie structural defects were observed in sections of the chiral nematic films. These defects are associated with a parabollc focal conie texture.
Chiral nematic gels were produced by y-ray irradiation of (hydroxypropyl)cellulose (HPC) mesophases in water or methanol. Solid/liquid extraction performed on irradiated HPC films and mesophases allow us to evaluate their respective degrees of crossllnking. Optical microscopy, TEM and AFM results showed that a chiral nematic order is preserved in the crossllnked mesophases.
Helicoidal suspensions of cellulosic microfibrils were prepared by acidic hydrolysis of wood pulp. Solid films, dried from these microfibril suspensions, show that the chiral nematic arrangement of the cellulosic microfibrils can be maintained in a solid material. Basic morphological data on chiral nematic films made from cellulosic microfibrils are given in this thesis.
The origin of the strong contrast observed in TEM images of
s~ctions of chiral nematic cellulosic materials is discussed. We also introduce novel sam pie preparation techniques for microscopie observation.
•
•
•
REMERCIEMENTS
Je souhaite exprimer toute ma gratitude aux docteurs Derek G. Gray & Jean-François Revol pour leur intérét et leur implication dans ce projet de recherche. Ils ont manifesté un enthousiasme et une patience hors du commun; je crois ne pouvoir jamais les en remercier assez.
Je désire également remercier:
- Glynis de Silveira & Claude Tremblay, pour leur contribution à
une partie du travail de microscopie optique.
- Guy Cormier & Christian Lauzler, pour les nombreuses discussions, leurs encouragements indispensables et une amitié à
toute épreuve.
- M. Jean St-Pierre pour l'utilisation du réacteur nucléaire de l'École Polytechnique de l'Université de Montréal.
- Le .Third Floor Tea Club-, pour les échanges agréables et fructueux qui y ont eu lieu.
- Le Centre Canadien de Recherches en Pâtes & Papiers et l'Université Mc Gill pour m'avoir permis d'évoluer, au cours de toutes ces années, dans un environnement scientifique de qual1té.
- Le Conseil de recherche en sciences naturelles & e':1 génie (CRSNG) pour une bourse d'études post-graduées (1987-1989). - L'Institut canadien de recherches en pâtes & papiers pour le
-François St-Germain Merit Award- (1990-1991).
- Le Fonds pour la formation des chercheurs et l'aide à la recherche (FCAR) pour une bourse d'études de cycle supérieur
(1991-1992).
- Mon employeur actuel, Cascades Inc.. pour l'aide apportée dans la préparation de ma défense de thèse.
Je tiens tout particulièrement à remercier mes parents, pour leur amour et support Inconditionnels.
Finalement, merci aux deux hommes de ma vie, mon époux et mon fils, Steeve et Vincent. Ils ont sans cesse manifesté leur compréhension et leur amour, tout au long du parcours parfois laborieux que fut celui-ci.
•
•
•
TABLE DES MATIÈRES
Résumé III
Abstract. 1V RcmerciCJI1ents V
Table des matiéres VI Liste des tables X
Liste des figures XI
CHAPITRE 1- INTRODUCTION
1.l Arrange.nent structural hiérarchique des biomatêriaux 2 1.1.1 Matériaux composites 2 1.1.2 Structures hélicoïdales dans la nature 4
1.1.3 Matériaux cellulosiques et arrangements
hélicoïdaux. 9
1.2Cristauxliquides 10
1.2.1 Notions debase 1 1
1.2.2 Textures des cristaux liquides nématiques
chiraux. 16
1.2.3 Cristaux liquides nématiques chiraux à base de
dérivés cellulosiques 19
1.3Butdutravail 24
CHAPITRE 2- TECHNIQUES MICROSCOPIQUES
2.1J:ntoduction. 29
2.2 Microscopie électronique Il transmission 3 1
2.2.1 Le microscope électronique à transmlssion 31
2.2.2 Modes d·imagerie 34
2.2.3 Traitement géométrique du contraste de phase 37
2.2.4 Traitement théorique du contraste de phase 41
2.3 Microscopie Il effet de force atomique .48
2.3.1 Les microscopies à sonde locale: principes de VI
•
2.3.2fonctionnement du microscope à effet tunneL 48 Le microscope à effet de force atomlque 51
3.2.5 3.2.6 3.2.7
•
•
CHAPITRE 3- TEXTURES NÉMATIQUES CHl:tALES DE FILMS
CELLULOSIQUES MISES EN ÉVIDENCE PAR
MICROSCOPIE ÉLECTRONIQUE
A
TRANSMISSIONET MICROSCOPIE À EFFET DE FORCE ATOMIQUE
3.1IntroductIon , 6 3
3.2Partieexpérimentale. 65
3.2.1 Préparation de solutions diluées 6 5 3.2.2 Formation de mésophases nématiques ehlrales 66 3.2.3 Préparation de films cellulosiques 67 3.2.4 Préparation des spécimens pour la microscopie
électronique à transmlssion 69 Diffraction électronique 72 Diffraction des rayons-X 7 2 Préparation des spécimens pour la microscopie à
effet de force atomique 72
3.3Résultats&discusslon. 73
3.3.1 Système cellulose d'éthyle. cellulose d'éthyle et
de méthyle et chloroforme 73 3.3.2 Système cellulose d'acétate. cellulose de
triacétate et acide trifluoroacétique 77 3.3.3 Systéme (cellulose de 6-0-trityle et de 2.3-0
hexyle)l et chloroforme 91 3.3.4 Systéme de cellulose regénérée et cellulose
prédpitée 109
CHAPITRE 4- CARACTÉRISATION DE FILMS ET MtsOPHASES
RÉTICULÉS DE CELLULOSE D'HYDROXYLE ET DE PROPYLE
4.1Introductlon. 1 1 9
4.2PartieexpéIhnentale 122
•
4.2.1 4.2.2 4.2.3 4.2.4 1.2.5 4.2.6 4.2.7 4.2.8 5.2.2 5.2.3 5.2.4 5.2.5•
•
Formation des solutions anisotropes de cellulose
d'hydroxyle et de propyle 122 Formation de films nématiques chiraux de
cellulose d'hydroxyle et de propyle 123 Irradiation des échantillons 123 Extractions solide··liquide 124
Préparation des spécimens pour la microscopie
optique 125 Préparation des spécimens pour la microscopie
électronique à transmission 125 Préparation des spécimens pour la microscopie à
effet de force atomique 125 Préparation des spécimens pour les mesures de
dichroïsme circulaire 126
4.3Résultats& discusslon. 126 4.3.1 Observation microscopique de mésophases et
films réticulés de cellulose d'hydroxyle et de
propyle 126 4.3.2 Degré de réticulation: extractions solide/liquide 136
CHAPITRE
5-
ARRANGEMENT HÉucoÏDAL DANS DES FILMS DE FRAGMENTS DE CELLULOSE5.1Introduction 144
5.2Partieexpêrhllentale 147
5.2.1 Préparation des suspensions de microflbri\les de
cellulose 147 Préparation des spécimens pour la microscopie
optique 148 Préparation des spécimens pour la microscopie
électronique à transmission 149 Diffraction électronique 149 Diffraction des rayons-X 149
5.3Résultats& discusslon. 149
•
5.3.1 5.3.2Observation microscopique des suspensions de
microfibrilles de cellulose 149 Observation microscopique de films formés à
partir d":ij suspensions de microfibrilles de
cellulose 154
CHAPITRE
6
•
•
CONCLUSIONS, PERSPECTIVES &
REVENDICATION D'ORIGINALITÉ
6.1 Conclusions & perspectives 173
6.2 Revendications d'orlginaJ!té 177
•
•
•
LISTE DES TABLES
Table 1.1. Exemples d'ultrastructures biologiques hélicoïdales
illustrant les différentes combinaisons fibres (mlcroflbrl\le: i /
matrices 4
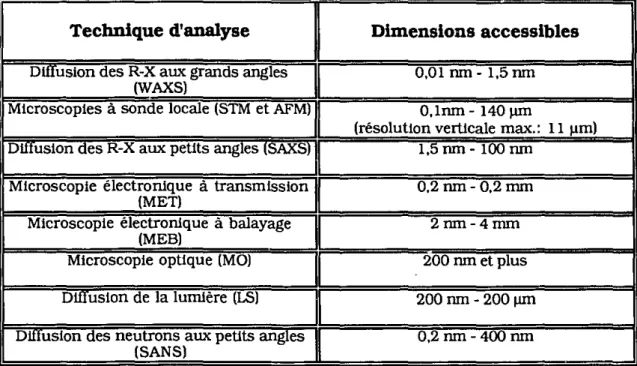
Table 2.1- Échelles des dimensions accessibles par différentes
techniques d'analyse morphologique 30
Table 4.1- Fraction de gel des films de CHP Irradiés 137
•
•
•
LISTE DES FIGURES
Figure 1.1.. lIIustration schématique du principe de la structure hélicoïdale. L'axe nématique chiral est représenté par l'axe z et le plan nématique chiral est selon la direction de l'axe y. la) Section oblique dans l'empilement des couches hélicoïdales. Une rotation progressive des microfibril\es de 1800
génére un arceau plus ou moins prononcé. selon l'angle de la coupe. Ici. l'angle de coupe est près de la direction horizontale. lb) Sections obliques symétriques illustrant l'inversion de la
courbure des arceaux 5 Figure 1.2. Coupe trallsverse d'une trachéïde d'épinette noire.
ML: lamelle médiane, SI: parois secondaire externe. S2: paroi secondaire principale. i...a zone de transition hélicoïdale entre SI et S2 est clairement visible et identifiée
lélectromicrographie de Jean-François Revol) 8 Figure 1.3. Molécules-bâtonnets en phase la) nématique. (b)
smectique A et (e) smectique C 13
Figure 1.4. Molécules-bâtonnets en phase nématique chirale. Une illustration simplifiée de l'arrangement est donnée dans la représentation de droite. où les macromolécules sont illustrées sous forme de -clou'!.. La pointe du clou symbolise l'extrémité de la molécule-bâtonnet pointant hors du plan de l'illustration.
Dans ce cas-ci. la structure a une hélicité droite 15 Figure 1.5. lal Illustration des principaux défauts de la texture
nématique chirale polygonale focale conique. 1- dislocation vis. Il- dislocation coin. IIl- disinclinaison +1t. IV- disinclinaison -1t
et V- lignes focales. (b) Processus de formation d'une dislocation coin selon le processus Volterra. Après séparation des plans par une section perpendiculaire imaginaire (surface hachurée). le déplacement mutuel de chaque partie des plans permet la reconstruction de nouveaux feuillets (d'après Y.
•
•
•
Boullgand. dans Geometry and topology oj dejects in liquid crystals. l'hysique des déjauts. Les Houches 1980. Session
XXXV. North Bolland. 665-711 (1981)) 17 Figure 1.6. Exemple de. fonnation des champs polygonaux. (a) À
la formation d'une ligne focale. l'emboîtement de 3 couches nématiques chirales superposées et. dans une section plane, la distribution des axes nématlques chiraux correspondants. (b) 1-superpositon de 2 couches nématlques chirales dans le champ polygonal, Il- double évasement d'une couche Isolée et II1-projection horizontale des points focaux du champ polygonal
(d'aprés Y. Bouligand. J.Phys.• 33. 715-736 (1972)) 20 FI.gure 1.7. Deux unités de base de la molécule de cellulose; un
homopolymére d'unités D-glucopyranose liées en ~ aux
posi tions 1 et 4 2 1 Figure 1.8. Arrangement polygonal focal conique dans un film
nématlque chiral de cellulose d'hydroxyle et de propyle. Micrographie optique du film entre polariseurs croisés et avec
un lame quart d'onde. Grossissement 450
x.
23 Figure 2.1. Représentations schématiques (a) d'un microscopeélectronique et (b) d'un microscope optique 33 Figure 2.2. Formation par la lentille-objectif des clichés de
diffraction (a) en champ clair et (h) en champ sombre centré;
e
est l'angle de Bragg (d'aprés J.W. Eddington, Practico1 Elect. Microscopy in Material Science, Van Nostrand. Reinhold Cie(1976)) 36
Figure 2.3. Représentation schématique de la formation de différence de phase par l'aberration de sphéricité et la mise hors focus de la lentiHe-objecttf. Les transformations correspondantes de la fonction d'onde électronique incidente
sont données 3 9
•
•
•
Figure 2.4. Variation de sin X(Uj en fonction de u pour Cs = 2.8 mm. Vo = 120kV et (a) M = 125 nm. la focalisation de Scherzer. (b) LU
=
0 . (c) LU=
2500 nm. (d) LU=
-2500 nm. (e)LU = 55000 nm et (0 LU = 70000 nm .46 Figure 2.5. Représentation schématique du microscope à effet
tunnel(SIM) 50
Figure 2.6. Représentation schématique du microscope à effet
de force atomique
lAFMl
53 Figure 2.7. Stylet de nitrure de silicium utilisé pour la lecturedes échantillons en AFM. Micrographie obtenue par microscopie électronique à balayage (micrographie de Glynis de Silveira) 55
Figure 3.1. Préparation des échantillons pour la microscopie
électronique à transmission (sections minces) 70 Figure 3.2. Micrographie électronique obtenue par MET d'une
section d'un film de cellulose d'éthyle. Des dlslncllnaisons de types +1t et - 1t sont visibles dans différentes zones de la
micrographie 75 Figure 3.3. Micrographie électronique obtenue par MET d'une
section d'un film de cellulose d'éthyle et de méthyle 76 Figure 3.4. Micrographie électronique obtenue par MET d'une
section d'un film de cellulose de triacétate. L'angle de la section est principalement parallèle à l'orientation des axes de l'arrangement parabolique focal conique du film nématlque chiral. Plusieurs lignes focales sont visibles. La zone délimitée par un rectangle correspond à une partie du film où la direction des axes hélicoïdaux change sur une très courte distance. Comme l'orientation de la coupe devient plus oblique
•
•
•
par rapport aux axes nématlques chiraux. la périodicité de
l'arrangement augmente 7 8
Figure 3.5. l1lustratlon de la technique de préparation des
coupes transverses 80
Figure 3.6. Micrographie électronique obtenue par MET d'une section d'un film de cellulose de triacétate. L'angle de la section est principalement perpendiculaire à l'orientation des axes de l'arrangement polygonal focal conique du film
nématiquechiral 81
Figure 3.7. Schéma du plan de coupe d'une section faite selon une direction (a) parallèle à l'axe de l'arrangement polygonal focal conique et (b) perpendiculaire à l'axe de l'arrangement
polygonal focal conique 83
Figure 3.8. a) Diagramme du mécanisme créant un artéfact de mlcrotomie dans une structure hélicoïdale. En coupant les éléments-bâtonnets ou en passant entre eux. le couteau crée des marches. Celles-ci ne sont pas nécessairement en phase d'une face à l'autre de la section. b) Section d'une organisation hélicoïdale après microtomie. L'observation de la section par transmission permet de voir une alternance de bandes claires et sombres. (D'aprës Y. Bouligand & M.-M. Giraud-Guille. dans Bwlogy of
Invertabrate and Lower Vertebrate Callagen. A. Barrat! & R Caronne Ed ..
Plenum Press. SeriesA. Llfe Sciences. V.93 (1985) p.1221 86
Figure 3.9. Micrographie électronique obtenue par MET de la réplique d'une section d'un film de cellulose de triacétate. L'angle de la section est principalement parallèle à
l'orientation des axes de l'arrangement polygonal focal conique du film nématique chiral. Les flèches Indiquent la direction
selon laquelle l'ombrage a été effectué 87
•
•
•
Figure 3.10. Micrographies obtenues par AFM d'une section
d'un film de cellulose de triacétate. La section est recouverte d'un film tungsten / tantale. (a) Représentation tridimensionnelle d'un défaut de texture. (h) Représentation en mode 'section» de la surface de la coupe. (Micrographies de K.
FJoller, DigitalIn.st:nnnents) ,.. , 89
Figure 3.11. Micrographie électronique obtenue par MET d'une
section d'un film isotrope de cellulose d'acétate 90
Figure 3.12. Exemple schématique de deux unités de base de la
molécule de (cellulose de 6-0-trltyle et de 2,3-0-hexyle)1. La
(C(Tr)(He))l est constituée de plusieurs unités glucosldlques liées en ~ aux positions J et 4. Dans le cas particulier de cette représentation, la (C(Tr)(Hell 1 possède un degré de substitution trityle de 1 (0.5.= 1) et un degré de substitution
hexyle de 2 (D.S.= 2) 92
Figure 3.13. Micrographie électronique obtenue par MET d'une
section d'un film de (C(Tr)(Helll formé à partir d'une
mésophase dans le chloroforme (temps de relaxation nul) 93
Figure 3.14. Micrographie optique d'un film de (C(Tr)(Hell 1
formé à partir d'une mésophase dans le chloroforme; séchage immédiat du film. Le film montre une texture de bandes. Micrographie obtenue avec polariseurs croisés et lame quart
d'onde. Grossissement 450 X 95
Figure 3.15. Détail de la partie centre-droit de la figure 3.13 97
Figure 3.16. Micrographie optique d'un film de (C(Tr)(Hell 1
formé à partir d'une mésophase dans le chloroforme (temps de relaxation du film: 48 heures). Le film montre une texture polygonale focale conique, Micrographie obtenue avec polariseurs croisés et lame de quart d'onde.
Grossissement 450 X 98
•
•
•
Figure 3.17. Micrographie électronique obtenue par MET d'une section d'un film de (C(Tr)(He)) 1 formé à partir d'une solution
diluée dans le chloroforme (temps de relaxation nul) 100 Figure 3.18. Micrographie électronique obtenue par MET d'une
section d'un film de (C(Tr)(He)) 1 formé à partir d'une solution diluée dans le chloroforme (temps de relaxation du film: 10
minutes) 101 Figure 3.19. Micrographie électronique obtenue par MET d'une
section d'un film de (C(Tr)(He)) 1 formé à partir d'une solution diluée dans le chloroforme (temps de relaxation du film: 24 heures). Les régions identifiées par les lettres A et B sont des zones représentatives de la différence d'organisation des axes
de l'arrangement polygonal focal conique de la texture du film ... 103 Figures 3.20. Micrographies obtenues par AFM d'une section
d'un film de (C(Tr)(He)) 1 séché sans relaxation. Des représentations tridimensionnelles d'une zone du film sont données en (a), où l'on voit l'interface du mm cellulosique avec la résine d'inclusion. (b) et (c). Le facteur de grossissement est
différent pour chacune des micrographies lOS Figure 3.21. Patron de diffraction des rayons-X d'un film de
(C(Tr)(He)) 1 formé à partir d'une mésophase: séchage immédiat. (a) Film fIxé à plat sur le collimateur. (h) Tranche du
film fIXée sur le collimateur 106 Figure 3.22. Rpprésentation de l'irradiation par rayons-X d'un
échantillon (a) à plat sur le collimateur (position perpendiculaire aux rayons incidents) et (b) sur la tranche (position parallèle aux rayons incidents). En (c). la direction incidente des rayons-X par rapport à la surface du collimateur
est montrée 108
•
•
•
Figure 3.23. Patron de diffraction des rayons-X d'un film de (C(Tr)(He)) 1 formé à partir d'une solution diluée. Temps de relaxation du film: 24 heu•.:s. (a) Film fixé à plat sur le
collimateur. (b) Tranche du film fixée sur le collimateur l1 0 Figure 3.24. Patron de diffraction électronique d'une section
d'un film de (C(Tr)(He)) 1 formé à partir d'une solution diluée.
Temps de relaxation du film: 10 minutes 111 Figure 3.25. Micrographie électronique obtenue par MET d'une
section d'un mm de cellulose. Le film de cellulose est obtenu par regénération à partir d'un film nématique chiral d'acétate
de cellulose 113 Figure 3.26. Micrographie électronique obtenue par MET d'une
section d'un film de cellulose. Le film de cellulose est obtenu par précipitation lente à partir d'une solution diluée de
cellulose dans un solvant. 114 Figure 4.1. Exemple schématique de deux unités de base de la
molécule de cellulose d'hydoxyle et de propyle (CHP). La CHP est constituée de plusieurs milliers d'unités glucosidiques liées en
p
aux positions 1 et 4. Dans le cas particulier de cette représentation. la CHP possède un degré de substitution de 2(D.S.= 2) et une substitution molaire de 4 (M.S.= 4) 120 Figure 4.2. Spectre de dichroïsme circulaire produit par une
mésophase aqueuse de CHP irradiée. La dose de rayons-y reçue par la mésophase est de 13.8 MRad. Le maximum d'ellipticité est enregistré à une longueur d'onde de 330 nm: valeur qui correspond au demi pas nématique chiral (p/2) de
l'arrangement anisotrope 128 Figure 4.3. Micrographies optiques d'un film de CHP réticulé
par exposition aux rayons-y (a) directement après irradiation. (b) après gonflement dans l'eau et le) après séchage complet
•
•
•
sur une lamelle de verre. Le film. formé à partir d'une
mésophase de CHP. est placé entre polariseurs croisés 130 Figure 4.4. Micrographie électronique d'une mésophase
réticulée de CHP dans l'eau. L'épaisseur de la section est de
300 nm. Dosede rayons-y de 5.7 MRad 13 1 Figure 4.5. Micrographie électronique d'une mésophase
réticulée de CHP dans l'eau. L'épaisseur de la section est de 70 nm, La flèche indique une zone où seulement les lignes à fortes densité de matériel ont résist,; au gonflement/séchage de la
section mince 133 Figure 4.6. (a) Micrographie électronique d'une mésophase
réticulée de CHP dans l'eau. La périodicité de l'arrangement nématique chiral est - 700nm. L'épaisseur de la section est de 350 nm. Quelques défauts de structure sont identifiés à l'aide de flèches. (b) Micrographie. obtenue par ·.~.icroscopie à effet de force atomique (AFM). de la surface du bloc dans lequel est incluse la mésophase. L'aire balayée par AFM correspond à la
surface du blocexposée au microtome 135 Figure 4.7. (:.) Variation de la fraction de gel des films irradiés
en fonction de la dose de rayons-y reçus par ces films et (b)
courbe de Charlesby-Pinnercorrespondante 139 Figure 5.1. Micrographie optique d'une suspension aqueuse de
microfibrilles de cellulose. Le plus petit rayon de courbure des tactoïdes est de 70 à 80 Ilm. L'espacement entre les bandes des tactoïdes est - 15 Ilm. La micrographie est obtenue à l'aide
depolariseurscroisés 151
Figure 5.2. Micrographie optique de la phase anisotrope d'une suspension aqueuse de microfibrilles de cellulose. Environ 48 heures se sont écoulées entre le moment où la suspension présente l'aspect de la figure 5.2 et celui de la figure 5.1. Ici. la
•
•
•
texture nématique chirale de la suspension est clairement visible grâce à l'apparence des patrons de type .empreinte digltale. ayant un espacement de -15 ~m. La micrographie est
obtenueà l'aide de poiartseurs croisés 153 Figure 5.3. Micrographie électronique obtenue par MET d'une
section mince (-70 nm) d'un film de microflb.illes cellulosiques formé sur une surface de polyéthylène à partir de la phase ani5otrope d'une suspension aqueuse de microfibrilles. Ce domaine très homogène du film prèsente un patron arqué caractéristique d'une organisation hélicoïdal. La périodicité
obseIvé. p/2. est -0.800~ 155 Figure 5.4. Micrographie électronique obtenue par MET d'une
section mince (-70 nm) d'un film de microflbrilles cellulosiques. La zone de rencontre de deux domaines adjacents de la texture nématique chirale du film de
microfibrilles est identifiée par une fléche 156 Figure 5.5. Micrographie électronique obtenue par MET d'une
section mince (-70 nm) d'un film de microflbrilles cellulosiques formé sur une surface de téflon™ à partir de la phase anisotrope d'une suspension aqueuse de microfibrilles.
La périodicité. p/2 est -0.350 ~m. Les striations verticales sont dues â la présence d'imperfections sur la lame du couteau de diamant utilisé pour la microtomie. Les flèches indiquent des défauts de structure tandis que la zone délimitée par l'encadré correspond à la surface du film balayée par AFM (voir figure
5.6) 158
Figure 5.6. (a) et (b) Micrographies obtenue par AFM d'une section épaisse (250 nm) du film de microfibrilles présentés à
lé' figure5.5 161
Figure 5.7. Patrons de diffraction des rayons-X d'un film de microfibrilles de cellulose formé à partir de la phase
•
•
•
anisotrope d'une suspension aqueuse de mlcrofibrilles. (a) Film fixé à plat sur le col1lmateur et (b) tranche du film fixé sur le
colllinateur. Leplan du film est vertical 162
Figure 5.8. Patron de diffraction électronique d'une zone de 0.5
~m de diamètre d'une section d'un film de microfibrilles de cellulose formé à partir de la phase anisotrope d'une suspension aqueuse de mlcrofibrilles de microfibrilles. L'axe
nématique chiral est horizontal 163
Figure 5.9. Micrographie électroni4ue obtenue par MET d'une section mince (-70 nm) d'un film de microfibrilles cellulosiques formé sur une surface de téflon™ à partir de la phase anisotrope d'une suspension aqueuse de microfibrilles.
Agrandissement d'un défaut de structure (voir figure 5.5) 165
Figure 5.10. Micrographie électronique obtenue par MET d'une section mince (-70 nm) d'un film de mic~'ùfibrilles
cellulosiques formé sur une surface de téflon™ à partir de la phase anisotrope d'une suspension aqueuse de microfibrilles. Agrandissement d'un défaut de type disinclinaison (voir figure
5.5) 166
Figure 5.11. Micrographies électroniques d'une coupe d'un film de microfibrilles cellulosiques séché sur téflonTM. Afin de
parvenir à identifier le sens d'hélicité dans la coupe. celle-ci est inclinée de (a) +420 (coin gauche supérieur de la
micrographie ramené vers le haut) et (b) -320
(coin droit
inférieur de la micrographie ramené vers le haut) 169
Figure 5.12. (a) et (b) l1lustration schématique de l'Inversion du patron arcqué de la texture hélicoïdale par inclinaisons
opposées de la section 170
•
•
•
Chapitre 1
Introduction
-1-•
•
•
1.1 Arrangement structural hiérarchique des
biomatériaux
Nous vivons présentement une époque charnière. Charnière puisque nous assistons à la transition entre deux mondes. L'épopée technologique de l'humanité débute avec la conquète des métaux. À
travers les différents âges. que ce soit celui du fer. du bronze en allant jusqu'à ceux de l'acier et de l'aluminium. toute une Infra-structure technologique s'est développée autour de la maîtrise et de l'utilisation de ces matériaux. Au fur et à mesure que de nouvelles applications apparaissent et que de nouvelles contraintes s'Imposent. ce qui constituait l'élément de fcrce des matériaux métalliques devient aujourd'hui leur principal handicap. La rigidité même des «réseaux atomiques cristallins. inhibe l'adaptabilité des métaux. En effet. en plus de posséder une masse spécifique considérablement élevée. les métaux font preuve de propriétés mécaniques relativement faibles. De plus. dans certains domaines d'application. leur conductibilité les élimine d'office. Plusieurs exemples peuvent justifier la tendance actuelle de recourir à des matériaux d'une nouvelle nature. Bien qu'initialement réservés aux domaines de hautes technologies (aéronautique. aérospatial. télécommunications. etc). ces nouveaux matériaux. qui sont en fait des composites. se retrouvent maintenant dans des objets de consommation courante. Les équipements sportifs et les prothèses font grand usage de matériaux composites.
1.1.1 Matériaux composites
Les nouveaux matériaux à haute performance sont généralement des matériaux dits 'composites.. Le terme composite implique que ces matériaux sont de composition hétérogène Le. qu'ils constituent un agencement complexe d'éléments distincts. De plus. cet arrangement est dit hiérarchique. Il n'est en fait qu'un pâle reflet des arrangements observés chez certains composites d'origine biologique. animale ou végétale.
La nature. de par la grande complexité de ses systèmes. s'est vu confrontée à la nécessité de diversifier et d'optimiser chacun de ceux-cl. Trois grandes règles peuvent être données. qui définissent la
-2-•
•
•
nature des composites biologiques aussi nommés .complcx assemblies" ou assemblages complexes. La première règle stipule que:
....the structure Is organized ln dlscrete levels or scales. Usually each level conslsls of flbrils lhal are lhemselves composcd of smallcr mlcroflbrils 'lnd nanoflbrlls. The flbrils are arranged ln layered structures that reOect lhe specifie functlonal requlrements of lhe overal1 system. The minimum number of dlscrele levels or sc ales observed thus far ln blocomposltes Is four. That Is, vlrlually ail blocomposltes systems are found to have distinct struclural levels al the molecular, nanoscoplc, microscopie and macroscoplc scales.• 1
Un exemple classique d'une telle construction est le tendon2 . La
structure hiérarchique de ce dernier, qui relie muscle et os, possède six niveaux. Les macromolécules à hélices triples de tropocollagène se regroupent pour former des structures mlcroflbrillalres de plus en plus complexes aux niveaux nanoscoplque et macroscopique. Les fibrilles se regroupent ensuite pour former l'unité de base ou faisceau tendineux constituant le tendon. Une structure de bande régulière (64 nm d'espacement) apparalt à la surface des flbrl1les tandis que la morphologie typique des fibres de collagène peut être observée par microscopie optique à la surface des faisceaux tendineux. Le tendon est finalement formé par le regroupement de deux ou trois de ces faisceaux.
Les deux autres règles régissant les assemblages complexes sont les suivantes:
.The second rule says that the levels are held together by specifie interactions between components. ConSiderable evldence Indlcates that strong surface-to-surface Interactions occur, caused by Intermolecular covalent bonds at specifie active sites and by van der Waals forces for specifie arrangements of Inorgaruc crystals at the
nanoscale. (...l Whatever the nature of the bondlng between levels,
adequate adheslon Is requlred to glve the system structural Integnty. The thlrd rule says that these hlghly Interactlng flbers and layers are organtzed Into an orlented hlerarchlcal composite system that Is deslgned to meet a complex spectrum of functlonal requlrements. Nature makes very dlfferent systems out of stmllar macromolecular constltuents by the process of dlfferentlatlon dUring development.
Furthermore, as composite systems Increase lncomplexity, they are
capable of functloning at hlgher levels of performance. The so-called Intelligent materlals and adaptlve composite systems result from thls type of complex architectural ar rangement. A hlerarchlcal blocomposlte Is more thanjust a matem out of whlch larger ob(ects
can be bulli. Rather, It Is a complete structural sy!'temlnItself.•
-3-•
•
1.1.2- Matériauz: cellulosiques et arrangements héUcoïdauz:
Plusieurs systèmes biologiques possèdent une ou plusieurs structures semblables à celles des matériaux composites modernes: une composante fibreuse contenue dans une matrice. Dans la majorité des cas, les fibres. fibrilles ou microfibrilles forment une ultrastructure
hélicoïdale, i.e, elles forment un .agencement stratifié,. Dans chacune
des couches O'J feuillets de l'arrangement hélicoïdal, les unités
fibrillaires sont parallèles dans le plan du feumet. Dans chaque feuillet consécutif, l'orientation fibrillaire subit une légère rotation par rapport
à un axe perpendiculaire au plan, Il existe une grande variété chimique dans la constitution des systèmes hélicoïdaux biologiques, Quelques exemples de ces systèmes sont donnés à la table 1.13.
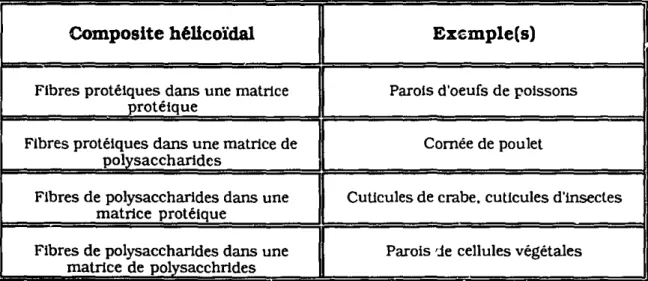
Table 1.1- Exemples d'ultrastructures biologiques hélicoïdales illustrant les différentes combinaisons fibres (mierofibrilles) / matrices,
Composite héUcoïdal Ex-.;mple(s)
Fibres protéiques dans une matrice Parois d'oeufs de poissons
protéique
Fibres protéiques dans une matrice de Cornée de poulet
polysaccharides
Fibres de polysaccharides dans une Cuticules de crabe. cuticules d'Insectes
matrice protéique
Fibres de polysaccharides dans une Parois 'Je cellules végétales
matrice de polysacchrldes
BouHgand fut le premier, en 1965. à interpréter en termes d'arrangement hélicoïdal le patron arqué très caractéristique obtenu par coupe oblique d'un système hélicoïdal tel celui des fibrilles chitinoprotéiques dans les cuticules de crabe4 . La figure 1.1 la) illustre le changement progressif de direction de fibrilles, d'un feuillet à l'autre de l'arrangement hélicoïdal, donnant ainsi naissance aux arceaux observés dans un plan oblique aux strates. D'un arceau à
-4-•
•
•
Figure 1.1. Illustration schématique du principe de la structure hélicoïdale. L'axe nématique chiral est représenté par l'axe z et le plan nématique chiral est selon la direction de l'axe y. (a) Section oblique dans l'empilement des couches hélicoïdales. Une rotation progressive des microflbrilles de 1800
génère un arceau plus ou moins prononcé, selon l'angle de la coupe. Ici, l'angle rie coupe est près de la direction horizontale. (h) Sections obliques symétriques illustrant \'inversion de la courbure des arceaux.
-5-•
x
y
(a)
y
(h)
•
•
•
l'autre. il Y a rotation des fibrilles de 180°. Celles-cl se retrouvent donc dans un positionnement antiparallèle. Le pas de l'arrangement hélicoïdal est la distance nécess<J.ire pour que les fibrilles redeViennent parallèles, Le. qu'elles effectuent une rotation de 360°. À la figure 1.1 (bl. deux sections obliques symétriques par rapport à l'axe y (l'axe y
étant perpendiculaire au plan des feul1\ets) montrent des séries d'arceaux dont la courbure est inversée. Le schéma l11ustre également l'absence d'arceaux lorsqu'une section verticale est produite. cette section étant perpendiculaire à l'arrangement des feul11ets de la structure hélicoïdale. L'usage d'un goniométre en microscopie électronique à transmission permet de simuler les différents angles de section dans un matériau hélicoïdal. L'Inversion du patron arqué. par rotation progressive d'un échantl11on. constitue une preuve Irréfutable de la présence d'hélicoïdess.6.
Il est maintenant reconnu que certains éléments qui composent la structure extracellulaire de différentes espèces animales existent sous la forme d'hélicoïdes. La suggestion que les parois cellulaires de plantes puissent également être hélicoïdales fut faite par Bouligand5 en
1972. Depuis. l'importance de l'ordre hélicoïdal dans le mécanisme de croissance et d'élongation des cellules végétales est devenue une considération d'ordre générale, De nombreux articles de revue portent sur des organismes végétaux connus. détenteurs de structures hélicoïdales6.7 ,
Deux principales propriétés caractérisent les parois hélicoïdales. Une premiére caractéristique de ces parois est leur grande capacité d'adaptation à la spécialisation cellulaire. Elles sont donc flexibles et
versatiles, Les parois végétales hélicoïdales sont également hautement
ordonnées. L'orientation des fibrilles varient dans l'espace mals également dans le temps (on parle alors de la quatrième dimension de la structure hélicoïdale). Le facteur temps étant relié au phénomène de croissance de l'organisme végétal. En effet. plUSieurs parois cellulaires manifestent un écart structural par rapport au modèle de base des hélicoïdes. Ces déviations peuvent être reliées à la différenciation cellulaire elle-même. mais elles peuvent également dêcouler d'événements extérieurs, Dans les deux cas. les manifestations en sont trés semblables7 . L'expression des déviations se fait par un
-6-•
•
•
changement (uniforme ou nonl du .shift. des fibrilles. Ce changement peut être régulier ou anarchique dans le temps. Les différentes apparences que peut prendre l'arrangement hélicoïdal sont alors multiples. En section, la forme et la largeur des arceaux peuvent varier
à l'infini.
Un exemple approprié pour illustrer le phénomène de croissance irrégulière des parois cellulaires est celui de la paroi secondaire triple des trachéides ou .fibres. de bois mou (généralement des conifères). Une tel1e fibre est montrée à la figure 1.2. Ces trachéides sont séparées les unes des autres par une lamel1e mitoyenne. Chaque trachéide comporte une paroi primaire et une triple paroi secondaire formant la majeure partie de la paroi cel1ulaire. Dans chacune de ces parois. les fibrilles de cel1ulose sont alignées de manière spécifique. Dans la paroi primaire (Pl. les fibrilles forment un .filet•. On note que les fibrilles situées à la surface intérieure de la paroi primaire sont orientées paral1èlement aux fibrilles de la surface extérieure de la paroi secondaire externe (51l. Dans 51. les fibril1es sont enroulées autour de l'axe de fibre. La paroi secondaire interne. 52. forme la matière principale de la fibre (son épaisseur est généralement de 2 à
10 ~m). Dans 52. les fibril1es de cellulose s'enroulent autour de l'axe de fibre selon un patron dextrogyre bien défini et avec un angle généralement inférieur à 30°. La paroi tertiaire. 53. est très mince et possède une composition et une organisation fribrillaire très semblable
à 51. La présence de couches intermédiaires dans les zones de transition· entre 51 et 52 ainsi que 52 et 53 a été confirmée avec différentes essences de conifères et de feuillus8 . Cest la croissance irrégulière des trachéides qui est responsable du changement d'orientation des fibrilles de cel1ulose d'une paroi cel1ulaire à l'autre. De plus. il est maintenant connu que les couches de transition entre
51 et 52 ainsi que 52 et 53 sont l'expression d'une modification hélicoïdale9 ou encore des semi-hélicoïdes6 . La micrographie
électronique de la figure 1.2 est obtenue à partir d'une coupe de trachéide de conifère. l'épinette noire. Les zones de transitions hélicoïdales entre les différentes parois secondaires y sont nettement Visibles. NeVille et Lévy proposent que
-7-•
•
Figure 1.2. Coupe transverse d'une trachéïde d'épinette noire, ML: lamelle médiane. SI: parois secondaire externe. S2: paroi secondaire principale. La zone de transition hélicoïdale entre SI et S2 est clairement visible et Identifiée (électromlcrographle de Jean-François Revol) .
-8-•
•
•
•
•
•... the cell Is capable of three sorts of commando Flrstly. a general Instruct10n to make hellcoldal walls by self-assembly. Secondly. a more specifie Instruct10n to orient several consecut1ve layers of
mlcroflbrils ln one parilcuiar direction only: (. ..). Thlrdly. an order
to change from one specU'Ic (ilrection to another vla Interve"llng
he\lcolds le.g. ln wood)·. 10
Le mécanisme de rotation des microfibrilles de cellulose dans les zones de transitions hélicoïdales des parois cellulaires n'est pas parfaitement connu. Il s'agit en fait d'un mécanisme fort complexe. Comme rappelé par Roland et al.ll • la cellulose est très étroitement entourée d'une matrice polymérique. Les principales composantes de cette matrice sont les pectines. la lignine et les hémicelluloses. La
pectine. présente sous la forme de gel. ainsi que la lignine ne sont pas considérés comme des agents de génération d'hélicoïdes I2 . Il existe plusieurs hypothéses quant à la participation des hémicellulosesI2.13.14 et plus spécifiquement de glucuronoxylans8.15 dans la formation des arrangements hélicoïdaux des microfibrilles de cellulose. Vian et al.a ont montré la localisation préférentielle des glucuronoxylans dans les zones de transitions hélicoïdales des trachéides de bois. Déjà en 1972. Nieduzinski et Marchessaultl6 parlèrent de la fonction
.plastifiante-des xylanes.
1.1.3- Hélicoïdes et cristaux liquides nématlques chtrauz: similitudes
Il existe une approche privilégiée pour permettre l'étude efficace de la complexité des structures hélicoïdales dans les parois de cellules végétales. Celle-ci consiste en l'utilisation du modéle dynamique bien connu des cristaux liquides nématiques chiraux (cholestérlques)l7. Cette similitude a été soulignée par de nombreux auteurs dont Bouligand4. Neville et al. 18. ainsi que plusieurs autres. L'une des hypothèses découlant de ces observations étant qu'un état précurseur des parois cellulaires hélicoïdales serait un cristal liquide nématique chiral. L'observation d'un arrangement hélicoïdal des microfibrilles de cellulose (fortement associées au glucuronoxylans) dans les mucilages de pépins de coingsl9 tend à confirmer cette hypothèse. Plus
récemment. des travaux ont été effectués dans le but de reproduire in vitro l'arrangement hélicoïdal des microftbrilles mentionnées
-9-haut20,21. D'après les auteurs. des observations faites par microscopie optique et électronique sembleraient Indiquer localement la présence de structures hélicoïdales, Dans ces systèmes où l'association des glucuronoxylans avec la cellulose est fortement marquée. la formation rapide d'un gel obtenu par ultracentrifugation semble limiter l'auto-assemblage des microfibrllles.
1.2 Cristaux liquides
Un peu plus de cent ans après leur découverte. les cristaux liquides font désormais partie intégrante de notre vie quotidienne. Les cristaux liquides peuvent plus justement étre nommés mésophases. puisqu'ils constituent un état intermédiaire entre les symétries des solides et des liquides. Une des utilisations les plus courante des mésophases est celle des affichages cristallins liquides (ou LCDs. pour
liquid crystalline displays) utilisés dans les calculatrices. les montres.
etc. Les fibres obtenues à partir de certaines mésophases. thermotropes (polymères purs) et lyotropes (solutions de polymères). ont des propriétés mécaniques supérieures à celles de l'acier22 . De plus. par simple recuit. on observe généralement une augmentation de la résistance des fibres à l'élongation et une augmentation du poids moléculaire moyen accompagnée d'une réduction des défectuosités critiques des fibres. 11 semble également que le recuit favorise la résistance chimique et thermique des fibres. tout en y augmentant l'ordre tri-dimensionnel ainsi que leur température de fusion. Lors du moulage par injection. les matériaux obtenus à partir de cristaux liquides thermotropes ont des propriétés très semblables à celles des thermoplastiques renforcés de fibres23 • Ce comportement est dû à
l'anisotropie (i.e. la variation des propriétés du matériau selon la direction considérée) de la matière utilisée.
Par réticulation de mésophases. on peut produire des élastomères cristallins liquides. Ces élastomères possèdent des propriétés anisotropes semblables à celles des cristaux liquides mais en raison du réseau tri-dimensionnel formé par les chaines polymériques. ils ont une grande élasticité et une stabilité de forme relativement élevée. 11 a été montré que suite à une déformation mécanique. un élastomère
-10-•
•
•
cristallin liquide peut passer d'une "'pparence opaque à translucide dû
à l'induction orientationnelle uniforme du .directeup 24. Les mêmes auteurs concluent que des élastoméres nématiques chiraux pourront éventuellement agir comme transducteurs piézoélectriques.
Ces quelques applications des cristaux liquides justifient l'intérêt théorique et pratique que suscitent ces matériaux depuis plusieurs années. D'un point de vue plus fondamental. les mésophases sont également très utiles dans l'étude de la rhéologie. de la plasticité. des transitions de phases. de la physique des défauts et de la formation de patrons en optique nonlinéaire.
1.2.1- Notions de base
La formation de solutions anisotropes fait l'objet de plusieurs études théoriques25 . Entre autres. la théorie des réseaux proposée initialement par Flory26 pour expliquer la séparation de phase de solutions de molécules-bâtonnets rigides a progressivement été modifiée dans le but d'éclaircir les mécanismes de formation de phases concentrées ordonnées. Flory a introduit dans cette théorie• tout d'abord. l'effet de l'attraction asymétrique mutuelle des chaînes polymériques27 , puis. l'effet de la flexibilité relative de ces chaînes formant des solutions cristallines liquides28. En 1989. Jung et Stem29
proposent une nouvelle variation â la lOi des réseaux de Flory. Ces auteurs ont aussi pris en considération la flexibl11té des chaînes latérales d'un polymère partiellement flexible. Parallèlement. la conception de chaînes semi-rigides .freely-jointed. de Flory a également été appliquée au modèle de Onsager30 •31 . Rappelons que dans son approche viriel, Onsager utilise l'énergie libre d'interaction entre des molécules-bâtonnets rigides et assymétriques. Onsager y démontre qu'en fonction du rapport d'axes des molécules. au-dessus d'une concentration critique. il doit y avoir séparation de phase. En intégrant l'approche des chaînes semi-rigides à celle du rapport axial. une concentration critique supérieure à celle estimée précédemment est obtenue.
L'intérét théorique et pratique suscité par les cristaux liquides vient de l'ordre moléculaire inhérent â ces fluides anisotropes. Comme l'orientation moléculaire de ces phases n'est pas fixe. on utllise le
-11-•
paramètre d'ordre de Maier et Saupe32 , Sm-s. pour quantifier l'ordre orientationnel moyen des molècules dans un volume donné de solution et ce. par rapport à une direction alèatoire pré-établie. En laboratoire. on fait généralement correspondre à cette direction. représentée par le vecteur "directeur-, l'axe optique des observations effectuées. Le paramètre d'ordre. Sm-s. est donné par la fonction(Ll)
•
•
où
a
est l'angle formé entre le directeur et un axe moléculaire intrinsèque. Lorsque S= 1 on a un ordre orientationnel parfait puisque cos 0° = 1, ce qui correspond au cas d'un solide cristallin. De même. un système ayant une valeur moyenne de s=o est dans un état liquide.Il existe différents types d'ordres moléculaires dans les cristaux liquides. Les crü;7~ux liquides nématiques (du grec vlil.la. pour fil.
filament33) sont des exemples d'ordre orientationnel pur (voir figure
1.3 (a)). à très faibles corrélations de position. Dans un volume donné. les molécules sont parallèles dans un espace tridimensionnel. Toutefois. sur une longue distance. l'orientation moyenne peut varier continuellement. mais la densité des centres de gravité demeure constante34 (Le. les centres de gravité des molécules sont répartis au hasard). Selon Kleman35 ainsi que Chandrasekhar et al. 36. les groupes de symétries des nèmatiques sont
R3: groupe de translation continue à trois dimensions
Doq,' groupe des rotations: 1t autour des axes perpendiculaires aux
molécules et continues autour de l'axe des molécules.
Dans le cas des cristaux liqUides smectiques (du grec o"I.lTl'YJla. pour savon). les molécules sont organisées en couches superposées de même épaisseur. Dans ce cas. la densité des centres de gravité n'est plus la même et il y a un ordre directionneP4. À la figure 1.3 (b), un exemple d'une phase smectique est donné. Dans cette illustration.
-12-•
•
•
Figure 1.3. Molécules-bâtonnets en phase (a) nématique, (b) smectique
A et (c) smectique C.
-13-•
(c)
•
•
•
comme toutes les molécules sont perpendiculaires à l'axe des couches.
il s'agit d'un smectique de type A. Si l'axe moléculaire forme un angle différent de 90 degrés avec ces méme couches. on parle alors de smectique C, Pour un smectique A. le groupe de symétrie est
R2: groupe des translations continues dans les plans smectiques
z:
selon la perpendiculaire aux couches. groupe des translations quantifiéesLes mésophases nématiques et smectiques sont généralement formées par des molécules allongées, Si les molécules considérées ont la forme de disques. une autre organisation peut-être obtenue. Cette troisième grande classe de cristaux liquides est celle des colonnades.
où des colonnes parallèles de molécules forment un arrangement ayant deux ordres directionnels.
Dans le cadre de cette thèse. notre attention portera sur un type particulier d'arrangement Hématique: les nématiques chiraux. Dans ces mésophases. des molécules possédant une activité optique s'organisent selon une configuration hélicoïdale. Ces cristaux liquides sont encore familièrement nommés cholestériques suite à la publication de Reinitzer. en 1888. où il rapporte le comportement cristallin liquide d'un dérivé du cholestérol. L'activité optique et les couleurs de réflection propres aux arrangements nématiques chiraux y sont rapportées.
Un exemple d'arrangement moléculaire nématique r.hiral est donné à la figure 1.4 . Dans une phase nématique chirale. les molécules-bâtonnets reposent les unes par-dessus les autres. selon une configuration hélicoïdale continue. On représente schématiquement ces molécules dans des couches également espacées. L'orientation des molécules est unidirectionnelle à
l'Intérieur d'une même couche. mais elle varie progressivement d'une couche à l'autre. On remarque une certaine périodiCité dans l'arrangement moléculaire selon l'axe z. Cet axe est parallèle à la direction de torsade des molécules et perpendiculaire aux plans dans
-14-•
•
•
Figure 1.4. Molécules-bâtonnets en phase nématique chirale. Une illustration simplifiée de l'arrangement est donnée dans la
repr~sentationde drc.!te. où les macromolécules sont illustrées sous forme de .clous•. La pointe du clou symbolise l'extrémité de la
molécule-b~tonnetpointant hors du plan de l'illustration. Dans ce cas-ci. la structure a une héliclté droite.
-15-•
z
z
l- I-
l-
I-It
• •. Pj2
= = =
--1 --1
--1 --1
l
=
= =
= = = =
•
•
•
•
lesquelles les molécules se trouvent. La périodicité observée tU ;: est la
demie du pas hélicoïdal, I.e. la distance nécessaire pour faire subir aux molécules une rotation de 1800
dans le plan des couches. La structure d'un cristal liquide est généralement représentée par une section plane, qui a une orientation définie par rapport à la structure eUe-même. À la figure 1.4. on peut observer une section verticale, parallèle
à l'axe hélicoïdale de l'organisation nématlque chirale. Les molécules parallèles au plan du dessin sont représentées par des segments de longueur unitaire. Les molécules normales à ce plan sont marquées par des points. Les molécules en position Intermédiaire sont symbolisées par un clou: le bout pointu correspondant à l'extrémité moléculalre qui pointe hors du plan du dessin. La longueur des segments est proportionneUe à cos a, a étant l'angle que fait la molécule du plan de représentation. Le groupe de symétrie des nématiques chiraux est
Rh: groupe de symétrie hélicoïdale
02:
rotations 1t autour des axes moléculaires1.2.2- Tenures des cristaux Uquides nêmatiques chiraux
Dans les cristaux liquides. la plupart <:les arrangements morphologiques sont impliquées dans la création de défauts de structure. Ces défauts apparaissent lorsqu'il y a un changement brusque d'orientation du directeur. Chez les smectiques et nématiques chiraux, la présence de surfaces parallèles détermine la particularité des défauts impliqués37 . Ces cristaux liquides montrent des dislocations de translation et de rotation (disinclinaisons) qui peuvent être observés sous la forme de lignes de défauts. Lorsqu'il y a convergence des normales aux surfaces parallèles des arrangements en couches. on observe également des courbes focales. L'arrangement des défauts et des domaines d'un système cristallin liquide donné constitue la
texture
de ce système. La figure 1.5 (a) montre quelques uns des défauts observés dans les systémes mésomorphes à couches parallèles. Ces représentations sont obtenues par le processus de Volterra:-16-•
•
•
Figure 1.5. (a) Illustration des principaux défauts de la texture
nématique chirale polygonale focale conique. 1- dislocation vis, 11-dislocation coin, III- dlslncl1nalson +lt, IV- disInclinaison -lt et V- lignes
focales. (b) Processus de formation d'une dislocation coin selon le processus Volterra. Après séparation des plans par une section perpendiculaire Imaginaire (surface hachurée). le déplacement mutuel de chaque partie des plans permet la reconstruction de nouveaux feuillets (d'après Y. Bouligand. dans Geometry and topology of defects in liquid crystals. Physique des défauts. Les Houches 1980. Session XXXV. North Holland. 665-711 (1981)).
-17-•
•
•
(a)
étapeA II(b)
étapeB•
•... qui consiste en l'ouverture de la surfacedl~ coupurer
d'un angle±1nIltautour de l'axe de la dlslncltnalson (supposée rectiligne) et en
l'addition (ou la soustraction) de matière dans l'angle balayé par
r.
On déftnit le rang S
=
± 1n/2 1 de la dlstnclinalson en choisissant lesigne + si l'opération a consisté en la soustractton de matière, et le
signe - en cas d'addltlon.•38
Cette description s'applique également à la formation des dislocation, Une iUustration du processus de Volterra est donné à la figure 1.5 (bl,
C'est par la qualification des défauts d'un système donné que l'on peut identifier la texture de ce système. Dans le cas qui nous intéresse.
il est généralement admis34 que les smectiques et les nématiques
chiraux planaires ne présentent que des dislocations de translation. Les textures focales. quant à elles. présentent des lignes focales en plus des dislocations de translation. Ces observations nous conduisent à la définition de l'une des plus fascinantes et des plus complexes textures observées pour les cristaux liquides nématlques chiraux: les
champs polygona~9qui définissent la texture .polygonal focal conlo.
Afin d'éviter toute ambiguité reliée à une liberté d'interprétation. il
semble justifié de citer la description originale des champs polygonaux faite par Bouligand:
• (...) Lamésophase cholestérlque (...1est arrangée selon un ensemble
de domaines qui ne sont pas exactement focaux. Leurs règles d'association diffèrent fondamentalement de celles connues
classiquement dans les smectiques. Les courbes focales
appartiennent généralement à plusieurs domaines Imparfaits et
peuvent être des coniques (segments d'hyperbole), mals ne sont pas associées de manière biunivoque en position focale. Les domaines rentrent en contact selon des surfaces coniques qui ne sont pas de révolution, en général.
Des dislocations de rotation (+ lt et -lt) et des dlslocattons-colns
Interviennent dans certains polygones a!lnsl que dans les réglons qui 1lmltent les champs polygonaux. Dans certains cas, les dislocations de rotation sont en même temps des segments focaux et Introduisent de fortes variations de pas cholestérlque. Le pas hélicoïdal présente également un maximum relatif au niveau des courbes focales claSSiques.
On peut démontrer dans quelques cas assez exceptionnels l'existence
d'une dislocation-vis superposée à un segment focal. (... ) La
distribution des axes cholestérlques selon des segments rectilignes. tendus entre des courbes focales qui ne sont pas des coniques focales,
est solénoïdale et conduit à des dislocations-vis. En fait. les
enveloppes des axes choIestériques ne sont pas exactem.ent
-18-•
•
•
rectlllAnes et sont méme fortement recourbées au voisinage des lIAnes focales et des divers types de dislocatlons.
(... ) Des ramllkations des cotés des polygones sont fréquentes et ne sont pas compatlbles avec leur forme rigoureusement hyperbolique. Ce fait Implique également des variations locales de pas cholestérlque. Les côtés des polygones peuvent étre également Interrompus par des petits quadrtlatéres montrant une dissymétrie liée au caractére hélicoïdal de la mésophase. (...)40
La figure 1.6 nous montre la superposition de couches nématiques chirales au niveau d'une courbe focale et la distribution des axes nématiques chiraux correspondants dans un plan méridien. Ces trois méme couches sont ensuite illustrées dans le contexte d'un champ polygonal (figure 1.6 (b)). où l'on suppose que chaque dome et chaque cuvette correspond à un polygone de l'arrangement conique focal.
1.2.3- Crlstau.x: liquides nématiques chirau.x: à base de dérlv&
cellulosiques
Il existe une grande similitude entre les hélicoïdes naturels décrits précédemment dans ce chapitre et les cristaux liquides nématiques chiraux. Dans le cas des parois cellulaires. des micra/lbrilles cristallines contenues dans une matrice forment l'arrangement hélicoïdal. Les phases cristallines liqUides nématiques chirales. quant à elles. sont composées de segments de chaînes moléculaires. Plusieurs dérivés de la cellulose peuvent former des arrangements cristallins liqUides lyotropes4l -45 ou thermotropes46-48.
La seml-flexibilité des macromolécules-bàtonnets49 ainsi que la nature
et le degré des substituants chimiques pouvant s'y greffer. sont responsables de la capacité des polymères cellulosiques à former des solutions cristallines liquides (aussi appelées mésophases). Tel qu'illustrè à la figure 1.7. la cellulose est un homopolymère d'unités D-glucopyranose. La nature des liens entre les unités D-glucopyranose est décrite comme ~-(1-4)50. Chaque unité glucosidique contient cinq
(5) carbones optiquement actifs. Cette assymétrie au niveau des monomères de la cellulose et de ses dérivés. explique le caractère nématjque chiral des solutions cellulosiques anisotropes.
La texture des cristaux liqUides nématiques chiraux cellulosiques est complexe. L'ètude de solutions de cellulose d'hydroxyle et de
-19-•
•
•
Figure 1.6. Exemple de formation des champs polygonaux. (a) À la formation d'une ligne focale, l'emboîtement de 3 couches nématiques chirales superposées et. dans une section plane, la distribution des axes nématiques chiraux correspondants. (b) 1- superpositon de 2 couches nématiques chirales dans le champ polygonal, II- double évasement d'une couche isolée et III- projection horizontale des points focaux du champ polygonal (d'après Y. Bouligand. J. Phys.• 33, 715-736 (1972)) .
-20-•
•
•
1-
11-(a)
c
'),
,
\
/
/ /"
\ 1/
/ /"
/ /"
\ 1/
/ /"
\ 1/
/ /"
\ 1/
/ /,
/"
\ 1/
/ /"
\ 1/
/ /"
/ /"
\ 1/
/ /"
\ 1/
/ /,
/"
\ /
/ /C
"')11-•
•
•
III-- - - :: - - : ..~ \1 \ _ _-:..-_
~~O~~~~~~~~~-f~~\;~
'"".:-.:-- - - -:.. -::. :.----:.-:-:::", ... - :: :: -::..~ -=.:.---~~-~~Y{;~i';:;;'k~~~if~~f~~~~~~
~---~--- - - ...{.. : ...iïi".... : ....-1--- - --":.--
0--:'...."---~-O- -, - -- - -
---21
~~~~-=.~:~?~~fi~~~:~
i
~;~t~~~~1~
(b)
•
•
Figure 1.7. Deux unités de base de la molécule de cellulose; un homopolymère d'unités D-glucopyranose liées en ~ aux positions 1 et 4 .