RÔLES DES PHOSPHOLIPASES A
2DANS LA
BIOLOGIE DU THYMUS
Thèse
Matthieu Rousseau
Doctorat en microbiologie-immunologie
Philosophiae doctor (Ph.D.)
Québec, Canada
© Matthieu Rousseau, 2015
Résumé
Les précurseurs des lymphocytes T appelés thymocytes se développent dans le thymus, un organe lymphoïde primaire, via différents processus de sélections aboutissant à l’élimination par apoptose de ceux qui sont inutiles ou dangereux (autoréactifs). Le développement des thymocytes nécessite de nombreuses molécules comme les cytokines et les chimiokines. Bien que le rôle des médiateurs lipidiques dans l’immunité soit bien décrit, leur rôle dans la maturation des thymocytes l’est peu. Nous avons étudié le rôle de la phospholipase A2 cytosolique du groupe IVA (cPLA2), une enzyme clé pour la biosynthèse des médiateurs lipidiques, dans le développement des thymocytes. En utilisant des approches génétiques (délétion de la cPLA2) et pharmacologiques (utilisation d’un inhibiteur de la cPLA2, la pyrrophénone) nous montrons que la maturation des thymocytes se déroule indépendamment de la cPLA2 suggérant que la plupart des produits dérivés de l’acide arachidonique ne sont pas nécessaires au développement des thymocytes.
Au cours des processus de sélections dans le thymus, environ 98% des thymocytes sont éliminés par apoptose. Des études ont montré que le lysophosphatidylcholine, obtenu suite au clivage d’un phospholipide membranaire par une phospholipase A2, permet une élimination efficace des cellules apoptotiques. Nous avons étudié le rôle des phospholipases A2 sécrétées (sPLA2) IIA, V et X dans l’élimination des thymocytes apoptotiques. Ces enzymes sont exprimées dans le thymus mais leur fonction est pour le moment inconnue. Nous montrons in vitro que toutes les sPLA2 testées, excepté la IIA humaine, éliminent les thymocytes apoptotiques et que ceci est dépendant de leur activité enzymatique.
De nombreuses études ont émis l’hypothèse que les sPLA2 peuvent affecter la détection et la quantification des microparticules (MPs) formées suite à l’activation cellulaire ou l’apoptose. Nous observons que les sPLA2 V et X humaines éliminent partiellement les MPs de thymocytes apoptotiques humains (il y a une grande quantité de thymocytes apoptotiques dans le thymus) mais pas celles de d’autres origines cellulaires. Nous montrons également que certaines sPLA2 affectent la détection et la quantification des MPs
selon l’espèce étudiée, l’origine cellulaire des MPs et le moyen de détection employé. Finalement l’impact de ces enzymes est dépendant de leur activité enzymatique.
Abstract
T cell precursors called thymocytes develop in the thymus, a primary lymphoid organ, by different selection processes that eliminate by apoptosis useless or dangerous (auto reactive) thymocytes. Numerous molecules such as cytokines and chemokines are needed for thymocyte development. While the roles of eicosanoids in immunity are described their role in thymocyte maturation remains uncertain. We have studied the role of the cytosolic phospholipase A2 of group IVA (cPLA2), a key enzyme in lipid mediator biosynthesis, in thymocyte development. Using genetic (deletion of cPLA2) and pharmacological approaches (using an inhibitor, pyrrophenone) we demonstrate that thymocyte maturation occurs independently of cPLA2 suggesting that most arachidonic acid metabolites are dispensable in thymocyte development.
During selection processes occurring in the thymus, around 98% of thymocytes are eliminated by apoptosis. Studies demonstrated that the lysophosphatidylcholine, produced by phospholipase A2 hydrolysis of membrane phospholipids, induces an efficient elimination of apoptotic cells. We investigated the role of secreted phospholipase A2 (sPLA2) IIA, V and X in the clearance of apoptotic thymocytes. These enzymes are expressed in the thymus but their functions in this organ are currently unknown. In vitro, we demonstrated that all sPLA2 tested, except the human IIA, eliminate apoptotic thymocytes and that their enzymatic activity is required.
Several studies have hypothesized that the sPLA2 could affect the detection and quantification of microparticles (MPs) produced during cell activation or apoptosis. We demonstrated that human sPLA2 V and X eliminate partially apoptotic thymocyte (there are many apoptotic thymocytes in thymus) MPs but not the MPs of other cellular origins. We also observed that certain sPLA2 enzymes impair the quantification of microparticles, depending on the species studied, the cellular source of microparticles and the means of detection employed. Finally, the sPLA2 impact on MPs is dependent on their enzymatic activity.
Table des matières
Résumé ... III Abstract ... V Table des matières ... VII Liste des figures ... XIII Liste des tableaux ... XV Liste des abréviations ... XVII Remerciements ... XXIII Avant-propos ... XXVII Chapitre 1 : Introduction ... 1 1.1 Le thymus ... 2 1.1.1 Caractéristiques du thymus ... 2 1.1.2 Formation du thymus ... 2 1.1.3 Morphologie du thymus ... 3 1.2 Les thymocytes ... 4 1.2.1 Origine ... 4
1.2.2 Migration dans le thymus ... 4
1.2.3 Les différents types de thymocytes ... 5
1.2.4 Développement des thymocytes ... 5
1.2.4.1 Stade double négatif... 8
1.2.4.2 Stade double positif ... 11
1.2.4.3 La sélection positive ... 12
1.2.4.4 Stade simple positif ... 14
1.2.4.5 La sélection négative ... 16
1.2.4.6 Les lymphocytes T régulateurs ... 18
1.2.4.7 Devenir des thymocytes apoptotiques... 19
1.2.4.8 Médiateurs lipidiques impliqués ... 20
1.2.5 Export des thymocytes naïfs matures ... 23
1.2.6 Les lymphocytes T périphériques ... 23
1.3 Les phospholipases A2 ... 24
1.3.1 Généralités ... 24
1.3.2 Les phospholipases A2 intracellulaires ... 25
1.3.2.1 Les différents groupes ... 25
1.3.2.2 La phospholipase A2 cytosolique du groupe IVA ... 27
1.3.2.2.1 Propriétés enzymatiques ... 27
1.3.2.2.2 Fonctions physiologiques et physiopathologiques ... 28
1.3.2.3 Les autres phospholipases A2 du groupe IV ... 29
1.3.2.4 Les phospholipases du groupe VI ... 30
1.3.3 Les phospholipases A2 sécrétées ... 31
1.3.3.2 La phospholipase A2 sécrétée du groupe IB ... 32
1.3.3.2.1 Distribution tissulaire ... 32
1.3.3.2.2 Propriétés enzymatiques ... 32
1.3.3.2.3 Fonctions physiologiques et physiopathologiques ... 33
1.3.3.3 La phospholipase A2 sécrétée du groupe IIA ... 33
1.3.3.3.1 Distribution tissulaire ... 33
1.3.3.3.2 Propriétés enzymatiques ... 34
1.3.3.3.3 Fonctions physiologiques et physiopathologiques ... 34
1.3.3.4 La phospholipase A2 du groupe IIC ... 36
1.3.3.5 La phospholipase A2 du groupe IID ... 36
1.3.3.5.1 Distribution cellulaire ... 36
1.3.3.5.2 Propriétés enzymatiques ... 36
1.3.3.5.3 Fonctions physiologiques et physiopathologiques ... 36
1.3.3.6 La phospholipase A2 IIE ... 37
1.3.3.6.1 Distribution tissulaire ... 37
1.3.3.6.2 Propriétés enzymatiques ... 37
1.3.3.6.3 Fonctions physiologiques et physiopathologiques ... 37
1.3.3.7 La phospholipase A2 du groupe IIF ... 37
1.3.3.7.1 Distribution tissulaire. ... 38
1.3.3.7.2 Propriétés enzymatiques ... 38
1.3.3.7.3 Fonctions physiologiques et physiopathologiques. ... 38
1.3.3.8 La phospholipase A2 du groupe III ... 38
1.3.3.8.1 Distribution tissulaire ... 38
1.3.3.8.2 Propriétés enzymatiques ... 38
1.3.3.8.3 Fonctions physiologiques et physiopathologiques ... 39
1.3.3.9 La phospholipase A2 du groupe V ... 40
1.3.3.9.1 Distribution tissulaire ... 40
1.3.3.9.2 Propriétés enzymatiques ... 41
1.3.3.9.3 Fonctions physiologiques et physiopathologiques ... 41
1.3.3.10 La phospholipase A2 du groupe X ... 43
1.3.3.10.1 Distribution cellulaire ... 44
1.3.3.10.2 Propriétés enzymatiques ... 44
1.3.3.10.3 Fonctions physiologiques et physiopathologiques ... 44
1.3.3.11 Les phospholipases A2 du groupe XII ... 46
1.4 Les vésicules extracellulaires ... 48
1.4.1 Généralités ... 48
1.4.2 Les microparticules ... 49
1.4.2.1 Définition ... 49
1.4.2.2 Mécanismes de formation des microparticules ... 49
1.4.2.2.1 Réarrangement des phospholipides membranaires ... 49
1.4.2.2.1.1 Asymétrie de la membrane plasmique... 49
1.4.2.2.1.2 Activation cellulaire, apoptose et exposition de la phosphatidylsérine sur le feuillet externe de la membrane plasmique ... 51
1.4.2.2.1.3 Lien entre l’exposition de la phosphatidylsérine sur le feuillet externe de la membrane plasmique et la formation des microparticules ... 51
1.4.2.2.1.4 La composition phospholipidique de la membrane plasmique est importante pour la formation des microparticules ... 51
1.4.2.3 Fonctions physiologiques et pathologiques des microparticules ... 53 1.4.2.3.1 La coagulation ... 53 1.4.2.3.2 La communication intercellulaire ... 54 1.4.2.3.3 L’immunité ... 57 1.4.2.3.4 La reproduction ... 58 1.4.2.3.5 L’athérosclérose ... 58 1.4.2.3.6 La progression tumorale ... 59 1.4.2.3.7 L’inflammation ... 60
1.4.2.3.8 Les maladies auto-immunes ... 61
1.4.2.4 Détection des microparticules ... 62
1.4.2.5 Éléments pouvant affecter l’analyse des microparticules ... 65
1.5 Objectifs ... 67
Chapitre 2 : La maturation des thymocytes à lieu indépendamment de la phospholipase A2 cytosolique alpha ... 71
2.1 Résumé ... 71
2.2 Abstract ... 73
2.3 Introduction ... 74
2.4 Materials and Methods ... 77
2.4.1 Ethic statement. ... 77
2.4.2 Mice and genotyping ... 77
2.4.3 Fetal Thymic Organ Culture ... 78
2.4.4 Human thymus ... 78
2.4.5 Flow cytometry analysis ... 78
2.4.6 RT-QPCR ... 79
2.4.7 Statistical analyses ... 79
2.5 Results ... 80
2.5.1 cPLA2 gene disruption does not affect the maturation of thymocytes in FTOC. ... 80
2.5.2 Evaluation of the impact of the cPLA2 inhibitor pyrrophenone on thymocyte maturation ... 80
2.5.3 cPLA2 gene disruption does not impact thymocyte maturation in the adult mouse. ... 81
2.5.4 Pharmacological inhibition of cPLA2 does not impact human thymocyte maturation. . 81
2.6 Discussion ... 83
2.7 References ... 85
2.8 Figures and legends ... 88
2.9 Supplementary figures and legends ... 98
Chapitre 3 : Les phospholipases A2 sécrétées induisent une diminution des thymocytes apoptotiques détectés ... 101 3.1 Introduction ... 101 3.2 Matériels et méthodes ... 103 3.2.1 Souris utilisées ... 103 3.2.2 Réactifs et anticorps ... 103 3.2.3 Phospholipases A2 recombinantes ... 103
3.2.4 Incubation des thymocytes murins avec les sPLA2 recombinantes murines ... 103
3.2.6 Cytométrie en Flux ... 104
3.2.7 Analyses statistiques ... 104
3.3 Résultats ... 105
3.3.1 Les sPLA2 murines IIA, V et X induisent rapidement une diminution des quantités de thymocytes apoptotiques murins. ... 105
3.3.2 Les sPLA2 humaines V et X, mais pas la IIA, induisent rapidement une diminution des quantités de thymocytes apoptotiques humains. ... 105
3.3.3 La délétion du gène de la sPLA2 X n’affecte pas l’élimination des thymocytes apoptotiques in vivo. ... 106
3.4 Conclusions ... 106
3.5 Références ... 107
3.6 Figures et légendes ... 109
Chapitre 4 : Détection et quantification des microparticules par cytométrie en flux de haute sensibilité. Évaluation de l’impact des phospholipases A2 sécrétées sur la détection des microparticules. ... 113
4.1 Résumé ... 113
4.2 Abstract ... 115
4.3 Introduction ... 116
4.4 Materials and Methods ... 120
4.4.1 Ethic statement. ... 120
4.4.2 Production and isolation of platelet MPs. ... 121
4.4.3 Production and isolation of erythrocyte MPs. ... 122
4.4.4 Production and isolation of endothelial cell MPs. ... 122
4.4.5 Production and isolation of thymocyte MPs. ... 123
4.4.6 Preparation of epididymosomes. ... 123
4.4.7 Preparation of prostasomes. ... 124
4.4.8 Human synovial fluids analysis. ... 124
4.4.9 Reagents an antibodies. ... 124
4.4.10 Incubation of MPs with sPLA2 enzymes. ... 124
4.4.11 Platelet free plasma preparation ... 125
4.4.12 MP labeling. ... 125
4.4.13 Flow cytometry analyses. ... 125
4.4.14 Recombinant phospholipase A2 enzymes. ... 126
4.4.15 Statistical analyses. ... 126
4.5 Results ... 127
4.5.1 Optimization of high sensitivity flow cytometric methods for the detection of MPs. ... 127
4.5.2 Impact of sPLA2s on platelet MPs. ... 129
4.5.3 Impact of sPLA2s on MPs from erythrocytes. ... 131
4.5.4 Impact of sPLA2s on MPs from endothelial cells. ... 132
4.5.5 Impact of sPLA2s on MPs from apoptotic thymocytes. ... 132
4.5.6 Impact of sPLA2s on MPs from the male reproductive tract. ... 133
4.6 Discussion. ... 135
4.7 References. ... 139
4.9 Table ... 157 4.10 Supplementary figures and legends ... 158
Chapitre 5 : Discussion générale ... 169
5.1 La maturation des thymocytes à lieu indépendamment de la phospholipase A2
cytosolique alpha ... 169 5.2 Les phospholipases A2 sécrétées induisent une diminution rapide et significative des
quantités de thymocytes apoptotiques détectées. ... 172 5.3 Détection et quantification des microparticules par cytométrie en flux de haute
sensibilité. Évaluation de l’impact des phospholipases A2 sécrétées sur la détection des
microparticules. ... 175
Liste des figures
Chapitre 1
Figure 1 : Développement du thymus murin.. ... 3
Figure 2 : Organisation du thymus humain. ... 4
Figure 3 : Localisation des thymocytes dans le thymus selon leur stade de développement .7 Figure 4 : Relation entre le stade de développement des thymocytes, le réarrangement des gènes du TCR et l’expression des protéines de surfaces ... 8
Figure 5 : Organisation germinale du locus des chaines et du TCR ... 10
Figure 6 : Des réarrangements successifs sont possibles afin de permettent la formation d’une chaine du TCR ... 11
Figure 7 : La sélection positive : mise en évidence à l’aide de souris chimériques ... 13
Figure 8 : Le modèle cinétique pour l’orientation des thymocytes dans la voie CD4+ ou CD8+ ... 16
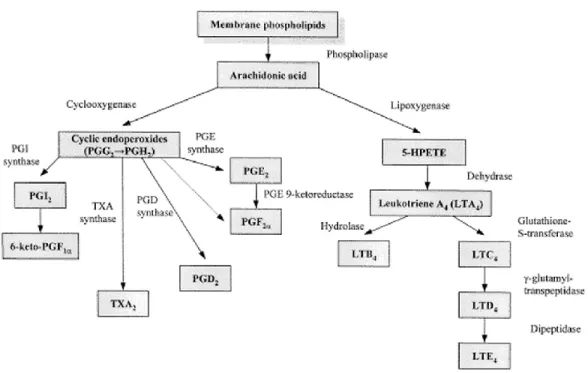
Figure 9 : Synthèse des eicosanoïdes ... 22
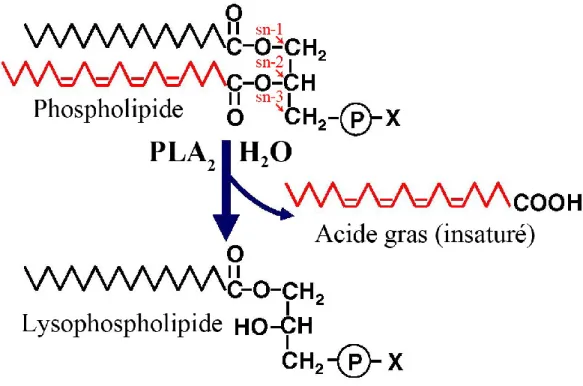
Figure 10 : Réaction catalysée par les PLA2 sur un phospholipide ... 25
Figure 11 : Classification des phospholipases A2 sécrétées ... 31
Figure 12 : Échelle de taille des vésicules extracellulaires ... 48
Figure 13 : Mécanismes conduisant à la formation de microparticules ... 53
Figure 14 : Mécanismes utilisés par les microparticules afin de transférer de l’information à des cellules cibles ... 55
Chapitre 2
Figure 1: cPLA2 gene disruption does not affect thymocyte maturation in FTOC ... 88Figure 2: Pharmacological blockade of cPLA2 does not affect thymocyte maturation in FTOC ... 89
Figure 3: cPLA2 inhibition by high concentration of PP impacts thymocyte maturation in FTOC ... 90
Figure 4: High concentration of PP impacts thymocyte maturation independently of cPLA2 inhibition ... 91
Figure 5: The nonspecific effect of PP on thymocyte maturation is not reversed by exogenous AA and PGE2. ... 93
Figure 6: cPLA2 gene disruption does not affect thymocyte maturation in adult mice ... 95
Figure 7: cPLA2 inhibition does not impact human thymocyte maturation ... 96
Supplementary Figure 1: cPLA2 mRNA expression is modulated according to the development stage ... 98
Supplementary Figure 2: sPLA2 X gene disruption does not affect thymocyte maturation in FTOC ... 99
Chapitre 3
Figure 1 : les sPLA2 IIA, V et X murine éliminent efficacement les thymocytes
apoptotiques murins ... 109
Figure 2 : les sPLA2 V et X humaine, mais pas la IIA, éliminent les thymocytes apoptotiques humains ... 110
Figure 3 : la délétion du gène de la sPLA2 X n’affecte pas la clairance des thymocytes apoptotiques in vivo ... 111
Chapitre 4
Figure 1. Optimization of flow cytometric methods for the detection of MPs ... 147Figure 2. Study of swarm detection in high sensitivity flow cytometry ... 148
Figure 3. Impact of human and mouse sPLA2s on platelet MPs ... 151
Figure 4. Impact of human and mouse sPLA2s on erythrocyte MPs ... 153
Figure 5. Impact of human and mouse sPLA2s on endothelial cell MPs ... 154
Figure 6. Impact of sPLA2s on MPs from apoptotic thymocytes ... 155
Figure 7. Impact of sPLA2s on MPs from the male reproductive tract ... 156
Supplementary Figure 1. Detection of CMFDA+ human platelets MPs and YFP+ mouse platelets MPs using high sensitivity flow cytometry ... 158
Supplementary Figure 2. Detection of erythrocyte MPs and sensitivity to Triton and EDTA treatments ... 159
Supplementary Figure 3. Detection of HUVEC MPs and sensitivity to Triton and EDTA treatments ... 161
Supplementary Figure 4. Detection of apoptotic thymocyte MPs and sensitivity to Triton and EDTA treatments ... 163
Supplementary Figure 5. Detection of epididymosomes and detergent treatment ... 165
Supplementary Figure 6. Enzymatic activities of human sPLA2 IIA, V and X on E. Coli membranes ... 166
Supplementary Figure 7. Impact of human sPLA2s on CD4+ MPs from human apoptotic thymocytes ... 167
Liste des tableaux
Chapitre 1
Tableau 1 : Classification des phospholipases A2 intracellulaires. ... 26 Tableau 2 : Rôle fonctionnel de la cPLA2 dans des modèles de maladies et dans des
processus physiologiques chez la souris ... 29 Tableau 3 : Phospholipases A2 impliquées dans le fonctionnement des cellules
immunitaires. ... 47
Chapitre 4
Table 1: Impact of human and mouse sPLA2s on detection of MPs from different cell origins ... 157
Liste des abréviations
AA Acide arachidonique
adPLA2 Adipose-specific phospholipase A2 AIRE Autoimmune regulator
APC Allophycocyanin
APECED Autoimmune polyendocrinopathy-candidiasis-ectodermal-dystrophy ApoE Apolipoprotéine E
ARF6 ADP-ribosylation factor 6 ARN Acide ribonucléique ATP Adénosine triphosphate bp Base pair
BPI Bactericidal/permeability-increasing protein Ca2+ Calcium
CCL Chemokine (C-C motif) ligand CCR Chemokine (C-C motif) receptor CD Cluster of differentiation
CD40L CD40 ligand
cDNA Complementary deoxyribonucleic acid CEC Cellules épithéliale corticale
CMFDA Celltracker 5-cloromethylfluorescein diacetate CMH Complexe majeur d’histocompatibilité
CO2 Dioxyde de carbone COX Cyclooxygénase
CPA Cellule présentatrice d’antigène cPLA2 Phospholipase A2 cytosolique alpha Cre Recombinase Cre
CXCR C-X-C chemokine receptor DC Dendritic cell
DEL-1 Developmental endothelial locus-1 DLL Delta-like
DMSO Diméthylsulfoxyde DN Double négatif
DNA Deoxyribonucleic acid DP Double positif
E. Coli Escherichia Coli
EDTA Ethylene diamine tetra acetic EGFR Endothelial growth factor receptor
EOMA Mouse hemangioendothelioma endothelial cell EP Prostaglandin E receptor
ERK Extracellular signal-regulated kinase EV Extracellular vesicle
FACS Fluorescence-activated cell sorting FBS Fetal bovine serum
FITC Fluorescein isothiocyanate Foxn1 Forkhead box N1
Foxp3 Forkhead box P3 FSC Foward scatter
FTOC Fetal thymus organ culture Gcm2 Glial cells missing homolog 2 H2O Eau
HDL High-density lipoprotein
HUVEC Human umbilical vein endothélial cell ICAM-1 Intercellular adhesion molécule 1 IgE Immunoglobuline E
IL Interleukine
iPLA2 Phopholipase A2 intracellulaire
Jag Jagged
KCl Chlorure de potassium kDa Kilo Dalton
KH2PO4 Dihydrogénophosphate de potassium
LDL Low-density lipoprotein LPC Lysophosphatidylcholine LPP3 Lipid phosphate phosphatase 3 LPS Lipopolysaccharide
MAC-1 Macrophage antigen 1
MAPK Mitogen activated protein kinases MDSC Myeloid-derived suppressor cell MEC Cellule épithéliale médullaire miARN Micro ARN
min Minute
ml Millilitre
MLCK Myosin light chain kinase MNK1 MAPK-interacting kinase
mpICs Microparticle-associated immun complexes MPs Microparticules
mRNA Messenger Ribonucleic Acid
mTEC Cellule épithéliale médullaire thymique mW Milliwatt
Na2HPO4 Hydrogénophosphate de sodium NaCl Chlorure de Sodium
ng Nanogramme NK Natural Killer nm Nanomètre nM Nanomolaire NO Nitric oxyde NS Non significatif
NTA Nanoparticle tracking analysis
PAF-AH Platelet-activating factor acetylhydrolase PBMC Peripheral blood mononuclear cell PBS Phosphate buffer saline
PCR Polymerase chain reaction PE Phycoerythrin
PE-Cy7 Phycoerythrin Cyanine 7 PFP Platelet free plasma PGE2 Prostaglandine E2
PIP2 phophatidylinositol-4,5-diphosphate PLA2 Phospholipase A2
PMT Photomultiplier tube
PNPLA Patatin-like phospholipase domain-containing lipases PP pyrrophénone
PRP Plasma rich platelets PS Phosphatidylsérine
PSGL-1 P-selectin glycoprotein ligand-1 pT Pré-T-cell (chaine de substitution ) RA Rheumatoid Arthritis
RAG Recombination-activating gene
RANTES Regulated on activation, normal T cell expressed and secreted RBC Red blood cell
RNA Ribonucleic Acid ROCK1 Rho kinase 1
RPMI Roswell park memorial institute medium
RT-QPCR Real-time Quantitative polymerase chain reaction S1P Sphingosine-1-phosphate
S1P1 Sphingosine-1-phosphate receptor 1 SCF Stem Cell Factor
SCID Severe combined immunodeficiency SEM Standard error of the mean
SP Simple positif
sPLA2 Phospholipase A2 sécrétée SSC Side scatter
TEM Microscopie électronique à transmission TF Tissue factor
TFPI Tissue factor pathway inhibitor TGF Transforming growth factor Th T helper (lymphocyte T auxiliaire) TNF Tumor necrosis factor
TRA Tissue-restricted antigens Treg Lymphocyte T régulateur TXA2 Thromboxane A2
VCAM-1 Vascular cell adhesion molecule 1 VIH Virus de l’immunodéficience humaine
WT Wild type
YFP Yellow fluorescent protein µm Micromètre
Remerciements
Maintenant que le manuscrit est écrit et que j’entrevois la lumière au bout de ce long tunnel qu’est la formation universitaire menant à l’obtention du doctorat, j’aimerais remercier toutes les personnes qui, de près ou de loin, ont contribué à ce cheminement et à ce résultat. J’aimerais tout d’abord remercier tous les enseignants que j’ai côtoyé durant mes longues années d’études et qui, par leurs conseils, leurs remarques, voir même leurs réprimandes, m’ont permis d’arriver là où j’en suis actuellement.
Je tiens à remercier tous les membres du jury composé du docteur Véronique Moulin, du docteur Marc Surette et du docteur Fawzi Aoudjit d’avoir accepté d’évaluer mon travail de thèse.
J’aimerais ensuite remercier tout spécialement mon directeur de thèse le docteur Éric Boilard de m’avoir accueilli dans son laboratoire. Sans lui, je serais sans doute actuellement dans un tout autre domaine que celui de la recherche faute d’avoir été recruté pour faire un doctorat. Ensuite, je le remercie pour tous les conseils qu’il m’a prodigué et de m’avoir enseigné une manière de travailler et de penser. En résumé, je le remercie pour la qualité de la formation scientifique qu’il m’a dispensé tout au long de ces années et qui me sera, sans aucun doute, très utile pour la suite de ma carrière scientifique. Je voudrais également les remercier, lui et sa femme Clémence Belleannée, pour leur accueil lors de mon arrivée au Canada mais également pour les nombreux 5 à 7, ou repas (pour les fêtes de fin d’année) qu’ils ont organisé chez eux et auxquels nos conjoints étaient toujours conviés. J’en garde de très bons souvenirs avec notamment de grands moments de rigolades.
Durant toutes ces années j’ai évolué dans un environnement où il a été plaisant de venir travailler grâce notamment à la bonne humeur et à l’esprit d’entraide qui règne au sein de l’équipe. De ce fait, j’aimerais remercier le docteur Nathalie Cloutier pour son aide et ses conseils tout au long de mon doctorat. Je voudrais souligner que, grâce à elle, nous avons trouvé à notre arrivée dans le laboratoire tout ce dont nous avions besoin pour travailler dans les meilleures conditions. J’aimerais également remercier Tania Lévesque qui m’a aidé dans certaines expériences et qui nous aide également tous au quotidien en assurant le
bon fonctionnement du laboratoire. Finalement, j’aimerais remercier tous les membres du laboratoire que j’ai pu côtoyer durant toutes ces années. Notamment, le docteur Luc Boudreau pour nos discussions scientifiques mais également sportives, Anne-Claire Duchez qui a souvent mis ma patience à rude épreuve en s’étendant de manière incontrôlé ou en empruntant (sans les remettre à leur place) différentes choses telles que mon Timer ou mes crayons mais qui est cependant toujours prête à aider, Geneviève Marcoux, le docteur Morgane Baron, le docteur Marc André Laplante, le docteur Carlos Enrique Melendez Pena, le docteur Valérie Garceau, le docteur Emmanuelle Rollet-Labelle ainsi que tous les stagiaires que le laboratoire a accueilli.
J’aimerais remercier les nombreuses personnes que j’ai rencontrées au CHUL et avec qui j’ai passé de bons moments. J’aimerais remercier tout spécialement Benoit Laffont et Nadège Brondelli, Mathieu Iampietro et Sharon Poulin, Aurélie Corduan et Nicolas Lescarret, Anne-Claire Duchez et Maxime Savard, Audrey Magron et Éric Poulin, Émilien Drouot et sa conjointe Jessica, Pascal Jalaguier et sa conjointe Sandra, Audrey Hubert et son conjoint Yanis, pour tous les bons moments que nous avons passés au laboratoire mais également en dehors lors de soirées ou d’activités extérieures en tout genre.
J’aimerais finir en remerciant et en dédiant cette thèse à toute ma famille pour le soutien et les encouragements qu’ils ont pu m’apporter. À mon frère Julien Rousseau, sa femme Élodie Rousseau et leurs enfants Mathis, Aurianne et Gabriel Rousseau, à ma sœur Adeline Rousseau et son conjoint Jean-Luc Chevallier, à mes beaux-parents Thierry et Isabelle Loiseau, aux grands-parents de Caroline, Raymond et Marie-Antoinette Loiseau ainsi que Louis et Marcelle Baraud, à ma belle-sœur Sandrine Loiseau-Alix, son conjoint Damien Alix et leur fille Pernelle Alix, à mon beau-frère Aurélien Loiseau. Ensuite, j’aimerais tout spécialement remercier et dédier cette thèse à mes parents Jean-Pierre et Monique Rousseau. C’est grâce à leur éducation que je suis devenu l’homme que je suis aujourd’hui. Merci de m’avoir notamment inculqué le respect des autres, la valeur de l’effort et du travail bien fait. J’aimerais également souligner dans ces quelques lignes que, toute leur vie durant, par leurs sacrifices pour l’éducation de leurs enfants et leurs dévouements, ils nous ont permis d’accomplir sereinement les études ou projets que nous avons entrepris. Mes succès sont bien sûr les fruits de mes efforts mais ils sont aussi les leurs. Pour qu’un arbre
pousse droit et donne du fruit il faut l’entretenir, s’en occuper et le guider. Finalement j’aimerais terminer en remerciant et en dédiant cette thèse à ma compagne Caroline Loiseau. Tout au long de cette thèse elle a été d’un grand soutien. Je suis conscient de tous les sacrifices qu’elle a consentis pour me suivre et me permettre de réaliser ce projet professionnel. Merci d’avoir accepté cet éloignement de plus de 6000 km durant la première année lorsque tu étais en France et que j’étais au Canada. Merci d’avoir accepté de me suivre alors que la séparation et la distance avec tes proches te pèse un peu plus chaque jours. Merci de m’avoir encouragé, soutenu mais également de m’avoir supporté durant toutes ces années car ce n’est pas toujours simple d’être la compagne d’un doctorant et d’accepter les contraintes qui y sont liées. Merci de me témoigner tous les jours l’amour que tu as pour moi. Je t’aime ma chérie!
Avant-propos
Le Dr. Éric Boilard a conçu et dirigé le projet de recherche. Il a participé à l’analyse des données et corrigé les articles.
Les Dr. Clémence Belleannée, Michael H. Gelb, Jean Perron, Frédéric Jacques, Mélanie Dieudé et Peter A. Nigrovic ont fournis des réactifs primordiaux.
Les Dr. Clémence Belleannée, Michael H. Gelb, Jean Perron, Frédéric Jacques, Mélanie Dieudé, Peter A. Nigrovic, Marie-José Hébert et Nathalie Cloutier ont aidé à la réalisation des manuscrits où ils figurent.
Tania Lévesque et Anne-Claire Duchez ont aidé à réaliser des expériences.
Anne-Claire Duchez a aidé à la réalisation du manuscrit qui constitue le chapitre 4.
J’ai imaginé et réalisé les expériences, analysé et interprété les données, réalisé les analyses statistiques et écrit les manuscrits de tous les articles présentés au chapitre 2, 3 et 4 de ce document.
L’article qui constitue le chapitre 2 intitulé, The maturation of thymocytes occurs
independtly of cytosolic phospholipase A2 alpha, a été soumis dans le journal PLOS
ONE le 12 Août 2014 (PONE-D-14-36134). Des révisions ont été requises et font actuellement l’objet d’expériences supplémentaires.
L’article qui constitue le chapitre 4 intitulé, Detection and quantification of
microparticles using high sensitivity flow cytometry. Evaluation of the impact of secreted phospholipase A2 on microparticle assessment, a été soumis dans le journal
PLOS ONE le 6 juillet 2014 (PONE-D-14-28884). Des révisions ont été requises et ont été soumises le 18 octobre 2014 (PONE-D-14-28884R1).
Les résultats contenus dans le chapitre 3 ne font pas l’objet d’une soumission pour publication.
Au cours de mon doctorat, j’ai collaboré à de nombreux projets au sein même de l’équipe du docteur Éric Boilard, du centre de recherche, en collaboration avec une équipe de recherche du CHUM de Montréal, ou à l’international avec une équipe de recherche de l’Australian National University de Canberra en Australie. Toutes ces collaborations donneront ou ont déjà donné lieu à des publications (les études publiés sont référencées ci-dessous). Nous avons choisi de ne pas insérer ces travaux dans ce document puisqu’elles n’ont pas un lien direct avec mon sujet de recherche.
Human herpesvirus 6B immediate early I protein contains functional HLA-A*02, A*03 and B*07 class I-restricted CD8+ T cell epitopes.
Iampietro M, Morissette G, Gravel A, Dubuc I, Rousseau M, Hasan A, O'Reilly RJ, Flamand L.
Eur J Immunol. 2014 Sep 22. doi: 10.1002/eji.201444931, PMID : 25243920.
Platelets release mitochondria serving as substrate for bactericidal group IIA-secreted phospholipase A2 to promote inflammation.
Boudreau LH, Duchez AC, Cloutier N, Soulet D, Martin N, Bollinger J, Paré A, Rousseau
M, Naika GS, Lévesque T, Laflamme C, Marcoux G, Lambeau G, Farndale RW, Pouliot
M, Hamzeh-Cognasse H, Cognasse F, Garraud O, Nigrovic PA, Guderley H, Lacroix S, Thibault L, Semple JW, Gelb MH, Boilard E.
Blood. 2014 Oct 2;124(14):2173-83. doi: 10.1182/blood-2014-05-573543. Epub 2014 Jul 31. PMID: 25082876.
Influenza virus H1N1 activates platelets through FcγRIIA signaling and thrombin generation.
Boilard E, Paré G, Rousseau M, Cloutier N, Dubuc I, Lévesque T, Borgeat P, Flamand L. Blood. 2014 May 1;123(18):2854-63. doi: 10.1182/blood-2013-07-515536. Epub 2014 Mar 24. PMID: 24665136
Chapitre 1 : Introduction
Le système immunitaire est un ensemble coordonné d’éléments de reconnaissance et de défense permettant à notre organisme de lutter contre différents types d’agressions et d’éliminer les pathogènes auxquels il est confronté. Le système immunitaire est constitué des réponses immunes innées et adaptatives pour faire face aux différentes infections. L’immunité innée, également appelée immunité naturelle, est la première ligne de défense contre les agents pathogènes auxquels notre organisme est confronté, une fois qu’ils ont traversé les barrières naturelles comme la peau et les muqueuses. Les agents pathogènes qui sont rencontrés fréquemment par notre organisme n’engendrent que très occasionnellement des maladies. Dans la plus part des cas, ils sont détectés et éliminés très rapidement (minutes ou heures) par les cellules qui constituent l’immunité innée comme les macrophages et les granulocytes. Cependant, les pathogènes ont développé des stratégies leur permettant parfois d’échapper aux mécanismes de défense de l’immunité innée et d’établir un foyer infectieux à partir duquel ils peuvent s’étendre. Dans ces circonstances, la réponse immune innée, même si elle n’a pas réussi à éliminer le pathogène, sert à préparer la réponse immune adaptative qui prend plusieurs jours pour se développer. Le système immunitaire adaptatif est plus efficace que le système inné pour éliminer les pathogènes et les infections et permet ainsi à notre organisme de neutraliser un pathogène ayant réussi à déborder la première ligne de défense. Le système immunitaire adaptatif est apparu chez les vertébrés et dépend des capacités de reconnaissances très spécifiques des lymphocytes (lymphocytes B et T) qui reconnaissent spécifiquement un pathogène, grâce à leurs récepteurs de surface, et concentrent sur lui la réponse immunitaire. Contrairement à la réponse immunitaire innée, la réponse immunitaire adaptative établit une mémoire immunologique qui permet à notre organisme d’éliminer plus rapidement un pathogène auquel il a déjà été confronté. Les lymphocytes B et T, cellules primordiales pour l’immunité adaptative, proviennent de la moelle osseuse mais se développent dans des zones différentes de notre organisme. Ainsi, les lymphocytes B (B pour bourse de Fabricius lieu de maturation des cellules B chez les oiseaux) se développent dans la moelle osseuse alors que les lymphocytes T se développent dans un organe appelé thymus (T pour thymus) où ils acquièrent les caractéristiques leur permettant de remplir adéquatement leur fonction de défense.1
1.1 Le thymus
1.1.1 Caractéristiques du thymus
Le thymus est un organe lymphoïde primaire situé dans la partie antéro-supérieure du thorax, juste au-dessus du cœur, et est le site de développement des précurseurs des lymphocytes T appelés thymocytes.2 Le thymus fournit un environnement qui est nécessaire pour le développement et la sélection des thymocytes afin qu’ils deviennent des lymphocytes T matures naïfs compétents et tolérants à nos propres antigènes.3 Les souris nude ou bien encore les personnes atteintes du syndrome de Di George ont mis en lumière l’importance du thymus dans le développement des lymphocytes T. En effet, dans ces deux cas le thymus est absent ou détérioré ce qui se traduit par un défaut de production des lymphocytes T 4,5 et conduit donc à un déficit immunitaire sévère.
Chez l’homme, le thymus est un organe qui est totalement développé dès la naissance. La production de lymphocytes T matures naïfs par le thymus est maximale avant la puberté. À partir de la puberté, l’involution du thymus débute et se poursuit pour le reste de la vie. Ce phénomène se traduit par une perte des cellules épithéliales thymiques, peu à peu remplacées par du tissu adipeux. De plus, l’involution s’accompagne d’une diminution progressive de la production de nouveaux lymphocytes T matures naïfs.6
1.1.2 Formation du thymus
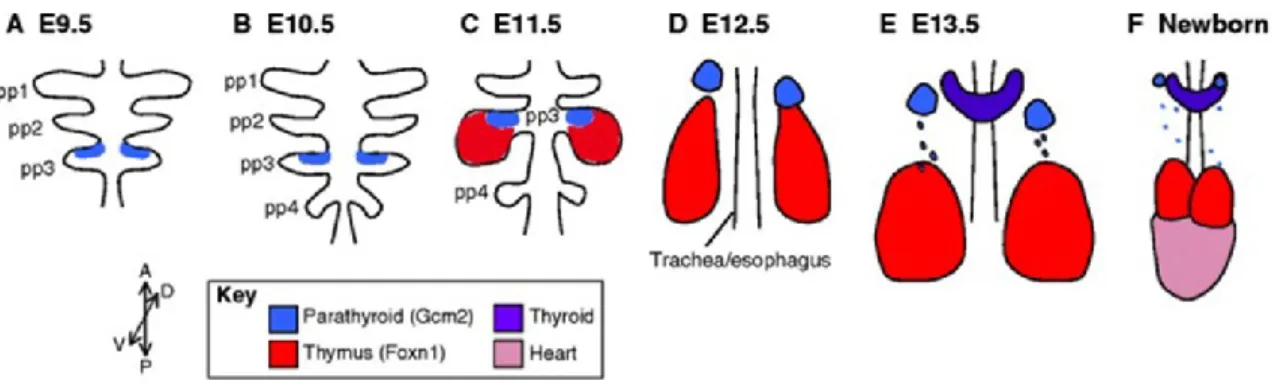
Deux excroissances apparaissent suite à la prolifération de l’endoderme des 3èmes poches pharyngiennes lors du 11ème jour de vie embryonnaire chez la souris. L’expression du gène Gcm2 dans une région délimité permet la formation des glandes parathyroïdes alors que la forte expression du gène Foxn1 conduit à la formation du thymus à partir des 2 excroissances. Entre le 12ème et le 13ème jour, les zones exprimant les gènes Gcm2 ou Foxn1 se séparent du pharynx et également entre elles. Les ébauches thymiques migrent alors vers leurs localisations définitives (il en est de même pour les ébauches de la glande parathyroïde) où elles vont fusionner et ainsi donner un organe bilobé situé dans la partie antérieur du thorax, en dessous de la glande thyroïde et au-dessus du cœur 7,8 (Figure 1).
Figure 1 : Développement du thymus murin. Les axes antérieurs (A), postérieurs (P),
dorsaux (D) et ventraux (V) sont indiqués par les flèches. Tirée de Gordon et al.9.
Chez l’homme, deux excroissances apparaissent également suite à la prolifération de l’endoderme des 3èmes poches pharyngiennes à la fin de la 4ème semaine de vie embryonnaire. À la moitié de la 8ème semaine les ébauches thymiques se séparent du pharynx (ainsi que les ébauches des glandes parathyroïdes) et migrent vers leurs localisations définitives où elles vont fusionner pour donner un organe bilobé situé en dessous de la glande thyroïde, au-dessus du cœur dans la partie antérieure du thorax 10 (comme pour la souris).
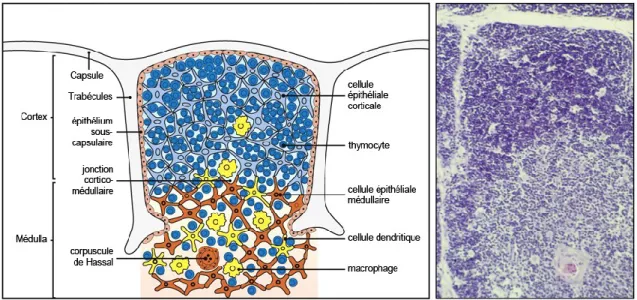
1.1.3 Morphologie du thymus
Le thymus est constitué de nombreux compartiments, appelés lobules, constitués de deux régions distinctes : une région externe appelée cortex thymique et une région interne appelée médulla thymique (Figure 2). Chez la souris, les compartiments corticaux et médullaires sont observés dès le 12ème jour de vie embryonnaire. La formation initiale de ces deux compartiments est indépendante des thymocytes. Cependant, le développement plus tardif du thymus fœtal (à partir du 15ème jour de vie embryonnaire), du thymus postnatal ainsi que le maintien de l’organisation thymique sont dépendants des interactions entre les thymocytes et les cellules épithéliales thymiques.7,8,11 Chez l’homme, le développement de la médulla thymique a été observé à partir de la 8ème semaine et des compartiments corticaux et médullaires distincts sont observés aux alentours de la 16ème semaine.10
Figure 2 : Organisation du thymus humain. Le cliché à droite montre une coupe du
thymus humain, coloré à l’hématoxyline-éosine. Le cortex a une coloration foncée ; la médulla est faiblement colorée. Cliché de C.J. Howe. Adaptée de Janeway’s Immunobiology.1
1.2 Les thymocytes
1.2.1 Origine
Les thymocytes se développent dans le thymus à partir de précurseurs dérivant du foie fœtal (au début du développement embryonnaire) et ensuite des cellules souches hématopoïétiques de la moelle osseuse.12-14
1.2.2 Migration dans le thymus
La migration des précurseurs des thymocytes dans le thymus se déroule selon au moins deux mécanismes ; un mécanisme indépendant de la vascularisation se déroulant tôt lors de l’embryogénèse et un mécanisme dépendant de la vascularisation ayant lieu plus tardivement ou cours du développement lorsque le thymus devient vascularisé.
La migration des précurseurs des thymocytes indépendante de la vascularisation se fait par chimiotaxie. Deux chimiokines et leurs récepteurs, CCL21/CRR7 et CCL25/CCR9, ont été décrits comme étant impliqués dans la colonisation du thymus fœtal.15
Dans le thymus vascularisé, les précurseurs des thymocytes qui pénètrent dans le parenchyme thymique sont essentiellement trouvés au niveau de la jonction cortico-médullaire,16 une zone du thymus où la vascularisation est bien développée, suggérant que ces précurseurs pénètrent par transmigration du sang vers le parenchyme thymique. Ainsi, il a été décrit que l’interaction entre la P-sélectine (exprimée par l’endothélium thymique) et son ligand le PSGL-1 (exprimé par les précurseurs des thymocytes) est nécessaire pour l’ensemencement du thymus par les précurseurs des thymocytes.17,18 Les molécules VCAM-1 et ICAM-1 (exprimées sur l’endothélium thymique) qui interagissent respectivement avec leurs récepteurs 41 et L2 (exprimés par les précurseurs issus de la moelle osseuse) ainsi que les récepteurs CCR7 et 9 et leur ligands respectifs les chimiokines CCL21 et CCL25 sont également impliqués dans la colonisation du thymus vascularisé.18-21
1.2.3 Les différents types de thymocytes
Dans le thymus on distingue deux types de thymocytes ; les : et les :. Ces 2 types de thymocytes sont formés à partir d’un précurseur commun. Cependant les lymphocytes T issus de ces 2 types de thymocytes se distinguent entre eux par le type d’antigène qu’ils reconnaissent, les corécepteurs exprimés à leurs surfaces (les : n’expriment pas le CD4 et le CD8) et leurs localisations anatomiques périphériques. En effet les lymphocytes T : sont principalement localisés au niveau des épithéliums intestinaux, de la peau, de la langue et des poumons où ils fonctionnent comme une première ligne de défense alors que les lymphocytes T :, dit conventionnelles et ayant un rôle prépondérant dans la réponse immunitaire adaptative, sont principalement localisés au niveau des organes lymphoïdes secondaires.1 Pour le reste de cette introduction, mais également pour les travaux réalisés au cours de mon doctorat, nous nous intéresserons uniquement aux thymocytes : que j’appellerai thymocytes dans le reste du document pour des raisons de simplicité.
1.2.4 Développement des thymocytes
Le thymus offre un microenvironnement spécialisé et organisé pour la maturation des thymocytes. Ce microenvironnement, constitué de cellules épithéliales, délivre des signaux nécessaires à la maturation optimale des thymocytes. Cependant, cette communication n’est
pas unidirectionnelle. En effet, l’utilisation de souris, ayant un blocage très précoce dans la différenciation des thymocytes a permis de montrer que la différenciation des thymocytes contrôle le développement du stroma thymique.22 Elle permet en premier lieu au microenvironnement cortical de s’établir, ce qui est un prérequis pour la mise en place subséquente du microenvironnement médullaire.22
Dès leur entrée dans le thymus au niveau de la jonction cortico-médullaire,16 les précurseurs issus de la moelle osseuse reçoivent des signaux les orientant vers la lignée des cellules T. En effet, ces précurseurs sont multipotents et peuvent donner naissance à des cellules de différentes lignées selon les signaux qu’ils reçoivent.
Le signal Notch a été décrit comme étant particulièrement important. En effet, une étude faite chez la souris a montré que la perte de Notch1, un récepteur de surface, sur les précurseurs hématopoïétiques conduit à un thymus avec un compte cellulaire réduit contenant principalement des cellules B.23 Une autre étude a montré que l’expression constitutive de Notch1 actif dans les cellules souches hématopoïétiques conduit à un développement extrathymique de lymphocytes T ainsi qu’à une suppression du développement des lymphocytes B dans la moelle osseuse.24 Ces résultats indiquent donc que Notch1 est requis seulement dans le thymus afin d’orienter les précurseurs de la moelle osseuse vers la lignée des lymphocytes T.
Chez les mammifères, 5 ligands du récepteur Notch ont été identifiés. Ces ligands sont séparés en 2 familles soit les Jagged (Jag1 et 2) et les Delta-like (DLL1, 3 et 4).25 Les souris déficientes pour les ligands Jag1 et 2 n’ont pas de déficiences graves dans le développement des cellules T.26,27 De plus, l’inactivation conditionnelle de DLL1 dans les thymocytes et/ou dans les cellules épithéliales thymiques n’affecte pas la maturation des thymocytes.28 Finalement, l’utilisation de souris DLL4-floxed:Foxn1-Cre, a montré que l’inactivation de DLL4 dans les cellules épithéliales thymiques conduit à un blocage total du développement des thymocytes et à une accumulation de lymphocytes B dans le thymus.29,30 Ces résultats démontrent donc que les précurseurs de la moelle osseuse ont besoin d’un signal Notch1-DLL4 à l’intérieur du thymus pour s’engager dans la lignée des lymphocytes T. L’interaction entre Notch et son ligand induit l’exposition de sites intracellulaires sensibles aux clivages protéolytiques. Ce clivage permet la génération et la
translocation au noyau d’un fragment intracellulaire de Notch (appelé ICN) qui agit comme un facteur de transcription et régule l’expression de gènes cibles primordiaux (notamment GATA-3 et CD25) pour l’orientation vers la lignée des lymphocytes T.
Le développement des thymocytes nécessite différents processus de sélections qui permettent l’élimination de ceux qui sont inutiles ou dangereux pour notre organisme. Ces processus de sélections sont particulièrement draconiens puisqu’environ 98% des thymocytes qui se développent dans le thymus sont éliminés par apoptose.31,32 L’expression de différents marqueurs à la surface des thymocytes est modulés au cours de leur maturation ce qui reflète leur stade de développement. De manière générale, le développement des thymocytes est divisé en 3 stades communément appelés le stade double négatif (DN), le stade double positif (DP) et le stade simple positif (SP). Cette classification que nous allons voir un peu plus en détail dans les prochaines sections est basée sur la présence ou non des corécepteurs CD4 et CD8 du récepteur des lymphocytes T (TCR).
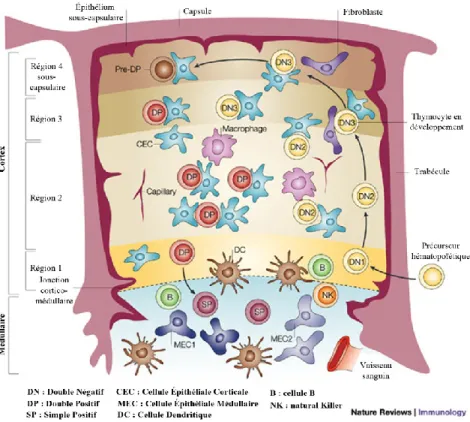
Figure 3 : Localisation des thymocytes dans le thymus selon leur stade de développement. Adaptée de Blackburn et al.7.
Selon leur stade de développement, les thymocytes sont localisés dans des zones spécifiques du thymus afin d’y recevoir les signaux nécessaires à leur orientation dans la lignée T, leur développement ou leur sélection (Figure 3).
1.2.4.1 Stade double négatif
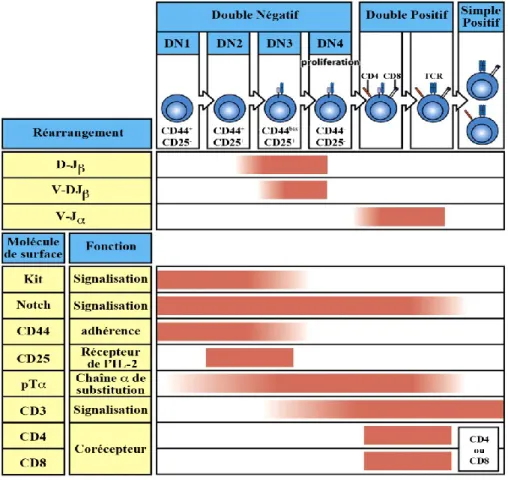
Les thymocytes DN n’expriment pas les corécepteurs CD4 et CD8 du TCR et représentent la population de thymocytes la plus immature. Les DN représentent environ 5% des thymocytes totaux du thymus. Cette population de thymocytes est divisée en 4 autres sous populations, DN1, 2, 3 et 4 selon l’expression des molécules de surface CD44 (molécule d’adhérence) et CD25 (chaine du récepteur de l’IL-2).33 L’expression de Kit (CD117), récepteur du Stem Cell Factor (SCF), à la surface des thymocytes DN est également utilisée, bien que moins fréquemment, pour distinguer ces 4 sous populations (Figure 4).34
Figure 4 : Relation entre le stade de développement des thymocytes, le réarrangement des gènes du TCR et l’expression des protéines de surfaces. Adaptée de Janeway’s
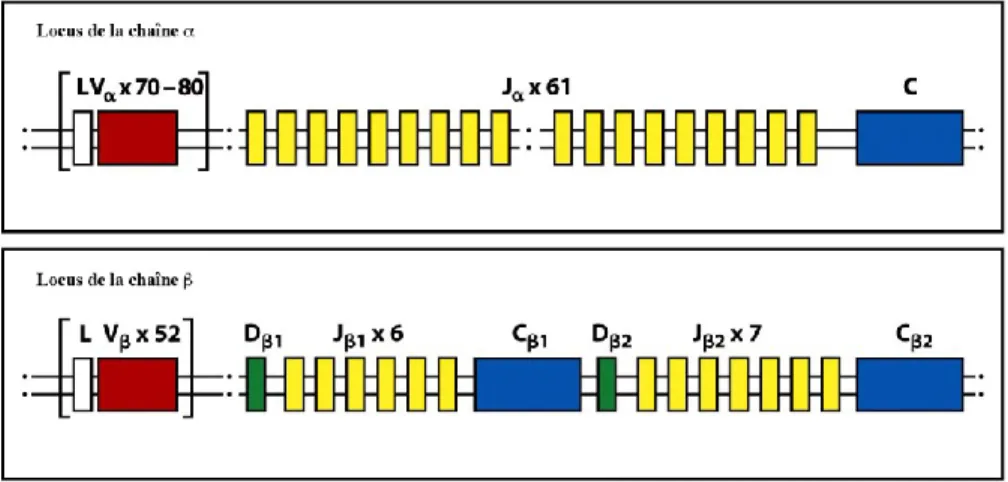
La progression des thymocytes à travers les différents stades DN reflète le réarrangement progressif des différents segments constituants la chaine du TCR afin de former un gène spécifique (Figure 4). Les recombinaisons des différents segments sont assurées par des enzymes appelées recombination-activating gene 1 et 2 (RAG-1 et 2), exprimées dans les thymocytes, permettant le rapprochement et la liaison des différents segments VDJC
(Figure 5).35,36 Ces différentes étapes de maturation des thymocytes DN se déroulent dans le cortex thymique (Figure 3) et ne nécessitent pas la présence d’antigènes.
Les thymocytes DN1 sont CD44+ CD25- Kit+. Dans ces cellules, les gènes des chaines et du TCR sont dans leur conformation germinale et l’accès à la chromatine est restreint. Ces thymocytes évoluent ensuite vers le stade DN2 CD44+ CD25+ Kit+. À ce stade, la chromatine pour les locus de la chaine devient accessible. Dans ces cellules, les enzymes RAG-1 et 2 sont produites et le réarrangement des locus de la chaines du TCR débute par les jonctions des segments D et J. Ceci entraine les thymocytes vers le stade DN3 CD44bas CD25+ kitBas. Le réarrangement se poursuit avec la jonction V et DJ. Les thymocytes restent au stade DN3 jusqu’à ce qu’un réarrangement productif de la chaine du TCR ait lieu. Si aucun réarrangement productif n’a lieu, les thymocytes meurent par apoptose. Il est important de noter que les thymocytes ont plusieurs chances de réaliser un réarrangement productif de la chaine puisque deux groupes de segments D et J existent de part et d’autre des segments C (Figure 5). Lorsqu’une chaine est produite elle s’apparie à une chaine de substitution, appelé pT (pour pré-T-cell ), et aux molécules du CD3 afin de former le pré-TCR. L’expression du pré-TCR à la surface des thymocytes induit la phosphorylation et la dégradation de l’enzyme RAG-2 ce qui arrête le réarrangement des chaines permettant ainsi le phénomène dit d’exclusion allélique. Le pré-TCR envoie un signal de manière constitutive via la protéine kinase cytoplasmique Lck induisant le stade DN4 CD44- CD25- Kit- au cours duquel les thymocytes prolifèrent fortement dans la zone corticale sous capsulaire du thymus (Figure 3). Durant cette phase intense de prolifération, les gènes des enzymes RAG-1 et 2 sont réprimés afin d’éviter que des réarrangements au locus de la chaine aient lieu. Suite à cette phase de prolifération la transcription des gènes RAG-1 et 2 reprend et le complexe RAG-1:RAG-2 s’accumule à nouveau permettant ainsi la recombinaison des locus de la chaine . Ces différentes étapes permettent qu’une chaine
fonctionnelle , exprimée par de nombreux thymocytes suite à l’étape de prolifération, puisse être associée à de nombreuses chaines différentes. Finalement à la fin de cette intense phase de prolifération les thymocytes expriment à leur surface les corécepteurs CD4 et CD8 devenant ainsi des thymocytes DP.1
Figure 5 : Organisation germinale du locus des chaines et du TCR. Adaptée de
Janeway’s Immunobiology.1
Lors de leur transition à travers les différents stades de maturation, les thymocytes DN migrent de la jonction cortico-médullaire (DN1) vers la zone sous capsulaire (DN4)
(Figure 3).16 Différents récepteurs de chimiokines tel que le CXCR4, CCR7 ou bien encore CCR9 semblent impliqués dans cette migration des thymocytes DN.37-39 Il a été montré que des thymocytes DN CXCR4 déficients ne migrent pas au-delà de la jonction cortico-médullaire et ne se différencient pas au-delà des stades DN.37 Une autre étude a montré que les thymocytes DN2 déficient pour le récepteur CCR7 (récepteur des chimiokines CCL19 et CCL21) sont partiellement arrêtés à la jonction cortico-médullaire.38 Il a également été montré que les thymocytes DN2 et 3, dans les souris déficientes pour le CCR9, sont distribués normalement à travers le cortex thymique mais ne s’accumulent pas dans la zone sous capsulaire.39 Le développement des thymocytes DN est donc partiellement arrêté en absence de CCR7 mais se déroule normalement dans les souris déficientes en CCR9.38,39 La relocalisation des thymocytes dirigée par les chimiokines semble donc être essentielle pour une initiation optimale de la maturation mais l’accumulation dans la zone corticale sous capsulaire des DN3 n’est pas nécessaire pour le développement normal des thymocytes.
1.2.4.2 Stade double positif
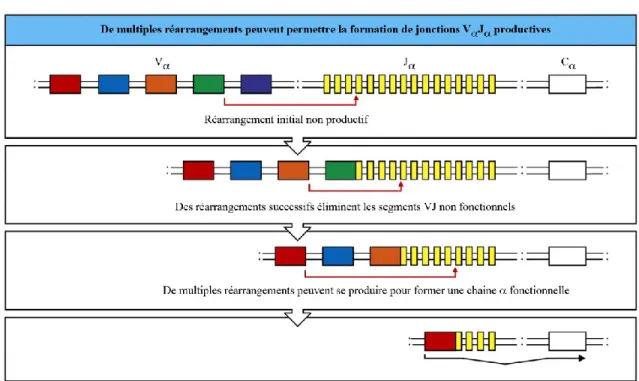
Les thymocytes DP représentent 80 à 90% des thymocytes du thymus et ont une durée de vie d’environ 3 à 4 jours (chez la souris) pendant lesquels ils vont migrer vers le cortex profond du thymus (Figure 3) et réarranger les gènes de la chaine du TCR (Figure 5). Ces réarrangements ont pour but de créer une chaine fonctionnelle qui pourra s’associer à la chaine déjà présente et ainsi former un TCR fonctionnel. Après 3 ou 4 jours, si le thymocyte n’a pas réussi à faire un réarrangement productif, donc permettre la formation d’un TCR fonctionnel, il est éliminé par apoptose. Cependant, un réarrangement non productif de la chaine ne condamne pas irrémédiablement le thymocyte. En effet, il existe de nombreux segments V et J permettant aux thymocytes DP de procéder à de nombreux réarrangements du gène de la chaine jusqu’à ce que l’un d’eux soit productif (Figure 6) et soit sélectionner positivement, induisant alors un signal de survie dans le thymocyte et l’arrêt des réarrangements géniques sur les deux chromosomes. Cette propriété augmente la possibilité que les thymocytes soient sauvés par un réarrangement productif de la chaine du TCR.1
Figure 6 : Des réarrangements successifs sont possibles afin de permettent la formation d’une chaine du TCR. Adaptée de Janeway’s Immunobiology.1
1.2.4.3 La sélection positive
La sélection positive permet la survie des thymocytes reconnaissant un complexe majeur d’histocompatibilité (CMH)-peptide qui leur est présenté par les cellules épithéliales corticales thymiques. À l’inverse, les thymocytes DP qui n’ont pas réussi à produire un réarrangement productif du gène de la chaine du TCR ou qui ont un TCR incapable de reconnaître un complexe CMH-peptide, ne reçoivent pas ce signal de survie et meurent par apoptose (appelé mort par négligence). Environ 90% des thymocytes DP meurent de cette manière.
Contrairement aux lymphocytes B qui reconnaissent directement un antigène natif, les lymphocytes T reconnaissent des fragments de protéines qui sont apprêtées dans des molécules du CMH. L’activation des lymphocytes T dans le contexte d’une réponse à un antigène étranger nécessite la reconnaissance par le TCR du peptide présenté et de la molécule de CMH dans lequel il est apprêté. Les lymphocytes T sont dits restreints aux molécules du CMH. La sélection positive permet donc d’éliminer tous les thymocytes pouvant donner naissance à des lymphocytes T inutiles qui seraient incapable de reconnaître un complexe CMH-peptide antigénique.
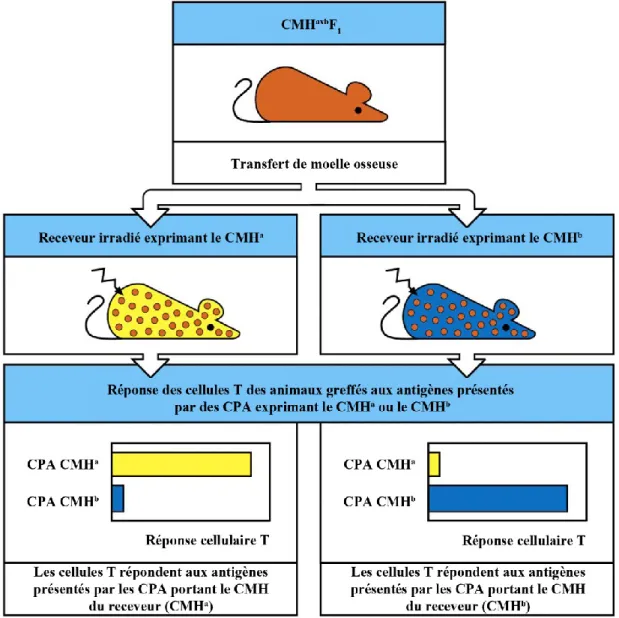
La sélection positive a été démontrée par des études utilisant des souris dont la moelle osseuse a été remplacée par la moelle osseuse de souris donneuses génétiquement identiques mais qui expriment des molécules de CMH différentes (Chimère de la moelle osseuse). Les souris receveuses sont irradiées afin d’éliminer toutes les cellules hématopoïétiques tel que les lymphocytes, les cellules dendritiques, les macrophages et les précurseurs de la moelle osseuse. Suite à la greffe, toutes les cellules dérivant de la moelle osseuse, c’est à dire les lymphocytes et les cellules présentatrices d’antigènes, auront le CMH de la souris donneuse. Le reste des tissus de la souris receveuse, comme le tissu épithélial thymique, porteront le CMH de la souris receveuse. Les souris receveuses utilisées pour démontrer la sélection positive étaient des souris de CMHa ou de CMHb et les souris donneuses étaient des souris hybrides de CMHaxb. Donc ces chimères possédaient des thymocytes capables de reconnaître les molécules de CMHa ou de CMHb, des cellules présentatrices d’antigènes portant les molécules de CMHa et de CMHb, mais un tissu épithélial thymique exprimant soit le CMHa soit le CMHb. À l’aide de ces chimères, les
auteurs ont démontré que les thymocytes CMHaxb qui se développent dans un thymus CMHa reconnaissent principalement, voir même exclusivement, les antigènes présentés par des molécules de CMHa même si les cellules présentatrices d’antigènes présentent dans le thymus ont les deux type de CMH à leur surface.40 Cette étude a donc démontré que le tissu épithélial thymique est responsable de la restriction des lymphocytes T et donc de la sélection positive (Figure 7).
Figure 7 : La sélection positive : mise en évidence à l’aide de souris chimériques.
Suite à l’introduction d’un TCR transgénique, spécifique d’une molécule de CMH connue, l’implication des molécules de CMH dans la maturation des thymocytes a pu être étudiée. Le croissement de souris ayant un TCR transgénique restreint au CMH murin H-2b avec des souris severe combined immunodeficiency (SCID) exprimant le CMH murin H-2d a permis d’obtenir des souris transgéniques H-2b/d et H-2d/d. Chez les souris SCID, les réarrangements des gènes du TCR et des immunoglobulines n’ont pas lieu. Ainsi, en réalisant ce croissement les souris expriment seulement le TCR transgénique en présence de différentes molécules de CMH. Ces études ont montré que les thymocytes progressaient jusqu’au stade DP dans des thymus avec le CMH H-2d/d.41 Cependant, contrairement aux thymocytes présents dans des thymus avec le CMH H-2b/d, ces thymocytes ne dépassent jamais le stade DP et sont éliminés par apoptose 3 à 4 jours après leur dernière division.41,42 L’utilisation de souris transgéniques pour le TCR a montré de manière claire que l’interaction des thymocytes avec une molécule de CMH est nécessaire pour leur survie et la sélection positive.
1.2.4.4 Stade simple positif
Au moment de la sélection positive les thymocytes sont au stade DP et expriment à la fois les corécepteurs CD4 et CD8. À la fin de ce processus de sélection, les thymocytes deviennent SP exprimant soit le CD4 soit le CD8. Des études faites avec des souris ont montré que la spécificité du TCR pour les molécules du CMH détermine la nature du corécepteur qui sera exprimé à la surface des thymocytes SP.43-45 Les thymocytes SP CD4+ portent à leurs surfaces des TCR qui reconnaissent la molécule du CMH de classe II et sont destinés à devenir des lymphocytes qui sécrètent des cytokines (lymphocytes T helper : Th) alors que les thymocytes SP CD8+ portent à leurs surfaces des TCR reconnaissant la molécule du CMH de classe I et sont destinés à devenir des lymphocytes cytotoxiques. Donc, en plus d’éliminer les thymocytes inutiles, la sélection positive oriente le phénotype des thymocytes et leurs futures fonctions.
Plusieurs modèles ont été proposés afin d’expliquer le choix du lignage CD4 ou CD8.46
Le modèle instructif : Dans ce modèle, le TCR reconnaît un complexe CMH-peptide sans l’aide des corécepteurs. Suite à cette reconnaissance le thymocyte est orienté vers le stade
SP adéquat. Ainsi, si le TCR reconnaît un complexe CMH de classe II-peptide le thymocyte réprime l’expression du CD8 et devient SP CD4+ alors que si il reconnaît un complexe CMH de classe I-peptide ceci induit la répression du CD4 et le thymocyte devient SP CD8+.
Le modèle stochastique : Dans ce modèle, la répression des corécepteurs CD4 et CD8 se fait de manière aléatoire. Les thymocytes SP ainsi formés qui reconnaissent un complexe CMH-peptide approprié survivent alors que les autres sont éliminés par apoptose.
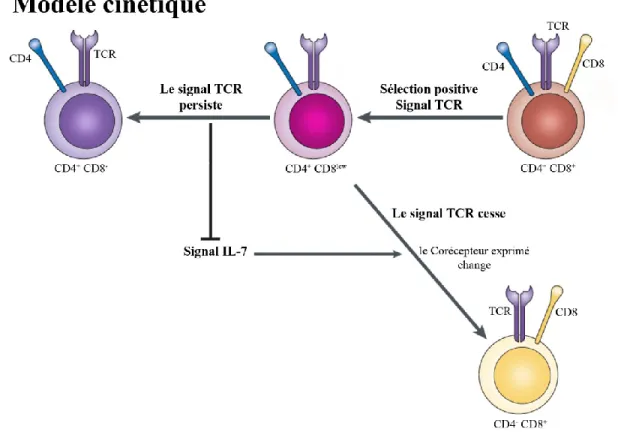
Le modèle cinétique : À l’heure actuelle, ce modèle semble le plus plausible. Il semblerait qu’un thymocyte DP recevant un signal de sélection positive lors d’une première interaction entre le TCR et un complexe CMH-peptide inhibe transitoirement l’expression du corécepteur CD8 donnant ainsi naissance aux thymocytes CD4+ CD8low. Ensuite un deuxième signal passant par le TCR ou le récepteur de l’IL-7 orienterait respectivement le thymocyte vers la lignée CD4+ ou CD8+. Si le TCR positivement sélectionné à la surface du thymocyte est spécifique de la molécule du CMH II, alors le second signal va provenir du TCR, réprimer le signal IL-7 et entrainer une répression totale de l’expression du CD8 orientant ainsi le thymocyte dans la lignée CD4+. À l’inverse, si le TCR positivement sélectionné à la surface du thymocyte est spécifique de la molécule du CMH I, alors le thymocyte recevra le second signal via le récepteur de l’IL-7 ce qui induira une répression total de l’expression du CD4 ainsi qu’une réexpression du corécepteur CD8 orientant ainsi le thymocyte dans la lignée CD8+ (Figure 8).
Alors que les thymocytes DP sont présents dans le cortex thymique, les thymocytes SP sont localisés dans la médulla thymique. Suite à la sélection positive les thymocytes migrent rapidement vers la médulla.47 Le passage du stade DP vers le stade SP corrèle avec une augmentation de la quantité d’ARN messager du récepteur CCR7 48,49 ainsi qu’une augmentation de son expression à la surface des thymocytes.50 Les ligands du CCR7, les chimiokines CCL19 et 21, sont quant à eux produits essentiellement par les cellules épithéliales de la médulla thymique.50,51 Les thymocytes DP positivement sélectionnés qui vont devenir SP sont donc attirés par chimiotaxie via le récepteur CCR7 et les chimiokines CCL19 et 21 dans la médulla thymique.50
Figure 8 : Le modèle cinétique pour l’orientation des thymocytes dans la voie CD4+ ou
CD8+. Adaptée de Singer et al.46.
1.2.4.5 La sélection négative
La sélection négative est un processus de sélection permettant l’élimination par apoptose des thymocytes autoréactifs qui reconnaissent avec une trop forte affinité des complexes CMH-peptide du soi. L’apoptose est déclenchée dans ces cellules selon la force du signal transmis par le TCR. Un signal fort induit le déclenchement du processus apoptotique et donc l’élimination des thymocytes concernés. Ceci évite que leur activation produise des effets délétères, si suite à la maturation, ils venaient à rencontrer les mêmes complexes CMH-peptide du soi en périphérie. C’est ce qui est appelé la tolérance centrale.
La sélection négative a été démontrée grâce à l’utilisation de souris exprimant un TCR transgénique spécifique d’un peptide d’une protéine du soi exprimée seulement chez les souris mâles. Cette étude a montré que les thymocytes portant ce TCR transgénique
disparaissent au stade DP et qu’aucun thymocyte SP mature portant ce TCR transgénique n’est détecté chez les mâles. Cependant, chez les souris femelles qui n’expriment pas cette protéine du soi, les thymocytes portant ce TCR transgénique se développent normalement.52
Bien que certaines études suggèrent que la sélection négative puisse se dérouler dans le cortex thymique, la médulla thymique reste le site privilégié et spécialisé pour éliminer les thymocytes autoréactifs.31 Plusieurs études ayant montré que la sélection négative pouvait avoir lieu dans le cortex thymique ont utilisé des souris transgéniques pour un TCR donné. Bien que ces souris soient des outils très utiles pour comprendre la sélection négative, les différents processus qui se déroulent dans ces souris ne reflètent pas exactement ce qui se passe dans un animal normal. En effet, contrairement aux thymocytes normaux, les thymocytes de ces souris transgéniques expriment très tôt au cours de leur développement une grande quantité de TCR fonctionnels. Cette expression très précoce des TCR (H-Y, spécifique d’un antigène mineur d’histocompatibilité présent uniquement chez les mâles) transgéniques induit une délétion clonale, également très précoce, au stade DN ou DP dans le cortex thymique.52,53 Cependant, lorsque le même TCR transgénique H-Y est exprimé de manière plus physiologique, seulement au stade DP, la délétion clonale a lieu plus tardivement au stade SP lorsque les thymocytes sont dans la médulla thymique.53
La médulla thymique est cruciale pour la tolérance centrale. En effet, des lésions génétiques qui empêchent l’entrée des thymocytes positivement sélectionnés dans la médulla, qui provoquent une sortie prématurée des thymocytes,54,55 qui induisent une désorganisation de l’architecture médullaire 56 ou qui interfèrent dans le développement des cellules épithéliales médullaires thymiques 57-61 (mTEC) induisent l’apparition d’une auto-immunité systémique. Le rôle crucial de la médulla thymique dans l’induction de la tolérance centrale dépend de la présence des cellules présentatrices d’antigènes (CPA) professionnelles tel que les cellules dendritiques ou les macrophages, mais également de l’expression ectopique de très nombreux antigènes normalement restreints à différents tissus de notre organisme (en anglais tissue-restricted antigens (TRA)). Cette expression de TRA dans la médulla thymique est induite par les cellules mTEC via l’action, au moins en partie, d’un facteur de transcription appelé AutoImmune Regulator ou AIRE.62-64 Une déficience en facteur de