Réponse des fibroblastes dermiques humains suite
à un stress génotoxique induit par un régime
d’irradiation chronique aux rayons ultraviolets de
type-B
Thèse
Marie-Catherine Drigeard Desgarnier
Doctorat en biologie cellulaire et moléculaire
Philosophiae doctor (Ph.D.)
Québec, Canada
Réponse des fibroblastes dermiques humains suite
à un stress génotoxique induit par un régime
d’irradiation chronique aux rayons ultraviolets de
type-B
Thèse
Marie-Catherine Drigeard Desgarnier
Sous la direction de :
Résumé court
L’exposition aux rayonnements ultraviolets (UV) solaires est un facteur de risque puisqu’ils induisent des dommages sur l’ADN responsables des mutations signatures retrouvées dans les cancers cutanés. Les principaux dommages induits sont les dimères cyclobutiliques de pyrimidine (CPD) et les photoproduits 6-4 de pyrimidine pyrimidone (6-4 PP). Étant très mutagènes, la cellule a mis en place des mécanismes de protection afin d’éliminer le dommage avant la survenue de mutations. La voie de réponse au dommage (DDR) est activée suite à une agression aux UV afin de détecter et signaler le dommage à la voie signalétique appropriée (réparation, mort cellulaire). La voie DDR est bien définie après une exposition à une dose unique d’UV, mais les conséquences d’une irradiation chronique aux UV (CLUV) et sa pré-stimulation précédant une dose unique sont méconnues.
Nos résultats attestent que la CLUV impacte différemment le cycle cellulaire et la voie de réparation comparée à une dose unique d’UV. De même, elle induit des changements transcriptomiques et protéomiques affectant différentes voies de la DDR. Nous avons aussi démontré que la pré-stimulation par la CLUV améliore la réparation des CPD bien que le traitement CLUV induise des CPD résiduels. Cette augmentation de réparation est confirmée par l’augmentation du niveau de DDB2 et XPC au niveau de la chromatine, deux protéines essentielles dans la reconnaissance du dommage induit par les UV. Finalement, nos analyses confirment la persistance et la tolérance des CPD résiduels dans le génome s’accumulant préférentiellement dans l’hétérochromatine et semblent favoriser l’instabilité chromosomique.
Ces données permettent de démontrer les conséquences d’un conditionnement cellulaire sur la modulation de différents mécanismes cellulaires, apportant indéniablement un apport dans la compréhension de la néoplasie induite par les UV.
Résumé long
L’exposition aux rayonnements ultraviolets (UV) solaires est un facteur de risque pour l’Homme puisque ces rayons sont responsables de l’induction des cancers de peau. En effet, les UV font partis des agents génotoxiques compromettant l’intégrité de l’ADN, ce qui aboutit à des modifications dans sa structure par dimérisation des pyrimidines. Ces dimérisations de base induisent des modifications conformationnelles, qui sont la conséquence de déformations dans l’ADN. Les deux types de dommages induits par les UV sont les dimères cyclobutiliques de pyrimidine (CPD) et les photoproduits 6-4 de pyrimidine pyrimidone (6-4 PP). Ces dommages sont impliqués dans la mutagénèse par l’induction de mutations signatures retrouvées dans les cancers cutanés. Il est donc primordial de comprendre le devenir de ces dommages et leurs conséquences sur le génome.
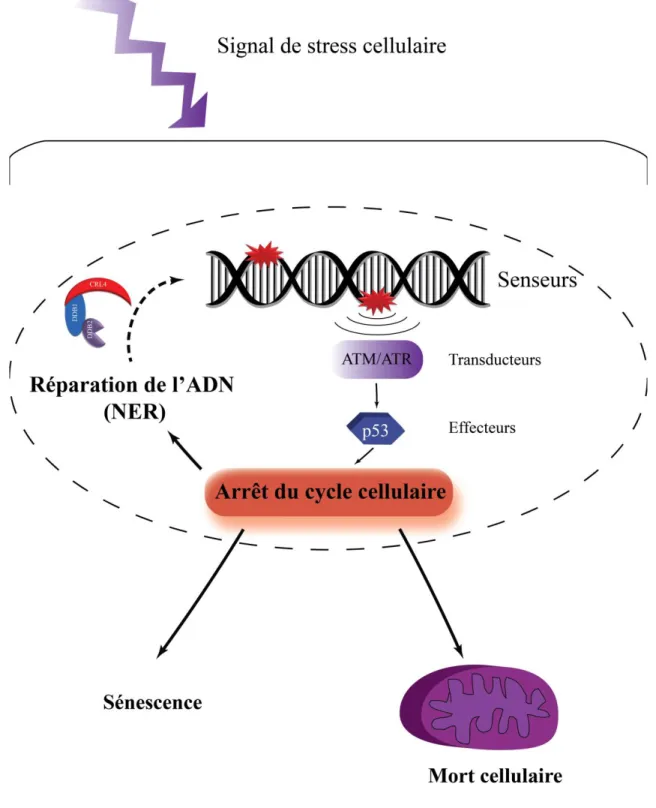
Néanmoins, la cellule a mis en place des mécanismes de protection afin d’éliminer le dommage avant la genèse de mutations. En effet, ils permettent l’activation de la voie de réponse cellulaire aux dommages (DDR) afin d’y être détectés et signalés par une voie signalétique appropriée. Dépendamment de la gravité et de la quantité de lésions sur l’ADN, la cellule décide soit d’entrer en processus de réparation de ces dommages, ou de les éliminer par la voie de mort cellulaire appropriée. Tandis que l’activation et les conséquences cellulaires de ces voies sont bien étudiées dans la littérature après des irradiations avec des doses uniques d’UV, nous sommes en réalité physiologiquement exposés à des doses chroniques répétées d’UV (CLUV). Nous ne connaissons pas l’influence de cette exposition chronique sur les différentes voies de la DDR, et nous pouvons nous questionner si les cellules sont capables d’améliorer leur réponse cellulaire après avoir été pré-stimulées par la CLUV préalablement à une dose unique d’UV. Ainsi, dans le cadre de cette thèse, nous avons étudié les différences possibles d’activation et de régulation de la voie DDR entre une dose unique d’UV, une CLUV, et une pré-stimulation par la CLUV, en analysant plus spécifiquement la voie de réparation par excision de nucléotides (NER), activée après des dommages induits par les UV.
Dans un premier temps, nous avons développé un modèle d’irradiation CLUV afin d’en étudier l’impact sur les mécanismes principaux de la voie DDR et de comprendre les changements potentiels d’un tel conditionnement. Nos résultats démontrent que la CLUV affecte différemment le cycle cellulaire et la NER comparé à une dose unique d’UV. De plus, la CLUV induit des changements autant au niveau transcriptomique que protéomique, mettant en lumière l’importance de connaître les conséquences associées de cette irradiation. En somme, nos résultats confirment qu’il existe une réponse de la voie DDR modulable et que celle-ci dépend du régime d’irradiation aux UV utilisé.
Par la suite, nous nous sommes particulièrement intéressés à la régulation de la NER, mécanisme principal activé après la signalisation du dommage. Nous avons établi que la CLUV induit des CPD qui ne sont pas réparés (CPD résiduels), mais qu’à l’inverse, la pré-stimulation permet d’améliorer de près de 6 fois la vitesse de réparation des dommages nouvellement induits, par rapport aux cellules recevant seulement une dose unique de rayons UVB. Par ailleurs, nous avons examiné le niveau protéique de DDB2 et XPC, deux protéines impliquées dans la reconnaissance des dommages induits par les UV (CPD et 6-4 PP), afin de quantifier leur régulation suite à un conditionnement par la CLUV. Nos analyses démontrent que DDB2 et XPC sont entre 2 et 3 fois plus abondants au niveau de la chromatine après une CLUV, suggérant un potentiel adaptatif des cellules conditionnées. Enfin, les conséquences des CPD résiduels induits par la CLUV ont été étudiées, et nos analyses attestent qu’ils sont tolérés dans le génome puisque les cellules sont capables de se diviser même en leur présence. Ces dommages résiduels se retrouvent préférentiellement au niveau de l’hétérochromatine et aux sites dipyrimidiques TT, mais semblent favoriser l’instabilité chromosomique puisque l’on retrouve une augmentation des échanges de chromatides sœurs.
Nos résultats ont permis de lever le voile sur des éléments clefs du conditionnement cellulaire par la CLUV, ainsi que sur le potentiel adaptatif des mécanismes cellulaires impliquées. Finalement, cette thèse est novatrice dans la compréhension et la modulation de la voie DDR selon le régime d’UV utilisé.
Abstract
Ultraviolet (UV) solar exposure is a risk factor for humans since they are responsible for skin cancer induction. UV is a genotoxic agent compromising DNA integrity, resulting in modifications of its structure by pyrimidine dimerization. This dimerization induces conformational changes, which are the consequence of DNA distortion. The two main types of UV-induced DNA damage are the cyclobutane pyrimidine dimers (CPD) and the 6-4 pyrimidine pyrimidone (6-4 PP). Both are involved in mutagenesis by the induction of signature mutations found in cutaneous cancers. Therefore, it is important to understand the fate of these damage and their consequences on the genome.
However, cells have protection mechanisms to eliminate damage before their conversion into mutations. These mechanisms allow the activation of the DNA damage response pathway (DDR) in order to detect and signal the damage using the appropriate signalling pathway. Depending on the severity and the amount of DNA damage, cells will repair them or simply eliminate the cell with damaged DNA using the appropriate cell death pathway. While the activation and cellular consequences of these pathways has been well studied after a single UV dose, in real life, we are more exposed to repeated chronic low UV doses (CLUV). Likewise, we do not know the influence of cell conditioning on the different DDR responses, i.e., are cells able to improve their cellular stress response after a pre-stimulation by a CLUV? Thus, we have studied the differences in the activation and regulation of the DDR pathway after a single UV irradiation, a CLUV treatment, and a pre-stimulation by the CLUV treatment followed by a single UV irradiation. We have analyzed more extensively the nucleotide excision repair (NER) pathway, which is activated after UV-induced DNA damage.
First, we have developed a chronic irradiation protocol to study its impact on the main DDR mechanisms but also to understand the potential changes induced by such a treatment. Our results demonstrate that CLUV differently affects cell cycle and NER compared to a single UV dose. Furthermore, CLUV induces both transcriptomic and proteomic changes, highlighting the importance to determine the consequences associated with a CLUV
irradiation. Our results confirm that the DDR response can be modulated depending on the type of UV protocol used.
Subsequently, we were particularly interested in the NER pathway, which is the main mechanism activated after the damage signalling. We have shown that the CLUV treatment induced CPD that are not repaired, but that CLUV pre-stimulation improve the NER efficiency of newly formed CPD which is up to 6 times faster compared to cells receiving only a single UV dose.
We then studied the protein levels of DDB2 and XPC, two proteins involved in the DNA damage recognition in the NER pathway. We have quantified their regulation following a CLUV treatment. Our analysis shows that DDB2 and XPC are 2 to 3 times more abundant at the chromatin after a CLUV treatment, suggesting an adaptive potential of the NER pathway.
Finally, the consequences of the residual CPD induced by the CLUV treatment have been studied and our analysis shows that they are tolerated in the genome since cells are able to divide even in their presence. These residuals damage are preferentially found at heterochromatin level and at the TT dipyrimidine site, but seem to promote chromosomal instability as we found an increase of sister chromatid exchange.
Our results shed some light of key element regarding cell conditioning by the CLUV treatment as well as the potential adaptive cellular mechanisms involved. Finally, this thesis brings new information in the understanding and the modulation of the DDR pathway according to the use of UV regimen.
Table des matières
Résumé court ... iii
Résumé long ... iv
Abstract ... vi
Table des matières ... viii
Liste des tableaux ... xiii
Liste des figures ... xiv
Liste des abréviations et des symboles ... xvi
Épigraphe ... xix
Remerciements ... xx
Avant-propos ... xxiii
L’ADN, molécule du vivant ... xxvii
Chapitre 1 ... 1
1.1 Le spectre électromagnétique solaire ... 2
1.1.1 Les rayonnements cosmiques du spectre solaire ... 2
1.1.1.1 Les rayonnements ionisants ... 2
1.1.2 Les rayonnements du spectre solaire terrestre ... 3
1.1.2.1 Les rayonnements UV ... 3
1.1.2.2 La lumière visible ... 5
1.1.2.3 Les infrarouges ... 5
1.2 Les conséquences des UV sur la vie terrestre ... 6
1.2.1 Les effets bénéfiques des UV ... 6
1.2.2 Le côté sombre des rayonnements UV... 7
1.2.2.1 Les complications liées à une surexposition ... 7
1.2.2.2 Les cancers cutanés ... 8
1.2.2.2.1 Les mélanomes cutanés ... 8
1.2.2.2.1 Les cancers non-mélanocytaires ... 9
1.3 Les dommages à l’ADN induits par les UV ... 10
1.3.1. Les dommages indirects ... 11
1.3.1.1 L’oxydation ... 11
1.3.1.2 Les 8-oxo-7,8-dihydroguanine ... 12
1.3.2. Les dommages directs à l’ADN ... 13
1.3.2.1 Les photoproduits 6-4 de pyrimidine pyrimidone ... 14
1.3.2.2 Les dimères cyclobutyliques de pyrimidine ... 16
1.4 Les voies de réponses au dommage ... 17
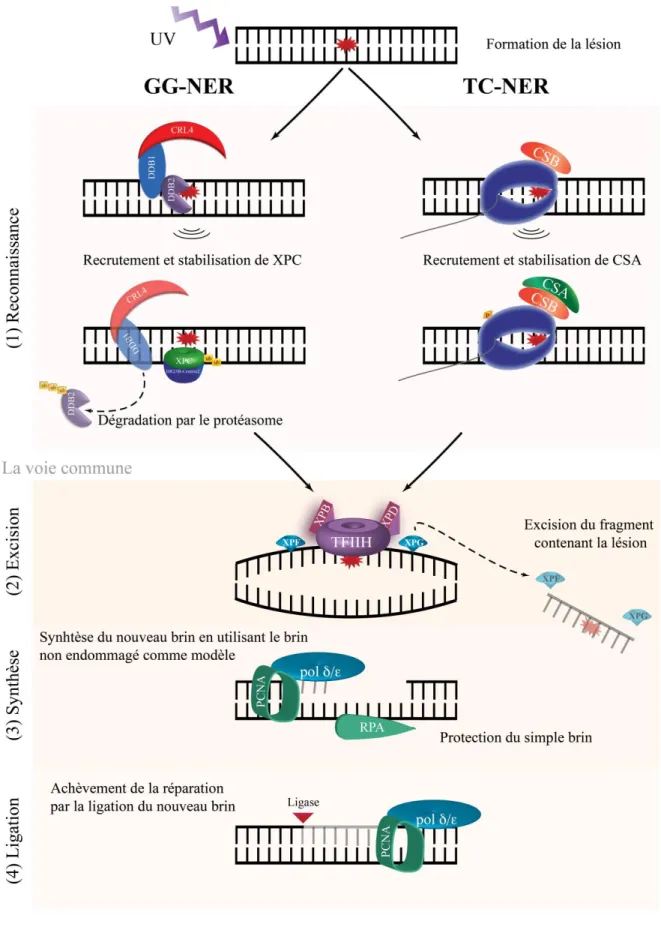
1.4.1 La réparation des dommages induits par les UV ... 19
1.4.1.1 La voie classique : la réparation par excision de nucléotides ... 19
1.4.1.1.1 La réparation TC-NER ... 21
1.4.1.1.2 La réparation GG-NER... 21
UV-DNA damage binding 2 ... 22
Xeroderma pigmentosum group C ... 23
L’excision, la synthèse et la ligation de l’ADN ... 24
1.4.1.3 La voie de secours : la tolérance des dommages ... 26
1.4.2 Le cycle cellulaire ... 27
1.4.2.1 L’arrêt du cycle cellulaire en lien avec la NER ... 28
1.4.3 La mort cellulaire ... 29
1.4.3.1 L’apoptose ... 30
1.4.3.1.1 Les voies caspases dépendantes ... 30
1.4.3.1.2 La voie intrinsèque caspase-indépendante ... 32
1.4.3.1.3 L’apoptose induite par les UV ... 32
1.4.3.2 La nécrose ... 34
1.4.3.2 La nécrose induite en réponse aux dommages ... 34
1.4.4 La sénescence ... 34
1.5 Les conséquences des photo-dommages dimériques persistants ... 35
1.5.1 Les CPD persistants induisent des mutations signatures ... 36
1.5.1.1 La réplication des dommages ... 36
1.5.1.2 La désamination des cytosines ... 36
1.5.2 Les conséquences indirectes des dommages persistants ... 38
1.5.2.1 La régression de la fourche de réplication ... 38
1.5.2.1.1 Les cassures monocaténaires ... 38
1.5.2.1.2 Les cassures bicaténaires ... 39
1.5.2.1.3 Les échanges de chromatides soeurs ... 39
1.6 Les conséquences pathologiques d’une déficience en NER ... 40
1.6.1 Xeroderma Pigmentosum ... 40
1.6.2 Syndrome de Cockayne ... 41
1.6.3 Trichotriodystrophie (TTD) ... 42
1.7 Les organes humains affectés par le rayonnement solaire ... 42
1.7.1 La peau ... 42
1.7.1.1 L’épiderme ... 44
1.7.1.2 Le derme ... 44
1.7.1.3 L’hypoderme ... 45
1.7.1.4 Les réponses cellulaires de la peau contre les attaques UV ... 46
1.7.1.4.1 La réaction des cellules épidermiques suite à une exposition aux UV .. 46
1.7.1.4.2 L’effet des UV sur le derme ... 47
1.7.1.4.3 L’effet des UV sur l’hypoderme ... 47
1.7.2 L’œil ... 48
1.8 Contexte des travaux ... 49
1.9 Hypothèses et objectifs ... 50
1.9.1 Comprendre la réponse au stress après une CLUV ... 51
1.9.2 Étudier l’efficacité de réparation NER après une CLUV... 51
1.9.3 Comprendre les conséquences des dommages persistants induits par la CLUV . 52 Chapitre 2 : Influence of a Pre-Stimulation with Chronic Low-Dose UVB on Stress Response Mechanisms in Human Skin Fibroblasts ... 53
2.1 Résumé en français ... 54
2.3 Résumé en anglais ... 56 2.4 Introduction ... 57 2.5 Matériels et Méthodes ... 59 2.6 Résultats ... 63 2.7 Discussion ... 67 2.8 Références ... 72 2.9 Figures et tableaux ... 78
Chapitre 3 : Enhancement of UVB-induced DNA damage repair after a Chronic Low-Dose UVB pre-stimulation ... 89
3.1 Résumé en français ... 90 3.2 Article ... 91 3.3 Résumé en anglais ... 92 3.4 Introduction ... 93 3.5 Matériel et Méthodes ... 95 3.6 Résultats ... 99 3.7 Discussion ... 102 3.8 Financements ... 106 3.9 Références ... 107 3.10 Figures ... 111
Chapitre 4 : Persistence and tolerance of DNA damage induced by chronic UVB irradiation of the human genome ... 115
4.1 Résumé en français ... 116 4.2 Article ... 117 4.3 Résumé en anglais ... 118 4.4 Introduction ... 119 4.5 Matériel et Méthodes ... 121 4.6 Résultats ... 124 4.7 Discussion ... 127 4.8 Financements ... 131 4.9 Références ... 132 4.10 Figures ... 135 Chapitre 5 : Discussion ... 142
5.1 La CLUV induit une réponse cellulaire dans les NHDF ... 143
5.2 La CLUV affecte les mécanismes de réponse au stress dans les NHDF ... 144
5.2.1 L’apoptose n’est pas le mécanisme principal induit par la CLUV ... 144
5.2.1.1 Dans les NHDF, la mort cellulaire principale induite par les UV n’est pas l’apoptose ... 145
5.2.1.1.1 La résistance apoptotique des NHDF irradiés en dose unique aigüe .. 145
5.2.1.1.1 La résistance apoptotique des NHDF traités par la CLUV ... 149
5.2.1.2 La sénescence comme possible mécanisme de remplacement de la mort cellulaire ... 150
5.2.2 D’autre facteurs pourraient jouer un rôle dans le contrôle de la DDR ... 152
5.2.2.2 Lien entre la régulation du cycle circadien et la CLUV ... 153
5.2.3 Le cycle cellulaire est modifié par un conditionnement CLUV ... 154
5.2.3.1 Le cycle cellulaire est retardé après une CLUV ... 154
5.2.3.1 Les protéines du cycle cellulaire pourraient affecter la voie de réparation de secours ... 156
5.3 Une pré-stimulation par la CLUV induit une réparation plus efficace des dommages ... 157
5.3.1 Les dommages induits par la CLUV ... 158
5.3.2 Les protéines de réparation sont plus abondantes après un conditionnement par la CLUV ... 159
5.3.2.1 Régulation des protéines de réparation ... 159
5.3.3 D’autres facteurs pourraient influencer l’efficacité de réparation ... 160
5.3.3.1 Remodelage de la chromatine ... 160
5.4 La CLUV conduit à des conséquences involontaires sur le génome ... 162
5.4.1 Des CPD résiduels persistent sur l’ADN hétérochromatinien ... 162
5.4.2 Les CPD résiduels et la mutagénicité... 163
5.4.3 Les conséquences d’une CLUV sur l’intégrité génomique... 164
5.5 Vers un modèle plus physiologique ... 166
5.6 Conclusion ... 167
Bibliographie ... 168
Annexe 1 : Implication of ultraviolet light in the etiology of uveal melanoma: a review ... 186
A1.1 Résumé en français ... 187
A1.2 Article ... 188
A1.3 Résumé en anglais ... 189
A1.4 Introduction ... 190
A1.5 Discussion ... 197
A1.6 Remerciements ... 199
A1.7 Références ... 200
Annexe 2 : Faster DNA repair of ultraviolet-induced cyclobutane pyrimidine dimers and lower sensitivity to apoptosis in human corneal epithelial cells than in epidermal keratinocytes ... 207
A2.1 Résumé en français ... 207
A2.2 Article ... 209
A2.3 Résumé en anglais ... 210
A2.4 Introduction ... 211
A2.5 Matériel et Méthodes ... 213
A2.6 Résultats ... 218 A2.7 Discussion ... 224 A2.8 Remerciements ... 228 A2.9 Financements ... 229 A2.10 Références ... 230 A2.11 Figures ... 236
Annexe 3 : Telomere length measurement in different ocular structures; a potential
implication in corneal endothelium pathogenesis ... 247
A3.1 Résumé en français ... 248
A3.2 Article ... 249
A3.3 Résumé en anglais ... 250
A3.4 Introduction ... 251
A3.5 Matériel et Méthodes ... 254
A3.6 Résultats ... 257 A3.7 Discussion ... 260 A3.8 Remerciements ... 266 A3.9 Financements ... 267 A3.10 Références ... 268 A3.11 Figures ... 273
Liste des tableaux
Chapitre 1 :
Tableau 1.1 Liste de certains chromophores retrouvés dans les cellules humaines ... 11
Chapitre 2 :
Table 2.1 List of biological processes deregulated by a CLUV treatment. ... 78 Table 2.2 List of biological processes of the 30 proteins analyzed. ... 79 Table 2.3 Compilation of deregulated genes related to stress response. ... 80 Table 2.4 List of the 30 proteins deregulated and their mass spectrometry characteristics. 81
Chapitre 5 :
Tableau 5.1 Liste des cibles du proteome apoptosis array et leur dérégulation après différents régimes aux UVB ... 148 Tableau 5.2 Liste des gènes associés à différents types de morts cellulaires après une CLUV ... 150 Tableau 5.3 Liste des gènes associés au cycle circadien après un traitment CLUV ... 153
Liste des figures
Chapitre 1 :
Figure 1.1 Représentation graphique du spectre solaire électromagnétique ... 3
Figure 1.2 Représentation schématique des rayonnements ultraviolets ... 4
Figure 1.3 Représentation schématique de la formation d’une 8-oxo-7,8-dihydroguanine par les ROS ... 13
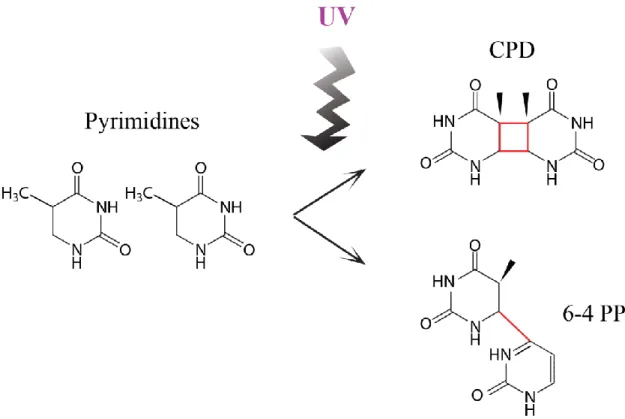
Figure 1.4 Représentation schématique de la formation d’un CPD et d’un 6-4 PP ... 14
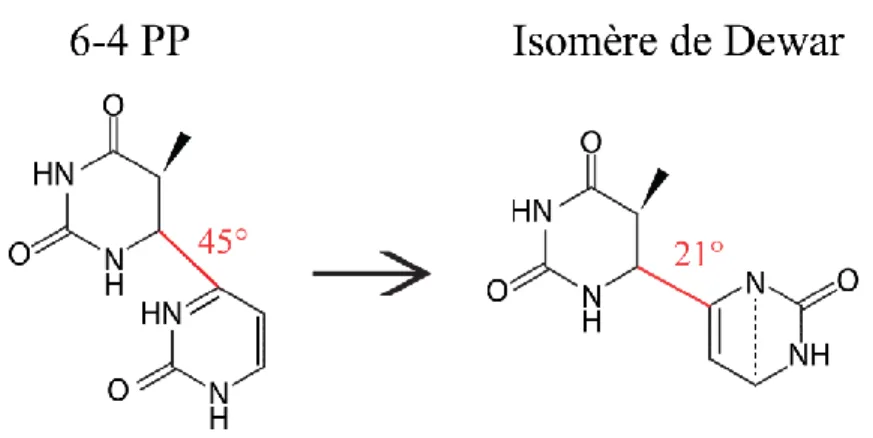
Figure 1.5 Représentation schématique de la formation d’un isomère de Dewar par les 6-4 PP ... 15
Figure 1.6 Représentation simplifiée de la DDR après un signal de stress aux UV ... 18
Figure 1.7 Représentation simplifiée de la NER chez l’Humain et des protéines principales impliquées ... 20
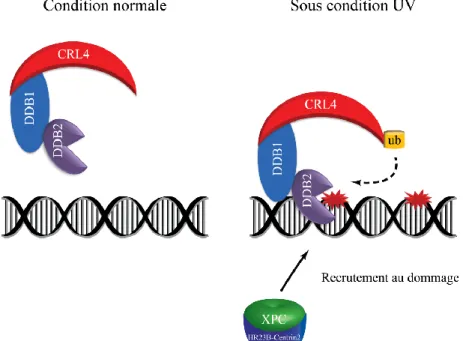
Figure 1.8 Représentation schématique du signal de recrutement de DDB2 et XPC au dommage ... 22
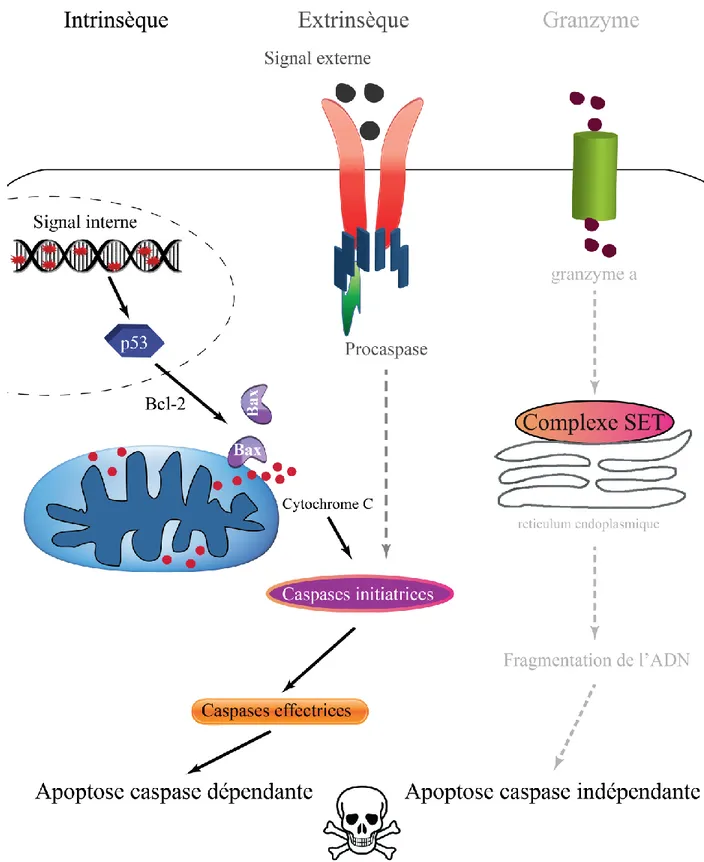
Figure 1.9 Représentation simplifiée des différentes voies apoptotiques et leur principaux acteurs impliqués ... 31
Figure 1.10 Représentation schématique de la réplication en présence d’un site dipyrimidique sous condition normale et UV ... 37
Figure 1.11 Représentation schématique de la pénétrance des UV sur une coupe histologique de peau ... 43
Chapitre 2 :
Figure 2.1 Schematic representation of the irradiation protocol ... 82Figure 2.2 CPD repair rate is enhanced by the CLUV pre-stimulation in NHDF. ... 83
Figure 2.3 Cell division analysis after single UVB and CLUV irradiation ... 84
Figure 2.4 Effect of a CLUV pre-stimulation on UV-induced cell death sensitivity. ... 85
Figure 2.5 CLUV treatment induces transcriptomic changes... 86
Figure 2.6 CLUV treatment induces proteomic changes. ... 88
Chapitre 3 :
Figure 3.1 Repair kinetics of CPD and 6-4 PP induced by UVB irradiation. ... 111Figure 3.2 P53 expression in CLUV treated cells. ... 112
Figure 3.3 DDB2 and XPC gene expression after a CLUV treatment. ... 113
Chapitre 4 :
Figure 4.1 Residual CPD induced by the CLUV irradiation and impact on cellular division
... 136
Figure 4.2 Dilution of residual CPD through DNA replication ... 138
Figure 4.3 Localisation of the residual CPD ... 139
Figure 4.4 Impact of CLUV-induced residual CPD on the accumulation of SCE ... 140
Figure 4.5 Residuals CPD are found at equivalent level in every cell ... 141
Chapitre 5 :
Figure 5.1 Niveau du signal des protéines apoptotiques après différents traitement par les UV ... 146Figure 5.2 Longueur relative des télomères en fonction du régime d’irradiation ... 151
Figure 5.3 Niveaux de p21 et p53s15 suite à un traitement CLUV ... 155
Figure 5.4 Niveaux protéiques de p21 et p53s15 après différents régime d’UVB ... 156
Figure 5.5 Hyperacétylation de H3K9 après un traitement par la CLUV ... 161
Annexe 2 :
Figure A2.1 More CPD are found in corneal explants than in skin explants following a same dose of UV-irradiation but similar levels of CPD are detected in cultured NHEK and HCEC. ... 237Figure A2.2 NHEK are more sensitive to UV-induced cell death when compared to HCEC. ... 238
Figure A2.3 CPD repair, but not 6-4 PP, is more efficient in HCEC than NHEK. ... 240
Figure A2.4 DDB2, XPC and p53 protein levels are higher in HCEC than NHEK. ... 242
Figure A2.5 DDB2, XPC and p53 follow same induction/translocation pattern after UV exposure in NHEK and HCEC. ... 244
Figure A2.6 DDB2 and XPC mRNA levels are lower in HCEC than NHEK. ... 245
Figure A2.7 NER damage recognition proteins DDB2 and XPC are longer-lived in HCEC than NHEK. ... 246
Annexe 3 :
Figure A3.1 Telomere length in different human ocular structures ... 273Figure A3.2 Telomere length in the different cellular layers of the cornea. ... 274
Liste des abréviations et des symboles
1
O2 Oxygène singulet
5-mC 5-méthylcytosine
6-4 PP Photoproduits 6-4 de pyrimidine pyrimidone 8-oxoG 8-oxo-7,8-dihydroguanine
A Adénine
ADN Acide désoxyribonucléique
AMD Age-related macular degeneration
ARN Acide ribonucléique
ATM Ataxia telangiectasia mutated
ATR Ataxia telangiectasia and Rad3 related
Bax Protéine Bcl-2–associated X
Bcl-2 B-cell lymphoma 2
BrdU Bromodésoxyuridine
C Cytosine
CB Fraction liée à la chromatine CBC Carcinome basocellulaire
CDK Kinases dépendantes des cyclines ChiP Immunoprécipitation de la chromatine Chk1 Checkpoint kinase 1
Chk2 Checkpoint kinase 2
CLUV Dose chronique aux UVB
CO2 Dioxyde de carbone
CPD Dimères cyclobutyliques de pyrimidines
CRH Corticolibérine
CRL4 Cullin-RING ubiquitin ligase
CS Syndrome de Cockayne
CSA Syndrome de Cockayne du groupe de complémentation A CSB Syndrome de Cockayne du groupe de complémentation B CSC Carcinome spinocellulaire
CUL4 Culline 4
CUO Centre universitaire d’ophtalmologie DAPI 4',6-diamidino-2-phénylindole
DDB1 UV-DNA damage binding-1
DDB2 UV-DNA damage binding-2
DDR Réponse au dommage à l’ADN
DMEM Dulbecco Modified Eagle Medium
DOT1L DOT1-like histone H3K79 methyltransferase
DSB Cassures double-brin
E. coli Escherichia coli
FACS Fluorescence-activated cell sorting
G Guanine
GG-NER Réparation par excision de nucléotides globale sur le génome
H2O2 Peroxyde d’hydrogène
H3K9 Histone 3 acétylé sur la lysine 9
HCEC Cellules épithéliales de la cornée humaine (annexe 2) HCEC Cellules endothéliales de la cornée humaine (annexe 3) HPLC/MS-MS Chromatographie en phase liquide
HRP Peroxydase du raifort (horseradish peroxidase) IL-33 Interleukine 33
IR Infrarouge
J Joule
J/m2 Joules par mètre carré
LMPCR Réaction de polymérisation médiée par ligation
LTC Confluence à long terme
MDM2 Murine double minute 2
MEC Matrice extracellulaire
NHDF Fibroblastes dermiques humains NHEK Kératinocytes épidermiques humains NER Réparation par excision de nucléotides NF-κB Facteur nucléaire kappa-B
NMSC Cancers non-mélanocytaires
NoUV Non-irradié
O2•- Anion superoxyde
OH- Radical hydroxyle
PARP-1 Poly(ADP-ribose) polymerase-1
PBS Tampon phosphate salin
PCNA Proliferating cell nuclear antigen
PTM Modification post-traductionnelle
Q-PCR PCR quantitative
RH Recombinaison homologue
ROC1 Régulateur de culline 1
ROS Espèces réactives de l’oxygène RPA Protéine de réplication A RPE Épithélium pigmentaire rétinien
RS Sénescence réplicative
S Seconde
SCE Échanges de chromatides sœurs SCC Carcinome spinocellulaire
SEM Erreur standard moyenne
SISP Sénescence prématurée induite par le stress SODM Superoxyde dismutase mitochondriale
T Thymine
TC-NER Réparation par excision de nucléotides couplée à la transcription TFIIH Facteur de transcription II humain
TLS Polymérase translésionnelle
TNF Facteur de nécrose tumorale
TTD Trichothiodystrophie
TTFL Boucle de rétroaction transcription-traduction
UVA Ultraviolets de type-A UVB Ultraviolets de type-B UVC Ultraviolets de type-C XP Xeroderma pigmentosum
XPA Xeroderma Pigmentosum du groupe de complémentation A
XPB Xeroderma Pigmentosum du groupe de complémentation B
XPC Xeroderma Pigmentosum du groupe de complémentation C
XPD Xeroderma Pigmentosum du groupe de complémentation D
XPE Xeroderma Pigmentosum du groupe de complémentation E
XPF Xeroderma Pigmentosum du groupe de complémentation F
XPG Xeroderma Pigmentosum du groupe de complémentation G
XP-V Xeroderma Pigmentosum du groupe de complémentation V
α-MSH Hormone stimulante des mélanocytes
Épigraphe
« Ce n’est pas le vent qui décide de ta destination, c’est l’orientation que tu donnes à ta voile : le vent est le même pour tous » Jim Rohn
Remerciements
« Un compliment est un rayon de soleil verbal » Robert Orben On a souvent tendance à se focaliser sur le négatif, et ne pas prendre le temps de remercier notre entourage pour leur dévouement. Pourtant, le monde serait bien meilleur si on commençait par remercier humblement les personnes qui ont joué un rôle de près ou de loin dans notre accomplissement. Je tiens donc à remercier les personnes ayant contribué à mes 4 ans de doctorat.
Mes premiers remerciements vont en premier lieu à mon directeur de recherche, Dr Patrick Rochette. Si on m’avait dit il y a quelques années que je ferai un doctorat, je ne l’aurais pas cru. Pourtant, vous m’avez donné cette fabuleuse opportunité et je vous remercie pour la confiance que vous m’avez accordée durant tout mon cheminement. Il n’a pas toujours été facile de travailler ensemble, mais cela m’a beaucoup aidé à mettre en valeur mes idées et à les défendre. Nous avons su travailler ensemble et trouver le chemin alternatif pour relever les défis et fournir notre modeste contribution à la communauté scientifique !
Votre caractère et votre dévouement pour la science est remarquable et votre façon atypique de développer un raisonnement scientifique est différente de ce à quoi l’on s’attend, ce qui est très formateur. Vos perceptions et votre sens critique m’ont impressionnée tout au long de mon doctorat. Merci pour votre implication tout au long de mon doctorat.
Je voudrais également remercier tous les membres de mon comité de thèse; Dr Antonio Conconi, Dr Sylvain Guérin, et Dr Jean-Yves Masson. Je vous suis très reconnaissante d’avoir accepté de prendre du temps pour réviser ma thèse. Je suis fière et heureuse de pouvoir compter sur des chercheurs respectés dans mon comité de thèse.
Mon cheminement n’aurait pas été le même sans certains membres de mon équipe : je remercie ainsi notre ancien collègue, Justin, qui lorsque je suis arrivée sans trop d’expérience, m’a « challengé » en me mettant seule devant un bench, livrée à moi-même (en réalité tu n’étais pas loin). Ce sont ces expériences qui rendent les gens plus
persévérants, plus motivés à travailler fort, alors merci ! Également, je remercie Sébastien G d’avoir pris le temps de me former pour la plateforme de profilage, ta patience et ta pédagogie ont été formatrices. Enfin, une dernière personne avec qui j’ai eu la chance de travailler, et qui est devenue plus qu’une collègue à mes yeux, Corinne. Tu es ce genre de force tranquille de la nature, comme on dit dans ma famille « Chi va piano, va sano e
lontano ». Cette phrase te sied à merveille, tu prends le temps de faire les choses
parfaitement, et ça roule. J’ai vraiment appris énormément à travailler avec toi, sur la patience (surtout dans l’écriture de « notre » article !), tu inspires la tranquillité, c’est tellement agréable ! Merci à toi ! J’apprécie également que nous soyons aussi connectés lorsqu’il s’agit de parler de chocolat ! J’ai toujours pensé que le problème venait de moi, mais non, ce sont bien les autres qui ne comprennent pas…
Je remercie également toutes les personnes qui ont participé à rendre la vie de labo parfois plus agréable, merci à Sarah et Marie pour les cours de sport (désolé de vous avoir lâché cette session, la vie fait que parfois…), Merci à Alicia pour les placotages, à Mathieu de toujours sortir des blagues dérangeantes et qui n’ont pas rapport, tu m’as fait beaucoup rire (dès que j’ai compris ton humour).
J’éprouve également de la gratitude envers ma famille, et belle famille, bien qu’elles soient de l’autre côté de l’océan, ils ont su me faire oublier à quelques moments les difficultés de mon quotidien d’étudiante. Je remercie spécialement Pierre-Marie (« mon Dou »), qui, en pleine adolescence apporte à mon attention des sujets bien singuliers qui, sans l’intention de faire rire m’amusaient tout de même.
Finalement, on dit toujours que l’on garde le meilleur pour la fin. Ainsi, je terminerai par François, celui qui est mon tout, à la fois mon meilleur ami, mon amant, mon fiancé, mon mari, le (très futur proche) papa de notre fils (et les autres bébés à venir éventuellement). Telle la cellule qui a besoin d’énergie pour fonctionner, tu es mon carburant (oui, il fallait que je sorte quelque chose de bizarre).
Je ne te remercierai jamais assez pour tous les efforts, tous les compromis que tu as fait pour moi au cours de ces 10 années ensemble. Bien plus encore, lors de nos 4 années de doctorats, tu as su gérer mes absences et mes promesses de ne pas revenir du labo « trop tard », tu m’attendais et même parfois m’accompagnais jusqu’à des heures un peu
indécentes et esclavagistes que je m’imposais. Merci d’avoir été l’un des rares à croire en mes capacités dès le début, et à me pousser à aller de l’avant. Je suis persuadée que sans toi, je ne serais pas arrivée aussi loin dans mon accomplissement professionnel.
Merci d’avoir tenu tant de rôles qui m’ont fait du bien : tu as su me remonter le moral lorsque j’étais désespérée et découragée du labo, tu as su me faire rire de ta tendre naïveté et de ton amour inconditionnel. Lorsque le travail ne fonctionnait pas, je savais que je te retrouverais, toi et le chocolat (disons-le !) et rien que cette pensée me rendait heureuse. Tu es de ces personnes qui ont cette capacité à ne pas ressasser, à ne pas laisser ta vie se définir par des échecs, que tu utilises pour devenir plus fort. C’est tellement inspirant. Je suis très fière de t’avoir dans ma vie. Merci d’être le positif dans ma vie, de m’aimer tout simplement !
Avant-propos
Contribution
Cette thèse de doctorat est écrite sous forme d’insertion d’articles. En conséquence, les chapitres 2 à 4 ainsi que les annexes 1 à 3 sont des articles scientifiques revus par des pairs ou en cours de publication tandis que les chapitres 1 et 5 représentent l’introduction et la discussion. Les articles présentés dans cette thèse n’auraient pas été aussi importants sans l’aide précieuse de collègues. Il m’apparait donc important de reconnaitre et de décrire leur contribution ainsi que la mienne pour chacun des articles.
Chapitre 2
L’article présenté en tant que chapitre 2, intitulé « Influence of a pre-stimulation with
chronic low-dose UVB on stress response mechanisms in human skin fibroblasts », a été
publié dans la revue scientifique PLoS One en mars 2017. Les titres de chaque section ont été traduits en français avant l’insertion de l’article dans cette thèse. Le reste du contenu de l’article est identique à la version publiée.
Pour l’étude présentée dans cet article, nous avons fait appel au Dr. Arnaud Droit ainsi que Frédéric Fournier, pour répondre aux besoins d’analyses informatiques approfondies du profilage génique (Tableau 2.1). De même, nous avons fait appel à un service de protéomique (Applied Biomics) pour analyser nos échantillons (Figure 2.6).
Ma contribution à cet article inclut la mise au point du régime d’irradiation et l’ajustement des protocoles de toutes les techniques présentées. J’ai ainsi réalisé toutes les manipulations, analysé tous les résultats, préparé les figures et écrit la première version complète de l’article. J’ai aussi contribué à la révision des différentes versions de l’article. Dr. Patrick J. Rochette a contribué de manière significative à la révision de toutes les versions de l’article.
Chapitre 3
Le chapitre 3 présente les travaux du manuscrit « Enhancement of UVB-induced DNA
damage repair after a Chronic Low-Dose UVB pre-stimulation » qui sera soumis dans les
prochaines semaines pour publication dans le journal DNA repair.
En ce qui concerne la contribution de chaque auteur, Dr. Patrick J. Rochette a contribué à la relecture et aux révisions de chaque version de l’article. En tant que première auteure, j’ai accomplie toutes les expériences ainsi que l’analyse et la préparation des figures. De plus, j’ai écrit la totalité de la première version de l’article tout en contribuant aux différentes révisions nécessaires pour une version finale.
Dans l’ensemble, je considère ma contribution à cet article à environ 80%.
Chapitre 4
Les travaux présentés dans ce chapitre sont le reflet de l’article intitulé « Persistence and
tolerance of DNA damage induced by chronic UVB irradiations on the human genome »,
qui sera soumis dans les prochaines semaines au journal Mutation Research.
En tant qu’auteur de cet article, Dr. Thierry Douki a contribué à la figure 4.5 par son expertise en chromatographie liquide couplé à un spectromètre de masse. Dr. Patrick J. Rochette a rédigé la première version de l’article. Roxanne Bérubé, en tant que co-première auteure, a participé aux manipulations de la figure 4.2A, B, 4.3A, et 4.4A, B. Elle a aussi participé à la relecture de l’article. Ariane Lechasseur, quant à elle a, contribué à des résultats qui n’ont pas été inclus dans la version finale de l’article.
Concernant ma participation en tant que co-première auteure, j’ai contribué entièrement à la figure 4.1, 4.2C, 4.5, et j’ai été impliqué dans une partie de la récolte des échantillons, des manipulations et l’analyse de la figure 4.2A, B. De même, j’ai pris part à la totalité de la mise au point des techniques ainsi qu’à la récolte des échantillons et l’acquisition d’une partie des images pour la figure 4.4A. Finalement, j’ai participé au montage des figures de l’article ainsi qu’à sa relecture.
Annexe 1
La première annexe « Implication of ultraviolet light in the etiology of uveal melanoma : A
review », est une revue de littérature publiée en 2013 dans le journal Photochemistry Photobiology. Les titres de chaque section de l’article ont été traduits en français dans le
cadre de l’insertion d’article. Cependant, le reste du contenu de l’article est inchangé comparé à la version publiée.
Justin D. Mallet et Dr. Patrick J. Rochette ont participé à la rédaction de l’article et Sébastien P. Gendron et moi-même avons participé à la révision de l’article.
Dans l’ensemble, ma participation à cette revue est de 10%.
Annexe 2
Les travaux présentés dans cette annexe sont le résultat de l’article « Faster DNA repair of
ultraviolet-induced cyclobutane pyrimidine dimers and lower sensitivity to apoptosis in human corneal epithelial cells than in epidermal keratinocytes », qui a été publié en 2016
dans la revue PLoS One. Les titres de chaque section de l’article ont été traduits en français dans le cadre de l’insertion d’article. Cependant, le reste du contenu de l’article est inchangé comparé à la version publiée.
Agissant en tant que premier auteur, Justin D. Mallet a préparé les protocoles et réalisé les manipulations des figures A2.1, A2.3B, A2.3D, A2.4A, A2.4B, et A2.7. De même, il a participé à la récolte d’échantillons pour toutes les figures excepté la figure A2.2. Il s’est occupé de la rédaction complète de la première version de l’article. Marie M. Dorr a réalisé certaines manipulations des figures A2.2, A2.4A, A2.4B, A2.5A-F et a analysé entièrement la figure A2.2. De plus, elle a grandement aidée dans la révision de l’article. Nathalie Bastien a participé à une partie de la figure A2.3A et C, tandis que Sébastien P. Gendron a été impliqué dans des manipulations non publiées. À titre de superviseur, Dr. Patrick J. Rochette a contribué de manière significative aux révisions de l’article avant publication. Pour ma part, en tant que co-deuxième auteure, j’ai grandement contribué aux mises au point de différentes techniques, j’ai pris part aux manipulations des figures A2.2, A2.3A,
A2.3C, A2.4, A2.5D, A2.5G, et j’ai intégralement contribué à la figure A2.6 ainsi qu’à son analyse. De surcroit, j’ai grandement participé à la révision de l’article.
Dans l’ensemble des travaux, ma contribution est de 25%.
Annexe 3
L’annexe « Telomere length measurement in different ocular structures: A potential
implication in corneal endothelium pathogenesis », a été publiée en 2016 dans Investigative ophthalmology & visual science (IOVS). Les titres de chaque section de l’article ont été
traduits en français dans le cadre de l’insertion d’article. Cependant, le reste du contenu de l’article est inchangé comparé à la version publiée.
En tant que co-première auteure, Corinne Zinflou a participé à la mise au point de la technique, aux manipulations de la figure A3.3 ainsi qu’à l’écriture et aux révisions de l’article. Justin D. Mallet et Sébastien P. Gendron ont participé à la banque de données des tissus utilisés dans cet article, tandis que Sébastien J. Méthot a procuré quelques échantillons de tissus lors des révisions de l’article. Dr. Patrick J. Rochette a révisé les versions de l’article.
Concernant ma contribution, j’ai participé à la mise au point de la technique, aux manipulations de la figure A3.1 et A3.2, ainsi qu’à l’écriture et aux révisions de l’article. Ainsi, ma contribution relative pour cet article est d’environ 30%.
L’ADN, molécule du vivant
« L’ADN, le secret de la vie » (James Watson). L’acide désoxyribonucléique (ADN) est la molécule universelle du vivant par excellence. Elle est présente chez tous les organismes qu’ils soient eucaryotes ou procaryotes (Bendich and Drlica, 2000, Vellai and Vida, 1999). Le rôle primordial de cette macromolécule est de stocker et transmettre l’information génétique des cellules-mères aux cellules-filles. En effet, l’ADN contient le matériel génétique constituant le génome, vecteur de la transmission de cette information entre les générations cellulaires (Alberts B et al., 2014). Son rôle indispensable nécessite un bon maintien pour préserver l’intégrité génomique (Jackson and Bartek, 2009).
Néanmoins, l’ADN est une macromolécule faisant perpétuellement face à de nombreuses attaques cellulaires (endogènes) ou externes (exogènes) (De Bont and van Larebeke, 2004, Lindahl, 1993, Rodriguez-Rocha et al., 2011). Il devient alors important de comprendre les mécanismes de protection que la cellule a mis en place afin de protéger l’ADN contre ces agressions.
Le rôle central du génome pour les êtres vivants en fait un sujet d’étude de choix. À travers cette thèse, nous nous concentrons particulièrement sur un mécanisme de réparation qui protège le génome contre la croissance cellulaire incontrôlée menant aux cancers de peau. Nous discuterons essentiellement d’une attaque exogène à laquelle nous sommes quotidiennement exposés : les rayons ultraviolets (UV). Nous étudierons les conséquences de cette exposition, et en particulier l’impact de différentes expositions sur la réponse aux dommages (la tolérance des dommages et le système de réparation par excision de nucléotides [NER pour nucleotide excision repair]), ainsi que l’adaptabilité du système NER.
1.1 Le spectre électromagnétique solaire
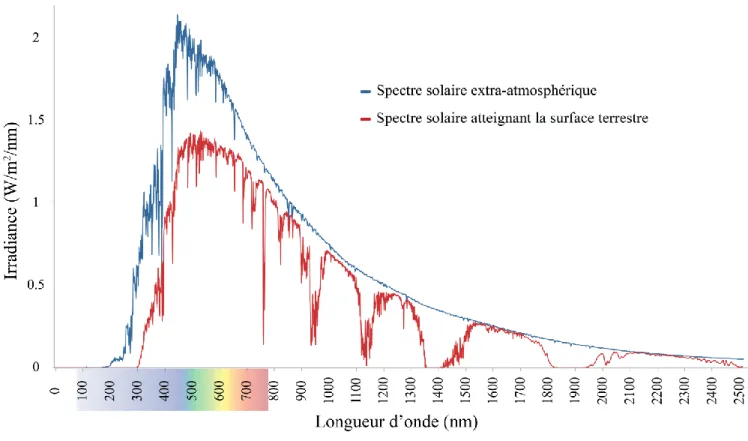
Sur terre, la vie est rendue possible entre autre grâce au soleil qui transmet l’énergie suffisante à toute vie terrestre. Le soleil est la source principale d’énergie lumineuse, thermique et photonique sur terre en émettant des longueurs d’ondes extra-atmosphérique comprises entre 5.10−4 µm et 1000 µm (Gueymard, 2004). Le soleil diffuse un rayonnement électromagnétique qui se décompose en plusieurs émissions : les radiations ionisantes (rayons x et gamma), et les radiations non-ionisantes (ultraviolets, lumière visible, infrarouge). Étant donné que la longueur d’onde et l’énergie sont inversement proportionnelles selon la relation de Planck, les longueurs d’ondes courtes sont les plus énergétiques et peuvent ainsi amener à une instabilité moléculaire dans l’organisme. Néanmoins, une grande partie du spectre solaire est bloquée par la couche d’ozone, et seulement les rayonnements s’étendant de 295 à 1400 nm peuvent atteindre la surface terrestre (Fig. 1.1). Le spectre solaire terrestre peut se décomposer en trois classes distinctes de rayonnements : les ultraviolets (UV) (295–400 nm); la lumière visible (400– 760 nm) ; et les infrarouges (IR) (> 760 nm).
1.1.1 Les rayonnements cosmiques du spectre solaire
1.1.1.1 Les rayonnements ionisantsLes radiations ionisantes sont très énergétiques et sont capables de transmettre leur énergie par ionisation à la matière qu’elles irradient, ce qui les rend extrêmement mutagènes pour les êtres vivants. En effet, leur énergie est suffisante pour créer des dommages à l’organisme irradié, altérant différents constituants qui absorbent cette énergie, telle la molécule d’ADN. Les rayonnements ionisants composent la partie à faible longueur d’onde du spectre solaire (0–100 nm), en conséquence, ils sont complètement bloqués par la couche d’ozone et n’atteignent pas la surface de la terre. Ils sont néanmoins présents artificiellement sur terre due à leurs capacités de transfert énergétique avec la matière cible, ce qui les rend indispensables pour l’imagerie médical et le nucléaire. Ainsi, de nombreuses études scientifiques ont vu le jour pour dénoncer l’effet nocif de ces radiations ionisantes sur les cellules et l’ADN (Azzam et al., 2012,
Braganza et al., 2012, Tubiana, 2009). L’ADN est une cible de choix pour ces radiations, puisqu’elles induisent des cassures bicaténaires, des changements épigénétiques, et des dommages oxydatifs aboutissant à une instabilité génomique (Einor et al., 2016, Szumiel, 2015, Vignard et al., 2013).
Figure 1.1 Représentation graphique du spectre solaire électromagnétique
(adapté de (ASTM, 2003))
1.1.2 Les rayonnements du spectre solaire terrestre
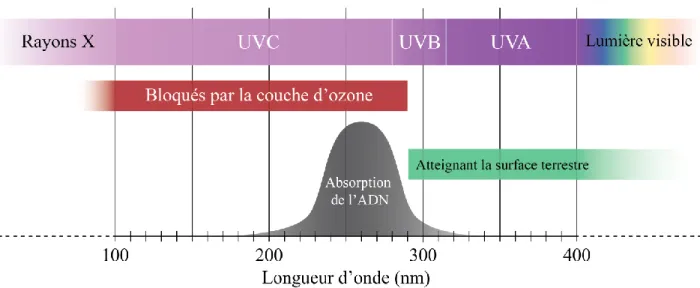
1.1.2.1 Les rayonnements UVLes UV représentent 5.1% du spectre solaire atteignant le niveau de la mer ce qui représente une faible proportion, mais est suffisant pour induire différents effets sur la vie terrestre. Dans le domaine de la photobiologie, les UV sont catégorisés en 3 classes : les UV de type-A (UVA [315–400 nm]), les UV de type-B (UVB [280–315 nm]), et les UV de type-C (UVC) [100–280 nm]) (Diffey, 1991) (Fig. 1.2). Étant donné qu’ils sont dans le spectre à faibles longueurs d’ondes, ils sont très énergétiques, et ont de nombreuses conséquences sur l’organisme. Ces 3 types d’UV ont des rôles bien distincts dans la
réponse biologique que ce soit au niveau tissulaire, cellulaire, ou moléculaire. De plus, lorsque leur longueur d’onde est élevée, les UV ont la capacité de pénétrer dans les tissus. Ceci a été démontré dans les deux organes directement exposés aux UV solaires : la peau et l’œil. Alors que dans la peau, les UVA peuvent pénétrer jusqu’au derme, les UVB et les UVC ne se rendent qu’à la première couche de la peau (D'Orazio et al., 2013). Au niveau de l’œil, notre équipe a démontré que les UVA pénètrent jusqu’aux premières couches de l’iris alors que les UVB et les UVC ne se rendent qu’au niveau de l’épithélium cornéen (Mallet and Rochette, 2013).
Figure 1.2 Représentation schématique des rayonnements ultraviolets
(image adaptée de © JD Mallet) Concernant les UVA, ils peuvent être divisés en 2 classes: Les UVA-1 (340–400 nm) et les UVA-2 (315–340 nm) (Sklar et al., 2013). Les UVA représentent 95% du spectre UV au niveau de la mer (de Gruijl, 2000). Ils sont principalement connus comme étant responsables du photo-vieillissement cutané. Les conséquences des UVA sur l’ADN seront décrites plus amplement dans la section 1.2.
Les UVB représentent, quant à eux, 5% des UV atteignant la surface de la terre. Il est à noter qu’une partie des UVB est bloquée par différentes molécules atmosphériques. Ainsi, les UVB « courts » (280–290 nm) ne se rendent pas jusqu’au niveau de la mer, bien qu’ils soient présents à haute altitude (Diffey, 2002). Les UVB sont souvent associés à la carcinogénèse par leur forte capacité à induire des dommages directs sur l’ADN
(Anna et al., 2007, van Kranen et al., 2005). C’est pourquoi nous étudierons ces dommages et les conséquences associées (décrits en détail dans des sections 1.2 et 1.3). Les UVC sont les UV les plus énergétiques puisqu’ils sont de longueurs d’onde plus courtes. L’ADN absorbant maximalement à 260 nm, les UVC sont les mieux absorbés et les plus mutagènes. Cependant, ils sont complètement bloqués par la couche d’ozone et le dioxyde de carbone (Ananthaswamy and Pierceall, 1990).
Les UV sont une partie intégrante de cette thèse puisqu’ils sont utilisés comme outil d’étude. Ainsi, les conséquences d’une exposition et les dommages associés seront décrits dans les sections 1.2 et 1.3, respectivement.
1.1.2.2 La lumière visible
La lumière visible, ou lumière blanche, s’étend du violet (400–445 nm) au rouge (650– 760 nm) en passant par toutes les couleurs de l’arc-en-ciel. Au total, elle correspond à 42.3% du rayonnement électromagnétique terrestre (EPA, 2012). La lumière visible joue un rôle majeur dans différents processus comme dans l’activité et l’écosystème terrestre, la guérison des troubles d’humeurs, la prévention contre certaines maladies ou encore dans la synchronisation de l’horloge circadienne (Boukari et al., 2015, Duteil et al., 2014, Parry and Maurer, 2003, Roenneberg et al., 2013).
1.1.2.3 Les infrarouges
La dernière composante du spectre solaire terrestre est les IR. Ils représentent 49.4% du spectre solaire atteignant la surface terrestre (EPA, 2012). Leur niveau énergétique est relativement faible comparé aux autres longueurs d’ondes terrestres. Cependant, les IR sont en grande partie responsables du transfert d’énergie thermique sur terre. Ils transfèrent de la chaleur en mettant en mouvement les atomes, ce qui conduit les molécules à un état excité et libère de l’énergie thermique. De plus, une partie des IR sont absorbés par certaines molécules atmosphériques (l’eau H2O; dioxyde de carbone CO2), ce qui permet de limiter la perte de chaleur vers l’espace, et de maintenir la chaleur terrestre via l’effet de serre (Czuba et al., 2011).
Bien qu’ils soient grandement utiles dans l’industrie et en recherche pour des mesures spectroscopiques, les IR ont aussi un côté sombre puisqu’il a été démontré qu’ils ont la
capacité d’altérer les protéines de la structure dermique, ce qui favorise le vieillissement prématuré de la peau (Cho et al., 2009).
1.2 Les conséquences des UV sur la vie terrestre
1.2.1 Les effets bénéfiques des UV
Bien souvent, les études sont alarmantes sur l’exposition aux UV et les conséquences sur notre organisme. Cependant, il est important de noter qu’à dose raisonnable, les UV ont des effets bienfaisants sur notre santé et sont primordiaux pour un bon maintien de l’écosystème terrestre.
En effet, l’Institut national pour la sécurité et la santé au travail (NIOSF pour national
institute for occupational safety and health) recommande l’utilisation des UVC de
sources artificielles pour leur utilité dans la désinfection et la stérilisation (NIOSH, 2008). Ainsi, ils sont principalement utilisés en laboratoire et dans l’industrie alimentaire car leur énergie permet de détruire les agents pathogènes les plus résistants en modifiant leur ADN, inhibant leur prolifération et en les tuant (Meulemans, 1987).
De plus, les UV sont régulièrement utilisés dans le domaine de la médecine où ils sont utiles en photothérapie pour traiter les problèmes de peau tel l’eczéma, la tuberculose, le rachitisme ou encore le psoriasis (Albert and Ostheimer, 2003, York and Jacobe, 2010). Plus spécifiquement, ils produisent des réactions cellulaires comme l’apoptose, l’isomérisation, ou l’arrêt du cycle cellulaire afin de cibler les molécules responsables de la maladie et d’aider au meilleur fonctionnement (Lee et al., 2013).
D’autre part, il a été démontré que les UV entrainent la stimulation et production de la sérotonine, hormone du bonheur, et la mélatonine, hormone de maintien du rythme chronobiologique. Ainsi, ils sont recommandés dans les cas de dépressions saisonnières ou les problèmes de sommeil (Gambichler et al., 2002).
Finalement, un des rôles les plus connus des UV est la fixation de la vitamine D3 à partir d’un dérivé du cholestérol. La vitamine D joue un rôle primordial dans la croissance des
os puisqu’elle aide à l’absorption du calcium et du phosphore. Elle aide ainsi à prévenir certaines maladies et cancers (Rajakumar et al., 2007).
1.2.2 Le côté sombre des rayonnements UV
1.2.2.1 Les complications liées à une surexpositionBien que les UV soient nécessaires à la vie terrestre, une forte exposition peut engendrer des problèmes de santé. À titre d’exemple, les UV sont responsables des érythèmes actiniques cutanés (coups de soleil). Bien que ces coups de soleil soient à première vue bénins et juste douloureux, ils peuvent en réalité jouer un rôle dans l’apparition des cancers (Petersen et al., 2013, Young and Walker, 1999).
D’autre part, des études démontrent que les UVA sont responsables du vieillissement prématuré de la peau, caractérisé par des rides et un relâchement de celle-ci (D'Orazio et al., 2013). En plus de ces changements phénotypiques, les UV entrainent la dégradation des protéines de la matrice extracellulaire (MEC) en produisant des radicaux libres. Ces radicaux libres ciblent les collagènes et dégradent l’élastine, favorisant ainsi la perte d’élasticité de la peau (Naylor et al., 2011).
De même, une exposition aux rayons UV favorise l’affaiblissement du système immunitaire (Morison, 1989). En effet, ils altèrent la capacité du système immunitaire à détecter et attaquer les cellules malignes en affectant la production d’interleukine (Gonzalez Maglio et al., 2016). Ces molécules jouent un rôle primordial dans le système immunitaire puisqu’elles modulent les lymphocytes (Bruhs and Schwarz, 2017, Loser et al., 2007). Ceci pourrait avoir des conséquences dans la propagation des infections cutanées mais pourrait également aider à la croissance maligne.
Outre la peau, les UV peuvent aussi conduire à des troubles oculaires plus ou moins graves. Le coup de soleil sur l’œil, ou photokératite, est une pathologie causée par une exposition prolongée aux rayonnements UV. Bien qu’elle soit douloureuse, il n’a pas été démontré de lien entre cette condition et des complications quelconques liées à la néoplasie oculaire (Delic et al., 2016). De plus, notre équipe a étudié la question du photo-vieillissement oculaire en mettant en place un système d’irradiation chronique aux
UVA, permettant de mimer la dose accumulée dans une vie. Ces études démontrent des changements similaires à ceux retrouvés dans la peau (Gendron et al., 2012, Gendron and Rochette, 2015), cependant, aucun lien n’a été trouvé avec une quelconque transformation tumorale.
1.2.2.2 Les cancers cutanés
L’effet le plus néfaste des UV vient probablement d’une accumulation d’expositions chroniques car elle peut mener aux cancers cutanés (Armstrong and Kricker, 2001, de Gruijl, 2002, Hoel et al., 2016). Ce n’est qu’à partir du début du XIXème siècle que l’on suspecte un lien entre l’exposition UV et le développement de formes cutanés précancéreuses, mais ce n’est que par les recherches de Eilham Hausser et Wilhem Vahle que les UVB ont été reconnus comme les principaux responsables (pour revue, voir (Dupont et al., 2013)). À partir de ces découvertes, le nombre d’études n’a cessé de croître et nous savons maintenant qu’il existe 2 grandes classes de cancers cutanés liés à une surexposition aux UV : les mélanomes, et les cancers non-mélanocytaires (NMSC).
1.2.2.2.1 Les mélanomes cutanés
Les mélanomes sont la forme de cancer cutané la plus invasive. Ce sont des tumeurs dérivées des cellules pigmentaires, les mélanocytes, retrouvés dans l’épiderme. Les mélanocytes sont les cellules qui protègent les kératinocytes de l’épiderme contre les dommages causés par les radiations UV (Dvorankova et al., 2016). L’exposition aux UV a été suggérée comme une des causes cancérigènes principales. De plus, les changements comportementaux vis-à-vis d’une exposition prolongée au soleil ont augmenté l’incidence des mélanomes qui ne cessent d’accroitre au fil des années.
L’association canadienne de dermatologie (ACD) estime que près de 5 500 canadiens reçoivent un diagnostic de mélanome et que 950 en mourront, soit 17% (ACD, 2010). La société canadienne du cancer (CSS) avance qu’en 2016, 6 800 canadien recevront un diagnostic de mélanome et 1 200 en mourront. (CCS, 2016). Bien que le pourcentage de décès reste constant, il y a une augmentation de près de 2% par an de ce cancer invasif (Bataille and de Vries, 2008).
Il existe aussi un risque génétique, lorsque les familles portent la mutation héréditaire du gène suppresseur de tumeur CDKN2A. Si ce gène est muté, il n’y a plus de contrôle sur la croissance des cellules cancéreuses. Ces personnes représentent 5–10% des patients atteints de mélanome (Bataille and de Vries, 2008).
Les mélanomes touchent les cellules de l’épiderme, mais sont capables d’envahir les couches les plus profondes de la peau, se rendant jusqu’au derme profond où l’on retrouve des vaisseaux sanguins. À partir de cette invasion, ils peuvent métastaser vers les organes internes, on parle alors de cancer au stade IV, et le diagnostic pour la survie du patient est généralement négatif. Ainsi, les traitements proposés mis en place permettent de soulager le patient et d’augmenter sa survie qui est estimée à seulement 50% sur un an (Balch et al., 2001).
1.2.2.2.1 Les cancers non-mélanocytaires
Ce sont les cancers les plus répandus, représentant près de 90% des cancers cutanés. En 2015, on estime qu’environ 78 300 nouveaux cas NMSC seront diagnostiqués (CCS, 2015). On retrouve 2 types de NMSC, les carcinomes spinocellulaires (CSC), et les carcinomes basocellulaires (CBC).
Les CSC, appelés également épithéliomas, représentent 20% des NMSC et sont liés à l’exposition totale à vie au soleil, incluant l’exposition récréative et professionnelle mais aussi à la surexposition aux rayons UV durant l’enfance. Ainsi, il apparait surtout chez les personnes âgées. Sa croissance incontrôlée se développe au niveau des cellules squameuses de l’épiderme, avec une prolifération accrue et rapide, qui peut aboutir à des métastases. Cependant, la survie de ce cancer est très favorable, avec un taux de 95% sur 5 ans (CCS, 2016).
Les CBC sont les plus communs puisqu’ils représentent près de 80% des NMSC (Diffey, 1991). Ils sont associés à des expositions induisant des érythèmes actiniques cutanés, et les caucasiens sont les plus affectés par ce type de cancer. Les cellules basales de l’épiderme sont modifiées dans leur cycle cellulaire, amenant à une prolifération autonome. Cependant, ils se développent lentement et ne se disséminent pas
contrairement au mélanome et au CSC. De ce fait, le taux de survie est excellent puisqu’il est de 100% sur 5 ans.
Outre les cancers de peau, les UV ont la capacité d’induire des dommages considérables au niveau de l’œil (Annexe 1,2) (Yam and Kwok, 2014). Cependant, les études antérieures ne sont pas suffisantes pour désigner l’exposition aux rayonnements UV comme cause principale de certaines pathologies oculaires.
Globalement, les trois types de cancers cutanés sont associés à l’exposition aux rayonnements UV (Hoel et al., 2016). Cette induction de cancer est principalement décrite dans la littérature comme étant la cause de mutations sur l’ADN causées par les UV (Soehnge et al., 1997). En raison de la forte capacité des UV à induire des changements physiques sur l’ADN, des dommages apparaissent au cours des expositions. Ces dommages, s’ils ne sont pas réparés, vont résulter en mutations et former des lésions précancéreuses dans les cellules. L’étude des UV a permis de comprendre en détail comment sont formés ces dommages à l’ADN. Ainsi, la prochaine section se concentrera sur les dommages induits par les UV.
1.3 Les dommages à l’ADN induits par les UV
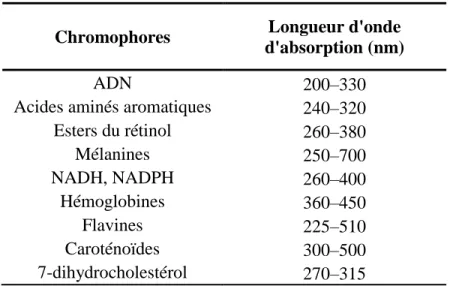
L’importance d’étudier les dommages à l’ADN résulte de leur capacité à se transformer en lésions génotoxiques. Les rayonnements UV sont absorbés efficacement par différentes molécules chromophoriques. Ces molécules absorbent l’énergie photonique des rayons UV en créant un nuage électronique. Dans une cellule, on retrouve un grand nombre de chromophores (Tableau 1.1) dont l’ADN, qui fait l’objet de cette thèse. Des changements au niveau de l’ADN peuvent conduire à l’évolution d’une espèce. Cependant, lorsque les changements sont trop importants, ils sont néfastes pour la survie de l’espèce en engendrant des pathologies comme celles que nous avons vues précédemment (section 1.2.2.2). En conséquence, l’ADN a un rôle primordial dans la survie de l’espèce et la transmission de l’information génétique. Il est donc indispensable de comprendre les dommages affectant cette macromolécule, leurs conséquences, et les différents moyens de contrer leurs effets délétères pour préserver l’intégrité génomique.
Dans la prochaine section, nous nous intéresserons particulièrement aux dommages induits par les UV.
Chromophores Longueur d'onde
d'absorption (nm)
ADN 200–330
Acides aminés aromatiques 240–320
Esters du rétinol 260–380 Mélanines 250–700 NADH, NADPH 260–400 Hémoglobines 360–450 Flavines 225–510 Caroténoïdes 300–500 7-dihydrocholestérol 270–315
Tableau 1.1 Liste de certains chromophores retrouvés dans les cellules humaines
1.3.1. Les dommages indirects
1.3.1.1 L’oxydationL’oxydation est une agression cellulaire qui est naturellement produite dans une cellule, principalement via la chaîne respiratoire mitochondriale. Néanmoins, elle peut être augmentée par des facteurs exogènes comme les UVA. Ces UV sont très faiblement absorbés par les bases d’ADN, ainsi ils n’induisent pas de dommages directs sur la molécule d’ADN. En revanche, ils sont capables d’exciter différents autres chromophores cellulaires (Wondrak et al., 2006) (Tableau 1.1). Lorsqu’ils sont excités, les chromophores passent dans un état intermédiaire, l’état triplet. Les molécules doivent alors retourner dans un état fondamental. Ainsi elles transfèrent de l’énergie aux molécules d’oxygène, aboutissant ultimement à la formation d’espèces réactives de l’oxygène (ROS). Il existe différentes molécules de ROS, l’oxygène singulet (1
O2), l’anion superoxyde (O2•−), et le peroxyde d’hydrogène (H2O2). Il existe aussi le radical hydroxyle (OH−) généré par H2O2. Ce sont ces ROS qui vont attaquer des molécules cibles par oxydation. Une cible des ROS sont les membranes cellulaires, constituées d’acides gras polysaturés. Ces molécules présentent des doubles liaisons qui sont
attaquées par les ROS; ainsi il y a une altération des membranes cellulaires qui ne peuvent plus jouer leur rôle de filtre, et favorisent le vieillissement cellulaire (Oliveira and Schoffen, 2010). D’autre part, certaines protéines comme le collagène dermique sont attaquées par ces radicaux libres, déstructurant les fibres de collagène. Finalement, l’ADN est aussi une cible des ROS qui, en oxydant la molécule d’ADN, induit des changements au niveau des bases d’ADN, résultant en des dommages. Ainsi, les UVA endommagent l’ADN indirectement en passant par la formation de ROS.
Le stress oxydatif étant naturellement produit, la cellule a mis en place des mécanismes de protection pour contrebalancer ses effets indésirables. Ainsi, des molécules permettent de protéger les membranes cellulaires (Kay et al., 1986), les protéines ou l’ADN (Ganceviciene et al., 2012). Cependant, si le stress oxydant est augmenté de manière exogène, l’équilibre cellulaire est débalancé. En conséquence, il devient important de comprendre les conséquences des dommages indirectement induits, et les mécanismes de protection associés.
1.3.1.2 Les 8-oxo-7,8-dihydroguanine
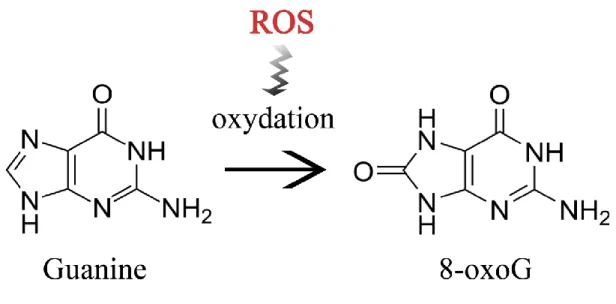
Nous venons de discuter des conséquences d’une oxydation incontrôlée qui mène à des changements métaboliques et physiques au niveau cellulaire. Nous allons maintenant nous intéresser plus en détail sur les conséquences de l’oxydation au niveau de la molécule d’ADN. Comme mentionné précédemment, lorsque les ROS interagissent avec l’ADN, ils l’endommagent par oxydation de la guanine, la base de l’ADN la plus vulnérable de par son faible potentiel redox (David et al., 2007). C’est de cette manière que les dommages indirects à l’ADN se produisent. L’oxydation de la guanine transforme ce nucléotide en un dérivé, la 8-oxo-7,8-dihydroguanine (8-oxoG) (Fig. 1.3). Ce dommage n’induit pas de distorsions sur l’ADN et n’aurait donc pas de rôle dans le blocage des polymérases réplicatives. Elle contribuerait toutefois à des mutations spontanées sur l’ADN (Bregeon et al., 2009, Shibutani et al., 1991). Les 8-oxoG sont considérés parmi les meilleurs biomarqueurs du stress oxydatif.
Il a longtemps été établi que les UVA sont les seuls UV responsables de l’oxydation. Cependant, des études ont émergées et démontrent que les dommages oxydatifs se
produisent à un spectre large d’UV (280–400 nm), comprenant ainsi les UVA et les UVB (Heck et al., 2003, Velasquez et al., 2014).
Figure 1.3 Représentation schématique de la formation d’une 8-oxo-7,8-dihydroguanine par les ROS
1.3.2. Les dommages directs à l’ADN
La capacité chromophorique de l’ADN lui confère l’aptitude à absorber efficacement l’énergie entre 200 nm et 330 nm (Fig. 1.2 et Tableau 1.1). Ce sont avant tout des liaisons covalentes qui sont capables de se former entre 2 pyrimidines adjacentes, aboutissant à des dimères de pyrimidines. Il en existe 2 sortes : les photoproduits 6-4 de pyrimidine pyrimidone (6-4 PP), et les dimères cyclobutyliques de pyrimidines (CPD pour
cyclobutane pyrimidine dimer). Ces 2 types de photo-dommages dimériques ont une
importance sur la suppression de l’intégrité du génome et représentent les dommages photo-induits les plus répandus (You et al., 2001) (Fig. 1.4).