يملعلا ثحبلاو يلاعلا ميلعتلا ةرازو
Ministère de l’Enseignement Supérieur et de la Recherche Scientifique يداولا رضخل همح ديهشلا ةعماج
Université Echahid Hamma Lakhdar -El OUED طلا مولع ةيلك
ةايحلاو ةعيب
Faculté des Sciences de la Nature et de la Vie ولويبلا مسق
ج ةيئيزجلاو ةيولخلا اي
Département de Biologie Cellulaire et Moléculaire
_____________________________________________________________________
MEMOIRE DE FIN D’ETUDE
En vue de l’obtention du diplôme de Master Académique
en Sciences biologiques
Spécialité : Toxicologie
THEME
Présenté Par :
BARIR Djalila
DOU Fatma Zohra
Devant le jury composé de :Présidente : M
elle. RAMDANE Farah (MCA) Université d’El Oued.
Examinateur : Mr. KIRAM Abderazzak (MAA) Université d’El Oued.
Promoteur : Mr. ACILA Smail (MCB) Université d’El Oued.
Année universitaire 2019 / 2020
Effets toxiques de l'aluminium (Al
3+) sur la germination, et
quelques marqueurs physiologiques et biochimiques des
Je dédie ce modeste travail à
À ceux qui sont la source de mon inspiration et mon
courage.
À qui je dois de l’amour et la reconnaissance.
le grand plaisir de dédier ce modeste travail
A mes parents, A mes frères, A mes sœurs, et
Tous les membres de mes familles BARIR et DOU sans
exception.
Et un grand merci à SHérif BENNOUR pour son aide
dans le travail dans l'institut National De Formation
Professionnelle Echahid Amamra Bashir BEN ALI EL
-OUED
Et enfin ,moi , Fatma Zohra DOU je dédie mon succès
A l’esprit de mon chère grand-mère DELIBA KHadra
t
Nous tenons tout d’abord à remercier
Dieu
le tout puissant
et
Qui nous a donné la force et la patience d’accomplir ce
Modeste travail.
Nous tenons à remercier notre encadreur
Dr :ASSILA Ismail
pour son précieux conseil et son
aide durant toute la période du travail.
Nos vifs remerciements vont également aux
membres du
jury
pour l’intérêt qu’ils ont porté à notre recherche en
acceptant d’examiner notre travail et de l’enrichir par leurs
propositions.
Une mention très spéciale à mon chers amis Kebsa Imane
et Mohrem Imane qui ont contribué de manière important
au succès de ce travail.
Nous tenons à remercier profondément tout qui nous aide
pour faire ce travail,
Nous n'oublions pas
nos parents
pour leur contribution,
leur soutien et leur patience. Ainsi que toute les personnes
Ayant participées de près ou de loin à la
Réalisation de ce travail
et quelques marqueurs physiologiques et biochimiques des axes embryonnaires du haricot (Phaseolus vulgaris L.)
Résumé
Cette étude vise à évaluer les effets d'un métal lourd (aluminium) sur la germination et la croissance des plantules de haricot (Phaseolus vulgaris L). Une expérience de germination a été réalisée in vitro, sur les graines de haricot variété
COCO ROSE, où elles ont été traitées par des concentrations croissantes d'une
solution de sels de chlorure d'aluminium (AlCl3) (0, 100, 300 et 600 mg/L). L'expérience a été réalisée à température de 27 °C et de l'obscurité totale. Des critères de germination, ainsi que des quelques biomarqueurs physiologiques et biochimiques des axes embryonnaires ont été étudiés. Les résultats obtenus ont montré que le stress d’aluminium (Al3+
) réduit considérablement les critères de germination des graines de haricot, telles que le pourcentage de germination (PG%) et l'indice de vigueur des graines (SVI), où une augmentation des taux d'inhibition a été enregistré, due au stress. Les résultats obtenus ont également confirmé la diminution de la mobilisation des réserves (SMR) et de l'efficience métabolique des graines (SME) de haricot sous l’effet du stress. De plus, une diminution de la longueur (EAL) et du poids secs des axes embryonnaires (EAW) a été enregistrée, avec une augmentation du pourcentage de phytotoxicité pour les deux critères de croissance sous l'influence du stress d’aluminium (Al3+
). D'autre part, les résultats obtenus ont également confirmé que la teneur en glutathion (GSH) des axes embryonnaires de haricot est diminuée de façon proportionnelle aux différentes concentrations d’AlCl3. Tandis que la teneur en malondialdéhyde (MDA) des axes embryonnaires augmente significativement, sous l’effet des différents niveaux du stress métallique.
Mots clés : Haricot (Phaseolus vulgaris L.) ; Aluminium (Al3+) ; mobilisation des réserves ; croissance ; stress oxydatif.
Toxic Effects of aluminum (Al3+) on germination, and some physiological and biochemical markers of bean (Phaseolus vulgaris L.) embryonic axes
Abstract
This study aims to evaluate the effects of a heavy metal (aluminum) on the germination and bean (Phaseolus vulgaris L.) seedlings growth. In vitro germination experiment was carried out, on the COCO ROSE bean variety seeds, where they were treated with increasing concentrations of aluminum chloride salts (AlCl3) solution (0, 100, 300 and 600 mg/L). The experiment was carried out at a temperature of 27 °C and in total darkness. Germination criteria, as well as some physiological and biochemical biomarkers of the embryonic axes were studied. The obtained results showed that aluminum stress (Al3+) considerably reduced the germination criteria of bean seeds, such as the germination percentage (PG%) and the seed vigor index (SVI), where an increase inhibition rate was recorded, due to stress. The obtained results also confirmed the decrease in seed reserve mobilization (SMR) and in bean seed metabolic efficiency (SME), under the metal stress effect. In addition, a decrease in the length (EAL) and dry weight of the embryonic axes (EAW) was recorded, with an increase in the phytotoxicity percentage for the two growth criteria under the influence of aluminum (Al3+) stress. On the other hand, the obtained results also confirmed that the glutathione (GSH) content of the bean embryonic axes was reduced in proportion to the AlCl3 different concentrations. While the malondialdehyde (MDA) content of embryonic axes increases significantly under different levels of metal stress.
Keywords: Bean (Phaseolus vulgaris L.); Aluminum (Al3+); reserves mobilization; growth; oxidative stress.
لا
ريثأت
ل يمسلا
موينمللأ
( Al+3 )ىلع
لإا
ععو ،ابنب
،ارشؤملا
ةيئايميكويبلاو ةيجولويسفلا
ةينينجلا رواحملل
ا دنع
ءايلوصافل
( Phaseolus vulgaris L. )صخلملا
مييقت ىلا ةساردلا هذه فدهت
تاريثأت
تارداب ومنو تابنا ىلع موينمللأا ليقثلا ندعملا
ءايلوصافلا
(Phaseolus vulgaris L.).
فنص ءايلوصافلا روذب ىلع ،ايربخم تابنلا ةبرجت تمت
COCO ROSE ،اهتلماعم تمت نيأ
لولحم نم ةديازتم زيكارتب
موينمللأا ديرولك حلامأ
(AlCl3) ( 0 ، 000 ، 000 ، 000 غلم / ل .)ةرارح ةجر يف ةبرجتلا تمت
72
م
مات ملاظ يف
.
،تابنلاا صئاصخ
اضيأ
ضعب
اهتسارد تمت ةيئايميكويبلاو ةيجولويسفلا ريياعملا
.
ترهظأ اهيلع لصحتملا جئاتنلا
موينمللأا داهجا نأ
(Al3+)ةيوئملا ةبسنلاك ،ءايلوصافلا روذب تابنا صئاصخ ايونعم ضفخي
تابنلإل
(PG%)تابنلاا ةوق رشؤمو
(SVI) ،داهجلاا ببسب طيبثتلا بسن يف ةدايز ليجست مت نيأ
.
يف ضافخنا اضيأ تدكأ اهيلع لصحتملا جئاتنلا
ح
تارخدملا ةيكر
(SMR)ضيأ ةءافكو
روذبلا
(SME)داهجلاا ريثأت تحت ءايلوصافلا دنع
.
لوط يف ضافخنا ليجست مت ،اضيأ
(EAL)فاجلا نزوو
(EAW)ريثأت تحت ومنلا يتيصاخل ةيمسلا بسن يف ةدايز عم ،ةينينجلا رواحملل
موينمللأا داهجا
(Al3+) .نم ىوتحملا نأ اضيأ اهيلع لصحتملا جئاتنلا تدكأ ،ىرخأ ةهج نم
glutathion (GSH)زيكارت عم انمازت ضفخنا ةينينجلا رواحملا يف
AlCl3 .ىوتحملا ناف نيح يف
نم
malondialdéhyde (MDA)داهجلاا زيكارت فلتخم ريثأت تحت ةينينجلا رواحملا يف عفترا
يندعملا
.
،املكلا
ةيحاتفملا
:
ءايلوصافلا
(Phaseolus vulgaris L.) ؛موينمللأا
(Al3+) ؛؛تارخدملا ةيكرح
يدسكأتلا داهجلاا ؛ومنلا
.
PREMIERE PARTIE: SYNTHESE BIBLIOGRAPHIQUE
CHAPITRE I: Métaux Lourds et leurs effets sur la plante
1. Généralités sur les métaux lourds 05
1.1. Définition 05
1.2. Sources 05
-Sources naturelles 05
- Sources anthropiques 05
2. Les principaux effets des métaux lourds sur les plantes 05 2. 1. Effet des métaux lourds sur la germination et la croissance 06 2. 2. Effet des métaux lourds sur la photosynthèse 06 2.3. Effet des métaux lourds sur la nutrition minérale 06
2.4. Métaux lourds induisent le stress oxydatif 07
3. Stratégies et mécanismes de tolérance des plantes 09
3.1. Paroi cellulaire et la membrane plasmique 09
3.2. Chélation et la compartimentation cellulaire 09
3.2.1. Chélation des ions métalliques 09
• Métallothionéines (MT) 09
• Phytochélatines (PC) 10
• Acides organiques 10
Table des matières
Dédicace
Remerciements
RESEME
LISTE DES FIGURES
LISTE DES TABLEAUX
LISTE DES ABREVIATIONS
3.2.2. Compartimentation des ions métalliques 11
3.3. Système antioxydant 11
3.3.1. Antioxydants 11
3.3.1. a. Système de défense enzymatique 12
3.3.1. b. Système de défense non enzymatique 12
a. Glutathion réductase (GSH) 12
b. Acide ascorbique (vitamine C) 12
c. Vitamine E 13
d. Caroténoïdes 13
3.4. Autres systèmes de défense au stress métallique 13
CHAPITRE
ІІ: Généralités sur le haricot (Phaseolus vulgaris L.)
1. Origine 16
2. Caractéristiques botaniques de l'espèce 16
3. Position systématique 17
4. Cycle de développement 17
5. Exigences climatiques du Haricot 18
DEUXIEME PARTIE: ETUDE EXPERIMENTALE
CHAPITRE III: Matériel et méthodes
1. Objectif de l’expérimentation
21
2. Matériel végétal et conditions de culture
21
2.1.Germination des graines
21
2.2.Traitement métallique
21
3. Méthodes et mesures effectuées
22
3.1.Paramètres de germination
22
3.1.1 Taux moyen de germination des graines
22
4. Mobilisation des réserves et l’efficience du métabolisme des graines
23
4.1. Efficience métabolique des semences
23
4.2. Quantité de matériel de semence respiré
23
5. Paramètres de croissance
23
5.1.Longueur et poids sec des axes embryonnaires
23
5.2. Pourcentage de Phytotoxicité de l'aluminium sur la longueur et le poids sec des axes embryonnaires
24
6. Caractéristiques biochimiques des axes embryonnaires
24
6.1.Dosage du malondialdéhyde (MDA)
24
6.2.Dosage de glutathion(GSH)
25
7. Analyse statistique
26
CHAPITRE ІV: RÉSULTATS ET DISCUSSION
I.
Résultats
1. Paramètres de germination
28
1.1.Taux moyen de germination des graines
28
1.2. Indice de vigueur des semences (SVI)
28
1.3.Pourcentage d'inhibition de germination et de vigueur des semences
29
2. Mobilisation des réserves et l’efficience du métabolisme des graines
30
2.1. Quantité de matériel de semence respiré (SMR)30
2.2. Efficience métabolique des semences (SME)
30
3. Paramètres de croissance et quelques caractéristiques biochimiques des axes embryonnaires.
31
3.1. Longueur et poids sec des axes embryonnaires
31
3.2. Pourcentage de Phytotoxicité de l'aluminium sur la longueur et lepoids sec des axes embryonnaires
32
4.2. Teneur en glutathion (GSH)
33
II.
Discussion
1. Effets du stress de l’aluminium (Al3+) sur Paramètres de germination
34
2. Effets du stress de l’aluminium (Al3+) sur Mobilisation des réserves etl’efficience du métabolisme des graines
36
3. Paramètres de croissance
38
4. Effet du stress de l’aluminium (Al3+) sur quelques marqueurs biochimiques
39
4.1.Effet de l’Aluminium sur l’activité du MDA
39
4.2.Effet de l’Aluminium sur l’activité du glutathion
40
CONCLUSION GENERALE
RÉFÉRENCES BIBLIOGRAPHIQUES
ANNEXES
Tableau 01. Liste des figures
N°
Titre
Page
Figure01
Description de la plante du Haricot 16Figure02
Cycle de développement du Haricot 18Figure03
Taux moyen de germination des semences de haricot (Phaseolus vulgaris L. var. coco rose), en fonction des concentrations de chlorure d’aluminium (AlCl 3).28
Figure04
Indice de vigueur des semences (SVI) de haricot (Phaseolusvulgaris L. var. coco rose), en fonction des concentrations de chlorure d’aluminium (AlCl 3).29
Figure05
Pourcentage d'inhibition de germination PI (GP%) et de vigueur des semences PI(SVI) de haricot (Phaseolus vulgaris L. var. coco rose), en fonction des concentrations de chlorure d’aluminium (AlCl 3)30
Figure06
Quantité de matériel respiré (SMR) et l’efficience métabolique des semences (SME) de haricot (Phaseolus vulgaris L. var. coco rose), en fonction des concentrations de chlorure d’aluminium (AlCl 3)31
Figure07
Pourcentage de phytotoxicité de chlorure d’aluminium (AlCl 3)sur la longueur et le poids sec des axes embryonnaires de haricot (Phaseolusvulgaris L. var. coco rose).32
Figure08
Effet de chlorure d’aluminium (AlCl 3) sur la teneur en malondialdéhyde (MDA) des axes embryonnaires de haricot (Phaseolusvulgaris L. var.
coco rose).
33
Figure09
Effet de chlorure d’aluminium (AlCl 3) sur la teneur en glutathion (GSH) des axes embryonnaires de haricot (Phaseolusvulgaris L. var. coco rose). 34
Tableau 02. Liste des tableaux
N° Titre
Page
Tab 01 Langueur moyenne (EAL) et le poids moyen des axes
Abréviation
Désignation
1O
2 Oxygéne singletADN
Acide désoxyribonucléotidiqueAl
AluminiumAlCl
3 Chlorure de l’AluminiumASS
Acide sulfosalicylique
Br
BoreCar
CaroténoïdesCAT
CatalaseCd
CadmiumCu
CuivreDTNB
Acide 5-5’ dithio-bis-2-nitrobenzoiqueEDTA
Ethyléne diamine tétraacétiqueETM
Elément trace métalliqueFe
FerFe
2+ Fer ferreux.Fe
3+ Fer ferrique.GSH
GlutathioneH
2O
2 Peroxyde d’hydrogèneHg
MercureMn
ManganèseMo
MolybdèneMS
Matière sècheMT
Métaux lourdsNADPH
Nicotinamide Adénine Dinucléotide Phosphate réduitNi
NickelO
2 OxygènemoléculaireO
2Pb
PlombPC
PhytochélatinesPG%
Taux moyen de germination des grainesPS II
Photosystème IIPSI
Photosystème IROS
Reactive Oxygen SpeciesSME
Seed metabolic efficiencySMR
Seed material respiredSOD
Superoxyde dismutaseSVI
Indice de vigueur des semencesTBA
ThiobarbituriquePollution de l'environnement par les métaux lourds est un problème croissant dans le monde. Ces métaux sont biopersistants et entraînent des effets graves sur les différents milieux : perturbation des écosystèmes et détérioration des sols, des eaux de surface, des forêts et des cultures (Benhamdi, 2014).
Les métaux toxiques sont biodisponible pour les plantes grâce à leur absorption à partir du sol et de l'eau. De nombreuses études antérieures ont révélé les effets phytotoxique des concentrations élevées de métaux lourds sur la croissance et les processus potentiels physiologiques, biochimiques et moléculaires des plantes (Sytar et al., 2013).
Dans les systèmes biologiques, le stress oxydatif est à l'origine de plusieurs stress abiotique (salinité, métaux lourds, stress hydrique….), d'où la mise en œuvre par la cellule végétale de plusieurs systèmes de détoxification tels que le métabolite secondaire, qui jouent un rôle crucial dans la détoxification des espèces réactives de l'oxygène (Ait yahya et Zemmoura, 2014).
Les espèces réactives de l'oxygène (ERO) peuvent engendrer des dommages importants dans la structure et le métabolisme cellulaire en dégradant de nombreuses cibles : protéine, lipides et acides nucléiques (Cadenas et Davies, 2000 ; Pincemail et al., 1999).
La toxicité des métaux lourds est intimement liée à leurs propriétés oxydo-réductrices et à la production d’espèces réactives de l’oxygène (ROS), tels que l’anion superoxyde ou le radical hydroxyle, qui possèdent un électron non apparié. Au niveau cellulaire, les principales cibles des ROS sont l’ADN, les phospholipides membranaires et les acides aminés (Remon, 2006). L'activité de l'appareil photosynthétique représente également une cible importante pour les contaminants métalliques parce que l'inhibition des processus biochimiques et biophysiques de la photosynthèse affectent en entier la physiologie des plantes (Mesnoua, 2016).
Les plantes possèdent des systèmes de stockage ou de détoxication qui leurs permettre de diminuer les effets néfastes des métaux lourds. Selon les espèces, ces système sont plus ou moins développés, mais, il semble à l’heure actuelle que trois
permet de réduire l’entrée des métaux dans la cellule, le système antioxydant, qui limite les dégâts des ROS et la chélation intracellulaire, qui empêche l’activité de l’ion métallique (Remon, 2006).
Pour faire face aux dommages oxydatifs causés par ces biomolécules toxiques (ROS), les plantes ont développé un mécanisme de défense antioxydant qui est à la fois composé de systèmes enzymatiques (catalase, superoxyde dismutase, peroxydase, glutathion réductase, glutathion S-transferase, glutathion peroxydase, etc…), ainsi que de systèmes non-enzymatiques (vitamines C et E, carticonoides, glutathion, etc…). Cela permet le maintien d'une capacité antioxydante élevée dans les cellules et l’augmentation de la tolérance au stress (Shahid et al., 2014).
L'élément trace métallique choisi pour ce travail est l'aluminium (Al), c'est l'un des polluants métalliques les plus abondants dans le sol, et avec de très petites quantités apparaissant dans les formes solubles capables d'influencer systèmes biologiques (May et Nordstrom, 1991).
En sols acide, cependant, la libération d'Al3+ est accéléré, et cela augmente la concentration de formes phytotoxiques d'Al dans la solution du sol. L'effet néfaste du sol acide sur la croissance des plantes dans de nombreux cas, est directement lié à la toxicité des ions Al3+ dissous ; et la toxicité de ce dernière forme des biomolécules a entraîné une réduction de 30 à 60% en production végétale (Wortman et al., 1998).
L’objectif de cette étude est de déterminer la réponse de haricot (Phaseolus
vulgaris L.) au cours de la germination des graines, comme une phase précoce de
développement, et d'évaluer quelques marqueurs physiologiques et biochimiques des axes embryonnaires sous l'effet de stress d’aluminium (Al3+
PREMIERE PARTIE
SYNTHESE
CHAPITRE I
Les métaux Lourds et leurs
effets sur la plante
5
1. Généralité sur les métaux lourds
1.1. Définition
Un métal lourd ou élément trace métallique (ETM) (Duruibe et al., 2007).Les métaux lourds peuvent être également définis comme tout métal ayant une densité supérieure à 5 et tout métal ayant un numéro atomique élevé, en général supérieur à celui du Sodium (Z=11).Tout métal pouvant être toxique pour les systèmes biologiques.
Les métaux lourds (MT) sont divisés en deux catégories : A - métaux essentiels ou oligo-éléments :
Sont des éléments nécessaires à la vie des plantes et se trouvent en faible quantité tels que : le Fer (Fe), le Manganèse (Mn), le Zinc (Zn), le Cuivre (Cu) et le Molybdène (Mo) (NEDJAH., 2015).
B -métaux non nécessaires :
Sont des éléments non indispensable à la vie des plantes et dans certains cas sont toxiques, même à de très basses concentrations dans la plante, de l’ordre du nanogramme ou du microgramme par kilogramme de matière sèche (MS), ils peuvent avoir un effet biologique, c’est le cas : du bore (Br), du plomb (Pb) et du nickel (Ni) et du cadmium (Cd) (NEDJAH., 2015).
1.2. Origine des métaux lourds
Les métaux lourds sont des constituants naturels de tous les écosystèmes. Ils se trouvent dans l’atmosphère, l’hydrosphère, la lithosphère et la biosphère. Leur distribution dans l’environnement procède à deux origines : origine naturelle et anthropique (Aoun., 2008).
6
2. Principaux effets des métaux lourds sur les plantes
2.1. Effets des métaux lourds sur la germination et la croissanceLe premier effet des métaux lourds observable chez les végétaux est une inhibition de la croissance (Remon., 2009).Les racines sont les plus sensibles aux MT par rapport à d’autres organes végétaux, parce qu’elles sont les premières cibles de passage et d’accumulation de ces métaux (Seregin et Ivanov., 2001).
L’effet toxique des ETM sur la croissance de la plante se manifeste par une réduction de la croissance des parties aériennes et des racines affectant ainsi dramatiquement la production de la biomasse (Zorrig., 2011). Ces effets s’accompagnent très souvent de nombreux autres indices de dysfonctionnement tel que la perturbation de l’équilibre de certaines hormones de croissance, notamment l’auxine (Wang et al., 2009).
Le mercure (Hg) est le métal le plus inhibiteur de la germination. Il provoque une inhibition complète dans les graines de blé (Seregin et Kozidzinska., 1998). Même à faibles doses, le plomb inhibe la germination des grains qui ont les enveloppes perméables comme le petit pois Pisumsativum (Seregin et Ivanov., 2000).
2.2. Effet des métaux lourds sur la photosynthèse
L’effet des métaux lourds sur la photosynthèse et la synthèse de la chlorophylle est largement documenté. L’inhibition de la photosynthèse causée par le Cd est due à un désordre de l’ultra structure des chloroplastes, la diminution de synthèse de la chlorophylle, des caroténoïdes, le transport des électrons, l’inhibition de l’activité des enzymes du cycle de Calvin et la déficience en CO2 due à la fermeture des stomates (Mishra et al., 2006).
En revanche, le plomb peut entrainer des changements de la composition lipidique membranaire et perturbe en particulier les flux de la chaine photosynthétique de transport des électrons (Pourrut., 2008).
7
3.3. Effets des métaux lourds sur la nutrition minérale
La présence de Cd dans la solution nutritive peut agir sur l’absorption et l’accumulation des éléments nutritifs essentiels pour la croissance des plantes (Sanitaet Gabbrielli., 1999). Dans la plupart des cas, le Cd inhibe l’absorption des cations K+ , Ca2+, Mg2+, Mn2+, Zn2+, Cu2+ et Fe3+ (Srivastava et Jaiswal., 1990). Certains signes de toxicité des plantes par le Cd ont été attribués à des perturbations d’origine nutritionnelle. Greger et Lindberg (1987) ont montré que les plantules de
Beta vulgaris, traitées par le Cd, développent des racines latérales courtes. Les mêmes
auteurs ont supposé que ces signes sont dus à une carence en approvisionnement calcique. La réduction des teneurs en calcium en présence d'un stress cadmique a été montrée aussi chez le pois (Sandalio et al., 2001). La perturbation de l’alimentation en éléments minéraux essentiels pour la croissance des plantes (Wang et al., 2009).
2.4. Métaux lourds induisent le stress oxydatif
Lors du métabolisme aérobie des plantes, la réduction de l’oxygène par les cytochromes de la chaîne respiratoire s’accompagne inévitablement d’une production des molécules intermédiaires radicalaires, très réactifs connus sous le nom espèces réactives de l’oxygène (ROS). Les espèces réactives de l’oxygène sont de puissants agents oxydants capables d’altérer toute une série de cibles biologiques importantes (Muschitz., 2009). A l’état normal les cellules des plantes possèdent un système antioxydant capable d’annuler l’effet des ROS. Cependant, à des concentrations élevées des ETM, le taux des ROS augment et dépasse les capacités du système antioxydant. Le "stress oxydatif" a été défini comme une perturbation dans l'équilibre pro-oxydant-antioxydant en faveur de l'ancien (Sies., 1991).
La production de formes réactives de l’oxygène est une réponse cellulaire commune à de nombreux stress chez les végétaux qui se localise au niveau de différentes sources (Parent., 2008).
-Les mitochondries végétales en tant que «usines d'énergie» un site majeur de production de ROS comme H2O2 ainsi que le ROS cible. La production de ROS dans les mitochondries a lieu sous respiration normale conditions mais peut être amélioré en réponse à divers biotiques et les conditions de stress abiotique. Complexe I et III
8
des mitochondries ETC sont les sites très connus d'O2 la production. (Gill et Tuteja., 2010).
-Les chloroplastes : Dans les plantes supérieures et les algues, la photosynthèse a lieu dans les chloroplastes, qui contiennent une membrane thylakoïde hautement organisée (Asada., 2006). Oxygène généré dans les chloroplastes pendant la photosynthèse peut accepter des électrons passant par les photosystèmes, entraîne donc la formation O2-..1O2 est un naturel sous-produit de la photosynthèse, formé principalement au PS II (Gill et Tuteja., 2010).
-Les peroxysomes: sont des petits microbes généralement sphériques délimités par une membrane bicouche lipidique unique. Les peroxysomes sont subcellulaires organites à métabolisme essentiellement oxydatif et sont probablement les principaux sites de production intracellulaire de ROS. Les peroxysomes produisent d’O2- les radicaux en raison de leur métabolisme normal. (Gill et Tuteja., 2010).
Les espèces réactives de l'oxygène, tels que O2-, H2O2 et OH. L'exposition des plantes à certains ions de métaux lourds déplace l'équilibre du métabolisme des radicaux libres vers une accumulation de l'H2O2 (Gill et Tuteja., 2010).
Le Peroxyde d'hydrogène se forme par dismutation du radical superoxyde, catalysée par lasuperoxydedismutase (SOD) (Marfak., 2003) :
2O2 + 2 H+ H2O2+ O2
Le radical hydroxyle est très réactif, il se forme soit par la dégradation du peroxyde d’hydrogène en présence de métaux de transition sous leur forme réduite, conduit à la réaction de Fenton :
H2O2 +Fe2+ OH· + OH-2+ Fe3+
Ou par son réaction avec le radical superoxide selon la réaction d’Haber-Weiss (Ait Yahia et Zemmoura, 2014) :
H2O2 + O2 ·- OH· + OH - + O2
Et l'autre ROS c'est l’anion superoxyde O2.-L’une des sources physiologiques majeures de O2·- est la chaîne respiratoire mitochondriale (MARFAK, 2003).
9
O2 + e- O2
·-Le stress oxydatif peut provoquer la mort cellulaire par altération de l'ADN, peroxydation des lipides et modification de la structure et du fonctionnement des protéines (Sunet al., 2018).
3. Stratégies et mécanismes de tolérance des plantes
3.1. Paroi cellulaire et la membrane plasmique
Toutes les cellules végétales ont la particularité d’être entourées par une matrice extracellulaire appelée paroi. La paroi cellulaire contient diverses molécules comme des protéines, des pectines et des celluloses possèdent des groupements hydroxyles, carboxyles, amines, aldéhydes, phosphates, thiols, … qui peuvent jouer un rôle de ligand assurent une complexassions et donc la détoxication de nombreux ETM (Muschitz., 2009).
Le transport à travers la membrane plasmique des cellules racinaires est un processus important car les ions ne peuvent pas diffuser librement à travers la double couche phospholipidique (Mitch 2002). La membrane plasmique peut limiter l’accumulation des ions toxiques soit par la modification de l’ensemble du flux ionique, soit par l’employabilité des systèmes ultra spécifiques empêchant le transport des ions toxiques (Meharg., 1993).
3.2. Chélation et la compartimentation cellulaire
3.2.1. Chélation
La chélation est la formation des complexes entre les métaux et les peptides ou les acides organiques ou bien entre les métaux et les ions inorganiques. Elle s’effectue au niveau de la paroi cellulaire ou à l’intérieur du cytoplasme. Il en résulte que le métal ne peut pas interférer avec les réactions métaboliques sensibles de la plante (Kabata-Pendias., 2010).
Cytochrome
01
• Métallothionéines (MT)
Sont des protéines largement distribuées dans le monde vivant. On les rencontre chez de nombreux procaryotes et chez la plupart des eucaryotes. Ces protéines sont caractérisées par leur richesse en cations métalliques (essentiellement Cu et/ou Zn) et par leur forte proportion de résidus cystéines (environ 30 %).
Le rôle précis des MT dans la réponse aux métaux lourds est encore débattu, mais de nombreuses observations ont montré qu’elles pourraient être impliquées dans certains mécanismes de tolérance, notamment vis-à-vis du cadmium et du cuivre. Chez Arabidopsisthaliana par exemple, il a été démontré que la présence de cuivre stimule la biosynthèse de MT et que la variation écotypique de la tolérance à ce métal est corrélée au taux de transcription des gènes MT (Murphy et Taiz, 1995). En fait, il est aujourd’hui bien établi que la surexpression de gènes MT, dans des organismes aussi variés que des cyanobactéries, des levures, des cellules de mammifères ou des plantes peut s’accompagner d’une augmentation de la tolérance à certains métaux lourds (Cu, Zn et Cd) (Misraet Genamu.,1989). • Phytochélatines (PC)
Représentent le deuxième groupe de chélateurs intracellulaires, uniquement rencontrés dans le règne végétal. De nature peptidique, ces molécules sont classées dans une petite famille apparentée aux MT, leur synthèse est stimulée par la présence de métaux lourds (Cd, Cu, Zn, etc.…). Une différence essentielle avec les autres MT réside dans l’origine biosynthétique des PC ; elles ne sont pas directement codées par le génome mais sont synthétisées par une phytochélatinesynthase, à partir d’un tripeptide précurseur, le glutathion (Glu-Cys-Gly). Bien que les PCs soient clairement impliquées dans la liaison des métaux intracellulaires, l’activité PC synthéase semble constitutive chez la plupart des plantes (De Knecht et al., 1992).
• Acides organiques
Représentent un autre groupe de chélateurs naturels. Sous cette dénomination sont classées des molécules diverses tels que des acides dicarboxyliques (acides fumarique, malique, oxalique)ou des acides tricarboxyliques (comme l’acide citrique).
00
Toutes ces petites molécules sont clairement impliquées dans les phénomènes d’accumulation. On observe souvent une stimulation de leur synthèse en présence de métaux lourds, ce qui laisse penser qu’elles assurent le transport des ions métalliques depuis les racines vers les parties aériennes de la plante. De plus, des observations récentes ont clairement montré que, au moins dans certains cas, des acides organiques pourraient être directement impliqués dans les mécanismes de tolérance. Ainsi, les capacités d’hyper-accumulation et de résistance de certaines variétés de blé noir (Fagopyrumesculentum) vis-à-vis de l’aluminium sont directement dépendantes de la synthèse d’acide oxalique (Ma et al., 1997).
• Acides aminés libres
Comme la proline, l’histidine et la cystéine, s’accumulent lors d’un stress métallique et pourraient être eux aussi impliqués dans la chélation de divers métaux lourds, notamment du zinc et du nickel (Briat et Lebrun., 1999). C’est ainsi que l’accumulation et la tolérance au nickel dans le genre Alyssum semblent principalement dues à une synthèse accrue d’histidine (Krämer et al., 1996).
3.2.2. Compartimentation cellulaire
Les plantes peuvent opérer une détoxification cytosolique par rapport au Zn, au Cd et au Pb, en les transportant dans certains compartiments de la cellule telle que les vacuoles, où ils ne peuvent plus interférer avec les processus métaboliques essentiels (Prasad et Hagemeyer., 1999). Les molécules solubles dans le cytoplasme telles que des acides organiques ou des polypeptides riches en S (comme les phytochélatines) forment des complexes avec les métaux et peuvent également fonctionner comme des «navettes» (transporteurs) pour faciliter le transport des métaux au travers le tonoplaste jusqu’à la vacuole (Tremel-Schaub et Feix., 2005).
3.3. Système antioxydant
3.3.1. Antioxydants
L'antioxydant s'oppose à l'oxydation ou inhibe réactions induites par l'oxygène ou les peroxydes. La capacité antioxydante généralement a été attribuée à l’activité
01
des enzymes antioxydants ainsi qu’aux teneur en antioxydants de faible masse moléculaire (non enzymatique) (Damir et al., 2014).
3.3.1.1. Système de défense enzymatique
Ces défenses permettent de maintenir la concentration en espèces radicalaires à un taux basal. En effet, elles possèdent une grande affinité pour les ROS, avec lesquelles elles réagissent très rapidement pour les neutraliser (BELKHEIRI., 2010).
Les antioxydants enzymatiques (le superoxydedismutase, la catalase, la glutathion peroxydase) sont considérés comme la première ligne de défense contre les ROS (Blandine., 2006).
3.3.2.2. Système de défense non enzymatique a. Glutathion réduit (GSH)
Le GSH est produit de manière intracellulaire à partir de trois acides aminés -glutamate, cystéine et glycine (Koji et Toshio., 2013).
Le GSH joue un rôle important comme antioxydant endogène et dans le maintien de l'équilibre d'oxydoréduction. En fait, le GSH participe à l'élimination du H2O2 et des LOOH, en servant de co-substrat à l'enzyme GSH-Px. (Ferrari et al., 1991). Le GSSG formé par cette première réaction est à nouveau réduit en GSH par la GSH réductase, une enzyme qui utilise le NADPH comme cofacteur. Le GSH peut inhiber la
peroxydation des lipides et s'avère efficace comme piégeur direct de certains ERO, tels les radicaux OH• et l'oxygène singulier 1’O2. (Halliwell., 1996).
b. Vitamine C ou acide ascorbique (ASC)
L'ascorbate (présent majoritairement à pH physiologique) est hydrosoluble, sont des agents réducteurs. L'ascorbate est un très bon capteur de radicaux libres oxygénés puisqu'il réagit non seulement avec les radicaux hydroxyles ·OH, mais aussi avec les radicaux superoxydes O2·-. Une propriété importante de l'ascorbate est la réparation possible de deux antioxydants, le glutathion et l'α-tocophérol (symbolisé par α-TH) à partir de leurs formes radicalaires (réactions (1) et (2))
(GARDES-03
ALBERT et al.,2003). L'ascorbate est recyclé, tout au moins en partie, par dismutation du radical ascorbyle.
AscH- + GS· → Asc·- + GSH (1) AscH- + α-T· → Asc·- + α-TH (2) C. Vitamine E
La vitamine E est regroupée la famille des tocophérols (α, β, δ, γ) (VERTUANI et al., 2004). Depuis la vitamine E n'est synthétisé que par les plantes, c'est un aliment très important nutriment pour les humains et les animaux (Afaf et Lars-Ake., 1996).Elle est antioxydant liposoluble puissant, synthétisé et accumulé dans le chloroplaste (Holländer-Czytko., 2005).Les tocophérols sont présent dans les graines oléagineuses, les feuilles et d'autres parties vertes des plantes supérieure (Afaf et Lars-Ake., 1996). Les tocophérols protégeraient l'appareil photosynthétique en piégeant l'oxygène singulet (Holländer-Czytko.,2005), sont bien reconnu pour leur inhibition efficace de l'oxydation des lipides(Afaf et Lars-Ake., 1996).
D. Caroténoïdes
Les Car sont des pigments que l'on trouve dans les plantes et les micro-organismes. Car effectuer des grandes fonctions dans les plantes. Ils protègent l'appareil photosynthétique en éteignant un sensibilisateur triplet (Chl3), 1O2 et autres radicaux libres nocifs qui se forment naturellement lors de la photosynthèse (une fonction antioxydante). Troisièmement, ils sont importants pour l'assemblage PSI et la stabilité du complexe de récolte légère protéines ainsi que la stabilisation de la membrane thylakoïde (Gill et Tuteja, 2010).
3.4. Autres systèmes de défense au stress métallique
D’autres mécanismes agissant contre les effets néfastes des métaux lourds peuvent être mis en œuvre chez les plantes :
Accumulation des métaux dans les feuilles âgées, juste avant leur abscission diminuerait ainsi les concentrations métalliques dans la plante. En général, la concentration dans les feuilles augmente avec l’âge. les concentrations en Cu, Cd, Zn
01
et Pb sont 3 à 8 fois celles des jeunes feuilles (Dahmani-Muller et al., 1999). Cette observation suggère un transport interne depuis des feuilles vertes, encore actives d’un point de vue photosynthétique, vers les feuilles qui sont sur le point de tomber, préservant ainsi la photosynthèse tout en détoxiquant la plante. Une accumulation de Cd a été également observée dans les trichomes de plusieurs espèces (Salt et al., 1995).
Biosynthèse d’éthylène : dans les racines et les feuilles est provoquée par certains métaux, comme le cadmium. L’éthylène serait alors un messager stimulant la lignification capable de limiter les flux de métaux dans les systèmes vasculaires et accélérant la réponse anti-oxydante par induction de l’activité ascorbate peroxydase, ainsi que la synthèse de métallothionéines (Sanita et Gabbrielli., 1999).
05
CHAPITRE
ІІ
Généralités sur le haricot
(Phaseolus vulgaris L.)
06
1. Origine
Le haricot est originaire d’Amérique latine et centrale, connu sous le nom scientifique de PhaseolusvulgarisL., ou il a été domestiqué depuis plus de 8000 ans (Khadir, 2018).
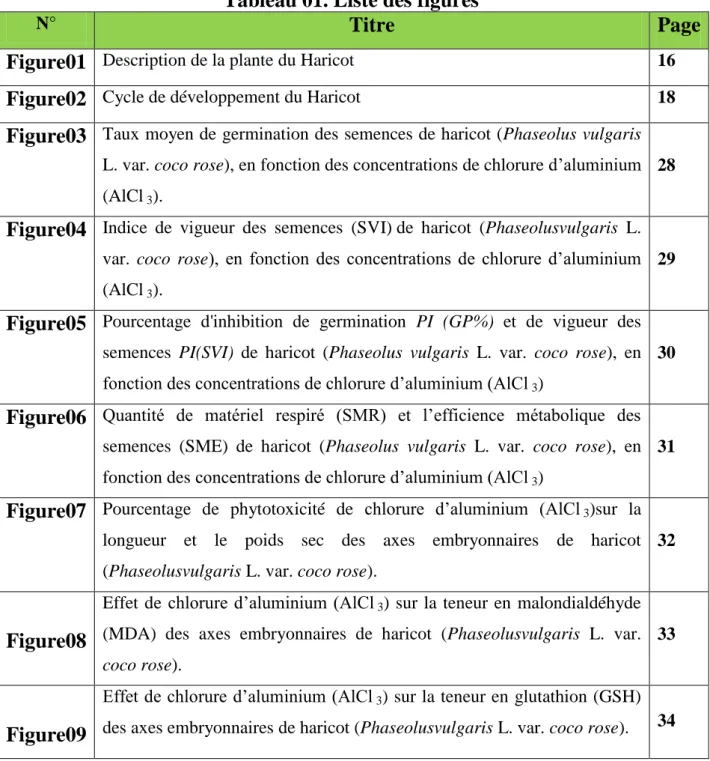
2. Caractéristiques botaniques de l'espèce
Le haricot Phaseolus vulgaris L, est une plante annuelle appartenant à l'ordre des Fabales et à la famille des Fabacées dont les feuilles sont trifoliées.
Le système radiculaire est constitué d’une racine principale et de nombreuses racines latérales qui se tiennent horizontales sur 10 cm de long. L’état structural du sol influence la profondeur d’enracinement de la plante (de 30 cm en conditions défavorables à 1 m dans d’excellentes conditions) et aussi son alimentation hydrique, déterminante pour la croissance de la plante. Une bonne implantation radiculaire permet d’éviter des problèmes de flétrissement de la plante en cas de fortes chaleurs. Sur celles–ci se développent des nodosités formées par des bactéries du genre
Rhizobium. Ces bactéries fixent l’azote de l’air en puisant l’énergie nécessaire dans
les sucres que la plante leurs fournit. Cet azote est restitué à la plante sous forme de composés azotés assimilables (Renard et al.,2007).
07
La classification de haricot dans le règne végétal comme suivante (Bouzid.,2010) : Classe : Magnoliopsida- dicotylédon.
Sous-classe : Rosidae Tribu : Phaseoleae. Sous-tribu : Phaseolinae
Famille : Fabaceae (légimineuses). Sous -famille :Papilionoideae. Ordre : Rosale.
Genre, Espèce : Paseolus vulgaris L. 4. Cycle de développement
4-1 Phase de germination
Les graines lèvent en 4 à 8 jours suivant la température. Elles doivent toutes être sorties de terre au bout de 8 jours, les cotylédons sortis du sol, se sont ouverts et la première paire de feuilles apparaît (HUBERT.,1978).
4-2 Phase de croissance
Trois à quatre jours après la levée, les cotylédons commencent à se faner (PITRAT et FOURY.,2003), cinq à six jours après la levée apparaît la première feuille trifoliolée, cinq à six jours après l'apparition de la première feuille trifoliolée apparaît la deuxième, Au bout d'un mois, le pied de haricot possède une dizaine de feuilles trifoliolées et il a atteint sa hauteur définitive de 30 à 40 cm pour les variétés naines (DUPONT et GUIGNARD.,1989).
4-3 Phase de floraison
Elle débute 3 semaines à 1 mois environ après le semis. Elle dure1 mois à 1 mois et demi suivant les condit ions climatiques. La jeune gousse met une douzaine de jours environ pour atteindre sa taille définitive (LECOMTE.,1997).
08
Une fois la taille définitive atteinte, les graines se forment en 15-20 jours. Il faut attendre encore 20 à 30 jours pour que les gousses s'ouvrent d'elles-mêmes, les graines étant mûres. Le cycle végétatif complet du haricot varie entre 75 et 130 jours (LECOMTE.,1997).
Figure 02. Cycle de développement de haricot (Renard et al.,2007). 5- Exigences climatiques du Haricot
Le haricot est une plante exigeante sur le plan des températures : il craint les gelées et nécessite des températures supérieures à 10 – 12 °C pour se développer. La période de culture du haricot est donc exclusivement estivale. L’eau joue un rôle important pour l’élaboration du rendement et la qualité de la récolte (apparition d’un fil au niveau de la nervure de la gousse si manque d’eau en fin de cycle). La plante n’a pas d’exigences particulières concernant le type de sol mais est sensible aux pH bas (optimum entre 6.1 et 7.4). Un sol bien aéré favorise le développement des nodosités (Renard et al.,2007)
09
DEUXIEME PARTIE
11
CHAPITRE III
10
1. Objectif de l’expérimentation
L’objectif de notre travail est l’étude de l’influence du stress métallique sur la germination et la croissance et quelques paramètres biochimiques des axes embryonnaires du haricot (Phaseolus vulgaris L.).
2. Matériel végétal et conditions de culture
Le matériel végétal utilisé dans ce travail est la variétédu haricot : coco rose (variété italienne).
2.1. Germination des graines
Les graines de haricot (Phaseolus vulgaris L.) sont triées et désinfectées par un trempage à l’eau de Javel (12°) diluée (10 %) pendant 10 min, puis rincées abondamment à l’eau distillée pour éliminer les résidus de désinfectant ayant adhéré à la graine.
L'état initial (graines non germées) a été obtenu par un gonflement dans l'eau distillée pendant 4 h à 4°C (Murray et al, 1979).
Après 4h les graines de haricot sont prises de façon aléatoire et mises à germer dans des boites de Pétri de 9cm de diamètre, tapissées de papier filtre doublé et imbibé d’eau distillée ou traitée et chaque boite comporte 12 graines.
Le test de germination se déroule en salle au niveau de la Faculté des Sciences de la Nature et de la Vie de l’Université Echahid Hamma Lakhdar -El OUED sous conditions à l’obscurité et à température moyenne de 27 ± 1°C.
2.2. Traitement métallique
Le métal utilisé pour cette étude est l’Aluminium sous forme de chlorure de l’Aluminium (AlCl3 6H2O).Les graines de haricot sont traitées par des solutions métalliques, à trois concentrations différentes : 0 (eau distillé), 100 ,300 et 600mg/l à raison de 5 à 7ml / boite / jour, l'expérience a duré huit jours. Pour chaque traitement 10 répliquâtes sont réalisés.
11
3. Méthodes et mesures effectuées
Les mesures ont été réalisées à la fin de l’expérimentation (après 8 jours) sur des paramètres de germination et de croissance et quelques caractéristiques biochimiques des axes embryonnaires de haricot.
3.1. Paramètres de germination
3.1.1. Taux moyen de germination des graines
C’est le pourcentage maximal de grains germés après 7 jours sur le nombre total de grains mis à germer .Une graine est considérée comme ayant germé, lorsque sa radicelle a au moins 2 mm de longueur (Krishnasamy et Seshu., 1990),).Taux moyen de germination (PG%)s’exprime en pourcentage (%) selon la formule suivante:
PG% = (NG/NGG) x 100 Où, NG: nombre de graines germées.
NGG: nombre de graines mises à germer. 3.1.2. Indice de vigueur des semences (SVI) :
L’indice de vigueur des semences (SVI) a été déterminé selon la formule donné par Abdul-Baki and Anderson (1973) :
SVI = (GP% x EAL) / 100
Où, EAL : longueur totale des axes embryonnaires (radicule + hypocotyle).
3.1.3. Pourcentage d'inhibition de germination et de vigueur des semences D’après la méthodologie de Nijara et al. (2019), on peut calculer le pourcentage d'inhibition : de la germination PI (PG%) et de la vigueur des semences PI(SVI), selon les formules suivantes :
PI (PG %) = 100 – (
PI(SVI) = 100 – (
13
4. Mobilisation des réserves et l’efficience du métabolisme des
graines
Efficience métabolique des semences: Selon Rao and Sinha (1993), l'efficience métabolique des semences on peut définie comme la quantité de matière sèche de la plumule et de racines (g) produite à partir de 1 unité (g) de poids sec de semences qui a été respirée ;donc, la valeur de l’efficience métabolique des semences (SME) est élevée, plus l’efficience des semences est élevée car davantage de réserves de semences seraient utilisées pour produire des racines et des parties aériennes.
Selon la méthodologie de Rao and Sinha (1993), la quantité de matériel de semence respiré (SMR) a été calculée selon la formule suivante :
SMR = SDW- (EAW + RCW) Où, SDW : poids sec des graines avant germination
EAL : longueur totale des axes embryonnaires (radicule + hypocotyle) RCW : poids sec restante de cotylédons
L'efficience métabolique des semences (SME) a été calculée selon la formule suivante (Rao and Sinha, 1993) :
SME =
5.
Paramètres
de
croissance
et
quelques
caractéristiques
biochimiques des axes embryonnaires
5.1. Longueur et poids sec des axes embryonnaires
Longueur et poids sec des axes embryonnaires ont été déterminé après 8 jours de traitement, 10 plantules sont prélevées pour chaque traitement, les plantules sont fractionnées en deux parties : les axes embryonnaires (radicule + hypocotyle) et les parties restantes des graines (cotylédons).
La longueur des axes embryonnaires EAL (mm) a été mesurée à l’aide d’un papier millimétrique.
11
Le poids sec des axes embryonnaires EAW (mg) est obtenu après dessiccation du matériel végétal dans une étuve pendant 28h à 70 °C. Les échantillons ont été pesés après refroidissement, à l’aide d’une balance analytique.
5.2. Pourcentage de Phytotoxicité de l'aluminium sur la longueur et le poids sec des axes embryonnaires :
Selon la méthodologie de Copeland ( 1976) , le pourcentage de phytotoxicité de la longueur des axes embryonnaires EALP(%)et pois sec des axes embryonnaires
EAWP(%) ont été déterminé selon les formules suivantes :
EALP (%) = ((EALcontrol – EALtreatment) / EALcontrol) x 100 EAWP (%) = ((EAWcontrol – EAWtreatment) / EAWcontrol) x 100 6. Caractéristiques biochimiques des axes embryonnaires
6.1. Dosage du malondialdéhyde (MDA)
Selon la méthode décrite par Velikova et al. (2000), les échantillons fraiches (200 mg) ont été broyés, à l’aide d’un mortier en porcelaine, avec 1 ml d’acide trichloracétique (TCA: 0.1 %). Le broyat a été centrifugé pendant 15 min à 15 000 gà 4 °C, ensuite, un volume de 0.5 ml de surnageant a été ajouté à un volume de 1 ml d’acide thiobarbiturique (TBA: 0.5 %) préparé dans du TCA 20 %. Le tout a été incubé pendant 30 min dans un bain-marie à 100 °C. Dans ces conditions, les composés aldéhydiques, essentiellement le malondialdéhyde, vont réagir avec le TBA pour former le complexe TBA-MDA. La réaction a été arrêtée par un refroidissement immédiat dans de la glace pilée, pendant 10 min. Le surnageant a été récupéré pour le dosage des lipoperoxydes par colorimétrie. L’absorbance est lue à 532 et 600 nm contre un blanc contenant un mélange de TBA-TCA. Après soustraction de l’abondance non spécifique lue à 600 nm, la concentration du malondialdéhyde (exprimée en µmole g-1 MF) a été calculée à l’aide de son coefficient d’extinction (ε =155 mM-1.cm-1) selon l’équation suivante (Velikova et al., 2000):
MDA = (
Où, V (cuve): volume de la cuve = 1 ml
15
V (TBA+surnageant): somme du volume de TBA et celui de l’extrait du surnageant en ml.
MF: masse de la matière fraîche des échantillons en g. 6.2. Dosage de glutathion(GSH)
Le dosage du glutathion a été réalisé selon la méthode de Weckberker et al. (1988). Le principe de ce dosage repose sur la mesure de l'absorbance optique de l'acide 2-nitro-5-mercapturique. Ce dernier résulte de la réduction de l'acide 5,5- dithio-bis-2-nitrobenzoique (réactif d'Ellman, DTNB) par les groupements (-SH) du glutathion. Pour cela une déprotéinisation de l'homogénat est indispensable afin de garder uniquement les groupements thiol spécifiques du glutathion.
25mg des axes embryonnaires de haricot fraiches est broyé à froid avec 2ml tampon phosphate (0,1 M pH= 6,5) le broyat filtré et centrifugé à 5000tr/mn pendant 15mn. L’homogénat doit d’abord subir une déprotéinisation par l’acide sulfosalysilique ASS (0,25%). Pour cela, au 0,8ml de l’homogénat sont additionnés 0,2ml d’ASS, le mélange est vortexé et laissé pendant 15min dans un bain de glace puis centrifugé à 1000tr/min pendant 5min. Le surnageant est utilisé comme source d’enzymes et il doit être conservé au congélateur à -80°C jusqu’au moment du dosage. Le volume réactionnel contient : 0,5ml d’extrait enzymatique, 1ml tampon tris-EDTA, 0,025ml DTNB. L’étalonnage de l’appareil se fait par 0,5ml eau distillé, 1ml tampon Tris-EDTA, 0,025ml DTNB. La lecture des D.O au spectrophotomètre à une longueur d’onde de 412nm. La concentration du GSH est obtenue par la formule ci-dessous, et la concentration du GSH est exprimée en µmole/mg de matière fraîche.
GSH = (
Où, DO = densité optique.
1 = volume total des solutions utilisées dans la déprotéinisation=0,8ml d’homogénat+0,2ml d’ASS.
1,525 = volume total des solutions utilisées dans le dosage de la GSH au niveau du surnagent=0,5 ml surnagent+1ml Tris-EDTA+0,025ml DTNB.
16
0,8 = volume de l’homogénat trouvé dans 1 (ml). 0,5 = volume du surnagent trouvé dans 1,525.
MF: masse de la matière fraîche des échantillons en mg.
7. Analyse statistique
Les résultats des tests effectués sont exprimés en moyenne ± déviationstandard (SD). La différence entre les moyennes a été effectuée par le test d'ANOVA à un facteur (facteur de stress métallique (AlCl3)), et les valeurs de P ≤ 0.05 sont considérées statistiquement significatives. La comparaison (Grouping) des moyennes a été déterminée par le test de Fisher (test de LSD) à l'aide du logiciel Minitab17. Les courbes et les histogrammes sont tracés par le logiciel Excel de Microsoft Office 2010.
17
CHAPITRE ІV
18
I.
Résultats
І.1. Paramètres de germination
І.1.1. Taux moyen de germination des graines
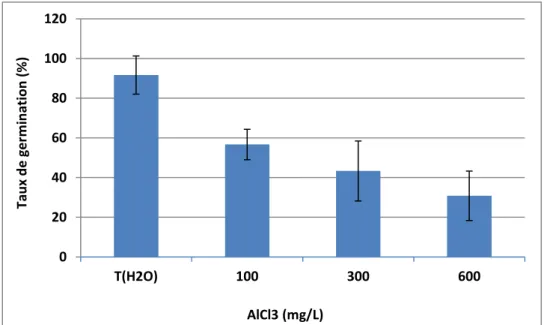
D'après les résultats obtenus (Figure 04), les échantillons témoins (non stressés) des graines de haricot avaient une bonne vitalité et le taux de germination était élevé (91,67%).
De plus, une diminution significative des taux de germination des graines de haricot a été enregistrée sous l'influence des concentrations de sels de chlorure d'aluminium (AlCl3) dans le milieu, et le taux le plus bas (30,83%) a été enregistré à la concentration 600 mg/L (AlCl3).
L'analyse de la variance ANOVA a confirmé que l'effet du facteur de stress sur le paramètre de taux de germination était d'une différence très hautement significative (P<0.001).
Figure 03. Taux moyen de germination des semences de haricot (Phaseolus vulgaris L. var. coco rose), en fonction des concentrations de chlorure d’aluminium (AlCl 3).
Les valeurs représentent la moyenne de cent vingt (10) expériences individuelles (± SD). 0 20 40 60 80 100 120 T(H2O) 100 300 600 Tau x d e ger m in ation ( % ) AlCl3 (mg/L)
19
І.1.2. Indice de vigueur des semences (SVI)
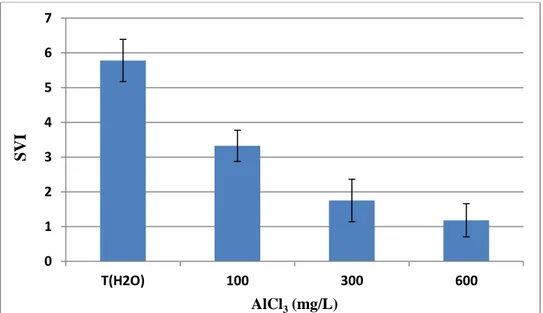
D’après les résultats obtenus (Figure 05), pour l'indice de vigueur des semences en présence de chlorure d’aluminium (AlCl 3) au milieu, une diminution significative de l'indice SVI a été observée avec l'augmentation des concentrations d'AlCl3. La valeur la plus basse (5,78) a été enregistrée sous l'influence de la concentration 600 mg/L, et la valeur la plus élevée (1,18) a été enregistrée chez les échantillons témoins (TH2O).
L’analyse de la variance ANOVA a montré que l’effet des concentrations d'AlCl3 sur les graines de haricot varie d’une manière très hautement significative (P ≤ 0.001), pour le paramètre de SVI.
Figure 04. Indice de vigueur des semences (SVI) de haricot (Phaseolus vulgaris L. var. coco rose), en fonction des concentrations de chlorure d’aluminium (AlCl 3)
Les valeurs représentent la moyenne de 10 expériences individuelles (± SD). І.1.3. Pourcentage d'inhibition de germination et de vigueur des semences
La figure 06 présente l’évolution de pourcentage d'inhibition de germination
PI (GP%) et de vigueur des semences PI(SVI) mesurée sur les graines de haricot
conduites sous stress métallique. Il en résulte que les pourcentages d'inhibition sont augmentées avec des différences très hautement significatives (P<0.001), pour les deux critères de germination (GP% et SVI)
0 1 2 3 4 5 6 7 T(H2O) 100 300 600 SV I AlCl3 (mg/L)
31
Figure 05. Pourcentage d'inhibition de germination PI (GP%) et de vigueur des semences PI(SVI) de haricot (Phaseolus vulgaris L. var. coco rose), en fonction des
concentrations de chlorure d’aluminium (AlCl 3)
Les valeurs représentent la moyenne de 10 expériences individuelles (± SD).
І.2. Mobilisation des réserves et l’efficience du métabolisme des
graines
І.2.1. Quantité de matériel de semence respiré (SMR)
A partir des résultats obtenus (figure 07), une diminution de la quantité de matériel de semence respiré (SMR) a été enregistrée, chez le haricot, sous l’influence des concentrations de stress métallique par rapport au témoin.
L’analyse de la variance ANOVA a montré que pour ce paramètre, l’effet de facteur de stress (AlCl 3)varie d’une manière très hautement significative (P ≤ 0.001). І.2.2. Efficience métabolique des semences (SME)
Les résultats obtenus (figure 07) indiquent une diminution de l’efficience métabolique des semences de haricot, notamment sous l'influence de la concentration élevée de chlorure d’aluminium (600 mg/L), où la valeur était de 0,064 mg mg-1
. Tandis que, sous l’effet de faible concentration (100 mg/L) d’AlCl 3, les semences de
0 10 20 30 40 50 60 70 80 90 100 100 300 600 Inh ibit ion (%) AlCl3 (mg/L) PI (GP %) PI (SVI %)
30
haricot ont montré une légère augmentation de SME, par apport aux échantillons témoins (TH2O), où la valeur enregistrée était de 0,1 mg mg-1.
L’analyse de la variance ANOVA a montré que l’effet de facteur de stress varie d’une manière significative (P<0.05), pour ce paramètre (SME).
Figure 06. Quantité de matériel respiré (SMR) et l’efficience métabolique des semences (SME) de haricot (Phaseolus vulgaris L. var. coco rose), en fonction des
concentrations de chlorure d’aluminium (AlCl 3)
Les valeurs représentent la moyenne de dix (10) expériences individuelles (± SD).
І.3. Paramètres de croissance
І.3.1. Longueur et poids sec des axes embryonnaires
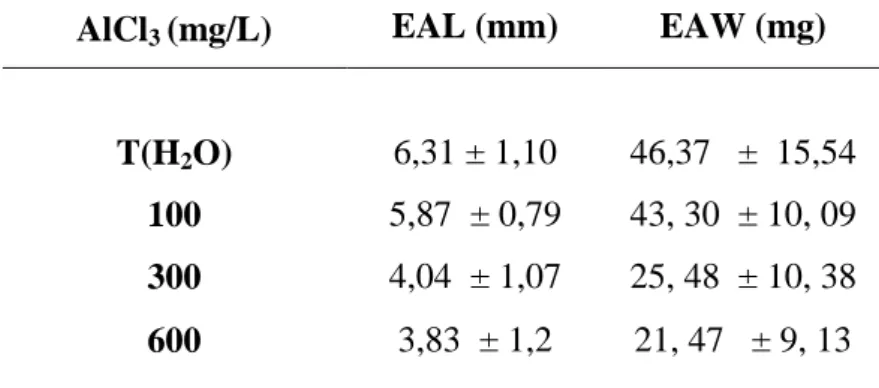
En général, le tableau (01) montre que la longueur et le poids sec moyen des axes embryonnaires de haricot sont inversement proportionnels à la concentration du milieu en chlorure d’aluminium (AlCl 3).
L’analyse de la variance ANOVA a confirmé que pour ces deux paramètres, l’effet de facteur de stress varie d’une manière très hautement significative (P < 0.001). 0 100 200 300 400 500 600 0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 0.16 T(H2O) 100 300 600 SMR ( m g) SME ( m g m g -1 ) SME (mg mg-1) SMR (mg)
31
Tableau 01. Longueur moyenne (EAL) et le poids moyen des axes embryonnaires (EAW) de haricot (Phaseolus vulgaris L. var. coco rose), en fonction des concentrations de Chlorure d’aluminium (AlCl3)
AlCl3 (mg/L) EAL (mm) EAW (mg)
T(H2O) 6,31 ± 1,10 46,37 ± 15,54 100 5,87 ± 0,79 43, 30 ± 10, 09 300 4,04 ± 1,07 25, 48 ± 10, 38 600 3,83 ± 1,2 21, 47 ± 9, 13
Les valeurs représentent la moyenne de dix (10) expériences individuelles (± SD). І.3.2. Pourcentage de Phytotoxicité de l'aluminium sur la longueur et le poids sec des axes embryonnaires
Les résultats obtenus (Figure 08) indiquent une nette augmentation de pourcentage de phytotoxicité de l'aluminium sur la longueur et le poids sec des axes embryonnaires des plantules de haricot, avec l’augmentation des concentrations d’AlCl 3, par rapport aux échantillons témoins.
L’analyse statistique (ANOVA) a montré que pour ces deux paramètres, l’effet de facteur de stress varie d’une manière très hautement significative (P<0.001).
-40 -20 0 20 40 60 80 100 300 600 Ph yt ot oxi ci té )%( AlCl3 (mg/L) EALP(%) EAWP(%)
33
Figure 07 : Pourcentage de phytotoxicité de chlorure d’aluminium (AlCl 3) sur la longueur et le poids sec des axes embryonnaires de haricot (Phaseolus vulgaris L. var.
coco rose).Les valeurs représentent la moyenne de dix (10) expériences individuelles (±SD).
І.4. Caractéristiques biochimiques des axes embryonnaires
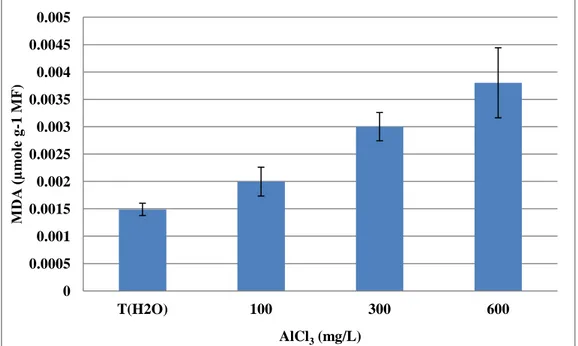
І.4.1. Teneur en malondialdéhyde (MDA) des axes embryonnaires
Les résultats de dosage de malondialdéhyde (figure 09) montrent que son concentration varie d’une façon très hautement significative (P≤0.001), sous l’effet de chlorure d’aluminium (AlCl 3).
D’une manière générale, les différentes concentrations (100, 300, 600 mg/l) d’AlCl 3 provoquent une augmentation significative de l’activité de la peroxydation lipidique des axes embryonnaires des plantules de haricot, par rapport aux échantillons témoin.
Figure 08. Effet de chlorure d’aluminium (AlCl 3) sur la teneur en malondialdéhyde (MDA) des axes embryonnaires de haricot (Phaseolus vulgaris L. var. coco rose)
Les valeurs représentent la moyenne de trois expériences individuelles (± SD).
0 0.0005 0.001 0.0015 0.002 0.0025 0.003 0.0035 0.004 0.0045 0.005 T(H2O) 100 300 600 M DA )µm ole g-1 M F ) AlCl3 (mg/L)
31
І.4.2. Teneur en glutathion (GSH) des axes embryonnaires
Les résultats obtenus montrent que le contenu en glutathion des axes embryonnaires du haricot varie d’une façon très hautement significative (P ≤ 0,001), sous l’effet de chlorure d’aluminium (AlCl 3).
A d’une façon globale, la figure 10 montre que le contenu des axes embryonnaires en glutathion, diminué progressivement chez les graines de haricot traitées, pour les trois concentrations croissantes d’AlCl 3, par rapport au témoin.
Figure 09. Effet de chlorure d’aluminium (AlCl 3) sur la teneur en glutathion (GSH) des axes embryonnaires de haricot (Phaseolus vulgaris L. var. coco rose)
Les valeurs représentent la moyenne de trois expériences individuelles (± SD).
0 0.001 0.002 0.003 0.004 0.005 0.006 0.007 T(H2O) 100 300 600 GSH ( µ m o le m g -1 M F) AlCl3 (mg/L)