Rôle des hormones thyroïdiennes sur le développement
neurologique des circuits cardio-respiratoires chez le
rongeur
Thèse
Jean-Philippe Rousseau
Doctorat en neurobiologie
Philosophiæ doctor (Ph. D.)
Québec, Canada
Rôle des hormones thyroïdiennes sur le
développement neurologique des circuits
cardio-respiratoires chez le rongeur.
Thèse
Jean-Philippe Rousseau
Sous la direction de :
Résumé
Les hormones thyroïdiennes sont essentielles au bon développement du système nerveux central. Ce dernier est très vulnérable à toute déficience en hormones thyroïdiennes, spécialement à la période périnatale précoce où il dépend entièrement du transfert de la part de la mère. Toute réduction du taux d’hormones thyroïdiennes chez la mère ou le retrait précoces du fœtus par la naissance prématurée peut avoir d’importants effets néfastes sur la formation du cerveau de la progéniture à court et long terme. Malgré l’état actuel des connaissances concernant l’effet de la carence en hormones thyroïdiennes sur le développement et la fonction du système nerveux central, leur influence sur les circuits nerveux qui régulent le système cardio-respiratoire reste méconnue. Nous proposons que les hormones thyroïdiennes au cours de la période périnatale du rat soient nécessaires au bon développement du réseau neuronal responsable du contrôle cardio-respiratoire. Afin de tester cette hypothèse, nous avons reproduit un modèle d’hypothyroïdisme expérimental par l’exposition de la femelle sur l’entièreté de la gestation à l’agent anti-thyroïdien méthimazole (MMI). L’évaluation des effets sur la commande respiratoire centrale, la ventilation, la réponse à l’hypoxie et l’inhibition cardio-respiratoire par stimulation du chémoréflexe laryngé a été divisée sur différentes tranches d’âge (jours postnataux : P1-P4-P15). Le traitement de MMI réduit le rythme respiratoire produit centralement dans les premiers jours de vie. Un effet âge dépendant du traitement est présent sur la ventilation de l’animal entier et sa réponse à l’hypoxie. L’inhibition cardio-respiratoire est augmentée chez les animaux déficients en hormones thyroïdiennes lors de la stimulation du chémoréflexe laryngé. L’activation importante du système GABAergique est au cœur des conséquences observées. Enfin, nous proposons que les cellules de type «microglie» pourraient moduler le développement du réseau neuronal de contrôle respiratoire en réponse aux hormones thyroïdiennes. En culture cellulaire, ses fonctions sont augmentées par l’exposition à l’hormone T3 et l’effet dépend du micro-environnement. Nous concluons que les hormones thyroïdiennes sont nécessaires pour la mise en place du système nerveux de contrôle respiratoire et autonome.
Abstract
Thyroid hormones are essential for the normal development of the central nervous system. The latter presents a high vulnerability to any thyroid hormones deficiency, especially in the early stages of perinatal development, when the mother is the only source for the foetus. At that time, any maternal hypothyroidism or premature birth can alter thyroid hormones supply and compromise brain functions on short and long term. Despite the current state of knowledge concerning the effect of thyroid hormone deficiency on the development and function of the central nervous system, their influence on the nervous circuits that regulate the cardiorespiratory system remains unknown. We propose that thyroid hormones during the perinatal period are necessary for the proper development of the neural network responsible for cardiorespiratory control. To test this hypothesis, we reproduced a model of experimental hypothyroidism by exposing the pregnant dams over the entire gestation to the anti-thyroid agent, methimazole (MMI). Effects of the treatment were evaluated on central respiratory command, ventilation, hypoxic response and cardiorespiratory inhibition by laryngeal chemoreflex stimulation, across multiple age groups (P1-P4-P15). MMI treatment reduces the central respiratory rhythm in the first days of life. An age-dependent effect was noted on whole animal ventilation and hypoxic response. Cardiorespiratory inhibition following laryngeal chemoreflex stimulation is increased in thyroid hormones deficient pups. The enhanced GABAergic system activation is a major player in the consequences observed here. Finally, we proposed that microglia could modulate development of the neuronal respiratory control network in response to thyroid hormones. Using cell culture, we demonstrated that their functions are increased by the exposure to T3 and the effect is mediated by the surrounding microenvironment. We conclude that thyroid hormones are necessary for the proper establishment of the respiratory and autonomic nervous control systems.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des figures ... xi
Liste des tableaux ... xiii
Liste des abréviations et des sigles ... xiv
Remerciements ... xvi
Avant-Propos ... xviii
Partie 1 ... 1
Introduction ... 1
1. Hormones thyroïdiennes et développement ... 1
1.1 Hormones thyroïdiennes chez les vertébrés ... 1
1.2. Axe hypothalamo-hypophyso-thyroïdien ... 2
1.2.1 Métabolisme des hormones thyroïdiennes ... 3
1.2.2 Transport et contrôle local des niveaux d’hormones thyroïdiennes ... 5
1.2.3 Action génomique et non-génomique des hormones thyroïdiennes ... 7
1.3 Ontogénèse des hormones thyroïdiennes et développement neurologique ... 10
1.3.1 Apport d’hormones thyroïdiennes maternelles pendant la gestation ... 12
1.3.2 Hormones thyroïdiennes en fin de gestation et période postnatale ... 14
1.3.3 Fenêtre temporelle des procédés neuro-développementaux influencés par les hormones thyroïdiennes ... 15
1.4 Causes de la déficience en hormones thyroïdiennes ... 18
1.4.1 L’hypothyroïdisme et l’hypothyroxinémie maternelle ... 18
1.4.2 Prématurité et production d’hormones thyroïdiennes ... 20
2. Système de contrôle respiratoire ... 21
2.1 Principes de base de la ventilation pulmonaire ... 21
2.2 Composantes centrales de la commande respiratoire ... 24
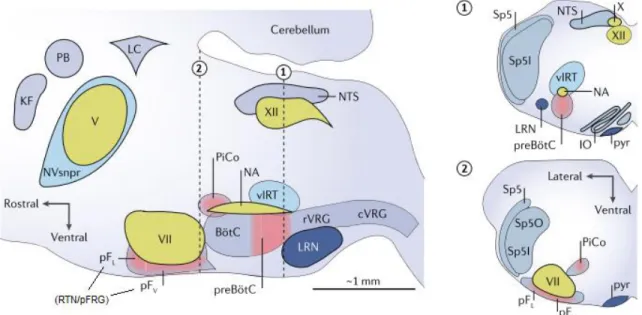
2.2.1 Le complexe pré-Bötzinger ... 27
2.2.2 Le complexe Bötzinger ... 29
2.2.3 Le noyau rétrotrapézoïde/groupe respiratoire parafacial ... 29
2.2.5 Les groupes respiratoires ventraux ... 31
2.2.6 Le noyau du tractus solitaire ... 32
2.2.7 Les noyaux du Raphé ... 33
2.2.8 Les groupes neuronaux respiratoires du pont ... 34
2.3 La genèse du rythme respiratoire ... 35
2.3.1 Les neurones rythmiques ... 36
2.3.2 Débats sur la génération du rythme ... 38
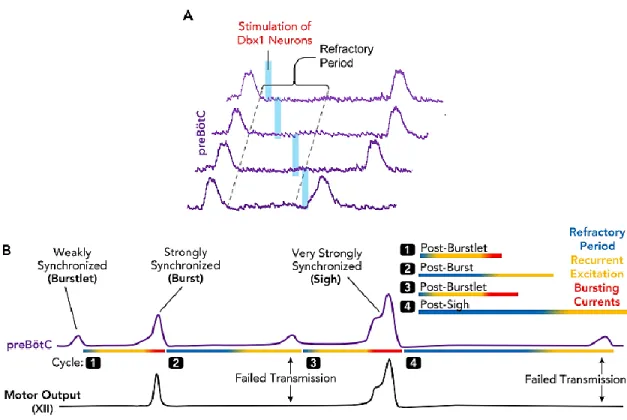
2.3.3 Le triangle rythmogénique ... 39
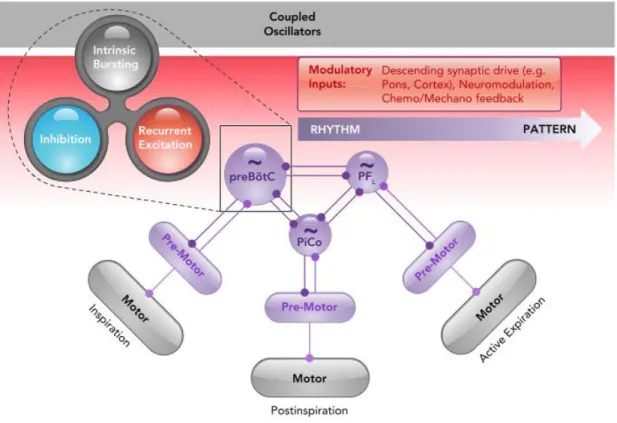
2.3.4 L’hypothèse du triple oscillateur ... 43
2.4 Développement du réseau de contrôle respiratoire ... 46
2.4.1 Modification cellulaire du réseau de contrôle respiratoire au cours du développement ... 46
2.4.2 Maturation physiologique du réseau de contrôle respiratoire en période périnatale ... 48
2.5 Physiologie de la réponse à l’hypoxie ... 50
2.5.1 Les corps carotidiens ... 51
2.5.2 Les corps aortiques ... 53
2.5.4 Réponse centrale à l’hypoxie ... 54
2.5.5 Réponse ventilatoire à l’hypoxie ... 58
2.6 Le chémoréflexe laryngé... 59
2.6.1 Définition et développement du chémoréflexe laryngé ... 59
2.6.2 Physiologie du chémoréflexe laryngé ... 61
2.7 Neuromodulation de la respiration par les hormones thyroïdiennes ... 63
3. Neurotransmission GABAergique ... 65
3.1 Action générale du GABA dans le développement ... 65
3.2 Métabolisme du GABA ... 67
3.3 Récepteur GABAA ... 69
3.3.1 Structure du récepteur GABAA ... 70
3.3.2 Modulation du récepteur GABAA ... 73
3.3.3 Changement développementaux de l’homéostasie du chlore ... 75
3.4 Récepteur GABAB ... 78
3.5 Modulation de la respiration par le GABA au cours du développement ... 80
3.6.1 Effet sur le métabolisme du GABA ... 85
3.6.2 Effet sur la fonction des récepteurs GABAergiques ... 86
4. Les microglies : effecteurs de plasticité au cours du développement... 87
4.1 Description des microglies ... 87
4.1.1 Physiologie des microglies ... 87
4.1.2 Origine développementale des microglies ... 88
4.2 Rôles des microglies dans le développement... 91
4.2.1 Les nettoyeurs du système nerveux central en développement... 91
4.2.2 Support de la survie et prolifération des neurones en développement ... 93
4.3 Influence des hormones thyroïdiennes sur les microglies ... 93
4.4 Microglie et contrôle respiratoire... 94
5. Problématique, objectifs et hypothèses de la recherche ... 95
5.1 Problématique ... 95
5.2 Objectif général ... 96
5.3 Hypothèse générale ... 96
5.4 Objectifs et hypothèses spécifiques ... 97
Partie 2 ... 101
Chapitre 1 ... 101
Thyroid hormones during the perinatal period are necessary to respiratory network development of newborn rats. ... 101
1.1 Résumé ... 102
1.2 Abstract ... 103
1.3 Introduction ... 104
1.4 Methods ... 106
1.4.1 Ethical approval... 106
1.4.2 Maternal methimazole (MMI) treatment to induce thyroid hormone deficiency in rat pups. ... 106
1.4.3 Thyroid hormone supplementation ... 107
1.4.4 Assessment of THs inhibition and supplementation efficacy by blood T4 measurements ... 108
1.4.5 In-vivo plethysmographic recordings ... 109
1.4.6 In-vitro measurements of neural respiratory-related activity ... 110
1.4.7 Western blot analysis ... 111
1.4.9 Statistics ... 113
1.5. Results ... 115
1.5.1 Efficacy of anti-thyroid hormone treatment (MMI) on pup’s thyroxine (T4) blood levels, weight and body temperature. ... 115
1.5.2 Thyroid hormones deficiency augments apnea frequency and duration. ... 117
1.5.3 Thyroid hormones deficiency depresses ventilation at rest. ... 119
1.5.4 Thyroid hormones deficiency delays development of phrenic motor output. ... 121
1.5.5 Enhancement of GABAergic inhibition by thyroid hormones deficiency is significant at 4 days old. ... 123
1.5.6 Thyroid hormones deficiency increases protein levels of GABAA receptor subunit α1. ... 127
1.6 Discussion ... 129
1.6.1 Effectiveness of thyroid hormones deficiency and L-T4 supplementation protocol ... 129
1.6.2 Thyroid hormones deficiency increases respiratory instability and alters ventilation in newborn pups. ... 130
1.6.3 Putative mechanisms underlying thyroid hormone modulation of respiratory development. ... 131
1.7 Conclusion ... 134
Chapitre 2 ... 135
Maternal thyroid hormone deficiency and cardiorespiratory disorder in rat pups. ... 135
2.1 Résumé ... 136
2.2 Abstract ... 137
2.3 Introduction ... 138
2.4 Methods ... 140
2.4.1 Ethical approval... 140
2.4.2 Maternal treatment and thyroid hormone deficiency in rat pups ... 140
2.4.3 Thyroid hormone measurements ... 141
2.4.4 In-vivo respiratory recordings in intact (non-sedated) pups ... 141
2.4.5 Laryngeal chemoreflex stimulation protocol in anesthetised pups ... 142
2.4.6 Data analysis and statistics ... 143
2.5 Results ... 146
2.5.1 Efficacy of maternal methimazole treatment (MMI) on thyroxin levels (T4) and pups ... 146
2.5.2 Thyroid hormone deficiency attenuates the breathing frequency response to
hypoxia in intact pups ... 148
2.5.3 Effect of anesthesia and thyroid hormone deficiency on cardiorespiratory activity at rest and in responses to laryngeal chemoreflex stimulation ... 151
2.6 Discussion ... 154
2.6.1 Critique of the model... 154
2.6.2 Hypoxic ventilatory response is attenuated thyroid hormone deficient pups. ... 156
2.6.3 Thyroid hormone deficiency augments anesthesia-induced respiratory depression. ... 157
2.6.4 The GABAergic regulation of the laryngeal chemoreflex following thyroid hormone deficiency ... 158
2.7 Conclusion ... 159
Chapitre 3 ... 160
Is regulation of microglial functions by thyroid hormone dependent on the micro-environment?: insights from the cortex and brainstem of newborn mice ... 160
3.1 Résumé ... 161
3.2 Abstract ... 162
3.3 Introduction ... 163
3.4 Material and methods ... 165
3.4.1 Ethical approval of animal experiments ... 165
3.4.2 Cell culture ... 165
3.4.3 Motility assay ... 167
3.4.4 Phagocytosis assay ... 167
3.4.5 Statistical analysis ... 168
3.5 Results ... 168
3.5.1 Influence of T3 on microglial motility is dependent on the micro-environment. ... 168
3.5.2 T3 increases phagocytosis in the single-cultured microglia from brainstem. .... 171
3.6 Discussion ... 173
3.6.1 Microglial motility in the brain is region dependent. ... 173
3.6.2 Direct microglial response to T3: assessment of motility according to the micro-environment. ... 174
3.6.3 The effect of T3 on microglial phagocytosis involves specific mechanisms ... 174
3.7 Conclusion ... 175
Discussion / conclusion générale ... 177
1. Principaux résultats ... 177
2. Précisions méthodologiques et limites des études ... 178
2.1 L’hypothyroïdisme expérimental par exposition à l’agent anti-thyroïdien méthimazole ... 178
2.2 L’utilisation de la pléthysmographie sur l’animal entier ... 180
2.3 Le modèle expérimental d’enregistrements électrophysiologiques sur préparations de tronc cérébral-moelle épinière isolés ... 181
2.4 Évaluation des niveaux de protéines du système GABAergique sur moelle allongée entière ... 183
3. Les hormones thyroïdiennes et le réseau neuronal de contrôle respiratoire ... 184
3.1 Les hormones thyroïdiennes ont-elles un effet sur le développement des noyaux respiratoires du tronc cérébral? ... 184
3.2 Effets dépressifs du rythme respiratoire par la déficience en hormones thyroïdiennes : la balance excitation/inhibition en cause ? ... 186
3.3 La chémoréception centrale est affectée par la déficience en hormones thyroïdiennes ... 188
4. L’effet d’une déficience en hormones thyroïdiennes varie selon l’âge ... 189
5. Retour sur la technique de culture primaire de microglie du tronc cérébral ... 192
5.1 Utiliser la culture cellulaire sur tronc cérébral entier pour répondre aux questions ... 192
5.3 Critique du modèle ... 193
6. Retombées dans la recherche clinique ... 194
7. Conclusion générale ... 196
Partie 4 ... 198
Bibliographie ... 198
Partie 5 ... 246
Liste des figures
Figure 1. Axe hypothalamo-hypophyso-thyroïdien. ... 3
Figure 2. Schéma de la synthèse des hormones thyroïdiennes. ... 5
Figure 3. Représentation schématique du transport et déodination des hormones thyroïdiennes. ... 7
Figure 4. Effet non-génomique de T3 et T4. ... 9
Figure 5. Résumé du développement fœtal et postnatal du cerveau humain en relation avec les hormones thyroïdiennes. ... 11
Figure 6. Les hormones thyroïdiennes au cours du développement postnatal. ... 15
Figure 7. Les hormones thyroïdiennes et le développement du cerveau. ... 18
Figure 8. Le système respiratoire. ... 23
Figure 9. Générateur de patron central (CPG). ... 25
Figure 10. Noyaux et groupes respiratoires du tronc cérébral impliqués dans la génération et régulation du rythme respiratoire. ... 26
Figure 11. Les types de neurones rythmiques selon les phases de ventilation. ... 37
Figure 12. Interactions entre la synchronisation, la décharge et la période réfractaire des cellules du préBötC. ... 41
Figure 13. Vision contemporaine de l’origine du rythme respiratoire. ... 45
Figure 14. Ontogenèse du réseau neuronal responsable de la rythmogenèse respiratoire. . 47 Figure 15. Enregistrements in-vitro et in-utero de l’activité respiratoire fœtal du rat. ... 49
Figure 16. Illustration schématique de l’activité sensorielle du corps carotidien en réponse à l’hypoxie. ... 53
Figure 17. Réponse ventilatoire à l’hypoxie. ... 59
Figure 18. Circuits neuronaux impliqués dans le chémoréflexe laryngé fœtal. ... 62
Figure 19. Métabolisation du GABA. ... 67
Figure 20. Diagramme schématique de la synthèse et le transport du GABA dans la synapse. ... 69
Figure 21. Le récepteur GABAA. ... 71
Figure 22. Expression des sous-unités α du récepteur GABAA à travers le développement. ... 72
Figure 23. Changements de l’homéostasie du chlore au cours du développement. ... 76
Figure 24. Expression des co-transporteurs NKCC1 et KCC2 à travers le développement. ... 78
Figure 25. Changement âge-dépendant de l’effet conducteur du chlore suite à l’exposition
au muscimol. ... 83
Figure 26. Représentation des possibles interactions entre l’axe HPT et le système GABAergique ... 84
Figure 27. Migration et différentiation des microglies à travers le développement. ... 90
Figure 28. Fonctions des microglies au cours du développement du SNC. ... 92
Figure 29. Schematic representation of the time course of the experimental protocol used to create all groups of pups ... 108
Figure 30. Time related changes of blood T4 levels between 2 and 4 days old pups. ... 116
Figure 31. Whole body plethysmography in unrestrained rats. ... 118
Figure 32. Ventilatory response to a 12% hypoxic event. ... 120
Figure 33. Measurements of phrenic burst activity in isolated brainstem-spinal cord preparations. ... 122
Figure 34. Dose dependent phrenic burst response to muscimol exposure ... 124
Figure 35. Phrenic burst response to muscimol exposure in 4 days old pups. ... 126
Figure 36. Western blot analysis of proteins expression from medulla oblongata homogenates ... 128
Figure 37. Maternal methimazole treatment (MMI) reduces thyroid hormone levels and body weight. ... 147
Figure 38. Whole body plethysmography in unrestrained rats. ... 149
Figure 39. Ventilatory response to a 12% hypoxic event between control and MMI-treated pups. ... 150
Figure 40. Original recording comparing cardiorespiratory responses to stimulation of the laryngeal chemoreflex by water injection (10 µl) near the larynx ... 152
Figure 41. Thyroid hormone deficiency augments cardiorespiratory inhibition induced by laryngeal chemoreflex stimulation. ... 153
Figure 42. T3-induced motility in primary cultured microglia from cortex and brainstem. ... 170
Figure 43. T3 increases phagocytosis of single-cultured microglia in the brainstem. ... 172
Figure 44. Représentation schématique du système d’enregistrement in-vitro sur préparation de tronc cérébral-moelle épinière isolés. ... 182
Liste des tableaux
Table 1. Comparison of body weight and temperature, T4 hormone levels and selected respiratory variables between 1 and 4 days old pups born under standard conditions (control) or born from mothers subjected to methimazole treatment (MMI; thyroid hormone deficient pups)……….…114
Table 2. Comparison of body temperature and selected cardiorespiratory variables between 14 and 15 days old pups born and raised under standard conditions (Control) or born to mothers subjected to methimazole treatment (MMI; thyroid hormone deficient pups)………....145
Liste des abréviations et des sigles
𝑽̇E : Minute ventilation
𝑽̇O2 : Volume d’O2 consommé
5-HT : Sérotonine
AoP : Apnea of prematurity ATP : Adénosine triphosphate
BDNF : Facteur neurotrophique issu du cerveau CO2 : Dioxyde de carbone
CPG : Générateur de patron central CRL : Chémoréflexe laryngé CX3CL1 : Fractalkine
DbX1 : Facteur de transcription du développement cérébral Homeobox 1 DMEM: Dulbecco’s Modified Eagle Medium
ƒR : Fréquence respiratoire FT4: Free T4
GABA : Acide y-aminobutyrique GAD : Glutamate décarboxylase GDx : Nombre (x) de jours de gestation IGF-1 : Facteur de croissance de l’Insuline-1 KF : Noyau Kölliker-Fuse
L-T4 : Levothyroxine MMI : Méthimazole NK1 : neurokinine-1
NTS : Noyau du tractus solitaire O2 : Oxygène
PaCO2 : Pression partielle artérielle en CO2
PFA : Paraforlmaldéhyde pFL : Noyau parafacial latéral pFv : Noyau parafacial ventral PiCo : Complexe post-inspiratoire préBötC : Complexe pré-Bötzinger PTU : Propylthiouracile
Px : Nombre (x) de jours de vie postnataux
RTN/pFRG : Noyau rétrotrapézoïde/groupe respiratoire parafacial SIDS : Syndrome de la mort subite du nourrisson
SNC / CNS : Système nerveux central (central nervous system) SpO2: O2 saturation SST : Peptide somatostatine T3 : Triiodothyronine T4 : Thyroxine TG: Thyroglobuline THs: Thyroid hormones TRH : Hormone thyérotrope
TRs : Récepteurs nucléaires de l’hormone thyroïdienne TSH : Thyréostimuline
TT4 : Total T4
VRG : Groupes respiratoires rostral-ventral VT : Volume courant
Remerciements
Cette thèse est le produit d’un travail soutenu dans les dernières années, mais aussi de précieuses collaborations et de l’entraide afin de progresser dans mon cheminement universitaire et parcours scientifique.
Je me dois de débuter en remerciant mon directeur de recherche, le Dr Richard Kinkead. Tu as cru en moi dès mon premier passage dans ton laboratoire en tant qu’étudiant de premier cycle. Cette confiance envers mes capacités d’apprentissage a permis de développer mon sens de l’autonomie, d’aiguiser mon esprit critique et ma rigueur scientifique, mais tu as surtout su cultiver cette passion de la recherche que je ne pensais pas posséder dans les premières années. Ta porte était toujours ouverte. Tu m’as fait découvrir toutes les facettes de la recherche ici, comme à l’international à travers divers congrès. J’ose croire que je suis maintenant un meilleur scientifique et c’est en grande partie grâce à toi. Tu es un mentor et es aussi devenu un ami.
Un merci au Dr Vincent Joseph, Dre Aida Bairam, Dre Marie-Ève Tremblay et Dr Jorge Soliz pour vos précieux conseils, votre générosité et les multiples discussions scientifiques que j’ai pu avoir avec chacun. Votre collaboration a été plus que bénéfique pour mon cheminement au doctorat. Je dois remercier les professionnels de recherche sans qui mon travail aurait été une montagne. Dre Roumiana Gulemetova qui m’a accueilli à bras ouverts dans les premières années et n’a jamais hésité à prendre du temps pour m’aider. Stéphanie Fournier pour tes conseils dans l’élaboration et application des protocoles ainsi que ton aide pour tous les papiers administratifs. François Marcouiller, un collègue et un ami, pour ton assistance dans le laboratoire et nos nombreuses discussions dans les dernières années.
Un doctorat ne peut être fait sans croiser une importante quantité de personnes qui marque votre parcours ; plusieurs d’entre elles avec qui on se lie d’amitié. Merci au Dre Céline Caravagna pour les fous rires et l’entraide dans les premières années. Dr Sofien Laouafa pour nos discussions, notre collaboration et tous les agréables moments passés
ensembles au laboratoire ou à l’extérieur. Dre Alexandra Demars pour la camaraderie créée en se supportant à chaque jour, le tout dans une bonne humeur qui fait toujours un grand bien. Une mention spéciale pour tous les autres collègues : Dr Tommy Seaborn, Dre Luana Tenorio-Lopes, Dre Cécile Baldy, Dre Tara Adel-Janes, Anabel Buteau-Poulin, Dre Orlane Rossignol, Mélanie Pelletier, Dre Hayet Kouchi, Orlane Ballot, Rose Tam, Christian Arias, Elizabeth Elliot Portal, Jaime Pablo Iturri Soliz, Dr Flavien Delhaes et Dr Morgan Gazzola.
Merci à mes parents pour votre soutien inébranlable sur l’entièreté de mon parcours académique (Oui Luc, je ne serai bientôt plus un étudiant !). Vous êtes des piliers et des modèles que je peux suivre sans hésitation. Votre confiance a fait de moi l’homme que je suis aujourd’hui et je vous en serai toujours reconnaissant. Je remercie ma sœur qui m’a écouté attentivement à chaque discussion. Tu apportes constamment du bonheur dans une journée avec ton rire communicatif. Finalement, ce texte ne peut se terminer sans remercier ma femme et amour : Audrey Cardinal. Tu me soutiens dans tous les moments, heureux ou difficiles, que je traverse depuis notre rencontre. Tu es ma confidente et ma meilleure amie, avec qui mon cheminement académique aura été bien plus plaisant. La mère exceptionnelle que tu es me rassure à chaque jour sur les choix que je fais dans la vie.
Avant-Propos
Les études intégrées à cette thèse ont été effectuées au cours de mes études supérieures de 3e cycle de 2015 à 2019 sous la direction du Dr. Richard Kinkead. Le travail a été effectué au centre de recherche du CHUQ à l’hôpital Saint-François d’assise (Université Laval) ainsi qu’au centre de recherche de l’Institut Universitaire de Cardiologie et Pneumologie de Québec (Université Laval). Les études du chapitre 3 ont été effectuées en partie dans le laboratoire du Dr. Mami Noda situé à l’Université de Kyushu lors d’un stage à l’étranger financé par une bourse de déplacement du Réseau en Santé Respiratoire du Québec.
L’article du chapitre 1 est considéré comme complet par le directeur de recherche pour insertion dans cette thèse. Il sera soumis prochainement au journal «Acta Physiologica» ou «Journal of Physiology». Les résultats contenus dans l’article ont été considérés par la communauté scientifique comme assez importants pour être présentés à de multiples conférences internationales lors de session orales dans les dernières années. Une liste des conférences nationales et internationales où j’ai présenté les résultats des trois chapitres de cette thèse est insérée en annexe.
L’article du chapitre 2 a été publié dans le journal «Experimental Neurology» le 18 Mai 2019 ; 320:112960. doi: 10.1016/j.expneurol.2019.112960.
L’article du chapitre 3 a été accepté pour publication dans le journal Brain Research Bulletin le 13 janvier 2020.
Chaque chapitre contient son propre avant-propos décrivant mon rôle exact ainsi que celui des autres auteurs dans la création de chaque article.
Je suis aussi co-premier auteur d’une revue de littérature et premier auteur d’un manuscrit de méthode expérimentale en format vidéo, tous deux effectués pendant le doctorat dans le laboratoire du Dr. Richard Kinkead :
Rousseau JP.*, Tenorio-Lopes L.*, Baldy C., Janes T.A., Fournier S., Kinkead R. (2017) On
the origins of sex-based differences in respiratory disorders: lessons and hypotheses from stress neuroendocrinology in developing rats. Physiol. Respir. Physiol. Neurobiol.
245: 105-121. doi: 10.1016/j.resp.2017.03.013
Rousseau JP., Caravagna C., (2015) Electrophysiology on isolated brainstem-spinal cord
preparations from newborn rodents allows neural respiratory network output recording. J. Vis. Exp. ; 105. doi: 10.3791/53071.
Enfin, j’ai eu l’opportunité de participer à la réalisation des expériences et la rédaction de deux manuscrits pendant mon doctorat :
Landry‐Truchon K., Fournier S., Houde N., Rousseau JP., Jeannotte L., Kinkead R. (2017)
Respiratory consequences of targeted losses of Hoxa5 gene function in mice. J. Exp. Biol.
220 (24): 4571-4577. doi: 10.1242/jeb.165084
Noda M., Tomonaga D., Kitazono K., Yoshioka Y., Liu J., Rousseau JP., Kinkead R., Ruff M., Pert C. (2018) Neuropathic pain inhibitor, RAP-103, is a potent inhibitor of
microglial CCL-1/CCR8. Neurochem. Int. 2018 Oct; 119: 184-189. doi: 10.1016/j.neuint.2017.12.005
Partie 1
Introduction
1. Hormones thyroïdiennes et développement
1.1 Hormones thyroïdiennes chez les vertébrés
Les hormones thyroïdiennes sont connues comme ayant des fonctions biologiques très répandues et essentielles au cours du développement non seulement des vertébrés, mais aussi des invertébrés (Ahmed et al., 2010a). Les procédés régulés par les hormones thyroïdiennes sont effectivement largement conservés dans le règne animal. Certaines espèces d’invertébrés utilisent les hormones thyroïdiennes en les ingérant depuis l’environnement et qui servent alors de signal développemental exogène (Moog et al., 2017). Pour les vertébrés, la majorité des animaux passent par une transition d’un stade «larvaire vers juvénile» contrôlée en partie par les hormones thyroïdiennes, que ce soit intra ou extra utérin. Un excellent exemple d’une transition extra-utérine est retrouvé dans la métamorphose de l’amphibien avec sa sortie de l’eau (Buchholz, 2015). Cette dernière, caractérisée par le passage de l’environnement aquatique vers l’environnement terrestre, dépend grandement de l’action des hormones thyroïdiennes. Ces dernières régulent entre autre la maturation des intestins pour adapter au changement de diète, l’élongation des membres, une maturation des poumons pour combler le nouveau type d’échange gazeux ainsi qu’une restructuration du système nerveux incluant le réseau de contrôle respiratoire tel que démontré par notre équipe (Buchholz, 2015; Rousseau et al., 2016a). De façon parallèle à la transition du têtard vers l’adulte chez l’amphibien, les mammifères sont exposés à un cocktail d’hormones incluant les hormones thyroïdiennes qui influencent la maturation d’une multitude de tissus et d’organes lors de la transition de la vie utérine vers l’air ambiant (Buchholz, 2015). Ces changements assurent l’activation de procédés essentiels à l’homéostasie de l’organisme suite à la naissance tels que les échanges gazeux au niveau des poumons, la régulation cardiaque, la thermogénèse et le développement du système nerveux
central (SNC) qui maintient une coordination adéquate des fonctions cardio-respiratoires (Buchholz, 2015). Alors que seule la physiologie des mammifères sera abordée dans les paragraphes suivants, tous les vertébrés possèdent de façon similaire un système de contrôle de production des hormones thyroïdiennes par l’axe hypothalamo-hypophyso-thyroïdien.
1.2. Axe hypothalamo-hypophyso-thyroïdien
Les hormones thyroïdiennes, principalement la thyroxine (T4; 3,5,3’,5’-tetraiodothyronine) et triiodothyronine (T3; 3,5,3′-triiodothyronine), sont produites via l’axe hypothalamo-hypophyso-thyroïdien (HPT) (Figure 1). Cette production est initiée par la libération de l’hormone thyérotrope (TRH) via la région périventriculaire parvicellulaire du noyau paraventriculaire de l’hypothalamus en réponse aux signaux environnementaux (Zoeller et al., 2007). La TRH circule jusqu’à l’hypophyse antérieure afin de déclencher la production de thyréostimuline (TSH) qui contrôle la production et sécrétion d’hormones thyroïdiennes (Degitz et al., 2005). Le taux de TRH et TSH dans la circulation est modulé en partie par le contrôle rétroactif des hormones thyroïdiennes sur l’hypothalamus et par conséquent, son action sur l’hypophyse. Les mécanismes moléculaires qui gèrent cette rétroaction restent vaguement compris, mais il est démontré que la T3 peut se lier aux récepteur thyrotrophes de l’hypophyse et la T4 agit sur l’expression des gènes TSH-β, suggérant ainsi que les hormones thyroïdiennes ont la capacité de réguler leur propre production (Ahmed et al., 2008; Bogazzi et al., 1997). La synthèse des hormones thyroïdiennes par la glande thyroïde sera abordée dans la section suivante.
Figure 1. Axe hypothalamo-hypophyso-thyroïdien. Régulation de la production des
hormones thyroïdiennes, transport dans le sang et dans les cellules et effets sur cette dernière à travers des mécanismes génomiques et non-génomiques (Moog et al., 2017).
1.2.1 Métabolisme des hormones thyroïdiennes
Les hormones thyroïdiennes sont d’abord synthétisées dans la glande thyroïde composée d’un seul type de cellule, les cellules thyroïdiennes folliculaires (Hulbert, 2000). Ces dernières se regroupent sous forme de follicule de type colloïde et assurent la production, le stockage et la libération d’hormones thyroïdiennes dans la circulation sanguine (Hulbert, 2000). La production débute avec la synthèse de la thyroglobuline (TG) qui sert de réservoir de résidus tyrosines sur lesquels pourront se lier des atomes d’iodes (figure 2) (Ahmed et al., 2008). L’hormone est produite par la condensation de deux cycles aromatiques de résidus de tyrosine couplés à des atomes d’iodes par la thyroperoxidase, le tout lié au précurseur TG (Dunn and Dunn, 1999). Chaque cycle aromatique (un extérieur et un intérieur) peut se lier à deux atomes d’iodes afin de déterminer le type d’hormones produit ; T4 contenant 4 atomes d’iode et T3 lié à 3 atomes suite à la déiodination sur le cycle extérieur (Hulbert, 2000). Afin de créer une déficience expérimentale en hormones thyroïdiennes, plusieurs composés
antithyroïdiens agissent sur l’iode et plus précisément son transport dans la glande thyroïde (perchlorate de sodium) ou sa liaison avec le résidu de tyrosine (méthimazole; MMI et propylthiouracile; PTU) (Opitz et al., 2006). La T4 et T3 restent liées à la thyroglobuline lors de leur entreposage dans le colloïde jusqu’à ce qu’elles soient prisent en charge par les cellules folliculaires et sécrétées (Wendl et al., 2002). La T4, majoritairement sécrétée par la glande thyroïde (~93%), possède une faible activité biologique alors que la T3, très active biologiquement, est sécrétée dans une moindre mesure (~7%) (Bernal, 2000; Holzer and Laudet, 2013). Les hormones en circulation dans le système se déplacent soit sous la forme libre (1% de la concentration d’hormones) ou en liaison avec des protéines de transport telles que la globuline de liaison à la thyroxine (TBG), la transthyrétine (TTR) ainsi que l’albumine (Moog et al., 2017). Une fois arrivées au tissu visé, les hormones passent par différents procédés qui déterminent la concentration locale dans le tissu.
Figure 2. Schéma de la synthèse des hormones thyroïdiennes. L’action des enzymes
D1-D3 s’exerce sur le cycle aromatique extérieur (ORD) ou intérieur (IRD). Tiré de (Holzer and Laudet, 2013)
1.2.2 Transport et contrôle local des niveaux d’hormones thyroïdiennes
Afin de contrôler localement la concentration d’hormones thyroïdiennes, trois iodothyronines déiodinases (D1, D2, D3) agissent en retirant l’atome d’iode du cycle extérieur ou intérieur de l’hormone (Figure 2) (Bianco and Kim, 2006). La D1 catalyse la conversion de la T4 en T3 dans le foie et les reins et est responsable de la majeure fraction de T3 en circulation dans le système. Au niveau du cerveau (e.g. cortex cérébral, cervelet,
tronc cérébral, hippocampe, thalamus, hypothalamus), la D2 catalyse la conversion de T4 en T3 principalement dans les astrocytes et T3 est ensuite relâchée afin d’être utilisée notamment par les neurones (Crantz et al., 1982; Guadaño-Ferraz et al., 1997). Il est estimé que près de 80% de T3 dans le SNC provient de la conversion locale de T4 par la D2 (Figure
3) (Crantz et al., 1982; Mohácsik et al., 2011). Pour sa part, D3 est située dans le SNC et
convertit la T4 en T3 inverse (rT3) et la T3 en 3,3'-diiodothyronine (T2), toutes deux considérées comme inactives, mais pouvant exercer un effet dans des conditions spécifiques (Ball et al., 1997; Köhrle, 2000). En plus de la conversion locale des hormones, le niveau de T3 et T4 dans les différents systèmes est contrôlé par le transport des hormones dans les cellules grâce aux transporteurs d’hormones thyroïdiennes transmembranaires (THTs) (Moog et al., 2017). Ce groupe inclus les membre de la famille des peptides de transport d’anions organiques (OATPs), les transporteurs L-amino acide (LATs) et les transporteurs monocarboxylates (MCTs) (Bernal, 2005). Les OATPs sont largement distribués à travers le cerveau et sont principalement retrouvés dans les cellules endothéliales des capillaires du cerveau et du plexus choroïdien (Figure 3) (Pizzagalli et al., 2002). Ils ont une grande affinité pour le transport de T4 et rT3 avec une plus faible affinité pour T3 (Pizzagalli et al., 2002). Leur rôle principal serait alors de transporter T4 à travers la barrière hémato-encéphalique par les astrocytes où l’hormone sera par la suite convertie en T3 et permettent aussi le relâchement de rT3 (Bernal, 2005). Parmi la famille des transporteurs monocarboxylates, les deux transporteurs spécifiques pour les hormones thyroïdiennes sont MCT8 et MCT10 (Visser et al., 2008). MCT8 est exprimé dans les neurones et pourrait jouer un rôle dans l’absorption neuronale de T3 produite par les astrocytes (Figure 3) (Heuer et al., 2005). MCT8 assure aussi le passage de T4 et T3 à travers la barrière hémato-encéphalique afin d’atteindre les cellules nerveuses et gliales situées proche des vaisseaux sanguins (Dumitrescu et al., 2006; Trajkovic et al., 2007). Une fois l’hormone convertie et transportée dans la cellule d’intérêt, son action sur l’organisme peut passer par la voie génomique impliquant les récepteurs nucléaires ou par différentes voies non-génomiques abordées dans la section suivante.
Figure 3. Représentation schématique du transport et déodination des hormones thyroïdiennes. A) Circulation de T3 et T4 dans le système sanguin ou le liquide
cérébrospinal. Transport des hormones à travers la barrière hémato-encéphalique et insertion dans les astrocytes par l’action de OATP1C1 ou MCT8. B) Conversion locale de T4 en T3 par D2. C) Transport de T3 des astrocytes vers les neurones par MCT8. Le transporteur responsable de la sécrétion de T3 par les astrocytes est encore inconnu. Tiré de (Dezonne et al., 2015)
1.2.3 Action génomique et non-génomique des hormones thyroïdiennes
La T3 produit la majorité de ses effets en interagissant avec des récepteurs nucléaires (TRs) comme facteurs de transcription (Moog et al., 2017). Ces récepteurs nucléaires sont
regroupés sous quatre isoformes dont deux (TRα1 et TRβ2) ont la capacité de se lier à T3, de former un complexe intra-nucléaire avec l’hormone et ainsi occuper les complexes régulateurs situés sur les gènes de réponse à l’hormone thyroïdienne pour modifier leur transcription (Cheng et al., 2010; Moog et al., 2017). Il est reconnu que la T3 possède une affinité pour les récepteurs TRs dix fois plus élevée que la T4, expliquant en partie sa catégorisation en tant que molécule biologiquement active (Hulbert, 2000). Malgré l’effet nucléaire reconnu des hormones thyroïdiennes, ces dernières peuvent également exercer certains de leurs effets via des mécanismes non-génomiques (Davis et al., 2016a). Ces mécanismes n’impliquent pas la transcription de gènes ni la synthèse de protéines assurant ainsi une réponse plus rapide (minutes ou quelques heures) comparativement à l’effet génomique de T3 et sa liaison aux récepteurs nucléaires (Davis et al., 2016a). L’effet non-génomique peut être engendré par la liaison de l’hormone thyroïdienne à un isoforme tronqué du récepteur nucléaire retrouvé dans le cytoplasme, la membrane plasmatique ou la mitochondrie tel que p30 TRα1 (Davis et al., 2016a; Kalyanaraman et al., 2014). Il a aussi été démontré que T3 et T4 agissent via un récepteur transmembranaire αvβ3 (Davis et al.,
2011). Contrairement aux isoformes tronqués, cette intégrine n’est pas homologue au récepteur nucléaire TR et possède deux domaines de liaison aux hormones thyroïdiennes avec un affinité plus importante pour T4 que T3 (Davis et al., 2016a; Lin et al., 2011). L’action non-génomique des hormones thyroïdiennes à travers les isoformes tronqués et l’intégrine αvβ3 a été reliée à la formation des microfilaments du cytosquelette (migration
neuronale et ostéogénèse), l’angiogénèse et le contrôle de la prolifération de cellules cancéreuses. Elle est aussi reliée à la respiration cellulaire de la mitochondrie par la liaison aux récepteurs mitochondriaux p43 et p28 (Figure 4) (Bergh et al., 2005; Davis et al., 2011; Kalyanaraman et al., 2014; Padron et al., 2014; Wrutniak-Cabello et al., 2001). L’action locale des hormones thyroïdiennes à la membrane plasmatique ou autres membranes active aussi plusieurs pompes ioniques telles que l’échangeur Na+/H+ qui maintient le pH cellulaire en cas de stress et Na+/K+-ATPase, cruciale pour l’homéostasie cellulaire (Figure 4) (D’Arezzo et al., 2004; Lei et al., 2004, 2009)
Figure 4. Effet non-génomique de T3 et T4. A) Liaison avec l’intégrine αvβ3 et action sur
la transcription du gène. B) Régulation du cytosquelette par T4 et rT3. C) Modification de la prolifération cellulaire par la liaison de T3 à l’isoforme tronqué p30 TRα1. D) Activation de l’échangeur Na+/H+ par T3 à travers la signalisation MAPK1 et MAPK2. E) Activation de la
pompe ionique Na+/K+-ATPase via PI3K/AKT. F) Mécanisme d’action directe de T3 et T2 sur la respiration mitochondriale par les récepteurs p43 et p28. Modifié de (Davis et al., 2016a).
1.3 Ontogénèse des hormones thyroïdiennes et développement
neurologique
Le modèle expérimental du rongeur a été extrêmement utile pour la compréhension de l’ontogénèse des hormones thyroïdiennes lors du développement, mais l’adaptation des résultats obtenus vers le modèle humain doit se faire avec précaution considérant les différences temporelles du développement de chacun. En effet, la glande thyroïde de l’humain est fonctionnelle à 18-20 semaines de gestation comparativement à l’âge gestationnel de 17.5-18 jours pour le rat (GD17.5-18) (Ausó et al., 2004; Morreale de Escobar et al., 2004; Porterfield and Hendrich, 1993). De plus, le nouveau-né humain peut être comparé à un raton de 10 jours, ce qui signifie que le rongeur naît avec un système nerveux sous-développé (Morreale de Escobar et al., 2004). Plusieurs évènements développementaux se produisent donc chez le rongeur en période postnatale où son système n’est plus protégé par le transfert d’hormones maternelles comparativement à l’humain, puisque le lait maternel du rongeur contient très peu d’hormones thyroïdiennes (Morreale de Escobar et al., 2004). Alors qu’une comparaison efficace peut être effectuée entre les deux modèles avant le début des fonctions de la glande thyroïde, les résultats provenant des périodes développementales subséquentes doivent être comparés avec modération. Afin de clarifier l’ontogénèse des hormones thyroïdiennes, la Figure 5 représente adéquatement les différentes phases de développement du système nerveux influencées par les hormones thyroïdiennes chez l’humain (peut être comparé au rongeur) ainsi que les procédés reliés à l’action et l’homéostasie de T3 et T4 qui seront abordés dans les sections suivantes.
Figure 5. Résumé du développement fœtal et postnatal du cerveau humain en relation avec les hormones thyroïdiennes. Le moment approximativement équivalent de la
naissance du rat est représenté par la barre grise vers la mi-gestation de l’humain. A) Ontogénèse des procédés régulant l’homéostasie des hormones thyroïdiennes. B) Altérations des niveaux d’hormones au cours du développement. C) Schéma des procédés neuro-développementaux influencés par les hormones thyroïdiennes. Tiré de (Bernal, 2007)
1.3.1 Apport d’hormones thyroïdiennes maternelles pendant la gestation
Pendant des années, le placenta était vu comme une barrière imperméable aux hormones thyroïdiennes de source maternelle. Plusieurs études démontrent désormais que les hormones thyroidiennes maternelles représentent la seule source d’hormone pour le fetus jusqu’à ce que la glande thyroide fetale soit fonctionnelle. Les hormones thyroidiennes sont donc présentent dans le système nerveux au cours de la majeur partie du développement (Bárez-López et al., 2018; Bradley et al., 1992; Dong et al., 2015; de Escobar et al., 2004; Fernández et al., 2015; Ferrara et al., 2013; Ferreiro et al., 1990; Morreale de Escobar et al., 1990, 2000; Obregon et al., 1984; Perez-Castillo et al., 1985; Porterfield and Hendrich, 1991; Ruiz de Oña et al., 1988, 1991). Avant que la glande soit en mesure de produire ses propres réserves d’hormone thyroïdiennes utilisables, les tissus embryonnaires sont fournis avec des faibles niveaux de T4 et T3 de source maternelle dès l’âge gestationnel GD11 (Calvo et al., 1990, 2002; Obregon et al., 1984; Woods et al., 1984). Une expression des récepteurs TRs est aussi retrouvée dans le tube neural à l’âge gestationnel GD11 ainsi que dans le prosencéphalon, mésencéphalon et rhombencéphalon à GD12.5 (Bradley et al., 1992). L’expression des TRs augmente avec l’âge et les récepteurs sont occupés (liés à leur hormones) en concentration assez significative (~25%) pour engendrer une réponse physiologique (Bradley et al., 1992; Ferreiro et al., 1990). Le transfert des hormones maternelles vers l’embryon est aussi confirmé par l’importante augmentation des taux de T4 maternels accompagnée par une inhibition de TSH dans le premier trimestre de gestation afin d’assurer un apport adéquat d’hormones thyroïdiennes à l’embryon lors des phases critiques de développement neurologique (de Escobar et al., 2004; Morreale de Escobar et al., 2004). La T4 transférée est retrouvée principalement sous forme libre dans le fœtus due aux différences entre la mère et le fœtus concernant la liaison de l’hormone aux protéines de transport (Calvo et al., 2002).
Au cours de la période fœtale, la réserve en T3 du SNC dépendrait principalement de la conversion locale de T4 maternelle en T3 générée par la déiodinase D2 (Calvo et al., 1990). Contrairement au raton et à l’adulte où une partie de la T3 est en circulation dans le système sanguin et traverse la barrière hémato-encéphalique pour être disponible aux cellules présentes, le cerveau fœtal semble être en partie imperméable à la T3 de source maternelle
(Calvo et al., 1990; Galton et al., 2007; Trajkovic et al., 2007). En effet, le tout a été démontré sur des rates femelles gestantes qui ont subi un hypothyroïdisme pour ensuite être supplémentées en hormones thyroïdiennes. Alors que l’administration de T4 chez la mère cause une augmentation des niveaux de T3 dans le cerveau fœtal, la même procédure avec T3 n’augmente que les niveaux périphériques de T3 et n’influence aucunement ceux du SNC (Calvo et al., 1990). La raison de cette imperméabilité peut être expliquée par le transport de l’hormone. Malgré le fait que le patron spatio-temporel d’expression des transporteurs d’hormones thyroïdiennes lors de la gestation chez le rongeur n’est pas entièrement compris, les protéines de MCT8 et OATP1c1 ont été retrouvées dans le cerveau prénatal (Grijota-Martínez et al., 2011). Il est tout d’abord supposé que MCT8 ait un rôle d’extraction de la T3 hors du SNC tôt dans le développement. Des souris déficientes du transporteur MCT8 présentent un stade d’hyperthyroïdisme du système nerveux de l’âge gestationnel GD18 jusqu’à l’âge postnatal P5 (Ferrara et al., 2013; Núñez et al., 2014). Ensuite, il est possible que la T3 qui passe la barrière hémato-encéphalique soit directement dégradée par la déiodinase D3 qui est exprimée en forte quantité tôt dans le développement afin de prévenir une surexposition du cerveau aux hormones thyroïdiennes et qui diminue avec le développement (Hernandez, 2005).
Il est intéressant de questionner la présence de T3 dans le cerveau fœtal alors qu’il est imperméable au passage de l’hormone provenant de la périphérie. L’activité de la déiodinase D2 n’a pour le moment été observée qu’à l’âge gestationnel GD17 et coïncide avec le début des fonctions de la glande thyroïde (Ruiz de Oña et al., 1991). Puisque l’enzyme D2 a déjà été observée chez le fœtus humain aux stades précédents le début de l’activité de la glande thyroïde, la présence de T3 dans le cerveau embryonnaire du rat peut être expliquée par l’action hâtive de la déiodinase D2 dans le système nerveux ou la participation d’un mécanisme complémentaire ici inconnu (Calvo et al., 2002; Karmarkar et al., 1993). Ces résultats démontrent qu’en absence d’un mécanisme compensatoire de la déiodinase D2 afin de maintenir les niveaux de T3 dans le cerveau, toute déficience en T4 de source maternelle ne peut se terminer que par une faible concentration intracellulaire de T3 résultant en désordre du développement nerveux.
1.3.2 Hormones thyroïdiennes en fin de gestation et période postnatale
Une fois fonctionnelle, la glande thyroïde assure la production d’hormones afin que les hormones maternelles transférées au fœtus à terme ne représentent que 17.5% des réserves pour la T4 et 47% pour la T3 (Grijota-Martínez et al., 2011; Morreale de Escobar et al., 1990). En phase postnatale, le raton se prépare au sevrage où il devra être indépendant de la mère. Pour se faire, plusieurs organes tels que les intestins et le cerveau subissent des modifications physiologiques qui sont en partie régulées par les hormones thyroïdiennes (Holzer and Laudet, 2013). Le nouveau-né doit être en mesure de produire ses propres hormones thyroïdiennes avant le sevrage puisque comme mentionné précédemment, le lait maternel ne contient qu’une infime quantité d’hormones thyroïdiennes (Morreale de Escobar et al., 2004). Suite à la naissance, la production de l’hormone T4 par le nouveau-né augmente afin d’atteindre son pic maximum vers 16 jours de vie (Figure 6) (Dussault and Labrie, 1975). Cette production coïncide avec les niveaux de TRH et TSH observés dans le sérum qui augmentent drastiquement à partir du 12e jour de vie et atteignent le pic vers l’âge postnatal P16 (Dussault and Labrie, 1975). Pour sa part, la T3 augmente aussi de façon parallèle à T4, mais atteint son pic de production plus tard vers 28 jours (Dussault and Labrie, 1975). L’expression de la déiodinase D2 augmente juste avant la naissance (GD18-21) pour ensuite atteindre son pic à l’âge postnatal P15, ce qui explique en partie la montée en T3 à cette période (Obregón et al., 1991; Ruiz de Oña et al., 1988). Il est supposé que c’est aussi à cette période que le cerveau est le plus sensible à la T3 en se fiant à la forte occupation des récepteurs TRs ainsi que les importants effets développementaux des hormones thyroïdiennes sur le cerveau qui se produisent dans les trois premières semaines de vie du rongeur (Ferreiro et al., 1990).
L’apport d’hormones thyroïdiennes de la mère et la production par le fœtus en période prénatale sont nécessaires au bon développement du SNC et l’effet se poursuit suite à la naissance où le rongeur produit ses propres réserves d’hormones. L’objectif est de maintenir un développement neural adéquat selon les phases critiques de sensibilité. Ces phases seront introduites dans le paragraphe ci-dessous.
Figure 6. Les hormones thyroïdiennes au cours du développement postnatal. Mesure des
niveaux d’hormones thyroïdiennes (T4 et T3) dans le sérum de ratons suite à la naissance. Tiré de (Dussault and Labrie, 1975)
1.3.3 Fenêtre temporelle des procédés neuro-développementaux influencés
par les hormones thyroïdiennes
Au cours de la gestation et suite à la naissance, le système nerveux est particulièrement sensible aux hormones thyroïdiennes, mais les périodes de dépendance restent encore à être caractérisées (Ahmed et al., 2008; Bárez-López and Guadaño-Ferraz, 2017). Tout d’abord, il est généralement accepté qu’il n’existe pas une simple période critique de dépendance aux hormones thyroïdiennes au cours du développement (Dowling et al., 2000). L’action des hormones thyroïdiennes dépendrait plutôt de la région ciblée et de sa sensibilité à l’hormone lors d’une période spécifique du développement, sensibilité qui est engendrée en partie par le contrôle local des hormones thyroïdiennes (Zoeller and Rovet, 2004). Malgré la large distribution régionale et temporelle de l’effet des hormones
thyroïdiennes sur le développement neurologique, il est possible de regrouper le tout en trois grandes périodes de dépendance (Figure 7) :
La première phase se produit avant le début des fonctions de la glande thyroïde où la mère est la seule source d’hormones thyroïdiennes pour le fœtus. Bien que les hormones thyroïdiennes n’ont pas d’influence sur les évènements développementaux très hâtifs tels que l’induction neural et l’établissement de la polarité, leur présence influence les procédés ultérieurs incluant la prolifération et la migration des neurones dans le cortex cérébral et l’hippocampe (Ausó et al., 2004; Lucio et al., 1997; Narayanan and Narayanan, 1985). Il a été démontré qu’un hypothyroïdisme maternel chez le rat mène à un défaut dans la prolifération de précurseurs neuronaux, des procédés qui sont habituellement complétés entre l’âge gestationnel GD12 et GD16-17, donc avant le fonctionnement de la glande thyroïde (Lucio et al., 1997; Narayanan and Narayanan, 1985). La T4, par sa liaison avec l’intégrine αvβ3, est nécessaire pour la prolifération de précurseurs neuronaux intermédiaires et une
déficience en T4 mène à une réduction de l’épaisseur corticale avec la perte de couches supérieures (Mohan et al., 2012). De plus, une déficience en hormones thyroïdiennes chez la mère, causée par une alimentation pauvre en iode s’ensuit d’une migration anormale des neurones qui est achevée aussi avant GD17.5-18 (Lavado-Autric et al., 2003).
La deuxième phase a lieu entre le début de l’activité de la glande thyroïde et la naissance. Au cours de cette période, le fœtus et la mère fournissent de façon combinée un stock d’hormones thyroïdiennes utilisables pour le développement (Ahmed et al., 2008). Cette phase est très courte chez le rat et inclue principalement la continuation de la migration et neurogénèse cérébrale (Porterfield and Hendrich, 1993). À ce stade, les procédés neurologiques dépendants aux hormones thyroïdiennes incluent la différentiation neuronale, la croissance axonale, la ramification dendritique, la synaptogénèse et la migration et différentiation des cellules gliales (Bernal et al., 2003; Morreale de Escobar et al., 2000; Porterfield and Hendrich, 1993). Il est d’ailleurs démontré que l’hypothyroïdisme développemental cause une réduction dans l’expression de régulateurs de la différentiation neuronale, la croissance des neurites et la synaptogénèse. Ces régulateurs incluent le facteur neurotrophique issu du cerveau (Brain derived neurotrophic factor; BDNF), le facteur neurotrophique-3 (NT-3), le facteur de croissance 1 analogue à l’insuline (IGF-1), la
sous-unité 5 du complexe ARP 2/3 (ARPC5) et la protéine 2B médiatrice de la réponse de la collapsine (CRMP2B) (Elder et al., 2000; Koibuchi et al., 1999; Lindholm et al., 1993; Liu et al., 2013)
Finalement la troisième phase se déroule suite à la naissance. Puisque le système nerveux du rat n’est pas entièrement développé à la naissance, la phase trois englobe encore la majorité des procédés de la phase deux ainsi que la myélinisation (Bernal et al., 2003; Morreale de Escobar et al., 2000; Porterfield and Hendrich, 1993). Un hypothyroïdisme néonatale retarde le dépôt de myéline par la suppression de la biosynthèse de ses composantes telles que la cérébroside, la sulfatide et la sphingomyéline (Tsujimura et al., 1973). En conséquence, une réduction du volume de la matière blanche et du pourcentage de matière blanche a été observé chez des rats déficients en hormones thyroïdiennes durant le développement (traitement PTU) et ces changements persistent longtemps après que les niveaux d’hormones normaux soient rétablis chez l’animal (Powell et al., 2012).
Chaque procédé développemental est altéré par une déficience en hormones thyroïdiennes et il est accepté que le moment où le fœtus est coupé de la source maternelle représente un facteur critique dans le dénouement du développement. Cependant, plus la carence en hormones thyroïdiennes est présente tôt dans le développement, plus grave seront les conséquences sur les fonctions neurologiques (Williams, 2008).
Figure 7. Les hormones thyroïdiennes et le développement du cerveau. Phases de
développement neurologique dépendantes aux hormones thyroïdiennes chez le rat. DPC : jours post-conception. DPN : jours postnataux. Tiré de (Porterfield and Hendrich, 1993)
1.4 Causes de la déficience en hormones thyroïdiennes
1.4.1 L’hypothyroïdisme et l’hypothyroxinémie maternelle
En lien avec l’hypothèse que le placenta agit comme barrière imperméable aux hormones thyroïdiennes, il a longtemps été proposé que les effets des hormones sur le cerveau aient seulement lieu suite à la naissance (Fisher, 1999). Cette hypothèse est en partie due aux études sur des modèles d’hypothyroïdisme congénital, un désordre du développement de la glande thyroïde du fœtus qui engendre une production réduite de T4 à la naissance (Macchia, 2000). Si l’hypothyroïdisme est détecté rapidement et traité dès la naissance, il est possible de contrer les défauts neurologiques habituellement rencontrés (Bernal, 2007). Dans cette situation, les cliniciens ont cependant omis de considérer le rôle des hormones maternelles qui ne sont pas affectées par l’hypothyroïdisme congénital et protègent le cerveau au cours de la gestation (Bernal, 2007). Un apport adéquat de T4 de la mère assure un niveau normal de T3 au cerveau du fœtus et évite des dommages sévères pendant la gestation. Puisque le cerveau a été épargné, il est possible de rétablir son
développement normal suite à la naissance avec une supplémentation en T4 (Morreale de Escobar et al., 2004).
Les désordres neurologiques plus importants se produisent plutôt lorsque les niveaux maternels de T4 sont sous les valeurs normales au cours de la gestation, situation engendrée par diverses affections du statut thyroïdien incluant l’hypothyroïdisme maternel avec des niveaux relativement faibles de T4 et T3 ou une hypothyroxinémie maternelle où seule la concentration de T4 est réduite alors que la T3 n’est pas affectée (Morreale de Escobar et al., 2004).
- L’hypothyroïdisme chez la mère peut être causé entre autre par une déficience de Pit-1, un facteur de transcription pour le développement de l’hypophyse ou par la présence en forte dose d’anticorps bloquant la stimulation de la glande thyroïde (Blizzard et al., 1960; Yasuda et al., 1999; de Zegher et al., 1995). Plusieurs études ont caractérisé les conséquences neuro-anatomiques et fonctionnelles d’une carence en hormones thyroïdiennes chez le rongeur par la provocation d’un hypothyroïdisme expérimental avec l’utilisation de drogues anti-thyroïdiennes (MMI et PTU) ou la thyroïdectomie de la mère lors de la gestation (Moog et al., 2017). Des modèles génétiques d’insuffisance en hormones thyroïdiennes par la délétion ou mutation des récepteurs TRs permettent d’engendrer des réductions drastiques des niveaux de T4 et T3 comparable à l’hypothyroïdisme (Moog et al., 2017).
- D’autres modèles de déficience modérée par l’apport de faibles doses de PTU à la mère ont aussi été utilisés afin de représenter la diminution dose-dépendante de T4 seulement, qui représente plus adéquatement l’hypothyroxinémie maternelle (Gilbert and Sui, 2006; Goodman and Gilbert, 2007). L’hypothyroxinémie reste cependant principalement causée par le manque d’iode chez la mère au cours de la grossesse (Morreale de Escobar et al., 2004). Un manque d’iode chez la mère au cours de la grossesse engendre une diminution des niveaux de T4 tant chez la mère que chez le fœtus. Les syndromes neurologiques tels que des défauts cognitifs, moteurs et retard de croissance ne sont pas corrigés par une supplémentation en hormones thyroïdiennes après la naissance (Gilbert et al.,
2012; Morreale de Escobar et al., 2004). Au cours de la gestation, les femmes représentent un groupe très vulnérable à toute déficience en iode puisque leur besoin augmente de 50% à 75% (Glinoer, 2007; McLeod and McIntyre, 2010). Très peu de femmes prennent des suppléments d’iode au cours de la grossesse et c’est pourquoi près de une femme sur trois est considérée comme déficiente en iode aux États-Unis et en Angleterre (Bath et al., 2013; Caldwell et al., 2011). L’apport d’hormones thyroïdiennes par la mère peut être coupé de manière autre que par la perturbation de la synthèse des hormones maternelles. Un retrait précoce du fœtus assure parfois cette interruption.
1.4.2 Prématurité et production d’hormones thyroïdiennes
Outre l’impact de l’hypothyroïdisme sur la mère, il a été démontré que cette déficience en hormones thyroïdiennes augmente le risque de naissance prématurée chez le nouveau-né (Shinohara et al., 2018). Le rôle des hormones thyroïdiennes dans ce phénomène est cependant encore méconnu. Malgré tout, puisque l’importance des hormones maternelles dans la gestation a été amplement discutée, il n’est pas surprenant de noter qu’une coupure précoce du fœtus de la source maternelle d’hormones par la naissance prématurée engendre de grave conséquences dans le développement du système nerveux, augmente les risque de paralysie cérébrale et cause d’importants dommages à la matière blanche (Den Ouden et al., 1996; Leviton et al., 1999; Reuss et al., 1996). La naissance prématurée engendre non seulement une baisse des niveaux de TSH, T4 et T3 de près de 75% chez le nouveau-né, mais empêche aussi l’importante élévation de production des hormones thyroïdiennes suite à la naissance (Biswas et al., 2002; Lain et al., 2016). Aussi, plus la naissance est prématurée, plus faibles seront les niveaux d’hormones thyroïdiennes chez l’enfant (Biswas et al., 2002). Une importante relation a d’ailleurs été effectuée entre les faibles niveaux de T4 chez les nouveau-nés prématurés et la sévérité de maladies pulmonaires amenant à la dépendance ventilatoire suite à la naissance ou même la mort (Biswas et al., 2002).
Il n’est pas difficile de croire que le système respiratoire est sensible aux hormones thyroïdiennes lors du développement et que les multiples perturbations de la synthèse de T4 et T3 pendant la gestation peuvent engendrer certains désordres respiratoires observés chez les nouveau-nés. Bien que plausible, cette idée n’a pas encore été testée de façon directe en laboratoire.
2. Système de contrôle respiratoire
La respiration chez les mammifères est un procédé qui paraît simple alors qu’il s’agit d’un comportement remarquablement complexe où des échanges gazeux sont effectués au niveau des poumons afin de supporter le métabolisme de l’organisme et contrôler son pH (Feldman and Del Negro, 2006).Le niveau des gaz sanguins dépend donc pour une part de l’activité métabolique – consommation d’oxygène et production de CO2, et pour autre part
des échanges avec l’air ambiant qui sont réalisés par les poumons. Des cellules spécialisées mesurent en permanence le niveau des gaz artérielles, et sont capable d’ajuster l’activité respiratoire selon les besoins métaboliques (Figure 8). C’est par exemple le cas lors d’une activité physique soutenue qui augmente le métabolisme et crée une augmentation rapide du rythme respiratoire(Feldman and Del Negro, 2006). En revanche, le rythme respiratoire peut aussi s’adapter facilement à des changements plus lents associés par exemple au développement, à la grossesse, au vieillissement ou à la maladie (Feldman and Del Negro, 2006). Les muscles respiratoires impliqués dans la ventilation des poumons seront abordés dans la section suivante.
2.1 Principes de base de la ventilation pulmonaire
Les échanges gazeux sont assurés par la ventilation des poumons, résultat d’une variation rythmique du volume thoracique divisée en trois phases principales : inspiration, expiration et post-inspiration (Ballanyi et al., 1999). Au cours de l’inspiration, la contraction
du diaphragme et des muscles intercostaux externes crée une pression négative à l’intérieur de la cavité thoracique, ce qui engendre un accroissement du volume pulmonaire et un influx d’air dans les voies aériennes supérieures (Figure 8) (Feldman and Del Negro, 2006). Une fois passé les voies aériennes supérieures, l’air entre dans les voies aériennes inférieures qui incluent la trachée, les bronches et les bronchioles jusque dans les alvéoles pulmonaires où les échanges gazeux sont effectués avec le système sanguin (Del Negro et al., 2018). Par la suite, l’expiration est habituellement effectuée sous forme passive lorsque les poumons et la cage thoracique reviennent à leur position d’équilibre et l’air est expulsé du corps (Feldman and Del Negro, 2006). Si le métabolisme augmente, l’expiration est effectuée sous forme active par le recrutement des muscles expiratoires incluant les muscles abdominaux et intercostaux internes (Del Negro et al., 2018). Au cours de l’inspiration et de l’expiration, les muscles squelettiques de la bouche, du nez et de la gorge ainsi que les muscles lisses des bronches produisent une résistance qui modifie le flux d’air (Figure 8) (Feldman and Del Negro, 2006). La post-inspiration peut survenir à la fin de l’inspiration et ralentie le dégonflement des poumons par un allongement de la contraction du diaphragme et une adduction des muscles laryngés (modification de la résistance aérienne) (Del Negro et al., 2018). Elle permet donc à l’air de rester plus longtemps dans les poumons, étape qui est bénéfique aux échanges gazeux dans les alvéoles (Dutschmann et al., 2014). Cette phase n’est cependant pas nécessaire à la respiration considérant que l’activité musculaire post-inspiratoire s’arrête de façon intermittente au cours du sommeil et en cas d’anesthésie (Dutschmann et al., 2014). La coordination de ces phases respiratoires requière une génération adéquate du rythme respiratoire effectuée dans les réseaux neuronaux du tronc cérébral. Les composantes de la génération seront abordées dans le paragraphe ci-dessous.
Figure 8. Le système respiratoire. Représentation anatomique des multiples composantes
dans le contrôle de la ventilation pulmonaire. Ceci inclut les muscles et nerfs respiratoires responsables des mouvements ventilatoires, les voies aériennes, les centres de chémoréception centrale (pF) et périphérique (corps carotidien) ainsi qu’un des noyaux de génération du rythme respiratoire situés dans le tronc cérébral (complexe pré-Bötzinger). Tiré de (Del Negro et al., 2018).