Les yeux ont des oreilles : examen de la pupillométrie
en tant qu’indice psychophysiologique de la capture
attentionnelle auditive
Thèse
Alexandre Marois
Doctorat en psychologie
Philosophiæ doctor (Ph. D.)
Québec, Canada
Les yeux ont des oreilles : examen de la pupillométrie
en tant qu’indice psychophysiologique de la capture
attentionnelle auditive
Thèse
Alexandre Marois
Sous la direction de :
Résumé
La présence de sons non pertinents est reconnue pour affecter le fonctionnement cognitif. Plus précisément, la présentation d’un son qui dévie du contexte auditif a le potentiel d’affecter la performance à une tâche réalisée simultanément. Plusieurs études s’intéressant à l’impact délétère des sons déviants sur la performance à une tâche montrent qu’il découle de la réorientation de l’attention déclenchée lorsqu’un son déviant est détecté par l’organisme. Cette capture attentionnelle (ou réponse d’orientation) est également reconnue pour engendrer plusieurs réponses physiologiques associées à l’état d’alerte. Ces réponses physiologiques, sous certaines conditions, sont considérées comme des indices psychophysiologiques de la capture attentionnelle auditive permettant de démontrer l’occurrence d’une réorientation de l’attention de la tâche en cours vers le son déviant. De récentes études suggèrent qu’il existe un lien entre ces indices et la réponse pupillaire, soit l’augmentation rapide du diamètre pupillaire. Quelques études ont tenté d’évaluer si cette réponse pouvait remplir les critères d’un indice valide de la réponse d’orientation; cependant, les résultats de ces études sont parfois contradictoires ou incomplets. La présente thèse propose donc une évaluation systématique de l’utilisation de la réponse pupillaire à titre d’indice psychophysiologique de la capture attentionnelle auditive. Les résultats de la première étude montrent que la réponse pupillaire respecte les critères d’un index valide de la réponse d’orientation, supportant ainsi la validité de cet index. L’Étude 2 montre que cet indice peut être utilisé dans des contextes dans lesquels les sujets effectuent simultanément à l’écoute des sons une tâche visuelle provoquant des changements systématiques de luminosité ou des mouvements oculaires qui affectent la taille de la pupille. Ces expériences appuient ainsi l’utilisabilité de cet index. Enfin, la dernière étude permet d’établir l’utilité de ce proxy puisque ce dernier permet de distinguer l’origine de deux phénomènes de distraction auditive différents. Dans l’ensemble, les résultats de la thèse révèlent que la réponse pupillaire représente un indice psychophysiologique adéquat qui pourrait être intégré aux études sur la distraction auditive ou dans des contextes plus appliqués où les mesures de la capture attentionnelle auditive peuvent s’avérer pertinentes.
Abstract
The presence of task-irrelevant sound is known to impede cognitive functioning. More precisely, presenting a sound that deviates from the auditory background has been shown to disrupt performance on an ongoing task. Several studies regarding performance disruption by deviant sounds showed that this effect originates from the reorientation of attention triggered when the organism has detected the deviant sound. Such attentional capture (or orientation response) also elicits many physiological responses related to one’s state of alertness. These physiological responses, under certain conditions, are considered as psychophysiological indices of auditory attentional capture, permitting to show that attention has been reoriented from an ongoing task toward the deviant auditory stimulus. Recent work suggested a relationship between these indices and the pupillary dilation response, that is a rapid increase in the pupil size. A few studies have attempted to assess whether the pupillary dilation response could respect the criteria for an index to be considered as a proxy for attentional capture; yet, results of these studies either lack consistency or are incomplete. Hence, the current thesis proposes a systematic assessment of using the pupillary dilation response as a psychophysiological proxy for the auditory attentional capture. Results of the first study suggest that the pupillary dilation response respects criteria of a valid auditory attentional capture index, thus supporting the validity of this index. Study 2 shows that this index can be used in contexts in which participants are exposed to irrelevant deviant sound while concurrently performing a task inducing luminance changes or ocular movements, both influencing the pupil size. These experiments hence supported the usability of this index. The last study allows establishing the utility of this proxy since it can be used to dissociate the origin of two different auditory distraction phenomena. Overall, results of the current thesis reveal that the pupillary dilation response is a psychophysiological index that could be added to several auditory distraction paradigms or in applied contexts in which the occurrence of attention reorientation toward a sound may be relevant to assess.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... ix
Liste des figures ... x
Liste des abréviations ... xiii
Épigraphe. ... xiv
Remerciements ... xv
Avant-propos ... xvii
Introduction générale ... 1
La capture attentionnelle auditive ... 6
Les mesures physiologiques de la capture attentionnelle auditive ... 9
Critères d’un indice valide de la réponse d’orientation. ... 11
Exemples d’indices valides de la réponse d’orientation. ... 13
La réponse pupillaire ... 15
La réponse pupillaire et la capture attentionnelle auditive. ... 20
Objectifs de la thèse ... 26
Chapitre 1 : Eyes have ears: Indexing the orienting response to sound using pupillometry ... 31
1.1 Résumé français ... 33
1.2 Abstract ... 34
1.3 Introduction ... 35
1.3.1 Amplitude of the Orienting Response ... 37
1.3.2 Habituation of the Orienting Response ... 38
1.3.3 The Present Study ... 40
1.4 Method ... 41
1.4.1 Participants ... 41
1.4.2 Apparatus and Material ... 42
1.4.2.1 Focal task. ... 42
1.4.2.2 Auditory sequences... 42
1.4.3 Procedure ... 43
1.4.4 Analyses ... 44
1.4.4.1 Pupillometry and preprocessing. ... 44
1.4.4.2 Data extraction. ... 44
1.4.4.3 Statistical analyses. ... 45
1.5 Results ... 46
1.5.1 Response Decrement to a Repeated Sound ... 46
1.5.2 Response Recovery to Auditory Change ... 48
1.5.4 Behavioral Performance ... 51
1.6 Discussion ... 52
1.6.1 Amplitude of the PDR ... 53
1.6.2 Habituation of the PDR ... 54
1.6.2.1 Decrement to the repetition of a sound. ... 54
1.6.2.2 Recovery to a deviant sound. ... 55
1.6.2.3 Dishabituation to the re-presentation of a standard sound. ... 57
1.6.3 Behavioral Impact of the Orienting Response ... 59
1.6.4 Implications for the Use of the PDR as an Index of the Orienting Response to Sounds ... 59
1.7 Conclusion ... 61
1.8 Acknowledgment ... 62
1.9 References ... 63
Chapitre 2 : Can pupillometry index auditory attentional capture in contexts of active visual processing? ... 70 2.1 Résumé français ... 72 2.2 Abstract ... 73 2.3 Introduction ... 74 2.4 Experiment 1 ... 78 2.4.1 Method ... 78 2.4.1.1 Participants. ... 78
2.4.1.2 Apparatus and material. ... 78
2.4.1.2.1 Visual task. ... 79
2.4.1.2.2 Auditory distractors. ... 79
2.4.1.3 Procedure. ... 80
2.4.1.4 Analyses. ... 80
2.4.1.4.1 Pupillometry and preprocessing. ... 80
2.4.1.4.2 Data extraction. ... 81 2.4.2 Results ... 81 2.4.2.1 Behavioural performance. ... 81 2.4.2.2 Pupillometry. ... 82 2.4.3 Discussion ... 83 2.5 Experiment 2 ... 87 2.5.1 Method ... 87 2.5.1.1 Participants. ... 87
2.5.1.2 Apparatus and material. ... 87
2.5.1.2.1 Visual task. ... 87
2.5.1.2.2 Auditory distractors. ... 88
2.5.1.3 Procedure. ... 88
2.5.1.4.2 Data extraction. ... 89 2.5.2 Results ... 90 2.5.2.1 Behavioural performance. ... 90 2.5.2.2 Pupillometry. ... 90 2.5.3 Discussion ... 91 2.6 General Discussion ... 96
2.6.1 Implications for the Study of Auditory Distraction ... 98
2.6.2 Potential Applications ... 100
2.7 Conclusion ... 101
2.8 References ... 103
Chapitre 3 : Is auditory distraction by changing-state and deviant sounds underpinned by the same mechanism? Evidence from pupillometry ... 111
3.1 Résumé français ... 113
3.2 Abstract ... 114
3.3 Introduction ... 115
3.3.1 Explanatory Models of the Changing-State and Deviation Effects ... 116
3.3.2 The Current Study ... 120
3.4 Method ... 123
3.4.1 Participants ... 123
3.4.2 Apparatus and Material ... 123
3.4.2.1 Focal task. ... 123
3.4.2.2 Irrelevant auditory sequences. ... 124
3.4.3 Procedure ... 125
3.4.4 Analyses ... 125
3.4.4.1 Behavioral performance. ... 126
3.4.4.2 Pupillometry and preprocessing. ... 126
3.4.4.3 Data extraction. ... 126 3.5 Results ... 127 3.5.1 Behavioral Performance ... 127 3.5.2 Pupillometry ... 128 3.5.2.1 Deviant-elicited PDRs. ... 129 3.5.2.2 Change-elicited PDRs. ... 130 3.6 Discussion ... 134 3.7 Conclusion ... 140 3.8 References ... 142
Chapitre 4 : Discussion générale ... 150
4.1 Retour sur les objectifs de la thèse et rappel des principaux résultats ... 151
4.1.1 Objectif 1 : Validité de la réponse pupillaire. ... 151
4.1.2 Objectif 2 : Utilisabilité de la réponse pupillaire. ... 153
4.1.3 Objectif 3 : Utilité de la réponse pupillaire. ... 155
4.2.1 Implications théoriques. ... 156
4.2.1.1 Physiologie du système LC-NA. ... 157
4.2.1.2 Relations entre le système LC-NA et la réponse pupillaire en contexte de réponse d’orientation. ... 160
4.2.1.2.1 Sensibilité à la déviation. ... 161
4.2.1.2.2 Habituation. ... 162
4.2.1.2.3 Amplitude de la déviation sonore. ... 163
4.2.1.3 Application de la théorie du gain adaptatif au modèle d’activation préattentionnelle de Schröger. ... 165
4.2.1.4. La réponse pupillaire en appui à l’intégration du système LC-NA au modèle de Schröger ... 168
4.2.2 Implications méthodologiques. ... 171
4.2.2.1 Limites de l’implémentation des mesures pupillaires aux études sur la distraction auditive. ... 175
4.2.3 Implications appliquées. ... 179
4.2.3.1 Intégration des mesures oculaires en contexte appliqué : exemple de l’aviation. ... 181
4.3 Limites de la présente thèse ... 189
Conclusion générale ... 194
Liste des tableaux Introduction générale
Tableau 1. Sources, descriptions et documentation des facteurs affectant la taille de la
pupille (tiré de Tryon, 1975, traduction libre) ... 29
Chapitre 2
Table 2.1. Mean pupil diameter (in mm), SD and Helmert contrast values at each serial
Liste des figures Introduction générale
Figure 1. Illustration schématique de l’activité cérébrale produite lorsqu’un stimulus
saillant, soit un son pertinent à la tâche ou déviant du contexte, est présenté (Sara & Bouret, 2012) ... 11
Figure 2. Illustration schématique de l’action des muscles responsables de la
constriction et de la dilatation de la pupille de l’œil (Nyström et coll., 2016) ... 17
Figure 3. Illustration montrant les voies sympathique (sympathetic) et
parasympathique (parasympathetic) directes et indirectes produisant une dilatation et une constriction de la pupille de l’œil, respectivement (Wang et Munoz, 2015) ... 19
Figure 4. Variation phasique du diamètre de la pupille (Pupillary dilation; en mm)
observée par Steiner et Barry (2011) ... 24
Figure 5. Variation lente du diamètre pupillaire (Pupillary dilation; en mm) observée
par Steiner et Barry (2011) ... 26
Chapitre 1
Figure 1.1. Schematic illustration of the irrelevant auditory sequences presented during
the retention interval of the Brown-Peterson task. ... 43
Figure 1.2. Average pupillary dilation response (PDR), in %, triggered by each sound
of the habituation phase (H1 to H8), the change phase (C1 to C8) and the dishabituation phase (D1 and D2) for each type of trial. ... 47
Figure 1.3. Average pupillary dilation response (PDR), in %, triggered by the first eight
sounds of the habituation phase (H1 to H8) for each type of trial... 48
Figure 1.4. Average pupillary dilation response (PDR), in %, triggered by the first eight
sounds of the change phase (C1 to C8) for each type of trial. ... 49
Figure 1.5. Average pupillary dilation response (PDR), in %, triggered by the 8th sound
of the habituation phase and the 1st sound of the change phase (H8 and C1, respectively) for each type of trial. ... 50
Figure 1.6. Average pupillary dilation response (PDR), in %, triggered by the 8th sound
of the habituation phase and the 1st sound of the dishabituation phase (H8 and D1, respectively) for each type of trial. ... 51
Figure 1.7. Mean recall performance on the Brown-Peterson task for small-deviation,
large-deviation and control trials. ... 52
Chapitre 2
Figure 2.1. Schematic illustration of the irrelevant sound paradigm used in Experiment
1. ... 79
Figure 2.2. Mean percentage of items correctly recalled in each serial position in the
Figure 2.3. Variation of the mean pupil diameter (in mm) in Experiment 1 as a function
of time (in ms) for both control and deviant trials. ... 83
Figure 2.4. Averaged deviant-control difference in pupil size (in mm) in Experiment 1
as a function of time (in ms). ... 84
Figure 2.5. Scatter plot illustrating the relationship between the size of the deviation
effect (in %) and the amplitude of the deviant-control difference in pupil size (in mm) in Experiment 1. ... 85
Figure 2.6. Schematic illustration of the reading comprehension task and of the
irrelevant auditory sequences presented concurrently. ... 89
Figure 2.7. Results from Experiment 2: Variation of the mean pupil diameter (in mm)
from sound onset (indicated by the dashed line) as a function of time (in ms) for control and deviant trials. ... 90
Figure 2.8. Averaged deviant-control difference in pupil size (in mm) in Experiment 2
as a function of time (in ms). ... 91
Figure 2.9. Mean performance (in %) on the reading comprehension task for each type
of trial averaged for blocks of five trials. ... 93
Chapitre 3
Figure 3.1. Schematic illustration of the stimuli used in the visual serial recall task
performed by participants. ... 124
Figure 3.2. Mean percentage of items correctly recalled in each serial position in
steady-state (SS), steady-state + deviant (SS+d), state (CS) and changing-state + deviant (CS+d) trials. ... 128
Figure 3.3. Variation of the mean pupil diameter (in mm) as a function of time (in ms)
for all types of trials. ... 129
Figure 3.4. (A) Averaged deviant-control difference in pupil size (in mm) as a function
of time (in ms). (B) Mean baseline-corrected deviant-elicited PDRs (in mm) as a function of State (either steady or changing)... 130
Figure 3.5. (A) Averaged changing-state-steady-state difference in pupil size (in mm)
as a function of time (in ms). (B) Mean baseline-corrected change-elicited PDRs (in mm) as a function of the type of deviation trial (either no deviant or deviant) averaged across Sounds 2 to 10. ... 131
Figure 3.6. Change-elicited PDRs (in mm) computed from the
changing-state-steady-state difference waves, averaged for all participants, as a function of the sound position. ... 133
Figure 3.7. Baseline levels of the change-evoked PDRs (in mm) computed from the
changing-state-steady-state difference waves, averaged for all participants, as a function of the sound position. ... 134
Chapitre 4
Figure 4.1. Schématisation du déclenchement des réponses électrophysiologiques et
périphériques de la réponse d’orientation auditive ainsi que de l’activité du système LC-NA (en rouge) dans les différentes régions du cerveau ... 158
Figure 4.2. Illustration simplifiée du modèle de Schröger (1997) décrivant la façon
dont les stimuli auditifs déviants sont mis en relation avec les prédictions engendrées par l’invariance qui caractérise l’environnement auditif et les étapes par lesquelles le signal qui en découle doit passer pour déclencher une réponse attentionnelle ... 166
Figure 4.3. Diamètre pupillaire mesuré suivant la présentation de différents types de
déviants auditifs (tiré de Wetzel et coll., 2016) ... 178
Figure 4.4. Diamètre pupillaire mesuré suivant la présentation d’une alarme auditive
en fonction de la charge mentale requise par la réalisation d’une tâche de pilotage concomitante (tiré de Causse et coll., 2016) ... 183
Liste des abréviations
ANOVA Analysis of variance
BF Bayes factor
CS Changing-state
ERP Event-related potential
ISI Interstimulus interval
LC-NA Locus coeruleus-noradrénergique
MMN Mismatch negativity
OR Orienting response
PDR Pupillary dilation response
SD Standard deviation
SS Steady-state
TBI To-be-ignored
Épigraphe.
…science is more than a body of knowledge. It’s a way of thinking. A way of skeptically interrogating the universe
with a fine understanding of human fallibility.
Remerciements
De nombreuses personnes ont contribué, au cours des cinq dernières années, à la réussite de mes études doctorales. Je tiens d’abord à remercier mon superviseur de thèse, François Vachon. François, l’écriture de cette thèse et la réalisation de l’ensemble du travail qui en découle n’auraient jamais été possibles sans ta supervision, ton appui et tes nombreux commentaires constructifs. Ta minutie légendaire m’aura encouragé à mettre les efforts nécessaires afin de me surpasser continuellement en vue d’atteindre des standards qui m’apparaissaient auparavant inaccessibles. Je suis également extrêmement reconnaissant de la confiance que tu m’as accordée pour la réalisation de ce projet doctoral et de bien d’autres études dans lesquelles j’ai pu m’impliquer. Je te souhaite beaucoup de succès dans ta carrière et beaucoup de temps de qualité avec ta famille, et j’espère sincèrement avoir encore la chance de travailler avec toi au fil des prochaines années.
Je tiens également à remercier les membres de ma famille, particulièrement ceux de ma famille immédiate : mon père Lévis, ma mère Hélène, mon beau-père Serge, mon frère Pierre et ma belle-sœur Fanny. Votre amour inconditionnel et votre support constant m’ont toujours encouragé à persévérer et à me donner à fond dans tout ce que j’entreprenais. Sans la curiosité intellectuelle, la persévérance et la résilience que vous m’avez inculquées, je n’aurais jamais pu entreprendre un tel projet ou même croire que j’avais la capacité d’un jour réussir des études doctorales. Bien que le futur soit incertain, je sais pertinemment que, peu importe le projet dans lequel je m’embarquerai, vous serez là pour m’appuyer, croire en moi et faire semblant de vous intéresser à mes sujets de recherche pour m’encourager !
Les mots me manquent pour remercier mon conjoint, mon amoureux, mon homonyme, Alexandre Lepage. Merci infiniment d’être là pour moi, de me supporter dans mes découragements, de comprendre mon contexte de travail et de me supporter au quotidien. Merci de m’écouter quand je crois avoir des épiphanies ou lorsque j’ai de gigantesques remises en question par rapport à mes travaux de recherche, puis de me questionner et m’encourager, et ce, malgré l’incompatibilité de nos postures épistémologiques. Je suis honoré de t’avoir à mes côtés et j’ai hâte de commencer cette nouvelle étape de ma vie avec toi. Peu importe l’endroit où nous irons, je sais que je peux compter sur toi pour ensoleiller
mes journées, tant au sens figuré, grâce à ton imagination infinie et ton humour douteux, qu’au sens littéral, via tes analyses quotidiennes et exhaustives de la météo… Je t’aime !
Ces années passées à être isolé dans le deuxième sous-sol du pavillon Félix-Antoine-Savard auraient probablement été insoutenables sans la présence de tous mes amis et de toutes mes amies aux laboratoires PACE et Co-DOT. Je parle évidemment ici de la fameuse
gang du 00 (ou comme certaines personnes des plus hautes sphères disent, « le monde en
recherche »), composée, entre autres, de Katherine, Cindy, Serge, Johnathan, Alessandro, Annie, Benoît, Jean-Denis, Mark, et de tous les autres membres étudiants ou employés qui ont pu collaborer, de près ou de loin, sur les projets de recherche dans lesquels je me suis impliqué au fil des dernières années. Le caractère unique et magique des relations d’amitié qui se bâtissent sur cet étage ne provient pas seulement de l’amour de la recherche ou des difficultés respiratoires—probablement causées par la piètre qualité de l’air ambiant qui finit par boucher nos sinus (ou sini ?)—que nous avons en commun. Cette amitié découle d’un assemblage de personnalités uniques et merveilleuses où chaque personne joue un rôle clé, comme chez les Schtroumpfs ! Les interactions que nous avons eues ont toujours mené à des moments de qualité empreints de conversations hautes en couleur et d’humour de mauvais goût. Avant de débuter mon doctorat, je n’aurais jamais pu envisager un tel scénario où mes collègues deviendraient mes meilleurs amis. Je vous remercie du fond du cœur d’avoir rendu ces années si agréables et d’avoir enduré toute la distraction auditive à laquelle j’ai pu vous exposer par le biais de mes études et de ma propre gorge. GG !
Je n’aurais jamais été en mesure de terminer mes études doctorales sans le support de mes nombreux amis « en dehors » du domaine de la psychologie. Mireille, Ann-Julie, Benjamin, Alexandre (Prévost), François-Olivier, David, Delphine, Marie-Gabrielle, Charles, Sabrina, et les autres, je suis extrêmement privilégié de pouvoir bénéficier de votre amitié. Vous m’avez permis de décrocher dans les moments où j’avais besoin de penser à autre chose qu’à mes études et à mon avenir professionnel. Merci d’être là pour moi !
Je tiens enfin à remercier les autres membres de mon comité de thèse, Sébastien Tremblay et Frédéric Dehais, pour les conseils et le support qu’ils m’ont fournis tout au long de mon projet doctoral. Un merci spécial à Sébastien qui m’a offert plusieurs opportunités de
Avant-propos
Cette thèse est composée d’un chapitre d’introduction générale, de trois chapitres empiriques (Chapitres 1, 2 et 3), d’un chapitre de discussion générale (Chapitre 4) et d’une conclusion générale, suivie de la bibliographie et des annexes. Les chapitres empiriques sont présentés sous forme de manuscrits d’articles rédigés en anglais qui ont été publiés dans des revues scientifiques internationales, sans modification autre que le déplacement de figures ou ajustements d’interlignes, de notes de bas de page, de sous-titres et de paragraphes pour des raisons de mise en page.
Le premier article, intitulé Eyes have ears: Indexing the orienting response to sound
using pupillometry (Marois, Labonté, Parent & Vachon, 2018), a été publié à l’International Journal of Psychophysiology. Ce dernier a été soumis le 12 mars 2017 et accepté le 25
septembre 2017. Le second article, intitulé Can pupillometry index auditory attentional
capture in contexts of active visual processing? (Marois & Vachon, 2018), a été publié au Journal of Cognitive Psychology. Il a été soumis le 3 février 2018 et accepté le 5 avril 2018.
Le troisième article, intitulé Is auditory distraction by changing-state and deviant sounds
underpinned by the same mechanism? Evidence from pupillometry (Marois, Marsh &
Vachon, 2019), a été publié à la revue Biological Psychology. L’article a été soumis le 26 juillet 2018 et accepté le 7 janvier 2019. La contribution de chaque coauteur et coautrice pour l’ensemble des articles est décrite comme suit :
1. Alexandre Marois, candidat au doctorat en psychologie, École de psychologie, Université Laval, et premier auteur sur les trois articles : recension des écrits scientifiques, élaboration des devis expérimentaux, passation d’une partie des participantes et participants, édition des stimuli et programmation des tâches expérimentales, traitement des données pupillométriques et comportementales, réalisation des analyses statistiques, interprétation des résultats et écriture de l’ensemble des sections des trois articles.
2. Katherine Labonté, candidate au doctorat en psychologie, École de psychologie, Université Laval, et deuxième autrice sur le premier article : aide à la programmation de la tâche expérimentale, et collaboration à l’écriture et à la révision des figures du premier article.
3. Mark Parent, candidat au doctorat en psychologie, École de psychologie, Université Laval, et troisième auteur sur le premier article : programmation des scripts permettant l’analyse des données pupillométriques du premier article, aide à la modification dudit script pour les analyses du second et troisième article, et révision de l’écriture du premier article.
4. John Marsh, Ph.D., professeur, School of Psychology, University of Central Lancashire, et deuxième auteur sur le troisième article : aide à l’élaboration du devis expérimental ainsi qu’à l’écriture et à la révision du troisième article.
5. François Vachon, Ph.D., professeur agrégé, École de psychologie, Université Laval, dernier auteur sur le premier, deuxième et troisième article, et directeur de recherche : aide à l’élaboration des questions de recherche et du devis, et collaboration et révision à l’écriture des trois articles.
L’autorisation écrite de chaque coauteur et coautrice a été prélevée afin que les articles puissent être insérés dans la présente thèse en respectant les clauses de droit d’auteur émises par l’Université Laval.
Le style privilégié dans l’écriture de la présente thèse vise à intégrer le mieux qu’il soit l’égalité des genres. Une écriture totalement épicène (c.-à-d. n'étant marquée d’aucun point de vue du genre grammatical), quoique souhaitable, peut s’avérer parfois complexe. Bien que les doublets abrégés (p. ex., participant.e.s) soient parfois utilisés dans des contextes où l’espace est restreint, l’Office québécois de la langue française ne recommande pas leur utilisation dans des textes qui offrent suffisamment d’espace pour intégrer les doublets complets (p. ex., participantes et participants). Ces derniers sont préférables puisqu’ils « donnent la même visibilité à une désignation masculine et à une désignation féminine, les deux apparaissant en toutes lettres » (Office québécois de la langue française, 2018)1. Une
forme de grammaire totalement neutre de genre, quoiqu’ultimement souhaitable selon l’auteur de la présente thèse, n’existe par ailleurs que par de récentes initiatives provenant de certains établissements et, n’étant qu’à ses balbutiements, risquerait d’alourdir la présente thèse et même d’en affecter sa clarté considérant qu’elle soit inconnue de la majorité. Afin de respecter les valeurs féministes d’équité de l’auteur, la présente thèse privilégie donc l’emploi des doublets complets lorsque l’utilisation de termes épicènes est difficile ou trop redondante. Il est à noter que ce choix traduit une prise de position de l’auteur. Pour plus de détails sur cette prise de position, voir la lettre ouverte publiée en septembre 2018 dans la revue Psycause, écrite par le comité éditorial de la revue dans lequel l’auteur de la présente thèse siège (cf. Comité éditorial de la revue Psycause, 2018).
Introduction générale
L’environnement dans lequel nous vivons comprend une abondance d’informations qui peuvent être perceptibles par l’ensemble de nos sens. Être en mesure de traiter l’ensemble de l’information pertinente pourrait s’avérer utile afin d’optimiser notre adaptation à l’environnement. Or, notre cerveau possède des facultés de traitement limitées. La capacité du système cognitif à sélectionner les éléments qui peuvent être pertinents aux buts comportementaux est donc un aspect crucial à l’adaptation de l’humain à un environnement en constant changement. L’attention sélective réfère à cette capacité à traiter de façon préférentielle l’information pertinente et à filtrer les éléments indésirables qui peuvent être non pertinents (Allport, 1989). Bien qu’il puisse paraître désirable de traiter seulement l’information utile à une tâche précise, l’humain se doit malgré tout de rester ouvert à certains stimuli possiblement importants, mais inutiles à la tâche. En effet, une telle flexibilité attentionnelle est nécessaire à la survie de l’humain (Hughes & Jones, 2003a). Elle permet notamment à un individu de détecter un événement potentiellement dangereux qui, malgré son importance pour la sécurité, n’est pas relié à la tâche réalisée au moment de son occurrence et est donc considéré d’emblée comme étant non pertinent. Outre le fait que cette perméabilité attentionnelle soit utile dans de telles situations, elle implique aussi qu’une personne puisse être distraite lors de moments inopportuns et inattendus par des événements qui ne revêtent aucune importance pour la tâche ou pour la sécurité. Cette distraction affecte le fonctionnement cognitif et, conséquemment, la performance à la tâche en cours. Cet impact sur la performance est d’ailleurs démontré dans plusieurs contextes différents, et ce, indépendamment de la modalité sensorielle dont provient la distraction, qu’elle soit auditive (p. ex., Vachon, Labonté & Marsh, 2017), visuelle (p. ex., Hickey, McDonald & Theeuwes, 2006), tactile (p. ex., Frings, Amendt & Spence, 2011) ou olfactive (p. ex., Basevitch et coll., 2011). La distraction demeure cependant principalement étudiée sous les modalités auditive et visuelle.
Parmi ces modalités sensorielles, les stimuli de nature auditive sont considérés particulièrement dérangeants puisque l’information auditive serait traitée par le système
cognitif d’une façon presque systématique2 (Hughes et coll., 2011). Plus précisément, de
nombreuses études sur la distraction auditive montrent que la présentation inattendue d’un son non pertinent qui dévie du contexte auditif dans lequel il est inséré (c.-à-d. d’un son déviant) peut affecter le fonctionnement cognitif. Il a par exemple été montré que la présentation d’un son déviant—p. ex., la lettre B dans la séquence A A A A A A B A—peut engendrer une augmentation du temps de réaction (p. ex., Escera, Alho, Winkler & Näätänen, 1998; Parmentier, 2008; Schröger & Wolff, 1998; Wetzel, 2015) et une diminution de la précision de réponse (p. ex., Escera et coll., 1998; Hughes, Vachon & Jones, 2005, 2007; Parmentier, 2008; Schröger & Wolff, 1998; Wetzel, 2015) à une tâche visuelle concomitante. Cette augmentation du temps de réaction doublée d’une diminution de la précision de réponse constitue un impact comportemental qui se nomme effet de déviation (Hughes et coll., 2005, 2007; Lange, 2005; Parmentier, 2008; Sörqvist, 2010; pour une recension sur le sujet, voir Hughes, 2014; Parmentier, 2014). L’effet de déviation est largement montré en laboratoire et peut être observé alors que des participantes et participants effectuent plusieurs types de tâches visuelles différentes telles que le rappel sériel visuel (p. ex., Hughes et coll., 2007; Lange, 2005; Marsh, Roër, Bell & Buchner, 2014; Sörqvist, 2010), la tâche de n-back (p. ex., Sörqvist, Dahlström, Karlsson & Rönnberg, 2016), le suivi visuel continu (p. ex., Muller-Gass, Macdonald, Schröger, Sculthorpe & Campbell, 2007), la tâche de l’item manquant (p. ex., Hughes et coll., 2007; Vachon et coll., 2017), ou la détection de stimuli cibles (oddball; p. ex., Escera et coll., 1998; Nöstl, Marsh & Sörqvist, 2012; Parmentier, 2008; Schröger & Wolff, 1998).
Une étude récente de Vachon et coll. (2017) montre que le fait que les caractéristiques des sons à ignorer et celles des stimuli impliqués dans la tâche soient similaires n’a pas d’impact sur l’effet de déviation. Dans cet article, la performance à une tâche de rappel sériel spatial, dans laquelle la position spatiale de points présentés séquentiellement sur un écran doit être rappelée selon l’ordre de la séquence, est affectée par une déviation auditive spatiale, mais également non spatiale. Par ailleurs, cet impact des deux types de déviants auditifs
2 Il est toutefois à noter que l’activité cérébrale, dont celle du cortex auditif qui possède des neurones réagissant spécifiquement à certaines caractéristiques des stimuli auditifs, peut s’ajuster selon les objectifs d’un individu. Le traitement auditif peut ainsi être modulé pour traiter de façon préférentielle les sons captés par le système sensoriel auditif (p. ex., Fritz, Elhilali & Shamma, 2007; voir également Kaya & Elhilali, 2017, pour une recension sur les modèles ascendants et descendants du traitement auditif et de l’attention auditive).
s’observe également lorsque les sujets exécutent une tâche de rappel sériel visuel qui consiste à rappeler une série de stimuli visuels (p. ex., des chiffres) en fonction de leur ordre de présentation. Cela suggère à nouveau que l’effet de déviation reflète une forme générale de distraction auditive pour laquelle l’impact négatif produit sur la tâche n’est ni tributaire de la nature des stimuli auditifs à ignorer ni de la tâche en cours.
Bien que ce phénomène soit observé dans plusieurs contextes, il n’est toutefois pas inéluctable et un certain contrôle attentionnel peut être effectué afin d’en éviter les conséquences négatives. La connaissance préalable de la présentation d’un stimulus déviant permet d’abord d’éviter l’effet de déviation. Par exemple, Hughes, Hursltone, Marsh, Vachon et Jones (2013) montrent que l’impact d’un déviant auditif sur la performance à une tâche de rappel sériel visuel est amoindri lorsqu’il est indiqué au début d’un essai qu’un déviant auditif sera présenté. De plus, Shelton, Elliot, Eaves et Exner (2009) montrent que des sujets effectuant une tâche de décision lexicale visuelle, dans laquelle la vraisemblance lexicale de deux stimuli visuels doit être jugée, récupèrent plus rapidement d’une distraction causée par une sonnerie de téléphone cellulaire lorsqu’ils sont avertis qu’un téléphone cellulaire pourrait sonner au cours de la tâche. Selon Hughes (2014), la connaissance préalable d’une distraction causée par un stimulus auditif déviant peut être représentée dans le schéma d’action de la tâche en cours (le task-set), c.-à-d. dans la chaîne de processus utilisés pour accomplir la tâche. Puisque la présentation d’un déviant fait partie de la chaîne de processus, aucun effet de déviation n’est produit, car sa présentation fait partie du contexte sonore prédit par la personne. Cette démonstration empirique appuie aussi le fait qu’un stimulus doit être inattendu pour être considéré comme étant déviant du contexte sonore.
Il est aussi possible de se prémunir de l’effet de déviation en augmentant le niveau d’engagement à la tâche exécutée simultanément à la présentation des stimuli auditifs. La difficulté de la tâche peut notamment être augmentée afin qu’il soit nécessaire de se concentrer davantage pour réaliser la tâche et, ainsi, que l’engagement envers la tâche soit supérieur. Une étude de Parmentier, Elford, Escera, Andrés et San Miguel (2008) montre notamment que le fait de catégoriser un stimulus parmi quatre catégories plutôt que deux catégories diminue l’impact d’une distraction causée par un déviant de nature auditive puisqu’il est plus difficile de catégoriser un élément parmi quatre catégories que parmi deux
catégories. Hughes et ses collaborateurs (2013) établissent des conclusions semblables alors que la performance de participantes et de participants prenant part à une tâche de rappel sériel visuel dans laquelle les stimuli à rappeler sont brouillés n’est pas affectée par les sons déviants. L’ajout de bruit perceptif—l’embrouillement de l’image—rend ainsi l’identification des items à rappeler plus difficile, exigeant un engagement supérieur envers la tâche, ce qui abolit l’effet de déviation. Par ailleurs, les auteurs ont mesuré la capacité de mémoire de travail et montrent qu’elle est inversement corrélée à la susceptibilité à l’effet de déviation. Selon eux, cette capacité est associée à l’habileté à maintenir l’engagement dans une tâche (voir aussi Halin et coll., 2014). Ainsi, lorsque le niveau d’engagement à la tâche est augmenté par des influences externes (p. ex., un haut niveau de difficulté ou des avertissements sur la présentation de déviants), les individus possédant une plus faible capacité de mémoire de travail peuvent atténuer l’effet de déviation. Les personnes présentant une meilleure capacité de mémoire de travail sont toutefois moins dépendantes de cette aide externe et réussissent d’elles-mêmes à garder un haut taux d’engagement envers la tâche, ce qui les protège de l’effet de déviation puisqu’il est plus difficile de désengager leur attention pour qu’elle soit, par exemple, redirigée vers un stimulus non pertinent. Bien qu’un certain contrôle de l’effet de déviation soit possible par la connaissance préalable de la présentation d’un stimulus déviant ou par un niveau d’engagement envers la tâche plus élevé, l’impact négatif d’un déviant auditif sur les temps de réponse et la précision à une tâche effectuée simultanément demeure tout de même bien démontré.
Cette vulnérabilité du système cognitif face à la présentation de stimuli auditifs déviants est la manifestation comportementale d’un réflexe automatique observé chez l’humain et chez plusieurs autres animaux. Ce réflexe se nomme capture attentionnelle ou
réponse d’orientation (p. ex., Pavlov, 1927; Sokolov, 1963a). La présente thèse porte sur la
problématique de la distraction auditive et, plus particulièrement, sur le phénomène de la capture attentionnelle produite par la présentation d’un son déviant. Cette thèse vise à établir si la capture attentionnelle de nature auditive peut être étudiée grâce aux mesures du diamètre de la pupille de l’œil. Pour mieux comprendre la relation qui peut unir la distraction auditive et le diamètre pupillaire, la prochaine section vise à décrire la provenance de la capture attentionnelle auditive et les différentes façons préconisées pour étudier ce phénomène.
La capture attentionnelle auditive
La capture attentionnelle, ou la réponse (ou réflexe) d’orientation3, est observée lorsque l’attention est momentanément désengagée, de façon involontaire et temporaire, d’une tâche centrale, faisant l’objet du focus attentionnel, vers un stimulus non pertinent4. Ce
réflexe représente en quelque sorte l’unité de gestion des ressources attentionnelles chargée de diriger un organisme vers des changements dans son environnement (Barry, 2009). Ainsi, le réflexe d’orientation aurait pour objectif de permettre à une personne de diriger son attention vers un changement potentiellement important présent dans son environnement.
Selon la théorie du modèle neuronal (Sokolov, 1963b), le système auditif construit de façon automatique une représentation mnésique des stimuli auditifs—un modèle neuronal— qui symboliserait les caractéristiques de l’environnement auditif. D’après Schröger (1996), le système auditif serait doté d’un système de détection de changement qui surveillerait les entrées acoustiques. Lorsqu’une divergence entre un stimulus entrant et le modèle neuronal est détectée, le système produirait un signal (en anglais, call for attention) afin que l’attention soit dirigée vers ce nouveau stimulus potentiellement important pour l’organisme, et ce, d’une amplitude proportionnelle à la différence détectée entre l’événement déviant et le contexte (cf. Schröger, 1997). Si le signal de divergence est « entendu » par l’organisme, une réponse attentionnelle est produite. Un stimulus auditif déviant peut capter l’attention puisque ses caractéristiques acoustiques sont différentes de celles des stimuli précédemment enregistrés dans le modèle neuronal (Hughes et coll., 2005; Näätänen, 1990). Par exemple, face à la présentation répétée de la lettre A dans une voix masculine (le son standard), le modèle neuronal intègre que l’environnement sonore à laquelle la personne est exposée est
3 Dès lors, ces termes (réponse d’orientation, réflexe d’orientation et capture attentionnelle; ou orientation
response, orientation reflex et attentional capture) seront utilisés de façon indifférenciée pour parler de la
réorientation de l’attention vers un son qui dévie du contexte auditif.
4 À des fins de précisions, il appert de rappeler que l’attention peut être définie, selon les propos classiques de William James (1890), comme émergeant de la prise de possession, sous une forme claire et active, d’un élément parmi plusieurs objets ou de pensées qui se manifestent simultanément et dont le focus et la concentration font partie intégrante. L’attention implique également le retrait de certains éléments afin de mieux traiter d’autres éléments. La capture attentionnelle auditive représente donc la prise de possession automatique et involontaire du focus attentionnel par un son déviant, au profit de la tâche sur laquelle le focus se trouvait précédemment. En d’autres termes, un son qui dévie du contexte auditif a le potentiel de « forcer » un individu à traiter ce son au niveau de la conscience ce qui, conséquemment, entrave le traitement de l’information sur
caractérisé par la répétition de cette lettre et il enregistre ainsi les caractéristiques acoustiques du stimulus, notamment le timbre de voix, la hauteur du son et la nature de la lettre présentée. Si la lettre A est ensuite présentée dans une voix féminine (le son déviant), une capture attentionnelle est produite puisque le système auditif signalera un écart entre le modèle composé des sons standards et le stimulus déviant qui, dans ce cas-ci, provient d’un changement de timbre de voix et de hauteur tonale.
Différentes visions du modèle neuronal ont été proposées afin d’expliquer la façon dont une dissonance entre un son et le modèle neuronal peut induire la capture attentionnelle. L’une d’entre elles, l’approche d’agrégation (aggregate-based model; voir, p. ex., Cowan, 1995, 1999), suggère que le modèle neuronal enregistre une représentation mnésique basée sur un agrégat de caractéristiques physiques des derniers sons entendus. Une réponse d’orientation se produit lorsqu’un son possède certaines propriétés acoustiques qui sont « nouvelles » dans le contexte sonore récent, c.-à-d. lorsque ces caractéristiques acoustiques ne sont pas représentées en mémoire dans le modèle neuronal (p. ex., Cowan, 1995; Sokolov, 1963b). Dans l’exemple proposé plus haut, cette approche stipule que le son énoncé dans une voix féminine capte l’attention puisque certaines de ses caractéristiques, notamment sa tonalité plus haute et son timbre différent, sont absentes du modèle neuronal plutôt composé d’éléments acoustiques reliés à la voix masculine. Une autre approche, l’approche algorithmique (algorithm-based model; voir, p. ex., Hughes et coll., 2005, 2007), stipule que le modèle neuronal correspond plutôt à une représentation mnésique basée sur un algorithme qui intègre les régularités acoustiques du contexte auditif récent plutôt que les caractéristiques physiques elles-mêmes (p. ex., Schröger, 1997; Vachon, Hughes & Jones, 2012). Selon cette approche, un stimulus déviant produit une capture attentionnelle lorsque ses caractéristiques transgressent les prédictions associées au patron d’invariance enregistré dans le modèle neuronal. L’exposition à une certaine régularité acoustique permettrait au modèle neuronal d’établir un patron qui émet des attentes et prédictions quant aux prochains stimuli à être présentés. Toutefois, la présentation d’un son déviant transgressant les règles de régularité acoustique et violant ainsi les prédictions qui en découlent, plutôt que la simple présentation d’un son possédant des caractéristiques différentes de celles enregistrées dans le modèle neuronal, déclencherait une réorientation de l’attention vers le son déviant. Cette vision du modèle neuronal, dans l’exemple employé plus haut, expliquerait la réorientation
de l’attention lors de la présentation de la voix féminine par la violation de la régularité établie par le fait que chaque son était précédemment énoncé avec une voix masculine.
Ces deux visions du modèle neuronal convergent, dans l’exemple cité plus haut, vers une même conclusion : la présentation rare d’un stimulus déviant provoque une réponse d’orientation puisqu’elle est incohérente avec le contenu du modèle neuronal. Toutefois, la capture attentionnelle causée selon l’approche d’agrégation est dépendante de la nouveauté acoustique et des caractéristiques des stimuli enregistrées dans le modèle, alors que celle causée dans l’approche algorithmique dépend plutôt de la transgression des règles établies par le modèle neuronal. En effet, la réponse attentionnelle selon l’approche d’agrégation découle de la nouveauté acoustique puisque c’est l’absence de propriétés sensorielles spécifiques au modèle (p. ex., le timbre féminin en soit) qui produit une réponse d’orientation (Näätänen, 1990; Schröger & Wolff, 1998). Dans l’approche algorithmique, la capture est déclenchée aussitôt qu’un son dévie du patron de régularité acoustique extrait (p. ex., la présentation d’une voix différente de celle attendue par le patron de répétition). Hughes et ses collaborateurs (2007) appuient notamment cette dernière vision du modèle neuronal. Dans l’une de leurs expériences, les sujets effectuent une tâche de rappel sériel visuel alors qu’ils sont exposés à des séquences non pertinentes de sons changeants qui alternent selon le timbre de voix (p. ex., entre une voix A et B, A B A B A B A B). Dans l’une des conditions, les expérimentateurs intègrent une répétition déviante de l’une des voix dans les séquences (p. ex., A B A B A B B A). Les analyses montrent que la répétition d’un stimulus dans un contexte de sons alternés entraîne une baisse de performance de rappel (voir aussi Halin, Marsh, Haga, Holmgren & Sörqvist, 2014; Marsh et coll., 2014). Ces résultats appuient l’approche algorithmique puisque la violation du patron d’alternance des voix cause une réponse attentionnelle, et ce, malgré l’absence de changement acoustique entre le son déviant et le son précédent. Selon l’approche d’agrégation et des caractéristiques acoustiques, la répétition du B n’aurait pas dû produire de réponse d’orientation puisque ses caractéristiques acoustiques étaient déjà présentes dans le modèle neuronal. Ainsi, la nouveauté acoustique à elle seule ne semble pas nécessaire pour provoquer une capture de l’attention. Elle ne semble pas non plus suffisante, car la présence de variations acoustiques dans l’environnement sonore ne garantit pas l’observation d’un effet de déviation. Par exemple, dans la séquence
dernier dévie, en l’absence du G, du contexte séquentiel de la présentation des lettres dans un ordre alphabétique qui, lorsqu’il n’est pas transgressé, ne génère pas de réponse attentionnelle (Unger, 1964). Effectivement, bien que les autres lettres soient nouvelles, elles ne provoquent aucun effet de déviation puisque leur présentation respecte les attentes de l’ordre alphabétique du modèle neuronal. La violation des prédictions du modèle neuronal serait donc nécessaire et suffirait pour causer un effet de déviation (cf. Vachon et coll., 2012). Ainsi, dès qu’un stimulus auditif ne correspond pas aux prédictions faites par le modèle neuronal, il capte l’attention et produit potentiellement un effet de déviation.
Les mesures physiologiques de la capture attentionnelle auditive
Plusieurs études sur la réponse d’orientation font état de nombreuses réponses physiologiques associées à la capture attentionnelle (p. ex., Barry, 1990; Escera et coll., 1998; Näätänen, Tervaniemi, Sussman, Paavilainen & Winkler, 2001; Schröger & Wolff, 1998). Alors que la réponse d’orientation était davantage considérée comme étant une réponse comportementale dans un contexte de conditionnement (p. ex., Pavlov, 1927), plusieurs études subséquentes de Evgeny Sokolov l’ont considérée comme un réflexe automatique produisant différentes réactions corporelles. Ce phénomène a donc été initialement étudié selon une approche psychophysiologique. Cette approche se définit comme étant l’étude des relations entre les manipulations psychologiques (p. ex., la présentation d’un son déviant qui permet de produire une réponse attentionnelle) et des réponses physiologiques qui en résultent (p. ex., l’augmentation du rythme cardiaque qui découle de cette réponse attentionnelle), mesurées afin de mieux comprendre la relation entre les processus mentaux et corporels (Andreassi, 2007). Il s’agit d’une approche directe puisqu’elle permet de mesurer directement les variations physiologiques associées à une manipulation psychologique, contrairement à l’approche comportementale où l’étude des processus cognitifs non observables via des comportements observables est plus indirecte. Également, cette approche est dite « objective » puisqu’elle permet d’établir la relation entre les réponses physiologiques et des manipulations de nature psychologique sans être affectée par des facteurs tels que la désirabilité sociale et les attentes qui sont reconnues pour moduler les états psychologiques rapportés (voir, p. ex., Fried, Rowland & Ferris, 1984). La psychophysiologie offre donc une
fenêtre plus directe et objective sur l’origine des différents processus mentaux, contribuant ainsi à une meilleure compréhension de ces derniers.
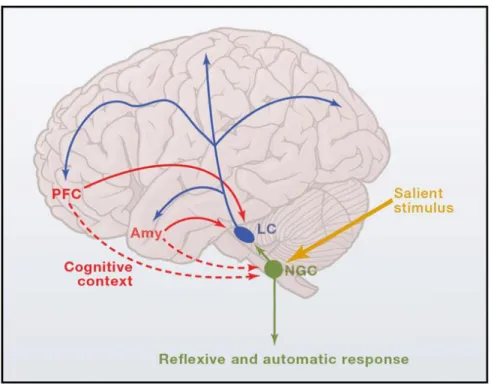
Selon Sokolov (1963a, 1963b), la capture attentionnelle remplit un objectif d’adaptation qui assure des conditions optimales de perception des stimuli. Conséquemment, les réponses physiologiques associées à ce phénomène permettraient d’améliorer momentanément la vigilance et le niveau d’alerte d’une personne. Ces réactions physiologiques suivant la réponse d’orientation proviennent d’une activation du système sympathique et des neurones du locus coeruleus, ainsi que d’une désactivation du système parasympathique. Selon Sara et Bouret (2012), lorsqu’un événement saillant (un son pertinent à la tâche ou déviant du contexte) est détecté, le locus coeruleus et le noyau gigantocellulaire sont activés tout en étant modulés par des afférences descendantes provenant de régions frontales et de l’amygdale. L’activité de ces régions afférentes dépend de plusieurs processus cognitifs, tels que ceux impliqués dans l’établissement d’un modèle neuronal déterminant si un stimulus présent dans l’environnement revêt une signification pour la tâche ou pour la sécurité d’un individu (c.-à-d. s’il s’agit d’un stimulus déviant; Nieuwenhuis, Aston-Jones & Cohen, 2005; Nieuwenhuis, De Geus & Aston-Jones, 2011; pour un lien entre l’activité des régions frontales, de l’hippocampe et le modèle neuronal, voir Alho, Woods, Algazi, Knight & Näätänen, 1994; Lopes, Simões, Ferraz & Leal, 2014; Sokolov, 1963b, 1990). L’activation de ces régions permet ensuite de moduler l’activité du locus coeruleus et du noyau gigantocellulaire. Cette activité produit une réponse phasique (c.-à-d. rapide) permettant la sécrétion de noradrénaline dans plusieurs régions clés responsables de l’activité sensorielle et motrice telles que le thalamus, les cortex cérébraux, les structures limbiques, le cervelet et la moelle épinière (p. ex., Miller & Cohen, 2001; Nieuwenhus et coll., 2005, 2001; Sara & Bouret, 2012). L’activation de ce système locus coeruleus-noradrénergique (LC-NA) déclenche ensuite la production de plusieurs réactions physiologiques via le noyau gigantocellulaire et la moelle épinière (p. ex., augmentation du rythme cardiaque et du niveau de sudation de la peau) qui améliorent la réceptivité du système envers l’environnement et, conséquemment, qui permettent à une personne de mieux s’adapter et d’être plus vigilante. La Figure 1, tirée de Sara et Bouret (2012), illustre l’activité de ces régions cérébrales en contexte de capture attentionnelle.
Figure 1. Illustration schématique de l’activité cérébrale produite lorsqu’un stimulus saillant,
soit un son pertinent à la tâche ou déviant du contexte, est présenté (Sara & Bouret, 2012)5. Le stimulus saillant (Salient stimulus; en jaune) active le noyau gigantocellulaire (NGC; en vert) qui, à son tour, active le locus coeruleus (LC; en bleu). L’activité de ces deux noyaux est modulée par des afférences provenant de régions cérébrales préfrontales (PFC), notamment affectées par des processus cognitifs dépendant du contexte (Cognitive context) et de l’amygdale (Amy; en rouge). Le locus coeruleus stimule ensuite différentes régions cérébrales telles que le thalamus, les cortex cérébraux et les structures limbiques, ce qui affecte à nouveau indirectement le noyau gigantocellulaire. Enfin, ce dernier stimule le cervelet et la moelle épinière, et de nouveau le locus coeruleus, permettant ultimement la production de réponses physiologiques associées à une meilleure vigilance (Reflexive and
autonomic response).
Critères d’un indice valide de la réponse d’orientation. Plusieurs études sur la
réponse d’orientation montrent ainsi que la capture attentionnelle peut être accompagnée d’un ensemble de réponses physiologiques (p. ex., Escera et coll., 1998; Schröger & Wolff, 1998; Steiner & Barry, 2011). Sous certaines conditions, ces réponses physiologiques peuvent être identifiées comme indices (ou proxy) de la capture attentionnelle, c.-à-d. que leur production en contexte de distraction permet de démontrer l’occurrence d’une réponse
5 Réimprimé de Neuron, 76, Susan J. Sara & Sebastien Bouret, Orienting and reorienting: The locus coeruleus mediates cognition through arousal, 130–141, Copyright © 2012 Elsevier Ltd., avec la permission de Elsevier
attentionnelle produite par la présentation d’un stimulus déviant. Sokolov (1963a, 1963b) établit d’ailleurs des critères spécifiques afin de considérer qu’un index physiologique puisse démontrer l’occurrence d’une réponse d’orientation (voir aussi Steiner & Barry, 2011). L’index physiologique doit d’abord réagir à la modification de l’un ou l’autre des paramètres du stimulus présenté. Ainsi, selon Sokolov (1963b), « dépendamment de son intensité, de sa signification ou de sa nouveauté, un stimulus produit une réponse réflexe qui implique différents organes à différents niveaux » (p. 36, traduction libre). Par exemple, l’impact de la présentation d’un stimulus qui dévie par rapport au timbre (p. ex., Lange, 2005) doit pouvoir être mesuré, à l’aide d’une réponse physiologique, au même titre que l’impact d’un stimulus auditif déviant de par son intensité sonore (p. ex., Dalton & Lavie, 2004).
L’index doit ensuite faire preuve d’habituation (Sokolov, 1963a). L’habituation se définit par une diminution graduelle de la réponse attentionnelle (et des réponses physiologiques qui en découlent) avec la présentation répétée d’une stimulation et qui n’implique pas l’adaptation ou la fatigue sensorielle (Rankin et coll., 2009). Thompson et Spencer (1966) ont établi des critères spécifiques pour l’habituation, révisés par Rankin et coll. (2009). Ces critères incluent : (a) une diminution progressive6 de l’amplitude de la réponse au fur et à mesure qu’un stimulus standard est répété7 (response decrement); (b) un
rétablissement de la réponse (response recovery), soit une augmentation de l’amplitude de la réponse lors de la présentation d’un stimulus déviant; et (c) la déshabituation (dishabituation) où l’amplitude de la réponse augmente lors de la re-présentation du stimulus standard sur lequel le système s’était auparavant habitué. Ainsi, face à la séquence auditive A A A A A A B A, l’amplitude d’un indice psychophysiologique de la capture attentionnelle doit diminuer au fil de la présentation répétée des six premiers A, doit se rétablir lorsque le déviant B est présenté, et doit également réagir à la présentation du dernier A, et ce, d’une amplitude supérieure à lorsque cette lettre avait été présentée pour la sixième fois avant l’événement déviant.
6 Le caractère progressif de la diminution de la réponse n’est pas systématique. Plusieurs études montrent effectivement qu’une seule répétition (c.-à-d. la deuxième occurrence d’un stimulus) engendre une baisse forte de l’amplitude de la réponse attentionnelle, voire l’atteinte d’un effet plancher (p. ex., Bendixen, Roeber & Schröger, 2007; Sams, Alho & Näätänen, 1984; Steiner & Barry, 2011).
L’amplitude d‘une réponse physiologique utilisée à titre de proxy de la capture attentionnelle doit également être associée à l’amplitude de la déviation produite dans l’environnement (Sokolov, 1963b; voir aussi Siddle & Heron, 1976, 1977; Sokolov & Paramonova, 1961; Williams, 1963). Sokolov (1963b) affirme effectivement que :
[La présentation] répétée d’un stimulus auditif d’une fréquence et d’une intensité fixes mène à la disparition des composantes de la réponse d’orientation et à un état apparent de non-réactivité. Un son d’une même intensité, mais de fréquence différente, produit ensuite une réaction distincte qui, sous certaines limites, augmente en intensité lorsque la différence entre ce nouveau son et les sons précédents est plus élevée (p. 286, traduction libre).
Plus précisément, la présentation d’un événement faiblement déviant (p. ex., la présentation d’un son pur de 520 Hz parmi une série de sons purs de 500 Hz; différence de 20 Hz) doit produire une réponse physiologique d’amplitude inférieure à celle qui aurait été produite si l’événement déviant avait davantage différé du contexte dans lequel il a été inséré (p. ex., la présentation d’un son de 600 Hz parmi une série de sons de 500 Hz; différence de 100 Hz). Enfin, selon Sokolov (1963b), un proxy de la réponse d’orientation devrait être sensible à la pertinence de l’événement. En d’autres mots, la présentation d’un stimulus qui revêt une importance pour les buts comportementaux d’un individu (p. ex., une cible précise dans une tâche de recherche) doit produire une réponse physiologique d’amplitude supérieure à la présentation d’un événement non pertinent qui, malgré tout, peut avoir le potentiel de produire une réponse attentionnelle (voir, p. ex., Kenemans, Verbaten, Roelofs & Slangen, 1989; Steiner & Barry, 2011, 2014).
Exemples d’indices valides de la réponse d’orientation. La réponse électrodermale
et les mesures des potentiels évoqués, plus précisément le potentiel P3, sont notamment considérées comme des indices adéquats pour évaluer la production d’une réponse d’orientation. Plusieurs études montrent effectivement que ces indices psychophysiologiques respectent les critères établis par Sokolov (1963a, 1963b). Les écrits montrent d’abord que des réponses d’orientation causées par plusieurs stimuli de natures différentes peuvent induire une réponse électrodermale. Ainsi, une réponse électrodermale est produite lorsqu’une réponse d’orientation est par exemple causée par le mouvement apparent d’un stimulus visuel (Bernstein, Taylor, Austen, Nathanson & Scarpelli, 1971), par la présentation
de stimuli visuels cibles (Barry, 2004), par l’omission inattendue d’un stimulus (Sokolov, 1963b), par la présentation d’un stimulus auditif déviant selon son intensité sonore (MacDonald, Barry & Rushby, 2013) ou sa hauteur tonale (Siddle & Heron, 1977; Steiner & Barry, 2011, 2014). Une réponse électrodermale produite en contexte de distraction auditive respecte aussi le patron classique d’habituation nécessaire pour représenter un indice de la réponse d’orientation. Notamment, Siddle et Heron (1977) montrent que, suivant une habituation de la réponse électrodermale à la présentation répétée d’un stimulus de 1000 Hz, la présentation inattendue de stimuli déviants plus graves (380 ou 670 Hz) entraîne un rétablissement de la réponse électrodermale (voir aussi Steiner & Barry, 2011, 2014). De plus, la magnitude de la réponse électrodermale est plus élevée lorsque la différence de fréquence est plus grande entre le standard et le déviant (p. ex., lors de la présentation d’un déviant de 380 Hz comparé à celle du déviant de 670 Hz). Enfin, Steiner et Barry (2011; voir aussi Steiner & Barry, 2014) montrent que la réponse électrodermale est sensible à la pertinence d’un stimulus. En effet, dans une condition où la tâche à effectuer est de compter le nombre de stimuli auditifs présentés (stimuli pertinents), la réponse électrodermale produite par chacun des sons est d’amplitude supérieure à une condition où les sons doivent plutôt être ignorés (stimuli non pertinents).
Des résultats semblables sont également observés par rapport à la P3, une mesure des potentiels évoqués associée à l’attention. Plusieurs études lient effectivement le potentiel P3a, soit la composante de la P3 associée à la distraction et produite par la présentation de stimuli non-cibles rares (p. ex., Demiralp, Ademoglu, Comerchero & Polich, 2001; Gumenyuk, Korzyukov, Alho, Escera & Näätänen, 2004), à la réponse d’orientation. Par exemple, la P3a est produite par plusieurs types de déviants ou de sons nouveaux et possède d’ailleurs des contributions provenant du lobe frontal et de l’hippocampe (p. ex., Knight, 1984), des régions cérébrales associées à la réponse d’orientation (p. ex., Fuster, 1989; voir également Sara & Bouret, 2012). Bien que la P3 ne semble pas s’habituer aussi facilement que d’autres index physiologiques (Courchesne, Courchesne & Hillyard, 1978), l’amplitude de sa réponse diminue tout de même au fur et à mesure qu’un stimulus déviant est présenté à plusieurs reprises. Polich (1989) montre par exemple qu’après environ 200 présentations d’un stimulus auditif cible parmi des stimuli standards, un patron classique d’habituation
l’amplitude de la réponse cesse de diminuer lorsqu’un changement au stimulus cible est amené, ce qui représente un rétablissement de la réponse. Lyytinen, Blomberg et Näätänen (1992) arrivent à des conclusions similaires alors que l’amplitude de la P3a est plus élevée lors des premiers essais de leur expérience que lors des derniers essais. La P3 est également associée à l’amplitude de la déviation. Escera et ses collaborateurs (1998) montrent par exemple que l’amplitude de la P3a est plus élevée lorsqu’un stimulus auditif déviant présenté possède de plus grandes différences avec le son standard. Enfin, Steiner et Barry (2011) montrent que, à même titre que pour la réponse électrodermale, la P3 déclenchée par la présentation de stimuli pertinents (c.-à-d. qui doivent être comptés) est supérieure à la P3 produite par les stimuli à ignorer.
Le système LC-NA, impliqué dans le déclenchement des réponses physiologiques produites par la capture attentionnelle, a également été associé aux fluctuations du diamètre pupillaire (Aston-Jones & Cohen, 2005). Notamment, Rajkowski, Kubiak et Aston-Jones (1993) montrent que le diamètre de la pupille est significativement corrélé aux variations de l’activité tonique (ou lente) du locus coeruleus (voir également Gilzenrat, Holmes, Rajkowski, Aston-Jones & Cohen, 2002; Murphy, O’Connell, O’Sullivan, Robertson & Balsters, 2014). Murphy, Robertson, Balsters et O’Connell (2011) montrent quant à eux que l’activité pupillométrique est liée à la production du potentiel P3 qui, tel qu’indiqué plus haut, permet d’indexer la capture attentionnelle auditive. Comme le diamètre pupillaire semble être associé aux variations de l’activité du locus coeruleus, région clé permettant l’activation corporelle suivant une réponse d’orientation, et que ces fluctuations peuvent notamment être engendrées par l’action du système sympathique, il a été suggéré que les fluctuations de la pupille de l’œil pourraient également servir d’indice psychophysiologique de la réponse d’orientation auditive (Nieuwenhuis et coll., 2011; Wang & Munoz, 2015; voir aussi Sokolov, 1963a, pour une première association entre la réponse d’orientation et les fluctuations du diamètre pupillaire).
La réponse pupillaire
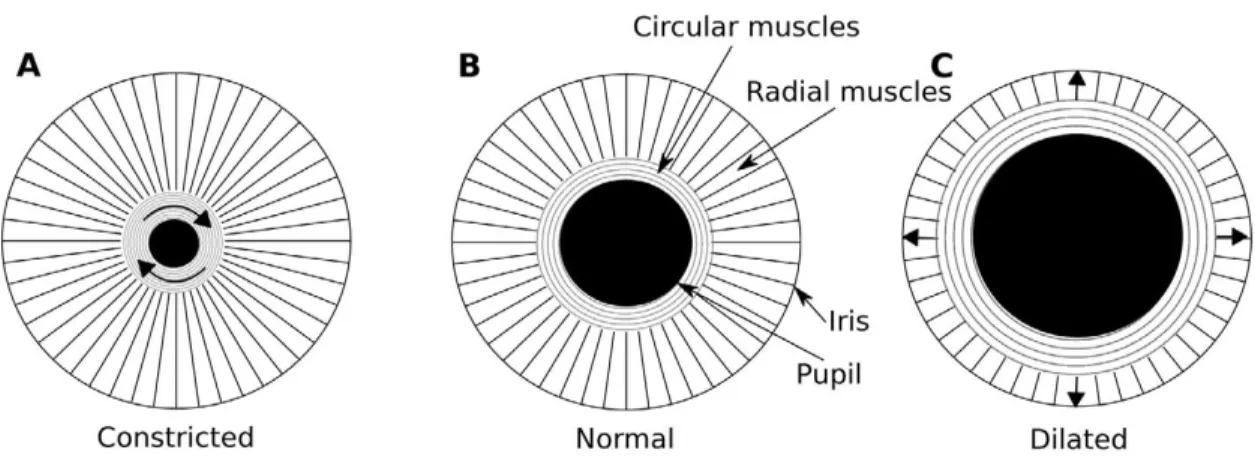
La pupille est l’ouverture au centre de l’iris de l’œil par laquelle la lumière entre pour atteindre la rétine. Son diamètre est régi par deux muscles de l’iris : le sphincter de la pupille et le dilatateur de la pupille. L’iris a notamment pour rôle d’augmenter le diamètre de la
pupille lorsque la lumière détectée par la rétine est de plus faible intensité et vice-versa (Andreassi, 2007; Nyström, Hooge & Andresson, 2016; voir Figure 2). La dilatation et la constriction de la pupille sont principalement causées par le réflexe photomoteur et le réflexe d’accommodation (Tryon, 1975). Le réflexe photomoteur se produit lorsque la pupille se contracte face à une luminosité qui s’intensifie et lorsqu’elle se dilate face à une lumière de faible intensité. Le réflexe d’accommodation se produit plutôt lorsque les deux yeux tentent, de pair, d’effectuer un focus sur un objet précis. Les mouvements des yeux peuvent également affecter le diamètre pupillaire. Par exemple, Jainta, Vernet, Yang et Kapoula (2011) rapportent que le diamètre pupillaire augmente précédant la production d’une saccade. De plus, considérant la forme sphérique du globe oculaire, les estimations de la taille de la pupille peuvent être affectées lorsque les yeux bougent. Selon la position du regard et de l’œil, cette déformation peut donc créer des biais systématiques dans les mesures du diamètre pupillaire, engendrant ainsi des mesures qui sont surestimées ou sous-estimées (Brisson et coll., 2013; Nyström et coll., 2016). La pupillométrie est définie comme étant la mesure des variations du diamètre de la pupille de l’œil (ou des réponses pupillaires; p. ex., Beatty, 1982a; Carver, 1971; Jepma & Nieuwenhuis, 2011; Just & Carpenter, 1993). Ces réponses pupillaires peuvent être mesurées via deux différentes composantes : la réponse tonique et la réponse phasique (Beatty, 1982b). Tel que présenté par Peysakhovich, Vachon et Dehais (2017), la réponse tonique reflète une composante soutenue, lente, et est exprimée par le diamètre pupillaire absolu (en mm) alors que la réponse phasique réfère à la composante transitoire, rapide, et est exprimée sous forme relative en fonction d’un niveau de base. Les variations de la réponse phasique sont habituellement produites 200 ms après la présentation d’un stimulus, le diamètre atteignant son maximum de 500 à 1000 ms après l’événement (p. ex., Lowenstein & Loewenfield, 1962).
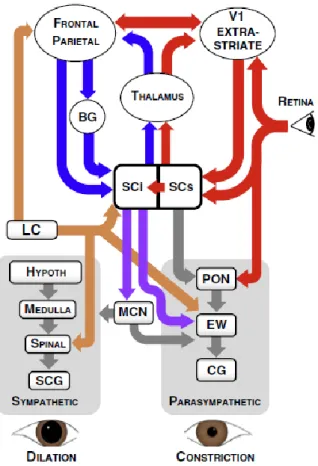
Selon Wang et Munoz (2015), la taille de la pupille est principalement contrôlée par l’activité des systèmes sympathique et parasympathique. Le système parasympathique comprend des cellules rétiniennes ganglionnaires qui s’activent lorsque la surface de la rétine détecte de la lumière. Ces cellules se projettent ensuite sur le colliculus supérieur et sur le noyau prétectal olivaire qui reçoit également des projections du colliculus supérieur. Le noyau prétectal olivaire active ensuite l’activité du noyau Edinger-Westphal (Gamlin, 2006).