Mécanismes moléculaires impliqués dans l'expression
et les effets de la 5-lipoxygénase et ses métabolites
Thèse
Samuel Poirier
Doctorat en microbiologie-immunologie
Philosophiæ doctor (Ph. D.)
Mécanismes moléculaires impliqués dans
l’expression et les effets de la 5-lipoxygénase
et ses métabolites
Thèse
Samuel J. Poirier
Sous la direction de :
Nicolas Flamand, directeur de recherche
Marc E. Surette, codirecteur de recherche
Résumé
L'inflammation est un processus important dans lequel le système immunitaire réagit à un irritant. Plus précisément, l'inflammation aide à défendre le corps humain contre les agents pathogènes. Cependant, une inflammation chronique et incontrôlée peut entraîner des pathologies telles que l'athérosclérose, l'asthme et le cancer. L'enzyme 5-lipoxygénase (5-LO), codée par le gène ALOX5, est principalement exprimée par les leucocytes et joue un rôle central dans la réaction immunitaire. C'est la première enzyme engagée pour la biosynthèse de leucotriènes (LT) à partir de l’acide arachidonique. L'activité biologique des LT est diverse, mais
principalement le LTB4 induit une chimiotaxie des phagocytes et la libération
d'effecteurs antimicrobiens, alors que les cystéinyl leucotriènes (LTC4, LTD4 et LTE4)
induisent la bronchoconstriction et la perméabilité vasculaire. Cette thèse porte sur
1) les effets biologiques des métabolites du LTB4 sur les fonctions des neutrophiles
et sur 2) les mécanismes par lesquels l’expression de la 5-lipoxygénase est régulée dans les monocytes dans le contexte de la défense de l’hôte et de l’athérosclérose.
Spécifiquement, le LTB4 est rapidement dégradé en 20-OH- et 20-COOH-LTB4 par
les neutrophiles humains. Bien que ces métabolites se lient au récepteur BLT1 avec
une haute affinité, ils sont généralement considérés comme inactifs car comparé au
LTB4, ils activent considérablement moins les leucocytes. Par conséquent, le
premier objectif de cette thèse était d'évaluer les effets biologiques du 20-OH- et du
20-COOH-LTB4 sur les fonctions des neutrophiles humains telles que la migration,
la biosynthèse des leucotriènes et la production d'effecteurs antimicrobiens.
Ensuite, des études antérieures ont montré que la différenciation des cellules
myéloïdes avec la 1,25-dihydroxyvitamine D3 et le TGF-β est associée à une forte
augmentation de l'expression de la 5-LO. Étant donné que les lipopolysaccharides (LPS) induisaient également la maturation cellulaire entraînant une expression accrue du CD14, nous avons émis l'hypothèse que le LPS pourrait moduler l'expression de la 5-LO dans des lignées monocytaires. En conséquence, notre deuxième objectif était d'étudier l'impact du LPS sur l'expression de la 5-LO et la
induction de l’activité transcriptionnelle du promoteur ALOX5 d’une manière agoniste-dépendante. Enfin, une interaction entre l'apport alimentaire en acides gras polyinsaturés (PUFA) et des mutations naturelles du promoteur ALOX5 a été associée à un risque accru de maladies cardiovasculaires. Par contre, des études antérieures utilisant des essais rapporteurs avaient opté pour des modèles cellulaires non-humains ou 5-LO-négatifs afin d'étudier la régulation de la transcription de la 5-LO impliquant les polymorphismes du promoteur. Par conséquent, en utilisant notre modèle d’essais rapporteurs précédemment validé dans des cellules monocytaires humaines, le troisième objectif de ma thèse était de comparer l'activité transcriptionnelle des variants du promoteur ALOX5 distincts en présence ou en l'absence d'une supplémentation en PUFA dans les cellules Mono Mac 6.
En conclusion, nous avons cherché à mieux comprendre les mécanismes impliqués dans la régulation transcriptionnelle de l'expression de la 5-LO et dans la réponse
des neutrophiles aux métabolites du LTB4. Nos données contribuent à la
compréhension du rôle crucial de la 5-LO et de ses produits sur la défense de l'hôte et les maladies.
Abstract
Inflammation is an important process where the immune system responds to an irritant. Specifically, inflammation helps defend the human body against pathogens. Chronic and uncontrolled inflammation, however, can lead to pathologies such as atherosclerosis, asthma, and cancer. The 5-lipoxygenase enzyme (5-LO), which is encoded by the ALOX5 gene, is mostly expressed by leukocytes and plays a central role in the immune reaction. It is the first committed enzyme for the biosynthesis of leukotrienes from arachidonic acid. The biological activity of leukotrienes is diverse,
but mainly LTB4 induces phagocyte chemotaxis and the release of anti-microbial
effectors, whereas the cysteinyl leukotrienes (LTC4, LTD4 and LTE4) increase
bronchoconstriction and vascular permeability. This thesis focuses 1) on the
biological effects of LTB4 metabolites on neutrophil functions and 2) on the
mechanisms by which 5-lipoxygenase expression is regulated in monocytes in the context of host defense and disease.
Specifically, LTB4 is rapidly degraded into 20-OH- and 20-COOH-LTB4 by human
neutrophils. Although these metabolites bind to the BLT1 receptor with high affinity,
they are generally considered inactive because they are considerably less capable
of activating leukocytes in comparison to LTB4. Therefore, the first objective of this
thesis was to evaluate the biological effects of the LTB4 metabolites, OH- and
20-COOH-LTB4, on human neutrophil functions like migration, leukotriene biosynthesis,
and production of antimicrobial effectors. Furthermore, previous studies found that
the differentiation of myeloid cells with 1,25-dihydroxyvitamin D3 and TGF-β is
associated with a strong increase in 5-LO expression. Since the endotoxin lipopolysaccharide (LPS) also induced cell maturation resulting increased CD14 expression, we hypothesized that LPS may modulate 5-LO expression in monocytic cell lines. In consequence, our second objective was to investigate the impact of LPS on 5-LO expression and LT biosynthesis. Importantly, this study was the first to report an agonist-dependent induction of ALOX5 promoter transactivation. Lastly, an association between dietary intake of polyunsaturated fatty acids (PUFA) and
increased risk of cardiovascular diseases. Unfortunately, prior studies using reporter gene assays opted for both non-humans or 5-LO-negative cell models to study the transcriptional regulation of 5-LO expression in relations to the promoter polymorphisms. Therefore, by using our previously validated gene reporter model in human monocytic cells, the third objective of my thesis was to compare the reporter construct activity of distinct ALOX5 promoter variants in the presence or absence of PUFA supplementation in Mono Mac 6 cells.
In conclusion, we sought to better understand the mechanisms involved in the
transcriptional regulation of 5-LO expression and in the neutrophil response to LTB4
metabolites. Consequently, our data increases the comprehension of the crucial role of 5-LO and its products on host defense and diseases.
Table des matières
Résumé ... ii
Abstract ... iv
Table des matières ... vi
Liste des figures ... viii
Liste des tableaux ... x
Liste des abréviations ... xi
Dédicace. ... xiv
Remerciements ... xv
Avant-propos ... xvii
Publication en tant que co-premier auteur faisant partie intégrante de cette thèse. ... xvii
Manuscrits en tant que premier auteur faisant partie intégrante de cette thèse. ... xvii
Autres publications en tant qu’auteur ne faisant pas partie de cette thèse. ... xviii
INTRODUCTION ... 1
1.1 Les acides gras polyinsaturés ... 1
1.1.1 Description ... 1
1.1.2 Libération des PUFA ... 3
1.1.3 Eicosanoïdes ... 5
1.2. Leucotriènes ... 6
1.2.1 Biosynthèse ... 6
1.2.2 Récepteurs des leucotriènes ... 8
1.2.2.1 Récepteurs BLT ... 9
1.2.2.2 Récepteurs des cysLT ... 11
1.2.3 Les leucotriènes et les maladies inflammatoires ... 12
1.2.3.1 L’asthme ... 12
1.2.3.2 Maladies cardiovasculaires ... 14
1.3 Specialized pro-resolving lipid mediators ... 15
1.3.1 Lipoxines ... 16
1.3.2 Resolvines ... 17
1.3.3 Protectines ... 17
1.3.4 Maresines ... 18
1.4 5-Lipoxygénase ... 18
1.4.1 Régulation de l’expression du gène ALOX5 ... 19
1.4.1.1 Méthylation du promoteur ... 19
1.4.1.2 Noyau du promoteur ... 20
1.4.1.3 Polymorphismes du promoteur ... 20
1.4.1.4 Cytokines et facteurs de croissances ... 23
1.4.2 Régulation de l’activité de la 5-LO ... 23
1.4.2.1 Domaine N-terminal et C-terminal ... 23
1.4.2.2 Isoformes de la 5-LO ... 24
1.4.2.3 État redox ... 24
1.4.2.6 Phosphorylation ... 25
1.4.2.7 Translocation et localisation cellulaire ... 26
1.4.2.8 Five lipoxygenase activating protein ... 27
1.4.2.9 Coactosin-like protein ... 27
1.5 Sommaire ... 28
CHAPITRE II : Problématique et objectifs de recherche ... 29
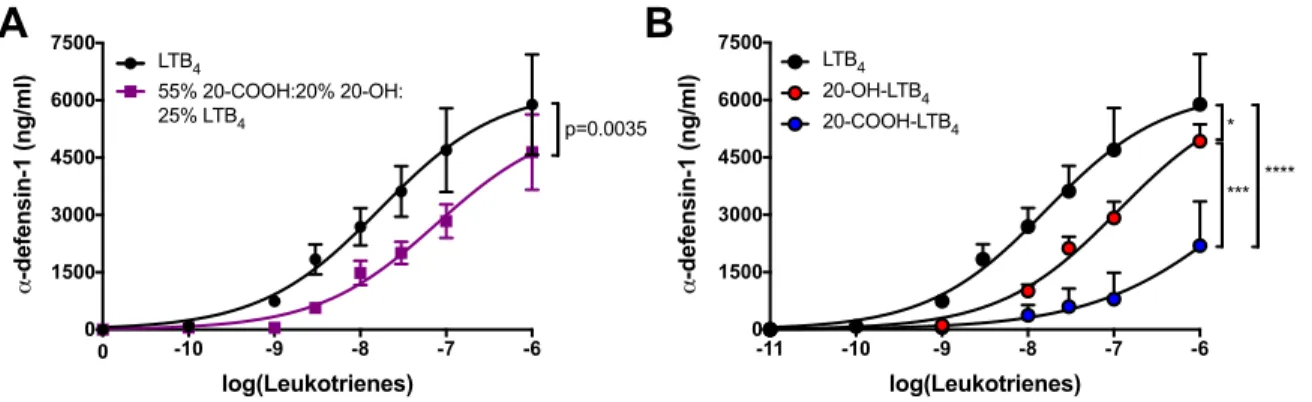
CHAPITRE III: 20-hydroxy- and 20-carboxy-leukotriene (LT) B4 downregulate LTB4-mediated responses of human neutrophils and eosinophils. ... 31
3.1 Résumé ... 32
3.2 Abstract ... 33
3.3 Introduction ... 34
3.4 Materials and Methods ... 35
3.5 Results ... 39
3.6 Discussion ... 43
3.7 Acknowledgements ... 48
3.8 Conflict of interest disclosure ... 49
3.9 References ... 50
3.10 Figures ... 57
CHAPITRE IV: LPS induces ALOX5 promoter activation and 5-lipoxygenase expression in human monocytic cell lines. ... 65
4.1 Résumé ... 66
4.2 Abstract ... 67
4.3 Introduction ... 68
4.4 Materials and Methods ... 69
4.5 Results ... 73
4.6 Discussion ... 77
4.7 References ... 81
4.8 Figures ... 87
CHAPITRE V: Reporter Gene Analysis of Human ALOX5 Promoter Polymorphisms in Monocytic Cells Enriched with Polyunsaturated Fatty Acids ... 94
5.1 Résumé ... 95
5.2 Abstract ... 96
5.3 Introduction ... 97
5.4 Materials and Methods ... 98
5.5 Results and Discussion ... 100
5.6 References ... 103
5.7 Figures ... 107
DISCUSSION ET CONCLUSION ... 111
6.1 Mise en contexte ... 111
6.2 Chapitre III : Effet du 20-OH-LTB4 et du 20-COOH-LTB4 sur les fonctions des granulocytes ... 112
6.3 Chapitre IV : Le LPS induit l’expression du gène ALOX5 et l’activité transcriptionnelle de son promoteur. ... 115
6.4 CHAPITRE V : L’activité transcriptionnelle des polymorphismes du promoteur ALOX5 ... 118
6.5 En conclusion ... 120
Liste des figures
Figure 1.1 : La voie métabolique de la biosynthèse des acides
gras polyinsaturés ... 3 Figure 1.2 : La structure chimique de l’acide arachidonique, de
l’acide eicosapentaénoïque et de l’acide docosahexaénoïque. ... 4 Figure 1.3 : La biosynthèse des leucotriènes ... 7 Figure 1.4 : La biosynthèse des SPMs et leurs structures (Tirée
de Rius et al. 2012) ... 16 Figure 3.1 : Impact of LTB4 metabolites on leukotriene
biosynthesis by human neutrophils. ... 57 Figure 3.2 : Impact of LTB4 metabolites on the migration of
neutrophils and eosinophils ... 58 Figure 3.3 : Impact of w-oxidation on the chemotactic vs.
chemokinetic effect of LTB4 on neutrophils and eosinophils. ... 60
Figure 3.4 : Analysis of superoxide anion release by neutrophils
in the presence of different lipid mediators ... 62 Figure 3.5: Impact of LTB4 metabolites on a-defensin-1 release
by neutrophils ... 63 Figure 3.6 : Impact of LTB4 metabolites on BLT1 cell surface
expression in human neutrophils ... 64 Figure 4.1 : CD14 cell surface expression in monocytic cells
treated with LPS or TGF-β ... 87 Figure 4.2 : Biosynthesis of 5-LO products by MM1 and THP-1
cells treated with LPS and TGF-β ... 88 Figure 4.3 : Combined action of LPS and TGF-β treatment on
5-LO expression in MM1 and THP-1 cells ... 89 Figure 4.4 : 5-LO promoter transactivation in MM1 and THP-1
cells ... 91 Figure 4.5 : Transactivation of the 5-LO promoter with or
without putative NFkB site in MM1 cells ... 92 Figure 4.6 : Treatment with LPS and TGF-β has no effect on
LTA4 metabolism ... 93
Figure 5.1 : Polymorphisms in the ALOX5 core promoter region
of the pGL4.17 reporter constructs ... 107 Figure 5.2 : Transactivation of the different human ALOX5
Figure 5.4 : Effects of AA and EPA on human ALOX5 promoter
Liste des tableaux
Tableau 1.1 : Expression des récepteurs de leucotriène par
Liste des abréviations
12-LO 12-lipoxygénase
15-LO 15-lipoxygénase
20-OH-LTB4 20-hydroxy-leucotriène B4
20-COOH-LTB4 20-carboxy-leucotriène B4
5-HETE Acide
5(S)-hydroxy-6-trans-8,11,14-cis-eicosatetraénoïque
5-HpETE Acide
5(S)-hydroperoxy-6-trans-8,11,14-cis-eicosatetraénoïque
5-KETE 5-oxo-ETE
5-LO 5-lipoxygénase
AA Acide arachidonique/arachidonic acid
AdC 5-aza-2’-deoxycytidine
AIA Aspirin-induced-asthma
AINS Anti-inflammatoires non stéroïdiens
ALA Acide linolénique
ALX/FPR2 Lipoxin A4 receptor/formyl peptide receptor 2
AMPc Adénosine-monophosphate cyclique
BAL Lavages broncho-alvéolaire
CIMT Épaisseur de l’intima-média de l’artère carotide
CLP Coactosin-like protein
COX-2 Cyclooxygénase-2
cPLA2α Phosholipase A2 cytosolique du groupe IVA
cysLT Cytéinyl-leucotriène
DHA Acide docosahexaénoïque
DMSO Dimethyl sulfoxide
EPA Acide eicosapentaénoïque/eicosapentaenoic acid
ERK Extracellular signal-regulated kinase
FAME Fatty acid methyl esters
FAS Fatty acid synthase
FLAP Five-Lipoxygenase activating protein
GC-FID Gas chromatography with flame ionization detection
GGT γ-glutamyl transpeptidase
GM-CSF Granulocyte/macrophage colony-stimulating factor
GPCR Récepteur couplé aux protéines G/G-protein coupled
receptors
GPL Glycérophospholipide
GPR/32 G protein-coupled receptor 32
LA Acide linoléique
LDLR Low density lipoprotein receptor
LPS Lipopolysaccharide
LT Leucotriène
LTA4 Acide
5(S)-trans-5,6-oxido-7,9-trans-11,14-cis-eicosatetraenoic (Leucotriène A4)
LTA4-H LTA4-hydrolase
LTB4 Acide 5(S)-12(R)-dihydroxy-6,8,10,14-eicosatetraenoïque (leucotriène B4) LTC4 Acide 5(S)-hydroxy-6(R)-S-glutathyionyl-7E,9E,11Z,14Z-eicosatetraénoïque (Leucotriène C4) LTC4-S LTC4-synthase LTD4 Leucotriène D4 LTE4 Leucotriène E4 LXA4 Lipoxin A4 LXB4 Lipoxin B4
MAPEG Membrane-associated proteins in
eicosanoids-and-glutathione metabolism
MAPK Mitogen-activated protein kinase
MaR Maresines
MBD Membrane-bound dipeptidase
MeOH Methanol
MI Infarctus du myocarde/myocardial infarction
MK2/3 MAPK-regulated mitogen-activated protein
kinase-activated protein kinases 2/3
MM1 Mono Mac 1 MM6 Mono Mac 6 n-3 Oméga-3 n-6 Oméga-6 NPD1 Neuroprotectine D1 pb Paires de base PC Phosphatidylcholine PD1 Protectine D1 PGE2 Prostaglandine E2
PKA Protéine kinase A
PLA2 Phospholipase A2
PLAT Polycystin-1, Lipoxygénase, α-Toxin
PUFA Acide gras polyinsaturé
RvE1 E-series Resolvin
SCD-1 Stearoyl-CoA desaturase-1
SMC Cellules de muscles lisses
SNP Single nucleotide polymorphisms
SPM Specialized pro-resolving mediators
SRS-A Slow reacting substance of anaphylaxis
TGF-β transforming growth factor-β
TRP Tryptophane
TSA Trichostatin A
VD3 1,25-dihydroxyvitamine D3
À ma conjointe Mylène, mes fils Dax et Félix, ainsi qu’à ma chienne Mika qui fait partie intégrante de notre famille.
Remerciements
“Sometimes life is going to hit you in the head with a brick. Don’t
lose faith” – Steve Jobs
J’ai vécu pendant mes études graduées les moments les plus difficiles de ma vie, mais aussi les plus beaux. Jamais je n’aurais pu persévérer sans le soutien des personnes qui me sont chères. Merci à tous ceux avec qui j’ai partagé cette aventure. Je ne vous serai jamais assez reconnaissant pour vos encouragements et votre support.
D’abord, je tiens à remercier les membres du jury, l’examinatrice externe Dre Jana Stankova ainsi que les examinateurs internes Dr Sylvain Bourgoin et Dr Marc Pouliot pour le temps que vous avez consacré à l’évaluation de ma thèse.
Particulièrement à mes mentors, mon superviseur Dr Nicolas Flamand et mon co-superviseur Dr Marc. E. Surette, je vous remercie infiniment pour vos précieux conseils, votre disponibilité et votre appui tout au long de ces années. C’est à l’aide de votre soutient et de votre passion infectieuse que j’ai fait preuve de persévérance dans mon parcours doctoral. La réalisation de cette thèse est grâce à vous.
Je désire remercier tous les membres du laboratoire du Dr Surette et du Dr Flamand que j’ai croisés durant ce long cheminement. Je suis fier d’avoir pu travailler avec une équipe pleine de personnes ambitieuses qui ont contribué énormément à l’élaboration de mes travaux de recherche. Merci pour le soutien et l’amitié.
Mes parents, Colin et Monique, vous avez toujours appuyé et accepté mes choix dans la vie. Je suis devenu la personne que vous voyez aujourd’hui à cause de l’amour que vous m’avez accordé. Merci.
Enfin, à ma conjointe Mylène, tu as toujours été présente durant les hauts et les bas. Merci pour ta patience, mais aussi ta confiance en moi. Je ne suis pas sûr que j’aurais pu persister autant sans ton encouragement continu. Je te serai éternellement reconnaissant pour la naissance de mon petit cœur et de ma source
de motivation, Dax. Également pour notre futur fils qui naîtra prochainement. Puis, je veux autant remercier Mika, ma confidente silencieuse, qui est membre intégral de notre famille et qui m’apporte le réconfort et le bonheur au quotidien.
Avant-propos
Publication en tant que co-premier auteur faisant partie intégrante
de cette thèse.
Chapitre III: 20-Hydroxy- and 20-carboxy-leukotriene (LT) B4 downregulate
LTB4-mediated responses of human neutrophils and eosinophils.
Anne-Sophie Archambault*, Samuel Poirier*, Julie-S Lefebvre, Philippe-Pierre Robichaud, Marie-Chantal Larose, Caroline Turcotte, Cyril Martin, Véronique Provost, Luc H. Boudreau, Patrick P. McDonald, Michel Laviolette, Marc E. Surette, Nicolas Flamand.
J Leukoc Biol. 2019. Epub. doi : 10.1002/JLB.MA0718-306R. PMID : 30676680. *
Co-premier auteurs
Manuscrits en tant que premier auteur faisant partie intégrante de
cette thèse.
Chapitre IV: LPS induces ALOX5 promoter activation and 5-lipoxygenase expression in human monocytic cell lines.
Samuel J. Poirier, Luc H. Boudreau, Nicolas Flamand, Marc E. Surette. Soumis prochainement au Journal of Leukocyte Biology.
Chapitre V: Reporter gene analysis of human ALOX5 promoter polymorphisms in monocytic cells enriched with polyunsaturated fatty acids.
Samuel J. Poirier, Nicolas Flamand, Marc E. Surette.
Soumis prochainement dans Prostaglandins, Leukotrienes and Essential Fatty
Autres publications en tant qu’auteur ne faisant pas partie de
cette thèse.
Identification of peracetylated quercetin as a selective 12-lipoxygenase pathway inhibitor in human platelets. Marco S. Doucet, Jean-Luc Jougleux, Samuel J. Poirier, Marc Cormier, Jacob L. Léger, Marc E. Surette, Nicolas Pichaud, Mohamed Touaibia, Luc H. Boudreau. Mol Pharmacol. 2019;95(1):139-150. doi: 10.1124/mol.118.113480. PMID: 30404890.
5-lipoxygenase-dependent biosynthesis of novel 20:4 n-3 metabolites with anti-inflammatory activity. Kristine J. Gagnon, Natalie Lefort, Samuel J. Poirier, David A. Barnett, Marc E. Surette. Protaglandins Leukot Essent Fatty Acids. 2018:138:38-44. doi: 10.1016/j.plefa.2018.10.005. PMID: 30392579.
On the cellular metabolism of the click chemistry probe 19-alkyne arachidonic acid. Philippe-Pierre Robichaud, Samuel J. Poirier, Luc H. Boudreau, Jérémie A. Doiron, David A. Barnett, Éric Boilard, Marc E. Surette. J Lipid Res. 2016;57(10):1821-1830. doi: 10.1194/jlr.M067637. PMID: 37538823.
Clicked cinnamic/caffeic esters and amides as radical scavengers and 5-lipoxygenase inhibitors. Jérémie A. Doiron, Benoit Métayer, Ryan R. Richard, Dany Desjardins, Luc H. Boudreau, Natalie A. Levesque, Jacques Jean-François, Samuel J. Poirier, Marc E. Surette, Mohamed Touaibia. Int J Med Chem. 2014;2014:931756. doi: 10.1155/2014/931756. PMID: 25383225.
2-arachidonoyl-glycerol- and arachidonic acid-stimulated neutrophils release antimicrobial effectors against E. coli, S. aureus, HSV-1, and RSV. François Chouinard, Caroline Turcotte, Xiaochun Guan, Marie-Chantal Larose, Samuel Poirier, Line Bouchard, Véronique Provost, Louis Flamand, Nathalie Grandvaux, Nicolas Flamand. J Leukoc Biol. 2013;93(2):267-76. doi: 10.1189/jlb.0412200. PMID: 23242611.
INTRODUCTION
1.1 Les acides gras polyinsaturés
1.1.1 Description
Les acides gras occupent diverses fonctions dans un organisme cellulaire. Ils sont une source d’énergie importante, sont l’une des composantes structurales majeures de la bicouche lipidique membranaire, et sont des précurseurs de médiateurs inflammatoires. Bref, les acides gras sont essentiels à la vie.
Les acides gras sont composés d’une chaîne hydrocarbonée, d’un bout méthyle, et d’un groupement carboxyle terminal. On peut les classer selon leurs structures : soient saturés (absence d’une liaison double), monoinsaturés (une liaison double) ou polyinsaturés (plus que deux liaisons doubles). Les acides gras cellulaires proviennent de sources exogènes et de la synthèse de novo. Cette dernière entraîne la production de l’acide palmitique (16:0) à partir de précurseurs à 2 carbones (acétyl-CoA) et à 3 carbones (malonyl-CoA) par les enzymes fatty acid synthase (FAS) et l’acétyl-CoA-carboxylase [1]. Les monoinsaturées sont obtenus par la désaturation d’un acide gras saturée. Par exemple, l’enzyme stearoyl-CoA
desaturase-1 (SCD-1) catalyse l’introduction d’une double liaison au 9e carbone à
partir du carboxyle du 16:0 pour former le 16:1n-7.
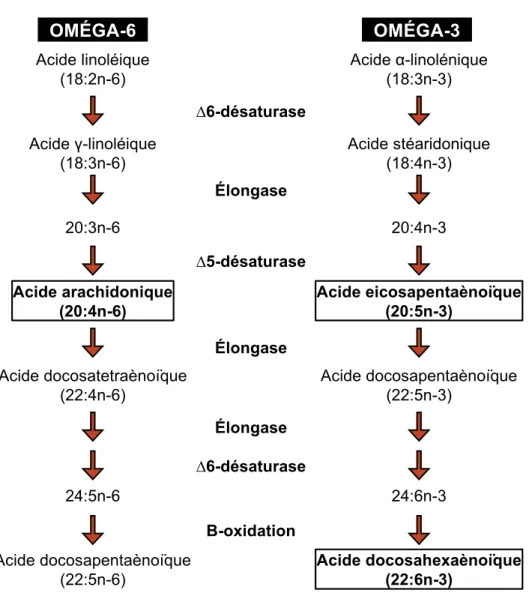
Malgré cette capacité de synthèse de novo, il est pourtant impossible aux organismes vertébrés de produire l’acide linoléique (18:2n-6; LA) et l’acide α-linolénique (18:3n-3; ALA). LA et ALA sont des précurseurs d’acides gras polyinsaturés (PUFA) de la famille des oméga-6 (n-6) et oméga-3 (n-3), respectivement (Figure 1.1). Ils sont dits essentiels, dû à la nécessité de les obtenir par notre alimentation. LA et ALA sont surtout retrouvés dans les huiles végétales comme l’huile de canola, l’huile de lin et l’huile de soja. La désaturation et l’élongation de ces acide gras mènent à la production de PUFA plus désaturés et à plus longues chaînes, tels que l’acide arachidonique (AA, 20:4n-6), l’acide eicosapentaénoïque (EPA, 20:5n-3) et l’acide docosahexaénoïque (DHA, 22:6n-3) (Figure 1.2). Cependant, la conversion des acides gras à 18 carbones en acides
gras à plus longues chaînes n’est pas efficace chez les populations qui se nourrissent principalement d’une diète occidentale (western) [2-4]. En conséquence, il est essentiel d’obtenir les acides gras n-6 et n-3 par la diète et l’équilibre entre les ces deux familles de PUFA est fondamentale pour maintenir la bonne santé chez les humains. Une diète favorisant les acides gras n-3 versus les n-6 est fondamentale pour maintenir la bonne santé [1,5]. Une alimentation qui implique un ratio n-6:n-3 élevé peut promouvoir des effets pro-inflammatoires, ce qui contribue à la prévalence de l’athérosclérose, l’arthrite rhumatoïde, et le cancer [6]. Cependant, le EPA et le DHA retrouvés dans une diète riche en poissons ou en d’huiles de poissons peuvent remplacer partiellement les PUFA n-6 incorporés dans les glycérophospholipides (GPL) des membranes cellulaires, notamment chez les monocytes, les neutrophiles, les plaquettes et les érythrocytes [7]. Donc ce changement de la composition de PUFA dans les GPL peut promouvoir la prévention et améliorer la gestion de maladies inflammatoires chroniques.
Les PUFA sont rarement en état libre dans la cellule. Comme mentionné précédemment, ils sont souvent incorporés comme composantes majeures des GPL membranaires [8,9]. Généralement en position sn-2 des GPL, les PUFA servent de source intracellulaire des précurseurs de molécules biologiquement actives. Ils sont libérés du GPL en réponse à un stimulus approprié et sont rapidement convertis en médiateurs lipidiques capables de réguler divers processus cellulaires.
Figure 1.1 : La voie métabolique de la biosynthèse des acides gras polyinsaturés. Cette thèse touche principalement les trois PUFA encadrés, soit l’acide
arachidonique (AA), l’acide eicosapentaènoïque (EPA) et l’acide
docosahexaènoïque (DHA).
1.1.2 Libération des PUFA
L’AA, le EPA et le DHA doivent se libérer de la position sn-2 des GPL pour devenir disponibles aux enzymes pouvant les convertir en médiateurs inflammatoires. Les
OMÉGA-6 OMÉGA-3 Acide linoléique (18:2n-6) Acide γ-linoléique (18:3n-6) 20:3n-6 Acide arachidonique (20:4n-6) Acide docosatetraènoïque (22:4n-6) 24:5n-6 Acide docosapentaènoïque (22:5n-6) Acide α-linolénique (18:3n-3) Acide stéaridonique (18:4n-3) 20:4n-3 Acide eicosapentaènoïque (20:5n-3) Acide docosapentaènoïque (22:5n-3) 24:6n-3 Acide docosahexaènoïque (22:6n-3) ∆6-désaturase ∆6-désaturase Β-oxidation Élongase Élongase Élongase ∆5-désaturase
PUFA sont libérés par une phospholipase, plus précisément la phospholipase A2
(PLA2). À présent, on connait plus de 30 enzymes capables de catalyser l’hydrolyse
des PUFA de la position sn-2 des GPL [10]. Parmi ceux-ci, la PLA2 cytosolique du
groupe IVA (cPLA2α) est reconnue comme l’isotype responsable de la libération de
l’AA pour la biosynthèse des médiateurs lipidiques de l’inflammation dans les cellules myéloïdes. Les macrophages péritonéaux isolés des souris knock-out pour
la cPLA2α perdent la capacité de produire les médiateurs inflammatoires dérivés de
l’AA [11,12].
Figure 1.2 : La structure chimique de l’acide arachidonique, de l’acide eicosapentaénoïque et de l’acide docosahexaénoïque.
Certaines cytokines et facteurs de croissance peuvent induire l’expression de la
cPLA2α, même si elle est exprimée de façon constitutive dans la plupart des tissus
[13]. La protéine a une masse de 85 kDa comptant 748 acides aminés [14]. Un domaine de 138 acides aminés dans le bout N-terminal comprend un domaine-C2
ayant une structure β-sandwich qui permet la liaison de deux ions de Ca2+ [15]. En
réponse à une hausse de [Ca2+] intracellulaire, la cPLA2α est activée et transloque
à la membrane nucléaire où elle catalyse l’hydrolyse de l’AA des GLP. Cette translocation est dépendante d’un domaine-C2 fonctionnel. Par contre, la translocation à la membrane nucléaire est indépendante du résidu Ser505 situé à proximité du domaine-C2, même si sa phosphorylation augmente l’activité de la
cPLA2α [16,17]. Ainsi, la libération de l’AA est fortement régulée puisque sa
disponibilité contrôle les quantités de métabolites de l’AA, ou eicosanoïdes, produites par les cellules myéloïdes.
1.1.3 Eicosanoïdes
Le terme eicosanoïde est composé du préfixe « eicosa » qui est dérivé du grec et signifie la notion de quantité vingt. Il définit collectivement l’oxygénation des PUFA à 20 carbones (AA et EPA). Les dérivés du DHA (22 carbones) sont désignés docosanoïdes, cependant certains les classent dans la famille des eicosanoïdes. Les eicosanoïdes sont des composés bioactifs puissants qui exercent diverses fonctions physiologiques et pathologiques [18,19]. Ils sont constitués de nombreuses familles de médiateurs lipidiques dérivés particulièrement des voies métaboliques des lipoxygénases (5-, 12-, et 15-lipoxygénase) et des cyclooxygénases (cyclooxygénase-1 et cyclooxygénase-2). Parmi ces composés on retrouve les leucotriènes, les lipoxines, les résolvines (série-E et série-D), les protectines, les marésines, les prostaglandines et les thromboxanes [20]. Les eicosanoïdes ont une demi-vie relativement courte (des secondes à des minutes) et par conséquence imposent leurs effets sur le tissu environnant de façon paracrine [21]. Le mode d’action des eicosanoïdes découle de leur liaison à un récepteur spécifique couplé aux protéines G (GPCR) qui initie soit une réponse inflammatoire ou de la résolution de l’inflammation.
1.2. Leucotriènes
Le terme leucotriène (LT) vient du préfixe “leuco” faisant référence aux leucocytes, les producteurs dominants, et du suffixe “triène” signifiant les 3 doubles liaisons conjuguées des structures. Les LT ont été découverts par le Dr Pierre Borgeat lors de ses études postdoctorales dans le laboratoire du Dr Bengt Samuelsson (lauréat du prix Nobel de physiologie ou médecine en 1982) lorsqu’ils ont observé la conversion de l’AA en acide 5(S)-hydroxy-6-trans-8,11,14-cis-eicosatetraénoïque (5-HETE) par les neutrophiles péritonéaux de lapin [22]. Par la suite, ils ont remarqué la formation de composés plus polaires, l’acide
5(S)-12(R)-dihydroxy-6,8,10,14-eicosatetraenoïque (LTB4) qui est de loin le plus abondant [23].
Également, Borgeat et Samuelsson ont identifié un intermédiaire instable, mais commun dans la voie de la synthèse des LT, soit l’acide
5(S)-trans-5,6-oxido-7,9-trans-11,14-cis-eicosatetraenoic (LTA4) [24]. Le LTA4 est le précurseur des deux
classes majeures de LT : le LTB4, l’un des agents chimiotactiques le plus puissant,
et les cystéinyl-leucotriènes (cysLT) LTC4, LTD4 et LTE4, des agents
spasmogéniques efficaces [25]. De même que la plupart des cellules non leucocytaires n’expriment pas suffisamment de 5-lipoxygénase (5-LO) pour la biosynthèse des LT, certaines cellules ont les enzymes en aval pouvant métaboliser
le LTA4 produit par les leucocytes via un processus nommé la biosynthèse
trans-cellulaire [26-30]. Quant à la 5-LO, l’enzyme est principalement retrouvée dans les monocytes/macrophages, les granulocytes, les mastocytes et les cellules dendritiques [31,32]. Puisque les LT sont liés à diverses maladies inflammatoires, inhiber leur production avec des anti-inflammatoires non stéroïdiens (AINS) ou bloquer la réponse aux récepteurs avec des antagonistes demeurent des stratégies thérapeutiques fondamentales.
1.2.1 Biosynthèse
Premièrement, la cPLA2α hydrolyse l’AA estérifié en position sn-2 des GPL
membranaires [33]. La réaction catalysée par la 5-LO est initiée par la perte d’un atome d’hydrogène et par conséquence la création d’un radical libre au carbone-7 de l’AA libre. Dû à sa grande instabilité, l’électron célibataire migre ensuite vers la
au carbone-5. L’oxydation du Fe2+ au Fe3+ du site catalytique de la 5-LO fournit un
électron et forme par conséquence un anion peroxyde qui est finalement protoné en hydroperoxide. Cette première réaction d’oxygénation mène la formation de l’acide 5(S)-hydroperoxy-6-trans-8,11,14-cis-eicosatetraénoïque (5-HpETE) (Figure 1.3). Étant un composé instable, le 5-HpETE est rapidement réduit en 5-HETE, sinon il subit une réaction de déshydratation toujours par la 5-LO. Cette dernière réaction chimique consiste de la perte de l’atome d’hydrogène du carbone-10 et la création d’un autre radical libre. Cette étape de déprotonation engendre le réarrangement des liaisons doubles et la formation d’un triène conjugué. Finalement, l’électron non apparié se combine avec le groupement hydroperoxyde pour former l’époxyde du
LTA4 (Figure 1.3).
Une fois relâché de la 5-LO, le LTA4 rencontre l’une des enzymes pouvant diriger la
synthèse vers l’une des deux classes de LT. L’enzyme LTA4-hydrolase (LTA4-H)
produit le LTB4 en catalysant l’hydratation stéréospécifique du carbone-12 du LTA4.
De plus, les neutrophiles peuvent au-delà métaboliser le LTB4 en 20-hydroxy-LTB4
(20-OH-LTB4) et ensuite en 20-carboxy-LTB4 (20-COOH-LTB4) [34]. L’oxydation du
méthyle terminal du LTB4 est effectué par un membre de la famille des P450, soit le
CYP4F3A [35-37]. Le CYP4F3A et son variant d’épissage alternatif, le CYP4F3B,
métabolisent le LTB4 avec un Km ayant des valeurs moyennes de 4.0 et de 105 µM
respectivement [38]. Ce dernier étant approximativement 26 fois plus élevé que le CYP4F3A.
L’interaction entre le LTA4 et la LTC4-synthase (LTC4-S) engendre la formation du
LTC4 (l’acide
5(S)-hydroxy-6(R)-S-glutathyionyl-7E,9E,11Z,14Z-eicosatetraénoïque). Ainsi, la LTC4-S favorise l’ouverture de l’époxyde du LTA4 par
l’anion thiol du glutathion et permet la conjugaison du pseudo-tripeptide avec le
carbone-6. Le LTC4 peut être ensuite converti en LTD4 et LTE4 par l’hydrolyse
séquentielle des acides aminés du glutathion (Figure 1.3). Initialement, l’hydrolyse peptidique procède par le clivage de la liaison peptidique glutamate par une
γ-glutamyl transpeptidase (GGT) [39,40]. Ensuite, la conversion du LTD4 en LTE4
implique l’hydrolyse de la liaison cystéine-glycine qui est catalysée par de nombreuses di-peptidases. Chez les neutrophiles humains, en plus des neutrophiles, lymphocytes et macrophages de rats, des études ont observé dans les fractions membranaires une activité di-peptidase que les auteurs ont associée à des
membrane-bound dipeptidases (MBD) [41,42].
1.2.2 Récepteurs des leucotriènes
Une fois synthétisés, les LT sont exportés par des mécanismes de transport actif dans le milieu extracellulaire et se lient à des récepteurs spécifiques localisés sur la membrane externe des cellules structurales et inflammatoires [43-46]. Même si
façon autocrine ou paracrine sur la même classe de récepteurs : des récepteurs couplés aux protéines-G à sept domaines transmembranaires (GPCR).
1.2.2.1 Récepteurs BLT
Deux GPCR ont été identifiés pour le LTB4 : le BLT1 et le BLT2 [45]. Le récepteur
BLT1 a une masse de 43 kDa et démontre une grande affinité pour le LTB4 avec un
Kd de 0.15 – 1.1 nM [47,48]. Certains analogues et produits dérivés des
lipoxygénases reconnaissent aussi le récepteur BLT1 avec une affinité dans l’ordre
suivante : 20-OH-LTB4 = 20-oxo-LTB4 > 12(R)-HETE > 20-COOH-LTB4 [49]. Alors
que la capacité du 20-OH-LTB4 de se lier au BLT1 (Ki = 0.54 nM) est comparable au
LTB4 [50]. Il est intéressant de noter que les resolvines sont aussi considérées des
ligands pour le récepteur BLT1 [51]. Le récepteur BLT1 est surtout exprimé par les
cellules inflammatoires telles que les neutrophiles, monocytes/macrophages, éosinophiles et lymphocytes (Tableau 1.1) [52,53], mais il aussi est faiblement
exprimé par des cellules endothéliales aux repos. Le BLT1 peut-être induit
davantage par le LPS, ainsi que le LTB4 lui-même. L’une des caractéristiques
physiologiques la plus importante du LTB4 est son effet chimiotactique sur les
leucocytes. Ainsi, les granulocytes BLT1-déficients ne peuvent migrer vers le LTB4
[54-56]. L’activation du BLT1 augmente également la perméabilité vasculaire [57-59]
qui suggère un rôle fondamental du BLT1 dans la réponse vasculaire inflammatoire
Tableau 1.1 : Expression des récepteurs de leucotriène par type cellulaire (Adapté de Peters-Golden et Hendersen 2007 [53])
Type Cellulaire BLT Expression du récepteur
1 BLT2 CysLT1 CysLT2 Neutrophile + + ± ± Monocyte/Macrophage + + + + Éosinophile + + + + Basophile + - + + Mastocyte + + + + Lymphocyte B ND + + ND Lymphocyte T CD4+ + + + ND Lymphocyte T CD8+ + + ND ND Cellule dendritique + + + ND
Un deuxième GPCR, désigné BLT2, détient un profile d’expression faible en ARNm
dans presque tous les tissus humains [48]. Le gène LTB4R2 est homologue à celui du LTB4R1 avec 45.2% et 44.6% de similarité chez l’humain et la souris,
respectivement [49]. Le LTB4 démontre une capacité de se fixer au le récepteur BLT2
avec des Kd de 23 nM dans les cellules HEK293 et de 0.17 nM dans les cellules
COS-7 exprimant le récepteur [48,50]. Malgré cette différence, il est généralement
considéré un récepteur à faible affinité pour le LTB4 puisque la concentration
nécessaire pour l’induction du chimiotactisme LTB4-dépendant est significativement
plus élevée comparativement à celle pour le BLT1 [48]. De plus, le BLT2 peut lier un
plus large spectre de ligands en comparaison à son homologue BLT1. Le potentiel
d’activation du récepteur BLT2 par les eicosanoïdes est classé selon l’ordre suivant :
LTB4 > 12-epi-LTB4 > 12(S)-HETE > 12(S)-HPETE > 12(R)-HETE > 20-OH-LTB4
[52,61]. Donc l’affinité du 20-OH-LTB4 au BLT2 est largement inférieure à celle du
LTB4 (Ki = 41 nM vs 2.3 nM respectivement) [50]. Récemment, des études avec des
agonistes du récepteur BLT2 ont démontré un potentiel thérapeutique pour la peau,
la cornée et les ulcères intestinaux [52]. Également, les souris BLT2-KO exhibent
une inflammation éosinophilique sévère des poumons dans un modèle allergique
1.2.2.2 Récepteurs des cysLT
Parmi les cinq récepteurs ayant une affinité pour les cysLT, les récepteurs CysLT1
et CysLT2 sont les mieux connus. En plus des leucocytes, on retrouve le CysLT1
dans une variété de tissus tels que la rate, les poumons, l’intestin grêle, le colon et
les muscles squelettiques [63-65]. Le LTD4 est le ligand le plus fort, suivi du LTC4 et
finalement le LTE4. Le récepteur CysLT1 joue un rôle fondamental dans la
bronchoconstriction, l’œdème et la sécrétion de mucus dans les voies respiratoires [49,63].
Le récepteur CysLT2 partage 37.3% des acides aminés du CysLT1 et il est
principalement exprimé dans le cœur, les leucocytes, la rate et le cerveau [46,66]. Il
reconnait identiquement le LTC4 et le LTD4. Des modèles murins qui sont déficients
et d’autres qui surexpriment le récepteur ont démontré que, contrairement au
CysLT1, le CysLT2 n’est pas impliqué dans la bronchoconstriction mais plutôt dans
la perméabilité vasculaire et dans la fibrose [67,68]. Alors la surexpression du récepteur est liée à la perméabilité de l’endothélium et à l’expression de gènes inflammatoires, ce qui augmente la sévérité du dommage causé par un infarctus du myocarde (MI) [69].
Plus récemment, les récepteurs P2Y12, GPR99 et GPR17, tous des membres de la
famille des récepteurs P2Y, ont été identifiés comme des récepteurs pour le LTE4
[70-72]. Un knockdown du récepteur P2Y12 dans les mastocytes humains atténue la
production de PGD2 et de MIP-1β dépendante du LTE4 [73]. Quant au GPR99, il
démontre une forte affinité pour le LTE4 (Kd = 2.5 nM) et l’absence du récepteur dans
les souris CysLT1/CysLT2 KO révèle un effet cardioprotecteur [72]. Contrairement
aux derniers, certaines études proposent que le GPR17 régule négativement
l’activation du récepteur CysLT1 à la membrane cellulaire par voie
d’hétérodimérisation [74]. Compte tenu des récentes découvertes, les rôles physiologiques de ces récepteurs P2Y nucléotidiques sont très peu connus.
1.2.3 Les leucotriènes et les maladies inflammatoires
La réponse inflammatoire aiguë protège l’organisme contre les infections et les dommages tissulaires. Lors de la phase d’initiation, des médiateurs inflammatoires tels que des cytokines et des LT permettent aux neutrophiles de s’infiltrer et aux monocytes/macrophages de s’accumuler pour éventuellement éliminer les microbes et les débris de tissus endommagés. Il est critique que cette phase d’initiation soit suivie par la phase de résolution qui activement contrôle la cessation de l’infiltration des neutrophiles, de l’activation et de l’accumulation des macrophages dans le but de revenir en état d’homéostasie. Sans cette phase terminale de la réponse inflammatoire, l’inflammation peut persister et mener à une condition chronique. Cette perte de contrôle de l’inflammation est associée avec des maladies telles que l’arthrite rhumatoïde, l’asthme, l’athérosclérose, et certains cancers [53,75-79]. Alors les prochaines sections porteront sur les rôles que les LT peuvent jouer dans l’asthme et l’athérosclérose.
1.2.3.1 L’asthme
Il est estimé que 300 millions de personnes à l’échelle mondiale souffrent d’asthme et ce nombre devrait augmenter à 400 millions en 2025 [80]. L’asthme est défini comme étant une maladie chronique et complexe des voies respiratoires qui implique des symptômes variables et récurrents comme l’obstruction du flux pulmonaire, l’hypersensibilité bronchique et l’inflammation sous-jacente [81]. Suite à l’inhalation d’un allergène ou d’un stimulus, la réaction inflammatoire est déclenchée et implique principalement l’infiltration des éosinophiles, mais aussi des neutrophiles pulmonaires, des lymphocytes T et des mastocytes [82]. Dès la découverte des « slow reacting substance of anaphylaxis (SRS-A) », les chercheurs ont rapidement considéré les SRS-A comme étant des médiateurs importants dans les réactions d’hypersensibilité, particulièrement la bronchoconstriction [83,84]. En 1979, on a finalement reconnu que les SRS-A appartenaient à la famille des LT
[24,85]. Le LTC4 et le LTD4 ont démontré ensuite des effets biologiques comparables
aux extraits impurs de SRS-A [86]. Ainsi, le groupe du Dr Bengt Samuelsson a
[87]. Ces résultats ont démontré l’impact pathophysiologique du LTC4 et du LTD4
sur l’asthme humain. Typiquement, les cysLT causent l’œdème [88], la migration des éosinophiles [89,90], l’induction de sécrétion par la muqueuse bronchique [91,92], ainsi que la stimulation du cycle cellulaire et de la prolifération des cellules de muscles lisses (SMC) [93,94].
Toutefois, l’implication des LT dans l’asthme n’est pas restreinte aux cysLT. Une
accumulation de LTB4 peut être mesurée dans les fluides obtenus de lavages
broncho-alvéolaire (BAL) de patients asthmatiques [95]. L’effet chimiotactique du
LTB4 pourrait potentiellement initier l’infiltration des granulocytes suite à une
sensibilisation à un allergène [96]. Plus récemment, une étude suggère que le LTB4
pourrait plutôt contribuer au développement de l’asthme par le recrutement de
lymphocytes T CD8+ [97]. Par contre, le rôle du LTB4 n’est pas encore bien établi.
En fait, le LTB4 semble jouer un rôle secondaire comparé au cysLT dans le
développement de l’asthme. D’ailleurs chez des sujets souffrant d’asthme atopique,
l’administration d’un antagoniste du récepteur BLT1, le LY293111, peut influencer le
recrutement par le LTB4 des neutrophiles dans les voies respiratoires [98]. Malgré
qu’il ait démontré un effet anti-inflammatoire, aucun bénéfice physiologique n’a pu être mesuré.
Clairement, les cysLT sont les seuls médiateurs lipidiques où leur inhibition est spécifiquement associée avec une amélioration des fonctions pulmonaires et des
symptômes asthmatiques [99,100]. Le CysLT1, qui reconnaît préférablement le
LTD4, est largement exprimé dans la muqueuse bronchique des sujets asthmatiques
[49]. D’autres part, le CysLT2 est retrouvé chez les leucocytes, les SMC et les
cellules endothéliales. Ceci suggère un rôle fondamental du CysLT2 dans le
remodelage tissulaire. C’est pourquoi les compagnies pharmaceutiques ont dépensé des grosses sommes d’argent sur le développement de drogues qui sont utilisées cliniquement et qui sont très efficaces contre l’asthme. Parmi ces drogues, on a les antagonistes des récepteurs CysLT comme le Montelukast (Singulair), le Zafirlukast (Accolate) et le Pranlukast (Onon). Les lukasts sont généralement bien tolérés, sauf ~40% des patients ne répondent pas aux traitements [25]. D’autres
part, le zileuton (Zyflo) est un inhibiteur de la 5-LO qui bloque la capacité de biosynthétiser les LTs. Malgré sa courte demi-vie et l’exigence d’administrer 4 doses élevées par jour, le zileuton est toujours commercialisé pour le traitement de l’asthme au États-Unis [25].
1.2.3.2 Maladies cardiovasculaires
Selon les données de 2012-2013 du Système canadien de surveillance des maladies chroniques de l’Agence de la santé publique du Canada, près de 2.4 millions de canadiennes et canadiens âgés de 20 ans ou plus (soit 1 adulte sur 12) vivent avec une maladie cardiovasculaire diagnostiquée, comme l’athérosclérose [101]. Ces maladies sont la deuxième cause de mortalité au Canada (environ 12 adultes qui décèdent par heure) et sont responsable de 31% des décès dans le monde [102].
L’athérosclérose est un processus qui se développe au cours de plusieurs années pouvant débuter à partir de l’enfance. Initialement, des lipides se déposent dans l’intima de la paroi des artères, déclenchent une réponse immunologique et entraînent le recrutement des cellules inflammatoires comme les monocytes, les mastocytes et les cellules dendritiques [103]. Une fois infiltrés dans l’intima, les monocytes maturent vers le phénotype de macrophages. Les macrophages phagocytent les lipides oxydés, menant à la formation des cellules spumeuses [104]. L’expression de la 5-LO dans les lésions athérosclérotiques corrèle positivement avec la localisation des cellules inflammatoires [105]. D’une part, la 5-LO est activée
par l’environnement inflammatoire et synthétise l’agent chimiotactique LTB4 qui agit
sur d’autres cellules myéloïdes via le récepteur BLT1 [106,107]. L’inflammation induit
également l’expression du BLT1 par les cellules endothéliales et les SMC [108].
Conséquemment, le LTB4 stimule la migration des SMC vers l’intima, un phénomène
important dans le développement de la maladie. En plus, l’athérosclérose rend le tissu vasculaire sensible aux cysLT. La contraction des artères coronaires
athérosclérotiques humains en réponse au LTC4 et LTD4 est indicatif de la propriété
nécrotiques dans l’intima contribue à l’hyperplasie et renforce la production des LT et amplifie le cycle inflammatoire qui mène à la déstabilisation de la plaque [105]. L’impact de la 5-LO et des LT dans l’athérosclérose a largement été étudié chez des modèles murins [105]. Les souris knockout pour récepteur de LDL (LDLR) représentent des bons modèles d’athérosclérose. Cependant une déficience en 5-LO peut réduire significativement le nombre de lésions athérosclérotiques dans le
modèle LDLR-/- [77,110]. Comme chez l’humain, le LTB
4 est aussi très important
dans la progression de la maladie dans les modèles athérosclérotiques murins. En
effet, le traitement des souris apoE-/- et LDLR-/- avec l’antagoniste du récepteur LTB
4 (CP-105,696) confère une résistance à la maladie [104]. Ces résultats dans les
modèles murins renforcent le rôle de la 5-LO et du LTB4 dans le développement de
l’athérosclérose.
1.3 Specialized pro-resolving lipid mediators
Les eicosanoïdes sont généralement vu comme des médiateurs lipidiques pro-inflammatoires. Toutefois, le résultat idéal suite à une inflammation aiguë est la résolution complète. Alors les avancées récentes en lipidomique ont mené à la découverte d’eicosanoïdes et de docosanoïdes uniques qui ont des fonctions anti-inflammatoires et pro-résolutions. Ces composés ont le défi de réduire de façon active les concentrations de médiateurs pro-inflammatoires dans le but de restaurer le bon fonctionnement du tissu affecté [111]. Cette prochaine section abordera les
specialized pro-resolving mediators (SPM), notamment les lipoxines, les résolvines,
Figure 1.4 : La biosynthèse des SPMs et leurs structures (Tirée de Rius et al. 2012 [112])
1.3.1 Lipoxines
La lipoxine A4 (LXA4) et la lipoxine B4 (LXB4) sont des dérivés de l’AA pouvant
exercer une puissante activité anti-inflammatoire. Initialement, elles ont été reconnues comme des inhibiteurs de l’infiltration des neutrophiles, ainsi que des
activateurs du recrutement de macrophages non-inflammatoires [113-116]. La LXA4
régule ces fonctions cellulaires par l’activation de récepteurs spécifiques, soit le
lipoxin A4 receptor/formyl peptide receptor 2 (ALX/FPR2) et le G protein-coupled
receptor 32 (GPR/32) [111,117]. Trois voies métaboliques de la LXA4 et de la LXB4
biosynthèse transcellulaire. Le deuxième mécanisme biosynthétique implique l’oxygénation séquentielle de l’AA par la 15-lipoxygénase (15-LO) et la 5-LO, suivie d’une hydrolyse enzymatique. Finalement, l’acétylation de la cyclooxygénase-2 (COX-2) change son activité et génère du 15(R)-HETE. L’intermédiaire 15(R)-HETE, qui maintient une configuration R, est rapidement converti par la 5-LO en
15-epi-LXA4 [119]. À cause du changement de chiralité, on différencie le 15-epi-LXA4 de
son énantiomère LXA4 avec le terme aspirin-triggered-lipoxin.
1.3.2 Resolvines
Les résolvines sont synthétisées à partir des PUFA n-3 EPA et DHA, ce qui les divisent en deux classes respectives : les E-series (RvE1, RvE2 et RvE3) et les
D-series (RvD1-RvD6) [117]. Les E-D-series sont produites par l’endothélium vasculaire
lorsque la COX-2 modifiée par l’aspirine transforme l’EPA en acide 18(R)-hydroperoxyeicosapentaénoïque et 18(S)-18(R)-hydroperoxyeicosapentaénoïque. Ces intermédiaires sont par la suite transformés en RvE1 et RvE2 par la 5-LO des neutrophiles [120]. Le récepteur ChemR23 reconnait spécifiquement la RvE1 et partiellement la RvE2 [121,122]. Les fonctions connues sont la régulation à la baisse des molécules d’adhésion des leucocytes et de l’activation des plaquettes [123,124]. Elles peuvent aussi induire l’apoptose des neutrophiles [125]. La RvE1 agit aussi
comme antagoniste du récepteur BLT1 et inhibe la mobilisation du Ca2+, l’activation
du NFκB et l’infiltration des neutrophiles [126].
Les RvD1-RvD6 sont synthétisées dans l’exsudat par les neutrophiles et les macrophages via la 15-LO et la 5-LO qui génèrent deux époxydes différents: le 7(S),8(S)-epoxy-17(S)-hydroxy-DHA et le 4(S),5(S)-epoxy-17(S)-hydroxy-DHA [111,127]. Comme les LXA, les RvD ciblent le GPR/32 et le ALX/FPR2, ainsi que le récepteur CB2 [120,128]. Les RvD protègent les organes des dommages liés aux reperfusions, en plus d’augmenter la défense anti-bactérienne [111].
1.3.3 Protectines
La protectine D1 (PD1), un dérivé du DHA, est produite enzymatiquement par les leucocytes à partir de l’intermédiaire acide 16(S),17(S)-époxy-protectine [129]. On
appelle la PD1 produite dans le système neuronal la neuroprotectine D1 (NPD1), indiquant son rôle protecteur dans la rétine, le cerveau et la douleur [130,131]. La modification de la COX-2 par l’aspirine est une autre voie alternative qui mène à la synthèse de PD1/NPD1 [129]. L’absence de compétition pour la liaison aux neutrophiles entre la PD1/NPD1 et la RvE1 ou la LXA4 suggère l’existence d’un récepteur spécifique au PD1/NPD1 [132]. La PD1/NPD1 réduit la transmigration des neutrophiles à travers l’endothélium et améliore l’efferocytose par les macrophages (processus physiologique caractérisé par la phagocytose des cellules apoptotiques) [133].
1.3.4 Maresines
Maresine est le diminutif de macrophage mediators in resolving inflammation. La biosynthèse des maresines (MaR1 et MaR2) est initiée sur l3 carbone-14 du DHA par la 12-LO de macrophages humains et le produit résultant, la
13(S),14(S)-époxy-maresine, peut directement réguler la biosynthèse du LTB4 par l’inhibition de la
LTA4-hydrolase [134]. La 13(S),14(S)-époxy-maresine subit ensuite une hydrolyse
enzymatique qui génère le métabolite MaR1 [135]. Dans la phase tardive de l’inflammation, MaR1 limite l’infiltration des PMN et, conforme aux autres SPM, augmente l’efferocytose des neutrophiles apoptotiques [127].
Un des objectifs de cette thèse sera de comparer la capacité des SPM et des
métabolites du LTB4 comme le 20-OH-LTB4 d’inhiber l’activation des neutrophiles
humains.
1.4 5-Lipoxygénase
Tel que déjà mentionné, la 5-LO joue un rôle fondamental dans la biosynthèse des médiateurs pro-inflammatoires, anti-inflammatoires et pro-résolution. Elle est principalement exprimée par les cellules d’origines myéloïdes, particulièrement les neutrophiles, les éosinophiles, les mastocytes, les monocytes/macrophages, les cellules dendritiques, les basophiles et les lymphocytes B [32]. Cependant, elle est absente dans les plaquettes, les lymphocytes T et les cellules endothéliales.
La 5-LO est codée par le gène ALOX5 qui est localisé sur le chromosome 10q11 humain et le chromosome 6E3 murin. Le gène humain mesure 82 kilobases (kb) et comprend 14 exons comptant entre 82 à 613 paires de base (pb) chacun, tandis que les 13 introns varient entre 200 pb jusqu’à plus de 26 kb [136]. La région présumée du promoteur ALOX5 n’a aucune boîte TATAA ou CCAAT et maintient huit séquences riches en GC (boîte GC) reconnues par le facteur de transcription Sp1 [137]. En outre, cinq boîtes GC sont en tandem et sont également reconnues par le facteur de transcription Egr-1. La région du promoteur ALOX5 ressemble à celles des gènes maisons, qui sont constitutivement exprimés dans les tissus. Par contre l’expression de la 5-LO se limite aux cellules myéloïdes.
La cristallisation de la 5-LO a été décrite pour la première fois en 2011 par le laboratoire de Marcia E. Newcomer [138]. Autrement, sa structure était basée sur celle de la 15-LO de lapin dû à l’homologie entre les deux lipoxygénases [139]. La 5-LO est une enzyme monomérique composée de 673 acides aminés avec une masse de 78 kDa [140]. Cependant, un complexe dimérique a aussi été rapporté [141]. La chaîne polypeptidique est divisée en deux domaines : un domaine régulateur N-terminal (résidus 1-120) [142] et un domaine catalytique C-terminal (résidus 121-673) [31]. Le domaine C-terminal retient un atome de fer non-hème qui
doit subir une oxydation de sa forme inactive (Fe2+) à sa forme active (Fe3+) [31].
D’autres part, le domaine N-terminal est formé d’un baril-β composé de deux brins de quatre feuillets β. Nous explorerons dans la section 1.4.2.1 le rôle des deux domaines dans la régulation de l’activité enzymatique.
1.4.1 Régulation de l’expression du gène ALOX5 1.4.1.1 Méthylation du promoteur
L’expression de plusieurs gènes riches en GC est régulée par la méthylation de l’ADN et il n’en va pas autrement pour la 5-LO [143]. Ainsi le traitement des lignées cellulaires U937 et HL-60TB avec l’agent déméthylant 5-aza-2’-deoxycytidine (AdC) a pu renverser l’inactivation du gène ALOX5 dans ces cellules [144]. Contrairement aux cellules HL-60 qui expriment la 5-LO, l’analyse de la région promotrice des U937 et HL-60TB a révélé une méthylation abondante des îlots CpG. En plus, il y avait
perte complète d’activité transcriptionnelle lorsque les auteurs ont induit la méthylation de la région promotrice d’ALOX5 dans les HL-60 à l’aide de la SssI méthylase. Donc, ces observations ont suggéré un mécanisme par lequel l’expression de la 5-LO peut être type cellulaire-dépendante.
1.4.1.2 Noyau du promoteur
Hoshiko et al. ont déterminé à l’aide d’un système d’essai rapporteur que la région de -5900 à +20 du gène ALOX5 (à partir du codon d’initiation de la traduction) détenait une activité transcriptionnelle [137]. Par contre, ils ont déduit que la région de -227 à +20 du promoteur présumée possédait une activité transcriptionnelle maximale dans les cellules HeLa transfectées. Cette région du noyau du promoteur contient les cinq boîtes GC (GGGCGG) en tandem étendues de la base -176 à -147 et qui sont reconnues par le facteur de transcription de doigt de zinc Sp1 [137]. Lorsque les boîtes GC sont en tandem, elles créent la séquence GCGGGGGCG qui est reconnue par le facteur de transcription Egr-1 [137,145]. Le noyau du promoteur est nécessaire pour l’expression basale de l’ARNm. En effet, l’expression de la 5-LO chez les cellules Mono Mac 6 (MM6) est grandement réduite lorsque les sites de reconnaissance du facteur de transcription Sp1 sont rendus inaccessibles par la mithramycine [146].
1.4.1.3 Polymorphismes du promoteur
Les polymorphismes consistent de la délétion d’une (4GC) ou de deux (3GC) boîtes GC, ou de l’addition d’une (6GC) boîte GC [147,148]. Des essais rapporteurs dans les cellules HeLa ont démontré que l’activité transcriptionnelle des formes mutantes était significativement diminuée comparativement aux cinq boîtes GC (type sauvage, WT) [147]. Cependant, une deuxième étude, cette fois dans la lignée cellulaire SL2 de la drosophile, a établi que l’activation du promoteur était proportionnelle au nombre de boîtes GC, ainsi qu’à l’expression des facteurs de transcription Sp1 et Egr-1 [148]. Il est à noter que ces mesures d’activité transcriptionnelle des différentes formes du promoteur n’ont jamais été évaluées dans des cellules qui expriment naturellement la 5-LO. L’évaluation de l’activité des
différentes formes du promoteur de la 5-LO dans les leucocytes humains est un des buts de cette thèse.
Une différente approche a tenté d’évaluer l’effet des différents polymorphismes du promoteur ALOX5 sur l’expression de la 5-LO et de la biosynthèse des LT [149]. À l’aide de single nucleotide polymorphisms (SNP) localisé respectivement dans l’exon 1 (C21T) et l’exon 2 (G270A) des mutants 3GC et 4GC, ils ont calculé que le ratio d’ARNm des hétérozygotes 4GC/5GC était de 1.7. Cela indique que l’allèle comprenant le génotype 4GC est presque deux fois plus exprimé que l’allèle WT. Également, le ratio pour le 3GC/5GC était de 2.5, suggérant alors que les variants 3GC et 4GC ont une plus grande activité transcriptionnelle que le génotype WT. Une tendance comparable a été observée chez les lymphocytes où l’expression de l’ARNm de la 5-LO du groupe homozygote pour le 3GC et 4GC était plus élevée que le groupe homozygote 5GC [150]. D’autre part, les différents polymorphismes n’avaient pas d’effet sur l’expression protéique de la 5-LO dans les monocytes,
quoique la biosynthèse de certains produits (5-HETE, 6-trans-LTB4, 5-oxo-ETE,
5,15-diHETE) était plus élevée dans les sujets homozygotes pour les cinq boîtes GC [151].
Tel que mentionné précédemment, les leucotriènes sont associés avec certaines maladies comme l’asthme et l’athérosclérose (voir section 1.2.3). Plusieurs études ont tenté d’évaluer le rôle des polymorphismes du promoteur ALOX5 dans les maladies inflammatoires. Des études cliniques avec le ABT-761, un inhibiteur de la 5-LO, ont exposé un effet pharmacogénétique entre les polymorphismes et la réponse des patients au traitement [152]. Effectivement, le ABT-761 n’a pu apporter une amélioration chez les patients homozygotes 5GC. Les auteurs ont postulé qu’une réduction de l’expression de la 5-LO serait liée aux mutations du promoteur.
Cette hypothèse est en accord avec la réduction d’ARNm de la 5-LO et de LTC4
dans les éosinophiles isolés de sujets asthmatiques homozygotes pour les allèles variants [153]. De même, le score clinique s’améliore suite au traitement avec
l’antagoniste du récepteur CysLT1 (montelukast) chez les sujets ayant un allèle WT
pharmacogénétique ne se concrétise pas dans une deuxième étude avec le montelukast [155].
De plus, les boîtes GC sont associées avec la sévérité de l’hyperréactivité des voies respiratoires chez les patients d’AIA (aspirin-induced-asthma) [156]. Il est connu qu’une surproduction de leucotriènes est importante dans le développement du AIA [157]. Cependant, la fréquence des différents polymorphismes n’est pas considérée comme un facteur de risque important dans le développement de l’asthme [156,158]. Contrairement à l’asthme, il existe une forte corrélation entre les polymorphismes du promoteur ALOX5 et l’épaisseur de l’intima-média de l’artère carotide (CIMT) [79]. Le CIMT est un bon marqueur du facteur de risque de maladie coronarienne [159-161]. Le CIMT de 470 participants en santé démontre que les porteurs de deux allèles variants ont une mesure de CIMT plus épais que les porteurs d’au moins un allèle commun [79]. Cette différence était cliniquement significative. La différence entre les groupes (62±17 μm) est autant importante que celle entre les diabétiques et les non-diabétiques (64±26 μm) et même plus considérable que les différences associées aux fumeurs (45±11 µm).
Aussi, l’étude a révélé l’existence d’une interaction nutrigénétique entre les différents génotypes du promoteur ALOX5, le CIMT et la consommation des PUFA n-3 et n-6 [79]. La nutrigénétique est définie comme l’effet de la variation génétique sur l’interaction entre la diète et la maladie [162]. À cet égard, Dwyer et al. démontrent qu’une consommation importante de PUFA n-6 par les porteurs d’allèles mutés est associée à un CIMT plus épais. Tandis que les PUFA n-3 effacent cette prédisposition génétique. D’autre part, certaines études ont tenté de lier les différents génotypes du promoteur avec le MI. Le MI est un phénotype plus pertinent que l’athérosclérose puisqu’il est lié au stade avancé de la maladie et à la rupture de la plaque. Cependant, même si l’apport en AA augmente le facteur de risque pour les porteurs d’allèles différents [149], l’incidence de MI n’est pas associée aux différents génotypes du promoteur ALOX5 [163,164].
1.4.1.4 Cytokines et facteurs de croissances
L’expression de la 5-LO est plus élevée dans les cellules myéloïdes différenciées par rapport aux cellules non-différenciées [31]. Certains facteurs de différentiation augmentent l’expression de l’ARNm de la 5-LO comme le dimethyl sulfoxide
(DMSO), le 1,25-dihydroxyvitamine D3 (VD3), le transforming growth factor-β
(TGF-β) et le granulocyte/macrophage colony-stimulating factor (GM-CSF). D’ailleurs, le GM-CSF seul induit l’expression de l’ARNm et de la protéine de la 5-LO chez les neutrophiles [165,166]. Par contre que le TGF-β stimule très peu l’expression du
gène, sauf s’il est combiné avec le DMSO, la VD3 ou l’acide rétinoïque [167].
Également, la 5-LO qui est absente dans les cellules MM6 non-différenciées [168], est néanmoins induite par la différenciation cellulaire suite au traitement
combinatoire du TGF-β et de la VD3 [169]. En effet, la régulation positive de l’ARNm
dans les cellules différenciées est principalement due à l’élongation et à la maturation du transcrit qui est justifiée par l’interaction entre la cascade de signalisation TGF-β/SMAD et des éléments régulateurs retrouvés dans la région distale du gène ALOX5 [170-172]. À date, aucun agoniste pouvant induire l’activation du promoteur de la 5-LO dans les cellules humaines n’a été rapporté. 1.4.2 Régulation de l’activité de la 5-LO
1.4.2.1 Domaine N-terminal et C-terminal
Le domaine N-terminal de la 5-LO consiste d’un baril β composé de deux brins
anti-parallèle de quatre feuillets β. La structure ressemble au domaine C2 de la cPLA2,
mais l’arrangement des feuillets β est plutôt caractéristique de la famille PLAT (Polycystin-1, Lipoxygénase, α-Toxin) [173]. Donc, on la considère « C2-Like » [174]. Le domaine « C2-Like » contient des résidus en boucles pouvant liés plusieurs
ligands, typiquement lesphospholipides membranaires, le Ca2+ et la coactosin-like
protein (CLP) [175].
Le domaine C-terminal (résidus 121-673) comprend environ 80% de la masse totale de la 5-LO. Au site catalytique, on retrouve un atome de fer non-hème supporté par des liaisons covalentes avec les acides aminés His367, His372, His550, et avec la chaine carboxylique du résidu Ile673 du bout C-terminal [138]. On retrouve aussi


![Tableau 1.1 : Expression des récepteurs de leucotriène par type cellulaire (Adapté de Peters-Golden et Hendersen 2007 [53])](https://thumb-eu.123doks.com/thumbv2/123doknet/3259644.93466/29.918.129.794.188.453/tableau-expression-récepteurs-leucotriène-cellulaire-adapté-peters-hendersen.webp)
![Figure 1.4 : La biosynthèse des SPMs et leurs structures (Tirée de Rius et al. 2012 [112])](https://thumb-eu.123doks.com/thumbv2/123doknet/3259644.93466/35.918.141.775.119.594/figure-biosynthèse-spms-structures-tirée-rius-al.webp)