HAL Id: hal-01486357
https://hal.archives-ouvertes.fr/hal-01486357
Submitted on 7 Jun 2020
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
pour les méthodes chimiques de diagnostic des risques
liés à la phytodisponibilité des éléments en traces dans
les sols. Etude de faisabilité
T. Sterckeman, J. Fismes
To cite this version:
T. Sterckeman, J. Fismes. Programme PHYTOREF. Etablissement d’un référentiel pour les méthodes chimiques de diagnostic des risques liés à la phytodisponibilité des éléments en traces dans les sols. Etude de faisabilité. [Rapport de recherche] Ademe–0375C0116, auto-saisine. 2005, 89 p. �hal-01486357�
Laboratoire Sols et Environnement ENSAIA – INPL / INRA
2, avenue de la Forêt de Haye – BP 172 54505 Vandoeuvre-Lès-Nancy cedex Tél. 03 83 59 58 65
Programme PHYTOREF
Etablissement d’un référentiel pour les méthodes chimiques
de diagnostic des risques liés à la phytodisponibilité
des éléments en traces dans les sols
ETUDE DE FAISABILITE
(Establishing a reference system for chemical methods used to assess risks due to
phyto-availability of trace elements in soils – Feasability study)
Thibault STERCKEMAN, Joëlle FISMES Janvier 2005
Convention Ademe n° 03 75 C0116 Date de la convention : 04/12/2003 Durée de la convention : 13 mois
Responsables Ademe : Antonio BISPO, Isabelle DEPORTES ; Département Gestion Biologique et Sols Confidentialité : Non
REMERCIEMENTS
Nous remercions Satish K. Gupta, de la Station fédérale de recherches en agroécologie et agriculture (Agroscope FAL Reckenholz) à Zürich pour les nombreux documents qu’il nous a fait parvenir et l’excellent accueil qu’il nous a réservé. Nous remercions également Andreas Prüess, de l’UMEG à Karlsruhe, et Joern Breuer, de Université Hohenheim à Stuttgart, pour la documentation qu’ils nous ont procurée. Nous exprimons notre gratitude à André Desaules, responsable de l’observatoire national des sols en Suisse (NABO), pour les informations qu’il a bien voulu nous communiquer.
RESUME
Nous avons réalisé une étude sur la faisabilité de la construction d’un référentiel d’interprétation de méthodes chimiques d’évaluation de la phytodisponibilité des métaux toxiques du sol.
L’étude s’est basée sur les résultats de travaux scientifiques et sur une analyse des expériences étrangères existant dans ce domaine (suisse et allemande).
L’examen de la littérature scientifique indique que les solutions de sel non tamponnées, du type CaCl2 à 0,01 mol L-1 ou NH4NO3 à 1 mol L-1, permettent de prévoir avec une précision acceptable, la phytodisponibilité d’éléments en traces cationiques, tels que Cd, Ni, Pb ou Zn. Il suggère également que la technique du DGT (Diffusion Gradient Thin film), relativement récente, permettrait une prévision encore meilleure du passage de ces cations métalliques dans les végétaux.
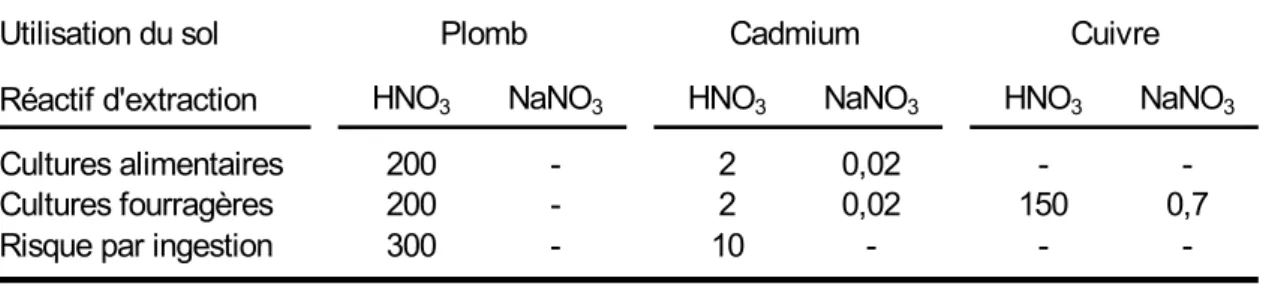
Les réglementations helvétique et allemande de protection des sols incluent des valeurs de seuils pour des teneurs obtenues à partir de solutions salines, à savoir NaNO3 à 0,1 mol L-1 en Suisse et NH4NO3 à 1 mol L-1 en Allemagne. Ces seuils visent essentiellement à protéger les cultures des baisses de production et les animaux d’élevage et l’Homme de l’intoxication. La voie de transfert des éléments commune aux expositions prises en compte par ces seuils est donc : sol → solution du sol → plante. L’exposition directe des cibles citées n’est pas prise en compte par ces méthodes. En Suisse, les seuils ont été fixés selon une méthodologie rigoureuse mais leur mise en œuvre pose des problèmes. En effet, les concentrations extraites par le nitrate de sodium sont souvent proches des limites de quantification et de ce fait peu reproductibles. Les teneurs obtenues par CaCl2 à 0,01 mol L-1 et NH4NO3 à 1 mol L-1 ont l’avantage d’être significativement plus élevées, de sorte que les méthodes peuvent être appliquées en sol peu contaminé.
Pour diagnostiquer le risque entraîné par un élément polluant, trois seuils de teneurs pourraient être envisagés : Le premier, le seuil d’alerte, correspondrait à la ligne de base, c’est dire à la limite supérieure du fond pédo-anthropique. Ce seuil serait fixé pour la teneur totale de l’élément dans le sol. Quand il est dépassé, il y a présomption de contamination et nécessité d’appliquer un test de phytodisponibilité si le sol est utilisé pour la production végétale. Si le premier seuil de phytodisponibilité, ou seuil d’investigation, est dépassé, il convient de mener des études sur le transfert des métaux aux plantes et les risques qui y sont associés, la conséquence pouvant être une modification des usages du sol. Le troisième, le seuil d’assainissement, est celui qui, s’il est dépassé, indique que l’usage du sol doit être retiré à la production végétale tant qu’il n’a pas été décontaminé de façon suffisante.
La prévision de la phytodisponibilité d’un élément à partir d’une méthode chimique découle de la corrélation entre la teneur du sol et celle dans la plante. Les teneurs obtenues par les solutions salines sont assez fréquemment corrélées à celles mesurées dans un végétal, cultivé dans des conditions données. Cependant, la grande diversité des aptitudes de phyto-accumulation des différentes espèces et cultivars fait qu’il n’est pas possible de trouver une corrélation commune à toutes les cultures. Un moyen de définir des seuils « universels », c'est-à-dire applicables à
toutes les situations de culture, est le choix de situation ou scénarios englobant, d’une certaine façon, tous les autres cas possibles, comme cela a été fait en Suisse. Ainsi, le seuil d’investigation pour les cultures alimentaires peut être défini sur la base de la relation entre les teneurs dans le sol et celles dans un végétal ayant tendance à accumuler fortement les métaux (scénario du pire des cas réaliste). De ce fait, le seuil d’investigation minimise la probabilité d’occurrence de situations à risque non détecté. Cette application du principe de précaution ne débouche cependant pas sur une surestimation du risque au détriment de l’utilisation du sol, mais sur une évaluation précise du risque par des études spécifiques au site ou sol contaminé. Les éléments que nous avons rassemblés indiquent qu’il est possible de définir des
seuils d’investigation et d’assainissement sur la base d’un test physico-chimique de
phytodisponibilité adapté aux conditions françaises, au moins pour certains éléments d’intérêt majeur. Cette définition résulterait, dans un premier temps, de cultures en milieu contrôlé, permettant de dériver, à partir d’une teneur critique dans le végétal, la teneur critique dans le sol. Les seuils seraient ensuite vérifiés à partir des relations entre teneurs dans les sols et dans les végétaux in situ. Les seuils devraient être définis en priorité pour Cd, Cu, Ni, Pb et Zn. L’occurrence des contaminations en As, Cr, Sb, Sn et Tl en France devrait être étudiée de façon plus approfondie avant de décider s’il est opportun de développer une méthode physico-chimique d’évaluation de leur phytodisponibilité et de l’étalonner sur la réponse de végétaux. Il n’est pas certain qu’une seule méthode soit adaptée à tous les éléments, aussi proposons nous de tester trois méthodes : CaCl2 à 0,01 mol L-1, NH4NO3 à 1 mol L-1 et le DGT.
ABSTRACT
We have carried out a study of the feasibility of establishing a reference system which would enable chemical tests to be used for the assessment of the phyto-availability of soil toxic metals.
This study is based on the results of scientific works and on an analysis of experience from abroad (Switzerland and Germany) in the field.
The scientific literature indicates that unbuffered saline solutions, such as 0,01 mol L-1 CaCl2 or 1 mol L-1 NH4NO3, enable the assessment of the phytoavailability of traces elements, like Cd, Ni, Pb or Zn, with an acceptable degree of uncertainty. It also suggests that the relatively new DGT technique (Diffusive Gradient Thin film) would permit a better forecast of the transfer of metallic cations into the plants.
The Swiss and German regulations on soil protection include threshold values for contents measured with saline solutions, i.e. 0,1 mol L-1 NaNO3 in Switzerland and 1 mol L-1 NH4NO3 in Germany. These thresholds essentially aim to protect the crops from production reduction and protect Man and cattle from intoxication. Therefore, the transfer pathway common to the exposures which is taken into account by these thresholds is: soil → soil solution → plant. Direct exposure of the targets is not considered by these methods. In Switzerland, the thresholds were established according to rigorous methodology, but their use causes difficulties. Indeed, the concentrations obtained using sodium nitrate are often close to the quantification limits and are poorly reproducible. The contents measured using 0,01 mol L-1 CaCl2 or 1 mol L-1 NH
4NO3 are significantly higher, so the latter methods can be applied to slightly contaminated soil.
To estimate the risk caused by a potentially toxic element, three thresholds could be proposed: The first one, the warning threshold, would correspond to the baseline content, regarded as the upper limit of the pedo-anthropogenic background content. This threshold would be fixed for the total content of the element in soil. When this is exceeded, there is a presumption of contamination and a necessity to carry out a phyto-availability test if the soil is used for plant growing. If the first phyto-availability threshold, i.e. the investigation threshold, is exceeded, studies must be carried out in order to evaluate the transfer of metals to plants and the associated risks. A consequence of these studies could be a modification of the soil use. The third threshold, the cleaning up threshold, is the one that indicates, when exceeded, that plant production must be stopped on the soil in question until it has been sufficiently decontaminated.
Assessing the phyto-availability of an element using a chemical test is made possible by the correlation of the soil content with that of the plant. Soil contents obtained using saline solutions are quite frequently correlated to those measured in one plant, for given cultivation conditions. However, the great variety of the ability of plants species and cultivars to accumulate trace elements makes it impossible to find a single correlation common to all crops. One possible way of defining “universal” thresholds, i.e. thresholds applicable to all cultivation conditions, is to choose a situation or a scenario which would include all the other possible ones, as has been done in Switzerland. For instance, the investigation threshold for food crops may be
established using the relationship between the trace element contents in soil and those in a plant which strongly accumulates the element (realistic worst case scenario). In such a case, the investigation threshold minimizes the probability that an undetected risk situation would occur. This application of the precaution principle does not lead to an overestimation of the risk which would prevent soil use, but to a precise risk assessment study, specific to the contaminated soil or site.
It seems possible to establish the investigation and cleaning up thresholds related to a phyto-availability physico-chemical test, which would be adapted to the French conditions, at least for some elements of major concern. Establishing these thresholds could be based on a first step, consisting of plant cultivation under controlled conditions. This would permit a critical soil content to be derived from a plant critical content. The thresholds should then be verified from relationships between in situ soil and plant contents. The thresholds should be established in priority for Cd, Cu, Ni, Pb and Zn. The occurrence of soil contamination in France by As, Cr, Sb, Sn and Tl should be estimated more precisely before deciding whether it would be appropriate to develop a chemical test for these elements and to calibrate it on a plant response. It is not certain that a single method would be suitable for all elements. Therefore we propose that three methods be tested : 0,01 mol L-1 CaCl2 or 1 mol L-1 NH4NO3 and DGT.
SOMMAIRE
I. INTRODUCTION
II. RISQUES LIES A LA CONTAMINATION DES SOLS PAR LES ELEMENTS EN TRACES
II.1. Voies d’exposition aux polluants des sols
II.2. Mécanismes du transfert des éléments en traces du sol à la plante III. METHODES CHIMIQUES D’EVALUATION DE LA PHYTODISPONIBILITE III.1. Introduction
III.2. Complexants organiques
III.3. Solutions salines non tamponnées III.4. Résines échangeuses d’ions
III.5. Dilution isotopique III.6. Spéciation en solution III.7. Conclusion
IV. ANALYSE DES APPROCHES ETRANGERES IV.1. Introduction
IV.2. Analyse de l’expérience suisse IV.3 Analyse de l’expérience allemande
IV.4. Conclusions sur les approches étrangères
V. LES SOLUTIONS SALINES ET LES SEUILS SUISSES ET ALLEMANDS DANS DES CONDITIONS FRANÇAISES
V.1. Comparaison des méthodes V.2. Conclusions
VI. LES ELEMENTS CONCERNES
VI.1. Dynamique des éléments dans le système sol plante VI.2. Conclusion
VII. PROPOSITION D’UN PROTOCOLE EXPERIMENTAL POUR LA DEFINITION D’UNE ECHELLE DE DIAGNOSTIC
VII.1. Introduction
VII.2. Démarche de diagnostic du risque VII.3. Esquisses de protocoles expérimentaux VII.4. Conclusions
VIII. CONCLUSION GENERALE
IX. REFERENCES BIBLIOGRAPHIQUES ANNEXES
Annexe 1. Fiches toxicologiques
Annexe 2. Analyse de l’expérience suisse : exemple du cadmium
8 10 10 12 16 16 16 21 24 25 27 28 30 30 30 40 45 46 46 50 51 51 55 57 57 58 60 63 64 66 75 76 83
I. INTRODUCTION
Si certains éléments en traces présents dans le sol sont indispensables à la nutrition des plantes, leur présence en excès peut les rendre phytotoxiques. D’autres éléments sont franchement indésirables du fait des risques qu’ils font encourir aux consommateurs des végétaux, notamment les Hommes et le bétail. Les teneurs excessives en ces éléments peuvent avoir une origine endogène, mais pour la plupart, sont anthropiques et contraignent les législateurs à fixer des normes de contamination tolérable pour la santé humaine et l’environnement.
L’évaluation de la phytodisponibilité des éléments en traces potentiellement toxiques des sols est fréquemment requise, notamment pour le diagnostic des risques engendrés par les sites industriels pollués, les sols agricoles en marge de ces sites, les sols urbains ou de jardins potagers, ou pour les demandes de dérogation pour les épandages de boues urbaines sur des sols aux teneurs anomaliques.
Il n’est le plus souvent pas possible de répondre de façon à la fois rapide, peu coûteuse et fiable à cette demande. En effet, l’évaluation de la phytodisponibilité doit généralement passer par différentes étapes assez lourdes, comme l’analyse de végétaux in situ, des cultures de végétaux en conditions contrôlées sur les substrats à évaluer, des mesures des compartiments biodisponibles par des techniques d’extractions chimiques ou de marquage isotopique.
L’extraction chimique sélective des compartiments disponibles des éléments du sol est une voie connue d’assez longue date pour simplifier la procédure d’évaluation de la phytodisponibilité. Cette approche a été validée initialement pour des éléments nutritifs et est à la base des méthodes de fertilisation chimique des sols. Diverses études en conditions contrôlées ont montré la pertinence de certains réactifs à prévoir le transfert du sol à la plante de certains éléments en traces, comme Cd, Ni, Pb ou Zn (Lebourg et al., 1996 ; McLaughlin et al., 2000). Des travaux plus récents menés en France (Programmes AGREDE-QUASAR, VADETOX et GESSOL) indiquent que des réactifs chimiques présentent une pertinence à prévoir le transfert de Cd et de Zn dans des organes récoltés (grain de blé) in situ, dans des contextes pédo-climatiques variés (Baize et al., 2003 ; Schwartz et al., 2000 ; Sterckeman, 2000). L’analyse chimique du sol peut expliquer une partie non négligeable de la variance des teneurs de Cd ou Zn dans le grain de blé. Elle peut donc conduire, en association avec d’autres paramètres du scénario d’exposition, à une évaluation relativement rapide et allégée du risque.
La Confédération Helvétique a fixé dès 1986, dans sa réglementation sur la protection des sols, des seuils de teneurs en éléments en traces extractibles pas un réactif d’extraction sélective (NaNO3 à 0,1 mol L-1). Plus récemment, la République Fédérale Allemande a fixé des seuils de teneurs en éléments en traces extractibles par NH4NO3 à 1 mol L-1.
L’usage des réactifs chimiques sélectifs pourrait donc être envisagé en France, mais il est pour le moment freiné par l’absence de références d’interprétation. Il reste en effet à bâtir une échelle de niveau (ou de risque) de transfert sol-plante correspondant à la gamme des valeurs que peut produire une extraction chimique sélective pour un élément donné du sol.
la phytodisponibilité des métaux toxiques. Ce rapport en présente les principales conclusions.
L’étude s’est basée sur les résultats de travaux scientifiques et sur une analyse des expériences étrangères dans ce domaine (suisse et allemande). La littérature scientifique sur les méthodes d’extraction chimique est assez abondante. Nous avons lu les documents et rencontré les responsables du programme qui a conduit à la mise en place d’un tel référentiel en Suisse et examiné la situation allemande au travers d’un certains nombre de publications scientifiques et réglementaires. Les questions qui ont guidé notre recherche sont principalement :
- Pour quels éléments en traces bâtir un référentiel, avec quelles priorités, pour quels domaines d’application (sol agricole, friche industrielle, etc.) ?
- Quelles méthodes chimiques pourraient être employées ?
- Quelles références d’interprétation, c’est dire quelles valeurs de seuils, existent déjà ?
- Comment étalonner la réponse d’un test chimique à celle d’un végétal ?
Après un rappel sur les risques liés à la contamination des sols par les éléments en traces, le présent rapport présente la synthèse de l’étude bibliographique des tests physico-chimiques existants. Celle-ci est suivie des résultats de notre analyse des expériences suisse et allemande, qui précède l’esquisse d’un protocole de construction d’un référentiel en France.
II. RISQUES LIES A LA CONTAMINATION DES SOLS PAR LES ELEMENTS EN TRACES
II.1. Voies d’exposition aux polluants des sols
Il existe 3 voies d’exposition de l’Homme et de l’animal aux divers polluants présents dans son environnement immédiat :
- contact – absorption par la peau : cette voie d’exposition consiste au contact de la peau avec des polluants présents dans le sol ou dans l’eau, c’est à dire, le contact direct de la peau avec du sol ou des poussières contaminées, ou encore avec de l’eau polluée au cours de la toilette ou en cas de baignade dans des eaux polluées ;
- inhalation : cette voie d’exposition représente l’inhalation directe de vapeur, de molécules d’eau (douche) ou encore de particules de terre contaminées ;
- ingestion : c’est l’ingestion directe de terre (bétail, enfants) ou de poussières contaminées, d’eau polluée et surtout de fourrages, de légumes potagers, de poissons, de viandes, de produits laitiers et d’œufs contaminés directement (dépôts de particules de terres contaminées/prélèvement de polluants dans le sol par les plantes) ou indirectement (ingestion de plantes contaminées par les ruminants par exemple).
Il existe différentes voies de contamination des plantes par les polluants métalliques, résumées sur la figure 1 : le prélèvement racinaire suivi éventuellement d’une translocation vers les autres organes de la plantes (organes consommables par exemple), le prélèvement foliaire par les stomates de polluants en phase gazeuse (volatilisation), la contamination directe des organes aériens par déposition humide ou sèche de molécules xénobiotiques ou la remise en suspension de particules polluées de sol sec ou humide par l’action du vent ou de la pluie (effet de « splashing »), suivi éventuellement d’une pénétration foliaire et d’une translocation vers d’autres organes cibles.
Adsorption sur les racines
Prélèvement racinaire et translocation Volatilisation à partir du sol et prélèvement foliaire Contamination du sol Application de boues et pulvérisation de pesticides Déposition sèche ou humide
de particules ou de gaz
Adsorption sur les racines
Prélèvement racinaire et translocation Volatilisation à partir du sol et prélèvement foliaire Contamination du sol Application de boues et pulvérisation de pesticides Déposition sèche ou humide
En ce qui concerne les éléments en traces dans les sols, les principales voies d’exposition des plantes, des animaux d’élevage et de l’homme sont données au tableau 1.
Tableau 1. Voies de contamination de l’Homme, des animaux d’élevage et des plantes cultivées par les polluants des sols (d’après Hämmann et Gupta (1998), modifié).
Transfert de particules du sol
Sol → plante (dépôt et adhésion de particules du sol) Sol → Homme (ingestion directe de terre)
Sol → plante fourragère (terre adhérente) → animal → produit animal → Homme Sol → animal (ingestion directe de terre) → produit animal → Homme
Sol → plante alimentaire (terre adhérente) → produit végétal → Homme Sol → air (poussière) → Homme (par inhalation)
Sol → air (poussière) → plante → Homme
Sol → air (poussière) → animal (par inhalation) → produit animal → Homme Transfert par solubilisation dans la solution du sol
Sol → solution du sol → plante
Sol → solution du sol → plante alimentaire → produit végétal → Homme
Sol → solution du sol → plante fourragère → animal → produit animal → Homme Sol → solution du sol → eaux souterraines et de surface→ eau potable → Homme Sol → solution du sol → eaux de surface → animal → produit animal → Homme Sol → solution du sol → sol (transfert de polluants vers les sols non atteints, par flux de masse et/ou diffusion)
Transfert par la phase gazeuse dans le sol (polluants volatiles) Sol → air → Homme (par inhalation)
Sol → air → plante (absorption stomatique) → Homme
Les voies d’exposition de l’Homme considérées comme les plus importantes par Hämmann et Gupta (1998) sont :
- Voie des Plantes Alimentaires : Sol → solution du sol → plante alimentaire → produit végétal → Homme
- Voie des Fourrages : Sol → solution du sol → plante fourragère → animal → produit animal → Homme
- Voie du Pâturage : Sol → plante fourragère (terre adhérente) → animal → produit animal → Homme et/ou Sol → Animal (ingestion directe de terre) → Homme et/ou Sol → animal → produit animal (par exemple le lait) → Homme.
- Voie d’Exposition Directe : Sol → Homme. C’est une voie qui concerne surtout les jeunes enfants jouant sur les sols contaminés.
Les plantes exposées à des métaux peuvent être intoxiquées (phytotoxicité), ce qui dans certains cas entraîne des dommages aux productions agricoles (baisses de rendement) :
- Voie de la Phytotoxicité : Sol → solution du sol → plante
L’exposition directe et celle du pâturage mettent en jeu la disponibilité des polluants dans les systèmes digestifs de mammifères monogastriques ou ruminants. Celle-ci n’entre pas dans le champ de nos compétences. Aussi avons-nous privilégié les voies restantes, qui toutes impliquent un passage du sol à la plante via l’absorption par les racines. Nous rappellerons donc ci-après les principaux mécanismes de ce transfert.
II.2. Mécanismes du transfert des éléments en traces du sol à la plante
Les mécanismes du passage d’un élément en traces du sol vers une plante supérieure peuvent être résumés schématiquement de la façon suivante (Barber, 1995 ; Clemens, 2001 ; Kochian, 1991 ; Marschner, 1995 ; Welch, 1995). L’élément est présent dans le sol (1°) en association à la phase solide et (2°) dissout dans la solution du sol. Sur la phase solide, il peut être réparti dans deux compartiments : le compartiment des ions pouvant passer en solution, que l’on peut considérer en équilibre avec la solution du sol et le compartiment des éléments non solubles. En solution, l’élément existe sous forme d’ions libres (par exemple Cd2+ ou Ni2+), de
complexes minéraux (par exemple CdCl+, ZnHCO3+) et de complexes
organométalliques (Cd complexé par des acides fulviques, Cu complexé par des acides humiques par exemple). La plante prélèverait essentiellement l’élément sous forme ionique. Certains complexes inorganiques semblent pouvoir être absorbés (CdCl+ par exemple) mais les complexes organiques ne passent généralement pas la membrane cytoplasmique des cellules racinaires. Pour pénétrer dans ces cellules, les éléments empruntent des voies plus ou moins spécifiques et régulées. Le prélèvement du zinc, oligo-élément, se fait par le biais de transporteurs membranaires spécifiques et actifs. Le cadmium, élément non essentiel, semble pénétrer dans les cellules racinaires en empruntant les voies d’autres cations, comme les transporteurs du fer, du manganèse, du zinc. Une fois dans la cellule, l’élément est partiellement séquestré, notamment dans la vacuole, l’autre partie
xylème. C’est avec la sève brute que l’élément est amené aux différents organes aériens transpirants du végétal. Le passage d’un organe à l’autre se fait via des transporteurs qui régulent la migration de l’élément et des mécanismes chimiques (complexation avec des molécules organiques, précipitation) qui en facilitent le déplacement ou le réduisent (séquestration). De ce fait, on observe souvent une réduction des teneurs en éléments en traces des racines aux parties aériennes. Les éléments en traces sont généralement transférés aux fruits et aux organes de réserve via la sève élaborée. Les teneurs dans les graines sont souvent plus faibles que celles des feuilles, bien que l’inverse puisse parfois être observé (dans le cas du zinc par exemple).
Le transfert d’un élément en traces du sol vers un organe récolté dépend à la fois de paramètres liés au sol (pH, CEC, MO, etc.), de facteurs propres à la plante (capacité d’absorption et de translocation, surface foliaire, âge de la plante, etc.) et de paramètres environnementaux (température, rayonnement, pluviométrie, etc.) influant à la fois sur le sol et sur la plante. Il résulte en quelque sorte de la rencontre entre l’offre du sol et la demande de la plante, dans des conditions agro-climatiques données. Notons qu’offre et demande ne sont pas totalement indépendantes. En particulier, la plante peut modifier l’offre du sol en changeant, notamment par exsudation racinaire de composés divers (protons, molécules organiques complexantes), les conditions physico-chimiques qui régissent la solubilité de l’élément sur la phase solide et sa spéciation dans la solution. Cet effet en retour de la plante sur la disponibilité et le flux des éléments en traces est actuellement difficile à quantifier.
La plupart des éléments en traces potentiellement toxiques présentent une forte interaction avec le sol. Ils sont retenus par la phase solide et leurs concentrations en solutions sont faibles. De ce fait, la demande de la plante est, dans les sols agricoles peu contaminés, non « satisfaite » et le sol contrôle en grande partie le transfert des éléments en traces. Connaître l’offre du sol est donc primordial pour prévoir le risque de contamination des récoltes.
II.2.1. Paramètres caractéristiques de l’offre du sol
L’offre du sol peut être décrite par trois variables, l’Intensité (I), la Quantité (Q) et la
Capacité (b). L’Intensité est la concentration de l’élément en solution. C’est de l’Intensité que dépend le flux d’ions entrant dans la racine (influx). La Quantité est la
dimension du compartiment de l’élément fixé de façon réversible (nous dirons adsorbé) sur la phase solide et susceptible de passer en solution. La Capacité est le rapport de la Quantité à l’Intensité. On désigne également ce ratio par l’expression « pouvoir tampon ». Il donne une appréciation de l’aptitude de la phase solide du sol à approvisionner la solution du sol, à maintenir constante sa concentration. Le pouvoir tampon varie selon le type de sol mais aussi selon sa teneur en l’élément considéré (son niveau de contamination). Cette variation n’est généralement pas linéaire (Figure 2), aussi est-il plus correct de représenter le pouvoir tampon par le rapport de la variation de la Quantité à celle de l’Intensité, soit :
dI dQ b=
Ces trois variables sont mesurables, avec une facilité et une précision inégales. Le compartiment phytodisponible, rassemblant les ions susceptibles d’être prélevés par
la plante cultivée, correspond ici à la somme des grandeurs Quantité et Intensité. Dans le cas des éléments en traces, l’Intensité est souvent très faible, par rapport à la quantité adsorbée. De ce fait, la mesure de Q donne l’essentiel du compartiment phytodisponible. 0 1 2 3 4 5 6 7 8 0 10 20 30 40 50 Concentration en solution, µg L-1 Concent rat ion adsorbée, mg kg -1
Figure 2. Relation typique entre la teneur en un élément en trace adsorbé sur la phase solide du sol et celle de l’élément dans la solution en équilibre avec cette phase solide. La pente de la courbe en chaque point donne le pouvoir tampon du sol. Celui-ci varie donc selon le niveau de contamination
II.2.2. Mesure du facteur Intensité
L’Intensité peut être quantifiée par analyse de la solution du sol, celle-ci n’étant cependant pas aisée à recueillir, tout au moins en routine. La solution du sol peut être récoltée in situ, au moyen de bougies poreuses implantées dans le sol. Une bonne appréciation de sa composition peut être obtenue en analysant l’extrait obtenu par centrifugation ou filtration sous vide d’un échantillon de sol porté à la capacité au champ. On utilise aussi la méthode du déplacement, qui consiste à déverser de l’eau à la surface d’une colonne de terre préalablement saturée et à l’équilibre physico-chimique (attente de 48 heures à saturation par exemple). La solution du sol (eau saturante) est déplacée par l’eau ajoutée, en une sorte d’effet de piston, et récoltée au bas de la colonne, avant que l’eau du « piston » ne l’atteigne. Une fois la solution du sol récoltée, l’élément d’intérêt est dosé, le plus souvent par des techniques spectrométriques. Il est important de remarquer que l’élément ainsi dosé n’est pas uniquement celui qui est absorbable, puisque les différentes espèces présentes ne sont pas distinguées.
II.2.3. Mesure du facteur Quantité
C’est celui que l’on cherche à l’apprécier classiquement par l’analyse de terre. Celle-ci consiste à mettre la phase solide du sol en suspension dans une solution aqueuse comportant un ou plusieurs composés chimiques susceptibles de dissoudre
spécifiquement l’élément appartenant au compartiment adsorbé. Les différents réactifs seront examinés au chapitre III.
En conditions contrôlées et homogènes (par exemple culture en serre d’une variété unique sur un même sol à des degrés variés de contamination), les quantités extraites par les réactifs chimiques sont corrélées à celles prélevées par un végétal. En effet, si l’on fixe à peu près la Capacité et les facteurs de la demande de la plante, le transfert d’un élément en traces est proportionnel au seul paramètre variable, la
Quantité. Dans les conditions agro-climatiques variées, la corrélation est moins
étroite, mais dans certains cas elle subsiste à un niveau relativement important. II.2.4. Mesure du facteur Capacité
La méthode des isothermes d’adsorption est classiquement utilisée pour évaluer le facteur Capacité. Des suspensions sont réalisées en mettant la prise d’essai de la terre à caractériser dans des solutions de teneur croissante en un élément en traces. Après une agitation de quelques heures, l’équilibre physico-chimique est atteint et l’on mesure la concentration de l’élément restant en solution. On peut ainsi tracer la relation entre quantité de l’élément en solution et quantité de l’élément adsorbé sur la phase solide. La courbe obtenue à l’allure présentée à la figure 2, qui peut être modélisée par une fonction dite de Freundlich ou de Langmuir. La pente de cette courbe en un point donné est le pouvoir tampon. Celui-ci varie donc selon l’endroit où l’on se situe sur la courbe, c’est à dire selon le niveau de contamination du sol en l’élément considéré.
III. METHODES CHIMIQUES D’EVALUATION DE LA PHYTODISPONIBILITE III.1. Introduction
Nous l’avons vu au chapitre II, connaître l’offre du sol permet de prévoir en grande partie le prélèvement de nombreux éléments en traces par une espèce végétale donnée. Cela provient du fait que la phase solide du sol exerce une forte rétention vis-à-vis des cations métalliques, limitant les transferts bien souvent en deçà de ce que la plante peu prélever.
De ce fait, l’objectif de l’analyse de terre est de quantifier le compartiment de l’espèce chimique absorbable par les cellules racinaires et susceptible de passer rapidement dans la solution du sol, à mesure que les racines l’y prélèvent. Jusqu’à présent, l’effet de la plante sur la disponibilité des éléments en traces (dû notamment aux divers exsudats des racines) n’a pas fait l’objet, à notre connaissance, de développement de tests physico-chimiques adaptés, même si l’effet des exsudats a été étudié dans divers travaux de recherche (voir par exemple Mench et Martin, 1991 ; Naidu et Harter, 1998 ; Zhao et al., 2001).
Au départ, ce sont les acides dilués et les solutions de complexants ou chélatants organiques qui ont été utilisées pour évaluer le risque de carence en oligo-élements (Cu, Mn, Zn) et en Fe. Avec l’amélioration des performances des techniques de dosage, les méthodes d’extraction chimique ont évolué vers l’utilisation de réactifs de moins en moins agressifs vis-à-vis du sol, les solutions salines et l’eau pure. Les résines échangeuses d’ions ont également été utilisées pour désorber les cations de la phase solide du sol (Lebourg et al., 1996 ; McLaughlin et al., 2000).
D’une façon générale, l’extraction par les solutions acides diluées (HCl, H2SO4, CH3COOH) se montre trop peu discriminante vis-à-vis des différentes formes sous lesquelles les éléments en traces sont présents dans le sol. Elles ne permettent généralement pas une prévision des transferts du sol vers la plante. A l’opposé, l’extraction à l’eau permettrait une bonne évaluation des risques de transfert des métaux tels que Cd, Cu, Ni, Pb et Zn. Cependant, cette technique pose différents problèmes dans sa mise en œuvre. Contrairement aux solutions salines, elle ne permet pas une floculation suffisante de la suspension. Ceci peut conduire à des résultats excessivement élevés en raison de la présence de particules colloïdales en suspension, porteuses de l’élément dosé. D’autre part, les mesures sont rendues difficiles du fait des faibles quantités mises en solution, souvent inférieures à la limite de quantification des techniques analytiques les plus sensibles (Lebourg et al., 1996). En conséquence, notre examen portera surtout sur les résultats des travaux basés sur l’estimation de la phytodisponibilité à l’aide des solutions de chélatants organiques et des solutions salines non tamponnées, ainsi que sur des résines échangeuses d’ions. Nous verrons également si la dilution isotopique et la spéciation des éléments en solution peuvent apporter une information utile à cette estimation. III.2. Complexants organiques
La complexation consiste en la fixation d’un métal (M) sur un ligand (L) apporté sous forme de sel (XL). L’addition de ce sel dans la solution du sol entraîne un changement de charge du métal, et par conséquent, sa désorption et son maintien dans la solution du sol sous forme de complexe (ML). La réaction est la suivante :
Sol-M +XL
↔
Sol-X + MLL’efficacité de la complexation dépend de l’affinité du métal pour le ligand et pour la phase solide du sol. La constante de stabilité Kf des complexes est donnée par :
Mx+ + Ly-
↔
MLx-y{
}
{ }{ }
+ − − = x x yy f L M ML Koù {C} représente l’activité du composé C.
Il est nécessaire d’utiliser des ligants forts qui puissent entrer en compétition avec les sites de sorption des métaux. Le ligant le plus largement utilisé est sans doute l’acide diéthylène triaminepentaacétique (DTPA), test mis au point par Lindsay et Norwell (1978) pour déterminer la disponibilité du Cu, du Fe, du Mn et du Zn en sol neutre à calcaire.
De façon analogue, l’acide éthylène diaminotétra acétique (EDTA) a été proposé comme réactif d’évaluation des risques de carences en oligo-éléments (Viro, 1955) et très tôt, des travaux ont été entrepris pour l’adapter à l’extraction des métaux polluants des sols (Clayton et Tiller, 1979).
D’autres chélatants plus doux peuvent être utilisés (Garett et al., 1998 ; Krishnamurti
et al., 1995 ; McLaren et Crawford, 1973) : l’acide nitrilotriacétique (NTA) et le
pyrophosphate de sodium.
Les complexants organiques mettraient en solution les éléments échangeables ainsi que ceux complexés principalement par la matière organique et ceux fixés sur les hydroxydes de Fe, Mn et Al eux-mêmes mis en solution par le réactif (Didier et al., 1992 ; Gatti et al., 1991 ; Sheppard et Thibault, 1992 ; Shuman, 1988). L’EDTA et le DTPA sont les composés les plus utilisés pour évaluer la phytodisponibilité de Cd, Zn, Ni, Cu et Pb (Lebourg et al., 1996). Pour chacun d’eux, divers modes opératoires ont été proposés (Beckett, 1989). Les autres complexants sont peu utilisés et ont donné de médiocres résultats (McLaughlin et al., 2000). Aussi nous concentrerons nous sur les réactifs à base de DTPA et d’EDTA.
III.2.1. Acide éthylène diaminotétraacétique (EDTA)
En Grande Bretagne, l’EDTA 0,05 mol.L-1 ajusté à pH 4 a été choisi pour estimer la quantité de Cu biodisponible (Lebourg et al., 1996). Cette même solution d’extraction semble également satisfaisante pour évaluer la quantité de Ni assimilable par des végétaux hyperaccumulateurs de métaux se développant sur un sol dérivé de serpentinite (Hughes et Noble, 1991). L’ex-Bureau Communautaire de Références (BCR) a recommandé en son temps l’EDTA sous forme acide à 0,05 mol.L-1 ajusté à pH = 7 pour extraire Cd, Cu, Pb, Ni et Zn. En France, la norme Afnor NF X31-120
propose une solution de Na2-EDTA à 0,01 mol.L-1 dissous dans l’acétate
d’ammonium molaire, ajusté à pH = 7, afin d’extraire Cu, Zn, Mn et Fe et de comparer les teneurs ainsi obtenues à des échelles de diagnostic des carences en ces oligo-éléments.
McLaren et al. (1984) ont effectivement observé des corrélations réactif-plante pour Cu et pour Zn extraits par Na2-EDTA à 0,04 mol.L-1, ajusté à pH = 6, lors de l’étude
de l’assimilation de ces éléments par de la luzerne présente sur de nombreux sites de Nouvelle-Zélande, potentiellement carencés en Cu et en Zn. De même, Haq et Miller (1972) ont montré qu’une solution d’EDTA à 0,01 mol.L-1 dans (NH4)2CO3 à 1 mol.L-1, ajusté à pH = 8,6, permettait d’évaluer la quantité de Zn susceptible d’être assimilée par le maïs (étude en serre de 85 sols relativement pauvres en zinc).
Mehlich (1984) a mis au point une solution d’extraction, dite « Mehlich 3 », renfermant divers composés, dont l’EDTA à 0,001 mol.L-1. D’après Tucker et Hight, (1990), cette méthode a l’avantage de fournir des résultats reproductibles pour l’extraction de Zn et de Cu. Il semble que les teneurs en Cu d’un sol acide pollué soient corrélées avec les teneurs que renferment les racines de Citrus sp (Alva et al., 1993). De même, les essais de Mulchi et al. (1992) soulignent l’intérêt d’utiliser cet extractant pour évaluer la phytodisponibilité de Zn, Cu, Ni et Cd de sols pollués, cultivés en tabac.
La méthode de Lakanen et Erviö (EDTA 0,02 mol.L-1 + CH3COOH 0,5 mol.L-1 + NH4CH3COO 0,5 mol.L-1, pH ajusté à 4,65) se révèle plus ou moins satisfaisante, selon les métaux et les sols considérés, pour estimer la phytodisponibilité (Gatti et al., 1991 ; Gupta et Aten, 1993 ; Lindsay et Norwell, 1978 ; Lindsay et Cox, 1985 ; Roca et Pomares, 1991). Son emploi ne serait à prescrire que dans le cas de sols acides. Cependant, les quantités ainsi extraites, ou suivant la norme Afnor NF X31-120 se révèlent souvent élevées et peu corrélées aux teneurs réellement phytodisponibles (Didier et al., 1992 ; Gupta et Aten, 1993). Le réactif a tendance à mobiliser les éléments retenus dans des compartiments du sol qui ne peuvent alimenter les racines. Une étude de Hogg et al. (1993) souligne ainsi que l’utilisation de l’EDTA conduit à surestimer Cu assimilable. Cette surestimation serait issue de l’affinité entre l’EDTA et le cuivre et de la mise en solution par l’agent chélatant de composés organiques, auxquels le cuivre est fortement lié (Andersson, 1975). Shuman (1988) envisage également que les composés organiques ainsi libérés agissent à leur tour comme des complexants, amplifiant ainsi la mise en solution de Cu. Des résultats comparables obtenus pour Pb sont expliqués par les mêmes hypothèses (Andersson, 1975). Pour améliorer les relations entre réactif et plante, Sillanpää, (1982) propose de corriger la concentration en Cu extrait par le réactif de Lakanen et Erviö en fonction de la teneur en matière organique du sol. De la même façon, Laurent et Castillon (1989) préconisent d’intégrer aux modèles de prévision de carence en cuivre la teneur en matière organique et/ou celle en P2O5. Il existe apparemment un antagonisme entre le cuivre et la matière organique et, dans une moindre mesure, le phosphore. On note également que la nature de la matière organique est à considérer car si les acides humiques insolubilisent le cuivre, alors les acides fulviques forment avec cet élément des composés solubles assimilables par les végétaux.
III.2.2. Acide diéthylène triaminepentaacétique (DTPA)
Initialement, son emploi été préconisé par Lindsay et Norwell (1978) pour évaluer les seuils de carence en Cu, Fe, Mn et Zn en sol neutre à calcaire. L’extractant proposé
par ces auteurs est une solution aqueuse de DTPA à 0,005 mol L-1, de
triéthanolamine (TEA) à 0,1 mol L-1 et de CaCl2 à 0,01 mol L-1 à pH 7,3. Ce pH permet la complexation optimale des métaux visés et correspond à celui des sols étudiés. Le DTPA est en effet l’agent complexant le plus puissant vis à vis des métaux précédemment cités, le TEA est un excellent tampon à pH 7,3 (pKa de 7,8),
France, cette méthode est normalisée (NF ISO 14870) pour les mêmes éléments, sans restriction de pH des sols analysés. Divers essais de culture (maïs, sorgho et blé) réalisés principalement sous serre, dans des conditions correctes d’utilisation (sols à teneurs faibles en métaux, de pH neutre à alcalin) ont montré l’intérêt de cette méthode (Gatti et al., 1991 ; Haq et Miller, 1972 ; Lindsay et Cox, 1985 ; Lindsay et Norwell, 1978 ; Morel et Guckert, 1984 ; O'Connor, 1988 ; Roca et Pomares, 1991). Sillanpää (1982) a également mis en évidence de bonnes corrélations réactif-plante pour Cu et Zn lors de l’étude de plus de 3000 sites répartis dans le monde entier, cultivés en blé et en maïs.
Dans le cas de sols pollués et de métaux autres que Cu, Fe, Mn et Zn, les résultats obtenus avec la méthode d’extraction de Lindsay et Norwell (1978) divergent selon les éléments étudiés et les conditions expérimentales adoptées. Ainsi, Roca et Pomares (1991) ont observé une corrélation entre réactif et plante dans le cas du maïs, de la pomme de terre et de la laitue pour Cd, Cu, Zn et Ni (mais pas pour Cr) sur un sol calcaire pollué par des boues de station d’épuration. Les études de la phytodisponibilité de Cd réalisées par Street et al. (1977) (culture en serre de maïs sur des sols neutres à alcalins enrichis en Cd) ainsi que par Juste et Tauzin (1992) (culture en serre de ray-grass sur des sols acides amendés par des boues) aboutissent à des conclusions identiques. De même, Adams et Kissel (1989) ont pu relier l’absorption de Cu et de Ni (mais pas de Zn) par du soja cultivé sur des sols acides à neutres ayant reçu des apports de boues aux quantités extractibles par ce réactif. Brown et al. (1989) observent une bonne corrélation entre la concentration en Ni extrait par le DTPA et celle déterminée dans divers organes végétaux (grain d’avoine et ray-grass) récoltés après culture en serre sur des sols possédant des pH différents, enrichis en Ni et en Cd par l’apport de boue. En revanche, aucune corrélation entre réactif et plante n’est observée pour Cd. D’autres essais ont également révélé l’absence de valeur prédictive du DTPA pour divers sols pollués. Ainsi, Kuo (1990) a constaté une faible corrélation entre Cd extrait par le DTPA et celui prélevé par des cardes cultivées sur des sols acides amendés par des boues. D’autre part, Hamilton et Westermann (1991) n’observent pas de corrélations entre les concentrations en Zn extrait et celles des haricots cultivés sur un sol enrichi en ZnSO4. Enfin, l’assimilation de Cd et de Pb par du ray-grass cultivé sous serre sur deux sols acides amendés par une boue ou enrichis par Pb(NO3)2 et Cd(NO3)2 n’a pu être évaluée à l’aide du DTPA (Hooda et Alloway, 1993). Pour obtenir une meilleure estimation des teneurs en Cd, Zn, Pb et Cu sur des sols acides, il est recommandé d’introduire les valeurs du pH, de la teneur en matière organique et en oxydes de fer dans des modèles statistiques de prédiction de l’assimilation (Kuo, 1990 ; Lindsay et Norwell, 1978 ; Morel et Guckert, 1984). Néanmoins, il semble que les phénomènes de compétition entre les éléments présents dans les extraits de sols acides ou pollués et la possible saturation de la capacité de complexation du chélatant soient un frein à l’estimation des risques de toxicité liés à la phytodisponibilité des métaux en traces à l’aide d’un chélatant (Schneider, 1989).
En horticulture, Alt et Peters (1992) suggèrent d’évaluer la phytodisponibilité des éléments présents dans le sol à l’aide d’un mélange de CaCl2 à 0,01 mol L-1 et de DTPA à 0,002 mol L-1. Ils ont ainsi montré que, pour des sols acides à neutres, enrichis en Cu et où sont cultivés des chrysanthèmes, la solution d’extraction ne permettait pas d’estimer la teneur en Cu phytodisponible au-delà d’une concentration en cuivre de 0,36 mg.L-1 dans l’extrait de sol. En effet, passé ce seuil, alors que la teneur en solution augmente, la teneur dans le végétal demeure relativement
constante. Il est probable que dans ce cas, ce ne soit pas la disponibilité du métal qui conditionne la teneur dans la plante, mais plutôt que cette dernière régule (limite) l’absorption du métal (Hamon et al., 1999).
D’après O'Connor (1988), l’utilisation d’une solution de DTPA dans l’hydrogénocarbonate d’ammonium (AB-DTPA) est restreinte aux mêmes conditions que celles définies dans la méthode de Lindsay et Norwell (1978). Cependant, elle aurait l’avantage d’être nettement plus rapide d’exécution (15 min d’agitation au lieu de 2 h). De plus, comme les quantités extraites en Cd, Ni, Pb et Zn par l’AB-DTPA et le réactif de Lindsay et Norvell sont significativement corrélées, l’utilisation de l’AB-DTPA pourrait avantageusement remplacer celle du l’AB-DTPA (Boon et Soltanpour, 1991 ; Soltanpour et Workman, 1979).
D
ED
AAAc
So
Réactif Références bibliographiques Concentration (mol L-1)
pH Ions extraits Domaine d'application Rapport m/V Durée d'agitation Centrifugation Filtration TPA Lindsay et Norwell (1978)
NF ISO 14870 (2002)
DTPA 0,005 M + TEA 0,1 M + CaCl2 0,01 M
7,3 Cu, Fe, Mn, Zn Sols neutres à calcaires
1/2 2 h 3000 g/10 min Membrane filtrante de 0,45 µm Alt et Peters (1992) DTPA 0,002 M +
CaCl2 0,01 M
4-5,5 Cu Max:0,36
mg Cu.L-1
solution
1/4 1 h
AB-DTPA Barbarick et Workman (1987) O'Connor (1988)
DTPA 0,005 M + TEA 0,1 M + CaCl2 0,01 M
+ HCO3NH4 (AB)
7,3 Cu, Fe, Mn, Zn Sols neutres à calcaires
15 min Papier
Whatman 42
TA Viro (1955) 0,05 7-9 Cu, Zn 1/5 15 min ?
?
Filtr lavé à l'acide Haq et Miller (1972) EDTA 0,01 M
+ (NH4)2CO31 M 8,6 Zn 1/2 30 min Clayton et Tiller (1979) 0,1 6 Cd, Zn, Pb 1/2,5 7 j 1000g/5mn + 20000g/10min + 12000g/30min Papier Whatman 2
McLaren et al. (1984) 0,04 6 Cu, Zn 1/2,5 2 h
Hughes et Noble (1991) 0,05 4 Ni 1/10 1 h Afnor NF X31-120 (2003) EDTA 0,01 M
+ NH4CH3COO 1M
7 Cu, Zn, Mn, Fe 1/10 2 h
"Mehlich 3" Mehlich (1984) EDTA 0,001 M + CH3COOH 0,02 M
+ NH4NO30,25 M +
NH4F 0,015 M +
HNO3 0,013 M
Zn, Cu, Ni, Cd 1/10 V/V 5 mn Filtre rincé
avec AlCl3
-EDTA Lakanen et Erviö (1971) EDTA 0,02 M + CH3COOH 0,5 M
+ NH4CH3COO 0,5 M
4,65 Fe, Zn, Mn, Cu Sols acides
dium Pyrophosphate
Garett et al. (1998) Na4P2O7 0,1 M 10 Cd 1/20 1 h 2800g/10min +
15000g/20min
Tableau 2. Récapitulatif des protocoles d’extraction utilisant des complexants organiques
III.2.3. Bilan sur les complexants organiques
Contrairement aux sels neutres que nous examinerons ci-après, les complexants organiques (Tableau 2) ont été originellement développés pour l’étude des carences en certains oligo-éléments. Ils extraient plus de métal du sol et ont tendance à surestimer la quantité disponible pour la plante dans la durée de sa culture, c'est-à-dire les ions de la solution du sol et ceux qui, adsorbés, peuvent alimenter cette solution. Les complexants semblent peu adaptés pour prévoir la réponse immédiate d’un organisme vivant. Il n’est cependant pas exclu que le DTPA présente un intérêt pour prévoir le transfert de certains éléments. Les complexants organiques mettant
en solution les éléments complexés principalement par la matière organique et ceux fixés sur les hydroxydes de Fe, Mn et Al, on peut se demander si les complexants organiques ne permettraient pas d’estimer les quantités d’éléments qui pourraient être libérés à plus long terme, par exemple en cas de changement des conditions physico-chimiques des sols du à une modification de leur gestion.
III.3. Solutions salines non tamponnées
Sous ce terme sont regroupées les solutions de sels divers, tels que BaCl2, AlCl3, CaCl2, Ca(NO3)2, NaNO3, NH4NO3, etc. Selon le mode opératoire, la concentration en sel des solutions (généralement des solutions d’un seul sel) varie généralement de 0,01 mol L-1 à 1 mol L-1. L’extraction des métaux se fait essentiellement par réaction d’échange cationique. Le métal M est partiellement déplacé de la phase solide par échange avec le cation C, selon la loi d’action de masse :
Sol-M +C
↔
Sol-C + MLa solubilisation peut être influencée par les capacités complexantes de l’anion accompagnant ou du cation lui-même. Ainsi, l’utilisation de chlorures favorise la désorption de métaux qui forment des complexes avec Cl-, tel Cd, Hg ou Mn. Cette complexation ne conduit cependant pas à des quantités extraites aussi importantes que celles obtenues avec les complexants organiques évoqués avant. Cependant, à concentration et cation échangeur identiques, les sels de chlore extraient plus de Cd que les sels de nitrates (Lebourg et al., 1996 ; McLaughlin et al., 2000).
III.3.1. Chlorures
L’extraction de Cd, Ni et Zn par le BaCl2 à 0,1 mol.L-1 a permis une bonne évaluation de la phytodisponibilité de ces éléments vis-à-vis du ray-grass dans le cas d’un sol de pH acide, amendé par des boues de station d’épuration (Juste et Solda, 1988). Les teneurs obtenues dans le BaCl2 à 0,1 mol.L-1 sont sensiblement les mêmes que celles relevées dans CaCl2 à 0,1 mol.L-1.
Dans le but d’extraire le chrome et le nickel de sols dérivés de serpentinite, Hughes et Noble (1991) ont testé AlCl3 à 0,3 mol.L-1. Aucune corrélation entre réactif et végétal (hyperaccumulateur, in situ) n’a été relevée pour le chrome. En revanche, cette solution a permis une estimation correcte de l’assimilation du Ni.
L’efficacité du CaCl2 à différentes concentrations, pour évaluer la biodisponibilité de Cd, Ni et Zn contenus dans des sols pollués et de pH varié est montrée par diverses études faisant intervenir la culture de multiples espèces végétales (Jackson et Alloway, 1991 ; Juste et Solda, 1988 ; Mench et al., 1992 ; Novozamsky et al., 1993 ; Sanders et al., 1987 ; Wu, 1989). Les raisons invoquées pour expliquer cette efficacité, si la solution est centimolaire, sont d’une part la faible modification du pH naturel du sol, d’autre part le déplacement aisé par Ca2+ des cations fixés sur le complexe argilo-humique du sol et enfin la similitude entre la composition qualitative et quantitative de la solution du sol avec la solution d’extraction, excepté en ce qui concerne les chlorures. Cependant, d’après Jackson et Alloway (1991) l’extraction de Cd par CaCl2 à 0,1 mol.L-1 serait représentative de l’assimilation par les plantes (laitue et chou) seulement si le pH du sol est supérieur à 5,5. De plus, l’emploi de CaCl2 est susceptible de surestimer la fraction extractible de Cd par la formation de complexes avec Cl- (Gupta et Aten, 1993). Les teneurs en Cu extraits par CaCl2 à 0,01 mol.L-1 peuvent se révéler proches des limites de détection et donc difficilement
exploitables (Alt et Peters, 1992). Lorsque ce n’est pas le cas, des corrélations significatives entre les concentrations en Cu dans les extraits de sol et les teneurs dans les végétaux sont parfois observées.
III.3.2. Nitrates
Pour éviter la complexation de l’ion étudié par Cl- et les problèmes de dosage par spectrométrie d’absorption atomique en four engendrés par la présence de l’ion chlorure (Didier et al., 1992), des solutions de Ca(NO3)2, de NaNO3 et de NH4NO3 sont aussi utilisées. L’emploi de ces solutions a également été développé afin de permettre le dosage des éléments en traces par polarographie, technique pour laquelle l’emploi du nitrate est quasiment indispensable.
Les tests réalisés à l’aide de Ca(NO3)2 à 0,1 mol.L-1 se sont avérés satisfaisants pour Cd, Cu, Ni, Pb et Zn lors d’essais en serre (maïs, ray grass) et au champ, sur des sols acides à neutres pollués (Didier et al., 1992 ; Mench et al., 1992), mais sont encore trop peu nombreux pour permettre d’apprécier l’efficacité de ce réactif.
Le NaNO3 aurait également pour avantage de ne pas perturber le pH du sol et de ne pas avoir de propriétés complexantes (Gupta et Aten, 1993). Malgré des concentrations en solution parfois proches des limites de détection, Gupta et Aten (1993) montrent que les faibles quantités de Cd, Cu et Zn extraits de sols pollués sont corrélées aux teneurs relevées dans des végétaux (laitue et ray-grass) et sont proches de celles de la solution de sol. Des corrélations étroites ont également été obtenues lors de l’estimation de l’assimilation de Cd par le maïs, les feuilles et les racines de radis et les feuilles d’épinard (Gupta, 1984 ; Gupta et Stadelmann, 1983), de Cu par le maïs (Gupta, 1987) et de Ni par la laitue (Gupta et al., 1987). Parallèlement, on a observé que l’influence de paramètres tels que le pH et la capacité d’échange cationique sur les équilibres entre les phases solides et le liquide du sol, tout comme les compétitions entre ions (Cd et Pb) pour les mêmes sites, sont correctement simulées par l’extraction au NaNO3 à 0,1 mol.L-1 (Gupta, 1987 ; Gupta et Stadelmann, 1983). Il en résulte que les concentrations en métaux solubles pouvant induire des concentrations toxiques dans les végétaux sont indépendantes des caractéristiques physico-chimiques des sols. Ainsi, après de nombreux essais de culture en serre, des valeurs guides maximales tolérables dans les extraits de sol ont été définies et réglementées en Suisse (voir chapitre IV). Afin de vérifier la pertinence de ces valeurs pour évaluer les risques de toxicité en Cd, Cu et Zn, Gupta (1991) a réalisé une étude sur 25 parcelles polluées où ont été cultivés du ray-grass et de la laitue. Il a obtenu des diagnostics satisfaisants, sauf dans le cas de l’assimilation du cadmium par la laitue. En effet, il a relevé des teneurs élevées dans les feuilles alors que les quantités de Cd extrait des sols sont très faibles. Concernant le cuivre, la valeur seuil définie s’avère trop élevée pour distinguer correctement, sur l’ensemble des sols, tout risque de toxicité. Le cas du plomb n’est que rarement abordé. En effet, les concentrations assimilées par les végétaux sont parfois trop faibles pour définir toute relation entre réactif et plante (Gupta et Aten, 1993). Coullery et al. (1996) ont comparés les teneurs en Cd, Cu, Pb et Zn des sols de quatre sites suisses contaminés avec celles dans divers organes de végétaux, cultivés in situ. Le NaNO3 à 0,1 mol.L-1 fournit des valeurs mieux corrélées à celles dans les plantes que l’acide nitrique à 2 mol L-1 (donnant une teneur pseudo-totale). Mais ce n’est pas toujours le cas. Par exemple, l’extrait par NaNO3 à 0,1 mol.L-1 ne permet pas de prédire la quantité de Cd absorbé par les graminées (dactyle, blé, orge), ni de Cu par aucune
des plantes. Il n’est pas possible ici non plus d’établir une relation entre réactif et plante pour le plomb, du fait des faibles quantités extraites par NaNO3.
Une étude de Symeonides et McRae (1977) souligne l’efficacité de NH4NO3 à 1 mol.L-1 pour évaluer la phytodisponibilité de Cd pour des radis cultivés sur des sols enrichis par l’ajout de CdCl2. Reprenant cette méthode, Prüess (1995b ; 1997) montre que l’extraction de nombreux éléments en traces du sol par cette solution est corrélée significativement aux teneurs en ces éléments dans divers végétaux prélevés sur de nombreux sites contaminés. La méthode a été normalisée en Allemagne (DIN 19730) et devrait l’être bientôt au niveau international (ISO). A partir de ces travaux, des valeurs de diagnostic ont été définies et réglementées dans un premier temps dans l’état du Baden-Württemberg, puis dans toute l’Allemagne (voir chapitre IV). Néanmoins, lors des essais de Jackson et Alloway (1991) et de Singh et
al. (1995), ce réactif s’est révélé peu approprié à l’évaluation de l’assimilation de Cd
par la laitue, le chou, le blé et la carotte cultivés sous serre sur des sols de pH varié amendés ou non par des boues. Enfin, l’utilisation de NH4NO3 à 0,1 mol.L-1 pour évaluer la biodisponibilité de Cd, Cu et Zn vis-à-vis du ray-grass et de la laitue cultivés sur différents sols pollués ne semble pas systématiquement adaptée (Gupta et Aten, 1993). Ces échecs auraient principalement deux causes : la solution a tendance à modifier le pH du sol et l’ammoniac est susceptible de complexer Cu, Ni et Cr ainsi que Cd et Zn.
III.3.3. Bilan sur les solutions salines non tamponnées
Les valeurs obtenues par les solutions salines non tamponnées (Tableau 3) sont souvent étroitement corrélées aux teneurs dans les plantes, ainsi que le montrent les coefficients de corrélation collationnés par Lebourg et al. (1996) (r2 variant de 0,35 à 0,94). Comme le font remarquer McLaughlin et al. (2000), ces corrélations de valeurs le plus souvent log transformées ne doivent pas faire oublier des variances résiduelles importantes en valeur absolue. De plus, les coefficients de détermination élevés sont souvent obtenus sur des sols peu nombreux et/ou contaminés artificiellement par des sels de métaux en dose croissante. Quand les mesures sont faites in situ, dans des conditions agro-climatiques variées (Coullery et al., 1996 ; Hämmann et Gupta, 1998 ; Prüess, 1997 ; Sterckeman, 2000), les corrélations entre réactif et plante sont souvent nettement moins étroites, expliquant au mieux un tiers à la moitié de la variance des teneurs dans le végétal.
Une solution saline donne une valeur qui représente (par proportionnalité) la quantité de cation métallique susceptible d’alimenter la solution du sol dans laquelle la racine va puiser. Cependant, connaître cette quantité n’est pas suffisant pour prévoir précisément la teneur d’un organe d’une variété de plante cultivée donnée. Comme nous l’avons vu au chapitre II, d’autres mécanismes conduisent à cette concentration, qui ne sont pas représentés par la valeur produite par le test chimique. On peut considérer que l’effet du pH du sol, de la capacité de celui-ci à retenir les cations via les différents composés réactifs de la phase solide (argile, oxydes de fer et de manganèse, matière organique…) sont intégrés dans la valeur produite par la solution saline. Cependant, les facteurs qui régissent la diffusion du métal dans le sol, son absorption par la racine et sa translocation ne sont pas pris en compte par l’analyse, car nombre d’entre eux sont extérieurs au sol (conditions climatiques, physiologie de la plante, etc.). La solution saline donne en quelque sorte une appréciation correcte de l’offre du sol. Elle ne permet pas de préjuger de la demande de la plante. C’est pourquoi, comme nous le verrons plus loin (Chapitre IV), les
solutions salines ont été calibrées sur des conditions de demande de la plante (scénarios) choisies, principalement selon une logique écotoxicologique.
Tableau 3. Récapitulatif des protocoles d’extraction utilisant des solutions salines non tamponnées CaCl CaCl CaCl CaCl CaCl NH NH NH
Réactif Références bibliographiques
Concentration
(mol L-1) Sol(m)/Solution(V)Rapport d'agitation CentrifugationDurée
Filtration
2 Jackson et Alloway (1991) 0,05 1/6 16 h 400 g/10 min Papier Whatman 44
2 Mench et al. (1992) 0,1 1/5 2 h Filtre sans cendre
2 Novozamsky et al. (1993) 0,01 1/10 2 Sanders et al. (1987) 0,1
2 Wu (1989) 0,1 1/2,5 2 h Filtre lent
NaNO3 Gupta et Hänin (1989) 0,1 1/2,5 2 h
Acétate de cellulose 0,45 µm Ca(NO3)2
Mench et al. (1992)
Didier et al. (1992) 0,1 1/5 2 h Filtre sans cendre
4NO3 Jackson et Alloway (1991) 1 1/6 1 h 400 g/10 min Papier Whatman 44
4NO3 DIN 19730 1 1/2,5 2 h Néant Membrane filtrante de 0,45 µm 4NO3 Symeonides et McRae (1977) Singh et al. (1995) 1 1/10 et 1/5 30 min, 1 h, 18h
AlCl3 Hughes et Noble (1991) 1 1/10 1 h
III.4. Résines échangeuses d’ions
Certains auteurs proposent d’utiliser des résines échangeuses d’ions pour évaluer les quantités de macronutriments disponibles dans le sol pour les plantes (McLaughlin et al., 1993 ; Skogley et Dobermann, 1996 ; Somasiri et Edwards, 1992 ; van Raij, 1998 ; van Raij et al., 1986). Ces techniques ont été peu appliquées sur des sols pollués et sont loin d’un usage commercial. Cependant, Jing et Logan (1991), Lee et Zheng (1993 ; 1994) et Liang et Schoenau (1995) présentent des données sur l’utilisation de résine chélatante pour l’extraction des éléments en traces dans les sols. Jing et Logan (1991) ont utilisé des lits de résine Chelex dans des poches de dialyse pour estimer la phytodisponibilité de Cd d’un sol contaminé avec 17 niveaux de boue. Ils n’ont cependant pas démontré la supériorité de la résine sur d’autres extractants (Cd total, Ca(NO3)2, Ca(NO3)2/EDTA). D’autre part Lee et Zheng (1993) ont montré que la résine ChelexTM était un bon outil de prédiction du prélèvement du Cd par les plantes (r = 0,97 pour le blé) lorsque le sol était amendé avec des sels de Cd, meilleur que CaCl2 à 0,01 (r = 0,84) et que DTPA (r = 0,59). Dans une publication suivante (Lee et Zheng, 1994), ces auteurs ont cette fois montré que la résine était inférieure au CaCl2 pour prévoir le prélèvement de Cd mais permettait d’évaluer de façon satisfaisante le prélèvement de Cu et Pb par du blé cultivé sur terres artificiellement polluées.
Liang et Schoenau (1995 ; 1996) proposent quant à eux une résine échangeuse d’anions, prétraitée avec du DTPA, et insérée dans le sol humide. Les métaux retenus par la résine et le DTPA sont ensuite élués avec du HCl. Les corrélations obtenues avec les plantes sur des sols amendés avec des sels de métaux très concentrés sont bonnes pour tous les métaux excepté le Pb. Cette technique mériterait d’être testée dans des conditions plus réalistes. Ces auteurs ont également
développé une technique d’extraction fractionnée à l’aide de résines, utilisant des résines/DTPA échangeuses de cations et d’anions avec différents ions (H+, Na+). Cela correspond à une série de résines produisant plusieurs pH de la solution à l’équilibre, allant de 3 à 9,5. De plus, le surnageant récupéré après extraction de la résine peut être séparé en 2 phases (aqueuse et colloïdale), cette technique permettant de définir 6 compartiments (« pools ») de métaux. Liang et Schoenau n’ont pas cherché à établir de relation entre cette méthode et la réponse d’une plante ou d’un quelconque organisme.
De même, Davison et Zhang (1994) ont par la suite développé pour les sédiments une autre technique à base de résines, qui a ensuite été appliquée aux sols (Hooda
et al., 1999) (Zhang et al., 2004 ; Zhang et al., 2001). Appelée DGT (Diffusive
Gradient Thin film technique), cette technique consiste en une couche de résine ChelexTM incorporée dans un gel de polyacrylamide et enduite d'une autre couche de gel. Le gel est mis en contact avec le sol saturé à la capacité champ. Pour atteindre la résine, les métaux doivent préalablement diffuser au travers de la couche de gel, et l’on peut calculer la teneur en métaux diffusant à travers le gel à partir des caractéristiques connues de diffusion du gel. Le principe est séduisant, puisque le dispositif simule la diffusion du cation dans le sol et sa désorption de la phase solide, dont ont sait qu’il est le processus central du transfert sol-plante des éléments en traces (chapitre II).
Dans le travail de Zhang et al. (2004), le zinc extrait par DGT de terres de nature et de pollutions variées est très étroitement corrélé à celui prélevé par la plante (cresson alénois, Lepidium sativum). Dans un travail précédent, Zhang et al. (2001) avaient montré la pertinence du DGT pour prédire le prélèvement de Cu par la même plante pour de divers sols contaminés par ce métal. Le DGT s’avérait dans ce cas nettement supérieur à l’EDTA et à l’activité de Cu2+.
Cette technique semble prometteuse et mériterait d’être testée un peu plus, notamment pour des métaux comme Cd, Ni, Pb.
III.5. Dilution isotopique
Le facteur Quantité peut également être mesuré par dilution isotopique, pour les éléments en traces pour lesquels il existe un isotope radioactif de période suffisamment longue (voir par exemple Tiller et al. (1972) ou Smolders et al. (1999)).
C’est le cas pour Cd, Cr, Ni ou Zn1. On procède de la façon suivante : Une
suspension de terre est amenée à l’équilibre chimique, par exemple par agitation pendant 24 h de 1 masse de terre dans 10 volumes d’eau. L’isotope radioactif ou radionucléide est introduit dans la phase aqueuse de la suspension, en quantité négligeable par rapport à la quantité de l’élément non radioactif (ou stable) de façon à ne pas perturber l’équilibre chimique. Le radionucléide (par exemple du 109Cd ou du 65Ni) est doté des mêmes propriétés physico-chimiques que ses homologues stables. Très rapidement, du fait de l’agitation thermique, le radionucléide s’échange avec ses homologues stables fixés sur la phase solide du sol de façon réversible, c’est à dire avec les éléments représentant le facteur Quantité. Une fois cet échange homoionique réalisé, on arrive à un équilibre dans la répartition de la radioactivité, que l’on peut formuler ainsi :