HAL Id: dumas-01400759
https://dumas.ccsd.cnrs.fr/dumas-01400759
Submitted on 22 Nov 2016
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Jérémy Chalmin
To cite this version:
Jérémy Chalmin. Immunothérapie alimentaire orale à l’arachide : expérience pédiatrique niçoise. Médecine humaine et pathologie. 2016. �dumas-01400759�
Université de Nice Sophia – Antipolis
Faculté de Médecine de Nice
Année 2015-‐ 2016
Thèse d’exercice de Médecine
Pour l’obtention du grade de Docteur en Médecine (Diplôme d’état)
Présentée et soutenue publiquement le mercredi 14 septembre 2016 par
Mr Jérémy CHALMIN
Né le 4 Juin 1987 à Nice
Interne des Hôpitaux de Nice
Spécialité Pneumologie
Composition du jury :
Monsieur le Professeur Charles-‐Hugo MARQUETTE
Président du jury
Monsieur le Professeur Marc ALBERTINI
Assesseur
Monsieur le Professeur Xavier HEBUTERNE
Assesseur
Madame le Docteur Sylvie LEROY
Assesseur
Monsieur le Docteur Thierry BOURRIER
Directeur de thèse
Immunothérapie alimentaire orale à l’arachide. Expérience
pédiatrique niçoise.
1
UNIVERSITÉ NICE-SOPHIA ANTIPOLIS
FACULTÉ DE MÉDECINE
_________
Liste des professeurs au 1er septembre 2015 à la Faculté de Médecine de Nice
Doyen M. BAQUÉ Patrick
Vice-Doyen M. BOILEAU Pascal
Assesseurs M. ESNAULT Vincent
M. CARLES Michel Mme BREUIL Véronique M. MARTY Pierre
Conservateur de la bibliothèque Mme DE LEMOS Annelyse Directrice administrative des services Mme CALLEA Isabelle Doyens Honoraires M. AYRAUD Noël
M. RAMPAL Patrick M. BENCHIMOL Daniel Professeurs Honoraires M. BALAS Daniel M. BATT Michel M. BLAIVE Bruno M. BOQUET Patrice M. BOURGEON André M. BOUTTÉ Patrick M. BRUNETON Jean-Noël Mme BUSSIERE Françoise M. CAMOUS Jean-Pierre M. CHATEL Marcel M. COUSSEMENT Alain M. DARCOURT Guy M. DELLAMONICA Pierre M. DELMONT Jean M. DEMARD François M. DOLISI Claude M . FRANCO Alain M. FREYCHET Pierre M. GÉRARD Jean-Pierre M. GILLET Jean-Yves M. GRELLIER Patrick M. HARTER Michel M. INGLESAKIS Jean-André M. LALANNE Claude-Michel M. LAMBERT Jean-Claude M. LAZDUNSKI Michel M. LEFEBVRE Jean-Claude M. LE BAS Pierre M. LE FICHOUX Yves Mme LEBRETON Elisabeth M. LOUBIERE Robert M. MARIANI Roger M. MASSEYEFF René M. MATTEI Mathieu M. MOUIEL Jean Mme MYQUEL Martine M. OLLIER Amédée M. ORTONNE Jean-Paul M. SAUTRON Jean Baptiste M. SCHNEIDER Maurice M. SERRES Jean-Jacques M. TOUBOL Jacques M. TRAN Dinh Khiem
M VAN OBBERGHEN Emmanuel M. ZIEGLER Gérard
2 M.C.A. Honoraire Mlle ALLINE Madeleine
M.C.U. Honoraires M. ARNOLD Jacques M. BASTERIS Bernard
Mlle CHICHMANIAN Rose-Marie Mme DONZEAU Michèle
M. EMILIOZZI Roméo M. FRANKEN Philippe M. GASTAUD Marcel M.GIRARD-PIPAU Fernand M. GIUDICELLI Jean M. MAGNÉ Jacques Mme MEMRAN Nadine M. MENGUAL Raymond M. POIRÉE Jean-Claude Mme ROURE Marie-Claire
PROFESSEURS CLASSE EXCEPTIONNELLE
M. AMIEL Jean Urologie (52.04)
M. BENCHIMOL Daniel Chirurgie Générale (53.02)
M. BOILEAU Pascal Chirurgie Orthopédique et Traumatologique (50.02) M. DARCOURT Jacques Biophysique et Médecine Nucléaire (43.01) M. DESNUELLE Claude Biologie Cellulaire (44.03)
Mme EULLER-ZIEGLER Liana Rhumatologie (50.01)
M. FENICHEL Patrick Biologie du Développement et de la Reproduction (54.05) M. FUZIBET Jean-Gabriel Médecine Interne (53.01)
M. GASTAUD Pierre Ophtalmologie (55.02) M. GILSON Éric Biologie Cellulaire (44.03)
M. GRIMAUD Dominique Anesthésiologie et Réanimation Chirurgicale (48.01) M. HASSEN KHODJA Reda Chirurgie Vasculaire (51.04)
M. HÉBUTERNE Xavier Nutrition (44.04)
M. HOFMAN Paul Anatomie et Cytologie Pathologiques (42.03) M. LACOUR Jean-Philippe Dermato-Vénéréologie (50.03)
M. MARTY Pierre Parasitologie et Mycologie (45.02)
M. MICHIELS Jean-François Anatomie et Cytologie Pathologiques (42.03) M. MOUROUX Jérôme Chirurgie Thoracique et Cardiovasculaire (51.03) M. PAQUIS Philippe Neurochirurgie (49.02)
M. PRINGUEY Dominique Psychiatrie d'Adultes (49.03)
M. QUATREHOMME Gérald Médecine Légale et Droit de la Santé (46.03) M. M.ROBERT Philippe Psychiatrie d’Adultes (49.03)
M. SANTINI Joseph O.R.L. (55.01)
M. THYSS Antoine Cancérologie, Radiothérapie (47.02) .
3 PROFESSEURS PREMIERE CLASSE
Mme ASKENAZY-GITTARD Florence Pédopsychiatrie (49.04)
M. BAQUÉ Patrick Anatomie - Chirurgie Générale (42.01) M. BÉRARD Étienne Pédiatrie (54.01)
M. BERNARDIN Gilles Réanimation Médicale (48.02) M. BONGAIN André Gynécologie-Obstétrique (54.03) M. CASTILLO Laurent O.R.L. (55.01)
Mme CRENESSE Dominique Physiologie (44.02)
M. DE PERETTI Fernand Anatomie-Chirurgie Orthopédique (42.01) M. DRICI Milou-Daniel Pharmacologie Clinique (48.03)
M. ESNAULT Vincent Néphrologie (52-03) M. FERRARI Émile Cardiologie (51.02)
M. FERRERO Jean-Marc Cancérologie ; Radiothérapie (47.02) M. GIBELIN Pierre Cardiologie (51.02)
M. GUGENHEIM Jean Chirurgie Digestive (52.02)
Mme ICHAI Carole Anesthésiologie et Réanimation Chirurgicale (48.01) M. LONJON Michel Neurochirurgie (49.02)
M. MARQUETTE Charles-Hugo Pneumologie (51.01)
M. MOUNIER Nicolas Cancérologie, Radiothérapie (47.02) M. PADOVANI Bernard Radiologie et Imagerie Médicale (43.02) Mme PAQUIS Véronique Génétique (47.04)
M. PRADIER Christian Épidémiologie, Économie de la Santé et Prévention (46.01) M. RAUCOULES-AIMÉ Marc Anesthésie et Réanimation Chirurgicale (48.01)
Mme RAYNAUD Dominique Hématologie (47.01) M. ROSENTHAL Éric Médecine Interne (53.01) M. SCHNEIDER Stéphane Nutrition (44.04)
M. STACCINI Pascal Biostatistiques et Informatique Médicale (46.04) M. THOMAS Pierre Neurologie (49.01)
M. TRAN Albert Hépato Gastro-entérologie (52.01)
PROFESSEURS DEUXIEME CLASSE
M. ALBERTINI Marc Pédiatrie (54.01) Mme BAILLIF Stéphanie Ophtalmologie (55.02) M. BAHADORAN Philippe Cytologie et Histologie (42.02) M. BARRANGER Emmanuel Gynécologie Obstétrique (54.03) M. BENIZRI Emmanuel Chirurgie Générale (53.02) M. BENOIT Michel Psychiatrie (49.03)
Mme BLANC-PEDEUTOUR Florence Cancérologie – Génétique (47.02) M. BREAUD Jean Chirurgie Infantile (54-02) Mlle BREUIL Véronique Rhumatologie (50.01) M. CANIVET Bertrand Médecine Interne (53.01)
M. CARLES Michel Anesthésiologie Réanimation (48.01) M. CASSUTO Jill-Patrice Hématologie et Transfusion (47.01) M. CHEVALLIER Patrick Radiologie et Imagerie Médicale (43.02) Mme CHINETTI Giulia Biochimie-Biologie Moléculaire (44.01) M. DELOTTE Jérôme Gynécologie-obstétrique (54.03) M. DUMONTIER Christian Chirurgie plastique
M. FONTAINE Denys Neurochirurgie (49.02) M. FOURNIER Jean-Paul Thérapeutique (48-04)
M. FREDENRICH Alexandre Endocrinologie, Diabète et Maladies métaboliques (54.04) Mlle GIORDANENGO Valérie Bactériologie-Virologie (45.01)
M. GUÉRIN Olivier Gériatrie (48.04)
4 PROFESSEURS DEUXIEME CLASSE (suite)
M. IANNELLI Antonio Chirurgie Digestive (52.02) M JEAN BAPTISTE Elixène Chirurgie vasculaire (51.04)
M. JOURDAN Jacques Chirurgie Thoracique et Cardiovasculaire (51.03) M. LEVRAUT Jacques Anesthésiologie et Réanimation Chirurgicale (48.01) M. PASSERON Thierry Dermato-Vénéréologie (50-03)
M. PICHE Thierry Gastro-entérologie (52.01)
M. ROGER Pierre-Marie Maladies Infectieuses ; Maladies Tropicales (45.03) M. ROHRLICH Pierre Pédiatrie (54.01)
M. RUIMY Raymond Bactériologie-virologie (45.01) Mme SACCONI Sabrina Neurologie (49.01)
M. SADOUL Jean-Louis Endocrinologie, Diabète et Maladies Métaboliques (54.04) M. TROJANI Christophe Chirurgie Orthopédique et Traumatologique (50.02) M. VENISSAC Nicolas Chirurgie Thoracique et Cardiovasculaire (51.03)
PROFESSEUR DES UNIVERSITÉS
M. HOFLIGER Philippe Médecine Générale
PROFESSEURS AGRÉGÉS
Mme LANDI Rebecca Anglais
Mme ROSE Patricia Anglais
MAITRES DE CONFÉRENCES DES UNIVERSITÉS - PRATICIENS HOSPITALIERS
Mme ALUNNI Véronique Médecine Légale et Droit de la Santé (46.03) M. AMBROSETTI Damien Cytologie et Histologie (42.02)
Mme BANNWARTH Sylvie Génétique (47.04)
M. BENOLIEL José Biophysique et Médecine Nucléaire (43.01) Mme BERNARD-POMIER Ghislaine Immunologie (47.03)
Mme BUREL-VANDENBOS Fanny Anatomie et Cytologie pathologiques (42.03) M. DOGLIO Alain Bactériologie-Virologie (45.01)
M DOYEN Jérôme Radiothérapie (47.02) M FAVRE Guillaume Néphrologie (52.03)
M. FOSSE Thierry Bactériologie-Virologie-Hygiène (45.01) M. GARRAFFO Rodolphe Pharmacologie Fondamentale (48.03) Mme GIOVANNINI-CHAMI Lisa Pédiatrie (54.01)
Mme HINAULT Charlotte Biochimie et biologie moléculaire (44.01) Mme LEGROS Laurence Hématologie et Transfusion (47.01) Mme MAGNIÉ Marie-Noëlle Physiologie (44.02)
Mme MOCERI Pamela Cardiologie (51.02)
Mme MUSSO-LASSALLE Sandra Anatomie et Cytologie pathologiques (42.03) M. NAÏMI Mourad Biochimie et Biologie moléculaire (44.01) M. PHILIP Patrick Cytologie et Histologie (42.02)
Mme POMARES Christelle Parasitologie et mycologie (45.02) M. ROUX Christian Rhumatologie (50.01)
M. TESTA Jean Épidémiologie Économie de la Santé et Prévention (46.01) M. TOULON Pierre Hématologie et Transfusion (47.01)
5 PROFESSEURS ASSOCIÉS
M COYNE John Anatomie et Cytologie (42.03) M. GARDON Gilles Médecine Générale
Mme PACZESNY Sophie Hématologie (47.01) Mme POURRAT Isabelle Médecine Générale
MAITRES DE CONFÉRENCES ASSOCIÉS
M BALDIN Jean-Luc Médecine Générale
M. DARMON David Médecine Générale
Mme MONNIER Brigitte Médecine Générale
M. PAPA Michel Médecine Générale
PROFESSEURS CONVENTIONNÉS DE L’UNIVERSITÉ
M. BERTRAND François Médecine Interne
M. BROCKER Patrice Médecine Interne Option Gériatrie M. CHEVALLIER Daniel Urologie
Mme FOURNIER-MEHOUAS Manuella Médecine Physique et Réadaptation M. JAMBOU Patrick Coordination prélèvements d’organes M. QUARANTA Jean-François Santé Publique
Immunothérapie alimentaire orale à l’arachide. Expérience
pédiatrique niçoise.
ABRÉVIATIONS
AG : Arachide Grillée
CHU : Centre Hospitalo-‐Universitaire DCR : Dose Cumulée Réactogène DEP : Débit Expiratoire de Pointe
EAACI : European Academy of Allergy and Clinical Immunology EBM : Evidence Based Medicine
EPIT : Immunothérapie par voie épicutanée ET : Écart Type
FA : Farine d’Arachide IgE : Immunoglobuline E ITO : Immunothérapie Orale mg : Milligramme
mm : Millimètre
OE : Oesophagite à Éosinophiles PAI : Projet d’Accueil Individualisé RAV : Réseau d’AllergoVigilance SFA : Société Française d’Allergologie SR : Seuil Réactogène
TH1 : Lymphocyte T helper 1 TH2 : Lymphocyte T helper 2 TPO : Test de Provocation Oral
RESUME
Introduction : La fréquence, la persistance et la sévérité de l’allergie à l’arachide incitent à la recherche d’une nouvelle approche thérapeutique par l’immunothérapie orale (ITO) en alternative au régime d’éviction seul. L’objectif est d’évaluer l’efficacité et la tolérance de ce protocole d’ITO mené à domicile avec des aliments commercialisés contenant de l’arachide.
Méthodes : Sur les 72 patients, 68 ont accepté et suivi le protocole d’ITO personnalisé après le test de provocation orale (TPO1). À environ 1 an, un deuxième TPO sous ITO était réalisé (TPO2). Il y a eu 10 échecs et 31 patients ont bénéficié du TPO2. Lors des deux TPO, la dose cumulée réactive (DCR) et le score de sévérité clinique étaient comparés. Les tests cutanés et IgE spécifique de l’arachide étaient réalisés avant le TPO1 puis au moment du TPO2.
Résultats : Trente et un patients avec un âge moyen de 8,1 ans ont bénéficié du protocole complet. Le délai médian entre les deux TPO était de 1,4 ans. La DCR moyenne entre les TPO1 (4207 mg d’arachide) et TPO2 (8769 mg d’arachide) a augmenté significativement (p<0,001). Le score de sévérité clinique a diminué significativement entre les deux TPO (p<0,001). Aucun effet indésirable grave n’a été signalé sous ITO.
Conclusion : Une prise en charge par ITO à l’arachide dans une population pédiatrique, réalisé à domicile, démontre une efficacité et un bon rapport bénéfice/risque. L’ITO à l’arachide s’inscrit dans une approche thérapeutique personnalisée de l’enfant
INTRODUCTION
L’allergie alimentaire est une facette des manifestations du terrain atopique qui a fortement augmenté en fréquence depuis une trentaine d’années en pédiatrie en particulier.
Le dogme de sa prise en charge a reposé longtemps sur l’éviction de l’aliment responsable, dans l’espoir que l’absence de contact avec l’allergène favoriserait une tolérance spontanée.
Pourtant ce dogme a, avec le temps et les données de la littérature, été bousculé par l’évolution des patients allergiques.
La seule thérapeutique spécifique de l’hypersensibilité allergique IgE dépendante est l’immunothérapie spécifique. Décrite pour la première fois en 1911, elle a été développée pour les pneumallergènes et pour les venins d’hyménoptères avec une démonstration de son efficacité.[1],[2],[3] Le concept d’immunothérapie alimentaire est récent, mais a lui aussi, dans les 10 dernières années, démontré son efficacité notamment dans le cadre de l’allergie alimentaire à l’arachide.
Dans notre travail, nous avons colligé les données des enfants à qui a été proposée, à la consultation d’allergologie pédiatrique des hôpitaux de Nice, une immunothérapie spécifique par voie orale pour l’arachide ces 6 dernières années.
1-‐ Épidémiologie de l’allergie alimentaire à l’arachide
En France, la fréquence de l’allergie alimentaire est estimée à environ 4,7% des enfants et 3,2% des adultes.[4] Les réactions anaphylactiques sévères ont doublé au Royaume-‐Uni passant de 0,5% à 1,2% de 1994 à 2002.[5]
En France, le Réseau d’AllergoVigilance (RAV) enregistre depuis 2002, les réactions allergiques sévères et les décès (14 cas en 10 ans) classés selon le groupe d’aliments. En 2011, les 152 cas déclarés concernent 46 allergènes alimentaires différents avec une prédominance de l’arachide (14,1%) et des fruits à coque (22,8% dont 12,8% de noix de cajou).[6]
L’allergie à l’arachide est devenue un problème de santé publique majeur. La prévalence de cette allergie dans la population française est estimée entre 0,3 et 0,75%.[7]
De plus, l’arachide est un allergène pouvant entraîner des réactions sévères voire mortelles. Dans les deux séries publiées en 1991 et 2002, l’arachide est la principale cause de décès.[8],[9] La mort par anaphylaxie est généralement rare surtout chez l’enfant mais possible. Du fait de sa fréquence et de sa sévérité, cette allergie altère sérieusement la qualité de vie des enfants et de leurs familles.[10] De plus, l’arachide est un allergène retrouvé dans beaucoup de préparations industrielles. Ce qui rend le régime difficile. Depuis le 25 novembre 2005, une directive européenne impose l’étiquetage des denrées alimentaires préemballées contenant de l’arachide. Elle a amélioré la vie des patients allergiques mais ne supprime pas tous les risques.
À l’heure actuelle, la première mesure thérapeutique repose sur un régime d’éviction strict afin de limiter les accidents allergiques sévères, associé à la prescription d’une trousse d’urgence comprenant très souvent de l’adrénaline en stylo auto-‐ injectable. Un programme d’éducation thérapeutique est souhaitable, mais loin de pouvoir être appliqué à tous les patients souffrant d’allergie alimentaire. Le Projet d’Accueil Individualisé (PAI) en milieu scolaire est spécifique à la pédiatrie mais complique lui aussi la vie de l’enfant.[11],[12] Cependant, l’éviction stricte n’a pas fait preuve d’une acquisition de tolérance avec l’âge, et est incriminée dans l’augmentation possible de la réactivité clinique se traduisant par une sévérité accrue et/ou un seuil
réactogène plus bas.[13],[14] L’éviction seule n’est pas une stratégie thérapeutique suffisante justifiant l’immunothérapie spécifique alimentaire.
2-‐ Immunothérapie allergénique alimentaire
Dès les années 1990, deux études randomisées se sont intéressées à l’immunothérapie à l’arachide par la seule voie alors envisageable, l’injection sous-‐ cutanée. Oppenheimer et al, ont utilisé un protocole rush puis une injection mensuelle en phase de maintenance. Les trois sujets du groupe actif ont eu une réduction de 67 à 100% des symptômes lors du test de provocation après immunothérapie spécifique, suggérant une efficacité. Cependant, le taux de réactions systémiques était élevé (13,3%), avec en outre le décès d’un patient du groupe placebo ayant reçu par erreur un extrait d’arachide.[15] Nelson et al, ont étudié les effets de l’injection d’extrait d’arachide aqueux, chez 12 patients. Tous les patients ont augmenté leur seuil de réactivité.[16] Mais le taux important de réactions indésirables, nécessitant le recours à l’adrénaline, rend ce traitement inacceptable pour la pratique clinique quotidienne et éthiquement inconcevable. D’autres allergènes rendus moins réactifs ou d’autres voies d’administration devaient être étudiées.
La voie sublinguale a un excellent profil de tolérance mais une efficacité modérée. [17],[18] L’administration par voie épicutanée en patch est encore au stade de la recherche clinique.
L’immunothérapie orale (ITO) a été la plus étudiée et la seule utilisée en pratique courante. Selon le principe classique de toute « désensibilisation », de faibles doses d’allergènes sont administrées par voie orale et augmentées progressivement pour induire
une désensibilisation (augmentation du seuil réactogène) en espérant une tolérance (absence définitive de réactivité à l’allergène).
L’immunothérapie alimentaire s’effectue en deux temps. Tout d’abord, la phase d’induction consiste en une augmentation progressive des doses jusqu’à atteindre une dose optimale. Puis, la phase d’entretien ou de maintenance qui, avec une consommation régulière idéalement quotidienne de l’aliment, a pour but de maintenir le bénéfice de l’induction de tolérance. Au cours de l’immunothérapie alimentaire spécifique, il semble difficile d’obtenir une restauration complète de la tolérance, comparable à l’acquisition physiologique de la tolérance aux aliments chez le nourrisson. De nombreux patients redevenant allergiques en l’absence de consommation régulière de l’aliment.
Les premières études sur l’immunothérapie orale ont pris en charge l’allergie au lait de vache et à l’œuf. Longo et al, ont inclus 60 enfants allergiques sévères au lait de vache. Après un an, dans le groupe ITO, 36% des sujets ont acquis une tolérance complète, 54% une tolérance partielle. Le taux d’échec était de 10%.[19] Une récente revue de la littérature a montré que l’immunothérapie spécifique comparée au régime d’éviction seul, augmentait la probabilité de tolérance au lait de vache.[20] De même, l’immunothérapie orale augmente le taux de désensibilisation dans l’allergie à l’œuf.[21] Ces résultats sont à pondérer par le fait que l’histoire naturelle de l’allergie à l’œuf et au lait de vache tend à une tolérance spontanée fréquente parfois après de nombreuses années, bien différente de celle de l’arachide.[22],[23] En effet, l’histoire naturelle de l’allergie à l’arachide montre que seuls 20% des patients guérissent spontanément.[24],[25]
En 2015, le consensus international sur l’immunothérapie spécifique recommande que tous les patients présentant une allergie alimentaire IgE médiée doivent bénéficier d’un test de provocation oral. Cependant, l’immunothérapie
spécifique n’est pas recommandée dans le traitement de l’allergie alimentaire en pratique clinique courante.[26],[27] La seule approche thérapeutique validée reste l’éviction de l’allergène.
Depuis 2008, plusieurs études ont été consacrées à l’immunothérapie orale à l’arachide.
L’objectif principal de notre travail est d’évaluer l’efficacité de l’immunothérapie orale à l’arachide en analysant l’évolution de la dose cumulée réactogène et de la sévérité clinique, ainsi que le suivi des tests cutanés et des IgE spécifiques à l’arachide dans une population pédiatrique niçoise en pratique courante. Nous avons aussi étudié la tolérance du traitement. Nous nous sommes également intéressés aux caractéristiques cliniques de la population des enfants allergiques alimentaires à qui cette approche thérapeutique a été proposée.
MATERIEL ET METHODES
MATERIEL
Il s’agit d’une étude descriptive rétrospective, monocentrique concernant des enfants porteurs d’une allergie alimentaire à l’arachide suivis au sein de la consultation d’allergologie pédiatrique des Hôpitaux Pédiatriques de Nice CHU Lenval (HPNCL), à qui a été proposée une immunothérapie alimentaire par voie orale à l’arachide.
Sélection des patients
Tous les patients auxquels a été proposée une immunothérapie par voie orale
dans le cadre d’une allergie alimentaire à l’arachide ont été colligés. Les patients inclus étaient des enfants présentant une allergie à l’arachide confirmée par un test de provocation oral. La sévérité clinique de la réaction lors du test de provocation oral n’était pas un critère d’exclusion. Par contre, les enfants ayant une dose réactogène considérée comme trop faible (une dose cumulée réactive inférieure à 191 mg) n’étaient pas inclus.
La période d’inclusion s’est étendue de octobre 2010 à juillet 2016.
METHODES
1-‐ Test de provocation oral
Examen-‐clé du diagnostic de l’allergie alimentaire, il est impossible d’envisager une immunothérapie sans l’avoir réalisé. Si l’étalon-‐or du diagnostic est le test de provocation oral en double aveugle contre placebo (TPODACP), nos patients, dans une prise en charge de routine et pour des raisons de coût et de temps infirmier, ont été provoqués en ouvert.
Le test de provocation oral était réalisé en hôpital de jour, avec perfusion de sécurité et monitorage cardio-‐tensionnel. Il ne devait être débuté qu’après un examen
clinique strictement normal. Il commençait par un test labial. Puis, la dose initiale était de 1 milligramme avec une augmentation toutes les trente minutes jusqu’à la dose de 5000 milligrammes (mg) par paliers progressifs: 1mg-‐5mg-‐10mg-‐25mg-‐50mg-‐100mg-‐ 250mg-‐500mg-‐1000mg-‐2500mg-‐5000mg soit une dose totale cumulée de 9441 mg. L’administration d’arachide était réalisée avec de l’arachide grillée et pesée par la pharmacie centrale. Le test était considéré comme positif en cas d’apparition de signes objectifs constatés par un médecin (urticaire, angio-‐œdème, rhino-‐conjonctivite, bronchospasme, troubles digestifs dont un syndrome douloureux abdominal coté par EVA, chute tensionnelle). Le traitement adapté était réalisé si nécessaire. Une surveillance clinique rapprochée était poursuivie au moins jusqu’à 4 heures après la fin du test. En cas de réaction violente et/ou retardée, une surveillance d’une nuit en hospitalisation conventionnelle était préconisée.
Le premier test de provocation oral (TPO1), réalisé à l’inclusion, a permis de confirmer le diagnostic d’allergie à l’arachide et de définir la dose cumulée réactogène
(DCR) exprimée en mg d’arachide ainsi que le type de réaction évalué par un score de sévérité clinique exprimé en six grades de 0 (aucun symptôme) à 5 (symptômes sévères respiratoires et/ou cardiovasculaires). (Tableau 1)[28]
Score Symptômes 0 Pas de réaction
1 Douleur abdominale isolée, disparaissant sans traitement ; rhino-‐conjonctivite ; légère urticaire (<10 papules) ; poussée d’eczéma
2 Un organe impliqué : douleur abdominale nécessitant un traitement ; urticaire généralisée ; angio-‐œdème non laryngé ; toux ou chute de DEP < 20%
3 Deux organes impliqués
4 Trois organes impliqués ou asthme nécessitant un traitement ou angio-‐œdème laryngé ou chute tensionnelle
5 Symptômes nécessitant une hospitalisation en soins intensifs
Tableau 1: Score de sévérité clinique de l’allergie à l’arachide d’après Moneret-‐Vautrin.
2-‐ Immunothérapie orale
Le protocole d’immunothérapie orale à l’arachide, déjà évoqué lors des consultations précédant l’indication du TPO, était proposé au décours du TPO1. L’ITO était débutée dans les jours suivants ou au plus tard dans le mois suivant le TPO1. L’information et le consentement de l’enfant et des parents étaient obligatoires. Une réévaluation à un an d’intervalle était réalisée selon les mêmes conditions et selon la même méthode (TPO2). La seule différence concernait les doses de cacahuète administrées : le premier palier était de 100 mg. Parfois, il pouvait être poussé à une dose cumulée plus élevée que 9441 mg en rajoutant une dose supplémentaire de 5 grammes. Le TPO est l’élément majeur du suivi sous traitement.
L’échec de l’ITO était défini par un arrêt définitif de la prise d’arachide qu’elle qu’en soit la cause. L’efficacité de l’ITO était définie par une augmentation de la DCR et/ou une amélioration du score de sévérité clinique.
Le choix de la dose initiale du protocole d’immunothérapie orale à l’arachide se base sur le seuil réactogène (SR) de l’enfant déterminé par le TPO1. La phase d’induction est débutée au 1/10ème de la dose tolérée. Les formes d’arachide utilisées étaient soit des
biscuits soufflés à l’arachide de type CURLY® (équivalant à environ 100 mg d’arachide native), soit une friandise chocolatée à la cacahuète de type M&M’S® (équivalant à environ 600 mg d’arachide native).[29],[30] Les quantités d’arachide étaient ensuite augmentées par paliers tous les quinze jours, sans dépasser le seuil réactogène initial. Cette dose maximale atteinte était maintenue (phase de maintenance). La famille et l’enfant étaient prévenus de la nécessité de la prise très régulière théoriquement
quotidienne. Cette prise s’effectuait le soir au retour de l’école pour permettre la surveillance à domicile de l’enfant par sa famille. La trousse d’urgence devait être disponible avec prescription systématique d’adrénaline auto injectable. Les facteurs potentiels de rupture de tolérance favorisant des évènements indésirables étaient expliqués également à l’enfant et à sa famille. En cas d’épisode infectieux, de période d’exposition pollinique chez les allergiques au pollen, de stress important, ou effort physique important, de prise de certains médicaments, la prise devait être décalée ou diminuée transitoirement sans être arrêtée de manière prolongée. Chez les patients asthmatiques, l’asthme devait être parfaitement contrôlé avec une épreuve respiratoire fonctionnelle normale avant le début de l’ITO. Pendant la phase initiale de l’immunothérapie, le régime d’éviction restait par ailleurs de mise. Il était demandé que tout effet indésirable soit notifié au médecin responsable pour réévaluation du protocole. L’ITO était poursuivie et adaptée après le TPO2.
3-‐ Suivi des patients
Le suivi des paramètres de sensibilisation était réalisé par tests cutanés en prick (extrait commercial laboratoires STALLERGENES® et/ou test avec cacahuète native). Les tests cutanés étaient réalisés par une infirmière lors des consultations. Un test cutané supérieur à 3 millimètres était considéré comme positif.
Le dosage sanguin des IgE spécifiques de l’arachide (f13) a été réalisé par la méthode Thermo Fischer® permettant une évaluation quantitative entre 0.1 et 100 kU/L. De même, un des principaux composants allergéniques, l’Ara h2 (f423), était évalué systématiquement et quand il était positif lors des bilans initiaux, l’Ara h9 (f427).
Le bilan était effectué avant le TPO1 puis lors des consultations de suivi et en particulier au moment du TPO2.
4-‐ Analyse statistique
Le logiciel R a été utilisé pour l’analyse statistique. L'évolution de la dose cumulée réactogène et l’évolution du score de sévérité clinique entre le début et la fin du protocole d’immunothérapie orale ont été analysés par un test t de student de comparaison de moyennes sur séries appariées, il en a été de même pour l'évolution des taux d’IgE spécifiques à l’arachide et des tests cutanés. L’impact du type de recrutement et du sexe a été évalué par un test de Chi 2. Les différences ont été considérées significatives lorsque p était inférieur à 0,05.
RESULTATS
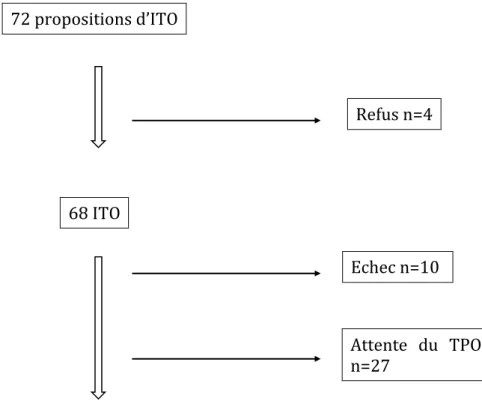
Parmi les 72 enfants à qui une l’ITO a été proposée sur une période de 6 ans, 68 l’ont accepté, 10 enfants n’ont pas poursuivi le protocole jusqu’au TPO2. Vingt-‐sept patients n’ont pas encore réalisé leur TPO2 et 31 enfants ont pu être analysés avec le protocole complet. (Figure 1)
72 propositions d’ITO 68 ITO
Figure 1 : Diagramme de flux des patients inclus dans l’étude.
Refus n=4
Echec n=10
Attente du TPO2 n=27
Le nombre d’enfants, à qui a été proposé l’immunothérapie, a régulièrement augmenté depuis sa mise en place aux HPNCL en 2010 comme rapporté dans la figure 2.
Figure 2 : Répartition des propositions d’ITO à l’arachide par année.
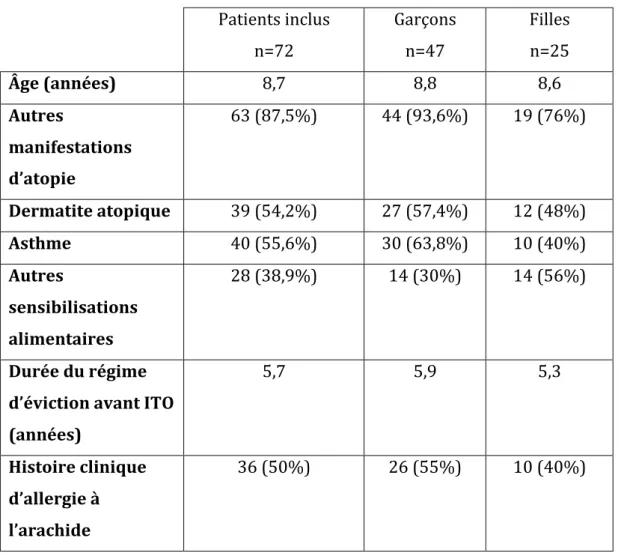
L’âge moyen au début du traitement des 72 enfants était de 8,7 ans (5,7-‐10,5). Le sex ratio était de 25 filles pour 47 garçons. D’autres manifestations rattachables au terrain atopique étaient présentes dans 87,5% des cas dont 54,2% de dermatite atopique et 55,6% d’asthme à composante allergique. Dans 38,9% des cas, une autre sensibilisation alimentaire était associée. La durée moyenne du régime d’éviction avant ITO était de 5,7 ans (2,1-‐7,9). La moitié des enfants avaient présenté une histoire clinique d’allergie à l’arachide avant que le TPO ne confirme leur statut d’allergique alimentaire. Seulement la moitié des enfants avaient présenté une histoire clinique d’allergie à l’arachide avant que le TPO ne confirme chez tous le statut d’allergique
alimentaire. (Tableau 2) 0 2 4 6 8 10 12 14 16 18 2010 2011 2012 2013 2014 2015 2016
En effet, comme souvent en pédiatrie la moitié de nos patients présentait un test cutané positif pour l’arachide dans le cadre du bilan d’une dermatite atopique ou d’une autre allergie alimentaire à un âge où ils n’avaient jamais consommé de dérivés de cacahuètes. Ils n’étaient que sensibilisés mais un régime de prévention secondaire avait été mis en place. Pour l’autre moitié, le test cutané confirmait une histoire clinique d’allergie à l’arachide. Il n’y avait pas de différence significative entre ces deux types de recrutement en terme de sévérité clinique ou de dose cumulée réactogène lors du TPO1. L’âge, la durée du régime d’éviction, et le mode de recrutement n’était pas différent entre les deux sexes.
Patients inclus n=72 Garçons n=47 Filles n=25 Âge (années) 8,7 8,8 8,6 Autres manifestations d’atopie 63 (87,5%) 44 (93,6%) 19 (76%) Dermatite atopique 39 (54,2%) 27 (57,4%) 12 (48%) Asthme 40 (55,6%) 30 (63,8%) 10 (40%) Autres sensibilisations alimentaires 28 (38,9%) 14 (30%) 14 (56%)
Durée du régime d’éviction avant ITO (années) 5,7 5,9 5,3 Histoire clinique d’allergie à l’arachide 36 (50%) 26 (55%) 10 (40%)
Les 10 échecs d’ITO s’étaient presque toujours à une exception près révélés précocement lors de la phase d’acquisition de tolérance, en moyenne à 3,9 semaines (0,2-‐6,9) du début de l’ITO. Cinq enfants ont arrêté à cause d’un refus brutal d’ingestion ou d’un dégoût impossible à surmonter. Les 5 autres échecs faisaient suite à des effets secondaires : prurit buccal, urticaire, douleur abdominale, nausée, rhinite et toux.
! ! Tabl ea u! 3! :!Ca ra ct érist iqu es! des! pa tient s! en! échec! d’ ITO .! ! 1! 2! 3! 4! 5! 6! 7! 8! 9! 10 ! Â ge $( an s) $ $ 11 ! 5,5 ! 15,1 ! 5,7 ! 9! 9,2 ! 9! 11 ! 6,5 ! 7,5 ! Sexe $ $ F! F! M ! M ! M ! M ! M ! F! F! M ! D CR $T PO 1$ (m g) $ 9441 ! 691 ! 9441 ! 4441 ! 941 ! 9441 ! 941 ! 1941 ! 1941 ! 1941 ! Sévérité$c lin ique$ TPO1 $ ! 4! 1! 2! 2! 2! 1! 4! 4! 2! 2! T est $c ut an é$ (mm) $ 15 ! 11 ! 8! 6! 9! 10 ! 24 ! 14 ! 8! 8! IgE $arac hide$ (f13) $ >100 ! 9,62 ! 12,1 ! 17,2 ! 83,6 ! 0,91 ! 4,05 ! 92,8 ! 5,19 ! 60 ! Ar aH2$(f423) $ $ >100 ! 7,21 ! 10,8 ! 22,6 ! 32 ! 0,72 ! 5,78 ! 38,2 ! 2,14 ! 52,3 ! Du rée$ IT O $ (se m ai ne s) $ 11 ! 3! 1! 1! 3! 8! 1! 3! 4! 1! Ca use s$ Prurit !b uccal !;! dou leu rs! ab do mi na le s! Refus ! Dég oû t! Refus ! Trop! cont raignant ! Prurit !b uccal !;! ur ticair e! Rhinite !;! to ux ! Na usée ! Dég oû t! Dég oû t!;! nausée !
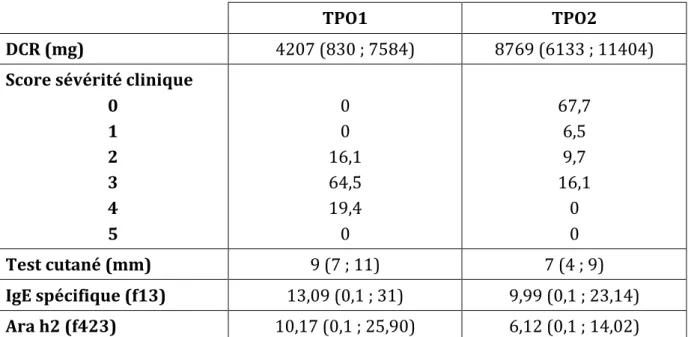
Les caractéristiques de l’évolution clinique et biologique, des 31 patients ayant bénéficié du second TPO, sont rapportées dans le Tableau 4.
TPO1 TPO2
DCR (mg) 4207 (830 ; 7584) 8769 (6133 ; 11404)
Score sévérité clinique 0 1 2 3 4 5 0 0 16,1 64,5 19,4 0 67,7 6,5 9,7 16,1 0 0 Test cutané (mm) 9 (7 ; 11) 7 (4 ; 9) IgE spécifique (f13) 13,09 (0,1 ; 31) 9,99 (0,1 ; 23,14) Ara h2 (f423) 10,17 (0,1 ; 25,90) 6,12 (0,1 ; 14,02)
Tableau 4 : Évolution clinique et biologique entre le TPO1 et TPO2 chez 31 patients. (TPO1 : test de provocation oral initial ; TPO2 : test de provocation oral à 1 an ; DCR : dose cumulée réactogène ; mg : milligramme ; f13 : Immunoglobuline E vis-‐à-‐vis de l’arachide (kU/l) ; f423 : dosage sérique du composant allergénique)
Le TPO2 a été réalisé après une durée médiane d’ITO de 1,4 ans (0,9-‐2,7). Le délai moyen de la phase d’acquisition de tolérance était de 3,5 mois (3,1-‐4,2). La dose moyenne d’arachide lors de la phase de maintenance était de 2250 mg (448 ; 4052). La DCR sous ITO lors du TPO2 a montré une augmentation significative (p<0,001), avec un doublement de la DCR initiale. L’efficacité de l’ITO était de 75%. Un seul sujet a vu sa DCR diminuer passant de 1941 mg à 936 mg sous ITO dans un contexte d’observance aléatoire. (Tableau 5 et Figure 2)
! Tabl ea u! !5 !:!R és ul ta ts !d es !d if fé re n ts !p ar am èt re s!m es ur és !c he z!3 1! pa ti ent s! lo rs !d es !TPO 1! et !TPO 2. !( D C R !:!d os e!c um ul ée !r éa ct iv e! ;!m g! :!m ill ig ra m m e! ;!T C !:!t es t!c ut an é! ;! ND !:!d on n ée !m an qu an te )! ! TP O 1 % TP O 2 % ! DC R %( m g) % Sc o re% cl in iq u e% TC % Ig E %( f1 3 )% Ar a% h 2 %( f4 2 3 )% DC R %( m g) % Sc o re% cl in iq u e% TC % Ig E %( f1 3 )% Ar a% h 2 %(f 423) % 1" 2" 3" 4" 5" 6" 7" 8" 9" 10" 11" 12" 13" 14" 15" 16" 17" 18" 19" 20" 21" 22" 23" 24" 25" 26" 27" 28" 29" 30" 31"! 1941 " 691 " 4441 " 1941 " 1941 " 9441 " 941 " 9441 " 9441 " 9441 " 9441 " 4441 " 4441 " 9441 " 1941 " 9441 " 1941 " 1941 " 4441 " 4441 " 1941 " 941 " 9441 " 941 " 941 " 941 " 4441 " 1941 " 941 " 1941 " 4441 " ! 3" 3" 3" 3" 3" 3" 3" 3" 3" 3" 3" 3" 3" 2" 2" 3" 2" 3" 4" 3" 3" 4" 2" 4" 4" 3" 3" 2" 3" 4" 4"! 8" 8" 14" 12" 6" 6" 8" 13" 9" 6" 8" 8" 9" 8" 8" 9" 10" 14" 10" 6,5" 6" 10" 9" 10" 8" "11 10" 10" 10" 12" 12"! 0, 73 " 1, 05 " 6, 86 " 2, 65 " 2, 53 " 9, 41 " 34, 1" 5, 16 " 88, 8" 20, 1" 3, 02 " 6, 2" 38, 4" 0, 92 " 18, 3" 16, 1" 19, 1" 13, 8" 4, 5" 43, 5" 8, 17 " 3, 77 " 2, 93 " 5, 13 " 14, 6" 2, 72 " 2, 74 " 3, 56 " 1, 69 " 7, 92 " 17, 3" ! 0, 27 " 1, 21 " 1, 32 " 2, 06 " 1, 67 " 7, 45 " 21, 8" 4, 3" 56, 5" 70 " 1, 39 " 6, 56 " 11, 5" 1, 44 " ND " 13 " 16, 2" 10, 4" 3, 05 " 22, 5" 6, 11 " 2, 71 " 2, 78 " 6, 82 " 7, 53 " 3, 41 " 2, 72 " 2, 73 " 1, 21 " 2, 42 " 14, 1" ! 9350 " 9441 " 9441 " 9441 " 9441 " 9441 " 9441 " 9441 " 9441 " 9441 " 9441 " 12250 " 11500 " 14250 " 9350 " 9441 " 9350 " 936 " 9250 " 4441 " 9250 " 6850 " 9441 " 4350 " 8550 " 9441 " 9441 " 9350 " 1941 " 9441 " 9250 " ! 0" 0" 0" 0" 1" 0" 3" 0" 0" 3" 0" 0" 0" 0" 1" 0" 0" 3" 0" 3" 0" 2" 0" 2" 0" 0" 0" 0" 2" 0" 3"! ND " 6" 8" 8" 3" 6" 6" 11" 7" 9" 8" 4" 6" 5" 6" 12" 5" 10" 5" 10" 4" 6" 4" 7" 6" 5" 6" 8" ND" 8" 4"! 1, 34 " 0, 48 " ND " 1, 27 " 2, 5" 7, 87 " 19, 9" 6, 34 " 15, 3" 49, 1" 1, 88 " 3, 9" 26, 2" 0, 89 " 11 " 17, 9" 13, 8" 11, 6" 2, 13 " 53 " 5, 65 " ND " 1, 93 " 2, 94 " 9, 33 " 0, 31 " 2, 38 " 1, 95 " 5, 26 " 2, 4" 11, 1" ! 0, 37 " 0, 57 " ND " 1, 33 " 1, 45 " 4, 48 " 15, 4" 7, 31 " 5" 26,1" 0,73" 3, 87 " 12, 9" 1, 15 " ND " 4, 3" 11, 5" 7, 8" 1, 05 " 33 " 3, 45 " ND " ND " 2, 84 " 4, 53 " 0, 24 " 1, 46 " 0, 63 " 4, 71 " 1, 03 " 7, 97 " !
Figure 2 : Évolution de la dose cumulée réactogène en mg (DCR) entre le TPO1 et le
TPO2 pour chaque patient.
Le score de sévérité clinique mesuré lors des deux TPO diminuait significativement (p<0,001). En effet, 64,5% des patients avaient un score évalué à 3 lors du TPO1 tandis que 21 patients (67,7%) ne présentaient aucun symptôme lors du TPO2. Quatre patients avaient nécessité un recours à un traitement par adrénaline lors du TPO1. Aucun patient n’avait nécessité ce traitement au cours du TPO2.
La diminution des concentrations sériques des IgE spécifiques vis-‐à-‐vis de l’arachide (f13) n’était pas significative (p=0,21). En revanche on observait une tendance
0 2000 4000 6000 8000 10000 12000 14000 DCR TPO1 DCR TPO2
statistique pour le dosage sérique du composant allergénique Ara h2 (p=0,06) avec une diminution moyenne de 4,05 kU/l.
Les tests cutanés montrait une diminution significative sous ITO (p<0,001) passant de 9 à 7 mm. Aucun patient n’avait négativé son test cutané à l’arachide.
Onze patients (35,5%) ont présenté des effets secondaires minimes (dégoût alimentaire, prurit buccal, douleur abdominale légère) lors de la phase d’induction. Aucun accident allergique grave (nécessitant une injection d’adrénaline) sous ITO n’était rapporté.
DISCUSSION
L’ITO à l’arachide est une thérapeutique étudiée depuis un peu moins de 10 ans sur une dizaine d’articles mais avec une hétérogénéité des patients inclus dans les études (pays, âge, durée du traitement, nombre de patients, sévérité).
Les résultats de l’immunothérapie orale à l’arachide montrent une efficacité de 60 à 100% selon les études. (Tableau 6) [31],[32],[33],[28],[34],[35],[36] Toutes ces études sont pédiatriques. Les seuils de tolérance atteignent jusqu’à 25 grammes d’arachide soit de 25 à 40 graines de cacahuètes. Notre seuil de tolérance espéré est d’une dizaine de grammes. Ces seuils permettent à l’enfant d’améliorer sa qualité de vie (et celle de ses parents). Outre l’hétérogénéité des groupes de patients, les protocoles sont loin d’être uniformes quant au type d’extrait d’arachide utilisé et aux schémas de montée de doses.
L’administration d’arachide est réalisée, soit sous forme de farine d’arachide (FA) contenant environ 50% de protéine d’arachide, soit sous forme d’arachide grillée (AG) contenant environ 25% de protéine d’arachide. Deux de nos patients ont des mères dont le métier leur a permis la pesée précise des doses d’ arachide comme dans les protocoles de recherche et notamment le protocole de Nancy et d’Épinal.[28] Notre protocole utilise de l’arachide grillée par le biais de préparations commerciales facilement disponibles. On note également un côté ludique non négligeable ainsi qu’un impact psychologique positif.
! Sujets ! Ag e! (a nnées) ! Al ime nt s! utilis és ! An ap hy la xi e! Type!d’ét ude ! Lieu !et !du rée! du ! pr otocole ! Ef ficacité ! Dose! at tein te! (g!d’a ra chide) ! Ef fets ! indésira bl es ! Ad ré na lin e! Clark&et&al,& 2009&(UK )& 4! 12,5 ! FA ! Inclus ! Ouve rte ! Au g! do se s/!2 !s em !(H) ! Mai nte nanc e! :!6! sem ! 100% ! 15,6! g! Lég ers! à! mo dé ré s! 0! Jo ne s& et &a l,& 2009&(USA) & 39 ! 4,8 ! FA ! Exclus ! Ouve rte ! Rush!1j!(H )! Au g! do se s! /! 2! se m ! Mai nte nanc e! :!1! an ! 69% ! 15 !,6!g ! Peu!fréquent ! 2! Blumc he n&e t& al,&2010& (A lle m agn e) & 23 ! 5,6 ! AG ! Inclus ! Ouve rte ! Rush!7j!(H )! Au g! do se s! /! 2! se m ! Mai nte nanc e! :!8! sem ! 60% ! 4! g! Lég ers! à! mo dé ré s! 0! Mon neret ? Vautrin &et&al ,& 2010&(Fran ce )& 51 ! 9,5 ! AG ! Inclus ! Ouve rte ! D omi ci le ! Selon!pr ofil!17!ou!34! sem ! 92,1% ! 4! g! 16%! sévères ! 1! V ar sh ne y& et&al ,& 2011&(USA) & 28 ! 6,4 ! FA ! Exclus ! Ra nd omi sé ! cont re! placebo ! Au g! do se s! /!2 !s em! (H) ! Mai nte nanc e! :!4! sem ! 100% ! 5! g! Lég ers! à! mo dé ré s! 0! A na gn ost ou &e t& al,&2011&(UK )& 22 ! 11 ! FA ! Inclus ! Ouve rte ! Au g! do se s/!2 !s em !(H ! Mai nte nanc e! :!34! sem )! 86% ! 12! g! Lég ers! à! mo dé ré s! 0! A na gn ost ou &e t& al,&2014&(UK )& 99 ! 11,9 ! FA ! Inclus ! Ra nd omi sé ! cont re! placebo ! Au g! doses !en!15!j !(H) ! Mai nte nanc e! :!26! sem ! 62 % ! 5,6! g! Lég ers! à! mo dé ré s! 1! Ch almin &et&al ,& 2016 &( Fran ce )& 31 ! 8,1 ! AG ! Inclus ! Ouve rte ! D omi ci le ! Au g! do se s/ 2! se m ! Mai nte nanc e! :!1,5! ans ! 75 % ! 7,8 !g ! Lég ers! à! mo dé ré s! 0! ! Tabl ea u! 6! :!Différen tes! ét udes! d’ ITO !à !l’ ara chide .!(F A! :!fa rine! d’ ara chide !;! AG !:! ara chide! gril lée !;! Au g! :!a ug me nt at io n! ;!(H) !:! en! hospit al isa tion !;! sem !:! se ma in e! ;!g !:! gr amme s) !
Ce type d’approche permet une accessibilité par tous les patients et la possibilité d’une utilisation en pratique clinique courante. La notion d’équivalences allergéniques est connue par la plupart des pédiatres allergologues en France, selon les travaux de Castelain et al à l’hôpital Saint-‐Vincent de Paul de Lille.[37]
L’approche plus standardisée proposée à Nancy par Moneret-‐Vautrin et al, propose un protocole d’ITO adapté en fonction du seuil de réactivité et du profil allergique des patients.[28] La durée de la phase d’induction est variable de 17 ou 34 semaines. L’augmentation des doses se fait au domicile avec de l’arachide grillée pesée en milieu hospitalier, que la famille vient retirer périodiquement à l’hôpital, pour atteindre la dose de 4 grammes d’arachide. Cette disponibilité des extraits uniquement hospitalière est probablement un facteur astreignant qui pourrait être limitatif dans la vraie vie. Une solution élégante sera peut être apportée par la mise à disposition de gélules « médicaments » de cacahuète à différents dosages comme cela doit être étudié dans un protocole de recherche allemand évoqué cette année lors du congrès annuel de l’EAACI (European Academy of Allergy and Clinical Immunology) à Vienne.
Le lieu où les paliers d’allergènes sont augmentés diffère également, avec notamment des temps hospitaliers (rush, semi rush ou paliers). Nous avons pris le parti là encore pratique d’effectuer les montées de dose à domicile avec comme seul temps hospitalier les jours de réalisation des TPO.
La durée de la phase de maintenance varie de quelques semaines à plus de 1 an, mais aucune étude ne donne de résultats au delà de 1 an. De même, l’étude remarquable STOP II d’Anagnostou et al, publiée en 2014 ne se déroule que sur 1 an. C’est un essai contrôlé randomisé contre placebo, incluant 99 enfants de 7 à 16 ans.[36] Dans le groupe actif, l’augmentation des doses est réalisée jusqu’à 800 mg de protéine d’arachide en quinze jours. À 6 mois, 62% des sujets sont tolérants à 1400 mg de
protéine d’arachide dans le groupe actif et aucun dans le groupe placebo. Un évènement indésirable nécessitant une injection adrénaline est décrit.
Les mécanismes sous jacents de l’ITO reposent sur l’équilibre de la balance lymphocytaire TH1/TH2. La tolérance immunitaire tend vers une augmentation des cytokines TH1 (IL10) et une réduction des cytokines TH2.[33] La diminution des IgE spécifiques et l’augmentation des IgG4 spécifiques sont observées.[28] Une ascension initiale des IgE dans les premiers mois de l’ITO est couramment observée. Au cours de l’ITO, la réactivité des basophiles (CD63+) est diminuée lors du test d’activation des basophiles.[32] Dans notre étude, seuls les dosages d’IgE spécifiques ont été effectués en routine. Le composant allergénique Ara h2 paraît être un meilleur marqueur de suivi que l’IgE à l’arachide (f13). Nous n’avons que peu souvent constaté, chez nos patients, l’augmentation classique des IgE en début d’ITO probablement par l’espacement de la première consultation de suivi. Nous n’avons pas d’explication pour le caractère non significatif des baisses d’IgE spécifiques. Même si, avec des réévaluations sur une durée plus longue de l’ITO, cette différence deviendrait probablement significative.
À l’inverse, la réactivité cutanée à l’arachide appréciée par les pricks tests diminue significativement. Ils gardent une place prépondérante dans le suivi, notamment par leur accessibilité. On garde toujours l’espoir qu’ils puissent avec le temps se négativer comme on le voit souvent en pédiatrie pour les allergiques aux protéines de lait de vache guéris.
En accord avec la littérature, les arguments de diminution de réactivité in vivo par les tests cutanés et in vitro par les IgE spécifiques ne vont pas jusqu’ à une extinction de la sensibilisation à l’arachide même pour les premiers enfants inclus ayant bénéficié de plusieurs années d’immunothérapie orale.