Étude de l'impact des gras laitiers sur la capacité
des lipoprotéines de haute densité à stimuler
l'efflux de cholestérol
Mémoire
Didier Brassard
Maîtrise en nutrition
Maître ès sciences (M. Sc.)
Québec, Canada
© Didier Brassard, 2017
Étude de l'impact des gras laitiers sur la capacité
des lipoprotéines de haute densité à stimuler
l'efflux de cholestérol
Mémoire
Didier Brassard
Sous la direction de :
Benoit Lamarche, directeur de recherche
Patrick Couture, codirecteur de recherche
III
Résumé
Diminuer la teneur en acides gras saturés (AGS) dans l'alimentation est une recommandation nutritionnelle classique, puisque les AGS augmentent les concentrations de cholestérol des lipoprotéines de faible densité (LDL-C). Les produits laitiers à plus faible teneur en gras sont donc souvent recommandés afin de limiter l'apport en AGS. Or, les AGS provoquent aussi une hausse du
cholestérol des lipoprotéines de haute densité (HDL-C) qui est associé à un plus faible risque de maladies cardiovasculaires (MCV). Néanmoins, un rôle causal du HDL-C dans le développement des MCV a été remis en question dans de récentes études contrôlées. Par contre, une mesure de fonctionnalité des HDL, telle la capacité d'efflux de cholestérol (CEC), pourrait apporter une information supplémentaire quant au rôle des HDL sur les MCV. Ainsi, notre groupe de recherche a entrepris l'étude de l'impact des gras laitiers sur la CEC stimulée par les HDL (CEC-HDL) afin de clarifier l'influence des AGS sur les HDL. Nos résultats ont montré que la source alimentaire des AGS influence cette mesure de
fonctionnalité: une diète riche en AGS du beurre a provoqué une plus grande augmentation de la CEC-HDL qu'une diète riche en AGS du fromage. De plus, les effets des gras alimentaires sur la CEC-HDL ont été modulés par le sexe. La diète riche en AGS du beurre a augmenté la CEC-HDL chez les hommes seulement, tandis qu'une diète riche en gras mono-insaturés a augmenté la CEC-HDL
seulement chez les femmes. Finalement, nous avons aussi trouvé une association entre l'augmentation du LDL-C et l'augmentation de la CEC-HDL en réponse à la diète « beurre » chez les hommes suggérant un certain mécanisme
IV
Abstract
Reducing saturated fatty acids (SFA) in the diet is a common nutritional guideline, because SFA raise low-density lipoprotein cholesterol (LDL-C) concentrations. Low-fat dairy products are often preferred to lower SFA intake. SFA also increase high-density lipoprotein cholesterol (HDL-C) associated with a lower risk of
cardiovascular disease (CVD). However, recent controlled studies indicated that HDL-C may not have a causal relationship with CVD. On the other hand, a
measure of functionality, as is the cholesterol efflux capacity (CEC), could provide additional information on the role of HDL in CVD. Thus, our group began the study of the effects of dairy fats on HDL-mediated CEC (HDL-CEC) to clarify the effects of SFA on HDL. Our results showed that the SFA food source affects this
functionality: a diet rich in SFA from butter increased HDL-CEC more than a diet rich in SFA from cheese. Additionally, gender seemed to modify the effects of dietary fats on HDL-CEC. The butter-rich diet increased HDL-CEC in men only, while a diet rich in monounsaturated fats increased HDL-CEC in women only. Finally, we also found an association between the increase in LDL-C and the increase in HDL-CEC after the butter-rich diet on men, suggesting a compensatory mechanism.
V
Table des matières
Résumé ... III Abstract ... IV Table des matières ... V Liste des tableaux ... VII Liste des figures et illustrations ... VIII Liste des abréviations et sigles ... IX Avant-Propros ... XI
Chapitre 1. Introduction générale ... 1
Chapitre 2. Problématique des MCV ... 3
2.1 Développement de l'athérosclérose et rôle des macrophages ... 3
2.2 Facteurs de risque ... 4
2.2.1 Non modifiables ... 4
2.2.2 Modifiables ... 5
Chapitre 3. Rôle des HDL ... 6
3.1 Caractérisation des HDL ... 6
3.2.1 Lien avec les autres lipoprotéines ... 7
3.2.3 HDL-C et MCV ... 8
3.3 Sous-classes et charge des HDL ... 9
3.3.1 Évaluation des sous-classes et de la charge ... 9
3.3.3 Sous-classes, charge et MCV ... 10
3.4 Impact des gras alimentaires sur les caractéristiques physiques des HDL .... 12
3.4.1 Alimentation et HDL-C ... 12
3.4.2 Alimentation et sous-classes de HDL ... 12
3.5 Conclusion sur le rôle des HDL ... 14
Chapitre 4. Rôle de l'efflux de cholestérol ... 16
4.1 Sommaire du RCT ... 16
4.2 Voies de mouvement du cholestérol ... 19
4.2.1 Transporteurs membranaires de cholestérol ... 19
4.2.2 Contribution quantitative des voies de mouvement ... 19
4.2.3 Substrats préférentiels des transporteurs membranaires ... 20
4.3 Évaluation de la CEC ... 23
4.3.1 Potentiel de l'accepteur ... 23
4.3.2 Potentiel du donneur ... 25
4.4 CEC, MCV et MCAS ... 26
4.4.1 Mesure de la CEC en prévention primaire ... 26
4.4.2 Mesure de la CEC en prévention secondaire ... 27
4.5 Impact de l'alimentation sur la CEC ... 30
4.5.1 AGS alimentaires et CEC ... 31
4.5.2 Teneur en gras de la diète et CEC ... 35
4.5.3 Gras mono-insaturés ... 36
4.5.4 Autres aliments ... 37
4.6 Conclusion sur le rôle de l'efflux de cholestérol ... 43
Chapitre 5. Objectifs et hypothèses ... 45
VI
5.2 Hypothèse de recherche ... 45
Chapitre 6. Étude de l'impact des gras saturés laitiers sur la capacité d'efflux de cholestérol stimulée par les lipoprotéines de haute densité ... 46
EFFECTS OF SATURATED FAT FROM DIFFERENT DAIRY FOODS ON HDL-MEDIATED CHOLESTEROL EFFLUX CAPACITY: A RANDOMIZED CONTROLLED TRIAL ... 46
Résumé ... 47
Abstract ... 48
Abbreviations ... 49
Introduction ... 50
Materials and Methods ... 52
Study design and population ... 52
Diets ... 52
Blood sampling ... 53
HDL isolation ... 53
HDL composition and apolipoprotein A1 ... 53
Mean HDL size and HDL subclasses ... 54
Cholesterol efflux capacity (CEC) ... 54
Sample size calculations and statistical analyses ... 55
Results ... 57
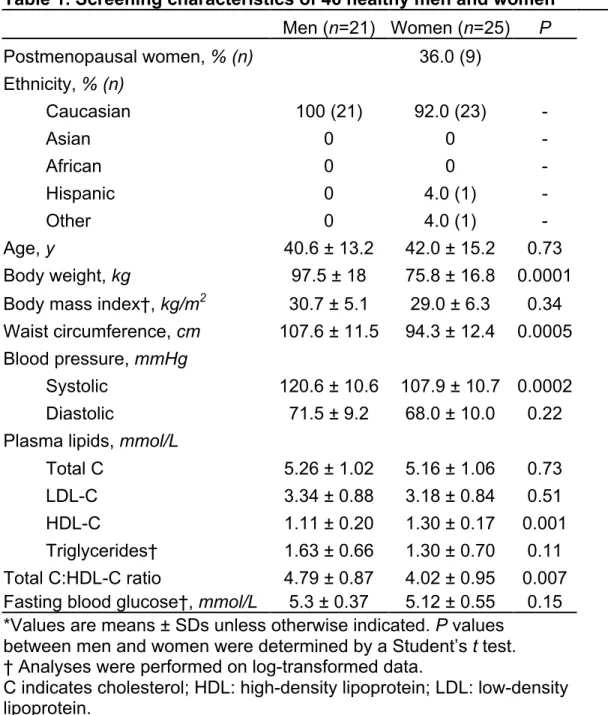
Participants characteristics ... 57
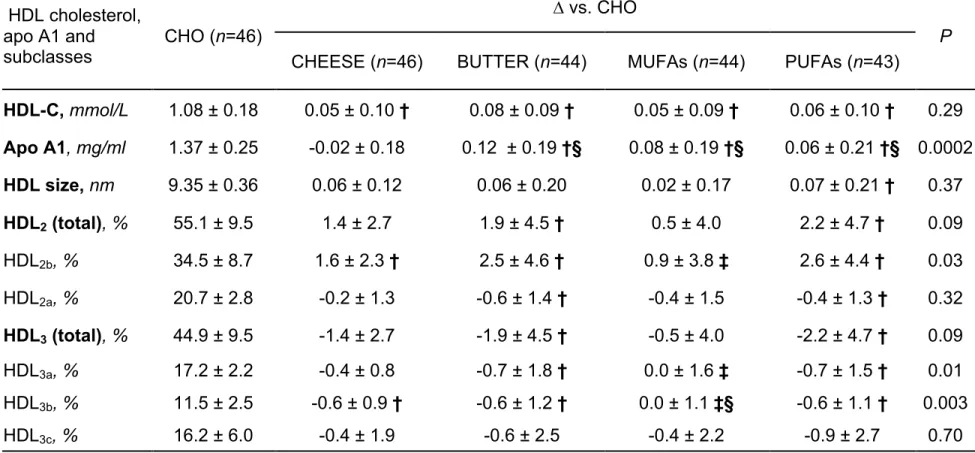
HDL cholesterol, size and subclasses ... 57
HDL composition ... 57
HDL-mediated cholesterol efflux capacity (CEC) ... 58
Discussion ... 59
Acknowledgments ... 64
References ... 66
Tables and figures ... 70
Chapitre 7. Conclusion générale ... 78
VII
Liste des tableaux
Tableau 1 Classification des HDL selon leurs propriétés physiques ... 15 Tableau 2 Voies de mouvement du cholestérol pertinentes chez l'humain ... 22 Tableau 3 Donneurs et accepteurs de cholestérol utilisés pour la mesurer la CEC ... 25 Tableau 4 Sélection d'études évaluant l'association entre la CEC et le risque de MCV .... 29 Tableau 5 Sommaire des études évaluant les effets de gras alimentaires sur la CEC ... 40
VIII
Liste des figures et illustrations
Figure 1 Relation entre les TG du plasma et le HDL-C ... 7 Figure 2 GGE sur une dimension ... 9 Figure 3 Transport inverse du cholestérol et (CEC) ... 18 Figure 4 Importance relative des fractions de HDL dans l'efflux de cholestérol par
IX
Liste des abréviations et sigles
ABCA1: ATP-Binding cassette sous famille A membre 1 ABCG1: ATP-Binding cassette sous famille G membre 1 ABCG5: ATP-Binding cassette sous famille G membre 5 ABCG8: ATP-Binding cassette sous famille G membre 8 ACAT: acyl-coenzyme A:cholestérol ester transférase AGS: acides gras saturés
AMPc: adénosine monophopshate cyclique Apo : apolipoprotéine
ATP: adénosine triphopshate C: cholestérol
CEC: capacité d'efflux de cholestérol
CETP: protéine de transfert des esters de cholestérol CPM: compte par minute
CHO: glucides CoA: coenzyme A
GGE: électrophorèse sur gel non dénaturant à gradient de concentration HDL: lipoprotéines de haute densité
HDL-P: particules HDL HMG: hydroxyméthylglutaryl HTA: hypertension artérielle IC: intervalle de confiance
IDL: lipoprotéines de densité intermédiaire IMC: indice de masse corporelle
LH: lipase hépatique LIP: lipides
LCAT: lécithine-cholestérol acyltransférase LDL: lipoprotéines de faible densité
MCAS: maladie cardiovasculaire athérosclérotique MONO: acides gras monoinsaturés
NA: non applicable PL : phospholipides
POLY: acides gras polyinsaturés PRO: protéines
RCT: transport inverse du cholestérol R-LDL: récepteur LDL
SR-B1: scavenger receptor classe B membre 1 TG: triglycérides
VLDL: lipoprotéines de très faible densité ↑: augmentation
X ø: aucun ∆: changement ?: inconnu
XI
Avant-Propros
Ce mémoire est le sommaire de mes lectures, de mes apprentissages et de ma participation à un projet de recherche de grande envergure à l'Institut sur la Nutrition et les Aliments Fonctionnels depuis presque deux ans. J'ai eu l'opportunité de participer à toutes les étapes de réalisation du projet de recherche allant du recrutement, aux manipulations en laboratoire, à la présentation de résultats en congrès jusqu'à la rédaction d'un article scientifique comme auteur principal. J'ai également contribué à la rédaction de trois articles scientifiques en tant que coauteur, en plus de celui qui est présenté dans ce mémoire. Ces expériences m'ont aussi permis de développer une véritable passion pour la recherche. Je remercie mon directeur de maîtrise, Dr Benoît Lamarche, de m'avoir accueilli dans son équipe et de cette opportunité incroyable qu'il m'a offerte. Sans lui, je n’aurais probablement jamais entrepris d’études supérieures. Je remercie également toutes (le féminin tend à l'emporter en nutrition!) mes collègues, étudiantes et professionnelles de recherche que j'ai côtoyées durant ma maîtrise. Votre aide me fut indispensable.
L'article inclus dans ce mémoire porte sur l'effet de gras laitiers sur une étape du transport inverse du cholestérol impliquant les lipoprotéines de haute densité: l'efflux de cholestérol. L'article sera prochainement envoyé aux coauteurs (Benoit Arsenault, Marjorie Boyer, Daniela Bernic, Maude Tessier-Grenier, Angelo Tremblay, Emile Levy, Peter JH Jones, Patrick Couture et Benoît Lamarche) pour obtenir leurs commentaires, procéder à une révision et le soumettre à un journal scientifique. L'implication de chacun des auteurs est la suivante: BL, PJ, AT, El et PC ont construit le protocole et obtenu le financement. PC était responsable de l'évaluation et de la supervision médicale des participants de l'étude. MTG et moi avons contribué à la coordination de l'intervention clinique. MB, BA et moi avons réalisé les manipulations de laboratoire pour mesurer l'efflux de cholestérol. J'ai réalisé les analyses statistiques et écrit la première version du manuscrit. Finalement, BL a révisé le manuscrit. Bonne lecture!
1
Chapitre 1. Introduction générale
L'athérosclérose peut être définie comme «[...] a chronic inflammatory disease that arises from an imbalance in lipid metabolism and a maladaptive immune response driven by the accumulation of cholesterol-laden macrophages in the artery wall (1).»a
Le développement long et sournois de l'athérosclérose rend le diagnostic des maladies cardiovasculaires (MCV) plus difficile. Un individu atteint sera souvent asymptomatique pendant de nombreuses années, nonobstant la présence de dommages vasculaires à différents degrés. Une intervention orientée sur les habitudes de vie et le traitement des facteurs de risque sont deux avenues qui pourront être adoptées selon le risque estimé. Ainsi, l'évaluation adéquate des facteurs de risque joue un rôle clé dans la prévention et le traitement des MCV. Malgré une diminution importante de la prévalence des MCV au cours des 25 dernières années, les MCV représentent toujours un fardeau important pour la plupart des pays industrialisés (2, 3). Par exemple, il est estimé que 741 800 adultes canadiens vivaient avec les séquelles d'un arrêt vasculaire cérébral en 2012-2013 (4).
Le contenu en cholestérol des lipoprotéines de faible densité (LDL-C) est un marqueur de risque établi et couramment utilisé dans la pratique médicale pour discriminer les individus sujets aux MCV (5). En plus d'une intervention pharmacologique, diverses stratégies nutritionnelles provoquent la réduction des concentrations de LDL-C. Entre autres, une réduction des apports en acides gras saturés (AGS) dans la diète réduirait le risque de MCV (5).
Cependant, de récentes études épidémiologiques ont remis en question la présence d'un lien direct entre la consommation d'AGS et le développement des MCV (6, 7). S’ajoutent à cette controverse d'autres recherches épidémiologiques
a Traduction libre : «[...] une maladie inflammatoire chronique qui prend naissance dans un déséquilibre du métabolisme lipidique et une réponse immunitaire inappropriée stimulée par une accumulation de cellules immunitaires (macrophages) riches en cholestérol dans les parois artérielles.»
2
ayant montré que la relation entre les AGS et le risque de MCV variait selon la source alimentaire des AGS (8, 9). Spécifiquement, la consommation d’AGS laitiers a été inversement associée au risque de MCV, alors que la consommation d’AGS provenant de la viande rouge a été associée à un risque plus élevé de MCV (8). Notons que la consommation d'AGS augmente la teneur en cholestérol de diverses lipoprotéines autres que les LDL. Par exemple, les AGS augmentent le cholestérol des lipoprotéines de haute densité (HDL-C) lorsqu'ils remplacent des glucides dans la diète (10). De plus, les individus avec des concentrations plus élevées de HDL-C ont un risque de MCV diminué par rapport à ceux qui ont des concentrations plus faibles (11, 12). Par contre, le lien de cause à effet entre la concentration plasmatique de HDL-C et le risque de MCV est remis en question par de récentes études de randomisation mendélienne (13).
Ce constat n’exclut pas la possibilité qu’une mesure de fonctionnalité des HDL puisse prédire de façon plus précise le risque de MCV que la simple mesure du HDL-C (14). C’est le cas, en particulier, de la mesure de la capacité des HDL à stimuler le transport inverse du cholestérol dont la première étape est l'efflux de cholestérol, c'est-à-dire le mouvement de cholestérol hors des cellules. Très peu d'études ont évalué les effets de certains gras ou des aliments sur le transport inverse du cholestérol dont l’efflux de cholestérol est l’étape clé (15). Considérant l'effet des AGS sur les taux plasmatiques de HDL-C, il est possible que la consommation de ces gras alimentaires considérés comme néfaste pour la santé du cœur puisse en fait stimuler la capacité d'efflux de cholestérol (CEC) et ultimement le transport inverse de cholestérol (RCT).
Ainsi, nous avons entrepris l'étude de l'impact des gras saturés laitiers sur la CEC stimulée par les HDL à l'Institut sur la Nutrition et les Aliments Fonctionnels afin de clarifier le rôle potentiel des gras saturés sur la CEC. Ce mémoire est divisé en plusieurs sections. La problématique des MCV, le rôle des HDL et de l'efflux de cholestérol dans les MCV, l'étude de l'impact des gras saturés laitiers sur la CEC et une conclusion générale sont les différentes sections de ce mémoire.
3
Chapitre 2. Problématique des MCV
2.1 Développement de l'athérosclérose et rôle des macrophages
Les lipoprotéines et les macrophages ont des rôles centraux dans le développement de l'athérosclérose et des MCV. Certaines régions des vaisseaux sanguins, notamment les points de branchement et les courbures internes, sont plus susceptibles à un écoulement sanguin anormal et une «activation de l'endothélium» (1). Une activation de l'endothélium à ces endroits augmente la perméabilité aux lipoprotéines et donc la rétention des particules contenant une apolipoprotéine B (apo B) et stimule le recrutement des monocytes en circulation (1). Des facteurs externes (stress mécanique, médicament, infection) peuvent aussi provoquer une lésion dans ces endroits susceptibles et stimuler une réponse immunitaire. Bien qu'une certaine réponse immunitaire aigüe soit probablement requise pour la guérison de la lésion initiale, l'activation chronique provoquera de changements indésirables. Éventuellement, des chémokines sécrétées, entre autres, par les cellules endothéliales et les cellules musculaires lisses stimulent la migration des monocytes, des cellules de l'immunité innée, au travers de la paroi endothéliale.
Les macrophages (monocytes différenciés, à la suite du passage dans les tissus) iront ensuite phagocyter les lipoprotéines contenant de l'apo B, les LDL et les lipoprotéines de très faible densité (VLDL), dans la plaque naissante et récupèreront leur contenu en cholestérol (16). À cet effet, les «scavenger
receptors» des macrophages jouent un rôle clé dans la reconnaissance des
particules LDL. La phagocytose des particules contenant de l'apo B est la première étape vers la formation de cellules spumeuses, des macrophages saturés de cholestérol. Le cholestérol récupéré par les macrophages est métabolisé dans le réticulum endoplasmique (RE) et estérifié (17). Le cholestérol estérifié est relativement inerte, car il est isolé de la membrane cellulaire à l'intérieur du macrophage (18). Cependant, une exposition prolongée aux particules contenant de l'apo B provoquera un enrichissement de la membrane du RE en cholestérol
4
libre. Une accumulation de cholestérol libre peut devenir toxique pour les macrophages et affecter leur fonctionnement normal (1, 17). Par exemple, le cholestérol libre limite l'efficacité de la protéine permettant l'estérification du cholestérol dans le RE des macrophages, l'Acyl-Coenzyme A(CoA):cholestérol ester transférase (ACAT), et perturbe la circulation des lysosomes. Conséquemment, l'accumulation de cholestérol libre stimulera divers signaux inflammatoires (cytokines) et limitera l'efflux de cholestérol des macrophages. Lorsque cet état de surcharge en lipides (cholestérol libre) est prolongé, il peut mener à l'apoptose des macrophages. L'accumulation progressive de ces cellules nécrosées formera le centre de la plaque fibreuse des vaisseaux sanguins affectés (17). Une rupture de cette plaque fibreuse peut provoquer l'obstruction d'un vaisseau sanguin important et provoquer un évènement cardiovasculaire. Une cardiopathie ischémique est l'obstruction d'une artère du coeur et l'accident vasculaire cérébral est l'obstruction d'une artère du cerveau (19). Ces obstructions s'accompagneront de manifestations cliniques. La plaque fibreuse peut aussi obstruer en partie la lumière du vaisseau affecté, diminuer le flux sanguin et provoquer une ischémie transitoire (19). Finalement, les maladies vasculaires périphériques sont aussi une manifestation de l'athérosclérose. Ces affections provoquent rarement la mortalité, mais sont un important fardeau chronique (2).
2.2 Facteurs de risque
2.2.1 Non modifiables
Bien qu'il ne soit pas possible d'influencer ces facteurs pour réduire le risque de MCV, ils sont utiles pour le dépistage des individus à risque. L'âge (augmentation du risque avec l’âge; il s'agit du facteur de risque le plus important), le sexe (les hommes sont plus à risque que les femmes) et la présence d'antécédents cardiovasculaire chez les parents sont les principaux facteurs de risque non modifiables (20).
5 2.2.2 Modifiables
Les facteurs de risque modifiables incluent la plupart des habitudes de vie. Entre autres, une saine alimentation et la pratique d'activité physique sont deux facteurs associés à une diminution de la mortalité par une cardiopathie ischémique et par un accident vasculaire cérébral (3). Le tabagisme est un facteur de risque majeur chez les hommes (21) et les femmes (22). L'arrêt complet avant l'âge de 40 ans permet d'éviter la presque totalité de l'augmentation des risques pour la santé. Une tension artérielle élevée [ou hypertension artérielleb (HTA)], dont les déterminants seraient l'âge, l'indice de masse corporelle (IMC) et les apports en sodium, est un autre facteur qui augmente considérablement le risque de MCV (2). Le contrôle des concentrations de LDL-C est aujourd'hui l'élément central de la gestion du risque global de MCV (5) étant donné leur rôle dans l'accumulation de cholestérol et le développement des cellules spumeuses des lésions endothéliales (16, 19). Les statines, des médicaments inhibiteurs de l'hydroxyméthylglutaryl(HMG)-CoA réductase, provoquent une diminution des concentrations de LDL-C et une diminution du risque de MCV en prévention primaire ou secondaire (23), chez les individus à faible risque (24) et de façon similaire chez les hommes et les femmes (25). Finalement, il est admis qu'une diminution de 1 mmol\L des concentrations de LDL-C par une statine réduit de 20 à 22% le risque relatif de MCV (5).
D'autre part, il semble qu'un risque résiduel persiste même lors de l'atteinte de concentrations sécuritaires de LDL-C grâce à une intervention pharmacologique. Entre autres, la concentration de HDL-C demeure un facteur de risque indépendant et significativement associé à la survenue d'une MCV chez des individus traités avec une statine et ayant atteint des niveaux sécuritaires de LDL-C en prévention primaire (26) ou secondaire (27). À l’inverse du LDL-LDL-C, des concentrations plus élevées de HDL-C ont été associées dans plusieurs cohortes
b L'hypertension artérielle est communément identifiée par une tension artérielle systolique ≥140mmHg et une tension diastolique ≥90 mmHg (6).
6
prospectives à un plus faible risque de MCV (12). Ainsi, cette association protectrice a stimulé l'intérêt pour des traitements favorisant l'augmentation du HDL-C et l'étude du rôle de HDL dans le risque de MCV.
Chapitre 3. Rôle des HDL
3.1 Caractérisation des HDL
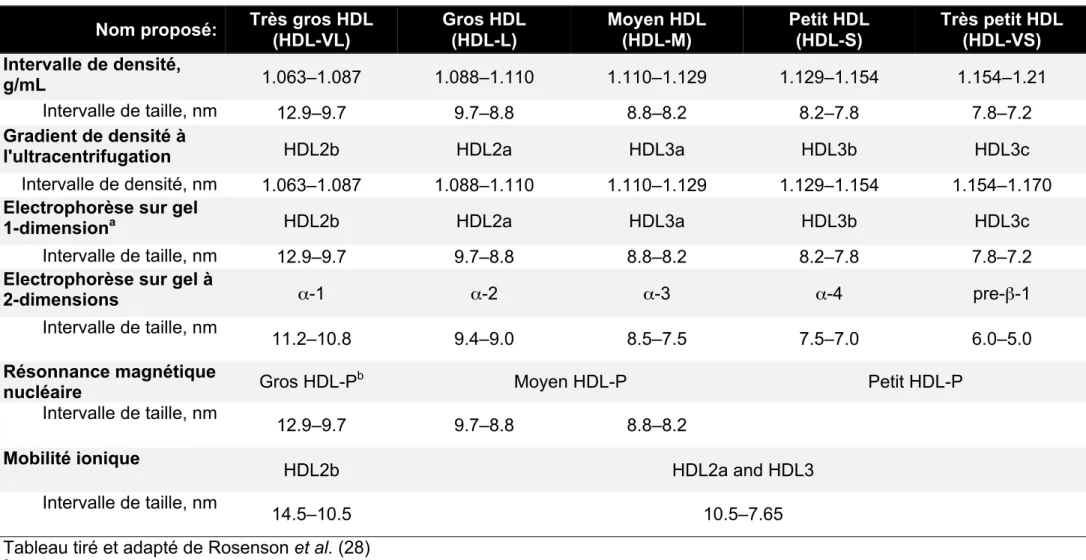
Les HDL sont des lipoprotéines hétérogènes quant à leur fonction et leur métabolisme. De nombreuses techniques d'évaluation existent et permettent de classer les HDL selon des caractéristiques physiques distinctes. Une nomenclature uniformisée (Tableau 1) fut proposée par Rosenson et al. en 2011 (28). Cette nomenclature rassemble les particules HDL selon leurs caractéristiques communes obtenues par différentes techniques d'évaluation. Il existe ainsi cinq grandes classes de HDL (Tableau 1), allant des HDL très petits (sous-classe: HDL3c; charge α-4) à des HDL très gros (sous-classe: HDL2b; charge: α-1).
La «forme» que prennent les HDL est intimement liée au métabolisme du RCT. Le rôle des HDL dans le RCT est leur principale fonction et sera discuté en détail à la section suivante («Chapitre 4. Rôle de l'efflux de cholestérol»). De façon générale, les HDL très petits sont pauvres en lipides, tandis que les HDL très gros en contiennent davantage (28).
Plusieurs études se sont intéressées au lien entre certaines caractéristiques physiques des HDL et le risque de MCV (28, 29). Le contenu en cholestérol (composition lipidique), la taille (sous-classes) et la charge sont des exemples de caractéristiques physiques des HDL ayant été associées au risque de MCV. Traditionnellement, les HDL sont évaluées en regard de leur contenu en cholestérol (HDL-C), une caractéristique physique de l'ensemble des particules
7
3.2 Composition lipidique des HDL
3.2.1 Lien avec les autres lipoprotéines
La composition lipidique des HDL reflète en partie les concentrations d'autres lipides sanguins. Notamment, il existe une relation inverse entre les concentrations
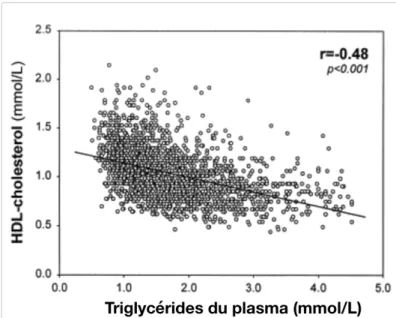
de triglycérides (TG) et les concentrations de HDL-C (30) (
Figure 1). De surcroit, la teneur en TG dans les HDL est augmentée chez les individus avec des niveaux plus élevés de TG à jeun (31). Un plus grand bassin de particules enrichies en TG, par exemple les TG provenant des VLDL, provoque une augmentation de l'enrichissement en TG des HDL par la protéine de transfert des esters de cholestérol (CETP). Cette protéine a pour rôle le transfert équimolaire de cholestérol estérifié entre les très gros HDL et les particules contenant de l'apo B en échange de TG (32). De plus, un enrichissement accru en TG provoquera une accentuation du catabolisme des HDL par la lipase hépatique (LH) étant donné que les HDL enrichis en TG sont d'excellents substrats de cette enzyme (33). En somme, ces effets génèreront de plus petites particules HDL, moins riches en cholestérol (32), et de plus faibles concentrations de HDL-C (33).
Figure 1 Relation entre les TG du plasma et le HDL-C Tirée et adaptée de Desprès et al. (30) n=2103, hommes
8 3.2.3 HDL-C et MCV
Malgré les associations protectrices entre la concentration de HDL-C et le risque de MCV observées à maintes reprises, de récentes investigations indiquent que le HDL-C n'aurait pas d'effets causaux dans le développement de MCV.
D'abord, une étude de randomisation mendélienne a montré que les porteurs d'un polymorphisme nucléotidique simple, le LIPG Asn396Ser, avaient des concentrations augmentées de HDL-C. Cependant, les porteurs de l'allèle ne sont pas protégés de la survenue d'un infarctus du myocarde par rapport aux non-porteurs [rapport de cotes: 0.99; intervalle de confiance (IC) 95% 0.88, 1.11] (13). Ensuite, une investigation en prévention secondaire a examiné l'effet d'un médicament («dalcetrapid») inhibiteur de la protéine de transfert des esters de cholestérol (CETP) (34). Malgré une augmentation du HDL-C de 31 à 40% dans le groupe de traitement, leur rapport de risque n'était pas différent des participants assignés au groupe du placebo (1.04; 95% IC 0.93, 1.16).
Finalement, une revue systématique avec méta-analyse publiée en 2014 a rassemblé les résultats des interventions évaluant l'effet de médicaments qui augmentent le HDL-C sur le risque de MCV (35). Parmi ces médicaments, des inhibiteurs de la CETP, la niacine et les fibrates ont été évalués. Semblable aux résultats déjà publiés, cette analyse n'a montré aucun avantage de ces médicaments sur le risque de MCV, malgré une augmentation du HDL-C.
En somme, l'association inverse entre les concentrations de HDL-C et le risque de MCV est bien établie: des concentrations plus élevées de HDL-C étant systématiquement associées à un plus faible risque de MCV (12). Néanmoins, la présence d'un lien de cause à effet impliquant le HDL-C dans le développement des MCV ne fut pas démontrée dans plusieurs investigations jusqu'à maintenant. Ainsi, un faible niveau sanguin de HDL-C, une caractéristique physique des HDL, semble être un marqueur de risque plutôt qu'un facteur causal du développement des MCV.
9
3.3 Sous-classes et charge des HDL
3.3.1 Évaluation des sous-classes et de la charge
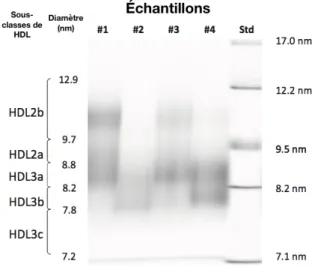
La première méthode développée pour caractériser les particules HDL au-delà du HDL-C est l'ultracentrifugation analytique qui permet de diviser les HDL en deux sous-classes, soit les HDL2 et les HDL3 (28). Dans le même ordre d'idées, les HDL2 et HDL3 peuvent être décomposées en cinq sous-classes par la technique d'électrophorèse sur gel non dénaturant à gradient de concentration (GGE) sur une dimension (Tableau 1) (36, 37). Brièvement, les HDL sont isolées du plasma par ultracentrifugation à une densité entre 1.063 et 1.21 g/ml. Le sérum est mélangé avec un tampon, puis, il est chargé sur un gel de polyacrylamide non dénaturant avec un gradient 4-30%. Les particules HDL seront différenciées selon la distance de leur migration sur le gel (Figure 2).
Figure 2 GGE sur une dimension Tirée et adaptée de Rosenson et al. (28)
La technique d'évaluation de la charge est similaire à la GGE, mais se réalise sur un gel à deux dimensions. Ainsi, les particules HDL seront séparées en fonction de leur taille et de leur charge et une analyse densitométrique permettra de quantifier les proportions des cinq sous-classes principales de particules (Tableau 1) (12).
10 3.3.3 Sous-classes, charge et MCV
Une revue de littérature de 80 études, publiée en 2012, a évalué l'utilité de la mesure des sous-classes de HDL pour une meilleure prédiction du risque de maladie coronarienne athérosclérotique (MCAS) (29). Les études recensées furent divisées en quatre catégories: les études transversales, les études cas-témoins, les études prospectives, et les études avec des mesures répétées du degré d'athérosclérose. Une difficulté lors de l'évaluation du risque de MCAS en fonction des sous-catégories de HDL est l'utilisation de plusieurs techniques d'évaluation différentes entre les études (28, 29). De surcroit, l'évaluation par GGE fut relativement moins utilisée par rapport à d'autres techniques comme l'ultracentrifugation analytique, car elle est plus laborieuse (29).
Parmi les études cas-témoins recensées (n=53), 45% des études ont rapporté que les deux sous-fractions (cholestérol des HDL2 et HDL3) étaient plus faibles chez les cas de MCAS; 26% des études ont rapporté des concentrations plus faibles de cholestérol HDL2 chez les cas seulement; 11% des études ont rapporté des concentrations de cholestérol HDL3 chez les cas seulement; 17% n'ont trouvé aucune association (29). Les études comptabilisées ont évalué les sous-classes de HDL principalement par ultracentrifugation analytique (29). Onze études cas-témoins ont évalué les sous-classes de HDL par GGE (à une dimension ou à deux dimensions). Sur ces onze études, dix ont rapporté des niveaux de HDL2b ou α-1 plus faibles chez les cas de MCAS que chez les témoins. Ainsi, les résultats obtenus par la technique GGE semblent plus cohérents entre les études que ceux obtenus par ultracentrifugation analytique. Finalement, sur huit études prospectives, quatre ont rapporté un risque plus faible de MCV associé à des concentrations plus élevées de HDL2 et HDL3 cholestérol; trois ont montré un risque plus faible associé au cholestérol HDL3 seulement; une étude a trouvé un risque plus faible associé au cholestérol HDL2 seulement (29).
Bref, les données actuelles montrent que la discrimination des sous-classes de HDL par ultracentrifugation analytique ne permet pas de préciser le risque
11
cardiovasculaire au-delà des facteurs de risque connu. La technique de GGE (à une ou deux dimensions) pourrait être pertinente, mais le manque d'études prospectives limite la valeur et la généralisation des résultats.
12
3.4 Impact des gras alimentaires sur les caractéristiques physiques des HDL
Les études contrôlées sont celles qui permettent de tirer des conclusions quant aux effets des aliments sur les caractéristiques des HDL. Ces études regroupent les interventions où les participants ont reçu des instructions sur les aliments à consommer ou encore une intervention où les aliments sont fournis par l'équipe de recherche.
3.4.1 Alimentation et HDL-C
Mensink et al. (10) ont montré qu'une augmentation des AGS dans la diète, au détriment des glucides, augmente les concentrations de HDL-C. Ces résultats ont été obtenus dans une méta-analyse de 60 études contrôlées. D'autres auteurs ont estimé l'augmentation du HDL-C à environ 11.8% dans le cas où 10% de l'énergie provenant de glucides serait remplacée par des AGS (38). La consommation modérée d'alcool (moins d'une consommation par jour) et la consommation de gras oméga-3 (0.045 g à 5.9 g par jour) sont deux facteurs qui augmenteraient le HDL-C de 9.2 et 4.0 %, respectivement (38).
3.4.2 Alimentation et sous-classes de HDL
Très peu d'investigations contrôlées ont examiné l'effet de diètes sur la distribution des sous-classes de HDL chez l'humain. En 1995, une étude publiée par Williams
et al. (39) rapporte les résultats d'une intervention contrôlée réalisée en
chassé-croisé chez 105 hommes. Les participants ont reçu des instructions nutritionnelles pour consommer une diète riche en gras [46% lipides (LIP), 18% AGS, 13% gras polyinsaturés (POLY)] ou faible en gras (24% LIP, 5% AGS, 4% POLY) dans un ordre aléatoire. Au terme des diètes de six semaines chacune, les sous-classes de HDL furent évaluées par GGE non dénaturant à une dimension selon la technique décrite ci-dessus. Le diamètre moyen des HDL des participants était significativement diminué au terme de la diète faible en gras. Les sous-classes
13
HDL2b, HDL2a et HDL3a étaient aussi significativement diminuées après la diète faible en gras comparé à la diète riche en gras.
En 1999, Berglund et al. (40) ont publié les résultats d'une étude randomisée contrôlée réalisée à double insu chez 103 hommes et femmes en santé. Les participants âgés de 22 à 67 ans (âge moyen, 37.9 ans) avaient des niveaux de lipides sanguins normaux. Trois diètes ont été fournies aux participants pendant des périodes de huit semaines, séparées de repos de quatre à six semaines: 1) une diète «américaine moyenne» [34.3% LIP: 15.0% AGS, 12.8% gras mono-insaturés (MONO), 6.5% POLY]; 2) une diète selon les lignes directrices de
l'American Heart Association Step I (AHA) (28.6% LIP: 9.0% AGS, 12.9% MONO,
6.7% POLY); 3) une diète faible en gras (25% LIP: 6.1% AGS, 12.4% MONO, 6.7% POLY). La différence de teneur en LIP entre les diètes était principalement due à une diminution des AGS. Chaque diète contenait environ ~300 mg de cholestérol. Les sous-classes HDL furent évaluées par la technique de GGE à une dimension. Dans l’ensemble, une diminution de la teneur en LIP et en AGS, soit les deux diètes plus faibles en gras comparées à la diète américaine moyenne, a provoqué une diminution significative des HDL2b (très gros HDL) et une augmentation significative des HDL3c, HDL3b et HDL3a (très petits à moyens HDL). Les changements étaient similaires pour la diète AHA et la diète faible en gras, quoique plus prononcé pour la diète faible en gras. De plus, les proportions de HD2b étaient inversement corrélées aux concentrations de TG chez les participants au terme des interventions. Par contre, les concentrations de TG n'expliqueraient que 10% de la variation du cholestérol des HDL2b impliquant que d'autres facteurs influencent les différences de proportion selon les auteurs. L'âge, le sexe ou l'ethnie des participants n'ont pas influencé la réponse aux diètes. Ainsi, une plus grande proportion d'AGS dans la diète favorise une augmentation des plus gros HDL, principalement en raison d'une augmentation relative des HDL2b et une diminution des très petits HDL (HDL3c).
14 3.5 Conclusion sur le rôle des HDL
Les caractéristiques physiques des HDL, particulièrement le HDL-C, ne semblent pas avoir une implication causale dans le développement des MCV. Ainsi, l'utilité clinique d'augmenter les concentrations de HDL-C est remise en question (14) et le potentiel de prédiction de la mesure des sous-classes de HDL est incertain (29). Toutefois, les HDL ont différentes fonctions qui vont au-delà de leur contenu en cholestérol ou de leurs caractéristiques physiques. Parmi ces fonctions, on note, entre autres, un rôle anti-inflammatoire, antioxydant, antithrombotique et des effets sur la fonction endothéliale. De plus, la fonctionnalité des HDL la plus étudiée jusqu'à maintenant est leur rôle dans l'efflux de cholestérol, une étape clé du RCT (41).
15
Tableau 1 Classification des HDL selon leurs propriétés physiques
Nom proposé: Très gros HDL
(HDL-VL) Gros HDL (HDL-L) Moyen HDL (HDL-M) Petit HDL (HDL-S) Très petit HDL (HDL-VS) Intervalle de densité, g/mL 1.063–1.087 1.088–1.110 1.110–1.129 1.129–1.154 1.154–1.21 Intervalle de taille, nm 12.9–9.7 9.7–8.8 8.8–8.2 8.2–7.8 7.8–7.2 Gradient de densité à
l'ultracentrifugation HDL2b HDL2a HDL3a HDL3b HDL3c
Intervalle de densité, nm 1.063–1.087 1.088–1.110 1.110–1.129 1.129–1.154 1.154–1.170 Electrophorèse sur gel
1-dimensiona HDL2b HDL2a HDL3a HDL3b HDL3c
Intervalle de taille, nm 12.9–9.7 9.7–8.8 8.8–8.2 8.2–7.8 7.8–7.2
Electrophorèse sur gel à
2-dimensions α-1 α-2 α-3 α-4 pre-β-1
Intervalle de taille, nm
11.2–10.8 9.4–9.0 8.5–7.5 7.5–7.0 6.0–5.0
Résonnance magnétique
nucléaire Gros HDL-Pb Moyen HDL-P Petit HDL-P
Intervalle de taille, nm 12.9–9.7 9.7–8.8 8.8–8.2 Mobilité ionique HDL2b HDL2a and HDL3 Intervalle de taille, nm 14.5–10.5 10.5–7.65
Tableau tiré et adapté de Rosenson et al. (28)
a Electrophorèse sur gel à une dimension réalisée sur un gel non dénaturant de polyacrylamide (concentration 4%-20%) b HDL-P, particules HDL
16
Chapitre 4. Rôle de l'efflux de cholestérol
4.1 Sommaire du RCT
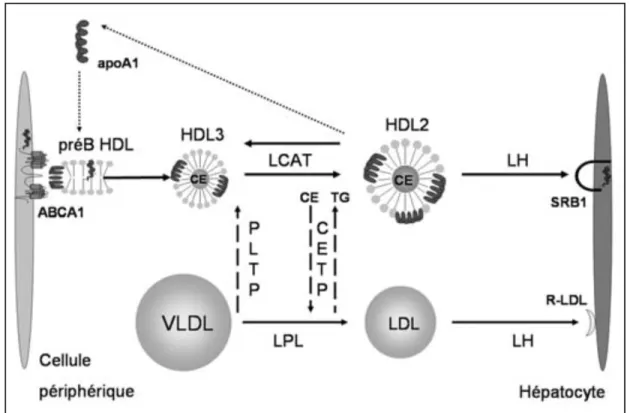
La principale fonction protectrice des HDL à l’égard des MCV est probablement son rôle dans le RCT qui implique la collecte du cholestérol (c'est-à-dire la CEC) des cellules de tissus périphériques et l'excrétion des surplus par le foie dans la bile (12). Ce processus complexe s'opère en lien étroit avec le métabolisme des HDL: les HDL naissants, des particules de petites tailles pauvres en lipides, vont progressivement s'enrichir de cholestérol grâce à leur interaction avec des transporteurs membranaires de cholestérol (42) et croître vers des HDL de plus grandes tailles, plus riches en lipides. La Figure 3 illustre l'ensemble du RCT et une portion du métabolisme des particules HDL.
Synthétisée par l'intestin et par le foie, l'apolipoprotéine(apo) A1, pauvre en lipides, est la première «particule HDL» à intervenir dans le RCT. L'apo A1 se lie aux transporteurs membranaires adénosine-triphosphate(ATP)-Binding cassette sous famille A membre 1 (ABCA1) et acquérir du cholestérol libre. Puisque les macrophages possèdent le transporteur ABCA1, ils interagissent avec l'apo A1 et transfèrent du cholestérol libre. Le rôle des transporteurs membranaires dans l'efflux de cholestérol est décrit en détail à la section suivante («4.2.1 Transporteurs membranaires de cholestérol»). La particule alors formée correspond aux particules pre-β-1. L'enzyme lécithine-cholestérol acyltransférase (LCAT) permet la croissance des HDL3 vers des HDL plus matures (HDL2) et plus riches en cholestérol. Le rôle de la LCAT est l'estérification du cholestérol libre situé à la surface des HDL permettant le mouvement du cholestérol estérifié vers le centre des HDL (41). Cette redistribution permet aux HDL de poursuivre le ramassage de cholestérol libre tout en maintenant un gradient de concentration de cholestérol favorable en périphérie des HDL. En d'autres mots, les particules HDL peuvent continuer de stimuler l'efflux de cholestérol, malgré l'accroissement de leur taille provoqué par une accumulation de cholestérol estérifié au centre de la particule.
17
Les HDL matures (HDL2), plus riches en lipides et en cholestérol, de mobilité α1 ou α2, peuvent aussi stimuler l'efflux de cholestérol à l'instar des HDL pauvres en lipides (43). Par contre, les HDL matures seraient moins efficaces que les petits HDL pour le ramassage de cholestérol (44) et utilisent des transporteurs différents (43). Les HDL matures libèrent leur cholestérol par deux mécanismes principaux (12). D'abord, une partie du noyau lipidique des HDL subit une excrétion indirecte par les particules contenant de l'apo B [LDL, lipoprotéines de densité intermédiaires (IDL) ou les VLDL]. La CETP a un rôle important à cette étape et provoque l'échange de TG (provenant des particules contenant de l'apo B) et de cholestérol estérifié (provenant des HDL matures). Une partie du cholestérol transféré aux particules contenant de l'apo B est ensuite être excrété au foie par le récepteur LDL (R-LDL).
L'excrétion directe consiste à l'interaction du HDL mature avec le transporteur SR-B1 au foie. Une partie du noyau lipidique du HDL mature est incorporé dans l'hépatocyte grâce au transporteur SR-B1 sans qu'il n'y ait internalisation de l'apo A1. Les lipases hépatique (LH) et endothéliale (LE) jouent un rôle dans l'hydrolyse des phospholipides (PL) et des TG des HDL matures à cette étape. Il s'en suit la libération de l'apo A1 qui retourne en circulation pour répéter le cycle. Le cholestérol est ensuite excrété dans la bile par les transporteurs entéro-hépatiques ACBG5 et ABCG8.
En somme, le RCT est un système complexe nécessitant l'action de plusieurs enzymes, l'interaction des particules avec des transporteurs précis et un métabolisme sain des HDL afin de permettre le ramassage de cholestérol. Des modèles animaux ont permis de réaliser l'étude complète de chacune des étapes du RCT. Malheureusement, il est impossible de réaliser la mesure complète chez l'humain. C'est plutôt la première étape du RCT, la CEC, qui peut être examinée ex
vivo et qui a fait l'objet de plusieurs investigations jusqu'à aujourd'hui. Bien qu'il ne
soit pas connu à ce jour si cette étape est limitante dans le RCT (45), elle n'en demeure pas moins importante. En fait, il s'agit du seul mécanisme de sortie du cholestérol des cellules à l'exception de quelques tissus où le cholestérol peut être
18
métabolisé (hormones sexuelles, bile) (46). La section suivante détaillera les différentes voies de mouvement du cholestérol qui sont d'une importance majeure dans l'évaluation de la CEC.
Figure 3 Transport inverse du cholestérol et (CEC) Tirée de Cano et al. (47)
Les particules d'apo A1, pauvres en lipides, vont interagir avec le transporteur membranaire ABCA1 des cellules périphériques et acquérir du cholestérol et des phospholipides. Les HDL3, nouvellement formés vont croître, en HDL2 sous l'action de la LCAT qui permettra l'estérification du cholestérol libre. Le retour du cholestérol au foie sera possible par deux mécanismes. Le premier mécanisme direct implique la lipase hépatique et le transfert de cholestérol par le transporteur membranaire SR-B1. Le second mécanisme est indirect et il implique l'enzyme CETP et les particules contenant de l'apo B qui accepteront le cholestérol des HDL en échange de TG. Le récepteur LDL au foie recevra le cholestérol de ces particules.
19
4.2 Voies de mouvement du cholestérol
Les voies de mouvement du cholestérol pertinentes chez l'humain sont détaillées dans le Tableau 2. Il semble y avoir quatre mécanismes principaux: la diffusion passive et les transporteurs membranaires ABCA1, l'ATP-Binding cassette sous famille G membre 1 (ABCG1) ainsi que le «scavenger receptor» classe B membre 1 (SR-B1). Ces voies jouent le rôle d'intermédiaire entre les donneurs (par exemple: macrophages) et les accepteurs (par exemple: HDL) de cholestérol. 4.2.1 Transporteurs membranaires de cholestérol
Le transporteur ABCA1 et ses fonctions furent découverts à la suite d'investigations sur les origines de la maladie de Tangier. Cette maladie est caractérisée par une accumulation de cholestérol estérifié dans les macrophages, des niveaux très bas de HDL-C et le développement précoce de MCV (48, 49). L'absence de transporteurs ABCA1 fonctionnels dans la maladie de Tangier est la cause principale de l'accumulation de cholestérol (48), puisque le transport actif est requis pour permettre l'efflux du cholestérol des macrophages.
Le rôle clé des transporteurs ABCA1 et ABCG1 dans l'accumulation de cholestérol et le développement de l'athérosclérose fut aussi mis en évidence à partir d'études animales. Des souris dépourvues de ces deux transporteurs majeurs, ABCA1 (ABCA1-/-) et ABCG1 (ABCG1-/-), ont été comparées à des souris possédant encore l'un ou l'autre de ces transporteurs. Les souris ABCA1-/- et ABCG1-/- ont montré une plus grande accumulation de cholestérol (cholestérol estérifié) dans leurs macrophages péritonéaux (diètes régulières ou riches en cholestérol), de même qu'une accumulation de cellules spumeuses (50).
4.2.2 Contribution quantitative des voies de mouvement
La contribution des différentes voies de mouvement de cholestérol à l'efflux total dépend des cellules étudiées (donneur) et de leur contenu en cholestérol. Néanmoins, différentes investigations ont tenté d'élucider les mécanismes les plus importants chez l'humain (Tableau 2). Adorni et al. (51) ont démontré que les
20
transporteurs ABCA1 et ABCG1 contribueraient à environ 50% et 10-25%, respectivement, de l'efflux de cholestérol total à partir de macrophages chargés en cholestérol vers du sérum humain dépourvu d'apo B. À partir de leurs résultats, les mêmes chercheurs ont extrapolé la contribution relative d'ABCA1 et d'ABCG1 chez l'humain à environ 80% et 20%, respectivement. Les contributions de la diffusion passive et du transporteur SR-B1 seraient négligeables pour des macrophages chargés en cholestérol. Une investigation plus récente utilisant des modèles de macrophages humains a confirmé que le transporteur ABCA1 était le plus important quantitativement lors d'efflux de cholestérol stimulé par du sérum dépourvu d'apo B (44). Cependant, la quantité de cholestérol à l'intérieur des macrophages influence également la voie préférentielle d'efflux. Par exemple, la diffusion passive est la voie de transfert préférentielle à partir de macrophages ayant des niveaux «normaux» de cholestérol. En somme, les transporteurs ABC, particulièrement ABCA1, semblent être les plus importants quantitativement en regard à l'efflux de cholestérol propre aux macrophages chargés en cholestérol. La diffusion passive est plutôt un mécanisme important pour des macrophages avec des niveaux «normaux» de cholestérol.
4.2.3 Substrats préférentiels des transporteurs membranaires
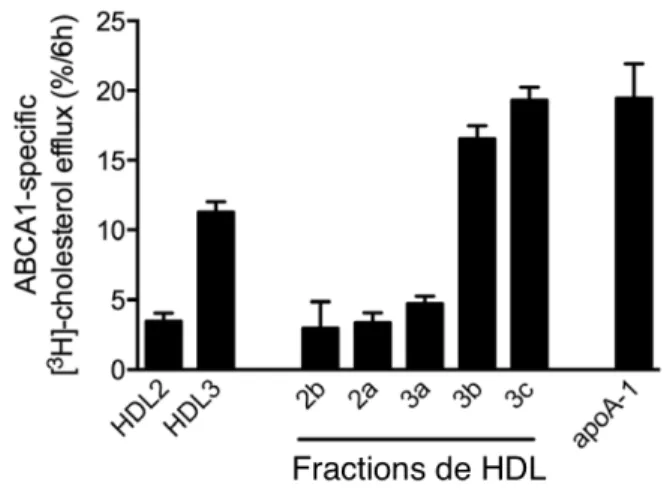
Les substrats préférentiels (accepteurs) de chacun des transporteurs sont différents (Tableau 2). Des études in vitro ont montré qu'ABCA1 interagit principalement avec les particules d'apo A1, pauvres en lipides, grâce à un lien direct entre l'apo A1 et le transporteur (52, 53). Conséquemment, les premières études sur le sujet ont établi que l'efflux de cholestérol stimulé par les HDL2 ou les HDL3 n'est pas efficient par le transporteur ABCA1 (52). Par contre, une récente étude a remis en question le modèle traditionnel (43, 44). Du et al. ont montré que les HDL3b et HDL3c sont aussi des accepteurs de cholestérol efficients et contribuent à l'efflux de cholestérol par ABCA1 au même titre que l'apo A1 (Figure 4) (44). Il semble donc que l'efflux de cholestérol par le transporteur ABCA1 ne soit pas propre à l'apo A1. Bref, le transporteur ABCA1 aurait une plus grande implication dans le métabolisme des HDL et la participation des différentes
21
particules HDL (43, 44) à l'efflux de cholestérol par ces transporteurs n'est probablement pas aussi clairement délimitée que le modèle traditionnel (52, 53).
Figure 4 Importance relative des fractions de HDL dans l'efflux de cholestérol par ABCA1
Figure tirée et adaptée de Du et al. (44)
Malgré de nombreuses études récentes sur ces transporteurs, certaines interrogations demeurent. Notamment, les interactions in vivo chez l'humain des transporteurs avec les accepteurs préférentiels respectifs ne peuvent pas être étudiées. Il existe potentiellement des différences importantes entre l'animal et l'homme quant à la contribution relative, au métabolisme et aux interactions des particules HDL avec chacun des transporteurs. Bref, la considération du transporteur est cruciale dans le choix de cellules pour l'évaluation de la CEC, puisque les transporteurs n'interagissent pas tous aussi efficacement avec tous les accepteurs de cholestérol. À cet effet, le transporteur ABCA1 fut le principal transporteur évalué dans les études de cohortes prospectives récentes qui mettent en relation la CEC et le risque de MCV (54-56).
22
Tableau 2 Voies de mouvement du cholestérol pertinentes chez l'humain
Nom Lieu d'expression principal Accepteurs préférentiels Contributiona au RCT Mécanisme du transport du cholestérol Transporteurs membranaires ABCA1 Macrophages, hépatocytes Apo A1, HDL3b, HDL3c Particules pre-β-1 (44, 52, 53) • Macrophages normauxb: négligeable • Macrophages chargésb: ~50% de l'efflux total
Transport actif par vésicule. Mouvement unidirectionnel.
Lien direct avec ApoA1, pas d'internalisation (52) ABCG1 Macrophages, cellules endothéliales HDL2 (57), Particules α • Macrophages normaux: négligeable • Macrophages chargés: 10-25% de l'efflux total Transport actif. Mouvement unidirectionnel. Pas de lien direct avec ApoA1, pas d'internalisation (58, 59)
ATP-Binding
cassette sous famille
G membre 5 (ABCG5) et membre 8 (ABCG8) (hétérodimère) Hépatocytes et entérocytes (membrane apicale)
Bile (60, 61) Excrétion hépatobiliaire seulement Transport actif. Mouvement unidirectionnel. SR-B1 Hépatocytes (principalement), cellules endothéliales et périphériques (moindre importance) HDL2 Particules α (62) *L'accepteur doit contenir des PL pour recevoir du cholestérol par SR-B1 (63) • Macrophages normaux ou chargés: négligeable
Transport passif (facilité) par gradient de
concentration. Mouvement
bidirectionnel. Lien direct et reconnaissance de l'hélice α des HDL (64) Autre Diffusion aqueuse HDL2 ou HDL3 Particules α * Les plus gros
HDL sont potentiellement de meilleurs accepteurs, car ils permettent un plus grand nombre de collisions (65) • Macrophages normaux: ~80 % (70 à 90%) de l'efflux total • Macrophages chargés: négligeable
Transport passif par gradient de
concentration. Mouvement bidirectionnel (65)
aContributions relatives dérivées des résultats d'Adorni et al. (51); estimation faite avec des macrophages péritonéaux de souris incubés avec du sérum humain dilué et dépourvu d'apo B.
bL'appellation «macrophages chargés» réfèrent aux macrophages ayant été incubés en présence de cholestérol ou de particules athérogènes. Cette méthode charge le macrophage de cholestérol et lui confère une allure semblable aux cellules spumeuses des lésions athérosclérotiques. Les «macrophages normaux» sont les cellules dont les niveaux de cholestérol ne sont pas saturés.
23
4.3 Évaluation de la CEC
Les méthodes actuelles d'évaluation de la CEC requièrent un donneur et un accepteur de cholestérol (66). Selon ce qui est évalué, il est possible de mesurer la capacité de recevoir du cholestérol («
4.3.1 Potentiel de l'accepteur
») ou de donner du cholestérol («4.3.2 Potentiel du donneur
»). Dans chacun des cas, des cellules génériques sont utilisées pour jouer le rôle complémentaire de la voie examinée. Il n'existe pas de technique standardisée pour la mesure de la CEC. Ainsi, les protocoles utilisés dans les études peuvent varier selon la voie de transport étudiée ou simplement par le choix du donneur ou de l'accepteur (Tableau 3).4.3.1 Potentiel de l'accepteur
La capacité de certaines particules à stimuler l'efflux de cholestérol (potentiel de l'accepteur) est plus étudiée que la capacité à donner du cholestérol. Pour l'étude de la capacité à stimuler l'efflux de cholestérol, des cellules donneuses génériques (voir «Donneurs» dans le Tableau 3) seront chargées en cholestérol. Le cholestérol radioactif ([3H]cholestérol) est souvent utilisé pour charger les cellules génériques, bien qu'il existe d'autres techniques. Étant donné le rôle central des macrophages dans le développement des MCV, des cellules de macrophages génériques sont très souvent choisies comme donneuses génériques (15). Dans certains cas, les cellules seront choisies en fonction du transporteur qu'elles expriment. Il existe aussi certaines techniques pour surexprimer le transporteur d'intérêt et s'assurer de mesurer spécifiquement cette voie d'efflux. Par exemple, l'incubation de macrophages J774 avec de l'adénosine monophosphate cyclique (AMPc) surexprime le transporteur ABCA1 dans ces cellules (66).
L'accepteur étudié (voir «Accepteurs» dans le Tableau 3), provenant des individus, sera incubé en présence des cellules radio-marquées pendant quelques heures (par exemple: quatre à dix heures) dans des puits sur une plaque. Suivant l'équilibration, les cellules donneuses seront lysées et le milieu sera récupéré afin
24
de procéder au comptage de la radioactivité qui se fait à l'aide d'un compteur à scintillation liquide. Les échantillons (milieu et lysat des cellules) seront mélangés à un liquide à scintillation émettant des photons qui seront ensuite captés et comptés par l'appareil. Dans les protocoles d'efflux, le scintillateur compte habituellement la radioactivité dégagée en une minute pour chaque échantillon (CPM).
La CEC sera lors mesurée selon la formule suivante:
!"!É!!!"#$%%&" = !"#!"#" ! /[ (!"#!"#"$%+ !"#!"#$%)]
Où CECÉchantillon = capacité d'efflux de cholestérol de l'échantillon;
CPMMilieu = radioactivité dans le milieu, c'est-à-dire ayant été transférée par
l'accepteur;
CPMLysat = radioactivité du lysat des cellules n'ayant pas été transférée par
l'accepteur et encore présente dans les cellules donneuses.
Étant donné que le donneur de cholestérol est un ensemble de cellules, il existe une instabilité relativement plus grande que d'autres mesures plus «inertes». Dans ce contexte, il n'est pas rare de mesurer l'efflux de cholestérol se faisant naturellement dans un puits vide, sans accepteur de cholestérol. Cette mesure de «blanc» pourra être soustraite des autres mesures d'efflux afin de retirer l'effet de l'efflux «naturel» et réduire la variation dans une même plaque (variation intraplaque). Dans le même ordre d'idées, certaines plaques sont plus «performantes» que d'autres et les valeurs d'efflux sont plus élevées. Une stratégie pour palier à cette variation entre les plaques (variation interplaque) est de mesurer une valeur témoin d'efflux de cholestérol. Un mélange d'accepteurs issu de plusieurs individus est souvent utilisé (67).
L'équation générale de la mesure de la CEC corrigée pour les variations intraplaque et interplaque prend alors l'allure suivante:
!"!!"##$%é!= !"!É!!!"#$%%&"− !"!!"#$% !"!!é!"#$
25
4.3.2 Potentiel du donneur
Il est aussi possible d'évaluer la capacité de cellules de participants à libérer le cholestérol en présence d'un accepteur générique. Cependant, cette mesure est plus rarement évaluée que le potentiel de l'accepteur. Des monocytes seront isolés à partir d'un prélèvement sanguin et seront ensuite différenciés en macrophages (macrophages monocytes-dérivés humains) (68). Les cellules seront ensuite chargées en cholestérol radio-marqué, puis incubées en présence d'un accepteur générique. Il est aussi possible de mesurer l'expression des gènes stimulant les transporteurs clés du mouvement du cholestérol, de même que les protéines de ces gènes (68). Dans le contexte de l'évaluation des effets protecteurs des HDL envers les MCV, l'évaluation du potentiel du donneur est moins pertinente.
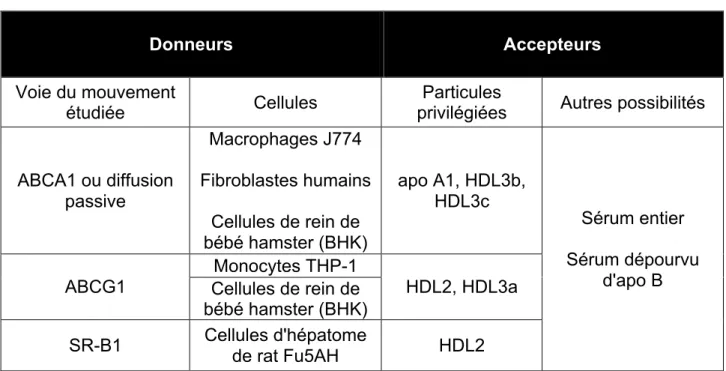
Tableau 3 Donneurs et accepteurs de cholestérol utilisés pour la mesurer la CEC
Donneurs Accepteurs
Voie du mouvement
étudiée Cellules
Particules
privilégiées Autres possibilités
ABCA1 ou diffusion passive Macrophages J774 Fibroblastes humains Cellules de rein de bébé hamster (BHK) apo A1, HDL3b, HDL3c Sérum entier Sérum dépourvu d'apo B ABCG1 Monocytes THP-1 HDL2, HDL3a Cellules de rein de bébé hamster (BHK)
26
4.4 CEC, MCV et MCAS
La CEC est un marqueur de risque connu depuis plus de 30 ans, mais la première étude d'envergure à avoir montré la valeur de ce marqueur pour la prédiction des MCV fut publiée en 2011 (54). Dans ce contexte, les données épidémiologiques établissant un lien entre le CEC et le risque de MCV sont très récentes. De plus, la littérature actuelle n'est pas assez mature pour justifier un rôle causal dans le développement de MCV. Les nombreuses manipulations requises pour mesurer la CEC limitent l'utilisation à grande échelle et rendent improbable l'utilisation de ce marqueur, sous sa forme actuelle, dans la pratique médicale quotidienne. Néanmoins, des données récentes appuient la présence d'une association entre la CEC et le risque de MCV (Tableau 4) et la possibilité d'un effet causal dans le développement des MCV n'est pas écartée.
4.4.1 Mesure de la CEC en prévention primaire
Khera et al. (54) ont comparé la CEC de 442 cas de MCV (évalués par angiographie) à 351 témoins sans évidence de MCV. Le donneur de cholestérol utilisé dans cette étude était des macrophages J774 traités avec l'AMPc pour induire une surexpression du transporteur ABCA1. Les individus dans le plus haut quartile de CEC avaient un rapport de cotes significativement plus faible que les individus du premier quartile (0.46; IC 95% 0.28, 0.75) et ce, même après des ajustements pour le HDL-C et l'apo A1. Les auteurs ont aussi réalisé une analyse transversale entre l'épaisseur de la média et de l'intima des artères carotides et la CEC chez des Caucasiens en santé. Une plus grande CEC était significativement associée à une plus petite épaisseur de l'intima-média.
Plus récemment, Rohatgi et al. (55) ont mesuré la CEC dans une cohorte de 2924 hommes et femmes sans MCV en début d'étude. Les individus âgés de 30 à 65 ans ont été suivis pendant 9.4 ans (médiane). Les individus dans le plus haut quartile de CEC avaient un risque significativement plus faible de MCV dans le modèle complètement ajusté (0.33; IC 95% 0.19, 0.55), incluant les concentrations de HDL-C, ou sans ajustements (0.44; IC 95% 0.27, 0.73) comparés aux individus
27
du quartile de référence. Notons que le HDL-C n'était pas associé au risque de MCV dans ces deux modèles.
Une autre étude prospective fut publiée dans un commentaire éditorial du New
England Journal of Medicine (56). Les auteurs présentent les courbes
Kaplan-Meier montrant la mortalité cardiovasculaire selon les différents quartiles d'efflux chez 2924 participants sans MCV en début d'étude. Les participants des quartiles trois et quatre avaient un risque significativement plus faible que les participants du quartile de référence (-33% et -35%, respectivement). Cependant, les méthodes sont absentes de cette publication incomplète.
Finalement, Saleheen et al. (69) ont aussi mesuré la CEC dans une cohorte prospective cas-témoins d'hommes et femmes de descendance européenne. Les auteurs ont comparé 1745 individus sains qui ont développé une MCAS à 1749 individus sains qui n'ont pas développé de MCAS sur une période de 12 à 16 années. Les individus du tertile le plus élevé de CEC avaient un risque 36% plus faible comparé aux individus du tertile le plus faible dans un modèle avec ajustements multiples, dont le HDL-C.
En somme, les études de Rohatgi, Ritsch et Saleheen ont montré qu'il existait une association négative entre la CEC et le risque de MCV ou de MCAS chez des hommes et femmes initialement sains. Bien que ces données ne confirment pas la présence d'une relation de causale, elles montrent que la CEC est un marqueur apportant une information supplémentaire et indépendante du HDL-C et, même de l'apo A1 (69). Les voies d'efflux étudiés (transporteurs) sont relativement homogènes et les résultats obtenus, chez des participants initialement en santé, sont cohérents.
4.4.2 Mesure de la CEC en prévention secondaire
Il est important de mentionner qu'une association protectrice entre la CEC et le risque de MCV n'est pas systématiquement observée chez les gens ayant déjà eu un évènement cardiovasculaire. Li et al. (70) ont rapporté une augmentation du
28
risque d'infarctus, d'arrêt vasculaire cérébral et de mortalité chez des participants dans le plus haut tertile de CEC comparés au tertile de référence. Il s'agissait d'individus ayant déjà subi un évènement cardiovasculaire. Cependant, une investigation ultérieure (71) chez des individus aux caractéristiques similaires a rapporté un risque 70% plus faible (0.30; IC 95% 0.14, 0.67) de MCV chez les individus avec la CEC la plus élevée comparée au groupe référence. Finalement, à la lumière de ces résultats, d'autres auteurs affirment que l'augmentation du risque identifiée par Li et al. serait plutôt due à des particularités méthodologiques (72). Bref, bien qu'il puisse y avoir une certaine controverse quant à la valeur de la CEC chez les individus avec une MCV déclarée, les associations protectrices sont plus constantes chez les patients en santé (73) (Tableau 4).
29
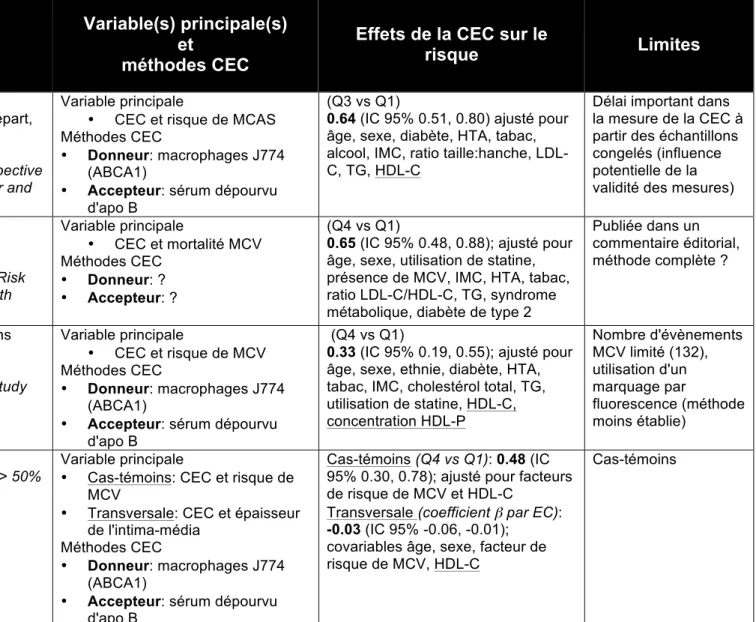
Tableau 4 Sélection d'études évaluant l'association entre la CEC et le risque de MCV
Auteur Année Devis d'étude Population (n, type, suivi) Variable(s) principale(s) et méthodes CEC
Effets de la CEC sur le
risque Limites Saleheen et al. 2015 (69) Cas-témoins, prospectif n=3495 (1745 cas, 1749
témoins), en santé au départ, 12-16 ans (intervalle)
Cohorte European Prospective
Investigation into Cancer and nutrition (EPIC-Norfolk)
Variable principale
• CEC et risque de MCAS Méthodes CEC
• Donneur: macrophages J774 (ABCA1)
• Accepteur: sérum dépourvu d'apo B
(Q3 vs Q1)
0.64 (IC 95% 0.51, 0.80) ajusté pour âge, sexe, diabète, HTA, tabac, alcool, IMC, ratio taille:hanche, LDL-C, TG, HDL-C
Délai important dans la mesure de la CEC à partir des échantillons congelés (influence potentielle de la validité des mesures) Ritsch et
al.
2015 (56)
Prospectif n=2450, risque élevé, ? (inconnu)
Cohorte Ludwigshafen Risk
and Cardiovascular health
(LURIC) Variable principale • CEC et mortalité MCV Méthodes CEC • Donneur: ? • Accepteur: ? (Q4 vs Q1)
0.65 (IC 95% 0.48, 0.88); ajusté pour âge, sexe, utilisation de statine, présence de MCV, IMC, HTA, tabac, ratio LDL-C/HDL-C, TG, syndrome métabolique, diabète de type 2
Publiée dans un commentaire éditorial, méthode complète ? Rohatgi et al. 2014 (55)
Prospectif n=2924, en santé, 9.4 ans (médian)
Cohorte Dallas Health Study (DHS) Variable principale • CEC et risque de MCV Méthodes CEC • Donneur: macrophages J774 (ABCA1)
• Accepteur: sérum dépourvu d'apo B
(Q4 vs Q1)
0.33 (IC 95% 0.19, 0.55); ajusté pour âge, sexe, ethnie, diabète, HTA, tabac, IMC, cholestérol total, TG, utilisation de statine, HDL-C, concentration HDL-P Nombre d'évènements MCV limité (132), utilisation d'un marquage par fluorescence (méthode moins établie) Khera et al. 2011 (54) Cas-témoins et transvers ale Cas-témoins MCV: Sténose luminale > 50% n=442, cas, NA (non applicable) n=351, témoins, NA Transversale n=203, en santé, NA Variable principale
• Cas-témoins: CEC et risque de MCV
• Transversale: CEC et épaisseur de l'intima-média
Méthodes CEC
• Donneur: macrophages J774 (ABCA1)
• Accepteur: sérum dépourvu d'apo B
Cas-témoins (Q4 vs Q1): 0.48 (IC 95% 0.30, 0.78); ajusté pour facteurs de risque de MCV et HDL-C
Transversale (coefficient β par EC):
-0.03 (IC 95% -0.06, -0.01); covariables âge, sexe, facteur de risque de MCV, HDL-C
30
4.5 Impact de l'alimentation sur la CEC
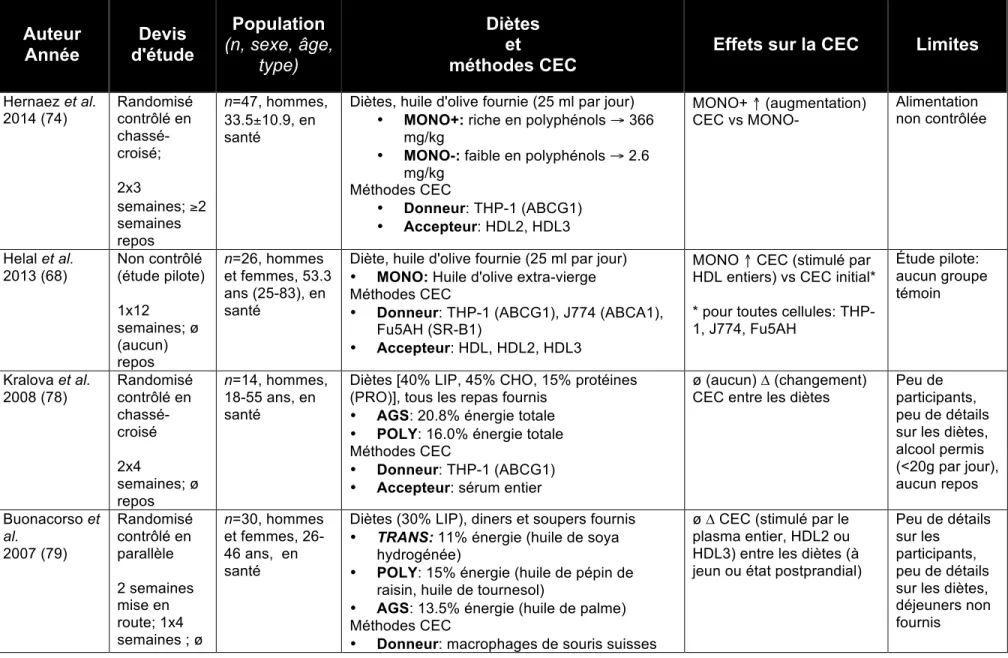
Une particularité importante des études d'intervention en nutrition ayant mesuré des modifications de la CEC chez l'humain (Tableau 5) est que le système d'évaluation de l'efflux est très différent d'une étude à l'autre. D'abord, de multiples donneurs de cholestérol ont été utilisés et les voies de transport du cholestérol varient d'une investigation à l'autre. De plus, différents accepteurs, notamment du sérum entier, des HDL entiers, des sous-fractions de HDL isolées (HDL2, HDL3), ont été examinés. Finalement, quelques études n'ont pas de groupe témoin. Cette grande hétérogénéité rend difficiles les comparaisons entre les interventions. Il faut donc être prudent dans l'interprétation des résultats de CEC, malgré des devis d'étude qui peuvent sembler similaires.
Plusieurs gras alimentaires ont été étudiés quant à leur impact sur la CEC: • MONO: huile d'olive (68, 74-77)
• POLY: huile de tournesol, huile de pépin de raisins, huile de poisson (75, 77-79);
• AGS: huile de palme, suif de boeuf, gras laitiers (75, 77-80); • Trans: huile de soya hydrogénée (79)
Des diètes faibles en gras (76) ou plus ou moins riches en cholestérol ont aussi été évaluées (80) quant à leurs effets sur la CEC. Deux études ont aussi comparé les changements dans la CEC à l'état postprandial (77, 81). D'autres auteurs ont examiné l'effet d'aliments précis, dont l'alcool (82), les oeufs (83) ou les noix de Grenoble (81). Les participants de ces interventions étaient majoritairement en bonne santé et sans antécédents de maladies.