Optimisation du potentiel thérapeutique des
cellules souches de sang de cordon ombilical
Mémoire
Marie-Eve Rhéaume
Maîtrise en microbiologie
Maître ès sciences (M. Sc.)
Québec, Canada
© Marie-Eve Rhéaume, 2017
Optimisation du potentiel thérapeutique des
cellules souches de sang de cordon ombilical
Mémoire
Marie-Eve Rhéaume
Sous la direction de :
André Darveau, directeur de recherche
Renée Bazin, codirectrice de recherche
iii RÉSUMÉ
Les cellules souches hématopoïétiques (CSH) sont greffées à des patients dont le système immunitaire est affaibli ou déficient, afin de reconstituer leur système hématopoïétique. En raison de leurs nombreux avantages, les CSH provenant du sang de cordon ombilical sont de plus en plus utilisées. Cette hausse de la demande a mené à l’implantation de plusieurs banques publiques, dont celle d’Héma-Québec, opérant selon les lignes directrices d’organismes réglementaires. Malgré la standardisation des protocoles de mise en banque, certains paramètres ne sont pas règlementés, telle la température d’entreposage des sangs de cordon avant leur cryopréservation. À Héma-Québec, le transport et la conservation des prélèvements avant la mise en banque sont faits à température pièce (TP) en respectant un délai maximal de 48 heures entre le moment du prélèvement et celui de la mise en banque. De récents travaux rapportés dans la littérature ont montré que les CSH provenant de sang de cordon conservé à TP pendant une période de 72 heures avant la mise en banque perdaient complètement leur capacité de reconstitution hématopoïétique alors que celle-ci était préservée si la conservation était faite à 4°C. Nous avons donc entrepris la présente étude afin de déterminer l’impact de l’entreposage à 4oC ou TP allant jusqu’à 48 heures sur plusieurs
paramètres fonctionnels des CSH de sang de cordon ombilical, soit la viabilité, la capacité à se différencier et le potentiel de reconstitution hématopoïétique à l’aide d’un modèle animal de greffe. Les essais de différenciation ont permis de prédire les résultats des greffes, et ces derniers ont mis en évidence une grande variabilité entre les différents sangs de cordon. À ce stade, l’impact de la température d’entreposage avant la mise en banque sur le potentiel de reconstitution hématopoïétique des CSH n’est pas encore déterminé et des travaux supplémentaires devront être effectués.
iv ABSTRACT
Umbilical cord blood (UCB) has been proven to be an important alternative source of hematopoietic stem cells (HSCs) mostly for pediatric patients suffering from hematologic disorders. Because of its many advantages over other sources of HSCs, such as ease of collection, less stringent HLA restrictions and lower risks of developing GVHD, the use of UCB has expanded in recent years and led to a growing number of public cord blood banks (CBB) that operate under guidelines established by the regulatory organisms such as Netcord FACT, AABB or FDA. Despite the standardization of CBB procedures, some parameters remain unregulated, such as the pre-processing storage temperature. At Héma-Québec Public CBB, the units are kept at room temperature (RT) before being processed and cryopreserved within 48 hours after collection. Recently, a study using a mouse model of engraftment revealed that a pre-processing storage of 72 hours at room temperature might have deleterious effects on the HSC reconstitution capacity. The aim of our study was to evaluate the impact of pre-processing storage temperature on HSCs, by evaluating their viability, differentiation capacity and in vivo hematopoietic reconstitution in a mouse engraftment model. Results show that hematopoietic reconstitution potential measured in NSG mice differed for each of CBUs tested and that, in contrast to the previously published study, the in vivo reconstitution could be predicted by CFU assays. At this stage, the impact of preprocessing temperature on HSCs has not been confirmed, and to do so will require additional experiments.
v TABLE DES MATIÈRES
RÉSUMÉ ... III ABSTRACT ... IV LISTE DES FIGURES ... VII LISTE DES ABRÉBIATIONS ... VIII REMERCIEMENTS ... X
1. INTRODUCTION ... 1
1.1 HÉMATOPOÏÈSE ... 1
1.2 LES GREFFES DE CELLULES SOUCHES HÉMATOPOÏÉTIQUES ... 3
1.2.1 Les types de greffe ... 4
1.2.2 La compatibilité HLA ... 5
1.3 LES SOURCES DE CELLULES SOUCHES HÉMATOPOÏÉTIQUES ... 6
1.3.1 La moelle osseuse ... 6
1.3.2 Le sang périphérique (cellules souches périphériques stimulées (CSP)) ... 7
1.3.3 Le sang de cordon ombilical ... 8
1.4 MISE EN BANQUE DU SANG DE CORDON OMBILICAL ... 12
1.5 STRATÉGIES POUR L’OPTIMISATION DES GREFFES DE CSH DE SANG DE CORDON OMBILICAL ... 14
1.5.1 Les doubles transplantations de sang de cordon ombilical ... 14
1.5.2 Expansion des CSH ... 15
1.5.2.1 Récepteurs Notch ... 16
1.5.2.2 Molécule Copper ... 17
1.5.2.3 Molécule UM171 ... 18
1.5.3 Optimisation du homing des CSH ... 19
1.6 UTILISATION CROISSANTE ... 21
1.7 CONDITIONS DE CONSERVATION DES SANGS DE CORDON ... 23
1.8 HYPOTHÈSE ET OBJECTIFS ... 28
2. MATÉRIEL ET MÉTHODE ... 29
2.1 EXPÉRIENCES IN VITRO ... 29
2.1.1 Traitement du sang de cordon ombilical ... 29
2.1.2 Protocole ISHAGE ... 31
2.1.3 Essais de progéniteurs... 33
2.1.4 Marquage des molécules de migration à la moelle osseuse ... 34
2.2 EXPÉRIENCES IN VIVO ... 35
2.2.1 Modèle murin ... 35
2.2.2 Analyses post-greffe... 36
2.2.2.1 Analyse sanguine ... 36
2.2.2.2 Évaluation de la prise de greffe ... 36
2.2.2.3 Analyses statistiques ... 37
3. RÉSULTATS ... 39
3.1 RÉSULTATS IN VITRO ... 39
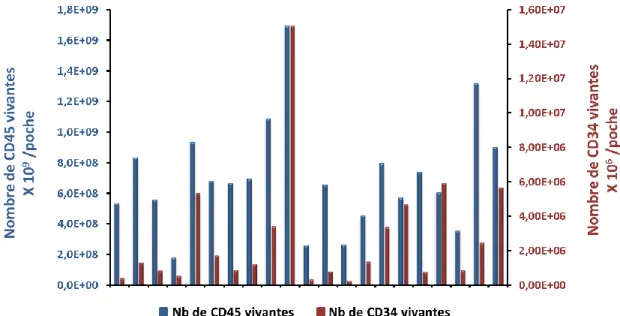
3.1.1 Contenu des unités de sang de cordon ... 39
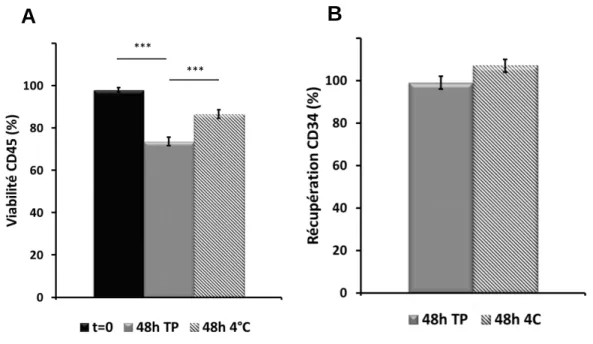
3.1.2 Effet de la température d’entreposage sur la viabilité des cellules ... 40
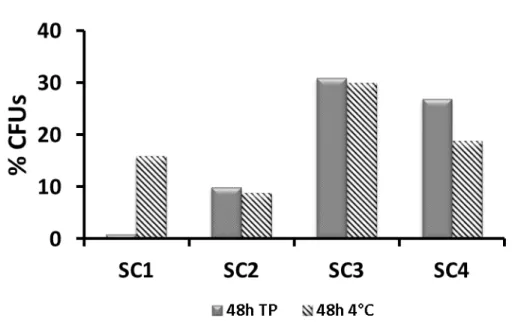
3.1.3 Effet de la température d’entreposage sur le potentiel de différenciation des CSH ... 42
vi
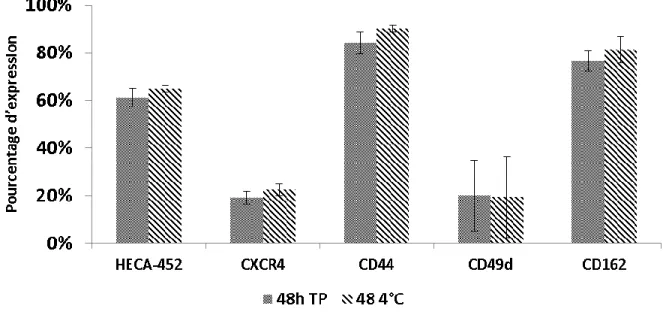
3.1.4 Effet de la température d’entreposage sur l’expression de molécules de
surface ... 44
3.2 RÉSULTATS IN VIVO ... 45
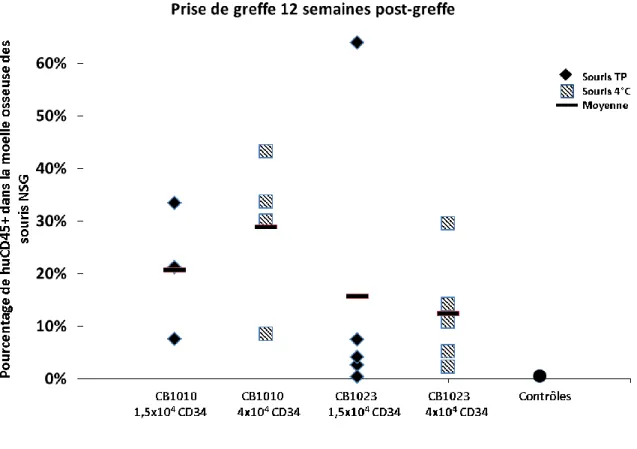
3.2.1 Mise au point de la transplantation de cellules souches hématopoïétiques 45 3.2.2 Reproductibilité des expériences 72 heures ... 47
3.2.3 Effet de la température d’entreposage pendant le traitement du sang de cordon sur la prise de greffe ... 49
3.2.3.1 Cellules humaines en circulation... 52
3.2.3.2 Prise de greffe à long terme ... 52
3.2.4 Prédictibilité de la prise de greffe ... 57
4. DISCUSSION ... 59
5. CONCLUSION ... 65
vii LISTE DES FIGURES
Figure 1. L’hématopoïèse. ... 3
Figure 2. Recours aux différentes sources de CSH. ... 22
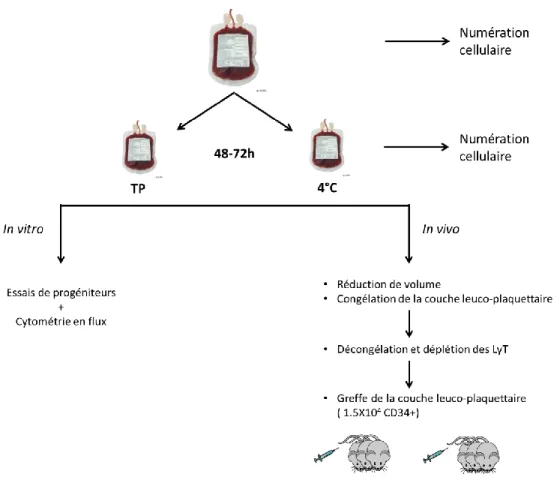
Figure 3. Schéma de la méthodologie utilisée pour les essais in vivo ... 30
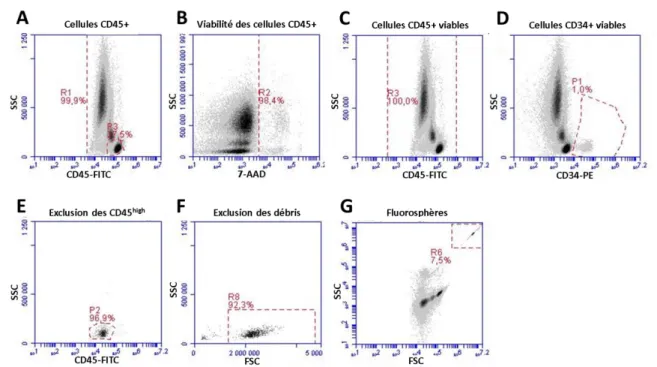
Figure 4. Stratégie d’analyse de cellules du protocole ISHAGE pour l’identification et le compte des CD34+ dans le sang de cordon. ... 33
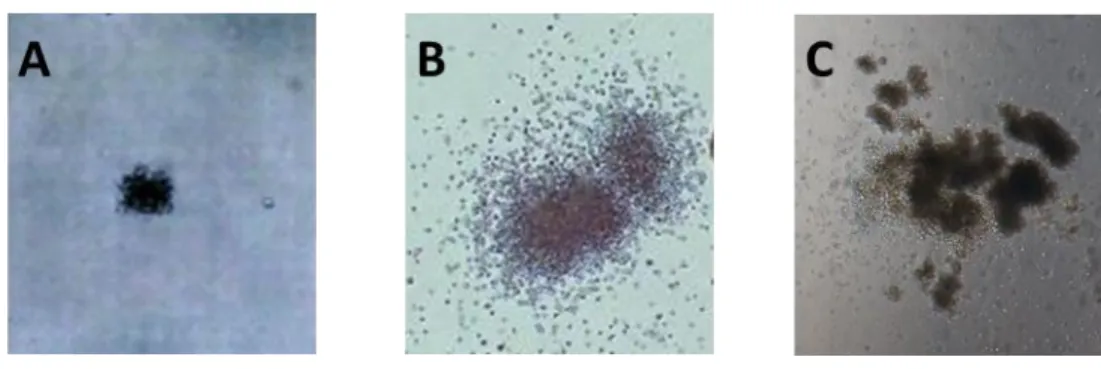
Figure 5. La morphologie des colonies des essais de progéniteurs. ... 34
Figure 6. Contenu cellulaire des unités de sang de cordon à leur réception. ... 40
Figure 7. Impact de la température d’entreposage sur les populations cellulaires des USC……… ... 42
Figure 8. Impact de la température d’entreposage sur le nombre de progéniteurs hématopoïétiques des USC... 43
Figure 9. Impact de la température d’entreposage du sang de cordon sur l’expression de molécules à la surface des CD34. ... 45
Figure 10. Prise de greffe chez les souris selon la dose de cellules transplantées………... ... 47
Figure 11. Impact de l’entreposage du sang de cordon ombilical pendant 72 heures avant la congélation sur la prise de greffe. ... 49
Figure 12. Analyse du contenu en CD34+ des USC en vue de la greffe. ... 51
Figure 13. Profils de cytométrie de la moelle osseuse de souris NSG. ... 53
Figure 14. Reconstitution hématopoïétique chez les souris NSG. ... 54
Figure 15. Reconstitution hématopoïétique chez les souris NSG (suite). ... 56
Figure 16. Corrélation entre le contenu en progéniteurs CFU et la prise de greffe………. . ……….58
viii LISTE DES ABRÉBIATIONS
AABB : American Association of Blood Banks ALDH : aldéhyde déshydrogénase
BEST :Biomedical Excellence for Safer Transfusion BSA : bovine serum albumin
CFC : colony-forming cell CFU : colony-forming unit
CFU-E : colony-forming unit - erythrocytes
CFU-GEMM : colony forming unit – granulocytes, erythrocytes, monocytes, megakaryocytes
CFU-GM : colony-forming unit – granulocytes, monocytes cGy : centigray
CHU : Centre Hospitalier Universitaire CMH : complexe majeur d’histocompatibilité CPA : Comité de protection des animaux CPH : cellules progénitrices hématopoïétiques CSH : cellules souches hématopoïétiques CSP : cellules souches périphériques stimulées CTL : contrôle
CXCR4 : C-X-C chemokine receptor type 4
DMSO : diméthyl sulfoxyde DPP4 :Dipeptidyl peptidase-4
EDTA : acide éthylène diamine tétraacétique
FACT : Foundation for the Accreditation of Cellular Therapy G-CSF : granulocyte colony-stimulating factor
GvHD : graft-versus-host disease HLA : antigènes leucocytaires humains huCD45 : cellules CD45+ humaines IL-3 : interleukine-3
IL-6 : interleukine-6
ISHAGE : International Society of Hematotherapy and Graft Engineering IV : intraveineux
LT-HSC : long-term hematopoietic stem cells muCD45 : cellules CD45+ murines
NAD : nicotinamide adénine dinucléotide NAM : nicotinamide
NK : natural killers
NOD-SCID : non-obese diabetic severe combined immunodeficiency NSG : NOD/SCID IL2Rgnull
PSGL-1 : P-selectin glycoprotein ligand-1 SC : sang de cordon
SCF : stem cell factor
SDF-1 : stromal cell-derived factor 1 SRC : SCID-repopulating cell
ix SVF : sérum de veau fœtal
TNC : cellules totales nucléées TP : température pièce
TPO : thrombopoiétine
x REMERCIEMENTS
Ce mémoire a été rendu possible (et surtout agréable) grâce à mes collègues et à mes proches.
J’aimerais remercier tous mes amis et collègues d’Héma-Québec, qui m’ont si bien soutenue et qui m’ont tant appris pendant ma maîtrise. Un gros merci en particulier à ma directrice Renée Bazin, dont la rigueur, l’attitude positive et l’enthousiasme pour son travail ont été contagieux et m’ont donné envie de faire carrière en science.
Et un gros merci à ma famille, qui a été très patiente et qui m’a endurée pendant ce long processus! Merci à mes parents et à Christina, pour vos encouragements, votre support inconditionnel et votre amour.
1 1. INTRODUCTION
1.1 HÉMATOPOÏÈSE
L’hématopoïèse est le processus permettant la production des cellules sanguines. Puisque ces cellules ont une durée de vie limitée, le corps humain a besoin en moyenne de 100 milliards de nouvelles cellules hématopoïétiques chaque jour. C’est dans les années 1960 que Till et McCulloch ont découvert que l’hématopoïèse est assurée par les cellules souches hématopoïétiques (CSH) (Figure 1) [1]. Ces cellules primitives et non différenciées possèdent deux caractéristiques qui les distinguent des autres cellules ; elles ont la capacité d’auto-renouvellement, et aussi de différenciation, c’est-à-dire qu’elles peuvent se différencier en tout l’éventail des cellules spécialisées qui composent le sang (érythrocytes, granulocytes, plaquettes, etc.) [2]. Des CSH qui reçoivent un signal de différenciation deviennent des cellules progénitrices hématopoïétiques (CPH), à partir desquelles deux voies de différenciation peuvent être empruntées, selon les cytokines et les signaux auxquels sont exposées les cellules : la voie lymphoïde, qui mène à la production des cellules de l’immunité acquise, soit les lymphocytes T et B et les natural killer (NK), ou la voie myéloïde, qui assure le renouvellement des globules rouges, des plaquettes et des cellules de l’immunité innée, c’est-à-dire les neutrophiles, basophiles, éosinophiles, et monocytes [2].
Chez l’adulte, la plupart des CSH se trouvent dans les niches ostoéblastiques de la moelle osseuse, où elles représentent environ 0,005% des cellules totales [3]. C’est dans la moelle osseuse qu’a lieu l’hématopoïèse, et d’où les cellules hématopoïétiques créées vont migrer vers la circulation sanguine.
Bien qu’elles aient été découvertes il y a plusieurs décennies, l’identification et la caractérisation des CSH demeurent problématiques, principalement à cause de l’hétérogénéité de cette population cellulaire et du fait que ces cellules sont très rares. Le modèle par excellence pour l’identification des CSH est l’essai in vivo, qui consiste à injecter des cellules à un animal et à observer s’il y a reconstitution
2
hématopoïétique [3]. C’est grâce à ce type d’essai que nous savons qu’il existe deux types de cellules souches hématopoïétiques; les short-term hematopoietic stem cells (ST-HSC), qui ont une capacité d’auto-renouvellement limitée et sont responsables de la prise de greffe initiale en procurant des cellules hématopoïétiques pendant trois à quatre mois, et les long-term hematopoietic stem cells (LT-HSC), qui vont assurer la production de cellules hématopoïétiques à long terme[4]. La transplantation chez des animaux est la seule façon de distinguer ces deux types de population cellulaire de façon certaine; on examine, après la transplantation, s’il y a présence soutenue de cellules hématopoïétiques à long terme. Par la suite, on utilise les cellules prélevées chez l’animal reconstitué pour transplanter un second animal. La transplantation secondaire est la seule manière d’identifier avec certitude les LT-HSC.
Mais puisque ces essais sont coûteux et requièrent beaucoup de temps, d’autres méthodes plus simples ont dû être développées pour l’identification des CSH. L’approche phénotypique est la plus utilisée; bien que nous ne sommes pas encore capables de caractériser et d’identifier toutes les CSH, nous savons que la majorité des CSH et CPH expriment à leur surface la molécule CD34, une glycoprotéine de 90-120 kilodaltons [3], ce qui en fait le marqueur le plus couramment utilisé pour identifier les CSH et CPH. Malgré les limites de cette approche, notamment la découverte d’une population de CSH/CPH CD34- [5], l’expression de CD34 est devenue le standard pour l’identification des CSH. Avec les années, d’autres marqueurs ont été découverts, de sorte que les CSH et CPH sont maintenant reconnues comme étant majoritairement une population CD34+CD38-CD45RA- (lineage-) [3].
3 Figure 1. L’hématopoïèse.
La production des cellules sanguines débute avec les CSH, capables de s’auto-renouveler et de se différencier en un large éventail de cellules. En se différenciant, la cellule en vient à perdre sa capacité d’auto-renouvellement; au stade des progéniteurs, deux voies de différenciation sont possibles, soit la voie lymphoïde ou la voie myéloïde.
1.2 LES GREFFES DE CELLULES SOUCHES HÉMATOPOÏÉTIQUES
Les cellules souches hématopoïétiques sont utilisées depuis plusieurs décennies pour traiter différents désordres du système immunitaire. C’est pendant la Seconde Guerre mondiale, à la suite des bombardements atomiques de Nagasaki et Hirochima, que les effets myélosuppresseurs des radiations ont pu être observés pour la première fois à grande échelle. En effet, tous les survivants avaient subi une baisse importante, voire même une suppression, de la production des cellules sanguines, laissant ainsi leur système immunitaire sans défense. C’est en cherchant un moyen de renverser cet effet que l’injection de moelle osseuse a été essayée, à la fin des années 1950 [6].
4
Depuis, la transplantation de cellules souches est utilisée comme traitement non seulement pour les victimes de radiations, mais également pour plusieurs désordres qui affectent le système hématopoïétique, causant un défaut ou un dérèglement dans la production des cellules du sang. Certaines maladies génétiques, comme l’anémie aplasique (absence de reconstitution des globules rouges, accompagnée de thrombocytopénie et de neutropénie) et l’anémie de Fanconi (qui cause aussi des insuffisances médullaires et des cancers du sang) nécessitent comme traitement la reconstitution d’un système hématopoïétique fonctionnel [7]. C’est aussi le cas de certains cancers, comme la leucémie et le lymphome ; la chimiothérapie nécessaire pour le traitement de ces cancers affecte les cellules en division, dont font partie les CSH. La chimiothérapie a donc comme effet secondaire la destruction du système hématopoïétique; pour la survie du patient, il est primordial de reconstituer sa capacité d’hématopoïèse, à l’aide de la transplantation de CSH [8].
Bien des facteurs influencent la réussite ou l’échec d’une greffe, ce qui fait qu’il est difficile de prévoir le résultat. Le type de cellules, leur provenance, le traitement de conditionnement que le patient reçoit ainsi que la dose cellulaire jouent tous des rôles importants lors de la transplantation de CSH.
1.2.1 Les types de greffe
Les greffes de CSH peuvent être catégorisées selon le type de cellules utilisées : on parle de greffe autologue lorsque les cellules sont préalablement prélevées chez le patient et entreposées/congelées pendant que le patient reçoit un traitement myéloablatif, le plus souvent de la chimiothérapie jumelée à des doses d’irradiation. Une fois son traitement terminé, le patient se fait ré-injecter ses propres cellules. La greffe autologue a l’avantage de permettre une reconstitution hématopoïétique rapide, de même que l’absence ou le faible risque de rejet, qui est une des complications possibles suite à une transplantation de CSH. Lorsqu’un
5
patient reçoit des cellules d’un donneur, plusieurs facteurs (comme par exemple un manque de compatibilité) peuvent faire en sorte que le système immunitaire du patient ne reconnaît pas les cellules du donneur, il engendre une réaction contre ces cellules, menant ainsi au rejet de la greffe [9]. Ce risque est absent lors des greffes autologues. Toutefois, l’utilisation de cellules autologues n’est pas toujours possible, par exemple si le patient a un système immunitaire non fonctionnel, ou encore si ses CSH sont malignes, ce qui entraînerait un risque de rechute important. Dans les cas où on ne peut procéder à une greffe autologue, on utilise les cellules d’un donneur compatible au patient, ce que l’on nomme une greffe allogénique [10]. Dans ce cas, le patient est assuré de recevoir un greffon qui ne contient pas de cellules malignes. Toutefois, la greffe allogénique est plus complexe que l’autologue, puisqu’elle repose sur la compatibilité entre le donneur et le receveur.
1.2.2 La compatibilité HLA
Sans la découverte des antigènes leucocytaires humains (HLA) par Jean Dausset en 1958 [11], il serait impossible de procéder à des transplantations allogéniques, qui requièrent de procéder au typage HLA du donneur et du receveur. Les molécules du complexe majeur d’histocompatibilité (CMH) sont des protéines membranaires exprimées à la surface des cellules; les CMH de classe I sont exprimés par l’ensemble des cellules nucléées de l’organisme, alors que les CMH de classe II sont exprimés à la surface des cellules présentatrices d’antigènes, dont le rôle est de présenter aux lymphocytes T des peptides d’antigènes [12]. On appelle les protéines humaines du CMH les HLA. Le locus CMH est un des principaux déterminants du rejet ou de la prise de greffe d’organes et de cellules, incluant les cellules souches hématopoïétiques [12]. Trois gènes de CMH de classe I existent (HLA-A, HLA-B, HLA-C) de même que plusieurs de classe II (HLA-DR, HLA-DQ, HLA-DP, HLA-DM, HLA-DO). Lors d’une greffe de tissu, la sélection d’un donneur dépend de la compatibilité HLA. Celle-ci est déterminée à partir des loci HLA-A, -B, -C et –DR [13]. Les différences de profils de HLA entre
6
donneur et receveur augmentant grandement le risque de rejet de greffe ou de la maladie du greffon contre l’hôte (graft-versus-host disease, GvHD), il est important de trouver le donneur le plus compatible possible afin d’optimiser la réussite de la greffe.
1.3 LES SOURCES DE CELLULES SOUCHES HÉMATOPOÏÉTIQUES
Les transplantations de CSH peuvent également être catégorisées selon la source des cellules utilisées. Alors qu’au début, on parlait de greffe de moelle osseuse, le terme a été remplacé par « greffe de cellules souches hématopoïétiques », en raison de l’utilisation croissante de sources alternatives à la moelle osseuse; le sang périphérique et le sang de cordon ombilical [14] [15]. Chacune de ces sources de CSH possède différentes caractéristiques, de même que des avantages et inconvénients à prendre en considération [16].
1.3.1 La moelle osseuse
La première transplantation de moelle osseuse réussie a été effectuée à la fin des années 1950 par le Dr ED Thomas et son équipe, chez un patient atteint de leucémie [17]. Les cellules provenaient de son jumeau identique, assurant donc la comptabilité entre le donneur et le receveur. Par la suite, la découverte des HLA a permis le début des allo-greffes. En raison de l’absence d’un registre de donneurs, toutes les transplantations allogéniques étaient effectuées avec le don d’un parent/frère/sœur des patients. Ce n’est qu’en 1973 qu’a eu lieu la première transplantation à partir de cellules d’un donneur non apparenté au patient [11]. Par la suite, la création d’un registre national, puis international, de donneurs de moelle osseuse a permis à plusieurs patients sans parent compatible d’être transplantés.
7
Le don de moelle osseuse requiert une chirurgie mineure; le donneur est placé sous anesthésie générale, et la moelle est prélevée dans les os du bassin à l’aide d’aiguilles stériles. Une période de convalescence pouvant aller jusqu’à deux semaines suit l’opération [18]. Étant donné le volume important (un litre) qu’il est possible d’aller chercher lors du don, l’extraction de moelle osseuse est la méthode qui permet d’aller chercher le plus de CSH possible. Toutefois, la recherche d’un donneur compatible (pouvant prendre plusieurs semaines), la procédure chirurgicale et la logistique nécessaire au déroulement du don et de la greffe sont des désagréments importants à l’utilisation de la moelle osseuse.
1.3.2 Le sang périphérique (cellules souches périphériques stimulées (CSP)) La présence de CSH dans la circulation sanguine est connue depuis les années 1950 [19]. L’idée d’utiliser des CSH prélevées de cette façon au lieu de dons de moelle osseuse est arrivée dans les années 1970, lorsqu’il a été possible pour la première fois de prélever des celulles formant des colonies (colony-forming cells ou CFC, c’est-à-dire des cellules encore capables de se différencier dans les différents lignages hématopoïétiques) dans le sang périphérique [19]. Les premières greffes de CSH de sang périphérique ont eu lieu dans les années 1980, avec le développement de techniques de cryopréservation et d’aphérèse; en effet, à l’état normal, les CSH se retrouvent en faible nombre dans la circulation sanguine. Il était nécessaire de faire plusieurs prélèvements jusqu’à l’obtention de la dose de cellules nécessaire. Chaque don de cellules était donc prélevé et cryopréservé jusqu’à la greffe.
Après les premiers cas rapportés de reconstitution totale du système hématopoïétique avec des CSH de sang périphérique, des efforts ont été faits pour augmenter les doses de cellules prélevées, menant à l’utilisation de certaines cytokines comme la granulocyte colony-stimulating factor (G-CSF), un facteur de croissance hématopoïétique permettant d’augmenter la quantité de CSH dans la circulation sanguine, en mobilisant les cellules de la moelle osseuse vers la
8
circulation sanguine [20]. Ainsi, quelques jours avant le prélèvement, le donneur reçoit de façon intraveineuse des doses de cytokines, et celles-ci mobilisent les CSH vers le sang périphérique. Une fois les cellules mobilisées, on procède à la leucophérèse; le sang du donneur est prélevé et centrifugé pour isoler les globules blancs des plaquettes et globules rouges. Ces derniers sont alors retournés au donneur, alors que les globules blancs, contenant les CSH, sont greffés au patient.
Malgré des inquiétudes initiales face à l’utilisation des CSH de sang périphérique, entre autres un plus grand risque de GvHD dû à la présence d’un plus grand nombre de lymphocytes T dans le sang périphérique que dans la moelle osseuse, de nombreuses études cliniques ont démontré qu’il n’y a pas de différence significative entre les taux de GvHD et de survie des patients après des greffes de moelle osseuse et de sang périphérique [21]. De plus, on observe chez les patients greffés avec des CSH de sang périphérique une reprise des neutrophiles et des plaquettes plus rapide que chez les patients greffés avec des CSH de moelle osseuse [22].
En raison de cet avantage, et du fait que cette technique de prélèvement soit moins invasive que le prélèvement de moelle osseuse, le sang périphérique comme source de CSH est de plus en plus favorisé par les cliniciens; entre 2002 et 2006, 74% des transplantations allogéniques de CSH chez les adultes étaient effectuées avec des cellules de sang périphérique [23].
1.3.3 Le sang de cordon ombilical
Toutefois, une autre source de CSH est de plus en plus sollicitée : le sang de cordon ombilical. La première greffe de cellules souches issues de sang de cordon ombilical a eu lieu en 1988. C’est le Dr Hal E. Broxmeyer qui a été le premier à s’interroger sur le potentiel du cordon ombilical [24], jusque-là considéré comme un déchet biologique et jeté après la naissance. Il était connu que le sang de cordon ombilical contenait des progéniteurs hématopoïétiques, qui pouvaient être
9
« cultivés » grâce aux essais de différenciation en progéniteurs précurseurs des granulocytes et macrophages (colony-forming unit-granulocyte/macrophage, CFU-GM) [25]. Toutefois, il était impossible de savoir si des LT-HSC s’y trouvaient, puisque le test in vivo consistant à transplanter des cellules à des animaux dont le système immunitaire est défectueux n’existait pas encore à ce moment, laissant les chercheurs incapables d’identifier les LT-HSC. Toutefois, en raison de la présence d’un nombre important de progéniteurs (CFC) et de la grande capacité de prolifération des progéniteurs dans le sang de cordon, Broxmeyer était convaincu de la possibilité d’utiliser des cellules de sang de cordon à des fins de transplantation. Cela fut démontré en 1988, lorsqu’un enfant atteint d’anémie de Fanconi fut transplanté avec le sang de cordon de sa sœur, qui avait été prélevé et congelé à sa naissance [26]. La greffe, effectuée par le Dr Eliane Gluckman, fut un succès, démontrant ainsi qu’une seule unité de sang de cordon était suffisante pour reconstituer, à long terme, le système hématopoïétique d’un enfant, et que la congélation du sang de cordon n’affectait pas la capacité de reconstitution des cellules.
Alors que les premiers essais cliniques fructueux s’enchaînaient, des tests en laboratoire ont été développés grâce à des modèles animaux comme les souris génétiquement modifiées SCID, NOD/SCID et NSG (voir section 2.2.1), permettant d’identifier les LT-HSC et d’analyser le potentiel de repopulation des CSH [25]. Ces tests mesurant les CSH possédant la capacité de reconstitution hématopoïétique (SCID-repopulating cells, SRC) ont permis d’observer que le potentiel et la capacité de prise de greffe des CSH de sang de cordon ombilical étaient comparables à ceux des cellules de moelle osseuse [27]. Après ces observations, et les succès cliniques, l’utilisation des cellules issues de sang de cordon ombilical s’est répandue. En plus de leur grand potentiel de prolifération, les cellules de sang de cordon ombilical ont plusieurs autres avantages, comme le fait que la méthode de prélèvement du sang de cordon ombilical ne comporte aucun risque pour le donneur. De plus, on observe, lors des greffes de CSH de sang de cordon ombilical, une plus faible incidence de GvHD [28]. Cette complication se développe
10
lorsque les cellules du greffon reconnaissent les tissus de l’hôte comme étant étrangers, ce qui enclenche l’activation et l’expansion des lymphocytes T du greffon, qui vont ensuite attaquer les tissus du receveur. Cet effet moindre serait dû à l’immaturité des lymphocytes T présents dans le sang de cordon ombilical [29].
Un autre avantage majeur du sang de cordon ombilical concerne la compatibilité HLA. Plusieurs études et résultats cliniques ont démontré que la greffe de sang de cordon ombilical permet une plus grande permissivité au niveau de la compatibilité entre le donneur et le receveur; le taux de survie sans rechute un an après une greffe de CSH de sang de cordon compatible entre 4/6 et 6/6 (donc avec aucune, une ou deux discordances au niveau des allèles HLA entre le patient et le donneur), est comparable à celui de patients greffés avec des cellules d’un donneur adulte compatible à 7/8 ou 8/8. En général, le typage HLA pour le sang de cordon se concentre sur 3 loci (HLA-A, -B et –DRB1) [30] alors que le typage HLA pour les cellules provenant de la moelle osseuse ou du sang périphérique va se faire sur 4 loci (HLA-A, -B, -C, DRB1) [31]. Ainsi, deux discordances HLA pour les CSH de sang de cordon ont le même effet qu’une seule discordance, ou même qu’un don totalement compatible provenant d’un adulte [32]. Cette compatibilité plus permissive du sang de cordon est un avantage considérable pour les patients possédant un typage HLA rare, surtout dans le cas des minorités ethniques. Considérant le fait que seulement 30% des patients cherchant un donneur à l’international trouvent un donneur adulte compatible, le sang de cordon ombilical est devenu une alternative très attrayante [33].
Finalement, la possibilité de prélever un sang de cordon, de faire le typage HLA à partir d’un échantillon et de le congeler par la suite est un avantage important, puisque cela permet la mise en banque des unités de sang de cordon. La présence d’un inventaire d’unités déjà typées assure la disponibilité immédiate des cellules, contrairement à l’utilisation de la moelle osseuse et du sang périphérique,
11
où la recherche d’un donneur compatible et l’organisation des procédures nécessaire pour le don peuvent prendre plusieurs mois.
Malgré tous les avantages des cellules de sang de cordon ombilical, il existe un inconvénient majeur à leur utilisation: le faible nombre de cellules présentes dans le sang de cordon. On y retrouve beaucoup moins de CSH que dans la moelle osseuse et le sang périphérique. Or, plusieurs études ont démontré que le facteur déterminant pour une prise de greffe rapide est la dose de cellules injectée [34-40]. Il a aussi été démontré que la dose de cellules greffées est directement reliée à la reprise des neutrophiles et des plaquettes; la dose minimale de cellules est de 3x107 cellules totales nucléées par kg [41, 42]. Les faibles doses de cellules du sang de cordon ombilical limitent donc l’utilisation des dons de sang de cordon, puisqu’il est rare de pouvoir greffer des patients de plus de 50kg. Cette limite empêche la plupart des patients adultes d’avoir recours au sang de cordon, particulièrement en Amérique du Nord, où le poids moyen d’un adulte est de plus de 80kg [43].
Même lorsqu’un sang de cordon contient assez de cellules pour greffer un patient, la dose est toujours plus faible que celle provenant d’une moelle osseuse; la médiane de la dose cellulaire pour un don de moelle osseuse est de 3x106 CD34/kg, alors que celle pour un sang de cordon est de 2,7x106 CD34/kg [35]. En plus d’augmenter le risque d’échec de la greffe, une faible dose de cellules mène à un délai de la prise de greffe et de la reconstitution hématopoïétique, augmentant ainsi les risques d’infection des patients lors de l’aplasie, et ce même si le patient reçoit une dose cellulaire suffisante à la prise de greffe [44]. De ce fait, un des problèmes les plus importants lors de la greffe de sang de cordon est le temps nécessaire à la reprise des neutrophiles et des plaquettes, qui est beaucoup plus long après une greffe de sang de cordon qu’après une greffe de sang périphérique ou de moelle osseuse; le temps médian pour la reprise des neutrophiles est de plus de 3 semaines pour le sang de cordon, alors qu’il est de 16 à 18 jours et de
12
13 à 15 jours respectivement pour le sang périphérique et la moelle osseuse [45-49].
En raison de cette contrainte, le sang de cordon ombilical est surtout utilisé pour transplanter les enfants, qui requièrent une dose de cellules plus faible que les adultes.
1.4 MISE EN BANQUE DU SANG DE CORDON OMBILICAL
Après le succès des premières transplantations de sang de cordon ombilical, des banques de sang de cordon ont été établies afin de prélever et d’entreposer des unités de sang de cordon. Il existe deux types de banques, les banques privées et les banques publiques [50]. Dans les banques privées, le sang de cordon est congelé et réservé uniquement à l’usage de la famille de l’enfant, ce qui assure la disponibilité de cellules compatibles dans l’éventualité où l’enfant développerait une maladie nécessitant une greffe de CSH. Pour ce qui est des banques publiques, les unités de sang de cordon sont prélevées et entreposées dans un inventaire mis à la disponibilité de la communauté internationale. Une différence importante entre les deux types de banques est le standard de qualité; alors qu’une grande partie des unités envoyées aux banques publiques sont disqualifiées et jetées en raison de critères de qualification très stricts, les banques privées ne peuvent disqualifier les dons qui leur sont acheminés, puisqu’ils appartiennent à la famille. Il est alors possible qu’une famille débourse des frais pendant plusieurs années pour la conservation d’une unité de sang de cordon ombilical qui ne pourrait finalement pas être utilisée pour une greffe. Au Canada, la plupart des banques de sang de cordon ombilical sont privées. Jusqu’à tout récemment, une seule banque publique était en opération au pays, administrée par Héma-Québec.
13
La collecte du sang de cordon ombilical ne comporte aucun risque pour la mère et le nouveau-né. Le sang de cordon est recueilli après l’accouchement, avant l’expulsion placentaire. L’infirmière désinfecte le cordon ombilical avec une solution antiseptique, et recueille le sang à l’aide d’une aiguille reliée à une poche de 250mL contenant une solution anticoagulante d’acide citrique et de dextrose.
Par la suite, la poche de sang de cordon est envoyée à la banque publique de sang de cordon d’Héma-Québec, située à Montréal. Comme de nombreuses banques publiques, celle d’Héma-Québec respecte les standards internationaux décrits par les organismes réglementaires tels que l’AABB (American Association of Blood Banks) et Netcord-FACT (Netcord-Foundation for the Accreditation of Cellular Therapy), fondé en 1998 dans le but d’établir un registre international regroupant les unités de toutes les banques publiques, de même que mettre en place des procédures assurant la qualité des unités mises en banque [51].
Subséquemment, plusieurs critères doivent être respectés lors de la mise en banque d’unités de sang de cordon. Tout d’abord, pour qu’une unité soit acceptée par la banque, la poche doit contenir un minimum de 85 mL de sang de cordon, ainsi qu’un minimum de 1.3 x 109
cellules totales nucléées (TNC). De plus, tous les dons doivent être congelés dans les 48 heures suivant le prélèvement. Ces critères de qualifications robustes font en sorte que plus de 60% des dons de sang de cordon prélevés et acheminés vers la banque sont disqualifiés.
Une fois le don qualifié, celui-ci est centrifugé et subit une réduction de volume, effectué avec un appareil semi-automatisé de type extracteur. Après centrifugation, le contenu de la poche de sang est séparé en 3 couches, soit une couche de globules rouges au fond de la poche, une couche de plasma au-dessus de la poche, et une couche leuco-plaquettaire à l’interface des deux couches, contenant les cellules mononuclées dont font partie les CSH. La réduction de volume à l’aide de l’appareil extracteur permet de se débarrasser d’une partie du plasma et des globules rouges présents, ce qui augmente la concentration en CSH. Une fois
14
réduite, la poche de sang de cordon est transférée dans une plus petite poche, à laquelle est ajoutée une solution de cryopréservation contenant du diméthylsulfoxyde (DMSO) et du Dextran 40. La poche est ensuite entreposée dans la phase gazeuse de l’azote liquide. Des échantillons sont prélevés pendant le processus de mise en banque, permettant ainsi de faire plusieurs tests de dépistage de maladies et de typage HLA.
1.5 STRATÉGIES POUR L’OPTIMISATION DES GREFFES DE CSH DE SANG DE CORDON OMBILICAL
Ces dernières années, plusieurs approches ont été tentées pour remédier au problème de la faible dose de cellules des dons de sang de cordon. Les deux approches principales sont l’expansion des CSH de sang de cordon avant la greffe, et la modulation des cellules pour augmenter leur capacité à se loger dans la niche hématopoïétique.
1.5.1 Les doubles transplantations de sang de cordon ombilical
Une des premières approches exploitées pour surmonter le problème est la greffe de deux unités de sang de cordon. Puisqu’il est souvent impossible de trouver une unité de sang de cordon respectant le minimum de 2.5x107 TNC/kg, l’utilisation de deux unités a été proposée. La faisabilité et la sécurité de l’approche ont été démontrées au début des années 2000, lorsqu’un groupe de l’Université du Minnesota a utilisé une stratégie mêlant des régimes de conditionnement à intensité réduite à la double transplantation, pour traiter des patients adultes qui n’avaient pas accès à des dons de sang de cordon avec suffisamment de cellules [52, 53].
15
Depuis, la double transplantation est devenue un moyen de greffer des patients adultes n’ayant pas accès à des donneurs de moelle osseuse ou de sang périphérique; chez les patients adultes, les patients recevant une double transplantation sont maintenant plus nombreux que ceux recevant une seule unité de sang de cordon [54]. Bien qu’initialement, chez les adultes, une meilleure prise de greffe a été observée chez les patients recevant deux unités de sang de cordon, comparativement à une seule [55, 56], les données cliniques dont nous disposons actuellement ne permettent pas de conclure qu’il y ait un avantage définitif, à long terme, à la double transplantation. Effectivement, des résultats plus récents semblent indiquer qu’il n’y a pas d’avantage à recevoir deux unités de sang de cordon, comparativement à une unité ayant une dose cellulaire adéquate [57]. De plus, une des limitations de cette approche est les coûts liés à celle-ci; alors qu’un sang de cordon est déjà dispendieux, les coûts pour une double transplantation, incluant la recherche et le typage afin de trouver deux unités, peuvent s’élever jusqu’à 90 000$ [58].
Malgré le fait qu’il est maintenant théoriquement possible de greffer n’importe quel adulte, peu importe son poids, avec des cellules de sang de cordon, l’utilisation de deux unités ne semble pas accélérer la reprise hématopoïétique [59, 60]. Ainsi, d’autres pistes ont été explorées afin de contrer la problématique du faible nombre de cellules dans le sang de cordon.
1.5.2 Expansion des CSH
Beaucoup d’efforts ont été investis pour tenter d’accroître la quantité de CSH dans le sang de cordon, en faisant des expansions en culture avant de greffer les cellules (expansion ex vivo). Les premières tentatives à cet effet se sont concentrées sur l’utilisation de cytokines, puisque plusieurs cytokines ont été identifiées dans la régulation des CSH, au niveau de leur survie, prolifération ou différenciation.
16
Une des premières études visant à tester l’expansion des CSH en culture a utilisé une approche qui consistait à greffer à des patients une unité de sang de cordon séparée en deux fractions; une fraction non manipulée et une fraction expansionnée, afin d’éviter d’utiliser deux unités de sang de cordon [61]. La partie non manipulée du sang de cordon était donc infusée aux patients, et l’autre fraction mise en culture pendant 10 jours avec un cocktail de cytokines comprenant du stem cell factor (SCF), granulocyte colony-stimulating factor (G-CSF) et de la thrombopoiétine (TPO). Cette fraction était par la suite infusée aux patients. Bien que la culture des cellules avec les cytokines ait permis des expansions de 56 fois des cellules mononuclées et de 4 fois des cellules CD34+, aucune amélioration dans le délai avant la prise de greffe n’a pu être observée chez les patients recevant des cellules cultivées de cette façon. Toutefois, cette étude a démontré que la greffe de cellules cultivées in vitro était sécuritaire, encourageant ainsi plusieurs autres équipes de recherche à poursuivre sur la voie de l’expansion des CSH, malgré le manque de succès.
La difficulté de cette approche vient du fait que les mécanismes entourant la capacité d’auto-renouvellement des CSH ne sont pas encore bien compris. Ainsi, différentes combinaisons de cytokines permettent d’augmenter le nombre de progéniteurs hématopoïétiques, mais poussent les CSH vers la différenciation, affectant la capacité de reconstitution à long terme des cellules. Le manque de succès de cette approche a mené la communauté scientifique à chercher d’autres façons de procéder à l’expansion des CSH en culture, notamment en travaillant sur des voies de signalisations moléculaires, et en utilisant des facteurs de transcription ou encore des composés chimiques à la pace de cytokines.
1.5.2.1 Récepteurs Notch
Les récepteurs Notch et leurs ligands (Jagged-1 et 2, et Delta-like 1, 3 et 4) jouent un rôle important dans une grande variété de processus biologiques. Des études portant sur les CSH ont démontré la présence du gène Notch1 chez les cellules CD34+ [62]. Depuis, cette voie de signalisation a été utilisée dans le but d’accroître
17
la quantité de CSH de sang de cordon. Les travaux de Varnum-Finney et Delaney, entre autres, ont permis d’obtenir des expansions des cellules CD34+ de plus de 10 fois, en exposant les cellules à une forme immobilisée du ligand Delta-1 et à un cocktail de cytokines contenant SCF, Flt3 ligand, IL-6, thrombopoïétine et IL-3 [63]. Après plusieurs études pré-cliniques démontrant l’augmentation du nombre de cellules SRC et la rapide reconstitution myéloïde chez les souris avec cette approche, l’équipe de Delaney a décidé de tester sa technique d’expansion avec une étude clinique de phase I. Chacun des 10 patients a reçu une unité de sang de cordon non manipulée, et une unité mise en culture de la façon détaillée ci-dessus. Après 16 jours de culture, l’expansion moyenne des cellules CD34+ était de 164 fois, permettant ainsi au patient de recevoir une dose de 6x106 CD34/kg [64].
Aucun effet négatif n’a été observé chez les patients, démontrant ainsi la sécurité du protocole. Le temps médian pour la prise de greffe était de 16 jours, soit 10 jours de moins que ce qu’on peut observer chez les patients recevant une thérapie conventionnelle avec deux unités de sang de cordon non manipulées. Toutefois, l’analyse de la prise de greffe à long terme a montré que la reconstitution hématopoïétique a été atteinte avec les cellules de l’unité manipulée chez seulement 2 patients, laissant croire que l’expansion des cellules n’était pas une expansion des « vraies » cellules souches à long terme, c’est-à-dire les LT-HSC.
1.5.2.2 Molécule Copper
Des molécules chimiques ont aussi été utilisées pour l’expansion des CSH. L’une d’entre elle, le nicotinamide (NAM), semble prometteuse. La nicotinamide fait partie du groupe de vitamine B, et est un inhibiteur des enzymes dépendantes du
nicotinamide adénine dinucléotide (NAD). Il a été démontré que le NAM retarde la différenciation des cellules CD34+ en inhibant SIRT1; en cultivant des CD34+ en présence de NAM et de plusieurs cytokines comme TPO et IL-6, Peled et al. ont obtenu une augmentation du nombre de SRC (9 fois plus de SRC avec les cellules cultivées en présence de NAM comparativement à des cellules CD34+ non expansionnées) [65]. Après ces résultats pré-cliniques encourageants, un produit
18
commercial, Nicord, fut développé afin de procéder à une étude clinique de phase I. Lors de cette étude, 11 patients ont reçu des cellules CD34+ expansionnées 72 fois avec NiCord, de même qu’un sang de cordon non manipulé [66]. La prise de greffe fut rapide, avec un temps médian de 13 jours pour la reprise des neutrophiles, et 33 jours pour celle des plaquettes. De plus, chez 6 patients, la reprise hématopoïétique à long terme fut assurée par le sang de cordon expansionné avec NiCord, une première dans des essais cliniques de cellules expansionnées. Ces résultats laissent donc croire que NiCord permet l’expansion des cellules CD34+ sans qu’il y ait perte de leur caractère multipotent. Des essais cliniques de phase II sont présentement en cours.
1.5.2.3 Molécule UM171
Plus récemment, les travaux d’un groupe de recherche canadien ont permis d’identifier un composé qui semble prometteur pour l’expansion des cellules souches [67]. Plusieurs tests in vitro ont démontré que le composé UM171 atténuerait la différenciation des cellules et stimulerait l’expansion des cellules hématopoïétiques primitives (LT-HSC), celles qui sont responsables de la reconstitution hématopoïétique à long terme. Plusieurs essais avec des modèles animaux de reconstitution hématopoïétique ont mis en évidence l’effet d’UM171 sur les cellules souches primitives, puisqu’on pouvait observer une prise de greffe chez les souris injectées avec très peu de cellules cultivées avec le composé. De plus, la présence soutenue de LT-HSC a été démontrée à l’aide de greffes secondaires, dans lesquelles on prélève les cellules souches de la moelle osseuse du premier groupe de souris greffées, pour les injecter à un deuxième groupe de souris immunodéprimés. La prise de greffe dans le deuxième groupe confirme la présence et la compétence de LT-HSC. Présentement, les auteurs de cette étude tentent d’élucider le mécanisme d’action du composé UM171. Des essais cliniques sont à prévoir pour évaluer le potentiel du composé, qui pourrait s’avérer la solution au problème du faible nombre de cellules souches hématopoïétiques présent dans le sang de cordon ombilical.
19
Plusieurs autres stratégies d’expansion des cellules de sang de cordon sont présentement étudiées. Bien que plusieurs semblent prometteuses, la plupart d’entre elles requièrent deux unités de sang de cordon, engendrant des coûts importants pour les centres hospitaliers. De plus, la plupart des techniques d’expansion actuellement testées semblent assurer une prise de greffe à court terme seulement. Toutefois, puisque l’infection lors de la période d’aplasie demeure l’une des causes principales de décès après transplantation, la prise de greffe à court terme assurée par les cellules expansionnées reste très utile.
Comme il a été mentionné ci-dessus, une autre stratégie vise à améliorer la prise de greffe des cellules de sang de cordon ombilical, en misant sur l’acheminement des cellules transplantées vers les niches de la moelle osseuse.
1.5.3 Optimisation du homing des CSH
La réussite d’une greffe de CSH repose, en premier lieu, sur la capacité des cellules injectées à migrer vers la moelle osseuse, pour aller se loger dans des niches. Ce processus est appelé homing, et bien qu’il ne soit pas encore complètement élucidé, nous savons qu’il implique la migration et la diapédèse des cellules, grâce à l’action de chimiokines sécrétées par la niche de la moelle osseuse et de molécules d’adhésion présentes à la surface des CSH [68].
Bien que la prise de greffe tardive observée après la greffe de sang de cordon ombilical puisse être expliquée par la faible dose cellulaire, un autre facteur pouvant être en cause serait la capacité de homing des CSH de sang de cordon. Plusieurs molécules d’adhésion jouent un rôle dans la migration des CSH vers la moelle osseuse, et les CSH de sang de cordon ombilical se sont avérées exprimer des niveaux inférieurs de CD49e, CD49f et de CXCR4 que les CSH de sang périphérique et de moelle osseuse [69]. Des efforts ont donc été faits, ces dernières années, pour améliorer le homing des CSH, par exemple en injectant les
20
cellules directement dans la moelle osseuse. Des études cliniques ont démontré que bien que les taux de prise de greffe étaient satisfaisants avec cette technique, les délais pour la prise de greffe dépassaient toujours la barre des 20 jours [70-72].
Une autre façon d’améliorer le homing des CSH est de bloquer certaines molécules ou peptides à la surface des CSH. Par exemple, plusieurs travaux se sont concentrés sur la dipeptidyl peptidase-4 (DPP4), une protéine à la surface des CSH qui clive et inactive la chimiokine stromal cell-derived factor 1 (1). SDF-1, ainsi que son récepteur CXCR4 (aussi appelé CD184), est l’un des médiateurs du homing des CSH vers la moelle osseuse après une transplantation. En clivant le SDF-1, DPP4 régule négativement l’activité de la chimiokine et de ce fait, la migration des CSH. Des études chez la souris ont démontré que l’inhibition de DPP4 menait à une augmentation du homing des cellules de sang de cordon [73]. Une étude clinique récente a testé un inhibiteur oral de DPP4, la sitagliptine, chez des patients recevant une greffe de sang de cordon [74]. 16 patients ont pris une dose quotidienne de sitagliptine entre la journée avant et deux jours après la greffe. Une amélioration très modeste du délai pour la reprise des neutrophiles fut observée. Toutefois, une différence marquée de l’inactivation de DPP4 fut observée entre les patients chez qui la reprise des neutrophiles fut rapide (<21 jours) et les patients avec une reprise plus lente (>21 jours). L’optimisation du dosage et de l’administration de la sitagliptine est nécessaire, mais, bien que modestes, ces résultats semblent indiquer que l’inhibition de DPP4 pourrait être une technique intéressante dans le futur.
D’autres équipes se sont penchées sur la diapédèse des CSH lors du homing, une des premières étapes clés. Les cellules commencent d’abord par rouler sur l’endothélium, et vont s’y lier grâce aux sélectines E et P. Ensuite, les intégrines activées par SDF-1 vont induire l’adhésion des cellules à l’endothélium, notamment grâce à CD44 et PSGL-1. Les cellules peuvent ensuite migrer à travers l’endothélium pour passer dans la moelle osseuse [75]. La liaison aux sélectines requiert la fucosylation des ligands présents à la surface des CSH [76]. Or, les
21
ligands présents sur les CSH de sang de cordon ombilical démontrent des niveaux de fucosylation bien moins élevés que les CSH de sang périphérique mobilisé ou de moelle osseuse [76, 77]. Cette observation a mené à l’hypothèse selon laquelle cette « déficience » en fucosylation expliquerait la plus faible capacité de homing des cellules de sang de cordon, en raison d’un plus faible pouvoir de liaison aux sélectines de l’endothélium. De ce fait, plusieurs équipes ont tenté de fucosyler les CSH de sang de cordon pour améliorer leur homing. En utilisant la fucosyltransférase et son substrat GDP-fructose, il est possible d’augmenter les niveaux de fucosylation des cellules CD34+ jusqu’à 99% [78]. Cette approche est présentement en cours d’essai clinique [78]. Jusqu’à maintenant, 10 patients ont reçu deux unités de sang de cordon; une unité non manipulée, l’autre traitée pendant 30 minutes avec la fucosyltransférase et son substrat. Le temps médian pour la reprise des neutrophiles et des plaquettes est de 14 et 33 jours respectivement, une amélioration comparativement aux contrôles historiques. Le recrutement de patients se poursuit dans cette étude, dont les résultats finaux seront disponibles en 2016.
1.6 UTILISATION CROISSANTE
Non seulement l’utilisation de cellules de sang de cordon pour les maladies hématopoïétiques connaît une hausse, mais depuis quelques années, le sang de cordon a commencé à être utilisé dans le traitement de plusieurs autres maladies, dont des maladies neurologiques.
22
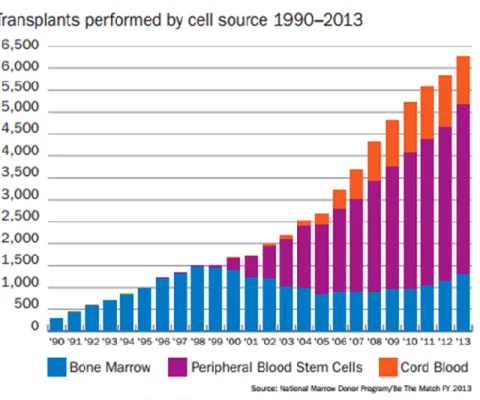
Figure 2. Recours aux différentes sources de CSH.
Nombre de transplantation de CSH selon les différentes sources de cellules, entre 1990 et 2013. Tiré de National Marrow Donor Program/Be The Match FY 2013.
Dans ces études, on mise sur le concept selon lequel les cellules de sang de cordon peuvent jouer un rôle dans la réparation de tissus non hématopoïétique [79]. Par exemple, une étude avec une petite cohorte d’enfants atteints de la maladie de Krabbe a démontré qu’une greffe de sang de cordon avant l’apparition des symptômes avait des effets favorables et entraînait une amélioration des signes neurologiques en permettant la progression de la myélination [80]. Des travaux sont en cours afin de développer un traitement à base de progéniteurs d’oligoendrocytes cultivés à partir de sang de cordon [79].
Un autre exemple est le travail du Dr Wise Young, qui traite des patients ayant des lésions de la moelle épinière. En injectant des cellules de sang de cordon directement dans la moelle épinière de 20 patients, il a été capable de restaurer un
23
niveau de motricité impressionnant chez ses patients; après plusieurs mois de thérapie, 15 des patients arrivaient à se déplacer à l’aide d’une marchette [81]. D’après leurs résultats, les cellules de sang de cordon stimuleraient la régénération en sécrétant des facteurs qui mèneraient à la croissance de fibres à l’endroit de la lésion de la moelle épinière, laissant croire que la réparation d’axones sectionnés pourrait être possible. Une étude clinique de phase III est en préparation.
Ainsi, tout porte à croire que plusieurs nouvelles applications pour le sang de cordon seront découvertes dans les prochaines années, ajoutant à la demande actuelle.
1.7 CONDITIONS DE CONSERVATION DES SANGS DE CORDON
Malgré tous les efforts déployés pour augmenter l’efficacité des greffes de sang de cordon ombilical, quelques aspects concernant l’utilisation et le traitement du sang de cordon restent à être optimisés, particulièrement au niveau de la congélation des dons. Bien qu’une réglementation soit en place actuellement, plusieurs paramètres des protocoles de récolte et de congélation des cellules de sang de cordon ombilical ne sont pas très encadrés. Le plus important d’entre eux est sans doute la température d’entreposage du sang de cordon entre le moment où il est récolté et sa congélation. Ce délai est important, puisqu’il est impossible de procéder à la congélation du sang de cordon immédiatement après son prélèvement. En effet, les banques de sang de cordon doivent traiter un volume trop important de dons, sans compter toute la logistique d’approvisionnement qui rend la mise en banque immédiate impossible. La réglementation de la Netcord-FACT en place suivie par la plupart des banques publiques accorde un délai de 48 heures avant la congélation du sang de cordon alors que ce délai est de 72 heures pour les banques privées. Par contre, aucune indication quant à la température à laquelle les unités doivent être conservées pendant ce délai n’est fournie [13].
24
Ce manque de précision sur la température d’entreposage fait en sorte que dans les banques publiques, le sang de cordon ombilical est gardé entre 4°C et 25°C avant sa congélation [82], ce qui représente une très grande variabilité. Ainsi, certaines banques conservent les poches à 4°C, et d’autres à température pièce (TP), pendant des périodes pouvant aller jusqu’à 48 heures avant de procéder à la réduction du volume et la mise en banque des unités. Chez Héma-Québec, les unités de sang de cordon (USC) sont entreposées à TP jusqu’à leur congélation, qui a lieu entre 24 et 48 heures après le prélèvement du don. Cette décision a été prise lorsque la banque a observé une meilleure récupération des cellules nucléées totales dans le produit mis en banque, lorsque la réduction de volume a lieu 24 heures après le prélèvement du sang de cordon.
Plusieurs équipes de recherche se sont penchées sur la question de la température d’entreposage des unités de sang de cordon avant leur congélation, afin de vérifier si ce paramètre pouvait affecter les CSH. Dès 1995, Campos et al. s’interrogaient sur les conditions optimales pour la collecte et la congélation du sang de cordon [83]. Après avoir fait des essais de progéniteurs sur des unités de sang de cordon conservées à la température de la pièce (TP) et 4°C pendant 48 heures, ils ont observé, après décongélation, une perte importante des progéniteurs lorsque les cellules étaient conservées à 4°C avant la congélation. Lorsque les cellules étaient conservées à TP, une perte substantielle avait également lieu, sauf lorsque les cellules étaient congelées dans un délai de 24 heures suivant la collecte du don. Leur étude suggérait donc l’entreposage du sang de cordon ombilical à TP, pour un délai maximal de 24 heures avant sa cryopréservation.
Une autre étude publiée en 2007 concluait aussi que l’entreposage à TP était optimale pour la qualité du sang de cordon [84], après avoir observé l’effet de la température d’entreposage sur la quantité de cellules CD34+, de progéniteurs, l’apoptose des cellules ainsi que leur capacité de transmigration (capacité de
25
migrer vers un gradient de SDF-1). D’après leurs observations, les cellules conservées à TP avaient une meilleure viabilité, un taux d’apoptose plus faible, une meilleure capacité de transmigration et exprimaient plus de CXCR4 que les cellules conservées à 4°C.
Cependant, plusieurs études avec des conclusions contraires ont été publiées. En 2011, le collectif Biomedical Excellence for Safer Transfusion (BEST) a publié les résultats de leur étude sur l’impact de la température d’entreposage sur le sang de cordon [85] : ils n’ont pas observé de différence au niveau des comptes de cellules CD34+ viables et des progéniteurs CFU-GM entre les deux températures d’entreposage. Toutefois, en raison de la baisse de viabilité des TNC à TP, ils recommandent la conservation des poches de sang de cordon à 4°C jusqu’à leur congélation. Un autre groupe, en 2012, est arrivé à une conclusion semblable, après avoir constaté que la récupération des cellules CD34+ viables était plus faible, après décongélation, lorsque le sang de cordon était conservé à TP comparativement à 4°C [86].
En plus du manque de consensus présent dans la littérature au sujet de la température d’entreposage, plusieurs des études mentionnées ci-dessus comportent certaines lacunes. Ainsi, certaines équipes ont étudié la viabilité des cellules par exclusion du bleu de trypan, une méthode qui permet seulement d’établir la viabilité des cellules totales, qui peut différer grandement de celle des cellules CD34+. D’autres études ont observé la viabilité des cellules CD34+, mais soit après avoir isolé les cellules du sang de cordon (méthode qui peut avoir comme effet de perdre les cellules mortes, affectant ainsi la viabilité mesurée) ou en n’utilisant qu’un simple marquage de cytométrie, sans utiliser la méthode standardisée d’énumération des cellules CD34+, le protocole ISHAGE (International Society for Hematotherapy and Graft Engineering [87]). Certaines des études ont aussi des protocoles expérimentaux qui ne sont pas optimaux pour pouvoir mesurer l’impact de l’entreposage du sang de cordon sur les cellules. Plusieurs équipes se sont contentées d’incuber différents groupes d’unités de sang
26
de cordon à différentes températures, ce qui a mené à de grands écart-types dans leurs résultats, en raison de la variabilité qu’on retrouve entre les différents dons de sang de cordon. D’autres ont testé les différentes températures et temps d’entreposage sur les mêmes unités, mais en les séparant en petits flacons de quelques millilitres, ce qui ne permet pas de reproduire l’impact de ces paramètres dans le contexte clinique.
En plus de ces différentes lacunes expérimentales, on remarque aussi dans la littérature un manque de données in vivo concernant la température d’entreposage optimale pour le sang de cordon. La première étude qui a testé cette variable avec un modèle animal a été publiée en 2012 par des chercheurs de l’hôpital Sainte-Justine à Montréal [88]. Dans le cadre de cette étude, des unités de sang de cordon ont été prélevées et laissées soit à TP ou 4°C pendant 72 heures. Comme contrôle, certaines poches ont été traitées et congelées dès leur réception. À la décongélation des poches, des tests in vitro et in vivo ont été faits; un compte de cellules totales, de cellules CD34+ et CD45+ a été effectué, de même qu’un essai de progéniteurs. De plus, des cellules de chaque condition d’entreposage (congelé immédiatement, après 72 heures à TP et 72 heures à 4°C) ont été injectées à des souris immunosupprimées NOD/scid gamma null (NSG). Les résultats des expériences in vitro de cette étude sont semblables à certains résultats mentionnés ci-dessus, c’est-à-dire que l’entreposage à TP pendant une longue période a un effet négatif sur la viabilité des cellules CD45+, de même que sur la récupération des cellules CD34+ après décongélation. Or, alors que la plupart des chercheurs préconisent une courte période d’entreposage du sang de cordon avant la congélation (en général, on observe un déclin de la viabilité des cellules et des progéniteurs après 48 heures d'entreposage), l’équipe de Sainte-Justine a observé que les cellules CD34+ ne sont pas sensibles à un long délai de traitement, mais plutôt à la température d’entreposage pendant ce délai. Ainsi, l’entreposage à 4°C pendant 72 heures n’aurait pas d’effet sur la récupération des cellules CD34+, alors que l’entreposage de 72 heures à TP se traduirait par une importante réduction de la viabilité de ces cellules. Toutefois, l’équipe n’a pas
27
observé cet effet sur la récupération des CFU après congélation; l’entreposage à TP ou 4°C n’avait pas d’effet sur ce paramètre. Ce dernier résultat est surprenant, puisqu’une baisse de la viabilité des cellules CD34+ devrait normalement se traduire par une réduction du nombre de progéniteurs, mesuré à l’aide du test de progéniteurs CFC.
Du côté in vivo, 20 semaines après la greffe, l’équipe a observé une prise de greffe chez les souris greffées avec les cellules conservées à 4°C pendant 72 heures avant la mise en banque et celles congelées immédiatement après le prélèvement, mais une absence totale de prise de greffe dans les groupes greffés avec des cellules conservées à TP pendant 72 heures. Ainsi, malgré une capacité de différenciation in vitro semblable à celles des cellules à 4°C, les cellules laissées à TP semblaient avoir une capacité de reconstitution in vivo déficiente. Les auteurs concluaient donc que la température d’entreposage du sang de cordon, et non le temps d’attente avant la congélation, a un effet sur la fonctionnalité des CSH, et recommandaient un entreposage à 4°C avant congélation. Contrairement à d’autres études [89], celle-ci conclut que les tests in vitro utilisés pour évaluer le potentiel des CSH, principalement l’essai CFC, ne corrèlent pas avec la capacité de reconstitution hématopoïétique telle que mesurée dans des tests in vivo.
Bien qu’il ne s’agisse que d’un seul article, les résultats de cette équipe sont néanmoins déconcertants, puisqu’ils sont les premiers à recommander l’entreposage des unités de sang de cordon à 4°C suite à des expériences in vivo. Toutefois, le délai de 72 heures appliqué dans leur étude dépasse la limite de 48 heures imposée aux banques de sang de cordon publiques accréditées par Netcord-FACT. Vérifier l’impact de l’entreposage à TP pendant 48 heures dans un modèle animal in vivo constitue un des principaux objectifs de mon projet de maîtrise, puisque cette température est utilisée dans plusieurs banques publiques de sang de cordon, y compris celle d’Héma-Québec.
28 1.8 HYPOTHÈSE ET OBJECTIFS
L’hypothèse posée ici, en se basant entre autres sur les résultats in vivo de l’étude décrite ci-haut [88], est que la capacité de reconstitution des CSH contenues dans le sang de cordon ombilical est affectée négativement durant l’entreposage prolongé à TP et qu’une optimisation du délai et de la température d’entreposage durant la période d’attente pré-congélation permettra d’augmenter le potentiel thérapeutique de ces cellules. Les résultats découlant de cette étude pourront permettre une optimisation des pratiques de la banque publique de sang de cordon d’Héma-Québec. Pour ce faire, plusieurs objectifs ont été définis :
Premier objectif : déterminer l’effet de la température d’entreposage avant la réduction du volume de l’unité de sang de cordon et sa mise en banque sur la reconstitution hématopoïétique par les CSH in vivo, à l’aide d’un modèle animal.
Deuxième objectif : déterminer quelles populations cellulaires peuvent être affectées par les conditions d’entreposage durant le délai respecté avant la mise en banque des unités de sang de cordon.
Troisième objectif : déterminer quel test ou paramètre in vitro serait le plus indicatif de la capacité des CSH de sang de cordon à reconstituer le système hématopoïétique.