© Rachel Durand, 2019
Valorisation d'hydrolysat de poisson pour la santé
humaine : séparation des composés bioactifs par
électrodialyse avec membranes d'ultrafiltration et
évaluation de leurs activités biologiques impliquées
dans le développement du syndrome métabolique
Thèse
Rachel Durand
Doctorat en sciences et technologie des aliments
Philosophiæ doctor (Ph. D.)
Valorisation d’hydrolysat de poisson pour la santé
humaine : séparation des composés bioactifs par
électrodialyse avec membranes d'ultrafiltration et
évaluation de leurs activités biologiques
impliquées dans le développement du syndrome
métabolique
Rachel Durand
Sous la direction de :
Laurent Bazinet, directeur de recherche
Erwann Fraboulet, codirecteur de recherche
III
Résumé
La valorisation des co-produits de poisson est un enjeu économique et environnemental. Depuis plusieurs années, des recherches ont montré que les co-produits de poisson contenaient des molécules actives pour la santé humaine comme des acides gras polyinsaturés et des peptides bioactifs. L’objectif principal de cette thèse était d’évaluer l’utilisation potentielle d’hydrolysats de laitance de hareng pour l’amélioration de la santé humaine, spécifiquement en agissant positivement sur certaines fonctions physiologiques associées au syndrome métabolique, et l’effet de leur séparation par électrodialyse avec membranes d’ultrafiltration (EDUF) sur la production de fractions bioactives.
Dans un premier temps, il a été démontré qu’une supplémentation avec différents hydrolysats de laitance de hareng d’une diète riche en gras et en sucre chez des souris permettait de moduler certains paramètres physiologiques impliqués dans le développement du syndrome métaboliques (MetS) : amélioration de la tolérance au glucose, augmentation de l’apport énergétique total et protection de la population de Lactobacillus dans le microbiote intestinal. De plus, les hydrolysats ont aussi montré des activités anti-inflammatoires in vitro à des concentrations de 1ng/ml et 100pg/ml.
Dans un second temps, la faisabilité d’une séparation par EDUF de deux hydrolysats de laitance de hareng différents a été évaluée : le premier plus complexe était un mélange de molécules (lipides, acides nucléiques, peptides, acides aminés libres), alors que le second était principalement composé de peptides et d’acides aminés libres. Une nouvelle configuration utilisant quatre membranes d’ultrafiltrations (deux de 50kDa et deux de 20kDa) a permis un double fractionnement simultané des composés anioniques et cationiques en seulement une étape. Il a d’abord été montré que seuls les peptides chargés ainsi que les acides aminés libres pouvaient être séparés par EDUF alors que les lipides et les acides nucléiques ne migraient pas dans les fractions de récupérations. De plus, l’utilisation de membranes présentant deux tailles de pores distinctes a permis le fractionnement des hydrolysats en différentes classes de poids moléculaires. En effet, l’utilisation de membranes de 20kDa a permis la concentration de peptides de faibles poids moléculaires (< 600Da) et
IV
d’acides aminés libres, alors que les populations peptidiques des fractions obtenues avec les membranes de 50kDa présentaient des poids moléculaires supérieurs et plus variés.
Dans un troisième temps, les bioactivités des fractions de récupérations et des hydrolysats de laitance de hareng ont été évaluées in vitro. Ainsi, la séparation du premier hydrolysat a permis l’obtention d’une fraction finale stimulant la captation du glucose in vitro et d’une fraction anionique antioxydante. Le fractionnement du second hydrolysat a permis quant-à lui la production de deux fractions cationiques anti-inflammatoires ainsi que l’identification subséquente de deux séquences peptidiques bioactives.
L’ensemble de cette thèse a donc démontré que les hydrolysats de laitance de hareng contenaient des composés actifs, comme des acides gras polyinsaturés et des peptides, modulant positivement certains paramètres physiologiques impliqués dans le MetS et pouvant ainsi permettre la diminution de son occurrence. De plus, la séparation des hydrolysats par EDUF a permis la production de fractions bioactives ainsi que l’identification de deux nouvelles séquences peptidiques anti-inflammatoires (IVPAS et FDKPVSPLL). Ces travaux ont démontré l’effet bénéfique pour la santé humaine des hydrolysats de laitance de hareng et de ses fractions, permettant d’envisager une valorisation plus efficace de ces co-produits de poisson par les industries de transformation dans les secteurs liés à la santé humaine.
V
Abstract
Fish by-product valorization is an economic and environmental issue. For several years, scientific researches have shown that fish by-products contained active molecules for human health, as polyunsaturated fatty acids and peptides. The aim of this thesis was to evaluate the potential use of herring milt hydrolysates for human health, especially by evaluating their potential actions in physiological parameters involved in the metabolic syndrome and the effect of their separation by electrodialysis with ultrafiltration membrane (EDUF) for the production of bioactive fractions.
First, we have demonstrated that the supplementation of three different herring milt hydrolysates in a high fat high sucrose diet in mice was able to modulate some physiological functions involved in the metabolic syndrome: improvement of glucose tolerance, increase of the total energy intake and protection against the Lactobacillus disappearance in the gut microbiota. Moreover, the hydrolysates decreased the inflammation induction in macrophages stimulated with LPS at 1ng/ml and 100pg/ml.
Secondly, we have evaluated the separation of two herring milt hydrolysates by EDUF: the first one was more complex with a mix of different molecules (lipids, nucleic acids and peptides) while the second one was mainly composed of peptides. A new configuration using four ultrafiltration membranes (two of 50kDa and two of 20kDa) allowed a simultaneous double separation of anionic and cationic compounds. It has been shown that only charged peptides and free amino acids were fractionated in EDUF, while the lipids and nucleic acids didn’t migrate to the recovery fractions. Moreover, the use of membranes with different cut-off allowed a separation of the hydrolysates in different molecular weight ranges. Indeed, the use of 20kDa membranes allowed the concentration of peptides with small molecular weights (<800Da) and free amino acids, while the recovery fractions obtained with the 50kDa membranes were composed oh peptide with higher molecular weights.
Thirdly, the potential bioactivities of the recovery fractions and the herring milt hydrolysates were evaluated in vitro. Hence, the separation of the first hydrolysate allowed
VI
the production of a final fraction increasing the glucose uptake and an antioxidant anionic fraction. While the separation of the second hydrolysate allowed the production of two anti-inflammatory cationic fractions as well as the identification of two bioactive peptides sequences.
All these results showed that milt herring hydrolysate contained bioactive compounds such as polyunsaturated fatty acids and peptides, improving some physiological functions involved in the MetS and may decrease its occurrence. Moreover, the separation of the hydrolysates by EDUF allowed the production of bioactive fractions and the identification of two new anti-inflammatory peptide sequences. This work demonstrated the existence of a beneficial effect of herring milt hydrolysate and its fractions for the human health, allowing a better valorization of this by-product of the food industry for the health sector.
VII
Table des matières
Les produits marins ... 4
1.1.1.1 Intérêt de la consommation de poisson ... 4
1.1.1.2 Production et utilisation du poisson : contexte global ... 5
1.1.1.3 Le hareng de l’Atlantique (Clupea harengus) ... 6
1.1.2.1 Valorisation de masse ... 9
1.1.2.1.1 Farine et huile de poisson ... 9
1.1.2.1.2 Pulpe et isolat de protéines ... 9
1.1.2.2 Valorisation de niche ... 10
1.1.2.2.1 Gélatine et collagène marin ... 10
1.1.2.2.2 Lipides marins ... 11
1.1.2.2.3 Les peptides bioactifs ... 13
1.1.2.2.3.1 Production des peptides de poisson bioactifs ... 13
1.1.2.2.3.1.1 Hydrolyse chimique ... 14
1.1.2.2.3.1.2 Hydrolyse enzymatique ... 15
1.1.2.2.3.2 Peptides d’hareng de l’Atlantique ... 17
1.1.2.2.4 Laitance de poisson ... 18
Le syndrome métabolique et les composés bioactifs marins ... 20
1.2.1.1 Résistance à l’insuline, obésité et diabète de type 2 ... 21
1.2.1.2 Maladies cardiovasculaires et dyslipidémie ... 22
1.2.1.3 L’inflammation dans le syndrome métabolique ... 23
1.2.1.4 Impact du microbiote intestinal sur le syndrome métabolique ... 25
1.2.2.1 Acides gras polyinsaturés et la résistance à l’insuline ... 26
1.2.2.2 Prévention de la dyslipidémie et des maladies cardiovasculaires ... 28
1.2.2.3 Effet des acides gras polyinsaturés sur l’inflammation ... 29
1.2.3.1 Rôle des hydrolysats et des peptides bioactifs de poisson dans la sensibilité à l’insuline ... 30
1.2.3.2 Hydrolysats et peptides bioactifs de poisson cardioprotecteurs ... 36
1.2.3.3 Hydrolysats et peptides bioactifs de poisson anti-inflammatoires ... 38
1.2.3.4 Hydrolysats et peptides bioactifs de poisson antioxydants ... 39
Procédés de séparation et de purification des hydrolysats de poisson ... 40
1.3.1.1 Les techniques chromatographiques ... 41
1.3.1.2 Les techniques baro-membranaires ... 42
VIII
1.3.2.2 L’électrodialyse avec membranes d’ultrafiltration ... 47
1.3.2.2.1 Un procédé sélectif et polyvalent ... 47
1.3.2.2.2 Les paramètres d’influences lors de l’électrodialyse avec membranes d’ultrafiltration... 49
1.3.2.2.2.1 Le champ électrique ... 49
1.3.2.2.2.2 Le pH ... 49
1.3.2.2.2.3 La concentration des solutions d’alimentation et de récupération ... 50
1.3.2.2.2.4 Les caractéristiques des membranes ... 51
1.3.2.2.2.5 Le colmatage membranaire ... 51 Hypothèse de recherche ... 59 Objectifs ... 59 Transition contextuelle ... 62 Résumé ... 63 Abstract ... 65 Introduction ... 66
Materials and methods ... 67
3.2.1.1 Supplementation ... 67
3.2.1.2 Animals and dietary treatment ... 68
3.2.1.3 Insulin tolerance test ... 68
3.2.1.4 Oral glucose tolerance test ... 69
3.2.1.5 Biochemical analysis ... 69
3.2.1.6 Gut microbiota analysis ... 69
3.2.2.1 Glucose uptake ... 69 3.2.2.2 Inflammation ... 70 Results ... 71 Discussion ... 77 Conclusion ... 81 Acknowledgements ... 82
Atteinte des objectifs et avancement des connaissances... 83
Transition contextuelle ... 85
Résumé ... 86
Abstract ... 87
IX
Materials and methods ... 89
4.2.1.1 Chemicals ... 89
4.2.1.2 Milt herring hydrolysate ... 90
4.2.1.3 Electrodialysis material ... 90
4.2.3.1 pH ... 92
4.2.3.2 Conductivity... 93
4.2.3.3 Peptide concentration in liquid samples. ... 93
4.2.3.4 Migration rate. ... 93
4.2.3.5 Nucleic acid concentration in dry samples... 93
4.2.3.6 Total peptide concentration in dry samples ... 94
4.2.3.7 Relative energy consumption ... 94
4.2.3.8 Molecular weight peptide distribution. ... 94
4.2.3.8.1 Initial and Final hydrolysates. ... 94
4.2.3.8.2 Recovery fractions. ... 95
4.2.3.9 Amino acid composition ... 96
4.2.3.10 Total lipid content and fatty acid composition ... 96
4.2.3.11 Antioxidant activity ... 97
4.2.3.12 Glucose uptake bioactivity ... 97
Results and discussion ... 98
Conclusion ... 112
Acknowledgements ... 113
Atteinte des objectifs et avancement des connaissances... 114
Transition contextuelle ... 117
Résumé ... 118
Abstract ... 119
Introduction ... 120
Materials and methods ... 121
5.2.1.1 Chemicals ... 121
5.2.1.2 Milt herring hydrolysate ... 122
5.2.1.3 Electrodialysis cell configuration ... 122
5.2.2.1 pH and conductivity. ... 123
5.2.2.2 Nucleic acid concentration in dry samples... 124
5.2.2.3 Peptide migration rate in liquid sample and final peptide concentration in dry powder. ... 124
5.2.2.4 Amino acid composition ... 124
5.2.2.5 Peptide sequences identification ... 125
X
5.2.2.7 Glucose uptake bioactivity ... 126
5.2.2.8 Inflammation. ... 126
Results and discussion ... 127
Conclusion ... 139
Acknowledgements ... 139
Atteinte des objectifs et avancement des connaissances... 140
Discussion générale ... 141
XI
Liste des tableaux
Tableau 1-1 : Composés à haute valeur présents dans les co-produits de poisson (Rustad et al.2) ... 8 Tableau 1-2 : Peptides issus d’hydrolysats enzymatiques de hareng de l'Atlantique (Clupea harengus). NI : Valeur non indiquée. ... 18 Tableau 1-3 : Critères pour le diagnostic du MetS pour différentes organisations. H: homme, F: femme, IDF: International Diabetes Federation, WHO: World Health Organization, AHA: American Heart Association, EGIR: European Group for Insulin Resistance. ... 21 Tableau 1-4 : Séquences peptidiques identifiées inhibitrices du DPP-IV dans des peaux de poisson. ... 31 Tableau 1-5 : Études in vivo utilisant des hydrolysats de poisson sur l’évolution de paramètres impliqués dans le développement du MetS. ... 34 Tableau 1-6 : Avantages et inconvénients des méthodes chromatographiques et baro-membranaires... 45 Tableau 1-7 : Séparation de peptides et/ou de fractions bioactives par électrodialyse avec membranes d’ultrafiltration. NI : non indiqué. ... 55 Table 3-1 :Chemical composition of the herring milt hydrolysate (HMH) products ... 68 Table 3-2: Effect of the HMHs supplementation after 8 weeks on the body characteristics (mean ± SEM, * p< 0.05 chow vs HFHS, # p< 0.05 HFHF vs HMH1). ... 71
Table 4-1: Chemical composition of the herring milt hydrolysate ... 90 Table 4-2:Final peptide and nucleic acid concentration in powders after EDUF separation, n=4, mean ± standard deviation (SD). Values followed by different letters in a column are significantly different p < 0.05 (Tukey test). ... 100 Table 4-3:Total and free amino acids composition of herring milt hydrolysate and recovery fractions after EDUF separation, n=3, mean ± SD. Values of total AA follow by different capital letters are significantly different. Values of free AA follow by different t ... 105 Table 4-4: Fatty acid composition of initial (IH) and final hydrolysates (FH) after EDUF treatment, n=6, mean ± SD. Different letters indicated significant difference p < 0.05 (t-test), *indicated significant difference p < 0.01 (t-test). ... 107 Table 4-5: ORAC capacity (µmol TE/g) for each fraction, n=3, different letters indicate significant difference (p < 0.05, Tukey test). ... 109
Table 5-1: Migration rate, final peptide and nucleic acid percentage in powders, n=4 ±SD. Values followed by different letters are significantly different (p<0.05, Tukey test). ... 129 Table 5-2: Total and free amino acids composition of herring milt hydrolysate and recovery fractions after EDUF separation, n=2, mean ± SD. ... 131 Table 5-3: ORAC values, n=3 ±SD. Values followed by different letters are significantly different (p<0.05, Tukey test). ... 134 Table 5-4: Peptide sequences characteristics identified in C50 and C20. ... 138
XII
Liste des figures
Figure 1-1 : Utilisation des produits de la pêche dans le monde (ventilés par volume), 1962-2016 (tiré de FAO20). ... 6 Figure 1-2 : Principaux co-produits de poisson (d’après Rustad et al.2). ND : non définis .. 8 Figure 1-3: Biosynthèse des AGPI ω-3 (tiré de Bergé et Barnathan44). ... 12 Figure 1-4: Schéma d'illustration des sites de coupures des protéases. ... 16 Figure 1-5 : Les deux voies principales de la signalisation à l’insuline (tiré de Miranda et al.91). ... 22
Figure 1-6: Changements phénotypiques du tissu adipeux et son rôle dans le développement d'une inflammation chronique (tiré de Ouchi et al.98). ... 24 Figure 1-7: Actions des AGPI dans la résistance à l'insuline et le développement des MCV (D'après Clarke SD137) ... 28
Figure 1-8 : Mécanismes d’action de l’enzyme convertissant l'angiotensin sur la régulation de la pression sanguine (Tiré de Li et al., 2004)172 ... 37 Figure 1-9: Les différentes membranes utilisées en filtration baro-membranaire (d'après Bazinet et Firdaous199). ... 43 Figure 1-10 : Schéma d'électrodialyse conventionnelle (d’après Strathmann, 2010)202 ... 46 Figure 1-11 : Formation de gradients de concentration en électrodialyse (d’après Bazinet, 2004)201 ... 47 Figure 1-12: Configurations possibles d'EDUF pour la récupération A) des peptides anioniques, B) des peptides cationiques et C) des peptides anioniques et cationiques simultanément (d'après Poulin et al.,2006 et Firdaous et al., 2009)203, 204 ... 48
Figure 3-1 :Hepatic lipid composition in mice fed with HFHS diet with or without HMHs supplementation. Dashed line represents the chow group, * p< 0.05 chow vs HFHS. ... 72 Figure 3-2: Impact of HMH supplementation in mice fed with HFHS on glucose and insulin tolerance. A) Glycemic curve during oGTT, B) Insulin production during oGTT, C) Glycemic curve during ITT. * p< 0.05 Chow vs HFHS, ## p< 0.01 HFHS vs HMH2, $ p< 0.05 HFHS vs HMH ... 73 Figure 3-3: A) Beta-diversity of gut microbiota in mice between groups after 8 weeks observed by means of Principal coordinates analysis (PcoA) on an unweighted UniFrac distance matrix. B) Alpha-diversity of gut microbiota between groups before and after the experimentation by measuring the Shannon reciprocal index. ... 74 Figure 3-4: The statistical significance of differentially abundant bacteria between the two distinct biological conditions was measured using Linear Discriminant Analysis Effect Size (LDA). Black bar: HFHS control, white bar: Chow group, grey bar: HMH supplementations groups, A) Chow vs HFHS, B) HFHS vs HMH1, C) HFHS vs HMH2 and D) HFHS vs HMH3. ... 75 Figure 3-5: Glucose uptake capacity A) without insulin; B) with insulin in L6 cells stimulating by HMHs at three concentrations (1µg/ml, 1ng/ml and 100pg/ml), n=6, mean ± SEM). ... 76 Figure 3-6 : Nitric oxide production in culture media after inflammation induction by LPS in J774 mice macrophages stimulating by HMHs at three concentrations (1µg/ml, 1ng/ml and 100pg/ml), n=6, means± SEM, *p<0.05, **p<0.01. ... 76
XIII
Figure 4-1: Configuration of the peptide separation by electrodialysis with ultrafiltration membrane cell; P+: cationic peptides, P-: anionic peptides, P-/+: neutral peptides, AEM: anion-exchange membrane, CEM: cation-exchange membrane, UF: ultrafiltration membrane ... 92 Figure 4-2: Evolution of the peptide concentration (µg/ml) in recovery fractions after EDUF treatment at pH 7 and 5.6 V/cm during 240min, n=4. ... 99 Figure 4-3:Molecular weight peptide distribution of A) initial and final hydrolysates by GPC-FPLC B) anionic recovery fractions by UPLC C) cationic recovery fractions by RP-UPLC; n=3, mean ± SD. ... 102 Figure 4-4 : Glucose uptake capacity A) without insulin; B) with insulin in L6 cells stimulating by herring milt hydrolysate or recovery fractions after EDUF separation at two concentrations (1µg/ml and 1ng/ml), n=9, mean ± standard error of mean (SEM). ** significant difference with the control (vehicle) at p < 0.01 (Dunnett test). ... 111
Figure 5-1: EDUF configuration; P+ cationic peptides, P- anionic peptides, P+/- neutral peptides. ... 123 Figure 5-2: Peptide migration of recovery fractions during EDUF, n=4 ± SD. ... 128 Figure 5-3 Glucose uptake activity for the A) basal way, B) Insulin stimulation, n=8 ± SEM p>0.05 (One-way ANOVA). ... 135 Figure 5-4: Nitric oxide production in culture supernatant after inflammation induction by LPS in J774 mice macrophage, n=6-10, means± SEM, *p<0.05, **p<0.01, ***p<0.001 (Dunett test). ... 137 Figure 5-5: Nitric oxide production in culture supernatant after inflammation induction by LPS in J774 mice macrophage, n=6, means± SEM, *p<0.05 (Dunett test). ... 138
XIV
Abréviations
Afin de simplifier la lecture de ce document, des abréviations usuelles en anglais seront utilisées dans les parties en français.
Abréviation française English abbreviation
AA Acides aminés AA Amino acids
AG Acides gras ACE Angiotensin-converting-Enzyme AGMI Acides gras monoinsaturés AEM Anionic exchange membrane
AGPI Acides gras polyinsaturés AMPK AMP-activated protein kinase AGS Acides gras saturés BGS Bovine growth serum
AI Indice athérogène CAT Catalase
ARA Acide arachidonique CEM Cationic exchange membrane CA Acétate de cellulose DHA Docosahexaenoic acid DH Degré d’hydrolyse DPPH 1,1dephenyl-2pircyk hydrazyl DPP-IV Dipeptidyl peptidase-IV DPP-IV Dipeptidyl peptidase-IV
DT2 Diabète de type 2 EDUF Electrodialysis with ultrafiltration membrane
ED Electrodialyse EPA Eicosapentaneoic acid EDUF Electrodialyse avec membranes
d’ultrafiltration
FA Fatty acids
GPx Glutathion peroxydase FAO Food and Agriculture Organization of United Nations
IC50 Concentration inhibitrice médiane FBS Foetal bovine serum
IL Interleukine GLUT4 Glucose transporter type 4 LPS Lipopolysaccharide GLP-1 Glucagon-like-peptide-1 MCV Maladies cardiovasculaires GPR-120 G-protein coupled receptor 120 MDA Malondialdéhyde HDL High density lipoprotein MEA Membrane échangeuse d’anions HFHS High fat high sucrose MEC Membrane échangeuse de cations HMH Herring milt hydrolysate
MEI Membrane échangeuse d’ions IC50 Half-maximal inhibitory
concentration MetS Syndrome métabolique IL Interleukin
PB Peptides bioactifs iNOS Inducible nitric oxide synthase PES Polyéthersulfone IR Insulin receptor
pI PM
Point isoélectrique Poids molécualires
IRS-1 Insulin receptor substrat 1 PVDF Polyvinylidène fluoride ITT Insulin tolerance test
SOD Superoxyde dismutase LDL Low density lipoprotein TG Triglycérides MetS Metabolic syndrome UF Ultrafiltration MW Molecular weight ω-3 Oméga-3 MWCO Molecular weight cut-off ω-6 Oméga 6 NF-κB Nuclear factor kappa B
NO Nitric oxide
oGTT Oral glucose tolerance test
ORAC Oxygen radical absorbance capacity PES Polyethersuflone
PI-3K Phosphatidylinositol-3-kinase PPAR Peroxisome proliferator-activated
receptor
XV
Abréviation française English abbreviation
PVDF Polyvinylidene fluoride ROS Reactive oxygen species
SD Standard deviation SEM Standard error of the mean SREBP Sterol regulatory element-binding
proteins
TBARS Thiobarbituric acid reactive substances
TG Triglycerides
TNF Tumor necrosis factor USD United States dollar
UF Ultrafiltration
VLDL Very low density lipoprotein ω-3 Omega-3
Acides aminés :
Ala, A : Alanine Arg, R : Arginine
Asp, D : Acide aspartique Cys, C : Cystéine
Glu, E : Acide glutamique Gly, G : Glycine His, H : Histidine Iso, I : Isoleucine Leu, L : Leucine Lys, K : Lysine Met, M : Méthionine Phe, F : Phénylalanine Pro, P : Proline Ser, S : Sérine Thr, T : Thréonine Trp, W : Tryptophane Tyr, Y : Tyrosine Val, V : Valine
XVI
« Dans la vie, rien n’est à craindre, tout est à comprendre»
XVII
Remerciements
Je tiens tout d’abord à remercier mon directeur de thèse, Laurent Bazinet, de m’avoir offert cette opportunité de réaliser ces travaux au sein de son équipe. Merci aussi pour ton soutien et ta disponibilité qui ont été précieux pendant ces trois années, de même que la confiance que tu m’as accordée et qui m’a permis d’avancer sur ce projet. J’aimerais aussi te remercier pour tes nombreux conseils et de m’avoir si souvent rappelé de prendre du recul afin de recentrer le sujet et d’éviter de m’éparpiller sur les petits détails. Enfin tu m’as fait découvrir le domaine des sciences des aliments et tu as partagé avec moi ta passion, j’ai énormément appris à tes côtés.
Je remercie aussi mon co-directeur Erwann Fraboulet pour son aide dans ce projet et ses précieux conseils d’un point de vu plus extérieur qui m’ont souvent permis de voir plus loin dans l’aboutissement de cette thèse. Merci aussi pour ta disponibilité, surtout les dernières semaines, et nos discussions qui m’ont permis d’approfondir ce travail de trois ans. Ton soutien et tes encouragements m’ont toujours redonné confiance et l’envie de continuer dans cette voie et pour tout cela un grand merci. Enfin, tes connaissances scientifiques et ta maitrise du sujet industriel ont aussi permis la réussite de ce travail collaboratif et son évolution.
J’aimerais aussi remercier notre partenaire industriel Ocean NutraSciences Inc. et son directeur Gilles Desjardins de nous avoir fait confiance dans la réalisation de ce projet. Merci aussi pour ton aide et ta collaboration dans cette thèse, mais aussi pour le partage de tes connaissances sur les produits marins. Tu as permis l’aboutissement d’un travail aux objectifs académiques mais aussi industriels, tout en nous faisant confiance. Merci, sans Ocean NutraSciences Inc. ce projet n’aurait jamais eu lieu.
Je remercie aussi les membres du jury, Lucie Beaulieu, Charles Lavigne et Romain Kapel d’avoir accepté d’évaluer cette thèse.
Je remercie aussi André Marette et toute son équipe pour leur accueil dans leur laboratoire et le partage de leurs connaissances. Merci à Geneviève Pilon et Vanessa Houde d’avoir aussi bien supervisé le projet in vivo ainsi que les techniciennes de laboratoire Joanie
XVIII
Dupont-Morissette, Jenny Rancourt-Mercier, Jacinthe Julien et Christine Dallaire pour leur aide sur le projet. Bien sûr, un énorme merci à Bruno Marcotte pour m’avoir tout appris sur la culture cellulaire. Merci pour ton soutien, d’avoir toujours répondu à toutes mes questions qui étaient souvent nombreuses, mais aussi pour ton aide lors de mon projet. Merci à vous tous pour votre bonne humeur quotidienne et votre accueil si chaleureux.
Je remercie aussi toute mon équipe pour leur soutien technique mais aussi moral pendant ces trois ans. Merci pour vos nombreux conseils qui ont permis à ce projet d’évoluer. J’aimerais remercier Jacinthe Thibodeau pour sa bonne humeur et son positivisme depuis le premier jour de notre rencontre. Tu as toujours été présente pour moi au niveau professionnel mais aussi personnel et au cours de ces trois ans tu es devenue une amie, une confidente mais aussi un peu une « maman » par intérim. Sans toi, mon expérience au Québec aurait été très différente. Merci pour tout.
Bien sûr aussi un énorme merci à tous mes amis que j’ai rencontré au Québec et sans qui cette expérience aurait été beaucoup moins sympathique, Agathe, Steffen, Mathou, Valentine, Jean-Philippe, Valentin, Isabelle, Clément, Dominique, Marco et Frédérique. Merci à vous tous pour votre bonne humeur et d’avoir partagé d’aussi bon moments pendant ces trois années.
Enfin, merci du fond du cœur à ma famille qui malgré les quelques kilomètres qui nous ont séparés, m’a toujours soutenue et a été présente pendant tout ce temps. Un merci spécial à ma sœur qui a pris du temps pour lire une partie de ce document. Merci à vous d’être toujours là et de m’avoir donné confiance dans les moments de doutes. Enfin, le meilleur pour la fin, je remercie ma douce moitié qui a été là dès le début et m’a supportée pendant les bons et aussi les mauvais moments (surtout les dernières semaines de rédaction). Merci de la confiance que tu m’as donnée et aussi de m’avoir suivie dans ce pays froid et enneigé. Je suis fière de toi et de ce que tu as accompli ici avec moi, merci pour tout.
XIX
Avant-propos
Cette thèse se divise en six chapitres. Le premier est une revue de littérature présentant le contexte de ces travaux, les différentes problématiques et les principales recherches faites sur ce sujet. Ainsi, elle comporte trois parties, la première présente les enjeux liés à l’augmentation de la consommation de poisson et aux principales utilisations des co-produits générés. La seconde partie se consacre au syndrome métabolique et à l’action de composés bioactifs présents dans le poisson (acides gras polyinsaturés et peptides) sur certaines fonctions physiologiques impliquées dans son développement. Enfin, la dernière partie de cette revue de littérature présente les avantages et les inconvénients des principales techniques de fractionnement utilisées de nos jours pour la séparation d’hydrolysats peptidiques, ainsi que l’utilisation de l’électrodialyse avec membranes d’ultrafiltration pour la production de fractions peptidiques bioactives. De ce chapitre, découlera l’hypothèse de travail de cette thèse et les différents objectifs permettant d’y répondre. Les chapitres trois, quatre et cinq sont sous forme d’articles scientifiques afin de répondre aux objectifs précédents. Enfin, une discussion générale des différents résultats et une conclusion de ces travaux concluront cette thèse.
Les chapitres un, deux et la discussion générale sont rédigés en français alors que les chapitres trois, quatre et cinq sont en anglais. Des abréviations usuelles en anglais sont cependant utilisées dans les parties en français afin de faciliter la compréhension et la lecture des parties.
Le premier article présenté dans le chapitre trois, s’intitule «Use of herring milt hydrolysate for the improvement of the metabolic syndrome: in vitro and in vivo experiments» et est en révision finale pour être soumis dans le journal «Food Research International». Les auteurs sont Rachel Durand, Erwann Fraboulet, Geneviève Pilon, Vanessa P. Houde, Thibaut Varin, André Marette et Laurent Bazinet. Le chapitre quatre présente le deuxième article, publié dans le journal «Separation and Purification Technology 210 (2019) 431-441» et intitulé «Simultaneous double cationic and anionic molecule separation from herring milt hydrolysate and impact on resulting fraction bioactivities.» Les auteurs sont Rachel Durand, Erwann Fraboulet, André Marette et Laurent
XX
Bazinet. Le dernier article présenté dans le chapitre cinq est en cours de révision et d’attente pour un brevet industriel. Il s’intitule «Screening for metabolic syndrome application of a fish by-product hydrolysate after its separation by electrodialysis with ultrafiltration membrane» et les auteurs sont Rachel Durand, Erwann Fraboulet, Andreé Marette et Laurent Bazinet.
1
Introduction
Les habitudes alimentaires des sociétés occidentales ont radicalement changé depuis ces cinq dernières décennies. En effet, la demande en produits transformés n’a jamais été aussi forte. Cependant, la transformation des aliments par l’industrie agroalimentaire engendre d’importants volumes de déchets, dont la plupart peuvent être considérés comme des co-produits. Les produits de la mer et notamment le poisson, sont reconnus pour leurs effets bénéfiques sur la santé humaine et leur consommation a fortement augmenté, engendrant de nombreux co-produits1. En effet, en moyenne, seulement 40% du poisson seront destinés à la consommation humaine alors que les 60% restant seront écartés et représentent autant de co-produits2. Ces derniers peuvent être la tête, les arêtes, la peau ou les organes reproducteurs (laitance, gonades) et contiennent des molécules actives pour la santé humaine comme des acides gras polyinsaturés, des protéines ou des vitamines. De nos jours, ils restent cependant principalement utilisés pour l’aquaculture comme farine et huile de poisson et ont de faibles valeurs ajoutées. L’utilisation généralisée et la valorisation des co-produits de poisson sont donc aujourd’hui des enjeux économiques et environnementaux.
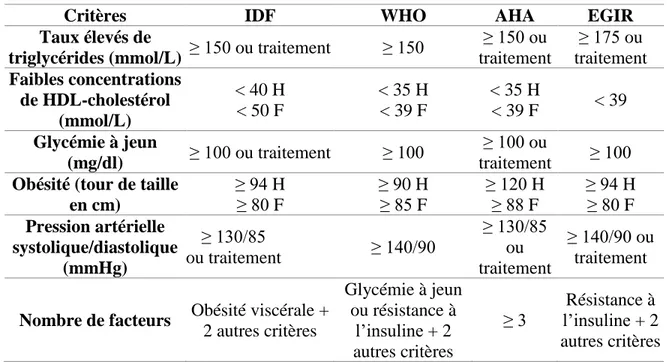
L’augmentation de la consommation en gras et en sucre dans les sociétés occidentales a conduit au développement du syndrome métabolique (MetS, «metabolic syndrome»), définis comme l’ensemble de plusieurs disfonctionnements : dyslipidémie, hyperglycémie, résistance à l’insuline, obésité viscérale, hypertension et inflammation, touchant aujourd’hui 20% de la population canadienne3. De plus, ce désordre métabolique augmente le risque de développement du diabète de type 2 par deux et par cinq le risque de maladies cardiovasculaires4. La prévention et le traitement du MetS sont donc devenus des enjeux
majeurs pour les services de la santé mondiale. Cependant, des études ont montré que l’utilisation de composés actifs de poisson, comme des acides gras polyinsaturés et des peptides, permettait l’amélioration de certains paramètres physiologiques impliqués dans le développement du MetS en améliorant la sensibilité à l’insuline, diminuant la dyslipidémie et l’inflammation5-10. Or, la laitance de poisson, co-produit de l’industrie de transformation
des produits de pêche, est une matière première riche en ces composés et sa valorisation pour la santé humaine augmenterait ainsi sa valeur ajoutée.
2
La partie protéique des co-produits de poisson peut être valorisée par hydrolyse enzymatique ou chimique afin d’extraire des molécules d’intérêts comme des peptides bioactifs. Cependant, les bioactivités des peptides sont liées à leur poids moléculaire et leur séquence en acides aminés. Des études ont ainsi montré que la séparation et la concentration des peptides bioactifs suivant leurs caractéristiques physico-chimiques permettait d’augmenter leur activité par rapport à l’hydrolysat initial11, 12. De nos jours, les deux
techniques principalement utilisées sont les méthodes baro-membranaires et chromatographiques. Cependant, elles présentent certaines problématiques comme le colmatage et une baisse de sélectivité pour les premières et des coûts importants et l’utilisation de solvant pour les secondes. Ainsi le développement de nouveaux procédés de séparation des hydrolysats est un enjeu important pour la valorisation ultérieure des co-produits de poisson pour la santé humaine. L’électrodialyse avec membranes d’ultrafiltration est une méthode de séparation des composés suivant leur charge et leur poids moléculaire13. Cette technique polyvalente et sélective a permis de générer des fractions peptidiques bioactives pour la santé humaine : antibactérienne, captation du glucose, anticancéreuse, antihypertensive14-18. Cependant l’électrodialyse avec membranes d’ultrafiltration n’a encore jamais été utilisée pour la séparation d’un hydrolysat complexe regroupant des peptides, des lipides et des acides nucléiques. De plus, cette méthode permet l’utilisation de plusieurs membranes ayant des tailles de pores différentes afin d’avoir une séparation des peptides en plusieurs classes de poids moléculaires simultanément19. Cette polyvalence de l’électrodialyse avec membranes d’ultrafiltration devrait permettre la production de fractions peptidiques aux caractéristiques diverses qui sont importantes pour la recherche de composés bioactifs.
L’objectif principal de cette thèse était donc de déterminer des allégations biologiques liées à l'amélioration des fonctions physiologiques du MetS lors de l'assimilation d'hydrolysats de laitance, et l’effet de leur fractionnement par électrodialyse avec membranes d’ultrafiltration sur la production de fractions bioactives. Dans un premier temps, des essais sur des souris ont été effectués afin d’analyser l’impact d’une supplémentation à base d’hydrolysat de laitance de hareng sur le développement de certains désordres métaboliques associés à une diète riche en gras et en sucre. Dans un second temps, deux de ces hydrolysats ont été séparés grâce à l’utilisation d’une nouvelle configuration d’électrodyalyse avec
3
membranes d’ultrafiltration permettant un double fractionnement simultané des composés anioniques et cationiques. Différentes bioactivités ont été testées in vitro : captation du glucose, antioxydante et antiinflammatoire. Finalement, les séquences peptidiques des fractions ayant démontré un effet positif sur certains paramètres physiologiques ont été identifiées lorsque possible.
4
CHAPITRE 1 : Revue de littérature
Les produits marins
Les produits marins représentent toutes les sources halieutiques exploitées par l’homme : les poissons, les crustacés, les mollusques et les algues. Cependant, le poisson reste une source alimentaire majeure pour de nombreuses populations et représente 17% des protéines animales consommées dans le monde20. Ainsi, cette thèse s’intéressera à l’utilisation de cette ressource et notamment à l’un des poissons les plus pêchés au Québec, le hareng de l’Atlantique (Clupea harengus). Dans cette partie, l’utilisation et la consommation du poisson au niveau mondial seront présentées ainsi que son intérêt pour la santé humaine. La production de co-produits de poisson ainsi que leurs principales voies de valorisation seront aussi détaillées. Enfin, cette thèse portant sur l’utilisation potentielle de la laitance de hareng de l’Atlantique pour la santé humaine, la valorisation actuelle de ce co-produit sera abordée dans ce document.
Le poisson : une denrée importante
Intérêt de la consommation de poissonDepuis ces dernières années les consommateurs ont pris conscience de l’étroite relation entre une alimentation saine et leur santé. Il est maintenant documenté qu’une alimentation équilibrée, grâce à la consommation de certains aliments, permet l’apport quotidien d’énergie mais aussi l’amélioration de la santé humaine21-23. Les produits
halieutiques, comme le poisson, font partie des aliments recommandés par les nutritionnistes, afin de prévenir les maladies chroniques comme le diabète ou les maladies cardiovasculaires24.
Cette prise de conscience de la population, a mené à une augmentation de la consommation mondiale de poisson d’environ 1,5% par année, atteignant 20,2 kg/personne/an en 201520. Cet engouement est dû à la qualité nutritionnelle des produits, mais aussi à leurs vastes choix au niveau gustatif et texturant. Le poisson est une denrée importante dans le régime alimentaire et permet l’apport d’éléments essentiels comme les protéines, les lipides, les minéraux ou les vitamines. En effet, la teneur en protéine dans la
5
chair, est en moyenne de 22% (w/w) indépendamment des espèces, représentant 17% des protéines animales consommées dans le monde20, 25. Les protéines des produits halieutiques sont reconnues comme étant plus digestes que celles de la viande et leur teneur en acides aminés essentiels est en général également un peu plus élevée1. Les lipides, autres composés essentiels dans l’alimentation, sont plus variables selon les espèces de poisson : les poissons maigres ayant une teneur en lipide inférieure à 1% et les poissons gras présentant une concentration supérieure à 10%. De plus, ils contiennent trois acides gras essentiels : l’acide linoléique, l’acide linolénique et l’acide arachidonique. En effet, ne pouvant être synthétisés par l’homme, leur apport dans l’alimentation est vital pour le bon fonctionnement du métabolisme.
Production et utilisation du poisson : contexte global
En 2016, d’après l’Organisation des nations unies pour l’alimentation et l’agriculture (Food and Agriculture Organization of United Nations, FAO) la production halieutique mondiale a atteint une valeur record de 171 millions de tonnes, grâce notamment à l’augmentation de la production par l’aquaculture, représentant 47% des captures mondiales20. La pêche de capture s’élevait à 90,9 millions de tonnes en 2016 pour une valeur commerciale estimée à 130 milliards de dollars américains (USD, «United State dollar»)20. La Chine reste le principal pays producteur avec plus de 15 millions de tonnes, suivie par l’Indonésie (6,1 millions de tonnes) et les États-Unis (4,8 millions de tonnes)20. Le Canada
se positionnait en 2016 au 20ème rang mondial des pays producteurs, représentant un volume de capture de 800 milles tonnes pour une valeur de 3,8 millions USD26. Le poisson et les produits à base de poisson font partie des aliments les plus échangés au niveau mondial. Ainsi, 35% de la production mondiale de poisson ont été échangés au niveau international en 2016, représentant une valeur d’exportation de 152 milliards USD20. Au Canada, l’exportation de poisson de capture représentait en 2016 20% de sa production (157 mille tonnes) pour une valeur de 5 milliards USD26. Ainsi, le commerce des produits halieutiques est une source importante pour le produit intérieur brut des gouvernements, mais aussi dans le secteur de l’emploi. En effet, au Canada 77 mille personnes travaillaient dans le secteur lié à la pêche en 2017, dont 28 mille dans la transformation des produits halieutiques26.
6
En 2016, la majeure partie de la production de poisson a été destinée à la consommation humaine directe (88%), sous forme de produits vivants/frais/réfrigérés (45%), congelés (31%), préparés et mis en conserve (12%) et enfin séchés/salés/fumés/saumurés (12%). La majeure partie de la production affectée à des usages non alimentaires, a été utilisée pour la production de farine et d’huile de poisson (figure 1-1)20.
Figure 1-1 : Utilisation des produits de la pêche dans le monde (ventilés par volume), 1962-2016
(tiré de FAO20).
Le hareng de l’Atlantique (Clupea harengus)
Le hareng de l’Atlantique (Clupea harengus) est la sixième espèce la plus pêchée au monde, avec en 2016 1,6 millions de tonnes débarquées à travers le globe, dont 140 mille tonnes au Canada, faisant du hareng l’espèce la plus pêchée dans le pays20. En effet, c’est une espèce endémique des côtes Atlantiques du Canada, avec une zone de capture s’étendant des côtes sud-ouest de la Nouvelle-Écosse, au sud du golfe du Saint-Laurent et sur les côtes est et ouest de Terre-Neuve-et-Labrador. Le hareng est un petit poisson pélagique mesurant entre 20 et 25cm de long, vivant en banc dans les eaux profondes en journée puis près de la surface la nuit pour se nourrir. Au Canada, le hareng de l’Atlantique est principalement pêché au printemps et en été. Cependant, la période de fraye du hareng pouvant être au printemps ou en automne, la pêche de cette espèce est interdite au printemps depuis 1994 dans la Baie de George et de Port-au-Port afin de maintenir des niveaux de stocks sains27. Faisant partie de la famille des poissons gras, le hareng est aussi bien utilisé pour la consommation humaine
7
que pour la production de farine et d’huile de poisson. En effet, le hareng est depuis longtemps connu pour son fort potentiel nutritionnel, notamment dans l’apport d’acides gras polyinsaturés (AGPI), comme les omégas-3 (ω-3) acides eicosapentaénoïques (EPA, «eicosapentaneoic acid») ou acides docosahexaénoïques (DHA, «docosahexaenoic acid»)28,
29.
Co-produits de poisson : utilisation et valorisation
Les co-produits de poisson désignent les parties du poisson écartées pour la consommation directe après leur transformation2. Ainsi ces co-produits s’ajoutent aux 19
millions de tonnes de poisson de capture destinées à la non-consommation humaine (figure 1-1)20. L’industrie agroalimentaire marine produit de nombreux déchets organiques dont les
co-produits, pouvant représenter jusqu’à 60% du poisson initial suivant l’espèce (arêtes, peau, tête, viscères, gonade…) (figure 1-2)2, 30. Cependant, ces déchets ont un réel impact environnemental et économique dans notre société et leur traitement et leur utilisation est une étape importante. Au Québec, les déchets organiques représentent environ 4 millions de tonnes métriques/an. Or, d’après le Plan d’action 2011-2015 sur la gestion des matières
résiduelles émis par le Ministère du Développement Durable, de l’Environnement et des
Parcs (MDDEP), l’enfouissement des déchets organiques sera banni à partir de 2020. Ainsi, le secteur agroalimentaire devra trouver de nouvelles solutions afin d’utiliser au mieux ses déchets. De plus, les co-produits de poisson sont riches en composés à hautes valeurs, comme les protéines et les lipides (Tableau 1-1), leur valorisation représente donc une source de diversification économique potentiellement très intéressante pour de nombreuses communautés2.
8
Figure 1-2 : Principaux co-produits de poisson (d’après Rustad et al.2). ND : non définis
Cependant, la valeur économique de ces co-produits dépend de la voie de valorisation choisie. Ainsi, une valorisation de masse va permettre l’utilisation de grandes quantités ayant une valeur finale plutôt faible alors qu’une valorisation de niche permet une utilisation à très haute valeur ajoutée mais en plus faible quantité.
Tableau 1-1 : Composés à haute valeur présents dans les co-produits de poisson (d’après Rustad et
al.2)
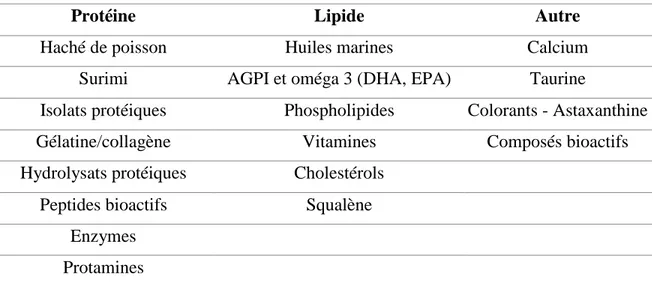
Protéine Lipide Autre
Haché de poisson Huiles marines Calcium
Surimi AGPI et oméga 3 (DHA, EPA) Taurine
Isolats protéiques Phospholipides Colorants - Astaxanthine
Gélatine/collagène Vitamines Composés bioactifs
Hydrolysats protéiques Cholestérols
Peptides bioactifs Squalène
Enzymes Protamines
9 Valorisation de masse
1.1.2.1.1 Farine et huile de poisson
La farine et l’huile de poisson restent les ingrédients les plus nutritifs et digestes pour les poissons d’aquaculture, c’est pourquoi ils sont majoritairement utilisés dans ce domaine20.
Brièvement, les farines de poisson sont obtenues après mélange et chauffage de la matière première, permettant la coagulation des protéines. Après une étape de séparation liquide/solide par pressage ou centrifugation, (i) les gâteaux de presse sont séchés, afin d’obtenir une poudre homogène de protéines, (ii) alors que la fraction liquide sera valorisée en huile. La farine et l’huile de poisson sont principalement produites à partir de petits poissons pélagiques, comme le hareng, l’anchois, le chinchard ou la sardine. Cependant, les co-produits sont de plus en plus utilisés dans ces procédés, du fait de leur variété et de leur faible coût, ils représentaient ainsi 25 à 35% des farines et huiles de poisson produites en 201620. Depuis quelques années, des alternatives à la farine et l’huile de poisson sont recherchées, afin de limiter la surexploitation des petits poissons pélagiques pour l’aquaculture. Des substituts à base de plantes sont utilisés, principalement pour les poissons omnivores et herbivores mais leurs utilisations restent restreintes pour les carnivores, dû à leur plus haute demande en protéines (entre 40-55% de la diète)31. De plus, les demandes en AGPI des poissons carnivores, et spécifiquement des poissons marins, sont importantes, c’est pourquoi en 2010 80% des huiles et 63% des farines de poisson étaient utilisées pour l’aquaculture31.
1.1.2.1.2 Pulpe et isolat de protéines
La transformation des produits de poisson est un procédé produisant de grands volumes de co-produits. L’opération de filetage va permettre de récupérer les filets de poisson pour la consommation humaine, mais va également produire des co-produits contenant encore de la chair et notamment des protéines32. Afin de valoriser ces déchets, la chair va être retirée mécaniquement par pressage des co-produits à travers des perforations permettant l’élimination de la peau et des arêtes, et l’obtention d’une pulpe de poisson haché2, 33. Cette pulpe de poisson va servir pour la confection de nombreux produits alimentaires
10
de retirer les protéines sarcoplasmiques et les composants participant à la dénaturation des protéines durant la congélation, afin d’obtenir du surimi de poisson2.
Une autre voie de valorisation de masse des protéines de poisson est la production d’isolats protéiques de poisson. En effet, ce processus va permettre le traitement de poissons entiers éviscérés et/ou de co-produits directement. Ces isolats font référence à des produits contenant au moins 90% de protéines de muscle (myofibrillaires), concentrées par la technique de «pH shift»2. Les protéines myofibrillaires vont pouvoir être solubilisées à de faibles forces ioniques et à de faibles ou hautes valeurs de pH, puis précipitées à leur point isoélectrique (pH 5.5)34, 35. Les isolats protéiques vont avoir une plus haute valeur
économique que la pulpe et le surimi de poisson grâce à leurs propriétés fonctionnelles plus importantes, notamment émulsifiantes et gélifiantes34. Ces deux propriétés sont
principalement dues à la présence de myosine dans les isolats protéiques de poisson. Sa capacité émulsifiante est expliquée par la présence de résidus hydrophobes dans la région globulaire et de groupes polaires dans la tige fibreuse, faisant de la myosine la protéine musculaire la plus émulsifiante34. De plus, cette protéine est aussi responsable de la formation de gels lors du chauffage36.
Valorisation de niche
1.1.2.2.1 Gélatine et collagène marin
La gélatine est obtenue à partir de l’hydrolyse partielle du collagène qui est la protéine majoritaire du tissu conjonctif. C’est une protéine soluble ayant de nombreuses propriétés fonctionnelles, telles que moussante, émulsifiante, filmogène et surtout la capacité de liaison avec l’eau. Cela fait de la gélatine une protéine très utilisée dans l’industrie agroalimentaire (texture, mâche, stabilisation de mousse, texture crémeuse, gélification), dans l’industrie pharmaceutique (implant, perfusion, encapsulation, pansement, expanseur de volume plasmique) et dans la cosmétique (hydratant et texturant)37, 38. Les principales sources de gélatine sont la peau de porc (46%), le cuir de bovin (29%) et les os (23%). Cependant, la préoccupation des consommateurs envers ces matières premières a incité les industriels à trouver de nouvelles sources37. Les restrictions alimentaires de certaines religions, l’augmentation du végétarisme et l’inquiétude envers l’encéphalopathie spongiforme bovine ont soulevé de nombreux questionnements sur la gélatine de mammifère et ont permis l’essor
11
de nouvelles matières premières comme les co-produits de poisson37, 38. La gélatine de poisson est extraite à partir de la peau, des arêtes et des nageoires, principalement par traitement acide ou basique à des températures entre 45°C et 60°C, permettant le clivage des liaisons croisées covalentes inter et intramoléculaires37. Les propriétés fonctionnelles de la gélatine sont en étroite relation avec la matière première et les paramètres de la méthode d’extraction (pH, température, temps) qui vont influencer la longueur du polypeptide obtenu39. Ainsi, la gélatine obtenue à partir de poissons d’eau froide va avoir une plus faible force de gel à 10°C que celle extraite de poissons d’eau chaude qui va se rapprocher de la gélatine de mammifère38. De plus, la température de fusion de la gélatine va aussi se différencier suivant l’espèce de poisson. Ainsi, les poissons d’eau froide auront une température de fusion plus faible que ceux d’eau chaude (proche de celle des mammifères)37, 38. La biodiversité marine permet donc d’obtenir des produits aux propriétés différentes,
élargissant ainsi leur champs d’utilisation : micro-encapsulation et produits réfrigérés pour la gélatine de poisson d’eau froide ; produits stockés à température pièce pour la gélatine de poisson d’eau chaude37.
De plus, les nouveaux procédés d’extraction et de pré-traitement comme l’hydrolyse enzymatique, les ultrasons et les ultra hautes pressions permettraient de réduire le temps d’extraction de la gélatine ainsi que les volumes d’eau utilisés39.
1.1.2.2.2 Lipides marins
Les lipides sont des composés importants pour la nutrition humaine et ils sont notamment indispensables au bon déroulement de nombreuses voies métaboliques. Ils sont divisés en deux classes suivant leur structure et leur rôle dans l’organisme. Ainsi les lipides neutres, majoritairement composés de triacylglycérols, sont des réserves énergétiques et l’oxydation de leurs acides gras (AG) va permettre la production d’adénosine-triphosphate (ATP). Les lipides polaires majoritairement composés de phospholipides, sont des lipides de structure et constituent la double couche membranaire des cellules. Les AG sont composés d’un acide carboxylique attaché à une chaine carbonée dont le nombre de doubles liaisons va définir leur degré d’insaturation : saturés (AGS), monoinsaturé (AGMI) et polyinsaturés (AGPI). De nombreuses études épidémiologiques ont présenté les effets bénéfiques des AGPI, en particulier des oméga-3 (ω-3), sur la prévalence des maladies cardiovasculaires
12
dans les populations ayant une diète riche en produits marins40-43. En effet, les poissons sont connus pour leur forte teneur en AGPI, pouvant représenter entre 25% et 40% des lipides totaux, et notamment en EPA (20:5 n3) et en DHA (22:6 n3)44. Les variations de concentration en AGPI sont dues à leur rôle physiologique au sein des organismes. L’insaturation des AGPI leur confère une température de cristallisation plus basse et permet ainsi de maintenir la fluidité des membranes cellulaires dans les eaux froides. De ce fait, les poissons des eaux froides auront une concentration en AGPI plus importante que les populations des eaux chaudes. De plus, les poissons gras comme le hareng, vont avoir une importante concentration en lipides dans tous leurs tissus, alors que pour les poissons maigres comme la morue (Gadus sp), les lipides seront majoritairement présents dans des organes de stockage comme le foie.
De ce fait, l’intérêt pour les huiles de poisson pour la santé humaine a fortement augmenté et les huiles de hautes qualités riches en AGPI représentent un marché important pour les industriels. En effet, les mammifères étant incapables de convertir l’acide linoléique (C18:2 n6) en acide α-linolénique (C18:3 n3), leur apport dans le régime alimentaire est indispensable au bon fonctionnement de l’organisme et en font des AG essentiels (Figure 1-3). De plus, la conversion de l’acide α-linolénique en EPA puis en DHA est très faible chez l’être humain (entre 0,2% et 8% pour l’EPA et 0% et 4% pour le DHA). De ce fait, le régime alimentaire, spécifiquement en poissons gras, reste la plus importante source d’AGPI ω-3 pour l’être humain.
13
De nos jours, le principal procédé d’extraction lipidique des co-produits de poisson se fait en milieu aqueux à hautes températures. Cependant, la présence d’insaturations dans les AG les rend plus sensibles et augmente le risque d’oxydation des AGPI. La qualité de l’huile de poisson va dépendre de sa concentration en AGPI et surtout de sa stabilité à l’oxydation. Ainsi, une extraction à des températures plus faibles (60°C - 70°C) ou pendant un temps plus court permettra de conserver un maximum d’AGPI dans les huiles finales45. De plus, des études ont montré que le temps de procédé et la fraicheur de la matière première influençaient aussi sur la qualité finale de l’huile28, 46. Enfin, des nouvelles techniques d’extraction lipidique comme les hydrolyses enzymatiques pourraient augmenter le rendement et la qualité des huiles finales45, 47, 48.
Depuis plusieurs années, les bienfaits des AGPI et notamment du DHA et de l’EPA sur la prévention des maladies cardiovasculaires ont largement été étudiés (voir section 1.2.2.2). Cependant, ces composés ont montré d’autres activités sur la santé humaine, comme des effets antiprolifératifs de cellules cancéreuses, reportées dans plusieurs revues de littératures49, 50. Plusieurs mécanismes d’actions du DHA et EPA ont pu être démontrés, comme l’apoptose des cellules grâce à l’augmentation de protéines pro-apoptotiques, l’induction du stress oxydant avec la formation importante d’espèces réactives à l’oxygène (ROS, «reactive oxygen species») dans les cellules cancéreuses suite à la peroxydation lipidique du DHA et la réduction de la production de la prostaglandine E2, un médiateur
lipidique induisant la croissance des cellules cancéreuses49-53. Des études ont aussi révélé la corrélation entre un régime alimentaire riche en poisson ou AGPI et la diminution de développement de désordres psychiatriques comme la dépression, la maladie d’Alzheimer et la schizophrénie54-56.
1.1.2.2.3 Les peptides bioactifs
Production des peptides de poisson bioactifs
Les aliments fonctionnels sont définis par Santé Canada comme étant des aliments conventionnels fournissant des avantages physiologiques ou réduisant les risques de maladies chroniques, au-delà de leurs fonctions nutritionnelles de base57. Depuis ces vingt dernières
années, il y a un intérêt majeur des scientifiques et des industriels pour les aliments fonctionnels, et notamment pour la production de peptides bioactifs (PB), qui résultent de
14
l’hydrolyse d’une protéine initiale. Ce sont des séquences d’acides aminés (généralement entre 2 et 20), ayant des propriétés bénéfiques pour la santé humaine25, 30. La recherche en agroalimentaire sur la production, la concentration et la caractérisation de ces PB, représente un véritable enjeu économique, écologique et sociétale58. Les protéines de poisson sont classées en trois groupes :
• Les protéines sarcoplasmiques (15 à 35% des protéines totales) présentent dans la sarcoplasme regroupant généralement des enzymes liées à la production d’énergie comme la créatine kinase ou l’aldolase25.
• Les protéines myofibrillaires (65 à 75% des protéines totales), sont des protéines de structure, principalement composées de la myosine et de l’actine. Elles sont solubles à de hautes concentrations en sels25.
• Les protéines du stroma ou tissu conjonctif (3% des protéines totales) composées essentiellement de collagène. Elles sont les moins solubles25.
Cependant, la valeur nutritionnelle et l’activité biologique des PB dépendent de nombreux paramètres. La production des PB est donc devenue un réel enjeu pour les industriels58. Pour cela, deux techniques principales d’hydrolyses peuvent être utilisées : chimique ou enzymatique. Ces deux méthodes vont permettre la rupture des liaisons peptidiques et donc la libération d’acides aminés (AA) libres ou de peptides.
1.1.2.2.3.1.1 Hydrolyse chimique
L’hydrolyse chimique utilise des acides (l’acide chlorydrique, HCl) pour une hydrolyse acide ou des bases (l’hydroxyde de sodium, NaOH ou l’hydroxyde de potassium KOH) pour une hydrolyse alcaline. Ces deux procédés ont largement été utilisés dans le passé, dû à leur facilité, leur rapidité et leur faible coût59. Cependant, certains AA sont très sensibles à ces substances. Ainsi, les acides détruisent le tryptophane et transforment les fonctions amides de la glutamine et de l’asparagine en acide, menant à la formation de glutamate et d’aspartate. Quant à l’utilisation de bases, cela dégrade la sérine, la thréonine et la cystéine. De plus, l’hydrolyse chimique est souvent couplée avec de hauts pH et températures. Il s’agit donc d’un procédé difficile à contrôler, menant souvent à la production de peptides aux compositions en AA et aux propriétés biologiques variables59. De plus, la
15
perte de nombreux acides aminés essentiels conduit à la formation d’hydrolysats de faibles qualités nutritives et fonctionnelles. Ainsi cette technique est de moins en moins utilisée, sauf pour la production d’hydrolysats concentrés en peptides à faibles valeurs ajoutées59.
1.1.2.2.3.1.2 Hydrolyse enzymatique
L’hydrolyse enzymatique utilise comme catalyseur de réaction des enzymes qui sont spécifiques au type de substrat à hydrolyser (lipides, glucides, protéines…)59. Ainsi pour la production de PB, les enzymes utilisées sont des protéases qui rompent les liaisons peptidiques entre les AA (figure 1-4). Elles vont donc libérer des polypeptides, des peptides de différents poids moléculaires (PM) et des AA libres. Ces protéases sont produites naturellement par de nombreux organismes vivants, comme les animaux (trypsine, pepsine), les plantes (papaïne, bromélaine) ou les microorganismes (Alcalase® et Flavourzyme®). Cependant, les industriels utilisent souvent des mélanges d’enzymes, afin d’augmenter le nombre des sites de coupures60, 61. En effet, deux types de protéases existent : les
exopeptidases qui rompent les groupements carboxyles (carboxyle peptidase) ou amines (amino peptidase), situés à l’extérieur de la chaine peptidique, libérant des AA libres ; et les endopeptidases qui coupent les liaisons peptidiques à l’intérieure de la chaîne, libérant des peptides de compositions et PM différents59 (figure 1-4). Pendant l’hydrolyse, un certain nombre de paramètres vont influencer l’obtention de PB, tels que la concentration et la nature de l’enzyme, la valeur du pH, le temps de réaction, la température et le ratio enzyme/substrat59-65. Kristinsson et Rasco61 ont démontré que le choix de l’enzyme influait sur la cinétique de la réaction enzymatique. Ainsi, la Corolase7089® présentait la meilleure vitesse de réaction suivi de la PCE (pyloric caeca extract), la Flavourzyme®, la Corolase PN-L® et l’Alcalase®. Ces paramètres influencent aussi le degré d’hydrolyse de la solution (DH, % de liaisons peptiques hydrolysées), étroitement lié aux activités biologiques et fonctionnelles des peptides finaux62, 64, 66, 67. Klompong et al.62, ont réalisé une hydrolyse enzymatique de Sélar à bande dorée (Selaroides leptolepis) par deux enzymes (Alcalase® ou Flavourzyme®). Les auteurs ont ainsi montré les relations entre le DH final, le type de protéase utilisé et les activités antioxydantes/fonctionnelles obtenues (capacité émulsifiante et solubilité). En effet les fractions présentant le plus fort DH (25%), amélioraient la solubilité de la solution, due à la présence de peptides de faibles PM pour les deux types d’enzymes.
16
La capacité émulsifiante était quant à elle augmentée par les fractions aux plus faibles DH (5%), suivant l’enzyme.
Pour les activités biologiques, les relations semblent plus subtiles, mais dépendent fortement du type d’enzyme et du DH. En effet, Klompong et al.62 reportaient une plus forte activité de chélation des métaux par les fractions générées par la Flavourzyme au DH le plus fort (25%). L’optimisation de ces paramètres est donc une étape cruciale pour les industriels afin de pouvoir au mieux générer des PB de manière fiable et reproductible. La recherche d’enzymes va donc permettre aux industriels d’identifier les meilleures protéases produisant des PB aux activités biologiques intéressantes et rentables. En fin de procédé les enzymes doivent être inactivées pour la mise sur le marché des PB. Pour cela, plusieurs techniques peuvent être utilisées : l’inactivation thermique (les températures sont augmentées jusqu’à 80-90°C pendant 10 minutes pour un hydrolysat de poisson), l’inactivation par le pH (diminution par l’ajout d’acide suivant l’enzyme utilisée) ou la filtration par membrane59.
Ainsi, la meilleure maîtrise de l’hydrolyse avec l’utilisation d’enzyme, fait de ce procédé le principal utilisé pour la production de PB. De plus, l’importante biodiversité du milieu marin et le riche choix des enzymes ont permis la production de nombreux PB présentant des bioactivités très diverses : antioxydante, anticancer, antihypertenseur, antibactérien30, 63, 68. Ainsi, les PB de poisson peuvent être utilisés dans l’industrie agroalimentaire comme conservateurs mais aussi dans l’industrie nutraceutique pour améliorer certains paramètres physiologiques pour la santé humaine. Cette dernière application des PB de poisson sera détaillée dans la section 1.2.3.
Endopeptidase
Carboxyle peptidase
NH2 COOH
Amino peptidase
17
Peptides d’hareng de l’Atlantique
Comme vu précédemment, les hydrolysats de poisson peuvent avoir des activités biologiques variées et complexes. Ces dernières vont dépendre de la composition en AA et du PM des PB. Ainsi la matière première reste cruciale dans l’obtention de PB de poisson. Le hareng de l’Atlantique étant un poisson gras avec une teneur importante en AGPI ω3, il est principalement utilisé pour la production de farine mais surtout d’huile. En effet, les chercheurs se sont principalement focalisés sur l’extraction d’huile de hareng, très recherchée du fait de sa grande qualité28. Néanmoins, très peu de publications scientifiques ont valorisé le potentiel des peptides contenus dans ces co-produits. Le tableau 1-2 présente la littérature traitant de PB issus d’un hydrolysat enzymatique de hareng de l’Atlantique (Clupea
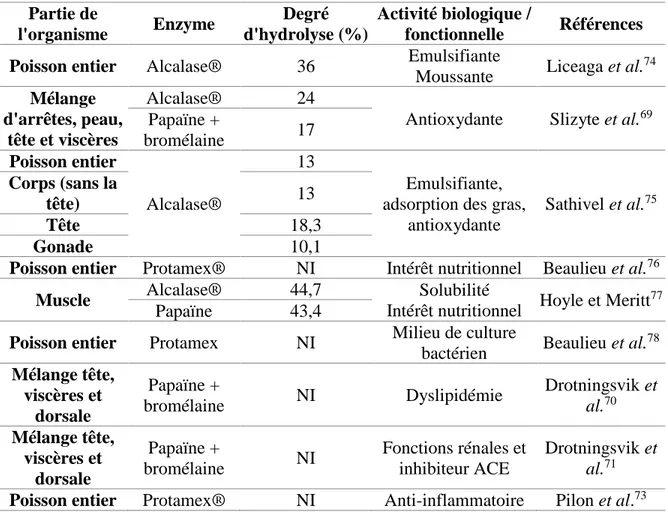
harengus). Dans leur étude, Slizyte et al.69 présentaient une augmentation de l’activité antioxydante (inhibition du taux d’oxygène catalysé par le fer) par deux hydrolysats enzymatiques de hareng. Cependant, de récentes études ont été faites sur l’effet de l’ajout d’hydrolysat de hareng dans la diète de rat Zucker fa/fa sur certains paramètres impliqués dans le syndrome métabolique comme la dyslipidémie, l’hypertension et les fonctions rénales (Tableau 1-2)70, 71. De plus, Pampanin et al.72 ont révélé la présence de PB issus de l’hydrolyse enzymatique de la peau et de co-produits de hareng, répertoriés dans les bases de données. Ainsi, certains PB présentaient des motifs liés aux activités antioxydante, antimicrobienne, cardioprotectrice et immunomodulatrice. Dans leur étude sur des rats Wistar nourris avec une diète riche en gras dont la fraction protéique était remplacée par un hydrolysat de hareng, Pilon et al.73 ont reporté une diminution de l’expression des cytokines TNFα et IL6 dans le tissu adipeux par rapport aux animaux nourris avec de la caséine. L’hydrolysat de hareng, permettait donc de réduire l’inflammation induite par une diète obésogène. Un grand intérêt a aussi été porté sur les activités fonctionnelles (émulsifiante et moussante) des hydrolysats de hareng, dû à la présence de nombreuses molécules amphiphiles74. Cependant, l’activité émulsifiante reste souvent inférieure à celle de l’œuf ou du soja, qui sont aujourd’hui majoritairement utilisés dans les procédés agroalimentaires75.
De plus, leur goût et leur odeur prononcés, permettent d’envisager leur incorporation seulement dans des matrices alimentaires marines. Ainsi, les co-produits d’hareng représentent des sources de matières premières intéressantes pour la production de PB.