Rééducation du langage au stade chronique post-AVC :
Approche individualisée en stimulation cérébrale non
invasive
Mémoire
Noémie Comeau
Maîtrise en neurosciences - avec mémoire
Maître ès sciences (M. Sc.)
R
ÉÉDUCATION DU LANGAGE AU STADE CHRONIQUE POST-AVC :
APPROCHE INDIVIDUALISÉE EN STIMULATION CÉRÉBRALE NON INVASIVEMémoire
Noémie Comeau
Sous la direction de :
Cyril Schneider, directeur de recherche
Laura Monetta, codirectrice de recherche
Résumé
L’accident vasculaire cérébral (AVC) génère un taux d’invalidité chronique très élevé dans le monde. L’aphasie, soit la perte de l’aptitude à communiquer, figure parmi les déficits fréquemment observés. La stimulation cérébrale non invasive (NIBS) est utilisée en recherche comme outil d’investigation du fonctionnement cérébral et d’influence de la plasticité cérébrale, de là son intérêt thérapeutique en réadaptation post-AVC. Étant donné l’hétérogénéité des résultats, le choix des protocoles à adopter est controversé, de là l’intérêt d’individualiser l’approche selon les caractéristiques individuelles des participants. Ce projet vérifiait chez des participants avec aphasie (PAA) au stade chronique post-AVC si l’individualisation de NIBS aurait un impact sur la plasticité et le langage. La première étude, vérifiait le fonctionnement cérébral des participants (avec ou sans aphasie) et leur plasticité induite par différents protocoles de NIBS (inhibiteur, excitateur, placebo sur le cortex moteur primaire M1 de l’hémisphère non lésé HNL) et a permis de montrer que l’intégrité des tissus épargnés du M1 de l’hémisphère lésé (HL), appelée réserve structurale (RS), doit être pris en compte lors du choix du protocole. La deuxième étude, portant sur le langage et la plasticité induite d’une intervention individualisée de NIBS du M1-HNL (déterminée par la présence ou l’absence d’une RS-HL) des PAA, a montré une tendance à l’amélioration fonctionnelle des PAA, associée à une augmentation de l’efficacité corticospinale du M1. La troisième étude vérifiait si l’ajout de NIBS individualisée à un traitement phonologique (TP) pourrait potentialiser les effets de ce dernier dans un cas d’anomie lexicale chronique. Elle a montré un meilleur maintien des améliorations de dénomination orale des items pratiqués, sans toutefois potentialiser l’efficacité du TP. La dénomination orale des items non pratiqués tendait à s’améliorer avec l’ajout de NIBS-excitatrice au TP. Cela semblait être associé à une augmentation de l'excitabilité corticospinale du M1-HNL, seulement observée avec la NIBS.
Abstract
Stroke generates a very high rate of chronic disability worldwide. Aphasia, the loss of the ability to communicate, is one of the frequently observed deficits. Noninvasive brain stimulation (NIBS) is used in research as a tool for investigating brain function and influencing brain plasticity, hence its therapeutic value in post-stroke rehabilitation. Given the heterogeneity of the results, the choice of the protocol to use is controversial, hence the interest in individualizing the approach according to the participants’ individual characteristics. This project investigated in participants with aphasia (PWA) at chronic post-stroke whether the individualization of NIBS would impact plasticity and language. The first study, verifying the cerebral functioning of the participants (with or without aphasia) and their plasticity induced by different protocols of NIBS (inhibitor, excitator, sham on the primary motor cortex M1 of the unlesioned hemisphere UH), made it possible to show that the integrity of the spared tissue in M1 of the lesioned hemisphere (LH), called structural reserve (SR), must be taken into account when choosing the NIBS protocol. The second study, on language and plasticity induced by an individualized intervention of NIBS of UH-M1 (determined by the presence or absence of a SR-LH) of PWA, showed a trend in functional improvement of PWA, associated with an increase of M1 corticospinal efficacy. The third study, verifying whether the addition of an individualized NIBS to a phonological treatment (PT) could potentiate the effects of the latter in a case of chronic lexical anomia, showed better maintenance of improvements in oral naming of practiced items, without potentiating the efficacy of the PT. The oral naming of unpracticed items also seemed to have improved with the addition of excitatory-NIBS to the PT. This appeared to be associated with an increase in corticospinal excitability of UH-M1, only observed with NIBS.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... vii
Liste des tableaux ... viii
Liste des abréviations ... ix
Liste des sigles ... x
Liste des acronymes ... xi
Remerciements ... xii
Avant-propos ... xiv
Introduction ... 1
Qu’est-ce que l’aphasie ? ... 1
Plasticité cérébrale post-AVC ... 2
Rééducation de l’aphasie post-AVC ... 3
Traitements orthophoniques ... 3
Stimulation cérébrale non invasive (NIBS) ... 3
Objectifs du projet de maîtrise ... 6
Hypothèses de travail ... 7
Approche expérimentale ... 8
Participants ... 9
Recrutement ... 9
Critères de sélection ... 10
Critères d’inclusion ... 10
Critères d’exclusion liés à la santé générale ... 11
Critères d’exclusion liés aux TMS ... 11
Résumé du devis expérimental ... 12
Mesures fonctionnelles et neurophysiologiques ... 12
Mesures fonctionnelles ... 12
Mesures neurophysiologiques par TMS ... 15
Protocoles de stimulations répétitives pour influencer la plasticité de M1 ... 18
Réduction des données et analyses statistiques ... 19
Chapitre 1 – Étude 1 ... 24
1.1 Résumé ... 25
Introduction ... 26
Material and Methods ... 27
Participants and study design ... 27
TMS testing (parts 1 and 2) ... 28
Intervention: NIBS of UH-M1 ... 29
Data reduction and statistical analyses ... 30
Results ... 31
Between-group differences of TMS outcomes ... 31
Corticomotor effects of each intervention ... 33
Correlations ... 34
Discussion ... 34
Plastic changes related to LH integrity and UH excitability ... 34
Corticomotor effects of NIBS over UH and clinical significance ... 37
Methodological considerations ... 39
Conclusion ... 40
Acknowlegments ... 40
References ... 42
Figures captions ... 51
Chapitre 2 – Étude 2 ... 58
2.1 Résumé ... 59
2.2 Abstract ... 59
Introduction ... 60
Material and methods ... 62
Participants and study design ... 62
Language testing ... 63
TMS testing ... 63
NIBS protocols ... 64
Data reduction and statistical analyses ... 64
Results ... 65
Inhibitory NIBS of UH M1 when LH M1 still works ... 66
Excitatory NIBS of UH M1 when LH M1 does not work ... 66
Discussion ... 66
Modulation of language abilities by NIBS of UH M1 ... 67
Methodological considerations ... 68
Conclusion ... 69
Acknowlegments ... 69
References ... 70
Figures captions ... 77
Chapitre 3 – Étude 3 ... 83
2.1 Résumé ... 84
2.2 Abstract ... 84
Introduction ... 85
Case description ... 86
Experimental protocol ... 87
TMS testing for both Phases ... 89
Excitatory NIBS of UH M1 for both Phases ... 90
Results ... 91
Phase 1: NIBS of UH M1 ... 91
Phase 2: Combination of NIBS of UH M1 with PT ... 92
Discussion ... 93
Conclusion ... 97
Acknowlegments ... 97
References ... 98
Figures captions ... 107
Discussion générale et conclusion ... 112
Retour sur les hypothèses de départ ... 112
Hypothèses relatives à l’article 1 ... 113
Hypothèse relative à l’article 2 ... 114
Hypothèse relative à l’article 3 ... 115
Implications des résultats pour la clinique et avenues de recherche futures ... 117
Modèle de Di Pino en récupération du langage ... 118
Rôle de l’hémisphère droit (HD) en récupération du langage ... 118
M1 en tant que cible à la rTMS en récupération du langage ... 119
Forces et limites ... 121
Conclusion ... 122
Bibliographie générale ... 124
Liste des figures
CHAPITRE 1 – ÉTUDE 1: Corticomotor after-effects of noninvasive brain stimulation
over the unlesioned hemisphere
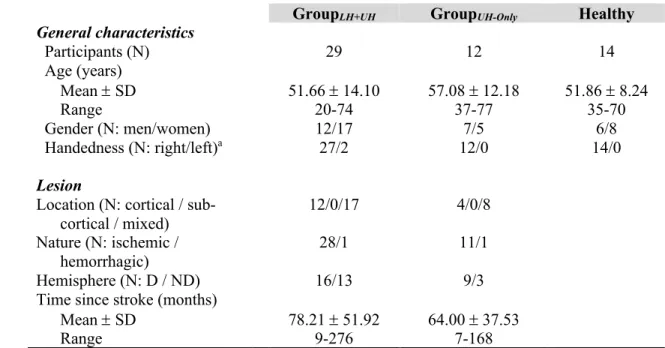
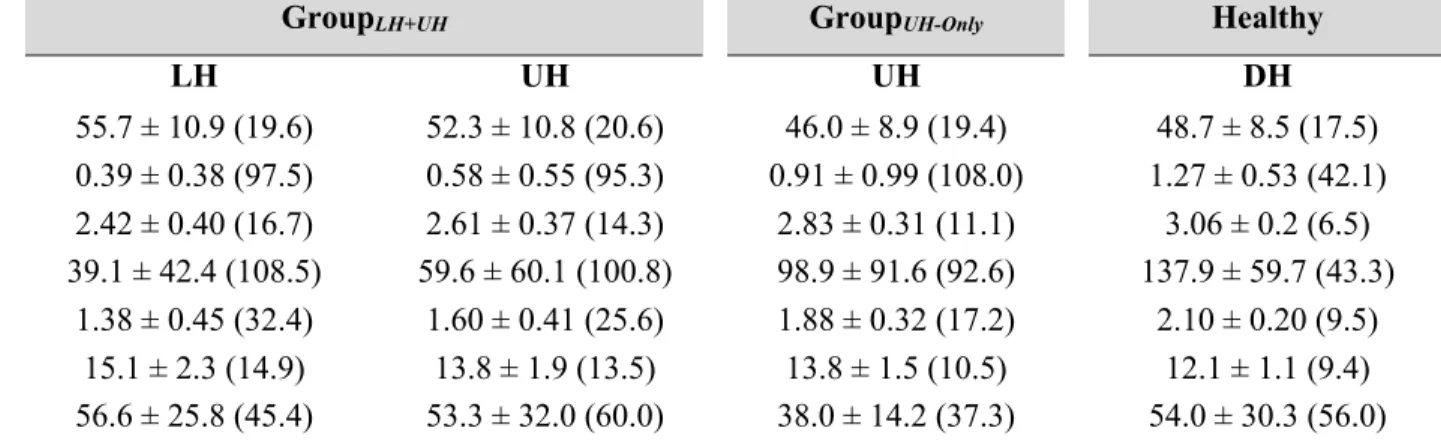
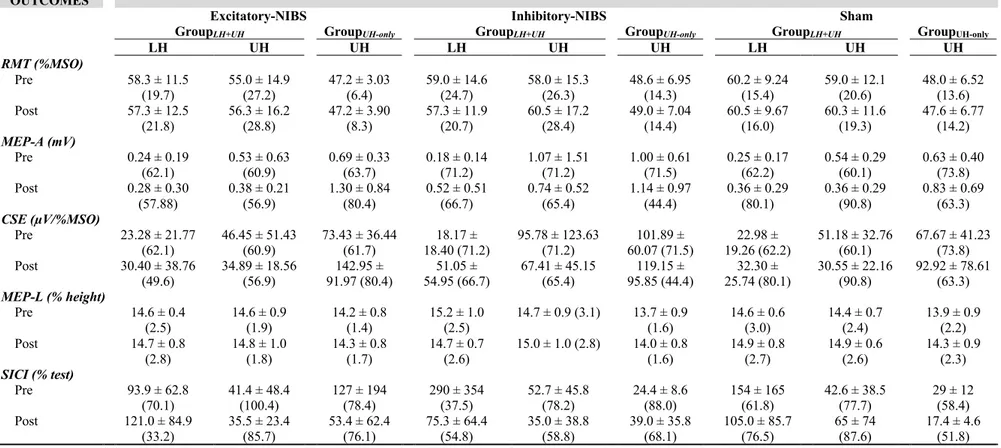
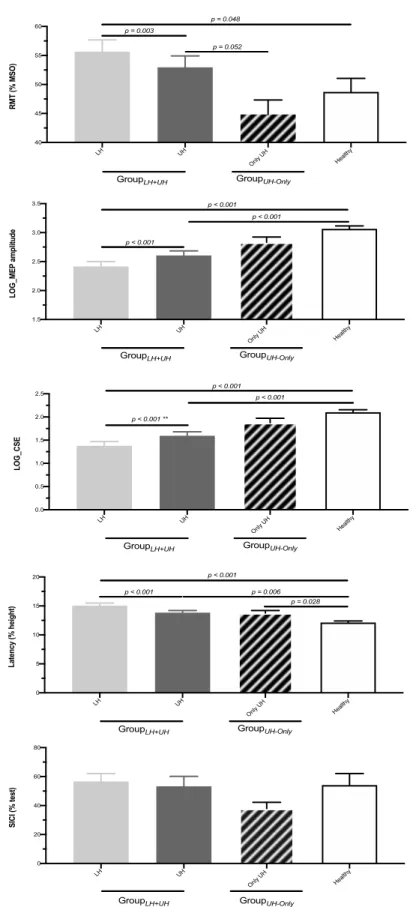
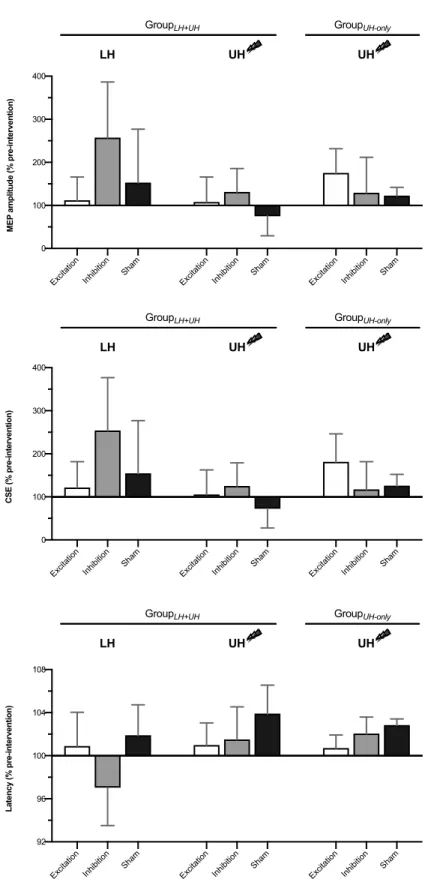
Figure 1. TMS data of GroupLH+UH, GroupUH-Only and Healthy………55
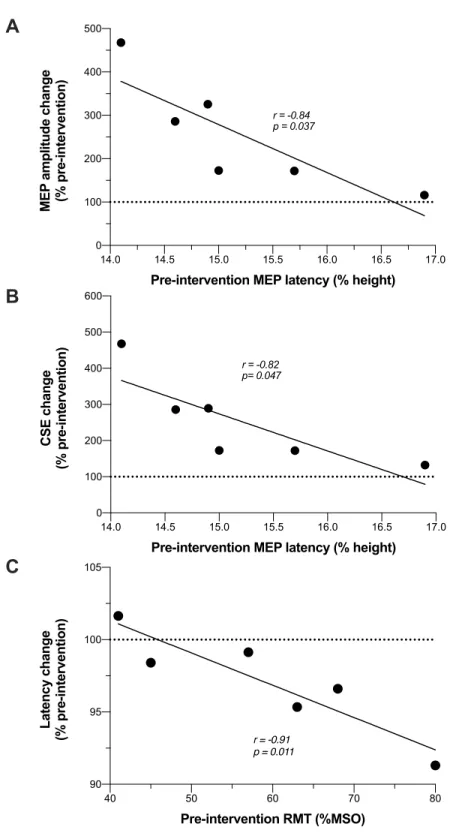
Figure 2. TMS data at post-intervention (% pre-intervention).………...56 Figure 3. Associations between changes and pre-intervention values………57
CHAPITRE 2 – ÉTUDE 2: Individualized noninvasive brain stimulation of the unlesioned
hemisphere in chronic post-stroke aphasia: Impact on language and neuroplasticity
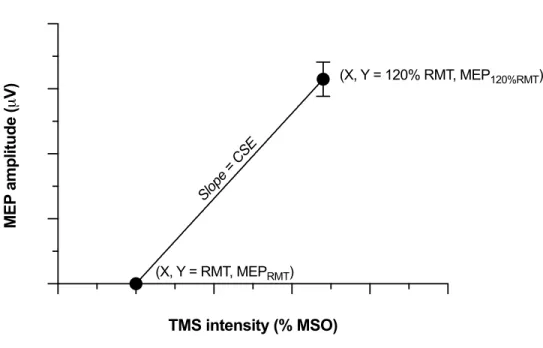
Figure 1. Corticospinal efficacy (CSE) illustration………80 Figure 2. Changes of langage performance and CSE……….………...81 Figure 3. Raw changes of CSE………...82
CHAPITRE 3 – ÉTUDE 3: Noninvasive stimulation of the unlesioned hemisphere and
phonological treatment in a case of chronic anomia post-stroke
Figure 1. Experimental set-up of the case study with intervention and measures of oral naming scores and TMS outcomes………...110 Figure 2. Changes of oral picture naming and TMS outcomes……….111
Liste des tableaux
CHAPITRE 1 – ÉTUDE 1: Corticomotor after-effects of noninvasive brain stimulation
over the unlesioned hemisphere
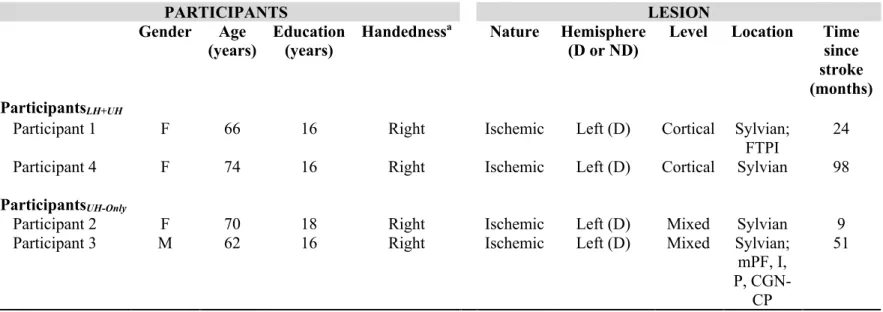
Tableau 1. Characteristics of participants……….…………52 Tableau 2. TMS outcomes (Part 1) in chronic stroke (2 groups) and healthy participants…………..53 Tableau 3. Acute TMS changes for each protocole (Part 2)………54
CHAPITRE 2 – ÉTUDE 2: Individualized noninvasive brain stimulation of the unlesioned
hemisphere in chronic post-stroke aphasia: Impact on language and neuroplasticity
Tableau 1. Participants and lesion………..78 Tableau 2. Langage tasks………...………79
CHAPITRE 3 – ÉTUDE 3: Noninvasive stimulation of the unlesioned hemisphere and
phonological treatment in a case of chronic anomia post-stroke
Tableau 1. Phase 1: raw data of langage and TMS outcomes (NIBS of UH M1)………..108 Tableau 2. Phase 2: raw data of oral picture naming and TMS outcomes (Sham+PT vs
Liste des abréviations
ATCD Antécédent
CSE Efficacité corticospinale (de l’anglais « corticospinal efficacy »)
DDK Diadococinésie
EEG Élecencéphalogramme
EMG Électromyographie de surface, « Electromyography » GABAA Acide g-aminobutyrique liée au récepteur de type A
M1 Cortex moteur primaire
Liste des sigles
AVC Accident vasculaire cérébral
BA Aires de Brodmann (de l’anglais « Brodmann area »)
BDNF Facteur neurotrophique (de l’anglais « brain-derived neurotrophic factor ») CNS Système nerveux central (de l’anglais « central nervous system »)
CTBS Stimulation continue à rythme thêta (de l’anglais « continous theta-burst
stimulation »)
FDI Premier interosseux dorsal (de l’anglais « first dorsal interosseous ») FIFC Feuillet d’information et formulaire de consentement
HD, HG Hémisphère droit, hémisphère gauche
HDo Hémisphère dominant
HL, LH Hémisphère lésé, « Lesioned hemisphere » HNL, UH Hémisphère non lésé, « Unlesioned hemisphere »
IO curve Courbe entrée-sortie de la fonction sigmoïdale de Boltzmann (de l’anglais «
input-output curve »
IRM, MRI Imagerie par résonnance magnétique, « Magnetic resonance imaging » IRMf, fMRI Imagerie par résonnance magnétique fonctionnelle, « Functional magnetic
resonance imaging »
ITBS Stimulation intermittente à rythme thêta (de l’anglais « intermittent
theta-burst stimulation »)
LTP, LTD Potentialisation, dépression à long terme (de l’anglais « long term
potentiation, depression »)
MSO Intensité maximale du stimulateur (de l’anglais « maximal stimulator output »)
MT Seuil moteur (de l’anglais « motor threshold ») NMDA Récepteurs glutamatergiques N-methyl-D-aspartate
RMT Seuil moteur au repos (de l’anglais « resting motor threshold ») RS, SR Réserve structurelle, « Structural reserve »
RTMS Stimulation magnétique transcrânienne répétitive (de l’anglais « repetitive
transcranial magnetic stimulation »)
SD Écart-type (de l’anglais « standard deviation »)
SEM Erreur standard de la moyenne (de l’anglais « standard error of the mean »)
SICI
Inhibition intracorticale avec conditionnement à courte latence (de
l’anglais « short-interval intracorticale inhibition »)
TCC Traumatisme cranio-cérébral
TDQ30 Test de Dénomination de Québec – 30 images
TBS Stimulation magnétique transcrânienne à fréquence thêta (de l’anglais « theta
burst stimulation »)
TMS Stimulation magnétique transcrânienne (de l’anglais « transcranial magnetic
stimulation »)
TO Traitement orthophonique
Liste des acronymes
ANOVA Analyses de variance (de l’anglais « analysis of variance »)
APIA-AVC Association des Personnes Intéressées par l’Aphasie et l’Accident vasculaire cérébral
BECLA Batterie d’Évaluation Cognitive du Langage BEPS Batterie d’Évaluation de la Production Syntaxique BOSS De l’anglais « Bank of Standardized Stimuli »
CIRRIS Centre interdisciplinaire de recherche en réadaptation et intégration sociale CHUL Centre hospitalier de l’Université Laval
CHUQ Centre hospitalier universitaire de Québec
MEP Potentiel moteur évoqué (de l’anglais « motor evoked potential »)
NIBS Stimulation cérébrale non invasive (de l’anglais « noninvasive brain
stimulation »)
TEFREP Test Français de Répétition de Phrases TEP Tomographie par émission de positron
Remerciements
Cette maîtrise a été une étape significative, à la fois dans ma vie professionnelle que personnelle. J’ai pu y acquérir de multiples connaissances en neurosciences et en neuromodulation.
La rencontre et les interactions avec les participants, à qui je dois un immense merci, m’ont fait grandir et m’ont permis de devenir une meilleure version de moi-même. Ils ont participé à mettre encore plus de l’avant les bienfaits d’aider son prochain.
Ces deux années d’apprentissages et de réflexions m’ont ouvert sur le monde de la recherche. J’ai maintenant en poches trois articles scientifiques en tant que première auteure. Bien sûr, tout cela ne vient pas sans aide, et je remercie de tout cœur l’implication majeure et primordiale de mon directeur de recherche, Cyril Schneider, et de ma codirectrice, Laura Monetta. Je leur suis très reconnaissante d’avoir participé à cette étape enrichissante de ma vie. Merci Cyril de m’avoir fait confiance et de m’avoir accueilli dans l’équipe. Merci Laura d’avoir accepté le rôle de codirectrice en cours de projet et d’avoir mis ta belle couleur à mon parcours. Merci à vous deux pour votre énergie débordante et votre passion contagieuse pour la recherche. Je remercie également la Fondation du CHU de Québec et le Fonds de soutien à la recherche Joseph-Demers de la Faculté de Médecine de l’Université Laval pour les bourses qui m’ont été octroyées.
Je remercie également mon équipe de laboratoire, Nicolas Mavromatis, Pier-Luc Champagne, Isabella Bienjonetti, Estelle Gouriou, Charlotte Souil, Élyse Roussel et Aymeric Averlant qui ont tous positivement influencé mon cheminement. Un merci tout particulier à Nicolas, qui a été une personne très significative tout au long de ce parcours. Il a toujours su me garder sur le droit chemin et m’encourager à dépasser mes limites. Il a su être à 120% disponible pour tous les étudiants, nous faire travailler fort, mais aussi nous faire rire fort.
Je remercie également toute l’équipe d’orthophonistes de Laura Monetta qui m’ont accueilli à bras ouverts dans leur merveilleuse équipe. Mon arrivée parmi eux a fait une énorme différence dans mon parcours. Ils ont été des acteurs très inspirants et motivants. Leur enthousiasme pour la recherche est contagieux et leurs connaissances, leurs réflexions et leur intelligence m’ont été d’une grande aide. Un merci spécial à Valérie Coulombe d’avoir participé à mon projet et de l’avoir rendu meilleur.
À mes proches et à ma famille, plus particulièrement à mes parents, un merci énorme de m’avoir permis de me rendre où je suis, de m’avoir inculqué les valeurs de persévérance et de détermination. Je ne peux trouver les mots pour vous dire à quel point je suis reconnaissante pour tout le support et l’amour dont j’ai eu droit depuis toujours. Merci Daniel et Francine pour vos beaux-mots et vos encouragements. Ils ont été significatifs, bien plus que vous ne le pensez.
À toi, mon supporteur #1, merci de rendre mon quotidien plus doux, plus beau, plus drôle. Ta présence à mes côtés me rend meilleure, honnêtement, et je suis tellement reconnaissante de chacun des petits mots, des petits gestes qui ont fait toute la différence durant ces dernières années.
Avant-propos
Ce présent mémoire porte sur les effets d’une intervention individualisée de stimulation cérébrale non invasive (NIBS) sur le langage des participants avec aphasie (PAA) au stade chronique post-AVC. Il est composé d’une introduction, de trois chapitres portant sur des études expérimentales séquentielles ainsi que d’une discussion générale et conclusion. L’introduction met sur table les différentes notions abordées dans ce présent mémoire, soit ce qu’est l’aphasie, la plasticité cérébrale et la rééducation post-AVC de même que la NIBS en tant qu’outil d’investigation et d’influence de la plasticité cérébrale. Les objectifs et hypothèses de même que l’ensemble de l’approche méthodologique y sont également abordés.
L’étude 1 (chapitre 1, article 1) porte sur l’influence de l’intégrité des tissus épargnés du cortex moteur primaire (M1) de l’hémisphère lésé (HL), appelée réserve structurale (RS), des participants (avec ou sans aphasie) au stade chronique post-AVC sur le fonctionnement cérébral et la plasticité induite par la NIBS. Cette étape est primordiale afin de déterminer si la RS doit être prise en compte lors du choix du protocole de NIBS. Cet article est en cours de soumission (prévue d’ici la fin de l’été 2020) à Clinical Neurophysiology.1
L’étude 2 (chapitre 2, article 2) vérifie les effets d’une intervention individualisée de NIBS sur la plasticité cérébrale et le langage des PAA en stade chronique post-AVC. Cette série de cas vérifie si l’individualisation de l’approche NIBS permet d’induire des changements fonctionnels significatifs. Cet article est en cours de soumission (prévue d’ici la fin de l’été 2020) à la revue Cortex.1
L’étude de cas en anomie lexicale chronique (chapitre 3, article 3) vérifie si l’ajout de la NIBS individualisée à un traitement orthophonique (TO) personnalisé et efficace pourrait potentialiser les effets de celui-ci. Cet article est également en cours de soumission (prévue d’ici la fin de l’été 2020) à la revue Brain and Language.1
Finalement, la conclusion générale revient sur les hypothèses et principaux résultats, aborde ses contributions et les perspectives scientifiques et cliniques potentielles de même que les forces et les limites du projet.
Contribution des coauteurs des articles présentés dans ce mémoire :
NOÉMIE COMEAU, étudiante à la maîtrise en neurosciences, Faculté de médecine de l’Université Laval, Laboratoire de Stimulation Non invasive (NOVA lab) au Centre de recherche du CHU de Québec – Université Laval (CHUQ-CHUL), axe Neurosciences : recension des écrits scientifiques, participation à l’élaboration du protocole, recrutement, collecte des données, analyse et interprétation des résultats et rédaction des trois articles (première auteure des articles 2 et 3; co-première auteure de l’article 1).
CYRIL SCHNEIDER, neurophysiologiste, chercheur et professeur titulaire, directeur de maîtrise, Département de réadaptation, Faculté de médecine de l’Université Laval, et NOVA lab au Centre de recherche du CHU de Québec – Université Laval (CHUQ-CHUL), axe Neurosciences : élaboration du protocole et de l’éthique du projet, supervision de la démarche scientifique, assistance et révision des trois articles (coauteur des trois articles).
LAURA MONETTA, orthophoniste clinicienne, chercheuse et professeure agrégée, codirectrice de maîtrise, Département de réadaptation, Faculté de médecine de l’Université Laval et Centre de recherche CERVO: assistance dans l’élaboration et la conduite du protocole de la deuxième et troisième étude, supervision de la démarche scientifique, assistance et révision des deuxième et troisième articles (coauteure des articles 2 et 3).
PIER-LUC CHAMPAGNE, étudiant à la maîtrise en neurobiologie et étudiant au baccalauréat en physiothérapie, Département de Réadaptation, Faculté de médecine de l’Université Laval, NOVA lab au Centre de recherche du CHU de Québec – Université Laval (CHUQ-CHUL), axe Neurosciences: co-premier auteur de l’article 1 (étude 1 conjointe; travail conjoint sur l’élaboration du protocole et l’approbation éthique de l’étude, le recrutement, la collecte des données, l’analyse et l’interprétation des résultats et la rédaction).
VALÉRIE COULOMBE, orthophoniste clinicienne, candidate au doctorat en sciences cliniques et biomédicales, Faculté de médecine de l’Université Laval, Centre interdisciplinaire de recherche en réadaptation et intégration sociale (CIRRIS) et CERVO: assistance dans la collecte, l’analyse et l’interprétation des données d’un sujet de la deuxième étude, assistance et révision du deuxième article (coauteure de l’article 2).
Introduction
Au Québec, environ 20 000 personnes par année subissent un accident vasculaire cérébral (AVC) et près de 130 000 victimes vivent avec des séquelles tant psychologiques que physiques (ministère de la Santé et des Services sociaux du Québec, 2020). Approximativement 21 à 38 % des participants ayant subi un AVC de l’hémisphère gauche (HG) souffrent d’aphasie (déficits d’expression orale et/ou de compréhension du langage) au stade aigu (Kapoor, 2017) et plus de 12 % ont une aphasie qui persiste six mois après l’impact (Kapoor, 2017).
Qu’est-ce que l’aphasie ?
L’aphasie se définit comme la perte, totale ou partielle, de l’aptitude à communiquer (Bleau-Lafond et coll., 2007). Cette problématique s’ensuit majoritairement d’un AVC fronto-temporal de l’HG, compte tenu de la latéralisation du langage à gauche dans la grande majorité de la population, mais peut aussi être causée par un traumatisme crânien, une maladie neurodégénérative, une tumeur cérébrale et un processus infectieux, entre autres (Verstichel et Cambier, 2005). Selon la localisation et l’étendue de la lésion, les déficits langagiers sous-jacents peuvent varier et être présents lors de la production et/ou de la compréhension du langage, à l’oral et/ou à l’écrit, définissant les différents types d’aphasie (aphasie dite de Broca, de Wernicke, de conduction, anomique, transcorticale sensorielle, transcorticale motrice et globale) (Monetta et coll., 2019). En ce qui concerne l’expression orale, les déficits peuvent se présenter à différents niveaux: traitement sémantique, traitement lexical ou son accès, mémoire tampon et panification motrice. Plusieurs modèles théoriques évaluant les étapes de la production du langage permettent de bien identifier les composantes altérées lors du langage (par ex., Patterson et Shewell, 1987; Denes et Pizzamiglio, 1999; Macoir et coll., 2015) et ainsi, bien orienter les interventions de rééducation. Parmi les manifestations observables d’une difficulté d’expression orale, l’anomie, soit une difficulté à trouver le mot voulu au moment voulu, est le déficit le plus commun et le plus persistant de l’aphasie au stade chronique post-AVC (Beeson et Rapcsak, 2006). Elle peut avoir des origines diverses, soit sémantique (associée au sens, au concept des mots), lexicale (associée au lexique, à la forme des mots) ou lexico-sémantique. L’anomie sémantique est caractérisée par des déficits d’activation du concept en mémoire sémantique présentée alors que l’anomie lexicale est caractérisée par des déficits d’activation lexicale du concept. L’anomie lexicale-sémantique combine ces déficits (lexicaux et sémantiques) (Marshall et coll., 1990; Raymer et Rothi, 2001).
Plasticité cérébrale post-AVC
Au cours des premières semaines suivant l’AVC (stades aigu et subaigu post-AVC), des mécanismes de récupération spontanée du cerveau (par ex., levées d’inhibition, activation de synapses latentes, bourgeonnement axonal collatéral, élaboration accrue de dendrites et d’épines, augmentation de l’efficacité synaptique) s’activent et permettent une amélioration fonctionnelle (Murphy et Corbett, 2009; Brown et coll., 2009). Cette plasticité spontanée génère une réorganisation neuronale dans l’ensemble du cerveau : l’activation des aires proximales à la lésion diminue suite à la mort neuronale et, selon la localisation et l’étendue de la lésion, l’activité peut être relocalisée vers les régions distales ipsilésionelles (plus antérieures ou postérieures) et/ou contralésionnelles (souvent observée dans les aires homologues aux aires lésées). Dans la période de trois à six mois post-AVC, ces mécanismes de plasticité spontanée diminuent progressivement et au stade chronique (après plus de six mois post-AVC), un déséquilibre interhémisphérique perdure de façon plus ou moins importante (selon la localisation et l’étendue de la lésion de même que le degré de plasticité spontanée, entre autres) : compte tenu de la perte de neurones transcallosaux de l’hémisphère lésé (HL), l’hémisphère non lésé (HNL), moins inhibé par l’HL, devient hyperactif et inhibe encore plus l’HL, qui devient hypoactif (Murase et coll., 2004; Duque et coll., 2007; Silasi et Murphy, 2014). Plusieurs études en neuroimagerie (imagerie par résonance magnétique fonctionnelle, IRMf; tomographie par émission de positrons, TEP; électroencéphalographie, EEG) ont pu effectivement observer chez des PAA une activation de l’hémisphère droit (HD) non lésé lors de tâches langagières, non observée chez les participants en santé (non lésés) (par ex., Weiller et coll., 1995; Cao et coll., 1999; Musso et coll., 1999; Leff et coll., 2002; Crinion et Price, 2005; Robson et coll., 2014). Ces adaptations cérébrales suscitent de nombreux questionnements en recherche quant à leur contribution lors de la récupération fonctionnelle : s’agit-il de plasticité cérébrale adaptée ou maladaptée? En d’autres mots, est-ce que ces changements périlésionnels puis surtout contralésionnels à long terme compensent pour les pertes neuronales et contribuent ou nuisent à la récupération fonctionnelle? Devrait-on encourager la réduction de cette activité contralésionnelle pour favoriser un retour vers un meilleur équilibre hémisphérique ou profiter de ces changements plastiques pour compenser les pertes de l’HL? Quels sont alors les liens entre changements plastiques et fonction? En aphasie post-AVC, ces questions sont majeures étant donné (1) la latéralisation du langage dans l’HG chez la majorité de la population et (2) les réseaux interhémisphériques connus pour leur implication dans la fonction du langage et donc la capacité (ou non) des aires ipsi- et contralésionnelles à contribuer à la rééducation des fonctions langagières.
Rééducation de l’aphasie post-AVC
Traitements orthophoniques
Les traitements orthophoniques existants peuvent non seulement être administrés au stade aigu pour surpasser les gains fonctionnels attribués à la seule plasticité cérébrale spontanée, mais également être administrés au stade chronique et être efficaces pour dépasser les gains déjà atteints (Brady et coll., 2016). Ces traitements sont cependant surtout offerts pendant les six premiers mois post-AVC et aujourd’hui, plus de 100 000 Canadiens présentent encore une aphasie au stade chronique post-AVC (Kapoor, 2017). Certaines études suggèrent cependant que la fonction (langage ou autres) peut toujours s’améliorer plusieurs années après l’AVC grâce aux mécanismes de plasticité cérébrale qui s’activent à plus long terme sous l’influence des thérapies (Krakauer et coll., 2006; Moss et coll., 2006; Holland et coll., 2017).
Comme mentionné plus tôt, l’identification des composantes altérées du langage post-AVC est importante pour bien orienter la rééducation fonctionnelle. Par exemple, le traitement orthophonique de l’anomie est établi en fonction du déficit sous-jacent, donc il doit être personnalisé. Dans le cas d’une anomie de nature sémantique, les traitements sémantiques visent le réapprentissage ou la réactivation des connaissances sémantiques liés aux concepts cibles (par exemple, si le mot-cible est « luciole », l’indice sémantique donné pourrait être « insecte qui émet de la lumière »), alors que dans le cas d’une anomie lexicale, les traitements phonologiques (TP) visant la restauration de l’accès au lexique phonologique de sortie des items spécifiques déficitaires est priorisé (par exemple, si le mot-cible est parapluie, l’indice donné serait la première syllabe /pa/) (Howard et coll., 1985; Monetta et coll., en révision). Certains traitements ne visent pas seulement l’amélioration et le maintien des items traités, mais visent également le transfert de l’amélioration à des items différents ou des contextes différents. Les améliorations de la fonction dans chaque cas dénotent une influence du traitement sur les mécanismes de plasticité cérébrale qui permettent la réactivation, voire le rebranchement et la modulation de l’activité synaptique, des réseaux neuronaux impliqués dans les activités langagières visées par le traitement.
Stimulation cérébrale non invasive (NIBS)
La stimulation cérébrale non invasive (NIBS, de l’anglais « noninvasive brain stimulation »), dont la stimulation magnétique transcrânienne (TMS, de l’anglais « transcranial magnetic
cette plasticité cérébrale, naturelle ou induite par différentes interventions, et d’influence de la plasticité cérébrale.
Étudier la plasticité cérébrale par TMS
La TMS est utilisée en recherche comme mesure du fonctionnement moteur cérébral et de la plasticité motrice cérébrale, c’est-à-dire comprendre les adaptations motrices et sensorimotrices corticales par exemple après une lésion ou pendant l’amélioration des fonctions. Cela permet de comprendre comment influencer les mécanismes cérébraux de plasticité et d’optimiser la récupération fonctionnelle qui leur est liée. La TMS est une puissante induction électromagnétique, de portée focale et de durée transitoire, ayant la capacité de traverser le cuir chevelu et le crâne pour directement dépolariser les cellules corticales sous-jacentes (Kobayashi et Pascual-Leone, 2003). Le fonctionnement moteur cérébral et la plasticité motrice cérébrale sont testés par TMS simple et double du M1 (Lefaucheur, 2005). La TMS simple active la voie corticospinale et induit un potentiel moteur évoqué (MEP, de l’anglais « motor evoked potential ») dans le muscle dont la représentation motrice corticale est stimulée. Les différents marqueurs de fonctionnement et de plasticité étudiés sont entre autres l’excitabilité de base du M1 (seuil moteur), la grandeur et le sens du déséquilibre hémisphérique (différence de seuil moteur entre HL et HNL) et l’excitabilité de la voie corticospinale (amplitude et latence des MEP, renseignant sur l’intégrité du système moteur descendant et la synchronisation des cellules). Les TMS doubles permettent de mesurer le niveau d’activité des circuits inhibiteurs GABAergiques du M1 qui modulent l’excitabilité des cellules corticospinales et des réseaux intracorticaux et donc qui sont impliqués dans la planification motrice et cognitive (Lefaucheur, 2005). L’ensemble de ces mesures sera abordé plus loin dans ce présent mémoire.
Influencer la plasticité cérébrale par TMS
La TMS, lorsqu’administrée de façon répétitive (rTMS, de l’anglais « repetitive transcranial
magnetic stimulation »), présente un intérêt thérapeutique en aphasie, car elles influencent la plasticité
cérébrale et par le fait même le déséquilibre interhémisphérique observé au stade chronique post-AVC: à basse fréquence (£ 1 Hz), elles diminuent l’excitabilité de la zone stimulée (inhibition) (Chen et coll., 1997) et à haute fréquence (³ 5 Hz), elles l’augmentent (excitation/facilitation) (Berardelli et coll., 1998). Les rTMS à fréquence thêta (TBS, de l’anglais « theta burst stimulation ») correspondent à un paradigme particulier et plus efficace de rTMS car elles requièrent des intensités plus basses que
les rTMS classiques et une durée de stimulation moins longue pour des effets plus consistants et à plus long terme, c’est-à-dire de 40 à 60min de changements plastiques persistants après la fin des stimulations (Goldsworthy et coll., 2016). Les TBS continues (cTBS) inhibent la zone stimulée ce qui correspond à une inhibition de type dépression à long terme (LTD-like, de l’anglais « long-term
depression ») et les TBS intermittentes (iTBS) activent la zone stimulée ce qui correspond à une
activation de type potentialisation à long terme (LTP-like, de l’anglais « long-term potentialisation ») (Chung et coll., 2016), c’est-à-dire que les effets continuent même après l’arrêt des stimulations. Également, quand iTBS est suivi de rTMS de fréquence 10Hz (rTMS10Hz), appelé « priming » iTBS des rTMS10Hz, la plasticité cérébrale induite serait plus importante qu’avec iTBS ou rTMS seules (Lefaucheur et coll., 2012). Ce « priming » excitateur a son pendant inhibiteur : quand une première application de cTBS est suivie 10min plus tard d’une autre application de cTBS (« priming » cTBS de cTBS), l’effet serait plus inhibiteur qu’avec une seule application cTBS (Goldworthy et coll., 2012). Ces effets plus importants de « priming » sur l’excitabilité de M1 seraient liés aux mécanismes de métaplasticité synaptique, c’est-à-dire à l’influence d’une activité neuronale antérieure (« priming ») sur la potentialisation ou la dépression des synapses (Abraham, 2008).
L’approche à adopter quant à l’utilisation de cette technique en récupération fonctionnelle post-AVC est questionnée, c’est-à-dire à savoir si le balancement interhémisphérique devrait être rétabli en phase chronique post-AVC ou bien si le déséquilibre observé devait être favorisé pour aider à la récupération des fonctions. En aphasie, cette question est d’autant plus importante, étant donné la controverse quant à la contribution ou non de l’HNL dans l’amélioration des fonctions. Certaines études ont inhibé l’HNL dans le but de permettre au tissu épargné dans l’HL de retrouver ses fonctions (par ex., Karbe et coll., 1998, Rosen et coll., 2000; Naeser et coll., 2005a,b; Hamilton et coll., 2010; Barwood et coll., 2011), alors que d’autres études ont excité l’HNL dans le but de favoriser une réorganisation cérébrale vers l’HNL des fonctions que l’HL ne peut plus assurer (Basso et coll., 1989; Weiller et coll., 1995; Thiel et coll., 2006; Basso et Macis, 2011; Flöel et coll., 2011; Mohr et coll., 2014; Chieffo et coll., 2014;). Or, les données de la littérature sont très variables et il n’est pas bien compris comment un protocole (inhiber l’HNL) vs l’autre (activer l’HNL) peut être choisi en fonction des caractéristiques individuelles des PAA. Un modèle plus récent en réadaptation motrice propose que l’HNL devrait être activé seulement si l’intégrité fonctionnelle et corticospinale de l’HL, appelé réserve structurale (RS), est perdue et donc sa RS est insuffisante pour assurer la fonction; l’HNL devrait être inhibé si l’HL a conservé sa fonction corticospinale et donc sa RS serait suffisante pour bénéficier de la réadaptation et assurer une récupération fonctionnelle (Di Pino et coll., 2014; Byblow et coll., 2015). Cette approche préconise l’individualisation de l’application des protocoles rTMS de l’HNL en fonction de la RS de l’HL.
En ce qui concerne les régions d’intérêt à stimuler chez les PAA, la plupart des études en récupération du langage se sont concentrées sur la modulation d’aires « classiques » frontale et temporale du langage dans l’HL (conventionnellement appelées Broca, correspondant aux aires 44 et 45 de Brodmann, et Wernicke, correspondant à la partie supérieure de l’aire 22 de Brodmann) ou leur homologue respectif dans l’HNL pour améliorer les déficits spécifiques liés à ces régions (par exemple, la production par stimulation de la zone de Broca, la compréhension par stimulation de la zone de Wernicke) (par ex., Naeser et coll., 2005a,b; Baker et coll., 2010; Barwood et coll., 2011a), mais les résultats restent controversés quant à l’efficacité de cette méthode. De plus, certaines études ont démontré que la fonction du langage peut impliquer des régions cérébrales éloignées des aires « classiques » (Lichtheim, 1885; Price, 2010; Weiller et coll., 2011; Crosson, 2013; Hebb et Ojemann, 2013; Marien et coll., 2014; Tremblay et Dick, 2016), incluant les aires motrices (cortex moteur primaire, M1) (Hauk et coll., 2004; Pulvermüller, 2005; Willems et Hagoort, 2007; Pulvermüller et Fadiga, 2010). Ainsi, la stimulation des aires motrices (telles que le M1) pourrait être une avenue intéressante à explorer en aphasie, quand les aires « classiques » frontale et temporale du langage sont détruites par l’AVC. Voilà pourquoi il est questionné si stimuler M1 chez un PAA pourrait aider à la récupération fonctionnelle et si cette zone de stimulation pourrait induire une amélioration fonctionnelle non-spécifique en activant l’ensemble du réseau.
Objectifs du projet de maîtrise
L’objectif principal du projet était de vérifier chez des PAA au stade chronique post-AVC (> 6 mois après la lésion) si l’adaptation individualisée des protocoles de rTMS de l’HNL (excitation vs inhibition, en fonction de l’intégrité fonctionnelle du M1-HL) aura un impact significatif et persistant sur la plasticité cérébrale et l’amélioration du langage. Pour ce faire, trois objectifs spécifiques découlent de l’objectif principal :
- Vérifier s’il existe des différences de fonctionnement cérébral (tel que testé par TMS du M1) entre participants (avec et sans aphasie) avec RS de l’HL et participants sans RS et tous comparés à des participants en santé (étude 1, partie 1) et vérifier si ces différences de fonctionnement cérébral déterminent la réponse plastique aux rTMS du M1-HNL (si les différents protocoles de rTMS, soit excitation, inhibition et placebo, induisent des effets neurophysiologiques aigus différents selon la présence ou l’absence d’une RS-HL des participants) (étude 1, partie 2);
- Vérifier si l’individualisation du protocole de rTMS du M1-HNL en fonction de la présence ou de l’absence d’une RS-HL administré sur plusieurs jours consécutifs permet d’améliorer la fonction du langage des PAA au stade chronique post-AVC, associé à des changements plastiques (étude 2);
- Vérifier si l’ajout d’un protocole individualisé de rTMS du M1-HNL à un TP potentialisera l’efficacité, le maintien des gains et la généralisation des effets du TP dans un cas d’anomie lexicale chronique post-AVC (étude 3).
Hypothèses de travail
Il était attendu que l’intervention de rTMS personnalisée sur M1 de l’HNL aurait un impact significatif sur la plasticité cérébrale et le langage des PAA au stade chronique post-AVC. Plus spécifiquement,
- L’HL des participants (avec et sans aphasie) avec RS du M1-HL serait hypoactivé par rapport à leur HNL, qui serait hyperactivé par rapport à l’hémisphère dominant (HDo) des participants contrôles. L’HNL des participants sans RS serait hyperactivé par rapport à l’HNL des participants avec RS et à l’HDo des participants contrôles. Ces différences entre les groupes dépendraient des mécanismes d’inhibition interhémisphérique.
- Les participants (avec et sans aphasie) sans RS montreraient de plus grands changements neurophysiologiques suite à une séance de rTMS-excitatrice (pour compenser la perte d’intégrité fonctionnelle du M1-HL) alors que les participants ayant une bonne RS montreraient de plus grands changements neurophysiologiques suite à une séance rTMS-inhibitrice (diminution du déséquilibre et donc réactivation du tissu épargné du M1-HL disponible pour la récupération fonctionnelle).
- L’administration d’une intervention individualisée de rTMS permettrait d’améliorer la fonction du langage des PAA au stade chronique post-AVC et cette amélioration serait corrélée à des changements plastiques de fonctionnement cérébral.
- L’ajout d’un protocole de rTMS à un TP augmenterait l’efficacité et le maintien des gains en comparaison au TP seul dans un cas d’anomie lexicale chronique post-AVC et ces effets seraient expliqués par une influence sur les mécanismes de plasticité cérébrale.
Approche expérimentale
Pour pouvoir répondre aux trois objectifs spécifiques, le projet se divisait en trois études. Chaque étude a permis la rédaction d’un article.
Étude 1 : fonctionnement cérébral et plasticité entre participants avec et sans RS du M1-HL
Dans la première partie de l’étude 1, les participants ayant subi un AVC (avec et sans aphasie) il y a plus de 6 mois (en phase chronique) et les participants contrôles étaient testés une seule fois (étude descriptive comparative contrôlée). Dans la deuxième partie de l’étude 1, un sous-groupe de participants avec AVC était testé dans trois protocoles de rTMS du M1-HNL (placebo, excitateur, inhibiteur), chaque séance étant séparée d’au moins une semaine. La séance placebo permettait de tester / contrôler les effets aspécifiques en lien avec la participation à l’étude (motivation des participants, nouvelle intervention prometteuse, etc.). Le devis expérimental était en double aveugle (ni les participants ni les expérimentateurs ne connaissaient le protocole administré et ce jusqu’à achèvement de l’analyse des données) et pseudo-randomisé pour l’ordre des séances entre les participants. Les mesures neurophysiologiques par TMS du M1 étaient effectuées avant et après chaque protocole (pré/post-intervention).
Étude 2 : individualisation des protocoles de rTMS selon la présence/absence d’une RS du M1-HL
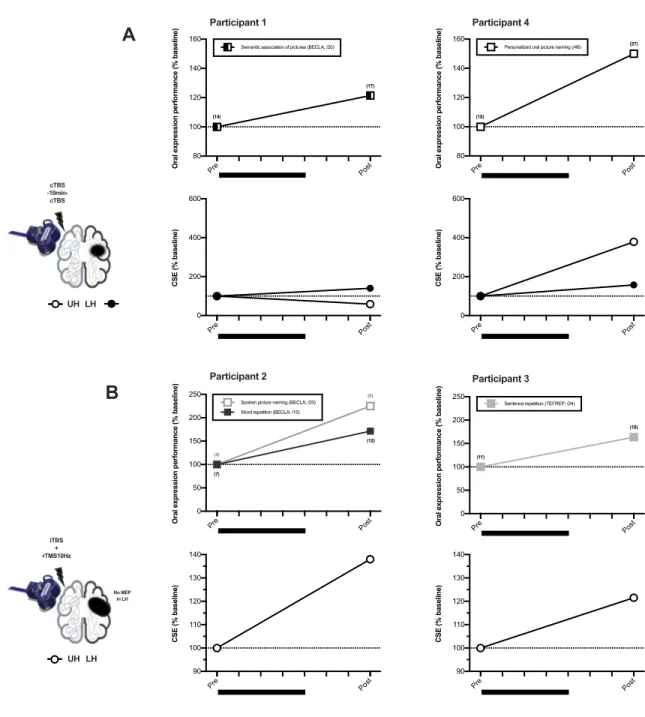
Parmi les participants de l’étude 1, quatre PAA recevaient cinq séances (cinq jours consécutifs, une fois par jour) du protocole de rTMS choisi en fonction de la présence ou de l’absence d’une RS du M1-HL (inhibition du M1-HNL si RS présente; activation du M1-HNL si RS absente). Les mesures neurophysiologiques par TMS du M1 et fonctionnelles (langage) étaient effectuées avant le début des cinq séances de stimulation (lundi 1) et trois jours après la dernière séance de stimulation (lundi 2, après la fin de semaine). La mesure post-intervention n’était pas effectuée immédiatement après la dernière séance de stimulation pour éviter de mesurer uniquement les effets aigus de la dernière séance. L’étude 2 correspondait donc à une étude de cas multiples.
Étude 3: étude de cas en anomie lexicale avec rTMS combinée à un TP
Cette étude de cas était contrôlée par placebo. Parmi les PAA de l’étude 2, une participante présentant une anomie d’origine lexicale recevait une combinaison de rTMS placebo et d’un TP (sur 10 jours, cinq jours par semaine), suivi un mois plus tard d’une combinaison du protocole
individualisé de rTMS (activation du M1-HNL car absence de RS du M1-HL) et d’un TP (sur 10 jours, cinq jours par semaine). Le TP était personnalisé en fonction des déficits (anomie lexicale). Les mesures neurophysiologiques par TMS du M1-HNL (pas de réponse du M1-HL) et fonctionnelles (dénomination orale d’images) étaient effectuées avant le début de chaque traitement (lundi 1), après une semaine de traitement (lundi 2), à la fin du traitement (à deux semaines, lundi 3) et une semaine après le dernier jour de traitement (suivi à une semaine, vendredi 3), puis seules les mesures fonctionnelles étaient répétées un mois après le dernier jour de stimulation (suivi à un mois). La mesure post-intervention n’était pas effectuée immédiatement après la dernière séance de stimulation pour éviter de mesurer uniquement les effets aigus de la dernière séance.
Participants
Quarante et un participants ayant subi un AVC il y a plus de 6 mois (en phase chronique, séquelles stables) avec et sans aphasie ainsi que quatorze participants contrôles sans lésion neurologique (appariés pour l’âge et le sexe) étaient inclus à la première partie de l’étude 1 du projet (article 1). Ces sujets contrôles fournissaient des valeurs neurophysiologiques comparatives. De ces quarante et un participants avec AVC, onze participants avec et sans aphasie participaient à la deuxième partie de l’étude 1 du projet. De ceux-ci, quatre participants présentant une aphasie participaient à l’étude 2 (article 2). De ceux-ci, une participante présentant une anomie d’origine lexicale en stade chronique post-AVC continuait à la troisième étude du projet (article 3).
Recrutement
Le recrutement des participants s’est fait de plusieurs façons :
- Par la liste de diffusion de l’Université Laval : deux appels à participation au projet (un pour les participants avec AVC, un pour les participants en santé) étaient distribués à la communauté de l'Université Laval.
- Par une présentation du projet à l’APIA-AVC (Association des Personnes Intéressées par
l’Aphasie et l’Accident vasculaire cérébral).
- Par une liste de participants ayant participé à de précédents projets et ayant accepté d’être recontactés si d’autres projets pouvaient les intéresser.
Les personnes intéressées à prendre part au projet ont contacté l’équipe de recherche. À ce moment, leur profil clinique et leur admissibilité au projet (voir section Critères de sélection et Annexe) ont été vérifiés une première fois par téléphone. Si la personne correspondait aux critères d’inclusion du projet et qu’aucun critère d’exclusion n’était rencontré, le projet lui était expliqué en détail. Si la personne montrait un intérêt pour participer au projet, le feuillet d’information et le formulaire de consentement (FIFC, voir Annexe) lui étaient envoyés et devaient être lus. Un deuxième contact téléphonique permettait à l’équipe de recherche de compléter les explications et de répondre à toutes les questions de la personne sur le projet de recherche pour une compréhension optimale et une décision éclairée. Si la personne acceptait de participer au projet de recherche et acceptait que son dossier médical soit consulté par l’équipe de recherche, elle devait préalablement prendre rendez-vous avec son médecin traitant ou médecin de famille pour que ce dernier contre-vérifie les critères d’inclusion et d’exclusion du projet de recherche en ayant en main le FIFC et son annexe à signer. Dans le cas où le médecin confirmait l’admissibilité (critères d’inclusion et d’exclusion respectés) et signait l’annexe du FIFC (officialisation médico-légale de l’admissibilité au projet), la personne rencontrait l’équipe de recherche au laboratoire de recherche du CHUL. Lors de cette rencontre, l’équipe de recherche s’assurait de nouveau que toutes les informations contenues dans le FIFC étaient comprises et répondaient à toutes les questions posées. Les critères d’inclusion et d’exclusion étaient revérifiés auprès de la personne et le FIFC était signé par le participant et la personne responsable du projet de recherche.
Critères de sélection
Critères d’inclusion
- Être âgé de 18 et plus. - Être francophone.
- Pour les participants ayant subi un AVC seulement :
a) Avoir eu un premier AVC unilatéral cortical ou cortico-sous-cortical il y a plus de 6 mois (stade chronique, état stable).
b) Pour l’étude 1, présenter ou non une aphasie chronique (tous types inclus). c) Pour l’étude 2, présenter une aphasie chronique (tous types inclus).
e) Avoir passé une Imagerie par Résonance Magnétique (IRM) ou une tomodensitométrie à la suite de l’AVC (pour la description de la lésion).
f) Être apte à prendre une décision éclairée et être capable de comprendre et réaliser les tâches à l’étude.
Critères d’exclusion liés à la santé générale
- Au niveau cervical : dénervation facettaire, thermocoagulation, chirurgie vertébrale (autre que parascopie) ou rhizotomie.
- Pour les participants ayant subi un AVC : Toute autre condition médicale, y compris (mais sans s'y limiter), une maladie circulatoire, respiratoire ou cardiaque majeure, troubles visuels, auditifs graves les empêchant de bien effectuer les tâches à l'étude, tous autres troubles neurologiques (TDAH, commotion cérébrale / TCC, DMC, sténose / lésion spinale / maladie affectant la moelle épinière, sclérose en plaques / latérale amyotrophique, tremblements atypiques, maladie de Parkinson ou d’Alzheimer).
- Pour les sujets contrôles : tout trouble médical et/ou neurologique (incluant AVC et ceux déjà mentionnés dans le point précédent).
- Changement de médication dans le mois précédant la participation à l’étude.
- Traitements de réadaptation en cours, ou ayant eu lieu dans le mois précédant l’étude.
Critères d’exclusion liés aux TMS
- Antécédent (ATCD) ou présence de tumeur cérébrale; - ATCD ou présence d’infection cérébrale;
- Chirurgie intracrânienne, clips intracrâniens (par ex., : clips d’anévrisme); - Présence d’implant à la tête incluant un implant cochléaire;
- Plaque métallique au crâne ou à la mâchoire;
- Système de dérivation du liquide céphalo-rachidien tel que rencontré dans l’hydrocéphalie à pression normale;
- Stimulateur implanté (intracérébral, épidural, subdural); - Grossesse;
- Syncopes récurrentes;
- Toute forme d’épilepsie non contrôlée par médication;
- Un ou plusieurs épisodes de convulsion dans les 12 derniers mois;
- Tout médicament qui abaisse considérablement le seuil de convulsion (ex : antidépresseurs) – le médecin qui signe l’annexe du FIFC doit donner une liste des médicaments en cours.
Résumé du devis expérimental
La première partie de l’étude 1 correspondait à une étude descriptive comparative contrôlée. La deuxième partie de l’étude 1 correspondait à une étude pseudorandomisée, testant trois interventions de rTMS (placebo, inhibiteur, excitateur) sur trois séances avec des analyses pré/post de chaque intervention et en double-aveugle (participants et expérimentateurs à l’aveugle jusqu’à la fin des analyses). L’étude 2 correspondait à une étude de cas multiples. L’étude 3 correspondait à une étude de cas, contrôlée par placebo.
Mesures fonctionnelles et neurophysiologiques
Cette section détaille les mesures utilisées dans le projet de recherche. Instruments de mesure et mesures sont également détaillés dans la section Methods des différents articles.
Mesures fonctionnelles
Étude 1 : fonctionnement cérébral et plasticité entre participants avec et sans RS du M1-HL
L’étude 1 se concentrait sur les différences de fonctionnement cérébral et de plasticité cérébrale entre participants (avec et sans aphasie) avec et sans RS du M1-HL et ne comprenait donc pas de mesures fonctionnelles.
Étude 2 : individualisation des protocoles de rTMS selon la présence/absence d’une RS du M1-HL
Les mesures fonctionnelles de l’étude 2 correspondaient à des mesures du langage pour (1) caractériser a priori les déficits fonctionnels de chaque PAA individuellement (mesures détaillées dans les sections suivantes) et (2) tester le changement de leur performance en post-intervention (seules les tâches dénotant des déficits pour chaque PAA sont retestées pour mesurer l’efficacité de l’intervention individualisée).
La sélection de tests pour chaque PAA dépendait des composantes spécifiques atteintes du langage (par ex., sémantique, lexique). Ainsi, différentes mesures ont été effectuées en fonction des déficits des PAA, comme suit.
Évaluation du traitement sémantique
Le traitement sémantique, c’est-à-dire l’activation des concepts, de la signification d’une image présentée ou d’un mot entendu, était évalué de façon spécifique par les sous-tests (tâches 5 et 6) de la « Batterie d’Évaluation Cognitive du Langage » (BECLA) (Macoir et coll., 2016). Dans la tâche 5 – appariement sémantique d’images, trois images étaient présentées au participant (une en haut de l’écran = stimulus; deux en bas = une cible et un distracteur) et le participant devait identifier quelle image du bas était la plus sémantiquement associée (caractéristiques encyclopédiques ou fonctionnelles/associatives) à l’image stimulus (sans contrainte de temps). Ce test inclut six images de pratique (deux stimuli) et 60 images tests (20 stimuli) et prend en compte la catégorie sémantique dans l’évaluation (10 images de catégorie « vivant » et 10 de catégorie « non vivant »). Dans la tâche 6 – appariement mot entendu à l’image, quatre images étaient présentées à l’écran (distracteurs sémantique, visuosémantique, visuel et neutre) et le participant devait identifier quelle image était la plus sémantiquement associée au mot dit par l’évaluateur. Ce test comprend 10 items de pratique (deux mots oraux) et 100 items tests (20 mots oraux) et prend également en compte la catégorie sémantique (10 mots de catégorie « vivant » et 10 de catégorie « non vivant ») et la nature des distracteurs (20 chacun). Les différents stimuli visuels de ces tâches proviennent de différentes banques d’images (Snodgrass et Vanderwart, 1980; Alario et Ferrand, 1999; Bonin et coll., 2003).
Évaluation du langage
La dénomination orale d’images de noms et de verbes était évaluée par le sous-test (tâche 8) de la BECLA (Macoir et coll., 2016), par le « Test de Dénomination de Québec – 30 images » (TDQ30) (Macoir et coll., 2019) et par le sous-test (tâche 1) de la « Batterie d’Évaluation de la
Production Syntaxique » (BEPS) (Monetta et coll., 2018; Coulombe et coll., 2019). Pour chacune de ces tâches, une image à la fois était présentée à l’écran au participant, qui devait nommer l’objet ou l’action associé(e) (sans contrainte de temps).
La BECLA (tâche 8) comprenait 24 images (quatre items de pratique et 20 items test dont 10 objets sélectionnés de la banque d’images de Snodgrass et Vanderwart (1980) et 10 actions sélectionnées de la banque d’images de Druks et Masterson (2000)), et tenait compte de la fréquence lexicale (10 élevée, 10 basse), de la catégorie sémantique des noms (cinq « vivant », cinq « non vivant ») et de la structure argumentale des verbes (un à aucun argument; quatre à un argument; cinq à deux arguments).
Le TDQ30 comprenait 31 images d’objets (un item de pratique et 30 items tests) sélectionnées de la banque de stimuli standardisés (BOSS de l’anglais « Bank Of Standardized Stimuli ») établie par Brodeur et coll. (2010, 2014). Ce test tenait compte de la catégorie sémantique (15 « vivant », 15 « non vivant »), de la familiarité lexicale et des concepts, de la fréquence lexicale, de l’âge d’acquisition, de la longueur phonémique et de la complexité visuelle.
La BEPS (tâche 1) comprenait 21 images d’action (trois items de pratique et 18 items tests) à fréquence lexicale élevée. Pour cette tâche, l’image représentant une action et une question écrite, lue par l’évaluateur, étaient présentées simultanément au participant qui devait nommer l’action associée à la question.
En plus de ces différentes tâches normées, la BOSS (version standardisée de Brodeur et coll., 2014) était utilisée dans un cas (une participante) pour la création d’une liste d’images à nommer (tâche non standardisée).
Évaluation de la répétition des mots et des phrases
La répétition de mots était évaluée par le sous-test (tâche 11) de la BECLA (Macoir et coll., 2016). La tâche 11 de la BECLA comprenait 17 items (deux items de pratique et 15 items de test) prenant en compte la fréquence lexicale (huit à haute fréquence), le degré d'imagerie (sept de degré élevé), la longueur des mots (une, deux ou trois syllabes, cinq éléments chacun) et la structure phonologique (sept simples et huit complexes). L'évaluateur prononçait le mot et le sujet devait le répéter immédiatement.
La répétition de phrases était évaluée par le Test Français de Répétition de Phrases (TEFREP) (Bourgeois-Marcotte et coll., 2015). Cette tâche comprenait 26 items (deux items de pratique et 24 items de test) prenant en compte la longueur des phrases (12 phrases courtes de sept à huit syllabes
et 12 phrases longues de 13 à 14 syllabes), la voix (huit phrases actives et huit phrases passives), la réversibilité sémantique (12 phrases réversibles et 12 phrases irréversibles) et les phrases comparatives (n=8). L'évaluateur disait la phrase et le sujet devait la répéter immédiatement.
Étude 3: étude de cas en anomie lexicale avec rTMS combinées à un TP
Les mesures fonctionnelles de l’étude 3 correspondaient à des mesures de dénomination orale d’images. Deux listes étaient créées pour chaque intervention (rTMS placebo du M1-HNL + TP; rTMS vraies du M1-HNL + TP). Une première liste d’items pratiqués était utilisée par intervention (Liste A pour placebo / Liste A’ pour vraies rTMS) pour évaluer l’efficacité des traitements et le maintien des améliorations. Une seconde liste d’items non pratiqués servait par intervention (Liste B pour placebo / Liste B’ pour vraies rTMS) pour l’évaluation de la généralisation des améliorations. La création des quatre listes se faisait comme suit : une liste de 150 images provenant de la BOSS (normes de la version de Brodeur et coll., 2014) était présentée trois fois à la participante avant le début des expérimentations (une fois par semaine, trois lignes de base) afin de déterminer les images dont la dénomination orale d’images était systématiquement échouée aux trois lignes de base (20 par liste créée, 80 au total). Quatre images, dont la dénomination orale d’images était réussie aux trois lignes de base, étaient ajoutées à chaque liste dans le but d’assurer la motivation de la participante (Leonard et coll., 2008). Les quatre listes créées étaient équivalentes sur le plan de la fréquence lexicale, c’est-à-dire par rapport à l’estimation du nombre d’occurrences des mots (http://www.lexique.org/shiny/lexique/, freqlemfilms2). À chaque temps de mesure, les items des listes pratiquée et non pratiquée (Listes A et B pour placebo / Listes A’ et B’ pour vrais rTMS) étaient mélangés de façon aléatoire et présentés à l’écran au participant, qui devait nommer l’objet ou l’action associé(e) (sans contrainte de temps).
Mesures neurophysiologiques par TMS
Les stimulations magnétiques transcrâniennes (simples et doubles TMS) permettent de tester l’excitabilité du M1 impliquée dans le contrôle des muscles et l’intégrité de la voie corticospinale innervant le muscle étudié: les TMS activent la voie corticospinale et induisent un potentiel moteur évoqué (MEP de l’anglais « motor evoked potential ») dans le muscle dont la représentation motrice corticale est stimulée (somatotopie motrice corticale). Ici, le muscle choisi était le premier interosseux dorsal (FDI, de l’anglais « first dorsal interosseous »). L’étude des MEP aux simples TMS du M1 permet de tester les marqueurs de plasticité cérébrale suivants : RS restante dans le M1-HL
(déterminée dans ce présent projet par l’existence ou l’absence de MEP du FDI de l’HL), excitabilité de base du M1 (seuil moteur, MT), différence de seuil entre les deux hémisphères (déséquilibre interhémisphérique), excitabilité corticospinale (amplitude et latence des MEP renseignant sur le tissu répondant dans le M1, la synchronisation des cellules du M1 et la synchronicité des volées descendantes sur les motoneurones alpha). Les TMS doubles permettent de mesurer l’amplitude des MEP conditionnés qui, exprimée en fonction de l’amplitude des MEP tests (avec simple TMS) informent sur le niveau d’inhibition GABAergique dans le M1 (mécanisme primordial de planification motrice) (Lefaucheur, 2005). Les mesures TMS permettaient donc (1) de tester le fonctionnement moteur cérébral du M1-HL et M1-HNL; (2) de détecter la plasticité cérébrale induite par rTMS du M1-HNL et (3) de vérifier si ces changements plastiques du M1 pouvaient être corrélés avec les mesures fonctionnelles (Beaulieu et coll., 2015, 2017b). Les TMS sont non invasives, indolores et les marqueurs choisis présentent une très bonne fidélité interséance et une très bonne sensibilité aux changements chez les personnes en santé (Beaulieu et coll., 2017a) et les personnes avec AVC chronique (Koski et coll., 2007; Liu et Au-Yeung, 2014; Schambra et coll., 2015; Beaulieu et coll., 2017b).
Stimulateur TMS utilisé pour les mesures de fonctionnement cérébral et plasticité cérébrale
Le stimulateur MagStim2002 à impulsions monophasiques simples et doubles (MagStimCompany, UK) était utilisé tout au long du projet. Plus précisément, deux stimulateurs électromagnétiques couplés entre eux activaient une bobine en forme de 8 (70-mm de diamètre externe) utilisée pour les mesures neurophysiologiques par TMS, permettant une estimation plus focale de l’excitabilité du M1 qu’une bobine circulaire standard (Cohen et coll., 1990). Pour l’ensemble des mesures, la bobine était positionnée dans un angle de 45° avec la ligne médiane pour induire un courant électrique à l’intérieur du FDI de M1, dans le sens antéromédian (Sakai et coll., 1997).
Détermination de la représentation M1 du FDI (ou « hotspot »)
Pour les mesures TMS, les participants étaient installés confortablement sur une chaise inclinable et réglable avec des appuis pour les jambes et les bras. La bobine était placée sur la région corticale du M1 contrôlant le muscle du FDI et le « hotspot » représentait le site de stimulation engendrant dans le FDI de la main contralatérale les MEP de plus grandes amplitudes pour la plus faible intensité de stimulation. Ces MEP étaient enregistrés par électromyographie (EMG) de surface via des électrodes Ag/AgCl (1 cm de diamètre), positionnées sur le corps du FDI. L'électrode de référence était sur le processus styloïde de l'ulna. Les signaux EMG étaient filtrés par bande passante
(10-450 Hz), amplifiés (x1500) avant leur numérisation (2 kHz) et leur stockage pour analyses post-hoc (système d'acquisition PowerLab). Une fois le « hotspot » localisé, les coordonnées du point étaient enregistrées grâce au système de neuronavigation en temps réel (Brainsight, Rogue Industries, Montréal). Le positionnement de la bobine (localisation, inclinaison) était ajusté à chaque fois par rapport à ces coordonnées enregistrées, ce qui assurait une consistance pour chaque participant tout au long des séances et donc un risque infime dans les erreurs de positionnement.
Mesure du seuil moteur au repos (RMT de l’anglais « resting motor threshold »)
Le seuil moteur au repos (RMT, de l’anglais « resting motor threshold ») était défini comme l’intensité minimale de stimulation provoquant cinq réponses d’une amplitude pic à pic minimale de 50 μV dans le muscle FDI contralatéral au repos sur un total de 10 essais consécutifs (Groppa et coll., 2012; Rossini et coll., 2015). Ainsi, le RMT était défini comme l'intensité minimale de stimulation pouvant dépolariser les cellules corticospinales du M1 contrôlant le FDI (excitabilité motrice corticale de base). Cette mesure permettait également de déterminer la différence d’excitabilité entre les deux hémisphères (information sur le déséquilibre interhémisphérique).
Mesures de l’amplitude et de latence des MEP tests
Les MEP dits « tests » étaient évoqués à une intensité TMS de 120% RMT. La latence, c’est-à-dire le temps de conduction corticomotrice entre l’artefact de stimulation et le début de la réponse dans le muscle (Kobayashi et Pascual-Leone, 2003), et l’amplitude pic à pic étaient mesurées pour chaque MEP et moyennées pour l’ensemble des MEP tests enregistrés (n»18).
Mesure SICI (de l’anglais « short-interval intracortical inhibition »)
Les doubles TMS permettaient d’induire deux stimulations du M1 à quelques millisecondes de différence sur le même point cortical : une première TMS dite « conditionnante » à 80% RMT était suivie 3 ms plus tard par une TMS dite « test » à 120% RMT. La TMS à 80% RMT n’induisait aucun MEP dans le muscle, mais activait les circuits inhibiteurs GABAergique de type récepteur A du M1. Ainsi, le MEP évoqué suite à la TMS test (après TMS conditionnante), appelé MEP conditionné, avait normalement une amplitude plus petite que celle du MEP test évoqué par TMS test seule. L’amplitude du MEP conditionné exprimée en % du MEP test permettait de tester les mécanismes d'inhibition intracorticale à court terme (SICI, de l’anglais « short-interval intracortical
inhibition ») (Lefaucheur, 2005). Le SICI était donc évaluée par le % du rapport amplitudeMEP conditionnés