HAL Id: dumas-01887329
https://dumas.ccsd.cnrs.fr/dumas-01887329
Submitted on 4 Oct 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Intérêts et limites d’une conciliation des traitements
médicamenteux de sortie au sein d’un groupement
hospitalier de territoire
Claire Duval
To cite this version:
Claire Duval. Intérêts et limites d’une conciliation des traitements médicamenteux de sortie au sein d’un groupement hospitalier de territoire. Sciences pharmaceutiques. 2017. �dumas-01887329�
0
UNIVERSITE DE CAEN
U.F.R. DES SCIENCES
ANNEE 2016-2017
PHARMACEUTIQUES
MEMOIRE
du DIPLOME D’ETUDES SPECIALISEES
de PHARMACIE HOSPITALIERE
soutenu devant le Jury Interrégional
le 12 octobre 2017
par Claire Duval
conformément aux dispositions de l’arrêté
du 4 octobre 1988 tient lieu de
THESE POUR LE DIPLOME D’ETAT
DE DOCTEUR EN PHARMACIE
INTERETS ET LIMITES D’UNE CONCILIATION DES TRAITEMENTS MEDICAMENTEUX DE SORTIE AU SEIN D’UN GROUPEMENT HOSPITALIER DE TERRITOIRE
JURY
Président Pr Michel Boulouard
Membres Dr Guillaume Saint-Lorant
Dr Anne-Claire Buire
Pr Thierry Dine
1
ENSEIGNANTS PAR DEPARTEMENT D'ENSEIGNEMENT
Département de Biochimie et Toxicologie Pr François Sichel
Dr Véronique André, MCU - HDR Dr Christophe Denoyelle, MCU Dr Sophie Krieger, MCU Dr Pierre Lebailly, MCU - HDR Dr Mathilde Lechevrel, MCU - HDR Dr Monique N'Diaye, MCU
Dr Marie Villedieu, MCU
Département de Biodiversité-Santé, Microbiologie, Biotechnologies Pr David Garon
Dr Anne Dhalluin, MCU
Dr Philippe Eldin De Pécoulas, MCU - HDR Pr Jean-Christophe Giard
Dr Monique N'Diaye, MCU Dr Jean-Philippe Rioult, MCU
Département de Biophysique et Modélisation Moléculaire Pr Ronan Bureau
Dr Alban Lepailleur, MCU Pr Jana de Oliveira Santos
Département de Chimie Minérale et Chimie Analytique Pr Raphaël Delépée
Dr Thomas Cailly, MCU - HDR Dr Catherine Laporte-Wojcik, MCU Dr Ivannah Pottier, MCU
Dr Virginie Prévost, MCU - HDR Dr Marc Since, MCU
2 Département de Chimie Organique, Chimie Thérapeutique et Chimie de
l'Environnement Pr Patrick Dallemagne Pr Frédéric Fabis
Dr Maria Pereira-Rosenfeld, MCU Pr Christophe Rochais
Dr Anne-Sophie Voisin-Chiret, MCU-HDR
Département de Pharmacie Clinique et de Sémiopathologie Dr Guillaume Saint-Lorant, PAST
Département de Pharmacie Galénique Pr Aurélie Malzert-Fréon
Dr Anne-Claire Groo, MCU
Département de Pharmacognosie Pr Valérie Collot
Dr Jérôme Quintin, MCU
Département de Physiologie et de Pharmacologie Pr Michel Boulouard
Dr Valentine Bouet, MCU - HDR Pr François Dauphin
Pr Thomas Fréret Dr Eleni Paizanis, MCU Pr Pascale Schumann Bard
3 REMERCIEMENTS
A Monsieur le Docteur Guillaume Saint-Lorant, Directeur de Thèse pour avoir accepté de diriger ce travail,
pour l'aide et les encouragements qu'il m'a prodigués,
qu'il me soit permis de lui exprimer ma profonde gratitude.
A Monsieur le Professeur Michel Boulouard qui me fait l'honneur de présider ce jury de Thèse,
je le prie de bien vouloir accepter le témoignage de ma reconnaissance. A Madame le Docteur Anne-Claire Buire, Membre du Jury
pour avoir accepté de faire partie de ce jury,
pour ses conseils et ses encouragements tout au long de cette Thèse,
pour tout ce qu'elle m'a appris en pharmacie clinique et dans la sécurisation de la prise en charge médicamenteuse,
mes sincères remerciements.
A Monsieur le Professeur Thierry Dine, Membre du Jury pour avoir accepté de faire partie de ce jury,
pour sa gentillesse et sa pédagogie, mes sincères remerciements.
4 Je tiens également à remercier...
Madame le Docteur Noëlle Fievet, pour l'accueil dans son service, sa gentillesse et ses encouragements,
Madame le Docteur Amandine Calesse, pour m'avoir conseillée et formée dans le domaine de la conciliation médicamenteuse,
Ainsi que les Docteurs Isabelle Lelièvre, Barbara Phan et Dorothée Piednoir, pour leurs précieux conseils tout au long de cette année,
Les Docteurs Anne-Laure Richard et Bernard Thalamy pour leurs conseils et leur aide dans la réalisation de ce projet, ainsi que les cadres de santé et les soignants des services du CH d'Avranches-Granville pour leur implication dans le déploiement de la conciliation médicamenteuse,
Je souhaiterais remercier Murielle Gauthron, ainsi que les préparateurs de la Pharmacie du CH d'Avranches-Granville : j'ai beaucoup apprécié de travailler avec eux.
Et les Docteurs Fahss et Djilali Saiah pour leur participation, leurs conseils et leur bienveillance.
Et plus personnellement, je souhaite remercier...
Mes parents et ma sœur Rozenn, pour leur soutien tout au long de mes études, dans les bons moments comme dans les moins bons, ce sont mes plus grands supporters.
Madou, ma meilleure amie, ma Binôme pour toute la vie, la meilleure. We did it! Mes amies du Locquidy qui ont toujours été présentes pour moi,
Tous les internes en pharmacie et en médecine que j'ai eu le plaisir de côtoyer : Tsanta, pour ses encouragements, ses conseils et pour sa joie de vivre contagieuse, Julia et Mérédith, pour les très bons moments passés à l'hôpital, à la fac ou en dehors, Béatrice et Raphy, pour leur accueil à Avranches,
Véronique Lucas, pour sa grande patience dans la relecture de ma Thèse, Les Peakers pour leurs encouragements jusqu'au bout !
5 ABREVIATIONS
BMO Bilan Médicamenteux Optimisé CH Centre Hospitalier
CHAG Centre Hospitalier d'Avranches-Granville
CMA Conciliation Médicamenteuse à l'Admission ou conciliation d'entrée CME Commission Médicale d'Etablissement
DCI Dénomination Commune Internationale DNI Divergence Non Intentionnelle
EHPAD Etablissement d'Hébergement de Personnes Agées Dépendantes EI Evènement Indésirable
EM Erreur Médicamenteuse
GHT Groupement Hospitalier de Territoire HAS Haute Autorité de Santé
LAP Logiciel d'Aide à la Prescription MCO Médecine Chirurgie Obstétrique PMSP Projet Médical et Soignant Partagé PUI Pharmacie à Usage Intérieur SSR Soins de Suite et de Réadaptation USLD Unité de Soins de Longue Durée
6 SOMMAIRE
INTRODUCTION ... 8
I. SECURISATION DE LA PRISE EN CHARGE MEDICAMENTEUSE AU SEIN D'UN GHT ...10
I.1. Erreurs médicamenteuses ...10
I.1.1. Définition et fréquence des erreurs médicamenteuses ...10
I.1.2. Origines des erreurs médicamenteuses aux points de transition et particularités des transferts inter-hospitaliers ...16
I.2. La conciliation des traitements médicamenteux : un outil de sécurisation de la prise en charge médicamenteuse ...19
I.2.1. Définition de la conciliation des traitements médicamenteux ...19
I.2.2. Méthode de conciliation des traitements médicamenteux ...21
I.3. Les Groupements Hospitaliers de Territoire: des opportunités de sécurisation offertes par un nouveau mode de coopération ...25
I.3.1. Origine des GHT ...25
I.3.2. Objectifs et fonctionnement des GHT ...27
I.3.3. Prise en charge médicamenteuse dans les GHT ...30
I.3.4. Place de la pharmacie clinique dans les GHT ...32
II. MISE EN PLACE D'UNE CONCILIATION MEDICAMENTEUSE AUX TRANSFERTS DU CH D'AVRANCHES-GRANVILLE VERS LES SSR ...34
II.1. Contexte général ...34
II.2. Matériel et méthode ...35
II.2.1. Le Groupe Hospitalier Mont-Saint-Michel ...35
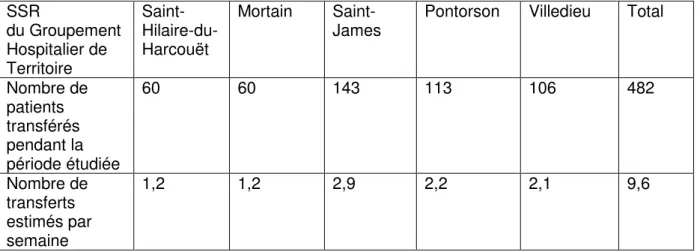
II.2.2. Population de l’étude ...39
II.2.3. Etat des lieux de la conciliation médicamenteuse dans les établissements concernés...42
II.2.4. Analyse des risques d’erreurs médicamenteuses associées au transfert en SSR ... 43
II.2.5. Méthode de conciliation ...45
7
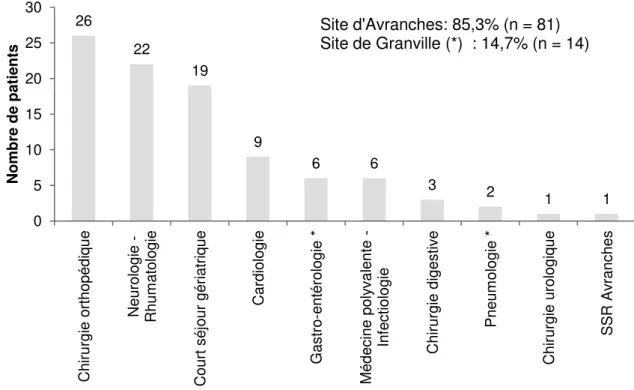
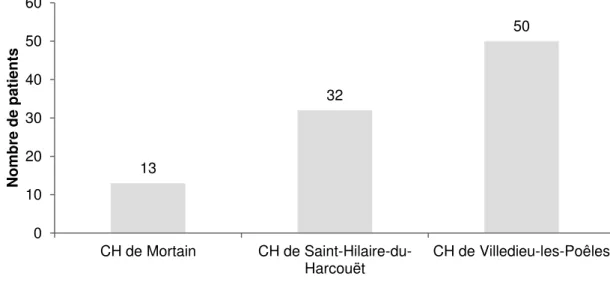
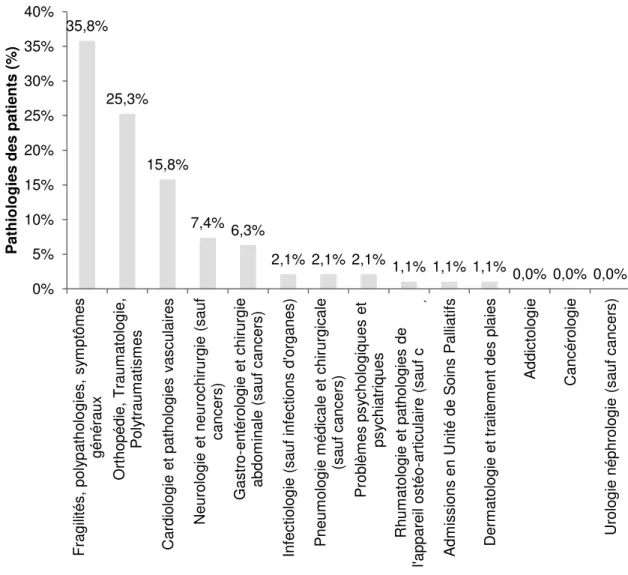
II.3.1. Caractéristiques des patients ...48
II.3.2. Analyse de risques a priori ...51
II.3.3. Analyse de risques a posteriori ...63
II.3.4. Résultats de la conciliation ...65
II.4. Discussion ...71
II.4.1. Limites dans l’étude de la population ciblée par la conciliation et comparaison avec la population conciliée ...71
II.4.2. Analyse de risques ...73
II.4.3. Intérêts et limites de la conciliation médicamenteuse entre établissements d’un GHT ... 79
II.5. Conclusion ...86
8
INTRODUCTION
L'actualité hospitalière est marquée par des changements importants dans l'organisation de la coopération entre les établissements publics de santé. La création des Groupements Hospitaliers de Territoire (GHT) a pour but, par l'organisation de l'offre de soins autour d'un projet médical partagé, d'améliorer la coordination et la cohérence de l'offre de soins hospitaliers d'un territoire (1). Cet objectif passe notamment par la mise en commun de fonctions telles que les achats, le système d'information et la direction de l’information médicale. La prise en charge des patients évolue d'une organisation locale à l'échelle d'un établissement vers la constitution de filières de soins à l'échelle territoriale (2), avec de multiples acteurs hospitaliers répartis sur l'ensemble du GHT. L'offre de soins se structure donc avec un parcours de soins coordonnés entre plusieurs hôpitaux du même GHT.
La prise en soins d’un patient à l’hôpital ou dans le cadre des GHT est émaillée de nombreuses étapes de transition qui représentent autant de risques de ruptures dans la prise en charge médicamenteuse. Ces transitions (admission, transfert, sortie d'hospitalisation, mais aussi pour certains auteurs, les changements de médecins ou d'équipes soignantes) (3) constituent des facteurs de risques d’erreurs médicamenteuses aux conséquences plus ou moins délétères, en particulier chez les populations telles que les personnes âgées (4), celles-ci étant en effet souvent polymédiquées (5). Elles sont également plus souvent hospitalisées que la population générale (6), ce qui les expose aux risques associés aux transitions. Elles sont enfin plus vulnérables aux erreurs médicamenteuses (7) en raison de modifications physiologiques liées à l'âge et de l'apparition de co-morbidités. Parmi les méthodes de lutte contre ces erreurs, la conciliation médicamenteuse est en plein développement, notamment en France (8). Elle a pour but de garantir l'exhaustivité et l'exactitude des informations sur les traitements médicamenteux aux points de transition (9).
L'objectif de cette thèse est d'étudier la sécurisation de la prise en charge médicamenteuse des patients aux étapes de transfert dans un contexte d’évolution des organisations inter-établissements.
Nous aborderons dans un premier temps la nature et les origines des erreurs médicamenteuses, particulièrement aux points de transition, puis seront développés les bénéfices de la conciliation et son fonctionnement.
Le contexte de mise en place de la conciliation médicamenteuse à l’hôpital sera mis en perspective avec la création des Groupements Hospitaliers de Territoire. En effet, la conciliation et l’amélioration de la prise en charge médicamenteuse aux transitions reposent
9 sur la coopération entre les professionnels de santé de ville et ceux des différents hôpitaux du parcours de soins du patient (lien ville-hôpital et lien inter-hospitalier). La modification des modes et moyens de coopération des hôpitaux aura donc un impact sur le déploiement et l’efficacité de cette activité.
Dans un second temps, sera présentée la démarche pilote de déploiement de la conciliation médicamenteuse pour les patients transférés du CH d'Avranches-Granville vers des établissements de Soins de Suite et de Réadaptation du "Groupe Hospitalier Mont-Saint-Michel". Cette étude sera précédée d'une analyse des risques associés à ces transferts.
10
I. SECURISATION DE LA PRISE EN CHARGE MEDICAMENTEUSE
AU SEIN D'UN GHT
I.1. Erreurs médicamenteuses
I.1.1. Définition et fréquence des erreurs médicamenteuses
I.1.1.1 Les évènements indésirables liés aux soins
Les erreurs médicamenteuses appartiennent aux évènements indésirables (EI) liés aux soins. Les EI constituent un sujet de préoccupation majeur dans l’amélioration de la prise en charge des patients hospitalisés. Ils sont définis comme « tout incident préjudiciable à un patient hospitalisé survenu lors de la réalisation d’un acte de prévention, d’une investigation ou d’un traitement »(10).
Leur gravité est très variable, allant de l’absence de conséquence perceptible à une prolongation d’hospitalisation ou ré-hospitalisation, voire à un handicap temporaire ou permanent. Dans de rares cas, ils peuvent conduire au décès du patient.
L’étude ENEIS2 réalisée en 2009 (2) relève 2,9 évènements indésirables graves (EIG) pour mille journées d’hospitalisation. Dans cette étude, 47% des EIG sont évitables, et la moitié d’entre eux concerne des produits de santé, dont des médicaments.
I.1.1.2 Les erreurs médicamenteuses
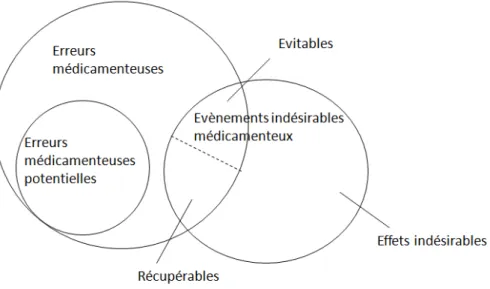
Parmi ces évènements indésirables associés à l’usage des médicaments, on distingue les effets indésirables et les erreurs médicamenteuses (Figure 1). Les effets indésirables sont inévitables, ils découlent de l’emploi du médicament dans ses conditions normales d’utilisation ou d’un mésusage (utilisation intentionnelle en dehors de ces conditions) (11). En revanche, les erreurs médicamenteuses (EM) se définissent comme « l’omission ou la réalisation non intentionnelle d’un acte survenu au cours du processus de soins impliquant un médicament » (12). Dans certains cas, il est difficile de distinguer les effets indésirables des erreurs médicamenteuses. Par exemple, dans le cas d'un patient prenant des anti-vitamines K (AVK), un surdosage/sous-dosage est parfois inévitable. En dehors d'une interaction médicamenteuse c'est donc un effet indésirable. Par contre, la survenue d’une hémorragie ou d’une thrombose faute de suivi de l’INR (International Normalized Ratio) et d’intervention adéquate constitue une erreur.
11
Figure 1: Evènements indésirables médicamenteux, erreurs médicamenteuses et effets indésirables, traduit d’après Morimoto et al. (13)
Ces erreurs peuvent être avérées (l’erreur s’est produite), potentielles (l’erreur a été interceptée) ou latentes (un risque d’erreur a été identifié).
Elles concernent potentiellement toutes les étapes du processus de prise en charge médicamenteuse: réception, stockage, prescription, dispensation, détention, reconstitution et administration d’un médicament, ainsi que la surveillance du patient et son information (5). Leur gravité potentielle et leur nature évitable en font des cibles évidentes des mesures d’amélioration continue de la qualité à l’hôpital (14).
Pour de nombreuses raisons méthodologiques, il est difficile d’évaluer exactement la fréquence de ces erreurs (15). Elle est notamment sous estimées par les études fondées sur les déclarations spontanées d'erreurs médicamenteuses (14,16).
L’étude de référence de Bates et al. a permis d’analyser les erreurs médicamenteuses, toutes causes confondues. Elle a relevé un taux de 5,3 erreurs pour cent prescriptions, soit 0,3 par patient par jour ou 1,3 erreur par admission. 0,9% des EM ont été à l’origine d’effets indésirables (17).
L’étude systématique d’un type d’erreur donné apporte une meilleure appréciation de l’incidence des EM. A titre d’exemple, une étude américaine effectuée auprès de trente-six établissements de santé, ne s’intéressant qu’aux écarts entre les médicaments administrés et les médicaments réellement prescrits, a relevé 11% d’erreurs (18).
12
I.1.1.3 Types d’erreurs médicamenteuses
Les erreurs médicamenteuses sont de natures variées (Figure 2) :
Figure 2: Types d’erreurs médicamenteuses (11)
L’académie américaine de médecine indique qu’outre les dommages potentiels ou avérés pour les patients, ces erreurs ont un impact organisationnel et financier non négligeable. En 2006, elle a attribué un coût annuel de ces EM de 2,6 milliard de dollars (coûts hospitaliers et extrahospitaliers associés aux EM hospitaliers) (15).
Ces éléments permettent donc de comprendre l’intérêt porté à l’étude des mécanismes aboutissant à ces erreurs et surtout aux moyens de les éviter. En France, la prévention et la déclaration des erreurs médicamenteuses est une exigence réglementaire (arrêté du 6 avril 2011) (19) qui s'inscrit dans le cadre de la gestion des risques associée à la prise en charge médicamenteuse dans les établissements de santé. La déclaration de ces erreurs médicamenteuses doit se faire auprès du Guichet Erreurs Médicamenteuses de l’Agence National de Sécurité du Médicament et des produits de santé (ANSM).
I.1.1.4 Origines des
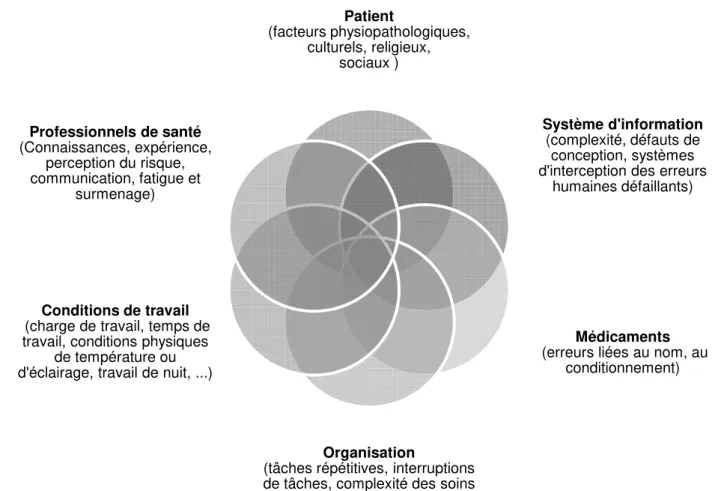
L’épidémiologie de ces erreurs ayant été largement étudiée, Santé (OMS) propose un ensemble de facteurs
erreurs médicamenteuses (20)
Figure 3: Principaux f
Les causes profondes des erreurs
leur prévention, ont été décrites par le Réseau Epidémiologique des Erreurs Médicamenteuses (REEM) et le
Reporting and Prevention (NCC Conditions de travail
(charge de travail, temps de travail, conditions physiques
de température ou d'éclairage, travail de nuit, ...)
Professionnels de santé
(Connaissances, expérience, perception du risque, communication, fatigue et
surmenage)
nes des erreurs médicamenteuses
épidémiologie de ces erreurs ayant été largement étudiée, l’Organisation Mondiale de la propose un ensemble de facteurs (Figure 3) intervenant dans la survenue des
(20). L’importance du facteur humain est considérable.
Principaux facteurs impliqués dans la survenue des EM
causes profondes des erreurs médicamenteuses, dont l’identification est in
ont été décrites par le Réseau Epidémiologique des Erreurs Médicamenteuses (REEM) et le National Coordination Council for Medication
(NCC-MERP) (11). Patient (facteurs physiopathologiques, culturels, religieux, sociaux ) Système d'information (complexité, défauts de d'interception des erreurs
(erreurs liées au nom, au
Organisation
(tâches répétitives, interruptions de tâches, complexité des soins
ou de surveillance du patient)
13 Organisation Mondiale de la intervenant dans la survenue des acteur humain est considérable.
(20).
identification est indispensable à ont été décrites par le Réseau Epidémiologique des Erreurs ncil for Medication Error Système d'information
(complexité, défauts de conception, systèmes d'interception des erreurs
humaines défaillants)
Médicaments
(erreurs liées au nom, au conditionnement)
14 Le facteur humain
« To err is human »1 (l’erreur est humaine), disait le poète anglais Alexander Pope en 1711
dans son Essay on Criticism. Cette idée s’est en effet vérifiée par la suite dans l’industrie et tous les domaines à hauts risques tels que l’aéronautique, très avancée dans la gestion des risques, et dans le domaine médical.
To err is human est également le nom d’un rapport de l’académie américaine de médecine sur l’erreur médicamenteuse (21). Il fait la promotion de la déclaration de celles-ci et tente de dédramatiser l’erreur en insistant sur l’effet de l’organisation et de l’environnement sur les soignants, évoquant des « erreurs honnêtes » (honest mistakes). L’idée d’erreur humaine d’origine systémique a été largement théorisée par le Professeur de psychologie James Reason (22). L’erreur médicamenteuse est donc toujours causée par une association de plusieurs facteurs.
Le facteur humain est primordial, tant du côté soignant que du côté patient. Les facteurs associés aux soignants :
• Professionnellement : la compétence, la qualité de la formation et l’expérience sont des facteurs évidents en relation avec les erreurs médicamenteuses (23), de même que l’ancienneté dans un établissement de santé. En effet, une étude a montré que les prescripteurs remplaçants faisaient significativement plus d’erreurs de prescription que les médecins présents depuis au moins un an dans l’établissement (24).
• la perception et la culture des professionnels de santé en matière d’erreur médicamenteuse (22) a également un impact,
• les conditions de travail comme une charge de travail élevée, les interruptions de tâches (25,26), les horaires de travail (27) parfois longs et le travail de nuit représentent autant de facteurs aggravants.
Facteurs associés aux patients :
• certains facteurs sociaux (éducation, isolement), religieux, culturels, cognitifs (déclin cognitif, maladie mentale) et linguistiques sont des barrières importantes aux échanges avec les professionnels de santé.
• ces mêmes facteurs, freinent la compréhension et l’adhésion des patients à leur traitement.
1
15 L’erreur médicamenteuse et les logiciels d'aide à la prescription
Concernant le mode de prescription, prescrire manuellement est plus à risque d’EM en comparaison de l’utilisation d’un logiciel d’aide à la prescription ou LAP (24), qui contient de nombreux outils d’interceptions d’erreurs, automatise certaines manipulations et limite les transcriptions. Cependant, les LAP peuvent générer des erreurs spécifiques (erreur de sélection dans un menu déroulant par exemple), et poser des problèmes de conception (utilisation trop complexe, génération d’anomalies, non interception d’erreurs qu’ils sont supposés arrêter) (28,29). Leur certification est donc indispensable, et leur choix et déploiement dans les établissements de santé doivent être bien pensés sous peine de devenir une source d’erreurs supplémentaires.
L’EM peut également être liée à des technologies de santé utilisées pour l’administration des médicaments telles que les pompes, pousse-seringues électriques et montages complexes de perfusion (30,31).
Le rôle des médicaments
Certains médicaments présentent des risques de confusion lors de leur prescription et/ou de leur administration en raison de noms très proches soit par leur nom de spécialité (EFFEXOR ®/EXFORGE ®), soit par leur DCI (dopamine/dobutamine, prednisone/prednisolone). Ces médicaments sont dits « sound-alike ». D’autres médicaments, dits « look-alike » (Figure 4), ont une similitude soit des médicaments (sels, dosages ; par exemple confusion entre le chlorure de potassium injectable et le phosphate dipotassique contenant deux fois plus de potassium; confusion entre le chlorure de calcium ou de sodium) ou des conditionnements similaires (32).
Figure 4 : Deux exemples de "look-alike"
Le cas des sels de potassium fait partie des « never events » (événements qui ne devraient jamais survenir) dont la liste a été publiée en 2012 par l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM). Ces never events sont des erreurs médicamenteuses graves contre lesquelles des mesures de prévention doivent absolument être mises en œuvre dans les établissements de santé (33).
16 I.1.2. Origines des erreurs médicamenteuses aux points de transition et
particularités des transferts inter-hospitaliers
I.1.2.1 EM aux points de transition
Selon le dictionnaire Larousse (34), une transition est le « passage d’un état à un autre ». Dans le domaine de la santé, c’est le passage d’un secteur, d’un service ou d’un établissement à un autre, dans le parcours de soins d’un patient.
Il existe a minima un changement d’équipe médicale et paramédicale en charge du patient, mais aussi éventuellement, de support pour les informations d’ordre médical, paramédical et pharmaceutique (le dossier médical du patient, le plan de soins, le Logiciel d’Aide à la Prescription ou LAP, et logiciel de Gestion Administrative du Malade ou GAM), voire de circuit logistique pour l’approvisionnement en médicaments et dispositifs médicaux.
La vulnérabilité du patient vis à vis des erreurs médicamenteuses aux points de transition découle de ces ruptures dans sa prise en charge.
L’Institute for Heath Improvement (35) américain estimait en 2009 que 46% des erreurs médicamenteuses surviennent aux points de transition dans le système de soins.
I.1.2.2 Types d’erreurs et conséquences
Les trois types d’erreurs dominantes aux points de transition sont les erreurs de molécules, les omissions/ajouts non intentionnels de médicaments et les erreurs de dosage et de posologie (36).
Les conséquences de ces erreurs sont principalement :
- une prise en charge non optimale du patient en raison de l’arrêt d’un traitement ou d’une erreur de dose,
- la génération possible d’effets indésirables (dont allergies) en cas de molécules ajoutées ou de posologies involontairement augmentées,
- une entrave ou un retard au diagnostic thérapeutique en cas d’effet indésirable ou au contraire d’un problème d’adhésion à un traitement dont le médecin n’a pas connaissance (37).
I.1.2.3 Origine des erreurs médicamenteuses aux points de transition
Les erreurs médicamenteuses reposent sur les mêmes facteurs que ceux décrits précédemment, avec des particularités liées aux types de patients les plus fréquemment concernés par ces transferts: les patients âgés.
Le manque de communication et de coordination entre les professionnels de santé est la cause majeure des EM aux points de transition. La reprise du traitement repose en effet sur
17 la transmission d’informations exactes et complètes (38). L’absence de standardisation dans la transmission des informations, la méthode de recueil et la traçabilité de ces données, ainsi qu’un manque de clarté dans le rôle de chaque professionnel de santé sont connus comme sources d’erreurs.
La transcription, est également génératrice d’erreurs (39). C'est pourquoi le recopiage d’une prescription est interdit (19). Mais le fait qu'un médecin reprenne une prescription antérieure (par exemple la reprise du traitement habituel au moment de l’admission) et la prescrive sur un support différent (logiciel d’aide à la prescription) en y apportant ou non des modifications est une situation fréquente. Il ne s'agit alors pas à proprement parler de (re)transcription, puisqu’elle suppose une réévaluation du traitement et un nouvel acte de prescription. Cependant, le risque d’erreur persiste. Cette situation peut se présenter plusieurs fois à l’occasion d’un transfert de patient (à la sortie du service d’amont et à l’entrée dans le service d’aval).
La généralisation de l’informatisation des prescriptions sécurise relativement la continuité des traitements lors de transferts intra-hospitaliers de patients, sauf entre deux champs d’activité distincts (ex. transition service des urgences/réanimation/services de médecine) où les besoins spécifiques associés à ces spécialités ne permettent pas toujours d’utiliser le même LAP au sein d’un hôpital.
Lors de la transition entre deux établissements, les LAP sont différents et les plateformes d’interopérabilités encore trop coûteuses et peu développées pour offrir une interface fiable entre eux. D’autre part, aucune norme d’interopérabilité n’est encore généralisée. La prénorme PN13-SIPh2 V3 est cependant en développement sous l’égide de la PHAST (association de professionnels dont le but est de développer ces standards informatiques entre les éléments du système d’information hospitalier) (40).
Chez les patients âgés et/ou atteints de pathologies lourdes et chroniques, les séquences d’hospitalisation, ré-hospitalisation et de transfert étant relativement plus fréquentes et complexes, ce risque peut éventuellement être aggravé par l'accumulation d’erreurs à chaque transition. En outre, ce sont des patients généralement polymédiqués, présentant un isolement social, un déclin cognitif ou un entourage familial limité qui est à l’origine de leur admission dans des structures de soins de long séjour, de soins de suite et de réadaptation ou en établissement médico-social. Ces facteurs réduisent leur capacité à informer les professionnels de santé sur leurs traitements en cours et les rendent plus vulnérables à ces EM (41) .
18 Une expérimentation internationale, Med’Rec, a montré en 2015 que sur 27 447 prescriptions étudiées en France, il existait 48 188 écarts entre le traitement théorique et celui prescrit à l’hôpital (42). Certains de ces écarts (appelés également « divergences ») étaient volontaires, car justifiés par l’évolution de l’état du patient ou l’absence d’un médicament au livret thérapeutique de l’hôpital. Une proportion non négligeable de ces divergences n’avait quant à elle, aucune justification. Ces divergences dites « involontaires », représentaient un risque de gravité très variable pour les patients allant de l'absence probable de conséquences à la mise en jeu du pronostic vital, un handicap permanent ou le décès du patient.
Une des solutions proposée pour prévenir et/ou intercepter ces erreurs médicamenteuses aux points de transition, et en particulier aux transferts, est la mise en place d’une activité de conciliation des traitements médicamenteux.
19
I.2. La conciliation des traitements médicamenteux : un outil de
sécurisation de la prise en charge médicamenteuse
I.2.1. Définition de la conciliation des traitements médicamenteux
Le collège de la Haute Autorité de Santé (HAS) a défini la conciliation des traitements médicamenteux, encore appelée « conciliation médicamenteuse », comme « un processus formalisé qui prend en compte, lors d’une nouvelle prescription, tous les médicaments pris et à prendre par le patient. Elle associe le patient et repose sur le partage d’informations et sur une coordination pluri-professionnelle. Elle prévient ou corrige les erreurs médicamenteuses en favorisant la transmission d’informations complètes et exactes sur les médicaments du patient entre professionnels de santé aux points de transition que sont l’admission, la sortie et les transferts (9) ».
C’est une démarche organisée et structurée, destinée à prévenir ou intercepter les erreurs médicamenteuses aux points de transition dans le parcours de soins du patient.
Elle repose sur la coopération entre :
• les professionnels de santé de ville (médecins, pharmaciens, infirmiers), • les professionnels de santé des établissements de santé (médecins,
pharmaciens, infirmiers, ...),
• les patients eux-mêmes ou leurs aidants.
Cette conciliation permet d’établir un bilan aussi exhaustif et fiable que possible des traitements pris par le patient, qu’ils soient prescrits ou non.
Bien que l’enchaînement des grandes étapes de la conciliation paraisse assez intuitive, il est indispensable de formaliser la façon de procéder pour la rendre efficace et en tirer un maximum de bénéfices (43).
Des études internationales sur le sujet, notamment l’initiative des High 5s, montrent les bénéfices de ce dispositif en terme d’interception et correction des erreurs médicamenteuses (42,44).
La réduction des erreurs médicamenteuses figurait parmi les objectifs de l’initiative internationale des High 5s via la mise en œuvre et l’évaluation de procédures standardisées de conciliation médicamenteuse (SOP Med’Rec). Neuf hôpitaux français ont participé à cette démarche. Sur les 22 863 patients conciliés en France, le nombre d’erreurs médicamenteuses interceptées et corrigées était en moyenne de 0,8 erreur par patient (42). Grâce au développement d’un outil d’évaluation de la gravité erreurs médicamenteuses par le CH de Lunéville et le CHU de Strasbourg, il a été déterminé que 17% des erreurs
20 interceptées étaient de gravité majeure, critique ou catastrophique et auraient eu un impact sur la santé des patients (42).
Cependant, il est difficile de montrer un gain en termes de morbidité, de mortalité et de réduction des ré-hospitalisations liées aux médicaments, d’autant plus que le séjour du patient est complexe (multiples changements de services) (45). En effet, si seule une minorité des erreurs a un impact évaluable sur la santé des patients, la réduction de la morbidité et de la mortalité qui découle de leur correction ne peut être mise en évidence par ce type d’étude (puissance statistique insuffisante).
Une évaluation médico-économique de la conciliation est en cours dans le prolongement du projet Med’Rec (46). Ces résultats préliminaires ont été présentés en congrès en 2016.
21 I.2.2. Méthode de conciliation des traitements médicamenteux
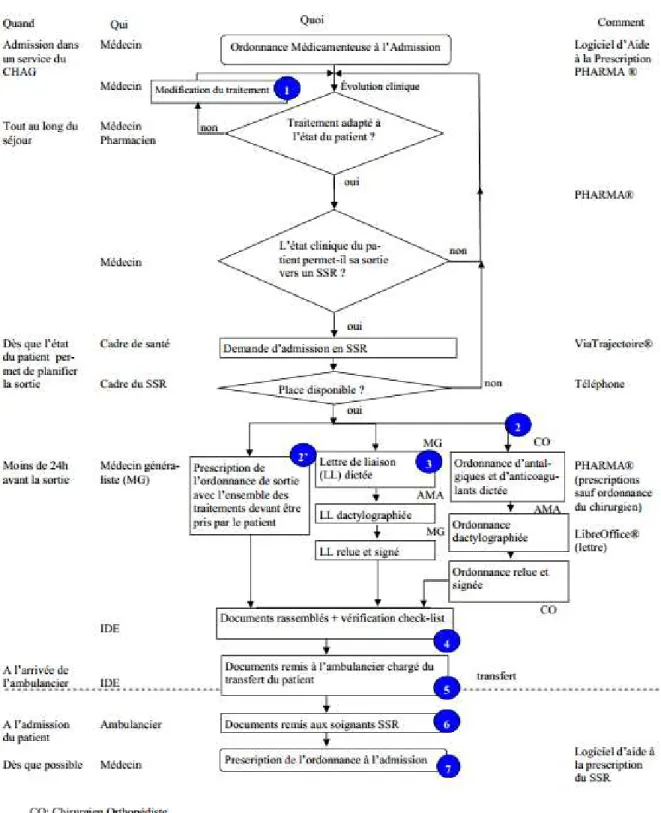
Quel que soit le point de transition à sécuriser (entrée, sortie ou transfert), la conciliation médicamenteuse comporte toujours une phase de conciliation des traitements à l’admission (CTA) dans le service de soins. Cette conciliation, sécurisant par elle-même la prise en charge médicamenteuse pendant le séjour du patient, servira de base pour la réalisation d’une conciliation de transfert ou de sortie.
I.2.2.1 Conciliation des traitements à l’admission
Elle peut être proactive (réalisée avant la première prescription dans le service ou rétroactive (après la première prescription).
La conciliation proactive s’avère la plus optimale car elle permet d’anticiper et de prévenir les erreurs médicamenteuses plutôt que de les intercepter. C’est la raison pour laquelle la Société Française de Pharmacie Clinique (SFPC) recommande de la privilégier quand elle est possible (47). Elle est en revanche difficile à mettre en œuvre, car elle implique plus de communication et de synchronisation entre professionnels de santé et plus de réactivité (donc de disponibilité) du professionnel de santé réalisant le recueil d’information.
La conciliation rétroactive est idéalement effectuée dans les quarante-huit premières heures suivant l’admission ou, à défaut, dès que possible après l’admission du patient (48).
Cette CTA s’organise en quatre grandes phases :
• le recueil des informations sur les traitements,
• la synthèse de ces informations sous forme d’un Bilan Médicamenteux Optimisé (BMO),
• la comparaison avec le traitement prescrit (si la CTA est rétroactive),
• l’échange avec le prescripteur pour identifier et éventuellement corriger les divergences involontaires (écarts entre le BMO et la prescription).
Recueil des informations
La recherche active d’informations sur les traitements peut être réalisée par ou en collaboration avec plusieurs professionnels de santé (médecins, pharmaciens ou des internes ou externes, infirmiers, sages-femmes, préparateurs en pharmacie). Elle doit impérativement comporter plusieurs sources (au moins trois parmi celles décrites dans la liste ci-après) (48).
22 Les sources d’information possibles sont (9) :
• le patient, son entourage, dont l’aidant2 et/ou les infirmiers intervenant dans la
préparation ou l’administration de ses médicaments, • les prescriptions du patient,
• les courriers médicaux et documents de liaisons divers issus d’établissements de santé ou médicaux-sociaux (EHPAD, ...),
• les dossiers d’anesthésie, notamment pour les patients hospitalisés dans un service de chirurgie,
• le dossier pharmaceutique,
• le dossier médical du patient dans l’établissement de santé, • les médecins généralistes et spécialistes
• le ou les pharmaciens d’officine ayant dispensé les traitements en ambulatoire ou les pharmaciens hospitaliers pour les médicaments rétrocédés.
L’ensemble de ces informations doit être regroupé dans un document formalisé signé par le professionnel de santé qui les recueille et être mis à disposition des autres professionnels dans le dossier médical du patient.
Réalisation du BMO
Ces informations sont ensuite synthétisées sous la forme d’un Bilan Médicamenteux Optimisé (BMO). Cette étape est préférentiellement réalisée par un pharmacien ou un interne en pharmacie et le cas échéant, est accompagné d’une analyse pharmaceutique(48). Le BMO doit également être laissé dans le dossier patient (ou le LAP s’il le permet), et officialise la démarche de conciliation médicamenteuse. Il peut s’accompagner de la proposition d’équivalences au livret thérapeutique.
Comparaison du BMO aux prescriptions en cours
Les écarts entre le BMO et les prescriptions sont alors analysés au regard du motif d’admission et de l’évolution clinique et biologique du patient. Les divergences (écarts entre le BMO et la prescription) sont repérées.
2
La HAS définit l'aidant naturel comme "les personnes non professionnelles qui viennent en aide à titre principal, pour partie ou totalement, à une personne dépendante de son entourage pour les activités de la vie quotidienne [...]"(49).
23 Il existe des divergences intentionnelles (ou volontaires), pour lesquelles le médecin a volontairement apporté une modification au traitement habituel du patient (par exemple, réduction de la posologie d’un antihypertenseur en cas d’hypertension artérielle). Elles peuvent être documentées (justifiées dans le dossier médical du patient) ou non.
Les divergences non intentionnelles (DNI) sont quant à elles des modifications involontairement apportées au traitement du patient. Ce sont donc par définition des erreurs médicamenteuses. Elles sont la cible principale de la CMA, qu’elles aient ou non un impact clinique sur le patient.
Echange collaboratif
Les divergences non documentées sont analysées avec le médecin à l’origine de la prescription pour déterminer si elles sont volontaires (DND) et noter leur justification, ou si au contraire elles ne le sont pas (divergences non documentées non intentionnelles (DNDNI)) et discuter de la suite à leur donner (modification ou non) ainsi que de leur éventuelle gravité en tant qu’indicateur qualité. Chaque modification est, là encore, tracée.
I.2.2.2 Conciliation médicamenteuse de sortie (CTS) ou de transfert
(CTT)
La conciliation médicamenteuse de sortie consiste à confronter la prescription de sortie du patient au BMO, aux prescriptions pendant le séjour et au courrier médical de sortie remis au patient. Cette lettre reprend en principe le traitement de sortie du service (50–52), ainsi que le détail et la justification des changements effectués. Ce dernier point est devenu une obligation légale au 1er janvier 2017 avec le décret n° 2016-995 du 20 juillet 2016 relatif aux
lettres de liaison.
De la même façon que pour la CTA, il existe un temps de recueil des informations, un temps de synthèse et un temps d’échange avec le prescripteur.
Le temps de recherche active d’informations s’appuie sur le BMO réalisé à l’admission, sur l’ensemble des prescriptions réalisées pendant le séjour, sur l’ordonnance de sortie et idéalement sur la lettre de sortie. Cette dernière doit être remise au patient à sa sortie de l’établissement et comporte en principe le résumé de l’évolution clinique du patient et la justification des modifications de traitement réalisées en conséquence.
Un document est rédigé pour synthétiser le traitement de sortie, les principaux éléments physiopathologiques en lien avec les traitements et les modifications effectuées par rapport à l’entrée. Les éventuelles divergences non documentées font une nouvelle fois l’objet d’un échange avec le prescripteur, et si nécessaire d’une rectification ou d’une justification écrite dans le bilan de sortie.
24 En cas de sortie vers le domicile, le patient est informé des changements effectués. Le bilan de sortie lui est remis et est envoyé à son médecin traitant, ainsi qu’à son pharmacien d’officine.
En cas de sortie vers un établissement de santé, les documents sont transmis à l’établissement d’aval. Pour la Société française de Pharmacie Clinique, la conciliation de transfert s’apparente à une conciliation de sortie.
Bien que ce ne soit pas à proprement parler le rôle de la conciliation de transfert, un temps pour proposer des équivalences au livret thérapeutique de l’établissement d’aval est concevable, même si en France une telle pratique devrait certainement être formalisée par une convention entre les deux établissements. Cette activité permettrait de fluidifier la prise en charge médicamenteuse à condition de transmettre également le traitement initial du patient. De même, l’établissement d'amont peut fournir 24h de traitement à l’établissement d’aval pour garantir l’absence de rupture dans le traitement.
La coopération entre établissements et professionnels de santé, non seulement ceux d’un même établissement de santé, mais aussi ceux d’établissements de santé différents, devient ainsi un facteur de prévention de l’erreur médicamenteuse.
L’organisation des hôpitaux d’un territoire de santé en groupements hospitaliers de territoire à compter de juillet 2016 représente une opportunité d’analyser ce type de situation de transfert. Elle permettrait aussi de mettre en place de nouvelles organisations dont certaines ont un impact sur la qualité et la sécurité de la prise en charge médicamenteuse.
25
I.3. Les Groupements Hospitaliers de Territoire: des opportunités de
sécurisation offertes par un nouveau mode de coopération
I.3.1. Origine des GHT
En novembre 2014, Marisol Touraine, Ministre des Affaires Sociales et de la Santé, missionne Jacqueline Hubert, et Frédéric Martineau, pour rencontrer les représentants des professionnels de santé hospitaliers et les représentants des usagers, afin d’évaluer, de préparer et de mettre au point des outils de mise en œuvre d’un nouveau mode de coopération hospitalière: les Groupements Hospitaliers de Territoire (GHT).
En effet, malgré l’existence de modes de coopération variés, la coopération entre établissements est insuffisante à l’échelle de la France entière et concerne rarement la mise en commun de fonctions transversales (à l’exception des Hospices civils de Lyon, de l’Assistance Publique des Hôpitaux de Paris et de l’Assistance Publique des Hôpitaux de Marseille).
Il n’existe pas de projet commun entre les hôpitaux publics, ce qui génère des doublons en compétences et en matériels lourds spécialisés. A l’inverse, dans certaines régions, l’accès à certaines spécialités/matériels lourds est compliqué. De nombreux hôpitaux présentent enfin des difficultés à recruter des médecins dans des spécialités telles que la médecine d’urgence, la radiologie et l’anesthésie (53).
En revanche, l’offre de soins est concurrentielle avec les établissements de santé privés qui n’ont ni les mêmes contraintes budgétaires ni les mêmes obligations vis-à-vis de la population.
Ces réalités engendrent un risque d'inégalité pour la population dans l’accès aux soins, la qualité et la sécurité des soins prodigués aux patients, dans un contexte de ressources budgétaires limitées et de besoins croissants, en raison notamment du coût associé aux thérapies innovantes.
La loi n° 2016-41 du 26 janvier 2016 de Modernisation de notre Système de Santé (LMSS) réforme le système de santé en introduisant les notions de territoire de santé, de gradation des soins et de Groupement Hospitalier de Territoire (54).
26 Le territoire de santé et la gradation des soins
L’amélioration de l’égalité d’accès aux soins passe par une planification territoriale (55) de ceux-ci :
• du point de vue géographique, les territoires de santé sont définis en remplacement de la notion de « secteur sanitaire ». Ils sont en principe déterminés en fonction des flux réels de patients au sein d’une région, plus qu’en fonction du découpage administratif.
• la prise en charge médicale est organisée en niveaux de recours pour orienter au mieux les patients en fonction de leurs besoins dans les territoires de santé et rationaliser le recours aux soins.
Les soins de premiers recours sont les soins assurés en ville par les professionnels de santé de proximité tels que le médecin généraliste (56). Ils doivent impérativement être accessibles à une distance et dans un délai « raisonnables », partout sur le territoire. Les soins de second recours sont les soins spécialisés, nécessitant des compétences et/ou équipements plus rares, sans que la loi ne précise leur nature. En 2010, 84 % des Français habitaient dans une commune possédant au moins un médecin généraliste et tous vivaient à moins de quinze minutes d’une commune dotée d’un médecin généraliste (57).
De même que la Loi de Modernisation du Système de santé fait évoluer l’orientation des patients dans un territoire, la création des GHT, correspond à une recherche de cohérence dans l’offre hospitalière de soins d’un territoire en rationalisant la répartition des spécialités médicales et des équipements, la mise en commun de moyens et l’orientation optimale du patient au sein de cette offre de soins.
27 I.3.2. Objectifs et fonctionnement des GHT
I.3.2.1 Objectifs des GHT
La Loi de Modernisation de notre Système de Santé a réformé les modalités et objectifs de la coopération hospitalière, anciennement représentés pas les GCS de moyen (Groupements de Coopération Sanitaire), les GCS érigés en établissements de santé et les CHT (Communautés Hospitalières de Territoire).
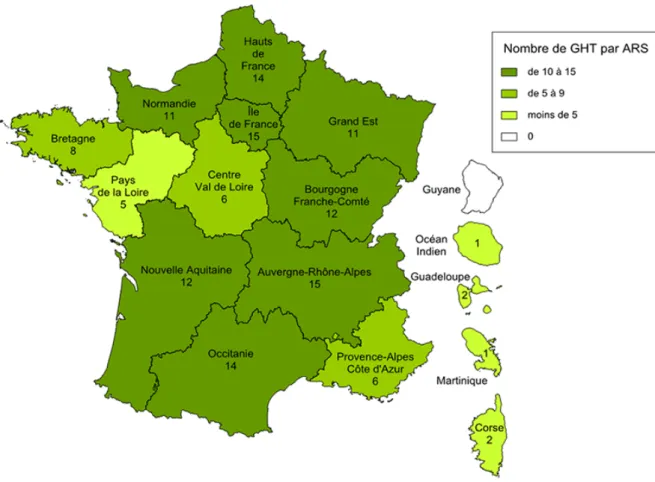
Le décret du 27 avril 2016 imposait l’intégration au 1er Juillet 2016 de l’ensemble des
établissements de santé publique à un des cent trente-cinq GHT (Figure 5), sauf dérogation accordée par le directeur général de l’ARS (58,59). Il existe en France vingt dérogations (60), concernant principalement des établissements de santé mentale.
Figure 5 : Carte de France des groupements hospitaliers de territoire (61)
La création des GHT a pour objectif d’améliorer le parcours patient et l’accès aux soins à l’aide d’une planification territoriale de l’offre de soins, graduée par filière entre les petits hôpitaux locaux, les hôpitaux de dimensions plus importantes disposant de plateaux techniques plus conséquents et plus spécialisés, et les grands centres hospitaliers universitaires (équipements lourd et accès à l’innovation).
28 Chacun doit, par exemple, pouvoir bénéficier de soins d’urgence à une distance raisonnable de chez lui. La notion de raisonnable n’a pas été définie par les textes de loi. Cette planification se fait autour de l’élaboration d’un Projet Médical et de Soins Partagé (PMSP). Le second objectif, clairement énoncé, est de « soigner mieux au moindre coût » (53) par le regroupement des fonctions de support, activités transversales de l’établissement (gestion du système d’information hospitalier, de la direction de l’information médicale et des fonctions d’achat et de formation).
I.3.2.2 Fonctionnement des GHT
Une convention constitutive est obligatoirement signée entre les établissements de santé membres du GHT, ainsi qu'éventuellement avec des établissements sociaux et médico-sociaux (par exemple un EHPAD, un centre médico-psychologique ou un service de soins infirmiers à domicile...). Cette convention désigne un établissement « support » pour la gestion des fonctions transversales, ainsi que pour la responsabilité de Personne Morale, non supportée par le GHT. Le GHT doit se doter d’une gouvernance commune via une Commission Médicale de Groupement (équivalent de la CME à l'échelle d'un GHT) (62). La convention constitutive est signée pour dix ans (63).
Les membres du GHT doivent ensuite s’accorder sur la définition du Projet Médical et de Soins Partagé (PMSP) pour une durée de cinq ans (58). Le PMSP définit les objectifs et la stratégie de prise en charge médicale et soignante des patients à l’échelle du territoire et des différents niveaux de soins. Il vise à définir une prise en charge coordonnée des patients par filière (Figure 6) en prenant en compte les caractéristiques actuelles des patients du territoire, l’évolution prévisible de la demande de soins pour chaque filière et l’offre de soins disponible (Figure 7) (2).
Figure
Figure
Le décret du 27 avril 2017 prévoit clairement
pharmaceutiques » dans le PMSP, de même que les activités de biologie médicale, ainsi que la définition commune d’objectifs d
terme (2021), les établissements du GHT doivent faire l non plus individuelles.
Le calendrier de déploiement des GHT exige
Figure 6 : Identification des filières de soins (2)
Figure 7 : Principe de construction du PMSP (2)
Le décret du 27 avril 2017 prévoit clairement « l’organisation en commun des act dans le PMSP, de même que les activités de biologie médicale, ainsi que
objectifs d’amélioration de la qualité et de la sécurité des soins. A terme (2021), les établissements du GHT doivent faire l’objet de certifications communes et
Le calendrier de déploiement des GHT exigeait que le PMSP soit défini au 1
29 organisation en commun des activités dans le PMSP, de même que les activités de biologie médicale, ainsi que amélioration de la qualité et de la sécurité des soins. A certifications communes et
30 I.3.3. Prise en charge médicamenteuse dans les GHT
Les changements dans l’organisation hospitalière provoqués par la création et la mise en place des GHT pourraient avoir un sérieux impact sur la prise en charge médicamenteuse. Cette évolution comporte des risques, mais aussi de vraies opportunités pour améliorer cette prise en charge.
Le décret du 26 avril 2017 prévoit « l’organisation en commun des activités de pharmacie » et qu’un pôle pharmaceutique inter-établissements peut être créé pour rendre effective cette coopération. Néanmoins, c’est l’ordonnance 2016-1729 du 15 décembre 2016 qui précise les modalités de cette coopération en modifiant le rôle des PUI.
D’autres fonctions transversales sont mises en commun. Les achats le sont, à l’exclusion de l’approvisionnement en produits pharmaceutiques qui reste donc la mission de la ou des PUI dispensant les médicaments aux patients de l’établissement. La gestion du Système d’Information Hospitalier (SIH), est également concernée, avec en premier lieu, la génération d’un identifiant unique par patient dans l’ensemble du GHT. L’objectif est de transformer la multitude de briques applicatives qui constituent le SIH de chaque établissement en un système convergent d’ici 2021 (décret n° 2016-524 du 27 avril 2016 relatif aux GHT et article R. 6132-15 du Code de la Santé Publique) permettant d’assurer, outre l’économie budgétaire attendue:
• une continuité dans la transmission des informations médicales, paramédicales et pharmaceutiques entre l’ensemble des établissements des GHT,
• une meilleure maîtrise du SIH, des risques associés,
• une uniformisation des protocoles de soins (par uniformisation des protocoles prescrits entre les établissements).
Concernant les changements pour les PUI, l’ordonnance du 15 décembre 2016 modernise leurs rôles et les adapte à l’exercice en GHT. Elle donne notamment le droit à une PUI d’exercer ses missions pour son propre compte ou pour celle d’autres PUI. C’est une nouvelle notion dans le domaine de l’achat et de l’approvisionnement en médicaments, mais existant déjà par le biais de conventions dans celui de la pharmacotechnie ou de la stérilisation. Une PUI peut exercer certaines fonctions dans un seul établissement pour l’ensemble du GHT. Ceci permet un investissement collectif plutôt qu'individuel dans des équipements lourds et une mutualisation des coûts d'achats, de fonctionnement et d'entretien. C'est par exemple possible pour l'achat d'automates de dispensation et de reconditionnement.
31 Cela nécessite éventuellement de modifier certaines installations pour les adapter à la croissance de l’activité et d’imaginer un juste mode de financement pour l’entretien et le fonctionnement. Se posent également des problèmes logistiques afin de répartir les médicaments et dispositifs acquis ou préparés entre les différents sites. La taille des établissements et les infrastructures routières les reliant différant d’un GHT à l’autre, l’opportunité et les modalités d’un tel fonctionnement sont à étudier au cas par cas et la réglementation actuelle laisse une certaine liberté de choix dans ce domaine.
Enfin, certaines missions des PUI peuvent être coordonnées par le pôle inter-établissements mais en aucun cas, délocalisées. C’est le cas de la Pharmacie Clinique, explicitement citée dans l’ordonnance du 15 décembre 2016. Il est également difficile d’imaginer supprimer les activités de rétrocession dans les hôpitaux locaux. De tels choix compliqueraient l’accès des patients à certains traitements.
32 I.3.4. Place de la pharmacie clinique dans les GHT
Dans la continuité de la création des GHT, l’ordonnance du 15 décembre 2016, entrant en application le 1er Juillet 2017, abroge la Loi n° 92-1279 du 8 décembre 1992 concernant le
rôle les Pharmacies à Usage Intérieur. Une telle mise à jour du rôle des PUI est en effet nécessaire pour prendre en compte les évolutions de la pharmacie hospitalière ces 25 dernières années, notamment le développement de la Pharmacie Clinique et pour permettre de mettre en œuvre de nouveaux modes de coopération entre PUI. Cela prévient également la réduction des PUI à une stricte mission logistique d’approvisionnement des établissements en produits de santé.
Pour la première fois, la Pharmacie Clinique est explicitement valorisée légalement à l’hôpital et devient officiellement une mission des pharmaciens hospitaliers. Ainsi, il revient aux pharmaciens hospitaliers (mais pas uniquement des établissements de santé publique) de « contribuer à la sécurisation, à la pertinence et à l’efficience du recours aux produits de santé [...] et de concourir à la qualité des soins, en collaboration avec les autres membres de l’équipe de soins » et « d’entreprendre toute action d’information aux patients et aux professionnels de santé [...], ainsi que toute action de promotion et d’évaluation de leur bon usage, et de concourir à la pharmacovigilance, à la matériovigilance, et à la politique du médicament et des dispositifs médicaux stériles mentionnée à l’article L. 6111-2 ».
Cette ordonnance mentionne également que ces missions peuvent être exercées pour le compte de la PUI dans laquelle le pharmacien exerce, ou pour le compte d’autres PUI dans le cadre de coopérations (autrement dit, des GHT).
Parmi les changements énoncés précédemment, nombreux sont ceux qui peuvent avoir un impact favorable sur la qualité et la continuité de la prise en charge médicamenteuse:
• convergence des SIH, • prise en charge par filière, • homogénéisation des pratiques.
Développer la pharmacie clinique dans les PUI, une activité qui ne peut pas être « centralisée » dans l’établissement support, et renforcer la coopération entre pharmaciens offre l'occasion d’améliorer la prise en charge médicamenteuse des patients, de se doter d'outils et de mener une réflexion commune sur les faiblesses éventuelles de la prise en charge médicamenteuse hospitalière dans le GHT, en particulier aux points de transition. Les GHT permettront un accès plus large aux informations médicales et pharmaceutiques via les dalles informatiques communes, une uniformisation dans les protocoles de prise en charge des patients ou l'échange plus aisé de ressources à ce sujet, une stratégie commune de choix des médicaments et dispositifs médicaux au livret via des COMEDIMS
33 (COmmission des MEdicaments et DIspositifs Médicaux Stériles) inter-GHT, et le déploiement d'une conciliation médicamenteuse aux points stratégiques du parcours dans le GHT. Tout cela va dans le sens d'une prise en charge médicamenteuse du patient mieux coordonnée.
Ce dialogue était possible bien avant la création des GHT mais dans ce nouveau contexte, il peut être facilité et les actions préventives et curatives vis-à-vis des risques identifiés sont beaucoup mieux coordonnées. Une vraie politique de gestion des risques peut être menée en commun.
Ces évolutions interviennent dans un contexte de développement croissant des activités de conciliation des traitements médicamenteux, comme décrit précédemment, et d’exigence croissante en matière de continuité dans la prise en charge médicamenteuse.
En conclusion de cette première partie, les transitions dans le parcours de soins d’un patient présentent des risques d’erreurs médicamenteuses et de ruptures dans la continuité des soins. Les réformes en cours dans l’organisation de la prise en charge hospitalière des patients, principalement la création des GHT ainsi que le développement d’activités de pharmacie clinique, offrent l'opportunité d’analyser ces risques aux points de transition et de mettre en œuvre des actions telles que la conciliation des traitements médicamenteux, afin de réduire ces risques et d’améliorer la qualité et la sécurité des patients lors de leurs séjours à l’hôpital.
34
II. MISE EN PLACE D'UNE CONCILIATION MEDICAMENTEUSE AUX
TRANSFERTS DU CH D'AVRANCHES-GRANVILLE VERS LES
SSR
II.1.
Contexte général
Le Centre Hospitalier d’Avranches-Granville (CHAG) est un hôpital public intercommunal du Sud-Manche. Il est issu de la fusion, en 1992, des Centres Hospitaliers d’Avranches et de Granville.
Suite au rapport de l’Inspection Générale des Affaires Sociales (IGAS) sur le circuit du médicament à l’hôpital (64) et au projet Med’rec (42), de nombreux hôpitaux français ont souhaité développer une activité de conciliation médicamenteuse pour réduire le risque d’EM. La mise en place de cette activité demandant des ressources humaines supplémentaires, en particulier en pharmaciens, a été encouragée par l’attribution de subventions par l’ARS suite à la circulaire n°SG/2015/152 de la Direction Générale de l’Offre de Soins (DGOS) (65).
La conciliation médicamenteuse et le déploiement de la pharmacie clinique font partie des obligations associées au CAQES (Contrat d’Amélioration de la Qualité et de l’Efficience des Soins). Le CHAG a souhaité lui-aussi développer cette activité.
Par ailleurs, des évènements indésirables relatifs à la continuité de la prise en charge médicamenteuse ont été déclarés au CHAG. Lors de transferts de patients depuis le CHAG vers des services de Soins de Suite et de Réadaptation (SSR), les informations concernant l’évolution du traitement du patient en cours d’hospitalisation et les traitements du patient à l’admission en SSR étaient incomplètes ou erronées.
Enfin, travailler à l’amélioration de la coordination des professionnels de santé entre établissements prend un sens particulier dans le contexte de la création des Groupements Hospitaliers de Territoire (GHT). En effet, les SSR vers lesquels les patients du CHAG sont les plus transférés sont tous membres du GHT « Groupe Hospitalier Mont-Saint-Michel ». L’objectif de cette étude est d’une part d’identifier, via une analyse de risques dans certains services, les points critiques du processus de transfert des informations relatives au traitement médicamenteux du patient et d’autre part, d’évaluer les intérêts et limites de la mise en place d’une conciliation médicamenteuse de sortie pour intercepter les erreurs médicamenteuses au transfert des patients en SSR.
35
II.2.
Matériel et méthode
II.2.1. Le Groupe Hospitalier Mont-Saint-Michel
L’étude a été réalisée au Centre Hospitalier d'Avranches-Granville, en collaboration avec les Centres Hospitaliers de Mortain, Saint-Hilaire-du-Harcouët et Villedieu-les-Poêles. Tous ces établissements sont, depuis le 1er Juillet 2016, membres du même Groupement Hospitalier
de Territoire.
Le Groupe Hospitalier Mont-Saint-Michel constitue un des onze GHT de Normandie (Figure 8). Il se situe dans le sud de la Manche, à la limite sud-ouest de la Normandie.
Ce territoire rural de 1 987 km2 comprend un total de 143 207 habitants en 2013, soit
72 hab. / km2 (116 hab. / km2 en France métropolitaine en 2011). La commune la plus
peuplée de ce bassin de population de 157 communes est Granville (66,67).
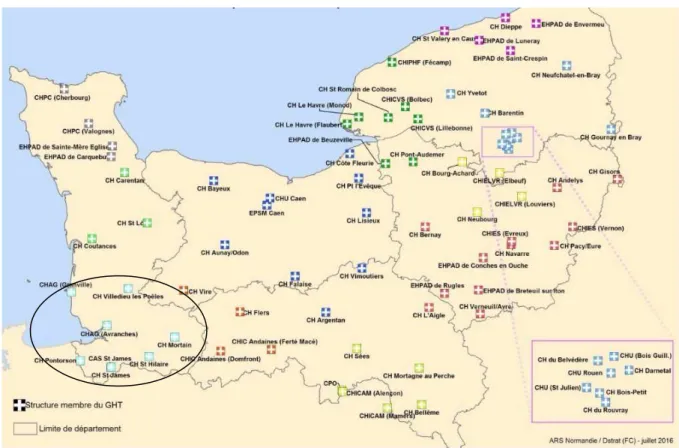
36 Le GHT est composé de six établissements de santé et d'établissements médicaux-sociaux qui y sont rattachés (Figure 9) :
• le Centre Hospitalier d'Avranches-Granville (établissement support de 549 lits d’hospitalisation dont 347 lits de MCO, 50 lits de SSR, 120 lits d'USLD),
• le Centre Hospitalier de Saint-Hilaire-du-Harcouët, en direction commune avec le CHAG (64 lits d’hospitalisation, dont 32 de médecine et 32 de SSR),
• le Centre Hospitalier de Saint-James (30 lits d’hospitalisation),
• le Centre Hospitalier de Mortain (direction commune avec le CHAG, 30 lits d’hospitalisation dont 10 de MCO et 20 de SSR),
• le Centre Hospitalier de l’Estran à Pontorson (124 lits d’hospitalisation dont 118 de psychiatrie),
• le Centre Hospitalier de Villedieu-les-Poêles (38 lits d’hospitalisation dont 15 de MCO et 23 de SSR).
Centres Hospitalo-Universitaires Centres Hospitaliers membres du GHT
Figure 9 : GHT Groupe Hospitalier Mont-Saint-Michel et ses CHU de recours (source Google MyMap ®).
37 Ces établissements totalisent également 958 lits d’EHPAD et possèdent des Services de Soins Infirmiers à Domicile (SSIAD).
Le CH de Villedieu et le CH de Mortain, membres d’un Groupement de Coopération Sanitaire avec le CH de Vire, dans le Calvados (GCS Vire Manche Calvados) vont intégrer le GHT.
Le CHAG possède deux des trois services d’accueil des urgences du Sud-Manche et un service de réanimation. Il dispose également de 230 lits de médecine, d’un plateau technique de chirurgie (urologique, orthopédique, digestive et ambulatoire) comprenant 93 lits d’hospitalisation, d’une maternité de niveau 2 associée à un service de pédiatrie et de néonatalogie. L’hôpital est enfin doté de deux services de SSR, de deux Unités de Soins de Longue Durée et est gestionnaire de deux Etablissements d’Hébergements de Personnes Agées Dépendantes (EHPAD) (68,69).
Les Centres Hospitalo-Universitaires (CHU) de référence en cas de soins spécialisés sont le CHU de Caen, à une heure du CHAG et parfois le CHU de Rennes, à environ une heure également. La situation géographique particulière d’Avranches explique la répartition des patients entre ces deux CHU en fonction de leur lieu de résidence, même si le CHU de recours est le CHU de Caen.
Avec la création du GHT Groupement Hospitalier Mont-Saint-Michel, la coopération entre les centres hospitaliers qui le composent est amenée à s’intensifier et à se pérenniser.
Dans ce contexte, le CHAG souhaite développer une conciliation médicamenteuse ciblant les patients orientés vers des SSR du GHT. L’enquête nationale de 2015 sur le déploiement de la conciliation dans les établissements de santé français (8) ainsi que le projet Med’Rec (42) permettent d’identifier des prérequis à ce déploiement :
• la mise en place de la conciliation est un élément d’une démarche globale de sécurisation. Ce travail comprend donc une démarche d’analyse des risques associés à la transmission de l’information sur les traitements. L’ensemble de la démarche est effectué en collaboration avec le pharmacien Responsable du Système de Management de la Qualité de la Prise en Charge Médicamenteuse.
• le déploiement et l’organisation de cette activité doit bénéficier de ressources adaptées,
• une priorisation est nécessaire : cette priorisation consiste à se focaliser sur les patients admis en SSR, supposés vulnérables en raison de leur âge, pathologies et conditions sociales. La pertinence de cette priorisation sera mise en perspective avec le mode de priorisation actuellement en vigueur dans l’établissement pour les autres patients conciliés.
38 • la gouvernance de l’hôpital doit soutenir le projet : le président de la Commission Médicale d’Etablissement s’est impliqué dans l’information des médecins sur la mise en place du projet,
• les professionnels de santé de ville sont impliqués dans le projet (réunion d’information réalisée en juin 2016),
• une formation est requise : une formation à cette activité a été assurée par le pharmacien référent de la Conciliation Médicamenteuse dans l’établissement,
• des outils, y compris informatiques, ont été formalisés (procédures et module dédié dans PHARMA ®).