HAL Id: dumas-01716729
https://dumas.ccsd.cnrs.fr/dumas-01716729
Submitted on 24 Feb 2018HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Protocole d’optimisation hémodynamique peropératoire
en chirurgie de reconstruction maxillo-faciale par
lambeau libre : impact en termes de réduction des
complications péri-opératoires globales
Pierre-Antoine Duvignaud
To cite this version:
Pierre-Antoine Duvignaud. Protocole d’optimisation hémodynamique peropératoire en chirurgie de reconstruction maxillo-faciale par lambeau libre : impact en termes de réduction des complications péri-opératoires globales. Médecine humaine et pathologie. 2018. �dumas-01716729�
Université de Bordeaux U.F.R DES SCIENCES MEDICALES
Année 2018 N° : 3005 Thèse pour l’obtention du
DIPLOME D’ETAT de DOCTEUR EN MEDECINE Présentée et soutenue publiquement
Le 16 janvier 2018 à Bordeaux Par Pierre-Antoine DUVIGNAUD Né le 10 mai 1988 à Mende, Lozère
Protocole d’optimisation hémodynamique peropératoire en
chirurgie de reconstruction maxillo-faciale par lambeau libre : impact
en termes de réduction des complications péri-opératoires globales
Directeur de thèse :
Madame le Docteur Isabelle ETCHEBARNE Rapporteur :
Monsieur le Professeur Matthieu BIAIS Jury :
Madame le Professeur Karine NOUETTE-GAULAIN Président Madame le Professeur Claire MAJOUFRE Juge Monsieur le Professeur Matthieu BIAIS Juge Monsieur le Docteur Erwan DE-MONES-DEL-PUJOL Juge Monsieur le Docteur Laurent SOUBIRON Juge
Remerciements
A Madame le Professeur Karine NOUETTE-GAULAIN, Président du Jury Professeur des Universités, Praticien Hospitalier, Chef de service,
Je vous remercie de m’avoir fait l’honneur de présider ce jury de thèse. Durant mon cursus, j’ai pu apprécier vos qualités tant médicales et académiques que personnelles. Malgré vos nombreuses obligations, votre disponibilité et votre sens de l’écoute sont un exemple. Soyez assurée de ma reconnaissance et de mon profond respect.
A Madame le Professeur Claire MAJOUFRE, Membre du Jury Professeur des Universités, Praticien Hospitalier, Chef de service,
Je vous remercie d’avoir accepté de juger mon travail. Vos compétences chirurgicales et votre expertise sur le sujet sont une valeur ajoutée pour l’évaluation de mon travail. Soyez assurée de mon profond respect.
A Monsieur le Professeur Matthieu BIAIS, Rapporteur et Membre du Jury Professeur des Universités, Praticien Hospitalier, Chef de service,
Je te remercie d’avoir accepté de rapporter ma thèse malgré tout le travail que tu as déjà. Je n’ai pas eu la chance de travailler à tes côtés, mais j’ai pu apprécier la grande qualité de ton enseignement universitaire. Ton esprit de synthèse est un bonheur qui rend simple même les sujets les plus complexes. Soit assuré de mon estime la plus sincère.
Monsieur le Docteur Erwan DE-MONES-DEL-PUJOL, Membre du Jury Praticien Hospitalier,
Je vous remercie d’avoir accepté de juger mon travail. J’ai pu apprécier lors de mon stage au CFXM votre rigueur et votre bienveillance. Soyez assuré de mon respect.
Monsieur le Docteur Laurent SOUBIRON, Membre du Jury Praticien Hospitalier, Responsable d’Unité Médicale,
Je n’ai pas eu la chance de travailler à vos côtés mais vous remercie de l’enthousiasme avec lequel vous avez accepté de juger mon travail. Soyez assuré de ma reconnaissance.
Madame le Docteur Isabelle ETCHEBARNE, Directrice de Thèse et Membre du Jury Praticien Hospitalier,
Je te remercie de m’avoir proposé ce travail et de m’avoir guidé tout au long de ce projet. Ta disponibilité, tes conseils avisés et ta bonne humeur ont été très précieux. J’ai beaucoup aimé
travailler à tes cotés et rêver un peu à chacun de tes récits de voyage. Sincèrement, merci pour tout.
Un grand merci à tous ceux qui m’ont permis de mener à bien ce travail.
- A Karine, Beatrix, Frédérique, Antoine, Marie-Christine, Amélie, Carlos, Lydia,
Bernard, Monique, Laurent, Robert et Jeanne, ainsi qu’aux internes du service qui ont accepté avec gentillesse de s’impliquer dans ce travail et d’inclure mes patients.
- Aux IADEs du CFXM : pour votre aide précieuse pour le recueil des données
périopératoires, mais surtout pour votre gentillesse et votre bonne humeur.
- A Imène, Annie et Nathalie pour leur travail de fourmi dans les méandres des archives
du CHU.
- A mes relectrices : Cécile et Isabelle qui ont eu beaucoup de travail. A ceux qui m’ont tout appris pendant ces 5 années
A toutes les équipes médicales et paramédicales qui m’ont accueilli en stage depuis le tout début de mon internat :
L’équipe d’Arcachon, les équipes du bloc et de la réanimation de Périgueux, d’anesthésie et réanimation cardiaque, de la maternité, de l’orthopédie, du CFXM, du pédiatrique, du digestif, de réanimation médicale et enfin du thoracique.
A tous mes co-internes sans qui les choses auraient été moins agréables.
A ceux qui ont beaucoup compté :
A Chloée avec un « e », Nathan, Karim et Sébastien pour ce merveilleux semestre que nous avons passé à Périgueux. Vous n’êtes pas pour rien dans le choix que j’ai fait aujourd’hui. Au Dr Antoine D. parce que tu m’as toujours impressionné par tes compétences, ta pédagogie, ta gentillesse et ta disponibilité. Qu’il me soit donné la possibilité de t’arriver un jour à la cheville.
A Arnaud, Simon et Philippe parce que nous étions une vraie équipe.
A Suzanne parce que tu resteras pour moi un exemple tant sur le plan clinique que pour tes qualités humaines. Sincèrement, merci ...
Remerciements particuliers,
A mes parents.
Pour votre soutien infaillible pendant toutes ces années. Je ne serais pas là sans vous aujourd’hui. Ma réussite est aussi la vôtre. Cette thèse vous est dédiée...
A Cécile,
Pour tous les merveilleux moments que j’ai passé avec toi. Pour m’avoir si bien soutenu durant toutes ces années. Tu me rends chaque jour un peu meilleur. Je suis fier et impatient de poursuivre mon chemin à tes cotés.
Merci également à ta famille de m’avoir accueilli si chaleureusement.
A Alexandre,
Parce que tu as toujours un peu joué le rôle du lièvre, que je n’ai jamais pu rattraper. N’oublie pas de te retourner de temps en temps.
A ma famille,
Mes oncles, tantes et cousin(e)s. Mais aussi mes grands-parents partis trop tôt.
A mes amis d’ici et d’ailleurs,
Anthony, Carlyne, Julien S, Pierre-Henri, Victor, Alexis, Thomas, Alexandre, Valérie et Bertrand, Julian et Aurélia, Fanny, Mareva et Rudy, Anne-Sophie et Thibaut, Les CoCo, Chloée (avec un «e »), Nathan, Karim, Lisa, Fabien et Julien D les inséparables, Suzanne, Arnaud, Simon et Philippe.
Que de bons moments passés ensemble. Notre amitié s’est soudée dans la joie mais aussi dans l’adversité. J’espère maintenant vous revoir plus souvent.
Table des matières
Table des illustrations... 6
Liste des abréviations ... 7
Introduction ... 8
I- Prise en charge hémodynamique per-opératoire en chirurgie de lambeaux libres ... 11
1. Pourquoi s’agit-il d’une chirurgie à risque ? ... 11
2. La gestion hémodynamique jusqu'à présent ... 13
3. Quelle prise en charge hémodynamique des lambeaux libres en 2017 ? ... 15
a. Goal-directed fluid thérapie ... 15
b. Rationnel sur l’usage des vasopresseurs ... 18
II- Protocole d’optimisation hémodynamique peropératoire en chirurgie de reconstruction maxillo-faciale par lambeau libre : impact en termes de réduction des complications péri-opératoires globales ... 22 1. Contexte et justification ... 22 2. Hypothèse de recherche ... 23 3. Matériel et méthode ... 24 a. Design de l’étude ... 24 b. Population étudiée ... 25 c. Intervention ... 25
d. Recueil des données ... 27
e. Critères de jugements ... 28
f. Analyse statistique ... 29
g. Considérations éthiques ... 30
4. Résultats ... 31
a. Population étudiée ... 31
b. Evolution des paramètres et prise en charge peropératoire ... 34
c. Evolution post-opératoire et survenue des complications ... 36
5. Discussion ... 40 6. Conclusion ... 46 III- Conclusion ... 47 Références bibliographiques ... 48 Annexes ... 51 Serment médical ... 54 English abstract ... 55 Résumé en français ... 56
Table des illustrations
Figure 1 : Volume d'éjection systolique (VES) en fonction de la précharge (POD : pression
dans l'oreillette droite) (SFAR 2012) ... 16
Figure 2 : Titration du remplissage guidée par le monitorage de la variation du volume d'éjection systolique (VES) (SFAR 2012) ... 17
Figure 3 : Déterminant du score composite de complications post-opératoires ... 28
Figure 4 : Diagramme de flux ... 31
Figure 5 : Score composite de complications post-opératoires... 36
Figure 6 : Détails des complications post-opératoires par catégories ... 37
Tableau 1 : Caractéristiques de la population ... 32
Tableau 2 : Caractéristiques de la chirurgie ... 33
Tableau 3 : Balance hydrique et données hémodynamiques peropératoires ... 34
Tableau 4 : Observance du protocole d'optimisation hémodynamique peropératoire ... 35
Tableau 5 : Paramètres ventilatoires peropératoires ... 36
Tableau 6 : Score composite global et complications post-opératoires par catégories ... 38
Tableau 7 : Taux de reprise chirurgicale et durée de séjour ... 39
Annexe 1 : Score de risque cardiaque de Lee (SFAR 2011) ... 51
Annexe 2 : Algorithme de prise en charge du coronarien avant une chirurgie non cardiaque (SFAR 2011) ... 51
Annexe 3 : Classification KDIGO 2012 ... 52
Annexe 4 : Critères diagnostiques de SDRA selon la définition de Berlin 2012 ... 52
Annexe 5 : Stades de gravité du SDRA selon la définition de Berlin 2012 ... 53
Liste des abréviations
VADS : Voies Aéro-Digestives Supérieures INCa : Institut National du Cancer
BPCO : Broncho-Pneumopathie Chronique Obstructive PAM : Pression artérielle moyenne
FC : Fréquence cardiaque
VES : Volume d’éjection systolique
SFAR : Société Française d’Anesthésie Réanimation IVSE : Intra-veineuse à la Seringue Electrique. ECG : Electrocardiogramme
VNI : Ventilation non invasive
SDRA : Syndrome de détresse respiratoire aiguë NVPO : Nausées et vomissements post opératoires SIRS : Syndrome de réponse inflammatoire systémique ISO : Infection de site opératoire
IRA : Insuffisance rénale aiguë (selon la classification KDIGO) T2A : Tarification à l’activité
Vt : Volume courant
FiO2 : Fraction inspirée en oxygène FR : Fréquence respiratoire
PEEP : Pression expiratoire positive HEA : Hydroxy-éthyl-amidon
Introduction
L’usage de transferts tissulaires appelés « lambeaux » est devenu un des standards pour la reconstruction des pertes de substances importantes de la tête et du cou. Si ces techniques ont beaucoup évolué au cours des 50 dernières années, notamment grâce à leur usage dans le domaine militaire, c’est aujourd’hui principalement dans le domaine de la carcinologie et de la grosse traumatologie civile qu’elles sont utilisées (1,2) .
Les cancers des voies aérodigestives supérieures (VADS) sont, avec 11 600 nouveaux cas en France en 2015 dont 74% chez l’homme, au 5ème rang des cancers (3). Il s’agit dans 80% des
cas de carcinomes épidermoïdes dont l’exposition au tabac et à l’alcool sont les deux principaux facteurs de risque. Selon le stade, leur prise en charge peut associer chirurgie, radiothérapie et chimiothérapie. La prise en charge chirurgicale (glossectomie, pelvectomie, mandibulectomie interruptrice ou non, laryngectomie partielle ou totale avec exérèse en marge saines et curage ganglionnaire) bien qu’indispensable reste souvent très délabrante.
Par rapport à la carcinologie, les interventions post traumatologie civile sont moins fréquentes (moins de 5% des chirurgies). Il peut s’agir d’accidentologie routière ou balistique (accident de chasse, tentative d’autolyse par arme à feu, criminologie).
Dans les deux situations, les pertes de substance peuvent être très importantes et aller à l’encontre des nombreuses fonctions remplies par ces organes : phonation, mastication, déglutition, ventilation et protection des voies aériennes. La chirurgie de reconstruction est alors une intervention indispensable, tant sur un plan fonctionnel que social, qui impactera directement la qualité de vie future du patient.
Sur le plan technique, ces interventions sont réalisées sous anesthésie générale. Le malade est intubé préférentiellement par voie nasale afin de faciliter l’accès chirurgical dans les atteintes limitées. En cas de lésions plus étendues, une trachéotomie première est nécessaire afin de garantir la perméabilité post-opératoire de la filière respiratoire.
Dans le cas de la carcinologie, la phase de reconstruction est précédée par l’exérèse tumorale et le curage ganglionnaire. Pour la traumatologie, la reconstruction est fréquemment différée des interventions initiales de parage de la plaie et de préparation de la greffe.
Les lambeaux sont prélevés directement sur le patient lui-même. Il peut s’agir de lambeaux cutanés, myo-cutanés ou ostéo-myo-cutanés en cas de perte de substance osseuse. On parle de lambeaux pédiculés s’il n’y a pas de section du pédicule vasculaire (transfert par rotation) et de lambeaux libres dans le cas contraire. Les lambeaux libres nécessitent donc des anastomoses vasculaires microchirurgicales en regard du site opératoire receveur. La section du pédicule vasculo-nerveux se traduit également par une sympathectomie chirurgicale du lambeau dont découlent quelques spécificités propres à l’hémodynamique locale, sur lesquelles nous reviendrons plus tard. Il s’agit d’interventions complexes, dont la durée, bien que dépendante de l’expertise du chirurgien, peut dépasser les 8h.
Parce qu’ils permettent une grande variété d’options de transfert et qu’ils ont fait preuve d’un taux de succès très satisfaisant, les lambeaux libres ont une place importante dans les algorithmes de reconstruction de la tête et du cou.
En effet, en analysant une cohorte rétrospective de plus de 2300 lambeaux libres réalisés sur une période de 23 ans (1977 à 2000), Nakatsuka retrouvait un taux de succès croissant des lambeaux supérieurs à 93% (4). Malgré ces bons résultats, comparables aux autres équipes, les complications péri-opératoires restent cependant nombreuses. Suh en 2004 (Californie) et Bianchi en 2009 (Parme) retrouvaient ainsi 20 à 40 % de complications des sites opératoires et 10 à 30% de complications systémiques (5,6). Elles surviennent la plupart du temps dans les 3 premiers jours post opératoires et justifient ainsi une surveillance initiale rapprochée, au minimum en Unité de Soins Continus.
Parmi les complications des sites opératoires, on retrouve notamment des complications vasculaires, hémorragiques, infectieuses et œdémateuses. Au niveau systémique, elles sont plutôt d’ordre cardiovasculaires, respiratoires et nutritionnelles, et sont aggravées par l’éthylo-tabagisme, terrain fréquemment présent dans cette population.
Bien qu’elles ne soient pas les plus fréquentes (2 à 7 % des sujets), les complications vasculaires sont les plus péjoratives sur le pronostic du lambeau, puisqu’elles ont souvent pour conséquence la nécrose partielle ou totale du greffon. L’origine ischémique de cette nécrose peut être liée à plusieurs mécanismes : thrombose d’origine vasculaire, compression extrinsèque du pédicule ou bas débit général.
Parmi les nombreux paramètres sur lesquels nous pouvons intervenir en anesthésie (ventilation protectrice, antibioprophylaxie, titration de l’hypnose et de l’analgésie…), l’optimisation de l’hémodynamique locale et générale revêt dès lors une importance toute particulière. Il s’agit certainement d’un des axes centraux sur lequel nous devons nous concentrer afin de réduire ce taux de complications.
Afin de mieux appréhender cela, nous traiterons d’abord des spécificités de la prise en charge hémodynamique peropératoire dans ces chirurgies. Pour cela, nous allons développer dans un premier temps les raisons qui en font une chirurgie à risque. Puis nous reviendrons sur l’historique des pratiques dans ce domaine. Et enfin nous verrons les évolutions récentes qui, comme nous en avons fait l’hypothèse, pourraient réduire de façon significative la survenue de toutes ces complications.
Nous présenterons dans la seconde partie l’étude que nous avons réalisée afin d’évaluer l’impact de ces changements sur la réduction des complications périopératoires globales, deux ans après la mise en place d’un nouveau protocole tenant compte de toutes ces évolutions.
I- Prise en charge hémodynamique per-opératoire en chirurgie
de lambeaux libres
1. Pourquoi s’agit-il d’une chirurgie à risque ?
Afin de répondre à cette question, il convient de revenir dans un premier temps sur le terrain de ces patients. Comme nous l’avons évoqué précedemment, les principaux facteurs de risque retrouvés en carcinologie des VADS sont l’éthylisme et le tabagisme, l’action des deux se renforçant de manière synergique (INCa 2016)(3). Au delà de la carcinologie, ces intoxications ont bien d’autres conséquences.
D’un point de vue cardiovasculaire d’abord, elles favorisent la survenue de maladies athéromateuses, mais également de cardiomyopathies éthylo-induites. Bien qu’il s’agisse d’une relative urgence thérapeutique, la consultation d’anesthésie est alors un moment privilégié pour optimiser la détection et la prise en charge de ces addictions et de leurs conséquences. Cela passe par une évaluation adaptée, avec la réalisation si nécessaire d’une échocardiographie pour explorer une insuffisance cardiaque ou un souffle non connu, mais également avec l’indication d’une échographie de stress en fonction du score de Lee (7) (Annexes 1 et 2). Cependant, l’obtention de ces examens complémentaires ne doit pas retarder la prise en charge chirurgicale. Ces données peuvent nous permettre d’adapter notre prise en charge hémodynamique peropératoire afin de limiter la survenue d’une complication ischémique, congestive ou rythmique.
Sur le plan respiratoire ensuite, il s’agit volontiers de patients bronchopathes et souvent non diagnostiqués. Ils sont particulièrement exposés au risque de décompensation de BPCO, à la faveur d’une trachéo-bronchite ou d’une pneumopathie, d’autant plus que leurs capacités d’expectoration sont limitées en post-opératoire. Ces évenements sont d’autant plus fréquents que la durée de ventilation a été prolongée ou que le patient présente un encombrement important. Il est donc important de garder à l’esprit l’impact respiratoire potentiel de notre prise en charge hémodynamique, et notamment d’un remplissage
Il faut également évoquer l’événement intercurrent dont souffrent ces patients. Qu’il s’agisse de carcinologie ou de grosse traumatologie, on se retrouve dans les deux cas confronté à un important risque nutrionnel.
L’amaigrissement récent, synonyme de dénutrition est une composante classiquement retrouvée dans les néoplasies actives. Elle est liée en partie à la toxicité de certaines de nos thérapeutiques (chimiothérapie), mais également à l’effet anorexigène secondaire aux modifications hormonales induites par la masse tumorale elle-même. L’altération des fonctions mécaniques de mastication et déglutition, ainsi que la douleur, aggravent cette situation.
Concernant la grosse traumatologie, ce risque est plutôt secondaire à la durée du séjour hospitalier ayant précédé l’intervention de reconstruction. En effet, après une hospitalisation souvent prolongée en réanimation, ils subissent généralement plusieurs interventions (parage des plaies, préparation des tissus), avant d’en arriver à la phase de greffe d’un lambeau. Cet état d’inflammation chronicisée et de catabolisme majore le risque infectieux et réduit les réserves myocardiques.
Enfin, le risque est lié à la chirurgie en elle-même. Ce sont des interventions longues et complexes que doivent réaliser nos confrères chirurgiens, durant lesquelles de nombreux paramètres vont compliquer notre gestion de l’hémodynamique. Parmi ceux-ci, on peut évoquer la multiplicité des sites opératoires : site d’exérèse ou de parage, site de curage ganglionnaire, site de prélèvement du lambeau. La multiplicité de ces sites rend difficile l’évaluation des pertes insensibles et du saignement, qui peut atteindre 1,5L. La réalisation d’un « juste remplissage » est alors un challenge.
A cela s’ajoute des concepts biaisés, mais encore bien ancrés de nos jours, traitant de la gestion du remplissage et des vasopresseurs dans ce type de chirurgie, que nous allons développer maintenant.
2. La gestion hémodynamique jusqu'à présent
La gestion hémodynamique peropératoire chez les patients devant bénéficier d’une intervention chirurgicale de la tête et du cou a longtemps souffert de certaines idées reçues. Il s’agissait, par exemple, de réaliser une « hypotension contrôlée » durant l’intervention afin de réduire le saignement, de limiter de façon très restrictive le remplissage vasculaire et d’écarter l’utilisation de toutes drogues à effet vasopresseur ou transfusion de produits sanguins (5,8–11).
Ces idées ont été confortées avec l’émergence de l’évidence base médecine par la mauvaise interprétation de travaux réalisés sur des modèles animaux ou dans des conditions et avec des protocoles souvent éloignés des conditions réelles.
Ainsi, en 2000, Godden (9) émet l’hypothèse que l’anastomose chirurgicale d’un lambeau libre sur une artère fémorale la rend plus sensible aux vasopresseurs et aux spasmes. Pour cela, il réalise sur des artères fémorales de rats l’anastomose d’un lambeau libre de leur truffe. Il compare ensuite à une et deux semaines de la chirurgie le niveau de vasoconstriction des artères fémorales anastomosées à ces lambeaux, par rapport à un groupe contrôle qui n’a pas subi cette anastomose. Pour cela, le protocole prévoit l’explantation d’une portion d’artère fémorale en distalité de l’anastomose, et l’exposition directe in vitro à des doses croissantes de phenyléphrine (jusqu'à 100 M). Il constate que par rapport au groupe contrôle, la vasoconstriction de l’artère anastomosée (sympathectomisée lors de la chirurgie initiale) est plus importante, et que cette vasoconstriction est inhibée par l’usage d’un alpha bloquant. Cette hypersensibilité serait donc médiée par ces récepteurs, probablement surexprimés depuis la sympathectomie.
De ce concept, et malgré l’absence d’étude clinique bien construite montrant l’association entre usage adapté de vasopresseurs et complications vasculaires, la profession retiendra que l’usage de ces drogues est contre-indiqué dans ces chirurgies, et beaucoup d’établissements vont bannir leur utilisation dans le domaine (8,12).
Les anesthésistes se retrouvent alors confrontés, dans des situations d’instabilité hémodynamique chez des patients aux multiples comorbidités, à devoir majorer les apports hydriques. Dès lors, apparaissent des travaux alertant sur les conséquences d’un excès de remplissage, notamment sur la survie du lambeau pour les reconstructions de la tête et du cou (Haughey 2001) (13) , mais également en chirurgie mammaire (14,15). Ainsi, Booi en 2011, constate dans une étude rétrospective sur une centaine de lambeaux libres en chirurgie de reconstruction mammaire que le taux de reprises chirurgicales et d’échecs des lambeaux est statistiquement corrélé au volume de remplissage, avec une augmentation des cas de thrombose veineuse du lambeau. Le mécanisme suspecté était une compression extrinsèque du pédicule, par la majoration de l’œdème au niveau du greffon. On s’oriente alors vers une politique de remplissage très restrictive.
Les résultats de ces différentes publications ont semé un certain flou sur nos pratiques. Cet héritage, essentiellement basé sur des principes physiologiques théoriques, a généré des comportements relevant plus de l’habitude de service que de la médecine factuelle.
Comme l’a constaté Gooneratne en 2011 (11), ils sont encore bien ancrés aujourd’hui. En effet, dans son étude, réalisée après une analyse approfondie de la littérature, il se propose d’évaluer les croyances et pratiques de 73 centres, pratiquant régulièrement ce type d’interventions, dans tout le Royaume Uni. Il constate que 50% de nos collègues pratiquent un remplissage très restrictif, visant un bilan entrées-sorties inférieur à 2L dans le cas d’une chirurgie de 12h. En cas d’hypotension, 35% considèrent le remplissage par cristalloïdes en fluid challenge comme contre-indiqué, 19% contre-indiquent les colloïdes et 62% les produits sanguins. L’argument opposé était le risque œdémateux pour les cristalloïdes et les colloïdes, et l’hypothétique effet prothrombogène pour les produits sanguins. De plus, même en cas de nécessité, 14% contre-indiquent l’éphédrine, 32% la néosynéphrine et 46% la noradrénaline. S’ils n’ont pas le choix, ils utilisent préférentiellement (70%) un alpha/béta agoniste.
C’est ainsi que Gooneratne fait le constat d’une hétérogénéité de prise en charge, avec des croyances parfois divergeantes, mais pouvant s’expliquer par la succession de politiques restrictives progressivement établies dans ce domaine avec finalement peu de moyens considérés comme surs pour répondre à une hypotension artérielle peropératoire.
Pourtant nous allons voir que nous avons des données suffisantes aujourd’hui pour permettre une approche plus rationnnelle de cette prise en charge hémodynamique.
3. Quelle prise en charge hémodynamique des lambeaux libres en
2017 ?
Dans ce chapitre, nous allons traiter dans un premier temps d’une approche plus rationnelle du remplissage. Dans un second temps nous verrons pourquoi les vasopresseurs ont toujours une place dans les chirurgies de reconstruction par lambeau libre.
a. Goal-directed fluid thérapie
L’objectif derrière l’idée d’optimiser l’hémodynamique est de maximiser le transport artériel en oxygène vers les tissus. Ce transport dépend de la saturation artérielle en oxygène, du taux d’hémoglobine et du débit cardiaque.
Le remplissage vasculaire est le principal outil que nous utilisons au bloc opératoire pour optimiser l’hémodynamique. Nous attendons, en réponse à ce remplissage, une augmentation de la pré-charge, du volume d’éjection systolique et donc du débit cardiaque. Cependant cette réponse dépend de nombreux paramètres : distribution du soluté au niveau des différents secteurs de l’organisme, fonction cardiaque de base, niveau de précharge ventriculaire avant remplissage (16,17). Traditionnellement et en l’absence de mesure directe du débit cardiaque, les anesthésistes ont appris à guider le remplissage vasculaire sur d’autres paramètres : pression artérielle, fréquence cardiaque, diurèse. Ces outils sont insuffisants, car ils ne nous permettent pas, dans la plupart des situations, de juger de la bonne efficacité du remplissage réalisé sur l’objectif recherché : l’augmentation du débit cardiaque.
On s’expose alors aux conséquences d’un excès de remplissage (augmentation inutile du travail myocardique, œdème tissulaire, altération de l’hématose), ou en cas de démarche restrictive, d’un défaut (hypovolémie et hypo perfusion d’organe) (18,19).
Dès lors, il a fallu développer d’autres outils afin d’appréhender plus finement la bonne réponse à ce remplissage.
Au cours des vingt dernières années, de nombreuses techniques ont été proposées. Elles sont pour la plupart basées sur l’interprétation des variations induites par les interactions cœur-poumon. Certaines techniques « prédictives » de la réponse au remplissage, comme la variation de la pression pulsée ou la variation du volume d’éjection ventriculaire (extrapolées à partir de l’analyse du contour de l’onde de pouls), ont prouvé leur fiabilité sous réserve du respect des nombreux critères de validité nécessaires à leur interprétation (17). Parmi ces critères, la généralisation des mesures de « ventilation protectrice » à petit volume courant (< 7 ml/kg), est la principale limite au bloc opératoire (20,21).
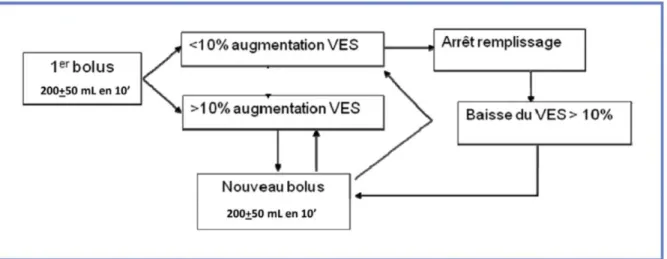
La stratégie alternative proposée a alors été d’observer la réponse à l’administration d’un faible volume de soluté. C’est le concept de « fluid challenge ». Il consiste à titrer le remplissage par l’administration répétée de petits volumes de soluté, en observant l’effet de cette expansion sur le volume d’éjection systolique. L’idée est de maximiser celui-ci, sans tomber dans l’excès, et de se trouver ainsi dans une zone de pré-charge indépendance, où le rapport travail myocardique / rendement (et donc débit cardiaque) est optimal (Figure 1) (16,22).
Figure 1 : Volume d'éjection systolique (VES) en fonction de la précharge (POD : pression dans l'oreillette droite) (SFAR 2012)
Plusieurs études prospectives, randomisées et contrôlées, comparant un remplissage vasculaire « traditionnel » à un remplissage guidé sur ces critères quantitatifs (notamment la mesure du volume d’éjection systolique : VES) ont permis de montrer un bénéfice en termes de morbi-mortalité en chirurgie lourde, orthopédique et digestive (23–25).
Le protocole le plus souvent utilisé consiste en l’administration d’un bolus de 250mL de fluide sur une période de 10 min et d’observer la variation du VES. Ces bolus sont alors répétés tant que l’augmentation du VES est supérieure à 10%. A défaut, ils sont interrompus, évitant un sur remplissage, et repris dès que le VES diminue de plus de 10% (Figure 2).
Figure 2 : Titration du remplissage guidée par le monitorage de la variation du volume d'éjection systolique (VES) (SFAR 2012)
Les bénéfices apportés sur la réduction des complications post-opératoires sont certainement généralisables aux autres chirurgies très invasives. Les recommandations de la SFAR et du National Institute of Clinical Excellence vont d’ailleurs dans ce sens (16,26). Comme nous l’avons vu précédemment, les chirurgies de reconstruction par lambeaux libres ont tous les critères (longueur d’intervention, terrain cardio-vasculaire, difficulté d’estimation des pertes insensibles et sanguines, conséquences d’un remplissage inadapté et taux de complications élevé) pour bénéficier de l’application de cette technique.
La mise en place d’une bonne perfusion tissulaire nécessite deux composantes physiologiques. La première est une pression de perfusion suffisamment importante pour pousser le sang jusque dans les capillaires des organes. La deuxième est un débit cardiaque suffisamment important pour, non seulement générer cette pression, mais aussi permettre un débit local adapté à la délivrance de l’oxygène et des autres substrats nécessaires au métabolisme cellulaire (17).
Nous l’avons vu, l’optimisation de la volémie est donc essentielle. Traitons maintenant du rôle que peuvent jouer les vasopresseurs.
b. Rationnel sur l’usage des vasopresseurs
La relation qui lie débit de perfusion et pression de perfusion n’est pas linéaire, puisqu’il dépend également des résistances à l’écoulement sanguin selon l’équation : Q= P/R. Ces résistances varient notamment avec le degré de vasoconstriction et la variation de l’hématocrite (viscosité sanguine) selon la Loi de Poiseuille (Q = P x ( R )/(8 L)).
Comme nous venons de le voir, l’usage des solutés de remplissage nous permet essentiellement d’optimiser le débit cardiaque. L’impact des agents vasopresseurs est quant à lui probablement double. Il permet, par la vasoconstriction induite, de recruter une partie du volume plasmatique non contraint (essentiellement splanchnique) et donc d’optimiser le débit cardiaque par un « effet remplissage ». Mais il peut permettre également de réguler le niveau de résistance, et donc le débit de perfusion à l’échelle tissulaire.
Comme nous l’avons évoqué précédemment, une des particularités des lambeaux libres est qu’ils subissent une sympathectomie chirurgicale lors de leur prélèvement (1). Il en découle une perte du tonus basal et des capacités vasomotrices locales contrôlées par le système nerveux autonome. Comme on peut le constater, par exemple, chez les traumatisés médullaire, il se développe secondairement une hypersensibilité aux amines, par externalisation de leurs récepteurs, afin de compenser la perte de ces capacités. C’est
(9). Cependant la mise en place de cette « compensation », si l’on en croit les différents travaux, nécessite jusqu'à une quinzaine de jours (12,27).
Après la publication par Godden de son étude objectivant une hypersensibilité aux amines vasopressives des lambeaux libres, beaucoup d’équipes les ont considérées comme contre-indiquées car favorisant le risque d’ischémie. Cependant, d’autres ont continué à les utiliser couramment (Monroe 2011, Hand 2011, Motakef 2015), et n’ont jamais pu établir d’association entre l’usage de vasopresseurs et l’augmentation du taux de complications ischémiques (8,12,28).
Partant de ce constat, Lecoq en 2008, a lui aussi publié une étude sur modèle murin, où il réalise une sympathectomie chirurgicale sur un lambeau épigastrique, et le compare au côté controlatéral (27,29). Il expose ses sujets à l’administration, systémique cette fois, de phénylephrine (10 g/kg) et de noradrénaline (10 g/kg) après administration d’un antagoniste alpha non sélectif (la prazosine). Il constate, en réponse aux vasopresseurs, une augmentation de la PAM, et une diminution lors des mesures doppler de la perfusion en regard du site témoin, alors que ces débits augmentent au niveau du lambeau qui a subi la sympathectomie. Lorsqu’il ajoute de la prazosine, qui diminue le tonus vasculaire basal, il constate pour les mêmes doses de noradrénaline, une augmentation moins importante de la PAM, et une augmentation moins importante également, mais cette fois-ci symétrique, du débit de perfusion tissulaire.
Les enseignements de cette étude sont particulièrement intéressants. En effet, comme nous l’avons vu, la sympathectomie est responsable d’une abolition du tonus basal. Ce phénomène est compensé par l’apparition d’une hypersensibilité du lambeau aux vasopresseurs dont le mécanisme est probablement médié par l’augmentation du nombre de récepteurs adrénergiques membranaires. Mais cette hypersensibilité est différée d’une à deux semaines. En per et post opératoire immédiat, le greffon est donc « protégé » de ce phénomène et bénéficie même d’une augmentation plus importante du débit local en réponse à une augmentation de PAM que le reste de l’organisme.
Ces conclusions ont été vérifiées par l’équipe d’Eley, lors d’un essai clinique chez l’homme (30). Il s’agit de lambeaux libres en reconstruction maxillo-faciale, avec exposition en post-opératoire immédiat à l’administration d’adrénaline, de noradrénaline, de dobutamine et de dopexamine. Les mesures transcutanées du flux capillaire, réalisées avec une sonde laser doppler mise en place en fin d’intervention au niveau du lambeau, sont comparées à un témoin au niveau du deltoïde. Les bénéfices en termes de perfusion du lambeau étaient plus marqués avec la noradrénaline. Mais l’autre intérêt de l’étude d’Eley est qu’elle nous apporte des détails sur le mécanisme modulant la perfusion tissulaire. En effet, lorsque l’on fait des enregistrements au laser doppler, on constate d’infimes oscillations du flux dans le temps. Ces oscillations peuvent être mesurées en fréquence et en amplitude. Les fréquences des oscillations sont associées aux mécanismes qui les génèrent : les battements cardiaques, les mouvements respiratoires, l’activité neurogénique vasculaire et l’activité myogénique du muscle lisse vasculaire. A une fréquence donnée, l’amplitude de l’oscillation traduit la part du mécanisme concerné par rapport au débit global. On peut donc, non seulement établir s’il y a une augmentation ou une diminution du débit de perfusion, mais également déterminer si cette variation a été influencée plutôt par la variation du débit cardiaque ou par la modulation des résistances vasculaires locales.
Dans cette étude, le débit local augmente parce que le gain apporté par la différence de pression est plus important que la diminution liée à l’augmentation des résistances locale sous l’effet des agents vasopresseurs (Q= P/R). Cela se traduit au doppler laser, par une augmentation de débit plus marquée dans le spectre fréquentiel traduisant l’activité du muscle lisse vasculaire.
Il semble donc que de faibles doses de noradrénaline (0,2 g/kg/min), en per et post opératoire immédiat de chirurgie de reconstruction par lambeau libre soit bénéfique au débit de perfusion tissulaire du lambeau. Ce bénéfice s’altère avec le temps et le développement d’une hypersensibilité aux agents vasopresseurs alpha adrénergique, secondaire à une augmentation locale du nombre de ces récepteurs, en réponse à une perte du contrôle vasomoteur lié au système nerveux sympathique.
Après cette analyse de la littérature et en accord avec les chirurgiens de notre structure, nous avons décidé de modifier notre gestion hémodynamique dans ces chirurgies, afin d’essayer de réduire la survenue des complications péri-opératoires.
Dans la deuxième partie de cette thèse, nous allons décrire ces changements, ainsi que l’étude que nous avons réalisée pour évaluer leurs impacts, sur notre taux de complications.
II- Protocole d’optimisation hémodynamique peropératoire en
chirurgie de reconstruction maxillo-faciale par lambeau libre :
impact en termes de réduction des complications
péri-opératoires globales
1. Contexte et justification
L’usage de « lambeaux » tissulaires est devenu un des standards pour les chirurgies de reconstruction des pertes de substances importantes que l’on peut rencontrer en carcinologie et grosse traumatologie maxillo-faciale et ORL (1,2). L’amélioration de la technique chirurgicale permet actuellement un taux de succès supérieur à 90% mais ces interventions restent marquées par de nombreuses complications (4–6). Parmi celles-ci, les complications vasculaires touchent entre 2 à 7 % des patients avec de lourdes conséquences sur le pronostic du greffon, puisqu’elles ont souvent pour conséquence la nécrose du lambeau. Sur le plan physiopathologique, elles s’expliquent par des mécanismes de thrombose vasculaire, de compression extrinsèque du pédicule ou de bas débit général.
De fait, la prise en charge hémodynamique durant ces chirurgies a toujours été très débattue et a connue des évolutions successives dans des directions parfois radicalement opposées. (5,8–11). Ainsi l’usage des vasopresseurs a longtemps été contre indiqué car ils été accusés de favoriser la nécrose des lambeaux (8,9,12). Les anesthésistes devaient alors, en cas d’instabilité hémodynamique, majorer les apports hydriques jusqu'à la publication de travaux alertant sur les conséquences d’un excès de remplissage sur la survie du greffon (13–15). On s’est alors réorienté vers une politique de remplissage beaucoup plus restrictive et une certaine tolérance des hypotensions.
Malgré des données suffisantes pour permettre une approche hémodynamique plus rationnelle, cet héritage explique l’hétérogénéité des croyances et conduites pour la prise en charge d’une hypotension artérielle peropératoire (11).
De nos jours, une des stratégies proposées pour optimiser le remplissage vasculaire est d’observer la réponse à l’administration d’un faible volume de soluté. C’est le concept de
cardiaque sans tomber dans un excès de remplissage pourvoyeur de complications (Figure 1) (16,22). Plusieurs études l’ayant appliquée en chirurgie lourde, digestive et orthopédique, montrent par rapport à un remplissage plus traditionnel, un bénéfice sur la morbi-mortalité (23–25). Les sociétés savantes, dont la SFAR, encouragent depuis l’application de cette méthode dans les autres chirurgies très invasives (16,26).
Concernant l’usage de vasopresseurs, une des particularités des lambeaux libres est qu’ils subissent une sympathectomie chirurgicale lors de leur prélèvement (1). Il en découle une perte du tonus basal et des capacités vasomotrices locales contrôlées par le système nerveux végétatif. Secondairement à la perte de ces capacités il se développe, en une quinzaine de jours, un phénomène de compensation par l’apparition d’une hypersensibilité aux amines (12,27). Durant cet intervalle, et donc en per et post opératoire immédiat, le greffon est « protégé » de ce phénomène. Il bénéficie même d’une augmentation plus importante du débit local en réponse à une augmentation de PAM, par l’administration d’agents vasopresseurs, que le reste de l’organisme (27,30).
Au cours de l’année 2015, après une analyse approfondie de la bibliographie dans ce domaine, nous avons travaillé à l’harmonisation des pratiques de chacun et la mise en place d’un protocole de prise en charge hémodynamique plus en accord avec les données actuelles de la littérature. Il existe malheureusement à l’heure actuelle peu de données traitant de l’impact d’un tel protocole sur les complications dans ces chirurgies. Nous avons donc souhaité évaluer l’effet de nos nouvelles pratiques sur le taux global de complications péri-opératoires.
2. Hypothèse de recherche
Nous avons émis l’hypothèse que la mise en place d’un nouveau protocole d’optimisation hémodynamique peropératoire associant titration du remplissage vasculaire et utilisation raisonnée des vasopresseurs pouvait permettre une réduction significative du taux global de complications péri-opératoires en chirurgie de reconstruction maxillo-faciale par lambeaux libres.
3. Matériel et méthode
a. Design de l’étude
Notre équipe est composée d’une vingtaine d’Anesthésiste-Réanimateurs, travaillant au sein du Centre François-Xavier Michelet, structure médico-chirurgicale faisant partie du site Pellegrin du Centre Hospitalo-Universitaire de Bordeaux. Nous exerçons dans un bloc opératoire de 12 salles, une unité de surveillance continue et une réanimation distincte spécialisée dans la prise en charge des grands brulés. Les activités chirurgicales proposées concernent, l’ophtalmologie, l’oto-rhino-laryngologie, la chirurgie maxillo-faciale, la chirurgie plastique et réparatrice, dont la chirurgie de la main.
Nous sommes fréquemment confrontés aux chirurgies de reconstruction par lambeaux, qui sont utilisées par nos confrères, en chirurgie plastique, ORL et Maxillo-faciale. L’activité représente ainsi environ une centaine de lambeaux libres par an.
Jusqu’alors dans notre service, l’évaluation hémodynamique et le remplissage vasculaire étaient faits de façon « traditionnelle ». Le monitorage hémodynamique était réalisé par un brassard à tension ou un cathéter artériel avec mesure de la pression invasive, un scope ECG 3 ou 5 brins et un oxymètre de pouls. L’abord vasculaire consistait en la pose d’une ou deux voies veineuses périphériques. Il existait une certaine variabilité de prise en charge en fonction du praticien, mais le remplissage vasculaire était généralement assez restrictif afin de limiter le risque d’œdème du lambeau. L’usage de vasopresseurs était également limité devant un hypothétique effet vasoconstricteur délétère au greffon. Enfin, le recours restreint à la transfusion était justifié par le risque pro-thrombotique local pouvant être favorisé par l’effet rhéologique des hématies.
Au cours de l’année 2015, après une analyse de la bibliographie dans ce domaine, nous avons travaillé à l’harmonisation de nos pratiques et la mise en place d’un protocole de prise en charge hémodynamique plus en accord avec les données actuelles de la littérature. Ce protocole est accès sur les deux points que nous avons évoqués précédemment : un
remplissage optimisé par une technique de titration et l’administration de vasopresseurs si nécessaires.
Nous avons donc réalisé une étude observationnelle, monocentrique, de type avant-après, pour évaluer l’impact de ce nouveau protocole de gestion hémodynamique sur la morbi-mortalité périopératoire.
b. Population étudiée
Les patients ayant bénéficié d’une chirurgie de reconstruction maxillo-faciale par lambeau libre au cours de l’année civile 2014 ont constitué notre groupe contrôle (« phase avant »). Le recueil des données de ce groupe a été réalisé de manière rétrospective sur dossier. Ils ont été comparés à une cohorte prospective constituée, après recueil du consentement oral, par les patients ayant bénéficié du même type d’intervention entre février 2016 et juin 2017 (« phase après »). Dans les deux groupes les patients ont été suivis jusqu'à leur sortie d’hospitalisation.
Nous avons défini comme critères d’inclusion la réalisation d’une chirurgie de reconstruction maxillo-faciale avec mise en place d’un lambeau libre.
Les critères d’exclusions étaient : le statut de mineur, la grossesse, la contre-indication ou l’échec à la mise en place du monitorage artériel invasif et le refus du patient.
c. Intervention
Lors de la phase « après », nous avons mis en place un protocole standardisé.
Le monitorage comprenait un ECG 5 brins, un oxymètre de pouls, et une sonde urinaire avec capteur thermométrique et compteur de diurèse horaire. Sur le plan tensionnel, le monitorage était réalisé par une mesure de tension artérielle non invasive lors de l’induction, puis la mise en place d’un cathéter artériel (préférentiellement radial, pose fémorale en seconde intention), associé à un capteur FloTrac et à un moniteur EV1000 (Société Edwards) permettant un monitorage du VES par analyse de l’onde de pouls. Les abords veineux étaient constitués d’au minimum deux voies veineuses périphériques, et éventuellement d’une voie veineuse centrale, selon le choix de l’anesthésiste. Les choix des drogues d’anesthésie, des paramètres ventilatoires et de l’analgésie postopératoire n’étaient pas contraints.
Le remplissage vasculaire était réalisé sur la base de 4 à 6 ml/kg/h, associé à une titration guidée par la mesure du VES selon le schéma proposé par la SFAR (Figure 2bis) (boli de 250 mL de fluide : cristalloïdes ou colloïdes au libre choix du praticien) (16).
Figure 2bis : Titration du remplissage guidée par le monitorage de la variation du volume d'éjection systolique (VES) (SFAR 2012)
En outre, nous avons fixé un objectif de PAM supérieure à 70 mmHg afin de favoriser la perfusion du lambeau. Pour cela, l’administration précoce de vasopresseurs (éphédrine en bolus, néosynéphrine ou noradrénaline IVSE) était réalisée si nécessaire après optimisation de la volémie.
Enfin l’antibioprophylaxie était réalisée dans le respect des recommandations actuelles (Amoxicilline et Acide Clavulanique ou Clindamycine et Gentamycine en cas d’allergie pour un durée de 48h) (31).
Le suivi post opératoire initial des patients était réalisé au sein de notre unité de surveillance continue, ou au sein de l’unité de réanimation des brulés (en cas de défaillance d’organe post-opératoire) afin d’intervenir le plus rapidement possible pour le diagnostic et la prise en charge des complications éventuelles. Ils étaient secondairement transférés en secteur d’hospitalisation chirurgicale conventionnelle après accord conjoint de l’anesthésiste et du chirurgien.
d. Recueil des données
Les données que nous avons recueillies concernaient la démographie de la population étudiée, la prise en charge peropératoire et l’évolution post-opératoire.
Concernant la démographie nous avons relevé, l’âge, le sexe, la taille, le poids, l’indice de masse corporelle (IMC), le score ASA (American College of Anesthesiology) ainsi que les différentes comorbidités (cardio-vasculaire, respiratoire, rénale, neurologique, hépatique, hématologique, métabolique …).
Concernant la prise en charge peropératoire nous nous sommes intéressés au type de chirurgie et de lambeau, au contexte chirurgical (carcinologie ou traumatologie, chirurgie première, reprise ou récidive à distance) et à la réalisation ou non d’une trachéotomie. Nous avons relevé la durée de l’intervention, les données hémodynamiques (FC, TA, SpO2, VES (phase après)), ventilatoires (volume courant, fréquence, FiO2, PEEP), les pertes sanguines, le volume transfusionnel et nature des produits utilisés, les types de solutés et les volumes de remplissage peropératoire, l’usage de vasopresseurs, leurs natures et posologies.
Enfin, durant la période postopératoire nous avons relevé toutes les complications entrant dans le cadre de notre score composite ainsi que la durée de séjour en USC et la durée de séjour intra-hospitalière totale.
e. Critères de jugements
Notre critère de jugement principal était un score composite de complications périopératoires (Figure 3). Nous l’avons établi en relevant les différents types de complications pouvant survenir à la suite de ces chirurgies (cardiovasculaire, respiratoire, locales …) et en stratifiant pour chacune d’elle, l’impact potentiel sur le devenir du patient.
Figure 3 : Déterminant du score composite de complications post-opératoires
ECG : Electrocardiogramme, VNI : Ventilation Non Invasive, SDRA : Syndrome de Détresse Respiratoire Aiguë (selon les critères de Berlin), NVPO : Nausées et Vomissements Post Opératoire, SIRS : Syndrome de Réponse Inflammatoire Systémique
Les insuffisances rénales étaient définies selon la classification KDIGO (Annexe 3). Le SDRA était défini selon les critères de Berlin (Annexe 4 & 5) (32). Pour les différents stades du sepsis nous avions utilisé l’ancienne définition du SEPSIS-2 (Annexe 6) car la nouvelle définition selon le SEPSIS-3 n’avait pas encore été publiée au moment de l’écriture du protocole d’étude (33).
Les critères de jugements secondaires concernaient les paramètres hémodynamiques peropératoires (PAM moyenne, temps sous les objectifs de PAM), le volume de remplissage, l’usage de vasopresseurs, le recours à la transfusion de produits sanguins labiles, la durée de séjour en unité de surveillance continue (USC) ou réanimation, la durée de séjour intra-hospitalière totale, ainsi que le respect du protocole (respect du fluid challenge et des objectifs tensionnels).
Nous avons également regardé de façon spécifique la survenue postopératoire d’ischémie, de nécrose partielle ou totale des lambeaux. L’ischémie était définie par la constatation clinique de signes d’hypo-perfusion du greffon (palette cutanée pâle, atone avec absence de saignement franc à la piqure ou à l’inverse palette cutanée tuméfiée, violacée avec saignement immédiat, abondant et rouge sombre), réversible avant le stade nécrotique, grâce à une prise en charge adaptée. La nécrose partielle était définie par la perte d’une partie du lambeau sans que cela remette en cause le succès de la reconstruction. La nécrose était qualifiée de totale si le volume infarci était incompatible avec son maintien en place, nécessitant une exérèse du greffon et une nouvelle reconstruction chirurgicale.
f. Analyse statistique
Les variables quantitatives ont été exprimées en médiane et écarts interquartiles lorsque les variables ne présentaient pas une distribution normale, en moyenne et écarts-types si la distribution était normale. Les variables qualitatives ont été exprimées en nombre et pourcentages. Les variables catégorielles ont été comparées par un test de χ2 ou un test
par un test de Mann-Whitney. Les ensembles assortis ont été analysés par un test de Wilcoxon.
Le score de complications moyen calculé sur un échantillon de 30 patients lors d’une étude préliminaire réalisée dans le service était de 5,6 (+/- 2,6). Nous avons calculé un nombre de sujet à inclure en se basant sur une réduction de 33% du score de complications (soit 1/3) dans le groupe « après », avec une puissance de 80%, un risque alpha de 5% et une réalisation des tests de façon bilatérale. Il nous fallait ainsi inclure 32 patients par groupe.
Les analyses statistiques ont été réalisées avec les logiciels MedCalc 1.4 (MedCalc Software, Ostend, Belgium) et GraphPad Prism version 6.00 (GraphPad Software, La Jolla California USA).
g. Considérations éthiques
Le protocole d’étude a reçu l’aval du Comité de Protection des Personnes du Sud Ouest et de l’Outre Mer III en février 2016 (Ref : DC 2016/13). Les données que nous avons recueillies sur tableur Excel (Microsoft ) et leurs traitements ont fait l’objet d’une déclaration à la Commission Nationale de l’Informatique et des Libertés (CNIL).
4. Résultats
a. Population étudiée
Figure 4 : Diagramme de flux
Comme le montre le diagramme de flux (Figure 4), nous avons repéré grâce aux codifications de la tarification à l’activité (T2A) et à notre logiciel de programmation du bloc opératoire (Opera®), 50 dossiers de reconstruction maxillo-faciale par lambeaux libres sur l’année 2014. Sur ceux-ci, 17 ont été exclus pour diverses raisons : 12 feuilles d’anesthésie
Durant la phase prospective (entre février 2016 et juin 2017), nous avons identifié 48 dossiers consécutifs éligibles. Quatorze patients n’ont pas bénéficié du nouveau protocole (et/ou n’ont pas eu de recueil des données peropératoires) par choix de l’anesthésiste ou difficultés de monitorage invasif et un a été annulé car il souffrait d’un carcinome mandibulaire infiltrant qui n’était finalement plus éligible à la chirurgie. Sur les 33 patients finalement inclus, aucun n’a été perdu de vue.
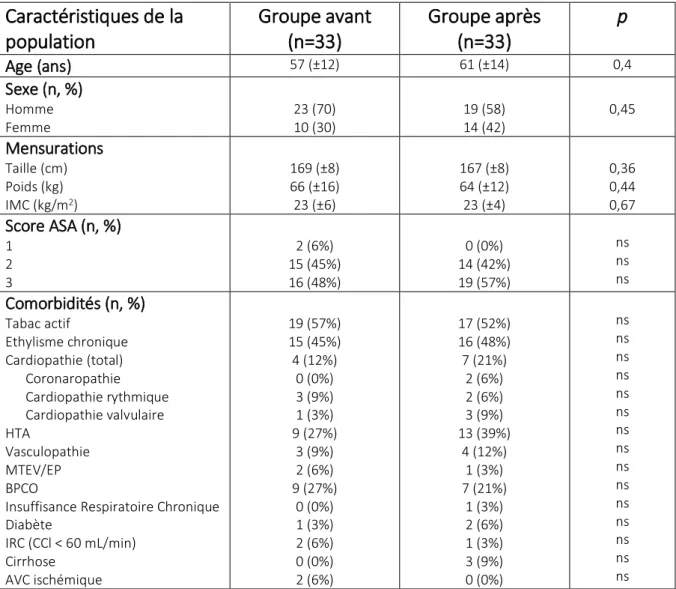
Le tableau 1 montre les caractéristiques de la population :
Caractéristiques de la
population
Groupe avant
(n=33)
Groupe après
(n=33)
p
Age (ans) 57 (±12) 61 (±14) 0,4 Sexe (n, %) Homme Femme 23 (70) 10 (30) 19 (58) 14 (42) 0,45 Mensurations Taille (cm) Poids (kg) IMC (kg/m2) 169 (±8) 66 (±16) 23 (±6) 167 (±8) 64 (±12) 23 (±4) 0,36 0,44 0,67 Score ASA (n, %) 1 2 3 2 (6%) 15 (45%) 16 (48%) 0 (0%) 14 (42%) 19 (57%) ns ns ns Comorbidités (n, %) Tabac actif Ethylisme chronique Cardiopathie (total) Coronaropathie Cardiopathie rythmique Cardiopathie valvulaire HTA Vasculopathie MTEV/EP BPCO
Insuffisance Respiratoire Chronique Diabète IRC (CCl < 60 mL/min) Cirrhose AVC ischémique 19 (57%) 15 (45%) 4 (12%) 0 (0%) 3 (9%) 1 (3%) 9 (27%) 3 (9%) 2 (6%) 9 (27%) 0 (0%) 1 (3%) 2 (6%) 0 (0%) 2 (6%) 17 (52%) 16 (48%) 7 (21%) 2 (6%) 2 (6%) 3 (9%) 13 (39%) 4 (12%) 1 (3%) 7 (21%) 1 (3%) 2 (6%) 1 (3%) 3 (9%) 0 (0%) ns ns ns ns ns ns ns ns ns ns ns ns ns ns ns
Tableau 1 : Caractéristiques de la population
Les résultats sont exprimés en moyenne avec écart-type entre parenthèses pour les variables quantitatives, en valeur absolue (n) et pourcentage (%)pour les variables qualitatives. IMC = Indice de masse corporelle, ASA = American College of Anesthesiology, HTA : Hypertension Artérielle, MTEV : Maladie thromboembolique veineuse, EP : Embolie Pulmonaire, BPCO :
Bronchopneumopathie Chronique Obstructive, IRC : Insuffisance Rénale Chronique, CCL : Clairance de la Créatinine, AVC : Accident Vasculaire Cérébral.
On ne retrouvait pas de différence statistiquement significative concernant les données démographiques et anthropomorphiques. Les moyennes d’âge étaient respectivement de 57 (±12) ans et 61 (±14) ans pour les groupes avant et après (p=0,4). Le score ASA et les comorbidités étaient comparables dans les deux groupes. On retrouvait un tabagisme actif supérieur à 50% et un éthylisme chronique chez près de la moitié de la population.
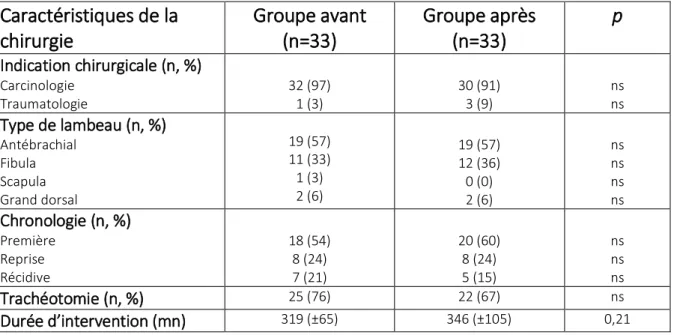
Le tableau 2 montre les informations concernant la chirurgie :
Caractéristiques de la
chirurgie
Groupe avant
(n=33)
Groupe après
(n=33)
p
Indication chirurgicale (n, %) Carcinologie Traumatologie 32 (97) 1 (3) 30 (91) 3 (9) ns ns Type de lambeau (n, %) Antébrachial Fibula Scapula Grand dorsal 19 (57) 11 (33) 1 (3) 2 (6) 19 (57) 12 (36) 0 (0) 2 (6) ns ns ns ns Chronologie (n, %) Première Reprise Récidive 18 (54) 8 (24) 7 (21) 20 (60) 8 (24) 5 (15) ns ns ns Trachéotomie (n, %) 25 (76) 22 (67) ns Durée d’intervention (mn) 319 (±65) 346 (±105) 0,21
Tableau 2 : Caractéristiques de la chirurgie
Les résultats sont exprimés en moyenne avec écart-type entre parenthèses pour les variables quantitatives, en valeur absolue (n) et pourcentage (%)pour les variables qualitatives.
Plus de 90 % des chirurgies étaient réalisées dans un contexte carcinologique (97% avant vs 91% après ; ns). Le type de lambeaux utilisés et la chronologie des interventions étaient comparables dans les deux groupes. La durée moyenne d’intervention était de 319 (±65) mn dans le groupe avant et 346 (±105) mn après (p=0,21).
b. Evolution des paramètres et prise en charge peropératoire
Les solutés administrés, la diurèse peropératoire, l’usage des vasopresseurs et les paramètres hémodynamiques peropératoires sont rapportés dans le tableau 3. En ce qui concerne le remplissage vasculaire, on retrouvait une augmentation significative du volume de remplissage par cristalloïdes (1945 (±437) ml vs 2680 (±925) ml ; p=0,0002). L’apport d’HEA était réduit de façon non significative (500 [0-500] ml vs 0 [0-500] ml ; p=0,06). Le taux de transfusion passait de 18% à 33% (p=0,26) sans qu’il soit constaté d’augmentation du volume des pertes sanguines peropératoires (350 [200-500] ml vs 300 (250-560] ml ; p=0,71). La diurèse peropératoire augmentait d’environ 30% avec 0,75 [0,5-1,1] ml/kg/h pour la phase avant versus 1 [0,9-2,1] ml/kg/h après (p=0,006).
Hémodynamique
Groupe avant
(n=33)
Groupe après
(n=33)
p
Remplissage vasculaire (mL) Cristalloïdes HEA 1945 (±437) 500 [0-500] 2680 (±925) 0 [0-500] 0,0002 0,06Usage de produits sanguins
Recours transfusion (n, %) CGR (U) PFC (U) CP (U) 6 (18) 0 [0-0] 0 [0-0] 0 [0-0] 11 (33) 0 [0-1] 0 [0-0] 0 [0-0] 0,26 ns ns ns Pertes sanguines (mL) 350 [200-500] 300 (250-560] 0,71 Diurèse (mL/kg/h) 0,75 [0,5-1,1] 1 [0,9-2,1] 0,006 Vasopresseurs Usage de vasopresseurs (n, %) Ephedrine (mg) Phenyléphrine (ug) Noradrénaline (ug) 22 (67) 6 [0-28] 0 [0-50] 0 [0-0] 33 (100) 30 [14-30] 450 [75-1310] 200 [0-2030] 0,0002 0,007 0,0001 < 0,0001 Paramètres hémodynamiques PAM moyenne (mmHg) PAM min (mmHg) PAM max (mmHg) FC moyenne (bpm) FC min (bpm) FC max (bpm) 68 (±6) 50 (±7) 99 (±14) 75 (±11) 59 (±8) 92 (±14) 71 (±7) 55 (±6) 95 (±13) 73 (±14) 61 (±10) 88 (±18) 0,05 0,006 0,19 0,5 0,4 0,2
Tableau 3 : Balance hydrique et données hémodynamiques peropératoires
Les résultats sont exprimés en moyenne avec écarts-type entre parenthèses pour les variables quantitatives à distribution normale, en médiane avec écarts interquartiles à 25 et 75% entre crochets pour les variables quantitatives à distribution anormale et en valeur absolue (n) et pourcentage (%)pour les variables qualitatives. U : Unité, HEA : Hydroxy-Ethyl-Amidon,
La mise en place d’un soutien vasopresseur était plus fréquente dans la phase après (67% vs 100% ; p=0,0002), avec un recours à des molécules plus puissantes telles que la Phényléphrine (0 [0-50] g vs 450 [75-1310] g ; p=0,0001) ou la Noradrénaline (0 [0-0] g vs 200 [0-2030] g ; p< 0,0001). Malgré tout, le niveau de PAM moyen ne différait que faiblement (68 ±6 mmHg vs 71 ±7 mmHg ; p=0,05) mais les épisodes hypotensifs étaient moins profonds (PAM min 50 ±7 mmHg vs 55 ±6 mmHg ; p=0,006). Les fréquences cardiaques moyennes étaient comparables (75 ± 11 bpm vs 73 ±14 bpm ; p=0,5).
Le tableau 4 montre l’observance du protocole d’optimisation hémodynamique dans le groupe après. Les objectifs fixés n’étaient pas parfaitement respectés. Un niveau de PAM > 70 mmHg était atteint pendant seulement 52 % du temps opératoire, versus 40 % durant la phase avant (p=0,46). L’algorithme de fluid challenge était bien réalisé pendant 80 % de la durée d’intervention. Enfin, si l’on couplait le respect des objectifs de PAM et la bonne réalisation du fluid challenge, le protocole était respecté durant 42 % du temps total d’intervention.
Observance du protocole
Groupe avant
(n=33)
Groupe après
(n=33)
p
Respect PAM > 70 mmHg (% de tps) Respect Fluid Challenge (% de tps) Respect couplé PAM et FC (% de tps)
40 (±23) - - 52 (±25) 80 (±15) 42 (±23) 0,46 - -
Tableau 4 : Observance du protocole d'optimisation hémodynamique peropératoire
Les résultats sont exprimés en moyenne avec écart-type entre parenthèses. % de tps : Pourcentage du temps opératoire total, PAM : Pression Artérielle Moyenne, FC : Fréquence Cardiaque.
Les données ventilatoires peropératoires sont rapportées dans le tableau 5. Les volumes courants et niveaux de FiO2 étaient comparables (Vt= 7±1 ml/kg de poids théorique vs 7±1 ; NS et FiO2= 50 % [45-56] vs 50 % [45-56] ; p=0,23). La fréquence respiratoire et le
Paramètres ventilatoires
Groupe avant
(n=33)
Groupe après
(n=33)
p
Volume courant (mL/kg poids
théorique) 7 (±1) 7 (±1) 0,99
Fréquence (c/mn) 12 (±1) 13 (±3) 0,003
PEEP (cmH2O) 5 [0-5] 6 [5-8] < 0,0001
FiO2 (%) 50 [45-56] 50 [45-50] 0,23
Tableau 5 : Paramètres ventilatoires peropératoires
Les résultats sont exprimés en moyenne avec écart-type entre parenthèses pour les variables quantitatives à distribution normale et en médiane avec écarts interquartiles 25-75 entre crochets pour les variables quantitatives à distribution anormale. Poids théorique selon la formule de Lorentz. PEEP : Pression Expiratoire Positive, FiO2 : Fraction inspirée en
oxygène, c/min : cycles par minute.
c. Evolution post-opératoire et survenue des complications
Le score médian de complications postopératoires était de 6 [5-7] points dans le groupe avant versus 3 [2-5] pts dans le groupe après (p< 0,0001) (Figure 5, Tableau 6), soit une diminution de près de 50% entre les 2 phases.
Figure 5 : Score composite de complications post-opératoires
Si l’on s’intéresse aux sous catégories, on constate une réduction significative des complications rénales (73% vs 12% ; p< 0,0001), cardio-vasculaires (42% vs 15% ; p=0,03), respiratoires (76% vs 46% ; p=0,02) et digestives (76% vs 46% ; p=0,02) (Figure 6, Tableau 6
et 7).
Figure 6 : Détails des complications post-opératoires par catégories
Les résultats sont exprimés en pourcentages du nombre de patients. * : p<0,0001, ** : p<0,05
Les complications rénales étaient majoritairement des insuffisances rénales aiguës fonctionnelles (Tableau 6). L’incidence des insuffisances rénales aiguë a diminuée de 73% lors de la phase avant à 12 % après (p<0,0001).
Le taux de complications cardio-vasculaires étaient de 42% avant versus 15% après (p=0,03) (Tableau 6). Il s’agissait pour la plupart de passages en fibrillation atriale. Un patient de la phase avant a présenté un choc mixte septique et hémorragique sur une pneumopathie et un saignement en regard du site opératoire. Aucun patient de la phase après n’a présenté
Ré na le Ca rdio -va scu lair e Re sp ira toir e Dig es tive Infe cti eu se Ne uro log iqu e Lo cale 0 2 0 4 0 6 0 8 0 1 0 0 A V A N T A P R E S * ** ** **
Complications post
opératoires
Groupe avant
(n=33)
Groupe après
(n=33)
p
Cardio-vasculaires (n, %) 1 pts 2 pts 3 pts 14 (42) 13 (39) 0 (0) 1 (3) 5 (15) 5 (15) 0 (0) 0 (0) 0,03 0,055 1 0,9 Respiratoires (n, %) 1 pts 2 pts 3 pts 25 (76) 17 (52) 7 (21) 1 (3) 15 (46) 10 (30) 3 (9) 2 (6) 0,02 0,12 0,3 0,9 Digestives (n, %) 1 pts 2 pts 3 pts 25 (76) 9 (28) 16 (48) 0 (0) 15 (46) 11 (33) 4 (12) 0 (0) 0,02 0,86 0,003 1 Infectieuses (n, %) 1 pts 2 pts 3 pts 24 (72) 20 (61) 3 (9) 1 (3) 16 (48) 17 (52) 1 (3) 0 (0) 0,08 0,06 0,6 0,9 Neurologiques (n, %) 1 pts 2 pts 3 pts 10 (30) 10 (30) 0 (0) 0 (0) 8 (24) 6 (18) 2 (6) 0 (0) 0,79 0,39 0,48 1 Rénales (n, %) 1 pts 2 pts 3 pts 24 (73) 13 (39) 11 (33) 0 (0) 4 (12) 4 (12) 0 (0) 0 (0) < 0,0001 0,02 0,15 1 Locales (n, %) 1 pts 2 pts 3 pts 23 (70) 7 (21) 12 (36) 4 (12) 20 (61) 13 (39) 5 (15) 2 (6) 0,67 0,18 0,09 0,67
Score composite Total (pts) 6 [5-7] 3 [2-5] < 0,0001
Souffrance du Lambeau (n, %) Signe d’ischémie Nécrose partielle Nécrose totale 9 (27) 4 (12) 4 (12) 4 (12) 1 (3) 2 (6) 0,22 0,36 0,67
Tableau 6 : Score composite global et complications post-opératoires par catégories
Les résultats sont exprimés en médiane avec écarts interquartiles à 25 et 75 % entre crochets pour les variables quantitatives et en valeur absolue (n) et pourcentage (%)pour les variables qualitatives. Score composite cf Figure 3.
Les complications respiratoires étaient moins fréquentes dans le groupe après (76% vs 46% ; p=0,02). Sans être statistiquement significatif, on remarquait des encombrements bronchiques moins fréquents et moins importants, avec une tendance à la réduction du taux de surinfections bronchiques, pneumopathies ou d’atélectasies (21% versus 9% ; p=0,3)