THÈSE
Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR de médecine et de pharmacie
Ischémie reperfusion en transplantation d’organes mécanismes et innovations thérapeutiques -IRTOMIT (Poitiers)
(Diplôme National - Arrêté du 7 août 2006)
École doctorale : Biologie-santé - Bio-santé (Limoges) Secteur de recherche : Biologie
Présentée par :
Vivien Aubert
Lésions d'ischémie-reperfusion rénale en transplantation : modélisation par agents des effets de l’oxygénation sur la dynamique cellulaire-tissulaire de l'inflammation et de la
fibrose
Directeur(s) de Thèse : Patrick Hannaert
Soutenue le 17 décembre 2015 devant le jury
Jury :
Président Omar Benzakour Professeur, IPBC, Université de Poitiers
Rapporteur Aurélie Edwards Chargée de recherche, Centre de recherche des Cordeliers, Paris Rapporteur Didier P. de La Garanderie Professeur et praticien hospitalier, Hopital Lariboisière, Paris
Membre Patrick Hannaert Chargé de recherche, CNRS-INSERM, Université POITIERS
Membre Thierry Hauet Professeur et praticien Hospitalier, Université de Poitiers Membre S. Randall Thomas Directeur de recherche CNRS, Université de Paris sud, Orsay
Pour citer cette thèse :
Vivien Aubert. Lésions d'ischémie-reperfusion rénale en transplantation : modélisation par agents des effets de l’oxygénation sur la dynamique cellulaire-tissulaire de l'inflammation et de la fibrose [En ligne]. Thèse Biologie. Poitiers : Université de Poitiers, 2015. Disponible sur Internet <http://theses.univ-poitiers.fr>
Université de Poitiers
École doctorale Biosanté
Équipe d
’accueil : INSERM U 1082 (IRTOMIT)
THÈSE
Pour l’obtention du grade de : DOCTEURDEL’UNIVERSITÉDEPOITIERS
Mention biologie
Présentée et soutenue par : Vivien A
UBERTLÉSIONS D
’ISCHÉMIE-REPERFUSION RENALE EN TRANSPLANTATION :
MODÉLISATION PAR AGENTS DES EFFETS DE L
’OXYGÉNATION
SUR LA DYNAMIQUE CELLULAIRE-TISSULAIRE
DE L
’INFLAMMATION ET DE LA FIBROSE
Directeur de thèse : Docteur Patrick H
ANNAERTSoutenue le 17 décembre 2015
Membres du jury :
Rapporteurs : Docteur Aurélie EDWARDS
Professeur Didier PAYEN DE LA GARANDERIE Examinateurs : Professeur Omar BENZAKOUR
Professeur Thierry HAUET
Docteur Randall THOMAS Directeur : Docteur Patrick HANNAERT
Résumé
En préservation-transplantation rénale, l’ischémie-reperfusion (IR) induit inflammation, fibrose, dysfonction et perte du greffon. Les évènements d’IR sont de mieux en mieux identifiés, mais leur complexité limite prédiction et thérapeutique. À partir d’une analyse bibliographique détaillée, nous proposons un modèle par agents de la réponse rénale aux lésions d’IR au niveau cellulaire/tissulaire, réalisé avec l’outil de modélisation NetLogo.
Dans un premier temps, nous développons un modèle dynamique de l’oxygénation du cortex rénal, avec apport et diffusion de l’oxygène (O2), et consommation dépendant de la filtration. Nous adaptons ce modèle à l’état stationnaire pour l’O2, puis nous couplons les niveaux de PO2 à l’état énergétique (ATP) des cellules épithéliales et endothéliales (avec voies aérobie et anaérobies). Le statut de viabilité cellulaire est lié au niveau d’ATP, aboutissant à une représentation semi-phénoménologique de la réparation/survie vs apoptose/nécrose. Enfin, nous explorons le destin cellulaire et tissulaire lors d’IR simulées, avec l’ajout progressif d’éléments clefs de l’inflammation (invasion tissulaire par leucocytes, signaux lésionnels, phagocytose) et de la fibrose (fibroblastes, collagène). L’évolution du modèle vers la résolution de l’inflammation/régénération du tissu ou vers la fibrose tissulaire est observée selon les conditions imposées (durée/intensité, ischémie vs hypoxémie).
Cette construction constitue le premier modèle des effets de l’oxygénation sur la dynamique cellulaire-tissulaire de l’inflammation-fibrose rénale en réponse à l’IR. À terme, elle permettra d’aborder clinique et thérapeutique de la conservation-transplantation rénale.
Mots-clés : modélisation par agents, rein, ischémie-reperfusion, hypoxie-réoxygenation, oxygène, inflammation, fibrose, mort cellulaire
Ischemia-Reperfusion Injury in Renal Transplantation: Agent-Based Modelling of the effects of Oxygenation on the Cell-Tissue Dynamics of Inflammation and Fibrosis
Abstract
In renal preservation-transplantation, ischemia-reperfusion (IR) causes graft inflammation and fibrosis, dysfunction and loss. Events involved in IR injury grow identified, but their intricacy hampers prediction and therapeutics. Based on a detailed bibliographical analysis, we propose an Agent-Based Model of renal response to IR injury at cell and tissue levels, created with the modeling tool NetLogo.
First, we develop and validate a dynamic model of the oxygenation of the renal cortex, featuring blood perfusion, oxygen diffusion, and oxygen consumption (driven by sodium filtered load and transport). We then adapt this model to oxygen steady-state, and PO2 level is coupled to energetic status (ATP) in epithelial and endothelial cells (aerobic and anaerobic pathways). Cell viability is coupled to ATP level, leading to a semi-phenomenological representation of repair/survival versus apoptosis/necrosis. Finally, we explore (and verify) cell and tissue fate during simulated IR sequences, with the gradual addition of key elements of inflammation (leukocytes infiltration, injury signals, phagocytosis) and fibrosis (fibroblasts, collagen). Model evolution toward the resolution of inflammation/tissue regeneration or toward tissue fibrosis is observed along imposed conditions (duration/intensity, ischemia vs hypoxemia). Results are compared to experiments from our laboratory.
This construction is the first model of the effects of oxygenation on cell-tissue dynamics during renal inflammation-fibrosis response to IR. Ultimately, it will allow to address clinical and therapeutic aspects of renal transplantation and conservation.
Keywords : agent-based model, kidney, ischemia-reperfusion, hypoxia-reoxygenation, oxygen, inflammation, fibrosis, cell death
Intitulé et adresse du laboratoire :
Centre Hospitalier Universitaire de Poitiers / INSERM1 U 1082 IRTOMIT2 CS 90577 / 2 rue de la Milétrie
86 021 Poitiers Cedex
1 Institut National de la Santé Et de la Recherche Médicale
Remerciements
Je tiens en tout premier lieu à remercier Thierry HAUET et Patrick HANNAERT pour m’avoir accordé leur confiance et donné l’opportunité de faire ce doctorat. Sans eux, cette recherche n’aurait pas été possible.
Un grand merci à mon directeur de thèse, Patrick HANNAERT. Il m’a guidé tout au long de ces années de travail. Ses connaissances dans des domaines très divers, son souci du détail et de la précision m’ont permis de bénéficier de conseils précieux, de nourrir ma réflexion, de clarifier ma pensée. Merci aussi pour toutes ces heures de discussions et pour ses encouragements.
Je remercie les professeurs Aurélie EDWARDS et Didier PAYEN de LA GARANDERIE d’avoir accepté d’être les rapporteurs de cette thèse. Merci pour le temps consacré à la lecture et à l’évaluation de ce travail.
Merci aux professeurs Omar BENZAKOUR et Thierry HAUET ainsi qu’au docteur Randall THOMAS qui ont accepté de faire partie du jury de cette thèse.
Merci à ma mère et à Jean-Claude qui m’ont permis de faire ces longues années d’études.
Merci aussi à Sébastien, Jacques, Delphine, François, Raphael et Fréderic pour leurs conseils scientifiques et techniques avisés.
Je remercie Solenne, Sylvain et Mohamed eux aussi doctorants et avec lesquels j’ai partagé de bons moments.
J’adresse mes remerciements au laboratoire et à toute l’équipe INSERM pour son accueil, son soutien et sa bonne humeur.
Merci beaucoup à Malika et Marithé qui m’ont soutenu durant la rédaction de ce travail.
Table des matie res
Table des matières ... 5
Table des figures... 10
Liste des tableaux ... 15
Abréviations ... 16
Préambule ... 18
Chapitre 1 : Contexte et notions ... 20
1. La modélisation par agents ... 21
1.1. Intérêts de la modélisation ... 21
1.2. Les modèles par agents ... 22
1.3. Définir un agent ... 25
2. Le rein ... 27
2.1. Le rein : un organe vital ... 27
2.2. Structure rénale ... 28
2.3. Néphrons et tubes collecteurs ... 29
2.4. Vascularisation rénale ... 31
2.5. Cortex ... 33
2.6. Médullaire ... 35
2.7. Interstitium et lymphatiques ... 36
3. L’ischémie-reperfusion et ses conséquences... 37
3.1. Transplantation, ischémie-reperfusion ... 37
3.2. Inflammation ... 42
3.2.1 Reconnaissance des lésions par le système immunitaire ... 43
3.2.2 L’endothélium vasculaire rénal ... 44
3.2.3 L’épithélium tubulaire rénal ... 45
3.2.4 L’interstitium ... 45
3.2.5 Les neutrophiles ... 46
3.2.6 Les macrophages ... 46
3.2.8 Les lymphocytes ... 48
4. Réparation / régénération tubulaire ... 49
5. Fibrose ... 52
5.1. Développement de la fibrose ... 53
5.2. Influences profibrotiques ... 54
5.3. Facteurs endogènes antifibrotiques ... 55
6. Modèles mathématiques de l’oxygénation rénale ... 55
7. Conclusion ... 56
Chapitre 2 : Matériel et méthodes ... 57
1. Les outils informatiques ... 58
1.1. L’environnement de modélisation ... 58
1.2. Les patches ... 59
1.3. Les tortues ... 60
2. Le corpus bibliographique ... 61
3. Les modèles exploratoires ... 61
4. Programme Draw-tissu ... 66
5. Modèles NetLogo 3D ... 66
Chapitre 3
: Modèle de l’oxygénation corticale... 68
1. Introduction ... 70
1.1. Renal hypoxia and renal pathology ... 70
1.2. Renal sensitivity to hypoxia and oxygen-related specificities ... 71
1.3. Renal oxygen consumption depends on filtration and transport ... 72
1.4. Anatomical, functional and oxygen heterogeneity in the kidney ... 73
1.5. Mathematical modeling of renal and regional oxygenation ... 74
1.6. Rationale and objective of the study ... 75
2. Results ... 76
2.1. Literature analysis, parameters and variables ... 76
2.2. Model verification ... 83
2.3. Parametric sensitivity analysis and I/O analysis ... 90
2.5. Model validation ... 102
2.6. Model exploitation and hypotheses ... 108
3. Discussion ... 113
3.1. Modeling choices ... 113
3.2. Bibliographical analysis and exploitation ... 114
3.3. Model verification and adjustments ... 115
3.4. Parameters, inputs and outputs ... 118
3.5. Model validation ... 124
4. Methods ... 129
4.1. Bibliographical analysis and data extraction ... 129
4.2. Units ... 130
4.3. Agent-based modeling and tools... 131
4.4. Structure and geometry of the Rat renal cortical model ... 132
4.5. Perfusion – Hemoglobin/O2– Diffusion – Consumption... 136
4.6. Modeling & simulation ... 143
4.7. Data handling and statistical calculations ... 144
5. Acknowledgments ... 145
6. References ... 146
7. Tables and Legends ... 157
8. Model tissues for RCM ... 179
9. House-keeping oxygen consumption in epithelial and other patches . 179 9.1. Epithelial patches (HK-QO2-EPI) ... 179
9.2. Other patches (HK-QO2) ... 181
10. Diffusion (programmed diffusion4 procedure)... 183
10.1. Patch-type DO2 ... 183
10.2. Exchange surface areas ... 183
10.3. Coding of diffusion... 184
11. Hemoglobin-O2 dynamics ... 184
12. Sensitivity analysis and I/O analysis ... 185
13. References ... 187
15. Conclusion ... 193
Chapitre 4
: Modèle à l’état stationnaire de l’oxygénation corticale .... 194
1. Mise en place du modèle ... 195
2. Vérification du modèle ... 200
3. Conclusion ... 201
Chapitre 5 : ATP dynamique ... 202
1. Métabolisme rénal ... 203
2. Modélisation des concentrations d’ATP et d’ADP ... 204
2.1. Consommation d’ATP liée aux transports de sodium ... 205
2.2. Consommation d’ATP HouseKeeping ... 206
2.3. Production d’ATP par la phosphorylation oxydative ... 206
2.4. Production d’ATP par voies anaérobies ... 207
3. Équations de bilan ... 208
4. Vérification du modèle ... 212
5. Gestion des vitesses de consommation et de production ... 212
6. Conclusion ... 213
Chapitre 6 : Module de survie cellulaire ... 214
1. Première approche de la survie cellulaire : modèle d’état cellulaire .. 215
2. Seconde approche de module de survie cellulaire ... 219
3. Conclusion ... 232
Chapitre 7 : Module Stress oxydant ... 233
1. Oxygène et espèces oxygénées réactives ... 234
1.1. Oxygène et espèces réactives ... 234
1.2. Stress oxydant et rein ... 235
1.3. La mitochondrie : source d’espèce réactive ... 238
1.4. Les défenses antioxydantes ... 240
1.5. Autres sources d’espèces réactives ... 241
2. Implémentation du module « stress oxydant » ... 241
4. Conclusion ... 247
Chapitre 8 : Module Inflammation-fibrose ... 248
1. Modèle par agents de l’inflammation et de la fibrose du poumon ... 249
2. Modèle inflammation-fibrose du cortex rénal ... 252
3. Comparaison du modèle vs données du laboratoire ... 257
4. Comportement du modèle ... 259 4.1. État normal ... 260 4.2. Récupération tissulaire ... 260 4.3. Régénération tissulaire ... 261 4.4. Lésion locale ... 262 4.5. Lésion globale ... 264 5. Conclusion ... 265
Chapitre 9 : Discussion ... 266
1. Validation et vérification des modèles... 267
2. Structure du tissu ... 268 3. Destin cellulaire ... 269 4. Stress oxydant ... 269 5. Inflammation ... 271 6. Régénération tissulaire ... 273 7. Interstitium et fibrose ... 273 8. Limites de NetLogo ... 274
Conclusion et perspectives ... 276
Bibliographie ... 278
Annexe 1 ... 290
Annexe 2 ... Erreur ! Signet non défini.
Annexe 3 ... 293
Table des figures
Figure 1 : Principaux composants d’un modèle par agents. ... 22 Figure 2 : Schéma de coupe sagittale de rein multilobaire / multipapillaire. ... 28 Figure 3 : Structure d’un néphron. Ce schéma ne représente pas certains détailles tel que la position exact de la macula densa. ... 30 Figure 4 : Conséquences de l’ischémie sur un greffon rénal (NFP : Non Fonction Primaire, RRF : Reprise Retardée de Fonction), (source iconographique : S. Giraud, IRTOMIT). ... 40 Figure 5 : Conséquences de la reperfusion sur un greffon rénal (Perico et al. 2004). ... 41 Figure 6 : Stimulation immunitaire induite par une séquence d’ischémie-reperfusion (source iconographique : S. Giraud, IRTOMIT). ... 44 Figure 7 : Mécanismes de réparation / régénération tissulaire épithéliale rénale. ... 50 Figure 8 : Altération et réparation des fonctions cellulaires du tubule proximal rénal après induction de lésions chimiques (Schnellmann & Kelly 1999). ... 51 Figure 9 : Coupe histologique présentant les 3 types de fibrose. Coloration Methenamine Silver / Masson trichrome. Barre d’échelle = 50 µm (Hewitson 2012). ... 52 Figure 10 : Mécanismes principaux de la fibrose rénale (Cho 2010). ... 55 Figure 11 : Structure des environnements ABM (« monde ») en fonction du mode d’enroulement. ... 60 Figure 12 A et B : Modèles exploratoires de tubules en coupe longitudinale. ... 62 Figure 13 A, B, C, D et E : Modèles exploratoires à différentes échelles. ... 64 Figure 14 : Comparaisons de différents modèles avec des coupes histologiques réelles (photos fournies par F. Favreau, IRTOMIT). ... 65 Figure 15 : Représentation de la PO2 et de la vitesse de diffusion d’O2 en gradients de couleurs dans NetLogo. ... 65
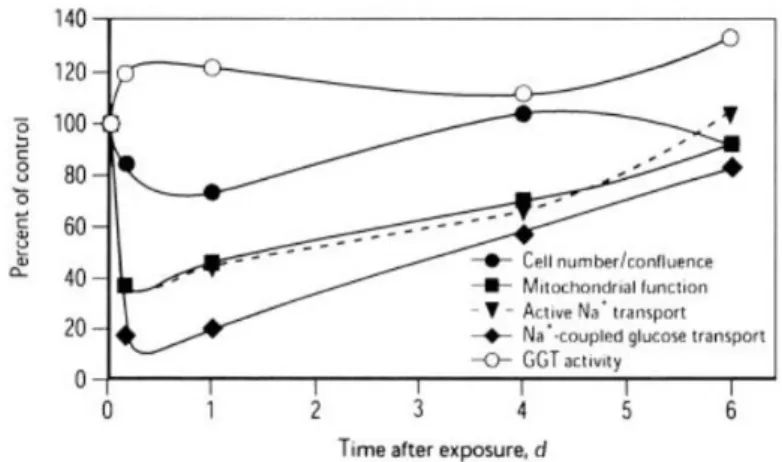
Figure 16 A et B : Modèles exploratoires en 3D. ... 66 Figure 17 A et B : Comparaison de la PO2 moyenne tissulaire en fonction de la PO2 d’alimentation des modèles dynamique et état stationnaire (A). Comparaison de la PO2 moyenne tissulaire en fonction de RBF des modèles dynamique et état stationnaire (B). ... 200 Figure 18 A et B : Comparaison des niveaux d’ATP du modèle vs données expérimentales (A). Comparaison de la fraction glycolyse anaérobie du modèle vs données expérimentales (B). ... 209 Figure 19 A et B : Comparaison de la décroissance « ischémique » de l’ATP (RBF = 0 à t0) dans le modèle vs données expérimentales (A). Comparaison de la récupération de l’ATP (RBF normal à t0) dans le modèle vs données expérimentales (B) (Stromski et al. 1986; Vogt & Farber 1968). ... 210 Figure 20 : Comparaison du niveau d’ATP du modèle vs données expérimentales, dans les conditions « contrôle » et traité au 2 déoxy-glucose ou à la roténone (Brezis et al. 1985). ... 212 Figure 21 : Exemples de « sandwich model » d’événements lésionnels cellulaires (à gauche) et de réponses cellulaires au stress (à droite) (DeGracia et al. 2012). ... 215 Figure 22 : Dynamique de D (dommages cellulaires) et S (réponse cellulaire au stress) au cours du temps (DeGracia et al. 2012). ... 216 Figure 23 : Exemple d’espace des phases (DeGracia et al. 2012). ... 217 Figure 24 A et B : Autres exemples d’espace des phases avec différentes valeurs de I (injury, inducteur de dommages cellulaires) ; « attracteur de vie » en vert, « attracteur de mort » en rouge (DeGracia et al. 2012). ... 217 Figure 25 A et B : Dynamique de mort cellulaire en fonction du niveau cellulaire d’ATP. Mort uniforme par nécrose (A) ; Mort uniforme par apoptose (B). ... 223 Figure 27 : Différents états observés des cellules épithéliales corticales lors de l’ischémie et de la réparation post-ischémique (Glaumann et al. 1977). ... 225
Figure 25 : Organigramme de programmation du module de survie cellulaire... 226 Figure 28 : Comparaison de la mort cellulaire simulée par le modèle vs données expérimentales (cf. tableau 3). ... 227 Figure 29 : Comparaison des pourcentages de LDH libérée (données expérimentales) vs lésions du modèle (calculées à partir de l’intégrité des patches). ... 228 Figure 30 : Comparaison des pourcentages de libération de LDH (données expérimentales) vs valeur de lésions des patches du modèle (calculées à partir de l’intégrité des patches). ... 230 Figure 31 : Rapport de la « valeur de lésions des patches du modèle » au « pourcentage de libération de LDH » (données expérimentales). ... 230 Figure 32 : Moyenne des rapports des valeurs de lésions du modèle sur le pourcentage de libération de LDH (données expérimentales) selon le modèle expérimental. ... 231 Figure 33 : Production et métabolisme des principales espèces réactives oxygénées (Fukai & Ushio-Fukai 2011). ... 235 Figure 34 : Proportion du complexe III passant du « stade 3 » au « stade 4 » (voir texte) en fonction de la fraction d’oxygène disponible (Selivanov et al. 2009). ... 242 Figure 35 : Comparaison des pourcentages de libération de LDH (données expérimentales) vs valeur de lésions des patches du modèle (calculées à partir de l’intégrité des patches), après intégration du module stress oxydant. ... 244 Figure 36 : Rapport de la « valeur de lésions des patches du modèle » au « pourcentage de libération de LDH » (données expérimentales), après intégration du module stress oxydant. ... 245 Figure 37 : Moyenne des rapports des valeurs de lésions du modèle sur le pourcentage de libération de LDH (données expérimentales) selon le modèle expérimental, après intégration du module stress oxydant. ... 246
Figure 38 : Interactions des composants du modèle de Brown (Brown et al. 2011). Inhibition / inactivation représentée par les traits pointillés et production / activation par les trait pleins. ... 251 Figure 39 : Comparaison du nombre de leucocytes (modèle vs données expérimentales) (Ysebaert & Greef 2000). ... 253 Figure 40 A et B : Comparaison du nombre de macrophages (A) et de fibroblastes (B) (modèle vs données expérimentales) (Tsuda et al. 2012). ... 253 Figure 41 : Comparaison du nombre de leucocytes (modèle vs données expérimentales) (Ysebaert & Greef 2000). ... 255 Figure 42 A et B : Comparaison du nombre de macrophages (A) et de fibroblastes (B) (modèle vs données expérimentales) (Tsuda et al. 2012). ... 256 Figure 43 A et B : Comparaison du nombre de macrophages (A) et du pourcentage de fibrose (B) (modèle vs données expérimentales) (Takada et al. 1997; Broekema et al. 2007). ... 256 Figure 44 A et B : Comparaison du nombre de macrophages et du pourcentage de fibrose lors d’une ischémie totale (modèle n = 7 vs données expérimentales n = 12) (Rossard et al. 2013). ... 258 Figure 45 A et B : Comparaison du nombre de macrophages (A) et du pourcentage de fibrose (B) lors d’une ischémie partielle (modèle n = 7 vs données expérimentales n = 12) (Rossard et al. 2013). ... 258 Figure 46 A et B : État du tissu observé après une séquence d’1 heure d’ischémie (A), suivie de 3 mois de reperfusion (B) ; noir, cellules mortes ; dégradé blanc-bleu, fibrose (intensité proportionnelle au degré de fibrose, ex : blanc = fibrose maximale)... 259 Figure 47 A et B : Comportements des variables d’intérêt (A) et structure du tissu (B) à l’état normal, stable. ... 260 Figure 48 : Comportements des variables d’intérêts lors d’une récupération tissulaire (ischémie courte et / ou limité). ... 260
Figure 49 A et B : Comportements des variables d’intérêt, lors d’une régénération tissulaire (après une ischémie limitée). ... 261 Figure 50 A et B : Lésions tissulaires locales (A, 1 tubule et 1 capillaire occlus dans 4 zones différentes), tissu cicatriciel en fin de régénération (B). ... 262 Figure 51 A et B : Comportements des variables d’intérêt lors d’une lésion locale (ischémie intense, 30 jours de reperfusion). ... 262 Figure 52 A et B : Lésions tissulaires locales (A), présence de fibrose en bordure de la zone lésée (B) au bout de 30 jours (voir texte pour détails). ... 263 Figure 53 A et B : Comportements des variables d’intérêt lors d’une lésion globale (ischémie totale 1h, reperfusion jusqu’à 90 jours). ... 264 Figure 54 A et B : Lésions tissulaires généralisées, après ischémie totale et 5 jours de reperfusion (A), présence de fibrose après 90 jours (B). ... 265 Figure 55 A et B : Coloration au Rouge Sirius de la fibrose tubulo-interstitielle (objectif x100) d’un rein « témoin » de porc contenant moins de 5 % de fibrose interstitielle (A), et d’un rein post-ischémique (3 mois) présentant 30-40 % de fibrose (B) (Rossard 2010). . 265 Figure 56 : Effet du positionnement (aux coins des patches) sur la PO2. ... 268 Figure 57 A et B : Effet du febuxostat sur les lésions rénales. Contrôle présentant de nombreuses cellules apoptotiques en marron (A), traitées au febuxostat, le nombre de cellules apoptotiques diminue (B) (Tsuda et al. 2012). ... 270 Figure 58 : Mise en évidence de « floating-point errors » dans NetLogo. ... 275
Liste des tableaux
Tableau 1 : Comparaison des caractéristiques principales de l’apoptose et de la nécrose. ... 220 Tableau 2 : Tableau récapitulatif des différents états des cellules, observés en fonction de la durée d’ischémie et de récupération (cf. figure 27). ... 225 Tableau 3 : Données expérimentales utilisées pour la vérification du module de survie cellulaire. ... 227 Tableau 4 : Espèces réactives oxygénées, azotées et chlorées produites dans / par les cellules (Evans & Halliwell 2001; Halliwell & Whiteman 2004). ... 235 Tableau 5 : Données expérimentales utilisées pour vérification du module « stress oxydant ». ... 244 Tableau 6 : Comportements successifs des agents. ... 251 Tableau 7 : Paramètres du modèle de Brown et al. (2011), ajustés au modèle inflammation-fibrose. ... 252
Abre viations
ABM : Agent Based Modeling
ABMS : Agent Based Modeling and Simulation ABS : Agent Based System ou Simulation ADP : Adénosine DiPhosphate
ATP : Adénosine TriPhosphate BMP : Bone Morphogenetic Protein CTGF : Connective Tissue Growth Factor
DAMPs : Damage Associated Molecular Pattern Molecules ou Danger Associated Molecular Pattern Molecules
EAR : Espèces Azotées Réactives ECR : Espèces Chlorées Réactives EGF : Epidermal Growth Factor
EMT : Transition Epithélio-Mésenchymateuse EOR : Espèces Oxygénées Réactives
EPO : Erythropoïétine ER : Espèces Réactives
FAD : Flavine Adénine Dinucleotide HGF : Hepatocyte Growth Factor HIF : Hypoxia Inducible Factor I / R : Ischémie-Reperfusion IBM : Individual Based Modeling IFN : Interféron
iNOS : Oxyde nitrique synthase
INSERM : Institut National de la Santé Et de la Recherche Médicale
IRTOMIT : Ischémie Reperfusion en Transplantation d’Organes Mécanismes et Innovations Thérapeutiques
LDH : Lactate Déshydrogénase
MCP-1 : Monocyte Chemoattractant Protein-1 MMP : Matrix Metalloproteinase
NADPH : Nicotinamide Adénine Dinucleotide Phosphate NFP : Non-Fonction Primaire
PDGF : Platelet Derived Growth Factor PHD : Proxyl-Hydroxylases
PO2 : Pression partielle d’Oxygène QKDB : Quantitative Kidney DataBase RBF : Renal Blood Flow
RIRR : ROS Induced ROS Release ROS : Reactive Oxygen Species RRF : Reprise Retardée de Fonction SMA : Systèmes Multi-Agents SOD : Super Oxyde Dismutase TBHP : Hydroperoxyde de Tert-Butyle TGF : Transforming Growth Factor TLR : Récepteurs Toll-Like
TNF : Tumour Necrosis Factor
Pre ambule
‘absence d’oxygène et de nutriments ainsi que leur retour lors de l’ischémie-reperfusion (I / R) ou de l’hypoxie-réoxygénation est un facteur étiologique bien connu des pathologies rénales chroniques ou aiguës. En préservation-transplantation rénale, les lésions d’ischémie sont particulièrement conséquentes, entraînant inflammation et fibrose, aboutissant à la perte du greffon et forçant le patient à retourner en dialyse. Les facteurs impliqués dans le développement et la progression des lésions d’ischémie-reperfusion sont nombreux et entraînent l’altération du métabolisme due au manque d’oxygène et de nutriments, la production d’espèces oxygénées réactives (EOR), d’oxyde nitrique et de péroxynitrite ainsi que la diminution d’antioxydants jouant un rôle de protection. Ces facteurs aboutissent à la dysfonction, la lésion et la mort des cellules rénales. L’inflammation rénale implique des cascades de cytokines / molécules d’adhésion qui aboutissent au recrutement, à l’activation et la diapédèse de leucocytes circulants. Si l’inflammation perdure, elle engendre des lésions plus importantes et peut aboutir à la fibrose. Si l’inflammation est résolue le tissu rénal se régénère.
Le rein est un organe structurellement et fonctionnellement complexe. De plus, bien que les lésions et les événements reliés à l’ischémie-reperfusion soient de mieux en mieux caractérisés, leur complexité en entrave la compréhension. Une réponse possible à cette complexité est le développement, l’analyse et l’exploitation d’une description réaliste du système que nous étudions à travers des modélisations et simulations intégratives biologiques : c’est le domaine appelé « system biology ». Notre laboratoire, qui étudie l’ischémie-reperfusion rénale lors de la préservation et de la transplantation, a commencé à développer au niveau cellulaire et tissulaire, un modèle de compréhension de l’inflammation et de la fibrose lors de l’ischémie-reperfusion rénale.
Nous avons fait le choix de modéliser seulement la partie corticale du rein pour plusieurs raisons :
- le cortex rénal représente la majeure partie du volume rénal et reçoit la fraction principale du débit sanguin rénal,
- le cortex rénal est le siège des deux processus principaux de la fonction rénale : (toute) la filtration et (la majorité) de la réabsorption. Le principal indicateur de la fonction rénale, la créatininémie, est le reflet de l’état des glomérules c’est-à-dire de l’intégrité et du fonctionnement cortical,
- le cortex rénal, dont les valeurs de pression partielle en oxygène (PO2) sont similaires aux autres organes, est particulièrement sensible au manque d’oxygène et à l’ischémie-reperfusion (potentiel glycolytique inférieur, phosphorylation oxydative dominante),
- le cortex rénal présente une réponse à l’hypoxie faible (Hypoxia Induced Factor, HIF) et produit l’érythropoïétine.
Nous présentons dans cette thèse, étape par étape, le développement des différents modèles et modules qui les composent. Nous nous sommes appuyé sur un imposant corpus bibliographique (environ 300 travaux différents) que nous avons intégré en une construction rigoureuse, dynamique et quantitative afin d’arriver à la modélisation et à la simulation des phénomènes aboutissant aux lésions d’ischémie-reperfusion. Les modèles que nous avons créés avaient pour objectif premier d’acquérir des connaissances permettant de tester des hypothèses.
Le premier chapitre de cette thèse sera consacré au contexte et aux connaissances qui ont été nécessaires pour aborder ce travail. Nous présenterons ensuite les outils utilisés ainsi qu’une série de travaux préliminaires qui ont conduit à la réalisation de notre premier modèle. Le chapitre suivant décrira ce premier modèle, celui de l’oxygénation du cortex rénal et sa validation sous forme d’un article en cours de publication. Un autre chapitre expliquera comment nous avons adapté le modèle dynamique de l’oxygénation cortical en modèle à l’état stationnaire. Les différents modules ajoutés au modèle d’état stationnaire seront exposés successivement : module ATP dynamique (Adénosine Tri Phosphate), module survie cellulaire, module stress oxydant et module inflammation-fibrose. Le dernier chapitre permettra de discuter des résultats obtenus avec nos modèles.
Chapitre 1 :
a réalisation de ce travail de thèse a nécessité l’étude de nombreuses notions issues de champs différents : modélisation par agents, physiologie rénale, pathophysiologie, histologie, immunologie, métabolisme… Ce premier chapitre résume l’essentiel des notions qui ont été importantes pour la réalisation des premiers modèles.
Nous présenterons d’abord l’utilité de la modélisation et la définition des modèles par agents. Puis nous traiterons des éléments de physiologie rénale qui ont été intégrés au modèle avant de terminer par la description succincte des conséquences de l ’ischémie-reperfusion rénale : inflammation, réparation et fibrose.
1. La modélisation par agents
1.1. Intérêts de la modélisation
Pour le grand public, les modèles informatiques sont souvent perçus uniquement comme des outils de prédiction à la manière des modèles météorologiques. Bandini (Bandini et al. 2009) apporte quelques nuances : un modèle est une représentation abstraite et simplifiée d’une réalité existante ou attendue. Les modèles sont donc conçus pour étudier et expliquer des phénomènes existants (modèles de connaissance) ou prévoir des phénomènes futurs (modèles prédictifs).
Dans une revue très générale Epstein (Epstein 2008) donne de nombreuses autres raisons de construire des modèles, en voici quelques exemples : renforcer les habitudes de réflexions scientifiques, guider la collecte de données, suggérer des analogies entre des processus qui à première vue ne semblent pas reliés, limiter les résultats dans des gammes plausibles…
Bandini (Bandini et al. 2009) considère deux autres utilités des modèles : l’usage d’environnements synthétiques est souvent nécessaire parce que le système simulé ne peut pas être observé pour des raisons éthiques (mise en danger de la sécurité des
hommes) ou pratiques (coût des expérimentations ou de la collecte de données trop important ; dynamiques trop lentes des systèmes observés ; systèmes non observables).
In fine, les raisons pour développer des modèles sont multiples : ils constituent des outils polyvalents et très utiles.
1.2. Les modèles par agents
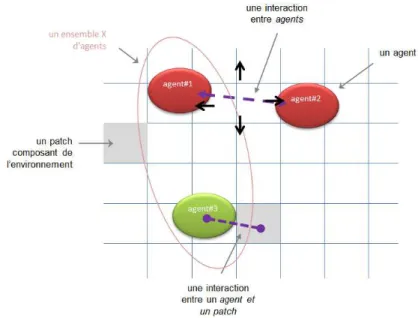
La modélisation par agents est connue sous de nombreuses appellations : Agent Based Modeling (ABM), Agent Based System ou Simulation (ABS), Agent Based Modeling and Simulation (ABMS), Individual Based Modeling (IBM) ou Systèmes Multi Agents (SMA) en français (Macal & North 2009; Ferber 1995). Un modèle par agents est un modèle composé d’agents disposés dans un environnement qu’ils partagent (lui-même éventuellement composé d’agents, figure 1). Les agents interagissent dynamiquement entre eux et avec l’environnement. Ils sont définis par : 1) des variables (par exemple dans le cas d’une cellule : niveau d’oxygène, niveau d’ATP…), 2) des fonctions qui vont déterminer leurs interactions / comportements (ex : réponses aux signaux et stimuli, changements d’état, production de signaux…).
Figure 1 : Principaux composants d’un modèle par agents.
Dans cet exemple, l’environnement est composé d’agents nommés patches (agents immobiles dans NetLogo) avec lesquels les autres agents interagissent.
La modélisation et la simulation par agents est une approche récente, régulièrement utilisée en sociologie et en écologie depuis les années 90 (Heath et al. 2009). Elle a gagné en attention depuis une dizaine d’années dans le domaine biomédical (une recherche PubMed en septembre 2015 « Agent Based Modeling » renvoie à 1032 articles dont 866 publications ces 10 dernières années). Certains auteurs estiment même que les modèles par agents sont une nouvelle voie pour faire de la science et peuvent prolonger les méthodes de découverte traditionnelle (Macal & North 2009).
La modélisation par agents est de plus en plus utilisée car c’est une solution possible pour modéliser et analyser les systèmes hétérogènes. Elle complète les autres paradigmes de modélisation (équations différentielles, réseaux booléens…) qui ne suffisent parfois pas à répondre aux questions que l’on se pose sur des systèmes considérés comme trop complexes pour les modéliser correctement. La modélisation par agents est progressivement facilitée grâce à : 1) l’apparition de bases de données biologiques dans lesquelles sont collectées et organisées les informations utiles à la modélisation (par exemple QKDB3, Quantitative Kidney DataBase dont nous nous sommes beaucoup servie), 2) la puissance de calcul informatique qui ne cesse d’augmenter, qui permet des simulations à des échelles de plus en plus larges et complexes qui auraient été impossibles il y a encore peu de temps.
Selon Ferber (1995), les racines historiques des approches par agents se situent dans deux domaines clés : l’intelligence artificielle distribuée et la vie artificielle.
L’intelligence artificielle distribuée voit ses premiers travaux réalisés dans les années 75-80. Elle comporte plusieurs courants correspondant à autant d’approches différentes de résolutions de problèmes. Mais leur objet reste le même : réaliser des organisations de systèmes capables de résoudre des problèmes à partir d’un raisonnement basé sur une manipulation de symboles (Ferber 1995). L’intelligence artificielle distribuée utilise très fréquemment une conception d’agents spécifiques : les agents délibératifs ou cognitifs. Ces agents possèdent des plans explicites permettant d’atteindre des buts précis. Ils sont caractérisés par des mécanismes de sélections d’actions complexes ; leur comportement
est basé sur ce que l’on appelle des « mental state » qui représentent la connaissance de l’agent sur son environnement et, possiblement, les mémoires d’expériences passées. Les agents délibératifs, pour chaque séquence de perception, tentent de sélectionner / planifier une séquence d’actions leur permettant d’atteindre un objectif donné. Les modèles délibératifs sont habituellement définis dans un contexte de planification où les agents ont leur propre représentation du monde ; et leurs décisions sont basées sur un raisonnement logique (Russell & Norvig 1995). Un exemple d’agents délibératifs est une simulation de grues automatisées dans une zone de stockage de containers ayant pour objectif de charger des containers sur des camions. Les grues possèdent un « état mental » qui représente le positionnement des conteneurs et des véhicules à charger. Après communication entre elles, elles se coordonnent pour choisir chacune un ensemble de tâches à accomplir successivement pour réaliser leur objectif (exemple provenant du cours en ligne « Artificial Intelligence Planning »4).
La « vie artificielle » vise à réaliser des modèles de connaissance de systèmes doués de vie et donc capables de survivre, s’adapter et se reproduire dans un environnement qui peut être hostile. Les premières approches prennent place dans l’histoire de l’informatique, notamment avec les travaux sur les automates cellulaires (Von Newmann) ou sur l’homéostasie (Ross Ashby). Mais sa constitution en tant que champ d’étude est plus récente (fin des années 80, début des années 90) (Ferber 1995). Cette approche de vie artificielle va utiliser préférentiellement un autre type d’agents : les agents réactifs. Ce sont des agents élémentaires (et souvent sans mémoire) avec une position définie dans l’environnement. Les agents réactifs réalisent leurs actions en réponse à la perception de stimuli provenant d’autres agents ou de l’environnement. Généralement, les spécifications comportementales de ce type d’agents consistent en un ensemble de règles condition-action, avec l’ajout d’une stratégie de sélections pour choisir une action prioritaire à effectuer lorsque plusieurs pourraient être activées. Dans ce cas, le choix d’une action provient d’un événement déclencheur détecté dans l’environnement (Russell & Norvig 1995). On pourrait trouver des exemples d’agents réactifs dans un modèle de type proie / prédateurs ; le prédateur s’orientant et se déplaçant en fonction de la perception des proies dans son environnement (Wilensky & Reisman 1999).
Un système multi-agents peut être composé d’agents cognitifs (généralement en petit nombre), chacun possédant sa propre mémoire déterminant son comportement et ses interactions avec les autres agents et l’environnement. Par opposition, il peut exister des systèmes multi-agents conçus uniquement à partir d’agents réactifs (c’est le cas des modèles que nous développons). Ce type de système est basé sur l’idée qu’il n’est pas nécessaire pour un agent d’être intelligent individuellement pour que le système démontre un comportement (une intelligence) complexe émergente. Les systèmes d’agents réactifs sont habituellement plus robustes et plus tolérants aux erreurs que les autres systèmes par agents (par exemple, un agent peut être perdu sans pour autant affecter de façon significative le système). D’autres bénéfices des systèmes multi-agents réactifs incluent la flexibilité et l’adaptabilité en comparaison à l’inflexibilité qui caractérise les systèmes par agents délibératifs (Brooks 1990). Il existe aussi des systèmes présentant une composition hétérogène d’agents délibératifs et réactifs.
1.3. Définir un agent
Selon les domaines d’études, la définition du terme « agent » dans le contexte des ABMS peut varier. Cette définition est encore sujet à débats, mais nous allons essayer d’en donner une à partir des réflexions de quelques experts (Macal & North 2009; Bandini et al. 2009; Ferber 1995; Collins et al. 2015) :
- un agent est autonome. Il peut opérer sans intervention humaine, il a un certain contrôle sur son état propre,
- un agent est indépendant. Discret et identifiable, il est indépendant de son environnement et des autres agents dans le sens où leur présence n’est pas nécessaire pour qu’il puisse fonctionner,
- un agent est modulaire. Il possède différentes caractéristiques, attributs, comportements. Cette modularité peut être utilisée pour intégrer dans les modèles des agents de natures différentes,
- un agent interagit avec les autres agents. Il peut s’agir d’échanges directs ou indirects réalisés à partir de protocoles et de mécanismes qui vont simuler le comportement de l’agent. Les protocoles d’interactions les plus fréquents
incluent : gestion de l’espace, reconnaissance des agents, reconnaissance de l’environnement, communication et échange d’informations… Généralement ils sont limités aux interactions considérées comme pertinentes,
- un agent possède et gère des ressources (indicateurs d’énergie, de santé…) utilisées le plus souvent pour moduler les comportements de l’agent.
Les agents ont souvent des propriétés additionnelles qui peuvent être ou non considérées comme des conditions nécessaires pour les définir :
- un agent interagit avec son environnement. En effet, l’environnement peut approvisionner les agents en informations et perceptions et conditionner ainsi ses actions. De plus, la position de l’agent dans l’environnement peut avoir des conséquences sur son comportement,
- un agent peut avoir la capacité de se reproduire. On retrouve ce genre de capacité dans de nombreux modèles simulant des comportements animaux, - un agent peut apprendre et s’adapter. L’apprentissage individuel et l’adaptation
requièrent une mémoire, habituellement sous forme d’une variable dynamique de l’agent (l’adaptation dont on parle ici est une adaptation individuelle et non pas une adaptation de la population. Si une telle adaptation devait apparaître, elle serait plutôt issue d’un comportement émergeant de l’ensemble des agents). Souvent les agents d’un modèle n’auront pas d’adaptation parce que non nécessaire pour les objectifs du modèle.
Les propriétés suivantes concernent essentiellement les agents cognitifs :
- un agent peut posséder une représentation de l’environnement. Ce type de représentation est souvent présent dans les modèles de planification,
- un agent a des buts / objectifs pour le guider. Un agent peut comparer de façon continue les résultats de ses comportements à ces buts / objectifs afin d’ajuster ses comportements,
- un agent est proactif. Il peut prendre des initiatives, démarrer des activités, en accord avec ses règles internes plutôt qu’en réaction à des stimuli externes.
Il peut arriver que les comportements intrinsèques des agents suffisent à expliquer le comportement global du modèle. Mais dans de nombreux cas, le comportement global du modèle ne peut pas être prédit, il est issu des interactions entre agents et / ou avec l’environnement. C’est cette émergence de comportements qui constitue l’une des grandes forces des ABM (Ferber 1995).
2. Le rein
Réaliser un modèle par agents de l’ischémie-reperfusion du cortex rénal nécessite une représentation spatiale en deux dimensions d’une section de ce cortex. Cette représentation peut contenir un certain nombre d’éléments différents : section de tubule, artères, veines, capillaires, interstitium, glomérule… Afin de créer une section de cortex rénal suffisamment complète, nous nous sommes intéressé à la structure du rein. Les sections suivantes présentent certains éléments à différentes échelles qui nous ont semblé essentiels, car susceptibles d’avoir un impact sur le modèle.
2.1. Le rein : un organe vital
Le rein maintient l’homéostasie du sang et de l’organisme en général. Cette homéostasie est obtenue par un processus complexe qui implique dans un premier temps une filtration, dans les glomérules, d’une grande quantité de fluides et solutés à partir du sang. Ensuite les solutés et l’eau sont réabsorbés, généralement à plus de 99 %, le long de systèmes tubulaires connectés aux glomérules. Les moins de 1 % restants contenant les déchets produits par le corps sont excrétés dans des tubes collecteurs ; ils représentent l’urine finale.
Il est à noter que le rein est un organe endocrine, produisant des hormones agissant aussi bien sur le rein que sur d’autres organes. Cette fonction endocrine, bien qu’intéressante, ne fait pas partie des éléments que nous avons souhaité modéliser dans notre travail : il n’en sera plus fait mention par la suite.
2.2. Structure rénale
Le rein des mammifères se présente sous de multiples formes. Selon Kriz et Kaissling (Kriz & Kaissling 1992), l’architecture du rein la mieux connue est celle du rein unipapillaire. C’est l’architecture la plus commune chez les espèces de petite taille. En ce qui concerne les deux espèces qui nous intéressent, à savoir le rat et le porc, les types de reins sont très différents. Le rat possède un rein unilobaire, unipapillaire tandis que le porc est pourvu d’un rein multilobaire (composé de plusieurs lobes) et multipapillaire (comprenant plusieurs papilles rénales). Un lobe rénal est un croissant constitué d’une pyramide rénale (appelée aussi pyramide de Malpighi) et de la section corticale correspondante. Une coupe sagittale d’un rein montre les principales structures qui le composent (figure 2).
Figure 2 : Schéma de coupe sagittale de rein multilobaire / multipapillaire5.
Le cortex rénal dans son entier a une forme incurvée. Il entoure la médullaire rénale. Le parenchyme cortical contient le labyrinthe cortical et les rayons médullaires. Le cortex possède une organisation structurelle similaire chez la plupart des mammifères. La médullaire peut être grossièrement comparée à une pyramide. Sa partie supérieure, la papille, se projette dans le pelvis rénal. La médullaire se divise en une médullaire externe (elle-même divisée en bande supérieure ou zone superficielle, et bande inférieure ou zone profonde) et une médullaire interne. La partie terminale de la médullaire profonde forme la papille rénale. La médullaire, contrairement au cortex, possède d’importantes différences architecturales selon les espèces. En effet, les espèces qui concentrent fortement leur urine ont généralement un volume médullaire supérieur. L’ensemble du rein est entouré par une enveloppe fibreuse appelée capsule rénale (Kriz & Kaissling 1992; Kaissling & Dørup 1995).
Le rein unipapillaire / unilobaire est le type de rein le plus simple. En anatomie comparée, les reins multipapillaires / multilobaires peuvent être considérés comme une adaptation à un corps plus grand par la multiplication des lobes et papilles (Kriz & Kaissling 1992; Kaissling & Dørup 1995).
2.3. Néphrons et tubes collecteurs
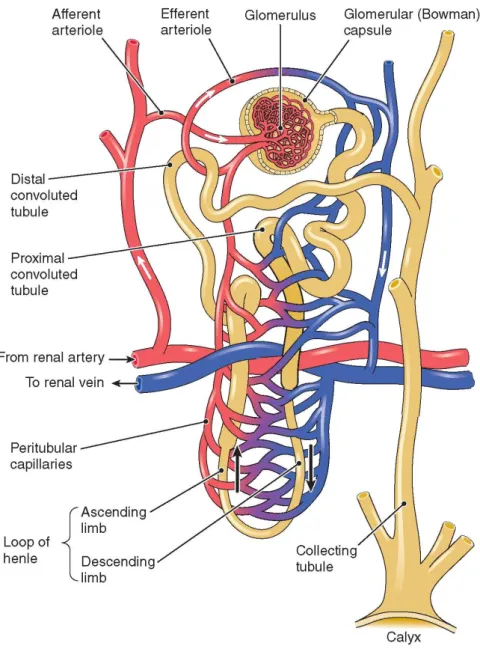
L’unité structurelle spécifique au rein est le néphron. Le néphron consiste en un corpuscule rénal (appelé parfois aussi corpuscule de Malpighi ou glomérule) relié à un tube collecteur par un tubule entortillé de façon complexe. Le glomérule est le siège de la filtration sanguine qui a lieu à travers la paroi de capillaires spécialisés. Ces capillaires sont alimentés par une artériole afférente puis drainés par une artériole efférente. Le taux de filtration et le débit sanguin peuvent être contrôlés par la contraction de ces artérioles. Un néphron seul ne suffit pas à concentrer le filtrat primaire. C’est la juxtaposition d’un grand nombre de néphrons et les échanges avec les capillaires qui permet d’assurer la fonction de l’organe. Chez le rat, chaque rein contient 30 000 à
35 000 néphrons. Chaque rein humain possède quant à lui environ 1 million de néphrons6.
Trois types de néphrons peuvent être distingués en se basant sur la position du corpuscule rénal dans le cortex : les néphrons superficiels, les néphrons intermédiaires et les néphrons juxtamédullaires. La partie tubulaire du néphron, qui est le siège de la réabsorption de l’eau et des solutés, consiste en une portion proximale et une portion distale connectées par l’anse de Henlé (figure 3). La longueur de l’anse diffère selon la position du corpuscule rénal (Kriz & Kaissling 1992; Kaissling & Dørup 1995).
Figure 3 : Structure d’un néphron7
. Ce schéma ne représente pas certains détailles tel que la position exact de la macula densa.
En fonction de la longueur de l'anse de Henlé, on distingue les néphrons à anse courte, incluant ceux avec anse corticale, et les néphrons à anse longue. Les 1ers ont leur anse située dans la médullaire externe. Les seconds se trouvent à différents niveaux dans la médullaire interne : un grand nombre à la base, d'autres au niveau intermédiaire et seulement quelques-uns à la base de la papille, c'est-à-dire que le nombre d'anses diminue progressivement de la médullaire interne à la papille. Cette décroissance importante, parallèle à une décroissance des tubes collecteurs et des vaisseaux, établit la forme caractéristique de la médullaire interne.
La division des néphrons en fonction de la position du glomérule dans le cortex ne coïncide pas avec la division basée sur la longueur des anses. Les trois types de corpuscules rénaux (superficiels, intermédiaires et juxtamédullaires) peuvent être rattachés aux anses longues et courtes.
Le nombre d’anses courtes et longues varie selon les espèces. Certaines espèces ont uniquement des anses courtes et en conséquence manquent de médullaire moyenne. Il en résulte une faible capacité à concentrer les urines.
Les tubes collecteurs sont formés dans le cortex rénal par la jonction de plusieurs néphrons. La localisation de la limite entre néphron et tube collecteur n’est pas bien définie. Les tubes collecteurs corticaux descendent à travers les rayons médullaires du cortex et traversent la médullaire externe sans y être rattachés. Ils fusionnent successivement en entrant dans la médullaire interne, (Kriz & Kaissling 1992).
2.4. Vascularisation rénale
Dans le cas des reins multilobaires, l’artère rénale se divise en plusieurs artères interlobaires qui entrent dans le tissu rénal au niveau de la limite entre cortex et médullaire. À partir de là, elles vont prendre une forme en arc et seront appelées artères arquées. Elles donneront naissance aux artères interlobulaires qui remontent
graduellement dans le labyrinthe cortical. Le cortex possède une grande densité d’artères, alors qu’aucune artère ne pénètre dans la médullaire. Les veines rénales (interlobulaires, arquées) accompagnent les artères correspondantes (Kriz & Kaissling 1992; Kaissling & Dørup 1995). Chez certaines espèces (le chat, le chien, l’humain, le rat), le sang veineux du cortex supérieur peut être drainé par des veines à la surface du rein (les « stellate veins ») connectées par des veines interlobulaires aux veines arquées. Ces veines supplémentaires ne sont pas accompagnées d’artères (Kriz & Kaissling 1992).
Le schéma micro vasculaire rénal est très semblable chez toutes les espèces de mammifères. Des artérioles afférentes issues des artères radiales corticales vont alimenter les glomérules des corpuscules rénaux. Des artérioles efférentes vont drainer le glomérule et alimenter les capillaires corticaux péritubulaires. Des capillaires entourent le néphron, ils peuvent être perfusés par d’autres néphrons. Les glomérules superficiels et intermédiaires alimentent le plexus capillaire cortical, tandis que les glomérules juxtamédullaires alimentent le plexus capillaire médullaire. L’ultrastructure des capillaires dans le rein est similaire dans le cortex et dans la médullaire à l’exception des capillaires glomérulaires. Les capillaires du rein sont de type fenestrés. Le mur capillaire consiste en un endothélium lâche entouré par une membrane basale fine. Environ 50 % de cette paroi est composée de zones contenant ces fenestrations. La barrière glomérulaire ne dépend pas uniquement de la fenestration des capillaires, en effet la couche épithéliale et en particulier le diaphragme de fente jouent un rôle déterminant (Kriz & Kaissling 1992; Kaissling & Dørup 1995).
Comme nous l’avons précisé, nous modélisons uniquement une section de cortex rénal qui ne contient aucun glomérule, aucune artériole afférente / efférente, ni artères, seulement des capillaires péritubulaires. Pourtant, la compréhension de la structure vasculaire est importante pour le modèle afin de pouvoir simuler correctement les différents débits de notre modèle à partir d’une seule variable d’entrée : le débit sanguin rénal (Renal Blood Flow, RBF). Le détail de la perfusion tissulaire implémentée dans notre modèle se trouve au chapitre 3 : modèle de l’oxygénation corticale.
2.5. Cortex
Le cortex rénal recouvre la médullaire, il est composé de deux structures : le labyrinthe cortical et les rayons médullaires. Les glomérules et les tubules contournés proximaux et distaux des néphrons sont localisés dans le labyrinthe cortical. On y retrouve également des axes vasculaires, artères et veines ainsi que des lymphatiques. Les glomérules (alimentés à partir des artères radiales corticales) et les tubules contournés correspondants (proximaux et distaux) sont situés autour de chaque axe vasculaire. Ainsi, le labyrinthe cortical est un parenchyme continu qui contient les axes vasculaires du cortex, et il entoure les rayons médullaires distribués régulièrement. Les tubules droits (proximaux et distaux), ainsi que les tubes collecteurs, sont localisés à l’intérieur des rayons médullaires. Le nombre de tubules droits augmente avec la profondeur en approchant de la bordure cortico-médullaire. Ainsi la taille des rayons médullaires augmente au fur et à mesure qu’ils progressent vers la médullaire externe (Kriz & Kaissling 1992; Kaissling & Dørup 1995).
Aucune structure régulière n’apparaît dans les tubes contournés du labyrinthe cortical. Les tubes contournés proximaux et distaux (les distaux constituent une fraction mineure en comparaison des tubes proximaux) sont répartis en quantité égale dans le plexus capillaire dense de cette région. À l’intérieur des rayons médullaires, les tubules droits des néphrons superficiels (proximaux et distaux) occupent généralement une position centrale, alors que ceux des néphrons plus profonds ont une position périphérique (Kriz & Kaissling 1992).
Il existe deux parties différentes dans le réseau capillaire du cortex : un plexus capillaire du labyrinthe cortical et un réseau moins dense de plexus au niveau des rayons médullaires. Le plexus des rayons médullaires va rejoindre le plexus du labyrinthe cortical avant de retourner dans les veines interlobulaires. Les artérioles efférentes ne rentrent pas dans les rayons médullaires mais se scindent fréquemment en capillaires à la bordure des rayons médullaires (Kriz & Kaissling 1992).
Anatomiquement, le tubule proximal est divisé en une partie droite et une partie contournée. Ultrastructurellement, on distingue généralement trois segments (S1, S2 et S3). La transition depuis les cellules S1 aux cellules S2 est graduelle et se produit dans la seconde moitié de la partie contournée. Ainsi, le segment S2 commence dans le labyrinthe cortical. La transition depuis les cellules S2 aux cellules S3 se produit le long de la partie droite à l’intérieur des rayons médullaires. Les segments S3 sont situés dans la portion profonde des rayons médullaires et dans la bande externe de la médullaire externe (Kriz & Kaissling 1992).
L’épithélium des tubules proximaux est caractérisé par une bordure en brosse, composée de microvillosités groupées de façon dense et homogène avec une taille et une forme régulière. La forme de la bordure en brosse augmente la surface d’échange luminale des cellules, comme il a été par calculé par Welling et Welling (Welling & Welling 1975), d’un facteur 36 dans les segments S1 chez le lapin. Cette grande surface d’échange de la membrane luminale est à mettre en relation avec la capacité du segment proximal à réabsorber les composés organiques de petite taille (acides aminés, peptides, glucose,...) et les ions (Na+, Cl-,…) présents dans l’ultrafiltrat glomérulaire. La surface basolatérale des cellules du tubule proximal est considérablement augmentée comparativement à la surface de la membrane basale tubulaire. L’amplification de la surface basolatérale est due à la formation de processus cellulaires latéraux qui s’étendent radialement depuis le centre de la cellule et qui se divisent en crêtes secondaires et tertiaires jusqu’à la base des cellules. Ces invaginations latérales sont intimement interdigitées avec celles des cellules adjacentes. L’espace intercellulaire, confiné entre les membranes cellulaires latérales apposées, présente un écartement régulier d’environ 20 nm. Il est séparé du compartiment luminal par des jonctions serrées. Leur structure suggère que ces jonctions ne sont pas parfaitement étanches. L’épithélium proximal est le seul type d’épithélium rénal dont les cellules sont couplées par des jonctions gap fréquemment rencontrées entre les invaginations latérales (Kriz & Kaissling 1992; Kaissling & Dørup 1995).
La bordure en brosse dans le segment S2 n’est pas aussi haute que celle du segment S1. De plus, la complexité des invaginations cellulaires latérales diminue. Ainsi, la surface des membranes cellulaires à la fois luminale et basolatérale est inférieure à celle des
segments S1 ; décroît progressivement jusqu’au segment S3, où la limite luminale des cellules se rapproche d’une forme polygonale. Cette décroissance est associée à une diminution de la densité mitochondriale et des apparatus vacuolaires. Dans le segment S3, les microvillosités de la bordure en brosse deviennent plus courtes et moins denses que celles du segment S2. A contrario, le réticulum endoplasmique lisse et les peroxysomes sont plus abondants que dans les segments précédents. Chez le rat et la souris, la transition depuis les cellules S2 vers les cellules S3 est abrupte. Ces différents types de cellules peuvent être retrouvés s’entremêlant sur de courtes distances dans le tubule. Les microvillosités issues de la bordure en brosse des cellules S3 de rat sont les plus longues et les plus densément arrangées de tous les segments proximaux (Kriz & Kaissling 1992).
2.6. Médullaire
La médullaire est formée de 3 couches concentriques : la médullaire externe composée d’une bande externe (Outer Stripe of Outer Medulla, OSOM) et d’une bande interne (Inner Stripe of Outer Medulla, ISOM) et la médullaire interne adjacente à la bande interne de la médullaire externe. La médullaire est principalement alimentée par les artérioles efférentes issues des glomérules juxta-médullaires. Ces artérioles efférentes descendent à travers la partie supérieure de la médullaire externe et se divisent en vasa recta descendantes. La quantité de capillaires dans la médullaire varie en fonction des zones. Dans la bande supérieure de la médullaire supérieure, la quantité de capillaires est réduite. Le plexus capillaire de la bande inférieure de la médullaire externe est au contraire très dense. Dans la médullaire profonde, le plexus capillaire est moins dense (Kriz & Kaissling 1992; Kaissling & Dørup 1995).
Les trois régions de la médullaire contiennent différentes populations de segments de néphrons. La bande externe de la médullaire externe contient les sections droites des tubules proximaux et des tubules distaux ainsi que des tubes collecteurs. La bande interne de la médullaire externe est composée des branches descendantes et ascendantes fines et de tubes collecteurs. La médullaire interne contient les branches
fines ascendantes et descendantes et des tubes collecteurs. L’organisation architecturale de la médullaire peut être mieux décrite en considérant que les groupements vasculaires en sont un axe central et en étudiant comment les tubules sont arrangés autour d’eux (Kriz & Kaissling 1992).
2.7. Interstitium et lymphatiques
L’espace entre les vaisseaux sanguins et les tubules est l’interstitium. Tout transport depuis les tubules vers les vaisseaux (et inversement) passe par cet interstitium. Il représente un volume de 5 à 7 % dans le cortex, un peu moins dans la médullaire externe (inférieur à 5 %). Mais le volume d’interstitium augmente régulièrement dans la médullaire interne jusqu’à la papille. L’espace interstitiel est occupé par la matrice extra cellulaire (protéoglycans, glycoprotéines et liquide interstitiel), par des fibres de collagène, par des micro-fibrilles et des cellules interstitielles (fibroblastes, cellules dendritiques, macrophages) (Kaissling & Le Hir 1994; Kaissling & Le Hir 2008; Kriz & Kaissling 1992; Kaissling & Dørup 1995).
Dans le cortex rénal l’interstitium péritubulaire peut être distingué de l’espace interstitiel péri-artériel. En effet les vaisseaux lymphatiques du rein sont situés principalement dans les tissus péri-artériaux. Dans la plupart des cas, on ne trouve pas de lymphatiques hors de ce tissu. L’interstitium péritubulaire du cortex est clairsemé et distribué de façon disparate autour du tubule. Les parois des tubules externes et les parois capillaires sont parallèles l’une à l’autre. À ces endroits, la membrane basale des tubules et celle des capillaires sont en apposition, proches l’une de l’autre. Cet interstitium étroit qui relie les tubules et les capillaires prend une forme plus large dans certaines portions de l’interstitium péritubulaire. La majeure partie du fluide tubulaire réabsorbé doit traverser cet espace interstitiel avant d’entrer dans les capillaires (Kriz & Kaissling 1992; Kaissling & Dørup 1995). La majorité des cellules interstitielles dans le cortex rénal est constituée de fibroblastes habituellement localisés dans la portion large de l’interstitium péritubulaire. Ils ont une apparence fine et longue qui s’étend le long des tubules, y compris dans l’espace péritubulaire étroit où ils sont souvent interposés entre
les capillaires et la membrane basale du tubule. Les fibroblastes interstitiels forment une structure de soutien du tissu permettant d’en maintenir la structure tridimensionnelle (Kaissling & Le Hir 2008; Kaissling & Le Hir 1994).
Comme nous l’avons précisé auparavant, le modèle réalisé se concentre sur le cortex rénal et plus particulièrement le labyrinthe cortical. Nous avons choisis de ne pas représenter les rayons médullaires et la médullaire rénale. Les sections modélisées ne contiennent que des tubules proximaux et de l’interstitium. Nous avons également fait le choix, dans un premier temps, d’ignorer les sections de tubules distaux et les glomérules normalement présents dans le cortex par souci de simplification mais nous avons prévu d’intégrer plus tard certains de ces éléments dans une section étendue de tissu rénal. Le principal outil que nous utilisons pour réaliser nos tissus virtuels (outil Draw-tissu présenté chapitre 2) possède déjà les fonctions permettant d’intégrer ces éléments (tubules distaux et rayons médullaires).
3. L’ischémie-reperfusion et ses conséquences
3.1. Transplantation, ischémie-reperfusion
La transplantation d’organes est l’acte chirurgical consistant à apporter à un organisme receveur un organe entier provenant d’un organisme donneur, afin de remplacer l’organe ayant perdu sa fonction physiologique. Selon les dossiers d’informations de l’INSERM8, la transplantation d’organe est la seule solution thérapeutique pour la plupart des pathologies conduisant à une perte irréversible de la fonction d’organes vitaux comme le rein, le cœur, le foie ou les poumons. En ce qui concerne le rein, la transplantation offre la meilleure issue thérapeutique. La seule alternative pour le patient étant la dialyse, beaucoup plus contraignante et coûteuse (un patient dialysé coûte quatre fois plus cher qu’un patient greffé ; source : site de l’Agence de la Biomédecine). Lors du prélèvement et de la conservation de l’organe, celui-ci subit une phase d’ischémie, c’est-à-dire la