FACULTÉ DES SCIENCES
Rabat N° d’orde : 2341THÈSE DE DOCTORAT
Présentée parRachid BOUHFID
Discipline : Chimie Spécialité : Chimie organiqueSYNTHESE DE NOUVEAUX DERIVES DE L’ISATINE ET DE
L’OXINDOLE ET EVALUATION DE LEURS PROPRIETES
BIOLOGIQUES
Soutenue le : 22 juin 2007, devant le jury :
Président :
El Mokhtar ESSASSI Professeur à la Faculté des Sciences, Université Mohammed V- Agdal, Rabat Rapporteur :
Noureddine Hamou AHABCHANE Professeur à la Faculté des Sciences, Université Mohammed V- Agdal, Rabat
El Moustafa RAKIB Professeur à la Faculté des Sciences et Techniques Université Cadi-Ayyad, Beni-Mellal
Examinateur :
Mostafa El GHOUL Professeur à la Faculté des Sciences, Université Mohammed V- Agdal, Rabat Bahia DJERRARI Professeur à la Faculté des Sciences,
Université Mohammed V- Agdal, Rabat
!
!
!
A mes chers parents ;
A mes sœurs ;
A mes frères ;
A toute ma famille ;
A mes amis ;
A tous ceux qui me sont chers ;
Pour leur présence de tous les instants,
Pour le soutien qu’ils m’ont apporté,
AVANT PROPOS
Ce travail a été réalisé au Laboratoire de Chimie Organique Hétérocyclique de la Faculté des Sciences de l’Université Mohammed V-Agdal, sous la direction de Monsieur le Professeur El Mokhtar ESSASSI.
Tout d’abord, j’adresse mes plus vifs remerciements à Monsieur le Professeur El Mokhtar ESSASSI, de m’avoir accueilli dans son laboratoire, pour sa gentillesse, sa disponibilité et sa rigueur scientifique. Ses compétences et son efficacité ont fortement contribué à la réalisation de ce travail. J’ai été particulierement sensible à la confiance qu’il m’a témoignée. Les tâches qu’il m’a confiées m’ont permis d’acquérir une expérience très enrichissante.
Je tiens également à exprimer mes sincères remerciements à Monsieur AHABCHANE Hamou Noureddine Professeur Habilité à la Faculté des Sciences de Rabat, pour l’honneur qu’il m’a fait en acceptant de siéger dans ce jury et pour ses encouragements. Je tiens encore à lui exprimer ma profonde gratitude pour son aide et tous ses précieux conseils.
Je tiens à adresser mes remerciements à Monsieur EL GHOUL Mostafa Professeur à la Faculté des Sciences de Rabat, qui a porté un intérêt considérable à ce travail et qui n’a ménagé aucun effort pour siéger au jury de cette thèse.
Je tiens à remercier Madame DJERRARI Bahia, Professeur à la Faculté des Sciences de Rabat, d’avoir accepté de faire partie de ce jury et à qui j’adresse mes plus vifs remerciements.
Je suis très reconnaissant à Monsieur MASSOUI Mohamed ancien Professeur à la Faculté des sciences de Kénitra pour l’honneur qu’il m’a fait de juger mon travail.
Je remercie très vivement Monsieur RAKIB El Mostapha Professeur à la Faculté des Sciences et Techniques de Beni-Mellal, pour avoir bien voulu juger cette thèse en tant que rapporteur et membre de jury.
Je tiens à remercier Messieurs BELLAN Jacques, WOLF Gérald, BERGON Michel et Madame MAZIERE Marie-rose Professeurs à l’Université Paul Sabatier de Toulouse, qui ont veillé au bon déroulement de mon stage à Toulouse je les remercie pour leurs conseils et pour l’aide qu’ils m’ont accordée, pendant mon séjour à toulouse.
Je suis particulièrement reconnaissant à Monsieur CHARRAH Yahia et Madame ZELLOU Amina du Laboratoire de Pharmacologie et Toxicologie de la Faculté de Médecine et de Pharmacie de Rabat pour m’avoir accueilli dans leur laboratoire.
Je remercie aussi Messieurs JOLY Nicolas et LEQUART Vincent professeurs à l’Institut Universitaire de Technologie de Béthune, pour leur aide constante efficace durant mon séjour à Béthune.
J’aimerais également remercier, Mesdemoiselles Farida OHMANI, Khadija KHEDID, Mesdames Jamila HAMAMOCHI, Aicha QASMAOUI et Monsieur Reda CHAROF de l’Institut National d’Hygiène de Rabat pour leurs conseils et leur aide lors de la réalisation des tests antibactériens.
Je tiens également à remercier tous les respectables Professeurs de l’UFR « Pharmacochimie » pour la qualité de leurs enseignements. Qu’ils soient tous honorés par ce travail.
Bien que la thèse soit fondamentalement un travail individuel, elle n’aurait pu être menée à bien sans une équipe de collègues qui contribuent au bon fonctionnement du laboratoire, avec lesquels il est possible d’échanger conseils et suggestions. Je remercie pour cela tous mes anciens et actuels collègues de laboratoire de Chimie Organique Hétérocyclique, dans le désordre: A. MOUSSAIF, Y. RAMLI, Z. BOUHARASS, A. HARMAOUI, M. L. DOUMBIA, M. R. ZEMMAMA., H. BENZEID, I. CHAKIB, R. MOHAMED, B. DOUAH., Y. BARAYALA, C. JARMOUMI, H. BENABDELKAMEL, A. MEKKAK, A. ALSUBARI, C. AHOYA.
Je suis particulièrement reconnaissant à Monsieur EL MANSOURI Mohammed Préparateur au Département de Chimie pour l’aide morale. Je lui exprime mes sincères remerciements.
SOMMAIRE
INTRODUCTION GENERALE :………1
Références bibliographiques: ...……….……...………....4
PARTIE I
CHAPITRE I : MISE AU POINT DE LA SYNTHESE, LA REACTIVITE ET
DE L'ACTIVITE BIOLOGIQUE DES ISATINES
Introduction :... 5A. ETUDE BIBLIOGRAPHIQUE DE LA SYNTHESE ET LA REACTIVITE DE L’ISATINE :... 5
I. Synthèse de l’isatine :... 5
I. 1. Méthode de Sandmeyer :... 5
I. 2. Utilisation des nitroacétanilides :... 6
I. 4. Méthode de Martinet :... 7
I. 5. Méthode de Gassman :... 8
I. 6. Métallation des dérivés de l'aniline :... 8
I. 7. Autres méthodes :... 9
II. Etude de la réactivité de l’isatine :... 12
II. 1. N-alkylation et N-arylation :... 12
II. 2. Réactivités du noyau aromatique :... 12
III. Applications de l’isatine en synthèse organique :... 13
III. 1. Réduction :... 13
III. 1. 1. Synthèse de l’indole :... 13
III. 1. 2. Synthèse de l’oxindole et dioxindole :... 14
III. 2. Oxydation :... 15
III. 4. Attaque nucléophile en C-2 et C-3 :... 16
III. 4. 1. Dérivés d’amines :... 16
III. 4. 1. 1. Ammoniac et hydroxylamine :... 16
III. 4. 1. 2. Alkyl amines :... 17
III. 4. 1. 3. Aniline et amines hétérocycliques :... 18
III. 4. 2. Réactifs nucléophiles oxygénés, soufrés et phosphorés :... 19
III. 4. 3. Réactifs nucléophiles carbonés :... 20
B. ACTIVITES BIOLOGIQUES DES ISATINES... 22
I. Activité sur le système nerveux central :... 22
I. 1. Activité antidépresseur :... 22
I. 2. Activité anticonvulsivante :... 22
I. 3. Activité anxiolytique... 26
II. Activité chimiothérapique :... 27
II. 1. Activité antibactérienne... 27
II. 2. Activités anti-VIH :... 29
II. 3. Activité anticancéreuse :... 30
III. Autres activités :... 31
Conclusion... 32
Références bibliographiqus: ...………..………...…31
CHAPITRE II: ETUDE DE LA REACTIVITE DE L'ISATINE
Introduction :... 38I. Étude bibliographique :... 38
I. 1. Alkylation de l’isatine :... 38
II. Réactivité de l’isatine :... 41
II. 1. Synthèse des N-alkylisatines :... 41
II. 2. Réaction d’acylation :... 45
II. 3. Action de l’hydrazine sur les isatines :... 46
II. 4. Action des o-phénylènediamines sur l’isatine :... 50
II. 5. Hydrolyse basique de l’ester :... 52
II. 6. Synthèse des acétamides dérivés de l’isatine :... 55
II. 7. Synthèse des quinoléines :... 60
Conclusion... 61
Partie expérimentale :... 62
Références bibliographiques : .………...………...……..……70
CHAPITRE III : SYNTHESE DE NOUVEAUX SYSTEMES
POLYHETEROCYCLIQUES PAR CYCLOADDITION DIPOLAIRE-1,3
Introduction... 75I. 3. Réactivité des nitrilimines... 79
II. Les oxydes de nitriles ... 82
II. 1. Synthèse des précurseurs des oxydes de nitriles ... 82
II. 2. Réactivité des oxydes de nitriles... 83
III. Les benzylazides :... 85
III. 1. Synthèse du benzylazide :... 85
III. 2. Réactivité des azides :... 85
B. ETUDE DES REACTIONS DE CYCLOADDITION DIPOLAIRE-1,3 SUR L’ISATINE ... 87
I. Etude bibliographique sur les réactions de cycloaddition sur l’isatine :... 87
II. Condensation de la N-allyl(propargyl)isatine avec la diphénylnitrilimine :... 90
II. 1. Action de la diphénylnitrilimine sur la N-allylisatine :... 90
II. 2. Action de la diphénylnitrilimine sur la N-propargylisatine... 91
III. Condensation de la N-allyl(propargyl)isatine avec la N-aryl-C-éthoxycarbonylnitrilimine.... 92
III. 1. Action de la N-aryl-C-éthoxycarbonylnitrilimine sur la N-allylisatine... 92
III. 2. Action de la N-aryl C-éthoxycarbonylnitrilimine sur la N-propargylisatine... 95
IV. Condensation de la N-alkylisatine avec l’oxyde de l’arylnitrile... 96
IV. 1. Action de l’oxyde de l’arylnitrile sur l’isatine et la N-benzylisatine... 96
IV. 2. Action de l’oxyde arylnitrile sur la N-allylisatine... 98
IV. 3. Action de l’oxyde de l’arylnitrile sur la N-propargylisatine... 99
V. Condensation de la N-propargylisatine avec le benzylazide... 104
Conclusion :... 107
Partie expérimentale : …….……….……..………...………...105
Références bibliographiques: ……….………..……….113
PARTIE II
CHAPITRE I : ETUDE DE LA TOXICITE AIGUË ET L’ACTIVITE
PSYCHOTROPE DES N-ALKYLISATINES
Introduction... 118A. ETUDE BIBLIOGRAPHIQUE :... 118
I. Psycholeptiques ou sédatifs psychiques... 119
I.1. Les Hypnotiques... 119
I.2. Les Anxiolytiques... 120
I.3. Les Neuroleptiques ou Antipsychotiques... 120
II.1. Les Antidépresseurs... 120
B. ETUDE DE LA TOXICITE AIGUE ET DE L’ACTIVITE PSYCHOTROPE... 121
I. Étude pharmacologique:... 121
I. 1. Matériels :... 122
I. 2. Méthodes :... 123
II. Résultats :... 125
II. 1. Toxicité aiguë :... 125
II. 2. Évolution de poids corporel :... 127
II. 3. Activité psychotrope :... 128
III. Discussion :... 129
Conclusion : ... 129
Références bibliographiques: ………..……..………..…..130
CHAPITRE II : EVALUATION DE L’ACTIVITE ANTIMICROBIENNE
DE QUELQUES DERIVES DE L’ISATINE
Introduction :... 133I. Techniques d’études in vitro du pouvoir antimicrobien :... 133
I. 1. Technique d’étude en vapeur :... 134
I. 2. Technique d’étude sur milieu solide :... 134
I. 3. Micro-organismes utilisés:... 135
I. 4. Technique de l’étude utilisée :... 137
I. 5. Préparation des suspensions de micro-organismes :... 137
I. 6. Technique de diffusion sur gel :... 137
I. 7. Témoin :... 138
I. 8. Produits testés :... 139
II. Résultats et discussion :... 140
Conclusion :... 145
Références bibliographiques:……….………..………….….146
ABREVIATIONS ET SYMBOLES
AcOEt Acétate d’éthyle I.P. intrapéritonéale
ATCC American Type Culture Collection m multiplet
Boc Tertio-butyloxycarbonyl MAO Monoamine oxydase
CBz Carbobenzyloxy MeCN Acétonitrile
CCM Chromatographie sur couche mince MeOH Méthanol
CDCl3 Chloroforme deuterié MHA Milieu Hanton Agar
CMI Concentration minimale inhibitrice MPA Acide mércaptopropionique COSY Corrélation spectroscopy NBS N-bromosuccinimide CTP Catalyse par transfert de phase OAc acétate
d Doublet PTZ Pentylènetétrazole
DCM Dichlorométhane q Quadruplet
dd Doublet dedoublé RMN Résonance magnétique nucléaire DEPT Destortion enhancement by
polarisation transfer
Rdt Rendement
DL50 Dose létale 50 s Singulet
DMF Diméthylformamide SM Spectrométrie de masse
DMSO-d6 Diméthylsulfoxyde deuterié SNC Système nerveux central
DPNI diphénylnitrilimine t Triplet
EDC 1-Éthyl-3-[3-diméthylaminopropyl] carbodiimide
t-Bu Tertio-butyl
EtOH Éthanol TEA triéthylamine
GABA γ−aminobutyric acid TA Température ambiante
h heure TCBS Tryptophan cystéine borth soja
HMQC Heteronucléaire multiple bond corrélation
THF Tétrahydrofurane
HOBt 1-hydroxybenzotriazole TMS Tétraméthylsilane
L’étude des systèmes hétérocycliques à cinq chaînons a connu un développement considérable, dû à la mise en évidence de leurs activités biologiques. L’indole est parmi une large variété des hétérocycles étudiés pour développer de nouvelles molécules actives.
En synthèse organique, plusieurs complexes des isatines avec les métaux de transition ont été utilisés comme catalyseurs des réactions de couplage oxydant des alkylphénols.[1-2]
D’autre part, Les isatines oximates de lithium et de thallium ont été employés dans la fabrication des électrodes sélectives aux ions de ces cations.[3]
La condensation de l’isatine avec différente amino-hétérocycles a permis d’isoler des dérivés de l’indole utilisé comme colorants.[4-7] Ainsi, les azobisisatines sont des colorants des matériaux plastiques, alors que les méthylèneoxindoles et les thioindigoidthiazolidines sont employés pour la teinture des fibres naturels et synthétiques.[8-10] (Figure 1)
N H H N O O N O N X N N O R R R1 R1 N O R R1 NC N H N Figure 1
Il est à noter que, les dérivés de l’indole présentent des activités pharmacologiques intéressantes, à titre d’exemple :
L’Indacin A appartient à la classe chimique des indoles. Elle est utilisée en thérapeutique principalement en raison des ses propriétés anti-inflammatoire, antipyrétique et analgésique.
Le produit B est un dérivé de l’indole utilisé en thérapeutique pour ses propriétés anti-tumorales. (Figure 2)
N CH3 OH O O Cl O H3C A N O N Cl Cl O O CH3 CH3 B N H NH C Figure 2
Compte tenu des activités pharmacologiques importantes que présentent ces hétérocycles, et dans le but de contribuer au développement de la chimie de l’isatine, nous nous sommes intéressés à la synthèse de nouveaux systèmes hétérocycliques polyfonctionnels dérivés de l’isatine, en faisant appel à des réactions d’alkylation dans les conditions de la catalyse par transfert de phase; aux réactions de cyclo-condensation et de cycloaddition dipolaire-1,3. Les composés ainsi synthétisés, seront ultérierement évalués pour leurs propriétés biologiques.
Les résultats que nous avons obtenus lors de cette étude seront exposés en deux parties.
La première partie sera consacrée à la synthèse de nouvelles molécules dérivées de l’isatine.
Le premier chapitre de cette partie rapporte un aperçu bibliographique sur la synthèse, la réactivité de l’isatine ainsi qu’une étude de l’activité biologique des dérivés de l’isatine.
Le deuxième chapitre traitera de la réactivité de l’isatine. Des dérivés N-alkylés, obtenus par catalyse de transfert de phase, seront par la suite soumis à des réactions de condensation avec l’hydrazine afin d’obtenir les hydrazones correspondantes, de l’o-phénylènediamine afin d’aboutir à des indoloquinoxalines ou avec des amines secondaires pour conduire à des acétamides susceptibles de présenter des activités antimicrobiennes.
Le troisième chapitre sera consacré à la synthèse de différents précurseurs des dipôles-1,3 utilisés par la suite dans des réactions de cycloaddition dipolaire-1,3, engageant comme dipôles les nitrilimines, les oxydes de nitrile et le benzylazide et comme dipolarophiles les dérivés
Ainsi dans le premier chapitre, nous évaluerons la toxicité aigüe ainsi que l’activité psychotrope de trois dérivés de la N-alkylisatine. Nous montrerons que ces derniers présentent des propriétés biologiques intéressantes.
L’étude de l’activité antimicrobienne de certains dérivés de l’isatine contre une série des souches bactériennes à gram positif et négatifsera également réalisée.
Références bibliographiques
1. T.F. Rutledge, US 4, 100, 203, 1978. (CA 90:P71895q) 2. T.F. Rutledge, US 4,100,205, 1978. (CA 90:P103608s)
3. E. Jansons, K. Puke, D. Cedere, Latv. Kim. Z., 1992, 680. (CA 118:246373u) 4. G. Lang, J. Cotteret, Eur. Pat. Appl. EP 502,783, 1992. (CA 117:P257972u) 5. H. Moeller, H. Hoffkes, WO 9847472, 1998. (CA 129:P347133y)
6. G. Rosenbaum, J. Cotteret, US 4750908, 1988. (CA 107:P120859m) 7. J.S. Anderson, T.M. Schultz, US 4921503, 1990. (CA 113:P217781s) 8. W. Mueller, Swiss 580, 673, 1976. (CA 86:P6388e)
9. F. Merlo, G. Bornengo, Eur. Pat. Appl. 3, 565, 1979. (CA 92:P7839p)
MISE AU POINT DE LA SYNTHESE, DE
LA REACTIVITE ET DE L'ACTIVITE
BIOLOGIQUE DES ISATINES
CHAPITRE I
Introduction :
L’isatine est un composé endogène identifié chez l’homme comme dérivé métabolique de l’adrénaline. Elle a été obtenue dans un premier temps comme étant un produit d’oxydation de l’indigo par l’acide nitrique et l’acide chromique. Elle a été trouvée dans le tissu de certains mammifères, comme modulateur de processus biochimique, et dans des plantes de genre Isatis.
[1-3]
L’isatine et ses dérivés ont montré des propriétés anxiolytiques, sédatives, anticonvulsivantes. Ils se sont avérés de bons antagonistes de récepteurs des peptides natriuritiques.[4,5]
A. ETUDE BIBLIOGRAPHIQUE DE LA SYNTHESE ET LA REACTIVITE DE L’ISATINE :
I. Synthèse de l’isatine : I. 1. Méthode de Sandmeyer :
Plusieurs méthodes ont été utilisées pour la synthèse de l’isatine ; celle développée par Sandmeyer est la plus fréquemment utilisée.[6-7] Elle consiste en la condensation de l’aniline 1a-c avec le trichloroéthandiol et le chlorhydrate d’hydroxylamine en présence du sulfate de sodium aqueux. L’isonitroacétanilide 2a-c formé est traité avec l’acide sulfurique concentré, pour donner l’isatine 3a-c correspondante (Schéma 1).
N O O H NH2 N NOH O H Cl3CCH(OH)2 NH2OH,HCl H2SO4 1a: X= H 1b: X= Cl 1c: X= Br 2a: X= H 2b: X= Cl 2c: X= Br 3a: X= H 3b: X= Cl 3c: X= Br X X X Schéma 1
De même Loloiu et coll.[8] ont fait réagir quelques amines hétérocycliques telle que la 2-aminophénoxathine 4. Ils ont ainsi isolé l'isatine correspondante 5 (Schéma 2).
S O NH2 S O N H O O 4 5 Schéma 2
I. 2. Utilisation des nitroacétanilides :
Kearny et coll.[9] ont obtenu le nitroacétanilide 9 à partir du 1-arylamino-l-méthylsulfanylo-2-nitroéthène 8, qui par hydrolyse alcaline, est aisément cyclisé en isatin-3-oxime 12. Ce dernier traité par l'acide sulfurique concentré ou l'acide trifluorométhane sulfurique, à température ambiante, conduit à l'isatine correspondante (Schéma 3).
NH2 O2N SMe MeS N SMe NO2 N O NO2 N O N OH OH N O H N HO OH N NOH O H R R H H H R R R R - H2O 6 7 8 9 10 11 12 H2SO4 NaOH N O O H R H2SO4 TFA 13 Schéma 3
La méthode de Stolle,[10] consiste en l’action des anilines avec le chlorure d’oxalyle pour former un intermédiaire chloro-oxalylanilide qui se cyclise, en présence d’un acide de Lewis, pour donner l’isatine correspondante.
H3CO OCH3 NH2 N O O H OCH3 H3CO (COCl)2 14 15 Schéma 4 I. 4. Méthode de Martinet :
Le procédé de Martinet[12] met en jeu l’action d'une amine aromatique 1a sur l'ester d'oxomalonate 16 ou son hydrate en milieu acide permettant d’obtenir l'acide 3-(3-hydroxy-2-oxindole) carboxylique 17, qui après décarboxylation, conduit à l'isatine 3a (Schéma 5).
NH2 N O H CO2R HO N O O H CO2R O CO2R 1a 16 17 3a Schéma 5
Les mêmes auteurs ont réalisé avec succès la synthèse de la 5,6-diméthoxyisatine 18 en partant du 4-aminovératrole 19 (Schéma 6).
NH2 MeO MeO N O O H MeO MeO 18 19 Schéma 6
I. 5. Méthode de Gassman :
Gassman et coll.[13,14] ont développé un procédé général pour la synthèse de l'isatine. Celui-ci consiste en la formation de l'intermédiaire 3-méthylsulfanyl-2-oxindole 20. L’halogénation suvi de l'oxydation de ce dernier, donne les isatines substituées correspondantes avec un rendement de 40 à 81% (Schéma 7).
NH2 R N SMe O H N O H SMe Cl N O O H R R R 1- tBuOCl 2- MeSCH2CO2Et 3- Et3N 4- H3O+ S CO2Et Cl Cl 1-2- Et3N 3- H3O+ NCS HgO/ BF3 ou H2O/ THF/ ∆ 6 20 21 13 Schéma 7 I. 6. Métallation des dérivés de l'aniline :
Une méthode plus récente pour la synthèse de l'isatine est basée sur l'ortho-métalation orientée de la N-pivaloyl et N-(tertiobutoxycarbonyl)-aniline 22. Les dianions correspondants sont traités avec l'oxalate du diéthyle. Les isatines 24 sont obtenues après déprotection et cyclisation de l'intermédiaire α-cétoester 23, avec un rendement de 79 à 89%.
Cette méthode a l'avantage d'être régiosélective pour la synthèse des isatines 4-substituées à partir des anilines méta 4-substituées[15] (Schéma 8).
N O O H R N O O H R O O N O O H R 1- n-BuLi, THF 2- oxalate de diéthyle HCl 12 M THF/ ∆
Récemment, Smith et coll.[16] ont décrit une méthode pour la synthèse d'isatines par lithiation de la N-(2-bromoaryl)-N,N-diméthylurée 25 avec le méthyllithium et le tertio-butyllithium sous atmosphère d’azote dans le THF anhydre à 0 °C. Elle donne des dérivés de l'arylurée 26 qui réagissent avec l'oxyde de carbone à 0 °C pour conduire aux isatines 27 avec de bons rendements (Schéma 9).
N N O H Br N Li O O N Me Me N O O R Li H R 1- MeLi, 0 °C 2- t-BuLi, 0 °C 3- CO 1- CO 2- H3O+ R 25 26 27 Schéma 9 I. 7. Autres méthodes :
Les méthodes précédemment décrites sont les plus générales pour la synthèse d'isatines. Cependant d'autres méthodes ont été employées, mais elles sont moins générales et quelques-unes ont pour rôle principal la synthèse d'isatines désirées avec un faible rendement.
C'est ainsi que, Parrick et coll.[17] ont développé une méthode synthétique d' isatine à partir de l'indole 28, La bromation de ce dernier, suivi de l'oxydation donne le 3,3-dibromo-oxindole 29 qui s'oxydent en isatines désirées (Schéma 10).
N H N H Br Br O N H O O NBS Oxydation 26 27 3a Schéma 10
Dans une méthode similaire, les 2-oxindoles 4 et 6-disubstitués 32, obtenus à partir d'o-nitroarylmalonates 31, ont été convertis en 3,3-dibromo-oxindoles 33 par action du pyridinuim
hydrobromide perbromide. Ces intermédiaires ont été hydrolysés en isatines 34 correspondantes[18] (Schéma 11). Cl NO2 R1 R2 R3 NO2 R1 R2 R3 CO2Et CO2Et N H O N H Br Br O N H O O R1 R2 R3 R1 R2 R3 R1 R2 R3 H2O/ MeOH Py, HBr, Br2 Sn, HCl (EtO2C)2CH2 NaH 30 31 32 33 34 Schéma 11
Il est à noter que Meth-Cohn et coll.[19] ont observé, que le traitement du produit obtenu par dimérisation des réactifs de Vilsmeir, préparés à partir de N-méthylformamides 35 dans l’oxychlorure de phosphore (POCl3), en présence d’une amine tertiaire donne, après hydrolyse,
les isatines 39 avec des rendements de 11 à 79%. Les meilleurs rendements ont été observés quand le brome a été utilisé comme espèce électrophile (Schéma 12).
X N Me CHO X N Me Cl X N Me N Cl Me Ar Cl N CH3 N Cl O Ar N CH3 O O X X Me POCl3 base de Hünigs 1- Br2 2- H2O H2O 35 36 37
Yamamoto et coll.[20] ont pour leur part, proposé une synthèse de l'isatine, basée sur l'utilisation du palladium comme catalyseur de double carbonylation de l'ortho-haloacétanilides 40 en présence de la diéthylamine pour obtenir l'amide de l'acide glyoxylique 41 correspondant. L'hydrolyse de ce dernier, conduit à l'isatine 3a correspondante (Schéma 13).
X NHAc NH2 CONEt2 O NH2 NEt2 O N H O O 40: X = I, Br CO, Pd Et2NH HCl 3M 41 42 3a Schéma 13
Bergman[21] a pu préparer la 1-(diméthylamino)isatine 46, à partir de cyclohexanone 43 en trois étapes; la dernière impliquant une oxydation par le dichlorodicyanoquinone de l’intermédiaire 45 (Schéma 14). O N N Me Me H N OH O N O O N Me Me N Me Me H2NNMe2 (COCl)2 DDQ 43 44 45 46 Schéma 14
II. Etude de la réactivité de l’isatine : II. 1. Alkylation et arylation :
Plusieurs méthodes de N-alkylation d'isatines ont été décrites dans la littérature. Ces dérivés sont généralement synthétisés par réaction du sel de sodium de l'isatine avec les halogénures d’alkyle ou les sulfates d’alkyles.[22,23] Ces sels sont préparés par réaction de l’isatine avec l’hydrure de sodium dans le toluène ou le DMF à reflux.[24] Plus récemment l'utilisation de CaH2 dans le DMF a été utilisée pour la synthèse des mono et des
bis-N-alkylisatines.[25] Ces derniers composés ont été préparés également en utilisant les dihalogénoalcanes et l’hydrure de sodium dans le dioxane. Certaines de ces méthodologies d’alkylation ont été évaluées pour le greffage de l’isatine sur un résidu glucosidique lié avec la position N-1.[26]
D'autre part, le composé de O-alkylation en position 2 a été obtenu, avec le produit N-alkylé, par utilisation du γ-butyrolactone comme agent d’alkylation avec le sel de sodium de l'isatine.[27] Ainsi, le O-méthylisatine est décrit comme étant le produit de la réaction de l’iodure de méthyle avec le sel d'argent de l'isatine, qui peut être préparé en présence de l'acétate d'argent.[28]
Notons que les N-arylisatines peuvent être obtenus par réaction de l’isatine avec le Ph3Bi(OAc)2 et Cu0 dans une atmosphère inerte ou par action des bromures d’aryle en présence
de l’oxyde de cuivre.[29]
II. 2. Réactivité du noyau aromatique :
Bien que, la plupart des isatines à noyau aromatique substitués sont obtenues à partir des anilines substituées, elles peuvent être préparées par substitution électrophile aromatique.
Ainsi, la nitration de l’isatine s’effectue dans un mélange sulfonitrique à température contrôlée, aboutit à la 5-nitroisatine. Cependant la bromation en présence des alcools, en milieu acide, donne le 5,7-dibromo-3,3-dialkyloxoxindole. La monobromation en position 5 peut être réalisée par l’utilisation du N-bromosuccinimide en milieu acide.[30]
III. Applications de l’isatine en synthèse organique :
Plusieurs méthodologies ont été décrites dans la littérature pour la conversion de l’isatine en d’autres systèmes hétérocycliques. Cette chimie a été adoptée dans les stratégies suivantes :
- Réduction partielle ou totale de l’hétérocycle pour obtenir l’indole et ses dérivés. - Réaction d’oxydation.
- Addition nucléophile en C-3, qui peut être suivie d’une cyclisation.
- Addition nucléophile en C-2 conduisant à l’ouverture du noyau hétérocyclique.
III. 1. Réduction :
III. 1. 1. Synthèse de l’indole :
La réduction de l’isatine est effectuée avec les hydrides métalliques dans un solvant polaire aprotique tel que le THF, dans une atmosphère inerte pour conduire aux indoles.
Ainsi, Mencagli et coll.[32] ont réalisé la réaction d’alkylation chimiosélective de l’isatine en position N-1 ou C-3, suivie d’une réduction avec l’hydrure de lithium et d’aluminium, conduisant aux 1- ou 3-alkylindoles 47 et 48 (Schéma 15).
N O O N N R R H H 1) RLi 2) LiAlH4 1) NaH 2) RX 3) BH3; THF 47 48 3a Schéma 15
La synthèse du Pemedolac 511 (analgésique) et celle des alcaloïdes hobartine et aristotoline, ont été initiées par une alkylation de C-3 de l’isatine pour obtenir les dioxindoles 49 correspondants, qui sont réduits en présence de l’hydrure de lithium et d’aluminium[33] (Schéma 16).
N O O N O HO CO2Me N N CO2H CO2Me H LDA H H H H LiAlH4 49 50 51 3a OH Schéma 16
D’autre part Dzyubenco et coll.[34] ont étudié la réaction de l’isatine-3-oxime 52 par le zinc en milieu acide. Ils ont obtenu les acétamido-oxindoles 53, qui après action de pentasulfure de phosphore, conduisent aux indolothiazoles 54 avec de bons rendements (Schéma 17).
N NHOH O N NHAc O N S N Me R R R Me Me Me Zn AcOH/ Ac2O P4S10 52 53 54 Schéma 17
III. 1. 2. Synthèse de l’oxindole et dioxindole :
La préparation des oxindoles et des dioxindoles par réduction partielle de l’isatine, est largement étudiée en synthèse organique, particulièrement dans le développent de nouveaux médicaments.
oxindole correspondante par réaction avec le tétracarbonylhydridoferrate de potassium [KHFe(CO)4].[35]
Alors que les oxindoles sont préparés par réduction de dioxindole ou de l’isatine, cette réaction peut s’effectuer en utilisant l’hydrogène sulfuré dans la pyridine ou par l’utilisation des conditions de Wolf-Kishner en présence de l’éthanol ou de l’i-propanol.[36]
Cependant la condensation de l’isatine 3a avec l’oxindole 55 en milieu acide permet d’isoler l’isoindigo 56. La réduction diastéreosélective de ce dernier en présence de Zn/HCl, suivie d’un réarrangement acido-catalysé, conduit au diazacrisenodione 58[37] (Schéma 18).
N O O N O N O N O N O N O N N H O O H H H H H H H H H AcOH, HCl Zn, HCl HCl 4M 55 56 57 58 3a Schéma 18 III. 2. Oxydation :
En présence de l’eau oxygénée, ou l’anhydride chromique, l’isatine 3a s’oxyde en anhydride isatoïque 59. Ce dernier par condensation avec la proline dans un solvant polaire aprotique à haute température ou en présence d’un catalyseur enzymatique (la catalase), conduit aux pyrrolo[1,4]benzodiazépines 60 (anti-tumoraux)[38] (Schéma 19).
N O O N O O O N N O O H N CO2H H H H H R R CrO3 catalase 59 60 3a Schéma 19
L’utilisation de l’acide métachloroperbenzoïque comme oxydant, permet de conduire à la 1,4-benzoxazine-2,3(4H)-dione 59, précurseur de la blepharin 61 (glycoside obtenu de Blepharis edulis Paris)[39] (Schéma 20).
N O O N O O O H H MCPBA N O OH O H N O O O H O HO OH OH OH KBH4 59 60 61 3a Schéma 20
III. 4. Attaque nucléophile en C-2 et C-3 :
L’isatine peut subir une attaque nucléophile en position C-2 et C-3. La chimiosélectivité de ces réactions dépend de la nature du nucléophile utilisée, de celle des groupements liés à l’atome d’azote, ainsi que de la polarité du solvant et de la température.
de l’isatine avec un équivalent de l’ammoniac ; l’intermédiaire 65 ainsi formé, subit une lactonisation suivie par une attaque nucléophile intramoléculaire. L’action d’une deuxième molécule d’ammoniac conduit à l’amide correspondant 66[40] (Schéma 21).
N O O R1 NH3 N O R1 N HO N O H N NH N R1 O R2OC 64 65 66 NH3 Schéma 21
La condensation de l’isatine et des 1-alkylisatines avec l’hydroxylamine ou de l’O-méthyhydroxylamine, en milieu aqueux conduit aux 3-oximes correspondants. Par contre l’action de l’hydroxylamine sur le 1-acétylisatine 67, conduit au quinazolin-3-oxyde 69, résultant de l’oxydation de l’acide hydroxamique 68[41] (Schéma 22).
N O O NH O O NOH O NHOH N N O CONHOH NH2OH, HCl -H2O 67 68 69 Schéma 22
III. 4. 1. 2. Alkyl amines :
La condensation de l’isatine ou de la 1-alkylisatine avec des alkylamines primaires conduit aux isatin-3-imines correspondantes. Si la réaction est effectuée avec des alkylamines secondaires la réaction conduit à un composé résultant de deux attaques nucléophiles avec l’amine sur le carbone en positon 3 de l’isatine. D’autre part, la réaction de l’isatine 3a avec le N,N-diméthyléthylènediamine dans l’eau, conduit au spiro-diazolaneoxindole 71. Cependant
lorsque la réaction est effectuée dans le toluène avec distillation azéotropique, il a été possibe d’isoler un composé 70 résultant de l’addition de l’azométhine ylide sur l’isatine[42] (Schéma 23).
N O O H N N N O H N O H N N N O N O NH2 Toluène, ∆ H2O 70 71 3a Schéma 23
III. 4. 1. 3. Aniline et amines hétérocycliques :
La condensation de l’isatine avec les o-phénylènediamines 70, conduit aux indophénazines 74, isatin-3-imines 73 et/ou spirobenzimidazoles 72. Les proportions de ces composés dépendent essentiellement de la polarité des solvants. Ainsi, l’indophenazines sont obtenues avec des rendements de l’ordre de 89% en utilisant l’acide acétique comme solvant. L’isatin-3-imines 73 sont obtenues avec des rendements de l’ordre de 90%, en utilisant le THF ou le benzène et de 50% avec le méthanol. L’utilisation d’un solvant polaire aprotique tel que le N,N-diméthylacétamide à haute température, conduit au spirobenzimidazole avec un bon rendement[43] (Schéma 24).
N O O NH2 NH2 H N O H NH HO NH2 N O H N NH2 N H N N N O H HN NH DMA, ∆ AcOH THF AcOH 3a 70 71 72 73 74 Schéma 24
III. 4. 2. Réactifs nucléophiles oxygènes, soufrés et phosphorés :
L’isatine et les 1-arylisatines s’hydrolysent dans des solutions alcalines, conduisant aux isatinates. Des études cinétiques et thermodynamiques ont été effectuées dans des conditions physiologiques, montrant que certaines activités biologiques et pharmacologiques décrites pour l’isatine sont, en effet, dues à la présence des isatinates. L'hydrolyse de l’isatine, en fonction du pH, a été également étudiée[44] (Schéma 25).
N O O H N O H OH O N O H O O N O OH O NH2 O CO2H NH2 O CO2 NH O CO2 H H 5<PH<6 6.5<PH<10.5 10.5<PH<12 3a 75 76 77 78 79 Schéma 25
La réaction de sulfuration de l’isatine 3a avec le pentasulfure de phosphore dans la pyridine, permet d’obtenir le pentathiepino[6,7-b]indole 80[45] (Schéma 26).
N O O H N S S H S S S P4S10 Pyridine/ ∆ 3a 80 Schéma 26
L’addition des dialkylphosphites à l’isatine 89 et aux dérivés N-substitués, sur le carbone C3, génère le dioxindolophosphite. Le chlorophosphite réagit d’une manière similaire conduisant aux oxydes de la 3-(3-chlorooxindolyl)phosphine 90[46] (Schéma 27).
D’autre part, les dioxaphospholanes cycliques, les phosphites et les trialkylphosphites, réagissent avec l’isatine pour donner le dimère du spiro-phospholanes.
N O O R N O R (PhO)2PX X = OH, Cl POPh2 X 89 90 Schéma 27
III. 4. 3. Réactifs nucléophiles carbonés :
La condensation de Knovenagel, de l’isatine avec le cyanoacétate d’éthyle, conduit à un mélange d’isomères E et Z de 3-[cyano(éthoxycarbonyl)méthylène]-2-oxindoles. Des études approfondies de RMN et de la chimie quantique ont montré également que l’isomère E existe en équilibre entre deux conformères ; le trans-s-cis 92 et le trans-s-trans 91[47] (Schéma 28).
N O O R NC CO2Et N O R NC CO2Et N O R CN N O R CN OEt O O EtO 89 90 91 92 Schéma 28
Les isatinates obtenus par hydrolyse basique de l’isatine, sont des précurseurs de synthèse de l’acide quinoline-4-carboxylique. Ces composés sont préparés en faisant appel à la réaction de Pfitizenger à partir de l’isatine et d’une cétone énolisable en milieu alcalin (8 mol.L-1 KOH). Dans cette réaction, l’isatinate se condense avec les composés cétoniques et se cyclisent en quinolines.[48]
Notons qu’une autre méthode a été décrite pour la synthèse des quinolines, utilisant des conditions acides. Ainsi, Lackey et coll.[49] ont appliqué cette méthodologie pour la synthèse du camptothecin (inhibiteur de topoisomerase I) 95 (Schéma 29).
N O O H R R N N O O HO CO2H O N O O O OHO 1- AcOH, HCl, TA 2- AcOH, HCl, ∆ 93 94 95 Schéma 29
III. 4. 4. Réactifs nucléophiles halogénés :
La réaction de l’isatine 3a avec le pentachlorure de phosphore dans le benzène à température ambiante, conduit au 3,3-dichlorooxindole 96. Cet intermédiaire a été utilisé dans la synthèse des oxindoles substitués en position 3 en mettant en jeu des agents nucléophiles tels que KSCN, les amines et les thiols. Cependant lorsque la réaction est effectuée, au reflux de benzène, les auteurs ont isolé la 2-chloro-3H-indol-3-one 97[50] (Schéma 30).
N O O H N O H N O Cl Cl Cl benzéne, ∆ PCl5 3a 96 97 Schéma 30
B. ACTIVITES BIOLOGIQUES DES ISATINES I. Activité sur le système nerveux central :
I. 1. Activité antidépresseur :
Les dérivés de l’isatine présentent un large spectre d’activité. Ils agissent comme inhibiteurs puissants de la monoamineoxydase (MAO). Ils possèdent des propriétés anticonvulsivants et anxiolytiques. Des propriétés de l’isatine relatives à l’augmentation de la vigilance ont été également mises en évidence.[51-53]
I. 2. Activité anticonvulsivante :
Bhattachaya et coll.[54] ont montré que l’isatine exerce des effets anxiolytiques sur le système nerveux central à des doses de 15-20 mg/kg, par voie intrapéritonéale. A des doses plus élevées des effets anticonvulsivantes significatifs contre Pentylènetétrazole (PTZ) et l’acide mércapto propionique (MPA) ont été mises en évidence.
Ils ont observé également que l’isatine intervient comme un antagoniste puissant du récepteur des peptides natriuritiques.
Pajouhesh et coll.[55] ont synthétisé une série de cétones cycliques dérivées de l’isatine et evalué leurs activités anticonvulsivantes. Un nombre considérable d’analogues ont montré une activité importante (Figure 1).
N H O HO O R R1 R = H, 1-CH3, 5-Br, 5-NO2, 4-Cl, 7-CH3 R1 = 2-méthyl cyclohexanone, 2-cyclohexyl cyclohexanone 3-méthyl cyclohexanone Figure 1
Jain et coll.[56] ont synthétisé une série de composés condensés en réagissant un système hétérocyclique comme l’isatine, la 5-fluoroisatine avec le cyanoacétate d’éthyle et des cétones substituées. Les produits obtenus ont montré une activité anticonvulsivante.
Blackburn et coll.[57] ont montré que les indoles comme la 1-[5-(2-thiènylméthoxy-1H-indol-3-yl)]propan-2-amine, ont été utilisés dans le traitement et la prévention de l’épilepsie et la migraine (Figure 2). N H O O NH2 CO2C2H5 C6H5OC H3C F Figure 2
Olesen et coll.[58] ont préparé les pyrido[2,3-b]indoles pour le traitement des maladies du systeme nerveux central via les récepteurs de métabotrophique glutamate. Ils sont utilisés également pour le traitement de l’épilepsie et la maladie de Parkinson (Figure 3).
N N R5 R8 R7 R6 R4 R3 R2 R1 R1 = H, C1-6 alkyl; C2-6 alkenyl R2 = piperidino, morpholino R3 = H, COOH, CN R4 = H, C1-6 alkyl; R5 = R8 = H, NO2, NH2 Figure 3
Sharaf[59] a synthétisé les pyrido-indoles et les indole-thiazépines pour leurs activités anticonvulsivantes, analgésiques, anti-inflammatoires et anti-ulcéreuses. Tous les produits ont montré une activité anticonvulsivante et analgésique importante (Figure 4).
N NH O N O R1 X R3 R4 X = H, halo, alkoxy, CF3 R1 = H, alkyl, cyclopropyl
R2 = alkyl, phényl alkyl, cyclohexyl méthyl, thiènylméthyl R3 = R4 = H, alkyl, alkoxycarbonylalkyl, phenyl alkyl, pyrrolidinyl, piperidinyl, morpholinyl, thiadiazonyl
Figure 4
Evanno et coll.[60] ont synthétisé des dérivés de la 4-oxo-3,5-dihydro-4H-pyridazono-[4,5-b]indole-1-acétamide, peuvant être utilisées pour traiter les maladies liées aux récepteurs GABA aminérgiques. Les composés ont également montré des activités hypnotiques et anticonvulsivantes (Figure 5). N N N O N R3 R2 X R1 N N N O OCH3 C2H5 F O Y O
X = H, halo, CH3, OCH3, OBn Y = H, halo, CH3, OH, OCH3, NO2 R1 = H, C1-4 alkyl,
R2R3 = H, C1-4, Bn or azetidine, pyrrolidinyl, pepiridinyl, morpholinyl, 1,3-thiadiazolinyl
Figure 5
Karali et coll.[61-62] ont préparé des dérivés de la 3-thiosemicarbazone indolinone à partir de la furfuryl dihydro triazole thione appropriées. Certains composés ont montré des activités anticonvulsivantes (Figure 6).
N N O NH S NHR2 R R1 N O R R1 S N O R2 R = H, COCH3; R1 = H, Br; R2 = CH3, C2H5, C6H5 Figure 6
Gursoy et coll.[63] ont synthétisé une nouvelle série de 3-aryloxy(arylthioacétyl) hydrazino-2-indolinones méthyl-3-aryloxyaryl-1-morpholinothioxyacétylhydrazino-2-ones. L’évaluation anticonvulsivant de ces composés a révélé des activités contre la pentylènetetrazole (PTZ) (Figure 7). N N O XR1 H R O X = O, S; R = H, Br; R1 = C6H5, 3-CH3C6H4, 4,5-diphényl-(1H)-imidazol-2-yl Figure 7
Galambos[64] a préparé des dérivés de la 3-spiroindole optiquement actifs. Les produits ont montré une activité hypnotique, anticonvulsivante et une protection contre des œdèmes cérébraux (Figure 8). N H N H N H H O O X X N X = H, halo Figure 8
Pendeya et coll. [65-68] ont synthétisé une série de dérivés de bases de Schiff de la N-méthyl et N-acyl isatine, par action de différentes arylamines, et les avaient examinés pour leur activité anticonvulsivante.
La N-méthyl-5-bromo-3-(p-chlorophénylamino) isatine, a donné une DL50 de l’ordre de
600 mg/kg, montrant ainsi une meilleure activité que certains médicaments (Phenytoin, Carbamazepine et l’acide valproique).
I. 3. Activité anxiolytique
Palit et coll.[69] ont étudié les effets comportementaux de l’isatine, ils ont montré que l’isatine est un constituant essentiel du tribulin marqueur endocoïde de stress et de l’inquiétude (Figure 9). N O N R2 R1 R R= Br, NO2; R1 = CH3, COCH3 R2 = NO2, COOH, OCH3, Cl, F Figure 9
Medvedev et coll.[70] ont étudié une gamme d’analogues de l’isatine pour leur inhibition in vitro de MAO A et B humain. La plupart de ces analogues étaient moins puissants que l’isatine.
L’hydroxylation du cycle benzénique a changé la puissance inhibitrice en faveur de MAO A.
L’analyse de la relation structure activité a révélé l’exigence d’une structure plane et des substituant en C-2 et C-3, pour avoir une sélectivité pour le MAO (Figure 10).
N H O O HO NH2 O COOH Figure 10
II. Activités chimiothérapiques : II. 1. Activité antibactérienne
Varma et Nobles[72] ont montré que certains dérivés de la 3-semicarbazone isatine, présentent des propriétés antivirales, antifongiques et antimicrobiennes (Figure 11).
N N O NH S NH2 R R1N N O O R R = H, CH3, Br; R1 = piperidino, morpholino, diéthylamino, 3-méthyl pepiridino
R1N
R = H, Br; R1 = piperidino, morpholino, N(C2H5)2, p-(propylbenzyl)-piperidino
Figure 11
Kupinič et coll. [73] ont synthétisé une série de bases de la N-Mannich isatine et évalué leurs activités antimicrobiennes. La plupart des composés préparés ont fortement inhibé les bactéries à gram négatif, et les moisissures (Figure 12).
N R2 O R3 R1 R1 = H, CH3, CH2N(CH2CH2OH)2, CH2N(CH2CH2Cl)2, CH2C4H8NO, CH2NC5H10; R2 = O, NNHCOCH3, NNHCH3, NNHCSNH2, NNHCOOH; R3 = H, NO2 Figure 12
Une série de 5-halogéno isatines, méthylées en position 1 et un groupe hydrazino en position 3 a été synthétisée par Maysinger et coll.[74]. Les bases de Mannich synthétisées ont été évaluées contre des bactéries et des moisissures. Le composé le plus actif est le 5-chloro-1-(( di-i-propylamino)méthyl)-3-hydrazonoindolin-2-one.
Daisley et shah[75] ont examiné les activités antimicrobiennes et antimycotiques d’une série de la 5-nitro-3-phényl iminoindole-2-one. L’inhibition de la croissance des bactéries à gram positif a été observée. Par contre l’activité antimycotique est absente.
Dilber et coll.[76] ont synthétisé plusieurs dérivés de la N-alkylisatine en utilisant la réaction de Reformatsky. Les composés ont été évalués contre Escherichia coli, Staphylococcus aureus et saccharomyces cervisiae. Deux composés ont montré une bonne activité contre les S. aureus et E. coli (Figure 13).
N HO O CO2R4 R3 R2 R1 R1 = H, CH3, C2H5; R2 = H, CH3; R3 = H, CH3; R4 = C2H5, 5-butyl, t-butyl Figure 13
Pandeya et coll.[77-83] ont synthétisé des dérivés de base de la Schiff avec le trimthoprim et leur base de N-Mannich. Tous les composés préparés ont montré une bonne activité contre le vibro-cholerae, shigella boydii, enterbacter faecalis et edward siella tards avec une CMI de l’ordre de 10-25 µg/ml. D’autres composés ont été trouvés pour être actifs contre la salmonelle typhi et vibrio cholerae. Deux produits ont inhibé le VIH IIB avec EC50 de 7.6 à 12.3 µg/ml
(Figure 14). N N O CH2R1 R N N CH2 OCH3 H3CO OCH3
R1= N(CH3)2,N(C2H5)2,morpholino, piperidino, pyrrolidino, sulphamethoxazolo Figure 14
Les bases de Mannich de la sulfodoxine, ciprofloxacine et lonefloxacine ont été synthétisées par pendeya et coll.. Tous les composés ont montré une activité notable par rapport à la sulfoxacine, la ciprofloxacine et la lomefloxacine (Figure 15).
N N O CH2R1 R SO2NH N N H3CO OCH3 R = H, CH3; R1= N(CH3)2, N(C2H5)2, 4-morpholinyl, 4-piperidinyl, 4-pyrrolidinyl, pyrimethamine
N O H2C R O N N R2 F R3 O COOH R1 R = R1= H, CH3; R2= H, F; R3= C2H5, cyclopropyl Figure 15
Les composés renferment le groupement méthyl piperidino se sont avérés les plus actifs dans la série.
Les mêmes auteurs ont synthétisé, également, les bases de Schiff de la N-[4-(4’-chlorophényl)thiazol-2-yl]thiosemicarbazide, et les bases de N-Mannich correspondantes.
L’activité antimicrobienne de ces composés a été évaluée contre 28 bactéries et moisissures. La 1-[N,N-diméthylaminométhyl] isatin-3-[1’-(6˝-chlorobenzothiazol-2˝-yl]thiosemicabazone et la 1-[N,N-diméthylaminométhyl]-5-bromoisatin-3-[1’-(4˝-chlorobenzothiazol-2˝-yl]thiosemicabazone, ont montré la plus grande activité parmi les composés synthétisés.
II. 2. Activités anti-VIH :
Comme il a été montré par Teitz et coll.[84] la N-méthylisatin-β-4’,4’-diéthylthiosemicarbazone et la N-allyl-β-4’,4’-diallylsemicarbazone ont présenté l’inhibition du VIH, par leur action sur la transcriptase des protéines virales (Figure 16).
N N O CH3 NH N S C2H5 C2H5 Figure 16
Webber et coll.[85] ont décrit la synthèse et étudié l’évaluation biologique des inhibiteurs non-peptidiques sur la Rhinovirus humaine (HRV) 3C protéase (3CP).
Trois composés (R=CONH2, R1 = CH2, CH2=CHC6H5 et CH2(p-CH3-C6H4) ont été
montrés pour avoir une excellente sélectivité pour le HRV-14 3CP, comparés à d’autres enzymes protéolytiques, y compris la chymotrypsine et la cathepsine B (Figure 17).
N O
O R1 R
R = H, Cl, I, NO2,COOH, COCH3, CN, CONH2,
CONHCH3, CON(CH3)2, CSNH2COCH3, OSCH3; R1 = CH3, CH2-CH=CHC6H5, CH(CH2)3, C6H5, CH2C6H5, CH2-β-naphthyl, CH2(4-CH3-C6H4)
Figure 17
Britcher et Susan,[86] ont préparé des inhibiteurs de VIH dérivés de l’indole substitué en position 2 par des hétérocycles (Figure 18).
N H S Het O O X X
X = halo, NO2, cyano, C1-4 alkoxy ou alkylamine, sulfonamido Het = 2-pyrazolo, 3-triazolo
Figure 18
Ces indoles et leurs sels sont utiles comme inhibiteur de la VIH transcriptase inverse, et pour le traitement et la prévention du VIH.
II. 3. Activité anticancéreuse :
Popp et Pajouhesh[87] ont préparé la 3-o-nitrophénylhydrazone isatine, par condensation de l’isatine avec l’o-nitrophénylhydrazine. Ces composés ont été trouvés, pour être actifs contre Walker carcinoma-256 et inactifs contre la lignée cellulaire (leucémie) (Figure 19).
N H N N H NO2 O R R = H, 4-CF3, 5-Br, 5-Cl, 5-F, 5-OCH3, 5-CH3, 5-NO2,
5-SO3H, 7-Cl, 7-CH3, 4-Cl-7-OCH3, 6-Cl-5-OCH3,
4-Cl-7-CH3, 4,7-(Cl)2, 5,7-(CH3)2, 6,7-(CH3)2
Figure 19
De nouveaux dérivés de la 5-(2-oxo-3-indolinolinyl)thiazolidine-2,4-dione, ayant en position 1 et 3, l’isatine et le thiazolidine respectivement, et substitué par diverses base de Mannich, ont été préparés par Eshba et Salama[88] (Figure 20).
N N O S N CH2N R R O O CH2N R R Br Figure 20
Cinq composés ont été évalués pour leur activité anti-leucémique.
Les bases de Mannich possedant un diméthylamino ont montré une activité plus importante. L’introduction du brome en position 5 de l’isatine a augmenté l’activité.
Broadbent et coll.[89] ont étudié la chimie et la pharmacologie de l’indol-3-carbinol et l’indol-3-méthoxyméthyle. Ces produits ont montré des activités antimutagènes et anticancérogènes.
III. Autres activités :
Ramachandran[90] a synthétisé la 1-nonyl-7-phényl-1H-indole-2,3-dione, la CMI contre la Mycobaclerium tuberculosis est inferieure à 20 µg/ml.
Varma et Pendeya[91] ont préparé les 3-[p-(p-(alkoxycarbonyl)phényl) carbonyl)]phénylimino-1-aminométhyl-2-indolinones et examiné leur activité anti tuberculose
contre la tuberculose H37Rv. Neuf composés ont montré une inhibition complète de la croissance
de tuberculose H37Rv avec une CMI entre 10 à 20 µg/ml (Figure 21).
N O CH2N X CONH COOR X = O, CH2 R = CH3, C2H5, n-propyl, n-butyl Figure 21 Conclusion
Les modifications structurales de la structure de base de l’isatine, ont permis l’apparition de nouveaux dérivés présentant un large spectre d’activité biologique.
Ainsi, les variations structurales les plus importantes concernant les substituants en position 1, sur le carbone en position 3 et au substituant en position 5.
Les études antérieurs ont montré que la modification structurale sur les différentes positions de la molécule de base, permet d’améliorer son profil pharmacologique lui conférant des propriétés sédatives, anticonvulsivantes, anxiolytiques, antimicrobiennes, anti-VIH et anticancéreuses.
Vu les activités biologiques que présentent ces molécules, l’objectif de notre travail sera consacré à la synthèse et la réactivité de nouveaux composés dérivés de l’isatine, ainsi qu’à l’étude de leurs activités biologique et pharmacologique.
Références bibliographiques
1. W.C. Sumpter, Chem. Rev., 34, 1954, 407. 2. F.D. Popp, Adv. Heterocycl. Chem., 18, 1975, 1. 3. Y. Guo, F. Chen, Zhongcaoyao, 17, 1986, 8.
4. Manjari, S. Pandey, A. Chakrabarti, L. K. Pandey, S.K. Bhattacharya, Stress and Health, 18, 2002, 133.
5. T. J. Singh, P. K. Gujral, Ind. J. Pharmac., 3 (4), 1971, 187.
6. S. R.R. Molders, A. Waefelaer, D. Francart, Ing. Chim. (Brussels), 64, 1982, 5. 7. M. Alam, M. Younas, M. A. Zafar, Pak. J. Sci. Ind. Res., 32, 1989, 246.
8. G. Loloiu, T. Loloiu, O. Maior, Khim. Geterosilk. Soedin., 1998, 396. 9. T. Kearney, P.A. Harris, A. Jackson, J.A. Joule, Synthesis, 1992, 769. 10. G. Loloiu, O. Maior, Rev. Roum. Chim., 42, 1997, 67.
11. G.J. Kapadia, Y.N. Shukla, S.P. Basak, E.A. Sokoloski, H.M. Fales, Tetrahedron, 36, 1980, 2441.
12. A. J. Taylor, Chem. Res.(S), 1980, 347. 13. P.G. Gassman, US 4252723,1981.
14. P.G. Gassman, K.M. Halweg, J. Org. Chem., 44, 1979, 628. 15. P. Hewawasam, N. Meanwell, Tetrahedron Lett., 35, 1994, 7303. 16. K. Smith, G. A. El-Hiti, A. C. Hawes, Synlett, 1999, 945.
17. J. Parrick, A.Yahya, Y. Jin, Tetrahedron Lett, 25, 1984, 3099.
18. E.A. Kraynack, J.E. Dalgard, F.C.A. Gaeta, Tetrahedron Lett., 39, 1998, 7679. 19. Y. Cheng, S. Goon, O. Meth-Cohn, J. Chem. Soc., Perkin Trans. 1, 1998, 1619. 20. F. Ozawa, H. Yanagihara, A. Yamamoto, J. Org. Chem., 51, 1986, 415.
21. J. Bergman, Tetrahedron Lett., 30, 1989, 1837.
22. L. Arsenijevic, M. Bogavac, S. Pavlov, V. Arsenijevic, Arh. Farm., 35, 1985, 39. 23. B.R. Boar, A. Cross, J. PCT Int. Appl. WO 93 12,0851993.
24. J. Tatsugi, K. Ikuma, Y. Izawa, Heterocycles, 43, 1996, 7.
25. S.J. Garden, J. C. Torres, L. E. Silva, A. C. Pinto, Synth. Commun., 28, 1998, 1679.
26. K. Hamada, S. Tanaka, T. Suzukamo, S. Morisada, M. Fukui, K. Kadota, T. Okuda, Jpn. Kokai Tokkyo Koho, JP 60, 246, 395, 1985.
27. N.A. Aliev, E.I. Ahmad-Hasan, A. Abdusamatov, Deposited Doc. VINITI 215-78, 1978. 28. A.B. Tomchin, G.A. Shirokii, V.S. Dmitrukha, Khim. Geterotsikl. Soedin., 1976, 83. 29. J.E. Dombrowski, P.G. Mattingly, Eur. Pat. Appl., EP369, 1990, 344.
30. M. Gopal, G. Srivastava, U.C. Pande, R.D. Tiwari, Microchim. Acta., 1977, 215. 31. G.K. Jnaneswara, V.H. Deshpande, J. Chem. Res. (S), 1999, 632.
32. R. Menicagli, C. Malanga, L. Lardicci, Chim. Ind. (Milan)., 59, 1977, 652.
33. A.H. Katz, C.A. Demerson, C.C. Shaw, A.A. Asselin, L.G. Humber, K.M. Conway, G. Gavin, C. Guinosso, N.P. Jensen, D. Mobilio, R. Noureldin, J. Schmid, U. Shah, D.V. Engen, T.T. Chau, B.M. Weichman, J. Med. Chem., 31, 1988, 1244.
34. V.G. Dzyubenko, P.I. Abramenko, Zh. Vses. Khim. O-va. Im. D.I. Mendeleeva, 31, 1986, 229. (CA106:32909b)
35. J.J. Brunet, R. Chauvin, F. Kindela, D. Neibecker, Tetrahedron Lett., 35, 1994, 8801.
36. R. Igarashi, A. Nakamura, Jpn. Kokai Tokkyo Koho, JP 07, 196, 610, 1995. (CA 123: P285775z)
37. C. Papageorgiou, X. Borer, Helv. Chim. Acta., 71, 1988, 1079. 38. A. J. Kamal, Org. Chem., 56, 1991, 2237.
39. A. Sahu, A. Chatterjee, Indian J. Chem. Sect. B, 29B, 1990, 603. 40. J.W. Cornforth, J. Chem. Soc., Perkin Trans. 1., 1976, 2004.
41. S. Ranganathan, D. Ranganathan, P.V. Ramachandran, M. K. Mahanty, S. Bamezai, Tetrahedron, 37, 1981, 4171.
42. J. Bergman, C. Stalhandske, H. Vallberg, Acta Chem. Scand., 51, 1997, 753.
43. a. V. A. Singh, R.S. Varma, S.D. Dwivedi, H.N. Verma, Indian Drugs, 22, 1985, 582. b. J.O.E. Bergman, S.G. Aokerfeldt, PCT Int. Appl. WO87 04, 436, 1987.
c. K.D. Banerji, A.K.D Mazumdar, K. Kumar, S.K. Guha, J. Indian Chem. Soc., 56, 1979, 396.
d. A.G. Drushlyak, A.V. Ivashchenko, V.V. Titov, Khim. Geterotsikl. Soedin., 1984, 1544. e. T.S. Hafez, Phosph. Sulf. Silicon., 61, 1991, 341.
f. K. Niume, F. Toda, K. Uno, M. Hasegawa, Y. Iwakura, J. Polymer Sci. Polymer Chem. Ed., 21, 1983, 615.
44. D. Maysinger, M. Birus, M. Movrin, Pharmazie, 37, 1982, 779.
45. J.J. Brunet, R. Chauvin, F. Kindela, D. Neibecker, Tetrahedron Lett., 35, 1994, 8801.
46. A.I. Razumov, P.A. Gurevich, S.K. Nurtdinov, S.A. Muslimov, L.M. Tyl’nova, Zh. Obshch. Khim., 47, 1977, 1421.
51. V. Glover, J. M. Halket, P. J. Watkins, A. Clow, B. L. Goddwin and M. J. Sandler, Neurochem., 51, 1988, 656.
52. J. Seidel and J. Wenzel, Pol. J. Pharmacol., 35, 1979, 407.
53. I. M. Mc Intyre and T. R. Norman, J. Neural Transm., 79, 1990, 35. 54. S. K. Bhattacharya , A. Chakraborti, Indian. J. Exp. Biol., 36, 1998, 118. 55. H. Pajouhesh, R. Parson, F. D. Popp, J. Pharm. Sci., 72, 1983, 318. 56. R. Jain, Bansal, Pharmazie, 50, 1995, 224.
57. T. Blackburn, K. Paul, G. Smith, G.B. Pat. 9, 425, 012, 28 Apr. 1993; Chem. Abstr., 122, 1995, 72046e.
58. H. P. Olesen, A. Kanstrup, Den. Pat. 97, 05, 137, 13 Feb. 1997; Chem. Abstr., 126, 1997, 212050m.
59. O. A. Sharaf, Bull. Fac. Pharm., 35, 1997, 79.
60. Y. Evanno, L. Dubois, M. Sevrin, F. Marguet, J. Proissant, R. Bartsch, C. Gille, Fr. Pat. 9, 906, 406, 1999; Chem. Abstr. 130, 1999, 168385f.
61. N. Karali, A. Gursoy, Farmaco., 49, 1994, 819.
62. N. Karali, G. Capan, C. N. Ergen, Sci. Pharm., 65, 1997, 277. 63. A. Gursoy, N. Karali, Farmaco., 51, 1996, 437.
64. G. Galambos, B. Kiss, E. Palosi, Hun. Pat. 65, 452, 1994; Chem. Abstr., 123, 1995, 169529y. 65. S. N. Pandeya, I. Ponnilavarasan, A. Pandey, R. Lakhan, J. P. Stables, Pharmazie, 54, 1999,
12.
66. S. N. Pandeya, S. Smitha, J. P. Stables, Arch. Pharm. Pharm. Med. Chem., 4, 2002, 129. 67. S. N. Pandeya, A. Senthil Raja, J. P. Stables, J. Pharm. Pharm. Sci., 5, 2002, 266. 68. S. N. Pandeya, A. K. Agarwal, A. Singh, J. P. Stables, Acta Pharm., 53, 2003, 15. 69. G. Palit, R. Kumar, G. K. Patnaik, S. K. Bhattacharya, Biogenic Amines, 13, 1997, 131. 70. A. E. Medvedev, A. Goodwin, A. Clow, J. Halket, V. Glover, M. Sandler, Biochem.
Pharmacol., 44, 1992, 590.
71. M. Sarangapani, V. M. Reddy, Indian. J. Pharm. Sci., 59, 1997, 105. 72. R. S. Varma, W. L. Nobles, J. Med. Chem., 10, 1967, 510.
73. M. Kupinič, M. Medič, M. Movrin, D. Maysinger, J. Pharm. Sci., 68, 1979, 459. 74. D. Maysinger, J. Ban, M. Movrin, Arzneim. Forsch., 30, 1980, 932.
75. R. W. Daisley, V. K. Shah, J. Pharm. Sci., 73, 1984, 407.
76. S. Dilber, M. Saban, A. Gelinco, L. Arsenijevi, M. Bogavac, S. Pavlov, Pharmazie, 45, 1990, 800.
78. S. N. Pandeya, P. Yogeeswari, D. Sriram, G. Nath, bull. Chim. Farm., 137, 1998, 321.
79. S. N. Pandeya, C. G, Sundari, M. Mariammal, M. Saravanan, P. S, Balaji, S. S, Kumar, D. Sriram, Indian J. Pharm. Sci., 60, 1998, 280.
80. S. N. Pandeya, D. Sriram, G. Nath, E. De Clercq, Eur. J. Pharm. Sci., 9, 1999, 25. 81. S. N. Pandeya, D. Sriram, G. Nath, E. De Clercq, Indian J. Pharm. Sci., 61, 1999, 358. 82. S. N. Pandeya, D. Sriram, G. Nath, E. De Clercq, Pharm. Acta Helv., 74, 1999, 11. 83. S. N. Pandeya, D. Sriram, G. Nath, E. De Clercq, Arzneim. Forsch., 50, 2000, 55.
84. Y. Teitz, D. Ronen, A. Vansover, T. Stematsky, J. L. Riggs, Antiviral Res., 24, 1994, 305. 85. S. E. Webber, J. Tikhe, S. T. Worland, S. A. Fuhrman, T. F. Hendrickson, D. A. Mathews, R.
A. Love, A. K. Patick, J. Med. Chem. 39, 1996, 5072.
86. F. Britcher, L. Susan, U.K. Pat. 2,282,808, 19 Apr 1995; Chem. Abstr., 123, 1995, 143634d. 87. F. D. Popp, H. Pajouhesh, J. Pharm. Sci., 72, 1983, 318.
88. N. H. Eshbha, H. M. Salama, Pharmazie, 40, 1985, 320.
89. A. Broadbent, H. Thomas, S. Broadbent, Curr. Med. Chem., 5, 1998, 469.
90. J. Ramachandran, Swed. Pat. 9,944,608, 20 Apr 1998; Chem. Abstr., 131, 1999, 209113g. 91. R. S. Varma, R. K. Pandeya, Indian J. Pharm. Sci. 46, 1982, 132.
ETUDE DE LA REACTIVITE DE
L’ISATINE
Introduction :
Durant les dernières années, l’étude des isatines a connu un grand développement dû à la mise en évidence de leurs activités pharmacologiques. De même ils se sont avérés d’excellents agents antimicrobiens et antiviraux, conduisant plusieurs chercheurs à entreprendre des recherches dans ce domaine.[1-5]
Ainsi, Il nous a donc paru intéressant de poursuivre les recherches dans ce domaine en examinant la synthèse de nouveaux dérivés de l’isatine différemment fonctionnalisés sur l’azote en position 1 ou sur le carbone en position 3 et susceptibles de présenter des activités biologiques intéressantes.
Avant d’exposer nos résultats, nous rapportons les méthodes décrites dans la littérature pour la synthèse de tels composés.
I. Étude bibliographique : I. 1. Alkylation de l’isatine :
La littérature rapporte quelques études concernant l’alkylation de l’isatine. Ainsi, Tatsugi et coll.[6] ont développé une méthode pratique pour la conversion du 7-azaindole 1 en 1-alkyl-7-azaisatines 3. Ces derniers ont été préparés par action du sel de sodium du 7-azaindole sur l’halogénure d’alkyle approprié dans le diméthylacétamide, à température ambiante, suivie de la réaction de bromation et d’oxydation (Schéma 1).
N N H N N R N N R O O 1- NaH 2- RX, DMAc NBS DMSO 3 1 2 Schéma 31
N CH3 3 CH (COCl)2 N CH3 O O 4 5 6 Schéma 32
D’autre part, Arsenijevic et coll.[8] ont étudié l’action des sulfates d’alkyles sur l’isatine 7 en présence de soude aqueuse. Ils ont obtenu dans chaque cas un seul produit N-alkylé 6-8 (Schéma 3). N H O O N R O O NaOH aqueuse 6 : R = CH3 8 : R = C2H5 (R)2SO4 7a Schéma 33
Récemment, Mesropyan et coll.[9] ont réalisé la réaction de Mannich des amines secondaires : la morpholine 10 et la pipéridine 11 avec le formaldéhyde, sur la 5-fluoroisatine 9; ils ont obtenu respectivement la fluoro-N-morpholinométhylisatine 12 et la 5-fluoropipéridinométhylisatine 13 avec des bons rendements (Schéma 4).
N H O O N O O N H X HCOH N X F F 9 10: X= CH2 11: X= O 12: X= CH2 13: X= O Schéma 34
L’examen de la littérature montre que la plupart des méthodes décrites pour la synthèse de N-alkylisatines consistent en la condensation du sel d’isatine obtenu par déprotonation par une base forte, avec des halogénures d’alkyle ou des sulfates d’alkyles.
Afin d’améliorer les rendements des réactions d’alkylations, les chercheurs ont mis au point une nouvelle méthode très efficace : la catalyse par transfert de phase CTP.[10] Selon la nature de la base utilisée , on distingue :
La CTP liquide-liquide : la base utilisée est une solution de soude dans un solvant aprotique tel que le benzène ou le toluène.
La CTP liquide-solide : elle fait intervenir une base moins forte telle que le carbonate de potassium dans le DMF.
Dans notre laboratoire, Ahabchane[11] a effectué la réaction d’alkylation de la 4-phényl-1,5-benzodiazépin-2-one 14 avec les bromures d’allyle et de propargyle dans les conditions de la catalyse par transfert de phase liquide-solide. Il a pu isoler un seul produit N-alkylé 15-16 avec un bon rendement (Schéma 5).
N H N Ph O RX N N Ph O R a: R = CH2CH=CH2 b: R = CH2C≡CH X = Br CTP 14 15, 16 Schéma 35
Ferfra et coll.[12] ont montré que la réaction d’alkylation de la 3-(éthoxycarbonylméthylène)-2-oxo-quinoxaline 17 dans les conditions de la catalyse par transfert de phase dépend de la nature de l’agent d’alkylation utilisé.
Ainsi, si les halogénures d’alkyle réagissent préférentiellement sur le carbone énaminique, le sulfate de méthyle affecte l’azote énaminique (Schéma 6).
N H N O OEt O N H N O OEt O N H N O OEt O N H N O OEt O R R H R CH3 CTP RX (CH3)2SO4 17 18 19 20 Schéma 36
II. Réactivité de l’isatine :
II. 1. Synthèse des N-alkylisatines :
Pour notre part, nous avons adopté l’alkylation des isatines 7a-c par differents agents alkylants dans les conditions de la catalyse par transfert de phase liquide-solide dans le diméthylformamide en présence du carbonate de potassium comme base, du bromure de tétra-n-butylammonium comme catalyseur. Dans tous les cas, la réaction conduit aux N-alkylisatines 21-23 correspondantes avec un bon rendement (Schéma 7).
N O O X N O O X R RX1 K2CO3/DMF BTBA/ TA + H a : R= CH2CH=CH2 b: R= CH2CC≡CH c: R= CH2C6H5 d : R= CH2CO2C2H5 7a: X= H 7b: X= Cl 7c: X= Br 21a-d 22a-d 23a-d Schéma 37
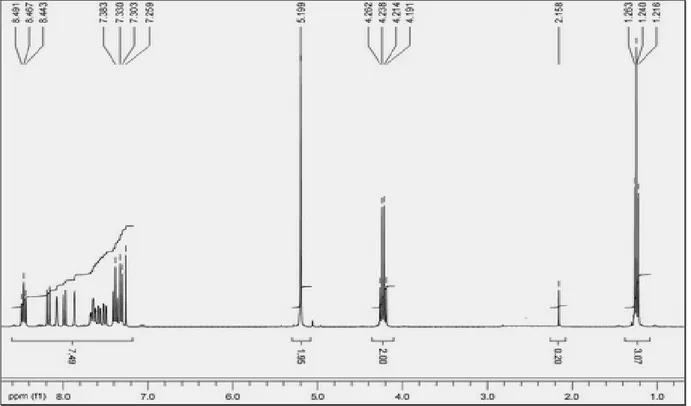
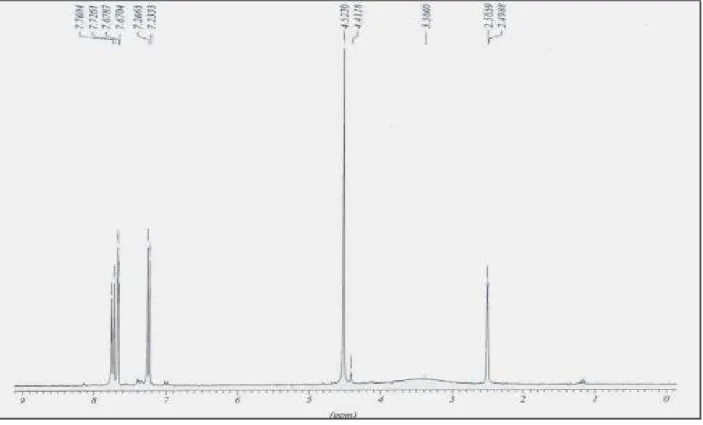
Les structures des composés alkylés ont été identifiées grâce aux données spectrales ( RMN 1H, 13C et spectrométrie de masse).
Les spectres de RMN1H des composés 21-23, pris dans le CDCl3, montrent, en
particulier, les signaux relatifs aux groupes alkyles, mettant en évidence la disparition des signaux attribuables au groupe NH, ce qui atteste leur engagement dans la réaction.
Tableau I : Données spectrales de RMN1H des composés 21a-d
Composés R HAromatique 21a 4.24 (dd, 2H, NCH2, 3J= 2.4 Hz, 4J=0.7 Hz); 5.19 (m, 2H, =CH2, 3J= 2.4 Hz, 3J=1.5 Hz); 5.70 (m, 1H, =CH, 3J= 1.5 Hz, 4J=0.7 Hz) 6.81-7.46 (m, 4H, HAr) 21b 4.52 (d, 2H, NCH2, 4J= 2.4 Hz); 2.35 (t, 1H, ≡CH, 4J= 2.4 Hz) 7.22-7.63 (m, 4H, HAr) 21c 4.86 (s, 2H, NCH2) 6.70-7.56 (m, 9H, H Ar) 21d 1.32 (t, 3H, CH3, 3J= 5.6 Hz); 4.32 (s, 2H, NCH2) ; 4.60 (q, 2H, OCH2, 3J= 5.6 Hz) 6.86-7.72 (m, 4H, HAr)
Les spectres de RMN13C montrent les signaux relatifs aux carbones des groupes alkyles portés par l’atome d’azote (Tableau II).
Figure 1 : Spectre RMN1H du produit 23d.
Tableau II : Données spectrales de RMN13C des composés 21a-d Composés R HAromatique Cq 21a 44.0 NCH2; 120.9 =CH2; 118.6 =CH 123.8, 125.3, 126.2, 138.3 117.4, 149.0, 156,8, 183.0 21b 29.8 NCH2, 73.9 ≡CH 111.7, 125.8, 126.2, 139.3 117.4, 149.4, 158.6, 182.7 21c 44.0 NCH2 112.4, 123.9, 125.4, 127.4, 129.0, 138.3 117.8, 150.2, 159.2, 150.7, 182.5 21d 14.2 CH3; 41.9 NCH2; 63.5 OCH2 110.8, 125.9, 126.6, 139.4 118.6, 150.8, 158.2, 160.9, 183.2
Sur les spectres de masse des composés 21-23, pris en mode d’impact électronique, ont note la présence du pic corespondant à l’ion moléculaire M .
La structure du composé 21d a été déterminée grâce à une étude par diffraction aux rayons-X.[13]
Tableau III : Données cristallographique de 21d
Empirical formula C12 H11 NO4
Formula weight 233.22
Temperature 296(2) K
Crystal system monoclinic Z = 4
Space group P21/c
Unit cell dimensions a = 13.6433 (6) Å b = 4.9505 (3) Å c = 16.2899 (8) Å β = 104.246 (2)°
Volume 1066.40 (10) Å3
Radiation Cu Kα
Final R indices [I>2sigma(I)] 0.040
(∆/σ)max 0.104
(∆ρ)max 0.33 Å
-3
(∆ρ)min -0.21 Å
-3
Measurement Bruker SMART 6000 diffractometer
Refinement SHELXL-95
II. 2. Réaction d’acylation :
Nous avons étudié la réaction d’acylation des isatines par le chlorure d’acyle dans les conditions de la catalyse par transfert de phase. Nous avons utilisé le carbonate de sodium comme base dans le DMF.
Dans tous les cas nous avons obtenu les composés N-acylés correspondants, avec des bons rendements (Schéma 8).
N O O H N O O O CH3 K2CO3/ DMF BTBA, TA H3C Cl O X X 7a: X = H 7b: X = Cl 7c: X = Br 24a: X = H 24b: X = Cl 24c: X = Br Schéma 38
Les structures des composés obtenus, ont été établies sur la base des données spectrales : RMN1H, 13C, IR et la spectrométrie de masse.
L’analyse des spectres de RMN1H des composés 24a-24c mettent en évidence, en particulier, un singulet à 2.22 ppm intégrant trois protons du groupe méthyle, ainsi qu’un massif entre 7.37 et 8.57 ppm correspondant aux protons aromatiques.
Les spectres de RMN13C des composés 24a-24c mettent en évidence, en particulier, un signal à 24.7 ppm attribuable au carbone du groupe méthyle, deux signaux à 167.0 et 186.5 ppm dû aux carbones des carbonyles en position 2 et 3.
Les spectres de masse (IE) présentent un pic moléculaire relatif aux ions moléculaires à m/z = 189, 223 et 267 confirmant ainsi les structures proposées.
II. 3. Action de l’hydrazine sur les isatines :
La littérature rapporte plusieurs travaux concernant la synthèse des hydrazones d’isatine, ainsi que l’étude de leurs activités biologiques.
L’action de l’hydrazine, alkylhydrazine, arylhydrazine et hétéroarylhydrazine dérivé de la pyrimidine, pyrazine, thiazole, 1,2,4-triazine, quinazoline, benzimidazole, benzothiazole, phthalazine et de la triazines, sur l’isatine et les alkylisatines, conduit au produit de condensation en position C-3 de l’isatine[14-22] (Schéma 9).
N O O R N N O R NH R1 NH2NHR1 25 26 27 EtOH Schéma 39