Étude des altérations métaboliques associées au
diabète de type 2 selon le statut pondéral après une
grossesse compliquée par un diabète gestationnel
Mémoire
Jessica Vigneault
Maîtrise en nutrition
Maître ès sciences (M.Sc.)
Québec, Canada
© Jessica Vigneault, 2014
Résumé
Les femmes avec un antécédent de diabète gestationnel présentent un risque élevé de développer plusieurs complications au cours de leur vie, dont le diabète de type 2. La prévalence du diabète de grossesse s'accroît et reflète proportionnellement l'augmentation du diabète de type 2 et de l’obésité. Ces travaux suggèrent qu’un score de risque génétique relié au diabète de type 2 est associé au diabète de grossesse ainsi qu’à la progression du prédiabète et du diabète de type 2 chez ces femmes. D'autre part, les altérations métaboliques associées au diabète de type 2 ont été étudiées en fonction du statut pondéral après la grossesse. Même avec un poids normal, les femmes avec un antécédent de diabète de grossesse présentent un risque plus élevé de développer le diabète et présentent les mêmes facteurs de risque clinique que les femmes avec embonpoint et obésité. Cependant, un excès pondéral augmente l’apparition des complications métaboliques.
Abstract
Women with prior gestational diabetes present higher risk to develop adverse metabolic complications such as type 2 diabetes in the years following delivery. In recent years, the prevalence of gestational diabetes has increased and proportionally reflects the increase in the rates of type 2 diabetes and obesity. Findings from the present study suggest that a genetic score is associated with both gestational diabetes and progression to prediabetes and type 2 diabetes in women with prior gestational diabetes. Secondly, metabolic deteriorations associated with gestational diabetes were investigated on glucose and insulin homeostasis according to weight status after delivery. Even with a normal weight, women with previous gestational diabetes present higher risk to develop type 2 diabetes and present same clinical risk factors compared to overweight and obese women. A further increase in postpartum weight favours the apparition of metabolic deteriorations in women with gestational diabetes.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... xi
Liste des abréviations ... xiii
Avant-propos ... xvii Chapitre 1 : Introduction ... 1 Chapitre 2 : Problématique ... 3 1. Le diabète gestationnel ... 3 1.1. Définition ... 3 1.2. Dépistage ... 3 1.3. Épidémiologie ... 6
1.4. Les facteurs de risque ... 7
1.4.1. L’âge de la mère ... 7
1.4.2. L’ethnie ... 7
1.4.3. Syndrome des ovaires polykystiques ... 8
1.4.4. Une grossesse antérieure avec un DbG ... 8
1.4.5. Les antécédents familiaux de DT2 ... 9
1.4.6. Les facteurs génétiques ... 9
1.4.7. L’obésité maternelle ... 11
1.4.8. Le gain de poids excessif ... 13
1.5. Les complications pour l’enfant ... 14
1.5.1. À la naissance ... 14
1.5.2. À l’enfance et à l’âge adulte ... 16
1.6. Les complications pour la mère ... 19
1.6.1. À la grossesse et l’accouchement ... 19 1.6.2. À long terme ... 20 2. Diabète de type 2 ... 23 2.1. Épidémiologie ... 23 2.2. Les conséquences du DbT2 ... 23 2.3. Dépistage ... 24
2.4. Les risques de DbT2 chez les femmes avec un antécédent de DbG ... 25
2.5. Facteurs influençant le développement du DbT2 chez les femmes avec antécédent de DbG ... 27
3. Le suivi après une grossesse compliquée par un DbG ... 30
4. La prévention du diabète par de saines habitudes de vie ... 32
Chapitre 4 : Description de la population à l’étude ... 37
Chapitre 5 : Un score de risque génétique associé à un antécédent de diabète gestationnel et à la progression du prédiabète et du diabète de type 2: une étude de cohorte ... 39
RÉSUMÉ ... 40 ABSTRACT ... 42 ABBREVIATIONS ... 43 INTRODUCTION ... 44 METHODS ... 46 RESULTS ... 50 DISCUSSION ... 52 CONCLUSION ... 56 REFERENCES ... 58
Chapitre 6 : Associations entre les altérations métaboliques reliées au diabète de type 2 et un antécédent de diabète de grossesse en fonction du statut pondéral ... 69
RÉSUMÉ ... 70 ABSTRACT ... 73 ABBREVIATIONS ... 74 INTRODUCTION ... 75 METHODS ... 76 RESULTS ... 79 DISCUSSION ... 81 CONCLUSION ... 83 REFERENCES ... 85 Chapitre 7 : Conclusion ... 95 Bibliographie ... 101
Liste des tableaux
Chapitre 2 ... 3
Tableau 1. Prévalence auto-rapportée des individus avec embonpoint et obésité selon l’âge et le sexe au Canada ... 11
Tableau 2. Statut pondéral auto-déclaré des femmes avec des enfants au Canada, selon l’Agence de santé publique du Canada... 12
Tableau 3. Recommandations relatives au rythme de prise de poids et au gain pondéral total durant une grossesse simple en fonction de l'IMC de la mère avant la grossesse... 14
Tableau 4. Fréquences des complications périnatales dans la cohorte de l’étude HAPO ... 15
Tableau 5. Diagnostic du prédiabète, selon l’ACD ... 24
Tableau 6. Diagnostic du diabète selon l’ACD ... 24
Chapitre 5 ... 39
Table 1. T2D risk loci ... 63
Table 2. Participants’ characteristics, anthropometric and metabolic variables (n=296) ... 64
Table 3. Differences in GRS between women with prior GDM and controls (n=296). ... 65
Table 4. Differences in GRS between normoglucotolerant and T2D status among women with prior GDM (n=119) ... 66
Chapitre 6 ... 69
Table 1. Participant’s characteristics by GDM and weight status ... 89
Table 2. Body fat composition and insulin and glucose profile according to GDM antecedent and weight status ... 90
Liste des figures
Chapitre 2 ... 3
Figure 1. L’approche privilégiée du dépistage et diagnostic du DbG ... 4
Figure 2. L’approche alternative du dépistage et diagnostic du DbG ... 5
Figure 3. La prévalence du DbG en fonction de l’IMC maternel pré-grossesse ... 13
Figure 4. Hyperglycémie maternelle et complication néonatales ... 16
Figure 5. Modèle de progression vers le DbT2 ... 25
Figure 6. Incidence cumulative du DbT2 après 9 ans selon un antécédent de DbG 26 Figure 7. Incidence du DbT2 selon le statut pondéral et un antécédent de DbG ... 28
Figure 8. L’approche suggérée dans le suivi post-grossesse des femmes avec DbG en prévention du DbT2 ... 30
Figure 9. L’incidence cumulative du risque de DbT2 chez les femmes avec un antécédent de DbG selon le traitement préventif utilisé dans l’étude DPP ... 32
Chapitre 4 ... 37
Figure 1. Recrutement des participantes de l’étude GDM entre 2009 et 2013 ... 38
Chapitre 5 ... 39
Figure 1. ROC curves for comparisons – prediabetics (n=135) vs. Normoglucotolerant (n=79) ... 67
Figure 2. ROC curves for comparisons – Normoglucotolerant (n=79) vs. Type 2 diabetes individuals (n=40) ... 68
Chapitre 6 ... 69
Figure 1. Prevalence (%) of abnormal glucose metabolism by GDM and weight status... 92
Liste des abréviations
ACD : Association Canadienne du Diabète AUC: Area under the curve
BMI: Body mass index
CDA: Canadian Diabetes Association DbG : Diabète gestationnel
DbT2 : Diabète de type 2
DEXA: Dual-energy x-ray absorptiometry DBT2 : Diabète de type 2
EV-GRS: Explained-variance genetic risk score FFQ: Food frequency questionnaire
FID: Fédération international de Diabète GDM: Gestational diabetes mellitus GLM: General linear model
GRS: Genetic risk score
GWAS: Genome-wide association study
HAPO: Hyperglycemia and Adverse Pregnancy Outcomes HbA1 : Glycated hemoglobin
HGPO: Hyperglycémie provoquée par voie orale
HOMA-IR: Homeostasis model of assessment for insulin resistance HOMA-IS: Homeostasis model assessment for insulin sensitivity HWE: Hardy-Weinberg equilibrium
IADPSG: Association internationale de l’étude du diabète durant la grossesse IFG: Impaired fasting glucose
IGT: Impaired glucose tolerance IMC: Indice de masse corporel
INAF: Institut sur la nutrition et les aliments fonctionnels ISI: Insulin sensitivity index
MAF: Minor allele frequency MCAS: Maladies cardiovasculaires OR-GRS: Odds ratio genetic risk score
RAMQ: Régie de l’Assurance maladie du Québec ROC: Receiver operating characteristic
ROIs: Regions of interest
SC-GRS: Simple-count genetic risk score SD: Standard deviation
SNP: Single-nucleotide polymorphism SM : Syndrome métabolique
Ce n’est pas dans la science qu’est le bonheur, mais dans l’acquisition de la science
Avant-propos
Mon projet m’a permis d’étudier l’impact du diabète gestationnel et de mieux comprendre les complications associées, mais également d’examiner l’effet de différents facteurs sur le risque d’obésité et de diabète de type 2 chez la mère en suivi post-grossesse. En raison du rôle clef de l’alimentation dans l’environnement, ce projet présente des retombées potentielles très importantes pour la prévention du diabète de type 2 par la modification des habitudes de vie. Dès mon adhésion au projet, il m’apparaît des plus stimulants que les besoins de la société en matière de promotion et de prévention de la santé demeurent au centre des objectifs de recherche.
Depuis 2011, j'ai acquis une expérience professionnelle grâce à mon poste d’auxiliaire à la recherche pendant mon baccalauréat et par la suite, par l’entremise de diverses tâches effectuées dans le cadre de mes études de deuxième cycle. Mon implication dans chacune des étapes de la réalisation du projet s’est révélée être un avantage majeur. En effet, pendant la période estivale de 2012, grâce à l’obtention de la bourse d’été des étudiants en santé de Diabète Québec, j’ai eu l’opportunité de continuer à travailler auprès de l’équipe de recherche du Dre Robitaille. Durant cette période, j’ai participé et animé des discussions scientifiques au sujet du diabète gestationnel qui m’auront permis de développer mon esprit critique, de me familiariser avec la terminologie et les diverses méthodes d’analyses statistiques. Plus encore, j’ai eu l’opportunité de seconder la rédaction d’un article scientifique « Accelerometry-measured physical activity and inflammation after gestational
diabetes » publié dans la revue Medecine and science in sports and exercice. J’ai également
rédigé de nombreux résumés de communication publiés. La participation à divers congrès s’est avérée très formatrice et tel qu’escompté, m’a permis d’acquérir une expérience significative en recherche.
Au cours de mes études de deuxième cycle, j’ai eu l’opportunité de travailler avec Hubert Cormier, un candidat au doctorat en nutrition. Celui-ci a apporté un grand nombre de connaissances en génétique à la néophyte que j’étais. En plus de l’article «An
with Progression to Prediabetes and Type 2 Diabetes: A Cohort Study » accepté dans
le « BJOG: An International Journal of Obstetrics & Gynaecology », cette collaboration aura été le début d’une belle complicité. À notre plus grand désarroi, nous avons eu à nous séparer, car il semblerait qu’une maîtrise et un doctorat ne puissent pas se faire en simultané!
La principale partie de mon projet fut orientée au cours d’une discussion avec ma codirectrice Simone Lemieux, alors qu’elle me partageait ses connaissances dans le domaine de l’obésité. Il m’apparaissait important de discriminer la contribution de l’excès pondéral dans les altérations métaboliques associées au diabète gestationnel. L’article « Association between metabolic deteriorations and prior gestational diabetes according to
weight status” a été accepté dans la revue scientifique “Obesity”.
Les résultats générés par mes travaux m’ont permis d’obtenir la bourse d’étudiante d’été de Diabète Québec deux années consécutives en 2012 et 2013. Je suis honorée de la confiance témoignée par cet organisme. J’aimerais également remercier l’Association des femmes diplômées universitaires (AFDU) pour leur contribution financière. Cet octroi est d’une importante valeur pour ma progression en recherche. Finalement, je souhaite exprimer mes plus sincères remerciements pour l’acceptation de ma candidature parmi les étudiants boursiers de l’Institut sur la nutrition et les aliments fonctionnels (INAF).
La réalisation de ce travail n’aurait pu être possible sans la précieuse collaboration de certaines personnes. Pour accroître ses chances de réussite, il faut savoir s’entourer des bons individus et bénéficier de leur savoir. J’aimerais souligner la présence de mes collègues de l’INAF. Pour un grand nombre d’entre vous, j’ai appris à vous connaître davantage et à créer des liens plus personnels, ce qui a contribué à l’ambiance exceptionnelle de l’INAF. Je remercie l’équipe de recherche de Dre Julie Robitaille. Sarah et Véronique (Gingras) ont su me partager leur expérience et me guider. Aujourd’hui, c’est à moi de suivre vos traces et de transmettre le projet au suivant avec Simon, Lydi-Anne et Camille. Je leur souhaite la meilleure des continuités. Je souhaite également remercier Véronique (Garneau) qui a outrepassé ses tâches de professionnelle de recherche lors de l’absence maternité de ma directrice. Merci Véronique pour toutes ses conversations et ta grande générosité. Sans oublier les coauteurs du projet GDM : Dr André Tchernof et Dr
John S. Weisnagel qui ont généreusement accepté de partager leur expertise dans le domaine de la santé métabolique des femmes. Je remercie Simone Lemieux pour ses réflexions qui ont orienté mon projet. La dernière, mais non la moindre : ma directrice Dre Julie Robitaille, qui même en étant absente lors de son congé de maternité, a su me témoigner sa présence. Merci Julie pour ta grande générosité, ton écoute et ta spontanéité. Je vais m’ennuyer de ton grand sens du renforcement positif. Avec toi, j’ai eu l’impression que la recherche et la science pouvaient être accessibles et tu m’as donné la confiance pour y parvenir.
Sur une note plus personnelle, j’aimerais témoigner ma gratitude envers les personnes qui ont cru en mes capacités et qui m’ont encouragée dans la réalisation de ma maîtrise. Lorsque l’on entame des études au deuxième cycle, il faut d’abord le faire pour soi et pour les bonnes raisons, mais lorsque l’on a l’appui des gens qui nous sont chers, c’est d’autant plus facilitant et valorisant.
Mes amies les « post-it », sans qui je ne pouvais pas m’imaginer poursuivre mes études. Merci pour toutes ses conversations de « diététeuses »!
Sandra, ma grande amie avec qui tout l’univers de la nutrition a commencé. Merci pour ta présence et ta confiance. Ti-tienne est un pur bonheur dans ma vie!
Marianne, Marie et Joëlle, mes amies de toujours, mes amies pour toujours. Malgré toutes ces années et la distance, rien n’a vraiment changé. Avec vous, je me sens plus accomplie. Merci.
Mes beaux-parents chéris, merci pour tous ces mots d’encouragement et votre présence dans ma vie. Sans oublier ma rayonnante BS!
Ma famille qui a toujours été derrière moi pour me soutenir dans mes choix et m’encourager à me dépasser. Vous m’avez toujours appris à donner le meilleur de moi-même dans tout ce que j’entreprends. Maman, papa et Jonathan, grâce à vous je suis une meilleure personne.
Guillaume, mon amoureux. Merci pour tous ces moments avec toi qui apportent une autre dimension à ma vie et qui me permettent de garder mon équilibre.
Chapitre 1 : Introduction
Le diabète gestationnel (DbG) est généralement diagnostiqué à un stade avancé de la grossesse, souvent entre la 24 et la 28e semaine (1). Cette affection grave et sous-estimée touche de nombreuses femmes et leurs nourrissons. Selon les critères diagnostiques, entre 4 et 9% des grossesses seraient compliquées par un DbG (1). La Fédération Internationale de Diabète (FID) estime que 21,4 millions d’enfants nés vivants auraient été exposés au DbG en 2013 (2). Non seulement le DbG augmente les risques de complications pour la santé de la mère et de son enfant, mais l’hyperglycémie pendant la grossesse peut conduire à un risque accru pour l’enfant de développer le diabète de type 2 (DbT2), l’obésité et le syndrome métabolique (SM) durant l’enfance et à l’âge adulte.
Tout comme le DbT2, la prévalence du DbG augmente et apparaît comme un important prédicteur de l’apparition des maladies chroniques chez les femmes avec un antécédent de DbG. Chez les mères, le DbG est associé au DbT2, au SM et aux maladies cardiovasculaires (MCAS) (3). Environ 10% des femmes avec un antécédent de DbG vont demeurer diabétiques suite à leur accouchement, alors que 20 à 60% vont développer un DbT2 dans les cinq à dix années qui suivront en l’absence de stratégies de prévention (4).
Le DbG est reconnu comme une maladie multifactorielle, où l’environnement interagit avec les variations génétiques individuelles (5). Comme il a été démontré que les femmes avec un antécédent de DbG présentaient des risques élevés de développer le DbT2 au cours de leur vie et que les femmes avec une histoire familiale de DbT2 sont plus à risque de DbG, il est permis de présager que le DbG et le DbT2 partagent les mêmes facteurs de risque génétiques (6). Ainsi, les variations génétiques qui déterminent le risque de DbT2 pourraient également être associées au DbG (7). Une nouvelle variance du score de risque génétique avec 36 polymorphismes en lien avec le DbT2 a été élaborée en considérant la fréquence de l’allèle mineure dans une population de femmes avec un antécédent de DbG. Ces résultats sont décrits plus en détail au chapitre 5 de ce mémoire.
D’autre part, la prévalence élevée de l’obésité chez les femmes en âge de procréer est également à prendre en considération. Parmi les femmes canadiennes âgées de 30 à 39 ans, 23,4% font de l’embonpoint, alors que 15,8% sont obèses (8). Un surplus pondéral est associé à un plus grand risque de développer un DbG et un DbT2 (9). Nombreuses sont les études à s’intéresser aux effets de l’obésité et de l’hyperglycémie pendant la grossesse, sans toutefois dissocier leur contribution respective (10). L’obésité et le DbG ont tous deux été positivement associés aux complications maternelles et néonatales, aux détériorations métaboliques ainsi qu’au risque plus élevé de développer hâtivement le DbT2 (4, 11, 12). Plusieurs études identifient l’obésité comme étant le principal facteur en cause des détériorations métaboliques chez les femmes avec un antécédent de DbG (13, 14). À ce jour, peu de recherches s’attardent aux profils métaboliques chez les femmes minces avec un antécédent de DbG. Les profils glycémiques et insulinémiques des femmes minces avec un DbG, des femmes avec embonpoint/obésité sans DbG et des deux conditions combinées ont été comparés au chapitre 6.
L’objectif principal de ce mémoire vise à identifier les facteurs qui contribuent au développement des complications métaboliques reliés au DbT2 chez les femmes avec un antécédent de DbG. Pour ce faire, le premier objectif spécifique a été élaboré en lien avec la prédisposition génétique qui relie le DbT2 au DbG à partir d’un score de risque génétique. D’autre part, le second objectif spécifique consiste à déterminer l’impact de la contribution pondérale sur les altérations métaboliques qui surviennent après une grossesse compliquée par un DbG. La section problématique de ce mémoire permettra de mieux concevoir cette pathologie, l’épidémiologie, les facteurs de risques ainsi que les conséquences qui lui sont associées et l'importance du suivi après une grossesse compliquée par un DbG.
Chapitre 2 : Problématique
1. Le diabète gestationnel
1.1. Définition
Au cours de la grossesse normale, une résistance à l'insuline s’installe progressivement au 2e trimestre, ce qui est associé à un état d’hyperinsulinisme réactionnel. Ces phénomènes d’adaptation favorisent l'augmentation des niveaux de glucose et d’acides gras libres afin de permettre la croissance optimale du fœtus. Une diminution modérée de la sensibilité à l'insuline fait partie du processus de gestation normal. En raison de l'augmentation de l'adiposité maternelle et de la sécrétion hormonale placentaire plus élevée chez la mère, le pancréas ne sécrète plus suffisamment d’insuline chez certaines femmes (15). Le DbG se définit par une intolérance au glucose qui est diagnostiquée pour la première fois pendant la grossesse (1). Lorsque comparées aux femmes qui présentent une tolérance normale au glucose durant la grossesse, les femmes avec un DbG ont une diminution plus importante de la sensibilité à l'insuline en plus d’une réduction de la sécrétion d'insuline (16). Des taux de glucose plus élevés sont occasionnés par une réponse insulinémique inadéquate chez les femmes aux prises avec le DbG. Bien que plusieurs mécanismes de résistance à l'insuline soient observés durant la grossesse, la physiopathologie du DbG demeure complexe. En plus des hormones, certains facteurs génétiques et environnementaux pourraient être à l’origine de cette résistance à l’insuline.
1.2. Dépistage
Un test de dépistage est administré à toutes les femmes entre la 24 et la 28e semaine de grossesse (1). Cependant, les mères âgées de 35 ans et plus ou qui ont un IMC supérieur ou égal à 30, devraient être suivies au cours du premier trimestre (1). L’approche privilégiée par l’Association Canadienne du Diabète (ACD) et les lignes directrices de 2013 indiquent que le test de dépistage du DbG devrait être réalisé dans un contexte d’hyperglycémie
provoquée par voie orale (HGPO) avec 50g de glucose (Figure 1). Le glucose plasmatique devrait être mesuré dans l’heure qui suit. Une valeur de glycémie ≥7.8 mmol/L à 60 minutes devrait être considéré positive et indique qu’une HGPO avec 75 g de glucose est requise. Une valeur de glucose plasmatique >11.1 mmol/L est suffisante pour émettre un diagnostic de DbG et ne requiert pas la confirmation par une HGPO avec 75 g de glucose (1).
Les valeurs seuils ainsi que les tests de dépistage utilisés pour le DbG ne font pas l’objet d’un consensus et varient selon les divers organismes de diabète. L’Association internationale de l’étude du diabète durant la grossesse (IADPSG) et l’Organisation mondiale de la Santé sont les deux seuls à recommander l’unique HGOP avec 75 g de glucose, ce qui correspond à l’approche alternative proposée par l’ACD (Figure 2) (1, 17).
1.3. Épidémiologie
Selon l’estimation de la FID, il y avait 22 millions de femmes en âge de procréer (20-39 ans) aux prises avec le diabète en 2010. De plus, 54 millions de jeunes femmes ont une intolérance au glucose ou un prédiabète, ce qui les prédispose à développer un DbG en cours de grossesse. En somme, c’est plus de 76 millions de femmes qui présentent un risque élevé d’une grossesse compliquée par un prédiabète gestationnel déjà existant ou encore un DbG qui se manifeste pour la première fois pendant la grossesse (2). Plus précisément au Canada, le DbG affecterait 4% des grossesses et la prévalence s’élèverait entre 8 et 18% chez les populations autochtones (18). Plus encore, l’IADPSG estime que la prévalence serait de 18% pour la population en général (10).
Depuis les dernières années, il devient plus ardu de comparer les prévalences de DbG en raison des valeurs diagnostiques qui diffèrent et l’absence d’un consensus international (15). En 2008, une étude canadienne réalisée par Feig et al. a relevé que 21 823 femmes sur un total de 659 164 (3,3%) avaient eu un diagnostic de DbG. Cette incidence a progressée au cours des neuf années de l’étude, soit de 3,2% en 1995 à 3,6% en 2001 (p<0,001) (18). De plus, deux études américaines en santé publique ont démontré que la prévalence du DbG étaient passée de 4 à 6% des grossesses aux États-Unis entre 1991 et 2002, et ce, peu importe l’ethnie, la différence géographique et la disparité entre les critères de diagnostic (4, 19). La hausse du DbG augmentait de façon parallèle dans tous les groupes ethniques, ce qui indique l’élévation de la prévalence du DbG avec les années. Un document du Kaiser Permanente publié en 2011 soulève l’importante présence du DbG. De 1995 à 2009, l’incidence cumulative du DbG était de 10% et variait selon l’origine ethnique, dont 17% chez les Asiatiques, 11% chez les Hispaniques, 7% chez les Caucasiennes et 7% chez les Afro-Américaines (20). Ces écarts entre les diverses populations ethniques seront abordés dans la section suivante en lien avec les facteurs de risque associés au DbG.
1.4. Les facteurs de risque
1.4.1. L’âge de la mèreBien que les grossesses soient moins nombreuses chez les femmes de plus de 45 ans, l’hyperglycémie pendant la grossesse augmente plus rapidement que chez les femmes plus jeunes (21). Environ 47,7% des femmes de 45 ans et plus ont un diagnostic de DbG (2). L’augmentation d’incidence du DbG au cours de la dernière décennie serait attribuable en partie aux grossesses tardives d’après Carolan et al. (21). Le risque de DbG serait 6,3 fois plus important chez les femmes de plus de 40 ans comparativement aux femmes dans la vingtaine (22). Selon la FID, l’âge expliquerait 23% des cas d’hyperglycémie durant la grossesse à travers le monde chez les femmes de plus de 35 ans (2).
1.4.2. L’ethnie
L’ACD a ciblé des groupes ethniques à risque de développer le DbG, dont les femmes d’origine aborigène, hispanique, asiatique et africaine (1). Les prévalences de DbG varient considérablement en fonction de l’ethnie. Environ 5,4% des femmes caucasiennes vont être diagnostiquées avec un DbG, comparé à 11,9% d’Asiatiques, dont 13,0% de Vietnamiennes, 14,0% d’Indiennes et 14,2% de Philippines (23). À l’opposé de l’Amérique du Nord, les prévalences élevées de DbG chez les populations asiatiques sont moins associées à l’excès de poids (23). Le risque relatif de DbG était significativement plus élevé chez les noirs (1,81; 95% IC 1,13-2,89) et les Hispaniques (2,45; 95% IC 1,48-4,04) que chez les Caucasiennes (24). De plus, lorsque nées dans leur pays d’origine et ensuite établies en Amérique du Nord, les immigrantes de l’Asie et des îles du Pacifique auraient des prévalences de DbG plus élevées (25). Tandis que, chez les femmes américaines nées en Afrique, Asie, Inde, Philippine, Îles du Pacifique, Chine et Mexique, les taux de DbG étaient supérieurs aux femmes qui habitaient toujours leur pays d’origine (25). Enfin, les femmes japonaises et coréennes nées à l’étranger auraient moins de risque de développer un DbG (25).
1.4.3. Syndrome des ovaires polykystiques
Le syndrome des ovaires polykystiques est une maladie hétérogène qui affecte 5 à 10% des femmes en âge de procréer. Ce syndrome augmente le risque d'infertilité chez la femme et se caractérise par une condition hyperandrogénique et hyperinsulinémique en concomitance avec la présence d'une obésité abdominale. Les femmes atteintes, notamment celles qui sont obèses, développent une résistance à l’insuline avec hyperinsulinémie compensatrice (40-50%) (26). L’étiologie demeure inconnue, mais l’excès primaire d’androgènes est la cause la plus probable. Son origine pourrait possiblement être génétique (27). Holte et al. rapporte une plus grande prévalence du syndrome des ovaires polykystiques chez les femmes avec un antécédent de DbG (28). Les femmes avec une histoire personnelle de DbG et un syndrome des ovaires polykystiques seraient un sous-groupe de femmes encore plus à risque de développement de la résistance à l’insuline au cours de leur vie en comparaison avec des femmes qui ont seulement un antécédent de DbG. Ces résultats ont été confirmés par plusieurs études, ce qui suggère de porter une attention particulière aux femmes porteuses de ce syndrome (1, 26).
1.4.4. Une grossesse antérieure avec un DbG
La récurrence du DbG est de 30 à 84 % et elle serait plus fréquente chez les mères d’origine non caucasiennes ou en cas de DbG insulinotraité (29). Selon MacNeill et al., dans une étude rétrospective canadienne en Nouvelle-Écosse, la récurrence du DbG était de 35,6% (30). Avec des modèles de régressions multivariées, il a été démontré que le poids de naissance de l’enfant ainsi que le poids de la mère avant la grossesse ultérieure pouvaient prédire la récurrence du DbG (30). Des taux supérieurs (69% des 78 femmes avec un DbG) ont été observés par Major et al. (31). Certains facteurs ont été associés au retour du DbG lors d’une grossesse subséquente : la parité ≥ 1 enfant (OR=3,0), l’IMC ≥ 30 kg/m2 (OR=3,6), le diagnostic antérieur de DbG ≤ 24 semaines (OR=20,4), l’insulinothérapie (OR=2,3), le gain de poids ≥ 7 kg (OR=2,9) ainsi que la période entre les grossesses ≤ 24 mois (OR=1,6) (31). Spong et al. ont également obtenu des valeurs similaires, soit une récurrence de DbG de 68% chez les 164 femmes avec un antécédent de DbG (32). Les
facteurs de risque identifiés étaient un diagnostic précoce du DbG lors de la grossesse précédente, l’insulinothérapie et les hospitalisations en cours de grossesse (32).
1.4.5. Les antécédents familiaux de DT2
Plusieurs études cliniques et épidémiologiques ont identifié l’histoire familiale de diabète comme un facteur de risque primaire dans le développement du DbG (33). Dans la Nurses’
Health Study II (n=14 613), l’histoire familiale de diabète a été indépendamment associée
au DbG (1,68; 95% IC 1,39–2,04) (34). Également, dans une étude de cas-témoin incluant 506 femmes, dont 133 avec un antécédent de DbG, Williams et al. a démontré que l’histoire familiale de diabète augmente significativement le risque de DbG. Cette association était positive, peu importe que l’antécédent de diabète soit présent chez la mère, le père ou la fratrie (35).
D’autre part, une étude de Tabak et al. mentionne que les antécédents maternels de diabète et de DbG étaient de plus grands prédicteurs du DbG que l’histoire de diabète paternel (36). Après plusieurs ajustements pour l’âge, l’IMC et les facteurs de risque habituels du DbG, l’histoire maternelle de diabète continuait de prédire le risque augmenté de DbG chez les femmes caucasiennes (36). Ces résultats appuient la relation complexe entre l’histoire familiale de diabète et le DbG (33). Ainsi, l’histoire familiale de diabète pourrait refléter autant la génétique que les habitudes de vie qui contribuent au développement du DbG (33).
1.4.6. Les facteurs génétiques
À ce jour, un grand nombre d’études tentent de démontrer la susceptibilité génétique de certaines femmes à développer le DbG (7). Tel que démontré dans le paragraphe précédent, plusieurs résultats suggèrent que les grossesses compliquées par un DbG seraient influencées par les antécédents familiaux de diabète (34). De plus, le DbG est récurrent chez 30% des femmes qui ont une histoire de DbG, ce qui suggère que certaines de ces femmes sont génétiquement prédisposées (37). La grossesse pourrait ainsi créer un
environnement propice au développement du diabète chez des femmes qui possèdent une susceptibilité génétique au DbT2. (38). La physiopathologie commune du DbT2 et du DbG suggère une composante génétique semblable.
En effet, les facteurs génétiques associés au DbT2 sont bien démontrés et ont fait l’objet d’études pangénomiques (39). Plus de 65 variantes génétiques sont reliées au DbT2 (40). Ces études offrent un grand potentiel afin de révéler les déterminants génétiques d'une maladie et elles permettent d'identifier des SNPs communs qui contribuent à la variabilité d’un trait d'intérêt. Plusieurs gènes sont dorénavant associés au développement du DbT2 dont le gène transcription factor 7-like 2 (TCF7L2) (41). Au cours de la dernière décennie, plusieurs gènes associés à la sécrétion d’insuline, à la résistance à l’insuline ainsi qu’au métabolisme du glucose et des lipides ont également été reliés au DbG dont GLUT1, TCF7L2, PPARGC1 et PPARG (42).
Un score de risque génétique dans un modèle de prédiction du DbT2 peut également être utilisé pour mieux identifier un groupe de population à risque. Néanmoins, peu d’études ont été réalisées à ce jour auprès des femmes avec un antécédent de DbG ou encore, ces dernières étudient une seule variante génétique à la fois alors que le développement du DbT2 et du DbG est complexe. Il demeure donc important de s’intéresser à plusieurs variantes génétiques et de recourir à l’utilisation de score de risque génétique (43). Kwak et
al. ont démontré qu’un score de risque génétique élaboré avec 48 gènes était associé au
développement du DbT2 chez les femmes asiatiques qui avaient un antécédent de DbG (44). Les femmes avec un antécédent de DbG et un diagnostic de DbT2 présentaient un score de risque génétique supérieur aux femmes sans DbG (9,36 ± 0,92 vs 8,78 ± 1,07; p < 1,56 × 10−7) (44). Une seconde étude de Ekelund et al. a également été réalisée avec un score de risque génétique basé sur 13 variantes génétiques du DbT2 (45). Dans une population multiethnique, le score génétique était associé à l’incidence du DbT2 chez les femmes qui avaient eu une grossesse avec un DbG (45). Plus particulièrement, les variants TCF7L2 rs7903146 et FTO rs8050136 de même que le score pondéré à partir du nombre d’allèles à risque pour le DbT2 pouvaient prédire le développement du DbT2 après un DbG (45).
1.4.7. L’obésité maternelle
La prévalence de l’obésité est en importante hausse et elle se répercute également auprès des jeunes femmes en âge de procréer et des femmes enceintes. En moyenne, les taux d’obésité chez les femmes enceintes américaines seraient entre 18,5 et 38,3% selon les facteurs sociodémographiques et l’ethnie (46). Au Canada, il y aurait 17,1% de femmes de 18 à 29 ans avec de l’embonpoint et 9,8% avec de l’obésité (8). Ces taux s’élèvent à 23,4 et 15,8% chez les femmes de 30 à 39 ans (Tableau 1) (8).Le tiers des femmes canadiennes aurait un IMC égal ou supérieur à 25 selon les données de l’Agence de santé publique en 2009 (Tableau 2).
Tableau 1. Prévalence auto-rapportée des individus avec embonpoint et obésité selon l’âge
Tableau 2. Statut pondéral auto-déclaré des femmes avec des enfants au Canada, selon
l’Agence de santé publique du Canada, 2009. (47) Âge IMC
moins de 18,5
(poids insuffisant) 18,5 à 24,9 (poids normal) 25,0 à 29,9 (excès de poids) 30,0 ou plus (obésité)
15 à 19 ans 11,8a 67,3 14,9 6,0a
20 à 24 ans 10,7 56,6 19,0 13,7
25 à 29 ans 5,2 58,3 21,4 15,1
30 à 34 ans 5,5 59,1 21,7 13,8
35 à 39 ans 4,5a 63,4b 19,9c 12,3c
40 ans ou plus 3,8d 58,4b 29,0c 8,8a,c
Toutes les femmes 6,1 59,3 21,0 13,6
a. Coefficient de variation entre 16,6 et 33,3 %. À interpréter avec prudence.
b. Surestimation par comparaison aux données mesurées sur la taille et le poids de l'Enquête sur la santé dans les collectivités canadiennes [ESCC] (2004, 2005 et 2007-2008).
c. Sous-estimation par comparaison aux données mesurées sur la taille et le poids de l'ESCC (2004, 2005 et 2007-2008).
d. Coefficient de variation > 33,3 %. À interpréter avec prudence.
Les preuves scientifiques sont univoques au sujet de la contribution du poids pré-grossesse comme étant un prédicteur indépendant de plusieurs complications pendant la grossesse (13). Un surplus de poids chez la mère a été associé à un risque plus élevé d’hypertension artérielle, de pré-éclampsie, de problèmes respiratoires, de malformations congénitales, de macrosomie (poids à la naissance >90ème percentile ou >4kg) et de dystocie de l’épaule chez le nouveau-né (48). Plus encore, Chu et a. a démontré que les femmes qui avaient de l’embonpoint, de l’obésité ou de l’obésité sévère avant la grossesse présentaient respectivement deux, quatre et huit fois plus de risque de DbG comparativement aux femmes de poids normal (9). Yogev et al. indique que l’obésité et l’intolérance au glucose sont toutes les deux associées au développement du DbG (46). Un IMC plus élevé contribue au DbG chez tous les groupes ethniques ce qui suggère qu’une perte de poids chez les femmes en âge de procréer pourrait diminuer les complications pendant la grossesse et les risques futurs de développer un DbT2 chez la mère et son enfant (23). Selon Kim et al, les pourcentages ajustés des cas de DbG attribuables à l’embonpoint et à l’obésité seraient de 17,8% chez les Asiatiques, 41,2% chez les Caucasiennes, 44,2% chez les Hispaniques, 51,2% chez les Afro-Américaines et 57,8% chez les Américaines aborigènes (23).
Une revue systématique a démontré que l’IMC pré-grossesse était directement associé au risque de développer un DbG (Figure 3) (49). La fréquence des intolérances au glucose et des diagnostics de DbG suite à une HGPO à 50 g de glucose était supérieure chez les femmes avec de l’embonpoint ou de l’obésité en période de préconception en comparaison aux femmes qui avaient un poids normal (49). Pour chaque unité d’IMC (1 kg/m2), la prévalence du DbG s’élevait de 0,92% (95%, IC 0,73 à 1,10) (49). Après plusieurs ajustements pour les variables confondantes, le risque de DbG demeurait significativement associé avec l’élévation de l’IMC maternel (49).
Figure 3. La prévalence du DbG en fonction de l’IMC maternel pré-grossesse, adaptée de
Torloni et al. (49)
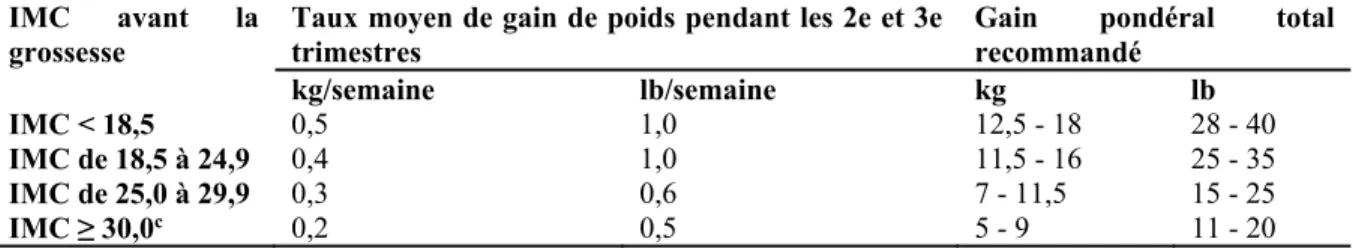
1.4.8. Le gain de poids excessif
Tout comme l’IMC pré-grossesse, le gain de poids recommandé pendant la grossesse devrait faire partie du suivi périnatal médical standard. Aux États-Unis comme au Canada, beaucoup de femmes prennent plus de poids qu'il n’est recommandé (Tableau 3) (9). De même, les femmes qui excèdent les recommandations pour le poids au cours du premier trimestre, soit plus que 2 kg, devraient bénéficier d’un suivi pour limiter le gain de poids afin d’éviter les complications associées au surpoids durant la grossesse. Ces femmes risquent davantage d'être atteintes de DbG, en particulier si leur IMC avant la grossesse
était >25kg/m2 (25). Dans le même ordre d’idées, Morisset et al. ont démontré que l’IMC pré-grossesse ainsi que le gain de poids au premier trimestre étaient tous deux associés à la prédiction du DbG (50). Un gain de poids conforme aux recommandations réduirait les risques de complications obstétriques de même que la rétention du poids après la grossesse chez les femmes avec ou sans surplus de poids.
Tableau 3. Recommandations relatives au rythme de prise de poids et au gain pondéral
total durant une grossesse simple en fonction de l'IMC de la mère avant la grossesse, adapté de l’Institut de Médecine, 2009 (51)
IMC avant la
grossesse Taux moyen de gain de poids pendant les 2e et 3e trimestres Gain pondéral total recommandé
kg/semaine lb/semaine kg lb IMC < 18,5 0,5 1,0 12,5 - 18 28 - 40 IMC de 18,5 à 24,9 0,4 1,0 11,5 - 16 25 - 35 IMC de 25,0 à 29,9 0,3 0,6 7 - 11,5 15 - 25 IMC ≥ 30,0c 0,2 0,5 5 - 9 11 - 20 a. Chiffres arrondis.
b. Le calcul des intervalles du gain de poids recommandé suppose un gain de 0,5 à 2 kg (1,1 à 4,4 lb) pendant le premier trimestre (Siega-Riz et al., 1994; Abrams et al., 1995; Carmichael et al., 1997). c. Dans le cas des femmes qui ont un IMC avant la grossesse égal ou supérieur à 35, un gain pondéral
plus faible peut être conseillé selon le jugement clinique, après une évaluation minutieuse des risques et des avantages pour la mère et l'enfant (Crane et al., 2009; Oken et al., 2009; Hinkle et al., 2010).
1.5. Les complications pour l’enfant
1.5.1. À la naissanceMême en cours de développement, le fœtus est généralement déjà bien formé à l’annonce du diagnostic de DbG. Les conséquences pour la santé du bébé sont donc moins critiques que pour les enfants dont la mère avait un diagnostic de DbT1 ou de DbT2 avant la grossesse (2). Toutefois, la FID mentionne que le DbG peut avoir de très lourdes conséquences pour la mère et son bébé si les glycémies ne sont pas bien contrôlées en cours de grossesse (2). L’hyperglycémie maternelle expose le fœtus à de plus grandes concentrations de glucose et ainsi une augmentation de sa sécrétion d’insuline. Ce phénomène d’adaptation accroît la croissance du fœtus et expose celui-ci à un plus grand
nombre de complications (Tableau 4), dont les malformations congénitales, un poids à la naissance plus élevé et une macrosomie (>4kg) (52). Ogonowski et al. a démontré que dans une population de femmes caucasiennes, les plus importants prédicteurs de macrosomie étaient un antécédent de macrosomie, un IMC >23kg/m2 et une histoire de DbG (53). L’étude de l’Hyperglycemia and Adverse Pregnancy Outcome (HAPO) a permis de mieux connaître l’impact des anomalies du métabolisme du glucose pendant la grossesse ainsi que le risque augmenté de plusieurs complications néonatales (Figure 4), les différences demeuraient significatives après avoir ajusté en fonction de l’IMC maternel (54).
Tableau 4. Fréquences des complications périnatales dans la cohorte de l’étude HAPO,
Metzger et al. (52) Complications Fréquence (%) Différence de fréquence (%) Grossesse avec DbG Grossesse sans DbG Pré-éclampsie 9,1 4,5 4,6
Accouchement prématuré, <37 semaines 9,4 6,4 3,0
Césarienne 24,4 16,8 7,6
Dystocie de l’épaule 1,8 1,3 0,5
Soins intensifs en néonatalité 9,1 7,8 1,3
Hypoglycémie néonatale 2,7 1,9 0,8
Hyperbilirubinémie 10,0 8,0 2,0
Poids de naissance >90e percentile 16,2 8,3 7,9 Niveau de C peptide dans le cordon
ombilical >90e percentile 17,5 6,7 10,8
Figure 4. Hyperglycémie maternelle et complications néonatales, Metzger (54)
D’autre part, les mécanismes de programmation fœtale de l'obésité et des maladies métaboliques sont également étudiés dans le DbG. Dans une étude sur les modifications épigénétiques chez les nouveau-nés exposés au DbG, plusieurs gènes étaient différentiellement exprimés pendant la grossesse, dont 326 gènes dans le placenta et 117 gènes dans le cordon ombilical (55). Ces gènes étaient également associés au poids à la naissance (55). Ruchat et al. suggèrent que le DbG aurait une influence épigénétique dans le développement des maladies métaboliques, et ainsi, des conséquences dans la croissance et le développement des enfants (55, 56). Ces résultats appuient l’implication de la méthylation de l’ADN dans le processus de programmation fœtale (55).
1.5.2. À l’enfance et à l’âge adulte
L’exposition fœtale au DbG influence également le développement au cours de l’enfance et de la vie adulte. Il a été démontré que la sécrétion plus élevée d’insuline pendant une grossesse compliquée par un DbG était un important prédicteur de l’embonpoint et de l’intolérance au glucose pendant l’enfance et l’adolescence, et ce, même après avoir ajusté pour le poids à la naissance (57, 58). Plusieurs études auprès des enfants exposés à une
hyperglycémie fœtale supportent la fréquence accrue d’obésité, de diabète et de SM à long terme chez ces enfants (59-61).
Bien que la plupart des études démontrent que le poids des enfants exposés au DbG serait plus élevé, certains résultats se contredisent. Dans l’étude de Pham et al. l’obésité des enfants de 2 à 4 ans n’était pas associée au DbG, mais davantage reliée à l’IMC maternel et à un poids de naissance supérieur (61). Selon les observations de Crume et al., l’exposition intra-utérine au DbG ne se refléterait pas par une augmentation de l’IMC avant l’âge de 2 ans (62). Les courbes d’IMC (ajustées pour le sexe et l’ethnie) n’étaient pas significativement différentes pour les enfants exposés ou non au DbG jusqu’à l’âge de 26 mois (p=0,48) (62). Par contre, à partir de 27 mois jusqu’à l’âge de 13 ans, les enfants dont la mère avait eu un antécédent de DbG avaient des courbes de croissance et de poids supérieures (p=0.008) (62). Aussi, une étude effectuée auprès de 51 enfants de trois ans a permis de constater que pour un même IMC, ceux qui avaient été exposés au DbG avaient des marqueurs d’adiposité plus élevés (59). Parmi des enfants âgés de 7 à 11 ans, la prévalence d’embonpoint était de 26,8% chez les garçons et 11,4% chez les filles nées d’une grossesse compliquée par un DbG (62). La prévalence d’embonpoint pour les enfants canadiens de cet âge est de 19,0%, laissant ainsi présager une plus grande influence chez le poids des garçons (63). Selon une revue systématique effectuée par le Centers for Disease Control and Prevention aux États-Unis, il demeure difficile de confirmer l’association entre le DbG et l’obésité infantile en raison du faible nombre d’études réalisées ainsi que des différences méthodologiques qui limitent les comparaisons (64).
Le milieu métabolique maternel a également été identifié comme l’un des facteurs clefs dans le développement de la résistance à l’insuline chez les enfants exposés au DbG. Le phénomène de programmation fœtale pourrait être à l’origine des perturbations métaboliques observées dans le métabolisme du glucose de ces enfants (65). Borgono et al. a étudié la résistance à l’insuline chez des enfants nés à terme âgés d’un an, dont 36 exposés au DbG et 68 non-exposés au DbG. L’indice de résistance HOMA-IR n’était pas significativement différent parmi les enfants exposés (p=0,74) vs. le groupe contrôle (66). Néanmoins, le poids à la naissance était un important prédicteur de la résistance à l’insuline
(t=3,33, p=0,002) (66) et le gain de poids durant la première année de vie chez les enfants exposés au DbG était associé à la résistance à l’insuline (t=2,19, p=0,039) (66). D’autre part, parmi des paires d’enfants dont l’un ayant été exposé au DbG in utero et l’autre né d’une grossesse sans DbG, il a été démontré que les enfants avec une exposition fœtale à des valeurs d’hyperglycémie présentaient un IMC supérieur de même qu’un plus grand risque de développer le DbT2 (4, 67).
Les nourrissons nés avec un poids supérieur par rapport à leur âge gestationnel en plus d’avoir été exposés à un environnement maternel de DbG et d’obésité, sont encore plus à risque de développer un SM au cours de leur vie (59). Cette exposition fœtale viendrait perturber le cycle de l’obésité, de la résistance à l’insuline de même que leurs conséquences pour les générations futures (59, 67). Dans la croissance du nourrisson (<1 an), il n’y aurait pas de différence dans le profil de risque cardiovasculaire chez les enfants exposés au DbG selon Retnakaran et al. Néanmoins, ces travaux suggèrent une différence dans la production d’adiponectine, soit la molécule produite par le tissu adipeux et la régulation du métabolisme des lipides et du glucose. Ce qui laisse présager un risque vasculaire plus élevé dès l’enfance chez les enfants exposés au DbG (68). En plus d’avoir des marqueurs d’adiposité et de sécrétion d’insuline supérieurs, l’exposition intra-utérine au DbG serait associée à des plus faibles concentrations de cholestérol-HDL de façon indépendante au statut pondéral de ces enfants (60). Ces résultats sous-tendent que lorsque l’exposition fœtale au DbG est combinée à un statut d’embonpoint, les profils métaboliques de ces enfants seraient encore plus à risque (60).
Les interventions visant à rétablir le contrôle glycémique de même que prévenir le gain de poids durant la grossesse auraient donc un impact déterminant dans la santé métabolique des enfants à long terme. Toutefois, l’incidence du diabète et de l’obésité auprès des enfants exposés au DbG n’aurait pas diminué depuis 1955, alors que les femmes bénéficieraient d’un suivi plus rigoureux pendant la grossesse (57, 69). La hausse d’incidence du DbG de même que la prévalence d’obésité infantile pourraient expliquer en partie ce résultat. Les enfants exposés au DbG demeurent un jeune groupe de population à risque de développer hâtivement des maladies chroniques (55). Il importe de considérer des stratégies
d’intervention dès la période intra-utérine afin de prévenir l’apparition de l’obésité et des anomalies du métabolisme du glucose.
1.6. Les complications pour la mère
1.6.1. À la grossesse et l’accouchementPlusieurs complications ont été recensées chez les femmes dont la grossesse était compliquée par un DbG. Entre autres, les femmes avec une hyperglycémie pendant la grossesse ont davantage d’accouchements par césarienne que celles n’ayant pas d’historique de DbG (31,7% vs. 20,9%, p=0,02) (70). Cette hausse serait principalement reliée au poids de naissance plus élevé chez le nouveau-né. De plus, les femmes avec un DbG ont un risque accru de développer des complications médicales durant la grossesse (48,8 vs. 17,1%, p<0.001) comparativement aux femmes du groupe contrôle (70). L’étude de Saydah et al. rapporte que 21,2% des femmes avec DbG présentaient une complication pendant la grossesse et que 27,6% présentaient deux complications ou plus vs. 6,9% et 10,2% chez les femmes sans DbG (p<0,0001) (70). La pré-éclampsie s’avère la complication de grossesse la plus souvent associée au DbG et touchait 20,7% des femmes avec DbG vs. 6,0% des femmes sans DbG (p=0,002). Plus encore, avoir un statut pondéral avec embonpoint ou obésité lorsque combiné au DbG, augmenterait les risques de pré-éclampsie et de césarienne en comparaison avec des femmes qui ont un DbG et un IMC normal (71). Les risques de fausses-couches et d’accouchement prématuré sont également plus élevés chez les femmes avec un DbG (19).
Un traitement intensif visant un meilleur contrôle des glycémies et du gain de poids pendant la grossesse permettrait de réduire l’incidence de maladies hypertensives (pré-éclampsie, hypertension gestationnelle) comparativement à un suivi obstétrique standard (71, 72). Ces résultats suggèrent que les grossesses compliquées par un DbG sont associées à un plus grand nombre de complications médicales (70-72).
1.6.2. À long terme
1.6.2.1. Les maladies cardiovasculaires
Les femmes avec un antécédent de DbG ont été reconnues plus à risque de développer des MCAS en comparaison avec des femmes qui partagent les mêmes caractéristiques sociodémographiques, l’âge et la parité (4). En effet, il a été démontré par Retnakaran et al. que l’hypertension artérielle en post-partum était plus fréquente chez les femmes avec une anomalie de la glycémie pendant la grossesse (73). À trois mois post-partum, les femmes avec une intolérance au glucose durant la grossesse (103,5 à 115,5 mm Hg; n = 91) et les femmes avec un DbG (105 à 119,5 mm Hg; n=137) avaient des valeurs de pression systolique supérieures aux femmes du groupe contrôle (102 à 114 mm Hg; n=259) (p=0,0158) (73).
Plus encore, un antécédent de DbG et une intolérance au glucose pendant la grossesse seraient également associés à la dysfonction endothéliale démontrée par la vasodilatation dépendante du flux sanguin mesurée par des ultrasons pratiqués sur des artères brachiales (74). Toutefois, ces marqueurs de la dysfonction endothéliale précoce ne seraient pas perceptibles avant 6 mois post-partum (15). D’autre part, chez les femmes avec DbG, la résistance périphérique, soit la force qui s`oppose à l`écoulement du sang était plus élevée (p≤0,04) alors que le volume d’éjection systolique (65 ± 13 vs. 75 ± 14 ml/battement), et le volume d’éjection cardiaque (70 ± 12 vs. 74 ± 13 ml/sec) étaient abaissés après avoir ajusté en fonction de l’IMC (75).
D’autre part, dans une étude de Retnakaran et al., les résultats démontrent que le DbG est un important prédicteur de l’augmentation du cholestérol total plasmatique (p=0,0047), de la faible densité des lipoprotéines (p=0,0002), et de la concentration de triglycérides (p=0,0002) à 3 mois post-partum (76). En comparaison avec des femmes contrôles, les femmes avec un antécédent d’intolérance au glucose pendant la grossesse ou de DbG avaient davantage des profils lipidiques athérogéniques caractérisés par une élévation du cholestérol LDL et des Apo B (76). Les données récemment publiées de l’étude Cardia appuient qu’une histoire de DbG pourrait être un important prédicteur de l’athérosclérose
en bas âge et ce, indépendamment de l’obésité en pré-conception chez les femmes qui n’avaient pas développé le DbT2 ou le SM en moyenne 13 ans après leur dernière grossesse (77).
Parmi les femmes qui ont un historique familial de DbT2, celles qui ont un antécédent de DbG seraient plus à risque d’avoir des facteurs prédicteurs de MCAS incluant le SM et le DbT2, mais également d’avoir des incidents cardiovasculaires en bas âge (78). La prévalence auto-rapportée d’évènements cardiovasculaires (accident vasculaire cérébrale et/ou maladie coronarienne) était supérieure chez les femmes avec DbG (n=332) en comparaison avec les femmes du groupe contrôle (n=662) de l’étude de Carr et al. (1,85; IC 95%: 1,21 à 2,82; p=0,005) (78). Plus encore, les évènements de maladies coronariennes rapportés surviendraient en moyenne 7 ans plus tôt chez les femmes avec un DbG que chez les femmes contrôles (45,5 ± 2,2 ans vs. 52,5 ± 1,9 ans, p=0,02) (78).
1.6.2.2. Le syndrome métabolique
Les anomalies du métabolisme du glucose et l’obésité abdominale sont deux composantes du SM qui sont très fréquentes chez les femmes avec un historique de DbG (79). L’apparition hâtive du SM pourrait compromettre la santé métabolique de ces femmes en jeune âge (79). Indépendamment des critères diagnostiques utilisés, la prévalence du SM serait 3 fois plus élevée chez les femmes avec DbG en comparaison avec des femmes contrôles (38,4 vs. 13,4%, P<0,0005) à 9,8 ans après la dernière grossesse (79). En utilisant les critères de l’Organisation mondiale de la Santé, la prévalence serait jusqu’à 7 fois plus élevée chez les femmes obèses avec DbG (79).
De plus, à 3 mois post-partum et selon les critères de la FID en 2005, la prévalence du SM était de 10% chez les femmes du groupe contrôle, 17,6% chez les femmes avec une intolérance au glucose pendant la grossesse et 20% chez les femmes avec DbG (p=0,016) (73). Dans une récente méta-analyse effectuée à partir de 17 articles publiés, il a été mentionné que les femmes avec un antécédent de DbG avaient un risque significativement
plus élevé de développer le SM en comparaison avec les femmes sans DbG (3,96 OR; IC 95%, 2,99 à 5,26) (80). D’ailleurs, les femmes avec un IMC élevé et un antécédent de DbG avaient un risque accru de développer un SM suite à leur grossesse (80). Ces résultats démontrent qu’une intolérance au glucose et un DbG peuvent prédire l’apparition hâtive du SM auprès de ce jeune groupe de population à risque de maladies chroniques (73, 79, 80).
1.6.2.3. Le diabète de type 2
À long terme, les femmes présentant un DbG sont également plus à risque de développer un DbT2 que les femmes avec une tolérance normale au glucose pendant la grossesse (6). Selon une revue de la littérature effectuée par Kim et al., la prévalence du DbT2 suivant le DbG variait entre 3% et 70% dans les 6 mois à 28 ans suivant l'accouchement (37). Bien que le DbG disparaisse la plupart du temps à la suite de l’accouchement, une résistance à l'insuline et un défaut de sécrétion d'insuline peuvent persister au cours de la période postpartum (37, 81). Lorsque ces perturbations du métabolisme continuent après l'accouchement, les risques d'anomalie de la glycémie à jeun, d'intolérance au glucose et de DbT2 sont plus élevés (73, 82). Un déclin de la fonction des cellules β a été relevé chez ces femmes dans la première année postpartum, ce qui contribue à accroître leur risque de développer le DbT2 (83). La physiopathologie commune au DbT2 et au DbG ainsi que le développement du DbT2 après un DbG sont abordés plus en détails dans la prochaine section.
2. Diabète de type 2
2.1. Épidémiologie
Il a été estimé que 371 millions de personnes étaient atteintes de diabète en 2012, selon la FID (2). Ce nombre pourrait atteindre les 552 millions, près d’un adulte sur 10 d’ici 2030 (1). Cette hausse importante concerne davantage les pays en développement. Toutefois, les répercussions au Canada s’annoncent toutes aussi importantes. En 2009, la prévalence canadienne du diabète était estimée à 6,8 % (soit 2,4 millions de Canadiens et Canadiennes), ce qui correspond à une hausse de 230 % devant les données de 1998. À court terme, la prédiction de 2019 s’élève à 3,7 millions de Canadiens aux prises avec le diabète (1).
2.2. Les conséquences du DbT2
Le DbT2 est une maladie progressive et dont la résistance à l’insuline accroit au cours des années. Avec le temps, l’hyperglycémie peut entraîner certaines complications, comme la cécité, des maladies cardiovasculaire, une atteinte rénale ainsi que neurologique. De plus, les diabétiques présentent un risque trois fois plus élevé d’être hospitalisés suite à une maladie cardiovasculaire et 20 fois plus élevé d’être hospitalisés à cause d’une amputation non traumatique (1). Chez les adultes de 20 à 49 ans, les diabétiques sont deux fois plus susceptibles de consulter un médecin généraliste et deux à trois fois plus susceptibles de consulter un spécialiste. D’ailleurs, l’espérance de vie d’une personne atteinte de DbT2 serait réduite de 5 à 10 années. Heureusement, des soins adéquats et une bonne gestion du diabète peuvent prévenir ou retarder l’apparition des complications (1).
Le rapport intitulé « Le diabète au Canada », publié en 2011 par l’Agence de la santé publique du Canada, n’a pu faire état du fardeau économique relié au diabète. Néanmoins, il a été conclu que les coûts continueront à croitre considérablement avec l’augmentation de la prévalence du diabète (1). Toutefois, en 2009, l’ACD a ordonné un rapport en vue
d’évaluer le fardeau économique du diabète à partir d’un modèle canadien de calcul des coûts utilisant les données du Système national de surveillance du diabète et du rapport intitulé Le fardeau économique de la maladie au Canada. Ce rapport a évalué que les coûts du diabète s’élevaient à 12,2 milliards de dollars en 2010 (1).
2.3. Dépistage
Il est recommandé d’effectuer un test de dépistage du DbT2 tous les trois ans partir de l’âge de 40 ans et plus (1). Néanmoins, les individus ayant des facteurs de risque additionnels (histoire familiale de DbT2, groupe de population à risque, histoire personnelle d’intolérance au glucose, hypertension, dyslipidémie, un surplus de poids et/ou une obésité abdominale) devraient avoir un dépistage plus tôt et plus fréquent (1). Les femmes avec un antécédent de DbG font également partie du groupe de population qui devrait bénéficier d’un dépistage précoce. Pour ce faire, plusieurs méthodes permettent le diagnostic du prédiabète (Tableau 5) et du DbT2 (Tableau 6). Il importe de considérer que 70% des gens avec un prédiabète vont développer un DbT2 au cours de leur vie (84).
Tableau 5. Diagnostic du prédiabète, selon l’ACD, 2013. (1)
Épreuve de laboratoire Résultat Catégorie de prédiabète Glycémie à jeun (mmol/L) 6,1 à 6,9 Anomalie de la glycémie à jeun Glycémie 2 heures après 75 g
de glucose (mmol/L) 7,8 à 11,0 Intolérance au glucose Taux d’HbA1c (%) 6,0 à 6,4 Prédiabète
Tableau 6. Diagnostic du diabète selon l’ACD, 2013. (1)
Épreuve de laboratoire Résultat
Glycémie à jeun ≥ 7,0 mmol/L
Taux d’HbA1c ≥ 6,5 %
Glycémie 2 heures après l’ingestion de 75 g de glucose
≥ 11,1 mmol/L
2.4. Les risques de DbT2 chez les femmes avec un antécédent de DbG
Tel que mentionné précédemment, le phénomène de résistance à l’insuline observé dans les grossesses compliquées par un DbG se résorbe dans 90% des cas suite à l’accouchement (4). Ces femmes sont alors considérées normoglucotolérantes. Cependant, il importe de considérer qu’une grande proportion de ces femmes développera un DbT2 dans les années à venir. En effet, le DbG s’est révélé un important prédicteur du prédiabète et du DbT2 à 3 mois post-partum (OR: 14,3; IC 95%: 4,2 à 49,1) (37). L’intolérance au glucose lors de la grossesse et le DbG sont d’importants facteurs de risque pour le développement du DbT2 (Figure 5) (85). Selon le continuum de la résistance à l’insuline proposé par Ben-Haroush et
al., la grossesse constitue une période où la résistance à l’insuline augmente et prédispose
certaines femmes à développer un DbT2 suite à une grossesse avec DbG (85).
Figure 5. Modèle de progression vers le DbT2, selon Ben-Haroush, 2004. (85)
Buchanan et al. a démontré que 20 à 60% des femmes avec un antécédent de DbG vont développer un DbT2 dans les 5 à 10 années suivant la grossesse en absence d’interventions spécifiques visant à réduire la progression de cette condition chez ces femmes (4). De façon similaire, Kim et al. appuie également que 20 à 30% des femmes avec DbG vont développer un DbT2 cinq ans après leur accouchement (37). Selon une autre étude, c'est plus d'un tiers des femmes avec un historique de DbG qui seront diagnostiquées avec une
altération du métabolisme du glucose, dont une anomalie de la glycémie à jeun, une intolérance au glucose ou un DbT2, dans les 6 à 12 semaines suivant leur accouchement (16). Ces variations importantes peuvent être expliquées en raison des différentes populations étudiées et le temps qui diffère après l'accouchement. Un groupe d’étude a analysé des données populationnelles ontariennes et a relevé une incidence de 20% de DbT2 chez les femmes avec un DbG en comparaison avec 1,95% de DbT2 chez des femmes sans DbG, neuf ans après leur dernier accouchement (Figure 6) (18). Ces prévalences sont très élevées en comparaison avec les femmes de 35-39 ans au Canada, dont seulement 3,3% sont atteintes de DbT2 (2008/09) (8).
Figure 6. Incidence cumulative du DbT2 après 9 ans selon un antécédent de DbG, adapté
de Feig, 2008. (18)
Dans une revue systématique de Golden et al., effectuée à partir de 11 études prospectives, il a été relevé que la glycémie à jeun pendant la grossesse était un bon prédicteur du DbT2 (86). De plus, l’altération du fonctionnement des cellules-β dans la compensation de la résistance à l’insuline augmentait avec le temps chez les femmes avec une histoire de DbG (4).
2.5. Facteurs influençant le développement du DbT2 chez les femmes
avec antécédent de DbG
D’autres caractéristiques du DbG ont également été associés au développement accéléré du DbT2 dont des valeurs élevées de glycémie à jeun et 2h-post HGPO, la résistance à l’insuline, un dysfonctionnement des cellules β, un diagnostic de DbG <24 semaines et l’insulinothérapie pendant la grossesse (29). Des niveaux élevés de protéine C-réactives et d’adiponectines peuvent également être associées à l’apparition hâtive du DbT2 (4).
Plusieurs auteurs attribuent les conséquences métaboliques du DbG au poids de la femme. En effet, le gain de poids et le développement de l’obésité chez les jeunes femmes sont d’importants prédicteurs des MCAS, du SM et du DbT2, ce qui s’apparente aux complications associées au DbG (87). Puisque l’obésité est un enjeu de santé publique majeur qui affecte désormais les jeunes femmes en âge de procréer, il importe de se préoccuper de son impact auprès des femmes avec un antécédent de DbG.
Une étude effectuée en Finlande par Pirkola et al. a permis de mieux comprendre la relation entre le poids pré-grossesse et le risque de DbT2 selon un antécédent de DbG (88). Les femmes qui présentaient le plus haut risque de diabète étaient celles avec un surplus de poids pré-grossesse et un antécédent de DbG. D’autre part, les femmes avec un poids avant grossesse normal et un antécédent de DbG présentaient un risque de DbT2 similaire à celles avec un surplus de poids, mais sans antécédent de DbG (Figure 7) (88). Un statut pondéral avec un surplus de poids chez les femmes avec un antécédent de DbG pourrait permettre l’identification d’un sous-groupe de femmes particulièrement à risque de DbT2.
Figure 7. Incidence du DbT2 selon le statut pondéral et un antécédent de DbG, Pirkola,
2010. (88)
D’autre part, la distribution du tissu adipeux diffère chez les femmes qui présentaient de l’embonpoint ou de l’obésité avant la grossesse. Parmi les changements morphologiques au cours de la grossesse, l’adiposité centrale et l’accumulation de la masse grasse en période post-partum sont plus élevées chez les femmes obèses en comparaison avec des femmes non-obèses (89). En ce sens, la mesure de la masse grasse de même que le tour de taille et le tour de hanche ont permis de constater que les femmes obèses avant la grossesse avaient développé davantage d’obésité abdominale à 6 mois post-partum (87). L’obésité intra-abdominale se définit comme une accumulation excessive de tissu adipeux entourant les viscères à l’intérieur de la cavité abdominale (90). Il demeure important de s’intéresser à la distribution de la masse grasse en plus de l’IMC lors de l’évaluation du risque de DbT2 (90). En effet, la répartition et les caractéristiques du tissu adipeux sont à prendre en considération, car l’excès de tissu adipeux viscéral est davantage associé au risque de développer les MCAS et le DbT2 que le gras sous-cutané (46, 90, 91).
Par ailleurs, dans un modèle ajusté pour l’âge des femmes, il a été rapporté que les mères qui avaient eu un gain de poids supérieur aux recommandations lors de la grossesse avaient 1,47 (IC 95% 1,11-1,94) fois plus de risque de développer un diabète 21 ans après la dernière grossesse, lorsque comparées avec des femmes qui avaient eu un gain à l’intérieur des cibles recommandées (92). Cette association n’était pas expliquée par les facteurs confondants attendus comme l’âge maternel, le niveau d’éducation, la parité, l’ethnie, le tabagisme, le temps d’écran et la sédentarité, mais principalement en lien avec l’IMC actuel de ces femmes. De plus, cette association entre le gain de poids excessif pendant la grossesse et le DbT2 n’était pas observée chez les femmes qui avaient un IMC normal en période de pré-conception (92).
3. Le suivi après une grossesse compliquée par un DbG
Après avoir identifié les facteurs qui contribuent à l’apparition des conséquences métaboliques suite à un DbG, il convient de mentionner le suivi recommandé chez ces femmes en post-partum. L’ACD, l’Association américaine du diabète, l’Organisation mondiale de la santé et le Collège américain des obstétriciens et des gynécologues recommandent à l’unanimité un test de tolérance au glucose dans les 6 mois après une grossesse compliquée par un DbG (Figure 9) (2). De plus, il est important d’effectuer un test de tolérance au glucose avant de planifier une nouvelle grossesse ainsi que tous les 3 ans pour les femmes avec un antécédent de DbG (1). Malgré cette recommandation et le risque accru de développer un DbT2, il a été recensé que la majorité de ces femmes n’avaient pas été rencontrées pour un suivi post-partum impliquant un contrôle du glucose sanguin (4, 93). Pourtant, plusieurs études confirment qu’il est possible de prévenir ou encore réduire la progression des altérations métaboliques associées au DbG, dont le DbT2 (94). Toutefois, peu de programmes visant la prévention du diabète auprès des femmes qui ont un historique de DbG ont été réalisés (93).
Figure 8. L’approche suggérée dans le suivi post-grossesse des femmes avec DbG en