iv
Dynamique d’une population faunique en
expansion sous différents scénarios
climatiques : le dindon sauvage (Meleagris
gallopavo)
Thèse
Maxime LavoieDoctorat en biologie
Philosophiae doctor (Ph.D.)
Québec, Canada
© Maxime Lavoie, 2016
Dynamics of an expanding animal population
under different climate change scenarios: the
wild turkey (Meleagris gallopavo)
Thèse
Maxime Lavoie
Sous la direction de :
Jean-Pierre Tremblay, directeur de recherche
Pierre Blanchette, codirecteur de recherche
iii
Résumé
Les changements climatiques récents ont mené à l’expansion de la répartition de plusieurs espèces méridionales, mais ont aussi causé l’extinction locale d’espèces se retrouvant à la limite de leur tolérance environnementale. Ces populations en expansion peuvent favoriser différentes stratégies d’histoire de vie en répondant à différents facteurs limitants. Dans cette thèse, je vise à déterminer et quantifier l’effet du climat et des évènements extrêmes sur le cycle de vie complet d’une espèce en expansion (le dindon sauvage) pour comprendre les changements au niveau populationnel ainsi que les mécanismes impliqués dans l’expansion de la distribution d’une espèce. J’ai défini les évènements extrêmes de pluie, d’épaisseur de neige au sol et de température, comme un évènement dont la fréquence est plus rare que le 10e et 90e percentile. En utilisant l’approche « Measure-Understand-Predict » (MUP), j’ai tout d’abord suivi trois populations le long d’un gradient latitudinal de sévérité hivernale pour mesurer l’effet de variables météorologiques sur la dynamique des populations. La survie des dindons sauvages diminuait drastiquement lorsque l’accumulation de neige au sol dépassait 30 cm pour une période de 10 jours et diminuait également avec la température. Au printemps, la persistance de la neige affectait négativement le taux d’initiation de la nidification et l’augmentation de la pluie diminuait la survie des nids. Dans une deuxième étape, j’ai examiné l’impact des évènements climatiques extrêmes et des processus démographiques impliqués dans l’expansion du dindon, liés à la théorie des histoires de vie pour comprendre la relation entre la dynamique de ces populations en expansions avec le climat. J’ai démontré que la fréquence des évènements extrêmes hivernaux et, d’une façon moins importante, les évènements extrêmes estivaux limitaient l’expansion nordique des dindons sauvages. J’ai appuyé, à l’aide de données empiriques et de modélisation, les hypothèses de la théorie classique des invasions biologiques en montrant que les populations en établissement priorisaient les paramètres reproducteurs tandis que la survie adulte était le paramètre démographique affectant le plus la dynamique des populations bien établies. De plus, les populations les plus au nord étaient composées d’individus plus jeunes ayant une espérance de vie plus faible, mais avaient un potentiel d’accroissement plus élevé que les populations établies, comme le suggère cette théorie. Finalement, j’ai projeté l’impact de la récolte sur la
iv
dynamique des populations de même que le taux de croissance de cette espèce en utilisant les conditions climatiques futures projetées par les modèles de l’IPCC. Les populations en établissement avaient un taux de récolte potentiel plus élevé, mais la proportion de mâles adultes, possédant des caractéristiques recherchées par les chasseurs, diminuait plus rapidement que dans les populations établies. Dans le futur, la fréquence des évènements extrêmes de pluie devrait augmenter tandis que la fréquence des évènements extrêmes de température hivernale et d’accumulation de neige au sol devraient diminuer après 2060, limitant probablement l’expansion nordique du dindon sauvage jusqu’en 2100. Cette thèse améliore notre compréhension des effets météorologiques et du climat sur l’expansion de la répartition des espèces ainsi que les mécanismes démographiques impliqués, et nous a permis de prédire la probabilité de l’expansion nordique de la répartition du dindon sauvage en réponse aux changements climatiques.
v
Abstract
Recent global climate changes have resulted in range expansion for many temperate species but have also led to local extinctions for species living at the fringe of their environmental tolerance. These expanding populations may prioritize different life history strategies by responding differently to limiting factors. In this thesis, we aim to assess and quantify the effect of climate and extreme events on the whole life cycle of an expanding wildlife species (wild turkey) to understand population change and range expansion. I defined an extreme climate event for rain, snow depth and temperature, as events rarer than the 10th and 90th percentile. Using a Measure-Understand-Predict (MUP) approach, I first followed three populations along a latitudinal gradient in winter harshness to measure the effect of weather variables on population dynamics. Winter survival of wild turkeys decreased dramatically when snow depth was over a 30 cm threshold and also decreased with temperature. Snow persistence and precipitation in spring negatively impacted initiation nesting rate and nest survival, respectively. In a second step, I examined the impact of extreme climate events and the demographic mechanisms driving their expansion in the context of life history theory to understand the relationship with climate. I showed that the frequency of extreme winter events and to a lesser extent extreme summer events limited the northern expansion of wild turkeys. I supported the hypotheses of the classical biological invasion theory, with empirical data and modelling, as establishing populations prioritized reproductive parameters while adult survival was the key demographic parameter driving the dynamics of well established populations. Furthermore, more northern populations were composed of younger individuals with a lower life expectancy but had a higher potential growth rate than populations located more southerly as predicted by this theory. Finally, I predicted the impact of the harvest on population dynamics as well as the population growth rate of this species using future climate conditions projected by IPCC-class models. Establishing populations had a higher harvest rate potential but the proportion of adult males, possessing enhanced characteristics sought by hunter, decreased faster than in established populations. In the future, frequency of rain extreme events is predicted to increase while frequency of winter temperature and snow cover extreme events should decrease after 2060, potentially restraining wild turkey northern expansion until at
vi
least 2100. This thesis increases our understanding of the effect of weather and climate on range expansion and their underlying demographic mechanisms, and allows us to predict the likelihood of the northern expansion range of wild turkey in response to climate changes.
vii
Table des Matières
RÉSUMÉ ... III ABSTRACT ... V TABLE DES MATIÈRES ... VII LISTE DES TABLEAUX ... X LISTE DES FIGURES ... XII LISTE DES ANNEXES ... XV REMERCIEMENTS ... XIX AVANT-PROPOS ... XXIII
CHAPITRE 1 ... 1
INTRODUCTION GÉNÉRALE ... 1
Changements climatiques ... 2
Réponses des populations ... 3
Variations des paramètres démographiques ... 5
Populations en expansion ... 5
Espèces chassées ... 6
Écologie et gestion du dindon sauvage ... 7
Objectifs et structure de la thèse ... 10
Approche conceptuelle ... 10
Approches méthodologiques ... 12
Captures et suivi télémétrique ... 12
Suivi des nids ... 13
Approche analytique ... 13
M : Évaluation des paramètres démographiques ... 13
U : Comprendre les liens avec le climat ... 13
P : Projeter les populations face aux changements climatiques futurs ... 14
CHAPITRE 2 ... 16
SNOW DEPTH, WINTER TEMPERATURE AND SUMMER RAIN MODULATE DEMOGRAPHIC PARAMETERS OF WILD TURKEY AT THE NORTHERN EDGE OF THE SPECIES DISTRIBUTION 16 Résumé ... 17
Abstract ... 18
Introduction ... 19
Materials and Methods... 20
Study area ... 20 Capture methodology ... 20 Survival parameters ... 22 Reproductive parameters ... 22 Statistical analyses ... 23 Survival parameters ... 23
viii Reproductive parameters ... 24 Results ... 25 Survival parameters ... 25 MODEL ... 29 PARAMETER... 29 ESTIMATE ... 29 95% CI ... 29 Reproductive parameters ... 32 Discussion ... 37 Acknowledgements ... 39 CHAPITRE 3 ... 40
EXTREME CLIMATE EVENTS LIMIT NORTHERN RANGE EXPANSION OF WILD TURKEYS ... 40
Résumé ... 41 Abstract ... 42 Introduction ... 43 Methods ... 44 Study area ... 45 Population modeling ... 45
The life cycle ... 45
Population model ... 49
Relationship between climate extreme events and vital rates ... 50
Stochastic extreme event forecasts and population projections ... 52
Results ... 53
Relationship between climate extreme events and vital rates ... 54
Stochastic extreme event forecasts and population projections ... 60
Discussion ... 65
Acknowledgements ... 68
CHAPITRE 4 ... 70
HOW TO ADAPT HARVEST RATES OF EXPANDING WILD TURKEY ACCORDING TO CLIMATE AND EXTREME WEATHER EVENTS. ... 70
Résumé ... 71 Abstract ... 73 Introduction ... 74 Methods ... 75 Study area ... 76 Population modeling ... 76
The life cycle ... 76
Stage-structured matrix population model... 81
Relationship between demographic parameters, expansion stages and climate ... 82
Interaction between hunting harvest, invasion stages and climate ... 83
Results ... 83
Relationship between demographic parameters, invasion stages and climate ... 83
Interactions between hunting harvest, invasion stages and climate: spring harvest ... 84
Interactions between hunting harvest, invasion stages and climate: fall harvest ... 84
Discussion ... 91
ix
CHAPITRE 5 ... 95
CONCLUSION GÉNÉRALE ... 95
M : Évaluation des paramètres démographiques ... 97
Les conditions météorologiques limitent les populations à la limite de leur répartition97 U : Compréhension de l’influence du climat ... 98
La fréquence des conditions climatiques extrêmes restreint l’expansion des populations à la limite de leur répartition ... 98
Différentes stratégies d’histoire de vie sont favorisées selon le stade d’invasion biologique ... 99
P : Projection des populations face aux changements climatiques futures ... 100
L’expansion nordique du dindon sauvage devrait être ralentie voire arrêtée au cours du prochain siècle ... 100
Effet additif de la chasse sur les conditions climatiques ... 101
Limites de l’étude ... 102
Contributions et perspectives futures ... 103
BIBLIOGRAPHIE ... 107 ANNEXE 1 ... 123 ANNEXE 2 ... 125 ANNEXE 3 ... 127 ANNEXE 4 ... 129 ANNEXE 5 ... 131 ANNEXE 6 ... 134 ANNEXE 7 ... 138 ANNEXE 8 ... 140
A SAFER NET PROPELLED DEVICE TO CAPTURE WILD TURKEY ... 141
Résumé ... 142
ABSTRACT ... 143
Introduction ... 144
STUDY AREA ... 144
MATERIAL AND METHODS ... 145
RESULTS ... 146
Device Efficiency ... 147
Animal Welfare ... 148
DISCUSSION ... 150
x
Liste des Tableaux
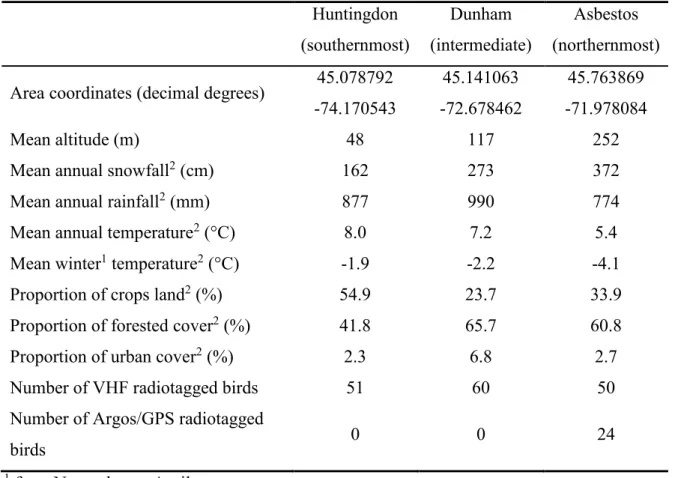
Table 2.1. Characteristics of three study areas representing a gradient of winter harshness
in southern Quebec, Canada. ... 21
Table 2.2. Demographic parameter estimates of wild turkey hens from three northern
populations located along a gradient of winter harshness. We evaluated winter and summer survival with Known Fates models and nest survival using Nest Survival models in MARK. We used generalized linear models for all other analysis. ... 26
Table 2.3. Survival models of wild turkey hens from three northern populations located
along a gradient of winter harshness. We located 181 hens from 2010 to 2013 in southern Quebec, Canada. Variables entering the models are: locality (p), month (m), snow depth (S), temperature (T), age (2a), reproductive status (N: first nesting attempt versus second nesting attempt, N1 [N2]: first [second] nesting attempt versus other reproductive status, N1,2: first and second nesting attempt versus other reproductive status), and rain
precipitation (R). The superscript 2 indicates a quadratic relationship. We incorporated a lag from 1 to 21 days between survival and snow depth or temperature in winter survival models and precipitation (c) in some nest survival models. Models with Δ AICc higher than 4 were not included in this table. ... 27
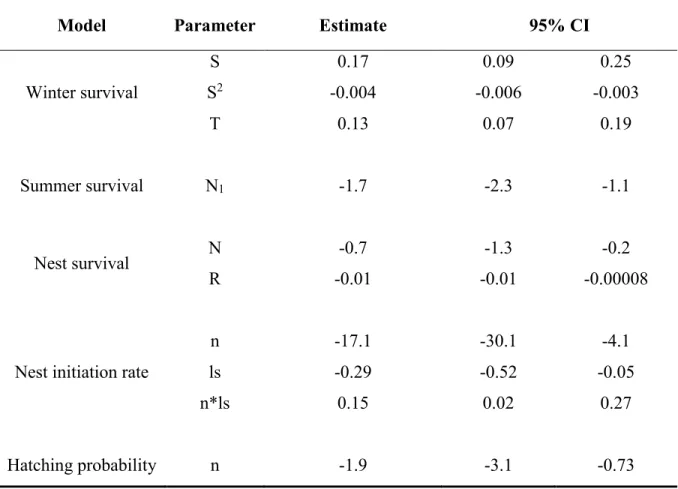
Table 2.4. Estimate with their 95% confidence intervals of parameters from retained
models. Parameters are: snow depth (S), temperature (T), reproductive status (N: first nesting attempt versus second nesting attempt, N1: first nesting attempt versus other reproductive status), rain precipitation (R), nesting attempt (n), and last day with snow on the ground (ls). The superscript 2 indicates a quadratic relationship. ... 29
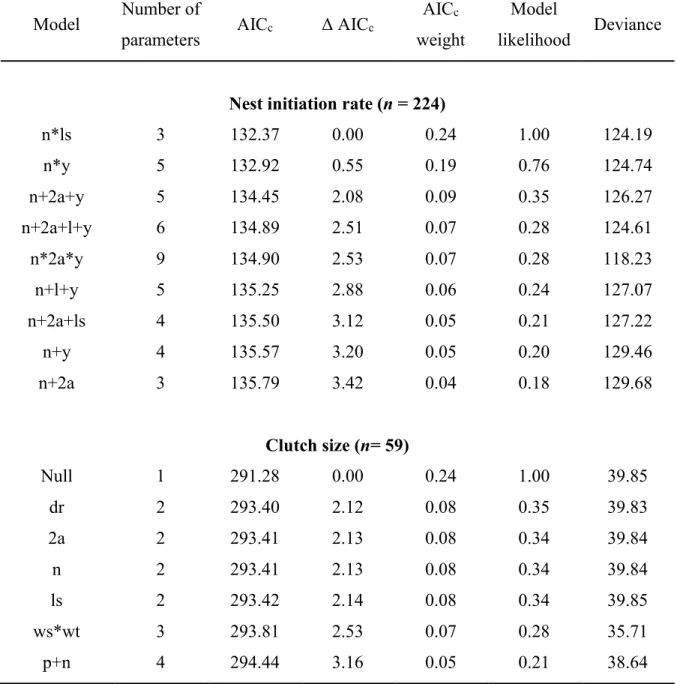
Table 2.5. Reproductive models of wild turkey hens from three northern populations
located along a gradient of winter harshness. We located 181 hens from 2010 to 2013 in southern Quebec, Canada. We evaluated nest initiation rate, hatching probability and clutch size using general linear models with a binomial distribution for the two former and a negative binomial distribution for the later. Variables entering the models are: locality (p), nesting attempt (n), year (y), age (2a), mean temperature from the previous winter (wt), mean snow accumulation from the previous winter (ws), last day with snow on the ground (ls), and mean daily precipitation during incubation (dr). Models with Δ AICc higher than 4 were not included in this table. ... 34
Table 3.1. Snow depth (S; cm), winter temperature (T; °C) and rain accumulation (R; mm)
threshold for the five climatic environments. We used historical data obtained from local government authority to create five climatic environments based on different percentile: extremely mild (S and R = 10%, T = 90%), mild (S and R = 25%, T = 75%), average (S, R and T= 50%), harsh (S and R = 75%, T = 25%), and extremely harsh (S and R = 90%, T = 10%). ... 55
Table 3.2. Deterministic population growth rate of wild turkeys from three northern
populations representing a gradient of climate harshness during various years and winter severity. ... 57
xi
Table 3.3. Age distribution (and life expectancy within brackets) or four reproductive
status stages and three northern populations of wild turkeys along a gradient of winter harshness. The four stages are: yearlings (Yf), adults that did not attempt to nest (F0), adults with one nesting attempt (F1), and adults with two nesting attempts (F2). ... 59
Table 4.1. Influence of climate severity on the population growth rate of wild turkeys using
a 5% harvest rate of males in spring for populations well established or at the expansion front for females, males, and population. We decided to use a 5% male-only spring harvest rate because it is the estimated rate in our study areas and the results are similar with rates up to 50% because males do not contribute to fertility. We evaluated the growth rate using a deterministic prospective analysis on three populations of wild turkey at the northern limit of its range. We used our five climate models, based on different percentile of snow, winter temperature and summer rain, to evaluate climate severity. 86
Table 4.2. Deterministic growth rates of male wild turkeys for populations at the expansion
front or well established for different percentages of fall and spring harvest. The results were evaluated under average summer conditions and A) extremely mild to average, B) harsh, and C) extremely harsh winter conditions using a deterministic prospective
xii
Liste des Figures
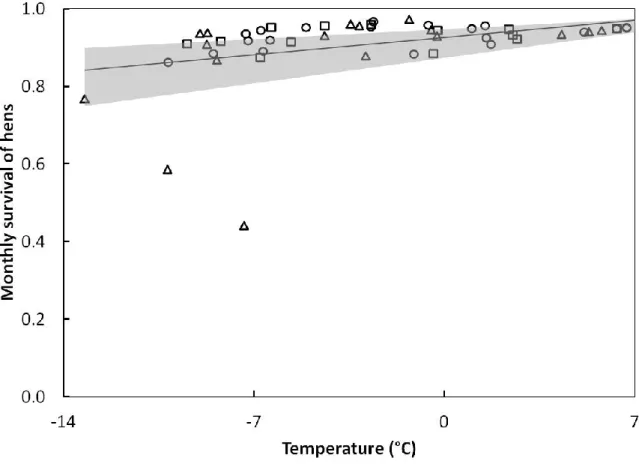
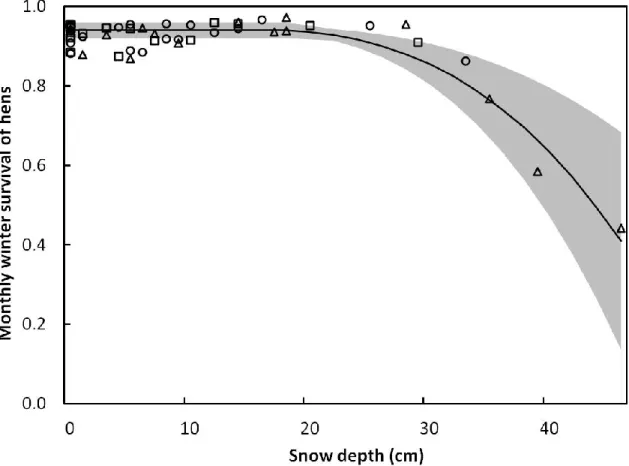
Figure 2.1. Increase in monthly winter survival with temperature for three northern
populations of female wild turkeys along a gradient of winter harshness. We located 181 hens from 2010 to 2013 in southern Quebec, Canada. The 95% confidence interval is shown in gray. We evaluated survival with Known Fates models in MARK (version 7.1). The original data set is shown for the southernmost (squares), intermediate (circles), and northernmost (triangles) areas. ... 30
Figure 2.2. Threshold effect of snow depth and temperature 14 days before the date used to
estimate monthly winter survival of female wild turkeys from three northern populations. We located 181 hens from 2010 to 2013 in southern Quebec, Canada. Three
temperatures are shown: -5 °C (dotted line), -15 °C (solid line and crosses), and -30 °C (hatched line). The 95% confidence interval of temperature -5 °C is shown in gray. We evaluated survival with Known Fates models in MARK (version 7.1) and estimated the snow depth breakpoint in winter survival, where the slope of the relation changes radically, using a piecewise regression. The original data set is shown for the
southernmost (squares), intermediate (circles), and northernmost (triangles) areas. ... 31
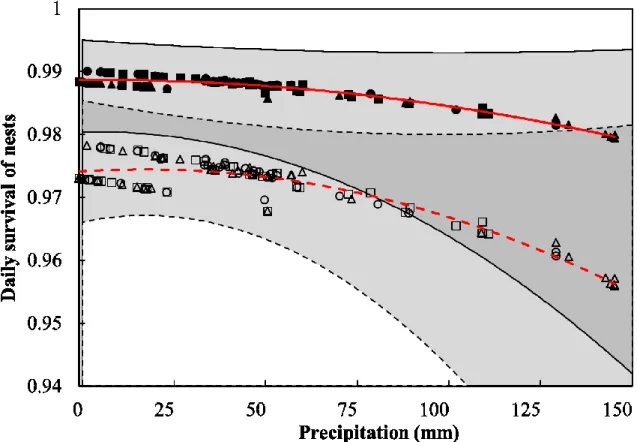
Figure 2.3. Decrease in the daily survival of first (hatched red line) or second (plain red
line) nesting attempt of female wild turkeys from three northern populations with
increasing cumulative precipitation over the previous 10 days. We located 181 hens from 2010 to 2013 in southern Quebec, Canada. The 95% confidence intervals of first (gray area bordered by hatched line) and second (gray area bordered by plain line) nesting attempts are shown. We evaluated survival using Nest Survival models in the program MARK (version 7.1). The original data set is shown for first (filled symbols) and second (unfilled symbols) nesting attempt in the southernmost (squares), intermediate (circles), and northernmost (triangles) areas. ... 33
Figure 2.4. Decreases in rates of first nesting attempt (open symbols and line) with
increasing persistence of spring snow cover of female wild turkeys from three northern populations: southernmost (squares), intermediate (circles), and northernmost (triangles). Second nesting attempt is represented by plain symbols. We located 181 hens from 2010 to 2013 in southern Quebec, Canada. The 95% confidence intervals of first nesting
attempts are shown in gray. ... 36
Figure 3.1. A) Periodic life cycle graph with 5 phases within the year. Filled circles
indicate transitions between stages. During the year (1) individuals survive during winter, (2) after mating, female either do or do not attempt a first nest, (3) Successful first nester produce poults and unsuccessful first nester do or do not attempt a second nest, (4) Successful second nester produce poults, (5) individuals survive during the summer and change stages. B) Annual life cycle model for the wild turkey. The four stages are yearlings (Yf), adults that did not attempt to nest (F0), adults with one nesting attempt (F1), and adults with two nesting attempts (F2). Each year, birds reproduce with the transition probability F, stay in the same stage with the probability S and change to another stage with the probability G. ... 47
xiii
Figure 3.2. Life cycle model of wild turkey from three populations representing a gradient
of climate harshness: southernmost (A), intermediate (B), and northernmost (C). The four stages are yearlings (Yf), adults that did not attempt to nest (F0), adults with one nesting attempt (F1), and adults with two nesting attempts (F2). Arrows represent the transitions that had the highest elasticities from the prospective (plain) and retrospective (hatched) analysis. The width of the arrow corresponds to the magnitude of the elasticity.58
Figure 3.3. Stochastic population growth rate of wild turkeys from three northern
populations representing a gradient of climate harshness for different proportions of years consider as extreme climatic events in winter (plain) and summer (hatch). The 95% confidence interval is shown in gray. ... 60
Figure 3.4. Mean smoothed probability to experience a year with extreme events for A)
snow accumulation, B) temperature, and C) rain from forecasts produced by 14 CMIP5 models forced using RCP4.5 (plain line) and 16 CMIP5 models forced using RCP8.5 (hatched line). For snow cover and temperature, each line represents a different month: January (blue), February (green), March (red), April (purple), November (yellow), and December (black). ... 62
Figure 3.5. Projections of the number of females over their initial number until 2100 for
three wild turkey populations along a gradient of climate harshness: southernmost (A), intermediate (B), and northernmost (C), produced by 14 CMIP5 models forced using RCP4.5 (A1, B1, C1) and 16 CMIP5 models forced using RCP8.5 (A2, B2, C2). The thick red line represents the median of respectively 1,400,000 (RCP4.5) and 1,600,000 (RCP8.5; 100,000 each model) stochastic projections based on snow, temperature and rain forecasts. The 95% confidence interval is shown in gray. The probability density function for simulated population size in 2100 is shown next to the graph. ... 64
Figure 4.1. A) Periodic life cycle graph for wild turkey with 7 phases within the year.
Filled circles indicate transitions between stages. During the year (1) individuals survive during winter, (2) males survive the spring hunting season, (3) after mating, females either do or do not attempt a first nest, (4) Successful first nesters produce poults and unsuccessful first nesters do or do not attempt a second nest, (5) Successful second nesters produce poults, (6) individuals survive during the summer and change stages, (7) individuals survive the fall hunting season. B) Annual life cycle model for a two sex model. The six stages are yearling females (Yf), adult females that did not attempt to nest (F0), adult females with one nesting attempt (F1), adult females with two nesting attempts (F2), yearling males (Ym), and adult males (M). Each year, birds reproduce with the probability F, stay in the same stage with the probability S and change to another stage with the probability G. ... 78
Figure 4.2. Proportion of the six stages in the stable population according to percentages of
male harvested in spring for populations at the expansion front (A) and well established (B) for wild turkeys located at the northern limit of their range. The six stages are: yearling female or male (plain line-same results), non-nesting females (dotted line), female attempting one nest (long hatched line), or two nests (short hatched line), and adult male (plain line with open squares). We evaluated the stable age distribution using
xiv
a deterministic prospective analysis on three populations of wild turkey at the northern limit of its range. ... 85
Figure 4.3. Elasticity for first (unfilled circles) and second (filled circles) nesting rates
according to summer survival of wild turkey poults in Quebec, Canada for individuals that were juveniles (plain lines) or adults with one nest (hatch lines) the year before. ... 89
Figure 4.4. Deterministic population growth rate of wild turkey according to the percentage
harvested in fall for a population in the A) establishment phase experiencing winter conditions 1) extremely mild to average, 2) harsh, or 3) extremely harsh and B) saturation phase. The growth rate is shown for five summer scenarios: extremely mild (plain line), mild (long hatched line), average (small hatched line), harsh (dotted line), and extremely harsh (plain line with open squares). We evaluated the growth rate using a deterministic prospective analysis on three populations of wild turkey at the northern limit of its range. ... 90
xv
Liste des Annexes
ANNEXE 1
Table A2.1. Survival models of wild turkey hens from three northern populations located
along a gradient of winter harshness ranked according to their AICc using a variance inflation factor of 4. We located 181 hens from 2010 to 2013 in southern Quebec,
Canada. Variables entering the models are: locality (p), snow depth (S), temperature (T), reproductive status (N: first nesting attempt versus second nesting attempt, N1(N2): first (second) nesting attempt versus other reproductive status, N1,2: first and second nesting attempt versus other reproductive status), and rain amount (R). The superscript 2 indicates a quadratic relationship. We incorporated a lag from 1 to 21 days between survival and snow depth or temperature in winter survival models and precipitation (c) in some nest survival models. Models with AICc weight lower than 0.05 were not included in this table. ... 124
ANNEXE 2
Figure A3.1. Population projection matrix A and contains the following demographic rates:
yearling survival (𝜎𝑠𝑐), winter survival(𝜎𝑤), survival on first (𝜎𝑠1) and second nesting attempt (𝜎𝑠2𝑏), summer hen survival of successful (𝜎𝑠1𝑠) and unsuccessful first (𝜎𝑠1𝑢) and second nesting attempt (𝜎𝑠2𝑠) (𝜎𝑠2𝑢𝑐), summer survival of non-nester (𝜎𝑠𝑛), first (𝛽1) and second nesting rate (𝛽2) and success (𝛾1) (𝛾2), and number of yearlings produced by first (𝜀1) and second nesting attempt (𝜀2). The superscript describes
yearling (J), a0 (adults that did not attempt to nest), a1 (adults with one nesting attempt), and a2 (adults with two nesting attempts). ... 126
ANNEXE 3
Table A3.1. Selected models from the fifth phase of the Coupled Model Intercomparison
Project produced by the Intergovernmental Panel on Climate Change used to estimate future climatic forecasts of snow cover, temperature and rainfalls to project wild turkey populations at the northern limit of their distribution, according to the radiative forcing: Representative Concentration Pathway 4.5 and 8.5. ... 128
ANNEXE 4
Table A3.2. Elasticity (prospective analysis) of and contribution (retrospective analysis) to
the population growth rate of wild turkeys from three northern populations representing a gradient of climate harshness to changes in the matrix entries of A (Supplementary Appendix S1). Four stages are included: yearlings (Yf), adults that did not attempt to nest (F0), adults with one nesting attempt (F1), and adults with two nesting attempts (F2). Each year, birds reproduce with the probability F, stay in the same stage with the probability S and change to another stage with the probability G. ... 130
xvi ANNEXE 5
Table A3.3. Elasticity (prospective analysis) of and contribution (retrospective analysis) to
the population growth rate of wild turkeys from three northern populations representing a gradient of climate harshness to changes in the following lower-level demographic parameters: yearling survival (𝝈𝒔𝒄), winter survival (𝝈𝒘), survival on first (𝝈𝒔𝟏) and second nesting attempt (𝝈𝒔𝟐𝒃), summer hen survival of successful (𝝈𝒔𝟏𝒔) and
unsuccessful first (𝝈𝒔𝟏𝒖) and second nesting attempt (𝝈𝒔𝟐𝒔) (𝝈𝒔𝟐𝒖𝒄), summer survival of non-nester (𝝈𝒔𝒏), first (𝜷𝟏) and second nesting rate (𝜷𝟐) and success (𝜸𝟏) (𝜸𝟐), and number of yearlings produced by first (𝜺𝟏) and second nesting attempt (𝜺𝟐). The
subscript in parenthesis describe the stage from the previous summer: Yf (yearling), F0 (adults that did not attempt to nest), F1 (adults with one nesting attempt), and F2 (adults with two nesting attempts). ... 132
ANNEXE 6
Figure A4.1. Population projection matrix A containing A) the life histories and B) the
demographic parameters. The upper left and lower right blocks of the matrix A describe respectively the production of females by females and males by males (adult male
survival and transition from yearling to adult). Value of the lower left block represent the production of males by females. Finally, the upper right block corresponds to the
production of females by males. The demographic parameters are: yearling survival (𝜎𝑠𝑐), winter survival(𝜎𝑤), survival on first (𝜎𝑠1) and second nesting attempt (𝜎𝑠2𝑏), summer hen survival of successful (𝜎𝑠1𝑠) and unsuccessful first (𝜎𝑠1𝑢) and second nesting attempt (𝜎𝑠2𝑠) (𝜎𝑠2𝑢𝑐), summer survival of non-nester (𝜎𝑠𝑛), first (𝛽1) and second nesting rate (𝛽2) and success (𝛾1) (𝛾2), number of yearlings produced by first (𝜀1) and second nesting attempt (𝜀2), and spring (Sh) and fall (Fh) hunting survival. The superscript describes yearling females (cf) and males (cm), a0 (adult females that did not attempt to nest), a1 (adult females with one nesting attempt), a2 (adult females with two nesting attempts), and adult males (M). ... 137
ANNEXE 7
Table A4.1. Elasticity of the population growth rate of wild turkeys from three northern
populations representing a gradient of climate harshness to changes in the following lower-level demographic parameters: male and female yearling survival (𝝈𝒔𝒄), winter survival (𝝈𝒘), survival on first (𝝈𝒔𝟏) and second nesting attempt (𝝈𝒔𝟐𝒃), summer hen survival of successful (𝝈𝒔𝟏𝒔) and unsuccessful first (𝝈𝒔𝟏𝒖) and second nesting attempt (𝝈𝒔𝟐𝒔) (𝝈𝒔𝟐𝒖𝒄), summer survival of non-nester (𝝈𝒔𝒏), first (𝜷𝟏) and second nesting rate (𝜷𝟐) and success (𝜸𝟏) (𝜸𝟐), fall (𝝈𝒇𝒉) and spring (𝝈𝒔𝒉) hunting survival, and number of male and female yearlings produced by first (𝜺𝟏) and second nesting attempt (𝜺𝟐). The six stages from the previous summer are: yearling females (Yf), yearling males (Ym), adult females that did not attempt to nest (F0), adult females with one nesting attempt (F1), adult females with two nesting attempts (F2), and adult males (M). We
xvii
evaluated the growth rate using a deterministic prospective analysis on three population of wild turkey at the northern limit of its range. ... 139
ANNEXE 8
A Safer Net Propelled Device to Capture Wild Turkey………….……….……141
Table S6.1. Comparison of capture efficiency and characteristics of wild turkeys captured
with a rocket-net and a net blaster. These data are based on capture of 344 wild turkeys using a rocket net (n = 30) and a net blaster (n = 15) during 2009–2012 in southern Quebec, Canada. ... 147
Table S6.2. Rates of injuries and survival of wild turkeys captured with a rocket-net and a
net blaster. These data are based on capture of 344 wild turkeys using a rocket net (n = 30) and a net blaster (n = 15) during 2009–2012 in southern Quebec, Canada. ... 149
xviii
“Anyone who thinks sky’s the limit, has limited imagination”
Anonymous
xix
Remerciements
Un projet de doctorat est bien plus qu’un travail qu’on laisse au bureau lorsque l’on traverse le seuil de la porte de la maison, c’est un morceau de vie et les premières personnes impliquées sont celles que l’on côtoie quotidiennement, la famille. Je tiens donc premièrement à remercier ma femme et âme sœur Aurélie Renard. J’ai eu l’immense chance de travailler en ta compagnie pour toutes les étapes de ce projet. Tu étais présente lors de ces longues journées de terrains entre autres pour les captures hivernales sous des températures jusqu’à « – frette » °C, pour caractériser l’habitat en compagnie de milliers de frappes à bords, lors de mes sautes d’humeur (ou est-ce l’inverse??), lors de souper en tête à tête en pédalo au milieu du lac, de pêche en rivière, d’escalade du Pinacle, pour réaliser plusieurs rêves… Tu es l’une des rares personnes qui m’impressionnent jour après jour par ta passion, ta persévérance, ton talent, tes idées, ta gentillesse… Merci de m’avoir toujours appuyé et encouragé. Au milieu de mon doctorat, j’ai également rencontré deux merveilleuses personnes qui ont bouleversé ma vie : mes enfants Léo et Liloup. Vous m’avez déjà beaucoup appris dans des aspects que l’on ne peut voir à l’université, sur la vie et sur moi-même. Merci d’égayer mes journées, pour toutes vos questions, vos rires, vos yeux pétillants, votre joie! Chacun de vos sourires est gravé dans ma tête et mon cœur.
Au courant de la vie, il y a des rencontres qui t’amènent à prendre de nouveaux chemins inconnus, qui font éclater plusieurs conceptions ancrées et te forcent à te dépasser. L’une de ces rencontres a été avec mon mentor et ami Serge Larivière. Je souhaite à tout le monde de rencontrer une telle personne (quoiqu’il n’y en a pas deux comme lui!). Serge, depuis ma sortie du baccalauréat tu m’as conseillé, épaulé, orienté. Tu as également réussi à me transmettre ta passion pour la recherche, la nature, les plaisirs de la vie. Tu as su comment être présent pour moi tout au long de ces années, jamais oppressant, mais toujours disponible dans les moments opportuns. Merci pour tes conseils, tes connaissances, tes party des bénévoles avec Nancy et les enfants qui égayaient la soirée, tes diners et toutes tes activités plein air!
xx
Au courant des dernières années, j’ai eu l’immense chance de rencontrer une autre personne de ce type : mon ange gardien Claude Daigle. Claude est apparu à des moments charnières de ma vie. À la fin de ma maîtrise il m’a ouvert les portes pour le projet Calway puis lorsque ce contrat se terminait a récidivé avec ce doctorat. Merci, Claude, pour ton écoute, tes conseils, ta rigueur, ton esprit scientifique, ta planification exemplaire pour les travaux de terrain. Tu as été l’élément liguant dans ce projet. Merci d’être toujours présent même après avoir pris ta retraite.
Deux autres personnes essentielles à ce projet sont l’instigateur et mon codirecteur Pierre Blanchette ainsi que mon directeur Jean-Pierre Tremblay. Pierre s’est impliqué d’une façon plus qu’espérée dans chaque facette de ce doctorat. Merci, Pierre, d’avoir cru en moi, d’avoir trouvé des solutions à chacun des problèmes et embûches survenus au courant des dernières années, pour tes compétences, ton expertise, ton expérience et tes réponses toujours très rapides. Merci de m’avoir supporté et encouragé durant toutes ces années. Jean-Pierre m’a accueilli dans son laboratoire tout en m’épaulant tout le long de mon doctorat. Merci, Jean-Pierre, de m’avoir fait développer le volet plus théorique et conceptuel, d’avoir eu confiance en me donnant l’opportunité de goûter à l’enseignement, de m’avoir fait de nombreux commentaires pour améliorer le projet et de m’avoir offert des sucreries lors des périodes de corrections!
J’ai également eu l’immense chance de rencontrer une très grande chercheure qui m’a accueilli dans son laboratoire et dans sa famille lors de mon stage doctoral malgré un emploi du temps très chargé : Stéphanie Jenouvrier. Merci, Stéphanie, pour tout le temps que tu m’as donné pour m’apprendre de nouvelles techniques d’analyse. Sans toi je n’aurais jamais pu mener ce projet aussi loin. J’ai adoré ta façon d’enseigner, ta passion pour la biologie et les mathématiques, ton enthousiasme inébranlable, ton expertise et ton amitié qui nous est très précieuse.
Je tiens à remercier mon comité d’encadrement : Dr Gilles Gauthier, Dr Gwénaël Beauplet et Dr Steeve Côté. Merci pour vos commentaires et suggestions pour réorienter mon projet.
xxi
Un merci spécial à Gilles pour m’avoir appris à analyser les données de dynamiques de populations. Je remercie également Dre Karen Hodges pour avoir accepté de faire partie de mon comité d’évaluation. Un immense merci à mes superviseurs en entreprise Alain Cossette et Pascal Alarie qui m’ont supporté depuis le tout début du projet.
Ce projet a nécessité de nombreuses heures-jours-mois-années de terrain qui n’aurait été possible sans l’aide de nombreuses personnes et principalement de mon Dream Team : Bruno Baillargeon, Philippe Beaupré, Claude Daigle, François Landry et Aurélie Renard. Merci à vous pour toutes ces heures à attendre dans le froid, votre ingéniosité à résoudre tous ces petits et grands problèmes, vos connaissances complémentaires, votre amitié lorsque la journée était terminée. Merci également à tous les autres ayant participé au terrain : Florent Archambeault, Stéphanie Cholette, Dominic Grenier, Daniel Guérin, René Houle, Florent Lemieux, Sophie Plante, Catherine Poussart, Daniel St-Hilaire, Gilles Sauvestre, Sarah Sherman-Quirion, Émilie Vidal et les nombreux autres volontaires et étudiants.
J’ai également eu la chance (j’ai longuement hésité à l’utilisation de ce mot et j’ai toujours un doute…) de côtoyer un statisticien (ou mathématicien, c’est du pareil au même!) : Florian Patout. Merci, Florian, pour tes explications sur des concepts qui étaient loin de mon domaine, tu réussissais à rendre le tout concret, mais aussi pour le divertissement et les rires que tu m’as apportés lors de mon stage doctoral. Je remercie également Solène Sacre qui était présente à la même période, a participé à ces moments, mais surtout m’a aidé à supporter le tout. Merci à Michael Polito pour tes idées et discussions concernant le projet. Je remercie les membres du laboratoire JP/Steeve qui m’ont influencé de près ou de loin.
Ce projet n’aurait pu se concrétiser sans la participation financière de plusieurs organismes : ministère des Forêts, de la Faune et des Parcs, Fédération québécoise des chasseurs et des pêcheurs, Fondation Héritage Faune, CRÉ Montérégie Est, CRÉ Vallée-du-Haut-Saint-Laurent, Fonds de recherche sur la nature et les technologies (FQRNT), Natural Sciences
xxii
and Engineering Research Council of Canada (NSERC), Université Laval et Centre d’études nordiques.
Je remercie spécialement la gang à Henderson : Pierre-Alexandre "l’amiral de la clé" Archer, Mathieu "Thermostat" Blanchette, Luc-Antoine "Scrotman/Uort" Boivin, Tommy "Major" Byrne, Vincent "le glisseur" Fortin, Charles "toujours prêt" Francoeur, David "Shotz" Garcia-Labbé, Christopher "le Boss" Guilbault-McHarg, Frédéric "Mac" Henderson, Nadim "Batman" Hourani, Jean-François "Fondateur du Pure Ga-xx-ess" Shields, Alexia "Sleepy" Tardif, Martin "Z-man" Zérounian. Je me souviendrai de toutes ces conversations où vous m’avez écouté et compris l’essence de mon travail comme :
- GH : " Tu fais quoi encore Max? ";
- Moi : " Je cherche à voir si le climat a un effet sur la survie et la reproduction du dindon sauvage";
- GH : " Aahhh c’est vrai tu travailles sur le dindon. C’est tu assez laid! Ça goûte-tu bon??"
Finalement, mais non le moindre, je remercie mes parents Lise Brind’Amour et Sylvain Lavoie pour votre support et vos encouragements inconditionnels qui m’ont aidé à aller jusqu’au bout. Merci également à mes beaux-parents : Béatrice et Michel Renard pour votre précieuse aide et votre considération. Je remercie mes familles québécoise, française et chilienne pour votre omniprésence malgré la distance ainsi qu’à mes grands-parents qui « s’accrochent toujours au cocotier » Anne-Marie "Mamie" et René "Pépé" Talleux, qui me rendent encore plus fier de cet accomplissement et dont je retiendrai plusieurs dictons tels que : « Il faut être raisonnablement pessimiste, mais obstinément optimiste ».
xxiii
Avant-propos
Cette thèse examine les liens entre les paramètres démographiques et les changements climatiques des espèces en expansion. Elle comprend cinq chapitres : deux chapitres rédigés en français, soit une introduction générale et une conclusion et trois chapitres rédigés en anglais sous forme d’articles scientifiques. Je suis l’auteur principal de tous les chapitres, ma contribution est majeure et j’ai travaillé à toutes les étapes de leur réalisation. Pour chacun des chapitres, j’ai effectué la revue de littérature, la planification des projets de recherche, l’acquisition des données de terrains, l’analyse et l’interprétation des données ainsi que la rédaction des articles.
Le premier chapitre de la thèse est une introduction de la théorie liée au projet de recherche. Il constitue en une revue de littérature sur l’effet des changements climatiques sur les populations, la dynamique des populations en expansion, l’impact de la chasse et certains concepts sur la biologie et la gestion du dindon sauvage. Ce chapitre inclut également les objectifs de la thèse, les populations étudiées et l’approche conceptuelle, méthodologique et analytique. Les chapitres 2 à 4 constituent le centre de la thèse qui se divise en trois parties suivant l’approche MUP. La première partie s’intéresse à l’évaluation des paramètres démographiques de trois populations de dindons sauvages suivant un gradient des conditions climatiques et situées à la limite nord de leur répartition. C’est un article rédigé en collaboration avec le Dr Pierre Blanchette, codirecteur de la thèse et chercheur au Ministère des Forêts, de la Faune et des Parcs, Dr Serge Larivière, codirecteur de la thèse et directeur général à Office de la Sécurité du Revenu des Chasseurs et Piégeurs Cris et Dr Jean-Pierre Tremblay, directeur de la thèse et professeur au département de biologie de l’Université Laval. Ces trois chercheurs ont commenté et révisé tous les chapitres de cette thèse. Le chapitre 2, intitulé « Snow depth, winter temperature and summer rain modulate demographic parameters of wild turkey at the northern edge of the species distribution », démontre que les conditions météorologiques hivernales (accumulation de neige au sol et température) et estivales (pluie) modulent la survie et la productivité des dindons. Cet article sera prochainement soumis à The Auk.
xxiv
La seconde partie de la thèse cherche à comprendre l’influence du climat sur la dynamique des populations de dindons sauvages. Le chapitre 3 intitulé « Extreme climate events limit range expansion of wild turkeys » a été écrit en collaboration avec la Dre Stéphanie Jenouvrier, chercheure au département de biologie de Woods Hole Oceanographic Institution et du Centre d’Études Biologiques de Chizé, du Dr Pierre Blanchette, du Dr Serge Larivière et du Dr Jean-Pierre Tremblay. Cet article montre que l’expansion nordique du dindon sauvage est limitée par la fréquence des conditions climatiques extrêmes et supporte les hypothèses de la théorie classique des invasions biologiques. Il projette également l’état des trois populations de dindons sauvages entre 2006 et 2100. Il sera prochainement soumis à Nature Climate Change.
La troisième partie de cette thèse projette les populations de dindons sauvages face aux changements climatiques futures et évalue l’effet de différents scénarios de chasse. Cette section se retrouve dans le chapitre 3 et 4. Le chapitre 4 s’intitule « Wildlife management and climate change: how to adapt harvest rates of expanding wild turkey according to climate and extreme weather events » et a été rédigé en collaboration avec la Dr. Stéphanie Jenouvrier, le Dr Pierre Blanchette, le Dr Serge Larivière et le Dr Jean-Pierre Tremblay. Cet article évalue l’interaction entre le climat, le statut des populations et le niveau de récolte et démontre que la chasse automnale au dindon sauvage est le facteur ayant l’impact potentiel sur le taux de croissance le plus élevé. Il sera soumis prochainement à Journal of Applied
Ecology. Un dernier article situé en annexe intitulé « A safer net propelled device to capture
wild turkeys » a été écrit en collaboration avec le Dr Pierre Blanchette, le Dr Serge Larivière et le Dr Jean-Pierre Tremblay. Il a été publié en 2014 dans la revue Wildlife Society Bulletin et compare l’efficacité d’un nouvel engin de capture par rapport à celui employé traditionnellement pour capturer des dindons sauvages. Finalement, le cinquième et dernier chapitre de cette thèse résume les principales conclusions et contributions de ce projet, les limites de l’étude et les perspectives de recherche.
1
Chapitre 1
2
Récemment, des changements majeurs du climat sont survenus et pourraient s’intensifier dans le futur (IPCC 2013). Les réponses des espèces à ces changements climatiques modifient la dynamique de leurs populations en changeant, entre autres, leur répartition spatiale (Parmesan et al. 2000, Walther et al. 2002). Afin de développer des stratégies de conservation efficaces, des études visant à comprendre l’impact des changements climatiques sur les populations et à projeter leur évolution face aux conditions climatiques futures sont essentielles (Jenouvrier 2013). Pour répondre à ces questions, l’utilisation de populations à la limite de leur répartition est particulièrement appropriée. En effet, étant à la limite de la tolérance climatique de l’espèce, ces populations sont plus sensibles aux variations de leur environnement (Sunday et al. 2012), facilitant ainsi l’évaluation des conséquences des changements climatiques. De plus, plusieurs de ces populations augmentent leur répartition en colonisant de nouveaux habitats jusqu’alors inexploités (Root et al. 2003, Chen et al. 2011), ce qui donne l’opportunité d’intégrer l’impact du stade d’invasion dans les analyses de dynamique des populations. En effet, selon la théorie classique des invasions biologiques, ces populations en expansion suivent généralement trois phases différentes qui favorisent différentes stratégies d’histoire de vie, se distinguent par leurs paramètres biodémographiques et réagissent différemment aux facteurs limitants ainsi qu’aux conditions environnementales (Sol et al. 2012). Par contre, comme une augmentation des évènements extrêmes est prévue au courant des prochaines années (Rahmstorf et Coumou 2011, Huntingford et al. 2013), ces expansions pourraient être retardées, voire même inversées (Walther et al. 2002, Diffenbaugh et al. 2005), rendant la compréhension des mécanismes régissant leur dynamique d’autant plus essentielle (Bailey et Van de Pol 2015).
CHANGEMENTS CLIMATIQUES
Au courant du dernier siècle, la température moyenne de la Terre a augmenté de 0,74 °C et le rythme des changements climatiques a doublé au cours des 25 dernières années (IPCC 2013). Ce réchauffement global a été plus élevé durant la saison froide ce qui a diminué les différences climatiques saisonnières, principalement dans les milieux tempérés (IPCC 2013). Par exemple, au Canada, cela a engendré une diminution du couvert de neige
3
de 10 % depuis 1966 ainsi qu’une augmentation de la température hivernale de 1.9 °C (Brown et Braaten 1998, Environnement Canada 2011). De plus, cette variabilité inter-saisonnière devrait continuer à diminuer de même que la fréquence des précipitations sous forme de neige (Krasting et al. 2013). Par contre, dû à l’augmentation du taux d’humidité atmosphérique causée par une évaporation accrue, la quantité de neige tombée par tempête sera plus importante (Chaumond et Brown 2010). La même tendance est également prévue pour la pluie (Hansen et al. 2011). Face à ces changements, les populations animales peuvent réagir de différentes façons et il s’avère essentiel de comprendre et d’analyser leurs réponses afin de limiter les effets négatifs de ces populations sur les espèces indigènes et/ou d’assurer leur pérennité.
Réponses des populations
Le réchauffement climatique peut être bénéfique pour les populations d’espèces situées à la limite de leur aire de répartition. Ces espèces sont généralement plus sensibles à l’amélioration des conditions vers les pôles et plus résistantes à l’augmentation des contraintes vers l’équateur (Sunday et al. 2012), engendrant une augmentation globale de leur répartition et de leur abondance (Parmesan et al. 1999). De plus, la rapidité des changements climatiques entrainerait un déplacement moyen de l’aire de répartition vers les pôles et en altitude de 17 km par décennie pour plus de 1300 espèces (Chen et al. 2011). Par exemple, une étude effectuée dans l’ouest de l’Amérique du Nord sur 40 espèces d’oiseaux chanteurs a démontré une augmentation de l’aire de répartition nordique au cours des 35 dernières années chez toutes ces espèces, qui concordait avec le réchauffement de la température estivale (Auer et King 2014). Ce changement de répartition est global, interspécifique et a été remarqué chez les mammifères (Lavoie et al. 2009, McCain et King 2014), l’herpétofaune (Raxworthy et al. 2008), les poissons (Alofs et al. 2014), les insectes (Ploquin et al. 2014) et les plantes (Telwala et al. 2013).
Les évènements extrêmes ainsi que la variabilité dans les conditions environnementales influencent le fitness individuel, la dynamique des populations et même la structure des communautés (Moreno et Møller 2011, Jenouvrier et al. 2013, Ballerini et al. 2015). Par
4
exemple, au cours des 30 dernières années, les tempêtes de neige extrêmes durant la période d’incubation ont eu des effets négatifs sur la nidification et la survie des poussins chez le pétrel antarctique (Thalassoica antarctica; Descamps et al. 2015). Similairement, les épisodes extrêmes de pluie sur la neige en Arctique diminuaient le taux de croissance des populations de caribou (Rangifer tarandus; Hansen et al 2011). Par contre, comme les évènements extrêmes sont par définition peu fréquents, peu d’études ont évalué leurs impacts sur la faune même si le réchauffement climatique a engendré une augmentation locale de leur fréquence (Huntingford et al. 2013, Rahmstorf et Coumou 2011). Toutefois, certaines études ont remarqué que la limite de l’aire de répartition d’une espèce est généralement mieux prédite par la fréquence des évènements extrêmes que par les changements climatiques moyens (Bateman et al. 2012). En effet, les populations à la limite de la répartition de l’espèce sont très sensibles aux variations dans leur environnement (Parmesan et al. 2000). Par conséquent, même si les conditions climatiques moyennes s’améliorent pour ces espèces, l’augmentation de la fréquence des événements extrêmes peut engendrer des extinctions locales. Par exemple, suite à une vague de chaleur inhabituelle, la limite nordique de l’algue Scytothalia dorycarpa s’est rétractée d’environ 100 km et son retour est peu probable considérant les caractéristiques biologiques de l’algue (Smale et Wernberg 2013). De façon similaire, malgré une amélioration des conditions environnementales moyennes pour le cormoran huppé (Phalacrocorax
aristotelis), une augmentation des évènements extrêmes hivernaux a augmenté sa
probabilité d’extinction puisque son plumage partiellement imperméable ne pouvait pas le protéger de ces conditions hivernales (Frederiksen et al. 2008). Finalement, la limite nordique de la chenille burcicole (Thyridopteryx ephemeraeformis) était restreinte par la température hivernale lorsqu’elle chute sous la température limite physiologique des œufs lors d’évènements extrêmes (Lynch et al. 2014). Comme la fréquence de ces évènements extrêmes est prévue à la hausse (Smith 2011), il est essentiel d’évaluer leurs effets sur les paramètres démographiques.
5
Variations des paramètres démographiques
Les populations à la limite de l’aire de répartition d’une espèce se situent également à la limite de la tolérance environnementale (Parmesan et al. 2000). Par conséquent, une légère modification dans les conditions environnementales peut engendrer des réponses importantes des populations, causées par des variations dans un ou plusieurs paramètres démographiques. Ces populations sont souvent limitées par la survie durant la saison la plus froide (Zub et al. 2011, Janke et al. 2015). Par exemple, une variation de la température hivernale a causé une diminution de 38 % du taux de survie des mâles tétras lyre (Tetrao tetrix), menaçant la persistance à long terme de cette population en Angleterre (Warren et al. 2013). Au Colorado, le taux de croissance d’une population de lagopède à queue blanche (Lagopus leucura) variait en fonction de la survie des femelles qui fluctuait selon les précipitations hivernales (Wann et al. 2014). De plus, chez les populations d’oiseaux, les précipitations estivales peuvent devenir un facteur limitant en affectant la survie des poussins. En effet, au courant des premières semaines de vie des oiseaux, avant le développement d’un plumage thermo-protecteur (Roberts and Porter 1998) et l’acquisition de l’endothermie (Dégletagne et al. 2013), les poussins sont plus vulnérables à la mortalité provoquée par le climat. Cela a été observé en Antarctique au courant d’un été particulièrement pluvieux, où près de la moitié des poussins manchots Adélie (Pygoscelis
adeliae) d’une colonie sont morts dus à la diminution de leur thermorégulation
(Ropert-Coudert et al. 2015). Il s’avère donc essentiel d’évaluer l’effet de plusieurs variables climatiques sur l’ensemble du cycle de vie (van Oudenhove et al. 2014) afin de bien comprendre les mécanismes affectant la dynamique des populations.
POPULATIONS EN EXPANSION
Les conséquences des changements climatiques sont plus importantes pour les populations d’espèces méridionales en expansion vers les pôles. En effet, ces populations en périphérie de leur aire de répartition présentent souvent de faibles densités et de légères variations dans les conditions environnementales peuvent être catastrophiques (Parmesan et al. 2000). Les paramètres démographiques ainsi que les traits d’histoire de vie favorisés varieront donc selon différentes phases. En effet, les espèces en expansion passent généralement par
6
trois phases : la phase d’établissement (aussi appelée phase de décalage), la phase d’expansion (aussi appelée phase d’augmentation) et la phase de saturation (Arim et al. 2006). La première étape d’expansion (phase d’établissement) est la colonisation d’un nouvel habitat. Lorsque l’espèce est bien établie et que son taux de croissance ne subit plus d’effet positif dépendant de la densité (effet d’Allee), elle connait une croissance exponentielle et entre dans la phase d’expansion. Finalement, la population atteint la capacité de support du milieu (phase de saturation) et se stabilise (Loughry et al. 2013). Le taux de croissance ainsi que l’importance des paramètres démographiques varient entre ces trois phases. Durant la phase d’établissement, la densité de la population est faible et la population demeure relativement stable. Selon la théorie classique des invasions biologiques, les individus ont une espérance de vie moindre et les paramètres de reproduction sont élevés (Sol et al. 2012). Lors de la phase d’expansion, les paramètres reproducteurs demeurent élevés, l’espérance de vie est légèrement augmentée et le taux de croissance augmente pouvant même être exponentiel (Sol et al. 2012). Finalement, lors de la phase de saturation, des mécanismes régulateurs dépendants de la densité deviennent plus importants (Arim et al. 2006), le taux de croissance diminue (Neubert et Caswell 2000) et les stratégies d’histoires de vie favorisent la survie des adultes par rapport aux paramètres reproducteurs (Loughry et al. 2013). Par contre, il existe peu de support empirique à cette théorie et un consensus n’a pas été atteint (Sol et al. 2012). La connaissance de ce processus est primordiale pour les gestionnaires afin d’adapter leurs décisions à l’arrivée d’une nouvelle espèce.
ESPÈCES CHASSÉES
La chasse a depuis toujours été une activité très importante d’un point de vue d’alimentation, médicinale, spirituelle, commerciale, d’élevage, de contrôle de déprédation ou récréatif (Fernandes-Ferreira et al. 2012). Par contre, ce n’est que récemment que celle-ci est devenue un outil de gestion (Decker et Connelly 1990). En effet, la chasse est souvent le principal outil utilisé par les gestionnaires pour maintenir les populations animales à des abondances suffisamment faibles pour ne pas être une nuisance, mais suffisamment élevé pour satisfaire les demandes récréatives (Woolf et Roseberry 1998). Chez les espèces
7
polygames, la dynamique des populations est principalement déterminée par le taux de reproduction et de survie des femelles (Giles et Findlay 2004). Par conséquent, la chasse peut être utilisée pour quatre fins de gestion : 1) interdire complètement la chasse pour restaurer les populations de faible densité, 2) permettre la chasse aux mâles seulement afin de protéger les femelles pour restaurer les populations tout en offrant des opportunités de chasse récréative, 3) permettre la chasse de tous les individus pour diminuer le taux de croissance ou stabiliser la population et 4) permettre la chasse de tous les individus pour réduire l’abondance de la population (Brown et al. 2000). Par contre, la nature dynamique des écosystèmes et les incertitudes environnementales (Packer et al. 2009) rendent le succès de cet outil de gestion variable et un suivi des populations est essentiel pour permettre aux gestionnaires d’adapter la gestion (Bunnefeld et al. 2011). De plus, la gestion des espèces chassées est spécialement délicate pour les populations en expansion, étant déjà sensibles à de faibles variations de leurs paramètres démographiques. Au Canada, le dindon sauvage est une espèce en expansion qui cadre bien dans cette problématique.
ÉCOLOGIE ET GESTION DU DINDON SAUVAGE
La densité de dindons sauvages en Amérique du Nord à l’époque précolombienne a été estimée à environ 10 millions d’individus (Schorger 1966). Les populations de dindons sauvages ont ensuite décliné avec le développement de la colonisation et la chasse excessive (Dickson 1992), ces animaux constituant une source de nourriture importante pour les colons. Les populations de dindons ont atteint leurs niveaux historiques les plus bas vers la fin du 19e siècle, ne survivant que dans les régions les plus inaccessibles. Par conséquent, des mesures de protection furent prises et permirent de freiner le déclin. Après la Deuxième Guerre mondiale, des programmes actifs de réintroduction et des efforts de recherche ont été mis en place. Des populations viables de dindons sauvages ont ainsi été reconstituées dans plusieurs régions des États-Unis et ces populations nouvellement rétablies ont été protégées légalement. En 1991, la chasse printanière a été ouverte pour la première fois dans chacun des 49 états ayant une population de dindons sauvages. Depuis, la chasse printanière est également autorisée au Mexique ainsi que dans certaines provinces canadiennes (Schorger 1966, Dickson 1992).
8
Le dindon sauvage a un potentiel d’accroissement de population très élevé. En effet, la taille des couvées varie généralement entre 10 et 12 œufs et le succès d’éclosion est fréquemment supérieur à 80 % (Glidden et Austin 1975, Everett et al. 1980, Little et Varland 1981). En cas d’échec d’une première tentative de nidification, les femelles peuvent essayer une seconde nidification. Le pourcentage de femelles effectuant une tentative de première nidification se situe généralement entre 75 et 100 % (Porter et al. 1983, Lockwood et Sutcliffe 1985, Vangilder et al. 1987, Vander Haegen et al. 1988, Vangilder et Kurzejeski 1995) et son succès varie grandement entre les années ainsi qu’entre les études allant de 39 à 83 % (Dickson 1992). Par conséquent, cette espèce possède un taux potentiel d’accroissement annuel élevé. De plus, les femelles peuvent se reproduire dès leur deuxième été. Ces caractéristiques ont probablement largement contribué à l’augmentation aussi bien en nombre qu’en répartition de cette espèce au courant des dernières années.
La présence historique du dindon sauvage au Québec est ambiguë. En effet, bien qu’un officier britannique, Fredecic Tolfrey, mentionne sa présence dans le Bas-Canada au 19e siècle (Tolfrey 1845) plusieurs instances le considèrent absent à l’arrivée des premiers colons européens (Mosby et Handley 1943, Schorger 1966). Par contre, cette espèce était définitivement absente au début du 20e siècle et les premiers individus ont été observés vers la fin des années 1970 (Yank et Aubry 1985). Depuis ce temps, la répartition de cette espèce n’a cessé de s’accroitre et il est désormais fréquent de l’observer dans certaines régions du sud du Québec (Rioux 2003). À partir de 2003, plusieurs relâchers ont été effectués dans l’ouest de la province, en Outaouais et sur la rive nord du fleuve St-Laurent. Par contre, ceux-ci ont été interdits au sud du St-Laurent et, malgré quelques relâchers illégaux dans cette région, on considère que les populations n’en n’ont pas été affectées. Par conséquent, les populations au sud du St-Laurent sont arrivées naturellement des États-Unis et leur dynamique suit celle d’une expansion naturelle. Ailleurs en Amérique, cette espèce est particulièrement sensible aux conditions climatiques, spécialement en hiver (Austin et DeGraff 1975, Porter et al. 1983). L’épaisseur de neige semble être le principal facteur limitant les populations de dindons, restreignant l’accès à ses ressources alimentaires, constituées essentiellement de graines de plusieurs espèces végétales (Porter et al. 1980,
9
Wright et al. 1996, Whissell 2002). La rigueur de l’hiver pourrait aussi affecter la condition physique et mener à une diminution de la productivité (Porter et al. 1983).
La prédation peut aussi être une source de mortalité importante, principalement en période de nidification (Miller et al. 1998, Vander Haegen et al. 1988) et d’élevage des jeunes (Palmer et al. 1993). En effet, lors de l’incubation, les femelles passent la grande majorité de leur temps au sol, ne quittant le nid que pour s’alimenter (Green 1982), puis demeurent au sol avec les poussins jusqu’à ce que ceux-ci puissent se percher vers l’âge de deux semaines (Barwick et al. 1970). La période de nidification est donc une période critique pour la survie des femelles dindons principalement pour les juvéniles qui ont un taux de mortalité plus élevé que les adultes (Vander Haegen et a1. 1988). La dispersion des individus entre leur habitat hivernal et celui de nidification est aussi une période où le risque de mortalité par prédation augmente. En effet, les dindons quittent leur groupe hivernal qui leur permettait une meilleure détection des prédateurs (Vander Haegen et al. 1989) et s’isolent des autres après la période d’accouplement. Durant la dispersion, les animaux parcourent de grandes distances de même que des territoires inconnus, augmentant ainsi la probabilité de rencontre de prédateurs (Aars et al. 1999, Yoder et al. 2004). Dans l’Iowa, le taux de mortalité augmentait avec la distance de dispersion des dindons (Hubbard
et al. 1999a). Par contre, les femelles survivant à la dispersion et ayant effectué un plus
grand nombre de déplacements avant la période de nidification visitaient ainsi une plus grande variété d’habitats et sélectionnaient de meilleurs sites de nidification, ce qui favorisait leurs succès de reproduction (Badyaev et al. 1996, Hubbard et al. 1999a).
Le dindon sauvage peut être récolté au courant de deux périodes distinctes soit au printemps et à l’automne. Au printemps, seule la chasse aux individus à barbe, qui sont majoritairement des mâles, est permise tandis qu’à l’automne, la chasse est permise pour tous les individus. La chasse automnale est économiquement moins importante, mais peut avoir un impact biologique plus sérieux et n’est permise que dans quelques régions où l’on retrouve des populations suffisamment abondantes. En effet, comme cette espèce est polygame, les mâles influent peu sur la dynamique de population, ne contribuant pas au taux de fertilité. La gestion du dindon sauvage se compare d’ailleurs à celle du cerf de
10
Virginie (Odocoileus virginianus). En effet, la gestion est basée sur la récolte des mâles pour les populations de faibles densités tandis que les femelles et les jeunes sont aussi récoltés lorsque l’on désire stabiliser ou réduire la densité des populations.
L’acquisition de connaissances sur la biologie des dindons sauvages à la limite nord de leur aire de répartition, particulièrement sur l’impact de la rigueur de l’hiver sur la dynamique de ces populations, s’avère donc primordial afin de développer ou d’adapter des indicateurs fiables dans le but de gérer cette espèce. Au cours des vingt dernières années, des études sur l’abondance et la répartition des dindons sauvages ont été réalisées au Québec (Robert 1988, Whissell 2002, Rioux 2003, Rioux et al. 2003, 2004, St-Hilaire 2007a, b). Cependant, l’écologie de cet animal et l’effet des conditions climatiques sur cet oiseau restent encore très peu connus à la limite nord de son aire de répartition.
OBJECTIFS ET STRUCTURE DE LA THÈSE
Cette thèse vise à comprendre l’impact des changements climatiques sur la dynamique des populations dans un contexte de populations situées à la limite nord de l’aire de répartition de l’espèce. Plus spécifiquement, la thèse tente d’établir des relations entre les paramètres démographiques et le climat pour ensuite comprendre et prédire les réponses des populations de dindons sauvages à divers scénarios de changement climatique et de récolte.
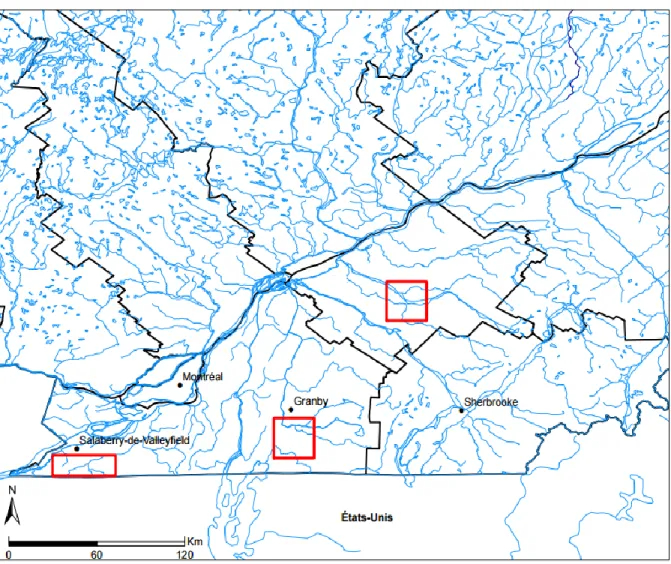
APPROCHE CONCEPTUELLE
L’étude s’est déroulée dans trois sites du sud du Québec (Figure 1.1). Ces sites présentaient un gradient de conditions climatiques hivernales (précipitations, accumulations de neige au sol, durée de l’enneigement et températures ; chapitre 2). Le secteur le plus au sud avait une proportion de terres agricoles plus élevée et une proportion de forêts plus faible tandis que le secteur intermédiaire possédait plus d’aires urbaines.
11
Cette thèse suit un cheminement logique et séquentiel qui respecte l’approche MUP ("Measuring-Understanding-Predicting"; Jenouvrier 2013) fournissant un cadre de travail permettant d’améliorer la compréhension des processus liant les populations et le climat pour projeter les réponses des populations aux futurs changements climatiques. Elle est donc divisée en trois chapitres :
1- Le première chapitre traite de l’évaluation des paramètres démographiques de trois populations de dindons sauvages suivant un gradient des conditions climatiques et situées à la limite nord de leur répartition (chapitre 2). Il vise à déterminer si certains taux vitaux des dindons sauvages sont liés au climat et à évaluer comment varient ces paramètres au courant du cycle de vie complet de cette espèce. Ce premier chapitre est une analyse démographique et évalue quantitativement les caractéristiques des populations.
2- Le deuxième chapitre traite de la compréhension de l’influence du climat sur la dynamique des populations de dindons sauvages (chapitre 3). Il vise à identifier comment la variabilité observée ou potentielle des paramètres démographiques, engendrée par différentes conditions climatiques, affecte le taux de croissance de la population. Il évalue également l’impact de diverses conditions climatiques sur le taux de croissance de la population. Ce chapitre analyse la dynamique des populations et tente de comprendre ce qui affecte la fluctuation dans le temps le taux de croissance des populations.
3- Le troisième chapitre traite de la projection des populations face aux changements climatiques futures et de l’évaluation de l’effet de différents scénarios de chasse. Il vise à projeter les populations de dindons sauvages jusqu’en 2100 selon 30 scénarios de changements climatiques provenant de 16 modèles globaux et deux forçages des émissions de gaz à effet de serre (chapitre 3). Ce projet évalue également l’effet d’une combinaison de 11 différents scénarios de chasse et de 10 conditions climatiques sur le taux de croissance des sections femelles et mâles ainsi que sur celui des populations (chapitre 4).