1
UNIVERSITE DE PICARDIE JULES VERNE
FACULTE DE MEDECINE D’AMIENS
Année 2017
Thèse n° 2017 – 130
THESE
Pour l’obtention du Diplôme d’Etat de Docteur en Médecine
Spécialité Santé Publique et Médecine Sociale
SURVIE DES SECONDS CANCERS PRIMITIFS
DE L’ŒSOPHAGE EN FRANCE EN FONCTION
DU TYPE HISTOLOGIQUE, ENTRE 1989 et 2010,
A PARTIR DE LA BASE DES REGISTRES DE
CANCER FRANCIM
Présentée et soutenue publiquement le 12 octobre 2017
Par Salah El Din ZERKLY
Devant un jury composé de :
Monsieur le Professeur Olivier GANRY, président du jury et directeur de thèse
Monsieur le Professeur Denis CHATELAIN
Monsieur le Professeur Eric NGUYEN-KHAC
Monsieur le Professeur Bruno CHAUFFERT
Madame le Docteur Catherine DOUTRELLOT
3 A Monsieur le Professeur Olivier GANRY, président du jury et directeur de thèse,
Professeur des Universités - Praticien Hospitalier (Epidémiologie, économie de la santé et Prévention)
Responsable du service d'Epidémiologie, hygiène hospitalière et santé publique Pôle "Biologie, pharmacie et santé des populations"
Je ne saurais comment vous remercier des belles conséquences de notre tout premier entretien il y a six années de cela, lorsque je m’intéressais à la Santé publique et souhaitais m’orienter au mieux. Depuis, je ne regrette pas ce choix, bien au contraire. Un grand merci également pour vos bons conseils prodigués tout au long de mon cursus ainsi que pour les semestres passés chez vous et le bon état d’esprit qui y règne. Hier, vous me faisiez l’honneur de diriger ma thèse, aujourd’hui l’honneur de la présider, soyez assuré de ma reconnaissance.
5 A Monsieur le Professeur Denis CHATELAIN,
Professeur des Universités-Praticien Hospitalier (Anatomie et cytologie pathologique)
Vous me faites l’honneur de faire partie du jury de cette thèse, je vous en suis sincèrement reconnaissant.
7 A Monsieur le Professeur Eric NGUYEN-KHAC,
Professeur des Universités-Praticien Hospitalier (Hépato-Gastroentérologue)
Chef du Service d'Hépato-Gastroentérologie
Pôle "Médico-chirurgical digestif, rénal, infectieux, médecine interne et endocrinologie" (D.R.I.M.E)
Vous me faites l’honneur de participer à ce jury de thèse. Soyez assuré de toute ma reconnaissance.
9 A Monsieur le Professeur Bruno CHAUFFERT,
Professeur des Universités-Praticien Hospitalier Chef du service d'Oncologie médicale
CHU d’AMIENS
Vous me faites l’honneur de siéger parmi les membres du jury. Vous avez accepté avec intérêt de juger mon travail. Je vous en remercie.
11 A Madame le Docteur Catherine DOUTRELLOT,
Maître de Conférences des Universités – Praticien Hospitalier Médecine du travail et des risques professionnels
J’ai le plaisir de vous voir siéger parmi les membres du jury. Je vous en suis grandement reconnaissant.
13
Remerciements personnels
A mes chers parents, dont les sacrifices n’ont pas été vains. Avec le temps nous
nous rendons compte plus que jamais des efforts que vous avez fournis pour nous élever, dans le sens d’une noble élévation. Cette prise de hauteur vis-à-vis des fausses valeurs est indéniablement notre meilleure arme dans cette société, après l’Amour que vous me portez et que je vous porte. Que Dieu vous récompense de la plus belle des manières.
A mon frère et à ma sœur. Je revis régulièrement dans ma tête nos souvenirs
d’enfance, entre éclats de rires, larmes, et chamailleries. Tout ceci me manque… ou plutôt vous. Cette époque d’insouciance où nous étions réunis en un seul et même endroit… Sauf que la vie moderne fait son œuvre, éparpille les êtres, occupe l’esprit d’innombrables activités chronophages qui nous font courir, sans trop savoir pourquoi parfois.
A Mariam, mon amie, ma sœur, ma complice, mais surtout, mon épouse, ma
moitié. Je me réjouis chaque jour de faire partie de ta vie. Merci mon cœur pour tes sacrifices, tes efforts et ta douceur pendant la préparation de cette thèse. En vérité, cela devait certainement être plus difficile pour toi que pour moi. Courage, encore quelques semaines avant l’arrivée dans ce monde de la choupinette iA. Merci d’exister. Deux mots et demi.
A ma petite Zaynab. J’ai grandement apprécié bavarder avec toi de certaines
parties de la thèse. Bravo pour ta patience et ton écoute plutôt attentive, même si parfois tu m’interrompais pour prendre la parole et m’imiter avec un air sérieux, du haut de la centaine de mots à ton vocabulaire. Ça promet ! Je vous aime, toi et ta future sœur.
A Noureddine Zaimen, j’aurais tellement aimé que tu assistes à ma thèse… alors
je te la dédie. Que Dieu t’accorde les plus hauts degrés du Paradis...
A la famille de Syrie et du Maroc : mon grand-père, mes oncles et tantes, mes
cousins/cousines, ma belle-famille. Vous me manquez. Je ne vous ai pas vu depuis des mois, et pour certains, depuis plusieurs années... Puisse la situation se rétablir au pays...
A Éric T. Merci pour tes nombreux conseils, pour le fait de te rendre disponible
chaque fois, d'être à l'écoute des autres, et de mettre cette ambiance au Registre. Tu es un peu le couteau suisse du service (c'est un compliment !)
A Bénédicte et les filles du Registre. Ravi de collaborer au quotidien avec vous
14 de tout mon estomac, pour les pâtisseries et le thé qui circulent quotidiennement
dans la joie et la bonne humeur jusqu'à mon bureau !
A Hajer B.K. Je tiens à te remercier pour les nombreux conseils et la relecture
de cette thèse. C'est une chance pour nous que tu sois là dans le service. Ton expertise et ta fascination pour l'épidémiologie te mèneront loin je l'espère iA. Et franchement, oui, tu es en quelque sorte une artiste.
A Pascal C. Merci pour les messages forts que tu nous transmettais et qui
restent gravés dans ma mémoire. Maintenant la bibliographie et le protocole tiennent une place importante dans ma vie. Ce fut agréable de te côtoyer pendant ton séjour amiénois.
Une pensée amicale aussi pour celles et ceux que j'ai croisé durant mon cursus et qui m'ont marqué par leur gentillesse et leur humanité : Caroline A. (je ne te remercierai jamais assez pour ton empathie et tes conseils avisés), Anne L. et
Marie G. (surtout restez comme vous êtes), Céline T. ("si tu as des questions, tu
m'appelles pas"), Emilie F. (merci de m'avoir systématiquement guidé dans ce que je faisais), François M. (nos discussions me manquent), Karima B. (jeune Docteur en Humanité), Youssef K… et la liste ne peut être exhaustive…
Au professeur Bruno Falissard, magicien de l'enseignement des statistiques, ayant le pouvoir d'expliquer aisément la théorie du maximum de vraisemblance à un enfant de 5 ans. Je ne pouvais pas ne pas vous mentionner, au nom de tout ce que vous provoquez de bien dans la tête de vos élèves à la sortie de votre enseignement (et/ou à la lecture de vos ouvrages).
Mes salutations aux internes de Santé publique d'Amiens, avec qui j'ai passé de bons moments dans les différents terrains de stage : Bruno, Tristan, Lionel,
Lise, Marion, Diana (je te compte parmi nous).
A Myriam H. On ne t'oublie pas. Puisse Dieu t'accorder Son Paradis.
Pour conclure : toutes les louanges vont à l'Unique, le plus Savant, et qui Sait à n'en point douter si les conclusions de cette thèse sont exactes ou non.
S.Z. le 27 septembre 2017
17
TABLE DES MATIERES
TABLE DES ILLUSTRATIONS ... 19
ABREVIATIONS ... 20
1. INTRODUCTION ... 21
1.1. CONTEXTE ET JUSTIFICATION DE L’ETUDE ... 21
1.2. EPIDEMIOLOGIE DU CANCER DE L’OESOPHAGE ... 23
1.2.1. Incidence, répartition et évolution ... 23
1.2.2. Histopathologie et facteurs de risque ... 24
1.2.2.1. Le carcinome épidermoïde (CE) ... 25
1.2.2.2. L’adénocarcinome (ADK) ... 25
1.2.3. Profil clinico-épidémiologique ... 27
1.2.4. Pronostic et facteurs pronostiques ... 27
1.2.5. Surveillance et prévention ... 29
1.3. L’ŒSOPHAGE EN TANT QUE SECOND CANCER PRIMITIF ... 30
1.3.1. Considérations générales ... 30
1.3.2. Les facteurs de risque de seconds cancers primitifs ... 30
1.3.3. Particularités des SCP de l’oesophage ... 32
1.4. OBJECTIFS DE L’ETUDE ... 33
2. MATERIEL ET METHODE ... 34
2.1. Genèse de l’étude ... 34
2.2. Schéma de l’étude ... 34
2.3. Centres participants et population étudiée ... 34
2.4. Critères d’inclusion ... 35
2.5. Données recueillies ... 36
2.6. Critère de jugement ... 37
18
2.7.1. Analyse descriptive ... 38
2.7.2. Analyse de survie ... 38
2.8. Considérations éthiques et légales ... 41
3. RESULTATS ... 42
3.1. Analyse descriptive ... 42
3.1.1. Délai entre le 1e cancer et le SCP de l’oesophage ... 51
3.1.2. Délai entre le SCP et le décès ... 53
3.2. Analyse de la survie à 1 an ... 54
3.2.1. Taux et médiane de survie ... 54
3.2.2. Analyse multivariée ... 55
3.3. Analyse de la survie à 5 ans ... 61
3.3.1. Taux et médiane de survie ... 61
3.3.2. Analyse multivariée ... 62
4. DISCUSSION ... 67
4.1. Des résultats… ... 67
4.1.1 … De l’analyse descriptive... 67
4.1.2 … De l’analyse de survie ... 68
4.2. Des limites de l’étude… ... 71
4.2.1 … A propos du contenu de la base K2 et des biais de confusions possibles ... 71
4.2.2 … Concernant la méthodologie épidémiologique retenue ... 72
4.2.3 … En rapport avec le fonctionnement des registres participants ... 73
4.3. Des forces de l’étude… ... 75
4.3.1 … De par la qualité des données recueillies ... 75
4.3.2 … De par l’ampleur de la collecte ... 75
4.3.3 … De par ses résultats originaux ... 75
5. CONCLUSION ... 76
19
TABLE DES ILLUSTRATIONS
Tableau 1: Principaux facteurs associés aux carcinomes épidermoïdes (CE) et aux adénocarcinomes
(ADK) de l’oesophage ... 27
Tableau 2 : Risque de survenue d'un cancer (valeurs SIR) de l'oesophage après un premier cancer localisé aux VADS ... 32
Tableau 3 : Liste des variables présentes dans la base de données ... 37
Tableau 4 : Caractéristiques sociodémographiques des patients inclus ... 44
Tableau 5 : Caractéristiques sociodémographiques des patients inclus, selon l'histologie ... 44
Tableau 6 : Analyse univariée des différentes variables explicatives sur la survie à 1 an ... 56
Tableau 7 : Résultats du modèle de Cox à 1 an ... 58
Tableau 8 : Résultats du modèle de Cox à 1 an, avec interaction ... 59
Tableau 9 : Analyse univariée des différentes variables explicatives sur la survie à 5 ans ... 63
Tableau 10 : Résultats du modèle de Cox à 5 ans... 64
Tableau 11 : Résultats du modèle de Cox à 5 ans, avec interaction ... 65
Figure 1 : Flow chart de l'étude ... 42
Figure 2 : Taux de participation des 12 registres de cancer dans la constitution de la cohorte ... 43
Figure 3 : Les différentes localisations du premier cancer ... 46
Figure 4 : Localisations du premier cancer avant un SCP œsophagien de type CE ... 47
Figure 5 : Localisations du premier cancer avant un SCP œsophagien de type ADK... 47
Figure 6 : Diagramme alluvial reliant les localisations de premier cancer aux deux entités histologiques du SCP œsophagien... 49
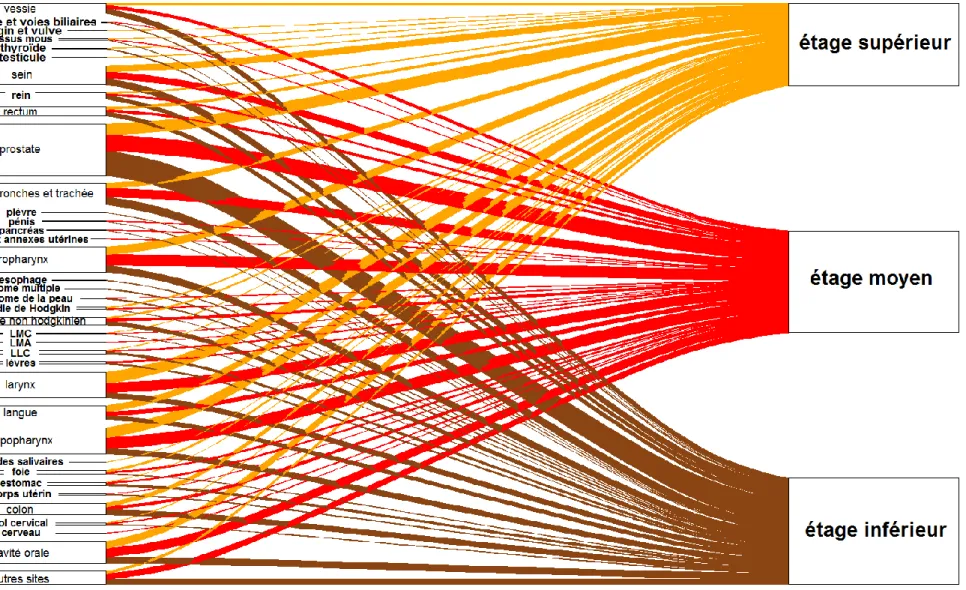
Figure 7 : Diagramme alluvial reliant les localisations de premier cancer aux étages anatomiques touchés par le SCP œsophagien ... 50
Figure 8 : Distribution des effectifs selon le délai moyen de survenue d’un SCP de l’œsophage après un premier cancer ... 51
Figure 9 : Délai moyen entre le premier cancer et le SCP de l’oesophage en fonction de la localisation du premier cancer ... 52
Figure 10 : Délai médian de survenue du décès après un SCP œsophagien en fonction de la localisation du premier cancer ... 53
Figure 11 : courbe de survie de Kaplan-Meier à 1 an... 54
Figure 12 : courbe de survie de Kaplan-Meier à 1 an, selon le type histologique du SCP de l’oesophage ... 55
Figure 13 : courbe de survie de Kaplan-Meier à 5 ans ... 61
Figure 14 : courbe de survie de Kaplan-Meier à 5 ans, selon le type histologique du SCP de l’oesophage ... 62
20
ABREVIATIONS
AD : Arcades Dentaires ADK : Adénocarcinome CE : Carcinome Epidermoïde
CIM-O : Classification Internationale des Maladies pour l’Oncologie CIRC (ou IARC) : Centre International de Recherche sur le Cancer EBO : Endobrachyoesophage
ET : Ecart-Type HR : Hazard Ratio
IC95 : Intervalle de Confiance à 95% IMC : Indice de Masse Corporelle
IReSP : Institut de Recherche en Santé Publique
LLA : Leucémie Lymphoïde Aigue LLC : Leucémie Lymphoïde Chronique LMA : Leucémie Myéloïde Aigue LMC : Leucémie Myéloïde Chronique LMNH : Lymphome Malin Non Hodgkinien RGO : Reflux Gastro-Œsophagien
SCP : Second Cancer Primitif SIR : Standardized Incidence Ratio
21
1. INTRODUCTION
1.1. CONTEXTE ET JUSTIFICATION DE L’ETUDE
Le cancer de l’œsophage est le huitième cancer le plus fréquent au monde avec un taux d’incidence estimé de 456 000 nouveaux cas en 2012, équivalent à 3,2% de tous les cancers, et possède un pouvoir létal qui l’élève au sixième rang des cancers les plus meurtriers, soit 400 000 décès pour l’année 2012, ce qui représente 4,9% de tous les décès par cancer. Le problème s’amplifie lorsque l’on sait que près de 80% de ces cas surviennent dans les pays en voie de développement [1]. En France, toujours pour l’année 2012, le cancer de l’œsophage se situait au 15e rang des cancers solides les plus fréquents avec un taux d’incidence annuelle de près de 4700 nouveaux cas, et au 10e rang des décès par cancer, avoisinant les 3500 décès [2]. Introduire cette thèse par ces quelques chiffres choisis, pris ensemble, permet d’éclairer sur la nécessité à grande échelle de prévenir, traiter et surveiller l’apparition de ce cancer de pronostic sombre, avec une survie globale à 5 ans variant de 10 à 25% selon les pays et les sources [3,4,5]. Elle est de 13,9% pour la France [6].
Au fur et à mesure que la médecine théorique et pratique progresse - tant par l’amélioration grandissante des techniques médicales et des thérapeutiques toujours plus ciblées que par l’optimisation de la prise en charge individuelle de « l’après-cancer » en terme de suivi, de surveillance, mais également de prévention - les diagnostics sont portés de manière plus précoce, et les individus atteints d’un cancer voient leur temps de vie s’allonger. Ainsi, en France, en 2008, on estimait à 3 millions le nombre d’individus (de 15 ans et plus) ayant eu un cancer au cours de leur vie [29]. Toutefois, ce qui apparait comme un contexte évolutif encourageant peut être également à l’origine de nouvelles difficultés auxquelles le clinicien doit faire face. Il s’agit de la problématique des seconds cancers primitifs (SCP) [7,8,9]. En effet, plus un individu survit à son premier cancer plus grande est sa probabilité de développer un SCP, notamment si les expositions environnementales ou comportementales (alcool, tabac, etc…) persistent chez cet individu. Il se pose alors le problème délicat de la
22 prise en charge du premier cancer par rapport au second, sur la thérapeutique parfois agressive ciblant le premier cancer et ses répercussions sur la prise en charge du second, et inversement [8,10]. Il se pose également le problème du pronostic, de l’impact du SCP sur la survie globale de l’individu. Et en ce sens, l’œsophage qui possède déjà un pronostic sombre en tant que cancer unique [4], laisserait aisément présager une accentuation de son caractère létal en tant que SCP [11].
Il a été établi dans la littérature, à de nombreuses reprises, que certains cancers primitifs sont « épidémiologiquement » liés, c’est-à-dire que leur association est fréquente car ils reposent sur un terrain commun, connu ou non, pouvant être génétique (les cancers entrants dans le cadre de tableaux syndromiques) mais aussi, par exemple, à partir du terrain alcoolo-tabagique, facteur de risque avéré des cancers épidermoïdes des voies aéro-digestives supérieures (VADS), pour ne citer que ce groupe topographique [12]. En ce qui concerne l’oesophage, une entité histologique est épidémiologiquement liée au cancer des VADS : celle des carcinomes épidermoïdes (CE), dont l’alcool et le tabac sont des carcinogènes avérés [12,18]. Il n’est donc pas rare de voir se développer un cancer primitif des VADS suivi d’un SCP de l’œsophage de type carcinome épidermoïde, ou bien l’inverse [8,9,11,13,14]. La deuxième entité histologique des cancers de l’œsophage, tout à fait différente, est celle des adénocarcinomes (ADK), qui survient dans un contexte de reflux gastro-œsophagien chronique (RGO), volontiers chez l’obèse [15,18]. Il est important de noter que ces deux principaux types histologiques sont considérés comme deux pathologies distinctes [15] tant les facteurs de risque et les mécanismes carcinologiques respectivement impliqués sont différents [5,16,18]. De ce fait, il a été jugé intéressant de distinguer dans notre travail ces deux entités en matière de survie.
Au vu de la littérature, relativement peu d’études traitent de la problématique des seconds cancers primitifs, et encore moins lorsqu’il s’agit de l’œsophage. Il apparait clairement que l’étude de la survie des SCP de l’œsophage fait défaut, et s’avère même inexistante lorsque l’on cherche à l’aborder selon l’angle histologique.
A la lumière de l’enjeu national et international du cancer œsophagien, de son pronostic défavorable, de l’apparition progressive des SCP œsophagiens dans le champ de la cancérologie, et de ses entités histologiques très différentes, cette thèse de santé publique vise à étudier l’impact, l’effet propre des deux principaux types histologiques sur la survie de patients atteints de SCP de l’œsophage, aspect non exploré jusqu’à présent dans la littérature.
23 Ceci permettrait d’affiner les connaissances en la matière chez des « profils histologiques » à risque et pour lesquels une surveillance plus adéquate pourrait être envisageable.
Les chiffres qui seront présentés reposent sur des données françaises provenant de 12 registres du cancer (réseau FRANCIM) recouvrant une période allant de 1989 à 2010. Cela constitue d’emblée une population d’envergure qui apportera sans doute les premiers éléments de réponse à ce sujet avant d’envisager, éventuellement, un approfondissement de la question à travers d’autres protocoles d’études.
1.2. EPIDEMIOLOGIE DU CANCER DE L’OESOPHAGE
1.2.1. Incidence, répartition et évolution
Le cancer de l’oesophage fait l’objet de préoccupations à l’échelle mondiale étant donné qu’il se place au 10e rang des cancers les plus fréquents et au 6e rang des cancers les plus meurtriers. Selon les données GLOBOCAN de 2012, son taux d'incidence avoisine les 470 000 nouveaux cas par an et est responsable de quelques 400 000 décès annuels dans le monde [1]. A l’échelon français, il représente près de 5000 nouveaux cas par an tandis que le nombre de décès s’élève à 3500 pour l’année 2012 [2], ce qui le place respectivement au 15e rang en fréquence et au 10e rang en létalité. Il existe cependant une variabilité conséquente des taux d’incidence, selon les zones géographiques, le sexe et l’histologie. En effet, les pays dits « en voie de développement » sont les plus touchés, et en particulier certains sous-continents comme l’Est de l’Asie et le Sud de l’Afrique. Ensuite, le cancer de l’oesophage atteint beaucoup plus les hommes que les femmes (sex-ratio mondial de 2,4:1). Enfin, les deux entités histologiques se répartissent différemment géographiquement parlant, suivant la présence ou non de leurs facteurs de risque respectifs. Ainsi, hors considérations histologiques, les taux d’incidence de l’Est de l’Asie et du Sud de l’Afrique culminent à plus de 15 cas pour 100 000 personnes chez les hommes (contre plus de 5 chez les femmes) tandis que l’Europe de l’Ouest montre un taux d’incidence de 7 cas pour 100 000 chez les hommes (2 chez les femmes). Au niveau mondial, les chiffres sont de l’ordre de 9 cas pour 100 000 personnes chez les hommes (contre 3 chez les femmes) [1]. A l’extrême, les pays comme le Malawi, l’Ouganda, le Turkménistan ou encore la Mongolie affichent respectivement des taux d’incidences chez les hommes de 28.2, 24.8, 24.0 et 21.2 cas pour 100 000 personnes [17]. Il n’est d’ailleurs pas rare, les concernant, d’entendre parler de deux « ceintures de cancers
24 œsophagiens », une partant du nord de la Chine jusqu’au nord de l’Iran, en passant par l’Asie centrale, et une autre allant de l’Est au Sud de l’Afrique. A l’inverse, les sous-continents les moins touchés sont l’Amérique Centrale et l’Afrique de l’Ouest avec des taux d’incidence descendants sous les 2 cas pour 100 000 personnes, quel que soit le sexe [1].
La répartition des entités histologiques est également fortement hétérogène. Le type le plus communément retrouvé dans le monde est le CE (87% de tous les cas en 2012), spécialement en Asie, en Afrique et en Amérique du Sud. Cependant, l’évolution récente de l’incidence des deux types histologiques est assez surprenante. En effet, l’incidence occidentale des ADK est en pleine ascension si bien qu’ils sont devenus, en l’espace de 40 ans, le type prédominant en Amérique du Nord (chez les populations blanches), en Australie et dans certains pays d’Europe, tandis que le phénomène inverse est constaté pour les CE [18]. Ce véritable « switch » pourrait trouver son explication par la mise en parallèle de l’augmentation de l’indice de masse corporelle (IMC) dans les pays occidentaux, favorisant les reflux gastro-œsophagiens chroniques, quand dans le même temps, l’impact des campagnes de prévention anti-tabac a pu permettre de faire reculer le taux d’incidence des CE. Malgré tout, ces derniers restent toujours prépondérants en Asie, en Afrique et en Amérique du Sud.
En France, le CE reste toujours le type histologique majoritaire (près des trois quarts) [22]. Par ailleurs, les chiffres français confirment que le cancer de l’œsophage reste un cancer très « masculin » (sex-ratio de 4,1 :1) [2], surtout vis-à-vis du CE. Mais il est intéressant de noter qu’il existe depuis trois décennies, dans l’hexagone, une évolution en sens inverse selon le sexe. En effet, chez les hommes, le taux d’incidence est en régulière diminution depuis les années 1980 (- 2,6% par an), ce qui n’est pas le cas chez les femmes (+ 1,5% par an) [2,19].
1.2.2. Histopathologie et facteurs de risque
La paroi œsophagienne, composée d’une muqueuse (épithélium malpighien pluristratifié non kératinisé, chorion et musculaire muqueuse), d’une sous-muqueuse (tissu conjonctif contenant vaisseaux, nerfs et glandes), d’une musculeuse (fibres musculaires lisses circulaires internes et longitudinales externes) et de l’adventice (couche externe de tissu conjonctif riche en cellules adipeuses, vaisseaux et nerfs), est soumise à deux principales transformations histopathologiques au niveau de sa muqueuse, selon la séquence classique « épithélium
25 malpighien normal – dysplasie de bas grade – dysplasie de haut grade – cancérisation » [19,21].
1.2.2.1. Le carcinome épidermoïde (CE)
Il s’agit d’une tumeur maligne qui se développe aux dépens de l’épithélium malpighien, selon la séquence précitée. D’aspect volontiers ulcéro-végétant, il peut toucher n’importe quel étage anatomique de l’oesophage (supérieur, moyen, inférieur). Dans le cadre de l’œsophage, il est lié à deux facteurs de risque majeurs avérés :
• le tabac : de nombreuses études ont mis en évidence le lien entre tabac et CE. Par exemple, d’après l’étude BEACON (2014), le risque chez les fumeurs est 3 à 5 fois plus élevé que chez les non-fumeurs [18].
• l’alcool : l’association entre l’alcool et le CE est également clairement établi, avec un risque 3 à 5 fois plus élevé chez les consommateurs que chez les abstinents. Par ailleurs, il existe un effet de potentialisation entre le tabac et l’alcool qui fait que le risque est 20 fois plus élevé chez les fumeurs et gros buveurs d’alcool en comparaison des fumeurs qui ne boivent pas [18].
D’autres facteurs sont régulièrement mentionnés dans la carcinogénèse des CE, tels que l’achalasie du sphincter inférieur de l’œsophage, le syndrome de Plummer-Vinson, l’œsophagite caustique, la faible consommation de fruits et légumes, la consommation de noix d’arec (bétel), l’ingestion d’aliments et de boissons très chaudes, ou encore le faible niveau socio-économique [19,20].
1.2.2.2. L’adénocarcinome (ADK)
Il s’agit par définition d’un carcinome développé aux dépens d’un épithélium glandulaire. Elle est une dégénérescence maligne ayant pour point de départ un endobrachyoesophage (EBO ou muqueuse de Barrett), lequel consiste en un remplacement de l’épithélium normal de l’œsophage distal par un épithélium métaplasique glandulaire de type intestinal [20,21,22]. L’apparition de l’EBO est fortement liée à la présence de RGO chroniques et sévères (dont l’hypothèse la plus probable est que le reflux chronique d’acide ou de bile engendre des lésions chroniques de l’épithélium induisant la cascade des cytokines pro-inflammatoires, les réactions inflammatoires et la prolifération cellulaire) [18]. La prévalence de l’EBO est de 8 à
26 20% chez les patients atteints de RGO (alors qu’elle est de 30 pour 100 000 personnes en population générale) et sa transformation maligne opère dans 10 à 15% des cas [20].
Diverses études ont montré que le risque de développer un ADK était 8 fois supérieur chez ceux qui avaient des symptômes récurrents hebdomadaires de RGO comparé à ceux qui n’en avaient pas, et bien supérieur encore chez ceux qui avaient des symptômes de RGO depuis plus de 20 ans (Kastelein, 2016). De même, l’étude BEACON a montré que les patients ayant des symptômes journaliers de RGO avaient 5 fois plus de risque de développer un ADK que les patients sans RGO et 8 fois plus si les symptômes de reflux étaient présents depuis plus de 30 ans [18].
D’autres facteurs que le RGO pathologique et la muqueuse de Barrett entrent en jeu dans le risque de développer un ADK de l’œsophage :
• l’obésité : bien qu’elle entre en jeu en tant que facteur de risque commun aux cancers de manière générale, l’obésité (surtout abdominale), ses désordres métaboliques et le comportement hygiéno-diététique sous-jacent (excès alimentaire, calories d’origine animale, insuffisance d’activité physique) sont associés à l’ADK œsophagien [6,18]. En outre, elle favorise l’apparition de RGO (surtout l’obésité abdominale).
• le tabac : l’étude BEACON a rapporté que le risque de développer un ADK était 2 fois plus élevé chez les fumeurs que les non-fumeurs, de même qu’une association dose-réponse était observée [18].
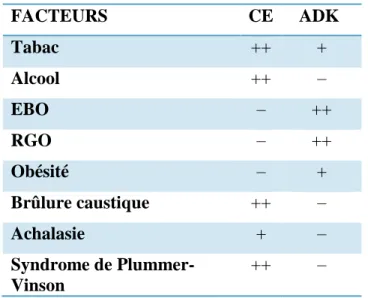
Le tableau ci-dessous résume les principaux facteurs associés aux deux types histologiques, selon qu’ils sont à risque (+), très à risque (++) ou non (–) [19].
27 FACTEURS CE ADK Tabac ++ + Alcool ++ – EBO – ++ RGO – ++ Obésité – + Brûlure caustique ++ – Achalasie + – Syndrome de Plummer-Vinson ++ –
Tableau 1: Principaux facteurs associés aux carcinomes épidermoïdes (CE) et aux adénocarcinomes (ADK) de l'oesophage
1.2.3. Profil clinico-épidémiologique
Les tumeurs de l’oesophage se révèlent le plus souvent au décours d’une dysphagie (aux solides puis, à mesure de l’évolution tumorale, aux liquides), parfois par des douleurs rétrosternales au passage du bol alimentaire (odynophagie). Aussi, l’individu peut afficher un amaigrissement du fait de la diminution des prises alimentaires causé par la dysphagie et par l’anorexie secondaire à la croissance tumorale [20,21].
Dans tous les cas il s’agit d’un cancer « masculin » touchant particulièrement la tranche d’âge 55-80 ans [2]
Le terrain clinique du carcinome épidermoïde de l’œsophage est donc assez typiquement celui de l’homme alcoolo-tabagique chronique de la cinquantaine, tandis que le terrain de l’adénocarcinome est plutôt celui de l’homme obèse qui présente une symptomatologie chronique de RGO (pyrosis, régurgitations acides).
1.2.4. Pronostic et facteurs pronostiques
Le cancer œsophagien possède un pronostic sombre, d’autant plus qu’il s’agit d’un cancer de découverte assez tardive (la dysphagie est déjà un signe tardif !) car le stade au diagnostic (classification TNM) conditionne fortement ce pronostic. Bien que la surveillance et le dépistage des sujets à risque (par exemple l’endoscopie chez les EBO) aient amélioré les
28 découvertes à des stades tumoraux plus précoces, il reste un pourcentage non négligeable de découvertes tardives [18]. S’ajoute à cela le terrain alcoolo-tabagique sous-jacent qui contribue certainement à son aggravation. Selon les données de l’étude EUROCARE-5 qui étudie la survie des cancers en Europe de 1999 à 2007, sa survie relative à 5 ans est de 12,0% [4]. D’autres études affichent des pourcentages du même ordre [23,24] mais globalement la survie à 5 ans varie de 10 à 25% selon les pays et les sources [3,4,5]. Dans le cas de la France, elle est de 13,9% [6]
Si l’on s’intéresse maintenant au pronostic selon l’histologie, on s’aperçoit que les deux types histologiques affichent des pourcentages de survie variables selon les sources mais la plupart du temps légèrement en « faveur » des ADK. Ainsi, selon une étude suédoise (Sundelöf, 2002), la survie à 5 ans de l’ADK était de 13,7% en 1990-1996 contre 8,9% chez les CE [25]. Elle était de 21,0% pour les ADK contre 13,9% pour les CE dans une étude suisse (Levi, 2004) qui effectuait son analyse pour la période 1994-1998 [27], et de 13,6% pour les ADK et de 11,8% pour les CE sur la période 1990-1994 ainsi que 19% pour les ADK contre 15% pour les CE sur la période 2003-2007, respectivement dans deux articles américains [28,18]. Une étude canadienne (Otterstater, 2012) a montré que les deux types avaient un pourcentage similaire de survie de 14% à 5 ans [23]. Enfin, une étude brésilienne (Tustumi, 2016) montrait une tendance un peu inverse dans sa cohorte, avec 22,8% de survie à 5 ans pour les CE contre 20,2% pour les ADK [26]. En France, CE et ADK présentaient un pourcentage identique de 9,2% (dans les années 1990) [22].
L’évolution de la survie selon l’histologie est également intéressante. Que ce soit l’ADK ou le CE, les articles qui en parlent montrent que la survie à 5 ans s’est améliorée au cours du temps : aux USA, la survie à 5 ans est passée de 6% (en 1973-1977) à 19% (en 2003-2007) pour les ADK [18]. En Suède, elle est passée de 5% (1961-1989) à 13,7% (1990-1996) pour les ADK et de 5% à 8,9% pour le CE aux mêmes périodes [25]. De même pour la Suisse, où la survie des ADK est passée de 12,9% à 21,0%, ainsi que de 5,2% à 13,9% pour les CE [27]. Cependant, au vu de ces pourcentages, il parait bien difficile d’affirmer qu’un des types histologiques possède un meilleur pronostic que l’autre, d’une part car la différence statistique entre les deux entités n’était pas testée par les auteurs, d’autre part car il existe des facteurs pronostiques qui font varier cette survie, et les différentes études épidémiologiques ne disposaient pas de toutes les informations nécessaires les concernant. Ainsi, le stade TNM au diagnostic apparait comme un facteur pronostic majeur [3] selon que la tumeur est classée T0
29 (survie à 5 ans de 74%) ou T3 (30%), N0 (63%) ou N+ (30%) en post-opératoire au décours d’une résection chirurgicale R0 (Mariette, 2008). La thérapeutique envisagée – endoscopie, chirurgie, radiothérapie, chimiothérapie ou une combinaison des deux/trois dernières modalités – est également un facteur pronostic majeur, bien qu’elle soit conditionnée en partie par le stade TNM. Globalement, la survie à 5 ans après résection chirurgicale R0 (exérèse de l’intégrité de la tumeur avec marges saines) se situe aux alentours de 40% (Mariette, 2004). Divers essais (CROSS, FFCD 9901) ont étudié le devenir pronostic des patients selon différentes combinaisons thérapeutiques et à des stades TNM divers [6]. D’autres facteurs pronostiques sont retrouvés dans la littérature, tels que le nombre de ganglions envahis ou encore l’indice de Charlson [24].
1.2.5. Surveillance et prévention
La surveillance d’un patient atteint d’un cancer de l’œsophage implique un examen clinique et un TDM thoraco-abdominal semestriel pendant 5 ans et des examens paracliniques régulièrement orientés vers la recherche de complications, récidives ou de cancers métachrones (surtout des VADS), à l’occasion d’un examen ORL annuel pour les carcinomes épidermoïdes et de fibroscopies digestives régulières voire bronchiques [6]. D’autres examens paracliniques sont envisagés selon le contexte (TDM thoraco-abdominal dans les RCT exclusives curatives avec réponse complète) ou selon les points d’appels cliniques (TEP, scintigraphie osseuse, IRM cérébrale…). A noter qu’une surveillance endoscopique est accrue chez les patients présentant un endobrachyoesophage.
La surveillance clinique et paraclinique, la prévention des expositions aux facteurs de risque dans le suivi (aide au sevrage alcoolique et/ou tabagique, prise en charge nutritionnelle, du surpoids), ainsi que l’amélioration des techniques et des protocoles thérapeutiques ont permis conjointement d’améliorer la qualité et d’allonger le temps de vie des individus atteints d’un premier cancer. Or, cet allongement du temps de vie est également responsable d’une augmentation croissante des cas de seconds cancers primitifs chez ces patients.
Dès à présent, nous n’aborderons plus la thématique des cancers de l’œsophage en tant que cancer unique, mais en tant que second cancer primitif, constituant l’objet de ce travail.
30
1.3. L’ŒSOPHAGE EN TANT QUE SECOND CANCER PRIMITIF
1.3.1. Considérations générales
Par définition, un second cancer primitif est une nouvelle tumeur primitive infiltrante diagnostiquée chez un individu déjà atteint par un cancer et qui n’est ni une récidive, ni une métastase, ni un cancer multifocal ou multicentrique [29].
Relativement peu d’études se sont penchées sur l’évaluation du risque moyen de survenue de SCP, toutes localisations de cancers confondues. Les résultats de ces quelques études montrent que le risque global variait via un SIR (ou Standardized Incidence Ratio) allant de 0,77 à 1,36 par rapport à la population générale, mais la majorité d’entre-elles montraient un risque significativement supérieur à 1. Pour la France, une étude menée par le réseau français des registres des cancers (FRANCIM) en 2012 a montré un risque de SCP supérieur de 40% par rapport au risque de cancer de la population générale (SIR = 1,4) [29]. D’après une étude américaine de référence en la matière (Curtis, 2006), l’augmentation du risque de second cancer par rapport au risque de cancer de la population générale était de 14% (SIR = 1,14). Bien que ce risque puisse être considéré comme « faible », ce pourcentage masque en réalité une hétérogénéité au niveau des 40 localisations étudiées. Par exemple, un cancer de la cavité buccale/pharynx ou du larynx en cancer initial révélaient respectivement des SIR de 2,45 et de 1,71 de développer un SCP. Par ailleurs, cette étude a montré que le développement d’un SCP en un site différent du premier était vu dans 80% des cas [9,29]. Il apparait donc que pour certains patients, selon la localisation du premier primitif, le risque de développer un SCP nécessite une attention particulière. Mais la localisation n’est pas le seul facteur de risque.
1.3.2. Les facteurs de risque de seconds cancers primitifs
Il existe divers facteurs de risque de développement de SCP qu’il convient de passer en revue :
• l’âge au diagnostic : l’étude menée par Curtis, qui avait analysé le risque de survenue de SCP selon l’âge au diagnostic du premier cancer, a mis en évidence que le risque était d’autant plus élevé que cet âge au 1e cancer était jeune [29]. Il est d’ailleurs bien
31 établi dans la littérature que la population des cancers pédiatriques est à risque de cancers multiples.
• la localisation du premier cancer : comme vu précédemment, les risques de SCP pour la cavité buccale et le pharynx ou encore le larynx montraient des SIR élevés (respectivement 2,45 et 1,71). Globalement, les patients les plus à risque de SCP sont ceux qui présentent un cancer des VADS et de l’œsophage (Curtis, 2006) [29].
• la susceptibilité génétique : les cancers multiples peuvent entrer dans le cadre de syndromes génétiques (exemple du syndrome de Lynch ou HNPCC). Les cancers héréditaires représentent 5 à 10% de tous les cancers [29].
• les thérapeutiques anticancéreuses : radiothérapie et chimiothérapie peuvent induire des tumeurs secondaires tardives, avec une latence inférieure à 8 ans pour les leucémies (surtout en post-chimiothérapie) et supérieure à 10 ans pour les tumeurs solides. Ce risque dépend de l’âge (les plus jeunes sont les plus à risque), des champs irradiés (pour la radiothérapie, certains organes sont dits radiosensibles, comme le sein, la thyroïde, le poumon) et des doses délivrées. Selon une étude américaine de 2011 (relatant la période 1973-2002), 8% des SCP seraient causés par la radiothérapie. Moins de 5% seraient imputables à la chimiothérapie (principalement des hémopathies) [29,31].
• l’exposition alcoolo-tabagique : le tabac est le premier facteur de risque de cancer dans la population générale (poumon, haut et bas appareil urinaire, VADS, appareil digestif supérieur et inférieur, appareil génital féminin…) et le risque de SCP est fortement augmenté après apparition d’un cancer lié au tabac (cavité buccale, pharynx, œsophage, larynx, poumon) avec un SIR de 1,64. A noter également que le tabac possède une action indirecte sur l’accentuation du risque de SCP de par son interaction avec la radiothérapie. Concernant la consommation d’alcool, il apparaitrait que les patients buveurs atteints d’un premier cancer des VADS seraient soumis à une augmentation du risque de SCP de manière globale, mais particulièrement aux VADS à nouveau [29].
D’autres facteurs seraient également impliqués, tels que la surcharge pondérale (certains travaux ont conforté l’idée que l’obésité chez les femmes atteintes d’un cancer du sein est associée à une augmentation du risque de cancer du sein controlatéral, de l’endomètre et du
32 cancer colorectal), les traitements hormonaux, les infections et immunodépressions (une infection virale persistante comme l’HPV, le VIH, l’EBV ou le VHB et VHC pourrait contribuer à l’augmentation du risque de développer un SCP) [29].
Ces facteurs de risque doivent être portés à la connaissance de l’équipe de cancérologie, afin de les prendre en considération dans la planification de la prise en charge du patient (dépistage accentué en ayant une meilleure connaissance des cancers liés, orientation optimale vers des consultations d’oncogénétique, identification des sur-traitements, prévention et promotion du sevrage alcoolo-tabagique…) [29].
1.3.3. Particularités des SCP de l’oesophage
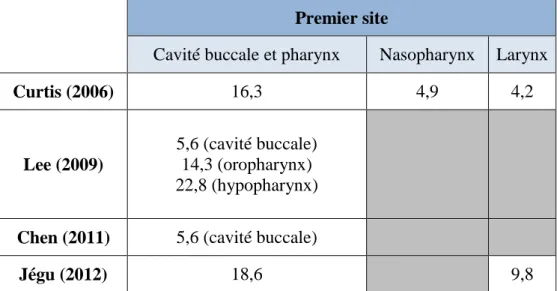
Il est bien documenté que l’œsophage, en tant que second cancer primitif, succède fréquemment à un premier primitif localisé aux VADS, du fait des facteurs de risque communs qu’ils partagent - tabac et alcool - spécialement pour le carcinome épidermoïde. Ainsi, lorsqu’un premier cancer concernait la cavité buccale (langue, bouche, amygdales) ou le pharynx (oro- et hypopharynx), le risque de développer un SCP œsophagien affichait un SIR de 16,3 pour l’étude de Curtis (2006) et de 18,6 pour une étude française menée par le registre du Bas-Rhin (Jégu, 2012), alors qu’il était respectivement de 4,2 et 9,8 pour ces deux études lorsque le premier primitif était localisé au larynx [9,13,29]. D’autres études, menées par les registres de cancers de Taiwan, montrent des valeurs élevées de SIR allant dans ce sens [11,32]. Concernant le poumon, une autre localisation à l’étiologie tabagique commune, le SIR était de 2,7 (Curtis, 2006) [9].
Premier site
Cavité buccale et pharynx Nasopharynx Larynx
Curtis (2006) 16,3 4,9 4,2 Lee (2009) 5,6 (cavité buccale) 14,3 (oropharynx) 22,8 (hypopharynx)
Chen (2011) 5,6 (cavité buccale)
Jégu (2012) 18,6 9,8
33 Concernant le pronostic des SCP œsophagiens, certaines études (Chen MC, 2010 et Chen PT, 2011) ont montré que ceux-ci possédaient un impact pronostic négatif significatif sur la survie des patients déjà atteints d’un cancer de la tête et du cou par rapport aux individus atteints d’un cancer tête et cou seul [32,33]. D’autres études (Lee, 2009) ont montré que les SCP de l’oesophage, après un cancer de la cavité buccale ou du pharynx, possédaient également un impact pronostic négatif significatif comparé aux SCP non œsophagiens, quel que soit le site du premier primitif (oropharynx, cavité buccale, hypopharynx) [11].
Quelques rares taux de survie des SCP de l’œsophage ont été retrouvés dans la littérature, notamment dans l’étude de Chen MC (2010) élaborée sur les données des registres de cancer de Taiwan, qui a mis en évidence une survie globale à 5 ans de 10,1%, qui différait selon la stratification par le site du premier primitif étudié : 6,8% pour un cancer buccal ou pharyngé (oro- ou hypopharynx), 10,0% pour un cancer du nasopharynx et 23,8% pour un cancer du larynx [33].
Malgré la paucité des études relatives aux SCP œsophagiens et à leurs pronostics, les résultats sur la survie tendent à montrer que ces derniers possèdent un impact négatif en comparaison des patients n’ayant pas développé de SCP, et plus néfaste encore que les SCP localisés ailleurs, quel que soit la localisation « tête et cou » du premier cancer relaté par ces études. En revanche, nous n’avons retrouvé aucune étude prenant en compte l’aspect histologique de ces seconds cancers primitifs de l’œsophage sur la survie.
1.4. OBJECTIFS DE L’ETUDE
L’objectif principal de l’étude est de déterminer l’effet propre du type histologique du SCP de l’œsophage sur la survie globale à 1 an et à 5 ans.
Les objectifs secondaires portent sur :
l’analyse de l’évolution de la survie globale à 1 an et à 5 ans selon l’année de diagnostic du SCP œsophagien.
la recherche d’une interaction entre la topographie et la morphologie du SCP de l’œsophage sur la survie globale à 1 an et à 5 ans.
34
2. MATERIEL ET METHODE
2.1. Genèse de l’étude
La thématique des seconds cancers primitifs en France fut initiée en 2011 par l’équipe du registre des cancers du Bas-Rhin, devant l’absence de données d’incidence produites à l’échelle nationale. Ce projet d’étude épidémiologique, nommé K2-France, qui a fait l’objet d’une demande de financement (approuvé) auprès de l’Institut de Recherche en Santé Publique (IReSP), s’est alors entouré des registres généraux du réseau français des registres de cancer (FRANCIM) afin de mener à bien cet objectif. La base de données K2 ainsi constituée, de portée nationale (grâce à l’activité d’enregistrement des registres dont l’ensemble des données d’incidence et de survie sont centralisées au sein d’une base de données commune hébergée par le service de Biostatistiques des Hospices Civils de Lyon) a ensuite été mise à la disposition des équipes collaboratrices des registres du réseau FRANCIM afin de permettre la multiplication de projets de recherche épidémiologiques sur divers aspects de cette thématique. Ainsi, le Service d’épidémiologie et de Santé publique du CHU d’Amiens, en étroite collaboration avec le registre du cancer de la Somme, a donc pu bénéficier de l’accès à la base de données K2 pour réaliser la présente étude de survie que constitue cette thèse.
2.2. Schéma de l’étude
Il s’agissait d’une étude épidémiologique observationnelle, analytique, de cohorte rétrospective et multicentrique.
2.3. Centres participants et population étudiée
La base de données K2 utilisée résulte de la participation de 12 registres des cancers du réseau FRANCIM participant au projet K2-France. Il s’agit des registres du Bas-Rhin, du Calvados (registre général des tumeurs du Calvados, registre des tumeurs digestives du Calvados), de
35 Basse-Normandie, du Doubs, de l’Hérault, de l’Isère, de Lille-Métropole, de Loire-Atlantique, de Vendée, de la Manche, de la Somme et du Tarn.
2.4. Critères d’inclusion
La population étudiée, suivie jusqu’au 30 juin 2013 (date de point), correspondait à l’ensemble des personnes :
possédant leurs résidences principales dans les départements couverts par ces 12 registres
ayant présenté un second cancer primitif localisé à l’œsophage :
o correspondant à une tumeur de nature maligne (= code 3 selon la CIM-O) 1
o découvert plus de 2 mois après la date de diagnostic du 1e
cancer o diagnostiqué sur une période allant du 1e
janvier 1989 au 31 décembre 2010. L’éviction des SCP de l’oesophage dont le diagnostic survenait moins de 2 mois après le diagnostic du premier cancer primitif constituait un critère de non-inclusion. Ce délai retenu définissait les cancers synchrones (survenant dans le même temps) par « opposition » aux cancers métachrones (décalés dans le temps) de délai supérieur à 2 mois entre les deux diagnostics de cancers.
D’autre part, les registres des cancers européens suivent les règles de codage des tumeurs multiples proposés par le CIRC, qui considère comme nouveau primitif tout cancer
présentant, soit une topographie (localisation) différente du premier cancer, soit une même topographie mais une morphologie (histologie) différente. Ainsi, les primitifs métachrones qui présentaient la même topographie et morphologie que le premier cancer n’étaient pas
considérés comme étant un deuxième primitif, définissant par là un deuxième critère de non-inclusion de notre étude [29,34].
Ainsi, dans notre étude, seuls les cancers métachrones de localisation différente du premier, ou bien de même localisation mais d’histologie différente, étaient considérés comme des SCP.
1
Etaient d’emblée exclus de la base K2 initiale, les sujet ayant présenté des tumeurs dont le code comportement était autre qu’un code 3 selon la CIM-O, c’est-à-dire les codes 0 (tumeurs bénignes), 1 (tumeurs à évolution
imprévisible ou inconnue), et 2 (tumeurs in situ). En effet, le projet K2-France ne ciblait que les tumeurs
36
2.5. Données recueillies
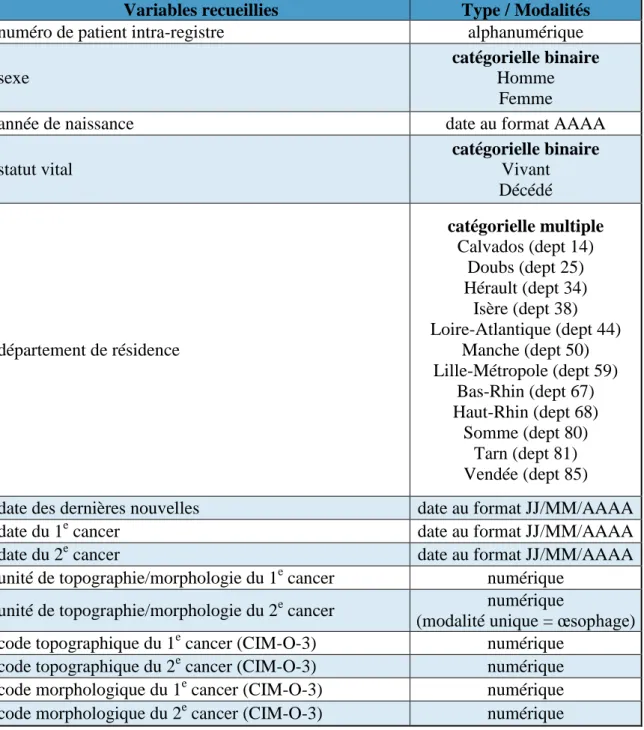
Au total, 14 variables composaient la base de données K2 (voir tableau n°3). Certaines d’entre-elles, soumises à des codages bien précis, nécessitent d’être expliquées :
Les variables « code topographique » : elles indiquent la localisation d’origine de la tumeur, et sont composées des codes topographiques issues de la Classification Internationale des Maladies pour l’Oncologie (3e
révision, CIM-O-3). Cependant le codage topographique de l’œsophage (C15) est un peu particulier dans le sens où coexistent un codage qui se base sur un point de vue radiographique et chirurgical – cervical (C15.0), thoracique (C15.1), abdominal (C15.2) – et un autre qui se base sur un point de vue endoscopique et clinique – supérieur (C15.3), moyen (C15.4), inférieur (C15.5) – l’un pouvant en partie inclure l’autre si l’on considère ces différents étages en terme de distance par rapport aux arcades dentaires [19,35].
Les variables « code morphologique » : ce sont les variables qui codent pour le type histologique du cancer, à partir des codes CIM-O-3. Pour l’œsophage, il existait quelques codes qui n’entraient pas dans le cadre des deux entités CE et ADK étudiées2. D’après le chapitre 4 de l’ouvrage intitulé Cancer incidence in Five continents (2014) publié par le Centre International de Recherche sur le Cancer (CIRC), les CE regroupent les codes morphologiques 8050–8078 et 8083–8084, tandis que les ADK regroupent les codes 8140–8141, 8143–8145, 8190–8231, 8260–8263, 8310, 8401, 8480–8490, 8550–8551, 8570–8574 et 8576. Cette référence a donc servi au regroupement des codes CIM-O-3 pour former nos deux types histologiques [36].
2 Ces derniers étaient exclus lorsque l’analyse portait sur la comparaison CE / ADK, mais laissés lorsque
l’analyse se rapportait à la cohorte au global, c’est-à-dire hors considération histologique, en particulier afin de rendre comparable les taux et médianes de survie avec ceux des quelques études qui traitent des SCP œsophagiens sans distinction histologique.
37
Variables recueillies Type / Modalités
numéro de patient intra-registre alphanumérique
sexe
catégorielle binaire
Homme Femme
année de naissance date au format AAAA
statut vital catégorielle binaire Vivant Décédé département de résidence catégorielle multiple Calvados (dept 14) Doubs (dept 25) Hérault (dept 34) Isère (dept 38) Loire-Atlantique (dept 44) Manche (dept 50) Lille-Métropole (dept 59) Bas-Rhin (dept 67) Haut-Rhin (dept 68) Somme (dept 80) Tarn (dept 81) Vendée (dept 85)
date des dernières nouvelles date au format JJ/MM/AAAA
date du 1e cancer date au format JJ/MM/AAAA
date du 2e cancer date au format JJ/MM/AAAA
unité de topographie/morphologie du 1e cancer numérique unité de topographie/morphologie du 2e cancer numérique
(modalité unique = œsophage) code topographique du 1e cancer (CIM-O-3) numérique
code topographique du 2e cancer (CIM-O-3) numérique code morphologique du 1e cancer (CIM-O-3) numérique code morphologique du 2e cancer (CIM-O-3) numérique
Tableau 3 : Liste des variables présentes dans la base de données
2.6. Critère de jugement
Le critère principal de jugement était la survie, combinaison de la durée de suivi des individus et de leur statut vital (vivant ou décédé) à la date la plus récente en notre possession. Le suivi
38 débutait à la date du diagnostic du SCP de l’œsophage et se terminait donc à la date des dernières nouvelles définie ainsi :
si la perte de vue ou le décès d’un individu survenait avant la date de point de l’étude (fixée au 30 juin 2013), alors la date des dernières nouvelles de son statut vital constituait la fin de son suivi.
si le décès survenait après la date de point, alors cette date de point constituait la date de dernières nouvelles, à laquelle l’individu était encore vivant.
de la même manière que précédemment, si l’individu était déclaré vivant après la date de point, alors cette dernière constituait sa date de dernières nouvelles.
2.7. Analyses statistiques
2.7.1. Analyse descriptive
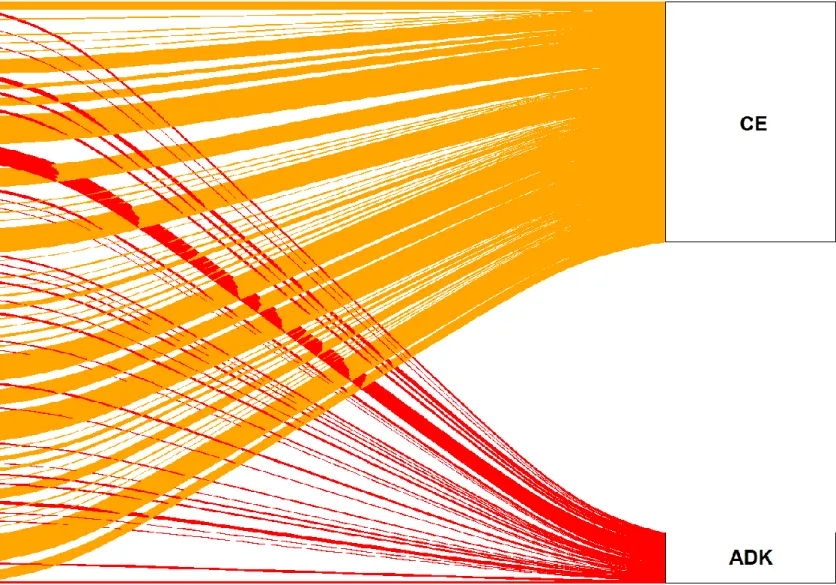
Un premier temps exploratoire a permis de décrire la base de données au moyen des analyses descriptives habituelles : moyenne, écart-type, médiane et étendue pour les variables quantitatives (continues ou discrètes), puis fréquence, pourcentage et intervalle de confiance à 95% (IC95) pour les variables qualitatives (binaires, catégorielles ordonnées ou non). Au niveau visuel, les graphiques étaient composés d’histogrammes pour les variables quantitatives continues, et de diagrammes en barre lorsqu’il s’agissait de variables qualitatives (binaires, catégorielles ordonnées ou non). Deux diagrammes dits « alluviaux » (package alluvial) ont été également été réalisés afin de mieux visualiser la fréquence des topographies de premiers cancers selon la localisation ou l’histologie du SCP de l’oesophage. Les tests statistiques inférentiels appliqués pour comparer les sous-populations histologiques étaient le test t de student (ou de Wilcoxon en cas de non-respect des conditions de validité du test t) pour les comparaisons de moyennes, et le test du chi-2 pour les comparaisons de proportions, avec un seuil de signification fixé à 5%.
2.7.2. Analyse de survie
Le second temps, établi pour répondre aux objectifs principaux et secondaires, concernait la survie proprement dite et fit appel à une série d’analyses spécifiques (package survival) :
39 la construction de courbes de survies de Kaplan-Meier à 1 an et à 5 ans, permettant d’apprécier les médianes de survie (et son IC95) et les taux de survie à 1 an et à 5 ans de notre population, au global et selon le type histologique.
le test du Log-Rank (et son degré de significativité p dont le seuil est fixé à 5%) afin de mettre en évidence une différence de survie statistiquement significative entre différents groupes testés, de manière brute (sans ajustement sur d’autres variables). le modèle multivarié de Cox à 1 an et à 5 ans, permettant le calcul du Hazard Ratio
ajusté sur d’autres variables (HR) et se définissant comme le « rapport des risques instantanés de décéder » d’un groupe par rapport à un autre (pris comme référence), indépendamment des autres variables insérées dans le modèle. Le HR est l’équivalent d’un risque relatif et s’interprète de la même manière : supérieur à 1, le risque de décès du groupe étudié est supérieur à celui du groupe de référence. Afin de témoigner du caractère significatif de leur interprétation au sens statistique, les HR étaient nécessairement accompagnés de leurs p-value (au seuil fixé de 5%) et de leurs IC95 respectifs. Le modèle était exprimé ainsi :
h(t) = h
0(t) * exp(a
1X
1+ a
2X
2+ … + a
nX
n)
La fonction de survie h(t) est définie par le produit de deux termes : un premier qui est une fonction dépendante du temps h0(t) et un deuxième, s’affranchissant du temps, représentant
les différentes variables explicatives (X1, X2, …, Xn) insérées dans le modèle, flanqués de leurs
coefficients respectifs (a1, a2, …, an). L’exponentiel de ces coefficients donnent les HR.
Comme tout modèle statistique, le modèle de Cox se devait de respecter certaines conditions essentielles de validité, notamment :
l’hypothèse des risques proportionnels : condition majeure qui stipule que la validité du modèle impose un rapport des « risques instantanés de décéder » constant, indépendant du facteur temps. Cette hypothèse devait se vérifier sur chaque variable explicative insérée dans le modèle, à travers 2 analyses : un test statistique dont la p-value rejetait ou non l’hypothèse (au seuil de 5%), ainsi qu’une analyse visuelle appréciant la répartition des résidus de Schoenfeld au cours du temps.
le fait qu’il existe de nombreux évènements « décès » dans le modèle, d’autant plus que le nombre de variables insérées est grand. Ainsi, le modèle devait comporter entre 5 et 10 évènements « décès » par variable explicative ajoutée.
40 La sélection des variables dans le modèle s’est faite selon plusieurs considérations :
certaines variables explicatives étaient forcées (imposées au modèle), comme le sexe ou l’histologie (variable d’intérêt de notre étude).
d’autres variables ont fait l’objet d’une analyse univariée à travers des modèles de Cox univariés satisfaisant aux mêmes conditions de validité que précédemment. Les variables présentant une p-value globale inférieure à 0.20 ET dont les conditions de validité étaient acceptables lors de cette étape étaient ensuite insérées dans le modèle multivarié.
l’aspect de redondance des informations apportées par deux variables fortement « liées » entre-elles fut exploré à travers des tests de corrélation (entre deux variables quantitatives) ou par le V de Cramer (entre deux variables catégorielles) allant de 0 (indépendance totale) à 1 (dépendance totale). Si une forte corrélation était présente, la sélection d’une seule variable sur les deux était requise.
Enfin, un test d’interaction a été réalisé au sein du modèle multivarié de Cox afin de déceler un possible phénomène de potentialisation entre la topographie et la morphologie du SCP de l’oesophage. En effet, il est possible que ces deux variables puissent interagir, c’est-à-dire produire un effet multiplicatif - et non simplement additif - sur la survie.
Nous nous sommes proposé d’analyser la survie en tant que survie « globale » (proportion de patients survivants observés à un temps t quelle que soit la cause de décès),par opposition à la survie spécifique (proportion de patients survivants que l’on observerait à un temps t si la seule cause de décès était le cancer étudié).
Enfin, les données manquantes n’ont pas été soumises à quelque gestion que ce soit, car la base de données n’en comprenait pas. En effet, les variables recueillies font partie des renseignements systématiquement enregistrés dans les registres.
Toutes les analyses ont été effectuées grâce au logiciel de traitement des données numériques R Studio (version 3.2.5) et aux différents packages sus-mentionnés.
41
2.8. Considérations éthiques et légales
Ce travail s’inscrit dans le cadre de l’utilisation des données des registres du cancer du réseau FRANCIM. Toutes les autorisations nécessaires ont été recueillies dans le cadre de l’activité de ces registres.
42
3. RESULTATS
3.1. Analyse descriptive
La base de données était constituée de 14 variables et de 1644 lignes correspondant à autant d’individus (unité statistique) atteints d’un SCP œsophagien et respectant les critères d’inclusion de notre étude.
Figure 1 : Flow chart de l'étude
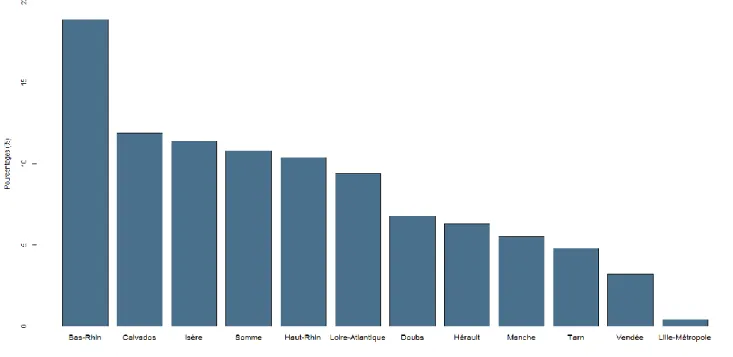
Parmi les 12 registres participants, la part du Bas-Rhin dans la constitution de la base était la plus importante (18,9%). A l’inverse, celui de Lille-Métropole (registre le plus récent, créé en 2005) a contribué à hauteur de 0,4%.
43
Figure 2 : Taux de participation des 12 registres de cancer dans la constitution de la cohorte
Sur l’ensemble de notre cohorte, 94,3% (n=1551) étaient décédés entre le 26 janvier 1989 et le 30 juin 2013 (date de point de l’étude), 2 individus étaient perdus de vue, et 91 étaient considérés comme exclus-vivants à cette date de point, ce qui représentait un total de 5,7% de censures.
Notre cohorte historique était essentiellement masculine (85,7%, n=1409), d’individus nés entre 1901 et 1964, avec un âge moyen et médian au diagnostic du 1e cancer de 61,4 ans (E.T = 11,4 ; min 25,1 ; max 94,6) et un âge moyen et médian au diagnostic de SCP de 66,8 ans (E.T = 11,1) et 67,0 ans (min 37,2 ; max 98,5) respectivement.
44
Population globale
n Moyenne (E.T) ou % [IC95]
Age moyen au diagnostic du premier cancer 1644 61,4 ans (11,4)
Age moyen au diagnostic du SCP 1644 66,8 ans (11,1)
Délai moyen entre les deux cancers 1644 5,4 ans (4,8)
Sexe Hommes Femmes 1409 235 85,7% [83,9 – 87,4] 14,3% [12,6 – 16,1] Morphologie du SCP
carcinome épidermoïde (CE) adénocarcinome (ADK) autres 1239 260 145 75,4% [73,2 – 77,4] 15,8% [14,1 – 17,7] 8,8% [7,4 – 10,3] Localisation œsophagienne
étage supérieur (15 à 24 cm des AD) étage moyen (24 à 32 cm des AD) étage inférieur (32 à 40 cm des AD) sans précision 3 314 388 405 537 19,1% [17,2 – 21,1] 23,6% [21,6 – 25,7] 24,6% [22,6 – 26,8] 32,7% [30,4 – 35,0]
Age moyen au décès 1551 68,3 ans (11,0)
Décès 1551 94,3% [93,1 – 95,4]
Tableau 4 : Caractéristiques sociodémographiques des patients inclus
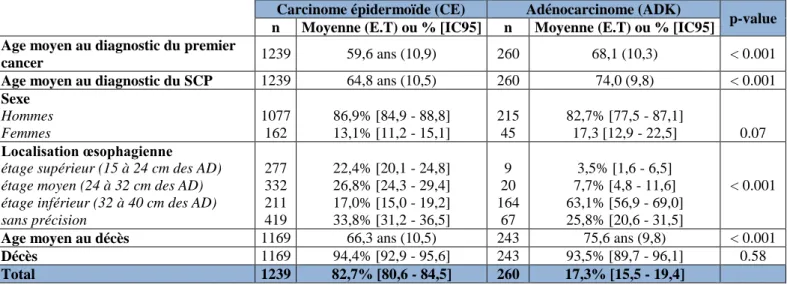
Carcinome épidermoïde (CE) Adénocarcinome (ADK)
p-value n Moyenne (E.T) ou % [IC95] n Moyenne (E.T) ou % [IC95]
Age moyen au diagnostic du premier
cancer 1239 59,6 ans (10,9) 260 68,1 (10,3) < 0.001
Age moyen au diagnostic du SCP 1239 64,8 ans (10,5) 260 74,0 (9,8) < 0.001
Sexe Hommes Femmes 1077 162 86,9% [84,9 - 88,8] 13,1% [11,2 - 15,1] 215 45 82,7% [77,5 - 87,1] 17,3 [12,9 - 22,5] 0.07 Localisation œsophagienne
étage supérieur (15 à 24 cm des AD) étage moyen (24 à 32 cm des AD) étage inférieur (32 à 40 cm des AD) sans précision 277 332 211 419 22,4% [20,1 - 24,8] 26,8% [24,3 - 29,4] 17,0% [15,0 - 19,2] 33,8% [31,2 - 36,5] 9 20 164 67 3,5% [1,6 - 6,5] 7,7% [4,8 - 11,6] 63,1% [56,9 - 69,0] 25,8% [20,6 - 31,5] < 0.001
Age moyen au décès 1169 66,3 ans (10,5) 243 75,6 ans (9,8) < 0.001
Décès 1169 94,4% [92,9 - 95,6] 243 93,5% [89,7 - 96,1] 0.58
Total 1239 82,7% [80,6 - 84,5] 260 17,3% [15,5 - 19,4]
Tableau 5 : Caractéristiques sociodémographiques des patients inclus, selon l'histologie
Lors de la déclinaison des caractéristiques précédentes selon l’entité histologique du SCP de l’œsophage, nous avons retrouvé cette même tendance masculine forte à travers le sex-ratio
3 La localisation “sans précision” est un regroupement des modalités « œsophage thoracique » (C15.1, n=21),
« lésion à cheval sur plus d’une localisation, sans précision » (C15.8, n=54), et « œsophage sans précision » (C15.9, n=462), c’est-à-dire l’ensemble des codes qui ne permettaient pas de classer distinctement la lésion à l’étage supérieur, moyen ou inférieur. L’« œsophage cervical » (C15.0, n=50) et l’« œsophage abdominal » (C15.2, n=11) étaient quant à eux respectivement inclus à l’étage supérieur et inférieur.
45 H/F (6,6:1 pour les CE et 4,7:1 pour les ADK). Le pourcentage de décès n’a pas différé significativement entre les deux types histologiques (p=0,58). Cependant, l’âge moyen, que ce soit au diagnostic de 1e cancer, au diagnostic du SCP ou au décès, montrait un écart significatif de près de 10 ans entre les deux types (p-value tous < 0,001). D’autre part, la localisation anatomique œsophagienne a montré que les CE touchaient de manière homogène les étages supérieurs, moyens et inférieurs (respectivement 22,4%, 26,8% et 17,0%), tandis que les ADK étaient nettement plus présents à l’étage inférieur (63,1%). Enfin, les CE étaient presque 5 fois plus nombreux que les ADK.
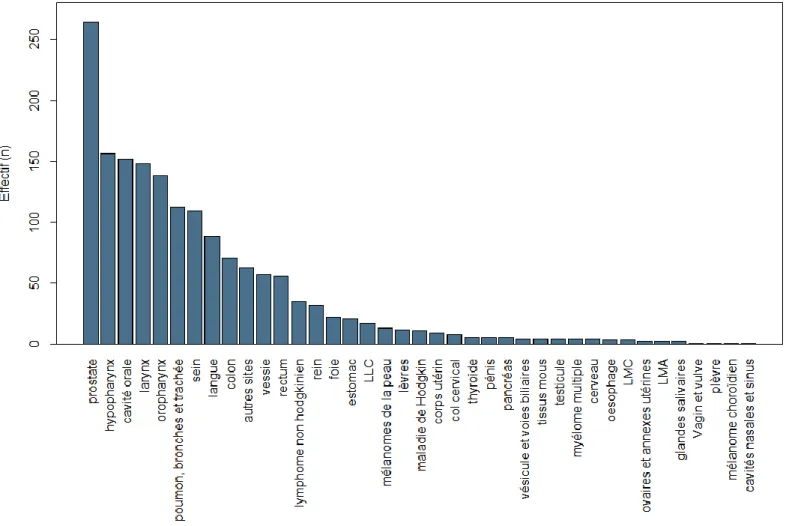
Il existait dans la base 39 localisations possibles de 1e cancer, se répartissant de manière inhomogène, dominées par la localisation prostatique (16,1% de toutes les localisations, n=264) et par le groupe des VADS (42,4%, n=697) constitués en détail de l’hypopharynx (9,5%, n=156), de la cavité orale (9,2%, n=152), du larynx (9,0%, n=148), de l’oropharynx (8,4%, n=138), de la langue (5,4%, n=88), des lèvres (0,7%, n=12), des glandes salivaires (0,1%, n=2), et des cavités nasales et sinus (0,1%, n=1) [37]. On retrouvait également fréquemment la localisation colorectale (7,7%, n=127), la localisation poumon, bronches et trachée (6,8%, n=112) ainsi que la localisation mammaire (6,6%, n=109, concernant 107 femmes sur les 235 de notre cohorte, soit 45,5%).
46
Figure 3 : Les différentes localisations du premier cancer
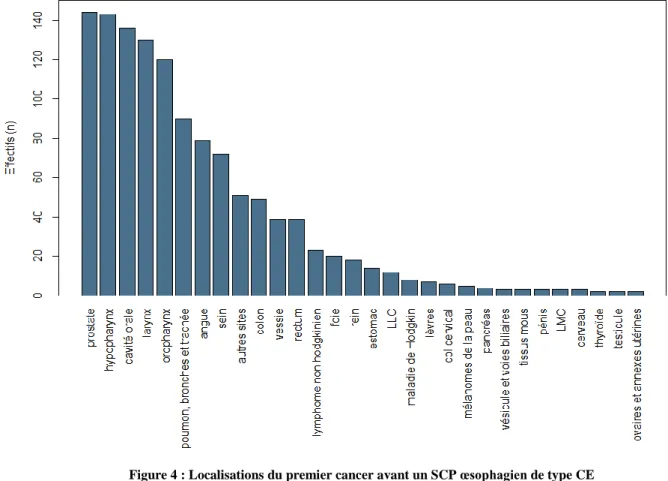
La déclinaison de la figure précédente selon les types histologiques de SCP de l’œsophage montrait, pour les CE, que la prostate (11,6%, n=144) et les VADS (49,9%, n=618) représentaient les deux entités majoritaires. Venaient ensuite les poumons, bronches et trachée (7,3%, n=90), l’entité colorectale (7,1%, n=88) et la glande mammaire (5,8%, n=72). Du point de vue des ADK, la localisation prostatique était également la principale (34,6%, n=90), mais les VADS ne représentaient cette fois-ci que 11,9% des localisations (n=31). Venaient ensuite les localisations colorectale (10,4%, n=27) et mammaire (8,5%, n=22).
47
Figure 4 : Localisations du premier cancer avant un SCP œsophagien de type CE