OATAO is an open access repository that collects the work of Toulouse researchers and makes it freely available over the web where possible
Any correspondence concerning this service should be sent
to the repository administrator: tech-oatao@listes-diff.inp-toulouse.fr
This is an author’s version published in: http://oatao.univ-toulouse.fr/ 25304
To cite this version:
Abrard, Marine . Etude de la qualité immunologique du lait de
pseudogestation de la chienne. Thèse d'exercice, Médecine
vétérinaire, Ecole Nationale Vétérinaire de Toulouse – ENVT, 2017, 68 p.
ANNEE 2017 THESE : 2017 – TOU 3 – 4093
ETUDE DE LA QUALITE IMMUNOLOGIQUE DU
LAIT DE PSEUDOGESTATION DE LA CHIENNE
________________
THESEpour obtenir le grade de DOCTEUR VETERINAIRE
DIPLOME D’ETAT
présentée et soutenue publiquement devant l’Université Paul-Sabatier de Toulouse
par
ABRARD Marine
Née, le 21/12/1991à TARBES (65)___________
Directeur de thèse : Mme Sylvie CHASTANT JURY
PRESIDENT :
M. Jean PARINAUD
ASSESSEURS :
Mme Sylvie CHASTANT
Mme Séverine BOULLIER
MEMBRE INVITE :
Mme Patricia RONSIN
Professeur à l’Université Paul-Sabatier de TOULOUSE
Professeur à l’Ecole Nationale Vétérinaire de TOULOUSE
Maître de Conférences à l’Ecole Nationale Vétérinaire de TOULOUSE Praticien Hospitalier à l'Ecole Nationale Vétérinaire de TOULOUSE
ANNEE 2017 THESE : 2017 – TOU 3 – 4093
ETUDE DE LA QUALITE IMMUNOLOGIQUE DU
LAIT DE PSEUDOGESTATION DE LA CHIENNE
_________________
THESEpour obtenir le grade de DOCTEUR VETERINAIRE
DIPLOME D’ETAT
présentée et soutenue publiquement devant l’Université Paul-Sabatier de Toulouse
par
ABRARD Marine
Née, le 21/12/1991à TARBES (65)___________
Directeur de thèse : Mme Sylvie CHASTANT JURY
PRESIDENT :
M. Jean PARINAUD
ASSESSEURS :
Mme Sylvie CHASTANT
Mme Séverine BOULLIER
MEMBRE INVITE :
Mme Patricia RONSIN
Professeur à l’Université Paul-Sabatier de TOULOUSE
Professeur à l’Ecole Nationale Vétérinaire de TOULOUSE
Maître de Conférences à l’Ecole Nationale Vétérinaire de TOULOUSE Praticien Hospitalier à l'Ecole Nationale Vétérinaire de TOULOUSE
REMERCIEMENTS
AUX MEMBRES DU JURY
A Monsieur le Professeur Jean PARINAUD Professeur à l’Université Paul Sabatier,
Praticien Hospitalier, Biologie de la reproduction, Qui nous fait l’honneur de présider le jury de cette thèse,
Hommage respectueux.
A Madame le Docteur Sylvie CHASTANT – MAILLARD Professeur à l’Ecole Nationale Vétérinaire de Toulouse, Pathologie de la reproduction,
Qui m’a confié ce sujet et aidée dans la réalisation de ce travail,
Pour sa gentillesse et sa disponibilité, Remerciements très chaleureux.
A Madame le Docteur Séverine BOULLIER,
Maître de conférences à l’Ecole Nationale Vétérinaire de Toulouse, Microbiologie – Immunologie – Maladies infectieuses,
Qui a accepté de faire partie du jury de cette thèse,
Sincères remerciements. A Madame le Docteur Patricia RONSIN,
Docteur vétérinaire, Praticien hospitalier, Pathologie de la reproduction,
Membre invité de ce jury de thèse,
Pour avoir participé à la collecte des échantillons,
1
T
ABLE DES MATIERESLISTE DES FIGURES ... 5
LISTE DES TABLEAUX ... 7
INTRODUCTION ... 9
SYNTHESE BIBLIOGRAPHIQUE : LA PSEUDOGESTATION ... 11
A . La pseudogestation chez deux espèces à ovulation provoquée ... 12
I. La pseudogestation chez la lapine... 12
1) Description ... 13
a) Hypothèses hormonales ... 14
b) Influence du stress ... 14
2) Signes cliniques observés ... 14
a) Modifications comportementales ... 14
b) Modifications utérines ... 15
c) Modifications mammaires ... 16
3) Prévalence ... 17
4) Conséquences ... 18
II. La pseudogestation chez la furette ... 19
1) Description ... 19
2) Signes cliniques observés ... 19
3) Modifications utérines ... 19
4) Modifications mammaires ... 20
B. La pseudogestation chez la chienne ... 21
I. Particularités de la physiologie sexuelle de la chienne ... 21
II. Signes associés à une pseudogestation clinique ... 21
III. Causes hormonales ... 22
1) Cas d’une chienne non gestante et n’exprimant pas de signes cliniques marqués de pseudogestation ... 22
2) Cas d’une chienne gestante ... 22
a) Avant mise bas ... 22
b) Après mise bas ... 24
3) Cas d’une chienne présentant une pseudogestation clinique ... 24
IV. Causes comportementales ... 26
V. Prise en charge des chiennes présentant des signes marqués ou persistants ... 26
1) Mesures hygiéniques ... 26
2
b) Effet d’une restriction alimentaire à long terme... 26
2) Traitement médical ... 27
a) Régulation de la synthèse et de la sécrétion de la prolactine ... 27
b) Molécules disponibles... 27
c) Autres traitements ... 31
d) Cas de chiennes réfractaires au traitement ... 32
VI. Effet des pseudogestations sur les tumeurs mammaires ... 32
1) Lien entre prolactine, pseudogestation et tumeurs mammaires ... 32
2) Effet de la cabergoline sur les tumeurs mammaires ... 33
ETUDEEXPERIMENTALE ... 35
A. Matériels et méthodes ... 35
I. Population ... 35
II. Prélèvements ... 35
III. Dosage des immunoglobulines ... 35
1) Principe général ... 35
2) Protocole ... 36
3) Principe d’interprétation des valeurs ... 39
B .Résultats ... 41 I. Description de la population ... 41 1) Format racial ... 41 2) Catégories d’âge ... 41 3) Parité ... 42 4) Moment du cycle ... 42
5) Prélèvements par paire de mamelles ... 42
6) Aspect des sécrétions ... 42
II. Concentrations en immunoglobulines dans le lait de pseudogestation ... 43
1) Concentration moyenne en IgA ... 43
2) Concentration moyenne en IgG ... 44
3) Corrélation entre concentration en IgG et IgA pour un même échantillon ... 45
... 45
4) Facteurs de variation de la concentration en immunoglobulines ... 45
a) Format racial... 45
b) Âge ... 47
c) Moment du cycle ... 49
d) Paire de mamelles ... 50
e) Aspect des sécrétions ... 50 5) Comparaison avec les concentrations en immunoglobulines des laits et des colostrums . 51
3
III. Discussion ... 53
1) Limites de l’étude ... 53
a) Population étudiée ... 53
b) Echantillonnage ... 53
c) Dosage des immunoglobulines ... 54
2) Résultats ... 54
a) Qualité immunologiques des sécrétions de pseudogestation ... 54
b) Comparaison des laits de pseudogestation au lait et au colostrum canins ... 56
c) Facteurs de variation des concentrations en immunoglobulines dans les sécrétions lactées ... 56
d) Lien entre concentration en IgG et IgA dans le lait de pseudogestation ... 57
e) Origine des immunoglobulines dans les sécrétions lactées ... 58
IV. Perspectives ... 60
1) Valeur énergétique des sécrétions de pseudogestation ... 60
2) Utilisation d’une chienne pseudogestante en cas de déficit colostral ... 60
3) Quels risques pour la femelle pseudogestante ? ... 61
4) Quels risques pour les chiots ?... 61
5
L
ISTE DES FIGURESFigure 1 : Réceptivité des lapines en fonction du nombre de jours post partum, d’après Fortun-Lamothe et Bolet (1995). ... 12 Figure 2 : Concentrations plasmatiques en progestérone durant la pseudogestation chez la lapine. La
pseudogestation a été induite par injection de 0,8 µg de GnRH. D’après Boiti et al (2006). ... 13 Figure 3: Fréquence des différents signes cliniques observés lors de pseudogestation chez la lapine de
compagnie, d'après Salissard (2013). ... 14 Figure 4 : Coupe histologique d'un épithélium utérin de lapine durant l’œstrus, d'après Davies et Hoffman (1970). ... 15 Figure 5 : Coupe histologique d'un épithélium utérin de lapine pseudogestante 8 jours après induction de l'ovulation, d'après Davies et Hoffman (1970). ... 16 Figure 6 : Coupe histologique d'un épithélium utérin de lapine pseudogestante 20 jours après induction de l'ovulation, d'après Busch et al. (1986). ... 16 Figure 7 : Présence de deux générations de corps jaunes sur un ovaire de lapine 24 heures après insémination artificielle, d'après Theau-Clément (2008). ... 17 Figure 8 : Bilan - La pseudogestation chez la lapine - Concentrations en progestérone et modifications
morphologiques de l'épithélium utérin. ... 18 Figure 9 : Comparaison des concentrations sériques en progestérone chez des furettes gestantes (formes pleines) et pseudogestantes (formes vides). Ovulation à J0, chaque forme correspond à une technique de dosage : fluorimétrie (ronds), ELISA (carrés) et radioimmunologie (triangles). D'après Heap et Hammond (1974). .... 20 Figure 10 : Evolution des profils hormonaux chez la chienne non gestante, adapté de Concannon (2010). ... 23 Figure 11 : Evolution des profils hormonaux chez la chienne gestante, adapté de Concannon (1986). ... 23 Figure 12 : Concentrations sanguines en prolactine chez des chiennes pseudogestantes entre J0 et J14 :
triangles, groupe placebo ; ronds : chiennes traitées par la bromocriptine ; carrés : chiennes traitées par la cabergoline. D'après Gobello et al (2001d). ... 24 Figure 13 : Concentrations en prolactine et en progestérone chez des chiennes pseudogestantes (ronds noirs) et chez des chiennes en diœstrus n'ayant jamais présenté de signes de pseudogestation, d'après Tsutsui et al (2007). ... 25 Figure 14 : Régulation de la synthèse et de la sécrétion de prolactine (GABA : acide gamma amino-butyrique ; GAP : Gonadotropin releasing hormon Associated Peptid ; TRH : Thyroxin Releasing Hormon ; VIP : Vaso-Intestinal Peptid). D’après Touraine et Goffin (2015). ... 27 Figure 15 : Réponse clinique des chiennes pseudogestantes à la cabergoline 7 et 14 jours après le début du traitement, d’après Gobello et al (2001d). ... 29 Figure 16 : Comparaison de l’évolution des signes cliniques chez les chiennes ayant reçu de la métergoline et celles ayant reçu un placebo, 7 et 14 jours après le début du traitement (grade 0 : glandes mammaires au repos ; grade I : hypertrophie mammaire et sécrétion séreuse ; grade II : hypertrophie mammaire et sécrétion lactée). D'après Castex et al (2002). ... 30 Figure 17 : Degré d'hyperplasie mammaire avant et après traitement avec de la cabergoline chez des chiennes présentant des tumeurs mammaires, d'après Verstegen et Onclin (2004). ... 33 Figure 18 : Degré de difficulté estimé par les chirurgiens pour le retrait des tumeurs mammaires avant et après traitement avec de la cabergoline, d'après Verstegen et Onclin (2004). ... 34 Figure 19 : Principe de l'ELISA "sandwich" ; en bleu, anticorps de capture ; en rouge, immunoglobulines à doser ; en vert et orange, anticorps de révélation. ... 36 Figure 20 : Aspect des échantillons après centrifugation. ... 36 Figure 21 : Exemple de répartition des échantillons et de la gamme étalon pour une plaque ELISA IgG (en gras, échantillons de lait de pseudogestation ; en italique, échantillons de colostrum ; en souligné, échantillons de lait). Les colonnes 11 et 12 contiennent la gamme étalon. ... 38 Figure 22 : Plaque ELISA après l'arrêt de la révélation. ... 38 Figure 23 : Valeurs et graphe obtenus après lecture des densités optiques par le spectrophotomètre. ... 39 Figure 24 : Répartition des chiennes selon leur format racial (n = 31). La première valeur représente le nombre de chiennes incluses dans la catégorie, la deuxième le pourcentage correspondant. ... 41
6
Figure 25 : Répartition des chiennes par catégorie d'âge (n = 31). La première valeur représente le nombre de chiennes incluses dans la catégorie, la deuxième le pourcentage correspondant. ... 41 Figure 26 : Répartition des échantillons selon leur couleur (n = 42). La première valeur représente le nombre de prélèvements inclus dans la catégorie, la deuxième le pourcentage correspondant. ... 42 Figure 27 : Concentrations en IgA dans les laits de pseudogestation pour chaque échantillon (n = 42). La ligne horizontale représente la moyenne. ... 43 Figure 28 : Distribution des concentrations en IgA des laits de pseudogestation (n = 42). ... 43 Figure 29 : Concentrations en IgG dans les laits de pseudogestation pour chaque échantillon (n = 41). La ligne horizontale représente la moyenne. ... 44 Figure 30 : Distribution des concentrations en IgG des laits de pseudogestation (n = 41). ... 44 Figure 31 : Corrélation entre les concentrations en IgG et IgA du lait de pseudogestation (n = 41 ; p = 0,015 ; r = 0,48). ... 45 Figure 32 : Concentration en IgA en fonction du poids de la chienne (n = 42 ; p = 0,03 ; r = 0,32). ... 46 Figure 33 : Concentrations en IgG en fonction du poids de la chienne (n = 41 ; p = 0,23 ; r = 0,19). ... 46 Figure 34 : Concentrations en IgA et IgG (moyenne ± écart type) suivant le format racial (n = 42 pour les IgA et n = 42 pour les IgG ; p = 0,01 pour les IgA et p = 0,35 pour les IgG). L’étoile montre que les catégories petit format racial et grand format racial sont différentes pour les IgA (p = 0,01). ... 47 Figure 37 : Concentrations moyennes en IgA et IgG (moyenne ± SD) suivant les catégories d'âge (n = 42 pour les IgA et n = 41 pour les IgG ; p = 0,01 pour les IgA et p = 0,15 pour les IgG). L’étoile montre que les
catégories moins de deux ans et plus de 6 ans sont différentes pour les IgA (p = 0,04). ... 49 Figure 38 : Concentrations en immunoglobulines (moyenne ± SD) en fonction du moment du cycle (n = 41). .. 49 Figure 39 : Concentrations moyennes en IgA et IgG en fonction de l'aspect des sécrétions de pseudogestation (n = 42 pour les IgA et n = 41 pour les IgG ; p = 0,051 pour les IgA et 0,47 pour les IgG). ... 51 Figure 40 : Concentrations moyennes en IgA et IgG dans les laits de pseudogestation, les colostrums et les laits (n = 42 et 41 pour les laits de pseudogestation ; n = 9 pour les laits et colostrum sauf pour les IgG des
colostrums où n = 21 ; p = 0,12 pour les IgA ; p < 0.0001 pour les IgG). L’étoile montre que les concentrations en IgG du lait de pseudogestation et du lait sont différentes (p < 0,0001). ... 52 Figure 41 : Pourcentage des différentes classes d'Ig (G et A) au cours de la lactation chez la chienne, d'après Albaret (2016). ... 58
7
L
ISTE DES TABLEAUXTableau 1 : Concentration en IgA par paires de mamelles (g/L) : ... 50 Tableau 2 : Concentration en IgG par paires de mamelles (g/L) : ... 50 Tableau 3 : Valeurs en IgG du colostrum obtenues dans la littérature, d'après Schäfer et Somi et al (2005) ; Bertieri (2012) ; Mila et al (2015) et Albaret (2016) :... 55 Tableau 4 : Valeurs moyennes en IgG et IgA pour le lait obtenues dans la littérature, d'après Schäfer- Somi et al (2005) ; Bertieri (2012) et Albaret (2016) : ... 55 Tableau 5 : Compositions énergétiques du colostrum et du lait à J3 et J14, d'après Chastant et Mila (2016). ... 60
9
I
NTRODUCTIONLa mortalité néonatale est très fréquente dans l’espèce canine, et constitue un enjeu en matière d’élevage : en effet, environ 20% des chiots meurent avant l’âge de 21 jours. Selon les études, les taux de mortalité néonatale varient entre 6,9% (Indrebo et al. 2007) et 10 % (Nielen et al. 1998) des chiots nés vivants, avec une répartition hétérogène : en effet, la mortalité néonatale précoce (durant les sept premiers jours de vie) varie entre 3,9% (Tonnessen et al. 2012) et 46,9% des nés vivants (Nielen et al. 1998), tandis que les valeurs de mortalité néonatale tardive (entre 8 et 21 jours de vie) sont proportionnellement moins élevées, entre 1,2 % (Indrebo et al. 2007) et 16,5 % (Nielen et al. 1998) des chiots nés vivants.
A sa naissance, le chiot possède un système immunitaire immature (Tizard 2013), et est quasiment dépourvu d’immunoglobulines : en effet, la placentation endothéliochoriale zonaire de la chienne ne permet le passage que d’une très faible partie des anticorps via la barrière placentaire (Dall’Ara et al. 2015). La majorité des anticorps est donc transférée au chiot après sa naissance, via le colostrum. Il s’agit de la première sécrétion mammaire produite après la mise-bas, qui permet un apport énergétique et immunologique au chiot. Celui de la chienne est particulièrement riche en immunoglobulines : 20 à 30 g/L d’immunoglobulines de type G (Coinus 2014 ; Mila et al. 2015), qui participent à l’immunité systémique, et environ 10 g/L d’immunoglobulines de type A, qui participent à l’immunité locale (Chabanne 2006 ; Tizard 2013 ; Albaret 2016).
Un déficit en immunoglobulines dans les premiers jours de vie est péjoratif à la survie du chiot : le taux de survie des chiots âgés de deux jours ayant un taux circulant d’immunoglobulines G de moins de 230 mg/dL est significativement inférieur à celui de ceux dont la concentration est supérieure à ce seuil (Mila et al. 2014). La prise d’un colostrum de qualité, en quantité suffisante, et avant la fermeture de la barrière intestinale est donc un facteur clé de la survie (Chastant-Maillard et al. 2012).
Dans l’espèce bovine, les éleveurs ont la possibilité d’apporter au veau du colostrum congelé ou des substituts colostraux, permettant un apport acceptable en immunoglobulines (Quickley et al. 2002 ; Jones et al. 2004). Des spécialités vétérinaires de lactosérum bovin contenant des immunoglobulines G sont disponibles, et peuvent être utilisées durant les douze premières heures de vie du veau (Locatim®, Merial, Lyon, France).
Chez le chien, aucun substitut colostral n’est disponible (le lait maternisé disponible n’apporte pas d’immunoglobulines), et aucune étude ne permet de déterminer si l’utilisation des substituts bovins (anticorps hétérologues dirigés contre des pathogènes bovins) serait efficace. L’adoption par une autre chienne ayant mis bas le même jour ou la veille est l’alternative idéale mais cette solution est peu fréquemment possible. De plus, l’utilisation du sérum canin par voie orale ne permet pas d’atteindre le taux minimal d’immunoglobulines protecteur (Chastant-Maillard et Mila 2016).
Les sources les plus logiques d’immunoglobulines seraient donc les sécrétions mammaires canines. La chienne peut produire des sécrétions lactées de trois types : le
10 colostrum, le lait, ainsi qu’une sécrétion produite pendant la pseudogestation, qui survient à la fin du diœstrus chez la chienne non gestante.
Le colostrum n’est sécrété que pendant les deux premiers jours post partum. De plus, sa concentration en IgG de l’ordre de 20 g/L lors de la mise-bas chute très rapidement, et perd 50 à 70% de sa valeur initiale au cours des premières 24 heures par épuisement du stock en IgG du tissu mammaire (Albaret 2016). Il n’est pas conseillé de traire une chienne au cours des premières heures (pour contribuer à une banque colostrale par exemple) de façon à ne pas dégrader la qualité colostrale pour les chiots de sa propre portée avant la fermeture de leur barrière intestinale.
Au-delà des 48 premières heures, la chienne produit du lait, sécrétion dont la concentration en IgG est faible, d’environ 1 g/L (Chabanne 2006 ; Albaret 2016). La composition immunologique du troisième type de sécrétion, le lait de pseudogestation, est inconnue.
L’objectif de notre étude a été de déterminer si le lait produit au cours de la pseuogestation se rapproche en ce qui concerne les concentrations en immunoglobulines d’une sécrétion de type colostrale ou lactée ; et dans une perspective plus large, s’il pourrait être utilisé comme substitut colostral.
La partie bibliographique qui suit s’intéresse aux espèces chez lesquelles une lactation de pseudogestation est décrite : parmi elles, deux espèces à ovulation provoquée, la lapine et la furette ; ainsi que la chienne, espèce à ovulation spontanée.
11
S
YNTHESE BIBLIOGRAPHIQUE:
LA PSEUDOGESTATIONChez les mammifères, l’œstrus signe une croissance folliculaire terminale, permise par la FSH (Follicle Stimulating Hormon). L’ovulation suit le pic de LH (Luteinizing Hormon) d’environ 24 à 48 heures. Certaines espèces ovulent spontanément, c’est le cas de la chienne, la chèvre et la vache. Chez les espèces à ovulation provoquée, comme la chatte ou la furette, c’est l’accouplement ou la stimulation mécanique vaginale qui provoque le pic de LH et ensuite l’ovulation.
Après l’ovulation, la granulosa folliculaire se lutéinise, formant le corps jaune qui sécrète de la progestérone : c’est la phase de diœstrus. Chez la chienne et les primates, la sécrétion de progestérone débute avant l’ovulation. Chez la plupart des animaux, une faible sécrétion de LH permet le maintien du corps jaune pendant la première moitié du diœstrus. Chez les rongeurs et chez la chienne, la prolactine y contribue. En l’absence de gestation, le corps jaune régresse, après une période variable suivant les espèces (Gayrard 2007). Chez la femelle gestante, le corps jaune se maintient pendant toute la durée de la gestation. Il produit de la progestérone, nécessaire au maintien de la gestation. Son maintien est également permis par d’autres hormones, notamment la prolactine (Concannon 2010).
La pseudogestation se définit par une persistance du corps jaune en l’absence de gestation, associée à des modifications comportementales et/ou morphologiques comparables à celles du péripartum (Allen 1986).
Certains auteurs généralisent la pseudogestation à tout phénomène entraînant la persistance du corps jaune au-delà de la durée d’une phase lutéale, en l’absence de gestation. Si l’on considère cette définition, la pseudogestation est décrite chez de nombreux mammifères : chez les félins comme la chatte (Paape et al. 1975) ou le lynx (Jewgenow et al. 2014), certains mustélidés (Heap et Hammond 1974), les rongeurs (Smith et al. 1975), mais aussi la chèvre (Duquesnel et al. 1992). Des cas sporadiques sont décrits chez l’ours (Schulz et al. 2003) et chez certains primates (Guedes et Young 2004). Chez la femme, la pseudogestation, appelée pseudocyèse, existe chez des personnes qui pensent être enceintes, et qui présentent des signes cliniques de grossesse (aménorrhée, augmentation du volume abdominal). Les cas les plus courants surviennent dans des pays en voie de développement, en milieu rural, où les outils de diagnostic sont peu présents (Tarin et al. 2013).
Une sécrétion lactée peut se mettre en place à la fin de la pseudogestation. Elle est décrite chez la lapine, la furette et la chienne. Cette partie bibliographique s’intéresse donc à ces espèces qui présentent une lactation de pseudogestation.
12
A . La pseudogestation chez deux espèces à ovulation provoquée
I.
La pseudogestation chez la lapine
La lapine présente des cycles œstraux irréguliers. L’ovulation est provoquée par un réflexe neuroendocrinien (qui fait suite à l’accouplement) ou par l’administration de GnRH (notamment utilisée en élevage pour synchroniser les inséminations artificielles). Si elle est suivie d’une fécondation, la lapine devient gestante pour une période d’environ 31 jours (Fortun-Lamothe et Bolet 1995).
Le mode de reproduction le plus utilisé en élevage actuellement est la conduite en bandes : l’ovulation est induite en même temps sur un groupe de lapines de façon à obtenir une synchronisation des ovulations puis des gestations ; l’insémination suivante se fait généralement à 11 jours post partum. La lapine d’élevage se trouve donc en lactation au moment de l’insémination, voire de la gestation suivante (Theau-Clément 2008).
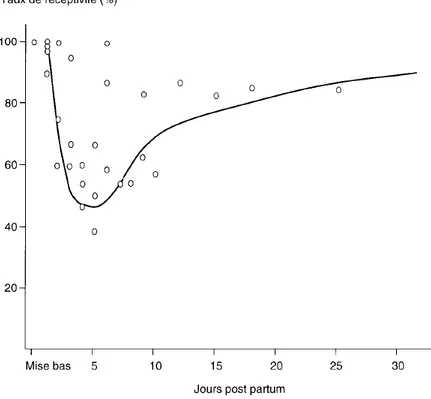
Ainsi, l’insémination doit être réalisée à un moment où la lapine est réceptive, en œstrus, c’est-à-dire au moment où elle est apte à ovuler, être fécondée et mener une gestation à terme. En pratique, une lapine est dite réceptive si elle adopte une position de lordose et accepte l’accouplement avec un mâle. Cette réceptivité (Figure 1) est élevée le jour de la mise bas, puis chute à 4 jours post partum pour ensuite croître à nouveau jusqu’à après le sevrage (Fortun-Lamothe et Bolet 1995).
Figure 1 : Réceptivité des lapines en fonction du nombre de jours post partum, d’après Fortun-Lamothe et Bolet (1995).
13 La croissance folliculaire du cycle suivant se fait pendant la gestation, ce qui permet l’obtention de follicules préovulatoires en postpartum (Theau-Clément 2008b).
1) Description
Le phénomène de pseudogestation est très étudié chez la lapine, le plus souvent pas en tant que tel mais pour comprendre les mécanismes d’implantation embryonnaire.
Des corps jaunes ont été observés chez des lapines qui refusaient l’accouplement en période postpartum ou chez des lapines qui n’avaient jamais été mises à la reproduction. Ces corps jaunes produisent de la progestérone, que l’on peut mettre en évidence dans le sang. Au-delà de 1 ng de progestérone par mL de sang, la lapine présente un syndrome dit d’hyperprogestéronémie : elle est pseudogestante. Cette valeur est un consensus établi par les chercheurs, basé sur le fait qu’il existe une corrélation négative entre les lapines qui ont une valeur de progestéronémie supérieure à 1 ng/mL et le pourcentage de fécondation chez celles-ci en post partum (Theau-Clément, 2005).
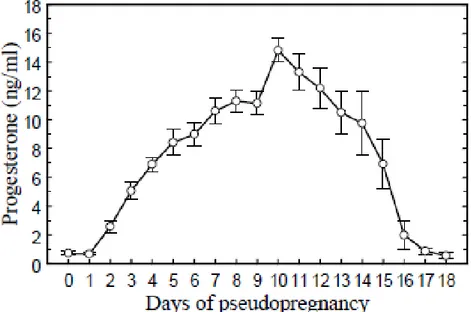
La pseudogestation est plus courte que la gestation, et dure entre 16 et 18 jours, période pendant laquelle les valeurs en progestérone restent élevées (Boiti et al. 2006).
La comparaison des concentrations sanguines en progestérone chez les femelles pseudogestantes (Figure 2) et gestantes ne montre pas de différence jusqu’à 12 jours après l’ovulation. Les concentrations en progestérone sont maximales dix jours environ après l’ovulation, autour de 15 ng/mL. Lors de pseudogestation, la concentration diminue progressivement pour atteindre des valeurs de l’ordre de 1 ng/mL entre J16 et J18. En cas de gestation, les concentrations diminuent également après J10 mais les valeurs restent élevées, entre 4 et 7 ng/mL, jusqu’à trois jours avant la mise bas (Browning 1980).
Figure 2 : Concentrations plasmatiques en progestérone durant la pseudogestation chez la lapine. La pseudogestation a été induite par injection de 0,8 µg de GnRH. D’après Boiti et al
14 a) Hypothèses hormonales
La cause exacte de ce phénomène est inconnue, mais plusieurs hypothèses ont été formulées : la plus probable serait la survenue d’une ovulation spontanée. En effet, en post partum immédiat, le jour même de la mise bas, la lapine se trouve dans une période de haute réceptivité (Figure 1) ; les stimuli extérieurs, tels que la monte par une autre femelle, peuvent facilement déclencher l’ovulation (Fortun-Lamothe et Bolet 1995; Theau-Clément 2008b).
Une autre possibilité serait la présence d’un corps jaune préexistant à durée de vie prolongée, avec un échec ou une inhibition du mécanisme de lutéolyse (les causes sont inconnues) ; ou encore une lutéinisation partielle de follicules préovulatoires (Boiti et al. 2006).
b) Influence du stress
Une étude de cas (Carter et al. 2016) rapporte une pseudogestation chez une lapine domestique après cohabitation avec une congénère agressive. Les signes cliniques mis en évidence étaient l’arrachage des poils et la construction d’un nid après séparation d’avec l’agresseur. Une ovariohystérectomie pratiquée dans le cadre de l’étude a permis la mise en évidence de corps jaunes bilatéraux associé à une hyperplasie de la muqueuse utérine.
2) Signes cliniques observés
a) Modifications comportementales
Les signes cliniques de pseudogestation sont rarement observés en élevage et peuvent être confondus avec ceux du post partum, étant donné l’enchaînement rapide des cycles. Les propriétaires de lapines de compagnie rapportent le plus souvent des comportements de nidification : dans l’étude de Salissard (2013) réalisée sur 358 femelles entières, plus de 80% des lapines pseudogestantes utilisent du foin ou leur propre poil qu’elles arrachent pour réaliser un nid (Figure 3). Des modifications mammaires telles qu’hypertrophie mammaire, voire montée de lait surviennent dans environ un tiers des cas.
Figure 3: Fréquence des différents signes cliniques observés lors de pseudogestation chez la lapine de compagnie, d'après Salissard (2013).
15 b) Modifications utérines
En œstrus, l’épithélium utérin est cylindrique (Figure 4). En début de pseudogestation, le tissu utérin subit des modifications identiques à celles qui se produisent lors de la gestation. On distingue plusieurs phases, J0 correspondant à l’induction de l’ovulation. Dans les premières 24h après induction de l’ovulation, aucun changement morphologique n’a lieu, mais de nombreux leucocytes envahissent l’épithélium. . Entre J1 et J4, la phase proliférative a lieu : l’épithélium subit de nombreuses mitoses, et devient pseudostratifié. Les glandes endométriales prolifèrent. Entre J4 et J6, la structure épithéliale se modifie à nouveau pour redevenir simple et former une seule couche cellulaire. Ce processus permet une augmentation de la surface disponible pour d’éventuelles interactions avec le trophoblaste.
Entre J6 et J8, les cellules de l’épithélium fusionnent et deviennent plurinucléées (Figure 5) ; la fusion est maximale à J7, correspondant au jour éventuel de l’implantation. Entre J8 et J13, le nombre de cellules multinucléées est maximal. Durant toute cette période de prolifération, les changements morphologiques de l’épithélium sont corrélés à l’augmentation des concentrations sanguines en progestérone (Davies et Hoffman 1970 ; Abd-Elkareem 2017).
Figure 4 : Coupe histologique d'un épithélium utérin de lapine durant l’œstrus, d'après Davies et Hoffman (1970).
16 Figure 5 : Coupe histologique d'un épithélium utérin de lapine pseudogestante 8 jours après
induction de l'ovulation, d'après Davies et Hoffman (1970).
Ces modifications sont identiques en gestation et pseudogestation. Cependant le processus de fusion semble plus avancé lors de la gestation. En pseudogestation, et donc en l’absence d’implantation, l’épithélium dégénère entre J14 et J16 par des phénomènes d’apoptose et de desquamation cellulaire (Figure 6). Le retour à un épithélium cylindrique et formé de cellules ciliées se fait entre J24 et J28. Ces derniers changements morphologiques sont retardés par rapport à la chute des concentrations sanguines en progestérone, et seraient plutôt corrélés à l’augmentation des concentrations en œstradiol (Busch et al 1986).
Figure 6 : Coupe histologique d'un épithélium utérin de lapine pseudogestante 20 jours après induction de l'ovulation, d'après Busch et al. (1986).
c) Modifications mammaires
De même que pour l’endomètre utérin, l’hypertrophie mammaire qui se met en place lors de la pseudogestation est corrélée à l’augmentation des concentrations en progestérone.
17 Cependant, contrairement à la gestation, les mamelles se développent de façon moins importante (notamment en épaisseur). La lactation se met en place uniquement à la fin de la pseudogestation, 19 jours après l’induction de l’ovulation. La substance produite est visuellement semblable à du lait obtenu après une mise bas, et contient des globules gras (Hammond et Marshall 1914).
3) Prévalence
La prévalence des pseudogestations est assez importante en élevage : les premières études montrent que 21% des lapines présentent un syndrome d’hyperprogestéronémie en post partum, avant l’induction de l’ovulation (Boiti et al. 1996). Des études plus récentes mettent en évidence des valeurs similaires avec 25,9% de lapines hyperprogestéronémiques à 11 jours post partum (Theau-Clément et al. 2008).
De plus, 20% des lapines primipares inséminées entre J0 et J19 post partum présentent deux générations de corps jaunes 24 heures après l’insémination (Figure 7) : une génération de corps jaunes récents, correspondant à l’injection de GnRH, et une génération de corps jaunes plus anciens et proéminents, qui sont des corps jaunes de pseudogestation (Theau-Clément 2008b).
Figure 7 : Présence de deux générations de corps jaunes sur un ovaire de lapine 24 heures après insémination artificielle, d'après Theau-Clément (2008).
La prévalence de cette affection varie en fonction de la parité : 31,2% des lapines primipares sont pseudogestantes, contre 12,2% des lapines secondipares (Theau-Clément et al. 2008). Une autre étude conforte les mêmes résultats : 16% des lapines nullipares sont pseudogestantes, contre 32,5% des lapines primipares et 4% des lapines multipares. De plus, les lapines en lactation sont également plus fréquemment pseudogestantes que celles qui se trouvent hors lactation (Theau-Clément et al. 2005).
Enfin, le type de logement influence la survenue de pseudogestations : 23% des lapines logées en groupe présentent ce syndrome, alors qu’il n’est pas observé chez des lapines logées individuellement (Rommers et al. 2006). Un questionnaire diffusé auprès de 57 propriétaires et éleveurs de lapins de compagnie et portant sur 358 lapines montre que 68,4% des lapines ont présenté au moins une fois dans leur vie une pseudogestation. Celle-ci est définie dans cette étude par la présence de signes cliniques : nervosité, nidification, hypertrophie mammaire ou production du lait (les concentrations sériques en progestérone n’ont pas été mesurées). Les
18 mêmes tendances qu’en élevage sont retrouvées : les femelles qui cohabitent dans le même enclos sont plus à même de développer une pseudogestation. La plupart du temps, les propriétaires sont capables de rapprocher l’épisode d’un stimulus déclenchant : monte entre femelles, chevauchement par un mâle castré ou échec de saillie. La moyenne d’âge de survenue de la pseudogestation est de 1,5 ans (avec des valeurs très disparates comprises entre 3 mois et 5 ans). La durée des signes cliniques est évaluée à 6,4 jours (là encore avec une forte variabilité, entre 1,5 et 30 jours) (Salissard 2013).
4) Conséquences
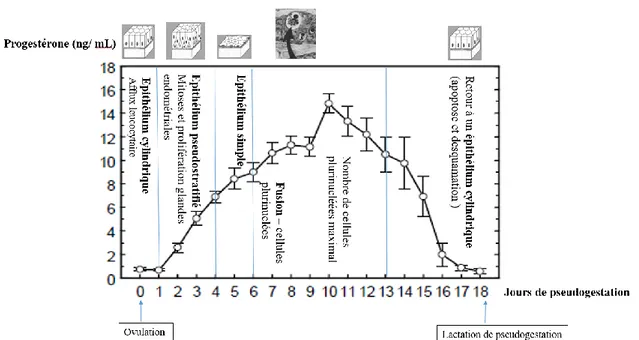
Ce phénomène impacte de façon importante les performances de reproduction en élevage cunicole, car l’imprégnation progestéronique peut inhiber la sécrétion des gonadotropines et le neuroréflexe indispensables à l’ovulation. Dans les cas où l’ovulation a quand même lieu, l’imprégnation progestéronique est responsable d’effets anti-reproductifs : diminution du pourcentage de fécondation ou de mise bas. En effet, le pourcentage de mise bas après saillie chez les lapines hyperprogestéronémiques est de 9 % contre 88% chez des lapines ne présentant pas de pseudogestation (Rommers et al. 2006). La figure 8 résume l’évolution des concentrations en progestérone et de l’épithélium utérin au cours de la pseudogestation chez la lapine :
Figure 8 : Bilan - La pseudogestation chez la lapine - Concentrations en progestérone et modifications morphologiques de l'épithélium utérin.
19
II.
La pseudogestation chez la furette
Des cas de pseudogestation sont décrits chez les Mustélidés, principalement chez la furette domestique, mais également chez le vison et le glouton (Mead et al. 1993).
La furette présente une reproduction saisonnée en jours longs, associée à une ovulation provoquée. Elle est en œstrus permanent de fin mars à début août ; durant cette période, une cohorte folliculaire est toujours disponible, permettant l’ovulation en cas de stimulus. Comme chez la lapine, cette ovulation peut être provoquée par une stimulation du col de l’utérus lors du coït ou par l’administration d’hCG (human Chorionic Gonadotropin) (Lindeberg 2008).
Très peu de données sont disponibles sur la pseudogestation chez la furette, et les sources sont relativement anciennes. Sa prévalence n’est pas connue.
1) Description
Si l’ovulation est suivie d’une fécondation, la furette devient gestante durant 41 jours environ (39 à 42 jours). En l’absence de fécondation, le corps jaune persiste pour une durée équivalente à celle de la gestation, 40 à 42 jours : la furette est pseudogestante (Lindeberg 2008).
Les concentrations sanguines en progestérone sont identiques au cours de la gestation et de la pseudogestation (Heap et Hammond 1974). Les valeurs maximales en progestérone sont atteintes 14 jours après l’ovulation, avec des valeurs pouvant aller jusqu’à 50 ng/mL (Figure 9).
2) Signes cliniques observés
De même que chez la lapine, des comportements de nidification peuvent être observés. On remarque également une augmentation du volume mammaire, et une prise de poids inconstante (Blancher 2003).
3) Modifications utérines
Les modifications utérines sont, comme chez la lapine, identiques en pseudogestation et gestation. En anœstrus, l’épithélium utérin est cubique. Après l’ovulation il devient cylindrique puis pseudostratifié à partir de J4. De nombreuses mitoses ont lieu. Dix à douze jours après le début de l’ovulation, moment qui correspond à l’implantation dans le cas d’une gestation, les cellules épithéliales deviennent de plus en plus grandes jusqu’à se regrouper pour former un syncitium. Ces cellules plurinucléées persistent jusqu’à 25 à 30 jours après le début de la pseudogestation. Puis, 35 à 40 jours après l’ovulation, l’épithélium redevient cubique par les mêmes phénomènes cellulaires que ceux observés chez la lapine (Hammond et Marshall 1930 ; Buchanan 1966).
20 Figure 9 : Comparaison des concentrations sériques en progestérone chez des furettes gestantes (formes pleines) et pseudogestantes (formes vides). Ovulation à J0, chaque forme
correspond à une technique de dosage : fluorimétrie (ronds), ELISA (carrés) et radioimmunologie (triangles). D'après Heap et Hammond (1974).
4) Modifications mammaires
L’évolution du tissu mammaire est comparable en gestation et pseudogestation. Les mamelles s’hypertrophient dans un premier temps en direction de la ligne blanche ; puis à partir de la troisième semaine, l’hypertrophie se fait dans toutes les directions. Les structures alvéolaires puis la sécrétion lactée se mettent en place à la fin de la pseudogestation, cinq semaines et demi environ après l’ovulation. La durée de la pseudogestation étant la même que celle de la gestation, le développement des glandes mammaires est plus complet que chez la lapine.
Ces deux femelles à ovulation provoquée, lapine et furette, peuvent donc exprimer en fin de diœstrus une pseudogestation clinique. La principale différence entre ces deux espèces est la durée de la pseudogestation : moitié de celle de la gestation chez la lapine et durée identique à celle de la gestation chez la furette. Ainsi, chez la lapine, le développement de la glande mammaire est partiel.
21
B. La pseudogestation chez la chienne
I.
Particularités de la physiologie sexuelle de la chienne
La chienne est une espèce monœstrienne, qui ne présente qu’un seul cycle sexuel par période de reproduction. C’est une espèce à ovulation spontanée : celle-ci se produit en fin d’œstrus et survient deux jours après le pic de LH. La phase lutéale, ou diœstrus, a une durée de 50 à 80 jours, quasiment identique à la durée de la gestation (qui dure 63 jours environ). Ainsi, à chaque cycle, un corps jaune est présent pendant environ 2 mois (Concannon 2010).
De ces particularités découlent encore deux définitions de la pseudogestation, cette fois-ci propres à la chienne. On peut choisir de considérer toute chienne en diœstrus comme pseudogestante, même si aucun signe clinique n’est présent. C’est ce qui est nommé dans la littérature anglosaxone « covert pseudopregnancy », pseudogestation sécrète, cachée. Selon cette définition, la pseudogestation est donc un phénomène physiologique, qui se produit chez toutes les chiennes. Au cours de chaque cycle, des modifications morphologiques sont présentes, notamment au niveau du tissu mammaire ; la plupart du temps, elles passent inaperçues.
Cependant, certaines chiennes expriment des signes cliniques marqués lors du diœstrus, principalement dans sa dernière partie ; on retrouve dans la littérature le terme d’« overt
pseudopregnancy », pseudogestation exprimée, visible (Concannon et al. 2009).
II.
Signes associés à une pseudogestation clinique
Peu d’études s’intéressent à la prévalence de cette affection, mais 50 à 75% des chiennes non stérilisées présenteraient au moins une fois dans leur vie une pseudogestation clinique. Parmi celles-ci, 7% présenteraient des lactations irrégulières (Gobello et al. 2001a ; Mir et al, 2013). De plus, les valeurs sont variables suivant les études, en fonction des critères choisis pour définir l’occurrence d’une pseudogestation, selon par exemple que la définition repose sur l’hypertrophie mammaire ou sur la présence d’une lactation (Razzaque et al. 2008 ; Fontbonne 2016).
La pseudogestation se manifeste par des signes comportementaux comparables à ceux de la chienne en période péripartum comme la nidification, le maternage d’objets, ou l’adoption des chiots d’une autre chienne. D’autres signes moins fréquents tels que de l’agitation, de l’anorexie, de l’agressivité ou encore le léchage de l’abdomen peuvent être présents. Ces signes apparaissent six à vingt semaines après le début de l’œstrus.
Des modifications physiques peuvent coexister et apparaissent en général dans un second temps : prise de poids, augmentation du volume mammaire, production et sécrétion de lait, et parfois des contractions abdominales mimant celles de la parturition.
D’autres signes peuvent survenir mais sont beaucoup moins fréquents : vomissements, diarrhée, polyuro-polydipsie, polyphagie (Gobello et al 2001c ; Razzaque et al. 2008 ; Fontbonne 2016). Les complications de type infectieux (mammites) sont rares : elles
22 surviennent dans environ 2% des cas et peuvent apparaître suite à un léchage prolongé (Fontaine et al 2017).
Le diagnostic différentiel doit d’abord se faire avec une réelle gestation : en effet, certaines chiennes peuvent produire des sécrétions lactées jusqu’à deux semaines avant la mise bas. Il faut également distinguer la pseudogestation d’un pyomètre, qui survient au même moment du cycle et peut provoquer une distension abdominale, des troubles digestifs et une polyuro-polydipsie.
III. Causes hormonales
La pseudogestation implique des mécanismes proches de ceux de la gestation et du diœstrus, qui sont expliqués dans les deux paragraphes suivants.
1) Cas d’une chienne non gestante et n’exprimant pas de signes cliniques marqués de pseudogestation
Le diœstrus peut être séparé en deux parties : une première où le corps jaune sécrète de façon importante de la progestérone, jusqu’à un plateau (15 à 80 ng/mL) entre le vingtième et le trente-cinquième jour après le pic de LH ; puis la production diminue jusqu’à des valeurs basales inférieures à 1 ng/mL environ 70 jours après le pic de LH (Figure 10).
Pendant la première phase, la progestérone en concentration importante stimule la production de GH (hormone de croissance) au niveau mammaire. Ceci permet la prolifération du tissu mammaire. La progestérone entraîne également l’hyperplasie de l’endomètre utérin et une hypertrophie des glandes endométriales. Enfin, elle est inhibitrice de la sécrétion de prolactine.
En deuxième partie de diœstrus, le corps jaune régresse : les concentrations décroissantes de progestérone permettent la levée de l’inhibition exercée sur la prolactine. En retour, cette dernière devient lutéotrophe et autorise le maintien du corps jaune pendant la fin du diœstrus. La prolactine permet également la différenciation finale du tissu mammaire. Souvent, ces modifications mammaires présentes à chaque cycle ne sont que peu visibles ; elles peuvent être mises en évidence par palpation (Kooistra et Okkens 2001, 2002 ; Concannon et al. 2009).
2) Cas d’une chienne gestante
a) Avant mise bas
Les concentrations en progestérone sont identiques chez la chienne gestante et non gestante. Cependant, la croissance et la décroissance de la progestéronémie sont plus rapides chez la chienne gestante. De plus, le catabolisme hépatique de la progestérone est plus rapide lors de la gestation; le corps jaune gestationnel produit donc l’hormone en quantité plus importante (Verstegen-Onclin et Verstegen 2008 ; Concannon 2010) (Figure 11).
La relaxine, produite par le placenta, est la seule protéine spécifique de la gestation connue chez la chienne. Elle permet le maintien de la production de progestérone par le corps jaune, et
23 indirectement l’augmentation de la sécrétion de prolactine (Concannon et al. 2009). La prolactinémie augmente comme chez la chienne non gestante après la première moitié de la gestation ; cependant elle continue d’augmenter jusqu’à la mise bas, et est présente dans des concentrations plus importantes qu’hors gestation. Sa valeur est maximale le jour de la parturition, supérieure à 40 ng/mL (Concannon 1986 ; Kooistra et Okkens 2001).
Figure 10 : Evolution des profils hormonaux chez la chienne non gestante, adapté de Concannon (2010).
Figure 11 : Evolution des profils hormonaux chez la chienne gestante, adapté de Concannon (1986).
24 b) Après mise bas
L’ocytocine permet l’éjection du lait en stimulant la contraction des cellules alvéolaires mammaires. Elle est libérée par la neurohypophyse en réponse à un stimulus mécanique comme la tétée. La prolactine permet le maintien de la lactation (Abdou 2012 ; Concannon 2010).
3) Cas d’une chienne présentant une pseudogestation clinique
Les mécanismes exacts de déclenchement des pseudogestations cliniques n’ont pas encore été entièrement élucidés. Une pseudogestation clinique peut se développer dans différentes circonstances : spontanément, à la fin du diœstrus, sans qu’il ne semble y avoir de facteur déclenchant ; après une ovariectomie chez une chienne en diœstrus ; à la fin d’un traitement progestatif de longue durée et enfin en réponse à des traitements anti-progestatifs (des cas sont décrits après utilisation d’aglépristone) (Fontbonne 2016).
Historiquement, les auteurs pensaient que la pseudogestation était due à une surproduction de progestérone ou à une persistance anormalement longue du corps jaune, car pseudogestation et pyomètre avaient lieu au même moment du cycle. Les études actuelles ne permettent pas de trancher sur la comparaison de la progestéronémie des chiennes gestantes et pseudogestantes : certaines mettent en évidence une progestéronémie plus élevée chez les chiennes gestantes que chez des chiennes présentant une pseudogestation clinique (Ozyurtlu et Alaçam 2006), d’autres ne montrent pas de différence significative entre les deux groupes (Gobello et al 2001d).
Par contre, le rôle de la prolactine a été clairement démontré : des chiennes présentant des signes cliniques de pseudogestation traitées avec des inhibiteurs de la prolactine (bromocriptine ou cabergoline) voient leur concentration sanguine en prolactine diminuer, corrélativement avec les signes cliniques associés à la pseudogestation (Gobello et al 2001d). Chez les chiennes non traitées, le taux de prolactine reste élevé (Figure 12).
Figure 12 : Concentrations sanguines en prolactine chez des chiennes pseudogestantes entre J0 et J14 : triangles, groupe placebo ; ronds : chiennes traitées par la bromocriptine ; carrés
25 La prolactinémie des chiennes pseudogestantes se situe suivant les études entre 13,8 ng/mL et 17,70 ng/mL (Gobello et al 2001b ; Tsutsui et al. 2007), pour des valeurs comprises entre 2,9 ng/mL et 6,3 ng/mL chez des chiennes au même stade du cycle mais n’exprimant aucun signe clinique. Elle semblerait donc en moyenne être plus haute chez les chiennes pseudogestantes (Figure 13).
Figure 13 : Concentrations en prolactine et en progestérone chez des chiennes pseudogestantes (ronds noirs) et chez des chiennes en diœstrus n'ayant jamais présenté de
signes de pseudogestation, d'après Tsutsui et al (2007).
Cependant, de grandes variations interindividuelles sont notées. Certaines chiennes avec des valeurs de prolactine basses peuvent développer une pseudogestation avec des signes cliniques très marqués, et inversement, comme on peut le voir sur la figure 13 (Tsutsui et al. 2007). La valeur absolue de la prolactinémie n’est pas toujours corrélée à l’intensité des signes observés. Une augmentation forte de la prolactinémie suite à une décroissance abrupte des concentrations en progestérone semble favoriser l’apparition d’une pseudogestation clinique, mais là encore uniquement chez certaines chiennes (Gobello et al. 2001a). On ne sait donc pas si c’est plutôt la valeur absolue ou la cinétique de la prolactinémie qui est en cause.
Outre les variations quantitatives de la prolactine, sur le plan qualitatif, il existe plusieurs formes de prolactine circulante chez la chienne. L’utilisation de la chromatographie révèle l’existence de 4 fragments de tailles différentes. Néanmoins, ils sont présents en proportion comparable que les chiennes soient pseudogestantes ou non (Gobello et al. 2001b). Une explication à cette variabilité importante en ce qui concerne les concentrations en progestérone et prolactine chez les chiennes pseudogestantes serait une différence de sensibilité à la prolactine suivant les chiennes. Certaines races seraient prédisposées, le beagle notamment, mais aucune étude ne comporte assez de chiennes pour mettre en évidence des différences interraciales. Une explication à cette différence de sensibilité serait que certaines races ont une phase lutéale plus courte, pouvant entrainer une décroissance abrupte en progestérone
26 responsable de la pseudogestation. Enfin, il semble exister une prédisposition individuelle : les chiennes ayant un historique de pseudogestation auraient une probabilité plus importante de développer à nouveau une pseudogestation clinique (Gobello et al, 2001c).
IV.
Causes comportementales
Certains auteurs évoquent une origine sociale à la pseudogestation, un comportement vestigial qui permettrait de nourrir la portée d’une autre femelle (Van der Weyde et al. 2015). L’étude des cycles sexuels chez les canidés non domestiqués montre l’existence d’un tel phénomène : chez les loups éthiopiens par exemple, chez lesquels les œstrus sont synchronisés au sein de la meute, certaines femelles subordonnées sont capables en diœstrus d’allaiter les louveteaux du couple dominant (Van Kesteren et al. 2013). Toutefois, il semblerait que la pseudogestation clinique soit moins fréquente chez des chiennes élevées en communauté en chenil que chez des chiennes vivant seules chez des particuliers (Fontbonne 2016).
V.
Prise en charge des chiennes présentant des signes
marqués ou persistants
1) Mesures hygiéniques
Le plus fréquemment, les signes observés se résolvent spontanément en deux à quatre semaines, sans nécessiter aucune prise en charge. Dans un premier temps, des mesures hygiéniques simples peuvent être prises. Si la chienne n’entretient pas la lactation par du léchage, celle-ci cesse spontanément. Le port d’une collerette peut permettre de résoudre ce problème. Les nids construits peuvent être défaits et les objets qui sont maternés retirés.
a) Effet d’une restriction alimentaire à court terme
Hermo et al ont pratiqué en 2009 une restriction alimentaire sur des chiennes pseudogestantes pendant 8 jours : les chiennes recevaient 50% de leurs besoins énergétiques pendant 2 jours, puis 40% pendant 3 jours, puis 30% pendant 2 jours. Après 5 jours, 75% des chiennes restreintes présentent des signes cliniques diminués (contre 25% des chiennes qui recevaient une ration complète). Après huit jours, 100 % des chiennes restreintes avaient des signes cliniques diminués contre 25% des témoins. Les concentrations sanguines en prolactine sont restées identiques dans les deux groupes au cours de l’étude. Une restriction alimentaire à court terme ne permet donc pas une résolution complète de la pseudogestation, mais une diminution des signes cliniques observés (Hermo et al. 2009).
b) Effet d’une restriction alimentaire à long terme
Lawler et al (1999) se sont également intéressés à cette restriction pratiquée sur une plus longue durée : des chiennes labradors âgées de 6 semaines ont été restreintes à 75% de leur besoin énergétique pendant plusieurs années. Toutes les chiennes non restreintes (14) ont présenté au moins une fois dans l’étude une pseudogestation clinique, contre seulement 9 chiennes restreintes (64 %). De plus, 10 chiennes non restreintes (71 %) ont présenté plusieurs épisodes de pseudogestation contre 50% des chiennes restreintes.
27 2) Traitement médical
a) Régulation de la synthèse et de la sécrétion de la prolactine
La prolactine est une hormone produite par l’hypophyse. Sa synthèse et sa sécrétion sont régulées au niveau central (hypothalamus) et périphérique (gonades et thyroïde). Le contrôle hypothalamique est principalement inhibiteur et se fait via différents neurotransmetteurs : la dopamine, qui, en se liant aux récepteurs dopaminergiques de type D2 de l’antéhypophyse, inhibe la sécrétion de prolactine ; l’acide gamma aminobutyrique (GABA) inhibe quant à lui la synthèse de la prolactine. D’autres ont un effet positif sur la sécrétion de prolactine, comme la sérotonine ou la TRH (Thyrotropin Reseasing Hormon) (Touraine et Goffin 2005) (Figure 14).
Figure 14 : Régulation de la synthèse et de la sécrétion de prolactine (GABA : acide gamma amino-butyrique ; GAP : Gonadotropin releasing hormon Associated Peptid ; TRH : Thyroxin Releasing Hormon ; VIP : Vaso-Intestinal Peptid). D’après Touraine et Goffin
(2015). b) Molécules disponibles
Différences molécules sont actuellement utilisées en médecine vétérinaire. Ce sont des alcaloïdes de l’ergot, qui sont des antagonistes de la prolactine.
Cabergoline
La cabergoline est un agoniste de la dopamine qui possède une action centrale sur l’antéhypophyse de longue durée, jusqu’à plusieurs jours après l’arrêt du traitement. Elle doit être administrée à la dose de 5 µg/kg/jour pendant 5 à 10 jours par voie orale. Les effets secondaires qui peuvent se manifester sont des vomissements, relativement rares (observés chez moins de 5% des chiennes), car elle franchit peu la barrière hémato-méningée. Différentes spécialités vétérinaires sont disponibles sous forme buvable : Galastop®, Finilac® et Kelactin® (Mallem 2016).
28 Plusieurs études s’intéressent à l’efficacité de la cabergoline dans la résolution des symptômes de la pseudogestation : en 1988, Arbeiter et al comparent l’efficacité de deux voies d’administration de la cabergoline : une administration orale à 5 µg/kg une fois par jour pendant 5 jours et des injections sous cutanées aux doses de 5 µg/kg, 2,5 µg/kg ou 1,5 µg/kg une fois par jour pendant la même durée. Les efficacités des deux voies d’administration sont comparables (hypertrophie et sécrétion mammaires sont complètement résolues 10 jours après le début du traitement) mais la voie sous cutanée entraîne des effets émétisants très fréquents (65,7 % des chiennes vomissent à la première injection contre 3% des chiennes traitées par voie orale) (Arbeiter et al. 1988).
L’utilisation de la cabergoline par voie orale à la dose de 5 µg/kg pendant 5 jours permet selon les propriétaires une résolution complète des signes cliniques dans 75 % des cas au cinquième jour du traitement (étude menée sur 26 chiennes). Les concentrations sanguines en prolactine diminuent dans 80 % des cas entre le début et la fin du traitement (Harvey et al. 1997).
Bastan et al (1998) évaluent l’efficacité de la cabergoline dans l’arrêt de la sécrétion lactée chez 22 chiennes pseudogestantes. Les critères utilisés pour caractériser la pseudogestation sont l’aspect des mamelles (présence ou non d’une hypertrophie) et le type de sécrétion lactée (lait, liquide séreux ou absence de sécrétion). Les chiennes ont été traitées à la dose de 5 µg/kg de cabergoline par voie orale pendant 4 jours. Après ces 4 jours, 95,5 % des chiennes ne présentent plus de sécrétion lactée ni d’hypertrophie mammaire, et 6 jours après le début du traitement, plus aucune chienne ne présente de modifications mammaires. En ce qui concerne les signes comportementaux observés lors de pseudogestation, les chiennes retrouvent un comportement normal 6 jours après le début du traitement (Bastan et al. 1998).
Enfin, une étude comparée de l’efficacité de la bromocriptine, un autre alcaloïde de l’ergot, et de la cabergoline à un traitement placebo montre des résultats similaires. Après un traitement de 7 jours les animaux sont répartis en trois groupes : 0 correspondant à des glandes mammaires au repos et sans sécrétion ; I à une hypertrophie mammaire accompagnée d’une sécrétion séreuse ; et II à une hypertrophie mammaire accompagnée d’une sécrétion lactée. Sept jours après le début du traitement, 50% des chiennes traitées avec de la cabergoline ont atteint le grade 0 (contre 0% dans le groupe placebo), et 90% l’ont atteint à 14 jours (contre toujours 0% dans le groupe placebo) (Figure 15) (Gobello et al, 2001b).
29 Figure 15 : Réponse clinique des chiennes pseudogestantes à la cabergoline 7 et 14 jours
après le début du traitement, d’après Gobello et al (2001d).
Métergoline
La métergoline est un inhibiteur compétitif de la sérotonine (elle vient se fixer sur ses récepteurs), et possède donc elle aussi une action centrale, mais de plus courte durée ; elle doit ainsi être utilisée deux fois par jour à cause de son élimination rapide. La dose recommandée est de 0,1 mg/kg, pendant 7 à 10 jours par voie orale. Une seule spécialité vétérinaire est disponible, dans deux dosages différents : le Contralac 5® et le Contralac 20®. A cause de son action antisérotoninergique, elle ne doit pas être utilisée chez des chiennes présentant des modifications comportementales importantes. Les effets secondaires émétisants sont peu fréquemment observés (moins de 10% des chiennes vomissent lors du traitement) (Mallem 2016).
Une seule étude s’intéresse à l’efficacité de la métergoline sur les chiennes pseudogestantes : Castex et al (2002) ont administré de la métergoline à la dose de 0,1 mg/kg deux fois par jour pendant 10 jours à 14 chiennes. Le groupe témoin (10 chiennes) recevait un placebo. Les chiennes ont été réparties en différents grades suivant le type de sécrétions lactées observées à J7 et J14 (les mêmes grades que ceux utilisés dans l’étude de Gobello et al en 2001 (b) sur l’efficacité de la cabergoline). Toutes les chiennes étaient en grade II avant le début du traitement. Sept jours après le début du traitement, 8 chiennes sur les 14 traitées avec la métergoline étaient passées en grade 0, et 5 en grade I (aucune en grade 0 et 3 en grade I pour le groupe témoin) ; 14 jours après le début du traitement, 10 chiennes traitées étaient passées en grade 0, et 3 d’entre elles en grade I (aucune en grade 0 et 5 en grade I pour le groupe contrôle). Des effets secondaires d’hyperexcitation et des nausées ont été observés sur une des chiennes traitées, mais n’ont pas conduit à l’arrêt du traitement (Figure 16) (Castex et al 2002).
30 Figure 16 : Comparaison de l’évolution des signes cliniques chez les chiennes ayant reçu de la métergoline et celles ayant reçu un placebo, 7 et 14 jours après le début du traitement (grade 0 : glandes mammaires au repos ; grade I : hypertrophie mammaire et sécrétion séreuse ; grade II : hypertrophie mammaire et sécrétion lactée). D'après Castex et al (2002).
Cabergoline ou métergoline ?
Aucune étude ne s’intéresse à la comparaison de l’efficacité de ces deux molécules. Le choix entre l’une ou l’autre doit se faire en tenant compte de l’anamnèse et des commémoratifs de l’animal communiqués par le propriétaire, ainsi que de l’examen clinique réalisé sur l’animal. Ainsi, chez une chienne anxieuse ou agressive, on préfèrera utiliser la cabergoline. De plus, cette dernière semble mieux tolérée et provoquer des effets secondaires uniquement transitoires, mais qui sont variables en fonction des animaux.
Le choix peut également se faire en fonction de la facilité de l’observance : pour certains propriétaires, il est plus compliqué d’administrer un produit deux fois par jour qu’une seule fois. Les spécialités à base de cabergoline sont disponibles uniquement sous forme buvable, ce qui peut être parfois plus difficile à administrer qu’un comprimé.
Enfin, on pourrait imaginer associer les deux traitements dans des cas réfractaires, en raison de leurs modes d’action différents, mais aucune étude ne s’y est intéressé pour l’instant (Mir et Fontbonne 2013).
Bromocriptine
La bromocriptine est une molécule qui était utilisée dans le traitement des lactations de pseudogestation il y a quelques dizaines d’années. Elle possède le même mode d’action que la cabergoline. Son utilisation a été abandonnée en raison de son fort effet émétisant : environ 20% des chiennes présentaient des vomissements importants nécessitant l’utilisation de métoclopramide environ une heure et demie après l’administration de bromocriptine par voie orale (Janssens 1986 ; Gobello et al 2001b).
31 c) Autres traitements
Avant l’arrivée de ces molécules sur le marché, les stéroïdes étaient utilisés dans le traitement de la pseudogestation. Ceux-ci participent au développement de la glande mammaire, mais à forte dose ils ont un effet inhibiteur de la sécrétion de prolactine. Ils occasionneraient également une diminution de la sensibilité des tissus à la prolactine (Razzaque et al. 2008).
Utilisation des progestagènes
Les progestagènes utilisés dans les années 80 étaient principalement l’acétate de mégestrol et la proligestone (Allen 1986). Ils permettent l’arrêt des signes cliniques de pseudogestation mais une récidive des signes après l’arrêt du traitement est fréquente. De plus, leur utilisation conduit à une augmentation de l’incidence d’affections utérines telles que le pyomètre et l’hyperplasie glandulokystique. L’incidence des tumeurs mammaires est également augmentée, ce qui a conduit à déconseiller leur utilisation pour cette affection (Razzaque et al. 2008 ; Fontbonne 2016).
Utilisation des œstrogènes et des androgènes
De même, certains œstrogènes étaient utilisés, tels que l’œstradiol ou le benzoate d’œstradiol. Ils permettent l’arrêt des signes cliniques temporairement, mais on observe également des récidives. Comme pour la progestérone, l’incidence du pyomètre est augmentée, ainsi que l’incidence des tumeurs ou de l’aplasie médullaire. Certains androgènes comme la testostérone permettent l’arrêt de la lactation. Les effets secondaires de masculinisation sont très marqués. Œstrogènes et androgènes ne sont plus utilisés aujourd’hui (Razzaque et al. 2008 ; Fontbonne 2016).
Utilisation de l’homéopathie
L’administration de 8 granules de Thuja D30 3 fois par jour chez des chiennes pseudogestantes permet la résolution des signes cliniques chez les 30 chiennes de l’étude après 14 jours de traitement en moyenne. Quinze jours après le début du traitement, 67 % des chiennes ne présentaient plus de signes cliniques contre 13 % du groupe témoin qui recevait un placebo. La durée maximale du traitement a été de trois semaines (Özyurtlu et Alaçam 2005).
Prise en charge des troubles comportementaux
Dans de très rares cas, des troubles comportementaux marqués peuvent nécessiter une prise en charge médicale dans les cas où la chienne est agressive ou difficile à contenir. Une sédation légère peut être pratiquée, toutefois l’usage des phénothiazines comme l’acépromazine doit être évité, car ces molécules bloquent la libération de la dopamine et favorisent la libération de la prolactine (Gobello et al 2001a ; Touraine et Goffin 2005).
Stérilisation
Seule la stérilisation de la chienne permet la suppression définitive de la source progestéronique et évite ainsi les récidives. La stérilisation doit être réalisée en anœstrus et en l’absence de lactation. En effet, si elle est pratiquée en diœstrus, la suppression brutale de la source de progestérone (les ovaires) peut déclencher une pseudogestation.