Utilisation des macrocycles de phénylacétylène en tant
qu'outils lors de la synthèse de nano-architectures
Thèse
Katy Cantin
Doctorat en chimie
Philosophiae Doctor (Ph. D.)
Québec, Canada
© Katy Cantin, 2013
Résumé
Il y a de plus en plus de recherches qui se font dans le domaine de la architecture organique. Ce type de recherche aide à avancer non seulement les nano-architectures, mais aussi les structures plus simples qui le composent. Comme nous sommes qu'au début de la recherche sur les macrocycles de phénylacétylène et qu'ils offrent plusieurs caractéristiques intéressantes, nous nous sommes penchés sur un moyen d'obtenir un nanotube organique rigide lié uniquement de façon covalente à l'aide de cette unité. En effet, la plupart des nanotubes organiques sont faits à l'aide de la chimie supramoléculaire. Ce type de nanotube est instable et il est possible de perdre la structure en changeant le pH, la température ou le solvant ce qui limite leur utilisation. De plus, l'utilisation d'un macrocycle rigide tel que le macrocycle de phénylacétylène éviterait tout effondrement de la structure sur elle-même. Pour y arriver, nous nous sommes penchés sur trois stratégies différentes. La première est basée sur la polymérisation d'un macrocycle de phénylacétylène par le centre. Nous avons tout d'abord synthétisé une rotaxane pour prouver que la tige passe bel et bien au centre. La deuxième stratégie est basée sur l'obtention en premier lieu d'une polyrotaxane fait de macrocycles de phénylacétylène. Nous devions ici réussir à trouver les groupements fonctionnels permettant l'obtention de cette polyrotaxane à l'aide de la chimie supramoléculaire. Pour ce faire, nous avons travaillé sur une [2]rotaxane et nous avons essayé aussi d'obtenir une pseudorotaxane. Finalement, la troisième voie est celle qui passe tout d'abord par la chimie supramoléculaire en gélifiant les macrocycles avant de les relier entre eux. Nous pensons que d'obtenir un gel de macrocycles de phénylacétylène nous permettra d'obtenir un empilement de macrocycles face-à-face et qu'il suffira par la suite de les relier ensemble à l'aide d'une réaction topochimique pour obtenir un nanotube organique.
Abstract
Over the last ten years, the interest in the development of new strategies to prepare nanoarchitectures has continuously grown. Phenylacetylene macrocycles are useful building blocks for the preparation of nano-architectures, especially nanotubes, owing to their rigidity and semi-conducting properties. Nanotubes are important nano-objects for different applications. Our goal was to obtain rigid organic nanotubes linked only with covalent bonds with phenylacetylene macrocycles as the building blocks. Most of the organic nanotubes reported in the literature are obtained through supramolecular chemistry. These types of nanotubes are unstable and easy to destroy by changing the pH, the temperature or the solvent. The instability limits the use of supramolecular nanotubes in real devices. The use of a rigid macrocycle such as a phenylacetylene macrocycle as a building block would avoid any collapse of the nanotube on itself. Our work concerns three different strategies. The first relies on the polymerization of macrocycles by its center. We synthesized a rotaxane to prove that the axis passes through the center of the macrocycles. The second strategy relies on the synthesis of a polyrotaxane with phenylacetylene macrocycles. The identification of suitable functional groups that lead to a polyrotaxane with the help of supramolecular chemistry is discussed. The use of a [2]rotaxane to obtain a pseudorotaxane was also studied. Finally, the third strategy relies on gelification of the macrocycles before their cross-linking. The gel allows a face-to-face stacking, which would facilitate formation of the organic nanotube by the cross-linking of the macrocycles by a topochemical reaction.
Avant-Propos
Tout d'abord, je voudrais remercier mon directeur de recherche, le professeur Jean-François Morin pour m'avoir donnée la chance de travailler dans son groupe de recherche ainsi que de m'avoir permis de faire le passage directe vers le doctorat. Sa disponibilité, sa bonne humeur, son écoute et bien évidemment son grand savoir sont tous des éléments qui m'ont grandement aidé tout le long de mon doctorat.
Je désire remercier Antoine Lafleur Lambert et Simon Pépin qui m'ont beaucoup aidé dans ce projet. Tous les deux m'ont permis d'avancer plus rapidement dans mes recherches. Un merci tout spécial à Philippe Dufour, professionnel de recherche, qui tout le long de mon doctorat, m'a aidé de bien des manières que ce soit en laboratoire ou lors de l'écriture.
Un des projets (celui des gels) a été un projet fait en collaboration avec plusieurs personnes dans le laboratoire. Je veux donc remercier Simon Rondeau, Jules Roméo Néabo pour leur travail fait dans ce projet. Sans eux, ce projet n'aurait pas eu lieu et c'est grâce à leur expertise qui nous avons réussi à avoir ces résultats. Je dois aussi remercier Maxime Daigle ainsi que Maude Desroches pour leur participation.
Je veux aussi remercier tout les collègues que j'ai côtoyés dans le laboratoire : Mathieu Arseneault, Francis Cronier, Maxime Daigle, Maude Desroches, Évelyne Gagnon-Thibault, Jean-Benoît Giguère, Hassan Iden, Antoine Lafleur Lambert, Isabelle Levesque, Jules Roméo Néabo, Simon Rondeau, Dominic Thibeault, Caroline Wafer ainsi que les stagiaires. J'espère sincèrement que je n'en ai pas oublié. Je considère un laboratoire comme étant un lieu de partage de connaissances et de ce fait même, je voudrais les remercier pour tous ce que j'ai appris grâce à eux.
Je veux remercier aussi les différents professionnels de recherche avec qui j'ai travaillé ces dernières années : Pierre Audet, Jean Frenette, Richard Janvier, Rodica Pleasu
et Jean-François Rioux. Toutes ces personnes m'ont transmises des connaissances et m'ont aidé à faire les analyses nécessaires pour mener à bien mes recherches.
Je veux aussi remercier Étienne Bélanger et Jean-Sébastien Marois, mes deux mentors lors de mes stages que j'ai faits durant mon baccalauréat. J'ai beaucoup appris grâce à eux et leur enseignement m'ont suivi tout le long de mon doctorat.
Finalement, je voudrais bien évidemment remercier mes amis et ma famille. Mes parents, qui m'ont toujours supportée et encouragée dans mes choix que j'ai faits et ils ont toujours cru en moi. Mes deux sœurs, Nathalie et Marie-Michelle qui, grâce à leurs propres expériences personnelles, m'ont toujours grandement conseillées.
Table des matières
Résumé ... III Abstract ... V Avant-Propos ... VII Table des matières ... XI Liste des tableaux ... XV Liste des figures ... XVII Liste des abréviations ... XXI
Introduction ... 1
1.1 Les nano-architectures organiques ... 1
1.2 Les macrocycles de phénylacétylène ... 3
1.2.1 La synthèse ... 4
1.2.2 Les propriétés des macrocycles de phénylacétylène ... 8
1.3 Les nanotubes ... 11
1.3.1 Les nanotubes de carbone ... 11
1.3.2 Les nanotubes organiques ... 14
1.4 Rotaxanes ... 26
1.4.1 Théorie sur les rotaxanes ... 26
1.4.2 Les éthers couronnes ... 28
1.5 Problématiques et objectifs ... 33
1.5.1 Nanotube obtenu par polymérisation de macrocycles ... 34
1.5.2 Nanotube obtenu à l'aide d'une polyrotaxane ... 39
1.5.3 Nanotube obtenu à l'aide d'un gel ... 42
Chapitre 2 : Méthodes expérimentales ... 47
2.1 Résonance magnétique nucléaire en solution ... 47
2.2 Spectroscopie infrarouge ... 47
2.3 Spectre de masse haute résolution ... 48
2.4 Chromatographie d’exclusion stérique par perméation de gel (SEC-GPC) ... 48
2.5 Microscopie à balayage électronique ... 48
2.6 Diffractogramme des rayons X ... 48
2.7 Optimisation géométrique ... 49
Chapitre 3 : Nanotube organique obtenu par polymérisation de macrocycles ... 51
3.1 Introduction ... 51
3.2 Synthèse du macrocycle de phénylacétylène pour la [2]rotaxane ... 51
3.2.1 Synthèse du macrocycle 10 ... 52 3.2.2 Synthèse du macrocycle 22 ... 62 3.2.3 Synthèse du macrocycle 36 ... 67 3.2.4 Synthèse du macrocycle 47 ... 72 3.2.5 Synthèse du macrocycle 56 ... 76 3.2.6 Synthèse du macrocycle 67 ... 81 3.3 Synthèse du bloqueur ... 86 3.3.1 Synthèse du bloqueur 71 ... 86 3.3.2 Synthèse du bloqueur 77 ... 88 3.3.3 Synthèse du bloqueur 86 ... 90 3.3.4 Synthèse du bloqueur 94 ... 95
3.3.5 Synthèse du bloqueur 105 ... 98
3.4 Synthèse de la [2]rotaxane ... 101
3.4.1 Avec le bloqueur 77 ... 101
3.4.2 Avec le bloqueur 86 ... 104
3.4.3 Avec le bloqueur 105 ... 106
3.5 Synthèse de la tige centrale ... 108
3.6 Synthèse de l'unité réticulable ... 110
3.7 Synthèse du macrocycle pour la nanocapsule ... 112
3.8 Conclusion ... 116
Chapitre 4 : Nanotube formé à l'aide d'une polyrotaxane ... 119
4.1 Introduction ... 119 4.2 Synthèse de la [2]rotaxane ... 119 4.2.1 Synthèse du macrocycle 131 ... 120 4.2.2 Synthèse de la tige ... 123 4.2.3 Synthèse du bloqueur ... 125 4.2.4 Synthèse de la [2]rotaxane ... 126
4.2.5 Étude de complexation avec le macrocycle 131 ... 127
4.2.6 Synthèse du macrocycle 153 ... 129
4.2.7 Étude de complexation avec le macrocycle 153 ... 131
4.3 Conclusion ... 132
Chapitre 5 : Nanotube obtenu à l'aide d'un gel ... 135
5.1 Introduction ... 135
5.1.1 Résumé sur les gels ... 136
5.1.2 Quelques exemples de PDA obtenus à l'aide d'un gel ... 136
5.1.3 Les PDAs ayant comme monomère des macrocycles ... 137
5.2 Première génération de macrocycles ... 139
5.2.1 Synthèses des macrocycles ... 140
5.2.2 Tests de gélification et caractérisation du gel obtenu ... 145
5.2.3 Test de photopolymérisation sur le gel du macrocycle 160 ... 148
5.3 Deuxième génération de macrocycles ... 148
5.3.2 : Synthèse du macrocycle 174 ... 149
5.4 Troisième génération de macrocycles ... 152
5.4.1 Synthèse du macrocycle 183 ... 153
5.4.2 Synthèse du macrocycle 188 ... 155
5.4.3 Synthèse du macrocycle 193 ... 157
5.4.4 Tests de gélification et caractérisation du macrocycle obtenu ... 159
5.4.5 Tests de photopolymérisation de la troisième génération de macrocycle ... 160
5.5 Conclusion ... 161
Chapitre 6 : Conclusion ... 163
Références ... 167
Annexe A : Partie expérimentale ... 173
Méthodes de synthèse générales ... 173
Synthèse des produits ... 173
Annexe B : Spectres RMN lors des essais de pseudorotaxanes ... 289
Annexe B.1 : Macrocycle 131 et diéthylamine protonée avec TFA ... 289
Annexe B.2 : Macrocycle 131 et pyridine protonée avec TFA ... 290
Annexe B.4 : Macrocycle 153 et diéthylamine protonée avec TFA ... 292 Annexe B.5 : Macrocycle 153 et pyridine protonée avec TFA ... 293 Annexe B.6 : Macrocycle 153 et pyrazine protonée avec TFA ... 294
Liste des tableaux
Tableau 1 : Résultats des tests de gélification à une concentration de 10 mg/mL pour le macrocycle 160. G = gel, P = précipitation, S = solution ... 145 Tableau 2 : Résultats des tests de gélification des macrocycles 160, 183, 188 et 193. G :
Liste des figures
Figure 1 : Macrocyclisation à l'aide d'un synthon unique ... 4
Figure 2 : Exemple d'un macrocycle obtenu par la synthèse itérative ... 5
Figure 3 : Macrocycle du groupe de Höger ... 6
Figure 4 : Stratégie du gabarit utilisée sur le macrocycle du groupe de Höger ... 6
Figure 5 : Exemple de macrocyclisation par métathèse ... 7
Figure 6 : Métathèse développée par le groupe de Moore ... 7
Figure 7 : Métathèse sur des oligomères dans le but d'obtenir un macrocycle ... 8
Figure 8 : Image STM ainsi que la structure observée sur une surface du macrocycle du groupe de Höger ... 10
Figure 9 : L'organisation du macrocycle du groupe de Moore ... 10
Figure 10 : Nanotube de carbone avec un bout ouvert et l'autre fermé ... 11
Figure 11 : C70 ... 12
Figure 12 : Exemples de nanotubes de carbone à simple paroi (à gauche) et à multiples parois (à droite) ... 12
Figure 13 : Les différentes modes de coupe du nanotube de carbone ... 13
Figure 14 : Les différents types de nanotubes de carbone ... 13
Figure 15 : Diverses méthodes de synthèse de nanotubes organiques par la voie supramoléculaire ... 14
Figure 16 : Tableau des formes de micelles possibles dépendant de v/a0lc ... 15
Figure 17 : Nanotubes faits à partir d'une molécule amphiphile ... 16
Figure 18 : Le nanotube du groupe de Masuda ... 16
Figure 19 : Nanotube formé de macrocycles peptidiques ... 17
Figure 20 : Canaux ioniques dans des membranes ... 18
Figure 21 : Structure du macrocycle du groupe de Sheldrick ... 19
Figure 22 : Macrocycle du groupe de MacLachlan ... 19
Figure 23 : Macrocycles du groupe de Moore ... 20
Figure 24 : Nanotube du groupe de Höger ... 20
Figure 25 : Exemple d'un foldamère ... 21
Figure 26 : Étapes de création du nanotube du groupe de Son ... 23
Figure 27 : Formation d'un nanotube à l'aide d'une polyrotaxane ... 24
Figure 28 : Formation d'un nanotube lié de façon covalente à partir d'un foldamère ... 24
Figure 29 : Formation du nanotube du groupe de Zimmerman ... 25
Figure 30 : Les différentes structures d'une rotaxane ... 26
Figure 31 : Les différentes synthèses d'une rotaxane1 ... 27
Figure 32 : Formation d'une rotaxane à l'aide d'un isocyanate ... 30
Figure 33 : Formation d'une rotaxane à l'aide d'une estérification ... 31
Figure 35 : Formation de la [3]rotaxane du groupe de Stoddart ... 31
Figure 34 : Formation d'une [2]rotaxane à l'aide d'un couplage de Sonogashira ... 32
Figure 36 : Formation de la [2]rotaxane du groupe de Coutrot ... 32
Figure 37 : Stratégie de synthèse du nanotube ... 35
Figure 38 : Polymère du groupe de Höger ... 36
Figure 39 : Résultats possibles lors du clivage du lien entre la tige et le macrocycle ... 37
Figure 40 : Exemple d'un macrocycle où la tige passe à l'extérieur 110 ... 37
Figure 42 : Stratégie de synthèse de la nanocapsule ... 39
Figure 43 : Stratégie de synthèse du nanotube ... 41
Figure 44 : Diynes sur un macrocycle de phénylacétylène ... 43
Figure 45 : Photopolymérisation de diynes ... 43
Figure 46 : Macrocycle générale pour la photopolymérisation. ... 44
Figure 47 : Macrocycle 10 ... 52
Figure 48 : Synthèse du macrocycle 10 ... 54
Figure 49 : Synthèse du centre 12 ... 55
Figure 50 : Synthèse de la molécule 1 à 3 ... 55
Figure 51 : Synthèse de la molécule 4 ... 56
Figure 52 : Synthèse des coins du macrocycle 7 ... 56
Figure 53 : Formation du demi-macrocycle 8 ... 57
Figure 54 : Mécanisme de la cyclisation d'un alcool en ortho d'un alcyne ... 57
Figure 55 : Formation du demi-macrocycle du groupe de Cho ... 59
Figure 56 : Formation du demi-macrocycle 16 ... 59
Figure 57 : Synthèse de la molécule 15 ... 59
Figure 58 : Formation du demi-macrocycle 17 ... 60
Figure 59 : Synthèse du centre 19 ... 61
Figure 60 : Formation du macrocycle ouvert 9 ... 62
Figure 61 : Macrocycle 22 ... 62
Figure 62 : Synthèse du centre 26 ... 63
Figure 63 : Synthèse du macrocycle ouvert 21 ... 64
Figure 64 : Demi-macrocycle déprotégé 27 ... 65
Figure 65 : Synthèse du macrocycle 22 ... 66
Figure 66 : Macrocycle 36 ... 67
Figure 67 : Synthèse du synthon 31 ... 68
Figure 68 : Synthèse du demi-macrocycle 34 ... 69
Figure 69 : Synthèse du macrocycle 36 ... 71
Figure 70 : Analyse chromatographique par exclusion stérique du macrocycle 36 avant sa purification ... 71
Figure 71 : Optimisation géométrique par le logiciel HyperChem du macrocycle 36 ... 72
Figure 72 : Macrocycle 47 ... 72
Figure 73 : Formation du demi-macrocycle 45 ... 73
Figure 74 : Synthèse de la molécule 44 ... 73
Figure 75 : Synthèse du macrocycle 47 ... 75
Figure 76 : Macrocycle 56 ... 76
Figure 77 : Optimisation géométrique du macrocycle 56 lorsque l'espaceur au centre a A) 2 carbones ; B) 3 carbones ; C) 4 carbones ; D) 5 carbones ... 77
Figure 78 : Synthèse du synthon 49 ... 78
Figure 79 : Synthèse du synthon 50 ... 78
Figure 80 : Formation de la molécule 52 ... 78
Figure 81 : Synthèse du macrocycle ouvert 55 ... 79
Figure 82 : Fermeture de cycle du macrocycle 56 ... 80
Figure 83 : Macrocycle 67 ... 81
Figure 84 : Synthèse de la molécule 59 ... 82
Figure 85 : Synthèse de la molécule 63 ... 82
Figure 87 : Synthèse du macrocycle ouvert 66 ... 83
Figure 88 : Fermeture de cycle du macrocycle ouvert 66 ... 85
Figure 90 : Synthèse du bloqueur 71 ... 87
Figure 89 : Bloqueur 71 ... 87
Figure 91 : Bloqueur 77 ... 88
Figure 92 : Synthèse de la molécule 75 ... 89
Figure 93 : Synthèse du bloqueur 77 ... 90
Figure 94 : Bloqueur 86 ... 91
Figure 95 : Synthèse des molécules 80 et 82 ... 92
Figure 96 : Synthèse de la porphyrine 84 ... 93
Figure 97 : Synthèse de la molécule 79 ... 93
Figure 98 : Synthèse du bloqueur 86 ... 94
Figure 99 : Bloqueur 94 ... 95
Figure 100 : Synthèse de la molécule 89 ... 96
Figure 101 : Synthèse du synthon 87 ... 96
Figure 102 : Synthèse de la molécule 92 ... 97
Figure 103 : Bloqueur 105 ... 98
Figure 104 : Synthèse de la molécule 96 ... 98
Figure 105 : Synthèse de la molécule 102 ... 99
Figure 106 : Synthèse du bloqueur 104 ... 100
Figure 108 : Synthèse de la [2]rotaxane 107 ... 102
Figure 107 : Représentation de la distance calculée sur le bloqueur 77 ... 103
Figure 109 : Macrocycle libre 108 ... 104
Figure 110 : Représentation de la distance calculée pour le bloqueur 86 ... 104
Figure 111 : Synthèse de la rotaxane non clivée 109 ... 105
Figure 112 : Représentation de la distance calculée sur le bloqueur 105 ... 106
Figure 113 : Synthèse de la [2]rotaxane 111 ... 107
Figure 114 : Tige centrale 118 ... 109
Figure 115 : Synthèse de la tige centrale 118 ... 109
Figure 116 : Unité réticulable 117 ... 110
Figure 117 : Synthèse de l'unité réticulable 117 ... 111
Figure 118 : Macrocycle 123 ... 113
Figure 119 : Synthèse du centre 124 ... 113
Figure 120 : Synthèse du demi-macrocycle 121 ... 114
Figure 121 : Synthèse du macrocycle 123 ... 115
Figure 122 : Macrocycle 131 ... 120
Figure 123 : Image HyperChem du macrocycle 131 (en turquoise) et du DB[24]C8 (en vert) ... 121
Figure 124 : Synthèse du synthon 128 ... 121
Figure 125 : Synthèse du macrocycle 131 ... 122
Figure 126 : Tige 148 ... 124
Figure 127 : Synthèse de la tige 148 ... 124
Figure 128 : Le bloqueur 151 ... 125
Figure 129 : Synthèse du bloqueur 151 ... 125
Figure 131 : Exemple de spectres obtenus lors des essais d'obtention d'une pseudorotaxane. La tige utilisée ici est la diéthyamine protonée avec le TFA et le macrocycle est le
macrocycle 131 ... 128
Figure 132 : Le macrocycle 153 ... 129
Figure 134 : Synthèse du macrocycle 153 ... 130
Figure 133 : Image HyperChem du macrocycle 153 (en turquoise) et du DB[24]C8 (en vert) ... 130
Figure 135 : Exemple de spectres obtenus lors des essais d'obtention d'une pseudorotaxane. La tige utilisée est la diéthylamine protonée avec le TFA et le macrocycle est le macrocycle 153 ... 131
Figure 136 : Organogélateur du groupe de Tamaoki ... 137
Figure 137 : Organogélateurs du groupe de Shinkai ... 137
Figure 138 : PDA de Shimizu ... 138
Figure 139 : PDA du groupe de Lauher ... 138
Figure 140 : Macrocycles du groupe de Tamaoki ... 139
Figure 141 : Macrocycles 160 et 166 ... 140
Figure 142 : Synthèse du synthon 157 ... 141
Figure 143 : Synthèse du macrocycle 160 ... 142
Figure 144 : Synthèse de la molécule 162 ... 143
Figure 145 Synthèse du macrocycle 166 ... 144
Figure 146 : Image SEM du gel séché fait dans le cyclohexane (10 mg/mL) ... 146
Figure 147 : Image SEM du gel séché fait dans le toluène (10 mg/mL) ... 146
Figure 148 : Spectres infrarouges du gel du macrocycle 160 dans la décaline à 10 mg/mL. Les valeurs en haut à gauche sont en degré Celsius ... 147
Figure 149 : Macrocycle 174 ... 149
Figure 150 : Synthèse du synthon 168 ... 149
Figure 151 : Synthèse du synthon 171 ... 150
Figure 152 : Synthèse du macrocycle 174 ... 151
Figure 153 : Macrocycles 160, 183, 188 et 193 ... 152
Figure 154 : Synthèse du synthon 180 ... 153
Figure 155 : Synthèse du macrocycle 183 ... 154
Figure 156 : Synthèse du synthon 185 ... 155
Figure 157 : Synthèse du macrocycle 188 ... 156
Figure 158 : Synthèse du synthon 190 ... 157
Figure 159 : Synthèse du macrocycle 193 ... 158
Figure 160 : Image SEM du gel du macrocycle 160 dans le toluène (10 mg/mL) ... 159 Figure 161 : Image SEM du gel partiel du macrocycle 180 dans le toluène (10 mg/mL) . 160
Liste des abréviations
Ǻ angström
ACN acétonitrile
APPI photo-ionisation à la pression atmosphérique (atmospheric pressure photoionization)
ATR réflection totale atténuée (attenuated total reflexion) Boc tert-butyl carbonate
br s large singulet (broad singulet) calcd calculé (calculated)
CAN. Canada
CDDP cis-dichlorodiamine platine (II)
conc. concentré d doublet dba dibenzylideneacétone DBTL dilaurate de dibutyl-étain DCM dichlorométhane dd doublet de doublets
DIAD diisopropyle azodicarboxylate DIC N,N-diisopropylcarbodiimide DIPEA diisopropyléthylamine DMAP 4-diméthylaminopyridine DMF diméthylformamide DMSO diméthylsulfoxyde DVB divinylbenzène EDC 1-éthyl-3-(3-diméthylaminopropyl)carbodiimide
ESI ionisation par électronébuliseur (electrospray ionization)
FTIR spectroscopie infrarouge à transformé de fourier (fourier transform infrared spectroscopy)
GC-MS chromatographie gazeuse, spectroscopie de masse (gas chromatography, mass spectroscopy)
HOBt 1-hydroxybenzotriazole
HPLC chromatographie liquide haute performance (high performance liquid chromatography)
HRMS spectroscopie de masse à haute résolution (high resolution mass spectroscopy)
IR infrarouge
J constante de couplage
m multiplet
MALDI désorption-ionisation laser assistée par matrice (matrix-assisted laser desorption/ionization)
MP point de fusion (melting point)
MS-TOF spectroscopie de masse, temps de vol (mass spectrometry, time-of-flight) NBS N-bromosuccinimide
NMR résonance magnétique nucléaire (nuclear magnetism resonance)
o-DCB ortho-dichlorobenzène
p para
PAMAM poly(amido amine) ppm partie par million PTFE polytétrafluoroéthylène
Py pyridine
q quadruplet
RMN résonnance magnétique nucléaire
s singulet
SEC-GPC chromatographie d’exclusion stérique par perméation de gel (size exclusion chromatography, gel permeation chromatography)
SEM microscopie électronique à balayage (scanning electron microscope) STM microscope à effet tunnel (scanning tunneling microscope)
t triplet
TBAF fluorure de tétrabutylammonium TBME méthyl tert-butyl éther
TEA triéthylamine
TFA acide tétrafluoroacétique THF tétrahydrofurane
TIPSA triisopropylsilylacétylène
TLC chromatographie sur couche mince (thin layer chromatography) TMSA triméthylsilylacétylène
Ts tosylate
tp température pièce
u.a. unité arbitraire USA États-Unis
UV ultra-violet
Introduction
1.1 Les nano-architectures organiques
Il y a plusieurs types de nanostructures organiques. Il y a les dendrimères2, les moteurs moléculaires3, les nanovoitures4, les rotaxanes5, les caténanes6, les foldamères7, les pinces moléculaires8 et les nanotubes9 pour ne nommer que ceux-là. Certains d'entre eux sont des structures supramoléculaires tandis que d'autres sont formés uniquement de liens covalents. Il y a bien évidemment des structures qui sont des unités formant des architectures plus complexes. De plus, ces architectures ont le potentiel d'être utilisées dans le domaine médical, pharmaceutique, biologique et de l'électronique.10 En fait, nous en sommes encore au tout début de la recherche en ce domaine et nous en sommes encore à découvrir et à développer les outils pour pouvoir obtenir ces nouvelles architectures, c'est-à-dire à développer des structures simples pour réussir à obtenir des structures plus complexes. Les essais d'obtention d'une nano-architecture ne font pas seulement pas augmenter notre connaissance de cette nano-architecture, mais aussi celle des unités composant cette nano-architecture.
Prenons, par exemple, les dendrimères. Le premier dendrimère connu est le PAMAM et il a été synthétisé en 1985.11 Il a été synthétisé grâce à la synthèse divergente. La méthode convergente a été découverte lors de travaux faits sur le dendrimère de type Fréchet en 1990.12 Cette méthode a permis la formation de nouveaux types de dendrimères qui étaient impossible à faire à l'aide de la méthode divergente.
Par la suite, il y a eu des dendrimères plus complexes, possédant plus qu'un type de fonctions en tant que termini.13 Au départ, ce fut fait de manière statistique, mais maintenant, il est possible de l'obtenir de manière très contrôlée.14
En plus, les dendrimères (ou les dendrons) sont maintenant utilisés dans des structures beaucoup plus complexes. En effet, ils sont utilisés lors de la formation de
polymères,15 de nanocages16, de micelles17 et même dans la formation de nanotubes.18 Bien que les recherches sur les dendrimères au départ n'étaient faites qu'au niveau fondamental, que plusieurs ne croyaient pas que les dendrimères apporteraient des caractéristiques nouvelles19 et qu'il était très difficile de prédire leurs domaines d'utilisations futures, ils sont maintenant utilisés dans plusieurs domaines et ont plusieurs utilisations futures possibles.
Le même raisonnement peut se faire pour les rotaxanes. La première pseudorotaxane obtenue à l'aide de la chimie supramoléculaire a été publiée en 1995 par le groupe de Stoddart.20 Elle était composée d'un éther couronne et d'une tige possédant un ammonium secondaire. Par la suite, une multitude de macrocycles, de tiges ainsi que de nouvelles méthodes de synthèse des rotaxanes ont été développées.21-25 Cet éventail de possibilités a permis d'élargir les domaines d'utilisation des rotaxanes. En effet, il est maintenant possible d'utiliser les rotaxanes dans plusieurs nano-architectures que ce soient dans les polymères26, les pinces moléculaires27, les navettes moléculaires28, etc. Bien qu'au départ l'intérêt pour les rotaxanes n'était que fondamental et basé sur la curiosité scientifique, l'utilisation des rotaxanes dans des structures plus complexes augmente encore une fois le potentiel des rotaxanes et donc leur utilisation dans un plus grand nombre de domaines.
Bien évidemment, toutes ces recherches ont un effet d'entraînement. À chaque fois qu'il y a développement d'une nouvelle possibilité d'utilisation d'une structure simple dans une structure plus complexe, il y a développement de nouvelles variantes de la structure simple en question. Ces nouvelles variantes simplifient la recherche sur l'utilisation de cette structure simple dans la synthèse d'une structure complexe différente. Donc, le but global lors de l'obtention d'une structure complexe n'est pas uniquement l'obtention de cette structure, mais aussi le développement de chaque structure simple et une plus grande connaissance des propriétés de chacune de ces structures. Au final, l'échec de l'obtention de la structure finale n'est pas un échec au projet, car ce travail aura permis de mieux connaître les structures simples.
1.2 Les macrocycles de phénylacétylène
Une structure intéressante et pour laquelle la chimie n'est pas encore très développée est le macrocycle de phénylacétylène. Il est composé d'alcynes (ou de diynes) et de cycles benzéniques en alternance. Cette particularité lui procure une rigidité qui est bien utile lors de la formation de nano-architectures plus complexes. En effet, cette rigidité permet à la fois d'obtenir une géométrie bien précise, mais aussi d'obtenir des « vides » et de les conserver, car la structure ne pourra pas s'effondrer sur elle-même. Aussi, il est envisageable d'obtenir une structure semi-conductrice, vu l'alternance des alcynes et des cycles benzéniques. De plus, ce macrocycle offre la possibilité d'ajouter des fonctions à l'intérieur et aussi à l'extérieur du macrocycle. Toutes ces particularités font en sorte qu'il est avantageux d'utiliser le macrocycle de phénylacétylène pour la construction de diverses nano-architectures.
Le premier macrocycle de phénylacétylène synthétisé à notre connaissance a été préparé par le groupe de Raphael en 1966.29 Bien qu'il y eu un autre exemple de macrocycle de phénylacétylène en 1974,30 les recherches sur ce macrocycle n'ont réellement commencé qu'en 1992 par le groupe de Moore.31 Depuis, plusieurs stratégies de synthèse ont été élaborées. Par contre, nous en sommes encore qu'au début de la recherche sur cette structure. Pour ces raisons, nous croyons qu'il est nécessaire de poursuivre ces recherches sur le macrocycle de phénylacétylène, mais pas directement sur cette structure, mais plutôt en tant qu'outil lors de la synthèse de structures beaucoup plus complexes.
Pour aller de l'avant, mieux vaut connaître les différentes stratégies de synthèse déjà développées. Pour cette raison, il y aura dans cette section les différentes stratégies de synthèse connues du macrocycle de phénylacétylène ainsi que quelques-unes de ses propriétés.
1.2.1 La synthèse
Les méthodes de synthèse des macrocycles de phénylacétylène peuvent se diviser en trois catégories : la polymérisation d'un synthon simple, la méthode itérative et la fermeture de cycle à l'aide d'un demi-macrocycle. Bien entendu, chaque stratégie a ses avantages et ses inconvénients. Il y aura dans cette section la description de chaque stratégie.
L'une des stratégies employées est, tout d'abord, de synthétiser un monomère simple en quelques étapes. Par la suite, ce synthon est réagi sur lui-même formant des oligomères et des macrocycles de différentes tailles (voir Figure 1).30 Cette stratégie ne comporte que peu d'étapes. Par contre, le rendement du macrocycle voulu est très bas. De plus, cette stratégie n'est utile que lorsque tous les cycles benzéniques formant le macrocycle comportent exactement les mêmes groupements, donc, lorsque le macrocycle est complètement symétrique.
La deuxième méthode est celle dite itérative, c'est-à-dire que chaque synthon (cycle benzénique) est ajouté à tour de rôle et que la dernière étape se retrouve à être la fermeture de cycle. Cette méthode permet d'obtenir des macrocycles hautement asymétriques (voir Figure 2).31 Par contre, cette méthode comporte plusieurs étapes. De plus, elle requiert plusieurs synthons asymétriques. En général, le rendement de la fermeture de cycle est élevé.
I
Cu
pyridine, 4,6%
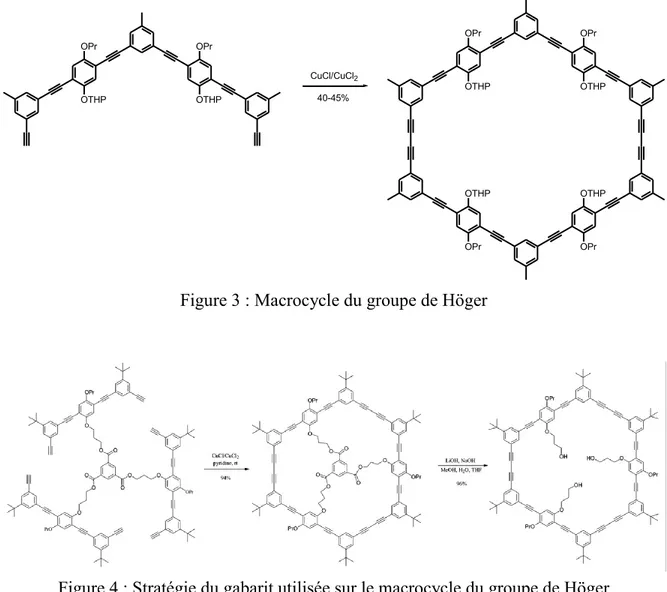
Une autre stratégie consiste à tout d'abord obtenir un demi-macrocycle ou une portion importante du macrocycle avant de faire la fermeture de cycle à l'aide de ces deux ou trois synthons. De ce fait, il est possible de faire un macrocycle non complètement symétrique (avec des groupements différents sur les cycles benzéniques) en limitant le nombre d'étapes pour se rendre à l'étape finale (voir Figure 3).32 Cette stratégie peut aussi être employée avec un gabarit. En effet, il est possible de faire réagir le demi-macrocycle sur un synthon central permettant d'approcher les deux demi-macrocycles permettant ainsi de limiter et même tout simplement éviter complètement la formation d'oligomères. Il est donc possible de passer d'un rendement d'environ de 30-50% à un rendement de 95% (voir Figure 4).33 La méthode du gabarit est plus longue et exige du demi-macrocycle d'avoir un groupement permettant le couplage entre le demi-macrocycle et le centre. Par contre, le rendement de la fermeture de cycle est presque quantitatif et est donc un net avantage.
Figure 2 : Exemple d'un macrocycle obtenu par la synthèse itérative R Et2N3 + R I TMS Pd0/CuI Et2N3 R R TMS K2CO3 Et2N3 R R MeI, 110 °C I R R TMS Et2N3 R R I R R TMS + R R R R R R I Pd0/CuI 75% R R R R R R
Vu la nature même du macrocycle de phénylacétylène, très peu de types de réactions sont utilisés lors de sa formation à partir des synthons. En fait, nous pouvons les résumer en trois classes : le couplage oxydatif des alcynes34, le couplage de Sonogashira35,36 et la métathèse.37 Les trois catégories doivent être bien évidemment prises au sens large, car elles englobent d'autres réactions. Lors du choix des réactions à utiliser, il faut prendre en considération la stratégie de synthèse, la structure finale voulue et finalement, l'efficacité de la réaction en elle-même. Par exemple, si le macrocycle de phénylacétylène voulu ne contient aucun diyne, il ne sera évidemment pas possible d'utiliser le couplage oxydatif des alcynes pour obtenir le macrocycle final.
OPr OTHP OPr OTHP CuCl/CuCl2 OPr OTHP OPr OTHP OPr OTHP OPr OTHP 40-45%
Figure 3 : Macrocycle du groupe de Höger
Au départ, la macrocyclisation par métathèse n'offrait pas beaucoup d'avantages, que ce soit dans l'une ou l'autre des stratégies de synthèse. Le rendement obtenu n'était pas réellement plus grand que les autres méthodes (voir Figure 5).38 Au départ, il y avait de grands espoirs sur les rendements de fermeture de cycle à l'aide de cette réaction, car elle est réversible et ainsi, elle devait permettre d'obtenir le produit le plus stable thermodynamiquement, c'est-à-dire le macrocycle à six membres.39
Le groupe de Moore a réussi à développer un nouveau catalyseur permettant d'utiliser cet avantage lors de la synthèse de macrocycle de phénylacétylène à six membres à partir d'un monomère, et ce, avec un excellent rendement de 84% (voir Figure 6).40 Non seulement il est possible d'obtenir un macrocycle à partir d'un monomère, mais aussi à partir d'oligomères ce qui prouve hors de tout doute que la réaction est réellement
Figure 5 : Exemple de macrocyclisation par métathèse
réversible et que le produit obtenu est le produit le plus stable thermodynamiquement (voir Figure 7).41
Figure 7 : Métathèse sur des oligomères dans le but d'obtenir un macrocycle
1.2.2 Les propriétés des macrocycles de phénylacétylène
1.2.2.1 Sa conformation
Selon les simulations, la plupart des macrocycles de phénylacétylène ont une conformation planaire, bien qu'ils puissent passer par la conformation chaise ou bateau, un peu comme le cyclohexane.42 C'est aussi ce qui est observé la plupart du temps dans les cristaux surtout lorsque le macrocycle est hexagonal.43 Par contre, il arrive que la forme chaise et la forme bateau soient des formes plus stables que la forme planaire, ce qui est aussi observable avec les cristaux obtenus.44
1.2.2.2 L'empilement
Une des propriétés des macrocycles de phénylacétylène est la possibilité de s'empiler. En effet, avec les groupements phényle présents sur le cycle, les macrocycles de phénylacétylène ont la possibilité de s'empiler grâce aux interactions π. Généralement, il est possible d'observer ces phénomènes en solution. La première publication à démontrer ce
phénomène est celle du groupe Moore.45 En effet, il est possible d'observer la formation de dimères en analysant les échantillons en RMN 1H. L'augmentation de la concentration de certains macrocycles de phénylacétylène dans le chloroforme deutéré fait déplacer les pics des protons aromatiques vers les hauts champs. À l'aide de ces déplacements chimiques, il est possible de calculer une constante d'association qui, dans le cas de l'article du groupe Moore, peut aller jusqu'à 60 M-1. À titre de comparaison, les constantes d'association de la dimérisation des porphyrines sont dans le même ordre de grandeur.46,47 Les groupements contenus sur les cycles aromatiques ont une grande influence sur les constantes d'association et sur la possibilité de former des dimères en solution. D'autres études ont été faites sur l'effet de la grandeur du macrocycle et des groupements internes du macrocycle par le groupe de Moore48, le groupe de Neamura43,49 et le groupe de Mayor.50 De plus, le groupe de Neamura a aussi démontré qu'il est possible de faire des dimères en solution à l'aide d'un sel de tropylium ou d'un sel de guandidinium lorsqu'il y a des groupements cyano au centre du macrocycle.51
L'empilement des macrocycles à l'état solide a tendance à former des canaux ou des nanotubes. Il en sera question plus en détail dans la section 1.3.2.1.3.
1.2.2.3 Propriétés sur les surfaces
Beaucoup de recherches se fait sur les macrocycles de phénylacétylène sur les surfaces. Le but ultime serait de réussir à obtenir des colonnes de macrocycles sur les surfaces, et ce, à partir de la première couche et de réussir par la suite de réticuler les macrocycles entre eux.42 Pour l'instant, nous ne réussissons qu'à obtenir une simple couche de macrocycle sur des surfaces. Nous observons généralement une interdigitation des chaînes alkyles se retrouvant à l'extérieur du macrocycle (voir Figure 8).44
Malgré le fait qu'en général, les macrocycles se placent sur la surface de manière parallèle à celle-ci, le groupe de Moore a réussi à obtenir des macrocycles perpendiculaires à la surface. Pour ce faire, il a utilisé des macrocycles contenant des groupements éthylène
glycol comme chaîne qu'il a déposés en solution sur une surface de verre. Les interactions des chaînes avec le verre et les interactions des cycles benzéniques entre eux ont fait en sorte que l'organisation obtenue est un empilement de macrocycles perpendiculaires à la surface (voir Figure 9).52
Figure 8 : Image STM ainsi que la structure observée sur une surface du macrocycle du groupe de Höger
Donc, nous pensons que la rigidité du macrocycle de phénylacétylène ainsi que sa capacité de s'empiler dans une conformation face-à-face font en sorte que le macrocycle de phénylacétylène est un candidat de choix pour un nanotube organique. Mais avant de décider du type de nanotubes dont nous voulons obtenir ainsi que de la stratégie à utiliser, nous devons connaître ce qu'il y a déjà été fait.
1.3 Les nanotubes
Il existe trois grandes catégories de nanotubes : le nanotube de carbone, le nanotube inorganique et le nanotube organique. Tous les trois ont des caractéristiques et des propriétés différentes ainsi que des synthèses bien différentes. Bien évidemment dans cette section, il va être question des nanotubes organiques, mais aussi des nanotubes de carbone qui sont, d'une certaine façon, les précurseurs des nanotubes organiques.
1.3.1 Les nanotubes de carbone
Le nanotube de carbone a été découvert en 1991 par le groupe de Iijima.53 Il existe des nanotubes ouverts ou fermés (voir Figure 10). Les nanotubes de carbone ouverts ne contiennent que des cycles à six. Par contre, ceux avec l'embout fermé contiennent des cycles à cinq à l'embout, dans la courbe du nanotube. Pour mieux comprendre sa structure, il est possible de considérer le C70 comme étant le plus court nanotube de carbone fermé
pouvant exister (voir Figure 11). De plus, il est possible d'obtenir des nanotubes de carbone simple paroi et multiples parois (voir Figure 12).54
Un élément important de la structure du nanotube de carbone est le mode de coupe (ou vecteur de repliement) (voir Figure 13). En effet, ce facteur va déterminer si le nanotube est un conducteur ou un semi-conducteur. Tout dépendant du mode de coupe, il y a obtention d'un nanotube d'une forme zigzag, d'une forme fauteuil ou d'une forme chirale (voir Figure 14). Il y a seulement le nanotube qui a la forme fauteuil qui est conducteur, les deux autres sont semi-conducteurs.55
Comme nous pouvons le voir, il existe plusieurs structures de nanotubes de carbone. Ces structures sont très importantes, car elles changent les propriétés des nanotubes. Il est très difficile d'obtenir un type précis de nanotubes par la voie de synthèse, même si certaines méthodes aident à obtenir des nanotubes plus d'une forme que l'autre.56 Il est aussi très difficile de les purifier. De plus, lors de la synthèse du nanotube de carbone, il peut avoir inclusion de défauts, que ce soit la présence de cycles à sept ou plus sur le nanotube, par un changement de diamètre le long du nanotube ou tout simplement par l'intrusion
Figure 11 : C70
Figure 12 : Exemples de nanotubes de carbone à simple paroi (à gauche) et à multiples parois (à droite)
d'une jonction. Toutefois, la présence de défauts sur le nanotube de carbone peut être salutaire, car elle facilite l'intrusion de fonctions à sa surface.57,58
Pour pouvoir utiliser les nanotubes de carbone dans diverses applications, entre autres des applications biologiques, il est utile de les fonctionnaliser pour tout simplement le rendre plus soluble ou pour ajouter une molécule aidant à l'application désirée. Il faut d'abord savoir que de base, le nanotube de carbone est très difficile à solubiliser et les méthodes de fonctionnalisation se font dans des conditions très rudes et peuvent produire de nouveaux défauts.59
Figure 13 : Les différentes modes de coupe du nanotube de carbone
1.3.2 Les nanotubes organiques
Dans le cadre du développement des structures organiques en nanoscience et dans le but de trouver une solution aux problèmes rencontrés par les nanotubes de carbone, les chercheurs travaillent sur des moyens d'obtenir des nanotubes organiques. Jusqu'à maintenant, il existe une multitude de méthodes employées pour les obtenir et la plupart d'entre elles passent par la chimie supramoléculaire. L'utilisation des interactions intermoléculaires dans le but d'obtenir une structure précise a l'avantage de simplifier la synthèse. En effet, il suffit d'obtenir un synthon relativement simple pour obtenir une structure beaucoup plus complexe. Par contre, ces structures sont instables, c'est-à-dire qu'il est possible de perdre la structure en changeant tout simplement le solvant, le pH ou même la température. Pour ces raisons, il y a de plus en plus de recherche qui se fait dans le but d'obtenir un nanotube lié uniquement de façons covalentes.
1.3.2.1 Les nanotubes organiques supramoléculaires
Figure 15 : Diverses méthodes de synthèse de nanotubes organiques par la voie supramoléculaire
Il y a plusieurs moyens d'obtenir des nanotubes organiques par la voie supramoléculaire. En effet, il y a les empilements de macrocycles, les foldamères, les micelles, les copolymères-blocs, les empilements de rosettes et autres (voir Figure 15).60 Chacune des méthodes demande plus ou moins de synthèse avant l'assemblage supramoléculaire.
1.3.2.1.1 Les micelles
Les micelles sont composées de molécules amphiphiles (aussi appelées tensioactifs). En général, les micelles sont plutôt de forme sphérique. Par contre, il est possible de réguler la forme des micelles en changeant le rapport entre la grosseur de la tête polaire et la longueur de la queue hydrophile.61 De ce fait même, il est possible de prévoir la forme de la micelle à l'aide du rapport v/a0lc où v est le volume moléculaire occupé par la
partie hydrophobe, lc la longueur maximale de la molécule et a0 l'aire occupée par la tête
polaire (voir Figure 16).62
Il existe plusieurs cas de nanotubes préparés à l'aide de micelles.63 D'ailleurs, en 2006, le groupe de Chulhee Kim a publié un nanotube formé à l'aide d'une molécule amphiphile qui est elle-même faite à partir d'une pseudorotaxane (voir Figure 17).64 Plus récemment, le groupe de Masuda a utilisé les molécules amphiphiles pour permettre d'incorporer à l'intérieur même d'un nanotube un médicament anticancéreux le cis-dichlorodiamine platine (II) (CDDP) (voir Figure 18).65
Figure 17 : Nanotubes faits à partir d'une molécule amphiphile
.
1.3.2.1.2 Assemblage de petites molécules
Ceci ressemble beaucoup à la dernière section, à peu de choses près qu'il ne s'agit pas nécessairement de molécules amphiphiles. Il arrive à l'occasion que l'assemblage de
petites molécules donne des nanotubes. Par exemple, le groupe de Chen a démontré qu'il était possible d'obtenir un nanotube à partir du azacalix[2]triptycène[2]pyridine.66 Bien évidemment, il y a d'autres exemples dans la littérature.67,68
1.3.2.1.3 Empilements de macrocycles
Les empilements de macrocycles ont pour grand avantage de pouvoir facilement réguler le diamètre du nanotube. En effet, il suffit d'ajuster la taille du macrocycle. Par contre, il est généralement plus long et plus difficile d'obtenir un macrocycle qu'une petite molécule. Évidemment, il y a des macrocycles plus faciles à obtenir que d'autres. Les interactions qui permettent l'empilement de macrocycles sont en général les ponts H, les interactions π et les interactions de van der Waals.
1.3.2.1.3.1 Macrocycles de peptides
Figure 19 : Nanotube formé de macrocycles peptidiques
Le grand avantage d'utiliser des macrocycles de peptides est la grande connaissance que nous avons de la synthèse peptidique. De plus, il est possible de créer un synthon de deux acides aminés et d'utiliser ce synthon pour obtenir un macrocycle. Aussi, vu que les peptides contiennent plusieurs fonctions amides reconnues pour aider lors de la formation
de structures supramoléculaires grâce aux ponts H qu'elles peuvent facilement former, il n'est pas nécessaire d'ajouter des fonctions aidant les interactions supramoléculaires (voir Figure 19). Le premier à notre connaissance à avoir formé un nanotube à l'aide de macrocycles peptidiques est le groupe de Ghadiri en 1993.69 De plus, le même groupe a démontré en 1998 qu'il est possible d'utiliser ce type de nanotube pour faire des canaux ioniques dans des membranes (voir Figure 20).70 Bien évidemment, il y a plusieurs exemples de nanotubes faits de macrocycles de peptides.71
1.3.2.1.3.2 Macrocycles d'aryles conjugués
L'un des avantages de ce type de macrocycle est sa rigidité, ce qui limite l'effondrement des nanotubes. Il faut tout d'abord dire que les macrocycles d'aryles conjugués, lorsqu'ils forment un nanotube, sont généralement décalés latéralement les uns par rapport aux autres. En effet, cette conformation permettrait de minimiser les répulsions π-π et de maximiser les interactions entre les protons positifs et les cycles aromatiques négatifs.72
De plus, il est très rare d'obtenir les structures de rayons X de ces molécules. En effet, leur faible solubilité rend les cristaux extrêmement difficiles à obtenir. De plus, même lorsqu'il est possible d'obtenir les cristaux, il est par la suite difficile de les conserver suffisamment longtemps pour pouvoir faire l'analyse. Finalement, la résolution du
diffractogramme est généralement mauvaise. Malgré tout, après un an de travail, le groupe de Sheldrick a réussi à obtenir la structure de leur molécule. Il y a formation d'une structure tubulaire grâce à l'empilement de ses macrocycles, mais avec un décalage comme mentionné plus haut (voir Figure 21).73
Il est aussi possible avec ce type de macrocycles d'obtenir la structure désirée à l'aide de cations, tout dépendant qu'elle est la structure à l'intérieur même du macrocycle. C'est ainsi que le groupe de MacLachlan a réussi à obtenir une structure tubulaire à l'aide de son macrocycle de « base de Schiff » (voir Figure 22). Il a réussi à prouver l'obtention d'un
Figure 21 : Structure du macrocycle du groupe de Sheldrick
empilement de macrocycles à l'aide de la spectroscopie RMN et aussi à la spectroscopie UV/visible.74
Le groupe de Moore a lui aussi obtenu des structures tubulaires à l'aide de macrocycles d'aryles conjuguées. Il a utilisé des macrocycles de phénylacétylène. Encore une fois, l'empilement s'est fait à l'aide de macrocycles décalés latéralement et non l'un vis-à-vis de l'autre. Par contre, dans ce cas-ci, les macrocycles n'étaient pas uniquement légèrement décalés, mais plutôt le macrocycle du dessus se trouvant entre deux macrocycles du dessous (voir Figure 23).75
Il est aussi possible d'obtenir des nanotubes en ajoutant des groupements encombrants à chaque extrémité des macrocycles de phénylacétylène. Ainsi, grâce aux
Figure 23 : Macrocycles du groupe de Moore
interactions supramoléculaires des groupements à la périphérie du macrocycle, il est possible d'obtenir des structures tubulaires. À l'aide de cette technique, le groupe de Höger a ainsi réussi à obtenir un nanotube (voir Figure 24).76,77
Bien entendu, il y plusieurs autres types de macrocycles qui peuvent être utilisés lors de la formation de nanotubes. Il y a les macrocycles de saccharides78, les pillararènes79,80, etc.
1.3.2.1.5 Les foldamères
Les foldamères sont tout d'abord formés d'une simple chaîne. Il est donc possible de tout simplement obtenir un monomère et le coupler avec lui-même pour obtenir un oligomère. Il est donc relativement facile ici de réguler la longueur du nanotube qui est proportionnelle à la longueur de l'oligomère. Les interactions supramoléculaires font en sorte que l'oligomère se replie sur lui-même sous la forme d'une hélice formant ainsi une cavité en son centre. Les interactions utilisées pour aider à la formation de foldamères sont les ponts H et les interactions π (voir Figure 25).81
Il y a bien évidemment les foldamères formés d'acides aminés. Ces derniers sont faciles à synthétiser et présentes des groupements (amides) qui sont souvent utilisés lors de la formation de structures supramoléculaires.82 Il y a aussi les foldamères formés de phénylacétylènes où la structure ici est conservée grâce aux interactions π.83
1.3.2.2 Les nanotubes organiques liés de façons covalentes
Malgré les avantages d'utiliser la chimie supramoléculaire pour obtenir les nanotubes, elle comporte aussi plusieurs désavantages. En effet, un seul changement de paramètre, que ce soit le type de solvant, la température, le pH ou tout simplement la présence d'autres espèces en solutions peut faire perdre la structure. Cette faible stabilité limite grandement l'utilisation éventuelle de ces nanotubes, car il faut les utiliser dans des conditions très spécifiques et fixes. Pour ces raisons, les chercheurs travaillent sur l'alternative d'obtenir des nanotubes organiques liés de façon covalente.
Il y a quelques stratégies possibles, certaines utilisant aux premiers abords la chimie supramoléculaire, d'autres des gabarits ou tout simplement en montant le nanotube pièce par pièce. Il sera présenté ici quelques stratégies.
Il est possible d'obtenir un nanotube organique lors de la polymérisation de deux monomères pour ainsi obtenir un copolymère réticulé. Le groupe de Son est parti d'un tétrayne et d'un dibromo et, à l'aide d'une polymérisation par couplage de Sonogashira, il a obtenu un nanotube lié de façon covalente. Le simple fait de mettre les deux monomères ensemble ne suffit pas à obtenir le nanotube, il y a alors obtention d'un matériel microporeux. Par contre, si le dibromo est ajouté à l'aide d'une pousse-seringue, il est alors possible d'obtenir le nanotube organique (voir Figure 26).84
Une autre stratégie est d'utiliser la chimie supramoléculaire pour obtenir le nanotube désiré. Cette stratégie permet d'utiliser les avantages de la chimie supramoléculaire, c'est-à-dire l'utilisation d'unités relativement simples et faciles à synthétiser tout en évitant les inconvénients, c'est-à-dire l'instabilité du nanotube. Par contre, il faut réussir à faire la réticulation des unités dans les conditions qui conservent la structure, ce qui limite les possibilités. De plus, il faut que les unités possèdent à la fois les groupements permettant la structure supramoléculaire et qui permet la réticulation ce qui complexifie la synthèse de ces unités.
L'une des possibilités serait d'utiliser une polyrotaxane. Il y a plusieurs exemples dans la littérature de polyrotaxane et il est relativement facile de les obtenir. La polyrotaxane permet d'aligner les différents macrocycles face à face. Il suffit alors d'utiliser un macrocycle avec un centre qui permet une complexation avec une tige et des fonctions périphériques qui permettent la réticulation des différents macrocycles. La difficulté ici est de réussir à enlever la tige pour finaliser la synthèse du nanotube. Pour ces raisons, le groupe de Kamachi a décidé d'utiliser la cyclodextrine avec une chaîne d'éthylène glycol comme tige. Ils ont ainsi obtenu une polyrotaxane où les macrocycles sont très proches les uns des autres. Ils ont par la suite réticulé entre eux les différentes cyclodextrines à l'aide de l'épichlorohydrine avant finalement de retirer la tige centrale en enlevant le bloqueur à l'aide d'une base forte (voir Figure 27).85,86
Une autre méthode est d'utiliser les foldamères. En effet, il suffit de prendre le monomère, y ajouter un groupement permettant la réticulation et ainsi figer sa conformation après avoir obtenu la structure supramoléculaire désirée. C'est ainsi que le groupe de Khan a réussi à obtenir un nanotube organique lié uniquement de façon covalente. Premièrement, ils ont synthétisé un monomère contenant une liaison double
Figure 27 : Formation d'un nanotube à l'aide d'une polyrotaxane
permettant facilement de réticuler à l'aide de la lumière, ce qui permet de lier ensemble les différentes unités dans n'importe quelles conditions, permettant ainsi de garder les conditions idéales à la formation du foldamère. Par la suite, ils ont polymérisé cette unité grâce à un couplage de Sonogashira. Finalement, après avoir obtenu le foldamère, ils ont réticulé pour obtenir un nanotube lié de façon covalente (voir Figure 28).87
Une autre stratégie développée par le groupe de Zimmerman est d'utiliser plusieurs synthons différents ayant chacun des propriétés différentes dans le but de les assembler et d'obtenir ainsi un nanotube organique lié de façon covalente. Pour ce faire, ils ont utilisé une porphyrine sur laquelle il a ajouté des dendrons de type Fréchet contenant des groupements allyle. Par la suite, ils ont polymérisé cette unité au centre de la porphyrine à l'aide de l'étain présent et d'un diacide. Par la suite, ils ont réticulé l'extérieur du polymère à l'aide d'un catalyseur de Grubbs 1ère génération.Cette réticulation a permis de lier ensemble les différentes unités à la périphérie. Donc, les monomères étaient liés entre eux au centre (la porphyrine), mais aussi à la périphérie (les dendrons de type Fréchet). Finalement,
l'hydrolyse permet d'enlever la tige et ainsi d'obtenir un nanotube organique lié de façon covalente (voir Figure 29).88 Le nanotube de groupe de Zimmerman a par contre quelques défauts. Tout d'abord, il est court, ne comportant qu'environ sept unités de long. De plus, il est flexible, il peut donc facilement s'effondrer sur lui-même perdant ainsi ses propriétés tubulaires.
1.4 Rotaxanes
Vu qu'une grande partie de ce document parle des rotaxanes, voici une section théorique sur les rotaxanes et ainsi qu'une courte revue de la littérature.
1.4.1 Théorie sur les rotaxanes
En premier lieu, une rotaxane est une structure contenant une tige qui est à l'intérieur d'un ou de plusieurs macrocycles. La tige est maintenue en place grâce à des bloqueurs qui sont à chaque extrémité de la tige. Le macrocycle peut faire deux types de mouvement : une translation le long de la tige entre les deux bloqueurs et une rotation sur lui-même, autour de la tige (voir Figure 30).
Pour la nomenclature, en général, les rotaxanes sont nommées de la façon suivante : [x]rotaxane. Le chiffre x représente le nombre de morceaux (tige et macrocycle) formant la rotaxane. La rotaxane la plus simple est donc nommée [2]rotaxane, car elle comporte une tige et un macrocycle. Une [3]rotaxane comporte soit une tige et deux macrocycles ou deux tiges et un macrocycle malgré que le dernier cas soit beaucoup plus rare. De plus, il est possible de parler de pseudorotaxanes. La seule unique différence est l'absence de bloqueur. La tige peut donc sortir du macrocycle lorsque les conditions de complexation sont perdues.89
Il y a plusieurs façons d'obtenir une rotaxane. Une première méthode qui est très courante est de former la pseudorotaxane à l'aide d'une complexation entre la tige et le macrocycle. Par la suite, dans des conditions qui ne perturbent pas la complexation, il y a ajout des bloqueurs.21,23 Cette contrainte limite beaucoup le type de couplage existant entre la tige et le bloqueur. En effet, le type de solvant, les réactifs utilisés ainsi que la
température sont limités. Une autre méthode est de faire la complexation entre un macrocycle ouvert et la tige contenant déjà les bloqueurs. Par la suite, il suffit de faire la fermeture de cycle pour obtenir la rotaxane.22 Une troisième méthode est de faire la rotaxane directement à partir du macrocycle fermé et de la tige déjà bloquée. En augmentant la température, il est possible de faire passer le macrocycle par-dessus le bloqueur et ainsi former la rotaxane.24 Finalement, la dernière méthode est la méthode de reconnaissance active. Un métal complexé sur le macrocycle permet de catalyser le couplage entre les deux portions de la tige qui restent par la suite emprisonnées à l'intérieur du macrocycle. Le métal sert donc à la fois de gabarit et de catalyseur (voir Figure 31).25
1.4.2 Les éthers couronnes
Bien que la première rotaxane synthétisée a été faite en 1967, elle a été obtenue uniquement de manière statistique.90 Les éthers couronnes sont les premiers macrocycles à avoir été utilisés lors de la formation des premières pseudorotaxanes faites à l'aide de la chimie supramoléculaire. D'ailleurs, l'éther couronne reste toujours le macrocycle le plus utilisé lors de la formation des rotaxanes. De plus, nous nous sommes fiés à ce macrocycle lors de nos essais de formation de rotaxanes (voir section 4.4). Pour cette raison, il y aura dans ce document quelques éléments théoriques importants liés à l'utilisation des éthers couronnes lors de la formation des rotaxanes ainsi que quelques méthodes de formation des rotaxanes à l'aide de ce macrocycle.
En général, les éthers couronnes s'écrivent comme suit : [x]Cy. Le nombre x représente le nombre d'atomes total formant le cycle et le y représente le nombre d'atomes d'oxygène (et d'azote, le cas échéant) formant le cycle. Lorsqu'il y a des cycles benzéniques faisant partie du cycle de l'éther couronne, alors il sera écrit B[x]Cy lorsqu'il y en a un, DB[x]Cy lorsqu'il y en a deux, TB[x]Cy lorsqu'il y en a trois et ainsi de suite.
La majorité du temps, lors de la formation de rotaxanes, les éthers couronnes sont utilisés avec une tige contenant des fonctions ammoniums.91 D'ailleurs, c'est à l'aide d'un
ammonium secondaire que la première pseudorotaxane avec un éther couronne a été formée.20 Il est important de noter que ce ne sont pas tous les éthers couronnes qui peuvent former des rotaxanes avec les ammoniums. En effet, il y a certains critères à respecter. Lorsqu'il s'agit d'ammoniums secondaires, le plus petit cycle pouvant former une rotaxane est le [20]C6. De plus, selon la même publication du groupe de Wu, il n'est pas possible de former de complexation assez forte entre l'éther couronne et l'ammonium pour former une rotaxane lorsque l'éther couronne contient moins de six oxygènes.92 Il est aussi à noter que le groupe de Stoddart a découvert que pour la même tige, lorsque la rotaxane est faite avec le DB[25]C8 plutôt que le DB[24]C8, la constante d'association baisse de façon significative.93 D'ailleurs, plusieurs publications indiquent que les éthers couronnes dépassant la grandeur du DB[24]C8 forment des complexations beaucoup moins fortes.94,95
Les rotaxanes formées d'éthers couronnes sont en général formées soit par la méthode du coiffage, soit par la méthode du clippage. Dans les deux cas, lors de la formation de la [2]rotaxane, c'est-à-dire lors de l'ajout du bloqueur ou lors de la fermeture du cycle, selon le cas, il est important de garder les conditions de complexation. Cette particularité limite grandement le nombre de réactions possibles lors de la formation de la rotaxane.
Étant donné la grande variété des rotaxanes existantes, que les tests de formation de notre rotaxane ait été fait à l'aide de la méthode du clippage et que la plupart des rotaxanes formées à l'aide des éthers couronnes ont été faites à l'aide de la méthode du clippage, nous allons nous restreindre dans les prochaines lignes à cette méthode.
1.4.2.1 Diverses méthodes de formation
Comme mentionné un peu plus haut, en général, les rotaxanes qui ont comme macrocycle un éther couronne ont une fonction ammonium sur la tige. L'ammonium peut compliquer la réaction de formation de la rotaxane. En effet, pour ne pas déprotonner l'ammonium, les réactions avec des bases sont en général à proscrire.96 Par contre, il a
quelques exemples dans la littérature où il est possible de faire le coiffage en milieu basique.96 Il faut par contre bien choisir sa base pour éviter la déprotonation de l'ammonium. En général, l'utilisation d'une base très encombrée est utilisée. De plus, il est important de l'ajouter après la complexation entre la tige et le macrocycle. L'encombrement formé par le macrocycle autour de l'ammonium évite la déprotonation de l'ammonium par la base encombrée.96
Il est aussi important d'éviter tout chauffage. En effet, plus nous augmentons la température, plus la constante d'association baisse. Un autre élément important est que la réaction doit avoir lieu dans un milieu relativement concentré pour aider à la complexation. Finalement, il faut éviter le plus possible les solvants polaires qui limitent la complexation avec le macrocycle.20 Tous ces éléments limitent grandement plusieurs types de réactions et plusieurs types de synthons. Ces derniers doivent être non basiques et solubles à haute concentration dans des solvants apolaires à température pièce.27
Figure 32 : Formation d'une rotaxane à l'aide d'un isocyanate
Une des réactions possibles lors de la synthèse de rotaxanes est de former un uréthane à l'aide d'un alcool un d'un isocyanate. La réaction peut se faire à température de la pièce et à l'aide du catalyseur dibutyledilauréate d'étain (voir Figure 32).97 Cette réaction
se fait dans un solvant apolaire et sur une relativement courte période de temps, et ce, avec un bon rendement.
Une autre méthode est la formation d'un ester à partir d'un anhydride. Le tout peut encore une fois être fait dans une multitude de solvants apolaires à température pièce, et ce, avec un bon rendement. L'utilisation d'un catalyseur (PBu3) est par contre nécessaire. Fait
intéressant, l'utilisation du chlorure d'acide correspondant plutôt que l'anhydride ne donne qu'un faible rendement. Le groupe de Takata pense que l'ion chlorure libéré serait probablement trop basique et viendrait déprotonner l'ammonium de la tige (voir Figure 33).98
Figure 33 : Formation d'une rotaxane à l'aide d'une estérification
Il y a même eu formation d'une [2]rotaxane à l'aide d'un couplage de Sonogashira, et ce, au sein même du groupe Morin. Par contre, il est nécessaire d'être rigoureux sur le choix et la quantité de la base utilisée. Malgré tout, les meilleurs rendements tournent aux alentours de 25% (voir Figure 35).99
Une autre possibilité est la chimie clic.100 Par contre, en général, la chimie clic a lieu en milieu basique et à l'aide d'un catalyseur de cuivre. Il est toutefois possible de le faire sans aucun autre réactif lorsque nous ajoutons des esters de chaque côté de l'alcyne. En effet, l'alcyne devient ainsi très pauvre en électron et devient suffisamment réactif pour qu'il puisse réagir sans la présence de catalyseurs ni de bases. Le groupe de Stoddart a utilisé cette particularité de la chimie clic pour former leur [3]rotaxane.101 Pour ce faire, il a
Figure 35 : Formation d'une [2]rotaxane à l'aide d'un couplage de Sonogashira
chauffé à reflux dans le dichlorométhane pendant 4 jours. Malgré le chauffage qui peut diminuer la complexation et le rendement de formation de la rotaxane, le groupe a obtenu un rendement de 77% (voir Figure 34). Ce type de chimie clic sans catalyseur est très pratique, par contre, il limite le choix du bloqueur.
Il est aussi possible d'utiliser la chimie clic plus traditionnelle (c'est-à-dire à l'aide d'un catalyseur de cuivre et d'une base) lors de la formation d'une [2]rotaxane. En effet, le groupe de Coutrot a réussi à obtenir une [2]rotaxane à l'aide de la chimie clic en présence d'une base encombrée et d'un catalyseur de cuivre et ce, avec un rendement de 72% (voir Figure 36).102
1.5 Problématiques et objectifs
Nos deux objectifs globaux sont d'utiliser le macrocycle de phénylacétylène comme outils lors de la synthèse de nano-architectures plus complexes et l'obtention d'un nanotube organique rigide lié uniquement de façon covalente. Bien évidemment, pour ce dernier objectif, l'utilisation du macrocycle de phénylacétylène est de mise, car il est rigide et sa capacité à s'empiler pourrait être un atout. Ainsi, il serait possible d'obtenir un nanotube dans lequel les bordures de ce dernier ne s'effondreraient pas sur lui-même. Il suffit maintenant de trouver la stratégie pour réussir à obtenir la structure voulue.
Au cours des dernières années, nous avons travaillé sur plusieurs projets pouvant être séparés en trois catégories : le nanotube organique lié uniquement de façon covalente formé grâce à la polymérisation d'un macrocycle, le nanotube organique lié uniquement de façon covalente formé à partir d'une polyrotaxane et finalement, la formation d'un nanotube à partir de gels. Le deuxième projet découle des résultats obtenus lors du premier projet tandis que le dernier a été fait de manière parallèle.







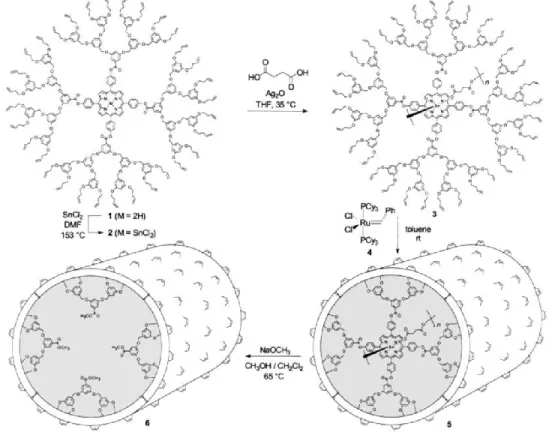
![Figure 34 : Formation de la [3]rotaxane du groupe de Stoddart](https://thumb-eu.123doks.com/thumbv2/123doknet/7446819.221032/53.918.305.668.692.1048/figure-formation-rotaxane-groupe-stoddart.webp)