HAL Id: dumas-01807896
https://dumas.ccsd.cnrs.fr/dumas-01807896
Submitted on 5 Jun 2018
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Distributed under a Creative Commons Attribution - NonCommercial - NoDerivatives| 4.0 International License
Mise au point sur les défauts primaires d’éruption :
établissement d’un protocole de soin
Rosalie Prioux
To cite this version:
Rosalie Prioux. Mise au point sur les défauts primaires d’éruption : établissement d’un protocole de soin. Chirurgie. 2018. �dumas-01807896�
ACADEMIE d’AIX-MARSEILLE
Mise au point sur les défauts
primaires d’éruption : établissement
d’un protocole de soin.
THESE
Présentée et publiquement soutenue devant la
Faculté d’Odontologie de Marseille
(Doyen : Monsieur le Professeur Jacques D
EJOU)
Aix Marseille Université
(Président : Monsieur le Professeur Yvon B
ERLAND)
Le 3 avril 2018
Par
PRIOUX Rosalie
Née le 9 avril 1993
à DINARD
Pour obtenir le Diplôme d’Etat de Docteur en Chirurgie Dentaire
E
XAMINATEURS DE LAT
HESE:
Président : Madame le Professeur
C. TARDIEU
Assesseurs : Monsieur le Docteur
M. LE GALL
Monsieur le Docteur JH. CATHERINE
Madame le Docteur
E. QUINQUE
ACADEMIE d’AIX-MARSEILLE
Mise au point sur les défauts
primaires d’éruption : établissement
d’un protocole de soin.
THESE
Présentée et publiquement soutenue devant la
Faculté d’Odontologie de Marseille
(Doyen : Monsieur le Professeur Jacques D
EJOU)
Aix Marseille Université
(Président : Monsieur le Professeur Yvon B
ERLAND)
Le 3 avril 2018
Par
PRIOUX Rosalie
Née le 9 avril 1993
à DINARD
Pour obtenir le Diplôme d’Etat de Docteur en Chirurgie Dentaire
E
XAMINATEURS DE LAT
HESE:
Président : Madame le Professeur
C. TARDIEU
Assesseurs : Monsieur le Docteur
M. LE GALL
Monsieur le Docteur JH. CATHERINE
Madame le Docteur
E. QUINQUE
ADMINISTRATION
DOYENS HONORAIRES Professeur R. SANGIUOLO
Professeur H. ZATTARA Professeur A. SALVADORI
DOYEN Professeur J. DEJOU
VICE –DOYEN Professeur J.D. ORTHLIEB
CHARGÉDESENSEIGNEMENTS
DIRECTEUR DU DÉPARTEMENT DE FORMATION INITIALE
VICE –DOYEN Professeur C. TARDIEU
CHARGÉDELARECHERCHE
DIRECTEUR DU DÉPARTEMENT DE LA RECHERCHE
DIRECTEUR DU DÉPARTEMENT DE FORMATION CONTINUE Professeur V.MONNET-CORTI
CHARGÉS DE MISSION Professeur F. BUKIET
Professeur A. RASKIN
RESPONSABLE DES SERVICES ADMINISTRATIFS ET TECHNIQUES Madame K. LEONI
PROFESSEUR ÉMÉRITE Professeur O. HUE
LISTE DES ENSEIGNANTS
56ème SECTION :
DEVELOPPEMENT,CROISSANCEETPREVENTION
56.01ODONTOLOGIE PÉDIATRIQUE ET ORTHOPÉDIE DENTO-FACIALE ODONTOLOGIE PÉDIATRIQUE
Professeur C. TARDIEU* Assistant I. BLANCHET Maître de Conférences D. BANDON Assistant V. MAGNAN Maître de Conférences A. CHAFAIE
Maître de Conférences associé A. CAMOIN
ORTHOPÉDIE DENTO-FACIALE
Maître de Conférences J. BOHAR Assistant M. BARBERO Maître de Conférences E. ERARD Assistant I. CAMBON Maître de Conférences J. GAUBERT Assistant L. LEVY Maître de Conférences M. LE GALL * Assistant R. MATTERA Maître de Conférences C. PHILIP-ALLIEZ Assistant C. MITTLER
Assistant A. PATRIS-CHARRUET
56.02PRÉVENTION-ÉPIDÉMIOLOGIE-ÉCONOMIEDELASANTÉ -ODONTOLOGIELÉGALE
Professeur B. FOTI* Assistant J. SCIBILIA Maître de Conférences D. TARDIVO
57ème SECTION :
CHIRURGIEORALE ;PARODONTOLOGIE ;BIOLOGIEORALE 57.01CHIRURGIE ORALE ; PARODONTOLOGIE ; BIOLOGIE ORALE PARODONTOLOGIE
Professeur V. MONNET-CORTI* Assistant A. BOYER Assistant C. DUMAS Assistant V. MOLL Assistant A. MOREAU
CHIRURGIE BUCCALE – PATHOLOGIE ET THÉRAPEUTIQUE - ANESTHÉSIOLOGIE – RÉANIMATION Maître de Conférences D. BELLONI Assistant E. QUINQUE Maître de Conférences J. H. CATHERINE *
Maître de Conférences P. ROCHE-POGGI Maître de Conférences associé F. CAMPANA
BIOLOGIE ORALE
Maître de Conférences P. LAURENT Assistant C. LE FOURNIS
65EME SECTION : BIOLOGIE CELLULAIRE
Professeur I. ABOUT* (Responsable de la Biologie orale)
58ème SECTION :
REHABILITATIONORALE
58.01RESTAURATRICE, ENDODONTIE, PROTHESES, FONCTION-DYSFONTION, IMAGERIE, BIOMATÉRIAUX
ODONTOLOGIE CONSERVATRICE, ENDODONTIE
Professeur F. BUKIET * Assistant B. BALLESTER Professeur H. TASSERY Assistant H. DE BELENET Maître de Conférences G. ABOUDHARAM Assistant A. FONTES Maître de Conférences C. PIGNOLY Assistant M. GLIKPO Maître de Conférences L. POMMEL Assistant S. MANSOUR Maître de Conférences E. TERRER Assistant L. ROLLET Maître de Conférences associé M. GUIVARC’H
PROTHÈSE
Professeur M. RUQUET* Assistant M. DODDS
Maître de Conférences G. LABORDE Assistant N. CHAUDESAYGUES Maître de Conférences M. LAURENT Assistant A. FERDANI
Maître de Conférences B.E. PRECKEL Assistant C. MENSE Maître de Conférences G. STEPHAN Assistant C. NIBOYET Maître de Conférences P. TAVITIAN Assistant A. REPETTO Maître de Conférences A. TOSELLO Assistant A. SETTE Maître de Conférences associé R. LAN
Maître de Conférences associé G. MAILLE
SCIENCES ANATOMIQUES ET PHYSIOLOGIQUES OCCLUSODONTOLOGIE, BIOMATÉRIAUX, BIOPHYSIQUE, RADIOLOGIE
Professeur J. DEJOU Assistant M. JEANY
Professeur J. D. ORTHLIEB * Professeur A. RASKIN
Maître de Conférences A. GIRAUDEAU Maître de Conférences B. JACQUOT Maître de Conférences J. P. RÉ
Maître de Conférences associé T. GIRAUD
A Madame le Professeur Corinne Tardieu,
Je vous remercie de m’avoir fait l’honneur d’accepter de présider ce jury de thèse. Merci pour vos conseils et la qualité de votre enseignement. Lors de vos cours interactifs, vous avez su ancrer chez vos élèves des automatismes précieux dans la prise en charge des enfants. Que ce travail soit le
A Monsieur le Docteur Michel Le Gall,
Je vous remercie pour l’intérêt spontané que vous avez porté à mon travail. Je suis honorée de votre présence en ce jour important. Merci pour votre disponibilité , vos conseils et votre grande sympathie, lors de vos cours participatifs en 5ème année, puis durant la rédaction de cette thèse. Vous avez su rendre votre discipline passionnante. Qu’il me soit permis de vous exprimer ici toute ma reconnaissance.
A Monsieur le Docteur Jean-Hugues Catherine,
Je vous remercie de l’honneur que vous me faites en acceptant de faire partie de ce jury de thèse. Je vous remercie pour votre gentillesse, votre écoute et la qualité de l’enseignement que vous prodiguez à vos étudiants. Merci de nous avoir accompagnés comme vous l’avez fait durant notre cursus. Veuillez trouver ici l'expression de ma gratitude la plus sincère et de ma profonde estime.
A Madame Le Docteur Emilie Quinque,
Je tiens à vous remercier d’avoir accepté la direction de cette thèse. Vous m’avez transmis le goût pour cette pathologie méconnue qu’est le DPE. Ce sujet passionnant que vous m’avez proposé m’a rendu l’écriture simple. J’ai apprécié votre implication et votre très grande disponibilité pour ce travail. Je tiens à vous remercier pour tout le temps que vous m’avez consacré et pour tous vos précieux conseils qui m’ont permis de mener à bien ce travail. Recevez ici le témoignage de mes sincères remerciements et de mon profond respect.
SOMMAIRE
Introduction
I. L’éruption dentaire physiologique ... 1
A. Développement dentaire avant l’éruption ... 2
1) Lame dentaire ... 2
2) Bourgeon dentaire... 2
3) Capuchon dentaire ... 3
4) Cloche dentaire ... 3
5) Différenciation terminale des odontoblastes et des améloblastes . 4 6) Rhizagenèse... 4
B. Les phases de l’éruption... 4
1) La phase pré-éruptive. ... 5
2) La phase éruptive pré-fonctionnelle ... 5
3) La phase post-éruptive ... 5
C. Les mécanismes de l’éruption... 6
1) Niveau tissulaire : rôle du follicule dentaire. ... 6
2) Niveau cellulaire ... 7
3) Niveau moléculaire ... 7
D. La chronologie de l’éruption ... 9
1) En dentition temporaire ... 9
2) En dentition permanente ... 10
II. Les pathologies de l’éruption ... 11
A. Echec d’éruption ... 11
1) Première étiologie : le dysfonctionnement biologique ... 11
2) Deuxième étiologie : l’obstruction mécanique ... 11
3) Troisième étiologie : les maladies syndromiques ... 12
B. Les retards d’éruption ... 13
2) Etiologies systémiques ... 14
3) Etiologies génétiques ... 14
4) Diagnostic de l’origine d’un retard d’éruption ... 15
C. L’ankylose ... 16
D. Le défaut primaire d’éruption (DPE), ... 17
1) Définition ... 17
2) Classification ... 18
III. Diagnostic du DPE ... 18
A. Signes cliniques ... 18
B. Signes radiologiques ... 20
C. Diagnostic génétique ... 21
D. Diagnostic différentiel avec l’ankylose ... 21
E. Diagnostic positif ... 22
IV. Le ParaThyroid Hormone Receptor 1 ou PTHR1 ... 24
A. Description ... 24
1) Description de PTHR1 ... 24
2) Description de ses ligands ... 25
B. Rôles dans l’éruption dentaire ... 26
1) Rôles au niveau osseux ... 26
2) Rôles au niveau du follicule dentaire ... 26
3) Rôles au niveau du ligament parodontal ... 27
C. Les mutations du gène PTHR1 ... 27
1) Rappels de génétique ... 27
2) PTHR1 ... 30
3) Pathologies liées à une mutation du gène PTHR1 autres que le DPE ………30
D. DPE et mutations du PTHR1 ... 32
V. Solutions thérapeutiques ... 35
A. Prises en charge orthodontiques ... 35
1) Orthodontie traditionnelle multi-attaches ... 35
2) Tractions sur ancrages osseux ... 36
B. Prises en charge chirurgicales ... 36
1) Ostéotomie segmentaire et déplacement du bloc alvéolo-dentaire ... 36
2) Extraction et remplacement ... 38
3) Décoronation et remplacement ... 38
C. Prises en charge chirurgico-orthodontiques ... 40
1) Luxation / Autotransplantation ... 40
2) Corticotomie et orthodontie ... 43
3) Ostéotomies et distraction ... 46
D. Solutions restauratrices et prothétiques ... 49
1) Prothèse fixe ... 49
2) Prothèse amovible ... 50
E. Abstention thérapeutique ... 52
1
Introduction
Le processus de l’éruption dentaire chez l’être humain est complexe et encore mal compris. De nombreux facteurs entrant en jeu, la compréhension de l’éruption est basée sur plusieurs théories.
Les pathologies touchant l’éruption dentaire sont un challenge pour les chirurgiens dentistes et orthodontistes dont le rôle est de mettre en place une thérapeutique sur des arcades en croissance. Traditionnellement, un traitement orthodontique est proposé aux patients présentant un échec d’éruption dentaire. Cependant, il n’a pas d’effet bénéfique chez les patients dont le gène PTHR1 est muté, on parle alors de Défaut Primaire d’Éruption (DPE).
Cette pathologie, initialement décrite par Proffit et Vig en 1981 [1], regroupe des tableaux cliniques divers. Le diagnostic est complexe du fait de la ressemblance de cette pathologie avec une ankylose.
De nombreuses solutions thérapeutiques peuvent être mises en place, permettant de soigner chaque individu présentant un DPE selon la situation clinique. Ce travail a pour but de proposer différentes traitements thérapeutiques du DPE. Pour cela nous nous intéresserons tout d’abord à l’éruption dentaire physiologique et pathologique, puis nous détaillerons ce qu’est le DPE et la mutation du gène PTHR1 pour pouvoir proposer les solutions thérapeutiques.
I.
L’éruption dentaire physiologique
L’éruption dentaire est le mécanisme physiologique qui conduit à amener la dent d’une position endo-osseuse jusqu’à sa position définitive en contact avec le milieu buccal dans une relation d’occlusion fonctionnelle au sein des arcades mandibulaire et maxillaire.
L’éruption débute juste après l’élaboration de la couronne dentaire. Il s’agit d’un processus localisé, symétrique et programmé dans le temps. L’éruption accompagne le développement de la racine, la mise en place du parodonte et le maintien d’une occlusion fonctionnelle. Elle concerne successivement les dentures temporaires et permanentes.
Au cours de l’éruption, plusieurs phénomènes se mettent en place simultanément : le développement en hauteur des procès alvéolaires, le déplacement de la dent au sein de l’os et, dans le cas des dents permanentes, la résorption radiculaire des dents temporaires jusqu’aux prémolaires. L’éruption dentaire fait partie intégrante de la croissance cranio-faciale de l’enfant. C’est un événement génétiquement programmé.
2
A. Développement dentaire avant l’éruption [2]
L’odontogenèse est classiquement décrite par la succession de divers stades : lame, bourgeon, capuchon, cloche dentaire, différenciation terminale des odontoblastes et améloblastes, rhizagenèse, et enfin éruption dentaire (fig. 1).
Figure 1 : Schéma illustrant les principales étapes de l'odontogenèse [1].
L’odontogenèse débute vers la 6-7ème semaine de la gestation par le développement des dents temporaires et s’achève vers 18-25 ans par la rhizagenèse des 3èmes molaires permanentes.
1) Lame dentaire
Au niveau des arcs mandibulaire et maxillaire, l’épithélium oral s’épaissi pour donner lieu aux lames dentaires en forme de fer à cheval.
2) Bourgeon dentaire
Chaque lame donne naissance à des bourgeons dentaires, épaississements épithéliaux plus conséquents et localisés correspondant à des dents individuelles. De même le mésenchyme sous-jacent se condense.
3
3) Capuchon dentaire
Les cellules épithéliales et mésenchymateuses se divisent activement, les bourgeons augmentent de volume et se transforment en capuchons dentaires. Ces capuchons dentaires se caractérisent par une concavité formée par l’ensemble des cellules épithéliales enveloppant partiellement le mésenchyme sous-jacent, future pulpe dentaire.
Progressivement, on observe une différenciation des cellules épithéliales en épithélium dentaire interne (EDI), en épithélium dentaire externe (EDE), en réticulum stellaire et en stratum intermedium.
L’EDI est une couche de cellules en contact de la future pulpe dentaire par l’intermédiaire d’une lame basale. L’EDE est une couche cellulaire située en périphérie du bourgeon et en contact du mésenchyme péridentaire. Le réticulum stellaire et le stratum intermedium se sont différenciés au centre du capuchon, ils sont entourés par l’EDI et l’EDE.
4) Cloche dentaire
Pendant le stade de cloche, progressivement, la lèvre épithéliale progresse en direction apicale délimitant de plus en plus la pulpe. La différenciation terminale des odontoblastes puis des améloblastes est initiée.
Les dents définitives commencent leur développement morphologique pendant l’odontogenèse des dents temporaires. Les dents de remplacement des dents déciduales se forment à partir de la région linguale de l’organe de l’émail de chaque dent temporaire (fig. 2). Quant aux molaires permanentes, elles se développent à partir d’une extension distale de la lame dentaire initiale.
4
5) Différenciation terminale des odontoblastes et des
améloblastes
Lors de cette différenciation terminale, les préodontoblastes se divisent une dernière fois, les cellules obtenues se polarisent et forment la prédentine. Puis on assiste à la différenciation terminale de L’EDI en améloblastes, cellule polarisée qui sécrète la matrice de l’émail.
On observe par la suite une minéralisation de ces tissus pour former la dentine et l’émail.
6) Rhizagenèse
La formation des racines débute en fin de développement coronaire, elle dépend de la progression apicale de la gaine de Hertwig formée par l’accolement de l’EDI et l’EDE. Au contact de l’EDI, les préodontoblastes radiculaires se différencient en odontoblastes fonctionnels et sécrètent la prédentine radiculaire. De même, les cémentoblastes se différencient et forment le cément.
B. Les phases de l’éruption
On peut décomposer l’éruption dentaire en trois parties selon leur chronologie : la phase pré-éruptive, puis la phase éruptive pré-fonctionnelle et enfin la phase post éruptive (fig. 3).
5
1) La phase pré-éruptive.
« Dès le début de la formation du germe dentaire jusqu'à l’achèvement de la couronne dentaire. »
Les mouvements pré-éruptifs positionnent le germe dans l’os alvéolaire avant d’amorcer la phase éruptive vers l’épithélium buccal. Ils résultent de la combinaison de deux facteurs : d’une part les mouvements effectués par le germe lui-même, et d’autre part, les mouvements « passifs » du germe dus à la croissance maxillo-mandibulaire.
2) La phase éruptive pré-fonctionnelle
« Dès que la formation de la couronne est achevée [3], jusqu'à l’émergence dans la cavité buccale. »
Lors de cette phase, la dent chemine à travers l’os alvéolaire en direction verticale. Cette migration osseuse est liée à un double phénomène : une résorption de l’os au niveau coronaire du follicule dentaire et une apposition osseuse au niveau de sa partie basale [4].
L’éruption intra-osseuse du germe s’accompagne de l’initiation de l’élongation radiculaire ainsi que du développement du ligament parodontal et de la jonction gingivale.
La phase éruptive pré-fonctionnelle se termine par la mise à jour de la dent dans la cavité buccale.
3) La phase post-éruptive
« Dès l’effraction gingivale puis tout au long de la vie.»
Après l’effraction gingivale, la dent poursuit son ascension jusqu’au contact occlusal des autres dents et devient alors fonctionnelle.
La phase post-éruptive se divise en deux étapes :
La phase pré-occlusale.
La dent est en contact avec le milieu buccal et se déplace jusqu’au contact des dents antagonistes.
6 Le follicule dentaire semble jouer un rôle peu important pendant cette phase et ce sont plutôt les facteurs biomécaniques (les pressions musculaires des joues, de la langue et des lèvres) qui influencent cette étape de l’éruption.
La phase post-occlusale.
Ces mouvements ont lieu après que la dent ait atteint le plan d’occlusion et se poursuivent toute la vie. Il s’agit de :
- Mouvements d’adaptation à la croissance des maxillaires.
Pendant l’adolescence, ces mouvements compensent la croissance alvéolaire pour permettre aux dents de rester en occlusion.
- Mouvements de compensation de l’usure occlusale.
Ils s’effectuent dans un plan axial grâce à l’action du ligament parodontal. - Mouvements de compensation de l’usure proximale ou « dérive
mésiale »
Ils ont une composante mésiale. Ils résultent de la combinaison des forces occlusales, de la contraction du ligament desmodontal et des pressions des tissus mous.
C. Les mécanismes de l’éruption [5]
Au cours du temps, de nombreuses hypothèses uni-factorielles ont été développées pour expliquer l’éruption dentaire (théorie de la pression hydrostatique, de l’édification radiculaire…). Aujourd’hui nous savons que l’éruption dentaire est un phénomène multifactoriel qui nécessite une résorption osseuse ainsi qu’une apposition osseuse. Dans le cas de l’éruption des dents permanentes, cette résorption est accompagnée de la rhizalyse des racines des dents temporaires. Le chemin éruptif est génétiquement localisé : il s’agit de l’élargissement du canal gubernaculaire. Celui-ci guide la dent vers la cavité buccale.
1) Niveau tissulaire : rôle du follicule dentaire.
L’éruption est un processus régulé par une série de signaux entre le follicule dentaire et l’os alvéolaire [4]. Le follicule dentaire est un sac de tissu conjonctif lâche qui entoure l’organe de l’émail de la dent à partir du stade de cupule. Il est interposé entre l’os et la dent, ce qui lui confère une localisation idéale pour réguler les évènements de l’éruption dentaire. Par la suite, il est destiné à former le ligament parodontal, l’os alvéolaire et le cément.
7 Le rôle du follicule est essentiel dans l’évolution de la dent :
- Il permet l’éruption de la dent par la résorption de l’os supra-coronaire et des racines des dents temporaires.
- Il favorise la formation des racines dentaires et du ligament parodontal.
Cahill et Marks ont démontré ce rôle essentiel du follicule dans l’éruption en remplaçant le germe par un morceau de métal. Le follicule contenant le métal à réalisé son éruption, ce qui prouve que le follicule est nécessaire et suffisant pour l’éruption [6].
2) Niveau cellulaire
Le sac folliculaire est richement vascularisé. Lors de l’éruption, les monocytes affluent dans le follicule puis vont proliférer et fusionner pour devenir des ostéoclastes. Les ostéoclastes sont responsables de la résorption du tissu osseux, ils créent le chemin d’éruption de la dent. A la base de la crypte osseuse, les ostéoblastes quant à eux synthétisent de l’os.
3) Niveau moléculaire
Nous avons vu que l’éruption dentaire était liée à deux phénomènes concomitants :
- D’une part à une résorption osseuse localisée au niveau coronaire de la crypte osseuse,
- D’autre part à une ostéogenèse dans la partie basale de la crypte.
Molécules liées à la résorption osseuse dans la partie coronaire de la crypte
Il existe des « gènes de l’éruption » transcrit et traduits dans le follicule dentaire et dans le réticulum étoilé en molécules responsables de l’éruption. [7]. Certaines de ces molécules permettent l’accélération de l’éruption, c’est le cas de l’Epidermal Growth Factor (EGF) et de Tumor Growth Factor (TGF). Par ailleurs, de nombreuses protéines telles que Colony Stimulating Factor 1 (CSF-1 ou M-CSF), Vascular Endothelial Growth Factor (VEGF) et Monocyte Chemoattractant Protein (MCP1 ou CCL2) sont impliquées dans le recrutement, la prolifération et la différenciation des monocytes.
8 Par la suite la différenciation des monocytes en ostéoclastes est réalisée suite à la liaison entre un ligand et son récepteur. Le ligand (RANK-L ou ODF) est présent à la surface des ostéoblastes et le récepteur (RANK) est situé sur les monocytes pré-ostéoclastes (fig. 4).
Figure 4 : Rôle des ostéoblastes dans l’activation des monocytes par la liaison RANK-RANKL (composition personnelle).
Enfin il existe un système de régulation sécrété par les cellules du follicule et qui inhibe la résorption osseuse : l’OstéoProtéGérine (OPG). Ce récepteur soluble se fixe au niveau de RANK-L. Ainsi la liaison RANK-RANK-L n’a pas lieu et le monocyte ne se différencie pas en ostéoclaste (fig.5).
9 Par ailleurs des études de Arai et al. en 1999 ont démontrées que CSF-1 induit l’expression de RANK et plus récemment, qu’il réduit l’expression génique de OPG ce qui favorise la résorption [8].
Molécules liées à l’ostéogénèse dans la partie basale de la crypte Les cellules folliculaires situées à la base du sac sécrètent la Bone Morphogenetic Protein 2 (BMP-2) qui contribue à la différenciation ostéoblastique. BMP-2 favorise l’ostéogénèse qui accompagne l’éruption dentaire et la formation radiculaire.
Des travaux chez la souris ont montrés qu’il existait une expression différente des gènes selon la localisation autour du germe : RANKL serait surexprimé au niveau coronal entrainant une résorption osseuse, et BMP-2 serait surexprimée dans la région basale de la crypte osseuse [9].
D. La chronologie de l’éruption [10]
L’éruption des dents temporaires puis des dents définitives suit une chronologie précise. Néanmoins, on observe une variabilité des dates d’éruptions selon des individus sans que cela soit pathologique. Certains facteurs, tels le sexe, l’environnement ou encore l’origine ethnique, influencent la chronologie de l’éruption.
1) En dentition temporaire (tabl.1)
L’éruption des dents temporaires se déroule sur 2 ans en moyenne. Elle débute vers 7 mois par la mise en place des incisives centrales mandibulaires et prend fin vers 30 mois par l’apparition des secondes molaires lactéales.
Dents temporaires Age moyen d’éruption
Incisives centrales mandibulaires 6-8 mois
Incisives centrales maxillaires 10 mois
Incisives latérales maxillaires 12 mois
Incisives latérales mandibulaires 14 mois
Canines 18 mois
Premières molaires 16 mois
Secondes molaires 20-30 mois
10
2) En dentition permanente (tabl. 2 et 3)
L’éruption des dents permanentes dure en moyenne 6 ans (excepté les troisièmes molaires). Elle commence vers 6 ans par les incisives centrales mandibulaires et se termine vers 12 ans avec les deuxièmes molaires. Les dents de sagesse font leur éruption entre 18 et 25 ans.
On observe une éruption plus précoce d’environ 6 mois chez les filles, accentuée à la puberté. La séquence d’éruption reste cependant la même pour les deux sexes avec une légère avance d’éruption entre la mandibule et le maxillaire.
Dents permanentes maxillaires
Age moyen d’éruption Filles
Age moyen d’éruption Garçons
Incisives centrales maxillaires 7,2 ans 7,47 ans
Incisives latérales maxillaires 8,2 ans 8,67 ans
Canines maxillaires 10,98 ans 11,69 ans
Premières prémolaires
maxillaires 10,03 ans 10,40 ans
Deuxièmes prémolaires
maxillaires 10,88 ans 11,18 ans
Premières molaires maxillaires 6,22 ans 6,40 ans
Deuxièmes molaires
maxillaires 12,27ans 12,68 ans
Tableau 2 : Chronologie de l’éruption physiologique des dents permanentes maxillaires [7].
Dents permanentes
mandibulaires Age moyen d’éruption Filles Age moyen d’éruption Garçons
Incisives centrales
mandibulaires 6,26 ans 6,57 ans
Incisives latérales
mandibulaires 7,34 ans 7,70 ans
Canines mandibulaires 9,86 ans 10,79 ans
Premières prémolaires
mandibulaires 10,18 ans 10,82 ans
Deuxièmes prémolaires
mandibulaires 10,89 ans 11,47 ans
Premières molaires
mandibulaires 5,94 ans 6,21 ans
Deuxièmes molaires
mandibulaires 11,66 ans 12,12 ans
11
II.
Les pathologies de l’éruption
Nous avons vu que l’éruption dentaire résultait d’un processus coordonné entre l’os alvéolaire et le follicule dentaire, par l’intermédiaire de nombreux signaux [4]. Une perturbation de ce processus peut entrainer des anomalies allant d’un simple retard d’éruption à l’échec total du mécanisme d’éruption [1].
On parle d’éruption pathologique lorsque l’éruption de la dent n’a pas lieu, est incomplète, mal localisée (ectopie...), ou encore lorsqu’elle présente une anomalie chronologique (précocité ou retard).
A. Echec d’éruption
On parle d’échec d’éruption lorsqu’une ou plusieurs dent ne parviennent pas jusqu’à leur position fonctionnelle dans la bouche. On parle de dent incluse si elle demeure dans l’os ou de béance (ou infraclusion) si elle a interrompu son éruption après l’effraction gingivale.
Selon Frazier-Bowers, on peut séparer les échecs d’éruption non syndromiques en deux catégories : les anomalies liées à une dysfonction biologique et les échecs dues à une obstruction physique [11]. On peut aussi noter des anomalies d’éruptions chez certains patients atteints de syndromes.
1) Première étiologie : le dysfonctionnement biologique
On observe une inclusion de la dent alors que la voie d’éruption est libre, c’est une anomalie qui touche le mécanisme de l’éruption lui-même. Parmi les anomalies, on trouve le défaut primaire d’éruption (DPE) et la rétention primaire.
2) Deuxième étiologie : l’obstruction mécanique
C’est cette étiologie qui est la plus répandue, la dent est bloquée dans son éruption par un obstacle physique. C’est le cas dans le défaut mécanique d’éruption (DME) où la dent est ankylosée, mais aussi en cas de tumeur (kyste, odontome), de manque de place sur l’arcade (dent temporaire résiduelle, dent surnuméraire, dysharmonie dento-maxillaire).
12
3) Troisième étiologie : les maladies syndromiques
On observe un échec d’éruption dans les maladies syndromiques suivantes : - Dysplasie cléidocrânienne [12],
La dysplasie cléidocrânienne est un syndrome à transmission autosomale dominante. Elle est caractérisée par une aplasie ou hypoplasie de la clavicule (absence partielle ou totale de la clavicule), par un retard d’ossification du crâne (persistance des fontanelles), par la présence de dents surnuméraires et par une petite taille.
On note aussi parfois chez les patients atteints une cage thoracique en forme de cloche, un agrandissement des os frontaux et occipitaux, une hypoplasie du pelvis et des phalanges distales, un hypertélorisme orbital (augmentation de la distance entre les yeux) ou encore des dents incluses.
- Syndrome de Rutherfurd [13] [14],
Il s’agit d’un syndrome génétique rare à transmission autosomique dominante. On retrouve chez les individus atteints les éléments suivants : fibromatose gingivale, retard d’éruption dentaire et dystrophie de la cornée.
- Syndrome GAPO [15],
Le syndrome GAPO est une pathologie de transmission autosomique récessive.
Les patients atteints présentent les symptômes suivants : un retard de croissance, une alopécie, une pseudo-anodontie par échec de l’éruption, et une atrophie progressive du nerf optique.
- Ostéopétrose autosomique récessive (ARO) [16],
L’ostéopétrose regroupe différentes pathologies ayant pour caractéristique commune une augmentation de la densité osseuse. Dans sa forme autosomique récessive, on peut noter une macrocéphalie avec un front proéminent, un défaut d’éruption dentaire avec des caries sévères. De plus l’expansion osseuse au niveau de la moelle peut entrainer des anémies, thrombopénies et leucopénies ; au niveau des nerfs, elle peut causer une perte de la vision et de l’audition.
- Dysplasie ostéoglophonique ou nanisme [17],
De transmission autosomique dominante, la dysplasie ostéoglophonique se caractérise par une faible croissance osseuse menant à des individus de petite taille. On peut décrire les symptômes suivants : anomalies craniofaciales (hypertélorisme, front proéminent), anodontie liée à un échec de l’éruption dentaire, prognathisme mandibulaire et macroglossie.
13 - Dysostéosclérose,
- Syndrome d’Apert, - Syndrome de Gardner, - Mucopolysaccharidose.
B. Les retards d’éruption
Le retard d’éruption est la pathologie d’éruption la plus répandue. Il se définit comme une éruption se déroulant à une date postérieure par rapport aux normes établies. De manière générale, on parle de retard pathologique six mois après les dates normales d’éruption pour les dents temporaires et un an après pour les dents permanentes.
Selon Rasmussen et Kotsaki, on mesure le retard d’émergence de la dent en Standard Deviations (SDs) : on considère l’éruption en retard si on mesure plus de 2 SDs par rapport aux dates de référence [18]. Une biologie d’éruption normale est définie par une éruption qui a lieu quand la racine de la dent a atteint approximativement 2/3 de sa longueur finale. S’intéresser à la longueur des racines peut alors aider au diagnostic d’un retard d’éruption.
Un retard d’éruption peut être liée à une anomalie locale, systémique ou encore génétique.
1) Etiologies locales [19]
Parmi les causes locales on trouve :
- Les anomalies du germe (malposition du germe, forme anormale, perles d’émail),
- Les troubles du développement (fentes labio-palatines, dysharmonie dento-maxillaire, radiations oro-faciales),
- Une lésion de la dent temporaire (perte prématurée, malposition, parodontite apicale, ankylose).
Enfin, la dent peut être bloquée à cause d’un obstacle qui empêche son éruption. L’obstacle peut présenter diverses formes :
- Une tumeur (tumeur odontogène et non odontogène),
- Une barrière muqueuse (hyperplasie gingivale, fibromatose gingivale, muqueuse cicatricielle suite à un traumatise ou une chirurgie),
14
2) Etiologies systémiques [19]
Les conditions suivantes peuvent être associées à des retards d’éruption : - Nutrition,
- Rachitisme,
- Anomalies endocriniennes (hypothyroïdisme, hypoparathyroïdisme, hypopituitarisme, pseudohypoparathyroïdisme),
- Chimiothérapie de longue durée, - Infection au HIV,
- Infirmité motrice cérébrale, - Dysostéosclérose,
- Drogues (phénytoïne), - Anémie,
- Maladies céliaques,
- Naissance prématurée et faible poids à la naissance, - Ichthyose,
- Hérédité familiale, - Tabac,
- Exposition hypobare,
- Intoxications à des métaux lourds (cobalt, plomb), - Idiopathique.
3) Etiologies génétiques [19]
On retrouve des retards d’éruptions parmi certaines maladies génétiques. C’est le cas des syndromes et maladies suivantes :
- Le syndrome d’Apert, - Le syndrome Carpenter, - Le chérubisme - La dysplasie chondro-ectodermale, - La dysplasie cleido-cranienne, - Le syndrome de Down, - La dysplasie ectodermale, - Le syndrome Ekman-Westborg-Julin, - L’ostéopétrose, - Le syndrome Gardners, - Le syndrome Gorlin, - La progéria, - Le syndrome Rothmund-Thompson, - L’amélogenese imparfaite,
- L’hypertrichose congénitale lanugineuse, - La dysplasie dentinaire,
15 - La mucopolysaccharidose, - La dyskératose congénitale, - L’épidermolyse bulleuse, - Le syndrome GAPO, - La maladie de Gaucher, - Le syndrome Laband, - Le syndrome Murray-Puretic-Drescher, - Le syndrome Rutherfurd, - Le syndrome Cross, - Le syndrome Hallermann-Streiff, - Le syndrome Buckley,
- La mucolipidose type II,
- Le syndrome Bloch-Sulzberger, - Le syndrome Mc-Cune-Albright, - La maladie de Menkes, - La neurofibromatose, - Le syndrome Goldenhar, - La dysplasie ostéoglophonique,
- L’ostéopathie striée sclérose crânienne, - L’ostéogénèse imparfaite, - Le syndrome oto-dentaire, - Le syndrome Parry-Romberg, - La sclérostéose, - Le syndrome Shokier, - Le syndrome SHORT, - Le syndrome Singleton-Merten, - La maladie de Von Recklinghausen, - Le syndrome de délétion 22q11.
4) Diagnostic de l’origine d’un retard d’éruption [19]
En premier on examine l’âge du patient et sa dentition clinique apparente.
On définit comme « retard d’éruption chronologique » une date d’éruption supérieure à 2 SDs par rapport aux normes de l’éruption.
Dans un second temps, on détermine la présence ou l’absence de facteurs pouvant gêner l’éruption.
Cela va permettre au praticien de considérer plusieurs maladies qui résultent de défauts de la structure, de la taille ou de la couleur de la dent. C’est le cas par exemple lors d’amélogenèses imparfaites, de dentinogenèses imparfaites, ou de dysplasies dentinaires.
16 Si le développement de la dent est normal, la troisième étape est de considérer l’âge dentaire du patient selon la formation des racines.
- « Une biologie d’éruption normale » est définie par une éruption qui a lieu quand la racine de la dent a atteint approximativement 2/3 de sa longueur finale.
- « Un retard biologique d’éruption » se défini comme une éruption dentaire n’ayant pas eu lieu malgré une racine atteignant les 2/3 ou plus de sa longueur finale.
- Enfin le patient peut présenter un retard chronologique d’éruption, associé à des racines de longueur inférieures au 2/3 de leur longueur finale. Dans ce cas le patient a simplement un âge dentaire qui ne correspond pas aux normes.
C. L’ankylose
On peut définir l’ankylose comme la fusion entre l’os et la racine : le ligament parodontal est absent. Dans le cas des dents immatures, elle entraine un retard ou une absence d’éruption de la dent et un défaut de croissance vertical de l’os alvéolaire autour de la dent.
Les étiologies de l’ankylose sont variées : problèmes métaboliques, génétiques et traumatiques.
Cliniquement l’absence de ligament parodontal autour de la dent se traduit par un son mat lors de la percussion de la dent.
Radiologiquement, on ne distingue pas l’espace du ligament autour de la dent. Cependant l’interprétation radiographique de l’absence de ligament n’est pas très fiable, surtout lorsque l’ankylose est localisée (très souvent au niveau inter-radiculaire). Le diagnostic radiologique et la percussion dépendent de l’étendue de la zone d’ankylose. Un test positif est fortement significatif mais un test négatif ne peut pas exclure l’ankylose.
Quand la fusion entre l’os et le cément empêche l’éruption de la dent, on parle de Défaut Mécanique d’Eruption (DME).
En pratique, DPE et DME peuvent être confondus : la dent concernée par ces pathologies n’est pas dans le plan d’occlusion.
17
D. Le défaut primaire d’éruption (DPE), 1) Définition
Le terme « Primary Failure of Eruption » (PFE) ou « Défaut Primaire d’éruption » en français, a été inventé par Proffit et Vig en 1981. Il correspond à un échec partiel ou complet de l’éruption d’une dent lié à une anomalie des mécanismes biologiques d’éruption, et en l’absence d’ankylose ou d’obstruction d’origine mécanique.
Les caractéristiques de cette pathologie sont exposées par Frazier-Bowers et al. en 2010 [11] : infra-occlusion des dents affectées, open-bite latéro-postérieur pouvant toucher de un à quatre quadrants, l’absence de réponse à la traction orthodontique et présence d’une voie intra-osseuse d’éruption libre (fig. 6).
La prévalence de cette anomalie dans la population générale est approximativement de 0,06% [20] avec un sex-ratio homme-femme de 1/2,25. Malgré cette faible prévalence les DPE ont des conséquences cliniques non négligeables.
Généralement, l’impact clinique est sévère et résulte en une déficience du processus de croissance de l’os alvéolaire dans les régions affectées. Les dents atteintes apparaissent à la base du défaut alvéolaire vertical et restent en infra-occlusion, c’est ce qu’on appelle l’infraclusion [21].
Initialement, les dents atteintes de DPE présentent une mobilité physiologique mais dans le temps, leur ankylose est inéluctable en particulier après une traction orthodontique.
18
2) Classification
Le DPE non syndromique peut être classé en trois types selon le système de Frazier-Bowers [11] (fig. 7) :
- Type I : Il est caractérisé par une infraclusion des secteurs postérieurs qui augmente progressivement de l’avant vers l’arrière de l’arcade.
- Type II : Il est caractérisé par un open bite non progressif.
- Type III : Il s’agit d’une combinaison des types I et II selon le secteur.
Figure 7 : Schéma explicatif présentant les DPE de type 1 et 2 (composition personnelle).
Selon Frazier-Bowers, cette variation de phénotype du DPE pourrait s’expliquer par une expression de PTHR1 selon un cadre spatio-temporel précis. Pour le type I, la dysfonction biologique apparaitrait au même moment du développement pour chaque dent ; alors que pour le type II, l’anomalie serait liée au stade de développement radiculaire [11].
III.
Diagnostic du DPE
A. Signes cliniques
La présence chez un patient des signes cliniques suivants nous orientent vers un diagnostic du DPE.
- On observe une infraclison uni ou bilatérale, les dents ne sont pas en occlusion (fig. 8).
19
Figure 8 : Photographie montrant une infraclusion côté droit [22].
- Les dents postérieures sont plus fréquemment affectées. Ainsi, les premières et deuxièmes molaires sont plus souvent atteintes que les prémolaires et les canines.
- Si une dent présente un défaut d’éruption, alors les dents qui lui sont postérieures seront aussi atteintes.
- Les deux dentures, temporaire et définitive, peuvent être atteintes.
- L’anomalie est souvent asymétrique (de 1 à 4 secteurs atteints).
- La dent affectée de DPE n’est pas ankylosée mais peut le devenir spontanément ou suite à l’application de forces orthodontiques (fig. 9).
Figure 9 : Modélisation 3D montrant des zones d'ankylose apparues suite à un traitement orthodontique sur une dent atteinte de DPE [23].
20
B. Signes radiologiques
L’analyse radiologique aide à affiner le diagnostic de DPE. On peut observer sur une radiographie les signes qui suivent :
- La dent atteinte reste incluse malgré la présence d’un chemin d’éruption libre (fig. 10).
Figure 10 : Radiologie panoramique montrant une 47 incluse malgré un chemin d’éruption dégagé [11].
- Présence d’un ligament parodontal.
- Tendance à la classe III squelettique mise en évidence par une télégraphie de profile [24].
Selon Frazier-Bowers, la classe III pourrait être le résultat d’une anomalie de développement du cartilage de la capsule nasale (qui participe au déplacement antérieur du maxillaire) entrainant une Classe III par hypoplasie maxillaire [25].
- Parfois présence d’anomalies radiculaires (racine de taille supérieure a la normale, apex courbés). L’aspect courbé des apex serait lié a la poursuite de l’allongement des racines au contact de la corticale osseuse malgré l’arrêt de l’éruption (fig. 11).
Figure 11 : Coupe sagittale d'un CBCT, 47 présente des apex en forme de crochets [26].
21
C. Diagnostic génétique
En 2001, dans une étude, Wysolmerski a rapporté qu’une altération du gène ParaThyroid Hormone Receptor 1 (PTHR1), pouvait être responsable de sévères impactions dentaires. Depuis, Decker et al. ont mis en évidence une mutation de PTHR1 qui est responsable de DPE [27]. Ce qui a été suivi de nombreuses études révélant d’autres mutations de PTHR1 [25] [28] [21] [26], aujourd’hui environ 30 variants ont été identifiés (cf tabl. 6).
Chez les patients atteints de DPE, la mutation est hétérozygote (elle apparait sur un seul allèle, l’autre étant sauvage) et se transmet selon un mode autosomique dominant. Le terme « autosomique » signifie qu’un chromosome autre que XY (gonosomes) est impliqué, et l’expression « dominant » indique que la présence d’un allèle muté suffi pour exprimer la maladie. Ainsi, si un des parents est atteint, l’enfant à une chance sur deux de recevoir son allèle muté, et donc une chance sur deux d’avoir un DPE.
Cependant, dans une étude récente, Jelani et al. ont identifié une nouvelle mutation de PTHR1 présente chez une famille atteinte de DPE et qui se transmet de façon autosomique récessive [29]. Cette altération récessive semble provoquer un phénotype plus sévère que les mutations dominantes liées au DPE.
En cas de suspicion d’un DPE (absence d’obstacle, signes cliniques et radiologiques de DPE), un interrogatoire rigoureux doit être effectué afin de mettre en évidence des antécédents familiaux d’anomalies d’éruptions qui confortent le diagnostic. Enfin c’est l’analyse génétique qui permet de poser le diagnostic de certitude. Malheureusement, cette analyse n’est pas encore accessible en pratique courante (coûts, délais, éthique).
D. Diagnostic différentiel avec l’ankylose [24]
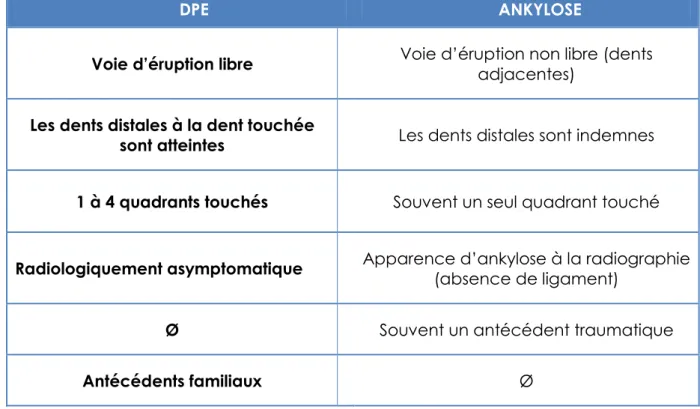
Nous avons vu que l’ankylose et le DPE avaient des tableaux cliniques semblables qui pouvaient mener à les confondre. Cependant il est essentiel de diagnostiquer si le patient présente une ankylose ou un DPE pour pouvoir appliquer les thérapeutiques appropriées à chaque pathologie.
Le tableau suivant énonce les signes cliniques et radiologiques qui diffèrent entre ankylose et DPE afin d’aider au diagnostic. Aujourd’hui, l’imagerie 3D permet de visualiser précisément les zones d’ankyloses. Cependant seul le diagnostic génétique apporte la certitude que le patient est atteint de DPE (tabl. 4).
22
DPE ANKYLOSE
Voie d’éruption libre Voie d’éruption non libre (dents adjacentes)
Les dents distales à la dent touchée
sont atteintes Les dents distales sont indemnes
1 à 4 quadrants touchés Souvent un seul quadrant touché
Radiologiquement asymptomatique Apparence d’ankylose à la radiographie (absence de ligament)
Ø Souvent un antécédent traumatique
Antécédents familiaux Ø
Tableau 4 : Signes permettant de faciliter le diagnostic différentiel entre DPE et ankylose.
E. Diagnostic positif (fig. 12)
Pour l’établissement d’un diagnostic de DPE parmi les anomalies d’éruptions non syndromiques, on commence par éliminer l’étiologie locale due à un obstacle mécanique (kyste, tumeur, manque d’espace, anomalie dentaire).
Puis on regarde la première molaire permanente : en cas de DPE, elle est quasiment toujours atteinte.
Pour différencier ankylose et DPE, on s’intéresse ensuite aux antécédents familiaux car la mutation de PTHR1 pouvant se transmettre, si quelqu’un d’autre dans la famille présente une anomalie d’éruption, alors on est face à un DPE.
Cependant, on peut observer un DPE chez un individu sans antécédent familial. Le diagnostic sera donc confirmé par l’analyse génétique.
23
Figure 12 : Arbre décisionnel pour le diagnostic des défauts d'éruptions (composition personnelle, d’après Rhoads [24] & Quinque [26]).
Néanmoins, dans une étude de Rhoads, certains patients présentent les signes cliniques du DPE sans présenter de mutation de PTHR1 ce qui semblerait indiquer qu’au moins un autre gène pourrait être responsable du DPE [24].
24
IV. Le ParaThyroid Hormone Receptor 1 ou PTHR1
A. Description
1) Description de PTHR1
Chez l’homme, le gène PTHR1 se situe sur le petit bras du chromosome 3 (locus 3p22-21.1). Son expression entraine la synthèse d’une protéine composée de 593 acides aminés : le ParaThyroid Hormone Receptor 1[11]. Ce gène est exprimé au niveau des reins, du foie, du cœur, de l’utérus, des ovaires… (fig. 13) [30] mais ici, c’est son expression au sein des ostéoblastes de la région du germe dentaire au moment de l’éruption dentaire qui nous intéresse.
Figure 13 : Expression du gène PTHR1 selon les tissus du corps humain [31]
PTHR1 est un récepteur couplé à une protéine G dont les ligands sont la parathormone ou ParaThyroid Hormone (PTH) et la ParaThyroid hormone-Related Protein (PTHrP). La fonction clé de PTH est la régulation du métabolisme du calcium alors que PTHrP joue un rôle majeur dans le développement du squelette.
Comme tout récepteur couplé à une protéine G, la structure de la protéine PTHR1 comprend 7 domaines transmembranaires, un système d’interaction avec la protéine G intra-cellulaire, et un domaine de réception des hormones extra-cellulaires (fig. 14).
25 La liaison d’un ligand (PTH ou PTHrP) sur son récepteur entraine l’activation de la protéine G, et de l’adénylate cyclase (AMPc) induisant la transmission d’un signal à l’intérieur de la cellule.
Figure 14 : Schéma détaillant la structure de la protéine PTHR1, et résumant les principaux variants nucléotidiques existants chez les patients atteints de DPE [21].
2) Description de ses ligands
Parathormone (PTH)
PTH est une hormone endocrine synthétisée par les glandes parathyroïdes et composée de 84 acides aminés. Son rôle principal est de maintenir le taux de calcium extracellulaire au niveau des os et du foie [32].
Parathyroïd hormone-related peptide (PTHrP)
Chez l’homme, l’hormone PTHrP est produite par de nombreux tissus (peau, endothélium, os, foie, bourgeons dentaire) et se compose de 141 acides aminés ou parfois en de 139 ou 173 acides aminés en cas d’épissage alternatif de l’ARNm [33]. PTHrP est une hormone paracrine et autocrine. Le rôle clé de PTHrP est de réguler le développement des os, du cœur, des glandes mammaires et d’autres tissus [34].
26
B. Rôles dans l’éruption dentaire
Nous avons vu que l’éruption dentaire a besoin d’une résorption osseuse coronaire pour que la dent puisse sortir de la crypte osseuse ainsi que d’une formation osseuse à la base du germe.
Par la fixation de ses ligands, nous allons voir que PTHR1 participe aux mécanismes de l’éruption.
1) Rôles au niveau osseux
Au niveau osseux, la fixation de PTH sur les ostéoclastes via son récepteur PTHR1, augmente la production de CSF-1 et de RANKL et diminue l’expression de OPG. CSF-1 induit l’expression de RANK au niveau des monocytes localisés dans le follicule dentaire et la liaison RANK-RANKL permet la différenciation et la fusion des monocytes en ostéoclastes (cf. partie I). Ainsi via PTHR1, PTH va permettre la résorption osseuse nécessaire à l’éruption dentaire [35] (fig. 15).
2) Rôles au niveau du follicule dentaire
Liu et al. ont découvert qu’après sa sécrétion par les cellules du réticulum stellaire puis sa fixation à PTHR1 au niveau du follicule dentaire, PTHrP protégeait le germe dentaire de l’envahissement par l’os alvéolaire [36].
Plus récemment, une étude sur des rongeurs a suggéré que des taux élevés de PTHrP au niveau du follicule dentaire avant l’éruption entrainaient une augmentation de l’expression de VEGF au niveau apical du germe et de
Figure 15 : Modulation de l’expression des gènes sécréteurs de OPG, RANKL et de CSF-1 à la suite de la fixation de PTHrP sur PTHR1 au niveau des ostéoblastes (composition personnelle).
27 BMP-2 au niveau basal [37]. Cette première molécule ayant un rôle dans la résorption osseuse et la seconde dans la croissance osseuse (cf partie I).
En 2014, une étude à montré qu’au sein du follicule dentaire, CSF-1 et PTHrP accélèrent l’expression de RANKL et inhibent l’expression de OPG ce qui augmente l’ostéoclastogénèse [38].
3) Rôles au niveau du ligament parodontal
Récemment une étude a montré que PTHR1 était présent au niveau des cellules ligamentaires. On pense qu’il aurait un rôle dans la modulation du remodelage osseux en agissant sur RANKL via PTHrP [39].
Une autre étude indique que PTHR1 est présent au sein les cellules progénitrices mésenchymateuses localisées autour des racines en formation. Sa liaison avec PTHrP serait essentielle pour la rhizagenèse notamment par la différenciation des cémentoblastes [40].
Les rôles du PTHR1 dans l’éruption sont donc essentiels à son bon déroulement puisqu’ils touchent de façon importante le remodelage osseux, le fonctionnement du follicule dentaire et de façon moins décryptée à ce jour le fonctionnement du ligament parodontal.
La compréhension de son rôle exact pourra permettre d’ouvrir des perspectives nouvelles dans le traitement des troubles de l’éruption.
C. Les mutations du gène PTHR1 1) Rappels de génétique [41]
Les chromosomes
Chez l’homme, l’information génétique (c'est-à-dire l’ADN) est fractionnée dans le noyau de chaque cellule sous forme de 23 paires de chromosomes (sauf les gamètes qui ont 23 chromosomes).
L’ADN
L’ADN a une structure bi-caténaire (deux brins complémentaires) et chaque brin est constitué d’un enchainement linéaire de sucres (désoxyriboses) liés par un acide phosphorique et présentant une base adénine, thymide, cytosine et guanine (A, T, C et G).
28
Le gène
Un gène est une séquence d’ADN occupant un site qui lui est propre dans le génome de l’espèce, sur un des chromosomes. Sa fonction est de coder une protéine ou un ARN. Un allèle est une variation de la séquence d’un gène.
La transcription
La transcription consiste en la synthèse d’un ARN messager, obtenu après l’ouverture des deux brins d’ADN. Sa structure est identique au brin sens du gène transcrit à l’exception du remplacement des bases thymides (T) par des uraciles (U), lesquelles sont positionnées sur une structure de sucres riboses et non désoxyriboses. Après une étape de maturation, l’ARNm se déplace du noyau vers le cytoplasme où s’effectue la traduction.
La traduction
La traduction conduit à l’obtention d’une chaine peptidique à partir de l’ARNm. Elle se fait par triplet de bases (ou codon) : un ensemble de trois bases correspond à un acide aminé ou à un codon STOP (UAA, UAG, UGA).
La traduction débute par la fixation d’un ribosome sur un triplet AUG (signal d’initiation), puis il se déplace le long de l’ARNm au fur et à mesure que l’ARNt apporte l’acide aminé correspondant à la séquence. Le codon STOP met fin à la traduction (tabl. 5). La suite d’acides aminés obtenue est une chaine peptidique, on parle de protéine à partir de 100 acides aminés.
Tableau 5 : Correspondance entre les triplets d'ARNm et les acides aminés de la chaine peptidique obtenue après traduction [42].
29
Mutation ponctuelle d’un gène « Single Nucleotide Polimorphism SNP » Une mutation ponctuelle d’un gène est une modification locale de sa séquence d’ADN par substitution (échange) d’une paire de base par une autre. Ainsi si une substitution apparait sur l’ADN, le triplet d’ARN est lui aussi modifié, ce qui peut entrainer le changement d’un acide aminé sur la protéine.
- Soit le triplet changé traduit le même acide aminé : pas de changement.
Exemple : UGU devient UGC : ces deux codons correspondent au même acide aminé cystéine (cf. tabl 5).
- Soit le triplet modifié est un codon STOP : la traduction sera interrompue précocement ce qui entraine une perte de fonction du gène sauf exception. On parle de mutation non-sens.
Exemple : UGU devient UGA : UGA est un codon STOP.
- Soit le triplet changé traduit un acide aminé différent : la protéine obtenue diffère par un acide aminé ce qui peut entrainer une perte ou un gain de fonction du gène. On parle de mutation faux-sens. Exemple : UGU devient UGG : l’acide aminé cystéine est remplacé par tryptophane dans la chaine peptidique.
De même, on parle de délétion lorsqu’une paire de base disparait et d’insertion lorsqu’une paire de base est ajoutée à la séquence.
- Si cela s’effectue sur une ou deux paires de bases, on observe un décalage du cadre de lecture entrainant sauf exception une perte de fonction.
- Si la délétion ou l’insertion s’exerce sur 3 paires de bases, il n’y a pas de décalage du cadre de lecture. Cela peut aboutir à une perte ou à un gain de fonction.
Mutation non ponctuelle de gène
C’est lorsque plus de 3 paires de bases sont substituées. Elle peut correspondre :
- A une délétion conduisant sauf exception à une perte de fonction du gène.
- A une insertion (comme lors d’infection à rétrovirus) conduisant sauf exception à une perte de fonction du gène.
30
2) PTHR1
Si on se réfère aux paragraphes précédents, on peut obtenir le raisonnement suivant pour PTHR1.
Chez un individu, dans le noyau des cellules, sur le chromosome 3, on retrouve deux allèles du gène PTHR1 entre les paires de base 46 877 746 et 46 903 799 (fig. 16). Après transcription et traduction de ce gène, on obtient une protéine dans le cytoplasme qui après maturation va devenir une protéine membranaire associée à une protéine G : le récepteur PTHR1.
Figure 16 : Localisation du gène PTHR1 sur le chromosome 3 chez l'homme entre les millions de paires de bases 46,88 et 46,9 [31].
3) Pathologies liées à une mutation du gène PTHR1 autres que
le DPE
Ce sont des pathologies causées par des mutations autosomiques ou récessives de PTHR1 et où l’on observe une dysplasie cartilagineuse ou osseuse.
Chondrodysplasie métaphysaire de Jansen [43]
La chondrodysplasie métaphysaire de Jansen est un syndrome rare (prévalence inférieure à 1/1 000 000), de transmission autosomique dominante et caractérisé par un nanisme et une hypercalcémie sévère.
Quatre mutations différentes du gène PTHR1 entrainant un gain de fonction ont été identifiées. In vitro, lorsqu’il est muté, PTHR1 provoque une accumulation de AMPc agoniste-indépendante.
Comme nous l’avions décrit précédemment, PTHR1 est exprimé au niveau du cartilage de croissance, où il intervient dans la régulation de la prolifération et de la différentiation des chondrocytes.
31 Cela explique que suite aux mutations du gène PTHR1 observées chez les patients atteints, on assiste à des problèmes de régulation de l’homéostase des ions minéraux et à des anomalies du développement du cartilage de croissance.
Enchondromatose ou maladie d’Ollier ou encore dyschondroplasie [44] L'enchondromatose est caractérisée par la présence d'enchondromes multiples avec une distribution asymétrique. Les enchondromes étant des tumeurs intraosseuses cartilagineuses généralement bénignes, qui se développent à proximité du cartilage de croissance.
La prévalence de cette maladie est estimée à 1/100 000, selon certains elle pourrait être liée à une mutation entrainant une perte de fonction du gène PTHR1 mais les chercheurs n’ont pas encore convenu si d’autres mutations sont associées.
Les signes cliniques de la maladie d’Ollier sont des déformations squelettiques, une asymétrie de longueur des membres et un risque potentiel d'évolution maligne vers un chondrosarcome.
Syndrome d’Eiken [45]
De transmission autosomique récessive, ce syndrome a été décrit uniquement dans une famille consanguine. Il s’agit d’une dysplasie osseuse caractérisée par une dysplasie épiphysaire multiple avec un important retard de l'ossification.
Une mutation du gène PTHR1 serait responsable de ce syndrome.
Chondrodysplasie létale de Blomstrand ou ostéochondrodysplasie de Blomstrand (BOCD) [46]
La chondrodysplasie létale de Blomstrand est un syndrome rare (prévalence inférieure à 1/ 1 000 000) à transmission autosomique récessive.
Il est caractérisé par une avance de la maturation osseuse et une accélération de la différentiation chondrocytaire, et à pour conséquence une mort précoce.
Cliniquement, les enfants atteints présentent des membres extrêmement courts. Radiologiquement, on peut distinguer une hyperdensité prononcée de tout le squelette et une ossification précoce.
La chondrodysplasie létale de Blomstrand est associée à une mutation de PTHR1 entrainant une perte de fonction du gène.
32
D. DPE et mutations du PTHR1
Comme pour les pathologies précédentes, le DPE est lié à une mutation du gène PTHR1 (cf. partie III, C. Diagnostic génétique). De nombreuses variations nucléotidiques responsables d’un phénotype de DPE ont été identifiées au cours du temps (tabl. 6).
1ère
identification Étude Changement de nucléotide Effet
2008 Decker et al. [27] c.1050-3C>G Cys351SerfsX133
2008 Decker et al. puis Roth et al. [21] c.543+1G>A Glu182Valfs*20
2008 Decker et al. puis Roth et a.l c.463G>T GGlu155X
2010 Frazier-Bowers et al. [25] puis Roth et al. c.1354-1G>A Gly452_Glu465del 2011 Yamaguchi et al. [47] puis Roth et al. c.356C>T Pro119Leu 2011 Yamaguchi et al. puis Roth et al. c.395C>T Pro132Leu 2011 Yamaguchi et al. puis Roth et al. c.439C>T Arg147Cys 2011 Yamaguchi et al. puis Roth et al. c.1148G>A Arg383Gln
2013 Risom et al. [28] c.1082G>A Trp361
2013 Risom et al. c.947C>A Ser316
2013 Risom et al. c.554-26_144-23del Glu182Alafs*38
2013 Risom et al. c.999G>T Gly330Val/altered splicing
2013 Risom et al. c.1348_1350del Phe450del
2013 Risom et al. c.892T>G Trp298Gly
2014 Roth et al. c.322delT Cys108Valfs*82
2014 Roth et al. c.813dupT Ala272Cysfs*127
2014 Roth et al. c.1036delC Leu346Trpfs*9
2014 Roth et al. c.1093delG Val365Cysfs*141
33
2014 Roth et al. c.331G>T Glu111X
2014 Roth et al. c.436C>T Arg146X
2014 Roth et al. c.636dupT Arg213X
2014 Roth et al. c.1016G>A Trp339X
2014 Roth et al. c.543+1G>A Glu182ValfsX20
2014 Roth et al. c.639-2A>C Intron
2014 Roth et al. puis Kanno et al. [22] c.639-2A>G Intron 2014 Frazier-Bowers et al.
[48] c.996_997insC A333fsX397
2014 Frazier-Bowers et al. c.572delA Y191fsX203
2016 Quinque et al. [26] c.1352A>G Q451R
2016 Jelani et al. [29] c.611T>C Val204Glu
Tableau 6 : Ensemble des variants de PTHR1 identifiés chez des patients aux phénotypes de DPE et leurs effets.
Comment un défaut génétique de PTHR1 peut il causer un échec d’éruption ? Le chemin d’éruption apparait dégagé, ce qui signifierait que la résorption nécessaire à l’éruption a eu lieu (fig. 17).
Frazier-Bowers émet l’hypothèse que la mutation de PTHR1 entrainerait un déséquilibre entre la résorption osseuse (nécessaire pour établir le chemin d’éruption) et la formation osseuse (au niveau basal du germe) au fur et à mesure que la dent migre [11].
Figure 17 : Radiologie panoramique montrant l'échec d'éruption d’une 47 malgré un chemin d'éruption dégagé [11].
34 Les études sur les souris ont permis de mieux comprendre les mécanismes cellulaires et moléculaires impliqués dans l’éruption dentaire, cependant ses déterminants génétiques et ses relations avec les anomalies d’éruptions sont encore mal connus.
On observe une grande variabilité de tableaux cliniques au sein des patients atteints de DPE et entre les différentes arcades d’un même patient. Cela suggère qu’il existe une combinaison entre des facteurs environnementaux et épigénétiques influençant le phénotype du DPE [24].
Dans une étude portant sur trois générations d’une famille, Frazier-Bowers à montré qu’une même mutation du gène PTHR1 (c.1353-1 G>A) pouvait s’exprimer différemment selon les individus. Ainsi par exemple sur les photographies suivantes, parmi les frères et sœurs, l’un présente un open-bite peu sévère unilatéral, classé type II alors que l’autre présente un open-bite bilatéral de type I très sévère [25] (fig. 18).
Figure 18 : Photographies montrant la variabilité d'expression de la même mutation PTHR1 entre deux frère et sœur [25].
Selon Roth, la cause du DPE serait l’haplo-insuffisance de PTHR1 : l’allèle sauvage ne suffit pas à compenser l’absence d’effet de l’allèle muté. Cela signifie que les cellules de l’individu atteint ne parviennent pas a synthétiser suffisamment du récepteur PTHR1 pour assurer sa fonction [21].
Dans son étude, il a découvert qu’une même mutation du gène PTHR1 (c. 1093delG) pouvait conduire à un DPE ou à un BOCD selon l’individu.
On peut alors penser que l’atteinte sera plus ou moins sévère selon un phénomène dose dépendant : la densité de récepteur PTHR1 à la surface des cellules étant diminuée chez le patient avec le DPE et nulle chez le patient atteint de BOCD.
![Figure 3 : Les phases de l’éruption [3].](https://thumb-eu.123doks.com/thumbv2/123doknet/5676425.138297/18.892.114.807.748.1118/figure-les-phases-de-l-éruption.webp)

![Tableau 1 : Chronologie de l’éruption physiologique des dents temporaires [7].](https://thumb-eu.123doks.com/thumbv2/123doknet/5676425.138297/23.892.116.795.821.1019/tableau-chronologie-l-éruption-physiologique-dents-temporaires.webp)
![Tableau 3 : Chronologie de l’éruption physiologique des dents permanentes mandibulaires [7]](https://thumb-eu.123doks.com/thumbv2/123doknet/5676425.138297/24.892.109.770.689.1007/tableau-chronologie-l-éruption-physiologique-dents-permanentes-mandibulaires.webp)

![Figure 10 : Radiologie panoramique montrant une 47 incluse malgré un chemin d’éruption dégagé [11]](https://thumb-eu.123doks.com/thumbv2/123doknet/5676425.138297/34.892.189.734.278.543/figure-radiologie-panoramique-montrant-incluse-chemin-éruption-dégagé.webp)
![Figure 12 : Arbre décisionnel pour le diagnostic des défauts d'éruptions (composition personnelle, d’après Rhoads [24] & Quinque [26])](https://thumb-eu.123doks.com/thumbv2/123doknet/5676425.138297/37.892.87.816.94.974/figure-décisionnel-diagnostic-défauts-éruptions-composition-personnelle-quinque.webp)
![Figure 13 : Expression du gène PTHR1 selon les tissus du corps humain [31]](https://thumb-eu.123doks.com/thumbv2/123doknet/5676425.138297/38.892.63.831.459.818/figure-expression-gène-pthr-selon-tissus-corps-humain.webp)
![Figure 14 : Schéma détaillant la structure de la protéine PTHR1, et résumant les principaux variants nucléotidiques existants chez les patients atteints de DPE [21]](https://thumb-eu.123doks.com/thumbv2/123doknet/5676425.138297/39.892.47.827.205.502/schéma-détaillant-structure-protéine-résumant-principaux-nucléotidiques-existants.webp)