UFR. SCIENCES ET IMAGERIE
THÈSE DE DOCTORAT
Présentée par
Sanaa EL MRINI
Discipline : Physique
Spécialité : Imagerie et Informatique
Etude de la performance de l'imagerie en parallèle combinant
l'encodage de sensitivité et l'écho de spin écho planaire
Soutenue le 02/07/2012 Devant le jury
Président
Pr. CHERKAOUI EL MOURSLI Rajaa
PES, faculté des sciences, Rabat.
Examinateurs
Pr. HAMRI Mohammed
PES, faculté des sciences, Rabat.
Pr. MASMOUDI Lhoussaine
PES, faculté des sciences, Rabat.
Pr. TAIRI Hamid
PH, faculté des sciences, Fes.
Pr. BOUKLATA Salwa
PES, faculté de médecine, Rabat.
Pr. EL ANSARI Mohamed
PH, faculté des sciences, Agadir.
N° d’ordre 2582
Avant-propos
Les travaux présentés dans le mémoire ont été effectués au laboratoire
d’électronique et de traitement du signal à la faculté des sciences de Rabat.
Je tiens dans un premier temps à remercier Monsieur Mohammed Hamri,
Professeur à La faculté des sciences de rabat, pour m’avoir confié ce travail de
recherches, ainsi que pour son aide et ses précieux conseils au cours de ces
années.
Je tiens à remercier Madame CHerkaoui EL Moursli Rajaa, Professeur à la
faculté des sciences de rabat, d’avoir accepté de présider le jury.
Je tiens à remercier chaleureusement Monsieur Lhoussaine Masmoudi,
Professeur à La faculté des sciences de rabat, pour ses remarques critiques et
ses conseils tactiques.
Je remercie également Monsieur Hamid Tairi, Professeur à la faculté des
sciences de Fès, pour sa sympathie, sa disponibilité, ses idées et conseils, ainsi
que pour son aide précieuse tout au long de ce travail.
Mes sincères remerciements sont adressés à Madame Salwa Bouklata
Professeur à la faculté de médecine de rabat et Monsieur Mohamed El Ansari
Professeur à la faculté des sciences de Agadir, pour avoir examiné ce travail et
d’avoir participé au jury malgré leur programme chargé.
Un très grand Merci! A toutes les personnes du Service Radiologie du CHU
Hassan II à Fès pour la bonne ambiance Dans laquelle on y travaille. Je
remercie particulièrement toutes les personnes qui ont acceptée de participer
bénévolement à nos expériences.
Table des matières
Avant-propos ... 1
Résumé ... 9
Abstract ... 10
Introduction Générale ... 11
Chapitre 1 : L’Etat de l’art sur l’Imagerie par Résonance Magnétique fonctionnelle (IRMf) ... 14
1.1 Principe de l’imagerie par résonance magnétique ...14
1.1.1 La précession libre...14
1.1.2. La résonance ...15
1.1.2.1. Effet d’une impulsion non sélective sur le MML ...16
1.1.3. Nécessité de la résonance ...16 1.1.4. La relaxation ...17 1.1.4.1. Retour à l’équilibre du MML ...17 1.1.4.2. Retour à l’équilibre du MMT ...17 1.1.4.3. Temps de relaxation ...19 a. Longitudinal ...19 b. Transversal ...19
1.1.4. Le codage spatial et l’imagerie par spin warp ...20
1.1.4.1. Le codage spatial ...20
1.1.4.2. L’espace k et la reconstruction par transformée de Fourier ...22
1.1.5. L’imagerie classique ...23
1.1.5.1. Echo de spin classique ...23
1.1.5.2. Echo de gradient ...25
a. La séquence de saturation partielle (MPGR) ...25
b. Valeur du moment magnétique transversal...25
1.1.5.3. La durée d’acquisition ...26
1.2. L’IRM fonctionnelle : CONTRASTES OBSERVABLES...27
1.2.1. Le volume sanguin...27
1.2.3. L’effet d’entrée de coupe ...28
1.2.4. L’oxygénation du sang : l’effet BOLD ...30
1.2.4.1. La diffusion ...33
1.2.4.2. Le déphasage intra-voxel ...33
Chapitre 2 : Méthodologie Instrumentale En IRMf ... 35
2.1. Facteurs de qualité de l’image ...35
2.1.1. Le rapport signal bruit RSB ...35
2.1.2. Le rapport contraste / bruit (RCB) ...35
2.2. La résolution temporelle ...36
2.3. La résolution spatiale ...36
2.3.1. Localisation des activations en contraste BOLD ...37
2.4. La sensibilité ...39
2.5. Imagerie rapide utilisée en IRMf ...40
2.5.1. La séquence Echo-Planar ...40
2.5.2. Les principaux paradigmes ...42
2.5.2.1. Nécessité d’un suivi dynamique de la réponse BOLD ...42
2.5.2.2. Interprétation d’un signal BOLD...42
2.5.2.3. Paradigmes classiques ...43
2.5.2.4. Paradigmes événementiels ...44
2.6. Les techniques d’acquisition parallèle ...45
2.6.1. Algorithmes de reconstruction en Imagerie parallèle/SENSE, SMASH, GRAPPA.. .46
2.6.1.1. La reconstruction dans le domaine image...46
2.6.1.2. La reconstruction dans le domaine fréquentiel ...48
2.6.1.3. Choix de l’algorithme de reconstruction ...48
2.6.2. Intérêts et défauts de l’imagerie parallèle ...49
2.6.2.1. Bénéfices de l’imagerie parallèle ...49
2.6.2.2. Inconvénients ...50
Conclusion ... 51
Chapitre 3 : Acquisition des images IRMf ... 52
3.1. Préambule ...52
3.3. Acquisition des images IRMf ...52
3.3.1. Préparation des volontaires: ...52
3.3.2. Acquisition des données...52
3.4. Traitement des images ...55
3.4.1. Prétraitement ...55
3.4.1.1. Correction de décalage d’acquisition entre les coupes fonctionnelles (“slice timing”) ...55
3.4.1.2. Correction du mouvement ...57
3.4.1.3. Normalisation spatiale ...58
3.4.1.4. Lissage spatial ...58
3.4.1.5. Recalage intra ou inter-modalités ("Coregister"") ...58
3.4.2. Analyse de données fonctionnelles ...59
3.4.2.1. Méthodologie SPM ...60
3.4.2.2. Construire un modèle ...60
3.5. Délimitation de la région motrice par Logiciel Pickatlas 2.3 ...62
3.5.1. Introduction ...62
3.5.2. Les aires de Brodmann ...62
3.5. 3. Description du logiciel pickatlas ...62
Conclusion ... 64
Chapitre 4 : Résultats et discussion ... 65
4.1 Introduction ...65
4.2 Les aires d’activation : ...65
4.3. Tableau récapitulatif des résultats ...68
4.4. Informations générales : ...70
4.5. Calcul du volume de l’activation ...70
4.6. Coefficient de régression ...72
4.7. Analyse statistique des résultats ...73
4.8. Discussion ...74
Conclusion générale... 77
Bibliographie ... 78
Liste des figures
Figure 1.1 : comportement du noyau d’hydrogène individuel en présence d’un champ
magnétique B0.
Figure 1.2 : composantes transversale ( ⃗ ) et longitudinale ( ) du moment magnétique macroscopique total.
Figure 1.3 : action d’une impulsion RF sur le MML d’un corps. Au début le corps possède un
moment longitudinal . Pendant l’impulsion le moment tourne autour de (Oy’ ) dans le plan x’Oy’ à la vitesse . A la fin de l’application du CMT, le corps possède un MML mais aussi un MMT.
Figure 1.4 : pendant la relaxation, le moment macroscopique M décrit une trajectoire en
forme de pavillon de trompette.
Figure 1.5 : valeur de la projection sur l’axe x du MMT dans le repère fixe (sinusoïde
amortie).
Figure 1.6 : le cas représenté illustre une séquence classique en écho de spin en 2D pour
deux tissus A et B avec > et > .
Figure 1.7 : illustration d’une séquence classique 2D en écho de gradient[8]
Figure 1.8 : illustration schématique de l’effet « inflow » communément utilisé en
angiographie par temps de vol.
Figure 1.9 : effet du déséquilibre entre les augmentations du CBF et du niveau
d’oxygénation sur la concentration en déoxy-Hb dans les cappillaires.
Figure 1.10 : profil 3D de la variation locale du champ magnétique, induite par la différence
de susceptibilité magnétique (Δχ), à l’intérieur et à l’extérieur d’un cylindre (vaisseau) plongé dans un champ magnétique principal .avec r= + , Y est la saturation du sang , Δχ la différence de susceptibilté entre le sang complétement oxygéné et le milieu intersticiel , l’intensité du champ principal, θ et ф des angles tenant compte de la configuration géométrique du cylindre (vaisseau) par rapport à la direction du champ et à l’orientation du voxel.
Figure 2.1: effet de la taille de vaisseaux sur la variation du signal BOLD entre un état de
repos (de signal ) et un état d’action (de signal ), à différentes intensités du champ principal , pour les séquences en écho de spin (ES) et en écho de gradient (EG). Ces résultats sont obtenus par simulations en utilisant le modèle déterministe de diffusion de Bandettini et Wong [56].
Figure 2.2 : séquence utilisée en EPI en écho de spin (ES) et en écho de gradient (EG) et
trajectoire induite par les gradients de codage de phase et de fréquence dans l’espace k. une seule impulsion RF est suffisante pour générer le train d’échos d’un plan de l’objet imagé. Les commutations du gradient de lecture indiquent le sens de lecture avec les instants correspondants.
Figure 2.3 : paradigmes de type « bloc » avec une ou plusieurs conditions d’activation. Figure 2.4 : paradigmes évènementiels à stimuli brefs avec temps de stimuli fixes ou
variables, et avec un ou plusieurs types d’évènements.
Figure 2.5 : variation périodique dans le temps d’un paramètre c du stimulis dans les
paradigmes du type « fourrier ». Ce paradigme active de manière périodique les neurones qui sont sélectifs à une gamme de valeurs du paramètre. La valeur « préférée » du neurone détermine le décalage temporel du signal observé.
Figure 2.6: principes de la reconstruction de l’image avec l’algorithme SENSE
Figure 3.1 : Chaîne de prétraitements dans le cas où les coupes d’un volume fonctionnel
sont acquises en mode SEQUENTIEL. Les flèches en gras représentent la configuration dans laquelle vous vous trouverez le plus souvent
Figure 3.2: Surface latérale cérébrale présentant les aires de brodmann cf annexe 1
Figure 3.3 : PickAtlas GUI. Le volet à gauche répertorie les types d'Atlas et est utilisé pour
naviguer dans les sous-régions des atlas. Le volet à droite énumère les régions sélectionnées.
Figure 4.1 : Visualisation de type “glass-brain” pour un mouvement simple de la main droite. Figure 4.2 : Superposition des activations sur un rendu 3D.
Figure 4.3 : exemple de tableau résumant les résultats statistiques au niveau du volume. Figure4.4: graphique représente le volume de l’activation des six volontaires aux
différentes séquences.
Figure 4.5: graphique représente l’intensité maximale des six volontaires aux différentes séquences d’acquisition
Liste des abréviations
BOLD Blood Oxygenation Level Dependent. CMT Champ magnétique tournant.
EG Echo de gradient.
EPI Echo-Planar Imaging.
ES Echo de spin.
FID Free Induction Decay (décroissance d'induction libre). FOV Field Of View (champ de vue).
IRM Imagerie par résonance magnétique.
IRMf Imagerie par résonance magnétique fonctionnelle. MML Moment magnétique longitudinal.
MMT Moment magnétique transversal. RMN Résonance magnétique nucléaire. ROI Region Of Interest (région d’intérêt). RSB Rapport signal/bruit.
SPM Statistical Parametric Map.
TE Temps d’écho.
TEP Tomographie à émission de positons. TR Temps de répétition.
CBF Cerebral Blood Flow (flux sanguin cérébral). CBV Cerebral Blood Volume (volume sanguin cérébral). déoxy-Hb Déoxy-hémoglobine.
EEG ElectroEncéphaloGraphie.
EPISTAR Echo-Planar Imaging with Single Targeting and Alternating RF. EVI Echo-Volume Imaging.
FAIR Flow Insensitive alternating Inversion Recovery. Fe Bande passante du signal RMN.
MPGR Multi-Planar Gradient Recalled. NEX Nombre d’excitation.
RCB Rapport contraste/bruit. RF Impulsion radiofréquence. RSB Rapport signal/bruit.
SPECT Single Photon Emission Computer Tomography (tomographie simple photon). SPGR Spoiled GRASS Recalled.
TEP Tomographie à émission de positons. SENSE Sensitivity Encoding.
ASSET Array Spatial Sensitivity Encoding Technique
GRAPPA GeneRalized Auto-calibrating Partially Parallel Acquisition SMASH SiMulaneous Acquisition of Spatial Harmonics
Résumé
l’objectif de ce travail est de valider la performance de la technique d’acquisition d’imagerie d’écho de spin echo planaire utilisant l’acquistion en paralléle en mode ‘SENSitivity Encoding:SENSE’ en la comparant aux différentes techniques d’acquisition d’imagerie d’écho de gradient écho-planaire utilisant l’acquisition en parallèle en mode SENSE classiquement en usage et aussi avec les séquences d’écho de gradient écho-planaire et celle de l’écho de spin écho-planaire. Cela consistera en une comparaison de la performance des séquences et leurs sensibilités à une activité motrice réfléchie par une activation recueillie dans l’aire motrice du cerveau.
Des analyses d’image de volontaire seront traitées individuellement. Une analyse de groupe sera aussi effectuée. Ainsi, les techniques d’analyse d’images telle que la normalisation, le lissage etc. seront d’usage. L’analyse sera effectuée en utilisant ‘Statistical Parametric Mapping’ opérant sous Matlab.
Abstract
This work aims to validate the performance of spin echo and parallel acquisition in mode ‘SENSitivity Encoding: SENSE’ by comparing it to different imaging techniques of gradient echo-planar using the parallel acquisition in mode SENSE usually used and gradient echo sequences and that of the echo of echo-planar spin. It compares the performance of sequences and their sensitivity to a motor activity reflected by activation within the motor part of the brain.
Image analysis of volunteers will be processed individually. Powered by cluster analysis. Image analysis techniques such as normalization and smoothing will be used. Analysis will be carried out using ‘Statistical Parametric Mapping’ operating under Matlab.
Introduction Générale
L’Imagerie par Résonance Magnétique fonctionnelle (IRMf) est une technique permettant la localisation, la cartographie et l’évaluation de l’activité fonctionnelle cérébrale. Cette technique utilise les phénomènes de relaxation de la magnétisation transversale en T2 et T2* pour acquérir des séries d’images de l’état d’activation cérébrale durant l’exercice d’une fonction donnée pour extraire l’activation correspondante et la cartographie par la suite. L’activation acquise est reflétée par un rehaussement de signal dans les images IRM, ce rehaussement est dû à l’augmentation du niveau de l’oxygénation (oxygène paramagnétique) du cortex impliqué dans la fonction à explorer. Ce phénomène ou ce signal est connue sous le nom de BOLD (Blood Oxygenation Level Dependent).
Cependant cette technique d’acquisition est très sensible aux artefacts de susceptibilité magnétique. Ainsi, des zones d’interface entre deux tissus de susceptibilité magnétique différente (liquide céphalorachidien-matière blanche) ou des zones d’interface entre le tissu et le milieu extérieur (tissu cérébral-air: tissu cérébrale est situé à la proximité des sinus nasaux ou auditives ). Ceci est devenu plus critique quand on travaille avec des systèmes IRM opérant à haut champ magnétique telle qu’à 3 Tesla.
L’imagerie écho-planaire (EPI) [1] est couramment utilisée dans l’IRM fonctionnelle (IRMf). Elle est appliquée dans la majorité des méthodes de l’IRMf de type (BOLD) [2] ainsi que d’autres séquences de l’imagerie fonctionnelle telles que ‘Arterial Spin Labeling’ (ASL) [3] ou Vascular Space Occupancy (VASO) [4]. Pour IRMF de type BOLD, l’Imagerie Echo du Gradient écho planaire (EG EPI) est très populaire puisque les images du cerveau entier sont bruitées et contrastées avec une résolution suffisamment élevée afin de mieux échantillonner la réponse BOLD.
une alternative intéressante pour l’IRMf à des intensités de champs élevées est assurée par le contraste basé sur T2 de l’Echo de Spin (ES), qui résulte des changements dans la moyenne dynamique extra vasculaire et des changements intra vasculaire dans le T2 effectif du sang, tous les deux sont associés à l’effet BOLD, l’atténuation du signal due au moyenne dynamique est induite par la diffusion, contrairement aux effets de déphasage statique dans les inhomogénéité de champs autour des vaisseaux les plus larges, n’est pas
recentré dans l’expérience de l’écho du spin du moment qu’elle s’agit d’un processus aléatoire.
Des intensités de champs plus élevées, entrainent une spécificité spatiale intrinsèquement meilleure, vu que la contribution relative du compartiment intra vasculaire est réduite, et le signal est pondéré vers la microvasculature, c'est-à-dire prévu être plus proche au « vrai » site de l’activité neuronale [5-10]. Tandis qu’à 1.5 T, l’activité de la contribution intra vasculaire au signal de l’IRMf-ES domine [11], le signal intra vasculaire se dissipe à une hyper puissance de champs comme 9.4T [7]. À 3T, encore presque la moitié du changement du signal fonctionnel est d’origine intra vasculaire [12,13], mais la spécificité accrue de l’ES sur l’EG pourrait être démontrée [14]. La mesure quantitative de l’étendue spatiale de la réponse BOLD [6] a montré une fonction d'étalement du point plus étroite de 13% pour ES-EPI,avec une réduction de 3 fois le CNR fonctionnel.
Un avantage additionnel de l’imagerie ES est son insensibilité aux gradients de susceptibilité ce qui donne comme résultat des vides substantiels importants du signal dans les images EG.
La plus grande majorité des études cognitives ont employé les séquences EG, qui sont sensibles aux vaisseaux larges ainsi qu’aux petits capillaires.Les séquences ES, en contraste éliminent les contributions non-spécifiques du signal BOLD des changements extravasculaires du signal BOLD autour des veines vaisseaux et sont moins sensibles à la réduction du signal relatif à la susceptibilité. Il a été suggéré qu’avec le contraste ‘ES’, une résolution spatiale des images fonctionnelles plus élevées peut être atteindre pourvu que les changements du signal intra vasculaire soient éliminés et que l’activation dans les régions touchées par des forts gradients de susceptibilités [5], tels que le cortex orbitofrontal, puisse être localisées [15],des études précédentes ont montré que l’IRMF basée sur l’ES est un outil puissant pour présenter l’activation fonctionnelle dans les cortex visuels et moteurs primaires [16, 17,18,19] .Lowe et al ont montré que le contraste de l’ES à 3T peut être soumis à des études cognitives de l’IRMf [11, 14, 20, 21] .
L’activation mesurée à l’aide des deux séquences l’EG et ES-EPI a été trouvée dans les mêmes régions responsives du visage. Pourtant, l’étendue spatiale de l’activation, la
signification statistique et l’amplitude du signal de type IRMf étaient significativement moindres dans les données de l’ES-EPI[22].
Ainsi, l’objectif de ce travail est de valider la performance de la nouvelle technique d’acquisition d’imagerie d’écho de spin écho-planaire utilisant l’acquisition en parallèle en mode ‘SENSitivity Encoding’(SENSE) en la comparant aux différentes techniques d’acquisition d’imagerie d’écho de gradient écho-planaire utilisant l’acquisition en parallèle en mode SENSE classiquement en usage et aussi avec les séquences d’écho de gradient écho-planaire et celle de l’écho de spin écho-planaire.
Cette étude consistera en une comparaison de la performance des séquences et leurs sensibilités à une activité motrice exprimée par une activation recueillie dans l’aire motrice du cerveau. Ainsi, quatre séquences écho planaires ont été consécutivement utilisé ; une séquence d’écho de gradient, une séquence d’écho de gradient avec SENSE, une séquence d’écho de spin et une séquence d’écho de spin avec SENSE.
Ce document est organisé en quatre chapitres, le premier présente les bases de l’imagerie par résonnance magnétique et les techniques de l’IRM fonctionnelle. Le deuxième chapitre est consacré à la description de la méthode utilisée. Le troisième et le quatrième chapitre comportent la présentation des résultats obtenus et leur analyse statistique.
Chapitre 1 : L’Etat de l’art sur l’Imagerie par
RésonanceMagnétique fonctionnelle (IRMf)
1.1 Principe de l’imagerie par résonancemagnétique 1.1.1 La précession libre
L’IRM exploite les propriétés des moments magnétiques nucléaires des tissus biologiques que l’on veut imager. Ceux-ci sont plongés dans un champ magnétique principal supposé constant et homogène et communément noté B0. Dans un milieu paramagnétique,
les moments magnétiques excités sont en moyenne (statistiquement) orientés dans le sens du champ B0. En plus de leur moment magnétique, les noyaux atomiques possèdent un
moment angulaire, une propriété quantique appelée le spin. Plutôt que de simplement s’aligner dans la direction du champ principal, les noyaux individuels précessent autour de leur axe principal dans le sens des aiguilles d’une montre. La fréquence de précession est proportionnelle à l’intensité du champ d’excitation principal B0 ainsi qu’au moment
magnétique des noyaux. Elle est en revanche inversement proportionnelle au moment angulaire. La fréquence de précession f0 est définie par la relation de Larmor :
f = − Eq.1
Soit 42.6Mhz/Tesla pour le proton.Où est le rapport entre les moments magnétique et angulaire de la particule appelé rapport gyromagnétique.
Figure 1.1 : comportement du noyau d’hydrogène individuel en présence d’un champ magnétique B0
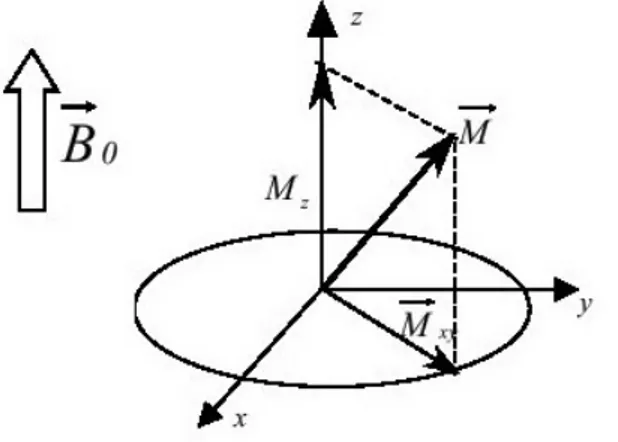
Le moment magnétique macroscopique ⃗ peut être décomposé en deux projections, l’une stationnaire suivant l’axe (Oz) notée ou encore MML (Moment Magnétique longitudinale), l’autre tournante dans le plan transversal (xOy) notée ou encore MMT (Moment Magnétique Transversale). Hors état de résonance, le MMT moyen observable est statistiquement nul alors que la composante suivant (Oz) est différente de 0.
Figure 1.2 : composantes transversale ( ⃗ ) et longitudinale ( ) du moment magnétique macroscopique total.
1.1.2. La résonance
Ces effets ont été élucidés il y a quarante ans grâce aux travaux de Felix Bloch [23,24] et d’Erwin Hahn [25]. Si les spins microscopiques précédents sont soumis, en plus du champ , à une impulsion de champ magnétique noté perpendiculaire à et tournant à la fréquence caractéristiques de la précession des spins (conditions de résonance) dans le plan transversal, les composantes du MML et du MMT subissent un basculement caractéristique de la largeur de l’impulsion radiofréquence (RF). Cet angle dit de basculement est définie par la relation :
= − < > Eq.2
Où ( ) est l’amplitude moyenne de l’impulsion RF dans l’intervalle de temps , celui-ci étant la largeur de l’impulsion RF.
1.1.2.1. Effet d’une impulsion non sélective sur le MML
Considérons une situation où le système de spins est à l’équilibre dans le champ magnétique B0. Le MMT est nul. On perturbe le système en appliquant un champ RF de
fréquence f0 et on se place dans un référentiel tournant à cette même fréquence. Sous
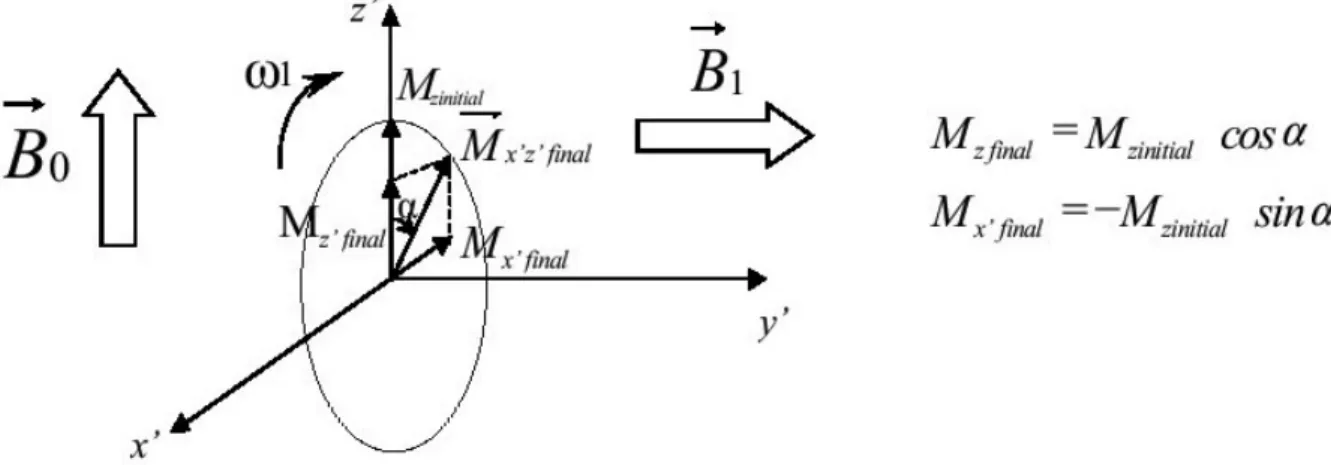
l’effet du champ magnétique tournant (CMT) le MMT initial s’écarte de sa position initiale dans le plan x’Oz ‘ à la vitesse = − . La figure 1.3 illustre cette action.
Figure 1.3 : action d’une impulsion RF sur le MML d’un corps. Au début le corps possède un moment longitudinal . Pendant l’impulsion le moment tourne
autour de (Oy’) dans le plan x’Oy’ à la vitesse . A la fin de l’application du CMT, le corps possède un MML mais aussi un MMT.
Ainsi une impulsion = /2 communément utilisée en imagerie, annule le MMl et crée un MMT de même module. Une impulsion = , transforme le MMT en un autre MML de direction opposée. Il n’apparait pas de MMT après l’impulsion . De la même manière, une impulsion RF peut agir sur le MMT d’un corps hors équilibre, situation crée par une impulsion antérieure. On peut facilement retrouver des relations analogues aux précédentes en procédant à une décomposition appropriée des différents moments. De manière générale, des impulsions sont souvent appliquées alors que coexistent un MML et un MMT. L’effet se déduit alors en étudiant séparément l’action de l’impulsion sur chacun de ces moments magnétiques.
1.1.3. Nécessité de la résonance
Quand une impulsion RF est appliquée à un corps, elle agit sur tous ses moments magnétiques microscopiques (nucléaires et autres). Son action n’a toutefois de traduction
macroscopique que sur le moment magnétique dû aux moments microscopiques dont la fréquence de précession est égale à la fréquence de l’impulsion. En effet, si la condition de résonance est remplis pour tous les moments protoniques du corps, alors les déplacements des moments provoqués par l’impulsion sont «cohérents» et conduisent à un déplacement « semblable » du moment magnétique macroscopique du corps. Par contre, si la condition de résonance n’est pas remplie, les déplacements des moments d’une catégorie donnée ne sont pas cohérents et l’effet de l’impulsion est ainsi, en moyenne, annulé. La résonance permet donc de sélectionner une catégorie déterminée de moments nucléaires.
1.1.4. La relaxation
C’est l’ensemble des phénomènes qui accompagnent le retour à l’équilibre d’une grandeur physique à partir d’un état d’excitation. Les temps de relaxation sont les durées pour que les grandeurs macroscopiques décrivant l’état du corps retrouvent leur valeur d’équilibre.
1.1.4.1. Retour à l’équilibre du MML
A la suite du basculement du MML et du MMT et l’annulation de l’impulsion RF, la valeur de Mz augmente jusqu’à ce qu’elle tend vers sa valeur d’équilibre. Plus précisément,
le retour de Mz décrit une loi exponentielle en fonction du temps[23,26] :
( ) = Eq.3
Où M0 est la valeur d’équilibre et T1 est le temps de relaxation longitudinal (quelques
centaines de ms à 1s pour les tissus biologiques).
1.1.4.2. Retour à l’équilibre du MMT
On se place dans le cas où un MMT vient d’être créé par une impulsion de CMT. A partir de cet instant, la RF est annulée et le corps ne subit que l’influence de B0. On constate
alors que la valeur Mxy du MMT décroit avec le temps pour tendre vers 0. Ceci est illustré
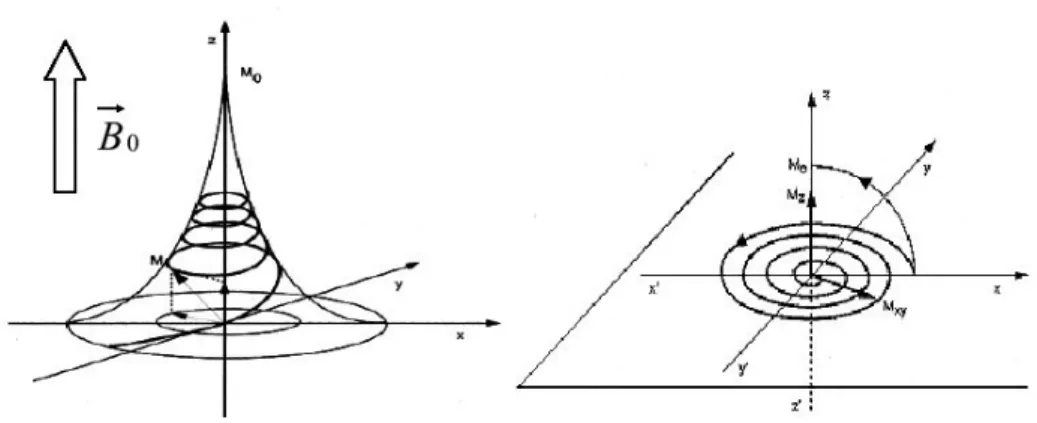
sur la figure 1.4. Cette décroissance est en revanche délicate à décrire dans le repère fixe à cause de la modulation à la fréquence de précession. Si on se place dans un repère x’Oy’ tournant à f0 comme précédemment (figure 1.4 de droite), la direction du MMT est fixe.
( ) = ( ) Eq.4
Où Mx’y’(0) est la valeur du MMT initial à la fin de l’application de la RF. T2 est appelé
temps de relaxation transverse (quelques dizaines de ms pour les tissus biologiques à imager).
Figure 1.4 : pendant la relaxation, le moment macroscopique M décrit une trajectoire en forme de pavillon de trompette.
Dans le repère fixe, l’expression complexe instantanée du moment transversal est décrite par le signal exponentiel précédent modulé par une onde harmonique à la fréquence de précession f0 :
M (t) = M (0)e e( ) Eq.5
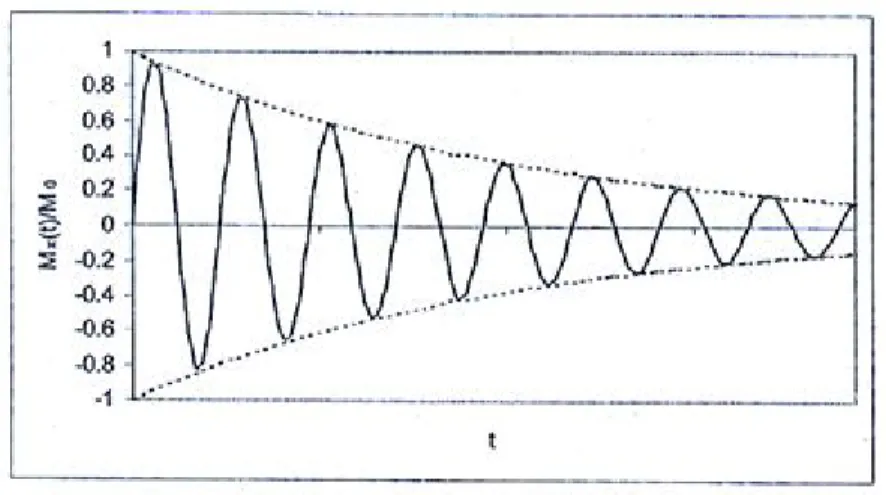
Dans le cas d’une impulsion α=π/2, ce signal est communément appelé signal de décroissance d’induction libre (DIL) (Free Induction Decay : FID). La Figure 1.5 représente un exemple de signal DIL.
Figure 1.5 : valeur de la projection sur l’axe x du MMT dans le repère fixe (sinusoïde amortie)
1.1.4.3. Temps de relaxation a. Longitudinal
A la suite du basculement α du MML et de MMT et l’annulation de l’impulsion RF, les moments magnétiques microscopiques µ se remettent en phase par basculement de l’état d’énergie vers l’état . Les transitions bas haut étant plus probables, ceci conduit à une augmentation de l’aimantation longitudinale . Chaque transition est accompagnée d’un transfert d’énergie ℏ des protons vers leur environnement. L’énergie cédée est finalement dissipée dans le corps par effet Joule. Cette relaxation, accompagnée d’un transfert d’énergie est aussi appelée relaxation spin-réseau.
b. Transversal
Simultanément à la relaxation longitudinale, il apparait des déphasages entre les moments microscopiques dans le plan transvesal d’où une déroissance de la composante transversale . Ce déphasage aboutit à une distribution au hasard des moments dans le plan transversal ce qui annule le MMT. Ce déphasage a une double origine :
- Chaque moment protonique est soumis à perturbé par la composante sur z du champ local altérant ainsi sa fréquence de Larmor et provoquant une perte de cohérence et donc un déphasage. L’ensemble de ces déphasages réduit le MMT qui est la somme vectorielle des moments individuels. D’autre part, les transitions complexes simultanées d’un moment de l’état haut à l’état bas et vice versa, sont aussi à l’origine de ce déphasage. Cette relaxation est dite spin-spin ( ').
- Une autre origine est liée à la relaxation spin-réseau ( '') induisant un transfert d’énergie vers le réseau cristallin voisin du moment protonique.
Dans la pratique, il apparait en plus une perte de signal issue du MMT du fait des inhomogénéités du champ ( ) et des phénomènes de diffusion ( ). Ceci se traduit par une diminution du temps de relaxation transversal. En fait, on appelle temps de relaxation transversal apparent * la quantité :
∗ = + + + + ( ) = + Eq.6
Les autres termes regroupent l’ensemble des variations dues à des phénomènes perturbateurs de la relaxation transverse tels que la variation de certains paramètres physiologiques ou biophysiques comme on peut le constater dans le contraste BOLD par exemple.
Les temps de relaxation longitudinal et transversal dépendent des tissus imagés. On présente un tableau donnant les valeurs des temps de relaxation longitudinaux et transversaux moyens de quelques milieux biologiques à 1.5T [27]:
Tissus T1 (en ms) T2 (en ms)
Substance grise 920 100
Substance blanche 790 90
Sang 1200 180
Liquide céphalo-rachidien 2400 300
1.1.4. Le codage spatial et l’imagerie par spin warp
1.1.4.1. Le codage spatial
L’idée d’utiliser le signal RMN pour des fins d’imagerie a été initialement introduite par Lauterbur [28]. La fréquence de précession dépendant du champ local, cet auteur a proposé de coder l’espace en appliquant un champ magnétique variant en chaque endroit de l’espace à imager. Il est ensuite possible de distinguer des signaux provenant de différents
emplacements en fonction de leur fréquence. Le principe consiste à coder l’espace d’acquisition par l’application de trois gradients orthogonaux et linéaires avec la cote de la direction qui les caractérisent :
= − = + , = , = { , , } Eq.7
Le marquage par les gradients, et donc la distinction spatiale des voxels dans l’espace 3D à imager, suit les étapes élémentaires suivantes :
- Sélection d’un niveau de plan : par impulsion sélective en imagerie 2D ou par déphasage en 3D. Le gradient utilisé à cette étape est appelé gradient de sélection de coupe.
- Sélection d’un numéro de ligne du plan au moyen d’un gradient utilisant les variations linéaires de phase. Ce gradient est appelé gradient de préparation ou gradient de codage de phase.
- Sélection d’un numéro de colonne de la ligne par un gradient de codage de fréquence. Ce gradient est appelé gradient de lecture ou gradient de codage de fréquence.
Afin d’acquérir un volume donné, il faut appliquer gradients de codage de plan par gradients de codage de phase par gradients de lecture. Ceci résulte donc en × × échantillons appelés pixels (élément d’une image 2D) ou voxels (éléments d’une image 3D).
Les dimensions réelles de l’objet imagé sont donc :
( ×δz ; × ;Nx×δx), où δz, δy et δx sont les résolutions spatiales dans les trois directions principales. Elles sont chacune, inversement proportionnelles aux gradients qui les caractérisent. Par ailleurs, lors de la lecture du signal échantillonné pendant la mesure, la transformation de Fourier suppose que le signal issu du MMT mesurable sur l’antenne réceptrice est constant pendant la durée de l’échantillonnage. Cependant, ce signal subit une décroissance du fait de déphasage des spins au sein d’une même colonne sous l’action du gradient de lecture. Ceci incite à produire un signal d’écho et échantillonner le signal mesurable à son maximum au temps d’écho TE où il sera considéré constant. L’écho sera soit
1.1.4.2. L’espace k et la reconstruction par transformée de Fourier
Les images recueilles en IRM sont complexes et sont obtenues par échantillonnage temporel dans un espace particulier appelé l’espace k [26]. Chaque point de l’objet lu est caractérisé par ses paramètres physiques (T1, T2, densité de protons), et aussi par une phase
et une fréquence particulière, acquise à cause des effets des gradients appliqués permettant de le distinguer spatialement. On établit alors une correspondance entre l’espace originel (spatial) et le domaine d’échantillonnage temporel (fréquences spatiales ou espace k).
On note les composantes kx et ky (en 2D) associées aux fréquences spatiales :
kx/y= ∫ / ( ). /
Eq.8 Où est la durée d’application de chaque gradient.
Chaque point de cet espace correspond à un échantillon de l’objet imagé codé par la phase et la fréquence des gradients de champ appliqués à ce moment. Les détails grossiers de l’image se trouvent au centre de l’espace k (faible fréquence). A cet endroit le RSB est meilleur grâce à une meilleure cohérence des spins. Les détails fins de l’image sont obtenus en parcourant les régions éloignées du centre. En s’appuyant sur les expressions analytiques du signal recueilli en IRM, on s’aperçoit facilement qu’une simple transformation de Fourier des données complexes temporelles, démodulées de la porteuse à la fréquence de précession f0, permet de retrouver l’image complexe originelle dans le domaine spatial et
vice versa.
L’image finale d’un objet réel doit théoriquement être réelle. Les valeurs en +k et en –k sont donc complexes conjuguées [29]. Il serait alors trivial de n’acquérir que la moitié de l’espace k, l’autre moitié sera déduite en inversant le signe de la partie imaginaire de la première (méthode HFS). Cependant, à cause des nombreuses sources d’artefacts affectant le signal (hétérogénéités de champ, non uniformité de la pénétration de la RF, mouvement du patient etc.), des distorsions de phase apparaissent. Par conséquent, l’image module reconstruite est généralement utilisé après transformation de Fourier des données de l’espacek.
1.1.5. L’imagerie classique
1.1.5.1. Echo de spin classique
Une impulsion π/2 est appliquée pour annuler le MML et créer un MMT. Un signal DIL (décroissance d’induction libre) est donc créé. Une impulsion écho gène π est ensuite appliquée après un temps T=TE/2 pour induire le signal d’écho après le même temps T. Les
séquences en écho de spin permettent de corriger les inhomogénéités du champ statique grâce à l’impulsion π. On montre que le signal mesuré dû au MMT dépend de T2 égale à T2*
diminué des effets d’hétérogénéités de champ statique.
A partir des évolutions du MML et du MMT illustré dans la figure 1.6, on remarque que l’intensité du signal recueilli à l’antenne dépend des temps de relaxations ainsi que de la densité de protons ρ dans l’échantillon. Ainsi, si le temps de répétition TR est long et le TE
sont cours, seul le MMT est à l’équilibre. L’image subit l’influence de T1 (pondération en T1).
Les tissus à plus faibles T1 apparaissent plus intenses (Ex : IRM cérébrale la matière blanche
plus intense que la matière grise plus intense que le liquide céphalo-rachidien). Finalement, si le TR et le TE sont longs, l’image est pondérée en T2. Cependant, ces indications gardent une
valeur didactique et des arrangements des paramètres peuvent être nécessaires, pour l’écho de gradient par exemple, afin d’obtenir les pondérations souhaitées en minimisant les artefacts.
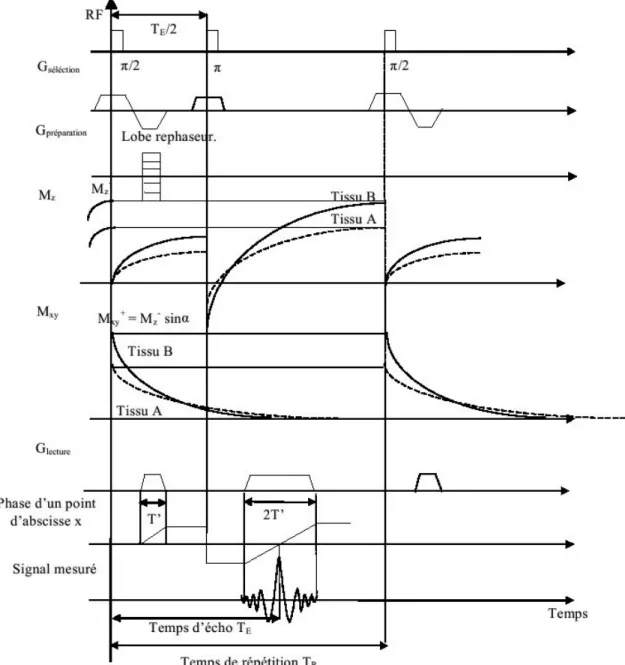
Figure 1.6 : le cas représenté illustre une séquence classique en écho de spin en 2D pour deux tissus A et B avec > et > .
1.1.5.2. Echo de gradient
a. La séquence de saturation partielle (MPGR)
La création d’un signal d’écho à partir du gradient de lecture se résume à retirer l’impulsion écho gène et à appliquer le gradient de lecture avec deux polarités différentes et de même amplitudes, le premier lobe est de durée moitié de celle du second lobe.
Figure 1.7 : illustration d’une séquence classique 2D en écho de gradient[30]
Cette séquence ne permet pas de corriger les hétérogénéités du champ statique. Ainsi, le signal mesuré est une fonction du temps de relaxation transverse T2*.
b. Valeur du moment magnétique transversal
Dans le cas d’une séquence avec impulsion α, l’établissement du régime permanent n’est pas immédiat. Cependant, comme le TR est grand devant ou de l’ordre de T1, ce régime
est atteint au bout de quelques cycles. On prouve très aisément que l’expression exacte du MMT au temps d’écho en régime permanent est [27] :
Mxy (TE) = M +xy ∗
= sinα. ∗ = .
.
. ∗ Eq.9
Pour TR/T1 fixé, la valeur de Mxy+passe par un maximum pour un angle α, compris entre
0° et 90°, appelé angle d’Ernst tel que : cosαErnst = ℯ . Pour une séquence classique, (TR de
l’ordrede ou supérieur à ), est voisin de 90°.
1.1.5.3. La durée d’acquisition
Les séquences présentées ci-dessus mettent en jeu des impulsions RF séparées par des temps de répétition grands devant le temps moyen de relaxation transversale T2. Dans ce
type d’imagerie, il est nécessaire d’attendre le retour à l’état d’équilibre du MML. Les temps de répétitions élevés induisent des temps d’acquisition important. Cette durée est d’autant plus importante que le nombre de moyennage (NEX) nécessaire est grand. Ceci rend leur utilisation en routine inintéressante (pour une matrice 256×256, un moyennage de 1, et un TR=1s l’acquisition d’une coupe prend 4 min 16s). Leur mise en œuvre dans des études
fonctionnelles est davantage compromise puisque l’objectif est justement de pouvoir atteindre une très bonne résolution temporelle (un volume en quelques secondes). Une première solution consiste à réduire le temps de répétition en choisissant des angles de basculement faibles, ceci se limite aux séquences générant des échos de gradient uniquement [31]. Cependant, ce type de séquences entraine une décroissance de l’intensité à mesure qu’on s’éloigne du centre de l’image reconstruite. Pour pallier cet effet, deux types de solution ont été envisagés : imageries rapides cohérentes et incohérentes. En imagerie cohérente, la distribution de la phase du MMT est constante ou uniforme dans [0,2π] à chaque répétition. On retrouve dans cette catégorie les séquences de type GRASS ou SSFP [32, 33,34]. En imagerie incohérente, la distribution de la phase du MMT est cette fois aléatoire d’un cycle à un autre. Elle regroupe des séquences de type FLASH [35, 36, 37], largement utilisées par plusieurs auteurs dans des études fonctionnelles [38, 39, 40, 41, 42, 43, 44], ou SPGR [45]. Une autre solution consiste à enchainer la génération et la lecture des échos d’un plan 2D durant le FID d’une seule impulsion de basculement. On parle alors d’imagerie ultra-rapide telle que l’Echo-Planar [46], la séquence PRESTO [47] ou la séquence Spirale [48]. Actuellement, la séquence Echo-Planar est de loin la plus utilisée lors des études
fonctionnelles. Elle offre effectivement une très bonne résolution temporelle permettant l’investigation des taches cérébrales à une échelle de temps en dessous de la seconde.
1.2. L’IRM fonctionnelle : contrastes observables
Plusieurs types d’informations cérébrovasculaires peuvent être cartographiés en utilisant l’imagerie par RM. Ainsi, l’information tomographique qui peut être obtenue comprend des cartes de volume sanguin cérébral (Cerebral Blood Volume : CBV) [49, 50, 51, 52] et de perfusion cérébrale [53, 54, 55, 56, 57, 58, 59], et des cartes de variation du volume sanguin [49], de la perfusion [54, 53, 57, 59, 60, 61], et de l’oxygénation [62, 63, 64, 65].
Il est important de signaler que les changements d’activité ou de métabolisme ne sont pas directement observés. Ce sont plutôt les effets des augmentations locales du flux sanguin et de l’oxygénation cérébrale sur les mécanismes induits en IRM qui sont traduits en variations d’intensité sur le signal mesuré en IRM. Ces mécanismes concernent le temps de relaxation transversal ou ∗ou le temps de relaxation longitudinal apparent sensible à la variation du flux sanguin, dans la portion de volume élémentaire : le voxel.
1.2.1. Le volume sanguin
Une technique développée par Belliveau et Rosen et coll. [51, 52,66] exploite le contraste lié à la susceptibilité magnétique produit par des agents de contraste paramagnétiques intravasculaires ainsi que la rapidité de la séquence EPI, que nous décrirons par la suite, afin de créer des cartes de CBV humain. Un bolus d’un agent de contraste paramagnétique est injecté (la technique est légèrement invasive) et des images pondérées en ou en ∗sont obtenues à une cadence d’environ une image par seconde en EPI [46, 60, 57, 68]. Au passage de l’agent de contraste dans la microvascularisation, des gradients de susceptibilité (distorsions de champ magnétique local) sont transitoirement produits. Ces gradients, qui durent le temps de passage du bolus dans la vascularisation cérébrale, engendrent un effet de déphasage intra-voxel, résultant ainsi en une atténuation du signal proportionnelle à la concentration de l’agent de contraste [51, 52, 69], elle-même fonction du volume sanguin. Les variations de CBV durant une activation cérébrale peuvent donc être observées par soustraction de deux cartes : l’une lors d’un état de contrôle et l’autre lors d’un état d’accomplissement de la fonction d’intérêt [49]. L’utilisation de cette
méthode a montré pour la première fois que les Changements hémodynamiques engendrés par une activité neuronale, pouvaient être cartographiés en utilisant l’imagerie par RM.
1.2.2. La perfusion du sang
Une batterie de nouvelles techniques destinées à la cartographie de la perfusion du sang cérébral chez l’homme a vu le jour. Les techniques utilisant l’IRM sont analogues à celles de la TEP ou la tomographie simple photon (SPECT) dans le sens où elles reposent sur le principe de marquage des spins artériels. Les techniques d’IRM sont prometteuses grâce à leur résolution spatiale sans agent de contraste exogène. Elles utilisent l’idée fondamentale du marquage magnétique du sang artériel en dehors du plan imagé, par une impulsion RF souvent égale à . Parmi ces techniques on trouve la séquence EPISTAR (echo-planar Imaging with Single targeting and Alternating RF) [60], la séquence FAIR (flow Insensitive alternating Inversion Recovery) [55, 56, 57, 61] ou encore la technique QUIPSS (Quantitative Përfusion with Single Substraction) [59]. En faisant varier le temps de retard entre le marquage des spins en dehors du plan acquis et l’acquisition même, on obtient des cartes de la perfusion mettant en évidence le sang à différentes étapes de son entrée dans le plan imagé. Ainsi, en allongeant le temps de retard, on obtient une évolution de la distribution du sang marqué des grandes artères vers les petits vaisseaux et les capillaires.
Afin d’observer les variations de perfusion sanguine induites par une activité cérébrale, une méthode communément utilisée, sensible aux flux, est mise en œuvre par application de l’impulsion d’inversion toujours dans le même plan. L’intensité des images est pondérée par la modulation du MML par le flux sanguin cérébral (CBF) ainsi que par les autres paramètres RM ( , , ). Par conséquent, cette technique permet de cartographier les variations de CBF engendrées par l’activité cérébrale [65]. Il est à noter que des variations de signal dues aux modifications locales du niveau d’oxygénation ont aussi été observées par ces auteurs.
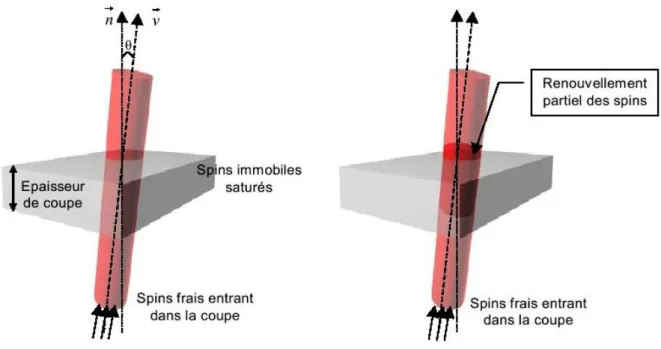
1.2.3. L’effet d’entrée de coupe
Certaines séquences en écho de gradient permettent de mettre en évidence le phénomène d’entrée de coupe appelé également inflow ou entrée de fluide (utilisé en angiographie dite par temps de vol) [42]. En effet, pour un temps de répétition court et un angle de basculement grand, le MML des tissus immobiles n’a pas le temps de se relaxer
complètement (effet dit saturation des moments) et présente une diminution du signal mesuré, les spins frais des fluides s’écoulant à une vitesse n’ont pas subi cette saturation et présentent un signal maximal au suivant. Cet effet dépend de la proportion des spins frais traversant la coupe influencée par les caractéristiques de la séquence choisie ( , et ) ainsi que de la vitesse de l’écoulement, la nature de cet écoulement et des propriétés géométriques des vaisseaux. Toutes ces grandeurs vont contribuer à fixer le nombre de spins frais intra vasculaires contenus dans un voxel lors de la mesure. Par ailleurs il existe une vitesse optimale d’écoulement pour laquelle le signal recueilli est maximal : = cos où est le temps de répétition, e l’épaisseur de la coupe et l’angle entre la vectrice vitesse et la normale à la surface définie par le plan de coupe. Enfin, un paramètre prépondérant quant à l’interprétation fonctionnelle de ce type d’imagerie, concerne la taille des vaisseaux. En effet, des vaisseaux de taille importante (veines de drainage par exemple) peuvent engendrer une perte sur la précision de localisation des populations neuronales concernées par une tâche.
Figure 1.8 :illustration schématique de l’effet « inflow » communément utilisé en angiographie par temps de vol.
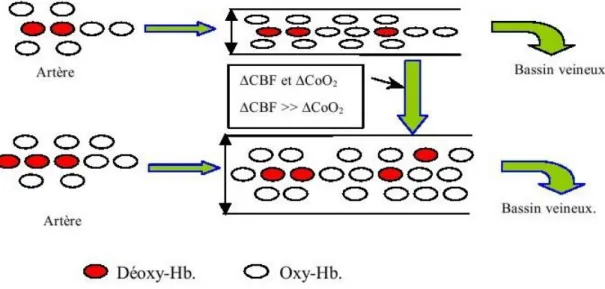
1.2.4. L’oxygénation du sang : l’effet BOLD
L’accomplissement d’une tâche cognitive ou sensorielle produit une augmentation localisée de l’activité neuronale. Ceci entraîne alors une vasodilatation locale qui engendre à son tour une augmentation rapide du CBF. Cette variation du CBF, et donc de l’apport en oxygène, est 2 à 4 fois supérieure à celle du CBF [70]. Un excès d’hémoglobine oxygénée est alors apporté à la région activée [71, 72]. En effet, ces auteurs ont prouvé, lors d’études en TEP, que l’augmentation du métabolisme oxydatif durant une activation est de 5% alors que l’augmentation du CBF est de 30%. Ceci se traduit donc par une diminution relative de la concentration en déoxyhémoglobine [65,73]. Ce type de contraste physiologique fut mis en évidence pour la première fois en 1991 par Ogawa et coll. [74] qui l’ont appelé le contraste
BOLD pour : Blood Oxygenation Level Dependent.
Figure 1.9 : effet du déséquilibre entre les augmentations du CBF et du niveau d’oxygénation sur la concentration en déoxy-Hb dans les cappillaires.
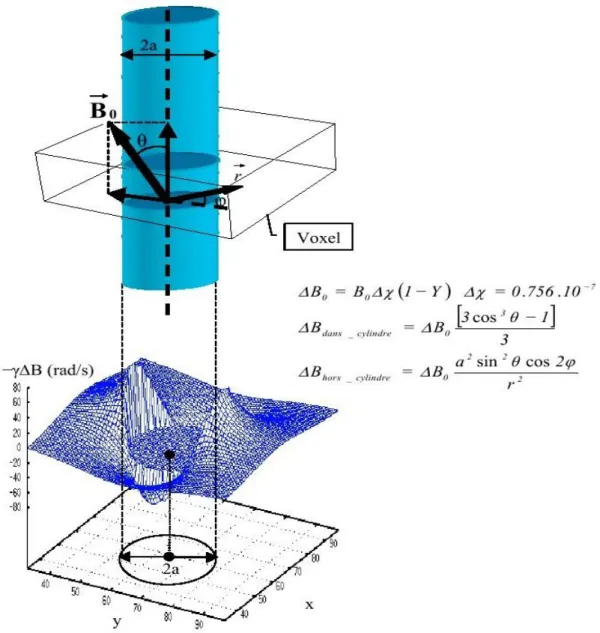
Les effets du niveau d’oxygénation sur le signal IRM ont été constatés pour la première fois par Ogawa et Lee [74] qui ont observé une meilleure visibilité des vaisseaux sanguins chez le rat lorsque le niveau d’oxygène dans le sang diminuait. Leur interprétation de cette observation reposait sur la création d’un gradient local de champ induisant une perte de signal à cause de la déoxy-Hb. En effet, depuis 1936, Pauling [75] a étudié la propriété paramagnétique de la déoxy-Hb ( = 1.57 ± 0.07) et diamagnétique de l’oxy-Hb (χ= −0.26 ± 0.07). Du fait de sa faible susceptibilité magnétique, l’oxy-Hb n’affecte pas le
temps de relaxation transversal ∗.La déoxygénation de l’hémoglobine produit la déoxy-Hb, une substance contenant un ion de Fer avec quatre électrons non appariés. La différence de susceptibilité entre les capillaires contenant de la déoxy-Hb et le milieu interstitiel induit la création d’un gradient local de champ qui croit linéairement avec l’intensité du champ principal et dépend de paramètres biophysiques, physiologiques et des propriétés géométriques du vaisseau [76, 77, 78].
Figure 1.10 : profil 3D de la variation locale du champ magnétique, induite par la différence de susceptibilité magnétique (Δχ), à l’intérieur et à l’extérieur d’un cylindre (vaisseau) plongé dans un
champ magnétique principal .avec r= + , Y est la saturation du sang , Δχ la différence de susceptibilté entre le sang complétement oxygéné et le milieu intersticiel , l’intensité du champ
principal, θ et ф des angles tenant compte de la configuration géométrique du cylindre (vaisseau) par rapport à la direction du champ et à l’orientation du voxel.
Figure 1.11 : Mécanismes physiologiques et biophysiques du contraste BOLD.
Fonction cérébrale
Augmentation locale de l’activité neuronale Augmentation du métabolisme Augmentation du métabolisme Augmentation du CBV (∆ CBV<∆CBF ) Augmentation du CBF (∆Métabolisme oxydatif<<∆CBF )
Diminution du rapport : déoxy-Hb/oxyHb
Variation du temps de relaxation transverse (moins de déphasage entre spins)
Cette perturbation locale de champ entraîne une variation du signal IRM à travers une modification des temps de relaxation et ∗ suivant deux processus complexes : la diffusion et le déphasage intra-voxel. En effet, plusieurs modèles décrivant les modifications du signal IRM induites par le contraste BOLD ont été publiés [69,77, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88]. La plupart de ces modèles considèrent deux variables fondamentales responsables de ces variations : les perturbations locales de champ et la dynamique des protons.
1.2.4.1. La diffusion
La dynamique des protons au voisinage de ce gradient de champ affecte la façon selon laquelle les effets de déphasage irréversible ( ) et réversible ( ∗) prennent place. Dans le contexte des effets de déphasage induits en IRMF, la diffusion a été considérée comme la source majoritairement responsable de la dynamique des protons. Ainsi, les molécules d’eau diffusent dans ce gradient local de champ entraînant une perte de cohérence des phases des spins d’où une perte de signal se traduisant par une diminution de (E.S) ou ∗ (E.G). Ce processus étant dynamique, les séquences en écho de spin pondérées en et celles en écho de gradient pondérées en ∗ sont sensibles à cette variation. Plusieurs auteurs se sont attaqués à la modélisation de ce phénomène. On peut distinguer deux familles principales : les modèles déterministes [82] et les modèles stochastiques [69, 77, 79] Ces auteurs simplifient le problème au cas de la diffusion isotrope, libre (par opposition à la diffusion restreinte) dans des liquides simples.
1.2.4.2. Le déphasage intra-voxel
L’augmentation de la concentration en déoxy-Hb induit une perturbation du champ local (figure 1.10). De ce fait, les spins subissent un déphasage dépendant de leur position. Ceci entraîne une diminution du signal provenant des interférences destructives entre signaux issus des moments microscopiques en question. Ce phénomène étant statique seules les séquences en écho de gradient pondérées en ∗ y sont sensibles.
Un travail remarquable de Bandettini et Wong [78] a permis, par la mise en œuvre d’un modèle déterministe, de faire un pas considérable dans la modélisation du contraste
BOLD. Ces auteurs ont simulé la variation du signal induite par une activité neuronale, à
comportementales : repos-tâche, et ce en fonction de divers facteurs physiologiques et biophysiques. L’évolution temporelle de l’aimantation transversale, supposée complexe, a été simulée par la création de deux cartes : l’une relative à la diffusion (effet de lissage) et l’autre au gradient de champ transformé en un décalage de fréquence puis en déphasage (effet de déphasage intra-voxel). Le processus est itéré jusqu’à l’échantillonnage du signal au temps d’écho. Ainsi, on peut étudier l’influence des différents paramètres physiques ( , , écho de spin, écho de gradient), biophysique (∆χ, géométrie des vaisseaux, saturation du sang en oxygène, hématocrite, coefficient de diffusion etc.) et physiologiques (CBF, CBV) sur le signal fonctionnel en contraste BLOD. Les effects des processus de déphasage et de diffusion ont été exprimés en termes de variation des vitesses de relaxation transversale : (ES) ou (EG) puis transformés en variation de signal dans le voxel en différenciant l’expression de l’aimantation transversale dans l’Eq.4 :
∆
(%) = 100. (e ∆ (∗)− 1)
≪∆ (∗) ≈ −100 × T ∆R (∗)
Chapitre 2 : Méthodologie Instrumentale En IRMf
2.1. Facteurs de qualité de l’image 2.1.1. Le rapport signal bruit RSB
Le rapport signal bruit (RSB) peut être défini de plusieurs manières. Dans un cadre statistique, on modélise souvent la dispersion d’un signal sous la forme d’une composante systématique et d’un bruit aléatoire. Dans le contexte de l’IRM, [89] a montré qu’une mesure du RSB, où les effets de l’antenne sont négligés, est la suivante :
RSB ∞( )× × × ×
× ×
Eq.11 Où NEX est le nombre d’excitations (moyennage), FOV est le champ de vue dans chaque direction, la taille de la matrice dans la direction u et est la fréquence d’échantillonnage. Dans cette mesure, seul le bruit thermique (dû à l’instrumentation et à l’objet imagé) supposé blanc est pris en compte. Pour la séquence Echo-planar, la fréquence d’échantillonnage est élevée ce qui provoque une baisse considérable du RSB. Pour pallier cet inconvénient deux alternatives sont possibles : augmenter le RSB par moyennage (NEX>1) ou choisir une taille de voxels plus grande. Ceci se fait alors au détriment de la résolution spatiale.
2.1.2. Le rapport contraste / bruit (RCB)
En IRM, le contraste entre deux tissus dépend des temps de relaxation et et par conséquent des choix initiaux de et . Une définition du contraste entre deux tissus est
, =
| |
, où et sont les intensités des tissus A et B et l’intensité d’une référence indépendante du tissu. Cependant, en IRM il n’existe pas de référence comme c’est le cas dans d’autres modalités. On définit alors le rapport contraste sur bruit (RCB) faisant intervenir l’écart type du bruit pur estimé sur l’image :
Une mesure combinée de la qualité de l’image est le produit de RSB par le RCB.
Par la suite, le terme RCB sera utilisé pour désigner le contraste sur bruit fonctionnel entre deux états cognitifs distincts (contrôle/tâche).
2.2. La résolution temporelle
Deux grandeurs temporelles sont omniprésentes et sont séparément mesurables : le temps de transition d’un état à un autre (repos-activation) et la précision avec laquelle cette transition peut être mesurée. La variation du signal IRMF découlant de changements hémodynamiques, la limite pratique haute de la résolution temporelle fonctionnelle est déterminée par le rapport contraste sur bruit (RCB) fonctionnel ainsi que par la variabilité de la latence de la réponse hémodynamique à travers le temps et l’espace [90, 91 ; 92, 93, 94]. Ces variations peuvent être dues à la différence de l’activité neuronale à travers les tâches, mais sont plus vraisemblablement dues à des différences dans la taille des vaisseaux [93]. La réponse hémodynamique a été décrite comme un opérateur de déphasage et de lissage appliqué à l’entrée neuronale [95]. Bien que le lissage crée une durée de transition de l’ordre de 5secondes à 8secondes, la précision dans la mesure de la localisation de cette transition est bien meilleure, limitée principalement par la réponse hémodynamique. En effet, le signal IRMF observé commence à augmenter environ 2secondes après le début de l’activation, puis atteint un état d’équilibre 3s à 4s après le début de l’activation [96,97, 98]. La limite haute de cette résolution a été située empiriquement aux alentours de la seconde [99] (Voir [94]), dans la limite des performances de l’imageur IRM. Ces effets temporels sont d’autant plus cruciaux que les performances de l’imageur IRM. Ces effets temporels sont d’autant plus cruciaux que la présentation du stimulus est brève (paradigme événementiel). Ces performances temporelles placent alors l’IRMf à l’intermédiaire entre l’EEG et la TEP.
2.3. La résolution spatiale
D’une part, des données d’études portant sur la réponse hémodynamique, obtenues en imagerie optique haute résolution [99], ont prouvé que le contrôle neuronal de l’oxygénation du sang a lieu à une échelle spatiale submillimétrique ( 0.5 mm voire moins [99]). D’autre part, des études IRM ont suggéré que l’augmentation de l’oxygénation du sang induite par une activité cérébrale est plus étendue spatialement que les régions activées effectives [100, 101, 102]. Cependant, la variation du signal IRMf étant relativement faible
(2% à 10% à 1.5T), une augmentation de la résolution spatiale entraîne une diminution du signal intra-voxel (moins de protons par voxel), et par conséquent du RSB proportionnel au volume du voxel. Puisque la méthode exploite des variations typiques de quelques pour-cent, le RSB doit être suffisamment haut pour queles effets du contraste BOLD soient observés. La résolution spatiale doit donc être plus grossière que la limite du pouvoir de résolution théorique de l’imageur.
2.3.1. Localisation des activations en contraste BOLD
L’IRM fonctionnelle est une technique plus sensible aux variations de signal provenant du sang veineux. En effet, à mesure que le contenu en sang d’un voxel augmente, une modification moins importante du niveau d’oxygénation est suffisante pour produire la même variation de signal mesurable. Ceci peut entraîner un décalage total entre les aires d’activation obtenues et les régions de populations neuronales effectivement concernées par la tâche [103 ; 104]. L’IRM agiographique peut donc offrir une solution adaptée permettant d’exclure de l’analyse les zones de veines de drainage [104 ; 105].
Des travaux précédents [78, 106, 107] ont pu montrer que la sensibilité de l’IRMf peut être aussi ajustée à des vaisseaux d’une taille donnée. Ainsi, elle peut favoriser la contribution au niveau de la micro vascularisation à l’échelle des capillaires qui sont plus efficaces à moduler le signal en contraste BOLD. Cette propriété intervient tout particulièrement lorsqu’on confronte les performances des séquences d’écho de spin à l’écho de gradient (Figure 1.12). Alors que l’écho de gradient présente une grande sensibilité aux effets de déphasage intra-voxel, l’écho de spin montre des variations de signal observables uniquement lorsque les protons sont capables de diffuser à des distances importantes en comparaison avec la taille des vaisseaux. Dans les échelles de temps utilisées en IRM, les spins peuvent diffuser à des distances comparables à la taille des capillaires. Ces vaisseaux ont donc un effet important sur le signal IRM en contraste BLOD. De plus, on note que l’écho de gradient présente un accroissement du signal BOLD beaucoup plus important que celui induit par l’écho de spin. De plus ; cette variation est une fonction croissante de la taille des vaisseaux dans le cas de l’écho de gradient alors qu’elle passe par un maximum pour a≈ 6 , avant de décroître dans le cas de l’écho de spin.
Figure 2.1: effet de la taille de vaisseaux sur la variation du signal BOLD entre un état de repos (de signal ) et un état d’action (de signal ), à différentes intensités du champ principal , pour les
séquences en écho de spin (ES) et en écho de gradient (EG). Ces résultats sont obtenus par simulations en utilisant le modèle déterministe de diffusion de Bandettini et Wong [78].
Actuellement, la taille des voxels typiquement utilisée en EPI sont de l’ordre de 3 à 4mm dans le plan, et de 4 à 10 mm en épaisseur de coupe. Ces dimensions sont déterminées en fonction des limitations pratiques, comme la largeur de la fenêtre de lecture, la fréquence d’échantillonnage, la limite de dB/dt, le RSB et la taille mémoire occupée par les données acquises lors des examens fonctionnels.
2.4. La sensibilité
L’extraction d’une variation de quelques pour-cent (typique en IRM), dans un fond pollué par les artefacts de mouvement, de pulsation et par le bruit requiert une prudence certaine quant aux différents paramètres influençant la détectabilité du signal. Ces grandeurs peuvent modifier le signal et/ou le contraste fonctionnel ; réduire le bruit physiologique ou les changements de signal induits par artefacts. Plusieurs facteurs sont alors à prendre en compte en vue d’optimiser cette sensibilité.
Le moyennage par accumulation successive de N mesures permet d’améliorer le RSB par un facteur√ . Ainsi, en répétant l’alternance des périodes de conditions comportementales, la sensibilité est améliorée. Toutefois, en moyennant sur des périodes trop longues (typiquement > 5min), des artefacts systématiques dus à des effets de mouvements ou de dérives lents, tendent à s’opposer aux bénéfices offerts par le moyennage.
L’augmentation de l’intensité du champ permet théoriquement d’améliorer le RSB ainsi que le RCB fonctionnel. Cependant, cette augmentation pose quelques problèmes tels que des hétérogénéités plus importantes, des fluctuations physiologiques plus prononcées et des limitations instrumentales sur les antennes. Pour un champ donné, la variation relative signal BOLD est proportionnelle, au premier ordre, au temps d’écho (Eq. 13) [38]. Par contre la variation absolue présente un maximum pour ≈ (∗) c’est pour cette raison que la plupart des études IRMf sont menées pour ≈ ∗(matière grise) = 60 ms.
Les séquences en écho de spin permettent d’obtenir un contraste BOLD particulièrement concentré autour des capillaires (Figure 1.12). La variation de ce contraste est cependant faible est de l’ordre de 2% à 6% pour un champ élevé (3T) et intérieure à 2% pour un champ classique de 1.5T. Les séquences en écho de gradient, du fait de la pondération ∗, donnent un contraste observable au niveau des vaisseaux de taille plus importante. De plus, l’amplitude de ce contraste est plus élevée qu’en écho de spin (de l’ordre de 2% à 10% à 1.5T et de 5% à 20% à 3T).
Lors des études IRM avec la séquence EPI ; le bruit est dominé dans le temps par la composante plutôt physiologique qu’instrumentale. Ces fluctuations correspondent à des composantes spectrales spécifiques (battement cardiaque, cadence respiratoire). Le filtrage
![Figure 1.7 : illustration d’une séquence classique 2D en écho de gradient[30]](https://thumb-eu.123doks.com/thumbv2/123doknet/2193768.11765/26.892.155.754.355.768/figure-illustration-sequence-classique-d-echo-gradient.webp)