Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées
Laboratoire Signalisation et transports ioniques membranaires - STIM (Poitiers) (Diplôme National - Arrêté du 7 août 2006)
École doctorale : Biologie-santé - Bio-santé (Limoges)
Secteur de recherche : Aspects moléculaires et cellulaires de la biologie
Présentée par :
Amandine Chepied
Étude de l'implication de la Connexine 43 dans le processus d'invasion des glioblastomes humains
Directeur(s) de Thèse : Marc Mesnil, Norah Defamie Soutenue le 02 octobre 2015 devant le jury Jury :
Président Frédéric Becq Professeur des Universités, Université de Poitiers Rapporteur Christian Giaume Directeur de recherche CNRS, Collège de France Rapporteur Sébastien Roger Maître de conférences, Université de Tours Membre Marc Mesnil Professeur des Universités, Université de Poitiers Membre Norah Defamie Maître de conférences, Université de Poitiers Membre Ahmed Idbaih Maître de conférences, CHU de La Pitié Salpêtrière Membre Dale Laird Professor, University of Western Ontario
Pour citer cette thèse :
Amandine Chepied. Étude de l'implication de la Connexine 43 dans le processus d'invasion des glioblastomes
humains [En ligne]. Thèse Aspects moléculaires et cellulaires de la biologie. Poitiers : Université de Poitiers, 2015.
THÈSE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITÉ DE POITIERS
(Diplôme national – Arrêté du 7 août 2006)École Doctorale Biosanté N°524 Discipline Biologie, Médecine, Santé
Spécialité Aspects Moléculaires et Cellulaires de la Biologie
Présentée par :
Amandine CHEPIED
**********************************************************************************
Étude de l’implication de la Connexine 43 dans le processus
d’invasion des glioblastomes humains
**********************************************************************************
Sous la direction du Docteur Norah DEFAMIE et du Professeur Marc MESNIL Soutenue publiquement le 2 octobre 2015
devant la Commission d’Examen
*JURY*
Pr Frédéric BECQ Professeur, Université de Poitiers Examinateur Dr Christian GIAUME Directeur de Recherche, Collège de France Rapporteur Dr Sébastien ROGER Maître de Conférences, Université de Tours Rapporteur Dr Dale LAIRD Professeur, University of Western Ontario Examinateur Dr Ahmed IDBAIH Maître de Conférences des Universités-Praticien Examinateur
Hospitalier, CHU de La Pitié Salpêtrière
Pr Marc MESNIL Professeur, Université de Poitiers Examinateur
« Ce qu'il y a de réconfortant dans le cancer, c'est que même un imbécile peut attraper une tumeur maligne. » Philippe Geluck
Les remerciements d’une thèse peuvent parfois
être (super) longs
Amandine Chepied1
1 Laboratoire STIM, Université de Poitiers, CNRS ERL 7368, Poitiers, France
Cet article, par ses résultats originaux, met en avant les appuis et soutiens nécessaires au doctorant lors des trois années intenses de sa thèse pour l’obtention du Grade de Docteur de l’Université de Poitiers. Deux aspects semblent importants : l’entourage professionnel et l’entourage personnel. L’entourage professionnel est constitué de personnels statutaires et non statutaires ayant côtoyé et aidé le doctorant durant ces trois années. L’entourage personnel semble n’avoir pas vraiment le choix au vu des liens forts unissant le doctorant à chacun de ces membres. Cet article met ainsi en avant des preuves irréfutables du nécessaire entourage du futur docteur durant ces trois années de dur labeur.
Mot-clés : thèse ; entourage ; équipe ; écoute ; soutien ; amitié ; amour
INTRODUCTION
L’étudiant en deuxième année de Master Recherche doit, à la suite de son stage, s’appliquer à trouver un laboratoire où effectuer sa THÈSE. Par chance, certains étudiants continuent leur recherche dans le même laboratoire que celui les ayant accueilli pour leur stage de Master. Ces derniers, appelés aussi «je-ne-me-donne-
pas-les-moyens-d’aller-dans-un-autre-laboratoire» ou encore plus
communément «je-suis-tellement-bien-
ici-que-j’y-reste», entament alors trois années de (liste non exhaustive) : bonheur, stress, patience, diplomatie, rigueur, folie, (in)satisfactions, dépression/joie…
Malgré ces (petits) désagréments occasionnés, le valeureux doctorant (ou thésard) essaye par tous les moyens dont ils disposent d’arriver à écrire sa (merveilleuse) thèse. Ceci est en grande partie dû à son (super) entourage qui le motive et le supporte.
Dans cette étude, les différents supports du thésard seront étudiés afin de
permettre la meilleure compréhension du «non-pétage-de-plomb-en-dernière-année» de celui-ci.
MATERIELS ET METHODES
Cohorte de stagiaires
Cette cohorte représente 27 personnes et fut créée entre les années 2012 et 2015. Les 27 personnes citées ont toutes été soumises à l’épreuve de la cohabitation avec le thésard susnommé et y ont, sauf erreur, survécut.
Cellules de glioblastome humain
Le schéma représente une cellule de glioblastome humain U251 (gliome de grade IV selon l’OMS, ou «laboratoire de recherche»). Les cellules sont mises en culture dans du CNRS (supplémenté avec de l’Université de Poitiers) sur une matrice
de recherche fondamentale pour
permettre l’observation des structures nécessaires pour le bon développement du doctorant. Les cellules sont observées,
après 3 ans de culture intensive, au microscope confocal Jurydethésus™.
Arbre généalogique
Pour permettre la création de l’arbre généalogique simplifié, les hommes ont été remplacés par des carrés et les femmes par des ronds. Les triangles représentent les espèces vivantes non humaines : Canus lupus familiaris (chien) en vert, Felis silvestris catus (chat) en orange, Betta splendens (combattant) en violet, Mus musculus (souris) en jaune,
Onyctolagus cuniculus (lapin) en marron et Gallus gallus domesticus (poule) en noir.
Le symbole # représentent les individus ayant préféré quitter le doctorant au cours de sa thèse pour ne pas devenir comme lui (fou). Tous les sujets représentés sont les supports vitaux du thésard*.
*Cette expérience est autorisée par le comité d’Éthique en expérimentation animale N°128456654757.
RESULTATS
Les stagiaires et autres « non statutaires » sont nécessaires à la bonne ambiance dans une équipe de recherche.
Un premier point étudié est l’ensemble du personnel non permanent d’une équipe de recherche. D’après la
Table 0 (que nous espérons exhaustive),
ceux-ci sont nombreux et participent au bon déroulement d’une thèse.
L’environnement de travail du doctorant est nécessaire au bon déroulement de la thèse.
Il apparaît que la matrice sur laquelle repose le doctorant et les éléments s’y trouvant sont importants pour l’équilibre de celui-ci. Que ce soit au sein du
laboratoire (Figure -2) ou au sein de son équipe d’accueil (Figure -1).
La famille est vitale au doctorant en formation.
Que ce soit sa propre famille ou sa belle-famille, les individus cités paraissent indispensable à l’intégrité du thésard
(Figure 0).
Table 0 : Liste des étudiants à remercier
2012 2013 2014 2015 Vincent Faugeroux (M2) Claire Simoneau (M2) Maxime Fouissac (M1) Elodie Peraudeau (M1) Madryssa Deboisvilliers (M2) Souheyla Bensalma (PhD) Abderrahmane Mokrani (PhD) Marie Kostine (M2) Agnès Garnier(M2) Laure Coutos-Thevenot (L3) Thomas Poirault (DUT) Emilien Meunier (3ème)
Aurélie Ginisty (PhD) Camille Hotten (M2) Marjolaine Debant (M2) Leïla Bellion (M2) Florian Perrin (M2) Jonathan Boucher (M1) Julie De Abreu (M1) Priscillia Charpentier (L3) Charles-Albert Chapotte-Baldacci (L2) Grégoire Manaud (L2) Brice Caillaud (3ème)
Dounia Delhamrani (PhD) Zeinaba Daoud Omar (M2) Julie Vorbe (M1)
Recherche fondamentale
Laboratoire
STIM
Laurence AnneIP
2C
Sandrine Thomas Ex PCDC Aberrahmane Laurent ElodieEQUIPE IP
2C
Figure -2 : Schéma de l’environnement global de travail du doctorant.
Figure -1: Schéma de l’environnement de travail proche du doctorant
Frédéric Becq
Dounia
R EM ER C IE M EN T S Papa Maman David
Elodie Justin Emilie
Moi Grosaure Boudine Pioux
Bernard Gratienne
Katy
Seb Sandrine Mickael
Sylvain
Sophie Cricri Manue
Kéké Titi
Juliette Bryan Alexis Maël
Gaya Chantal Liloo Dora Urfée Despé Chipie Houba Ibis Marcel # #
Tipou Plume Rosalie
Hulk# Papy# Mamie
Figure 0 : Arbre généalogique représentant l’environnement familial du doctorant Tigrou
Cocorette Chance
DISCUSSION
L’ensemble des résultats présentés nous démontrent que l’environnement de travail et l’entourage du doctorant semblent être des éléments nécessaires au bon déroulement de la thèse.
Plus en détail, les stagiaires ou autre « non titulaires » présentés dans la table 0 sont importants pour permettre au doctorant de transmettre son savoir. Dans notre cas Élodie, Camille, Marie et Madryssa sont des individus particulièrement remarquables.
La figure -2 nous permet de mettre l’accent sur le côté d’entraide et de
collaborations nécessaires pour
l’aboutissement de la dite thèse.
Nous pouvons citer, en premier lieu, Laetitia Cousin pour son extrême gentillesse, les cappu, son écoute et pour sa générosité et son amitié.
Un autre soutien important est celui de l’équipe de l’animalerie à savoir Isabelle Paris, Sandrine Clarhaut, Bellinda Rabéony, Thomas Solau mais surtout Laurence Turi (ou maman murine d’adoption, bien à toi) sans qui les souris ne se porteraient pas si bien.
Quelques individus se sont fait remarquer par leur présence aux côtés du doctorant comme Afsaneh Gaillard (pour les perfusions), Maureen Francheteau (pour
les coupes de cerveaux), Matthieu Regnacq pour l’huile rouge (ou Oil Red O c’est pareil…) ou encore Anne Cantereau (pour la microscopie).
William Même a permis au doctorant de découvrir les joies du double patch clamp sur astrocytes et Sandra Même (ainsi que Dounia) ont essayé tant bien que mal d’expliquer l’IRM (et la biophysique) au thésard. Merci à ces trois Orléanais ! Sans oublier les multiples personnes avec qui des conversations ont pu faire réfléchir le doctorant comme Élizabeth, Amandine (Rat), Patrick Bois, Thomas Desplantez, Thomas Harnois et Sébastien Roger.
La figure -1 permet l’exploration de l’environnement proche du doctorant à savoir son équipe d’accueil actuelle ; l’équipe Implication Physiologique et Physiopathologique des Connexines. Nous pouvons remarquer qu’Arnaud Monvoisin, Laurent Cronier, Annie-Claire Balandre, Isabelle Courtin, Gaël Epistolin,
Abderrahmane Mokrani, Jonathan
Clarhaut, Élodie Peraudeau et Camille Hötten sont des éléments nécessaires à la bonne mise en place de la structure du doctorant.
Il est à noter qu’à son arrivée, l’équipe d’accueil du thésard comptait d’autres membres qui sont bien entendu
chaleureusement remerciés : Patricia Arnault (pour la stéréotaxie), Valérie Coronas, Omar Benzakour (pour les carbohydrates), la Dr. Aurélie Ginisty (pour les pauses bien méritées et son amitié), Corine Chadeneau, Jean-Marc Muller, Paule Seïte, Brigitte Vannier, Joëlle Roche, Madryssa De Boisvilliers, Souheyla Bensalma et Alice Barbarin.
Par ailleurs, les directeurs de thèse Marc Mesnil et Norah Defamie se distinguent par leur rôle primordial d’échafaudage du futur docteur. Marc Mesnil semble être un chef d’équipe passionné par son travail (et par les chaussures qui couinent…), possédant une patience et une écoute hors du commun (avec les deux folles), étant une aide (plus que) précieuse et réellement apprécié par le thésard.
Quant à Norah Defamie [le nombre de page dans ce journal étant particulièrement
limité, nous ne pourrons
malheureusement que résumer les qualités de cette dernière], même si ce n’est pas facile tous les jours, celle-ci fait preuve de détermination et de persuasion dans tout ce qu’elle entreprend, se montrant à l’écoute de son doctorant. Nous ne savons pas si les liens d’amitié se construisent de la sorte mais le doctorant encadré est extrêmement reconnaissant envers sa directrice de thèse : pour les
conversations scientifiques et (surtout et heureusement) non scientifiques, pour les réglisses-remontent-moral (et les mouchoirs) dans le bureau, pour sa bonne humeur, pour ses leçons de géographie Chilienne hors norme, son aptitude à la marche (mais pas quand il fait trop chaud ni deux jours de suite) son humour, son caractère (que le doctorant ne se permettra pas de critiquer, le sien ressemblant particulièrement à celui de sa directrice de thèse) et enfin (liste non exhaustive) pour son investissement sans faille aux côtés du doctorant (t’inquiètes pas, ça, ça va aller vite). En résumé, tout étant parfois beaucoup plus simple en une seule phrase, nous dirons simplement que c’est la directrice de thèse rêvée.
Enfin, la figure 0 permet d’observer l’environnement familial de l’étudiant. En citant en premier lieu ses parents sans qui celui-ci ne serait pas là (d’un point de vue biologique bien sûr), à qui le doctorant doit tout et qui les aime du plus profond de son cœur. Les frères et sœurs de celui-ci, David, Justin (et Émilie pour les encouragements culinaire), Clémentine, Emeline et Arthur, sans qui rien ne serait pareil (d’un point de vue purement logique concernant l’héritage parental et la place occupée par ceux-ci dans le myocarde du doctorant)
ainsi que leur conjoint(e)s et bestioles à poils (d’un point de vue animalier bien entendu), plumes et écailles. Les grands parents (où qu’ils se trouvent) occupent une partie du cortex cérébral du thésard. La belle-famille possède aussi une place importante dans sa vie. A commencer par Bernard et Gratienne [et Dodo (ce n’est pas son corps qui est gros….c’est sa tête qui est petite) et Louloute] ayant mis au monde cinq garçons en deux grossesses… (Statistiquement non significatif !). Le premier individu Sébastien et sa femme Katy sont eux-mêmes devenus parents de deux sublimes enfants Bryan et Alexis (et d’une bête à poil). Les trois individus suivants sont aussi importants à commencer par Sylvain, Christopher et Kévin et leurs conjointes respectives Sophie, Emmanuelle et Tatiana.
La dernière personne à évoquer est le conjoint du thésard Anthony. Cet individu apparaît comme étant vital au thésard en formation quoiqu’un peu étrange. En effet, lors de sa dernière année de thèse, le doctorant subit une mutation anormale de « chiantitude extrême ». Le conjoint se doit alors de : calmer, consoler, faire rire, détendre, aimer, parler, disputer le thésard qui est particulièrement insupportable. Malgré tout, le conjoint reste au domicile conjugal, ce qui paraît d’ailleurs assez
étonnant, et encourage le doctorant comme il le peut. Le thésard n’a alors plus qu’à avouer son amour inconditionnel à son conjoint et l’embrasse du plus profond de son cœur ainsi que Gaya, Harmonie, Elektron, Imodium et Les chouris.
Pour conclure, une bonne thèse ne peut se passer d’un environnement de travail enrichissant et motivant, d’ami(e)s et de famille emplissant d’amour le docteur en devenir.
REMERCIEMENTS SPÉCIAUX
Le doctorant tient à remercier vivement le Dr. Christian GIAUME et le Dr. Sébastien ROGER pour avoir accepté d’être les rapporteurs de ce manuscrit.
La Pr. Frédéric Becq et le Dr. Ahmed Idbaih sont également sincèrement remerciés pour avoir accepté de juger ce travail.
Special thanks to Pr. Dale Laird who agreed to judge my work despite the language and distance.
(Et merci à Walter Elias Disney pour son génie qui m’a tant aidé…) Soumis le 21 Août 2015.
1
ABRÉVIATIONS………..………..7
TABLE DES FIGURES……….………..13
TABLE DES TABLEAUX………17
PARTIE 1 : ETAT DE L’ART……….18
CHAPITRE 1 : LE CANCER ... 18
Généralités ... 18
Processus de cancérisation et métastases ... 18
Le microenvironnement tumoral ... 20
1. Cellules endothéliales (EC) ... 20
2. Cellules immunitaires de l’inflammation (ICs) ... 21
3. Fibroblastes associés aux tumeurs (CAF) ... 22
4. Péricytes (PC) ... 22
5. Cellules souches et progénitrices du stroma tumoral ... 23
6. Réseaux vasculaires sanguin et lymphatique ... 24
Réseau sanguin : angiogenèse ... 24
Réseau lymphatique : lymphangiogenèse ... 25
7. Matrice extracellulaire (MEC) ... 26
8. Signaux hétérotypiques du microenvironnement tumoral ... 27
Les tumeurs cérébrales ... 28
1. Généralités ... 28
2. Gliomes ... 29
Généralités ... 29
Origines génétiques ... 29
2
Généralités ... 30
Origines des GBM : cellules souches et progénitrices ... 30
Thérapies ciblées ... 31
CHAPITRE 2 : LES INVADOPODES ... 33
Structure ... 33 1. Initiation ... 33 2. Assemblage ... 34 3. Maturation ... 35 4. Fonctions ... 35 5. Renouvellement ... 36
CHAPITRE 3 : LA COMMUNICATION INTERCELLULAIRE PAR JONCTIONS DE TYPE GAP ... 38
Historique ... 38
1. Innexines ... 38
2. Pannexines ... 39
Protéines constitutives des jonctions communicantes : les Connexines ... 40
1. Nomenclature ... 40
2. Gènes ... 41
3. Conformation ... 41
Hémicanal (HC) ou connexon ... 42
1. Régulation de l’état d’ouverture des HC ... 42
Le canal jonctionnel ... 43
La communication intercellulaire par jonctions de type Gap ... 43
1. Régulation de la communication jonctionnelle ... 44
2. Renouvellement des plaques jonctionnelles ... 44
3. Techniques d’évaluation de la CIJG ... 45
3
Micro-injection ... 45
« Scrape loading » ... 45
Électroporation... 45
« Gap-FRAP » ... 46
Test de pré-charge ou du parachute ... 46
« LAMP» ... 47
Transfert de composants endogènes ... 47
Nucléotides radio marqués ... 47
Vagues calciques ... 48
Mesures de courants par double patch clamp ... 48
Physiologie et Physiopathologies liées aux connexines ... 49
1. Implications physiologiques ... 49
Dans le développement ... 49
Dans l’homéostasie tissulaire ... 49
Dans le contrôle du cycle cellulaire ... 49
2. Implications physiopathologies ... 50
CHAPITRE 4 : CONNEXINES ET CANCERS ... 51
Les connexines, des suppresseurs de tumeur ? ... 51
Connexines dans la migration et l’invasion tumorales ... 52
Connexines et tumeurs cérébrales ... 53
1. Connexines du système nerveux central ... 53
2. Connexines et gliomes ... 54
Connexines, polluants et perturbateurs endocriniens ... 56
1. Pathologies associées à l’exposition aux polluants et effets sur la CIJG ... 56
2. Perturbateurs endocriniens ... 56
4
BPA ... 57
BPA chlorés ... 58
PARTIE 2 : OBJECTIFS DE L'ÉTUDE……….59
PARTIE 3 : MATÉRIELS ET MÉTHODES………61
Matériels Biologiques ... 61
Anticorps primaires ... 61
Lignée U251 et shRNA ... 61
Souris SWISS : génotypage ... 61
Culture cellulaire ... 62
Estimation de la prolifération cellulaire par le test XTT ... 63
RT-PCR quantitative... 64
Analyses des protéines ... 65
Western Blot... 65
Séparation des domaines membranaires ... 67
Co-Immunoprécipitation ... 67
Mesure de l’invasion par les invadopodes par le Fluorescent Gelatin Degradation Assay ... 69
Mesure de l’activité hémicanal par le Dye Uptake Assay ... 70
Mesure de l’activité des métalloprotéinases par zymographie ... 71
Observation du cerveau ... 72
Procédure expérimentale pour l’obtention des animaux d’intérêt ... 72
Imagerie cérébrale et hépatiques in vivo ... 72
Coupes de cerveaux et immunofluorescence ... 73
Coloration Hématoxyline-Eosine (HE) ... 74
5
Protéomique ... 75 Imagerie ... 76 Logiciels utilisés ... 77 Analyses statistiques ... 77 PARTIE 4 : RÉSULTATS………78 Cx43 et invadopodes : contexte ... 78Les cellules U251 forment des invadopodes ... 79
La Cx43 est présente dans les invadopodes ... 80
La diminution d’expression de la Cx43 est corrélée à la réduction de la dégradation de la gélatine ... 81
La diminution du niveau d’expression de la Cx43 est associée à une capacité réduite à former des invadopodes... 82
La Cx43 favorise la formation et la maturation des invadopodes grâce à sa fonction de protéine d’interaction ... 83
La Cx43 favorise la formation et la maturation des invadopodes grâce à sa fonction hémicanal ... 85
Analyse protéomique des cellules U251 et de leur clones shRNA ... 87
Cx43 et BPA : contexte ... 90
L’exposition des souris au Bisphénol A et la présence de la Cx43 modifient leur prise de poids et leur survie ... 92
L’hétérozygotie des souris modifie les profils de texture obtenus dans l’hippocampe et le cortex ... 93
L’hétérozygotie des souris modifie les concentrations des métabolites cérébraux ... 94
6
PARTIE 6 : CONCLUSIONS ET PERSPECTIVES………...106
ANNEXES……….……109 Publications ... 109 Communications orales ... 109 Communications affichées ... 109 Articles………..……….110 BIBLIOGRAPHIE………..203
7
Pour les définitions en anglais, les traductions sont ajoutées entre parenthèses.
~SYMBOLES~
% : pour cent ‘ : minute ‘’ : seconde +/- : hétérozygote (HTZ) °C : degrés Celsius ‰ : pour mille ∞ : infini~A~
A : adénineADN : acide désoxyrinonucléique
AFAP110 : 110kDa actin filament-associated protein (protéine de 110KDa associée aux filaments d’Actine)
AKT : protéine kinase b
AM : acetoxymethyl ester group (groupe ester acétoxyméthyle) ARN : acide ribonucléique
ARNm : ARN messager
Arp2/3 : actine-related protein 2/3 complex (complexe 2/3 lié à l’Actine) ATP : adénosine tri phosphate
~B~
BEC : blood vascular endothelial cell (cellules endothéliales vasculaires sanguines) BET : bromure d’ethidium
BM : basement membrane (membrane basale) bp : base pair (paire de bases)
BrDU : 5-bromo-2-déoxiuridine
BSA : bovine serum albumin (albumine bovine sérique)
~C~
C : cytosineCaCl2 : chlorure de calcium
cADPR : cyclic ADP-ribose (ADP-ribose cyclique) Calcéine-AM : calcéine-acétoxyméthyle ester
CAMKII : Ca2+/calmodulin-dependent kinase II (kinase II dépendante de Ca2+/calmoduline) Cav : cavéoline
CCDC26 : CCDC26 long non-coding RNA (long ARN non codant CCDC26) Cdc2 : CDK1, cyclin-dependent kinase 1 (kinase 1 dépendante de la cycline)
Cdc42 : cell division control protein 42 homolog (homologue de la protéine 42 contrôlant la division cellulaire)
CDKN2A/B : proteins cyclin-dependant kinase 4 inhibitor 2 A/B (protéines inhibitrices 2 A/B de la kinase 4 dépendante de la cycline)
cDNA : complementary DNA (ADN complémentaire) CEL : cellules endothéliales lymphatiques
CIJG : communication intercellulaire par jonctions de type gap
CIP85/150 : Cx43-interacting protein of 85/150kDa (protéines de 85/150kDa interagissant avec la Cx43)
8
CK1 : casein kinase 1 (kinase 1 de la caséine)CL : cytoplasmic loop (boucle cytoplasmique de la connexine) CMTX : maladie de Charcot-Marie Tooth liée au chromosome X CSN : cellules souches neurales
CSPG : chondroitin sulfate proteoglycan (protéoglycane chondroïtine sulfate) CT : carboxyl-term (extrémité carboxyle de la connexine)
Cx : connexine
~D~
DDT : dichlorodiphényltrichloroéthaneD-Glc : énantiomère D du glucose
DMEM : Dulbecco’s modified Eagle medium (milieu minimum essentiel de Eagle modifié par Dulbecco) DMSO : diméthylsulfoxyde
DNA : desoxyrinonucleic acid (ADN)
dNTP : mélange des quatre désoxyribonucléotides : dATP (désoxy adénine tri-phosphate), dCTP (désoxy cytosine tri-phosphate), dGTP (désoxy guanine tri-phosphate), dTTP (désoxy thymine tri-phosphate).
DO : densité optique
DTT : 2,2-bis(p-chlorophenyl)-1,1,1-trichloroethane
~E~
E1/2 : extracellular loop 1/2 (boucles extracellulaires 1/2 de la connexine) ECL : enhanced chimioluminescence (réhausseur de chimioluminescence) ECM : extracellular matrix (MEC)
EDTA : ethylène diamine tétra acétique
EGF : epidermal growth factor (facteur de croissance des cellules de l’épiderme) EGTA : ethylène glycol tétra acétique
ER : endoplasmic reticulum (RE)
ERAD : endoplasmic reticulum associated degradation (dégradation associée au réticulum endoplasmique)
ERCC1/2 : DNA excision repair protein ERCC-1/2 (protéine ERCC-1/2 de réparation des excisions d’ADN) ERK : extracellular signal-regulated kinases (kinases régulées par signaux extracellulaires)
~F~
FAK : focal adhesion kinase (kinase des adhésions focales) FFA : flufenamique acid (acide flufénamique)FGF : fibroblast growth factor (facteur de croissance des fibroblastes) FITC : fluorescein isothiocyanate (fluorescéine isothiocyanate)
Fluo-3 : (5-oxazolecarboxylic acid, 2-(6-(bis(carboxymethyl)amino)-5-(2-(2-bis(carboxymethyl)amino)-5-methylphenoxy)ethoxy)-2-benzofuranyl)
Fura-2 : (glycine, N-[2-[[[[2-[bis(carboxymethyl)amino]-5-(2,7-dichloro-6-hydroxy-3-oxo-3H-xanthen-9-yl)phenoxy]methyl]methyl]oxy]-4-methylphenyl]-N-(carboxymethyl)
~G~
g : accélération (g ≈ 9.81m/s2)G : guanine
GAPDH : glyceraldehyde-3-phosphate deshydrogenase GBM : glioblastome multiforme
GFAP : glial fibrillary acidic protein (protéine acide fibrillaire de la glie) GL : ganglions lymphatiques
9
GTP : guanosine triphosphateGTPases : enzymes qui lient et hydrolysent la GTP
~H~
H : human (humain)HC : hémicanal
HCl : acide chloridrique
HEPES : acide 4-(2-hydroxyethyl)-1-piperazine ethane sulfonique Hic-5 : (=TGF-β1I1) transforming growth factor β1 induced transcript 1
HID : hystrix-like ichthyosis deafness syndrome (syndrome de l’hystrix, l’ichthyosis et surdité) HRP : horesradish peroxidase (peroxidase de raifort)
Hsp : heat shock protein (protéine de choc thermique)
~I~
ICW : intercellular calcium waves (vagues calciques intercellulaires) IF : immunofluoresence
IgG : immunoglobuline gamma IL : interleukine
IP : intrapéritonéale IP3 : inositol trisphosphate
IQGAP : Ras GTPase-activating-like protein
~K~
KCl : chlorure de potassiumkDa : kiloDalton
KID : keratitisichthyosisdeafness syndrome (syndrome de la kératitis, l’ichthyosis et surdité) KO : knock out (-/-)
~L~
LEC : lymphatic endothelial cell (cellulkes endothéliales lymphatiques)
LOH 10q : loss of heterozygositiy on chromosom 10q (perte d’hétérozygotie sur le bras court du chromosome 10)
LPA : lysophosphatidic acid (acide lysophosphatidique)
LSMC : lymphatic smooth muscle cell (cellules lymphatique du muscle lisse)
~M~
M1/2/3/4 : domaines transmembranaires 1/2/3/4 de la connexine M : mouse (souris)
m/g/L/M/V : mètre/gramme/litre/molaire/volt
mAChR : muscarinic acetylcholine receptor (récepteur muscarinique de l’acétylcholine) MAP : mitogen-activated protein (protéine du mitogène activé)
MEC : matrice extracellulaire MgCl2 : chlorure de magnésium
MGMT : O6-methylguanine DNA methyltransferase
MMP : matrix metalloproteinase (métalloprotéinase matricielle) mRNA : messenger RNA (ARNm)
10
~N~
n/µ/m/c : nano/micro/milli/centi Na3VO4 : sodium orthovanadate
NAADP : nicotinic acid adenine dinucleotide phosphate NaCl : chlorure de sodium
NaF : fluorure de sodium
NaH2PO4 : dihydrogénophosphate de sodium NaHCO3 : bicarbonate de sodium
NAD+ : nicotinamide adénine dinucléotide NaOH : hydroxyde de sodium
Nav1.5 : cardiac voltage-gated Na+ channel (canal sodique dépendant du voltage)
NCK1/2 : non-catalytic region of tyrosine kinase adaptor protein 1/2 (région non catalytique de la protéine adaptatrice tyrosine kinase 1/2)
Nedd4 : neural precursor cell expressed developmentally down-regulated protein 4 NeuN : neuronal nuclei (noyau neuronal)
NHE-1 : sodium-hydrogen antiporter 1 (échangeur Na+/H+ 1) NO : nitric oxide (oxide nitrique)
NOV : nephroblastoma overexpressed NP40 : nonidet P 40
NT : N-terminal (extrémité amine de la connexine) nt : nucléotide
~O~
ODDD : oculodendrodigital dysplasia (dysplasie oculodendrodigitale) OL : oligodendrocyte
OMS : organisation mondiale de la santé
~P~
p : phospho-p130CAS : (=BCAR1) breast cancer anti-estrogen resistance protein 1 P2X7 : P2X purinoceptor 7
PAK : p21-activated kinase (kinase p21) PARP1 : poly [ADP-ribose] polymérase 1 PBB : biphenyl polybrominate
PBS : phosphate buffer saline (tampon salin phosphate) PCB : biphenyl polychlorinate
PCR : polymerase chain reaction (réaction de polymérisation en chaîne)
PDGF : platelet-derived growth factor (facteur de croissance dérivé des plaquettes) PE : perturbateur endocrinien
PFA : paraformaldéhyde
PFOA : acide perfluorooctanoïque PFOS : perfluorooctane sulfonate PGE2 : prostaglandine E2
pH : potentiel hydrogène
PHLDB1 : pleckstrin homology-like domain family B member 1 PKA/C/G : protéine kinase A/C/G
PMSF : fluorure de phénylméthylsulfonyl PMSF : perméthylsulfoxyde
PRKDC : DNA-dependent protein kinase, catalytic subunit (sous-unité catalytique de la protéine kinase dépendante de l’ADN)
11
PtdIns(3,4)P2 : phosphatidylinositol (3,4)-bisphosphatePtdIns(3,4,5)P3 : phosphatidylinositol (3,4,5)-trisphosphate
PTEN : phosphatase and tensin homolog (homologue des phosphatases et tensine)
~Q~
qPCR : quantitative-PCR (réaction de polymérisation en chaîne quantitative)
~R~
R : rabbit (lapin)
RB : gène du rétinoblastome RE : réticulum endoplasmique
RhoA : Ras homolog family, member A (member A de la famille des homologues de Ras) RIPA : radioimmunoprecipitation assay (technique de radioimmunoprécipitation) RNA : ribonucléic acid (ARN)
ROS : reactive oxygen species (espèces réactives de l’oxygène) Rpm : rotation par minute
RTEL1 : regulator of telomere elongation helicase 1 (régulateur de l’élongation des télomères par l’héliscase 1)
RTK : recepteur à tyrosine kinase
RT-PCR : real-time PCR (réaction de polymérisation en chaîne en temps réel)
~S~
SDS : sodium dodecyl sulfate
shRNA : small-hairpin RNA (petit ARN en épingle à cheveux) SLN : sentinel lymph node (ganglions sentinels lymphatiques) SMC : smooth muscle cell (cellules du muscle lisse)
Src : sarcoma tyrosine kinase SVF : sérum de veau fœtal
~T~
T : thymineTBS-T : tris buffer saline-tween (tampon salin tris-tween)
TERT : telomerase reverse transcriptase (transciptase inverse des télomérases) TIMP1/2 : metallopeptidase inhibitor 1/2 (inhibiteur 1/2 des métallopeptidase) TKS5 : protéine d’adaptation TKS5
TNF-α : tumor necrosis factor α (facteur de nécrose de tumeur α) TOM20 : translocase of the outer membrane 20
TPA : tetradecanoyl phorbol acetate Tris : trizma base
TRITC : tetramethylrhodamine B isothiocyanate
~U~
u/U : unité~V~
VEGF : vascular endothelial growth factor (facteur de croissance de l’endothélium vasculaire) VEGFR : vascular endothelial growth factor receptor (récpeteur du VEGF)
12
~W~
(N-)WASP : (Neuronal-) Wiskott-Aldrich syndrome protein (protéine (neuronale) du syndrome de Wiskott-Aldrich)
WB : western blot
WIP : WASP interacting protein (protéine interagissant avec WASP) WT : wild type (type sauvage, +/+)
~X~
XRCC1 : X-ray repair cross-complementing protein 1XTT : 2,3-Bis(2-methoxy-4-nitro-5-sulfophenyl)-2H-tetrazolium-5-carboxanilide inner salt
~Z~
ZnCl2 : chlorure de zinc ZO : zona-occludens
13
Figure 1 : Incidence et mortalité des cancers en France en 2012 par localisation et par sexe
chez l’adulte ... 18
Figure 2 : « Ce qui donne le Cancer » par Nathalie Ruaux ... 18 Figure 3 : Les différentes phases du processus de cancérisation ... 18 Figure 4 : Marqueurs et caractéristiques des cellules cancéreuses et cibles thérapeutiques
associées ... 19
Figure 5 : Comment une cellule devient cancéreuse ? ... 19 Figure 6 : Le microenvironnement tumoral ... 20 Figure 7 : Lien entre inflammation et cancer ... 21 Figure 8 : Les fibroblastes associés au cancer dans leur microenvironnement ... 22 Figure 9 : Angiogenèse ... 24
Figure 10 : Régulation de l’angiogenèse par les facteurs activateurs et inhibiteurs de
celle-ci ... 25
Figure 11 : Le « switch » angiogénique ... 25 Figure 12 : Structure du réseau vasculaire lymphatique ... 25 Figure 13 : Remodelage des vaisseaux lymphatiques pendant la tumorigenèse et leur
contribution au phénomène métastatique ... 26
Figure 14 : Diagramme représentant la réciprocité dynamique permettant le maintien et
l’expansion de l’ECM ... 26
Figure 15 : Interactions et signaux du microenvironnement tumoral pendant la progression
maligne ... 27
Figure 16 : Association entre altérations génétiques et progression des gliomes ... 30 Figure 17 : Image d’IRM d’un patient atteint d’un glioblastome multiforme dans le lobe
temporal droit ... 30
Figure 18 : Etapes de la formation et de la maturation des invadopodes (et podosomes) .... 33 Figure 19 : Cascade de signalisations associée aux domaines d’adhésion, de protéolyse et
d’invasion des invadopodes ... 33
Figure 20 : Concentration en protons et en dioxygène au sein du microenvironnement
tumoral... 35
Figure 21 : Structures hexagonales observées en microscopie électronique sur des portions de
membranes plasmiques de foie de rat ... 38
14
Figure 23 : Analyse comparative de la conformation membranaire des innexines, pannexines
et connexines ... 38
Figure 24 : Représentation schématique des trois membres de la famille des Pannexines ... 39 Figure 25 : Structures et mécanismes d’épissage alternatifs des gènes des connexines
humaines ... 41
Figure 26 : Modèle topologique des connexines ... 41 Figure 27 : Sites de phosphorylation localisés sur l’extrémité carboxyle de la Cx43 ... 42 Figure 28 : Protéines interagissant avec la Cx43 ou protéome des Jonctions de type gap ... 42 Figure 29 : Les connexines s’oligomérisent en hexamères appelés hémicanaux ou
connexons ... 42
Figure 30 : Molécules ayant la capacité de transiter à travers les hémicanaux de
connexines ... 42
Figure 31 : Peptides interférant avec la fonction hémicanal de la Cx43 ... 43 Figure 32 : Formation du canal jonctionnel à partir des connexons ... 43 Figure 33 : Schéma d’une plaque jonctionnelle permettant la mise en place de la
communication jonctionnelle ... 44
Figure 34 : Le cycle de vie de la Cx43 ... 44 Figure 35 : Méthodes utilisées pour étudier la communication jonctionnelle (CIJG) ... 45 Figure 36 : Implication des connexines dans les différentes étapes du cancer du sein ... 53 Figure 37 : Expression des connexines dans les cellules gliales ... 53 Figure 38 : Les perturbateurs endocriniens au quotidien ... 57 Figure 39 : Structures et formules chimiques du bisphénol A et ses composés chlorés. ... 57 Figure 40 : Sources environnementales et voies d’exposition de la population française au
BPA ... 57
Figure 41 : Schéma du programme PCR utilisé pour le génotypage des souris SWISS ... 62 Figure 42 : Schéma des bandes théoriques attendues après migration (gauche) et exemple
d’un gel (droite) ... 62
Figure 43 : Gel représentatif d’une migration des ARN ribosomaux de différents
échantillons ... 64
Figure 44 : Gel représentatif d’une migration des ADNc après PCR quantitative de différents
échantillons ... 65
15
Figure 46 : Procédure expérimentale pour l’obtention des animaux ... 72 Figure 47 : Exemple de résultat obtenu après le test du parachute sur des cellules U251 de
glioblastome humain ... 75
Figure 48 : Les cellules U251 forment des invadopodes ... 79 Figure 49 : Les cellules U251 forment des invadopodes ... 79 Figure 50 : Les cellules U251 forment des invadopodes contenant la Cx43 ... 80 Figure 51 : Les cellules U251 forment des invadopodes contenant la Cx43 ... 80 Figure 52 : Implication de la Cx43 dans la formation et dans la maturation des
invadopodes ... 80
Figure 53 : La formation et la maturation des invadopodes dépendent du niveau d’expression
de la Cx43 ... 81
Figure 54 : L’activité de la métalloprotéinase matricielle de type 2 (MMP-2) diminue avec le
niveau d’expression de la Cx43 ... 81
Figure 55 : Niveaux d’expression des protéines et leurs interactions avec la Cx43 en corrélation
avec le niveau d’expression de celle-ci ... 83
Figure 56 : Niveaux d’expression des protéines et leurs interactions avec la Cx43 en corrélation
avec le niveau d’expression de celle-ci ... 83
Figure 57 : Gels représentatifs d’immunodétection ... 83 Figure 58 : Niveaux d’expression des protéines et leurs interactions avec la Cx43 en corrélation
avec le niveau d’expression de celle-ci ... 83
Figure 59 : La formation et la maturation des invadopodes sont réduites quand les cellules
U251 mock sont cultivées à forte densité ... 84
Figure 60 : Corrélation entre l’augmentation de l’activité hémicanal et la diminution du niveau
d’expression de la Cx43 ... 85
Figure 61 : Représentation schématique permettant l’identification des protéines du
protéome des cellules U251 et des clones shRNA par analyse Nano-LC-MS/MS ... 87
Figure 62 : Représentation schématique permettant l’identification des protéines du
sécrétome des cellules U251 et des clones shRNA par analyse Nano-LC-MS/MS ... 87
Figure 63 : Localisation subcellulaire et classification des fonctions des protéines du protéome
et du sécrétome des cellules U251 et des clones shRNA ... 87
Figure 64 : Suivi du poids des souriceaux pendant 70 jours selon leur sexe, leur génome et leur
16
Figure 65 : Suivi de la survie des souriceaux à long terme selon leur sexe, leur génome et leur
traitement ... 92
Figure 66 : Exemple d’imagerie par résonance magnétique (IRM) de cerveau de souris ... 93 Figure 67 : Histogramme présentant les différences de texture entre souris femelles WT et
Cx43+/- dans l’hippocampe et le cortex... 93 Figure 68 : Exemple de coloration Hématoxyline-Eosine réalisée sur des coupes de cerveaux
de souris ... 93
Figure 69 : Zone de définition du voxel (2,5mm3, jaune) sur une image de cerveau de souris en IRM ... 94
Figure 70 : Exemple d’un spectre obtenu après SRM, dans le voxel définit, sur un cerveau de
souris ... 94
Figure 71 : Quantification des métabolites cérébraux par SRM en fonction du sexe, du
génotype et du traitement des souris ... 94
Figure 72 : Schéma simplifié des modifications des concentrations des métabolites cérébraux
en lien avec la tumorigenèse ... 95
Figure 73 : Immunohistochimie sur coupes de cerveaux de souris femelles et localisation de la
GFAP, NeuN, la Cx43 et le BrDU (x4) ... 95
Figure 74 : Immunohistochimie sur coupes de cerveaux de souris mâles et localisation de la
GFAP, la Cx43 et le BrDU (x4)... 95
Figure 75 : Rôle de la Cx43 dans les différentes étapes de formation et de maturation des
17
Tableau 1 : Classement des gliomes selon l’OMS ... 29 Tableau 2 : Tableau récapitulatif de la distribution tissulaire des différentes Cx retrouvées chez
l’Homme ... 40
Tableau 3 : Régulation de l’état d’ouverture et de fermeture des HC ... 43 Tableau 4 : Comparaison des méthodes d’étude de la communication jonctionnelle ... 45 Tableau 5 : Pathologies liées à des mutations de connexines ... 50 Tableau 6 : Pathologies associées à une exposition aux perturbateurs endocriniens ... 56 Tableau 7 : Caractéristiques des anticorps primaires utilisés ... 61 Tableau 8 : Caractéristiques des anticorps secondaires utilisés... 61 Tableau 9 : Caractéristiques des conjugués fluorescents utilisés ... 61 Tableau 10 : Description des amorces utilisées pour le génotypage des souris SWISS ... 62 Tableau 11 : Description des amorces utilisées pour la PCR quantitative ... 65 Tableau 12 : Tableau récapitulatif de la préparation des couches du gradient de densité
OptiPrep ... 67
Tableau 13 : Logiciel utilisé selon les données à traitées ... 77 Tableau 14 : Données des figures 55 et 57 ... 83 Tableau 15 : Données des figures 56 et 57 ... 83 Tableau 16 : Données de la figure 60 ... 85 Tableau 17 : Données brute de l’analyse protéomique des cellules U251 mock et des clones
shRNA 1 et shRNA 2 ... 87
Tableau 18 : Données brute de l’analyse « sécrétomique » des cellules U251 mock et des
clones shRNA 1 et shRNA 2 ... 87
Tableau 19 : Résultats de l’analyse du protéome (P shRNA) et du sécrétome (S shRNA) des
18
CHAPITRE 1 : LE CANCER
Généralités
Le cancer est la première cause de mortalité en France devant les maladies cardiovasculaires. En 2012, 355 354 nouveaux cas de cancers y ont été diagnostiqués et 148 378 décès par cancer recensés. Il est la première cause de mortalité chez l’homme (environ un décès sur deux) et la deuxième chez la femme (environ un décès sur trois) après les maladies cardiovasculaires. Les trois cancers présentant la mortalité la plus élevée sont actuellement, chez l’homme, les cancers pulmonaires, colorectal et de la prostate, et chez la femme, ceux du sein, du poumon et colorectal (Figure 1) (Institut National du Cancer, « Les cancers en France, Edition 2014 »).
Processus de cancérisation et métastases
Qu’ils soient internes (polymorphismes et prédispositions génétiques…) ou externes (alimentation, exposition à des agents polluants, infectieux ou des radiations…), les facteurs contribuant à l’apparition d’une cellule cancéreuse sont nombreux et leurs interactions sont complexes (Figure 2) (Institut National du Cancer). Différents individus exposés à des environnements semblables ne développeront pas tous les mêmes pathologies cancéreuses. Si le facteur « chance », récemment mis en évidence, peut expliquer de telles différences, il sera néanmoins modulé par le terrain génétique individuel (Tomasetti and Vogelstein, 2015).
L’apparition d’un cancer résulte d’un processus évolutif complexe mais présentant des similitudes quel que soit le cancer. Ceci est particulièrement vrai pour les tumeurs solides dont les étapes peuvent être distinguées en phases successives d’initiation (mutation d’une cellule saine), de promotion (expansion clonale de la cellule mutée), de progression (apparition de la tumeur maligne) et d’invasion. Cette dernière phase se caractérise par l’invasion locale des tissus sains entourant la tumeur, pouvant aboutir à la formation de tumeurs secondaires à distance (métastases) (Figure 3) (Institut National du Cancer).
Au niveau cellulaire, le cancer se manifeste surtout par une perte de réponse adaptée aux signaux de son environnement. En effet, les cellules cancéreuses se caractérisent par l’acquisition de nouvelles propriétés telles qu’une insensibilité aux signaux inhibiteurs de
19
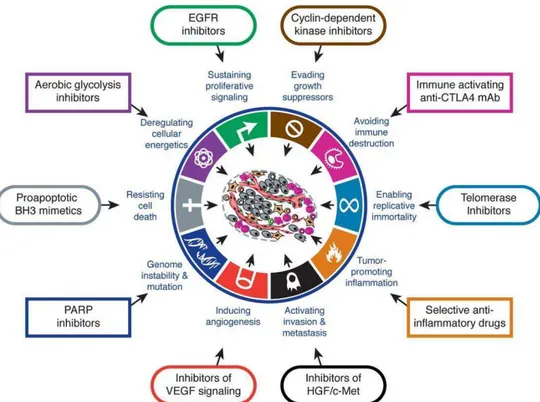
prolifération, une résistance à l’apoptose, un potentiel de prolifération illimité, et dans lecontexte tissulaire, par une capacité angiogénique accrue ainsi qu’une capacité d’invasion et de colonisation métastatique (Hanahan and Weinberg, 2000; Trosko et al., 2005). Plus récemment, d’autres caractéristiques spécifiques des cellules cancéreuses ont été relevées telles que des modifications du métabolisme cellulaire, l’échappement à la destruction par les cellules du système immunitaire (lymphocytes B et T, macrophages, cellules tueuses…), l’instabilité de leur génome (et les mutations qui en résultent) et enfin leurs capacités d’induire une réponse inflammatoire favorisant la promotion tumorale (Hanahan and Weinberg, 2011).
Ces différentes caractéristiques distinguant progressivement les cellules cancéreuses des cellules saines permettent l’identification de cibles thérapeutiques potentielles et donc de substances capables d’agir contre leur prolifération. En effet, l’étude de ces caractéristiques aide à la description des cascades moléculaires impliquées et ainsi à l’élaboration d’inhibiteurs agissant spécifiquement contre les cibles identifiées. Le métabolisme dérégulé des cellules cancéreuses s’avère être une cible de choix par des inhibiteurs de la glycolyse aérobie
(Hanahan and Weinberg, 2011) (Figure 4).
L’initiation est la première étape nécessaire au développement du cancer. Elle est la conséquence de l’altération définitive de l’ADN (mutation) d’une cellule saine par divers agents mutagènes qui peuvent être de nature physique (UV, rayons X…), chimique (hydrocarbures, amines aromatiques, nitrosamines…), infectieuse (virus…) ou génétique (rares cas dus à l’hérédité) (Wu et al., 2007). De plus, trois classes de gènes sont des cibles potentielles de ces agents mutagènes et jouent un rôle important pendant l’initiation : les proto-oncogènes, les gènes suppresseurs de tumeurs et les gènes impliqués dans la réparation de l’ADN. Des mutations affectant ces gènes risquent de conduire à la dérégulation des mécanismes impliqués dans le contrôle de la prolifération et la différenciation des cellules saines (Grander, 1998). Ces évènements sont suivis par une sélection clonale des cellules les plus prolifératives au cours de la phase de promotion (Tysnes and Bjerkvig, 2007) (Figure 5).
La promotion et la progression tumorales caractérisent la prolifération de la cellule initiée pour former d’abord une population cellulaire clonale, puis éventuellement, in fine, une tumeur maligne. La promotion a été décrite expérimentalement comme étant la conséquence à l’exposition de substances non génotoxiques, les promoteurs tumoraux (comme par exemple les oestrogènes, l’alcool, les esters de phénol, etc.). Puis, lors de la
20
progression, apparaît une hétérogénéité génétique des cellules tumorales favorisée parl’exposition aux agents génotoxiques ambiants et par la prolifération accrue des cellules tumorales. L’accroissement de la masse tumorale induit, au-delà d’un certain volume (1mm3), une angiogenèse augmentant la survie des cellules cancéreuses et donc leur expansion. La phase de progression est ainsi favorisée par le recrutement des cellules du microenvironnement associées à la tumeur telles que les cellules endothéliales (angiogenèse) mais aussi par l’infiltration de cellules inflammatoires (cf C. microenvironnement tumorale).
Lors de la phase d’invasion, certaines cellules peuvent migrer par voies sanguine et lymphatique pour former des tumeurs secondaires à distance (cancer métastatique). Cette étape est la conséquence de mutations génétiques et/ou d’évènements épigénétiques permettant la sélection des clones les plus prolifératifs et invasifs. La formation d’une nouvelle tumeur, dite « à distance » ou métastase, s’accompagne d’un dialogue accru entre cellules cancéreuses et d’autres types cellulaires rencontrés pendant l’invasion et leur déplacement dans le réseau vasculaire (cellules épithéliales, endothéliales, fibroblastes, péricytes, etc.).
Le microenvironnement tumoral
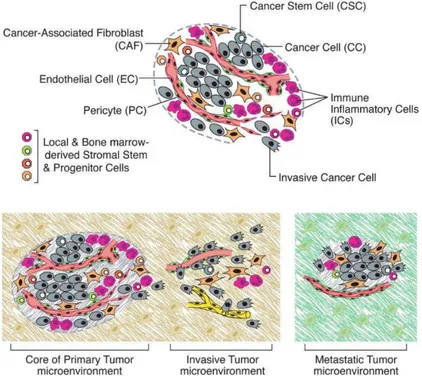
La compréhension du processus tumoral passe nécessairement par celle des mécanismes développés intrinsèquement par les cellules cancéreuses mais aussi, et ce depuis quelques années, par celle de leurs interactions avec le microenvironnement de la tumeur. Ce microenvironnement comprend ses différents types cellulaires associés, sa vascularisation, la présence de matrice extracellulaire, l’état d’oxygénation, le pH, etc. La masse tumorale est elle-même hétérogène par la présence de différents types cellulaires (fibroblastes, cellules souches, cellules endothéliales, péricytes, cellules immunitaires) qui, associés à une matrice extracellulaire, favorisent l'invasion des tissus sains et la formation de métastases (Figure 6).
1. Cellules endothéliales (EC)
Lors du processus d’oncogenèse, les cellules endothéliales des vaisseaux sanguins proches de la tumeur passent d’un état de quiescence à un état « actif » permettant la formation de nouveaux vaisseaux sanguins capables d’irriguer la tumeur. C’est le début de l’angiogenèse. Différentes voies de régulations sont impliquées dans ce phénomène (Hanahan
and Weinberg, 2011) telles que celles contrôlées par les récepteurs Eph et les éphrines qui
21
surexpression est en partie causée par des facteurs de croissance (VEGF, FGF…) sécrétés parles cellules tumorales en situation hypoxique. La surexpression de ces récepteurs permet d’augmenter l’activité angiogénique du VEGF ou encore de stimuler les voies ERK/MAPK, et donc la prolifération de cellules cancéreuses (Pasquale, 2010). Ces cellules endothéliales sont aussi celles formant les vaisseaux lymphatiques. (Tammela and Alitalo, 2010).
2. Cellules immunitaires de l’inflammation (ICs)
Dans la masse tumorale, des infiltrations des cellules immunitaires de l’inflammation sont souvent retrouvées. La présence de ces cellules inflammatoires induit des effets opposés sur la tumeur, à la fois antagoniste et de promotion tumorale (Hanahan and Weinberg, 2011;
Schafer and Werner, 2008). Ce rôle de promotion tumorale est la conséquence, en grande
partie, de facteurs sécrétés par les cellules inflammatoires telles que l’EGF, le VEGF, des facteurs pro-angiogéniques et des cytokines qui amplifient l’état d’inflammation. Des enzymes pro-invasives de dégradation de la matrice extracellulaire sont aussi sécrétées (comme la métalloprotéinase MMP-9) par ces cellules (Hanahan and Weinberg, 2011; Murdoch et al.,
2008; Qian and Pollard, 2010). Les cellules inflammatoires infiltrées, par leurs sécrétions, sont
donc impliquées dans divers processus comme l’induction et le maintien de l’angiogenèse tumorale (VEGF), la stimulation de la prolifération des cellules cancéreuses (EGF, cytokines) mais aussi l’invasion tissulaire (MMP-9) et la dissémination métastatique (Joyce and Pollard,
2009; Mantovani, 2010; Mantovani et al., 2008). Il existe deux voies d'activation possibles des
cellules immunitaires ; la voie extrinsèque, en réponse à une infection ou une inflammation, et la voie intrinsèque, en réponse à l'activation d'oncogènes. Ces deux modes d'activation conduisent à l'expression de facteurs de transcription (NF-κB, STAT3, HIF1α) dans les cellules tumorales qui permettent la sécrétion de molécules (chimiokines, cytokines, prostaglandines, etc.) favorisant le recrutement des cellules inflammatoires (macrophages, cellules éosinophiles et neutrophiles, etc.). Les cellules immunitaires activées, associées aux cellules cancéreuses et stromales, surexpriment les facteurs de croissances cités précédemment qui eux-mêmes permettent la production de chimiokines. Ceci forme donc une boucle d’activation positive où l'inflammation est de plus en plus présente favorisant la prolifération et la survie des cellules tumorales, l'angiogenèse, la lymphangiogenèse, la migration et l'invasion (Figure 7).
22
3. Fibroblastes associés aux tumeurs (CAF)
Les fibroblastes associés aux tumeurs sont les cellules prépondérantes de la population stromale, à proximité des tumeurs. Dans les tissus tumoraux, il existe deux sous-types de population fibroblastique: les fibroblastes nécessaires au support structural des épithélia (fibroblastes dérivés du tissus) et les myofibroblastes (rares dans les tissus épithéliaux sains sauf dans le pancréas et le foie) qui se caractérisent par l’expression d’actine des muscles lisses. Ces derniers sont nécessaires à la réparation tissulaire mais sont aussi responsables d’effets délétères lors des inflammations chroniques, contribuant par exemple, aux fibroses pulmonaires, rénales ou hépatiques associées à certaines pathologies. Les myofibroblastes sont aussi impliqués dans la progression tumorale et surtout dans la prolifération, l’angiogenèse, l’invasion et la dissémination des métastases (Hanahan and Weinberg, 2011;
Kalluri and Zeisberg, 2006). Cette implication est la conséquence de leurs interactions avec les
autres types cellulaires présents dans l’environnement tumoral (cellules cancéreuses, cellules épithéliales, cellules endothéliales, cellules immunitaires de l’inflammation, péricytes) via la sécrétion de facteurs de croissance (VEGF, HGF, TGF-β), d’interleukines (IL-1), de métalloprotéinases, de ténascine (ténascine C) (Figure 8). Cependant, les rôles de ces cellules restent encore à définir.
4. Péricytes (PC)
Les péricytes (de péri-, « autour » et –cytes, « cellules ») sont des cellules périvasculaires présentant des protrusions qui s’enroulent autour des vaisseaux sanguins. Ils ont pour origine les progéniteurs de péricytes issus de la moelle osseuse, la prolifération de péricytes préexistants et probablement d’autres sources encore inconnues (Winkler et al., 2011).
Les péricytes possèdent de nombreuses fonctions telles que la stabilisation des vaisseaux sanguins, l’aide à la maturation des vaisseaux néoformés, l’apport de signaux de survie (paracrine) aux cellules endothéliales.
Ainsi, par exemple, les péricytes sécrètent de l’angiopoïétine 1 et 2 (signaux angiogéniques qui se fixent sur les récepteurs Tie2 des cellules endothéliales) et de petites quantités de VEGF nécessaires à la prolifération de ces cellules (Bergers and Song, 2005;
23
du PDGF) provoque, entre autres, la dilatation des vaisseaux sanguins et des fuitesgénéralisées au niveau des microvaisseaux menant à la mort de l’animal pendant la gestation
(Lindahl et al., 1998).
Dans le contexte tumoral, bien que moins présents que dans les tissus sains, ils participent au maintien de l’intégrité et de la fonction de la vascularisation tumorale. (Bergers
and Hanahan, 2008). Pour cette raison, les péricytes sont devenus une nouvelle cible
antiangiogénique dans les thérapies tumorales et, actuellement, des traitements anti-VEGF sont testés cliniquement sur des patients (combinés à des traitements anti-PDGF) (Benjamin et al., 1998; Gaengel et al., 2009).
5. Cellules souches et progénitrices du stroma tumoral
Le réservoir principal des différents types cellulaires du stroma tumoral est le tissu sain adjacent. Mais, depuis quelques années, la moelle osseuse est apparue comme étant un nouveau réservoir de cellules associées aux tumeurs. En effet, des cellules souches et progénitrices mésenchymateuses présentes dans les tumeurs proviennent de la moelle osseuse (Bergfeld and DeClerck, 2010). Ces cellules s’y différencient en plusieurs types cellulaires du stroma tumoral ou persistent en l’état avant de se différencier plus tardivement. Les cellules du stroma tumoral peuvent ainsi avoir plusieurs origines. Elles peuvent proliférer à partir de cellules stromales préexistantes ou provenir de la différenciation de cellules souches/progénitrices originaires des tissus sains voisins ou de cellules souches/progénitrices provenant de la moelle osseuse (Bergfeld and DeClerck, 2010; Fang and Salven, 2011; Lamagna and Bergers, 2006).
Un autre type de cellules souches sont les cellules souches cancéreuses, de plus en plus étudiées actuellement, et décrites comme étant des « réservoirs » potentiels de cellules cancéreuses. L’appellation « souche » provient de leur propriété d’auto-renouvellement et de leur capacité à générer différents types cellulaires (Hanahan and Weinbeg, 2011). On ignore encore si ces cellules souches cancéreuses proviennent de la transformation de cellules souches préexistantes du tissu originel de la tumeur ou si elles sont la conséquence d’une dédifférenciation de cellules du tissu. Un intérêt croissant s’est porté sur ces cellules car elles seraient la cause principale de la prolifération tumorale et de son auto-renouvellement. De
24
plus, ces cellules semblent être une des causes principales de la résistance aux thérapies et derécidives de certains cancers comme les gliomes (Singh and Settleman, 2010).
6. Réseaux vasculaires sanguin et lymphatique
Réseau sanguin : angiogenèse
Par la création de nouveaux vaisseaux sanguins, l’angiogenèse tumorale permet d’irriguer la tumeur. D’une manière générale, ce n’est pas un phénomène pathologique en soi car il assure le renouvellement du réseau sanguin dans l’organisme sain ou suite à la cicatrisation de tissus endommagés. A l’origine d’un nouveau réseau vasculaire, des cellules précurseurs de cellules endothéliales (angioblastes), présentes dans les tissus, se différencient en cellules endothéliales (50-200 fois plus dans le contexte du cancer que dans un tissu sain) et forment des nouveaux vaisseaux. Ce processus s’accompagne du recrutement de péricytes et de cellules musculaires lisses (Martinive and Coucke, 2010). Dans la zone de néovascularisation, des taux élevés de VEGF et de FGF permettent aux cellules composant le réseau de proliférer (Figure 9). Ce processus est identique dans le contexte tumoral et permet, par l’apport de nutriments et de dioxygène, la croissance de la tumeur. Cependant, le réseau vasculaire tumoral nouvellement formé présente des différences structurelles par rapport au réseau vasculaire normal et entraîne par dérivation sanguine, l’apparition de zones hypoxiques dans le tissu normal à proximité de la tumeur. En outre, les vaisseaux néoformés augmentent la résistance aux traitements des tumeurs et favorisent leur dissémination métastatique (Bergers and Benjamin, 2003).
L’angiogenèse tumorale est régulée par un nombre importants de facteurs pro-angiogéniques (facteurs de croissance, etc.) ou anti-pro-angiogéniques (statines, etc.). Appelé « switch » angiogénique, l’équilibre de cette balance peut être rompu par excès de molécules pro-angiogéniques. L’EGF, sécrété par les cellules tumorales, permet de surexprimer les niveaux de VEGF (surexprimé aussi par l’acide lysophosphatidique, LPA), de FGF et d’IL-8. Parmi les molécules anti-angiogéniques, la thrombospondine-1 diminue la prolifération et la motilité des cellules endothéliales. Les statines, quant à elles, dérivent de grosses protéines qui n’ont pas d’effet sur l’angiogenèse (par exemple, l’angiostatine qui est un fragment de plasminogène liant l’ATP synthétase et l’annexine II ou encore la canstatine qui est un fragment de collagène se liant aux intégrines). Les niveaux d’activateurs et d’inhibiteurs
25
permettent de rendre une cellule endothéliale quiescente ou angiogénique (Bergers andBenjamin, 2003) (Figure 10).
Les stimuli permettant le « switch » angiogénique sont nombreux tels que l’hypoxie, l’activation d’oncogènes, la mutation de suppresseurs de tumeur, etc. Mais les raisons exactes provoquant le déséquilibre de cette balance sont encore mal connues. En revanche, les conséquences sont relativement bien décrites, à commencer par la dilatation des vaisseaux sanguins existants et proches de la tumeur. Par la suite, de nouveaux vaisseaux sanguins sont formés et les cellules périvasculaires sont recrutées. Les vaisseaux sanguins nouvellement formés augmentent ainsi l’apport de nutriments et de dioxygène aux cellules tumorales permettant la survie de celles-ci (Figure 11) (Bergers and Benjamin, 2003).
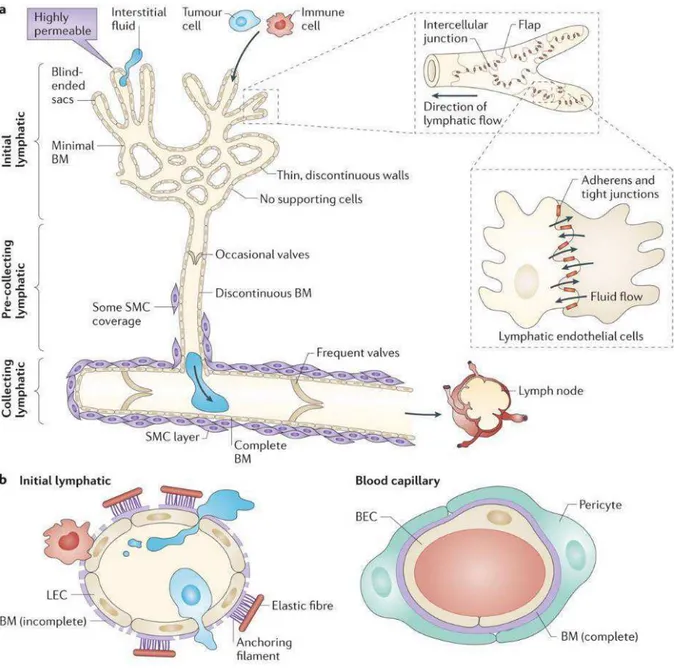
Réseau lymphatique : lymphangiogenèse
Le système lymphatique est essentiel pour la fonction immunitaire, l’homéostasie des fluides tissulaires et pour l’absorption des graisses alimentaires. Au sein des tissus, le réseau lymphatique initial est constitué des petits vaisseaux lymphatiques dont les cellules sont caractérisées par la présence de filaments intracellulaires courts et d’ancrage qui relient la membrane luminale des cellules endothéliales lymphatiques (CEL) aux fibres élastiques environnantes de la matrice extracellulaire. Dans les tissus, les fluides extracellulaires, d’abord collectés par les petits vaisseaux lymphatiques, sont ensuite conduits vers des vaisseaux pré-collecteurs qui débouchent dans des vaisseaux pré-collecteurs plus gros (Gerli et al., 2000) (Figure 12).
Les CEL tumorales proviennent des vaisseaux lymphatiques préexistants ou de la différenciation d’autres cellules. Leur prolifération, permettant l’élargissement du réseau lymphatique, est stimulée par des facteurs de croissance sécrétés par les cellules cancéreuses et par les cellules du système immunitaire du microenvironnement tumoral (Achen et al.,
1998; Karkkainen and Petrova, 2000; Makinen et al., 2001). La présence de la matrice
extracellulaire, des fibroblastes, et des cellules mésenchymateuses joue un rôle prépondérant dans la prolifération des CEL (Dadras et al., 2003; Padera et al., 2002).
Le rôle exact des vaisseaux lymphatiques intra-tumoraux dans la tumorigenèse est constamment débattu puisque la plupart d’entre eux semblent « écrasés » dans la tumeur et donc non fonctionnels. En revanche, les vaisseaux lymphatiques péri-tumoraux, connus pour
26
s’élargir pendant la tumorigenèse, participent à la dissémination métastatique. En effet, demême que pour le réseau sanguin, le développement de ces vaisseaux augmente leur surface de contact avec la tumeur et donc le risque de passage de cellules tumorales à l’intérieur du réseau lymphatique (Li and Li, 2015) (Figure 13). Une fois que les cellules tumorales sont
parvenues à l’intérieur des vaisseaux lymphatiques collecteurs, elles suivent la lymphe qui est drainée jusqu’aux ganglions lymphatiques sentinelles (GLS) puis au conduit thoracique. De là, la lymphe déversée dans la circulation sanguine permet la dissémination des cellules cancéreuses à l’organisme entier. Ce phénomène reste à ce jour mal décrit mais mériterait d’être d’avantage étudié pour diminuer le risque de généralisation des cancers qui est principalement limité au ciblage des VEGFR3 et VEGFA/C/D (Li and Li, 2015; Stacker et al., 2014).
7. Matrice extracellulaire (MEC)
Les myofibroblastes sont les principaux producteurs de la MEC interstitielle. Les cellules tumorales et stromales activées peuvent réguler la composition et l’abondance de la matrice en sécrétant des quantités croissantes de protéases et de facteurs de croissance au cours de la progression tumorale (Cukierman and Bassi, 2010; Goetz et al., 2011). La MEC synthétisée contient de grandes quantités de collagène I, de fibronectine et d’autres protéines matricielles telles que la périostine (Cirri and Chiarugi, 2011).
Des compositions particulières de la MEC sont utilisées comme marqueurs de pronostics de certains cancers. Par exemple, la sécrétion plus importante de hyaluronane par les fibroblastes tumoraux est fréquemment observée dans les cancers du pancréas et est connue pour promouvoir la croissance tumorale (Kultti et al., 2014). Dans les gliomes, des protéoglycanes, comme le chondroïtine sulfate (CSPG), sont surexprimés et jouent un rôle central dans l'organisation de la MEC (Silver et al., 2013). En outre, la MEC est un réservoir de facteurs de croissance (TGF-β, FGF, PDGF-BB, VEGF, HGF, IGF-1, etc.) (Kanematsu et al., 2004)
et l'augmentation des stimuli mécaniques, causée par la pression exercée par la prolifération des cellules tumorales, facilite leur diffusion locale (Hinz, 2009) (Figure 14).
Pendant la tumorigenèse, les cellules cancéreuses et stromales expriment des facteurs biochimiques tels que des enzymes modifiant la composition de la matrice (MMP, LOX (Lucero