HAL Id: dumas-01858571
https://dumas.ccsd.cnrs.fr/dumas-01858571
Submitted on 21 Aug 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Manifestations buccales des maladies auto immunes :
microbiote, immunité, et nouvelles thérapeutiques
Mona Hamdi
To cite this version:
Mona Hamdi. Manifestations buccales des maladies auto immunes : microbiote, immunité, et nouvelles thérapeutiques. Sciences pharmaceutiques. 2018. �dumas-01858571�
Université de Bordeaux
U.F.R DES SCIENCES PHARMACEUTIQUES
Année 2018 N°28
Thèse pour l’obtention du
DIPLOME D’ÉTAT DE DOCTEUR EN PHARMACIE
Présentée et soutenue publiquement le 05 Mars 2018
Par Mona HAMDI
Née le 08 octobre 1991 à VIERZON
Manifestations buccales des maladies auto immunes : microbiote,
immunité, et nouvelles thérapeutiques.
Directeur de thèse
Maria MAMANI MATSUDA
Président du jury
Dr. Thierry NOEL Docteur en Pharmacie
Professeur de Mycologie
Membres du jury
Dr. Maria MAMANI MATSUDA Maître de conférences en Immunologie Dr. Julie NOTS Docteur en Pharmacie
REMERCIEMENTS
À mon président de thèse, Monsieur le Professeur Thierry Noël, Docteur en pharmacie et professeur en mycologie
Pour m’avoir fait l’honneur de présider le jury de cette thèse. À ma directrice de thèse, Madame Maria MAMANI MATSUDA, Maitre de conférence en immunologie
Je vous remercie pour votre disponibilité, le partage de vos connaissances, votre esprit critique. Je vous adresse mes remerciements les plus sincères.
Soyez assurée de ma profonde reconnaissance. À mes juges,
Madame Julie NOTS, Docteur en pharmacie
Vous avez accepté, avec un grand intérêt, de juger ce travail.Soyez assurée de l’honneur que vous me faites. Pour votre encadrement et le partage de vos connaissances durant mon stage de 6ème année.
Veuillez trouver ici le témoignage de ma reconnaissance et de mes sincères remerciements. Madame Leila KAROUCH,
Docteur en chirurgie dentaire
Pour avoir aimablement accepté de participer à ce jury de thèse, en m’apportant des connaissances en médecine dentaire.
À mon mari
Pour ta patience inégalable, et tes encouragements incessants durant ces longues années d’études. Pour avoir supporté mes sauts d’humeurs avant mes examens, et les coups de stress avant l’annonce des résultats.
À ma fille
Qui a été pour moi, une source de motivation pour finaliser cette thèse. Je vais enfin pouvoir t’accorder toute mon attention et ma délicatesse.
À mes parents, mes frères et soeurs, À ma belle-famille,
Merci pour votre soutien, et pour votre présence durant toutes ces années. Vous tous qui êtes venus en ce jour et pour tous ceux qui n’ont pas pu se déplacer.
À Fedoua, Zachiya et Estelle et autres camarades de classes
À nos délires, nos bonheurs partagés ensemble. Pour m’avoir aidée et supportée dans mes études.
À mes professeurs
Pour votre disponibilité, votre écoute et pour tous ce que vous m’avez transmis. À l’équipe de la scolarité
Tables des matières
Liste des figures ...5
Liste des tableaux ...6
Liste des abréviations ...7
Introduction ...8 I- La cavité buccale ...9 A) Généralités ...9 B) L'immunité buccale ...10 1) L’immunité innée ...11 1.1) Barrières physico-chimiques ...11 1.2) La salive ...11
1.3) La pellicule exogène acquise ...15
1.4) Cellules de l’immunité innée ...15
2) L’immunité adaptative ...17
3) La réaction immunitaire due à la présence d’un antigène dans la cavité buccale 19 . 3.1) Transport de l’Ag ...19
3.2) Stimulation des lymphocytes T et B ...22
3.3) Adressage des lymphoblastes stimulés vers la cavité buccale ...23
3.4) IgA ...23
II- Qu'est-ce que le microbiote ? ...25
A- Généralités ...25
1) Définition du microbiome ...25
2) La naissance du microbiote ...26
B) Le microbiote buccal ...27
1) Composition du microbiote buccal ...27
2) La dysbiose orale ...31
C) Lien entre immunité et microbiote ...31
1) Rôle protecteur du microbiote ...32
2) Rôle du microbiote dans l’inflammation ...35
3) Rôle du microbiote dans la tolérance ...36
4) Rôle dans la pathogenèse ...36
5) Les interactions entre immunité, alimentation et microbiote ...37
III- Les manifestations buccales des maladies auto-immunes ...38
A) Généralités sur les maladies auto-immunes ...38
B) Les maladies auto-immunes et les perturbations éventuelles du microbiote ...41
1) Le lupus érythémateux disséminé (LED) ...43
1,1) Caractéristiques générales du lupus érythémateux disséminé ...43
1,2) Impact sur le microbiote ...43
2) La polyarthrite rhumatoïde ...48
2,1) Caractéristiques générales de la polyarthrite rhumatoïde ...48
2,2) Impact sur le microbiote ...48
3) Les maladies inflammatoires chroniques de l’intestin (MICI) ...50
3,1) Caractéristiques générales des MICI ...50
3,2) Impact sur le microbiote ...52
4) Le syndrome de Sjögren (SS) ...56
4,1) Caractéristiques générales du syndrome de Sjögren ...56
4,2) Impact sur le microbiote ...56
IV- Prise en charge thérapeutique et la place du pharmacien d'officine ...57
A) Les traitements généraux des maladies auto-immunes ...57
3) Les immunosuppresseurs ...57
4) Les biothérapies ...60
B) Les manifestations buccales des maladies auto-immunes et leurs traitements ...62
1) Aphtes ...62
2) La xérostomie ...63
3) La candidose ...63
4) La glossite ...63
5) Autres manifestations buccales ...63
C) Les nouvelles perspectives de traitements ...64
1) Les probiotiques ...64
2) Les prébiotiques ...68
D) La place du pharmacien d’officine ...69
Conclusion ...74
Liste des figures
Figure 1: Anatomie buccale(1)
Figure 2: Epithélium kératinisé de la muqueuse buccale(2) Figure 3: Les différentes glandes salivaires(3)
Figure 4: L’anneau de Waldeyer(12) Figure 5: Structure des amygdales(13) Figure 6: Plaque de Peyer(13)
Figure 7: Effet des cytokines sur la production d’immunoglobulines A (IgA)(6) Figure 8: IgA sécrétoires dimériques(9)
Figure 9: Les divers microbiotes humains(17)
Figure 10: Promotion de l'immunité protectrice par le microbiote(24) Figure 11: Le pare-feu muqueux(24)
Figure 12: Promotion de la régulation immunitaire par le microbiote pendant l'état d'équilibre et l’inflammation(24)
Figure 13: Interdépendance des interactions entre l'alimentation, le système immunitaire et le microbiote (24)
Figure 14: Lien entre dysbiose et différentes maladies auto-immunes(45)
Figure 15: Le développement de maladies auto-immunes systémiques dans le temps (4)
Figure 16: Érythème muqueux léger de la gencive maxillaire antérieure droite(61)
Figure 17: Une zone délimitée d'érythème muqueux impliquant la muqueuse alvéolaire maxillaire antérieure gauche(61)
Figure 18: Gonflement nodulaire des papilles interdentaires entre les incisives mandibulaires centrales et latérales permanentes droites et la canine primaire(61)
Figure 19: Modèle de la pathogenèse de la maladie parodontale et de la maladie inflammatoire de l’intestin(21)
Figure 20: Métabolisme simplifié des thiopurines (72)
Liste des tableaux
Tableau 1: Liste des bactéries les plus représentées au niveau buccal(29) Tableau 2: Distribution phylogénétique des 619 taxons du microbiome oral(16)
Tableau 3: Critères de classification du lupus érythémateux systémique selon le SLICC (adapté de Petri et al. Arthritis Rheum 2012)(49)
Tableau 4: Résumé des principales études épidémiologiques évaluant l'association entre la parodontite et la MICI(21)
Tableau 5: Les anti-TNFα(74)
Tableau 6: Les différents mécanismes des probiotiques pour induire les Treg(80)
Tableau 7: Induction des cellules T régulatrices par différents mécanismes à médiation par les prébiotiques et les probiotiques(80)
Liste des abréviations
Ac : Anticorps
AGCC : Acides gras à chaîne courte
ACPA : Anticorps anti-peptides ou protéines citrullinées Bdb : Bain de bouche
CDs : Cellules dendritiques
CMH : Complexe Majeur d’Histocompatibilité CPA : Cellules présentatrices des antigènes CTLA4 : cytotoxique T-Lymphocyte Antigen 4 GALT : Gut-associated lymphoid tissue GITR : Glucocorticoïde TNF receptor HBD : Human Beta-defensines HLA : Antigène leucocytaire humain; IgA : Immunoglobuline A
IgAs : Immunoglobulin A secrétoire IL : Interleukine
IFN : Interférons
LED : Lupus érythémateux disséminé MALT : Mucosa-associated lymphoid tissue
MICI : Maladies Inflammatoires Chroniques de l’Intestin MC : Maladie de Crohn
MP : Maladie paradontale MTX : Méthotrexate
Cellules NK : Cellules Natural-Killer PAD : Peptidylarginine desaminases
PAMP : Pathogen Associated Molecular-Pattern PGE2 : Prostaglandine E2
PR : Polyarthrite rhumatoïde PRP : Proline-rich proteins
PRR Pattern Recognition Receptors RCH : Rectocolite hémorragique SS : Syndrome de Sjögren
TGF-β : Transforming Growth Factor TLR : Toll Like Receptor
TM7 : Famille de bactérie Candidatus Saccharibacteria TNF α : Tumor necrosis factor α
Introduction
Les maladies auto-immunes résultent d'un dysfonctionnement du système immunitaire qui va alors s’attaquer aux constituants normaux de l’organisme, ou « auto-antigènes ». Elles touchent de plus en plus la population, notamment les pays industrialisés.
Du point de vue physiopathologique, ces maladies correspondent à la survenue d’une rupture de tolérance au soi, dont les mécanismes sont complexes et font appel à l’ensemble des acteurs du système immunitaire. Leurs origines restent, de nos jours, encore hypothétiques mais les facteurs génétiques et environnementaux semblent jouer un rôle primordial.
Ces maladies auto-immunes peuvent se manifester cliniquement au niveau buccal par des ulcérations, des érythèmes muqueux. L’étude des manifestations orales dans la maladie de Crohn, la polyarthrite rhumatoïde, le lupus et le syndrome de Sjögren ont mis en évidence le rôle de certaines bactéries dans le processus inflammatoire retrouvé dans les maladies auto-immunes.
L’objectif de cette thèse est d’établir un lien entre le système immunitaire et le microbiote buccal.
Le système immunitaire buccal est spécifique notamment grâce à ces immunoglobulines A. Les cellules de l’immunité vont communiquer avec les commensaux présents dans notre flore par l’intermédiaire des cytokines et d’autres médiateurs. La compréhension de ces différents mécanismes de communication permettrait la découverte de nouvelles thérapeutiques prenant en compte le pouvoir modulateur du microbiote.
Dans un premier temps, l’immunité buccale sera traitée en détail. Ensuite, le microbiote buccal sera étudié. À travers certaines maladies auto-immunes, on verra les changements du microbiote chez les personnes malades et l’influence de celui-ci sur la maladie.
Le microbiote est aujourd’hui au coeur des recherches scientifiques, son rôle est encore mal connu mais en partie résolu. Des études plus poussées pourraient être à l’origine de nouvelles thérapeutiques beaucoup moins contraignantes que les immunosuppresseurs, notamment les probiotiques et prébiotiques.
I- La cavité buccale A) Généralités
La cavité buccale comprend les lèvres, les joues, le palais (plafond de la bouche), le plancher de la bouche et une partie de la langue (Figure 1).
Figure 1: Anatomie buccale(1)
La cavité buccale occupe le tiers inférieur de la face, elle se situe entre les maxillaires et la mandibule, elle est ouverte en avant au niveau des lèvres par la fente orale, en continuité en arrière avec la paroi orale du pharynx au niveau d'une large ouverture l'isthme du gosier.
L’oropharynx est l’un des trois segments du pharynx, organe considéré comme le carrefour entre les voies aériennes (de la cavité nasale vers le larynx) et les voies digestives (de la cavité buccale vers l’oesophage). Il contient les amygdales impliquées dans le système de défense immunitaire de l’organisme. Il en existe plusieurs au sein du pharynx mais les plus connues sont les amygdales palatines, nommées sous le terme globale d’« amygdales » dans le langage courant. L’oropharynx inclut également d’autres éléments comme la luette, le voile du palais, ainsi que la base de la langue.
Le voile du palais est une lame fibreuse quadrilatère dont le bord antérieur s'attache au bord postérieur de la voûte osseuse. La luette est un organe de 10 à 15 millimètres de long, de forme tubulaire quand il est détendu, qui pend à la partie moyenne du bord inférieur du voile du palais. Elle est constituée d'un tissu membraneux et musculaire. Depuis la partie antérieure du voile du palais, s'étendent vers le bas les piliers antérieurs (muscle palato-glosse) délimitant ainsi l'isthme de l'arrière-bouche (entre la cavité buccale et l'oropharynx) et plus loin, se trouvent les piliers postérieurs (palato-pharyngien), qui délimitent l'isthme rhinopharyngé séparant le rhinopharynx de l'oropharynx.
De chaque côté, entre le pilier antérieur et le postérieur, se trouvent les amygdales palatines.
La langue est divisée en deux sections, la racine de la langue et le corps de la langue qui est, lui aussi, divisé en deux parties : le tiers postérieur ou segment pharyngien et les deux-tiers antérieurs ou segment buccal.
Les papilles gustatives circumvallées ou caliciformes forment un V ouvert en avant. Elles portent des bourgeons du goût . Ces papilles du V lingual sont justes en avant du sillon terminal. Elles forment la limite antérieure de la racine de la langue ou partie fixe, et la limite postérieure de la partie mobile ou pointe de la langue.
La muqueuse buccale est en continuité avec celle du tractus gastro-intestinal (Figure 2). Elle est composée par :
- un épithélium pavimenteux stratifié qui peut être kératinisé ou non.
-
une jonction épithélio-conjonctive appelée la membrane basale-
un tissu conjonctif dont le rôle est d’assurer les fonctions de nutrition et d’alimentation du tissus épithélial.Figure 2 : Epithélium kératinisé de la muqueuse buccale(2)
A. Epithélium kératinisé
1- Cornéocytes trichome de Masson 2- Cellules granulaires
3- Cellules épineuses 4- Cellules suprabasales 5- Cellules basales 6- Lamina propria
L'épithélium de la cavité buccale est une couche stratifiée de cellules squameuses non kératinisées (à l'exception de la gencive kératinisée) et a une nature beaucoup moins absorbante et perméable que l'épithélium intestinal qui est composé d'une seule couche cellulaire. L'excrétion cellulaire de la couche superficielle de l'épithélium buccal minimise la colonisation des bactéries3.
B) L'immunité buccale
La protection de la muqueuse buccale est assurée par l’immunité spécifique (réaction à un Ag spécifique par les IgA) complétée par l’immunité innée.
Physiologiquement, il existe dans la cavité buccale un équilibre entre l’hôte, la flore et les facteurs exogènes.
En effet, l’immunité innée joue un grand rôle au niveau des muqueuses. Il peut s'agir d'un rôle purement physique, comme l'effet-barrière grâce à l'étanchéité des épithéliums ou l'effet "chasse" des sécrétions muqueuses comme la salive.
L’ensemble des muqueuses est protégé par un système immunitaire dédié appelé MALT (Mucosae Associated Lymphoid Tissus). Les sites inducteurs du MALT (plaques de Peyer et nodules solitaires) assurent une protection dynamique vis-à-vis des antigènes de l’environnement qu’ils captent par des cellules spécialisées, les cellules M.
Les IgA sécrétoires sont les principaux anticorps de l’immunité des muqueuses et ils empêchent la pénétration des antigènes.
On va donc voir en détail les mécanismes de l’immunité notamment la réaction immunitaire en réponse aux antigènes retrouvés dans la cavité buccale.
1) L’immunité innée
1.1) Barrières physico-chimiques
La barrière cutanéo-muqueuse est recouverte en continu par des cellules épithéliales et elle constitue la première ligne de défense non spécifique. Elle s’oppose à la pénétration des micro-organismes. Elle est faite grâce à des composants antibactériens contenus dans les muqueuses et dans la salive.
Elle est en contact avec les virus, parasites et bactéries. Elle empêche leur adhésion par des mécanismes mécaniques, chimiques ou biologiques grâce au mucus. Cette protection est permise par des barrières physicochimiques, la desquamation des couches superficielles de la muqueuse buccale et le flux salivaire.
1.2) La salive
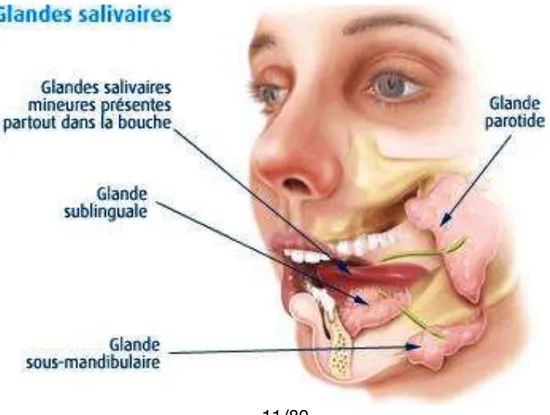
Les glandes salivaires principales sont présentes dans la cavité buccale au nombre de 3 paires (Figure 3):
• les glandes sublinguales qui déversent la salive dans la bouche, par l'intermédiaire des canaux de Walther et de Rivinus.
• les glandes sous-mandibulaires (aussi appelées glandes sous-maxillaires) déversent la salive par l'intermédiaire du canal de Wharton.
• les glandes parotides, les plus grosses, sont situées de chaque côté. Elles déversent la salive au niveau de la joue par le canal de Sténon.
Ils existent aussi des glandes salivaires accessoires tapissant la muqueuse buccale. Ces glandes sécrètent la salive qui joue un rôle important dans l’immunité buccale.
Il faut différencier le fluide oral et le fluide gingival. Le fluide gingival vient du sillon gingivo-dentaire : on y retrouve de l’albumine, du fibrinogène, des globulines, des cellules polynucléaires majoritairement de type neutrophiles, quelques lymphocytes et plasmocytes qui vont migrer à travers l’attache épithéliale.
Il participe à la défense de l’organisme par rapport à l’agression bactérienne grâce notamment aux immunoglobulines sécrétées et puis grâce aux quelques cellules qui auront pu traverser cet épithélium de jonction. Alors que, le fluide oral comprend le fluide gingival, les sécrétions salivaires, les sécrétions nasales et les sécrétions bronchiques. Les sécrétions salivaires ont une composition différente selon leur origine, elles contribuent à l’écosystème buccal.
En effet, la salive a de nombreuses fonctions notamment digestive, de protection, de réparation des tissus mous grâce à la présence de facteurs d’accélération de la cicatrisation (facteur de croissance épithéliale).
Elle est composée :
- de 99% d’eau,
- d’enzymes : hyaluridase, bêta-galactosidase, alpha-amylase, - d’électrolytes : Na+, K+,Ca 2+,
- d’IgG, IgA, IgM, -d’urée.
Elle exerce la fonction antibactérienne par l’intermédiaire de plusieurs protéines et peptides :
• Les peroxydases
Elles sont produites par les cellules acineuses des glandes salivaires. Cette enzyme a non seulement des propriétés antioxydantes par la détoxication du peroxyde d'hydrogène mais elle permet aussi la production de composés antimicrobiens. Elles sont capables de catalyser, en présence de peroxyde d'hydrogène, de l'iode, du brome et du thiocyanate et ainsi de produire les composés antimicrobiens qui sont connus pour être bactéricides ou bactériostatiques et cela selon le type de bactérie (Gram positif, Gram négatif) mais ils sont également virucides et fongicides.
• Les agglutinines
Ces glycoprotéines favorisent l'agrégation des bactéries buccales et elles sont présentes dans les salives parotidiennes et sous-mandibulaires.
• Les défensines
Les défensines sont de petits peptides classés en 2 groupes différents : les alpha-défensines et les bêta-alpha-défensines. Les alpha-alpha-défensines (HNP Human Neutrophil Peptides) sont synthétisées par les polynucléaires neutrophiles en haute concentration dans le fluide gingival, elles sont activées après protéolyse. Quant aux beta-défensines (HBD Human Beta-defensins), elles sont synthétisées par les cellules épithéliales de la muqueuse orale et les glandes salivaires contrôlées par les médiateurs de l’inflammation TNF, IL-1, IFN ou même certaines bactéries. Elles possèdent une activité bactéricide, fongicide et virucide.
• Lysozyme
Le lysozyme est une protéine globulaire qui est impliquée dans la défense contre les infections bactériennes. Le lysozyme est retrouvé dans la salive mais aussi dans les larmes et le mucus. Il s'agit d'une glycoside hydrolase acide sécrétée par les granulocytes et les monocytes. Elle détruit la paroi des bactéries à Gram positif en catalysant l'hydrolyse des peptidoglycanes. Le lysozyme pourrait inhiber la croissance du
Streptococcus mutans.
• La lactoferrine
Elle est synthétisée par les cellules de glandes salivaires et les leucocytes. En plus de son site de fixation du fer, elle possède une séquence en N-terminal porteuse de l’activité bactéricide. Elle forme des pores dans la paroi bactérienne. Elle appartient à la famille des CAP (Channel-forming Amphiphatic Peptides)5.
• Les histatines
Ce sont des protéines riches en histidine retrouvées dans les sécrétions parotidiennes et sous-mandibulaires. Elles possèdent une activité anti-bactérienne, leur façon d’agir est encore mal connue mais les histatines sembleraient perturber le métabolisme des bactéries. Elles sont aussi antifongiques. Elles contribuent à la formation de la pellicule acquise exogène.
Ce sont des facteurs de stimulation de la cicatrisation buccale en activant la migration des cellules épithéliales.
Les molécules antibactériennes lysozymes, lactoferrines, et défensines sont produites par les polynucléaires neutrophiles notamment les défensines sous types beta HBD1 qui sont retrouvées en plus grande quantité dans les cellules épithéliales gingivales et les glandes salivaires.
• Les mucines
Ce sont des glycoprotéines qui tapissent le tissus épithélial pour former un film muqueux visqueux qui a pour but de protéger contre les agressions microbiennes. Elles sont synthétisées par les cellules acineuses des glandes salivaires (sous-mandibulaires, sublinguales) et elles constituent le principal constituant de la salive.
Il existe 2 types de mucines :
-
les mucines de type 1 (codés par le gène MUC5B):Elles sont de haut poids moléculaire, insolubles, elles ont des propriétés viscoélastiques qui contribuent à la mastication, à l’élocution, à la déglutition mais aussi à la formation de la pellicule acquise exogène. Elles participent à former une barrière protégeant les muqueuses contre les agressions mécaniques, bactériennes et virales. Ils forment une matrice qui piège d’autres protéines comme les lysosymes, les immunoglobulines A, ou la lactoferrine. Les glandes accessoires jouent un rôle important dans cette synthèse. Sans les mucines, la pellicule formée par la salive n’offre que 30% de son potentiel normal de protection.
-
les mucines de type 2 (codés par le gène MUC7) :Elles sont petites et solubles, synthétisées par les glandes sous-mandibulaires et sublinguales. Grâce à ses adhésines, elles piègent certains micro-organismes tels que
Porphyromonas gingivalis, Helicobacter pylori, Actinomyces naeslundii, Streptococcus sanguis et Candida albicans pour les évacuer afin qu’ils soient déglutis. Donc selon le type
de mucines, il y a aura une sélection des micro-organismes : ceux qui adhèrent aux surfaces orales et ceux qui sont agglutinés et déglutis.
• Alpha-amylase
Elle représente 10% des protéines salivaires. C’est une enzyme sécrétée par la glande parotidienne servant à la digestion en hydrolysant l’amidon en glucides simples. Elle constitue un site de liaison aux adhésines bactériennes.
• Proline-rich proteins PRP
Les protéines riches en proline sont des composants majeurs de la salive parotidienne et sous-maxillaire chez l'homme. Ils peuvent être divisés en :
- protéines acides, qui contribuent à la pellicule acquise exogène en servant de récepteurs pour le Porphyromonas gingivalis,
- protéines basiques qui sont produites exclusivement par la parotide, - protéines glycosylées
Les PRP sont apparemment synthétisées dans les cellules acineuses des glandes salivaires et leur expression phénotypique est sous contrôle génétique complexe.
• Stathérine
C’est une protéine produite par les glandes parotides et les glandes sous-mandibulaires qui est capable d’interagir avec Porphyromonas gingivalis et Fusobacterium. Elle fait partie des « protéines intrinsèquement désordonnées ».
Elle possède une structure spéciale ; elle s’ordonne seulement si elle est liée à une autre protéine. Elle a un domaine d’affinité à l’hydroxyapatite, au calcium, et au phosphate donc elle permet d’éviter la précipitation du phosphate de calcium et elle participe à la pellicule acquise exogène, elle protège les dents contre les frottements en formant un film.
• Cystatines
Ce sont des inhibiteurs des « cystéines endo/exoprotéases ». Elles sont produites par les glandes sous-mandibulaires et sublinguales. Elles participent à la pellicule acquise exogène et elles s’occupent de la transformation cristalline des phosphates de calcium dans le milieu buccal(3).
Pour résumer, l’agglutinine salivaire et les SIgA (Secretory Immunoglobulin A) se lient aux bactéries et empêchent leur fixation à la muqueuse buccale. La modulation bactérienne implique la mucine 5B (MUC5B), la plus grande molécule dans la salive. MUC5B est un peptide fortement glycosylé avec un ensemble extrêmement hétérogène d'oligosaccharides. C’est la principale source d'hydrates de carbone pour les micro-organismes lorsque l'apport externe est absent. L’inhibition de la croissance bactérienne est donc contrôlée par des composants antimicrobiens salivaires, tels que le lysozyme, les histatines, les β-défensines et la cathélicidine humaine LL37. Ces composants antimicrobiens exercent leur fonction antibactérienne en affectant l'intégrité de la paroi
cellulaire, directement en formant des pores et indirectement par la signalisation immunitaire. Considérant que la salive joue un rôle dans l'homéostase du microbiome oral, il n'est pas surprenant que l'hyposalivation puisse perturber cette équilibre(6).
1.3) La pellicule exogène acquise
La pellicule exogène acquise est un élément important car il constitue l‘interface entre la surface de l’émail et la première couche du biofilm oral. Il est prouvé que cette structure est formée par l’adsorption sélective de protéines, de peptides et d’autres molécules de la salive.
C’est un film protéique fin. Il se forme spontanément sur les surfaces dentaires par adsorption sélective de protéines d’origine salivaire. On y trouve également d’autres composants tels que des glycoprotéines, des phosphoprotéines comme les immunoglobulines A (IgA), les immunoglobulines G (IgG), le lysosyme, l’albumine, l’alpha-amylase, la glycosyl-transferase, les mucines de haut poids moléculaire MG1 et les cystatines, l’anhydrase carbonique, les PRPs, la stathérine, et l’acide sialique. On a aussi identifié des sucres : galactose, mannose, glucose. On a découvert la calgranuline B et des cytokératines. La calgranuline B est une protéine qui capte le calcium et elle peut se lier avec la calgranuline A pour former un hétérocomplexe appelé complexe L1 leucocytaire qui est présent en concentrations élevées dans le sang lors de maladies inflammatoires, telles que la polyarthrite rhumatoïde. Ce complexe possède une activité antimicrobienne (7). La composition de la pellicule acquise exogène diffère selon le milieu, celle trouvée dans le sillon gingivo-dentaire est différente que celle trouvée sur l’émail car elle comprend en plus des constituants provenant du fluide gingival comme notamment les phospholipides.
Elle sert de lubrifiant qui va donc protéger les surfaces contre l’usure. De plus, elle joue un rôle dans l’homéostasie minérale de l’émail dentaire en formant une barrière et un tampon contre les agents de déminéralisation et en constituant un réservoir en électrolytes de reminéralisation. Elle permet la fixation de bactéries pour former un biofilm. En effet, les bactéries possèdent des adhésines chargées positivement qui vont se fixer aux lectines chargées négativement de la pellicule(8).
1.4) Cellules de l’immunité innée
L’immunité innée est la première ligne de défense vis-à-vis des agents infectieux et pathogènes qui nous entourent. La réponse immunitaire innée est induite par un signal de danger émis suite à l’interaction spécifique entre récepteurs du soi appelés PRR Pattern Recognition Receptors et des molécules du non-soi appelées PAMP (Pathogen Associated Molecular-Pattern). Les PRR sont exprimés par les cellules NK, les macrophages, les cellules dendritiques, les polynucléaires, les mastocytes et les cellules épithéliales. Toutes ces cellules participent à la réponse immunitaire innée.
Il y a plusieurs cellules de l’immunité dans la cavité buccale : • Les polynucléaires
Ces types cellulaires sont tous représentés au niveau du parodonte, mais les polynucléaires neutrophiles sont les seuls constamment présents dans les tissus parodontaux, le fluide gingival et la salive de sujets indemnes de parodontites. Les polynucléaires neutrophiles représentent 95 à 97% des polynucléaires du fluide gingival. On attribue généralement trois capacités principales à ces cellules : la migration en
présence de facteurs chimiotactiques, l'adhérence non-spécifique à l'antigène lié et la phagocytose. Les neutrophiles produisent aussi des cytokines. Le chimiotactisme des neutrophiles dépend en grande partie de l'interleukine-8 (IL-8) produite par les neutrophiles eux-mêmes, les mononucléaires, les cellules endothéliales, les fibroblastes et plus, généralement les cellules synoviales, les chondrocytes, divers types de cellules épithéliales et diverses cellules tumorales. Mais d'autres substances sont chimiotactiques envers les neutrophiles comme :
• les composants du complément C3b et C5a
• les produits d'autres cellules, comme les métabolites de l'acide arachidonique, les interleukines-1a et b
• les produits bactériens
• les produits de dégradation de la fibrine • le PAF (platelet activating factor)
• la substance P
Les polynucléaires neutrophiles adhèrent à l'antigène opsonisé par le C3b.
Ils ont aussi le pouvoir de phagocytose : l’antigène est ingéré par déclenchement d'un mécanisme local qui provoque l'englobement par des pseudopodes membranaires, et il est inclus dans un phagosome. Après l’accolement du phagosome avec le lysosome, formant ainsi un phagolysosome, a lieu la phagocytose proprement dite.
• Les basophiles et les mastocytes
Plus ou moins confondues fonctionnellement, ces cellules contiennent des granules d'héparine, de tryptase, de ß-glucosamidase, d'ECF-A (endothelial cell factor) et de NCF-A (neutrophil cell factor)(9).
• les monocytes/macrophages
Les monocytes sont présents dans les vaisseaux parodontaux. Ces cellules sont très mobiles et se portent par chimiotactisme sur les sites enflammés. Leur facteur chimiotactique spécifique est la MCP-1 (Monocyte Chemoattractant Protein 1).
Les macrophages sont la forme tissulaire des monocytes circulants, mais l'expression des récepteurs membranaires est différente. Ils sont essentiellement présents dans les tissus parodontaux et le fluide gingival (10 à 20% du total des cellules immunitaires). Après différenciation, ces cellules ont pour rôle majeur d'éliminer les antigènes particulaires et les micro-organismes.
Par ailleurs, les monocytes/macrophages fabriquent des cytokines impliquées dans l'activation des cellules de l'immunité spécifique, particulièrement les lymphocytes T(9):
• Interleukines-1 (IL-1), -3 (IL-3) et -6 (IL-6) • Tumor necrosis factor a (TNFa) et b (TNFb)
• Granulocyte macrophage colony stimulating factor (GM-CSF) • Granulocyte colony stimulating factor (G-CSF)
• Macrophage colony stimulating factor (M-CSF) • Les cellules de Langerhans
Ces cellules claires, dotées de prolongements dendritiques irréguliers, présentent l'antigène aux lymphocytes T. Dans la cavité buccale saine, on en trouve 20 par mm2 dans la gencive. Elles font partie des cellules présentatrices des antigènes (CPA). Les CPA digèrent l'antigène afin de bien le présenter aux cellules effectrices de l'immunité cellulaire ou humorale(9).
• Le complément
Il représente un ensemble de 11 protéines plasmatiques nomenclaturées C1q, r, s, C4, C2, C3, C5, C6, C7, C8 et C9. On attribue au complément trois activités biologiques majeures :
• l'activation des phagocytes (neutrophiles et macrophages) • la cytolyse des cellules-cibles
• l'opsonisation des micro-organismes et des complexes immuns pour les cellules possédant des récepteurs pour les composants du complément.
Le complément, une fois activé, joue un rôle important dans l’induction de lésions tissulaires. En effet, la formation des C3 et C5 convertases induit la libération des anaphylatoxines C3a et C5a qui possèdent d’importantes capacités chimiotactiques sur les cellules inflammatoires dont les polynucléaires neutrophiles, les monocytes et macrophages ainsi que les lymphocytes T et B activés. Via leurs récepteurs, C3aR et les C5aR (CD88 et C5L2), ces petites protéines peuvent activer les cellules endothéliales et les plaquettes mais aussi induire la sécrétion de cytokines et de chimiokines à activité pro-inflammatoire. De plus, C3b, par l'intermédiaire des récepteurs CR1,CR3 et CR4 peut activer les leucocytes. Enfin, C5b9, y compris des complexes sublytiques C5b7 et C5b8 formés à la surface des cellules cibles, induisent l’hydrolyse des phospholipides membranaires et l’activation des protéines G. Ces complexes sont ainsi capables de transmettre un signal et de stimuler différentes fonctions cellulaires comme la synthèse de cytokines ou l’activation de proto-oncogènes intervenant dans le cycle cellulaire. L’ensemble de ces phénomènes sont démontrés dans de nombreuses situations pathologiques notamment les maladies auto-immunes. Son activation est à l'origine de dommages tissulaires, due en particulier à son effet chimiotactique sur les neutrophiles, à son rôle de médiateur de la lyse cellulaire, et à son intervention dans le processus de dégranulation des mastocytes(9).
• les interférons (IFN)
Ils sont produits par divers types de cellules, dont les lymphocytes T "helper" et NK, ils constituent un groupe de protéines immunomodulatrices (IFN α, β et γ)(9).
2) L’immunité adaptative
Elle dépend surtout des lymphocytes. Les lymphocytes représentent 20% des leucocytes circulants chez l'adulte. De nombreux lymphocytes matures peuvent survivre plusieurs années et ont un rôle de cellules à mémoire.
On connaît deux types principaux de lymphocytes : les T et les B; leurs fonctions sont distinctes, mais ils sont tous deux capables de reconnaître l'antigène. Leurs précurseurs apparaissent dans la moëlle osseuse. La différenciation des lymphocytes T s'opère dans le thymus alors que celle des lymphocytes B se fait dans le foie du foetus et la moëlle osseuse chez l’adulte. Dans ces organes, les précurseurs des lymphocytes matures acquièrent la capacité de reconnaître l'antigène grâce à l'apparition de récepteurs de surface.
Les lymphocytes T sont divisés en plusieurs sous-populations :
• Les lymphocytes T cytotoxiques (TCD8) détruisent les cellules infectées. Ces cellules sont dites cytotoxiques car elles sont à elles-mêmes capables de détruire des cellules
cibles qui présentent des antigènes spécifiques à travers le CMH de classe I. Elles portent à leur surface un marqueur CD8.
• Les lymphocytes T auxiliaires (TCD4 ou T helper) sont des intermédiaires de la réponse immunitaire et prolifèrent pour activer en quantité d'autres types de cellules qui agiront de manière plus directe sur la réponse. Les T auxiliaires régulent ou 'aident' à la réalisation d'autres fonctions lymphocytaires. Elles portent à leur surface un marqueur CD4. Ils sont présents en plus grande quantité dans la cavité buccale que les autres types de lymphocytes donc on les verra plus en détail ultérieurement.
• Les lymphocytes T régulateurs (Treg) aident à prévenir l'activation des lymphocytes auto-immuns qui détruisent les cellules de leur propre organisme. Ils sont très importants pour le maintien de l'homéostasie. Le rôle principal est de réprimer l’activité des cellules de l’immunité, soit auto-immune, soit en fin de réaction immunitaire. Ils se distinguent facilement des autres lymphocytes T : ils portent à leur surface les marqueurs CD4 et CD25 à leur état basal, et expriment la molécule FOXP3 dans leur cytosol. La fonction de FOXP3 est de supprimer la fonction de NFAT et NFkappaB et cela conduit à la suppression de l'expression de nombreux gènes, y compris IL-2 et les cytokines induites par les lymphocytes T. FOXP3 est également un activateur de transcription pour de nombreux gènes incluant le gène cytotoxique T-Lymphocyte Antigen 4 (CTLA4) et le gène glucocorticoïde TNF receptor (GITR). Ces gènes sont importants dans la régulation de la réponse immune. En effet, le gène CTLA4 agit comme un inhibiteur(10). Le GITR, quant à lui, agit comme un co-stimulateur en améliorant les fonctions effectrices et régulatrices.
Les cellules T FOXP3+ sont fabriquées dans le thymus et la périphérie. Les cellules T FOXP3+ fabriquées dans le thymus migrent vers les tissus lymphoïdes secondaires et suppriment l'amorçage antigénique des lymphocytes. L'amorçage de l'antigène des lymphocytes T FOXP3 naïfs et des cellules T FOXP3 naïves conduit à la génération de cellules T FOXP3+ de mémoire qui sont efficaces dans la migration vers les tissus non lymphoïdes. La mémoire des cellules T FOXP3+ sont donc efficaces dans la suppression de la fonction des cellules T effectrices, alors que les cellules T FOXP3 naïves sont capables de supprimer les réponses immunitaires précoces dans les tissus lymphoïdes. Les cellules T FOXP3 naïves et de mémoire sont nécessaires pour le maintien efficace de la tolérance et la prévention des maladies auto-immunes dans tout le corps.
Les lymphocytes B synthétisent les immunoglobulines (ou anticorps), protéines membranaires qui jouent le rôle de récepteurs spécifiques pour l'antigène. Quand ils sont activés, les lymphocytes B se différencient en plasmocytes; très rarement présents dans la circulation, ces derniers se localisent essentiellement dans les divers tissus et les organes lymphoïdes. Les plasmocytes produisent des anticorps : ce sont des glycoprotéines de la famille des immunoglobulines qui ont pour rôle de neutraliser un antigène spécifique. Un nombre réduit de plasmocytes est trouvé aux stades initial et précoce des parodontites, qui correspondent à une gingivite modérée mais dans les lésions établies, comme une gingivite chronique, la majeure partie de l'infiltrat est constitué de plasmocytes. Au stade avancé, correspondant aux parodontites chroniques, l'infiltrat cellulaire est constitué essentiellement de lymphocytes, macrophages, neutrophiles et plasmocytes; ceux-ci se localisent toujours dans les couches profondes du conjonctif gingival, sous les neutrophiles.
3) La réaction immunitaire due à la présence d’un antigène dans la cavité buccale
Par sa situation anatomique, la cavité buccale fait partie à la fois des systèmes digestif et respiratoire. Le système muqueux se caractérise par l’existence de sites inducteurs et producteurs distincts. Ainsi, les coopérations cellulaires nécessaires à la stimulation des lymphocytes B et à leur commutation isotypique vers les IgA, se déroulent dans les organes lymphoïdes associés aux muqueuses (amygdales, plaques de Peyer) alors que la différenciation plasmocytaire et la sécrétion des IgA ont lieu à proximité des sites de sécrétion notamment les glandes salivaires pour la cavité buccale). La commutation isotopique est un processus qui, lors de la maturation d'un lymphocyte B, permet de changer l'isotype (classe) des immunoglobulines produites.
Cette organisation fonctionnelle implique l’existence d’un système d’adressage (homing) des cellules stimulées dans les sites inducteurs vers les sites de production.
Les antigènes peptidiques, pour être reconnus par les lymphocytes T, doivent au préalable être rendus accessibles à un récepteur pour l’antigène présent à la surface du lymphocyte T (TCR).
Cette fonction de présentation de l’antigène est assurée par les molécules du Complexe Majeur d’Histocompatibilité (CMH). Les gènes HLA classiques codent pour les molécules qui assurent la fonction de présentation de l’antigène et l’histocompatibilité. Ils sont localisés sur le bras court du chromosome 6. Le complexe est subdivisé en 3 régions qui contiennent chacune de nombreux autres gènes avec ou sans fonction immunologique. La région CMH de classe I comprend 3 gènes HLA de classe I dits "classiques", HLA-A, HLA-B, HLA-C.
La région CMH de classe II comprend 3 paires de gènes HLA de classe II dits "classiques", HLA-DP (gènes DPA et DPB), HLA-DQ (DQA et DQB) et HLA-DR (DRA et DRB1).
Les lymphocytes T caractérisés par l’expression des molécules CD8 sont susceptibles de répondre aux antigènes présentés par les molécules CMH de classe I. L'expression ubiquitaire de ces dernières permet aux mécanismes effecteurs de l’immunité dépendant des lymphocytes T CD8 de s’exercer vis-à-vis de la quasi-totalité des cellules nucléées. Les lymphocytes T qui expriment les molécules CD4 sont susceptibles de répondre aux antigènes présentés par les molécules CMH de classe II à la surface des cellules présentatrices d’antigènes (11).
Les cellules dendritiques (CDs) présentes dans la muqueuse buccale sont principalement des cellules de Langerhans et elles sont capables de capturer l'antigène, de migrer vers les ganglions lymphatiques et de présenter les antigènes aux lymphocytes T. Cependant, en raison de la nature non adsorbante de l'épithélium buccal et parce que les extensions de ces CDs ne font pas saillie dans la cavité buccale, la muqueuse doit d'abord être pénétrée ou endommagée pour que l’antigène puissent être capturé par les CDs. La muqueuse sublinguale est une exception, car l'antigène est facilement adsorbé et capturé par les CDs.
3.1) Transport de l’Ag
L’antigène sera transporté de la cavité buccale vers les organes lymphoïdes associés au MALT par voie transépithéliale. Le tissu lymphoïde associé aux muqueuses MALT est formé d’une part d’un tissu lymphoïde diffus dans le tissus conjonctif sous-épithélial et d’autre part de formations lymphoïdes organisées qui sont des sites d’induction de la réponse immunitaire vis à vis d’Ag pénétrant par la muqueuse à travers l’épithélium.
Le MALT inclut plusieurs structures anatomiques bien identifiables. Ainsi, au niveau de la sphère ORL, on retrouve l’anneau de Waldeyer (Figure 4) et au niveau du tube digestif, les plaques de Peyer et l’appendice constituent d'autres structures identifiables macroscopiquement. Apparentés aux plaques de Peyer, les nodules solitaires constituent des structures plus petites mais très nombreuses, réparties dans tout le tube digestif, avec une prédominance dans l'iléon.
Dans tous les autres territoires muqueux (digestifs, respiratoires, génito-urinaires), on observe par ailleurs un tissu lymphoïde diffus tapissant de façon plus ou moins dense, la lamina propria sous-épithéliale.
Figure 4: L’anneau de Waldeyer (12)
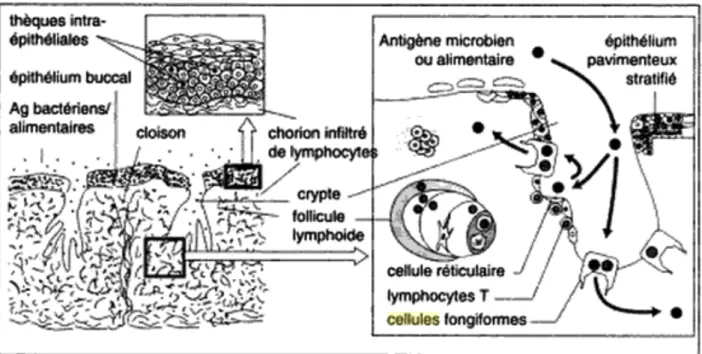
L’anneau de Waldeyer est un ensemble de formations lymphoïdes diffuses ou structurées entourant le carrefour aéro-digestif : amygdales linguales, pharyngées et palatines, végétations adénoïdes. Les Ag particulaires pénétrant dans les fosses nasales ou la cavité buccale sont retenus dans les cryptes des amygdales au fond desquelles se trouvent des cellules fongiformes assurant le passage de ces Ag dans le tissu conjonctif. Celui-ci est occupé par des formations lymphoïdes dont la structure rappelle celle des ganglions lymphatiques, mais qui ne possèdent pas de vaisseaux lymphatiques afférents.
Figure 5 : Structure des amygdales(15)
Les amygdales sont constituées de nombreux follicules (nodules) lymphoïdes enchassés dans le chorion.
Ce tissu lymphoïde occupe la majeure partie du chorion qui est alors peu visible. L’épithélium sus-jacent est souvent atrophique et dessine des cryptes plus ou moins profondes.
Dans les follicules lymphoïdes, la zone folliculaire est riche en lymphocytes B quant à la zone parafolliculaire est riche en lymphocytes T. Il y a la présence de cellules M (détaillé plus tard). Il existe un réseau de lymphocytes efférents analogue à celui de la plaque de Peyer (Figure 6) grâce à des vaisseaux folliculaires et interfolliculaires(9).
Le dôme de la plaque de Peyer est formé de lymphocytes T, lymphocytes B et de macrophages. La zone B correspond aux follicules. Cette zone est riche en lymphocytes B. La zone T est la zone interfolliculaire riche en lymphocytes T. Les lymphocytes T et B formés au sein des plaques de Peyer migrent vers les ganglions mésentériques et le canal thoracique puis par la circulation lymphatique et sanguine, viennent se localiser dans la paroi intestinale au niveau de la lamina propria, mais aussi dans d’autres territoires muqueux et glandulaires tels que les glandes lacrymales, salivaires et bronchiques(13). Les cellules M sont des cellules spécialisées, possédant des extensions cytoplasmiques qui entourent les lymphocytes et les macrophages. Elles ont un rôle de capture et transfert de macromolécules et des microorganismes. Elles présentent les pathogènes capturés aux cellules présentatrices d’antigènes (CPA). Le fait que la membrane basale soit discontinue favorise le contact entre les cellules M, les CPA, les lymphocytes et les macrophages. Les cellules M vont donc capturer les antigènes et les transférer vers les follicules lymphoïdes sous-jacents par un système d’endocytose, laissant intact l’antigène de toute transformation.
3.2) Stimulation des lymphocytes T et B
Arrivé dans les follicules lymphoïdes, l’antigène va stimuler la différenciation de lymphocytes T Th et lymphocytes B IgA+, on parle de stimulation antigénique. Les lymphocytes B vont reconnaitre l’antigène directement grâce à leur récepteur membranaire IgM ou IgD alors que les lymphocytes T ne peuvent reconnaitre l’antigène sans les cellules présentatrices d’antigènes comme les macrophages. Les lymphocytes T sont stimulés par les CPA, ils expriment le CD4 et un récepteur membranaire pour l’antigène (TCR) et vont se différencier en lymphocytes T helper qui sont indispensables pour la commutation des lymphocytes B en lymphoblastes IgA+. Il existe des sous types de lymphocytes T helpers : les Th1 qui expriment l’IL-2 et l’interféron IFNy et les Th2 qui expriment les IL-4, IL-5, IL-6, Il-10 et IL-13. Les cellules Treg sécrètent le TGFβ (Transforming Growth Factor β).
Pour que les lymphocytes B se différencient en lymphoblastes IgA, il faut que le lymphocyte B soit stimulé par les lymphocytes helper exprimant le CD40L et CD154, mais le TGFℬ secrété par les lymphocytes Treg est aussi nécessaire à la commutation en lymphocytes B IgA+. Ensuite, ils vont proliférer sous l’expression de IL-2 par les lymphocytes T Th1 (Figure 7).
Les lymphocytes B sont stimulés par la reconnaissance de l’antigène, les interactions membranaires directes avec un lymphocyte Th et les cytokines. Les interactions Th/B sont spécifiques (TCR+CD4/CMH II-Ag) et non spécifiques (CD154/CD40) de l’antigène. L’environnement en cytokines détermine l’isotype des Ig produites. Dans les plaques de Peyer, le TGFβ favorise la commutation vers IgA, IL-2 et l’IL5 induisent la prolifération des cellules commutées et leur transformation blastique. Après migration des cellules vers le site sécréteur, l’IL5, l’IL6 et l’IL10 produites localement assurent la différenciation plasmocytaire et la sécrétion de dimères d’IgA. L’IL2 est produite par des Th1, l’IL5, l’IL6 et l’IL10 sont produites par des Th2 et le terme de Th3 (= Treg) a été proposé pour désigner les lymphocytes sécrétant du TGF β(14).
3.3) Adressage des lymphoblastes stimulés vers la cavité buccale
Après cette étape de prolifération, les lymphocytes B IgA+ vont être adressés vers les glandes salivaires. Ils empruntent les vaisseaux lymphatiques, le canal thoracique, puis la circulation sanguine pour arriver dans les veinules à haut endothélium VHE.
Ces VHE captent les cellules de grâce à leurs propriétés d’adhésion et leur permettent de gagner la lamina propria. Les lymphocytes B activés quelques heures auparavant au contact de l'antigène terminent à ce niveau leur différenciation en plasmocytes et produisent des IgA spécifiques de cet antigène, effecteurs solubles du MALT. Les VHE vont interagir avec les lymphocytes par le biais de molécules membranaires qui vont adhérer aux lymphoblastes pour induire leur diapédèse. Parmi ces molécules, il y a LFA-1 Lymphocyte Fonction associated antigen-1 qui se lie à ICAM-1 et 2 sur l’endothélium. Le CD-44 exprimé par le lymphoblaste va se lier aux mucines à la surface de l’endothélium.
Arrivés dans le conjonctif périglandulaire, les lymphoblastes IgA+ vont se différencier en plasmocytes et sécréter des IgA. Cette différenciation de même que la sécrétion sont sous la dépendance d’IL-5, IL-10 et IL-6 exprimés par le lymphocytes Th2. Ces lymphoblastes IgA+ vont se différencier en plasmocytes qui sécrètent des IgA polymérisées dimèriques pour la majorité qui passent du tissus conjonctif vers la salive par l’intermédiaire des cellules acineuses (seulement celles qui expriment un récepteur spécifique pour les Ig polymérisées), on parle de trancytose(14).
3.4) IgA
On retrouve différentes immunoglobulines dans la cavité buccale(15): • IgA sécrétoire (IgAs) : immunoglobuline de la salive
• IgG : d'origine sérique, elles sont présentes dans le fluide gingival (la concentration de ce groupe d'immunoglobulines dans le fluide est corrélée à l'importance de l'inflammation).
Les IgAs représentent le composant humoral majeur et caractéristique du MALT. Ce sont les plus polymorphes des immunoglobulines, et les plus glycosylées. Leur production est le résultat d'une commutation de classe préférentielle pour les IgA orientée au niveau des centres germinatifs des muqueuses par le TGF-β.
La production quotidienne d'IgA est de 3 à 4 grammes, et cette quantité double par la production de la glande mammaire chez une femme allaitante. Les IgA sont retrouvés dans les sécrétions exocrines au niveau bronchique, digestifs notamment dans la salive, génito-urinaire, dans les larmes et le colostrum.
Les IgA sécrétoires présentent la particularité de résulter de la combinaison d’IgA dimériques (2 molécules d’IgA et une pièce de jonction ou pièce J) synthétisées par les plasmocytes de la lamina propria des muqueuses et de la pièce secrétoire (encore appelée poly Ig recepteur) élaborée dans les cellules épithéliales. Leur association se fait lors d’un phénomène de transcytose dirigée permettant aux IgA dimériques captées par la pièce secrétoire au niveau basolatéral des cellules épithéliales, d'être internalisées et libérées au pôle apical sous forme d’IgA secrétoires complètes.
La compréhension de ce phénomène a permis de mieux préciser les rôles des IgA sécrétoires. En tapissant la surface des muqueuses, elles peuvent capter les antigènes et empêcher leur entrée dans le tissu sous-jacent. Leur grande taille et leurs quatre fragments Fab leur permettent de constituer de volumineux complexes immuns qui complètent ce rôle d'élimination. La taille de ces complexes leur permet également d'être captés par les cellules M, augmentant le contact du système immunitaire avec l'antigène. Les IgA, pendant leur passage dans la cellule épithéliale, sont capables de reconnaître des virus et de favoriser leur élimination lors de leur sortie apicale dans la lumière de la muqueuse. Enfin, si elles ont reconnu dans la lamina propria un antigène ayant réussi à traverser la barrière épithéliale, elles peuvent effectuer leur transcytose sous forme d'un complexe immun, permettant là encore l'exclusion de l’antigène.
On distingue deux types d’IgA (9):
-
IgA sériques (monomère / 90 % IgA1 et 10% IgA2, 3 domaines CH)-
IgA sécrétoires dimériques (Figure 8) : 2 IgA, chaine J , composante secrétoire (CS, associée au dimère lors de ma transcytose dirigée par les cellules épithéliales) produites dans les cellules acineuses et canalaires des glandes salivaires. Figure 8: IgA sécrétoires dimériques (9)L’IgA trouvée dans les sécrétions est associée à une autre molécule : la pièce sécrétoire ou chaîne T. Contrairement au reste des IgA qui sont produites dans les plasmocytes, la pièce sécrétoire est produite dans les cellules épithéliales et est ajoutée à l’IgA lorsque celle-ci passe dans les sécrétions. La pièce sécrétoire facilite le transport de l’IgA au travers de la muqueuse et protège également l’IgA de la dégradation dans les sécrétions. Les IgA génèrent un état physiologique de tolérance particulier de par son caractère non inflammatoire. On parle de tolérance orale, le système immunitaire maintient un état d’équilibre permettant de contrôler l’invasion par des pathogènes, tout en tolérant les Ag
alimentaires et ceux de la flore digestive commensale. Les IgA ont pour rôle de neutraliser les antigènes et leur empêcher de gagner l'immunité systémique. Les réponses cellulaires qui prennent place dans les plaques de Peyer et les nodules solitaires sont non seulement très orientées vers la production d'IgA mais également très fortement régulées par les lymphocytes régulateurs par le biais de synthèse de cytokines notamment le TGFβ.
C’est un système de protection périphérique non inflammatoire. Elle assure une protection des muqueuses grâce aux IgA sécrétoires. Les IgA participent à la régulation de l’environnement de la muqueuse en agissant sur les réponses des cellules épithéliales. De plus, ils participent à l’équilibre de la flore microbienne buccale car ils permettent de réduire l’adhésion des bactéries et ils favorisent leur élimination grâce au flux salivaire. Des chercheurs supposent l’existence d’auto-Ac sous forme d’IgAs polyréactives.
La notion de tolèrance est importante. En effet, la muqueuse buccale est également exposée à une très grande diversité de micro-organismes (≈700 espèces bactériennes différentes) et de peptides alimentaires. Malgré cette charge antigénique élevée, la muqueuse buccale reste dans un état de santé relatif en raison de la nature pro-tolérogène du système immunitaire muqueux et de ses mécanismes de défense antimicrobiens(16). Le microbiote y joue un rôle aussi, que l’on abordera dans la partie II.
II- Qu'est-ce que le microbiote ?
A- Généralités
1) Définition du microbiome
Le microbiome est l’ensemble des micro-organismes vivant à la surface et à l’intérieur du corps. Il constitue l’ensemble de cette flore. Le microbiote lui est restreint à la flore d’un organe. Les recherches actuelles donnent au microbiome une place importante dans la physiopathologie de l’organisme humain.
Chaque interface du corps avec l'extérieur possède un microbiote particulier. Les micro-organismes de chaque microbiote contribuent, lorsque leurs populations sont en déséquilibre, à de nombreuses familles de maladies (voir Figure 9)(17).
On peut lier le microbiote buccal au microbiote intestinal. En effet, une étude a postulé que le microbiote salivaire peut affecter dans une certaine mesure le développement du microbiote intestinal, puisque la salive s'écoule toujours dans le tractus gastro-intestinal, et que les bactéries salivaires ont de nombreuses occasions d'atteindre l’intestin(18).
On a découvert que des espèces buccales, dérivées d'échantillons de salive, étaient détectables dans l'intestin au niveau de l'ADN, bien qu'elles y montraient une activité transcriptionnelle minime(19).
Fait intéressant, il a été rapporté que chez les patients atteints de cirrhose du foie, la plupart des espèces retrouvées dans le microbiote intestinal sont d'origine orale, ce qui suggère que des espèces bactériennes buccales pourraient envahir l’intestin(20). D’autres
arguments scientifiques permettent de prouver le lien entre système digestif et système buccal(21).
Figure 9: Les divers microbiotes humains (17)
Ce dessin montre les différents microbiotes du corps humain et les pathologies qui peuvent découler du dérèglement de celui-ci.
2) La naissance du microbiote
L’acquisition de la flore s’effectue dès la naissance. En effet, la bouche du nourrisson est généralement stérile à la naissance, mais lors de l’accouchement, elle est en contact avec les organismes du canal génital de la mère. Quelques heures plus tard, les organismes de la bouche de la mère et ceux du personnel soignant, on parle de transmission verticale, et peut-être quelques-uns de l'environnement, s'établissent dans la bouche.Ces interactions précoces sont considérées comme fixant le tonus du système immunitaire muqueux et systémique à long terme. Le mécanisme par lequel les tissus néonataux s'adaptent au formidable défi de la colonisation microbienne reste incomplètement compris, mais on pense que les facteurs contenus dans le lait maternel définissent certaines de ces réponses précoces aux commensaux. En effet, le colostrum et le lait maternel contiennent des microbes vivants, des métabolites, des IgA, ainsi que les cytokines. Ces facteurs agissent de façon synergique pour façonner le microbiote du nourrisson allaité et la réponse de l'hôte à ces microbes. Par exemple, l'IgA maternelle limite l'activation immunitaire et l'attachement microbien en liant les antigènes nutritionnels et microbiens et la présence de métabolites incluant les oligosaccharides dans le lait maternel favorise l'expansion des constituants définis du microbiote tels que Bifidobacterium(22).
La translocation bactérienne de l'intestin de la souris est augmentée pendant la grossesse et l'allaitement, et des cellules dendritiques chargées de bactéries dans le lait contribuent à l'immunité néonatale en influençant la nature de la réponse immunitaire aux antigènes commensaux (23).
La principale voie de transmission se fait par la salive, bien que les organismes puissent également provenir de l'eau, de la nourriture et d'autres fluides nutritifs. Le microbiome oral se formera par une large gamme de bactéries Gram-positives et Gram-négatives, y compris les anaérobies obligatoires (qui métabolisent l'énergie de façon anaérobie et sont détruites par la concentration atmosphérique normale d'oxygène) et anaérobies facultatives (qui obtiennent de l'énergie de respiration aérobie si l'oxygène est présent, mais sont capables de passer à la fermentation ou à la respiration anaérobie en l'absence d'oxygène). Ces espèces pionnières sont généralement des streptocoques, qui se lient à l'épithélium de la muqueuse (par exemple, Streptococcus salivarius, Streptococcus mitis et Streptococcus oralis). Leur activité métabolique altère alors l'environnement oral pour faciliter la colonisation par d'autres genres et espèces bactériens, par exemple, S salivarius produit des polymères extracellulaires à partir du saccharose, auxquels d'autres bactéries telles que Actinomyces spp peuvent se fixer.
La flore buccale au premier anniversaire de l'enfant se compose généralement de streptocoques, de staphylocoques, de Neisseria, ainsi que de quelques anaérobies à Gram négatif tels que Veillonella spp. Les espèces Lactobacillus, Actinomyces, Prevotella et Fusobacterium sont moins fréquemment retrouvées.
Le changement évolutif suivant dans cette communauté se produit pendant et après l'éruption des dents, lorsque deux autres niches sont prévues pour la colonisation bactérienne: la surface des tissus durs non émaillés de l'émail et du cément, et la crevasse gingivale. Les bactéries à Gram positif telles que Streptococcus mutans, Streptococcus sanguinis, Actinomyces spp, Lactobacillus et Rothia colonisent sélectivement les surfaces de l'émail. À leur tour, les organismes Gram négatif, y compris Prevotella spp, Porphyromonas spp, Neisseria et Capnocytophaga, qui préfèrent les environnements anaérobies, colonisent les tissus gingivaux.
Les commensaux contribuent également au développement post-natal du système immunitaire qui, à son tour, contribue à leur confinement. Des études effectuées chez des animaux élevés en l'absence de microbes vivants dénommés sans germes, ont révélé que le microbiote joue un rôle essentiel dans le développement de la structure lymphoïde secondaire. Le système immunitaire néonatal et l'action des commensaux conduisent à l'établissement d'une relation hôte/commensal homéostatique durable. Ces premières rencontres entre le système immunitaire de l'hôte et le microbiote ont des implications profondes et à long terme pour la santé humaine. En effet, les observations épidémiologiques ont révélé que l'altération du microbiote chez les mères ou les nouveau-nés peut prédisposer à des maladies associées à des réponses immunitaires déréglées notamment de l’asthme(24).
B) Le microbiote buccal
1) Composition du microbiote buccal
De par sa situation anatomique et son rôle physiologique, le microbiote buccal est un des plus complexes dans le corps humain. Il joue un rôle important dans la manifestation des maladies buccales mais il communique avec les autres microbiotes notamment le microbiote digestif mais aussi avec le microbiote respiratoire du fait de la proximité entre ces différents systèmes.
Le microbiote buccal contient un ensemble de micro-organismes diversifiés. Une partie est commune aux différents microbiotes de l’organisme, par exemple le champignon Candida albicans présent dans le microbiote intestinal et le microbiote vaginal, la bactérie Helicobacter pylori que l’on retrouve également dans l’estomac ou la bactérie anaérobie Porphyromonas gingivalis que l’on trouve dans les poches parodontales et « qui migrent » ensuite dans l’organisme via le système vasculaire. Mais une autre partie de ces bactéries est tout à fait spécifique à la bouche. On va ainsi retrouver de nombreuses bactéries aérobies du fait de l’air que l’on respire, ainsi que des bactéries anaérobies qui se cachent dans des poches difficiles d’accès et seront donc sont plus difficiles à éliminer(25).
La cavité buccale abrite de multiples microniches anatomiques où des caractéristiques physico-chimiques, telles que le pH, l'oxygène, la température ou le potentiel redox, influencent la sédimentation des microorganismes, créant ainsi un microbiote complexe. Le microbiote diffère selon les différents tissus. En effet, la muqueuse buccale, les gencives et le palais dur ont un microbiote similaire, tandis que la salive, la langue, les amygdales et la gorge et la plaque supra et sous-gingivale ont chacune des communautés distinctives. Le microbiome oral peut être considéré comme un groupe de biofilms microbiens diversifiés(26).
Le biofilm microbien se définit comme une accumulation de micro-organismes, de différentes espèces, adhérant à une surface généralement en relation avec un environnement aqueux. Il se forme à partir des microorganismes contenus dans la salive et le fluide gingival. Des cellules microbiennes se développent au sein d’une matrice formée de bio-polymères, principalement des polyosides, excrétés par des micro-organismes à certains moments de leur cycle cellulaire. L’architecture de ce biofilm est complexe et l’organisation des différents micro-organismes ne se fait pas au hasard. Cela dépend notamment de leur nature et de leurs affinités variables de co-adhésion. De plus, il est important de noter que le biofilm est en interaction constante avec l’environnement et il peut donc varier en fonction de celui-ci mais aussi en fonction des conditions physico-chimiques externes et de l’activité des métabolismes microbiens(27).
Les bactéries du biofilm peuvent résister à la réponse immunitaire de l’hôte et sont beaucoup plus résistantes aux antibiotiques et aux désinfectants que les cellules bactériennes planctoniques.
Parmi ces bactéries, certaines s'installent très tôt (des streptocoques notamment : S. oralis, mitis, gordonii), d'autres ont un rôle prépondérant (F. nucleatum) car ils jouent le rôle de pont entre les bactéries colonisatrices du début de la formation du biofilm et celles qui adhèrent plus tardivement (A. actinomicetemcomitans, P. intermedia, P. gingivalis, Spirochètes…)(28).
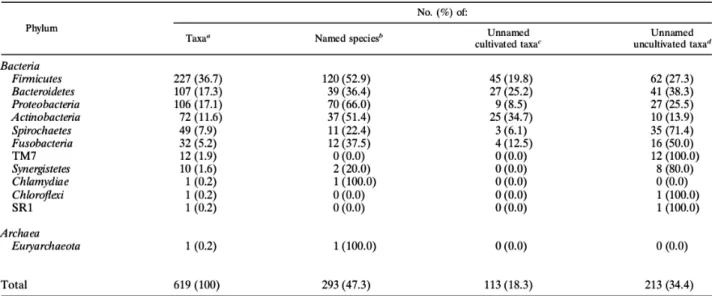
On considère actuellement que la cavité orale de l’adulte héberge 1000 espèces bactériennes différentes dont plus de la moitié n’ont pas encore été identifiées car elles ne sont pas cultivables.
La composition de l’écosystème est hétérogène et varie fortement en fonction de la niche buccale considérée (muqueuse, gencive, salive, dent, etc.), des apports nutritifs, de l’hygiène bucco-dentaire ainsi que de l’âge de l’individu. En effet, la flore buccale est dynamique et sa composition évolue au fur et à mesure que la biologie de la cavité buccale se modifie.
Parmi cette flore, on retrouve :
• Des champignons parmi eux, Candida albicans est le plus fréquemment retrouvé sans pourtant être porteur de maladie.
- Cladosporium, - Aspergillus, - Fusarium, - Glomus, - Alternaria, - Penicillium, - Cryptococcus...
• Des protozoaires, tels que Entamoeba gingivalis et Trichomonas tenax. Leur nombre augmente lors d’une mauvaise hygiène buccale mais les chercheurs n’ont pas mis en évidence de lien direct avec des maladies.
• Des archaea qui sont constitués d'une cellule unique qui ne comprend ni noyau ni organites, à l'instar des bactéries. Ils représentent une composante mineure mais leur prévalence et leur nombre sont élevés chez les sujets atteints de parodontite.
• Des bactéries
La communauté bactérienne de la bouche est dominée par le phyla Firmicutes, Bacteroidetes, Proteobacteria, Actinobacteria, Spirochètes et Fusobacteria qui représentent 96% des espèces détectées (Tableau 1).