REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET
POPULAIRE
MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA
RECHERCHE SCIENTIFIQUE
UNIVERSITE BATNA 1
INSTITUT DES SCIENCES VETERINAIRES
ET DES SCIENCES AGRONOMIQUES
MEMOIRE
Pour l’obtention du diplôme de
Filière
Sciences vétérinaires
Option
Histologie et histopathologie des animaux domestiques
Présenté par :
MEGAACHE Mounia
THEME
JURY
Grade et université
Président : MEZIANE Toufik
Prof - Université Batna 1
Rapporteur : ALLOUI Nadir
Prof - Université Batna 1
Examinateur: BENHAMZA-MANSAR Louiza
Prof-Université de Constantine1
Examinateur : BENNOUNE Omar
Prof - Université Batna 1
Examinateur : OUACHEM Derradji
Prof - Université Batna 1
Année universitaire : 2017/2018
MAGISTER
Effet d’un complexe phytogénique sur la structure
histologique de l’intestin grêle et des organes
I
Remerciements
Tout d’abord je tiens à remercier toute personne qui m’a aidé près ou de loin dans l’accomplissement de ce travail et à leurs tête mon directeur de mémoire Pr ALLOUI Nadir qui m’a fait l’honneur d’accepter la direction de ce travail et aussi pour son soutien et ses conseils pertinents et incontournables dans la correction et la réalisation de ce travail. Je tiens aussi à exprimer mes plus chaleureux remerciements et mon profond respect à l’égard du Pr BENNOUNE Omar qui m’aidé énormément dans la réalisation de ce mémoire. Aussi je tiens à remercier Dr BOUBEKEUR Fayçal, directeur technique de « Plantaxion » pour nous avoir le complexe phytogénique fourni (Volarom®)
Un remerciement particulier aux membres de jury, Pr MEZIANE Toufik accepter la présidence de notre jury de mémoire ainsi que Pr BENHAMZA-MANASAR Louiza, Pr BENNOUNE Omar et Pr OUACHEM Derradji qui m’ont honoré par leur présence et accepter d’être membres de jury et participer dans l’évaluation de ce mémoire.
A toute ma famille, mes parents, mon mari pour son soutien si précieux sans oublier mes frères et mes sœurs pour le support et le soutien moral tout au long de mes études. Je suis aussi dans l’obligation de remercier tous mes collègues au sein de notre laboratoire d’histologie et d’histopathologie.
II
Liste des abréviations
Françaises
%: pourcentage
°C: Degré Celsius
BF: bourse de Fabricius
CMV: Compléments minéraux et vitaminés
EEP: Extrait de Pépin de Pamplemousse. ET: écart type
F: follicule
g: gram
GI: gros intestin H : hétérophile
H/L: Rapport hétérophiles sur lymphocytes
H&E : coloration à l’hématoxyline et à l’éosine IG: intestin grêle
Kg: kilogram L leucocyte MMP: Mentha piperita MS: Métabolite Secondaire. ZnB: bacitracine de zinc μm: micromètre
Anglaises
AGP
: antibiotic growth promotor CD: crypt depthDBT: Dagguuibuxue Tang
FDA: food and drug administration GALT: gut associated lymphoid tissue IBD: Infectious Bursal Disesease MEO: oil essential of myrt NK: natural killer
III PBL: péréphéral blood lymphocyt
PBS: tampon phosphate salin (phosphate buffered saline) RBC: Red Blood Cells
RP : red pulp
SRBC: Sheep Red Blood Cell TLC: total leucocyt count VH: villi heigh
IV
TABLES DES ILLUSTRATIONS VII
LISTES DES ABREVIATIONS II
INTRODUCTION 1
CHAPITRE I : ETUDE BIBLIOGRAPHIQUE
1. Les phytogénique 4
1.1.Définition 4
1.1.1. Les huiles essentielles 5
1.1.2. Les herbes 5
1.1.3. Les extraits végétaux 6
1.1.4. Les épices 7
1.2.Classification des phytogéniques 7
1.3.Composition du complexe phytogénique 8
1.3.1. Le curcuma 8
1.3.2. Le thym 9
1.3.3. La feuille d’olive 9
1.3.4. Le romarin 10
1.3.5. Les pépins de pamplemousse 10
2. L’effet des phytogéniques sur l’appareil digestif 11
2.1.L’appareil digestif 11
2.1.1. L’intestin grêle 12
2.1.2. Les caecum 13
2.1.3. Organisation de la paroi gastrique 14
2.2.L’effet des phytogéniques sur l’intestin grêle 15
2.2.1. L’effet des phytogéniques sur la hauteur des villosités et la profondeur des cryptes
15
2.2.2. L’effet des phytogéniques sur les micro-organismes 17
3. L’effet des phytogéniques sur les organes lymphoïdes 19
3.1. Particularité du système immunitaire chez les volailles 19
3.1.1. La rate 21
3.1.2. Le thymus 20
V
3.2. L’effet des phytogéniques sur les paramètres immunologiques 22 3.2.1. L’effet des phytogéniques sur le poids des organes lymphoïdes 22 3.2.2. L’effet des phytogéniques sur les paramètres sanguins : taux
des hétérophiles et des lymphocytes
25
CHAPITRE II : MATERIEL ET METHODES
1. Animaux 30
2. Réception des poussins 30
3. Alimentation et abreuvement 31
4. Vaccination 32
5. Méthodes 32
a. L’échantillonnage 32
b. L’autopsie et le prélèvement des organes 33
c. La mesure 33
d. La préparation et la mise en cassette des prélèvements 34
e. La circulation 34
La déshydratation 34
La clarification 35
L’inclusion et la mise en bloc 35
f. La confection des coupes 35
g. Le montage des coupes sur les lames 35
h. La coloration 35
i. Le montage 36
j. La prise des photos 36
k. La mesure par le logiciel Image j 36
CHAPITRE III : RESULTATS ET DISCUSSION
1. L’effet du complexe phytogénique sur la mortalité des poulets 38 2. L’effet du complexe phytogénique sur le poids vif du poulet et les organes
immunitaires
38
3. L’effet du complexe phytogénique sur l’histologie des organes chez le poulet
40
VI
3.2.L’effet du complexe phytogénique sur les organes lymphoïdes 49
CONCLUSION 55
REFERENCES 56
VII
TABLE DES ILLUSTRATIONS
1. Liste des figures
Figure 1 : l’appareil digestif.
Figure 2 : Duodénum (oiseau). HE. ×62.5.
Figure 3 : Caecum (oiseau). HE. x 12.
Figure 4 : les organes lymphoïdes périphériques.
Figure 5 : Structure histologique de thymus. x 12,5.
Figure 6 : Structure histologique de la BF. x 12,5.
Figure 7 : Structure histologique de la rate. x 25.
Figure 8 : Réception des poussins.
Figure 9 : Installation et élevage des poussins.
Figure 10 : Une représentation des mesures histologiques prises à partir du tube digestif des poulets de chair. A : hauteur de villosité ; B : profondeur des cryptes.
Figure 11 : Automate pour la post-fixation.
Figure 12 : poids des organes(g).
Figure 13 : la hauteur des villosités(μm) et la profondeur des cryptes (μm) de l’intestin
grêle et caecum obtenus à partir de poulets de chair abattus à 42 jours, nourris avec un régime contrôle non supplémenté(T) et autre supplémenté par un complexe phytogénique (CP).
Figure 14 : Structure histologique de duodénum des poulets de chair à 42 jours nourris avec différents traitements expérimentaux. DT : duodénum témoin, DCP : duodénum du complexe phytogénique, V : villosité et Cr : crypte de lieberkühn. (H&E à 10X).
Figure 15 : Structure histologique de jéjunum des poulets de chair à 42 jours nourris avec différents traitements expérimentaux. JT : jéjunum témoin, JCP : jéjunum du complexe phytogénique, V : villosité et Cr : crypte de lieberkühn. (H&E à 10X).
Figure 16 : Structure histologique de l’iléon des poulets de chair à 42 jours nourris avec différents traitements expérimentaux. IT : iléon témoin, ICP : iléon du complexe phytogénique, V : villosité et Cr : crypte de lieberkühn. (H&E à
VIII 10X).
Figure 17 : Structure histologique de caecum des poulets de chair à 42 jours nourris avec différents traitements expérimentaux. CT : caecum témoin, CCP : caecum du complexe phytogénique, V : villosité et Cr : crypte de lieberkühn. (H&E à 10X).
Figure 18 : le périmètre (P)et la longueur (L) (μm) des follicules de la bourse de Fabricius obtenus à partir de poulets de chair abattus à 42 jours, nourris avec un régime contrôle non supplémenté(T) et autre supplémenté par un complexe phytogénique (CP).
Figure 19 : Coupe transversale de BF affectée par les traitements diététiques. (BT) bourse témoin, (BCP) bourse du complexe phytogénique. F : follicule, LF : longueur de F et PF : périmètre de F. (H&E à 10X).
Figure 20 : Coupe transversale de rate s affectée par les traitements diététiques. (RT) rate témoin, (RCP) rate du complexe phytogénique. PR :la pulpe rouge, PB : la pulpe blanche et VS : vaisseau sanguin. (H&E à 10X).
2. Liste des tableaux
Tableau 1 : Métabolites secondaires des plantes.
Tableau 2 : compositions des rations alimentaires pour les poulets .
Tableau 3 : programme de prophylaxie médicale pour les poulets de chair. Tableau 4 : Nombres de sujets morts.
Tableau 5 : Poids (moyenne (g)) ± écart type (SD) des organes obtenus à partir de
poulets de chair abattus à l’âge de 42jours, nourris avec un régime contrôle non supplémenté (T) et autre supplémenté par un complexe phytogénique (CP).
Tableau 6 : Morphologie de l'intestin grêle moyenne (μm) ± Résultats de l'écart-type
(ET) obtenus à partir de poulets de chair abattus à 42 jours, nourris avec une alimentation de base (témoin) etCP.
Tableau 7 : Morphologie des F de la BF (μm) ± Résultats de l'écart-type (ET) obtenus à
partir de poulets de chair abattus à 42 jours, nourris avec un régime contrôle non supplémenté (T) et autre supplémenté par un complexe phytogénique (CP).
1
Introduction
Les additifs alimentaires sont des produits utilisés en nutrition animale pour améliorer la qualité des aliments, ou pour augmenter les performances et la santé des animaux (Hashemi et Davoodi, 2011). L'utilisation précoce des antibiotiques dans les régimes alimentaires découle de la découverte à la fin des années 1940, aux États-Unis. Il est important de distinguer les antibiotiques utilisés dans le traitement et la prévention des maladies chez les animaux d'élevage (utilisation thérapeutique et prophylactique prescrite), ce qui diffère de leur utilisation comme additifs alimentaires pour améliorer la croissance (Castanon, 2007).
L'utilisation d'antibiotiques comme facteurs de croissance dans la production animale est devenue pratiquement mondiale. En raison des faibles concentrations auxquelles les antibiotiques sont ajoutés à l'alimentation, les agents pathogènes sont capables de développer une résistance à l'antibiotique et de survivre. Cela se traduit par le développement des populations pathogènes résistants aux antibiotiques, et donc des maladies incurables. On s'inquiète également de la présence de résidus d'antibiotiques dans les produits animaux destinés à la consommation humaine, ce qui suscite l'inquiétude du public sur à la sécurité des œufs et des produits carnés achetés. Le souci de la sécurité des antibiotiques dans l'alimentation, en tant que promoteurs de croissance a conduit au début du XXème à l'interdiction des antibiotiques comme facteurs de croissance en alimentation des animaux de production en 1986 en Suède. En 1998, tous les antibiotiques facteurs de croissance sauf quatre étaient interdits dans les États membres européens. Les quatre autres antibiotiques, l'avilamycine, la bambermycine, le monensin et la salinomycine, ont ensuite été interdits en 2006 dans l'Union européenne (UE).
Cela a abouti à la recherche d'alternatives aux antibiotiques facteurs de croissance en alimentation, qui fourniront la même protection contre les micro-organismes entériques pathogènes et non pathogènes, ainsi que d'améliorer la performance des animaux. Une recherche intensive de substituts tels que probiotiques, prébiotiques, symbiotiques, enzymes, liants de toxines, acides organiques, minéraux organiques, oligosaccharides et autres additifs alimentaires a eu lieu au cours de la dernière décennie (Fulton et al., 2002). Parmi les candidats potentiels, les phytogéniques représentent un nouveau groupe et passionnant d'additifs alimentaires, provenant principalement d'herbes, d'épices ou d'autres plantes. Ceci
2
est dû au fait que les extraits de plantes et les huiles essentielles ont naturellement des propriétés antibactériennes, antimicrobiennes, anticoccidiennes et antioxydantes. Selon l’administration des aliments et des médicaments, les extraits des plantes ont été considérés comme des additifs alimentaires sûrs, en étant moins toxiques et en produisant des produits animaux sans résidus pour la consommation humaine.
Volarom® est un complexe phytogénique composé par le curcuma, le thym, les pépins de pamplemousse, les feuilles d’olives et le romarin. Il a été utilisé pour améliorer l'efficacité de l'utilisation des aliments, augmenter la résistance aux maladies et améliorer l'état général des animaux.
L'objectif de cette étude expérimentale est de distinguer l’effet du complexe phytogénique (Volarom®) en tant qu’alternatif aux antibiotiques facteur de croissance sur la morphohistologie de quelques organes du tube digestif et des organes immunitaires des poulets de chair élevés dans des conditions ambiantes optimales.
3
4
ETUDE BIBLIOGRAPHIQUE
1. Les phytogéniques 1.1. Définition
Les phytogéniques ou phytobiotiques sont des produits dérivés des plantes (Windischt
et Kroismayr, 2006) ajoutés aux aliments pour améliorer la performance du bétail agricole (Vidanarachchi et al., 2005). Tous les végétaux produisent des composés chimiques dans le cadre de leurs activités métaboliques normales. Ceux-ci sont divisés en métabolites primaires, tels que les sucres et les graisses, présents dans toutes les plantes et les métabolites secondaires ou phytochimiques (Hashemi et Davoodi, 2011).
Généralement, les métabolites secondaires permettent aux plantes d'interagir avec l'environnement et peuvent agir dans un système de défense contre le stress physiologique et environnemental ainsi que des prédateurs ou des agents pathogènes (Wenk, 2003). Ces métabolites secondaires sont évalués comme des alternatives aux antibiotiques d'alimentation, car ils ont été démontrés avoir des effets bénéficiaires sur le métabolisme des animaux, ainsi que les produits alimentaires produits par ces animaux de production (Wenk, 2003).
Les produits phytochimiques sont constitués d'une vaste gamme de substances, qui peuventêtre divisées en quatre groupes :
Les herbes, qui proviennent d'une plante non floraison boisée.
Les plantes botaniques, qui sont constituées d'une partie de la plante, par ex. racines, feuilles et écorce.
Les huiles essentielles, qui sont les composés végétaux volatils.
Les oléorésines, qui sont les extraits végétaux à base de solvants non aqueux (Windisch et al., 2008).
Les phytogéniques ont une activité antimicrobienne (Cowan, 1999), Ils ont la capacité de manipuler les micro-organismes intestinaux (Hashemi et Davoodi, 2011), d’améliorer la propriété immunitaire (Guo et al., 2004). Aussi ils ont une activité coccidiostatique (Allen et al., 1997; Youn et Noh, 2001).
Les phytochimiques peuvent agir en tant qu'antioxydants (Lopez-Bote et al., 1998; Botsoglou et al., 2002) et hypocholesterolémique (Craig, 1999). Aussi ils peuvent augmenter
5
la production d'enzymes digestives et donc améliorer l'utilisation des produits digestifs par l'augmentation de la fonction hépatique (Hernández et al., 2004).
1.1.1. Les huiles essentielles
Les huiles essentielles dérivées de plantes sont considérées comme une alternative aux antibiotiques, mais leurs effets in vivo et in vitro ne correspondent pas toujours aux objectifs visés. Cela pourrait être dû en grande partie à la teneur variable des huiles essentielles , qui se composent de divers substances aromatiques et volatiles (Jang et al., 2004). Il a été constaté que la qualité et la quantité des produits chimiques actifs dans les huiles essentielles varient, et a donc un effet sur la réponse physiologiques de l'animal (Cross et al., 2007). L’âge de la plante à la récolte, la zone géographique de la plante, la composition du sol dans laquelle l'herbe a été plantée et la partie de la plante utilisée pour extraire le produit ont tous un effet sur l'efficacité du supplément sur la réponse de l’animal (Windisch et al., 2006).
Les huiles essentielles sont obtenues à partir de plantes aromatiques soit par distillation hydro ou par extraction au solvant (Bendahou et al., 2008). La méthode d'obtention des huiles essentielles des plantes aromatiques joue également un rôle dans la concentration des ingrédients actifs et la qualité du produit (Bendahou et al., 2008).
D'après des recherches effectuées in vivo avec des huiles essentielles, il existe des études montrant un effet positif des huiles essentielles sur la performance de croissance chez les poulets de chair (Alçiçek et al., 2003; Cross et al., 2007), et d'autres études montrent l'absence d'effet des huiles essentielles sur la croissance du poulet de chair (Botsoglou et al., 2002; Lee et al., 2003; botsoglou et al., 2004; Hernández et al., 2004; Jang et al., 2007).
1.1.2 Les herbes
Les huiles essentielles d'origan et les feuilles d'herbes d'origan séchées sont ajoutées à l'alimentation des poulets de chair, La supplémentation des feuilles d'origan et de son huile essentielle aux aliments des poulets a entraîné une diminution de l'apport en aliments par rapport au témoin, et la supplémentation en huile essentielle d'origan a entraîné une augmentation de l'efficacité alimentaire (Halle et al., 2004). Il a été rapporté que l'huile essentielle avait un effet plus prononcé sur la production des animaux que les feuilles d'herbes séchées d'origan (Halle et al., 2004).
6
1.1.3 Les extraits végétaux
Les effets bénéfiques des herbes et de certaines plantes médicinales résultent par les métabolites secondaires que la plante produit au cours de ses stades de vie. Les métabolites végétaux secondaires comprennent les terpénoïdes (mono- et sesquiterpènes, stéroïdes, etc.), les huiles essentielles, les phénoliques (tanins), les polyphénols, les glycosides et les alcaloïdes (présents comme alcools, aldéhydes, cétones, esters, éthers et lactones) (Huyghebaert et al., 2011). On pense que ces composants bio-actifs de la plante ont des activités synergiques (Hashemi et Davoodi, 2011).
Il existe de nombreuses variations de composition et de quantité des bio-actif dues à des facteurs biologiques (espèces végétales, lieu de culture et conditions de récolte), à la fabrication (extraction / distillation, stabilisation) et aux conditions de stockage (lumière, température, tension d'oxygène et temps) (Huyghebaert et al., 2011).
Il existe de nombreuses classifications de ces produits, qui varient selon le domaine d’application. Ils peuvent être regroupés en fonction de leur structure, de leur voie de synthèse, de leur activité biologique…
Ils peuvent être regroupés selon la présence d’azote dans leur composition. Parmi les familles de molécules contenant de l’azote on retrouve les alcaloïdes, les acides aminés non protéiques (analogues structurels des acides aminés protéiques), les amines, les glycosides cyanogéniques, les glucosinolates, les alkyl-amides, les lectines, peptides et polypeptides. Parmi les familles de molécules ne contenant pas d’azote on trouve les terpénoïdes (monoterpènes, sesquiterpènes, diterpènes, triterpènes, stéroïdes, saponines, tétraterpènes), les flavonoïdes, anthocyanes, catéchines, et tannins, les phénylpropanoïdes, lignines, coumarines et lignanes, les polyacétylènes, acides gras et cires, les polyketides, les glucides et acides simples (Wink, 2003).
Dans le cas des huiles essentielles, il existe des activités synergiques entre les huiles essentielles, elles ne sont jamais fournies comme une huile isolée mais plutôt comme un mélange d'huiles. Il existe également des rapports d'activités synergiques entre les huiles essentielles et les ingrédients des aliments auxquels ils sont mélangés (Zheng et Wang, 2001).
7
Il a été rapporté que les composés phénoliques des herbes et des épices sont largement responsables des propriétés antioxydantes et pharmaceutiques (Cai et al., 2004; Shen et al., 2009).
1.1.4 Les épices
Les épices ont des propriétés aromatiques et médicinales. Ils sont souvent ajoutés aux aliments pour en modifier le goût et ainsi le rendre plus appétissants.
Oregano ou Origanumvulgare L., comme on le sait scientifiquement, provient de la famille Labiatae et du genre Origanum, originaire d'Europe, de la Méditerranée et de l'Asie. Il s'agit d'une herbe culinaire, utilisée pour ajouter de la saveur aux aliments, qui est devenu populaire après la guerre mondiale, deux soldats rentrés à la maison en Italie avec l'herbe et ont ajouté à leurs pizzas, se référant à elle comme la «pizza herbe» (Bertelli et al., 2003).
Traditionnellement, l'origan a été utilisé dans la vieille médecine populaire comme un antimicrobien (Dorman et Deans, 2000), anticoccidien (Giannenas et al., 2003), antifungique (Pina-vaz et al., 2004) et enfin comme un antioxydant (Zheng et Wang, 2001).
1.2 Classification des phytogènes
Les métabolites secondaires(MS) des plantes regroupent un très grand nombre de composés, plusieurs dizaines de milliers sont déjà connus, mais un grand nombre reste à découvrir, et présentent une diversité structurelle importante. Il existe de nombreuses classifications de ces produits, qui varient selon le domaine d’application.
D'un point de vue pratique, nous pouvons diviser les MS en ceux qui contiennent de l'azote dans leurs structures et ceux qui n'en contiennent pas (Wink, 2008).
8
Tableau 1 : Métabolites secondaires des plantes (Wink, 2008)
Métabolites contenant de l’azote Métabolites sans azote
Alcaloïdes Monoterpènes (C10)
Lectines, peptides et polypeptides Sesquiterpènes (C15)
Acides aminés non protéiques Diterpènes (C20)
Alkylamides Triterpènes, steroïdes, saponines (C30, C27)
Amines Tetraterpènes (C40)
Glucosinolates Flavonoïdes, anthocyanines, catéchines,
tannins
Glycosides cyanogéniques Phénylpropanoïdes, coumarine, lignanes, lignine
/ Polyacétylènes, acides gras, cires
/ Polyketides
/ Glucides, acides simples
Parmi les familles de molécules contenant de l’azote on retrouve les alcaloïdes, les acides aminés non protéiques (analogues structurels des acides aminés protéiques), les amines, les glycosides cyanogéniques, les glucosinolates, les alkyl-amides, les lectines, peptides et polypeptides. Parmi les familles de molécules ne contenant pas d’azote on trouve les terpénoïdes (monoterpènes, sesquiterpènes, diterpènes, triterpènes, stéroïdes, saponines,tétraterpènes), les flavonoïdes, anthocyanes, catéchines, et tannins, les phénylpropanoïdes, lignines, coumarines et lignanes, les polyacétylènes, acides gras et cires, les polyketides, les glucides et acides simples (Wink 2003; Acamovic et Brooker, 2005; Wink, 2003).
1.3 La composition du complexe phytogénique (CP) 1.3.1 Le curcuma
Les extraits de curcuma sont obtenus à partir du Rhizome de Curcuma longade la famille des Zingiberaceae. C’est une plante originaire du sud de l’Asie et dont le nom
9
commun est safran des Indes. La poudre obtenue à partir du rhizome est beaucoup utilisée comme épice et comme teinture jaune orangée. Le curcuma est également utilisé en médecine traditionnelle africaine et asiatique, et les possibilités d’utilisation de la curcumine, son composant principal, dans le traitement par la médecine moderne de nombreuses maladies, est très étudiée (Sharma et al., 2007; Hatcher et al., 2008). L’utilisation de curcuma dans l’alimentation des poulets a permis de mettre en évidence une amélioration des performances de croissance, particulièrement dans des conditions d’élevage défavorables pour les animaux, comme une température élevée (38°C pendant 3 jours toutes les semaines), la présence d’aflatoxine dans leur aliment (1mg/kg d’aflatoxine B1), ou une infection par des coccidies (Eimeria Acervulina) (AL-Sultan, 2003; Gowda et al., 2009; Ali et al., 2010; Lee et al., 2010). Cette amélioration de la croissance s’est accompagnée d’une réduction de la température corporelle dans le cas d’un stress thermique. Une augmentation de la capacité antioxydante et une réduction de l’oxydation des lipides ont pu être observées avec des différences très importantes dans le cas des poulets confrontés à l’aflatoxine B1 (Gowda et al., 2009).
1.3.2 Le thym
Beaucoup de ces espèces sont typiques de la région méditerranéenne (Cosentino et al., 1999).Le thym serait efficace grâce à ses substance les plus actives, le thymol et le carvacrol contre les champignons(Cosentino et al., 1999), il a aussi une efficacité contre les salmonelles (Ayachi et al., 2009). La possibilité d'utiliser les huiles essentielles de thym ou certains de leurs composants dans les systèmes alimentaires pour empêcher la croissance de bactéries d'origine alimentaire et prolonger la durée de conservation des aliments transformés (Cosentino et al., 1999).
1.3.3 Feuille d’olive
Les feuilles d'olivier (Olea europaea) sont un sous-produit important et copieux de la culture de l'olivier et des moulins à olives (Varmaghany et al., 2013). Des études empiriques, expérimentaleset cliniques ont démontré que les feuilles d'olivier ont le potentiel de réduire la tension artérielle chez les rats (Khayyala et al., 2002) et chez l'homme (Somova et al., 2003).
En fait, il est documenté que l'extrait de feuilles d'olivier a réduit la pression sanguine et le cholestérol du plasma chez les rats (Perrinjaquet-moccetti et al., 2008) et les acides gras mono
10
insaturés disponibles dans la feuille d'olivier comme l'acide oléique réduit les lipides du plasma et prévient l'incidence des maladies cardiovasculaires (Huang et al., 2010).
Les feuilles d'olivier contiennent des composés lignocellulosiques, qui peuvent être nocifs pour l'environnement (Varmaghany et al., 2013). L'oleuropeine et ses dérivés (par exemple l'hydroxytyrosol) sont des composants importants des feuilles d'olivier (Bouaziz et al., 2008). L'oleuropeine est le principal composé phénolique dans les feuilles d'olivier (Lee et al., 2009) et a une activité anti-hypertensive (Bouaziz et al., 2008; Omar, 2010). La supplémentation alimentaire en feuilles d'olivier est efficace pour réduire la pression artérielle et la mortalité liée à l'ascite chez les poulets de chair (Varmaghany et al., 2013).
1.3.4. Le romarin
Le genre Rosmarinus (famille Lamiaceae) comprend trois espèces différentes (Rosmarinus officinalis, Rosmarinus eryocalix et Rosmarinus tomentosus) qui poussent à l’état sauvage, principalement dans la région de la Méditerranée occidentale. Le romarin a été utilisé depuis l'antiquité pour des usages médicinaux. En sciences de l'alimentation, le romarin est l'une des plantes les plus importantes en termes d'applications d'huiles essentielles, en raison de ses propriétés antimicrobiennes, antimycosiques et antioxydantes.
Rosmarinus officinalis L., est devenue l'un des antioxydants naturels utilisés pour remplacer les antioxydants synthétiques ou permettre l'utilisation de synthétiques en moindre quantité pour préserver les aliments et les produits cosmétiques. Ils possèdent de fortes activités antibactériennes et antimicrobiennes (Taylor et al., 2013).
Une étude montre l’efficacité de la supplémentation diététique du romarin et son huile volatile à améliorer la qualité de la viande de poulet (Taylor et francis , 2013), d’autre ont montré les meilleurs effets sur les micro-organismes d’iléon (Behzad et al., 2015).
1.3.5. Les pépins de pamplemousse
Une autre catégorie de phytogène est extraite exclusivement de fruits (Alloui et al., 2014). Ils sont représentés par des polyphénols hydrosolubles (flavonoïdes) qui peuvent également être utilisés dans l'alimentation animale (Lopez-Bote, 2004).
11
L’extrait de pépin de pamplemousse (EPP) est considéré depuis une quinzaine d’années comme le meilleur antimicrobien naturel pour l'usage interne et externe naturel (Takeoka et al., 2001).
Les composés communément présents dans les suppléments de bioflavonoïdes citrus comprennent hespéridine, rutine, naringine, et la quercitine. L’hespéridine (un flavonoïde d'agrume) a été identifiés comme un antioxydant potentiel dans des études in vitro (Rice-Evans et Miller, 1996). Les résultats d’une étude impliquent que les bioflavonoïdes diététiques, la génistéine et l'hespéridine, pourraient améliorer positivement le profil des acides gras et des métabolites lipidiques de la viande de poulet de chair de manière dose-dépendante. Ainsi, les bioflavonoïdes pourraient constituer une alternative possible aux plantes antioxydantes / aux herbes et aux additifs alimentaires synthétiques pour la production de viande de poulet plus saine (Kamboh et Zhu, 2011). Une autre étude a évalué l'activité antioxydant des extraits aqueux et organiques des graines de pamplemousse et de la peau. Ceux-ci sont transformés en farines et soumis à l'extraction des flavonoïdes par des solvants organiques. Les résultats de cette étude montre que les extraits de flavonoïdes incorporés dans l'huile de soja désodorisée ont un effet antioxydant (Mario et al., 2007).
2. L’effet des phytogéniques sur l’appareil digestif 2.1.L’appareil digestif
Le tube digestif s'étend de la bouche à l'anus (figure 1). En général, sa paroi est formé d'une sérosité externe (ou d'une adventice), d'un muscle externe, d'une sous-muqueuse et d'une muqueuse interne. La muqueuse est constituée d'un épithélium interne, d'une lamina propria interne et d'une muqueuse musculaire externe (Bacha et Bacha, 2000).
Le tube digestif est le site principal de la digestion terminal et d'absorption dans le corps, ainsi que le premier site de protection contre les pathogènes exogènes, ce qui en fait le plus grand organe immunologique du corps (Choct, 2009). Il interagissant avec les nutriments fournis par le régime, les micro-organismes du tube digestif ont un effet significatif sur la santé de l'hôte, la nutrition et la croissance(Hashemi et Davoodi, 2011).
L'intestin du poulet est de structure semblable dans toute sa longueur (les villosités présentes dans intestin grêle et gros intestin). Il se compose d'un duodénum, du jéjunum, de l'iléon et du
12
gros intestin (Bacha et Bacha, 2000). L'intestin grêle du poulet de chair est semblable à celui des mammifères mais est plus uniforme sur toute sa longueur.
Figure 1 : l’appareil digestif (Villate, 2001).
2.1.1 L’intestin grêle
Le duodénum est défini comme étant la partie commençant au niveau de la zone pylorique et formant une boucle autour du pancréas, le jéjunum est défini comme la portion suivante s’arrêtant au niveau du diverticule de Meckel (résidu du sac vitellin), enfin l’iléon est défini comme étant la partie allant du diverticule de Meckel à la jonction iléo-caecale (Klasing, 1998).
La muqueuse intestinale porte un grand nombre de villosités qui sont des projections de la muqueuse intestinale dans la lumière permettant d’augmenter la surface d’absorption (Hodges, 1974). A la base des villosités se trouvent les cryptes de Lieberkühn qui sont formées par une invagination de la muqueuse intestinale.
13
Figure 2 : Duodénum (oiseau). H&E. ×62.5.(Aughey et Frye, 2001).
1 : épithélium cylindrique simple, 2 : glandes muqueuses intestinales, 3 : tissu conjonctif de la villosité, 4 : muscularis mucosae.
2.1.2 Les caecum
Chez le poulet, les caeca forment deux diverticules d’égale longueur, situés à la jonction entre l’iléon et le colon. A l’entrée des caeca se trouve un sphincter déterminant leur ouverture. L’épithélium au niveau des sphincters est constitué de longues villosités qui forment une sorte de filtre. Ainsi, seuls les fluides et les plus fines particules provenant de l’iléon et du colon peuvent entrer par rétro péristaltisme dans les caeca, empêchant l’entrée de particules fibreuses solides indigestibles. Quatre-vingt-sept à quatre-vingt-dix-sept pourcent des fluides du caeca proviendraient de l’urine.
Leur rôle chez les oiseaux domestiques n’est pas très bien connu, mais il semble participer à l’absorption d’eau et d’électrolytes (Clench et Mathias, 1995; Józefiak et al., 2004).
14
Figure 3 : Caecum (oiseau). H&E. x 12,5(Aughey et Frye, 2001).
Des masses denses de tissu lymphatique remplissent la lamina propria.
2.1.3 Organisation de la paroi gastro-intestinale
Le tractus gastro-intestinal est composé de quatre couches : la muqueuse est la couche la plus interne ; La sous-muqueuse est une couche de tissu conjonctif qui supporte la muqueuse ; La musculeuse externe est la paroi musculaire entourant la sous-muqueuse ; Et l'adventice ou la séreuse est la couche la plus éloignée du tube gastro-intestinal
La muqueuse est composée d'une couche interne de cellules épithéliales, une couche de tissu conjonctif lâche de support directement sous l'épithélium, appelée la lamina propria, et une mince couche de cellules musculaires lisses, qui forme la frontière entre la muqueuse et La sous-muqueuse.
Pour augmenter la surface d'absorption, les couches muqueuses et sous-muqueuses de l'intestin grêle et du côlon sont organisées en crêtes régulières, appelées plicas circulares, qui augmentent la surface absorbante d'environ trois fois. En outre, les villosités, telles que les projections de la muqueuse qui s'étendent dans la lumière, augmentent la surface absorbante d'une autre dizaine (Shen, 2009).
15
2.2.L’effet des phytogéniques sur l’intestin grêle
Les phytogéniques améliorent la santé intestinale de l'animal, en contrôlant et en éliminant les microorganismes pathogènes dans le tube digestif.
2.2.1 L’effet des phytogéniques sur la hauteur des villosités et la profondeur des cryptes
L'intestin grêle est le site principal de digestion et d'absorption des nutriments, il est divisé en trois parties, à savoir le duodénum, le jéjunum et l'iléon. La couche épithéliale qui recouvre l'intestin grêle a des protubérances semblables à des doigts, faisant saillie dans la lumière de l'intestin (Choct, 2009; Shen, 2009).
Ces protrusions sont appelées villosités et jouent un rôle important dans l'absorption des nutriments dans l'intestin grêle. La longueur des villosités est la plus longue dans le duodénum et diminue en longueur vers l'iléon (Choct, 2009). Une augmentation de la longueur des villosités entraîne une augmentation de la surface et donc une plus grande zone d'absorption des nutriments (Parsaie et al., 2007; Saeid et al., 2013). Aux alentours des villosités se trouvent des indentations dans la muqueuse musculaire, appelées cryptes (Choct, 2009) qui sont responsables de la production des entérocytes et des cellules caliciformes (Shen, 2009). Comme les entérocytes migrent vers le haut des villosités, où ils sont finalement connecté avec la lumière, ils subissent un changement fonctionnel, d'avoir une fonction sécrétoire dans les cryptes, à une fonction absorbante (Uni et al., 2000).
La hauteur des villosités et la profondeur des cryptes jouent un rôle important dans la digestion et l'absorption des aliments dans l'intestin grêle, car une augmentation de la profondeur des cryptes et une diminution de la hauteur des villosités peuvent entraîner une augmentation des sécrétions dans le tractus gastro-intestinal. La résistance aux maladies et une diminution des performances animales (Catala et al., 2008; Parsaie et al., 2007; Nabuurs et al., 1993).
Les cryptes profondes sont un signe d'un fort renouvellement des cellules le long des villosités, et une forte demande pour produire de nouvelles cellules pour rassurer la croissance des villosités (Xu et al., 2003).
16
Les entérocytes sont endommagés par les bactéries pathogènes dans le tractus digestif, ce qui conduit à une augmentation de la profondeur des cryptes (Parsaie et al., 2007).
Plus les villosités sont longues, plus la surface disponible pour l'absorption des nutriments est grande (Shen, 2009; Saeid et al., 2013). Ceci est dû à l'augmentation du nombre d'entérocytes le long des villosités dans la phase d'absorption (Choct, 2009).Les cryptes moins profondes sont associées à une diminution du roulement des tissus et donc à une moindre demande de nouveaux tissus, une meilleure absorption des nutriments associé à une diminution de la sécrétion (Nabuurs et al., 1993; Saeid et al., 2013). Par conséquent, le rapport des villosités à la crypte de l'intestin grêle, joue un rôle important dans la capacité d'absorption (Buddle et Bolton, 1992), et la capacité digestive de l'intestin grêle (Saeid et al., 2013)
En plus les cryptes contient également des cellules caliciformes (Shen, 2009), qui sont responsables de la production de glycoprotéines de mucine, qui est le composant principal de la couche de mucus qui recouvre l'ensemble du tractus gastro-intestinal (Smirnov et al., 2006). Cette couche de mucus joue un rôle important dans l'absorption des nutriments et la protection du tractus gastro-intestinal des agents pathogènes (Smirnov et al., 2006).
Une étude a été menée sur des poulets nourris avec des régimes supplémentés soit avec des probiotiques soit avec un mélange phytogène. Le mélange phytogène était un mélange d'huiles essentielles provenant de l'origan, de l'anis, des agrumes et des fructo-oligosaccharides. Les poulets nourris avec la diète complétée de probiotiques avaient apparemment augmenté la hauteur des villosités et la surface du jéjunum. Le groupe phytogène complété de poulets n'a montré aucun signe d'augmentation de la hauteur des villosités ou de la surface, et il a été rapporté qu'il avait un rapport villosité-crypte réduit. Cependant, il y a eu une augmentation de la performance animale, et on pense donc que cette augmentation n'est pas liée à la morphologie intestinale, mais d'autres mécanismes (Perić et al., 2010).
Une concentration élevée de micro-organismes présents dans le tube digestif de l'animal hôte entraîne un fort retournement des cellules d'entérocytes et de caliciforme dans l'épithélium du tube digestif (Richards et al., 2005). Il en résulte des villosités plus courtes, qui diminuent la surface d'absorption, et des cryptes plus profondes pour suivre la production d'entérocytes le long des villosités (Xu et al., 2003). En conséquence, il y a plus d'entérocytes
17
le long de la crypte par rapport à le long des villosités, car les villosités sont plus courtes, ce qui crée plus de sécrétions dans la lumière de l'intestin grêle et moins d'absorption (Parsaie et al., 2007). Ce déséquilibre de l'absorption et de la sécrétion dans l'intestin grêle, aboutit à moins d'absorption par les entérocytes, donc une diminution de l'absorption des nutriments dans l'intestin grêle (Saeid et al., 2013).
Un taux élevé de renouvellement des cellules d'entérocytes dans la lumière de l'intestin grêle entraîne une augmentation de la demande d'énergie du tractus digestif (Choct, 2009). Les cellules caliciformes sont responsables de la sécrétion des glycoprotéines de mucine, qui est le composant principal de la couche de mucus qui recouvre l'ensemble du tube digestif (Smirnov et al., 2006). Cette couche de mucus joue un rôle important dans la protection du tractus gastro-intestinal des agents pathogènes, ainsi que l'aide à l'absorption des nutriments (Smirnov et al., 2006). Une population immature de cellules caliciformes entraînerait un taux plus faible de production de mucus et pourrait entraîner une diminution de l'efficacité d'absorption, conduisant à une diminution globale de la performance (Choct, 2009).
On croit que les microorganismes dans le tube digestif augmentent l'épaisseur de la paroi du tube digestif (Saeid et al., 2013) ce qui diminue l'efficacité de l'absorption et de l'utilisation des nutriments (Visek, 1978). Une diminution de la concentration des microorganismes dans le tractus digestif pourrait donc conduire à une diminution de l'effritement des entérocytes et des cellules caliciformes, conduisant à des villosités plus longues, ce qui augmente la surface d'absorption. En raison de la diminution de l'effritement des entérocytes et des cellules caliciformes le long des villosités, les cryptes seraient plus petites, ce qui entraînerait moins d'énergie pour le maintien du tube digestif (Saeid et al., 2013). Une concentration plus faible de microorganismes dans le tube digestif entraînerait une paroi intestinale plus mince, ce qui améliorerait l'absorption et l'utilisation des nutriments (Visek, 1978). Collectivement, cela se traduirait par une augmentation de l'absorption des nutriments, une diminution des sécrétions et une augmentation du rendement (Saeid et al., 2013).
2.2.2 L’effet des phytogéniques sur les micro-organismes
Chez les animaux monogastriques, le tractus digestif contient une forte densité et une sélection de microorganismes (Bauer et al., 2006) où les bactéries étant l'espèce prédominante (Mackie et al., 1999). Ces micro-organismes jouent un rôle important en influençant la santé
18
et les performances de l'hôte, en influençant les processus physiologiques, nutritionnels, développementaux et immunologiques chez l'hôte (Richards et al., 2005; Bauer et al., 2006). Les bactéries qui vivent dans le tube digestif de l'hôte ont un rôle important dans le développement sain de l'organe de l'hôte, les tissus et le système immunitaire (Snel et al., 2002), Ainsi que l'approvisionnement de l'hôte avec une variété de composés nutritionnels (Richards et al., 2005). La population de micro-organismes bénéfiques dans le tractus gastro-intestinal bénéficie également à l'hôte en empêchant les espèces pathogènes de coloniser dans le tractus gastro-intestinal. Ceci est assuré par un processus compétitif (Mackie et al., 1999; Snel et al ., 2002), ainsi que par la production d'acides gras volatils qui réduisent le pH du tractus digestif (Ferket, 2004). On a une population plus élevée de microorganismes favorables dans le tractus digestif, elle provoque une diminution de la population, des bactéries pathogènes, ce qui conduit à une plus grande utilisation de l'alimentation et de la digestibilité, et donc une performance accrue de l'animal (Varmaghany et al., 2013).
Les micro-organismes bénéfiques dans le tube digestif ont la capacité de stimuler le système de défense intestinale de l’hôte. Ce système de défense intestinale implique la couche de mucus, la monocouche épithéliale, ainsi que la lamina propria (Snel et al., 2002). La lamina propria est une couche sous l'épithélium contient des cellules immunitaires, des anticorps, des lymphocytes T cytotoxiques et combattants, ainsi que des cellules phagocytaires (Richards et al., 2005).
Les antibiotiques en alimentation améliorent les performances en réduisant la charge totale de microorganismes dans le tube digestif, ce qui entraîne une diminution de la production d'énergie pour l'entretien des intestins (Ferket, 2004). Cette énergie métabolique supplémentaire est ensuite utilisée pour la croissance, ce qui entraîne une meilleure performance (Hashemi et Davoodi, 2011). Les solutions de rechange aux antibiotiques en alimentation agissent principalement en manipulant l'écosystème des micro-organismes du tube digestif pour contenir des microorganismes plus bénéfiques, tels que les Lactobacillus et les Bifidobactéries (Snel et al., 2002). Les additifs alimentaires à base d'extraits végétaux présentent des résultats prometteurs en tant qu'alternative aux antibiotiques dans l'alimentation, car ils ont des propriétés antimicrobiennes. En particulier, l'origan, avec l'ingrédient actif carvacrol, a des propriétés antimicrobiennes (Akgiil et Kavanq, 1988), et réduit le nombre de microbes, en supprimant la croissance des bactéries, similaire à celle des facteurs de croissance antibiotiques (Fekret, 2004) . Dans une étude portant sur des
19
polysaccharides de champignons et de plantes, plus spécifiquement l'extrait de Lentinus edodes, l'extrait de Tremella fuciformis et l'extrait de Radix d'Astragalus membranaceus, aucune suppression de croissance bactérienne n'a été observée (Guo et al., 2003), mais plutôt une augmentation du nombre des bactéries bénéfiques et une réduction du nombre de bactéries potentiellement dangereuses.
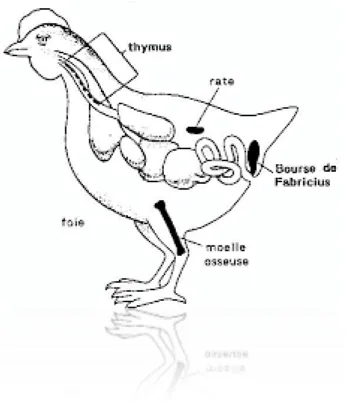
3. L’effet des phytogéniques sur les organes lymphoïdes 3.1.Particularités du système immunitaire des volailles
Le système immunitaire du poulet se compose de la rate, du thymus, des nodules locaux dans la paroi des vaisseaux lymphatiques et des muqueuses, et de la bourse de Fabricius. Il n'y a pas de ganglions lymphatiques, bien que le tissu lymphatique diffus et les follicules lymphatiques soient présents (Aughey et Frye, 2001), il est également constitué de tissu lymphoïde associé à la muqueuse des yeux, des voies respiratoires et génitales, ainsi que de la moelle osseuse (Jeurissen et al., 1988).
20
3.1.1. Le thymus
Le thymus a une fine capsule de tissu conjonctif s'étendant dans la glande et la divisant en un nombre variable de lobe. Les lobes sont divisés en lobules comme chez les mammifères. Chaque lobe a un cortex et une moelle de thymocytes. Ces cellules sont la source des lymphocytes T. Les cellules réticulaires forment des îlots de cellules vacuoles, l'équivalent du corpuscule thymique mammalien (Aughey et Frye, 2001).
.
Figure 5 : Structure histologique de thymus. x 12,5.(Bacha et Bacha, 2012)
3 : cortex, 11 : structure réticulum, 12 : septum, 7 : médulla.
3.1.2. La bourse de Fabricius (BF)
La bourse de Fabricius (BF) est l'organe lymphoïde primaire du poulet (Jeurissen et al., 1988; Casteleyn et al., 2010).
La BF est une petite cavité en forme de sac dorsal qui représente un diverticule dorsal du proctodeum connu uniquement chez les oiseaux. Elle est caractérisée par la présence de plis muqueux élevés et épais remplis par de nombreux follicules ou lobules bursiques polyédriques ; chaque repli est maintenu par un axe conjonctif. Chaque lobule est composé d’un tissu lymphoïde, divisé en zone corticale sombre riche en lymphocytes de petite taille et une médullaire pâle contenant un nombre moindre de cellules de taille variable (Bacha et Bacha, 2000). A l’éclosion la BF contient approximativement 10 000 follicules dont chacun contient environ 100000–150000 lymphocytes B (Fellah et al., 2008).
21
Figure 6 : Structure histologique de la BF. x 12,5 (Bacha et Bacha, 2012).
1 : lumière de la BF, 5 : lobule bursique, 8 : la musculeuse, 10 : épithélium pseudostratifié.
3.1.3. La rate
La rate dans le poulet est un petit organe doux, situé près du gésier, et de couleur similaire au foie, elle est le site où les globules rouges et blancs sont formés (John, J. L., 1994).
La capsule est fibromusculaire comme chez les mammifères, mais plus mince. Les trabécules sont mal définies. La pulpe blanche est un tissu lymphoïde enveloppant une artère et la pulpe rouge est un agencement lâche de sinusoïdes. La fonction de la rate est la phagocytose des érythrocytes sénescents, la lymphopoïèse et la production d'anticorps comme chez les mammifères (Aughey et Frye, 2001).
Figure 7 : Structure histologique de la rate. x 25 (Bacha et Bacha, 2012).
22
3.2. L’effet des phytogéniques sur les paramètres immunologiques
L'immuno-modulation peut être définie comme un changement (stimulant ou supprimant) dans les indicateurs des mécanismes de défense spécifique (cellulaires et humoraux) et non spécifiques (Tan et Vanitha, 2004). Il existe deux types d'immunomodulateurs basés sur leurs modes d'action : l'immunosuppresseur qui supprime l'activité du système immunitaire et les immunostimulateurs qui stimulent son activité.
Les plantes phytogéniques ont prouvé leur activité immunitaire stimulante par la production de cytokines, l'activation des macrophages et l'activité lymphocytaire (Tan et Vanitha, 2004) ou l’activité anti-inflammatoire (Li, 2000).
3.2.1 Effet des phytogéniques sur le poids des organes lymphoïdes
Les poids des organes lymphoïdes donnent une bonne indication de la santé du poulet. Un poulet stressé, sous la forme d'un stress thermique ou d'une augmentation des densités de stockage, il a été rapporté que les poids des organes lymphoïdes diminuent (Pope, 199). Le poids de la bourse de Fabricius est l’image la plus précise de l'immunité du poulet (Heckert et al., 2002).
L'inclusion du poudre de curcuma a augmenté le poids de la rate et le poids total des poulets de chair (Durrani et al., 2006).
AL-Sultan (2003) a constaté que les indices de poids de la bourse et du thymus supérieurs ont été détectés chez les oiseaux recevant un régime alimentaire contenant 0,5% de curcuma, tandis que l'indice de poids de la rate plus élevé a été observé chez les oiseaux recevant de l'alimentation contenant 1,0% de curcuma.
Hernandez et al. (2004) ont révélé qu'il n'y avait aucune différence dans le poids des organes des poulets de chair nourris avec des régimes contenant un extrait de thym et d'origan.
Gupta et Charan (2007) ont montré que la supplémentation en produits de feuilles de tulsi dans les rations de poulet a montré peu d’importance dans le poids du foie, de la bourse et de la rate.
23
Durrani et al. (2008) ont rapporté que le titre d'anticorps plus élevé des poulets de chair traités dans qui serait probablement dû aux propriétés immunostimulantes de la menthe.
Toghyani et al. (2010) ont indiqué que l'effet du traitement des oiseaux recevant 5g/kg de thym sur le poids des organes lymphoïdes à 42 jours et les différences dans le poids des organes lymphoïdes n'étaient pas statistiquement significatives. Ils ont rapporté que le poids relatif de la bourse, de la rate et du foie était plus faible chez les poussins nourris avec le thym.
Tollba (2010) a rapporté que les poids de la rate et de la BF étaient plus important lorsque les poussins recevaient des suppléments diététiques du romarin.
Rahimi et al. (2011) ont conclu que le poids relatif de la bourse de Fabricius dans le groupe des ails a montré une augmentation significative par rapport à d'autres groupes, mais le poids relatif de la rate n'a pas été affecté par les différents traitements.
Hegazi et al. (2014) ont observé que l'extrait de propolis entraînait une augmentation du poids des organes lymphoïdes des poussins.
Khaligh et al. (2011) ont montré que la plante de Mentha piperita (MPP) et la luzerne n'avaient aucun effet statistique en ce qui concerne l'augmentation du poids relatif de la bourse par rapport au groupe témoin. Le pourcentage de poids du foie a considérablement augmenté en réponse aux traitements MPP par rapport au contrôle. Le poids relatif de la rate a diminué avec l'administration de MPP et de luzerne par rapport au traitement témoin.
Toghyani et al. ( 2015) ont montré que le poids relatif des organes lymphoïdes chez les poulets de chair n'était pas affecté par les traitements alimentaires (1 et 2 g/kg de graines d'orge dans l'alimentation, 100 et 200 mg/L d'extrait de graines de pétrole dans l'eau potable).
Vijay Kumar et al. ( 2014) ont étudié qu'il n'y avait pas de différence significative dans le poids des organes internes et tous les organes étaient dans la gamme de poids normale. Seule la bourse de Fabricius dans le groupe témoin était légèrement supérieure à celle des autres groupes. Cela explique que les additifs alimentaires antistress soient Ayucee liquide (vitamine C naturelle avec bioflavonoïdes et sélénium et herbes, à savoir Phyllanthus emblica, Withania somnifera, Terminalia chebula et beaucoup plus en concentration fixe) ou la vitamine C ; n'a aucun effet néfaste sur les organes internes.
24
En général, l'augmentation du poids corporel et le poids relatif de la bourse de Fabricius en raison des additifs expérimentaux peuvent refléter une immunité plus élevée. D'autre part, il a été proposé que l'immunostimulation puisse avoir des effets néfastes sur la croissance, car plus de nutriments seront répartis pour synthétiser les anticorps et le développement des organes lymphoïdes en diminuant les nutriments disponibles pour la croissance (Takahashi et al., 2000).
Le stress peut également avoir un effet négatif sur le système immunitaire du poulet, ce qui entraîne une diminution de la capacité à surmonter les infections virales et bactériennes (Heckert et al., 2002). Dans une étude de Heckert et al. (2002), ils ont été rapporté qu'avec une augmentation de la densité d'élevage des poulets, il y avait une diminution significative du poids de la bourse, ainsi que du rapport entre la bourse et le poids corporel. Dans la même étude, il y avait une diminution des poids de la rate par rapport à une augmentation de la densité d'élevage. Toutefois, cette diminution n'a pas été significative. Les rapports entre la rate et le poids corporel des poulets ne différaient pas avec les densités d'élevage croissantes (Heckert et al., 2002). Cela montre qu'avec des niveaux de stress croissants sur les oiseaux, il y a une diminution des poids des organes lymphoïdes (Heckert et al., 2002). La recherche s'est concentrée récemment sur la fonction du système immunitaire du poulet, plus spécifiquement le tissu lymphoïde associé à l'intestin (GALT), en raison du fait que les antibiotiques utilisés dans l'alimentation comme stimulateurs de croissance ont été interdits et d'autres méthodes pour atteindre la croissance maximale du poulet doivent être explorées (Casteleyn et al., 2010).
Le régime alimentaire complété par l’huile essentielle du Myrte (MEO) a amélioré la performance de croissance et l'augmentation des titres d'anticorps contre les globules rouges du mouton(SRBC), en particulier au niveau de 300 mg/Kg, chez les poulets (Salehifa et al., 2017).
25
3.2.2 L’effet des phytogéniques sur les paramètres sanguins : taux des hétérophiles et des lymphocytes.
Les lymphocytes sont les principales cellules du système immunitaire impliqué dans la santé ; Ils participent principalement aux défenses immunitaires innées (monocytes et cellules NK) et acquises (T et B). Des études ont démontré que les effets des phytogènes sur la défense de l'hôte contre les agents pathogènes et les tumeurs microbiens étaient directement liés à leur capacité à stimuler la prolifération des lymphocytes (Kim et al., 2004).
Les lymphocytes constituent le composant clé du système immunitaire. Une augmentation ou une baisse de la concentration de ces cellules affecte la santé ou la constitution immunitaire du corps car ils reconnaissent les antigènes étrangers et donner une réponse immunitaire (Balwinder et al., 2005).
Borkar et al. (2002) ont observé que « Growell » est un immunomodulateur à base de plantes. Il a entraîné une augmentation significative des paramètres hématologiques (TEC, TLC, Hb et PCV) chez les poussins vaccinés contre les IBD.
AL-Sultan (2003) a constaté que les niveaux plus élevés d'inclusion tumérique (0,5 et 1,0%) dans le régime des poulets de chair augmentaient le nombre d'érythrocytes et le nombre total de leucocytes par rapport au témoin.
Valle-Paraso et al. (2005) utilisent Aloevera comme un complément alimentaire. L'évaluation des paramètres sanguins a montré une augmentation du nombre total des globules blancs et des lymphocytes aux jours 37 et 52 pour les poulets de chair qui ont reçu 2% de gel d'Aloevera (mélangé à l'eau potable) par rapport au groupe témoin.
Esonu et al. (2006) ont observé une augmentation significative de la TLC (total leucocyt count) en nourrissant le neem aux poules pondeuses.
Kumari et al. (2007) ont constaté qu'il n'y avait pas de variation significative dans le nombre total de leucocytes, d'éosinophile et le nombre absolu de monocytes entre les deux groupes de poulets, un témoin et l’autre traité par le curcuma, et que l'augmentation significative du taux d'hémoglobine et du nombre absolu d'hétérophiles dans les groupes traités.
26
L'extrait de feuille de carthame a significativement amélioré la prolifération des lymphocytes du PBL (peripheral blood lymphocyte) par rapport au contrôle négatif du PBS. L'augmentation de la prolifération des lymphocytes induite par l'extrait de feuille de carthame était d'environ 50% de celle produite par le contrôle positif Con A (la concanavaline A est une glycoprotéine de la famille des lectines, elle est aussi appelée hémaglutinine, en raison de sa capacité à précipiter les érythrocytes). En revanche, les extraits méthanoliques de racines de pissenlit et des feuilles de moutarde ne stimulent pas la prolifération de PBL (Sung-Hyen Lee et al., 2007).
Balwinder et al. (2005) ont observé que le nombre total des leucocytes et le nombre des lymphocytes absolus étaient augmentés chez les poulets traités par Immuplus par rapport au groupe témoin.
Nidhi Singh et al. (2008) étudient le nombre d'hétérophiles, comme le montre l'analyse de la variance présentée, elle a diminué avec la supplémentation de formulations à base de plantes (Amla+poudre de curcuma chaque 5 g/Kg d'alimentation) dans la nourriture, indépendamment des saisons. Cette diminution du nombre des hétérophiles a été très significative dans des saisons comme l'été, l'hiver et les pluies. Cette observation prouve l'effet immuno-modulant des préparations à base de plantes.
Oyagbemi et al. (2008) ont révélé que le taux inférieur d'hétérophiles sur lymphocytes (H/L) a été observé pour les groupes qui ont reçu des doses plus élevées (951,6 mg dissous dans 2 litres d'eau) de Stresroak (mélange phytogénique) et cela a été cohérent tout au long de l'expérience, ce qui implique que le mélange phytogénique a amélioré l'immunité du poulet.
Biu et al. (2009) ont observé que l'inclusion du neem dans l'alimentation des poulets de chair diminuait significativement le taux moyen d'hétérophiles et de lymphocytes avec une dose accrue.
Une étude a montré que la supplémentation d'extrait d'huile de 200 ppm dérivé du thym et de la cannelle dans les régimes des poulets de chair diminue considérablement le taux de cholestérol sérique et le rapport H/L dans le sang par rapport au groupe témoin (P <0,05) (Al-kassie, 2009).
27
Dhenge et al. (2009) ont rapporté que l’utilisation de la poudre du racine Andrographis paniculata dans l'alimentation pour les poulets avait considérablement augmenté le nombre total des leucocytes par rapport au groupe témoin.
Galib et Kassie (2010) ont montré que le régime alimentaire additionné d’extraits d'huile dérivés du thym et de la cannelle aux poulets de chair augmentait considérablement les valeurs de globules blancs par rapport au groupe témoin. L'augmentation du nombre des lymphocytes et des basophiles indique que les plantes médicinales telles que la plante de Mentha piperita (MPP) et la luzerne améliorent la capacité phagocytaire du système immunitaire, protègent les oiseaux contre l'invasion de microorganismes pathogènes et prédisposent les animaux à améliorer leurs réponses immunitaires aux infections.
Darabighane et al. (2011) ont rapporté que l'augmentation du nombre total des globules blancs chez les poulets de chair en raison de l'ajout du gel d'Aloevera dans leurs alimentations.
Ali Nobakh et al. (2012) a étudié une piste en utilisant différents niveaux de Satureja hortensis L (0,5, 1, 1,5 et 2% de Satureja hortensis L.) et n'a pas eu d'effets significatifs sur la réponse des cellules immunitaires et les paramètres biochimiques du sang ont été inchangés parmi tous les traitements des poulets de chair.
Alireza Safamehr et al. (2012) ont étudié l'impact du niveau d'ortie sur les constituants sériques et les paramètres liés à l'immunité chez 42 jours d'âge. Les résultats montrent que le glucose, la protéine totale, les hétérophiles, les lymphocytes et H/L des oiseaux n'ont pas été influencés par différents niveaux d'ortie, tandis que les concentrations de cholestérol et de triglycérides dans le sang ont été significativement affectées (P <0,05) par l'ortie.
Raghdad et Abd Al-Jaleel (2012) ont révélé que le rapport H/L, le taux d'albumine était significativement (P <0,05) inférieur dans le groupe traité par le curcuma par rapport au groupe témoin, il semble que divers organes du groupe traité n'a révélé aucun réaction inflammatoire, par conséquent, l'hétérophile dans ces groupes peut résulter de l'afflux de granulocytes de la moelle.
Karami et al. (2013) ont montré que des différences significatives étaient observées dans les lymphocytes, les basophiles et les taux d'éosinophiles, mais aucune différence n'a été trouvée dans le nombre d'hétérophiles traités (régime basique complété par 1,5% de MPP
28
(T2), 3% de MPP (T3), 1,5% de luzerne (T4) et 3% de la luzerne (T5) et des groupes non traités). Les rapports sur l'effet des plantes médicinales telles que la plante de Mentha piperita (MPP) et la supplémentation en luzerne sur les paramètres hématologiques du sang sont très effrayants.
Mathivanan et Edwin (2012) ont étudié un parcours en nourrissant une alimentation contenant Andrographis paniculata et ont constaté que le nombre total de leucocytes était significativement plus élevé (P <0,05) dans le groupe traité (3,0 g) par rapport au groupe témoin.
Roozbeh Fallah et al. (2013) ont montré que, après l’utilisation des feuilles d'oignons d'artichauts et l'extrait de Menthe dans l’alimentation, il y avait un pourcentage plus élevé d'hétérophiles et que le rapport entre les hétérophiles et les lymphocytes est plus élevé.
Xu Ting Li et al. (2013) ont étudié une réponse proliférative de lymphocytes significativement plus élevée (P <0,05) à Con A dans les groupes traités par Dangguibuxue Tang(DBT) indique que la réponse accrue à l'immunité cellulaire serait la principale fonction de l'immunité régulatrice de DBT (Con A est connu pour stimuler la prolifération des lymphocytes T). Le test de prolifération des lymphocytes est largement utilisé pour évaluer la réponse immunitaire à médiation cellulaire pour les échantillons sains et malades pour les poussins.
Vijay et al. (2014) ont porté une étude sous le stress qui a été indiquée par un pourcentage accru d'hétérophiles et une diminution du pourcentage de lymphocytes et donc un rapport H/L élevé (0,71). La supplémentation en produits anti-déstore la vitamine C (0,39) et le liquide Ayucee (0,69) ont considérablement abaissé le rapport H/L chez les poulets de chair.
29
30
MATERIEL ET METHODES
1. Animaux
Cette étude a été réalisée au niveau de l’animalerie du département vétérinaire de l’université El- Hadj Lakhdar (Batna) où une grande salle a été aménagée pour l’élevage expérimental des poulets. La salle est divisée en deux compartiments, le premier est destiné au stockage des aliments tandis que le deuxième est réservé à l’élevage des poulets pour avoir de meilleures conditions expérimentales. Le chauffage est assuré par des radiateurs bain d’huile à température réglable. La ventilation de type statique est assurée par l’ouverture partielle des portes. L’éclairage assuré par des lampes néon, est renforcé par des lampes tungstène avec une intensité lumineuse avoisinant 5 Watts/m2 et un éclairage de 23h/24h.
La salle d’élevage a été correctement préparée avec un vide sanitaire prolongé suivi d’un nettoyage énergique avec une désinfection et une fumigation avec du formol et du permanganate de potassium.
2. Réception des poussins
Après une période de préchauffage qui a duré deux jours avant l’arrivée des poussins ; ces derniers de souche « Cobb » issus d’un couvoir de la région de Sétif sont ramenés dans des cartons. 100 poussins de souche Cobb âgés de 1 jour ont été divisés en 2 lots (témoin et expérimental) de 100 sujets avec cinq réplicas de 20 poussins chacun par groupe (5 × 20) dans un dispositif complètement aléatoire. Les poussins ont reçu l’alimentation suivante :
Lot Témoin : Aliment de base.
31
Figure 8 : Réception des poussins
3. Alimentation et abreuvement
L’alimentation des animaux est assurée par un aliment équilibré avec une composition adaptée à la période d’élevage, de démarrage, de croissance et de finition et une granulométrie respectée (type ONAB). L’alimentation ainsi que l’abreuvement sont distribuées ad libitum.
32
Tableau 2 : compositions des rations alimentaires pour les poulets (%)
Phase Démarrage Croissance Finition
Mais 61 65 65 Tourteau soja 32 28 25 Son de blé 2,5 4 7 Poudre de marbre 1,5 0,5 1 Phosphate bicalcique 1,5 1 1 CMV* 1,5 1,5 1
*Compléments minéraux et vitaminés
4. Vaccination
Le protocole vaccinal utilisé dans ce travail est dirigé contre certaines maladies (Tableau 2).
Tableau 2 : programme de prophylaxie médicale pour les poulets de chair
Vaccin Vaccination contre
3 jours primovaccination contre la maladie de Newcastle à 7 j
10 jours vaccination contre la maladie de Gumboroà 14 j
16 jours rappel contre la maladie de Newcastle à 21 j
21 jours rappel contre la maladie de Newcastle à 21 j
5. Méthodes
a) L’échantillonnage : À l'âge de 42 jours, Cinq oiseaux par traitement ont été sélectionnés au hasard et pesés à l’aide d’une balance puis abattus. Des segments