Développement d’antioxydants pour les huiles de friture
et contribution à l’étude du mécanisme de formation des
monomères cycliques à partir d’acides gras oméga-3
Mémoire
Vanessa Perreault
Maîtrise en sciences et technologie des aliments
Maître ès sciences (M. Sc.)
Québec, Canada
iii
Résumé
Les acides gras polyinsaturés oméga-3 sont reconnus pour leurs bienfaits sur la santé. Cependant, lors d’un traitement thermique, tel que la friture, plusieurs dégradations peuvent se produire, entre autres, l’oxydation, la polymérisation et la cyclisation. Ces dégradations se produisent aux températures utilisées dans l’industrie pour la désodorisation des huiles ainsi que par les consommateurs pour la friture. Ce projet avait pour but, d’une part, de développer de nouveaux antioxydants naturels pour les huiles de friture. Ces composés seraient des dérivés d’acides phénoliques. Le coumarate d’hexyle s’est d’ailleurs avéré être un bon antioxydant potentiel pour l’utilisation en friture. D’autre part, ce projet a permis de contribuer à la synthèse d’un acide gras oméga-3 marqué, l’acide α-linolénique, afin de déterminer le mécanisme de formation des monomères cycliques. Un schéma de synthèse pour l’acide gras marqué a été élaboré et la synthèse a été amorcée.
v
Abstract
Omega-3 polyunsaturated fatty acids are well known for their benefits on health. Unfortunately, thermal processes, such as deep frying, lead to the formation of degradation products such as cyclic fatty acid monomers, oligomers, polymers, trans and oxygenated fatty acids. All these degradations occur at temperature used in industries for oil deodorisation and by consumers in frying process. In this context, the first part of this project was to develop novel natural antioxidants for frying oil. Different phenolic acid derivatives were tested for their antioxidant properties. Amongst them, hexyl coumarate have shown a good potential as an antioxidant in frying process. Second part of this project was to synthesize deuterated omega-3 fatty acid, α-linolenic acid, to determine the mechanism of formation of cyclic fatty acid monomers. A synthesis scheme of the deuterated α-linolenic acid was elaborated and the synthesis was carry out.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Liste des abréviations ... xvii
Remerciements ... xxi
Avant-Propos ... xxiii
Introduction ... 1
Chapitre 1 Revue de littérature ... 5
1.1 Acides gras polyinsaturés oméga-3 ... 7
1.1.1 L’acide α-linolénique ... 8
1.2 Altération des acides gras polyinsaturés ... 8
1.3 Dégradation oxydative des acides gras ... 9
1.3.1 Mécanisme d’oxydation ... 9
1.3.2 Facteurs qui influence l’oxydation des acides gras ... 12
1.3.3 Les antioxydants ... 13
1.3.3.1 Antioxydants primaires ... 13
1.3.3.2 Antioxydants secondaires ... 15
1.3.3.3 Antioxydants synthétiques ... 15
1.3.3.4 Antioxydants naturels ... 16
1.4 Monomères cycliques d’acide gras ... 16
1.4.1 Monomères cycliques de l’acide α-linolénique ... 17
1.4.2 Effets des MCAG sur la santé ... 19
1.4.3 Cinétique de dégradation de l’acide α-linolénique ... 19
1.4.4 Mécanisme de formation des MCAG ... 22
1.4.4.1 Formation des MCAG par cyclisation concertée ... 22
1.4.4.2 Formation des MCAG passant par un intermédiaire radicalaire ... 23
1.4.4.3 Formation des MCAG par cycloaddition intramoléculaire suivi d’une migration prototropique [1,6] ... 24
viii
Hypothèse et Objectifs ... 27
Hypothèse ... 27
Objectifs généraux ... 27
Chapitre 2 Antioxydants pour les huiles de friture ... 29
2.1 Introduction ... 31
2.2 Hypothèse et objectifs spécifiques ... 33
Hypothèse ... 33
Objectifs ... 33
2.3 Méthodologie ... 34
2.3.1 Synthèse du vanillate d’hexyle ... 34
2.3.2 Synthèse du vanillate de dodécyle ... 35
2.3.3 Synthèse du coumarate d’hexyle ... 35
2.3.4 Analyse thermique différentielle ... 36
2.3.5 Test d’efficacité des antioxydants dans l’huile de Canola ... 36
2.3.6 Test d’efficacité des antioxydants en condition de friture ... 37
2.3.7 Analyse des huiles ... 38
2.4 Résultats et Discussion ... 39
2.4.1 Synthèse du vanillate d’hexyle ... 39
2.4.2 Synthèse du vanillate de dodécyle ... 40
2.4.3 Synthèse du coumarate d’hexyle ... 41
2.4.4 Analyse en DSC ... 43
2.4.5 Test d’efficacité des antioxydants dans l’huile de Canola ... 45
2.4.5.1 Test antioxydant du vanillate d’hexyle ... 45
2.4.5.2 Test antioxydant du vanillate de dodécyle ... 46
2.4.5.3 Test antioxydant du coumarate d’hexyle ... 47
2.4.6 Test d’efficacité des antioxydants en condition de friture ... 50
2.5 Conclusion ... 52
Chapitre 3 Approche à la synthèse de l’acide α-linolénique marqué ... 53
3.1 Introduction ... 55
3.2 Hypothèse et objectifs ... 57
Hypothèse ... 57
ix
3.3 Approche à la synthèse ... 58
3.3.1 Choix de l’atome marqueur ... 58
3.3.2 Synthèse d’acides gras non marqués ou marqués ... 59
3.3.3 Stratégie de synthèse ... 60
3.3.4 Synthèse de l’acide 14,14-[H2-H2]-Z,Z,E-octadéca-9,12,15-triénoïque ... 63
3.4 Résultats et discussion ... 64
3.4.1 Mono-protection du nonane-1,9-diol ... 64
3.4.2 Oxydation de la fonction alcool ... 67
3.4.3 Seconde partie de la synthèse ... 69
3.4.3.1 Réduction/deutération du trans-pent-2-énoate de méthyle ... 69
3.4.3.2 Formation de la fonction nitrile ... 69
3.4.3.3 Réduction partielle du nitrile ... 70
3.4.4 Protection de l’alcool en éther de pyranyle ... 70
3.4.5 Réaction de Wittig ... 71
3.4.5.1 Préparation du sel d’ylure ... 71
3.4.5.2 Formation de l’alcène ... 72
3.5 Perspectives envisagées pour la synthèse de l’AAL marqué ... 74
3.5.1 Approche selon la réaction de Wittig ... 74
3.5.2 Approche selon un couplage d’alcynes ... 75
3.6 Conclusion ... 76
Chapitre 4 Discussion générale, conclusions et perspectives ... 79
4.1 Discussion générale ... 81
4.2 Conclusions et perspectives ... 84
Bibliographie ... 87
Partie expérimentale ... 95
Solvants et réactifs ... 97
Purification des composés ... 98
Appareils d’analyse pour la synthèse ... 98
Chapitre 2 : Antioxydants pour les huiles de friture ... 100
Synthèse du vanillate d’hexyle ... 100
Synthèse du vanillate de dodécyle ... 101
x
Chapitre 3 : Approche à la synthèse de l’acide α-linolénique marqué ... 103
Monoprotection du nonane-1,9-diol ... 103
Oxidation du diol monoprotégé : synthèse du synthon (3.26) ... 104
Réduction/deutération du trans-pent-2-énoate de méthyle ... 105
Formation du nitrile ... 105
Réduction partielle du nitrile ... 106
Protection de l’alcool en éther de pyranyle ... 106
xi
Liste des tableaux
Tableau 1.1 : Identification des temps de rétention par GC et signaux en FT-IR des
insaturations pour les isomères de MCAG de l’AAL dérivés en esters méthyliques avec une colonne BPX-70 (Dobson, et al., 1996a, Mossoba, et al., 1994, Sébédio, et al., 1987a). .... 18
Tableau 2.1 : Programme de température utilisé en GC pour la séparation des FAME. ... 39 Tableau PE.1 : Programme de température utilisé en chromatographie en phase gazeuse
xiii
Liste des figures
Figure 1.1 : Structures de l'AAL, de l'AEP et de l'ADH, les principaux AGPI n-3. ... 7
Figure 1.2 : Délocalisation du radical sur une structure d’AG insaturé (McClements et Decker, 2007). ... 10
Figure 1.3 : Cycle d'oxydation des acides gras et mécanisme des antioxydants. ... 11
Figure 1.4 : β-scission d’un hydroperoxyde lipidique (Frankel, 1980, McClements et Decker, 2007). ... 12
Figure 1.5 : Résonance d’un électron dans la structure d’un groupement phénol (McClements et Decker, 2007, Wanasundara et Shahidi, 2005). ... 15
Figure 1.6 : Structures principales des MCAG formées par l'AAL (Christie et Dobson, 2000). ... 17
Figure 1.7 : Structure des 8 isomères géométriques de l’AAL ... 20
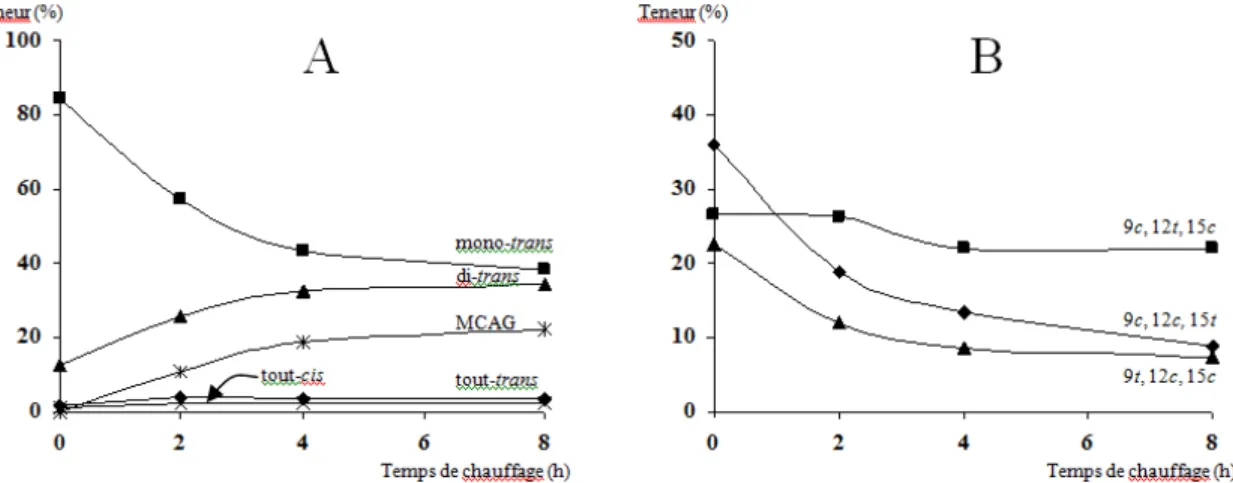
Figure 1.8 : Cinétique de formation des MCAG à partir d’un mélange enrichi en isomères mono-trans de l’AAL (A) et présentation des résultats pour chaque mono-trans (B) (Desmarais, 2013). ... 21
Figure 1.9 : Cinétique de formation des cycles à 5 carbones entre le C10 et le C14 (A) et entre le C11 et le C15 (B) et des cycles à 6 carbones avec une double liaison en C8 (C) et en C16 (D) (Desmarais, non publié). ... 22
Figure 1.10 : Formation des MCAG à partir de l’AAL par la cyclisation concertée (adapté de (Destaillats et Angers, 2005, Gast, et al., 1963)). ... 23
Figure 1.11 : Formation des MCAG à partir d’un AGPI par la voie radicalaire (adapté de (Destaillats et Angers, 2005, Dobson, et al., 1996b)). ... 24
Figure 1.12 : Mécanisme général de formation des MCAG par cycloaddition intramoléculaire. ... 25
Figure 1.13 : Formation des MCAG à partir de l’AAL selon un réarrangement sigmatropique [1,5] (adapté de (Destaillats et Angers, 2005)). ... 25
Figure 2.1 : Schéma de synthèse du vanillate d’hexyle. ... 34
Figure 2.2 : Synthèse du vanillate de dodécyle. ... 35
Figure 2.3 : Synthèse du coumarate d’hexyle. ... 36
Figure 2.4 : Réarrangement de McLafferty du vanillate d’hexyle. ... 40
Figure 2.5 : Réarrangement de McLafferty du vanillate de dodécyle. ... 41
Figure 2.6 : Produits secondaires de la réaction d’estérification de l’acide p-coumarique. 42 Figure 2.7 : Réarrangement de McLafferty du coumarate d’hexyle. ... 42
Figure 2.8 : Structure de résonance de l’acide p-coumarique. ... 43
Figure 2.9 : Comparaison des résultats du vanillate d’hexyle et de dodécyle et du coumarate d’hexyle au DSC pour des températures de 50°C à 200°C. ... 44
Figure 2.10 : Analyse du vanillate de dodécyle par DSC de 20°C à 250°C. ... 44
Figure 2.11 : Teneur résiduelle en acides gras insaturés après 1 (A) et 2 (B) jours de chauffage thermo-oxydatif à 120°C de l’huile de Canola avec différentes concentrations de vanillate d’hexyle par rapport à l’huile de Canola seule. ... 46
xiv
Figure 2.12 : Teneur résiduelle en acides gras insaturés après 1 et 2 jours de chauffage
thermo-oxydatif à 120°C de l’huile de Canola avec le vanillate de dodécyle à une
concentration de 1,0% par rapport à l’huile de Canola seule. ... 47
Figure 2.13 : Teneur résiduelle en acides gras insaturés après 1 (A) et 2 (B) jours de chauffage thermo-oxydatif à 120°C de l’huile de Canola avec différentes concentration de coumarate d’hexyle par rapport à l’huile de Canola seule. ... 48
Figure 2.14 : Rapport des teneurs résiduelles en acide linoléique (A) et en acide α-linolénique (B) à 180°C de l’huile supplémentée en coumarate d’hexyle (HC) ou en BHT à une concentration de 0,1% par rapport à l’huile de Canola seule. ... 49
Figure 2.15 : Teneur résiduelle des différents acides gras lors de la friture. ... 50
Figure 2.16 : Teneur résiduelle en acide linoléique (A) et en acide α-linolénique (B) de l’huile supplémentée en coumarate d’hexyle (HC) ou en BHT à une concentration de 0,1% par rapport l’huile de Canola seule en condition de friture. ... 51
Figure 3.1 : Déplacement d’un atome de deutérium lors de la formation d’un cycle. ... 58
Figure 3.2 : Mécanisme réactionnel pour un couplage d’alcyne suivi d’une hydrogénation complète (A) et d’une hydrogénation partielle (B), ainsi qu’une réaction de Wittig (C). ... 59
Figure 3.3 : Mécanisme réactionnel d’une deutération à l’aide d’un dideutérium (A) et d’un deutérure de lithium et d’aluminium (B). ... 60
Figure 3.4 : Schéma rétrosynthétique I du 11,11-[2H,2H]-linolénate de méthyle (3.15) ... 61
Figure 3.5 : Schéma rétrosynthétique II du 11,11-[2H,2H]-linolénate de méthyle (3.15) ... 61
Figure 3.6 : Schéma rétrosynthétique I de l'acide 14,14-[H2-H2 ]-Z,Z,E-octadéca-9,12,15-triénoïque (3.40). ... 62
Figure 3.7 : Schéma de synthèse de l’acide 15-trans-14,14-[2H,2H]-linolénique (3.40). ... 64
Figure 3.8 : Schéma réactionnel de la mono-protection du diol. ... 65
Figure 3.9 : Fragmentation de la partie acétal du diol mono-protégé. ... 66
Figure 3.10 : Fragmentation de l’acétal. ... 66
Figure 3.11 : Fragmentation du groupement acétal de l’aldéhyde ... 68
Figure 3.12 : Fragmentation de McLafferty de l’aldéhyde ... 68
Figure 3.13 : Schéma réactionnel de la réduction/deutération du trans-pent-2-énoate de méthyle. ... 69
Figure 3.14 : Schéma réactionnel de la formation de la fonction nitrile via la réaction de Mitsunobu-Wilk. ... 70
Figure 3.15 : Schéma réactionnel de la réduction partielle de la fonction nitrile. ... 70
Figure 3.16 : Réaction de protection de l’alcool en éther de pyranyle. ... 71
Figure 3.17 : Schéma réactionnel de la synthèse du sel d’ylure. ... 72
Figure 3.18 : Réaction de Wittig avec le nonanal. ... 72
Figure 3.19 : (I) Chromatogramme des produits obtenus suite à la réaction de Wittig avec le nonanal. (II) Spectre MS de l’alcène (3.35) obtenu suite à la réaction de Wittig. ... 73
Figure 3.20 : Spectre MS de l’éther d’énol (3.50) obtenu lors de la réaction de Wittig. .... 73
Figure 3.21 : Hydrolyse de l’éther d’énol (3.50) pour former l’aldéhyde (3.51). ... 74
Figure 3.22 : Schéma rétrosynthétique I via le couplage d’alcynes de l’acide 14,14-[2H,2H]-Z,Z,Z-octadéca-9,12,15-triénoïque (Desmarais, 2013). ... 76
Figure A.1 : Spectre MS du vanillate d’hexyle ... 110
xv
Figure A.3 : Spectre MS du vanillate de dodécyle ... 110
Figure A.4 : Spectre IR du vanillate de dodécyle ... 110
Figure A.5 : Spectre MS du coumarate d’hexyle ... 110
Figure A.6 : Spectre IR du coumarate d’hexyle ... 110
Figure A.7 : Spectre MS du mom-nonanol ... 110
Figure A.8 : Spectre IR du mom-nonanol ... 110
Figure A.9 : Spectre RMN 1H du mom-nonanol ... 110
Figure A.10 : Spectre RMN C13 du mom-nonanol ... 110
xvii
Liste des abréviations
A• : Antioxydant radicalaire
AAL : Acide α-linolénique
AcOEt : Acétate d’éthyle
ADH : Acide docosahexaénoïque
AEP : Acide eicosapentanéoïque
AG : Acide gras
AGPI n-3 : Acide gras polyinsaturé oméga-3
AH : Antioxydant primaire
AL : Acide linoléique
AlCl3 : Trichlorure d’aluminium
AO : Acide oléique
ATR : de l’anglais «attenuated total reflectance», soit réflexion totale interne
BHA : Hydroxyanisole butylé
BHT : Hydroxytoluène butylé
bp : de l’anglais «boiling point», soit point d’ébullition 13C : Carbone 13
CCM : Chromatographie sur couche mince
CDCl3 : Chloroforme deutéré
CH2Cl2 : Dichlorométhane
CSA : Acide D-10-camphorsulfonique
δ : Déplacement chimique
D : Deutérium
DIAD : Diisopropyl azodicarboxylate
DIBAL-H : Hydrure de diisobutyl aluminium
DMF : N,N-diméthylformamide
DMOX : 4,4-diméthyloxazoline
DMSO : Diméthylsulfoxyde
DSC : de l’anglais «differential scanning calorimetry», soit colorimétrie
différentielle à balayage
équiv. : équivalent
Et2O : Éther diéthylique
EtOH : Éthanol
eV : Electronvolt
FAME : de l’anglais «fatty acid methyl ester», soit ester méthylique d’acide gras
xviii
GC : Chromatographie en phase gazeuse
GC-MS : GC couplé à un spectromètre de masse
GPr : Groupement protecteur 1H : Hydrogène ou proton 2H : Deutérium H2O2 : Hydopéroxyde d’hydrogène HCl : Acide chlorydrique He : Hélium HMPA : Hexaméthylphosphoramide IE : Impact électronique IR : Infrarouge kcal : kilocalorie
KD : Vitesse de réaction du Deutérium
KH : Vitesse de réaction de l’Hydrogène
KHCO3 : Bicarbonate de potassium
KOH : Hydroxyde de potassium
KPa : Kilopascal
L• : Radical lipidique
LiAlD4 : Deutérure de lithium et d’aluminium
LiAlH4 : Hydrure de lithium et d’aluminium
LH : Acide gras
LO• : Radical alkoxyde
LOH : Alcool lipidique
LOO• : Peroxyde lipidique
LOOH : Hydropéroxyde lipidique
M : pic moléculaire
MCAG : Monomère cyclique d’acides gras
MCAG-D : Monomère cyclique d’acides gras marqué par le deutérium MgSO4 : Sulfate de magnésium
MHz : Mégahertz
m/m : masse sur masse
MOM : méthoxyméthyle
MS : Spectrométrie de masse
m/v : masse sur volume
m/z : Rapport masse sur charge n-BuLi : n-Butyllithium
NaCl : Chlorure de sodium
xix
NaOH : Hydroxyde de sodium
Na2S2O3 : Thiosulfate de sodium
O=PPh3 : Oxyde de triphénylphosphine
PDC : Dichromate de pyridinum
PPh3 : Triphénylphosphine
Psi : de l’anglais «pound per square inch», soit livre par pouce carré
RMN 13C : Résonance magnétique nucléaire du carbone 13
RMN 1H : Résonance magnétique nucléaire du proton
u.m. : Unité de masse
T : Tritium
t-BDMS : tert-Butyl diméthylsilyle
TBHQ : Butylhydroquinone tertiaire
THF : Tétrahydrofurane
TsOH : Acide p-toluènesulfonique
µm : Micromètre
xxi
Remerciements
Je tiens tout d’abord à remercier Paul Angers, mon directeur de recherche, pour m’avoir donné l’opportunité de réaliser mes deux années de maitrise au sein de son équipe de recherche. Le fait de m’avoir permis de travailler seule sur certain projet lors de mon baccalauréat m’a permis d’acquérir une autonomie qui m’a fait apprécier mon expérience au maximum, tant lors de mon stage que durant ma maitrise. Merci pour les conseils, les réponses à mes questions et les encouragements lorsque la synthèse ne semblait pas du tout avancer. Son approche humaine et sincère n’aura fait que rendre cette expérience plus agréable. Un énorme merci pour m’avoir permis de participer à un congrès international en Turquie.
Je souhaiterais remercier Joseph Arul et Khaled Belkacemi pour avoir accepté d’évalué ce mémoire.
Je tiens également à remercier Amélie Desmarais qui m’a accueilli dans le laboratoire et m’a supervisé lors de mon stage il y a déjà quatre ans. Elle a su me transmettre sa bonne humeur et sa persévérance.
Je tiens à remercier mes deux stagiaires, Laura Chevalier et Véronique Perreault, qui m’ont aidé dans l’avancement des projets. Leur bonne humeur, leur persévérance et leur initiative m’a beaucoup aidé à avancer. J’aimerais également remercier Ronan Corcuff pour sa disponibilité, sa bonne humeur, son soutien et son aide pour les analyses. Je voudrais également remercier Diane Gagnon, Pascal Lavoie, Gaétan Desnoyer et Pierre Côté.
Je tiens également à remercier mes collègues étudiants de l’ACCESTA et mes amis pour leur soutien, leurs conseils et leurs encouragements et leur aide précieuse au quotidien. Merci pour votre bonne humeur, les discussions et les rires échangés au cours des années. Merci pour les sorties et les soupers de filles qui nous permettaient de décrocher. Merci
xxii
Amélie, Marie-Ève, Audrey-Anne, Laetitia, Marie-Christine, Elodie, Shyam, Sergei, Abdel, Valérie, Alina, Cheslav et tous les autres.
Bien entendu, je souhaite remercier ma famille, mes parents et ma sœur, qui m’ont supporté et encouragé tout au long de ce projet. Leur support moral a été d’une grande importance durant ces deux années.
xxiii
Avant-Propos
Ce mémoire est composé de quatre chapitres. Le premier chapitre est une revue de littérature traitant des dégradations oxydatives et thermiques des acides gras dans les huiles de fritures. Enfin les problématiques qui en découlent seront présentées, ainsi que notre hypothèse de recherche et les objectifs à atteindre afin de vérifier cette hypothèse.
Les deuxième et troisième chapitres présenteront les méthodologies et les résultats obtenus pour les deux projets de recherche. Le deuxième sera sur l’efficacité des antioxydants dans l’huile de friture et le troisième sera sur la synthèse de l’acide α-linolénique marqué au deutérium.
Le dernier chapitre présentera une discussion et une conclusion générales, ainsi que les perspectives pour les projets.
1
Introduction
L’industrie du fast-food est l’un des symboles de la malnutrition et de l’obésité en Amérique du Nord. Ces facteurs peuvent d’ailleurs augmenter les risques de maladies cardiovasculaires. À titre d’exemple, au Canada, en 2009, les maladies cardiovasculaires étaient la cause d’environ 29% des décès, en partie dû à la mauvaise alimentation de la population (Statistique Canada, 2009). En 2000, les coûts reliés à ces maladies étaient de plus de 22 milliards de dollars au Canada (Agence de la santé publique du Canada, 2000). Parmi les facteurs qui augmentent les risques de maladies cardiovasculaires, certains sont indépendant de notre volonté, tel que l’âge et le sexe, alors que d’autres peuvent être contrôlé, dont le diabète, les lipides anormaux et l’obésité (Aronne, et al., 2007, Dahlöf, 2010). Pour ces raisons, les consommateurs essaient d’inclure une alimentation plus saine dans leurs habitudes de vie. Les bienfaits des acides gras polyinsaturés oméga-3 (AGPI n-3) étant très souvent cités, cela incite donc les consommateurs à diminuer la quantité d’acides gras (AG) saturés qu’ils consomment pour les remplacer par des AG insaturés. L’utilisation de l’huile de Canola, riche en AG insaturés, comme huile de friture en est un bon exemple.
Toutefois, les AGPI n-3 présent dans les huiles de friture tendent à se dégrader lorsqu’ils sont en présence de certains facteurs, dont l’oxygène et les hautes températures. En présence d’oxygène, l’oxydation sera la réaction prédominante. Les insaturations vont alors former des peroxydes et des radicaux libres (Frankel, 1984), néfastes pour la santé. De plus, lorsqu’on effectue un traitement thermique prolongé, les AGPI présents dans les huiles peuvent subir des réactions de polymérisation, d’isomérisation en acides gras trans, et peuvent également former des monomères cycliques d’acides gras (MCAG). Inévitablement, toutes ces dégradations se produisent aux températures utilisées dans l’industrie pour la désodorisation des huiles et pour la friture (Sébédio et Grandgirard, 1989).
2
Ainsi, les AGPI n-3 présents dans les huiles se détérioreront en AG trans, en polymères et en MCAG sous l’effet de la chaleur (Sébédio et Grandgirard, 1989). Cela se produit aux températures utilisées par l’industrie alimentaire pour la friture et la désodorisation des huiles (environ 180°C), ainsi que par les consommateurs pour la friture (Aladedunye et Przybylski, 2009). À titre d’exemple, les MCAG peuvent être retrouvés à des teneur de 0,01 à 0,7% dans les huiles (Frankel, et al., 1984, Sébédio et Grandgirard, 1989). Plus le degré d’insaturation est élevé, plus l’AG aura tendance à se cycliser. Ainsi, l’acide α-linolénique (AAL) sera l’acide qui formera le plus de MCAG dans les huiles végétales. Les monomères de cet acide sont bien connus et leurs structures ont déjà été caractérisées (Christie et Dobson, 2000, Dobson, et al., 1996a, Mossoba, et al., 1995). Toutefois, leurs mécanismes de formation ne restent qu’hypothétique à ce jour. Récemment, un mécanisme de formation des MCAG passant par une cycloaddition intramoléculaire suivi d’une migration prototropique [1,6] a été proposé (Destaillats et Angers, 2005).
Pour ce qui est de la dégradation oxydative, différents moyens peuvent être utilisés afin de la limiter ou de la retarder. Parmi ceux-ci, les antioxydants sont parmi les plus utilisés. Il existe deux types d’antioxydants, soit primaires et secondaires. Les premiers vont réagir avec les radicaux formés afin d’arrêter la propagation des produits de dégradation (Gutteridge, 1994, McClements et Decker, 2007), alors que les antioxydants secondaires vont plutôt capter l’oxygène présent dans les huiles et ainsi retarder le mécanisme d’oxydation (Gutteridge, 1994). Les antioxydants primaires sont ceux qui sont le plus souvent utilisés dans les huiles de friture. Ce type d’antioxydants est principalement de molécules possédant un groupement phénol. Le BHT, le BHA et le TBHQ sont les antioxydants synthétiques les plus souvent retrouvés dans les huiles et les plus efficaces. Certaines études ont toutefois démontré qu’ils pouvaient être potentiellement nocifs pour la santé (Farag, et al., 2003, Shahidi et Zhong, 2005). Pour cette raison, les consommateurs cherchent à les éviter.
3 La voie empruntée lors de la formation des MCAG n’a donc toujours pas été élucidée. Une partie de ce projet visait donc à apposer des atomes marqueurs, soit le deutérium, sur la structure de l’AAL. En les apposant sur un carbone impliqué dans la réaction de cyclisation, le mécanisme emprunté pourra ainsi être élucidé. D’un autre côté, ce projet visait également à développer des antioxydants pour les huiles de friture. L’activité des antioxydants qui auront été synthétisés sera testée préalablement dans l’huile de canola avant d’être testée en condition de friture.
Chapitre 1
7
1.1 Acides gras polyinsaturés oméga-3
Les acides gras polyinsaturés oméga-3 (AGPI n-3) sont reconnus pour leurs nombreux bénéfices pour la santé. Ils permettent entre autre d’abaisser les risques de maladies cardiovasculaires et contribueraient au développement de certaines fonctions du cerveau (Kris-Etherton, et al., 2002, Ruxton, et al., 2004, Vancassel, 2004). De plus, les AGPI n-3 aurait également un impact sur la santé oculaire, en particulier sur la rétine (Jeffrey, et al., 2001, SanGiovanni et Chew, 2005). Pour tous ces bienfaits qui leurs sont associés, les consommateurs tentent d’en inclure le plus possible dans leur diète, entre autre par la consommation de poissons gras et d’huiles végétales riches en AGPI n-3, tel que l’huile de Canola.
Les trois principaux AGPI n-3 sont l’acide α-linolénique (AAL), l’acide eicosapentaénoïque (AEP) et l’acide docosahexaénoïque (ADH) (Figure 1.1). Le premier est d’origine végétale, alors que l’AEP et l’ADH sont d’origine marine. L’AAL est dit essentiel, car il ne peut être synthétisé par l’être humain. Son apport provient donc essentiellement de l’alimentation. De plus, l’AAL sert de précurseur chez l’homme à la synthèse des AGPI n-3 à longue chaîne, tels que l’AEP et l’ADH (Barcelo-Coblijn et Murphy, 2009, Burdge et Calder, 2005).
HO O HO O HO O
Acide -linolénique (AAL)
Acide eicosapentaénoique (AEP)
Acide docosahexaénoique (ADH)
9 12 15
5 8 11 14 17
4 7 10 13 16 19
8
Bien que les AGPI n-3 soient bons pour la santé, ils sont tout de même sensibles aux dégradations thermiques et oxydatives, produisant alors des produits nuisibles pour la santé. En effet, les insaturations (doubles liaisons carbone-carbone) présentes sur les AG sont des sites très susceptibles aux dégradations. Les AGPI n-3, contenant au moins trois insaturations, sont donc très sensibles aux dégradations induites par la chaleur et l’oxydation.
1.1.1 L’acide α-linolénique
L’AAL est présent dans certaines noix et certaines plantes. Son origine végétale en fait l’AGPI n-3 le plus susceptible de se retrouver dans les huiles alimentaires. L’huile de lin est celle contenant le plus d’AAL, soit 58,0g d’AAL pour 100g d’huile (Belitz, et al., 2009a). Toutefois, cela la rend inappropriée pour une utilisation en alimentaire dû son haut taux en AGPI n-3. Cette teneur en AAL la rend très susceptible aux réactions d’oxydation et de polymérisation (Belitz, et al., 2009a, Kochhar, 2002). D’autres huiles très utilisées pour la friture, comme l’huile de Canola et de soya, contiennent également des quantités non négligeables d’AAL. Elles contiennent respectivement 9,2 et 7,8g d’AAL pour 100g d’huile (Orthoefer et List, 2007c). Cela les rend donc moins adaptées pour la friture car elles auront tendance à se dégrader plus facilement.
1.2 Altération des acides gras polyinsaturés
La friture est un mode de cuisson très employé autant dans les restaurants qu’à la maison. L’huile de Canola est très prisée pour ce type de cuisson dû, entre autre, à son faible coût. Toutefois, cette huile à un faible taux d’acides gras saturés et une forte teneur en AGPI n-3. Ces derniers sont composés de trois insaturations et plus, ce qui les rend très sensibles aux dégradations lorsqu’ils sont en présence de certains facteurs, tels que l’oxygène, la vapeur d’eau ou les hautes températures. En présence d’oxygène, des réactions d’oxydation se produisent, formant des composés volatiles et non-volatiles. Les AGPI n-3 formeront alors des hydroperoxydes, des alcools, des aldéhydes et des polymères (Dana et Saguy, 2001, Frankel, 1984, Marquez-Ruiz et Dobarganes, 2007). Tous ces
9 produits augmenteront la polarité de l’huile, ainsi que sa viscosité. En présence de vapeur d’eau, les AGPI n-3, ainsi que les AG présents, formeront des AG libres, ainsi que des mono- et di-glycérides. Ces derniers augmentent la polarité des huiles, alors que les AG libres vont abaisser le point de fumée des huiles (Aladedunye et Przybylski, 2009, Dana et Saguy, 2001, Perkins, 2007). Finalement, les hautes températures vont transformer les AGPI n-3 en polymères, en AG trans et en monomères cycliques d’acides gras (MCAG) (Billek, 2000, Frankel, et al., 1984, Sébédio et Grandgirard, 1989, Sébédio et Juaneda, 2007). Tous ces produits sont à éviter dans une saine alimentation, car ils ont des répercussions néfastes sur la santé (Billek, 2000, Sébédio, et al., 2007).
1.3 Dégradation oxydative des acides gras
Lors de la friture des aliments, les AG présents dans l’huile, en particulier les AG insaturés comme l’AAL, subiront une dégradation oxydative sous l’effet de la chaleur. Il s’agit de la dégradation la plus importante se produisant dans les huiles de friture. Cette dégradation mènera à la formation de produits nocifs pour la santé, tels que des radicaux libres, des aldéhydes, des alcools et des peroxydes.
1.3.1 Mécanisme d’oxydation
L’oxydation est une réaction en chaîne radicalaire en trois étapes. Il y a tout d’abord la formation de radicaux lipidiques, soit l’initiation, puis la propagation de la formation des peroxydes et finalement la terminaison, soit la formation de produits non-radicalaires (Figure 1.3). Ainsi, cette réaction peut se produire en continue jusqu’à ce qu’un substrat l’arrête.
Pour ce qui est de l’initiation, cette réaction implique la perte d’un radical afin de former un radical lipidique. Cela nécessite l’aide d’un agent externe afin de débuter la réaction. Généralement, il s’agit de lumière, de chaleur, de radiation ionisante ou d’une initiation chimique impliquant un ion métallique (Antolovich, et al., 2002, Kamal-Eldin et Pokorny, 2005). Il est à noter que les AG insaturés sont plus faciles à convertir en radicaux
10
libres. En effet, un atome d’hydrogène est plus facilement extrait d’une molécule si une double liaison se trouve sur le carbone adjacent. Ainsi, plus une molécule est insaturé, plus il est facile d’extraire un atome d’hydrogène. À titre d’exemple, un lien C-H se situant sur une chaîne aliphatique demande une énergie de 98 kcal/mol pour être dissocié. Cette énergie diminue à 89 kcal/mol lorsque le lien C-H se trouve adjacent à une double liaison. Lorsque ce lien se retrouve sur un groupement méthylène séparant deux doubles liaisons, l’énergie de dissociation peut diminuer sous les 80 kcal/mol. Ainsi, plus un AG a de doubles liens, plus il perdra un atome d’hydrogène facilement, et donc plus il s’oxydera facilement (Kamal-Eldin et Pokorny, 2005, McClements et Decker, 2007).
De plus, dans les AGPI, le radical libre est stabilisé par la délocalisation d’un double liens, ce qui entraînera la formation de doubles liens conjugués (Figure 1.2) (McClements et Decker, 2007). Lorsque cette résonance se produit, la densité électronique sera plus forte dans le centre (près du carbon 11) et plus faible sur les extrémités (près des carbones 9 et 13). Lors de l’étape suivante, l’oxygène aura donc tendance à se fixer là où la densité électronique est moindre, soit sur les extrémité du système de doubles liaisons (Schaich, 2005). H H+ 9 10 11 12 13 9 10 11 12 13 9 10 11 12 13 9 10 11 12 13
Figure 1.2 : Délocalisation du radical sur une structure d’AG insaturé (McClements et
Decker, 2007).
La propagation consiste en une oxydation. L’oxygène va réagir avec le radical libre du lipide afin de former un radical peroxyde (LOO٠). Ce radical possède une grande énergie, ce qui lui permet d’attirer un atome d’hydrogène d’une autre molécule d’AG. Comme le lien C-H d’un AG insaturé est faible, il est donc facile pour un radical peroxyde
11 d’en extraire un hydrogène. Le radical de peroxyde est alors transformé en une molécule d’hydroperoxyde lipidique (LOOH), en plus de former un autre radical lipidique. La propagation des radicaux libres se fait donc ainsi (Kamal-Eldin et Pokorny, 2005; McClements et Decker, 2007).
La terminaison se produit lorsque les radicaux sont présents en abondance. Ils réagiront alors avec d’autres radicaux libres afin de former des espèces non radicalaires, tels que des dimères. Dans les conditions atmosphériques, cela se fera entre des radicaux de peroxyde et d’alkoxyde. Alors que dans un milieu où il y a une faible concentration en oxygène, cela se fera entre deux radicaux d’alkyle (McClements et Decker, 2007). Les produits obtenus à cette étape correspondent aux produits primaires d’oxydation.
LH L• LOO• O2 LH LOOH (hydropéroxyde) AH A• LOOH Produits secondaires
(aldéhydes, cétones, alcools, acides courts, alcanes) (chaîne d'acides gras)
Étape d'initiation Étape de propagation Antioxydant
H•
Figure 1.3 : Cycle d'oxydation des acides gras et mécanisme des antioxydants.
Des produits secondaires d’oxydation seront ensuite formés. Les hydroperoxydes, formés précédemment, sont très instables dans les conditions de friture et se dégradent donc très rapidement (Dobarganes, 2009, Lomanno et Nawar, 1982). Par exemple, à des températures de 150°C, les peroxydes auront un temps de demi-vie d’une heure (Pryor, 1966). Ils se dégraderont donc en radicaux d’alkoxyle (LO٠). Il est à noter que ces radicaux sont très réactifs. Or, ils ont assez d’énergie pour arracher un électron au lien covalent adjacent et causer ainsi le clivage de la chaîne aliphatique. Cette réaction est appelée une β-scission (Figure 1.4). Lors de celle-ci, un aldéhyde et un radical d’alkyle sont obtenus
12
après le clivage. Ce radical peut alors réagir avec de l’oxygène pour faire un hydropéroxyde, un radical d’hydroxyle afin de former un alcool ou un radical d’hydrogène pour former un hydrocarbure. Les produits formés dépendent de l’endroit où se situe l’hydropéroxyde sur la molécule d’acide gras de départ (McClements et Decker, 2007). Il peut donc y avoir plusieurs sortes de produits secondaires. Parmi ceux-ci, on en retrouve 3 types différents. Il y a des monomères, des composés à faible masse moléculaire qui proviennent du clivage des chaînes d’hydropéroxyde et, finalement, des produits à haute masse moléculaire qui sont formés par la polymérisation des radicaux libres des produits de dégradation (Kamal-Eldin et Pokorny, 2005).
O O H O O H
Figure 1.4 : β-scission d’un hydroperoxyde lipidique (Frankel, 1980, McClements et
Decker, 2007).
1.3.2 Facteurs qui influence l’oxydation des acides gras
Certains facteurs permettent aux acides gras polyinsaturés d’être convertis en radicaux libres plus ou moins facilement. La présence de métaux lourds par exemple, en particulier le fer, va accélérer l’oxydation (Perkins, 2007). Une grande concentration d’oxygène, une température élevée et une grande surface de contact entre l’huile et l’air peuvent également augmenter l’oxydation. L’eau, qui est générée par celle présente dans les aliments, peut ralentir ou accélérer le processus d’oxydation. En effet, lorsque la quantité d’eau commence à augmenter, cela diminue la mobilité de l’oxygène et des métaux, ce qui diminue la vitesse de l’oxydation. D’un autre côté, lorsque l’activité de l’eau devient plus élevé, l’eau libre présente dans l’huile augmentera la mobilité des prooxydants, ce qui augmentera l’oxydation (Belitz, et al., 2009b, McClements et Decker,
13 2007). La présence de prooxydant ou d’antioxydant peuvent également modifier le taux d’oxydation de l’huile (Kamal-Eldin et Pokorny, 2005, McClements et Decker, 2007). La composition de l’huile a également un impact sur l’oxydation des acides gras. Comme il a déjà été expliqué, plus il y a des AG insaturés dans l’huile par rapport aux AG saturés, plus vite l’huile s’oxydera (Kamal-Eldin et Pokorny, 2005).
1.3.3 Les antioxydants
L’une des méthodes qui peut être utilisée pour retarder ou inhiber l’oxydation des acides gras est l’utilisation d’antioxydants. Les antioxydants naturels, tel que les polyphénols des plantes, sont de plus en plus prisés pour la conservation des produits alimentaires, dû au développement d’un courant santé chez les consommateurs (Antolovich, et al., 2002). Un antioxydant est une substance qui, lorsqu’elle se retrouve à faible concentration dans un substrat oxydable, peut retarder ou inhiber, de façon significative, l’oxydation de ce substrat (Gutteridge, 1994). En industrie alimentaire, les antioxydants sont utilisés pour prévenir la détérioration de la qualité des produits et maintenir leur valeur nutritive.
L’activité des antioxydants dépend des aliments dans lesquels ils sont ajoutés, de la concentration utilisée, de la quantité d’oxygène présent et de la présence de catalyseur d’oxydation (ions métalliques), ainsi que de la présence de molécules synergiques (McClements et Decker, 2007). Leur activité dans les huiles dépend également de leur stabilité thermique et de leur volatilité. Il existe deux sortes d’antioxydants, soit les primaires et les secondaires. Chaque type possède un mode d’action différent. Les plus souvent utilisés en alimentation sont les antioxydants primaires. Parmi ceux-ci, on peut retrouver des composés synthétiques ainsi que naturels.
1.3.3.1 Antioxydants primaires
Les antioxydants primaires sont considérés comme des briseurs de chaîne ou des intercepteurs de radicaux libres et comprennent principalement des composés phénoliques.
14
Ces molécules contiennent donc un cycle aromatique substitué par un groupement –OH ou un groupement –OR. Ils sont efficaces à faibles concentrations, mais peuvent devenir prooxydant à forte concentration. Ces antioxydants peuvent inhiber la réaction d’initiation en réagissant avec un radical ou inhiber la propagation et la réaction de β-scission en réagissant avec un des radicaux peroxydes ou alkoxydes. (Gutteridge, 1994, McClements et Decker, 2007, Wanasundara et Shahidi, 2005, Yanishlieva et Marinova, 2001). Des produits non radicalaires et plus stables sont alors obtenus. Ainsi, l’efficacité d’un antioxydant est dépendante de sa capacité à donner un atome d’hydrogène à un radical libre. Les réactions sont les suivantes (Antolovich, et al., 2002, Wanasundara et Shahidi, 2005) :
Réaction entre un antioxydant et un radical : L• + AH → LH + A• LOO• + AH → LOOH + A• LO• + AH → LOH + A• Réaction de terminaison : A• + A• → AA A• + LO• → LOA A• + LOO• → LOOA
Les antioxydants radicalaires qui sont obtenus lors de ces réactions sont très stables et n’induiront donc pas la propagation des radicaux libres, à moins qu’ils soient présents en grande quantité. Ils vont plutôt réagir avec d’autres radicaux libres, comme les radicaux peroxyde et les radicaux alkoxyde. L’efficacité antioxydante est donc également dépendante de la stabilité de résonance de la molécule. En effet, lorsqu’un antioxydant devient radicalaire, il est stable dû à la résonance de l’électron dans le cycle aromatique (Figure 1.5) (McClements et Decker, 2007, Wanasundara et Shahidi, 2005).
15 OH
ROOH
O O O O
ROO
Figure 1.5 : Résonance d’un électron dans la structure d’un groupement phénol
(McClements et Decker, 2007, Wanasundara et Shahidi, 2005).
Les antioxydants primaires sont ceux qui sont le plus souvent retrouvés dans le domaine alimentaire. Bien souvent, il s’agit d’antioxydants synthétiques, tels que le BHT, BHA et TBHQ, mais ils peuvent également être d’origine naturelle. C’est le cas par exemple pour le α-tocophérol et des dérivés de l’acide cinnamique.
1.3.3.2 Antioxydants secondaires
Les antioxydants secondaires sont considérés comme des antioxydants préventifs pouvant agir en éliminant, ou du moins en diminuant la concentration d’oxygène présent dans l’huile. Ils peuvent également agir en tant qu’agent séquestrant pour diminuer l’effet des ions métalliques catalytiques, éliminer les espèces réactives de l’oxygène, tels que H2O2 et O2-, ainsi que réagir avec l’oxygène singulet (1O2). Ce type d’antioxydants ne
permet donc pas de stabiliser les radicaux libres qui sont formés durant l’oxydation des AG (Gutteridge, 1994, Wanasundara et Shahidi, 2005). Ces antioxydants sont principalement composés de molécules possédants un système de liens π conjugués. C’est le cas par exemple de l’acide ascorbique. Les antioxydants secondaires peuvent également augmenter l’efficacité d’un antioxydant primaire lorsqu’ils sont ajoutés à ceux-ci (Wanasundara et Shahidi, 2005).
1.3.3.3 Antioxydants synthétiques
Les antioxydants synthétiques comprennent très souvent un groupement phénolique. Les plus souvent utilisés dans les huiles de friture sont le BHT, le BHA, le TBHQ, ainsi
16
que le gallate de propyle (Madhavi, et al., 1996, McClements et Decker, 2007). Ils présentent tous un très bon effet antioxydant, mais plusieurs études ont démontré qu’ils pouvaient avoir un effet néfaste sur la santé s’ils sont ingérés à forte dose (Farag, et al., 2003, Shahidi et Zhong, 2005, Wanasundara et Shahidi, 2005). Pour cette raison, la teneur de ces antioxydants est régie par la loi. Au Canada, la concentration de ces antioxydants dans les huiles ne doit pas dépassée 0,02% (Santé Canada, 2013). La limitation est également en vigueur aux États-Unis et en Europe. Toutefois, leur utilisation dans les aliments commence à diminuer dû à leur effet cancérogène potentiel, ainsi qu’à un éveil de la conscience santé chez les consommateurs (Shahidi et Zhong, 2005).
1.3.3.4 Antioxydants naturels
Afin de remplacer les antioxydants synthétiques, différents composés phénoliques naturels peuvent être utilisés comme antioxydants. Les plus importants sont le α-tocophérol, l’acide ascorbique et les dérivés de l’acide cinnamique (Madhavi, et al., 1996). Bien que certains de ces antioxydants soient tout de même synthétisés, ils sont considérés comme naturels puisqu’ils peuvent être retrouvés naturellement (Wanasundara et Shahidi, 2005). Le α-tocophérol est déjà retrouvé naturellement dans certaines huiles et est un antioxydant efficace. D’autres molécules, tels que les acides caféique, férulique, vanillique et p-coumarique, sont également retrouvés naturellement et ont déjà démontré des effets antioxydants. Toutefois, la plupart des composés phénoliques, dû à leur polarité, sont hydrosolubles et se dissolvent donc très mal dans les lipides (Choe et Min, 2009, Shahidi et Zhong, 2010). C’est pour cette raison que ces composés n’ont jamais été utilisés dans les huiles de friture. Une solution qui pourrait être envisagé est de rendre ces molécules plus lipophiles, en ajoutant, par exemple, une chaîne hydrophobe sur ces molécules.
1.4 Monomères cycliques d’acide gras
Toutes les dégradations pouvant affectées les AG surviennent à des températures entre 170°C et 195°C, soit celles utilisées dans l’industrie pour la transformation des huiles, telles que la désodorisation, ainsi que pour la friture, qui est également utilisée comme
17 méthode de cuisson par les consommateurs (Belitz, et al., 2009b). Les monomères cycliques d’acides gras (MCAG) sont présents en faible quantité dans les huiles de friture polyinsaturées, soit à une teneur de 0,01 à 0,66% des acides gras totaux (Sébédio et Grandgirard, 1989).
1.4.1 Monomères cycliques de l’acide α-linolénique
L’AAL peut former seize isomères géométriques possédant quatre structures principales (Figure 1.6). Deux de ces isomères contiennent un groupement cyclopentényle (cycle à 5 atomes de carbone) (1.3 et 1.4) et les deux autres ont un groupement cyclohexényle (cycle à 6 atomes de carbone) (1.1 et 1.2) (Christie et Dobson, 2000). Ces deux types
d’isomères se retrouvent
approximativement en même quantité dans les huiles riches en AAL (Sébédio et Grandgirard, 1989). Chacun d’eux possède une double liaison dans le cycle, située entre les carbones 12 et 13, et une autre sur la chaîne aliphatique. Pour ce qui est de la double liaison intra-cyclique, la configuration cis est requise pour minimiser la tension dans le cycle. Les insaturations situées sur la chaîne alkyle peuvent prendre la configuration Z ou E. Quant aux cycles, ils peuvent s’orienter cis ou trans dans l’espace. Ce qui donne donc un total de seize isomères (Christie et Dobson, 2000).
Les temps de rétention en chromatographie en phase gazeuse (GC) des seize isomères de MCAG ont été déterminés (Dobson, et al., 1996a). Une colonne capillaire
O HO 10 15 16 12 HO O 8 10 12 15 HO O 9 11 15 12 HO O 10 14 15 12 1.1 1.2 1.3 1.4
Figure 1.6 : Structures principales des MCAG
18
polaire BPX-70 a été utilisée avec un programme de température isotherme à 180°C. Lorsque le GC est couplé à un spectromètre infrarouge à transformée de Fourier (FT-IR), la distinction entre les isomères Z et E des doubles liens est possible (Mossoba, et al., 1995, Mossoba, et al., 1994, Sébédio, et al., 1987a) (Tableau 1.1). Les MCAG de l’AAL ont été analysés sous forme d’esters méthyliques (FAME).
Tableau 1.1 : Identification des temps de rétention par GC et signaux en FT-IR des
insaturations pour les isomères de MCAG de l’AAL dérivés en esters méthyliques avec une colonne BPX-70 (Dobson, et al., 1996a, Mossoba, et al., 1994, Sébédio, et al., 1987a).
Grandeur du cycle Position du cycle Position des doubles liaisons Configuration de la double liaison Signaux en FT-IR des doubles liens (cm-1)a Configuration du cycle Temps de rétention (min.)b 5 11-15 9, 12 Z 708, 3013 trans 18.80 5 10-14 12, 15 E 968 trans 18.61 5 11-15 9, 12 E 968 trans 18.68 5 10-14 12, 15 Z 708, 3013 trans 18.83 5 10-14 12, 15 E 968 cis 18.84 5 11-15 9, 12 E 968 cis 18.95 5 11-15 9, 12 Z 708, 3013 cis 19.39 5 10-14 12, 15 Z 708,3013 cis 19.34 6 10-15 8, 12 E 968 cis 19.55 6 10-15 8, 12 Z 708, 3013 trans 19.64 6 10-15 8, 12 E 968 trans 19.65 6 10-15 8, 12 Z 708, 3013 cis 19.94 6 10-15 12, 16 E 968 trans 19.87 6 10-15 12, 16 E 968 cis 19.98 6 10-15 12, 16 Z 708, 3013 trans 20.21 6 10-15 12, 16 Z 708, 3013 cis 20.51
a(Sébédio, et al., 1987a) b(Dobson, et al., 1996a)
Lorsque le GC est couplé à un spectromètre de masse (MS), certaines dérivations des AG permettent une meilleure séparation et une meilleure interprétation. Par exemple, la dérivation en ester picolinique permet une meilleure interprétation du spectre de masse, puisque les ions sont stabilisés par le fait que l’atome d’azote présent sur ce fragment porte
19 la charge. La dérivation en 4,4-diméthyloxazoline (DMOX) a le même effet sur la stabilisation des ions (Christie, 1998, Dobson, et al., 1995, Sébédio et Juaneda, 2007).
1.4.2 Effets des MCAG sur la santé
Les effets des MCAG sur la santé humaine sont étudiés depuis de nombreuses années. Des études faites dans les années 50 suggéraient déjà que ces composés pouvaient être parmi les plus toxiques retrouvés dans les huiles de friture dû à leur rôle dans la lipogenèse (Sébédio et Grandgirard, 1989). Plusieurs études suggèrent d’ailleurs que les MCAG peuvent être métabolisés comme les AG réguliers, c’est-à-dire qu’ils seront utilisés pour la production d’énergie et ils seront incorporés dans les phospholipides des membranes. En effet, des études suggèrent que la chaîne aliphatique présente sur les MCAG pourrait participer à la production d’énergie de la même façon que les AG naturels (Desmarais, 2013). Cela peut donc affecter le métabolisme des AG (Sébédio, et al., 2007).
Leurs effets sur le métabolisme intestinal dépendent de leurs positions dans le triacylglycéride et la structure des MCAG peut également avoir un impact sur leur récupération dans le système lymphatique s’ils sont absorbés comme des AG libres (Martin, et al., 1997). De plus, une étude suggère que les MCAG pourraient avoir d’autre effet sur la lipogenèse (Martin, et al., 2000). Des travaux réalisés dernièrement suggèrent également leurs accumulations dans des organes cibles, tels que le foie et les tissus adipeux, ainsi que leur élimination sous forme de glucuronides, de sulfates et/ou de nitrates. D’autres sous-produits qui ont été observés suggèreraient la participation des MCAG dans le mécanisme de β-oxydation (Desmarais, 2013).
1.4.3 Cinétique de dégradation de l’acide α-linolénique
L’AAL retrouvé naturellement contient trois insaturations de configuration cis. Lors d’un chauffage, les insaturations auront tendance à s’isomériser en leur conformation trans, cette conformation étant thermodynamiquement plus stable (Sonnet, 1980). L’AAL peut
20
donc former 8 isomères géométriques (Figure 1.7). La configuration de l’AAL pourrait donc avoir une influence sur la formation des monomères cycliques d’acides gras.
HO O HO HO HO O O O 9 12 15
9-cis, 12-cis, 15-cis
9 12 15
9-cis, 12-cis, 15-trans
9 12 15 9 12 15 9 12 15 9 12 15 9-cis, 12-trans, 15-cis
9-cis, 12-trans, 15-trans
HO HO HO HO O O O
O 9-trans, 12-trans, 15-cis
9
12 15
9
12
15
9-trans, 12-trans, 15-trans
9-trans, 12-cis, 15-cis
9-trans, 12-cis, 15-trans
Figure 1.7 : Structure des 8 isomères géométriques de l’AAL
Les acides gras les plus souvent retrouvés dans les huiles végétales utilisées pour la friture sont l’acide palmitique (16:0), l’acide stéarique (18:0), l’acide oléique (AO) (18:1), l’acide linoléique (AL) (18:2) et l’AAL (18:3). Ce dernier étant l’AG comportant le plus d’insaturations, il sera donc le plus susceptible de subir des dégradations, oxydatives ou thermiques, et donc l’acide gras qui formera le plus de MCAG (Sébédio et Grandgirard, 1989). D’ailleurs, les MCAG se formeraient 10 fois plus vite dans les huiles ayant une forte teneur en AAL par rapport à celle ayant une forte teneur en AL (Sébédio, et al., 1987b), bien que les AG mono- et di-insaturés forment également des MCAG (Christie et Dobson, 2000, Destaillats et Angers, 2005).
Afin d’optimiser la synthèse de l’AAL, des travaux ont été effectués afin de déterminer l’effet des isomères sur la formation des MCAG (Desmarais, 2013). Ces travaux suggèrent que la configuration des doubles liaisons, soit cis ou trans, aurait un impact sur la cinétique de formation des MCAG. En effet, une double liaison trans permettrait de diminuer l’encombrement et accélèrerait ainsi la formation des cycles. De plus, ces travaux suggèrent que l’isomère mono-trans de l’AAL formerait des MCAG plus rapidement que l’isomère di-trans. Lors du chauffage de l’AAL enrichi en mono-trans (Figure 1.8A), une
21 augmentation dans le temps de l’isomère di-trans, dû à une isomérisation, et des MCAG de 22% chacun est observée en même temps que la diminution de l’isomère mono-trans. L’isomère tout-trans, quant à lui, tenderait plutôt à s’accumuler.
Figure 1.8 : Cinétique de formation des MCAG à partir d’un mélange enrichi en isomères
mono-trans de l’AAL (A) et présentation des résultats pour chaque mono-trans (B) (Desmarais, 2013).
Parmi les trois isomères mono-trans (Figure 1.8B), les isomères ayant la double liaison sur les carbones 9 et 15 en configuration trans vont former des MCAG plus rapidement que celui avec la double liaison trans sur le carbone 12. Cela concorde avec le mécanisme de formation des MCAG via un réarrangement sigmatropique [1,5], puisqu’afin de diminuer l’encombrement, la double liaison du carbone 12 doit être en configuration cis. De plus, les travaux suggèrent que l’isomère mono-trans au carbone 15 formerait des MCAG plus rapidement que le mono-trans au carbone 9. Pour cette raison, l’AG qui sera synthétisé aura une double liaison de configuration trans sur le carbone 15.
D’autres études cinétiques ont été effectuées afin de déterminer lequel des MCAG à cinq carbones se formera le plus rapidement et lequel restera le plus longtemps dans le mélange avant de former un MCAG à six carbones (Figure 1.9). D’après cette étude, les MCAG dont le cycle à cinq carbones se situe entre les carbones 10 et 14 se formeraient plus rapidement que ceux ayant le cycle entre les carbones 11 et 15. Ces derniers se
22
transformeraient toutefois plus vite en cycle à six carbones. Ce qui signifie que, dans le mélange final, l’isomère contenant un cycle à cinq entre les carbones 10 et 14 sera plus prépondérant. Il serait donc judicieux, lors de la synthèse de l’AAL marqué de remplacer l’un des atomes d’hydrogène impliqué dans la formation de cet isomères de MCAG par un deutérium.
Figure 1.9 : Cinétique de formation des cycles à 5 carbones entre le C10 et le C14 (A) et
entre le C11 et le C15 (B) et des cycles à 6 carbones avec une double liaison en C8 (C) et en C16 (D) (Desmarais, non publié).
1.4.4 Mécanisme de formation des MCAG
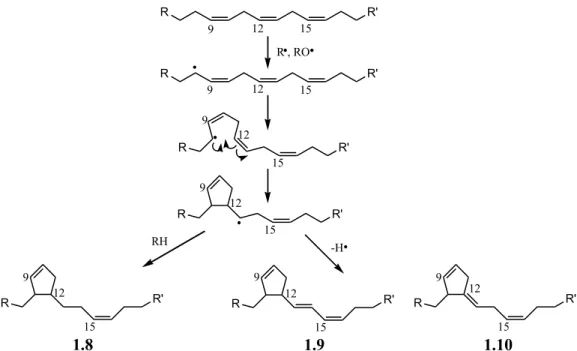
La présence des MCAG dans les huiles après un traitement thermique a bien été confirmée et leurs structures sont bien connues. Toutefois, leur mécanisme de formation n’a été que suggéré et reste encore hypothétique. Jusqu’à présent, trois voies possibles ont été présentées dans la littérature. La première suggère une cyclisation concertée (Gast, et al., 1963), la seconde, une réaction radicalaire (Christie et Dobson, 2000) et la dernière est une réaction de cycloaddition combinée à une migration prototropique [1,6] (Destaillats et Angers, 2005).
1.4.4.1 Formation des MCAG par cyclisation concertée
Le premier mécanisme à avoir été suggéré proposait un mécanisme de cyclisation concerté pour l’AAL (Figure 1.10) (Gast, et al., 1963). Une fermeture d’un cycle à cinq
0,0 3,0 6,0 9,0 12,0 15,0 0 2 4 6 8 T en eu r (% ) Temps de chauffage (h) A B C D
23 carbones entre les carbones 9 et 13 a donc lieu dû à un transfert d’un atome d’hydrogène. La migration d’une double liaison se produit en même temps.
HOOC H 9 13 Encombrement Stérique HOOC 9 13 H HOOC H 9 13 Acide -linolénique
(9-cis, 12-cis, 15-cis)
Acide -linolénique (9-trans, 12-trans, 15-cis)
1.5
1.6
1.7
Figure 1.10 : Formation des MCAG à partir de l’AAL par la cyclisation concertée (adapté
de (Destaillats et Angers, 2005, Gast, et al., 1963)).
Toutefois, ce mécanisme n’explique pas la formation de MCAG à partir d’acide gras monoinsaturé, comme l’acide oléique. De plus, la conformation tous-cis engendre un encombrement stérique qui pourrait limiter la formation du monomère cyclique. Le mécanisme n’explique la formation de cycle qu’entre les carbones 9 et 13, cet structure ne correspondant à aucune de celle qui a précédemment été identifiée (Christie et Dobson, 2000, Dobson, et al., 1996a, Mossoba, et al., 1995).
1.4.4.2 Formation des MCAG passant par un intermédiaire radicalaire
Dans cette optique, un mécanisme impliquant un intermédiaire radicalaire (Figure
1.11) a été proposé (Dobson, et al., 1996b). Ce mécanisme consiste en l’abstraction d’un
hydrogène allylique, formant ainsi l’intermédiaire radicalaire. La fermeture du cycle a ensuite lieu via le carbone radicalaire d’une double liaison. Le MCAG ainsi formé doit alors soit acquérir ou perdre un hydrogène radicalaire afin de retrouver un état stable.
24 R R' R , RO 9 12 15 R R' 9 12 15 R 9 12 15 R R' R' 9 12 15 R 9 12 15 R' R 9 12 15 R' R 9 12 15 R' RH 1.8 1.9 1.10 -H
Figure 1.11 : Formation des MCAG à partir d’un AGPI par la voie radicalaire (adapté de
(Destaillats et Angers, 2005, Dobson, et al., 1996b)).
Ce mécanisme permet effectivement d’obtenir tous les isomères des MCAG, autant avec un cycle à cinq qu’à six carbones. Toutefois, si le MCAG radicalaire perd un hydrogène radicalaire, une nouvelle double liaison sera formée. Des produits qui n’ont jamais été identifiés (1.9 et 1.10) seront alors obtenus.
1.4.4.3 Formation des MCAG par cycloaddition intramoléculaire suivi d’une migration prototropique [1,6]
L’hypothèse la plus récente suggère que les MCAG se formeraient d’abord selon une cycloaddition intramoléculaire (Figure 1.12) (Destaillats et Angers, 2005). Ce mécanisme permettrait la formation dans un premier temps des cycles à cinq carbones. Une configuration cis de la double liaison entre les carbones 12 et 13 des AG de départ (1.14) est requise pour que la cyclisation est lieu. Si ce n’est pas le cas, une tension de cycle trop importante empêchera le cycle de se former.
25 C C C H C C C H C C C H H R2 R1 H R2 R1
( )n ( )n ( )n n = 1, 2 1.11 1.12 1.13 1.14 1.15Figure 1.12 : Mécanisme général de formation des MCAG par cycloaddition
intramoléculaire.
Une migration prototropique [1,6] conduirait par la suite à la formation des MCAG à six carbones (Figure 1.13). Le dernier réarrangement s’accompagne du déplacement d’une double liaison, soit du carbone 15 au 16 (1.20) ou du 9 au 8 (1.21). Ce mécanisme peut donc expliquer la cyclisation des AG mono-, di- et polyinsaturés. Il a également l’avantage de se limiter à la formation des seize isomères observés de MCAG pour l’AAL dans les huiles de friture (Dobson, et al., 1996b).
HOOC(H2C)7 CH3 H 9 12 1415 HOOC(H 2C)7 H CH3 9 15 14 12 HOOC(H2C)7 CH3 H 9 12 1516 10 14 10 HOOC(H2C)6 H CH3 9 12 15 HOOC(H2C)6 H CH3 9 15 12 10 HOOC(H2C)6 H CH3 9 10 15 12 11 1.16 1.18 1.20 1.17 1.19 1.21
Figure 1.13 : Formation des MCAG à partir de l’AAL selon un réarrangement
sigmatropique [1,5] (adapté de (Destaillats et Angers, 2005)).
La synthèse d’un AG marqué au deutérium semble donc être un choix judicieux pour vérifier l’implication du réarrangement sigmatropique [1,5] dans la formation des MCAG. Le remplacement d’un des atomes d’hydrogène impliqués dans ce réarrangement, soit celui sur les carbones 14 ou 11, par un atome marqueur, permettra d’élucider le mécanisme de formation. Comme il s’agit d’un mécanisme en deux étapes, l’AG qui sera
26
synthétisé devra permettre de maximiser la formation des produits primaires, soir les MCAG possédant un cycle à cinq carbones.
Ainsi, la friture induit différentes dégradations des AG. En présence d’oxygène, l’oxydation sera la réaction principale. Celle-ci formera, entre autres, des peroxydes, des hydroperoxydes et des radicaux libres. Des antioxydants peuvent être utilisés pour ralentir l’oxydation. Ceux qui sont utilisés actuellement sont de nature synthétique et sont potentiellement cancérigènes. Des antioxydants naturels, provenant d’acides phénoliques, seraient une alternative à envisager. Toutefois, ces acides, dus à leur polarité, sont hydrophile. L’ajout d’une chaîne lipophile sur les acides pourrait donc permettre d’augmenter leur solubilité dans les huiles, et ainsi leur permettre d’être testé comme antioxydant. D’un autre côté, la chaleur transformera les AG en polymère et en MCAG. Ces derniers ont bien été identifiés dans les huiles de friture et leurs structures sont donc bien connues. Toutefois, leur mécanisme de formation n’est encore qu’hypothétique. La synthèse d’un isomère de l’AAL marqué à un endroit stratégique pourrait permettre d’élucider le mécanisme.
27
Hypothèse et Objectifs
Hypothèse
D’un côté, l’oxydation des acides gras contribue à former des produits nuisibles pour la santé. Des antioxydants peuvent être utilisés pour ralentir cette réaction. Les antioxydants naturels sont toutefois trop hydrophiles et volatiles pour être utilisés dans les huiles de friture. L’ajout d’une chaîne hydrophobe sur certains acides phénoliques permettrait d’augmenter leur solubilité dans les lipides, tout en diminuant leurs volatilités. Cela permettrait donc d’obtenir un meilleur effet antioxydant de ces molécules. D’un autre côté, les hautes températures utilisé en friture engendrent la formation de MCAG. Ces monomères ont bien été identifiés, mais leur mécanisme de formation est encore hypothétique. Nous croyons qu’ils sont formés par une cycloaddition suivi d’une migration prototropique [1,6]. La synthèse d’un isomère de l’AAL marqué d’atomes de deutérium sur le carbone 14 pourrait permettre de démontrer le mécanisme de formation des MCAG.
Objectifs généraux
Synthétiser des dérivés d’acides phénoliques et testés leur efficacité antioxydante dans l’huile de Canola et en conditions de friture.
Synthétiser un isomère de l’AAL marqué d’atomes de deutérium sur le carbone 14 et effectuer des traitements thermiques afin de cycliser l’AAL tout en suivant le déplacement des atomes marqueurs.