THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS (Faculté de Médecine et Pharmacie) (Diplôme National - Arrêté du 7 août 2006) Ecole Doctorale : BioSanté N°524
Champs disciplinaires : Biologie, Médecine, Santé
Secteur de Recherche : Recherche clinique, innovation thérapeutique, santé publique Présentée par :
Yoann Sottejeau
************************
DEVENIR DE LA NA+, K+-ATPASE DANS L'ISCHEMIE REPERFUSION CARDIAQUE
(De sa régulation aux compléments alimentaires) ************************
Directeur de Thèse : Jean Michel Maixent Codirecteur de Thèse:
Sandrine Pierre Ghislaine Gerber ************************
Soutenue le 12 Décembre 2011 Devant la Commission d’Examen
************************
JURY
Jean-François Faivre Université de Poitiers Président
Monique Bernard CRMBM / CNRS UMR 6612 Rapporteur
Thomas A. Pressley University of Texas Tech Rapporteur
Remerciements
Remerciements
Je tiens à remercier chaleureusement mes co-directeurs de thèse : - le Pr Jean-Michel Maixent qui m'a soutenu, conseillé durant ces quatre ans de thèse et qui en 2003 m'a fait traverser l'Atlantique direction Toledo.
- le Dr Sandrine Pierre qui m'a accueilli, encadré et m'a fait évoluer dans mon approche scientifique.
- Mme Ghislaine Gerber pour m'avoir permis de continuer cette aventure américaine, pour la confiance qu'elle m'a accordée pour mener à bien le projet scientifique d'Holistica et de m'avoir fait découvrir la recherche en entreprise.
Je souhaite adresser mes plus vifs remerciements au Pr Amir Askari, chairman du département de "Physiology, Pharmacology, Metabolism, and Cardiovascular Sciences" de l'University of Toledo (USA) pour m'avoir accueilli au sein de son département au début de ma thèse et à son remplaçant le Pr Nader Abraham; au Pr Gérard Mauco, directeur de l'unité INSERM U927 pour m'avoir accueilli au sein du laboratoire à Poitiers.
J'adresse de profonds remerciements au Pr Zijian Xie pour son soutien, ses explications, ses conseils éclairés ainsi que pour ses questions pertinentes au labmeeting.
Je tiens tout particulièrement à remercier le Dr Thomas Pressley (University de Texas Tech) et le Dr Gustavo Blanco (University of Kansas) et le Dr Peter Lauf (Wright State University) avec qui j'ai pu collaborer durant ce stage, le Dr David Giovannucci, le Dr Andrea Kalinoski pour leurs aides précieuses et conseils sur l'utilisation du microscope confocale, le Pr Andrew Beavis pour m'avoir intégré aux activités de l'école doctorale de l'University of Toledo et encouragé à présenter chaque année au Pharmacology Research Colloquium, le Dr Guillermo Vasquez pour m'avoir permis d'utiliser son laboratoire pour la culture cellulaire et le Dr Daniel Marc pour m'avoir fait prendre goût à la recherche scientifique.
Je voudrais remercier également mes partenaires institutionnels publiques : l'école doctorale Biosanté de l'Université de Poitiers, le Ministère de l'Education Nationale de l'Enseignement Supérieur et de la Recherche, l' ANRT ainsi que l'entreprise Holistica pour leur participation dans mon financement CIFRE.
Je remercie les membres du laboratoire du Dr Pierre, ceux du Pr Xie et Pr Askari pour leur soutien permanent et leurs nombreux conseils plus particulièrement Qiming Duan, Jiang Tian, Luis Quintas, Eric Morgan, Liu Lijun, Margie et Mano.
Je remercie mes collègues du laboratoire du Pr Maixent, Mathieu Chaillou, Phillipe Rigouard, Mourad Fares, Céline François, Emmanuelle Jolivet, Stéphane Sardrin pour les conversations constructives que j'ai eu avec eux lors de mes venues à Poitiers, ainsi que les salariés d'Holistica avec qui j'ai pu échanger.
Je voudrais exprimer ma profonde reconnaissance à Martha Heck, Karen Edwards, Marianne Miller Jasper, Debra Lebarr, Anita Easterly et Elizabeth Akeman du secrétariat du département de "Physiology, Pharmacology, Metabolism, and Cardiovascular Sciences" de l'University of Toledo pour l'aide apportée pendant ses quatre années sans qui rien n'aurait été possible.
Je remercie Amit Patel, Susan Salari, Karen Judd, Paula Kinoshita et Bernard Wang pour leur patience, leur écoute lorsque je les ai formé au laboratoire et pour les travaux que nous avons réalisés ensemble.
Un grand merci et une pensée pour mes amis de l'University of Toledo : Lucas, Jean-Yves, Angela, Danny, MJ, Brian, Bernard, Joae, Nitin, Kathy, Jihad, Lisa, Rudel, Maria qui ont facilité mon intégration et permis de passer dans la joie et la bonne humeur les rudes hivers de l'Ohio ainsi qu'au Dr Manning et à toute l'équipe de football de l'Université de Toledo pour ses parties endiablées.
Remerciements Je remercie du fond du cœur :
Aude, ma compagne, ma collègue : Merci pour ces formidables années américaines
passées au laboratoire et dans la vie de tous les jours ainsi que pour nos futurs projets.
Jan et Erika Rizzo, ma famille américaine : Merci pour les cours d'anglais, les
leçons de golf, les théories de Lost et vos invitations de Thanksgiving et 4th of July.
A ma famille, mes parents et mon frère : Merci de votre soutien, de votre écoute, de
Publications et Communications
Articles publiés :
Chaillou M, Rigoard P, Fares M, François C, Sottejeau Y, Maixent JM., Relation between Į-isoform and phosphatase activity of Na+,K+-ATPase in rat skeletal muscle fiber types., Cell Mol Biol (Noisy-le-grand). 2011 Jul 25;57 Suppl:OL1520-7. (Annexe)
Pierre SV, Belliard A, Sottejeau Y., ."Modulation of Na+, K+-ATPase cell surface abundance through structural determinants on the {alpha}1-subunit", Am J Physiol Cell Physiol. 2011 Jan;300(1):C42-8. (Résultats)
Sottejeau Y, Patel AM, Gerber G, Pierre SV, Maixent JM., Effect of a novel Omegacoeur®/Doluperine® nutritional combination on human embryonic kidney cell viability., Cell Mol Biol (Noisy-le-grand). 2010 Oct 5;56 Suppl:OL1400-9. (Résultats)
Sottejeau Y, Belliard A, Duran MJ, Pressley TA, Pierre SV., Critical role of the isoform-specific region in alpha1-Na,K-ATPase trafficking and protein Kinase C-dependent regulation., Biochemistry. 2010 May 4;49(17):3602-10. (Résultats)
Rigoard P, Chaillou M, Fares M, Sottejeau Y, Giot JP, Honfo-Ga C, Rohan J, Lapierre F, Maixent JM., [Energetic applications: Na+/K+-ATPase and neuromuscular transmission], Neurochirurgie. 2009 Mar;55 Suppl 1:S92-103. (Annexe)
Pierre SV, Sottejeau Y, Gourbeau JM, Sánchez G, Shidyak A, Blanco G., Isoform specificity of Na-K-ATPase-mediated ouabain signaling., Am J Physiol Renal Physiol. 2008 Apr;294(4). (Résultats)
Communication affichées :
Sottejeau Y, Belliard A, Pierre SV, Modulation of Na/K-ATPase surface abundance during ischemia/reperfusion injury in rat cardiac myocytes Présenté durant les événements suivants :
- Experimemtal Biology 2011, Washington D.C., USA. 9-13 Avril 2011 - Printemps de la cardiologie 2011, Lyon, France, 12-14 mai 2011
Sottejeau Y, Patel AM, Gerber G, Pierre SV, Maixent JM., Effect of a novel Omegacoeur®/Doluperine® nutritional combination on human embryonic kidney cell viability. Présenté à l' Experimemtal Biology 2011, Washington D.C., USA. 9-13 Avril 2011
Sottejeau Y, Belliard A, Pierre SV., Na+, K+-ATPase alteration by
ischemia/reperfusion Injury. Présenté durant les événements suivants :
- Inaugural Student Research Forum, Toledo, Ohio, USA. 17 Juin 2010 - 37th Pharmacology Research Colloquium, Lansing, Michigan, USA. 25 Juin 2010 - Ohio Physiology Society meeting, Cleveland, Ohio, USA. 14-15 Octobre 2010
Sottejeau Y, Belliard A, Patel AM., Morgan EE., Pierre SV. Ouabain protects
cardiac Na+, K+-ATPase during Ischemia/Reperfusion Injury. Présenté à l’University
of Toledo Medical Center Graduate Forum 2010, Toledo, Ohio, USA. 30-31 Mars 2010
Sottejeau Y, Morgan EE., Belliard A, Stebal C, Pierre SV. Ouabain Pre and
Post-conditioning protects cardiac function and Na,K ATPase against Ischemia/Reperfusion injury. Présenté au 36th Pharmacology Research Colloquium, Detroit, Michigan, USA. 19 Juin 2009
Publications et Communications
Sottejeau Y, Pierre SV, Duran MJ, Carr DL, Pressley TA, , The last residue of the
Na,K-ATPase catalytic subunit isoform specific region (ISR) plays a critical role in Na,K-ATPase membrane trafficking. Présenté durant les événements suivants :
- University of Toledo Medical Center Graduate Forum 2008, Toledo, Ohio, USA. 2-3 Avril 2008
- Experimemtal Biology 2008, San Diego, California, USA. 5-9 Avril 2008 (non présent, présenté par Dr Pierre)
Table des matières
Remerciements ... 2
Publications et Communications... 5
Articles publiés : ... 6
Communication affichées :... 7
Table des matières... 9
Table des illustrations ... 14
Liste des figures ... 14
Liste des tableaux... 15
Abréviations ... 16
Introduction ... 20
I Physiologie et Pathophysiologie cardiaque, traitement et prévention ... 21
1 Physiologie du cœur ... 21
2 Maladies cardiovasculaires ... 24
a L'infarctus du myocarde ... 25
i Définition ... 25
ii Symptômes et dépistage ... 27
iii Facteurs de risques ... 30
b L'insuffisance cardiaque... 33 i Définition ... 33 ii Symptômes et dépistage ... 33 3 Traitements cliniques ... 35 a L'infarctus du myocarde ... 35 b L'insuffisance cardiaque... 37
c Approche du complément alimentaire ... 38
4 Phénomène de l’ischémie/reperfusion ... 38
a D’un niveau organique ... 38
b Du niveau de la cellule... 39
5 Recherche préclinique sur ischémie/reperfusion ... 41
a Modèle utilisé... 41 i in vitro ... 42 ii ex vivo ... 44 iii in vivo... 45 b Protection ... 46 i Preconditioning ... 46 ii Perconditioning ... 49 iii Postconditioning... 49 II Na+, K+-ATPase ... 51 1 Famille et Structure ... 51 a Sous-unités et Isoformes ... 52 i Sous-unité Į... 52 ii Sous-unité ȕ... 53 iii Sous-unité Ȗ ... 55 2 Fonction / Régulation... 55 a Echangeur d’ions... 56
i Participation au maintien du potentiel de membrane et de l'excitabilité des cellules nerveuses et musculaires... 56
ii Régulation de la balance osmotique et du volume cellulaire... 56
b Fonction de signalisation... 58
i Mécanisme réactionnel... 58
ii Régulation des fonctions cellulaires... 60
iii Interaction Na+, K+-ATPase et Src... 60
iv "Pumping pool" et "Non-pumping pool" de la Na+, K+-ATPase ... 61
v Spécificité liée aux isoformes ... 62
c Ligand spécifique de la Na+, K+-ATPase, les stéroïdes cardiotoniques... 62
d Régulation de la Na+, K+-ATPase par les PKC... 63
i Rôle des PKC ... 63
ii La famille des PKC et leurs structures... 64
iii Action du diacylglycérol et des phorbol ester sur les PKC... 64
iv Régulation des isoformes Į de la Na+, K+-ATPase par les PKC... 65
v Rôle de la partie N terminale de l' Į1 dans la régulation de la Na+, K+-ATPase par les PKC... 65
vi Rôle de la diversité de l'ISR dans la régulation de la Na+, K+-ATPase par les PKC 66 e Muscle cardiaque et Na+, K+-ATPase ... 66
i Muscle cardiaque ... 66
ii Durant ischémie/reperfusion cardiaque... 67
iii Durant la protection (ouabaïne preconditioning) ... 67
III Application en Nutrition ... 69
1 Le complément alimentaire et la réglementation européenne... 69
a Allégation santé... 70
i dans le domaine cardiovasculaire... 71
2 Régime méditerranéen... 71 3 Omégacoeur® ... 72 a ȍ 3... 73 b ȍ 6... 75 c ȍ 9... 76 d Basilic... 77 e Ail... 77 4 Régime ayuvédique ... 77 5 Dolupérine®... 77 a Curcuma ... 78 b Poivre ... 78 c Gingembre... 78
6 Incidence de ces régimes sur les maladies cardiovasculaires ... 79
a Régime méditerranéen... 79 i ȍ 3... 79 ii ȍ 6... 81 iii ȍ 9... 81 iv Basilic... 81 v Ail... 81 b Régime ayuverdique... 82 i Curcuma ... 82 ii Poivre ... 82 iii Gingembre... 82
7 Incidence de ces régimes sur la Na+, K+-ATPase ... 82
a Régime méditerranéen... 83
Table des matières
Problématiques et Objectifs ... 85
I Différence des isoformes Į de la Na+, K+-ATPase ... 86
II Caractérisation de la Na+, K+-ATPase durant ischémie/reperfusion cardiaque ... 86
III Effets cardiovasculaires de l'association des composés Omégacoeur® et Dolupérine® 87 Matériels et Méthodes ... 88
I Culture Cellulaire ... 89
1 Lignée de rein d’opossum : OK ... 89
2 Lignée de rein de porc : LLC-PK1 et ses lignées modifiées PY17 et AAC19 ... 89
3 Lignée embryonnaire de rein humain : HEK 293 ... 89
4 Conditions de culture des lignées cellulaires ... 90
5 Cellules primaires de myocytes cardiaques néonataux de rats sains ... 90
II La transfection... 91
1 Création de lignées stables ... 91
2 Transfection transitoire par lipofection... 92
III Induction de l’ischémie/reperfusion... 92
1 Technique ... 92
2 Protocole... 93
IV Mesure du transport ionique et de l’activité enzymatique de la Na K ATPase ... 94
1 Mesure du transport ionique : assimilation du Rubidium ... 94
2 Mesure de l’activité enzymatique totale ... 95
V L’immunodétection ... 96
1 Extraction des protéines totales... 96
2 Western-Blot ... 96
3 Immunofluorescence indirecte ... 97
VI Technique de biotynilation... 98
1 Mesure des protéines membranaires ... 98
2 Mesure des protéines endocytées ... 98
VII Mesure de viabilité cellulaire ... 99
1 Test de viabilité : coloration au bleu de trypan... 99
a Principe... 99
b Technique ... 99
2 Test de cytotoxicité cellulaire : mesure du relâchement de LDH ... 100
a Principe... 100
b Technique ... 100
3 Mesure de la mort cellulaire : marquage Annexin V / Propidium Iodide... 101
a Principe... 101
b Technique ... 101
VIII La microscopie à lumière transmise... 102
IX La microscopie confocale... 102
X Association des solutions Omégacoeur® et Dolupérine®... 102
1 Choix des doses... 102
2 Préparation des solutions Omégacoeur® et Dolupérine® ... 103
XI Analyse statistiques des données ... 103
Résultats ... 104
I Etude de la fonction de signalisation des isoformes de la Na+, K+-ATPase ... 105
1 Article : Pierre SV, Sottejeau Y, Gourbeau JM, Sánchez G, Shidyak A, Blanco G., Isoform specificity of Na-K-ATPase-mediated ouabain signaling., Am J Physiol Renal Physiol. 2008 Apr;294(4):F859-66.. ... 105
II Etude de la Na+, K+-ATPase dans des cellules rénales ... 115
1 rôle de la Na+, K+-ATPase "Isoform Specific Region"... 115
a Article : Sottejeau Y, Belliard A, Duran MJ, Pressley TA, Pierre SV., Critical role of the isoform-specific region in alpha1-Na,K-ATPase trafficking and protein Kinase C-dependent regulation., Biochemistry. 2010 May 4;49(17):3602-10... 115
2 lors de l’ischémie reperfusion ... 126
a Article : Pierre SV, Belliard A, Sottejeau Y., Modulation of Na(+)-K(+)-ATPase cell surface abundance through structural determinants on the Į1-subunit., Am J Physiol Cell Physiol. 2011 Jan;300(1):C42-8... 126
III Etude de la Na+, K+-ATPase lors de ischémie reperfusion dans les cellules cardiaques 135 1 Données supplémentaires... 135
IV Etude de la toxicité de l'association des composés Omégacoeur® et Dolupérine® dans des cellules humaines... 160
V Protocole d'essai clinique de l'association composés Omégacoeur® et Dolupérine® dans une protection cardiovasculaire ... 171
Discussion et Perspectives ... 177
I Na+, K+-ATPase, signalisation et IR ... 178
II Na+, K+-ATPase, endocytose et IR ... 181
III Effets cardiovasculaires de l'association des composés Omégacoeur® et Dolupérine® 185 Conclusion... 188
Références Bibliographiques ... 191
Annexes... 220
Publication non présenté : Rigoard P, Chaillou M, Fares M, Sottejeau Y, Giot JP, Honfo-Ga C, Rohan J, Lapierre F, Maixent JM., [Energetic applications: Na+/K+-ATPase and neuromuscular transmission], Neurochirurgie. 2009 Mar;55 Suppl 1:S92-103. ... 221
Publication non présenté : Chaillou M, Rigoard P, Fares M, Francois C, Sottejeau Y, Maixent JM., Relation between Į-isoform and phosphatase activity of Na+,K+-ATPase in rat skeletal muscle fiber types., Cell Mol Biol (Noisy-le-grand). 2011 Jul 25;57 Suppl:OL1520-7... 234
Table des matières
Table des illustrations
Liste des figuresFigure 1 Représentation schématique de l’anatomie du cœur ... 22
Figure 2 Représentation schématique du tissu nodal ... 23
Figure 3 Représentation schématique de la paroi cardiaque... 23
Figure 4 Représentation schématique de l'infarctus du myocarde ... 26
Figure 5 Représentation d'une onde d'ECG normal ... 28
Figure 6 Détection des principaux biomarqueurs de l’IDM adapté de [14] ... 30
Figure 7 Hospitalisations en soins de courte durée pour cardiopathie ischémique selon l’âge en 2006 d'après [17] ... 31
Figure 8 Mise en place d'un stent... 36
Figure 9 Induction de la mort cellulaire par l'ischémie/reperfusion adaptée de [52]... 41
Figure 10 Reproduction des zones ischémiques par la technique de "Coverslip Hypoxia" .... 43
Figure 11 Représentation schématique d'un système de cœur isolé perfusé... 45
Figure 12 Mécanisme de protection du Preconditioning ... 48
Figure 13 Mécanisme de protection du Postconditioning... 50
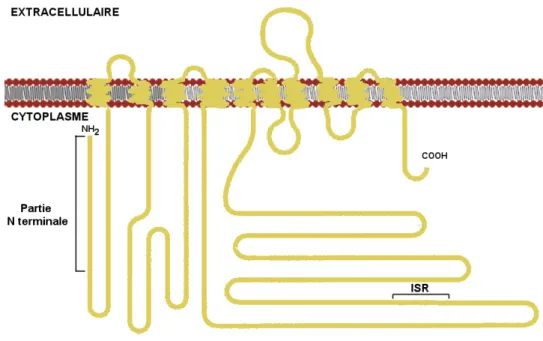
Figure 14 Structure primaire de la sous-unité Į de la Na+, K+-ATPase... 52
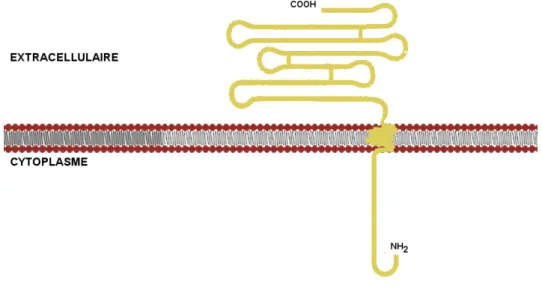
Figure 15 Structure primaire de la sous-unité ȕ de la Na+, K+-ATPase... 54
Figure 16 Structure primaire de la sous-unité Ȗ de la Na+, K+-ATPase ... 55
Figure 17 Fonction d'échangeur d’ions de Na+, K+-ATPase... 56
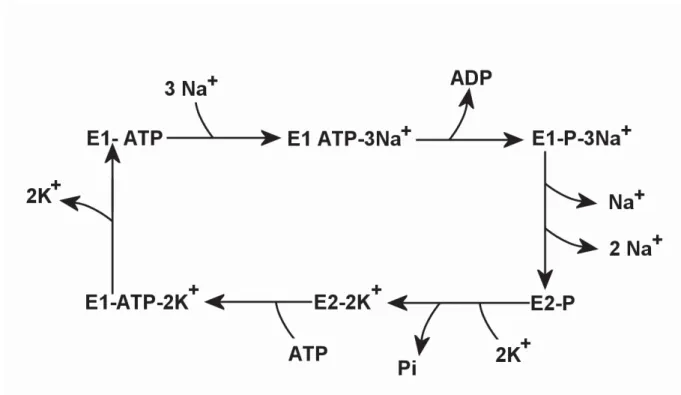
Figure 18 Cycle réactionnel de la Na+, K+-ATPase dit cycle de Post-Albers... 58
Figure 19 Fonction de signalisation de la Na+, K+-ATPase... 59
Figure 20 Représentation schématique des six de domaines de Src ... 61
Figure 21 Structure chimique des molécules d'ouabaïne, digoxine et marinobufagénine ... 63
Figure 22 Structure des différentes PKC adaptée de [153]... 64
Figure 23 Différence de séquences de l' ISR des isoformes Į de la Na+, K+-ATPase ... 66
Figure 24 Base du régime méditerranéen adapté de [180]... 72
Figure 25 Formule chimique des principaux acides gras du groupe Ȧ-3... 74
Figure 26 Synthèse des acides gras du groupe Ȧ-3... 74
Figure 27 Synthèse des acides gras du groupe Ȧ-6... 76
Figure 28 Représentation schématique du positionnement des lamelles de verres pour la technique de "Substrate and Coverslip hypoxia" ... 92
Figure 29 Protocole d'ischémie/reperfusion... 94
Figure 30 Réaction chimique intervenant lors du dosage de la lactate déshydrogénase (LDH) ... 100
Figure 31 Détection par Western Blot des sous-unités Į1 et Į2 de la Na+, K+-ATPase sur différentes lignées cellulaires. Résultat représentatif de 3 expériences indépendantes sur 3 lignées cellulaires PY-17, AAC 19 et PY17- Į2 pour la détection des isorformes Į1 et Į2 de la Na+, K+-ATPase ... 115
Figure 32 Localisation cellulaire de la Na+, K+-ATPase Į1 durant la reperfusion... 159
Figure 33 Théorie du signalosome adaptée de [293] ... 180
Liste des tableaux
Tableau 1 Classification fonctionnelle de l'insuffisance cardiaque basée sur l'activité physique et les symptômes selon les recommandations du NYHA d'après [23]... 34 Tableau 2 Evaluation des concentrations intracellulaire de différents paramètres cellulaires
pendant l'ischémie reperfusion d'après [48] ... 40 Tableau 3 Techniques d'étude spécifique en fonction du modèle d'ischémie reperfusion... 42 Tableau 4 Recommandation de différentes organisations pour la prévention de risques
cardiovasculaire d'après [191, 207, 260]... 80 Tableau 5 Spécificités et caractéristiques des anticorps utilisés lors des Western Blot ... 97
AA : acide arachidonique
AGPI : acide gras polyinsaturés
AJR : apport journalier recommandé
ALA : acide Į-linolénique
AVC : accident vasculaire cérébral
BNP : Brain natriuretic peptide
BSA : Bovine Serum Albumin, sérum d'albumine bovine
DAG : diacylglycérol Cl- : chlorides CMN : cardiomyocytes néonataux COX 2 : cyclooxygénase 2 CPK : Créatine PhosphoKinase CRP : C-reactive protein
DHA : acide docosahexaénoïque
DMEM : Dulbecco's modified Eagle medium
ECG : électrocardiogramme
EFSA : European Food Safety Authority, l’Autorité européenne de sécurité des aliments
EGFR : Epidermal Growth Factor Receptor
EPA : acide eicosapentaénoïque
ERK ½ : Extracellular-signal-regulated kinase ½
Abréviations Grb2 : Growth factor receptor-bound protein 2
HEK293 : Human Embryonic Kidney cells
IC : insuffisance cardiaque
IDM : infarctus du myocarde
ISR : "Isoform Specific Region"
IR : ischémie/reperfusion
JAK : Janus Kinase
KATP : canaux potassiques dépendants de l'ATP
KH : Krebs-Henseleit
LA : acide linoléique
LDH : lactate déshydrogénase
LDL : Lipoprotéine de basse densité (Low Density Lipoprotein)
LLC-PK1: cellules de rein de porc
LVDP : pression développée du ventricule gauche
MAPK : mitogen-activated protein kinase
MP : matrice métalloprotéinase
MPTP : pore de transition de perméabilité mitochondriale
NCX : échangeur sodium/calcium
NHE : échangeur sodium/proton
NT-proBNP : N-terminal pro–brain natriuretic peptide
OPC : Ouabaïne Preconditioning
PDK1 : phosphoinositidedependent kinase-1
PI3K : phosphatidylinositol 3-kinase
PKA : protéine Kinase A
PKC : protéine Kinase C
PLC : phospholipase C
PMA : phorbol ester, phorbol 12- myristate 13 acétate
RISK : Reperfusion Injury Salvage Kinase
ROS :Reactive oxygen species
SAFE : Survivor Activating Factor Enhancement
SERCA : reticulum sarcoplasmique
SHC : src homology collagen like
SOS : son of sevenless
STAT-3 : signal transducer and activator of transcription 3
SVF : sérum de veau fœtal
TCEP : tris(2-carboxyethyl)phosphine hydrochloride
TNF Į : Tumor necrosis factor Į
I Physiologie et Pathophysiologie cardiaque, traitement et prévention
1 Physiologie du cœurLe cœur est un organe musculeux creux. Il est situé dans la partie médiane gauche du thorax. Il assure la circulation sanguine dans le corps grâce à ses contractions régulées par le système nerveux autonome. Cette fonction permet de maintenir en adéquation l'apport et les besoins en oxygène de l'organisme. Il est composé de quatre cavités soit deux oreillettes et deux ventricules respectivement droits et gauches. Les oreillettes sont séparées par le septum inter-auriculaire et les ventricules par le septum interventriculaire.
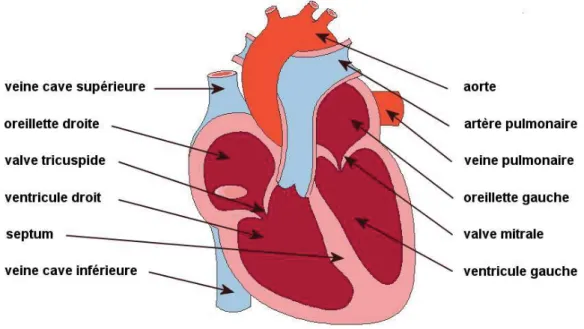
D'un point de vue physiologique, le sang appauvri en oxygène après son passage dans l'organisme arrive dans l'oreillette droite par les veines caves inférieure et supérieure. Le sang est alors reversé via la valvule tricuspide dans le ventricule droit. Celui-ci propulse le sang désoxygéné via la valvule pulmonaire par l'artère pulmonaire jusqu'au poumon (petite circulation). Après enrichissement en oxygène dans les poumons, le sang retourne au cœur par les veines pulmonaires dans l'oreillette gauche. Le sang est alors reversé via la valvule mitrale dans le ventricule gauche. Celui-ci propulse le sang oxygéné via la valvule aortique par l'aorte et ses branches, dans tout l'organisme (grande circulation). (Figure 1)
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention
Figure 1 Représentation schématique de l’anatomie du cœur
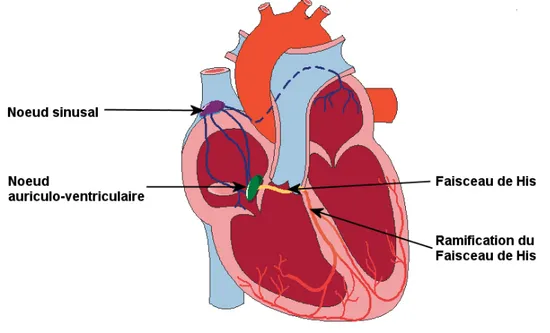
Les contractions du cœur sont engendrées et se propagent grâce au tissu nodal. Celui-ci comprend le nœud sinusal situé dans la l'oreillette droite qui commande la fréquence cardiaque, et le nœud auriculo-ventriculaire, placé à la jonction des oreillettes et des ventricules et prolongé vers les deux ventricules par le faisceau de His et ses ramifications, qui permettent le passage de l'influx vers les ventricules. Le fonctionnement du tissu nodal est influencé par le système nerveux végétatif et par les catécholamines. Les différentes phases de la contraction cardiaque sont nommées systoles auriculaire et ventriculaire, correspondant respectivement à la contraction des oreillettes et des ventricules. Chaque phase de contraction est suivie d’une phase de relaxation cardiaque appelée diastole. (Figure 2)
Figure 2 Représentation schématique du tissu nodal
D'un point de vue musculaire, la paroi cardiaque, ou muscle cardiaque est composée de trois épaisseurs : l'endocarde, le myocarde et le péricarde. Chaque épaisseur a une fonction propre. (Figure 3)
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention L'endocarde est composé essentiellement de cellules endothéliales qui tapissent la paroi interne du cœur. Cette membrane interne se trouve directement au contact de l'intima de l'aorte et des veines caves supérieure et inférieure. Elle participe à la régulation de la contraction cardiaque via l'activation hormonale endocrine des cardiomyocytes [1].
Le myocarde est le muscle cardiaque en lui-même. C'est un muscle strié capable d'une contraction régulière autonome. Il est sensible aux stimulations hormonales et neuronales [1]. D'un point de vue cellulaire, il est composé de cardiomyocytes (30 à 40% représentant 75% du volume du myocarde), de cellules endothéliales, de cellules musculaires lisses et de fibroblastes [1].
Le péricarde est l'enveloppe du cœur. Ce tissu fibreux est composé de deux couches : une couche fibreuse externe reliant le cœur aux organes environnants tels que les poumons et une couche séreuse interne maintenant la structure du cœur et des vaisseaux avoisinant tels que l'aorte et les veines caves. Le péricarde interne est constitué de deux feuillets (le péricarde viscéral ou épicarde qui adhère directement ou myocarde et le péricarde pariétal) qui sont séparés par l'espace inter-péricardique. Ce dernier est une cavité virtuelle contenant physiologiquement 50 à 70 millimètres de liquide péricardique lui permettant d'assurer une meilleure fluidité des mouvements cardiaques.
2 Maladies cardiovasculaires
Selon l'Organisation Mondiale de la Santé (OMS), les maladies cardiovasculaires sont la première cause de mortalité dans le monde. Les statistiques en 2009 estiment que les maladies cardiovasculaires occupent 29% de la mortalité mondiale totale. D'après les projections, ces maladies devraient rester les premières causes de décès en 2020 [2].
Les maladies cardiovasculaires se définissent par l'ensemble des troubles affectant le cœur et les vaisseaux sanguins comprenant :
- les cardiopathies coronariennes (touchant les vaisseaux sanguins qui alimentent le muscle cardiaque) comprenant l'angor (ou angine de poitrine) et infarctus du myocarde
- les maladies cérébro-vasculaires (touchant les vaisseaux sanguins qui alimentent le cerveau) comprenant les accidents vasculaires cérébraux (AVC)
- les cardiopathies rhumatismales, affectant le muscle et les valves cardiaques et résultant d’un rhumatisme articulaire aigu, causé par une bactérie streptocoque
- les malformations cardiaques congénitales (malformations de la structure du cœur déjà présentes à la naissance)
- les thromboses veineuses profondes et les embolies pulmonaires (obstruction des veines des jambes par un caillot sanguin, susceptible de se libérer et de migrer vers le cœur ou les poumons).
- les maladies du muscle cardiaque comprenant les cardiomyopathies et les insuffisances cardiaques
- les maladies des valves cardiaques comprenant les endocardites et les valvulopathies cardiaques
a L'infarctus du myocarde
i Définition
L'infarctus du myocarde (IDM) se définit par une nécrose d'une partie plus ou moins importante du myocarde consécutive à une obstruction brutale d'une artère coronaire [3]. Lors d'un infarctus du myocarde, l'irrigation d'une partie du cœur ne se fait plus. Durant cette ischémie prolongée, les cellules du myocarde privées de sang et d'oxygène meurent, libérant leurs enzymes qui détruisent le tissu environnant. Le plus souvent, l'infarctus du myocarde est une complication aiguë de l'athérosclérose coronaire par la rupture d'une plaque d'athérome sur l'artère causant son occlusion. Cette plaque athéromateuse correspond à une accumulation de lipides, de glucides, de
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention sang, de produits sanguins, de tissu fibreux et de dépôts calcaires. Elle forme un amas lipidique dans la paroi artérielle. Les lipoprotéines de basse densité (LDL), composés plasmatiques transportant le cholestérol, pénètrent et s'accumulent dans l'intima des artères. Après leur pénétration, les LDL s'oxydent et ne peuvent plus être dégradées. Les macrophages accumulent les oxy-LDL et se transforment en cellules spumeuses ce qui induit une réaction inflammatoire chronique. Enfin, les cellules musculaires lisses migrent dans l’intima des artères et constituent la chape fibreuse dont l’épaisseur est déterminante dans le phénomène de rupture de la plaque d’athérome à l’origine de l'infarctus du myocarde.
La rupture de la plaque d'athérome permet le contact du sang circulant avec le sous-endothélium pro-thrombogène ce qui aboutit à la constitution d'un thrombus occlusif. En effet le sous-endothélium est composé principalement de macromolécules synthétisées par les cellules endothéliales et les cellules musculaires lisses de l'endothélium vasculaire tel le collagène, des microfibrilles, de la fibronectine, de la thrombospondine, du facteur de Von Willebrand et des glycosaminoglycanes qui favorisent la coagulation sanguine. Le thrombus occlusif est accompagné d'une réponse inflammatoire et provoque l'ischémie myocardique et la nécrose des cardiomyocytes. (Figure 4).
ii Symptômes et dépistage
En 2000, la Société Européenne de Cardiologie et du Collège Américain de Cardiologie établissent les nouveaux critères de diagnostics [4]. Le diagnostic définitif de l'infarctus du myocarde est posé lorsque le patient présente une augmentation de biomarqueurs plasmatiques de la nécrose myocardique tels que la troponine T ou I et la fraction myocardique de la Créatine Kinase et au moins un de ses critères :
- des symptômes d'ischémie tels que des douleurs thoraciques angineuses rétrosternales en barres oppressantes irradiant dans le bras gauche et la mâchoire accompagnées de sueurs [5]. Ces symptômes typiques doivent être observés au repos, de manière prolongée et être résistants à la trinitrine qui est un puissant vasodilatateur.
- un développement pathologique de l'onde Q décelé lors de l'électrocardiogramme. (ECG)
- des troubles de l'ECG indicatifs d'ischémie par élévation ou dépression du segment ST.
- intervention sur les artères coronaires
Il faut noter que les parmi les biomarqueurs plasmatiques de la nécrose myocardique, la troponine T ou I sont les plus spécifiques et ont une meilleure sensibilité que les autres biomarqueurs [6]. L'évolution de l'infarctus du myocarde dépend de l'étendue de la nécrose cellulaire et de sa localisation. Elle dépend très largement de l'étendue de l'infarctus ; une mort subite peut survenir surtout pendant les premières heures qui suivent la crise, ce qui justifie une hospitalisation aussi rapide que possible. Des complications peuvent apparaître tel l'insuffisance cardiaque, des troubles du rythme cardiaque, une rupture d'un des deux piliers de la valvule mitrale ou, beaucoup plus rarement, la perforation de la paroi cardiaque nécrosée. Cependant, le cœur n’est pas le seul organe atteint lors d’un infarctus du myocarde important, puisque la diminution du débit cardiaque induit par cette pathologie peut avoir des conséquences néfastes sur les poumons en entraînant une congestion pulmonaire, sur les reins en induisant une insuffisance rénale ou sur le pancréas en inhibant la sécrétion d’insuline.
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention Pour la moitié des infarctus, il existe une période plus ou moins longue où le sujet souffre d'angine de poitrine (angor). Cela se définit par des crises douloureuses survenant soit à la marche, en particulier au froid et au vent, soit au repos (de préférence de nuit). Ces douleurs, qui sont des sensations de serrement, de brûlures voire de broiement sont ressenties derrière le sternum et peuvent irradier dans le bras gauche, vers la mâchoire voire dans le dos et disparaissent en deux ou trois minutes. Dans l'autre moitié des cas, l'infarctus est inaugural. Il peut se manifester par de violentes douleurs similaires à celle de l'angor de façon plus violente et plus longue. Certains infarctus ne se manifestent par aucun signe clinique, ils sont dits "méconnus" ou "ambulatoires" et sont détectés accidentellement à l'occasion d'un ECG. L'ECG est l'examen complémentaire réalisé dès l'apparition de ces symptômes (3). Celui-ci permet de poser un diagnostic préliminaire et ainsi de débuter la prise en charge thérapeutique précoce du patient [7]. Cet examen permet de mettre en évidence soit un développement pathologique de l'onde Q, soit une élévation ou dépression du segment ST. (Figure 5)
Figure 5 Représentation d'une onde d'ECG normal
Cet examen seul, est insuffisant puisque de nombreuses pathologies cardiovasculaires telles que les péricardites ou myocardites démontrent elle aussi une modification du segment ST (7). Afin d'établir un diagnostic final, la mesure des
biomarqueurs disponibles est indispensable (3). Ces biomarqueurs sont des marqueurs sériques de la nécrose myocardique comprenant la troponine I ou T, la sous-fraction MB des Créatine PhosphoKinases (CPK) et la myoglobine. Les troponines sont des filaments protéiques régulateurs de la contraction musculaire et, durant la nécrose, la majeure partie des troponines cardiaques est relâchée [8]. Ce biomarqueur est détectable dans le sérum à partir de la 4ème ou 12ème heures après infarctus (en fonction de la durée de l'ischémie) avec un taux maximal entre la 12ème et la 48ème heure [9]. Depuis la définition des nouveaux critères, le dosage de la troponine est le marqueur de référence [4, 10]. La troponine a été définie comme étant le plus sensible et le plus spécifique des biomarqueurs plasmatiques grâce à la très bonne sensibilité des dosages [9]. La quantité de troponines libérées dans le plasma semblant proportionnelle à la taille de la zone infarcie, le dosage permet d'estimer la taille de l'infarctus [11]. Bien que se soit le marqueur de référence, le taux n'est pas détectable de manière précoce [9] et son élévation peut être associée à de nombreuses conditions sans thrombose cardiaque [10]. C'est pour ces raisons et de la possibilité de faux positif, qu'il est conseillé de doser les CPK-MB l'ancien biomarqueur de référence. La sous-fraction MB des CPK augmente à partir des 4-6 ème heures après le début de la douleur et est présente pendant 24-48h [9]. Comme les troponines, ce marqueur n'est pas un marqueur précoce. La sensibilité des dosages est satisfaisante, seulement la spécificité du biomarqueur est remise en question car elle peut être détectée lors de toute souffrance musculaire [9]. Le biomarqueur de la myoglobine est utilisé comme marqueur précoce [12]. La myoglobine s'élève dès la 2ème heure et atteint son pic à la 4ème heure [9]. Ce marqueur dosé seul offre peu de spécificité pour les infarctus du myocarde notamment chez les patients souffrant de traumatisme ou d'insuffisance rénale [9].
L'intérêt de ce dosage, combiné à un marqueur plus spécifique (troponine ou CKMB), peut être utile dans un diagnostic plus précoce de l'infarctus du myocarde [13]. Le dosage de ces trois marqueurs est complémentaire et permet de détecter l'infarctus du myocarde à tout moment [14] (Figure 6).
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention
Figure 6 Détection des principaux biomarqueurs de l’IDM adapté de [14]
L'échocardiographie Doppler est la méthode non invasive de choix pour mettre en évidence l’évaluation initiale de la taille de l’IDM en milieu hospitalier (3). Elle permet de déterminer la localisation et l'importance des troubles de la cinétique segmentaire, d'évaluer la fonction ventriculaire gauche globale, de détecter un éventuel thrombus intraventiculaire gauche, de dépister des complications mécaniques de l'infarctus du myocarde notamment une dysfonction valvulaire (insuffisance mitrale), une communication interventriculaire, une rupture myocardique ou un épanchement péricardique [15]. En revanche, l’échographie cardiaque ne permet pas d’affirmer le caractère récent ou ancien des anomalies de la cinétique segmentaire révélées.
iii Facteurs de risques
L’infarctus du myocarde comme de nombreuses pathologies cardiovasculaires, est une pathologie multifactorielle pour laquelle il existe de nombreux facteurs de risque tant génétiques qu’environnementaux agissant le plus souvent en synergie. Ces facteurs de risque sont majoritairement liés à l’athérosclérose qui comme exposé précédemment est un précurseur principal de l'infarctus du myocarde, ou pour certains
Environ 300 facteurs de risques cardiovasculaires ont été répertoriés ayant des impacts plus ou moins importants sur la physiopathologie [16]. Parmi ces facteurs, on distingue des facteurs irréversibles, principalement génétiques et des facteurs réversibles basés sur des modes de vie ou des maladies non cardiovasculaires. Ces facteurs réversibles englobent 80% des risques de développer une pathologie cardiovasculaire. De nombreuses campagnes de prévention visent à réduire leurs impacts [16]. Si l'on s'attarde sur les chiffres en France en 2006 (Figure 7) [17], on s'aperçoit que les hommes ont plus de risques que les femmes. L'âge joue aussi un rôle, on note une augmentation du risque à partir de 50 ans et un risque maximum à 65 ans. - 25 an s 25à 4 4 ans 45 à 64 ans 65 à 84 an s + de 84 ans 0 30000 60000 90000 120000 Hommes Femmes N o m b re s d' hos pi ta li sa ti on s pour c ar d io pa th ie i sché m iq u e
Figure 7 Hospitalisations en soins de courte durée pour cardiopathie ischémique selon l’âge en 2006 d'après [17]
A ces deux facteurs irréversibles s'ajoutent également les antécédents familiaux d’infarctus du myocarde ce qui augmentent le risque dans la descendance, et qui peut être en partie imputable aux nombreux facteurs génétiques de l’infarctus du myocarde. Ceux-ci ont cependant un impact relativement restreint [16]. Parmi les facteurs de
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention risques réversibles, le tabagisme, la dyslipidémie, l'hypertension artérielle, le diabète de type 2 et l'obésité sont les plus importants.
Le tabagisme qu'il soit actif ou passif augmente le risque cardiovasculaire. Il entraîne une augmentation du taux de LDL et une dysfonction endothéliale qui augmente le risque de rupture de la plaque d'athérome [18].
La dyslipidémie se définit par une élévation des concentrations de cholestérol et /ou des triglycérides dans le sang. Cette augmentation de cholestérol est notamment due à une augmentation de cholestérol. L’effet néfaste d’un taux élevé de LDL-cholestérol peut s’expliquer par l’augmentation du risque de formation d’une plaque d’athérome, à l’inverse d’un taux élevé de HDL-cholestérol [19].
L’hypertension artérielle correspond à une élévation de la pression du sang dans les artères, par rapport à une valeur dite “normale”. L'augmentation de la pression artérielle favorise le dépôt de graisses sur et dans la paroi des artères. Elle cause aussi un remodelage vasculaire conduisant à une perte des capacités vasodilatatrices des vaisseaux et à une dysfonction endothéliale. Cet hypertension est fortement corrélée au diabète de type 2 [20].
Le diabète de type 2 se manifestant chez les personnes atteignant la cinquantaine résulte d'une mauvaise réponse des cellules musculaires ou adipeuses à la sécrétion d'insuline. Les patients diabétiques présentent des altérations de la microcirculation conduisant à une dysfonction endothéliale [20]. Le diabète de type 2 est souvent lié à un problème d'obésité.
L’obésité se définit par un excès de graisses dans l’organisme se traduisant par un indice de masse corporelle (kg/m²) supérieur ou égal à 30. L'obésité favorise les risques d'hypertension et de diabète de type 2.
Outre ces facteurs de risque cardiovasculaire majeurs, de nombreuses études mettent en évidence des facteurs de risque secondaires comme les effets néfastes de la pollution atmosphérique ou la consommation excessive d’alcool.
b L'insuffisance cardiaque
i Définition
L'insuffisance cardiaque se définit par l'incapacité du cœur à assumer un débit sanguin adapté aux besoins métaboliques et fonctionnels de l’organisme [21]. Ce dysfonctionnement entre la fonction de pompe cardiaque et les besoins de l'organisme se retranscrit par une augmentation des pressions ventriculaires et/ou une diminution du débit cardiaque. L'insuffisance cardiaque est avant tout une conséquence de nombreuses maladies cardiovasculaires (hypertension artérielle, atteinte valvulaire, maladie cardiaque congénitale, cardiopathie ischémique, myocardiopathie…) et touche les ventricules gauche et droit. L'insuffisance cardiaque gauche, conséquence notamment d'un infarctus du myocarde, entraîne un œdème pulmonaire responsable d'une gêne respiratoire parfois intense à l'effort puis au repos. L'insuffisance cardiaque droite est le plus souvent consécutive à une hypertension artérielle pulmonaire, elle-même causée par une affection pulmonaire. Une insuffisance ventriculaire gauche peut se compliquer d'une insuffisance ventriculaire droite et ainsi créer une insuffisance cardiaque globale.
ii Symptômes et dépistage
Lorsque l'insuffisance cardiaque s'installe, l'organisme va mettre en œuvre une série de mécanismes pour tenter de compenser la défaillance du muscle cardiaque. Les mécanismes d'adaptation sont une dilatation des cavités gauches (essentiellement le ventricule) et/ou un épaississement de leurs parois musculaires ou une accélération du rythme cardiaque. Cette insuffisance cardiaque dite compensée est asymptomatique. Une fois, les mécanismes compensateurs dépassés, l'insuffisance cardiaque décompensée s'installe et les premiers symptômes apparaissent. Les symptômes sont des essoufflements au repos ou pendant un exercice, une fatigue, un gonflement des chevilles [22]. Selon les symptômes, l'insuffisance cardiaque peut être classée selon les critères de la New York Heart Association (NYHA) [23] (Tableau 1).
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention
Tableau 1 Classification fonctionnelle de l'insuffisance cardiaque basée sur l'activité physique et les symptômes selon les recommandations du NYHA d'après [23]
Classe I
Aucune limitation de l'activité physique.
Une activité physique ordinaire provoque une fatigue, des palpitations ou une dyspnée.
Classe II
Légère limitation de l'activité physique.
Confort au repos mais une activité physique ordinaire provoque une fatigue, des palpitations ou une dyspnée.
Classe III
Limitation marquée de l'activité physique.
Confort au repos, mais celui-ci est réduit lors d'une activité physique ordinaire provoquant une fatigue, des palpitations
ou une dyspnée.
Classe IV
Impossibilité de supporter une activité physique sans inconfort.
Les symptômes sont présents au repos et augmentent lors d'une activité physique.
Des signes cliniques typiques d'une insuffisance cardiaque sont de la tachycardie, des râles pulmonaires, des effusions pleurales, des œdèmes périphériques. Il peut être mis en évidence au repos, une cardiomégalie, des murmures cardiaques, des anomalies décelées sur les échocardiogrammes (22). Les biomarqueurs sériques de l'insuffisance cardiaque sont très nombreux notamment l'albumine, la CRP (C-reactive protein), le TNF Į (Tumor necrosis factor Į), les procollagènes de type III, Provasopressine, troponines cardiaques, BNP (Brain natriuretic peptide) et NT-proBNP (N-terminal pro–brain natriuretic peptide) [24]. Tous ces biomarqueurs ne sont pas exclusifs à l'insuffisance cardiaque. Cependant les marqueurs BNP et NT-proBNP sont les marqueurs alliant la meilleure spécificité/sensibilité [25].
3 Traitements cliniques
a L'infarctus du myocarde
La stratégie employée lors d'un infarctus du myocarde est la reperfusion rapide de l'artère afin de diminuer la mortalité et les risques de complications comme l'insuffisance cardiaque. La reperfusion artérielle est réalisée soit par thrombolyse veineuse ou soit par angioplastie coronaire. Dans les douze premières heures, le traitement thrombolytique est possible. Ce traitement peut être débuté en phase pré-hospitalière par le SAMU. La dissolution du caillot intra vasculaire est réalisée par l'activation du système fibrinolytique. En effet le traitement va transformer le plasminogène inactif en plasmine active. L’action protéolytique de la plasmine va s’exercer sur la fibrine du caillot pour le dissoudre et sur le fibrinogène circulant. L’efficacité est d’autant plus grande que le caillot est récent. Les molécules sont injectées en intraveineuse en une ou plusieurs fois selon le produit injecté. Les molécules les plus utilisées sont Altéplase (activateur tissulaire du plasminogène : t-PA), Rétéplase (analogue simplifié du t-PA humain obtenu par génie génétique), Ténectéplase (une protéine recombinante différente du t-PA endogène), Streptokinase (protéine produite par le streptocoque ß-hémolytique se combinant au plasminogène) et Urokinase (protéase activant la transformation du plasminogène circulant et lié à la fibrine en plasmine). L’efficacité est d’autant plus grande que le caillot est récent [26, 27]. Le risque majeur des traitements thrombolytiques est l'hémorragie, en particulier les hémorragies cérébrales et la dissolution partielle du caillot qui peut permettre une ischémie récidivante. Cependant ce traitement n'est pas le traitement de choix et ne s'applique que si l'angioplastie n'est pas possible [28].
L'angioplastie coronaire est pour la majorité des cardiologues la meilleure stratégie de reperfusion pour la plupart des patients avec un infarctus du myocarde. Cette technique est l'introduction, par une artère périphérique, d'une sonde munie à son extrémité d'un ballonnet gonflable. Les coronaires sont visualisées après injection d'un produit de contraste radiologique pour localiser le lieu de l'intervention. Lorsque que la sonde atteint la zone d'intervention, un fil très fin est utilisé pour franchir l'occlusion afin de servir de guide et de positionner de manière stable la sonde
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention d'angioplastie. La sonde placée, le ballonnet est alors gonflé. Le ballonnet va écraser la plaque d'athérome contre la paroi et réattribuer au coronaire un diamètre normal. Dans la plupart des interventions, cette technique est couplée à la mise en place d'un stent. Le stent est un petit ressort métallique positionné sur le ballon d'angioplastie dégonflé. Après gonflage du ballonnet, le stent se détend et maintient la paroi de l'artère. Le stent permet d'éliminer la possibilité d'un nouveau rétrécissement de l'artère [29] (Figure 8). Le stent étant un corps étranger, il peut permettre la formation d'un caillot. C’est pour cela, que chaque pose est accompagnée d'un traitement d'antiagrégants plaquettaires. Le stent posé est dit actif si celui-ci délivre des molécules diminuant le risque de resténose.
Figure 8 Mise en place d'un stent
Cette intervention est accompagnée par des traitements adjuvants. Ce traitement comprend des anticoagulants (héparine et acide acétylsalicylique), des antiplaquettaires (thienopyridine) et des inhibiteurs des récepteurs des glycoprotéines IIb et IIIa [30].
Lorsque l'angioplastie est inefficace ou si plusieurs artères sont occluses, la chirurgie cardiaque est utilisée. La technique utilisée est celle du pontage coronarien. Elle consiste à contourner une artère coronaire rétrécie ou obstruée en implantant un autre vaisseau en aval de cette dernière pour rétablir la circulation sanguine [31].
Après l'intervention, un traitement médical est administré. Celui-ci vise la diminution de la mortalité cardiovasculaire en diminuant le risque de récidive et en
stabilisant la plaque d'athérome. Ce traitement est une association de béta-bloquants, d’acide acétylsalicylique, de statine, d’inhibiteurs de l’enzyme de conversion de l’angiotensine. La prise en charge des facteurs de risque par des mesures hygiéno-diététiques tels que la reprise d’une activité physique, l’arrêt de la consommation de tabac et un changement dans les habitudes alimentaires afin de favoriser une alimentation pauvre en lipides saturés et en glucides, fait aussi partie du traitement [32].
b L'insuffisance cardiaque
Lors de l'insuffisance cardiaque (IC) dès les premiers signes cliniques, une prise en charge thérapeutique doit être effectuée pour traiter les symptômes ainsi que la cause. Le traitement médical associe diurétique, inhibiteur de l’enzyme de conversion et anti-arythmique.
Les diurétiques sont recommandés en cas de signes de congestion (insuffisance cardiaque congestive). Ils permettent à l'organisme de soulager l’excès de rétention d'eau et de sel (sodium) diminuant ainsi le volume de sang circulant et la charge pour la contraction cardiaque. L'association d'inhibiteur de l’enzyme de conversion (inhibiteur de l’enzyme de conversion d'angiotensine) et anti-arythmique (ȕ-bloquant) ont pour but d'améliorer les fonctions ventriculaires. En cas de contre-indication ou d'intolérance à l'un de ses deux produits, ils peuvent être remplacés par des antagonistes de l'adostérone, des bloqueurs du récepteurs à l'angiotensine. La Digoxine, un glycoside cardiaque inhibiteur de la Na/K ATPase, est prescrit pour contrôler les fréquences cardiaques, les ralentir, souvent en association avec des ȕ-bloquants (22). Son intérêt est aussi important lorsque l’IC est associée à une fibrillation auriculaire [33]. De part sa toxicité, l'utilisation des digitaliques est réduite. Elle est pourtant conseillée en cas d'insuffisance cardiaque clinique et de dysfonction systolique du ventricule gauche [34].
Lorsque les traitements ne sont pas suffisants, la mise en place d'un pacemaker peut diminuer les symptômes d’insuffisance en améliorant la synchronisation de la contraction des ventricules. En dernier recours, en cas d'échec de toutes les
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention thérapeutiques, une greffe cardiaque peut être effectuée pour les patients de moins de 65 ans.
c Approche du complément alimentaire
Selon la directive européenne 2002/46/CE, un complément alimentaire est une denrée alimentaire dont le but est de compléter le régime alimentaire normal en constituant une source concentrée de nutriments ou d'autres substances ayant un effet nutritionnel ou physiologique. La nutrition et le traitement de l'infarctus ou de l'insuffisance cardiaque sont étroitement liés. En effet, après un accident cardiovasculaire, un changement de comportement alimentaire est exigé. D'ailleurs les agences de sécurité sanitaire préconisent certains nutriments en prévention ou en protection du système cardiovasculaire. Cette partie sera détaillée plus spécifiquement dans le chapitre "Application en Nutrition". La restriction sodique est l’intervention diététique la plus facilement réalisée (pain sans sel). Malheureusement le sel (NaCl) reste très utilisé comme additif dans l’industrie alimentaire, son remplacement par le KCl reste préconisé. Sodium et potassium diminue la tension artérielle et permettent une élimination rénale de la surcharge sodée de l’IC.
Les Ȧ 3 constituent la seconde voie avec le remplacement de lipides saturés par des insaturés et aussi par une action protectrice cardiaque qui reste à déterminer [35]. De nombreuses pistes anti-aggrégant plaquettaire, anti-inflammatoire (résolution de l’inflammation), anti-arythmique, effets conjugués sur le métabolisme énergétique [36], effet de préconditionement [37]. Ces deux derniers mécanismes ont été seulement été démontrés in vitro.
4 Phénomène de l’ischémie/reperfusion
a D’un niveau organique
Lors de l'ischémie cardiaque, il y aune chute brutale de l'activité contractile jusqu'à devenir nulle. Lors des premières minutes de l'ischémie, les dommages
irréversible. Celle-ci s'étend de l'endocarde vers l'épicarde, c'est le "wavefront phenomenom". [39, 40]. Ce phénomène dynamique de nécrose du myocarde dépend principalement de trois facteurs: la taille de la zone ischémique (zone à risque), la durée et l'intensité de l'ischémie (degré de réduction du débit sanguin myocardique). Cette nécrose s'accompagne d'une réaction inflammatoire [41]. A cause du "wavefront phenomenom", il existe une période critique pour le sauvetage du myocarde infarci qui diffère selon les espèces [38]. La seule méthode reconnue réduisant la taille de l'infarctus est la reperfusion coronaire. De façon contradictoire, la reperfusion a aussi des effets néfastes comme le montre les travaux de Jennings (38, 39) et d'Hearse [42]. La réoxygénation du myocarde ischémique s'accompagne de dommages ultrastructuraux beaucoup plus importants que si l'ischémie avait été maintenue, c'est le "paradoxe de l'oxygène". Ces lésions de reperfusion correspondent à un événement associé à la reperfusion (nouveau ou pouvant être atténué par l'intervention thérapeutique commencée seulement à la reperfusion). Cinq formes de lésions de reperfusion sont possibles : les arythmies de reperfusion, la sidération myocardique (myocardial stunning), les dommages vasculaires, le phénomène de "no-reflow" et la nécrose de reperfusion. Cette reperfusion active et amplifie aussi la réaction inflammatoire [43].
b Du niveau de la cellule
Lors de la séquence ischémie/reperfusion, les variations intracellulaires majeures sont celle des ions et de l'ATP. Celles-ci mèneront à la mort cellulaire. Lors de l'ischémie, il n’y a plus de transport d’oxygène ce qui entraîne une chute brutale de l'ATP intracellulaire [44] et une dépolarisation de la mitochondrie. De plus une augmentation de la concentration de sodium intracellulaire, par l'intermédiaire de l'échangeur sodium/proton (NHE) se produit [45] ce qui entraîne une augmentation de la concentration du Calcium intracellulaire par la mise en mode inverse de l'échangeur sodium/calcium (NCX) [46]. Le pH intracellulaire s'acidifie par la glycolyse anaérobique et l'hydrolyse de l'ATP [47]. A la reperfusion, il y a un large nombre de réactions radicalaires impliquant toutes les espèces de ROS. La restauration de l’homéostasie cellulaire est différente selon les ions, l’ATP et le pH. Les
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention concentrations ioniques intracellulaires se normalisent dans les 30 premières minutes de la reperfusion [48] (Tableau 2).
Tableau 2 Evaluation des concentrations intracellulaire de différents paramètres cellulaires pendant l'ischémie reperfusion d'après [48]
Condition
normoxique
30 min
d'ischémie
0 min de
reperfusion
5 min de
reperfusion
30 min de
reperfusion
Na+
10 mM ύ 40 mM 15 mM 10 mMCa2+
0.1 – 1 μM ύ 3 μM 1.8 μM 0.7 μMMg2+
0.8 mM ύ 2.5mM 0.8 mM 0.8 mMATP
10 mM ώ 2 mM 5mM 5mMPH
7.1 ώ 6.0 7.1 7.1Le stock d'ATP est revenu à la normale après 24h. Le pH intracellulaire revient à l'homéostasie au bout de 5 minutes. La normalisation du pH désinhibe l'ouverture du pore de transition de perméabilité mitochondriale (MPTP). Ce dernier est activé par l'activation des calpaïnes et l'accumulation de calcium mitochondriale. Son activation mène à la rupture de la membrane sarcolemale et donc à la mort cellulaire [49, 50]. A cela, s'ajoute dans les premières minutes de la reperfusion, une hypercontracture provoquée par le taux élevé de calcium intracellulaire et la dysfonction mitochondriale [51]. Cette hypercontracture mène elle aussi à la mort cellulaire (altération du sarcolemme) [52] (Figure 9).
Figure 9 Induction de la mort cellulaire par l'ischémie/reperfusion adaptée de [52]
5 Recherche préclinique sur ischémie/reperfusion
a Modèle utilisé
En recherche préclinique, différents modèles sont utilisés pour étudier l'ischémie/reperfusion et permettre des avancées dans de nouvelles thérapies. Chaque modèle a ses avantages et ses inconvénients mais permet l'étude précise de certaines caractéristiques des voies d’altération de la séquence d’IR comme le démontre le Tableau 3.
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention
Tableau 3 Techniques d'étude spécifique en fonction du modèle d'ischémie reperfusion.
Techniques
Etude in vitro
Mesure des doses réponses, Etudes biochimiqueEtude ex-vivo
Mesure des paramètres cardiaques fonctionnels, Mesure de la taille de l'infarctus, Etude des mécanismes de l'arythmieEtude in vivo
Echographie, Mesure de la taille de l'infarctus, Mesure de la densité des artères et capillairesi in vitro
Les modèles in vitro sont utilisés pour les études biochimiques, la mesure des doses réponses des différentes molécules et l'étude des phénomènes cellulaires lors de l'ischémie/reperfusion. L'ischémie/reperfusion myocardique se réalise sur des cellules isolées de cardiomyocytes. Le travail sur cellule permet une manipulation plus aisée des gènes (surexpression ou sous-expression), le travail avec une grande variété de techniques d'imagerie grâce à la visualisation des cellules; une utilisation facile des techniques d'immunodétection ainsi que l'étude de l'internalisation des protéines. L'étude sur myocytes isolés permet d'étudier spécifiquement ce type cellulaire en évitant l'influence des cellules environnantes telles que les cellules endothéliales et les fibroblastes. En revanche, la culture cellulaire rend l'étude de la contractilité imparfaite en enlevant une partie des phénomènes dus à l'aspect pathophysiologique de l'ischémie/reperfusion myocardique que l'on retrouve sur le cœur entier.
Les techniques les plus utilisées pour induire l'ischémie in vitro sont les suivantes :
L'ischémie chimique est l'empoisonnement métabolique de la cellule par la reproduction de la perte d'ATP et de l'acidose cellulaire produite lors de l'ischémie à l'aide d'agent chimique (2-deoxyglucose et de cyanure de sodium –NaCN-) [53, 54].
L'"ischemic pelleting" ou culotage ischémique ischémie/reperfusion cellulaire est réalisé par la centrifugation des cardiomyocytes fraîchement isolés avec un surnageant couvert d'huile [55]
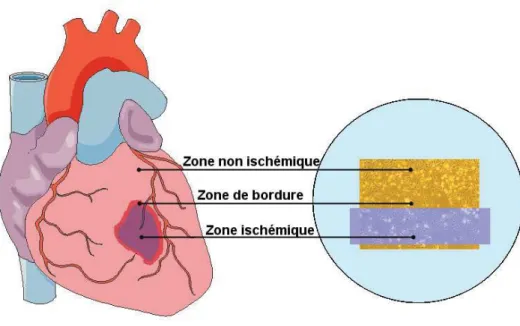
La sévère hypoxie cellulaire, avec ou sans privation de substrats (absence de glucose), est réalisée à l'aide de chambre hypoxique utilisant une atmosphère en nitrogène entre 95 et 100% [56, 57]. Le "Coverslip hypoxia" est la reproduction d'une hypoxie sévère sur une portion du tapis cellulaire en le recouvrant d'une lamelle de verre formant une barrière de diffusion qui le prive d'oxygène et restreint la présence au milieu de culture [58]. A l'inverse des autres techniques énumérées qui réalisent des ischémies totales des cellules, cette technique réalise une ischémie régionalisée qui reflète plus précisément les événements ischémiques in vivo en recréant les zones : la zone ischémique, la zone non ischémique et la zone de bordure à l’interface de ces 2 zones comme lors d’un infarctus du myocarde (Figure 10). De plus la reperfusion est possible et est simulée par une simple réoxygénation du milieu avec une composition ionique normale.
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention ii ex vivo
Le modèle ex vivo est utilisé pour l'étude de la fonction contractile, la
fréquence cardiaque, la mesure de la taille de l'infarctus, l'étude des mécanismes de l'arythmie, la mesure des effets de différentes doses de molécules. L'utilisation du cœur isolé perfusé permet d'examiner spécifiquement l'étude des fonctions contractiles telles que les effets inotropiques, chronotropiques et vasculaires sans les complications neuronales et hormonales obtenues sur un model in vivo. En revanche, le cœur isolé demande une expertise technique accrue afin d'éviter la formation de contusions, la possibilité de réaliser par inadvertance une protection à l'ischémie/reperfusion et la perfusion ne peut durer que quelques heures.
De plus l'ischémie/reperfusion produite est réalisée sur le cœur en entier alors qu'in vivo celle-ci est régionalisée.
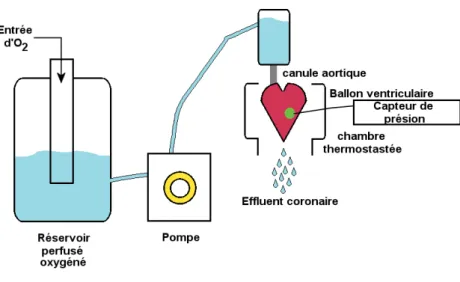
Le concept de cœur isolé perfusé fut introduit et établi par Oska Langendorff en 1898 [59]. Cette technique est devenue maintenant une technique prédominante en recherche pharmacologique et physiologique.
Brièvement celle-ci consiste à isoler le cœur de l'animal et canuler l'aorte. Le cœur est alors perfusé dans une solution oxygénée comprenant des nutriments. La solution de Krebs–Henseleit est la solution de référence pour la perfusion de tissu de mammifères composée notamment de sodium, potassium, calcium, chloride, glucose, phosphate, sulfate de magnésium et du bicarbonate afin de mimer le contenu ionique du plasma. [60]. Afin de mesurer les paramètres cardiaques et notamment la pression développée du ventricule gauche (LVDP, la différence entre la systole et la diastole du ventricule gauche), un ballon de latex connecté à un capteur de pression est introduit dans le ventricule gauche (Figure 11). L'ischémie et la reperfusion sont réalisées respectivement par l’interruption de la perfusion puis par sa restauration.
Figure 11 Représentation schématique d'un système de cœur isolé perfusé
iii in vivo
Les modèles in vivo sont utilisés pour la mesure de la taille de l'infarctus, des
mesures échographiques, l'étude des molécules avant des tests cliniques, l’étude des effets à long terme de l'ischémie/reperfusion et de sa protection. Ces techniques sont les plus proches de la clinique et mime la situation d'ischémie/reperfusion pendant un traitement chirurgical après ischémie myocardique. En revanche, ces modèles demandent une grosse logistique et une expertise technique. Sur les modèles d'animaux anesthésiés, il est possible de produire un effet de preconditioning avec des agents anesthétiques volatiles [61]. Sur les modèles d'animaux conscients, la vérification du succès de la reperfusion est difficile [62, 63].
Les techniques in vivo sont réalisées soit sur des animaux conscients, soit sur
des animaux anesthésiés.
Sur des animaux conscients, les animaux sont préalablement opérés et un système hydraulique d'occlusion est posé sur l'artère interventriculaire antérieure. L'ischémie est réalisée ultérieurement à l'acte chirurgical par fermeture du système hydraulique [64].
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention Sur des animaux anesthésiés, l'ischémie est réalisée pendant l'opération par clampage de l'artère interventriculaire antérieure [65-67] .
b Protection
En recherche préclinique, l'étude et la recherche de la protection cardiovasculaire sont basées sur le phénomène de "conditioning" (conditionnement) qu'il soit mécanique ou pharmacologique. Celui-ci peut avoir lieu avant l'ischémie (preconditioning), à distance (perconditioning) et après l'ischémie (postconditioning).
i Preconditioning
Le premier phénomène de conditionnement à été découvert chez le chien par Murry en 1986 [68]. Ce "preconditioning" consiste à réaliser de brefs épisodes d'ischémie cardiaque non létale afin de protéger le cœur en le rendant plus résistant pour l'ischémie suivante. La protection de cette ischémie de "preconditioning" persiste après l'acte protecteur et démontre l'existence d'une "mémoire" cardiaque. En effet le cœur "se rappelle" d'avoir été exposé à des stimuli de "preconditioning" et maintient la protection même quand les stimuli sont arrêtés. Ce phénomène décrit par Murry a été reproduit chez d'autres espèces incluant le rat [69], le lapin [70], le cochon [71] ainsi que chez l'homme [72, 73]. Le precondioning peut aussi être réalisé notamment par des agents pharmacologiques bradykinine, ouabaïne et des opioïdes. Le mécanisme précis de cette protection cardiovasculaire est encore peu connu. Lors du preconditioning, cela va entraîner l'activation de la voie du phosphatidylinositol 3-kinase (PI3K) qui entraînera l'activation successive de Akt, eNOS, Guanylate cyclase (via la libération de NO). Ce qui amènera à la translocation de la PKCİ et l'ouverture des canaux potassiques dépendants de l'ATP (KATP) des mitochondries [74]. L'activation de cette voie avant l'ischémie va permettre l'activation d'une voie de signalisation cardioprotectrice similaire à la reperfusion qui est la Reperfusion Injury Salvage Kinase (RISK). Le preconditioning ischémique provoque à la reperfusion le relâchement d'agoniste tel que l'adénosine, la bradykinine et des opioïdes qui s'attachent à des récepteurs couplés à la protéine G (GPCR). L'activation des GPCR
mène à l'activation d'Epidermal Growth Factor Receptor (EGFR) via la matrice métalloprotéinase (MP). EGFR va activer la kinase Src qui mène à l'activation de la voie du PI3K [75]. Cette voie résulte en l'activation successive de Akt, eNOS, Guanylate cyclase. Ce qui amènera à la translocation de la PKCİ et l'ouverture des KATP des mitochondries [76] qui libèrent une faible quantité de ROS mitochondriale pour activer des PKC et Erk ½ et qui inhibent l'ouverture du MPTP (Figure 12) .Outre cette cascade d'activation, la voie PI3K/Akt inhibe des agents pro-apoptotiques tel que BAD [77], BAX [78]ainsi que l'inhibition de la cytochrome C mitochondriale [79]. Parallèlement à la voie PI3K/Akt, les GPCR activent aussi Erk ½. qui vont phosphoryler des protéines tel que BAD [80], BAX [81]. Une autre voie de signalisation indépendante de RISK a été décrite avec la voie SAFE (Survivor Activating Factor Enhancement). Cette voie est initiée par le TNFĮ et implique les Janus Kinase (JAK) et STAT-3 (Signal Transducer and Activator of Transcription 3) [82].
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention
ii Perconditioning
Le "perconditioning" ischémique consiste à protéger le cœur pendant une ischémie prolongée par plusieurs brefs épisodes ischémiques sur du tissu périphérique au cœur. Cette protection a été mise en évidence chez le rat [83] et chez l'homme [84] par réalisation d'ischémie au niveau de la jambe par arrêt du flux sanguin. Le mécanisme de cette protection est très peu décrit mais passerait par l'ouverture des KATP des mitochondries [83].
iii Postconditioning
Le "postconditioning" ischémique consiste à protéger le cœur après une ischémie prolongée par plusieurs brefs épisodes d'ischémie cardiaque non létale [85]. Ce postconditioning est réalisable de manière clinique, comme lors de la reperfusion par angioplastie réalisée durant la phase aiguë de l'infarctus du myocarde [86]. Celui-ci doit être effectué dans les dix premières minutes de la reperfusion [87] et n'est efficace seulement si l'occlusion coronaire est inférieure à 45 minutes [88]. L'effet obtenu par postconditioning ne peut s'ajouter à l'effet obtenu par preconditioning [89]. Le mécanisme amenant à la protection cardiaque est similaire à celui du preconditioning par l'activation des mêmes voies de signalisation et kinase [90] (Figure 13).
Introduction: Physiologie et Pathologie cardiaque, traitement et prévention
Figure 13 Mécanisme de protection du Postconditioning
Cette protection par le phénomène de "conditioning" qu'il soit avant ou après l'ischémie déclenche les mêmes voies de signalisation. Une meilleure compréhension de ces voies de signalisation permettrait la mise en place de nouveaux traitements cardioprotecteurs.
![Figure 7 Hospitalisations en soins de courte durée pour cardiopathie ischémique selon l’âge en 2006 d'après [17]](https://thumb-eu.123doks.com/thumbv2/123doknet/7781428.258546/31.892.181.686.473.829/figure-hospitalisations-soins-courte-durée-cardiopathie-ischémique-âge.webp)
![Tableau 2 Evaluation des concentrations intracellulaire de différents paramètres cellulaires pendant l'ischémie reperfusion d'après [48]](https://thumb-eu.123doks.com/thumbv2/123doknet/7781428.258546/40.892.105.820.264.574/tableau-evaluation-concentrations-intracellulaire-paramètres-cellulaires-ischémie-reperfusion.webp)
![Figure 9 Induction de la mort cellulaire par l'ischémie/reperfusion adaptée de [52]](https://thumb-eu.123doks.com/thumbv2/123doknet/7781428.258546/41.892.270.637.116.616/figure-induction-mort-cellulaire-ischémie-reperfusion-adaptée.webp)