Bioraffinage de sous-produits de l’épinard
(Spinacia oleracea L.) : comparaison de
méthodes vertes pour l’extraction de
composés phytochimiques bioactifs
Thèse
Maëlle Derrien
Doctorat en sciences et technologie des aliments
Philosophiae Doctor (Ph.D.)
Québec, Canada
Bioraffinage de sous-produits de l’épinard
(Spinacia oleracea L.) : comparaison de
méthodes vertes pour l’extraction de
composés phytochimiques bioactifs
Thèse
Maëlle Derrien
Sous la direction de :
Paul Angers, directeur de recherche
André Gosselin, codirecteur de recherche
Yacine Boumghar, codirecteur de recherche
Résumé
L’industrie maraichère génère une quantité importante de sous-produits pouvant être valorisés pour leurs contenus en biomolécules. Les composés phytochimiques issus des fruits et des légumes présentent des effets bénéfiques sur la santé humaine et animale, comme le rapporte la littérature. Cependant, une des problématiques majeures actuelle est que l’extraction des molécules naturelles utilisent des solvants pétrochimiques, issus de sources fossiles non renouvelables et présentant une certaine toxicité pour l’environnement, les consommateurs et aussi les opérateurs.
L’épinard est un légume feuillu riche en composés bioactifs tels que les polyphénols, la lutéine et la chlorophylle. Ces deux derniers présentent des effets antioxydants, anti-inflammatoire, anti-génotoxique majoritairement au niveau des yeux pour la lutéine et du côlon pour la chlorophylle.
Le présent projet a donc pour objectif principal de développer un procédé d'extraction et de séparation de deux biomolécules d’intérêts, la lutéine et la chlorophylle, à partir de sous-produits d’épinard. L’efficacité d’extraction des différents procédés a été comparée à l'extraction totale traditionnelle des molécules avec des solvants organiques peu polaires. Trois procédés écologiques ont été optimisés : une extraction à l’eau et à l’éthanol, un procédé utilisant une saponification pour permettre la séparation de la lutéine et de la chlorophylle et une extraction au CO2 supercritique. Une modélisation permettant
la prédiction de la solubilité des molécules dans le solvant supercritique a également été réalisée afin de limiter et de valider les essais expérimentaux. Aussi, le procédé montrant les meilleurs résultats a fait l’objet d’une analyse technico-économique afin d’étudier sa faisabilité à l’échelle industrielle.
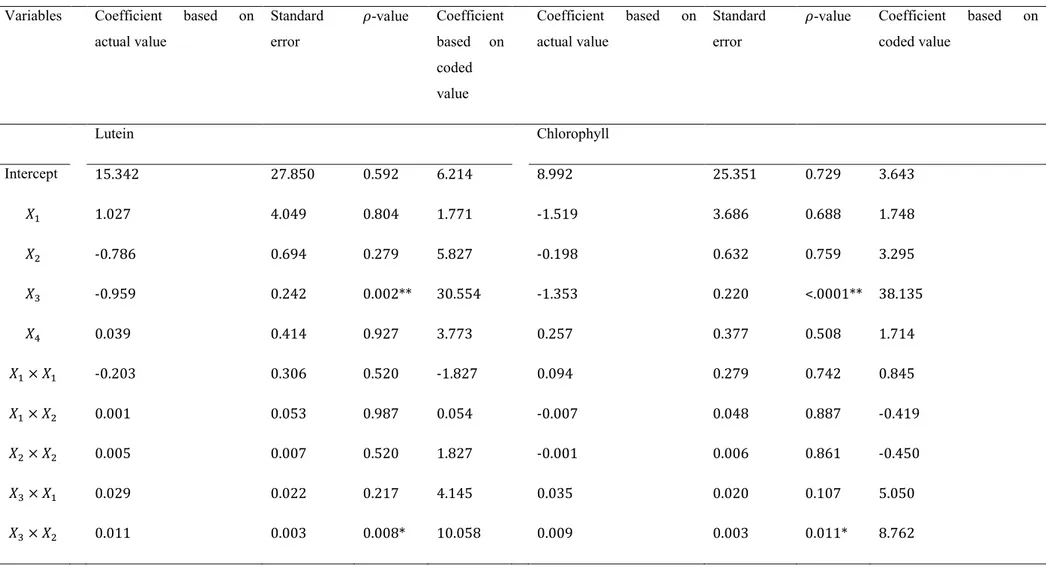
Les résultats montrent que l’extraction à l’eau et à l’éthanol est efficace à 70% et à 96% pour extraire respectivement la lutéine et la chlorophylle en utilisant les paramètres retenus par le modèle statistique avec un rendement en matière de 1,4%. Toutefois, ce procédé nécessite de nombreuses étapes, de grands volumes de solvant et ne sépare pas la lutéine et la chlorophylle. Le procédé utilisant la saponification permet une séparation efficace de ces deux molécules, mais engendre d’importantes dégradations de la lutéine
(récupération de 27% de lutéine avec un rendement en matière de 0,63%). Il utilise aussi de grandes quantités de solvant, de nombreuses étapes et est en plus dangereux pour le personnel (utilisation de NaOH). L’extraction par fluide supercritique permet quant à elle, avec les paramètres retenus par le modèle statistique, un rendement de 70% en lutéine et de 50% en chlorophylle avec un rendement en matière de presque 3%, sans inconvénient majeur. La modélisation de la solubilité, utilisant la théorie de Charles Hansen adaptée aux conditions supercritique, rejoint les résultats obtenus expérimentalement et de fait s’avère efficace pour la prédiction de la solubilité des biomolécules dans le solvant supercritique. L’extraction par fluide supercritique est donc une méthode de choix pour l’extraction de la lutéine et de la chlorophylle et répond à tous les principes de la chimie verte. Dans notre cas, l’addition d’un co-solvant est nécessaire pour augmenter la solubilité de nos molécules dans le solvant supercritique. L'ajout de co-solvants est connu pour augmenter les coûts de production et d’investissement du procédé supercritique. Ainsi, la simulation du procédé à l’échelle industrielle et son analyse économique ont permis de conclure quant à sa faisabilité et sa rentabilité à l’échelle industrielle. Les résultats ont montré un coût d’investissement total de 5 555 000 USD, avec un prix fixe d’investissement de 4 721 240 USD. Le coût de production annuel a été estimé à 1 800 000 USD, correspondant à un coût spécifique de 1700 USD par kg d’extrait produit.
Les résultats ont donc montré que tous les procédés développés répondaient aux objectifs de départs en respectant les principes de la chimie verte appliquée à l’extraction de composés phytochimiques. Toutefois, les meilleurs résultats ont été obtenus avec l’extraction par fluide supercritique. Néanmoins, cette technologie s’avère très couteuse à mettre en place dans une industrie. De fait, le procédé vert le plus applicable à l’échelle industrielle et permettant une séparation de la lutéine et de la chlorophylle est le procédé utilisant une étape de saponification.
Abstract
Industrial vegetable by-products contain high levels of valuable phytochemicals that can be used as a rich source of biomolecules. Phytochemical compounds from fruits and vegetables exhibit several benefits on human and animal health, as reported in the literature. However, the extraction of these natural molecules is still carried out using petrochemical harmful solvents, from non-renewables fossil sources exhibiting environmental, and health toxicity. Spinach is a leafy vegetable highly concentrated in bioactive compounds such as polyphenols, lutein and chlorophyll. The latter two exhibit antioxidant, anti-inflammatory, anti-genotoxic effects.
The main objective of this project was to develop an extraction process technology for the recovery of two highly valuables biomolecules, lutein and chlorophyll, using spinach by-products and respecting the main principles of green chemistry. This work focused on the development and optimization of 3 ecological extraction and separation processes of these phytochemicals, using conventional green extraction methods with green solvents (water and ethanol, NaOH) and innovative technologies, supercritical CO2.
The extraction efficiency has been compared to the total extraction of lutein and chlorophyll obtained with petrochemical solvents. Solubility prediction of the studied molecules in the supercritical solvent was also carried out in order to decrease the experimental tests number and validate the results. Finally, a technical-economic analysis was performed in order to evaluate the feasibility of an industrial scal-up of the most promising developed process.
A green extraction method, using ethanol and water as extraction solvents was developed in order to extract these plant compounds from spinach by-products. The optimal extraction parameters predicted were 93% ethanol concentration, for 4.3 h at 43°C and a solvent to raw material ratio of 1/66. These parameters gave a recovery of 96% of chlorophyll and 70% of lutein, along with an extraction yield of 1.4%. However, this process was not efficient for the separation of the two compounds and furthermore, used high amount of extraction solvents. A saponification in an aqueous medium was carried out to hydroxylate the ester bond of the aliphatic chain of chlorophyll. Through this
process, using the Derringer’s desirability function, the optimal conditions for separation were 16 h of saponification, at 60°C and with 3.9% of sodium hydroxide. The process can be streamlined in a commercial extraction process for these compounds. However, the saponification step resulted in a significant degradation of lutein (only 27% of lutein was recovered, with an extraction yield of 0.63%). Using supercritical fluid extraction along with ethanol as modifier, the optimal extraction parameters allowed the recovery of 70% of the lutein and 50% of the chlorophyll, with a yield of almost 3% without major drawback. The supercritical fluid extraction is therefore a valuable method for extracting lutein and chlorophyll while complying to all green chemistry tenet. The addition of modifier for the extraction of these phytochemicals was needed, known to increase the capital and production cost of SC-CO2 process. Thus, process design and economic
analysis of the process was studied to conclude about the viability and the feasibility of the eventual SC-CO2 proposed process for the replacement of conventional one for the
recovery of spinach extracts rich in lutein and chlorophyll. The results exhibited a total cost of investment (TCI) of 5,555,000 USD, along with a fixed cost of investment (FCI) of 4,721,240 USD. The yearly production cost was estimated at 1,800,000 USD.
The optimization of the optimum extraction conditions requires a critical analysis. The objective of this project was also to develop a predictive approach based on the Hansen solubility theory to ascertain and optimize the solubility of solutes, in supercritical carbon dioxide (SC-CO2). The predictive approach was then considered an efficient tool regarding
the solubility of solutes in SC-CO2 and can be used to estimate the condition for
solutes-SC-CO2 optimum miscibility in a wide range of pressure.
Finally, we showed that processes developed in this project respected all the green chemistry principles applied to the extraction of phytochemicals and thus meet the objective of the project. The best results are obtained with supercritical fluid extraction. However, this technology necessitates high investment which can limit the profitability of the technique. We thus recommend to adopt a process using a saponification step for the separation of lutein and chlorophyll.
Table des matières
Résumé ...III Abstract ... V Table des matières ... VII Liste des figures ... XII Liste des tableaux... XIV Remerciements ... XVI Avant-propos ... XVIII
Introduction ... 1
1 État de l’art ... 3
1.1 Valorisation de sous-produits issus de l’agriculture : Choix de l’épinard. ...4
1.1.1 Valorisation des déchets et chimie verte : Principes ... 4
1.1.2 L’épinard : Botanique et production mondiale ... 4
1.2 Intérêt santé de l’épinard ...6
1.3 Les composés majeurs d’intérêt dans l’épinard ...8
1.3.1 La chlorophylle ... 8
1.3.2 La lutéine ... 11
1.4 Purification et extraction des molécules à l’étude ... 14
1.4.1 Techniques d’extractions conventionnelles ... 14
1.4.2 Techniques d’extraction innovantes ... 15
1.4.3 Méthodes de purification ... 17
1.5 La sélection de solvants et la chimie verte ... 18
1.6 Les fluides supercritiques ... 21
1.6.1 Introduction ... 21
1.6.2 L’état supercritique : définition ... 22
1.6.3 Choix du solvant supercritique ... 23
1.6.4 Propriétés de transport ... 24
1.6.5 Effet des conditions opératoires sur la solubilité du SC-CO2 ... 25
1.6.7 Prétraitement de la matière de départ ... 27
1.6.8 Équipement ... 28
1.6.9 Extraction de la lutéine et de la chlorophylle par le CO2 supercritique ... 29
1.7 Applications industrielles et analyse technico-économique ... 30
1.7.1 Mise à l’échelle industrielle : étude des paramètres opérationnels ... 30
1.7.2 Estimation des coûts de production ... 30
1.7.3 Comparaison économique des procédés conventionnels et supercritiques ... 32
1.8 Prédiction de la solubilité des composés phytochimiques dans un solvant : Application de la théorie de Hansen à la lutéine et chlorophylle dans un solvant supercritique. ... 33
2 Problématique, hypothèse de recherche, objectif principal et objectifs spécifiques 40 2.1 Problématique ... 41
2.2 Hypothèse de recherche... 41
2.3 Objectif principal ... 41
2.4 Objectifs spécifiques ... 42
3 Optimization of a green process for the extraction of lutein and chlorophyll from spinach by-products using response surface methodology (RSM) ... 43
3.1 Transition contextuelle ... 44
3.2 Résumé ... 45
3.3 Abstract ... 46
3.4 Introduction ... 47
3.5 Materials and methods ... 49
3.5.1 Chemicals ... 49
3.5.2 Methods ... 49
3.6 Results ... 53
3.6.1 Quantification of lutein and chlorophyll in spinach ... 53
3.6.2 Accuracy and variance analysis of the regression model ... 57
3.6.3 Analysis the effects of extraction parameters on lutein and chlorophyll extractability ... 63
3.7 Discussion ... 64
3.8 Conclusion ... 66
3.9 Acknowledgements... 67
4 Optimization of a sustainable purification of lutein and chlorophyll from spinach by-products by a saponification procedure using Box Behnken design and desirability function. ... 68
4.1 Transition contextuelle ... 69
4.2 Résumé ... 70
4.3 Abstract ... 71
4.4 Introduction ... 72
4.5 Material and methods ... 74
4.5.1 Plant material ... 74
4.5.2 Chemicals ... 74
4.5.3 Methods ... 74
4.6 Results and discussion ... 78
4.6.1 Observation and analysis of the preliminary results ... 78
4.6.2 Effects of saponification parameters on lutein and chlorophyll recovery in the ethanolic extract: analysis of the statistical data ... 81
4.6.3 Analysis of variance of the model ... 86
4.6.4 Quantification of chlorophyllin in the first aqueous medium ... 87
4.6.5 Optimization saponification parameters ... 87
4.7 Conclusion ... 89
4.8 Acknowledgements... 90
5 Optimization of a sustainable SC-CO2 extraction of lutein and chlorophyll from spinach by-products using response surface methodology ... 91
5.1 Transition contextuelle ... 92
5.2 Résumé ... 93
5.3 Abstract ... 94
5.4 Introduction ... 95
5.5 Material and methods ... 97
5.5.2 Chemicals ... 97
5.5.3 Experimental method ... 98
5.5.4 HPLC analysis ... 101
5.6 Results and discussion ... 102
5.6.1 Screening of SFE studied variables ... 102
5.6.2 Effect of extraction factors on the extraction of lutein and chlorophyll ... 103
5.6.3 Mathematical treatment of data and evaluation of the fitted model ... 111
5.6.4 Selectivity of the supercritical solvent ... 112
5.6.5 Determination of the optimum conditions ... 113
5.6.6 Comparison with a conventional green extraction process ... 115
5.7 Conclusion ... 115
5.8 Acknowledgements... 116
6 Modelization of the supercritical carbon dioxide solubility of carotenoids and chlorophyll using Hansen theory ... 117
6.1 Transition contextuelle ... 118
6.2 Résumé ... 119
6.3 Abstract ... 120
6.4 Introduction ... 121
6.5 Material and methods ... 123
6.5.1 Experimental extraction of lutein and chlorophyll using supercritical carbon dioxide (SC-CO2) ... 123
6.5.2 Computational method ... 126
6.5.3 Solute solubility parameters determination... 129
6.6 Results ... 130
6.6.1 Experimental results ... 130
6.6.2 Effects of extraction parameters ... 130
6.6.3 Computational results ... 133
6.7 Discussion ... 138
6.8 Conclusion ... 140
7 Supercritical fluid extraction from spinach by-products: process design and economic analysis ... 142 7.1 Transition contextuelle ... 143 7.2 Résumé ... 144 7.3 Abstract ... 145 7.4 Introduction ... 146 7.5 Modeling ... 148
7.5.1 Raw material: Spinach by products ... 148
7.5.2 Operational conditions ... 148
7.5.3 Process model and extraction system: equipment capacity ... 148
7.5.4 Description of the extraction section ... 151
7.5.5 Description of the separation section ... 151
7.5.6 Description of the modifier separation and recycle section ... 151
7.6 Economic analysis ... 152
7.7 Results and discussion ... 154
7.7.1 Selection of operating conditions ... 154
7.7.2 Economic analysis ... 158
7.7.3 Profitability analysis ... 165
7.8 Conclusion ... 167
7.9 Acknowledgements... 167
8 Discussion, conclusion et perspectives ... 168
8.1 Discussion ... 169
8.2 Conclusion ... 177
8.3 Perspectives ... 177
Liste des figures
Figure 1-1: Situation mondiale de la production d'épinard (Source : FAO STAT
http://www.fao.org/faostat/fr/#data/QC/visualize) ... 5
Figure 1-2: Répartition mondiale de la production d'épinard (Source : FAO STAT http://www.fao.org/faostat/fr/#data/QC/visualize) ... 6
Figure 1-3: Structure de la chlorophylle ... 8
Figure 1-4: Structure de la lutéine ... 13
Figure 1-5: Diagramme de phase d’un composé pur ... 22
Figure 1-6: Visualisation du passage à l'état supercritique ... 24
Figure 1-7: Variation de la densité d'un corps pur en fonction de son état de la matière. Adapté de Bendaoud A. (Bendaoud, 2014) ... 24
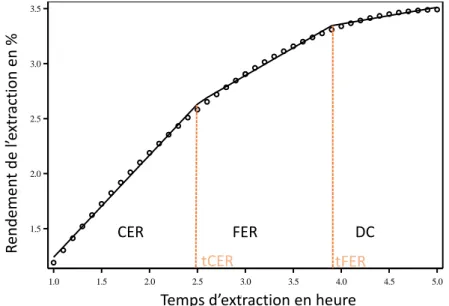
Figure 1-8 : Courbe de suivi cinétique montrant les différentes périodes de transfert de masse pendant l’extraction par fluide supercritique (exemple de l’épinard) ... 27
Figure 1-9: diagramme de l'installation de laboratoire utilisée pour les extractions ... 29
Figure 1-10: Représentation de la solubilité totale du CO2 supercritique obtenue par utilisation de l’équation 1.6, donc en fonction de la pression et de la température. . 38
Figure 1-11: Sphère de solubilité de Hansen ... 39
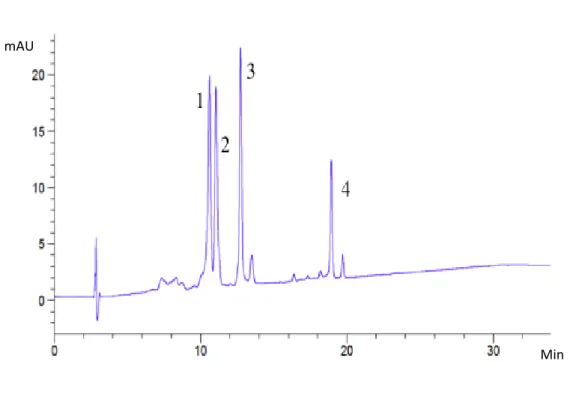
Figure 3-1: HPLC chromatogram of total extraction of lutein and chlorophyll obtained using conventional solvent extraction i.e acetone, measured at 450 nm by UV/vis detector ... 54
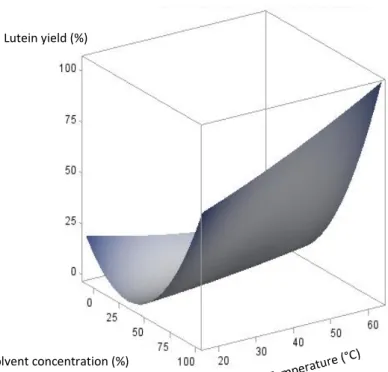
Figure 3-2: Response surface 3D plots showing the interaction effect of extraction temperature and solvent concentration on lutein yield ... 59
Figure 3-3: Response surface 3D plots showing the interaction effect of extraction temperature and solvent concentration on chlorophyll yield ... 60
Figure 4-1: RP-HPLC chromatograms of lutein and chlorophyll from spinach by-products, on a C30 column, at 450 nm (see Material and Methods for details). A) acetone extract; B) ethanolic extract performed after saponification. Peak identification: (1) chlorophyll b ... 80 Figure 4-2: Response surface plots of chlorophyll recovery from spinach by-products for
different combinations of saponification parameters (time, temperature and concentration of sodium hydroxide). ... 84 Figure 4-3: Response surface plots of lutein recovery from spinach by-products for
different combinations of saponification parameters (time, temperature and concentration of sodium hydroxide). ... 85 Figure 5-1: SC-CO2 process flow diagram ... 99
Figure 5-2: HPLC chromatogram of SC-CO2 of extraction of lutein and chlorophyll obtained at different extraction conditions measured at 450 nm by UV/vis detector. Peak identification: (1) lutein (2) β-caroten (3) chlorophyll b (4) chlorophyll a. ... 105 Figure 5-3: Prevision 3D plots outputs after maximization of the desirability function for
extraction yields of lutein and chlorophyll ... 114 Figure 6-1: SC-CO2 process flow diagram ... 126 Figure 7-1: Process flow diagram of the design factory ... 152 Figure 7-2: 3D plots exhibiting the influence of pressure and temperature on the extraction
yield... 156 Figure 7-3: HPLC chromatogram of SC-CO2 of extraction of lutein and chlorophyll
obtained at different extraction combination parameters, with and without modifier, at 450 nm by UV/vis detector. Peak identification: (1) lutein (2) 𝛽-caroten (3)
chlorophyll b (4) chlorophyll a. ... 157
Figure 7-4: Direct manufacturing cost repartition, in percentage ... 159 Figure 7-5: Cost of utilities repartition in percentage ... 160
Liste des tableaux
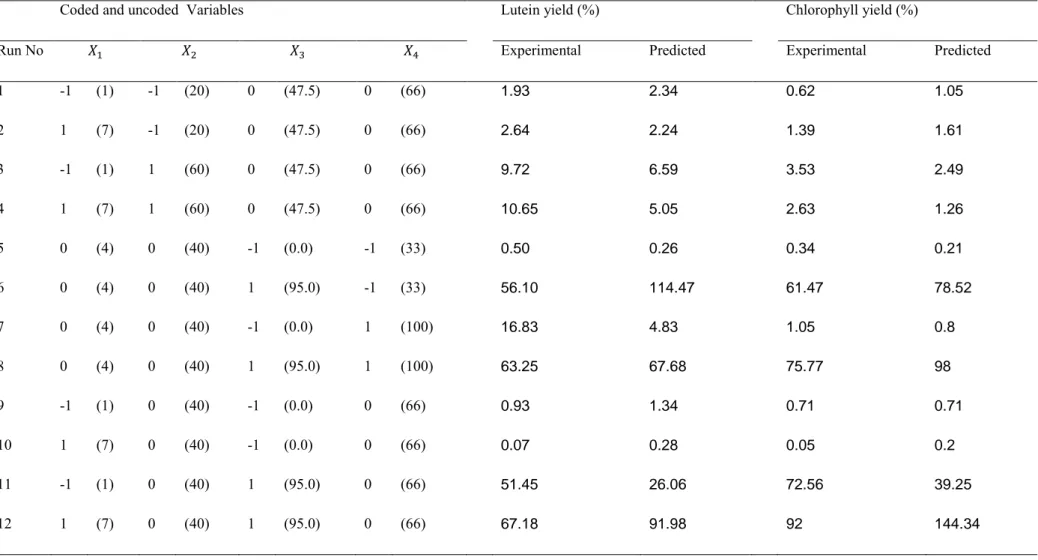
Tableau 1-1: Présentation des techniques d’extraction conventionnelles... 15 Tableau 1-2: Présentation des différents solvants verts ... 20 Tableau 1-3: Températures et pressions critiques de différents composés purs ... 23 Tableau 3-1: Box Behnken matrix with predicted and experimental response values for
lutein and chlorophyll ... 55 Table 3-2: Analysis of variance (ANOVA) of quadratic polynomial model for lutein and
chlorophyll responses... 57 Table 3-3: Regression coefficients for the estimated yields in lutein and chlorophyll ... 61 Tableau 4-1: : Recovery of lutein and chlorophyll for different combinations of
saponification parameters ... 81 Tableau 4-2: Regression coefficients for the lutein and chlorophyll variable ... 82 Table 4-3: Multivariate analysis and desirability value predict by the statistical model .. 89 Tableau 5-1: Regression coefficients for the estimated yields in lutein and chlorophyll 107 Tableau 5-2: Regression coefficients for the estimated yields in lutein and chlorophyll 109 Table 6-1: Experimental results of ScCO2 extraction of lutein and chlorophyll ... 132
Tableau 6-2: Structures and hansen solubility parameters of Lutein and Chlorophyll... 134 Table 6-3: Hansen solubility parameters of CO2 at different conditions ... 136
Table 6-4: Distance and solubility of lutein and chlorophyll in different conventional solvents ... 137 Table 6-5: Distance and solubility of lutein and chlorophyll at different pressure condition
Tableau 7-1: Operating conditions used to run the simulation ... 150 Tableau 7-2: Repartition of the equipment energetic consumption per batch ... 161 Tableau 7-3: Total yearly operating cost calculation based on the Turton methodology162 Tableau 7-4: Yearly cost directly connected to the operation for the design plant ... 166 Tableau 8-1: Rendements d'extraction de l'expérience par fluide supercritique ... 173
Remerciements
Je tiens tout d’abord à remercier mon directeur de thèse, Paul Angers, pour m’avoir donné l’opportunité de réaliser ce doctorat et de mener à bien ce projet. Aussi, j’ai apprécié la liberté de décision au cours de ces années, m’ayant permet d’acquérir beaucoup d’autonomie. Je voudrais aussi le remercier pour son soutien et ses conseils tout au long de cette thèse. Je tiens également à remercier André Gosselin, co-directeur de ce projet, pour avoir partagé sa vision industrielle du projet à travers ce fructueux partenariat industriel avec DianaFoodCanada (anciennement Nutra Canada). Je voudrais également remercier Yacine Boumghar, également co-directeur du projet, pour m’avoir permis d’accéder aux équipements du CEPROCQ et de fait m’avoir permis d’acquérir des précieuses connaissances sur les fluides supercritiques et les procédés chimiques. Aussi, je voudrais le remercier pour sa disponibilité et sa confiance en me confiant des projets très intéressants, ainsi que son très bon suivi dans les révisions de mes articles. Je remercie aussi Yves Desjardins pour sa grande disponibilité et ses révisons de qualités de mes articles. J’ai grandement apprécié vos conseils donnés tout au long de ma thèse. Je tiens également à remercier Milad Aghabaranejad pour sa grande disponibilité, ses conseils et la révision de mes articles.
Je tiens aussi à exprimer ma gratitude envers les partenaires industriels du projet, DianaFood et Vegpro international. Aussi, je voudrais remercier le Fond de recherche nature et technologie du Québec (FRQNT) et le conseil de recherches en sciences naturelles et en génie du Canada (CRSNG) pour le financement de cette thèse par l’obtention d’une bourse BMP (Bourse en milieu pratique).
Je tiens également à remercier l’équipe de la plateforme analytique, Pascal Dubé, Véronique Richard, Perrine Feutry et Stéphanie Dudonné pour leurs disponibilités, leurs conseils, la qualité de leurs expertises et leur soutien tout au long de ces 3 années. Merci également à mes collègues de laboratoire Ashraf, Christiana, Minty, Rafik, Ines, Ishrak pour les moments passés ensembles. Aussi, je voudrais remercier le personnel du CEPROCQ pour leurs disponibilités et leurs patiences au cours de mon passage.
Je voudrais également remercier tous mes collègues et amis INAFiens, Camille, Mérilie, Joseph, Alex, Ana-Sofia, Juan, Jeremie, Benedicte, Lémia et tous les autres pour
les lunchs, les moments passés au soccer (Vive l’équipe des Bas-Longs !) ainsi que les nombreux restos, soirées et 5 à 7 partagés. Une petite pensée supplémentaire à Jérémie, Perrine et Véro pour les pauses chocolats bien méritées à leur bureau.
Je voudrais également remercier tous mes amis Vincent, Marine, Benjamin, Samuel, Marie Lugaz, Marie Verheyde, Valentin, Camille, Mérilie, Émilie et Francis, de fait, à tous les membres abonnés de la cagette espagnole, pour leurs soutiens, les moments passés ensemble et leur présence assidue aux apéros.
Je voudrais remercier bien évidemment mes parents, pour m’avoir encouragée et soutenu tout au long de cette thèse par les nombreux appels Skype. Merci également de m’avoir donné tout au long de ma vie les outils me permettant de prétendre maintenant au grade de docteur. Cette réalisation est en grande partie possible grâce à vous.
Je tiens également à remercier Jeremy, mon partenaire de vie, qui a été suffisamment patient pour me soutenir et me supporter au cours de ces 3 années de thèse même dans mes moments de stress et de doutes. Merci également de me soutenir ou de me canaliser dans toutes mes idées un peu « farfelues » (Le Mont Denali en Alaska c’est toujours non ?)
Avant-propos
Cette thèse comporte 8 chapitres. Les résultats principaux sont présentés sous forme d’articles scientifiques, soumis ou publiés dans des journaux avec comités de lecture. Le premier chapitre introduit le sujet en présentant l’état de l’art concernant les propriétés santé de l’épinard, reliés directement à son contenu en biomolécules, notamment en lutéine et en chlorophylle. Aussi, ce premier chapitre présente le principe de l’extraction verte et son enjeu dans la société, avec une brève introduction aux méthodes conventionnelles et novatrices qui y sont associées. Ces méthodes d’extraction écologiques constituent une bonne solution de remplacement des solvants pétrochimiques, toujours utilisés pour l’extraction des biomolécules dans le monde de l’industrie pharmaceutique et nutraceutique.
À la suite de cette revue de la littérature, le chapitre 2 présente la problématique et l’hypothèse de ce projet, dont découleront naturellement l’objectif principal et les objectifs spécifiques. S’en suivra dans les chapitres 3, 4, 5, 6 et 7, contenant les résultats principaux répondant aux différents objectifs présentés.
Le chapitre 3 présente une optimisation de l’extraction écologique de la lutéine et de la chlorophylle à partir de sous-produits d’épinards selon une méthode d’extraction conventionnelle avec utilisation d’eau et d’éthanol, deux solvants verts, et des surfaces de réponse comme outil statistique. Les résultats ont été publiés sous forme d’un article scientifique intitulé Optimization of a green process for the extraction of lutein and
chlorophyll from spinach by-products using response surface methodology (RSM),
publié dans LWT, journal of Food Science and Technology dont les auteurs sont Maëlle
Derrien ; Ashraf Badr ; André Gosselin ; Yves Desjardins ; Paul Angers. (79, 170–177.
http://dx.doi.org/10.1016/j.lwt.2017.01.010)
Le chapitre 4, présente une optimisation de l’extraction et une séparation de la lutéine et de la chlorophylle à partir de sous-produit d’épinard avec des solvants verts et de l’hydroxyde de sodium. Cet article a été soumis au Journal of Food Engineering et s’intitule
Optimization of a sustainable purification of lutein and chlorophyll from spinach by-products by a saponification procedure using Box Behnken design and desirability
function. Les auteurs sont Maëlle Derrien; Ashraf Badr; André Gosselin; Yves Desjardins;
Paul Angers.
Le chapitre 5 introduit l’extraction de la lutéine et de la chlorophylle par fluide supercritique et l’optimisation des paramètres en adoptant les principes des surfaces de réponses comme outils statistique. Ce chapitre fait aussi l’objet d’une publication qui s’intitule Optimization of a sustainable SC-CO2 extraction of lutein and chlorophyll from spinach by-products using response surface methodology, accepté dans LWT,
journal of Food Science and Technology. Les auteurs sont Maëlle Derrien, Milad
Aghabaranejad, André Gosselin, Yves Desjardins, Paul Angers, Yacine Boumghar.
Le chapitre 6, présente le développement d’un outil de prédiction de la solubilité des composés phytochimiques dans le dioxyde de carbone supercritique. Ce chapitre fait l’objet d’un article scientifique, soumis à journal of supercritical fluids et s’intitule
Modelization of the supercritical carbon dioxide solubility of carotenoids and chlorophyll using Hansen theory. Les auteurs sont Maëlle Derrien, Milad
Aghabaranejad, André Gosselin, Yves Desjardins, Paul Angers, Yacine Boumghar.
Le chapitre 7 étudiera la faisabilité du procédé d’extraction de la lutéine et de la chlorophylle par fluide supercritique par une analyse technico-économique du procédé. Ce chapitre fait également l’objet d’un article scientifique, soumis à journal of supercritical fluids dont les auteurs principaux sont Maëlle Derrien, Milad Aghabaranejad, André
Gosselin, Yves Desjardins, Paul Angers, Yacine Boumghar. Cet article s’intitule
Supercritical fluid extraction from spinach by-products: process design and economic analysis.
Enfin, le chapitre 8 présente une discussion plus large et une conclusion faisant le lien entre tous les chapitres présentés et tout en faisant ressortir les perspectives qui découlent de ce projet.
L’auteur de la thèse, à savoir Maëlle Derrien, était responsable de la planification, de l’exécution des manipulations aux laboratoires, ainsi qu’à l’interprétation de ces derniers et aussi à la rédaction des différents articles présentés. L’auteur est d’ailleurs le premier auteur de tous les articles rédigés dans le déroulement de cette thèse. Le Dr Paul Angers, directeur de la thèse, et les Dr André Gosselin, Yacine Boumghar, co-directeurs de la thèse ont participé à la planification des travaux de recherche, à la discussion des résultats lors de réunions ainsi qu’à la révision des articles présentés. Le Dr Yves Desjardins a également participé à la planification des travaux de recherche, à la discussion des résultats lors de réunions ainsi qu’à la révision des articles présentés. Le Dr Milad Aghabaranejad a participé à l’interprétation et à la discussion des résultats, a réalisé la simulation du procédé à l’échelle industrielle sur Aspen présenté au chapitre 7 et enfin à la révision des articles présents dans les chapitres 5, 6 et 7. Le Dr Ashraf Badr a contribué à la discussion des résultats et la planification des expériences conventionnelles (chapitres 3 et 4).
Introduction
De nombreuses études épidémiologiques ont montré qu'une alimentation saine et riche en fruits et légumes a un impact positif sur la santé et réduit l’incidence négative du risque de plusieurs maladies chroniques comme le cancer, les maladies cardio-vasculaires, le diabète. En plus d’une alimentation saine, l’engouement des consommateurs pour les compléments alimentaires et les aliments fonctionnels, composés ou enrichis en molécules issus des plantes n’a cessé de croître au fils des années (Ferruzzi and Blakeslee, 2007a; Herrero et al., 2006). En effet, tout comme une alimentation saine, ces composés sont à l’origine d’effets bénéfiques sur les fonctions physiologiques en augmentant le bien-être et en diminuant les risques des différentes pathologies citées plus haut. Ce phénomène s'explique par la présence de composés phytochimiques contenus dans les plantes. Ces dernières possèdent en effet plusieurs groupes de molécules ayant une activité biologique avérée agissant sur les cellules de notre organisme. Ces molécules appartiennent par exemple à la famille des polyphénols, terpénoïdes, alcaloïdes et des composés soufrés. Les composés phytochimiques sont connus pour leur capacité à stimuler la réponse immunitaire et aussi leurs propriétés antioxydantes, anti-radicalaires, anti-inflammatoires (Dudonne et al., 2009; Humayoun Akhtar and Bryan, 2008).
De ce fait, il est intéressant d’effectuer une valorisation des molécules bioactives contenues dans les fruits et légumes. Beaucoup de légumes déclassés ou rejetés par l’industrie maraîchère contiennent de fortes concentrations en de molécules fonctionnelles, mais restent peu exploités. La valorisation de ces sous-produits végétaux est donc susceptible de fournir des extraits riches en composés fonctionnels leur donnant des propriétés bénéfiques pour la santé humaine et animale.
L’épinard (Spinacia oleracea L.) est un légume très consommé partout à travers le monde. La surface cultivée d’épinard au Canada atteint 822 hectares, avec un rendement de 7,1 tonne par hectares. On retrouve par contre des taux élevés de pertes qui peuvent atteindre près de 25%, soit 1,75 tonne par hectares, dont une bonne partie peut être valorisée (Canada, 2013; L´Agriculture and Statistique, 2013). Les épinards sont connus pour être une bonne source de caroténoïdes (lutéine et son isomère la zéaxanthine) et de chlorophylle (Bunea et al., 2008a). La chlorophylle et la lutéine sont des molécules essentielles à la vie sur terre étant essentielles à la photosynthèse. Elles confèrent par
ailleurs la couleur aux légumes et à plusieurs fruits. Les extraits ainsi obtenus peuvent être utilisés sur le marché des ingrédients pour diverses utilisations par exemple pour servir de colorant naturel ainsi que d’ingrédients pouvant entrer dans la composition d’aliments fonctionnels. En effet, ces deux molécules présentent des effets santé (antioxydant, anti-inflammatoire, anti-mutagène) avérés par de nombreux auteurs ( Schoefs, 2002; Ferruzzi and Blakeslee, 2007a; Kijlstra et al., 2012; Lienau et al., 2003; Sharma et al., 2007; Simonich et al., 2008).
Compte tenu de la nature hydrophobe de plusieurs molécules bioactives, l’extraction de substances naturelles nécessite l’usage de solvants organiques et demeure la méthode la plus utilisée dans l’industrie. Les solvants pétrochimiques sont des solvants très efficaces, car ils dissolvent des solutés d’intérêts facilement et leur volatilité facilite grandement leur élimination en fin de procédé. Toutefois, ces solvants organiques sont nocifs et potentiellement cancérigènes, en plus d'être impliqués dans la pollution environnementale. Aussi, l’épuisement progressif des ressources pétrolières pousse les industriels à se pencher sur une solution plus durable et plus respectueuse à la fois de l’environnement et des consommateurs. Le domaine de l’extraction végétale, sous l’influence des évolutions sociétales et économiques, valorise le développement de techniques d’éco-extraction permettant une extraction saine et sécuritaire pour le consommateur et l’environnement tout en étant peu coûteuses (Chémat, 2010). Les extraits obtenus au cours de ce projet auront une haute teneur en molécules bioactives qui leurs permettrons d’améliorer la santé animale et humaine ainsi que d’intégrer le marché des ingrédients fonctionnels. Les techniques qui seront utilisées pour l’extraction de la lutéine et de la chlorophylle ont été choisies pour leurs caractères innovants et pour répondre au mieux aux contraintes écologiques de ce projet.
Ce projet a donc pour but de valoriser les légumes déclassés ou rejetés de l’industrie maraîchère. Plus spécifiquement, ces travaux porteront sur l’épinard et l’optimisation de procédés écologiques d’extraction et de purification de la lutéine et de la chlorophylle permettant d’obtenir de nouveaux extraits potentiellement bioactifs pour une utilisation en nutrition animale. Les techniques d’extraction utilisées dans ce projet respecteront les procédés d’éco-extraction avec l’utilisation de techniques innovantes et de solvants verts.
1.1 Valorisation de sous-produits issus de l’agriculture : Choix de l’épinard.
1.1.1 Valorisation des déchets et chimie verte : Principes
La valorisation des sous-produits issus de l’agriculture intensive et du domaine de la transformation alimentaire a été introduite pour répondre au gaspillage alimentaire et aussi pour permettre la limitation de l’utilisation des sources énergétiques fossiles. D’autre part, la gestion des déchets est particulièrement coûteuse pour les différents secteurs concernés. Pour ces raisons, l’industrie ainsi que les instances gouvernementales sont intéressées à exploiter et valoriser ces sous-produits, constituant un matériel très prometteur représentant plusieurs mégatonnes chaque année à travers le monde (Martins and Ferreira, 2017).
Selon la nature des sous-produits à valoriser, différentes méthodologies de valorisation sont privilégiées. Ainsi, une des voies de valorisation très prometteuse sur le plan économique et écologique est la transformation de ces déchets en produits chimiques, en biocarburants et en biosolvants. Par exemple, les huiles alimentaires usagées peuvent être transformées en biocarburants, les sous-produits de la vinification comme le marc de raisin peuvent fournir des molécules pour l’industrie pharmaceutique et les graisses animales fondues peuvent être valorisées par l’industrie chimique. D’autres types de sous-produits peuvent intégrer le marché de l’alimentation animale pour leurs propriétés nutritionnelles. Les déchets issus de l’agriculture et de la pêche sont également largement valorisés pour leurs contenus en composés bioactifs (Tuck et al., 2012). Les molécules retrouvées dans les fruits et les légumes peuvent être valorisées afin d’intégrer le domaine de la santé et des aliments fonctionnels, permettant ainsi la diminution de l’incidence des maladies chroniques (Lam et al., 2014; Peschel et al., 2006).
Ce projet se concentrait plus particulièrement sur l’exploitation phytochimique des sous-produits issus de l’industrie maraîchère tels que l’oignon, le brocoli, l’asperge et l’épinard, en partenariat avec deux entreprises locales au Québec : Vert Nature et DianaFood Inc. Plus particulièrement, notre projet se penche sur la valorisation phytochimique de l’épinard.
1.1.2 L’épinard : Botanique et production mondiale
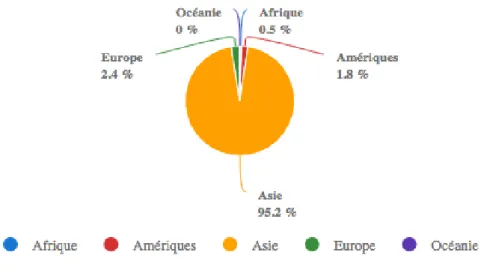
L’épinard est un légume feuille, cultivé dans le monde entier. La Chine est le premier producteur mondial d’épinard, avec plus de 2207220 tonnes produites en 2014 et une surface cultivée d’environ 760000 hectares, correspondant à plus de 90% de la production
mondiale. Les États Unis suivent, avec 350410 tonnes produites cette même année pour une surface cultivée de 18870 hectares. Le Canada est un faible producteur d’épinard, avec une production chiffrée à 5611 tonnes en 2014, pour une surface cultivée de 688 hectares. Sa production a augmenté de façon très importante, avec une augmentation de 419% depuis les années 1970. Toutefois, la consommation d’épinard en Amérique du Nord reste inférieure à celle d’autres légumes verts feuillus, tels que la salade, le kale et la laitue. Les déchets issus de cette production sont estimés pour l’épinard à 25%, représentant pour le Canada seul, en 2014, 1400 tonnes de déchets exploitables pour la valorisation en composés phytochimiques. (Source : FAO STAT http://www.fao.org/faostat/fr/#data/QC).
Figure 1-1: Situation mondiale de la production d'épinard (Source : FAO STAT http://www.fao.org/faostat/fr/#data/QC/visualize)
Figure 1-2: Répartition mondiale de la production d'épinard (Source : FAO STAT http://www.fao.org/faostat/fr/#data/QC/visualize)
1.2 Intérêt santé de l’épinard
Les épinards sont connus pour avoir des propriétés antioxydantes, anti-inflammatoires, antiprolifératives, anti-obésité, hypoglycémique et enfin de réduction des lipides sanguins, permettant par ces différents effets la réduction des maladies chroniques. Des études in vitro et in vivo ont été réalisées dans ce sens, sur des modèles cellulaires, animaux et des modèles humains. Le plus souvent, ces études ont été réalisées avec des extraits aqueux ou éthanoliques d’épinards (effet antioxydant, anti-inflammatoire), des échantillons d’épinards lyophilisés, des extraits de thylakoïdes (effet anti-obésité, hypoglycémique, diminution de lipides sanguins), des repas avec des épinards frais, des extraits d’épinards obtenus avec de l’acétone, des fractions de glycolipides (anticancer) (Roberts and Moreau, 2016). Une autre étude a également démontré une modulation du microbiote intestinal lors de la prise d’extrait de thylakoïdes d’épinards (Montelius et al., 2013). Ces effets sont expliqués par la composition de l’épinard, contenant 92 % d’eau, 2,9 % de protéines, 3,6 % de glucides et 0,4 % d’acide gras. Parmi ces acides gras, des acides gras mono- et polyinsaturés (acide linoléique, alpha linolénique et oléique) ont été principalement caractérisés. Quelques traces d’acides gras saturés (acide caprique, myristique et stéarique) ont également été détectées. L’épinard a également une quantité non négligeable de fibres (2,2 g pour 100 g d’épinard frais, soit 9 % de la quantité recommandé par jour et par portion). Enfin, cette plante à une haute valeur nutritionnelle due à la présence de fortes teneurs en minéraux (Fe, Mg, Mn) et de vitamines (A, B9, K,
C). Une portion de 100 g d’épinard permet d’atteindre voir même de dépasser les recommandations journalières de certaines vitamines et de certains minéraux, comme c’est le cas pour la vitamine C (47 % des besoins journaliers couverts), la vitamine K (604 %), la vitamine A (188 %), folate (49 %), Mg (20 %), K (16 %) et Fe (15 %).
L’épinard contient également des composés phytochimiques tels que les caroténoïdes, les polyphénols et la chlorophylle (Bunea et al., 2008). Les composés phytochimiques sont des nutriments non essentiels pour l’homme, mais présents de façon ubiquitaire dans les plantes. Ils possèdent notamment des effets santé avérés par de nombreux auteurs(Roberts and Moreau, 2016). Les composés phénoliques sont présents de façon importante dans l’épinard. Ils produisent des métabolites secondaires en réponse à un stress comme lors d’une exposition aux UV, aux pathogènes, aux basses températures et à un déficit en nutriments. Leurs proportions dans les épinards sont 40 à 70% plus élevées que dans les laitues et salade, en faisant donc une source très intéressante.
La quantité de chlorophylle retrouvée dans les épinards est d’environ 130 mg pour 100 g d’épinard frais (Ferruzzi and Blakeslee, 2007a; Khachik et al., 1986). Le caroténoïde majoritaire contenu dans l’épinard est la lutéine dont la concentration dans cette plante varie entre 3,9 et 9,5 mg pour 100 g d’épinard frais comparativement à 6,4-15 mg pour 100 g de kale frais et 1.5-2.8 pour le brocoli (Burri, 2013). La présence de la lutéine est masquée par la chlorophylle qui donne à la feuille sa couleur verte. La lutéine et la chlorophylle sont également impliquées dans les effets santé des extraits d’épinards de par leurs effets anti oxydant, anti-inflammatoire et antimutagène.
1.3 Les composés majeurs d’intérêt dans l’épinard
1.3.1 La chlorophylle
1.3.1.1 Description
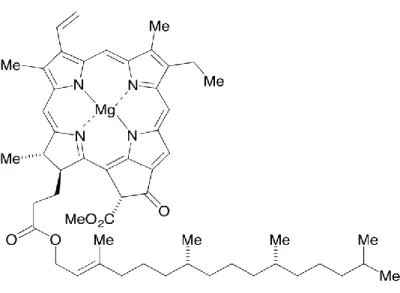
La chlorophylle est un pigment vert largement distribué dans la nature. Cette molécule est responsable de la couleur verte des feuilles et de la capture de l’énergie lumineuse utilisée lors de la photosynthèse. Les chlorophylles trouvées dans les fruits verts et les légumes sont les chlorophylles a et b, avec une concentration plus importante de la chlorophylle a selon un rapport 3 pour 1. Elles ne diffèrent entre elles que par de petits détails de structure. La chlorophylle a est la seule à se retrouver dans tous les végétaux. La chlorophylle est constituée de deux parties, une tête hydrophile formée d’une porphyrine et d’une longue queue aliphatique hydrophobe ou phytol. Elle contient aussi un ion magnésium en son centre formant un chélat avec les quatre autres atomes d’azote (Figure 1). La chlorophylle b est identique à la chlorophylle a sauf qu’elle possède un groupement formyle (-CHO) à la place du groupement méthyle (-CH3) sur le noyau pyrrolique II, en position 7 (Hopkins, 2003). Dans la plante, la chlorophylle est essentiellement localisée au dans les membranes des thylakoïdes des chloroplastes. La chlorophylle est composée d’un circuit fermé de doubles liaisons conjuguées et d’électrons délocalisés lui permettant d’absorber la lumière (Scheer, 2013; Schoefs, 2002)
1.3.1.2 Les dérivés de la chlorophylle
En plus de la chlorophylle a et b, il existe de nombreux dérivés de cette molécule, qui se forment lors d’un traitement à la chaleur ou lorsque que la molécule est mise en contact avec un milieu acide, ou alors avec une dégradation enzymatique (Huang et al., 2008). Il s’agit de la phéophytine a et b, la pyrophéophytine a et b, la phéophorbide a et b et la chlorophyllide a et b, présents dans les plantes (Pumilia et al., 2014).
La chlorophylle est une molécule très sensible, car elle contient une longue chaîne aliphatique insaturée. Cette chaîne réagit facilement avec les acides, bases, l'oxygène et est également très sensible à la chaleur et à la lumière. (Schoefs, 2002). À cause de sa forte réactivité, la chlorophylle est susceptible d'être dégradée en différents dérivés par les procédés industriels de transformation des aliments et aussi par la digestion (Ferruzzi and Blakeslee, 2007a).
Les procédés utilisant de la chaleur ou un milieu acide (lors de la digestion par exemple) induisent la transformation de la chlorophylle à l'origine verte en des produits de couleur marron. La perte de la couleur verte est caractéristique de la phéophitinization, une réaction provoquée par la libération de l'ion Mg2+ de la molécule de chlorophylle qui se dégrade en phéophitine et en pyrophéophitine. L'activité de la chlorophyllase est augmentée par les procédés utilisant de la chaleur, induisant des dérivés nommés chlorophyllide. Cette enzyme catalyse l'hydrolyse de l'ester de phytol de la molécule initiale.
Des formes de chlorophylle semi-synthétiques sont plus résistantes faces aux procédés alimentaires, ayant souvent des étapes utilisant des températures élevées. En effet, le remplacement de l'ion Mg2+ des métallochlorophylles par l'ion Zn2+ et Cu2+ (réaction nommée « regreening ») va rapidement former des Zn ou Cu-phéophitine ainsi que des Zn ou Cu-pyrophéophitine. Ce procédé est fait avant un traitement thermique pour augmenter de façon significative la stabilité de la molécule à la chaleur, car les Zn ou Cu chlorophylles sont connus toutes les deux pour leurs grandes stabilités à la chaleur et aux procédés industriels par rapport à la chlorophylle native. D’autres dérivés commerciaux de la chlorophylle telle que la SCC (sodium copper chlorophyllin) sont solubles dans l’eau, ce qui présente différents avantages lors de l’élaboration d’extraits. En effet, il s’agit de molécules très stables, résistant à la chaleur et aux variations de pH et ayant aussi un faible coût. Dans ce cas, le magnésium de la porphyrine a été remplacé par l’ion
Cu2+ avec un traitement par un hydroxyde de sodium méthanolique. Le produit final
obtenu est un mélange de nombreux types de composés chlorés dérivés de la chlorophylle naturelle, dont les principaux sont le Cu-chlorin-e4, le Cu-chlorin-e6, le Cu pheophorbide a et le Cu-rhodin g7 (Ferruzzi and Blakeslee, 2007b; Inoue et al., 1994). Ce type de dérivé soluble commercial de la chlorophylle est utilisé de façon importante en Europe et moins importante aux États-Unis (Ferruzzi and Blakeslee, 2007b; Ferruzzi et al., 2002). Ces molécules transformées de chlorophylle sont utilisées afin d'améliorer la couleur verte dans les procédés de mise en conserve des denrées alimentaires par exemple.
1.3.1.3 Les effets bénéfiques de la chlorophylle et de ses dérivés
La chlorophylle et ses dérivés ont été étudiés pour leurs effets sur l'organisme, car ils possèdent des effets bénéfiques sur la santé des individus.
Les dérivés de cette molécule ont montré des activités biologiques in vivo et in vitro telles que la prévention du cancer, liées à leurs activités antioxydantes, antimutagènes et pro apoptotiques. Les dérivés de la chlorophylle ont aussi des applications médicales, comme le traitement photodynamique du cancer dûe à leur propriété photosensible (Ferruzzi and Blakeslee, 2007b) (Ferruzzi et al., 2002). De récentes études ont montré un lien entre la consommation de la chlorophylle et la diminution du risque de cancer colorectal. Dans l’estomac, la chlorophylle est dégradée en phéophytine sans métal en présence du milieu acide de cet organe. Cette molécule étant liposoluble, elle sera absorbée par les cellules intestinales. Cette absorption étant limitée et variant selon la concentration, une grande quantité de chlorophylle se retrouve dans le gros intestin où elle est dégradée par le microbiote. De plus, une activité anti-génotoxique luttant contre les dommages de l’ADN par la chlorophylle a et b et la chlorophylline a été démontrée (Bez et al., 2001) ainsi qu’un effet inhibiteur de la phéophorbide sur l’apparition de cancers de la peau chez la souris. La capacité antioxydante de la chlorophylle naturelle est variable, tout dépendant de sa structure moléculaire, mais elle reste néanmoins significativement inférieure à celle de son dérivé soluble, la SCC (Fernandes et al., 2007; Tumolo and Lanfer-Marquez, 2012). La chlorophylline (SCC) a suscité beaucoup d’attention au cours des dernières années en raison de sa forte activité santé et ceci sans effet secondaire. Plusieurs études ont révélé que les chlorophyllines ont une influence sur diverses molécules et voies de signalisation cellulaires impliquées dans la prolifération cellulaire, l’inflammation, l’apoptose, les défenses antioxydantes, l’angiogenèse, le métabolisme des molécules cancérigènes (Kamat et al., 2000; Nagini et al., 2015; Sharma et al., 2007). Dans ce
dernier cas, la chlorophylline agit en tant qu’intercepteur des molécules cancérigènes pendant le temps de l’exposition en formant des complexes avec le composé toxique rendant difficile son absorption (Fernandes et al., 2007).
En plus de son excellent effet santé, la chlorophylline est également une molécule facilement assimilable par l’organisme, en comparaison avec la chlorophylle. En effet, la chlorophylle naturelle, connue pour sa sensibilité aux pH extrêmes va être dégradée dans l’estomac en dérivés lipophiles (phéophitine, Zn-phéophitine). Le caractère apolaire de ces dérivés nécessite une étape de mycelisations avant d’être absorbé par les cellules intestinales. Les dérivés SCC n’ont pas besoin d’être solubilisés par les micelles pour leur absorption. Ces dérivés sont également résistants aux pH acides de la digestion. De plus, une faible quantité de dérivés naturels de chlorophylle sera assimilée par rapport à la quantité ingérée (de 5 à 10 %), mais étant donné la forte présence de chlorophylle dans l’alimentation, même si une faible proportion est assimilée elle se retrouvera quand même à une concentration significative au niveau intracellulaire des tissus cibles comme l’intestin. En comparaison avec les dérivés de la chlorophylle naturelle, les dérivés semi-synthétiques comme la SCC montrent une absorption de 45 à 60% par les cellules intestinales en culture.
Hormis ses nombreux effets santé et son utilisation comme complément alimentaire, la chlorophylle est susceptible d’avoir d’autres applications pour l’industrie agroalimentaire. En effet, cette molécule est largement utilisée comme colorant alimentaire. Il est possible de distinguer le colorant alimentaire naturel vert issu de la chlorophylle native (E140), et les colorants alimentaires verts semi-synthétiques comme la Cu-chlorophylline (E141) (Humphrey et al., 1980).
1.3.2 La lutéine
1.3.2.1 Description
Les caroténoïdes, formant une famille de pigments oranges et jaunes présents dans les organismes photosynthétiques. Ils sont présents en grandes quantités dans les plantes (les fleurs, les fruits et les feuilles) plus précisément dans les carottes, tomates, les épinards. Les caroténoïdes sont localisés dans la membrane des plastes (Arnold et al., 2014). Il s'agit d'une molécule de 40 carbones ayant pour formule chimique C40H56, formée de 8
unités isopréniques dont quatre sont l’image inversée en son centre des quatre autres. Ces molécules appartiennent à la famille des terpénoïdes et possèdent deux extrémités
cyclisées. Le précurseur des caroténoïdes est le phytoène (molécule linéaire de 40 C) qui est synthétisé par condensation de deux molécules de géranyl pyrophosphate (molécule à 20C), elles-mêmes synthétisées par condensation de quatre molécules d'isoprène pyrophosphate (molécule à 5C). Le phytoène subit ensuite des désaturations, cyclisations à ses extrémités pour former les carotènes. Le carotène va ensuite être hydroxylé pour former les xanthophylles, la famille de molécules contenant la lutéine et son isomère la zéaxanthine. Les caroténoïdes peuvent donc être divisés en deux classes distinctes à savoir les carotènes qui n'ont pas de fonction OH et les xanthophylles, comme la lutéine, qui en contiennent deux. La structure chimique de ces molécules les rend lipophiles et donc insolubles dans l'eau. Les caroténoïdes sont retrouvés majoritairement en configuration trans, mais également quelques-uns assez stables en configuration cis (Rodriguez, 2001; Scheer, 2013; schoefs, 2005). La répartition de ces molécules au sein de la cellule est influencée par leur caractère hydrophobe. Une fois assimilés par l’organisme, les caroténoïdes sont répartis au niveau de la bicouche lipidique membranaire des cellules. La configuration trans présente plus d'avantages à ce niveau, car elle facilite l'insertion dans les membranes. A l'aide de leurs groupements hydroxyles, la lutéine et la zéaxanthine vont interagir avec les têtes polaires de la bicouche lipidique créant un déplacement de ces caroténoïdes qui vont alors se positionner d'une façon qui permet de modifier la fluidité de la bicouche lipidique (Carpentier et al., 2009). Les caroténoïdes, et tout particulièrement les xanthophylles, sont des molécules sensibles à l’isomérisation et à l’oxydation. En effet, les caroténoïdes ont une sensibilité différente pour l’oxydation, la lutéine étant plus instable que d’autres molécules de cette même famille. C’est la raison principale de la dégradation de ces molécules. L’isomérisation de la forme trans de ces molécules vers la forme cis induit une perte de leur bioactivité et de leur couleur. L’isomérisation et l’oxydation sont deux réactions se produisant dans les conditions régnant lors de la préparation, l’analyse, la conservation, la transformation des aliments : des précautions doivent être prises afin de prévenir tout risque de dégradations des caroténoïdes. La manipulation de la lutéine doit être réalisée à des températures faibles, inférieures à 60°C afin d’éviter sa dégradation (Gómez-Prieto et al., 2007; Macías-Sánchez et al., 2010). Les échantillons doivent être placés à l’abri de la lumière et protégés par de l’aluminium, car les rayons Ultraviolet (UV) induisent une photo-isomérisation provoquant de fait une photodégradation des molécules. La présence d’O2
et de tout autre agent oxydant dans les échantillons induit rapidement leur dégradation pour produire deux dérivés : l’époxycaroténoïde et les apocarotals (Britton, 1991).
Le marché mondial de la lutéine était d’environ 233 millions de dollars US en 2010 et il est devrait atteindre 308 millions de dollars en 2018, avec une croissance annuelle de 3,6 % (Lin et al., 2014). Actuellement, les extraits de lutéine proviennent essentiellement d’Asie et sont produits à partir de la fleur de souci (marigold) qui contient également une forte concentration de lutéine par rapport à l’épinard (21,6 à 97,6 mg/100g de matière fraîche).
Figure 1-4: Structure de la lutéine
1.3.2.2 Les effets bénéfiques de la lutéine
La lutéine, avec son isomère la zéaxanthine se retrouve au niveau de la rétine, avec une concentration importante dans la macula lutea. Elle a pour rôle de protéger cette région de l’œil contre la photo-oxydation. En effet, elle a un rôle dans la prévention de la dégénérescence maculaire liée à l’âge (AMD). La rétine est sensible au stress oxydatif à cause de sa demande en O2, son métabolisme aérobie et de la grande quantité d’acides
gras polyinsaturés qu’elle contient (Carpentier et al., 2009). La lutéine et la zéaxanthine représentent respectivement 36 et 18% des pigments caroténoïdiens contenus dans la rétine. La zéaxanthine est présente en plus grande concentration au niveau de la région centrale et la lutéine est plus abondante en régions périphériques. La lutéine et la zéaxanthine permettent également de réduire les dommages liés à la lumière (Ultra-violets) dans l’œil, plus particulièrement dans la macula lutea dû à la présence de doubles liaisons conjuguées dans leurs structures (le chromophore). (Carpentier et al., 2009). Aussi, à l’aide de liaisons spécifiques avec d’autres types de molécules, la lutéine pourrait protéger contre les accidents vasculaires cérébraux (AVC) et contre les maladies coronariennes (Kijlstra et al., 2012; Simonovska et al., 2013). Cette molécule à également un rôle dans l’amélioration de la fonction immunitaire et protégerait de certains cancers (Tanaka et al., 2012). La lutéine aurait aussi un impact sur les fonctions cognitives. Des auteurs ont en effet pu mettre en évidence un lien entre la démence chez des personnes âgées et la concentration de lutéine dans le cerveau (Johnson, 2012).
Des études portant sur la biodisponibilité des caroténoïdes montrent que la lutéine et son isomère le zéaxanthine sont stables durant le processus de digestion in vitro (Nimalaratne et al., 2015). La libération des caroténoïdes à partir de la matrice alimentaire suivie de leur absorption sont les facteurs déterminant leur bioactivité. En général, la biodisponibilité de la lutéine est affectée par un certain nombre de facteurs, comme les procédés industriels et la présence de lipides dans la matrice. Il a été observé que la biodisponibilité in vitro de la lutéine et la zéaxanthine atteint presque 100% à partir de fruits (orange, kiwi, pamplemousse et la patate douce), comparativement à 19% et 38% pour l’épinard et le brocoli (Abdel-Aal et al., 2013). La lutéine, comme les autres molécules de la famille des caroténoïdes est aussi un colorant alimentaire naturel.
1.4 Purification et extraction des molécules à l’étude
1.4.1 Techniques d’extractions conventionnelles
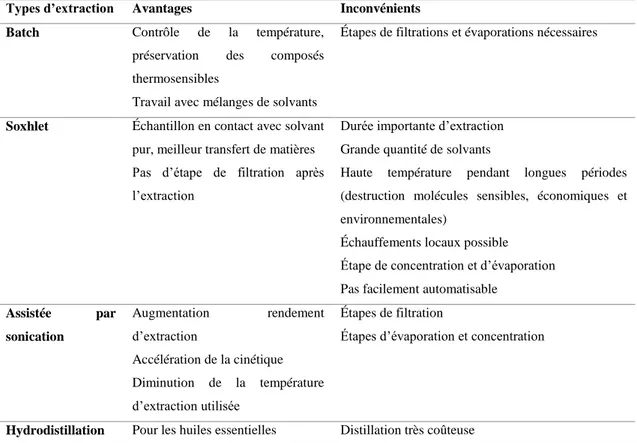
De nos jours, les techniques d’extraction, que ce soit pour l’industrie chimique, pharmaceutique ou même agroalimentaire, doivent répondre à plusieurs exigences, telles que la recherche de l’efficacité d’extraction du composé choisi, la sélectivité, la préservation de ce composé, ainsi que le choix de techniques dites « propres », pour la préservation de l’environnement. Les extractions conventionnelles sont par définition celles utilisées traditionnellement et depuis de nombreuses années dans l’industrie pour l’extraction de différents composés phytochimiques. Elles comprennent les extractions en batch, par soxhlet, l’extraction assistée par sonication et l’hydrodistillation. Cette dernière technique consiste en un entrainement à la vapeur et concerne plus particulièrement les huiles essentielles (Chémat, 2010; Yim et al., 2014). Le tableau 1.2 décrit les avantages et les inconvénients de chacune de ces techniques conventionnelles. Ces méthodes conventionnelles sont connues pour utiliser de grands volumes de solvants organiques, engendrant des problèmes environnementaux et aussi économiques, nécessitant beaucoup d’énergie pour leur évaporation. De plus, elles sont souvent basées sur des protocoles nécessitant beaucoup de main-d’œuvre et de suivis. Enfin, la génération de déchets issus de ces procédés est importante.
Le principe de l’extraction verte, mais aussi de la chimie verte dans son ensemble passe par des efforts dans la réduction de l’énergie utilisée pendant les procédés. La minimisation de la consommation d’énergie passe par l’optimisation de ces derniers, mais également par la récupération et la réutilisation de l’énergie libérée pendant le procédé,
par l’innovation et l’intensification des procédés. Pour finir, la réduction des différentes étapes lors d’un procédé permet de sauver du temps, d’économiser l’énergie et réduire les coûts de main d’œuvre (Chemat and Strube, 2015).
Tableau 1-1: Présentation des techniques d’extraction conventionnelles
1.4.2 Techniques d’extraction innovantes
Face aux inconvénients des techniques conventionnelles, de nouvelles méthodes d’extractions ont été développées afin d’améliorer l’efficacité de l’extraction de molécules alimentaires. Ces nouvelles méthodes d’extractions, détaillées ci-après, permettent d’automatiser des procédés dans les usines, de réduire l’utilisation de solvants organiques et d’augmenter la sélectivité de l’extraction.
L’extraction assistée par liquide pressurisé est basée sur l’utilisation de solvants à température élevée et soumise à des pressions suffisamment élevées pour maintenir leur état liquide. Ces conditions procurent certains avantages tels qu’un temps d’extraction et un volume de solvant réduits, une possibilité d’automatisation ainsi qu’une efficacité d’extraction accrue. En effet, le travail à une température plus élevée permet d’augmenter la solubilité des composés dans un liquide en diminuant la viscosité et la tension de surface du liquide utilisé, assurant ainsi un meilleur contact avec la matrice. De plus, une
Types d’extraction Avantages Inconvénients
Batch Contrôle de la température,
préservation des composés thermosensibles
Travail avec mélanges de solvants
Étapes de filtrations et évaporations nécessaires
Soxhlet Échantillon en contact avec solvant
pur, meilleur transfert de matières Pas d’étape de filtration après l’extraction
Durée importante d’extraction Grande quantité de solvants
Haute température pendant longues périodes (destruction molécules sensibles, économiques et environnementales)
Échauffements locaux possible
Étape de concentration et d’évaporation Pas facilement automatisable
Assistée par sonication Augmentation rendement d’extraction Accélération de la cinétique Diminution de la température d’extraction utilisée Étapes de filtration
Étapes d’évaporation et concentration
température plus haute va favoriser un meilleur transfert de matières à partir de la matrice végétale. Seulement deux facteurs varient au cours de ce type extraction : le temps et la température d’extraction. Pour les caroténoïdes et la chlorophylle, des températures supérieures à 100°C engendrent des dégradations significatives de ces deux composés. L’éthanol soumis à une pression de 100 bar et 50°C a permis d’obtenir de bons rendements d’extraction des caroténoïdes de germes de maïs (Jaime et al., 2010; Mattea et al., 2009).
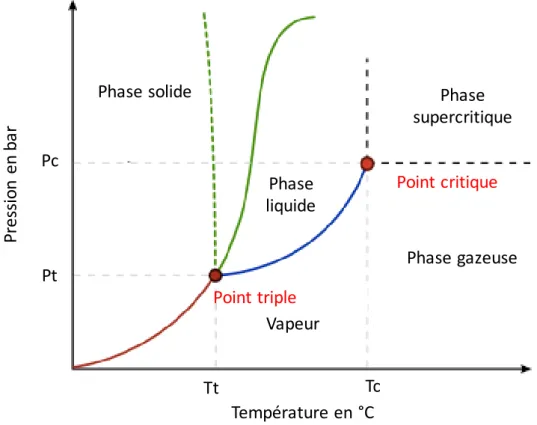
L’extraction par de l’eau subcritique est également très utilisée pour l’extraction de phytomolécules. L’état subcritique d’un liquide est défini lorsque la température ou la pression atteint sa température critique, c’est-à-dire la température maximale en phase liquide. L’eau dans sa forme subcritique possède une constante diélectrique beaucoup plus faible qu’à son état normal, c’est-à-dire à température et pression normale (TPN). En effet, à ces températures, on retrouve une constante diélectrique (𝜀) de l’eau d’environ 80; elle s’abaisse à 25 lorsque la température atteint 250°C. Cette dernière valeur est similaire à celle de solvants organiques à TPN, tels que l’éthanol et le méthanol (Herrero et al., 2006). Rappelons que plus une constante diélectrique est basse, plus le solvant présente des caractéristiques apolaires, car moins il sera capable de séparer les charges, caractérisant les molécules polaires. Néanmoins, la plupart des caroténoïdes ont une polarité bien plus basse, rendant inefficace cette technique pour l’extraction de ces molécules, et la chlorophylle, bien que plus polaire que la lutéine est une molécule hautement thermosensible (Schoefs, 2005).
L’extraction assistée par micro-onde est une technique simple, basée sur la destruction des cellules végétales permettant par conséquent la libération de leurs contenus. L’appareil va émettre des ondes de hautes fréquences et donc soumettre le matériel à extraire à un champ électromagnétique. L’eau contenue dans la matière de départ va être chauffée par ce champ, provoquant une lyse des cellules végétales. L’avantage de cette méthode est qu’elle requiert moins d’énergie que les méthodes conventionnelles qui ont recours à un broyage cellulaire et que requiert moins de solvant pour l’extraction. L’inconvénient majeur de cette technique est la chaleur émise au cours du procédé qui peut-être incompatible avec les caractéristiques de thermolabililité des molécules (Gong and Bassi, 2016; Herrero and Ibáñez, 2015; Herrero et al., 2010, 2013)