ETUDE DE LA LOCALISATION ET DE LA FONCTION DE
LA NUCLEOSIDE TRIPHOSPHATE
DIPHOSPHOHYDROLASE-3 DANS LE SYSTÈME DIGESTIF
Thèse présentée
à la Faculté des études supérieures de l'Université Laval
dans le cadre du programme de doctorat en Microbiologie-Immunologie pour l'obtention du grade de Philosophiae Doctor (Ph.D.)
DEPARTEMENT DE MICROBIOLOGIE-INFECTIOLOGIE ET IMMUNOLOGIE FACULTÉ DE MÉDECINE
UNIVERSITÉ LAVAL QUÉBEC
2010
Les nucleotides et nucleosides extracellulaires sont impliqués, via l'activation de récepteurs spécifiques, dans la régulation de diverses fonctions biologiques. Les récepteurs ionotrophes P2X et métabotrophes P2Y répondent aux nucleotides di- et tri-phosphates alors que les récepteurs métabotrophes PI sont activés par 1'adenosine. L'activation de ces récepteurs est modulée par la concentration de leurs agonistes dans le milieu. Des enzymes membranaires que l'on nomme ecto-nucléotidases modulent les concentrations en nucleotides extracellulaires en les hydrolysant. À pH physiologique, les nucleosides triphosphates diphosphohydrolases (NTPDases) et l'ecto-5'-nucléotidase sont les plus importantes. La signalisation purinergique est impliquée dans tous les aspects de la digestion, comme par exemple, dans la sécrétion salivaire, gastrique et intestinale, dans le péristaltisme ainsi que dans la relâche des hormones pancréatiques.
La localisation des ecto-nucléotidases est une étape essentielle dans la compréhension de leurs fonctions digestives. L'expression digestive des NTPDasel et 2 et de l'ecto-5'-nucleotidase est rapportée, par contre, rien n'est connu en ce qui à trait à la localisation de la NTPDase3. Des buvardages de type northern publiés préalablement montrent que l'ARN messager de la NTPDase3 est présent dans le pancréas et dans l'intestin. L'hypothèse de mes études doctorales est que la NTPDase3 est exprimée dans le système digestif et qu'elle participe à la régulation de l'activation des récepteurs P2 dans différentes fonctions digestives.
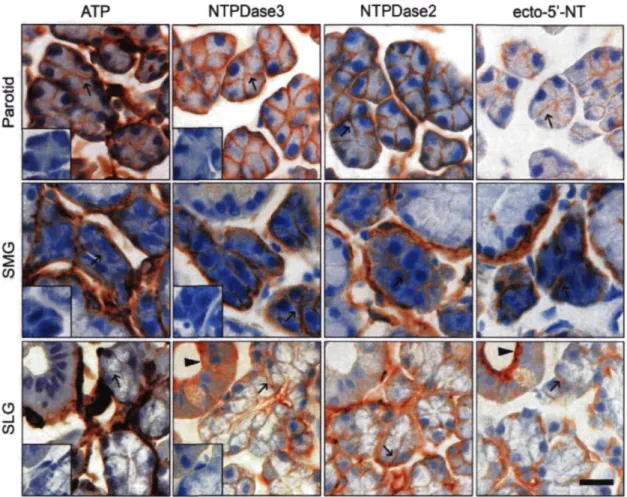
La localisation de la NTPDase3 dans le système digestif de la souris a été déterminée par histochimie enzymatique et par immunohistochimie. Les résultats obtenus montrent que la NTPDase3 est présente sur les neurones du système nerveux entérique ainsi que sur plusieurs types de cellules épithéliales comme sur les acini séreux des glandes salivaires submandibulaires et des parotides, sur les acini muqueux et l'épithélium des canaux collecteurs des glandes sublinguales ainsi que sur l'épithélium stratifié de l'œsophage et de l'estomac supérieur. De plus, certaine cellules endocrines comme les cellules des îlots de Langerhans et un sous-type de cellules entéroendocrines gastriques expriment aussi la NTPDase3. L'analyse de l'expression des NTPDasel, 2 et de l'ecto-5'-nucleotidase sur les cellules et tissues expriment la NTPDase3 montre que la NTPDase3 est exprimée avec la NTPDase2 et/ou l'ecto-5'-nucleotidase sur plusieurs de ces types cellulaires.
Le deuxième volet de mes travaux montre que la NTPDase3 est exprimée par tous les types de cellules des îlots de Langerhans, autant chez le rat, l'humain que la souris, alors que
l'ecto-5'-nucleotidase n'est retrouvée que chez le rat. J'ai montré que l'activité nucléotidasique de la NTPDase3 est impliquée dans la modulation de la sécrétion d'insuline par des cellules 0-pancréatique de rat, les cellules INS-1 (832/13). Cette enzyme régule la sécrétion basale d'insuline par l'hydrolyse des nucleotides relâchés de façon basale. En présence d'ATP exogène et de forte concentration de glucose, la NTPDase3 régule la sécrétion d'insulin par la modulation de la production d'adénosine.
En conclusion, le profil de localisation de la NTPDase3 dans le système digestif suggère l'implication de la NTPDase3, en association avec la NTPDase2 et l'ecto-5'-nucleotidase, dans la transmission nerveuse entérique et dans la sécrétion épithéliale comme la sécrétion salivaire. De plus, la démonstration de l'implication de la NTPDase3 dans la sécrétion d'insuline représente la première fonction physiologique connue de cette enzyme.
Extracellular nucleotides and nucleosides activate a specific family of receptors, that are regulating of many biological fonctions. P2X ionotropic and P2Y metabotropic receptors are activated by extracellular di- and tri-phosphonucleosides while adenosine activates Pl metabotropic receptors. The activation of these receptors is modulated by the concentration of their agonists. Enzymes of the ecto-nucleotidase families regulate P2 and Pl receptor activation by hydrolysing extracellular nucleotides. At physiological pH, nucleoside triphosphate diphosphohydrolases (NTPDases) and ecto-5'-nucleotidase are the primary ecto-nucleotidase involved in the regulation of nucleotide and nucleoside concentrations. In the digestive system, purinergic signalling is affecting the entire digestive process including salivary, intestinal and gastric epithelia secretion, peristaltism as well as in the secretion of pancreatic hormones.
Establishing ecto-nucleotidase localisation is a critical first step to determine their physiological functions. NTPDasel, NTPDase2 and ecto-5'-nucleotidase expression is already reported in some digestive tissues, while NTPDase3 localisation is not known. Northern blot data previously showed that NTPDase3 mRNA is expressed on human pancreas and intestine. The hypothesis underlying my PhD project was that NTPDase3 is expressed in the mouse digestive system and that this enzyme is regulating the digestive functions.
The ecto-nucleotidase activity was visualised by enzyme histochemistry and the presence of the protein by immunohistochemistry. The obtained results show that NTPDase3 is expressed by enteric neurones and by various epithelial cell types including serous salivary acinar cells of parotid and submandibular gland as well as mucous acini and duct cells of sublingual gland. In addition, esophagus and forestomach stratified epithelia and endocrine cells of Langerhans islets and a sub-type of enteroendocrine gastric cells also expressed this ecto-nucleotidase. NTPDase 1 and 2 and ecto-5'-nucleotidase expression was analysed on NTPDase3 expressing cells and tissues and this analysis shown that NTPDase2 and/or ecto-5'-nucleotidase expression are often observed on NTPDase3 expressing cells.
The second part of my PhD project shows that all Langerhans islet cell types of human, rat and mouse pancreas expressed NTPDase3 while only rat pancreatic endocrine cells expressed ecto-5'-nucleotidase. NTPDase3 activity is implicated in the modulation of basal insulin release by hydrolysing endogeneouly secreted nucleotides by the rat INS-1 (832/13) P-cell line. When exogenous ATP was apply in the presence of high glucose concentration, NTPDase3 activity
contrôles insulin secretion by modulating adenosine level, which inhibited insulin secretion by the rat cell line.
In conclusion, the NTPDase3 localisation profile in the mouse digestive system suggested a physiological role for NTPDase3 in the enteric neurotransmission and epithelial secretion, as saliva secretion. The modulatory role of the NTPDase3 in insulin secretion is the first physiological function reported for this ecto-nucleotidase.
Cette thèse est constituée de deux chapitres de résultats présentés sous forme d'articles scientifiques. Le premier s'intitule « Ectonucleotidases in the mouse digestive system: Focus on NTPDase3 localization ». Il est présenté sous la forme d'un manuscrit soumis à « Am J Physiology-Gastrointestinal and Liver Physiology». En tant qu'auteure principale de ce manuscrit, j'ai participé à la conception de l'article en plus d'effectuer la majorité des expérimentations. J'ai aussi rédigé le manuscrit avec l'aide des co-auteurs. Le Dr Brian D. Gulbransen a fait les expériences présentées à la figure 6 en plus de participer à la rédaction avec l'aide du Dr Keith A. Sharkey. Dr Mireia Martin-Satué a participé à la rédaction de ce manuscrit en plus de m'aider dans l'interprétation des résultats de localisation. Ce travail a été réalisé sous la supervision de mon directeur de thèse, le Dr Jean Sévigny.
Le deuxième article est soumis pour évaluation par les pairs au journal « Am J Physiology-Endocrinology and Metabolism » et s'intitule « Identification of the ectonucleotidases expressed in murine and human Langerhans islets: Potential role of NTPDase3 in insulin secretion ». Pour cet article j'ai réalisé la conception de l'étude, effectué la majorité des expérimentations et rédigé le manuscrit avec l'aide des co-auteurs. Dr Michel Fausther, en plus de son implication tout au long de la réalisation et de la rédaction de ce manuscrit, a effectué les expériences de localisation chez le rat et l'humain présentées aux figures 1 et 2 et dans les figures supplémentaires. Dr Gilles Kauffenstein m'a assisté dans les expériences en HPLC (Figure 3.5A) alors que le Dr Filip Kukulski a participé à la rédaction et à la conception de ce manuscrit. Ce travail a été réalisé sous la supervision de mon directeur de thèse, le Dr Jean Sévigny.
Remerciement
Je tiens à remercier mon directeur de recherche, le Dr Sévigny, qui m'a permis de poursuivre mes études graduées dans son laboratoire et de travailler sur un sujet qui m'a passionné. J'ai appris beaucoup de chose tout au long des sept années passées dans son laboratoire mais je pense que l'autonomie que j'en retire est la plus importante. Je tiens aussi à remercier tous les collègues, étudiants et professionnels qui sont passés dans le labo au cours des années.
Je veux remercier mes parents et mes soeurs qui m'ont toujours soutenu, encouragé et motivé à continuer. Finalement, un merci tout spécial pour Michel, sans qui ces années n'auraient pas été les mêmes.
Abstract i Avant-Propos iii Remerciement iv Table des matières vi Liste des tableaux ix Liste des figures x Liste des abréviations xi Chapitre 1 : Introduction 1
1.1 La signalisation purinergique 1
1.1.1 Les nucleotides 1 1.1.1.1 Les nucleotides et les nucleosides extracellulaires 2
1.1.1.2 Les sources et mécanismes de relâche des nucleotides et nucleosides 2
1.1.1.3 Réabsorption des nucleosides 5 1.1.2 Les récepteurs à l'adénosine et aux nucleotides 6
1.1.2.1 Les récepteurs PI : récepteurs à l'adénosine 6 1.1.2.2 Les récepteurs P2 : récepteurs aux nucleotides 7
1.1.2.2.1 Les récepteurs P2X 8 1.1.2.2.2 Les récepteurs P2Y 12 1.1.3 Ecto-enzymes impliquées dans la régulation des concentrations de
nucleotides et nucleosides extracellulaires 14
1.1.3.1 Ecto-nucléotidases 14 1.1.3.1.1 Les ecto-nucléotides pyrophosphatases/phosphodiesterases : NPP.. 15
1.1.3.1.2 Les phosphatases alcalines 16 1.1.3.1.3 Les phosphatases acides 17 1.1.3.1.4 L'ecto-5'-nucleotidase 18 1.1.3.1.5 L'ecto-adénosine désaminase (ADA) 19
1.1.3.1.6 Les nucleosides triphosphates diphosphohydrolases : NTPDases.... 20
1.1.3.1.6.1 Historique 20 1.1.3.1.6.2 Les NTPDases intégrées à la membrane plasmique 21
1.1.3.1.6.3 Les NTPDases intégrées à la membrane
d'organelles intracellulaires 24
1.1.3.2 Les ecto-kinases 25 1.1.3.2.1 L'adénylate kinase (AK) 25
1.1.3.2.2 Les nucleosides diphosphokinases/NM23 (NDP-kinase) 25
1.2 Le système digestif 26 1.2.1 Introduction 26 1.2.2 Les glandes salivaires 26
1.2.2.1 Les glandes salivaires et la signalisation purinergique 27
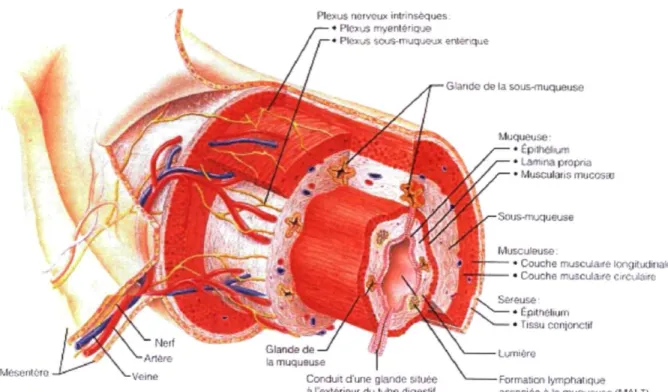
1.2.3 Le tube digestif 30 1.2.3.1 La signalisation purinergique dans le tube digestif 31
1.2.3.1.1 La muqueuse 31 1.2.3.1.2 Le système nerveux entérique 34
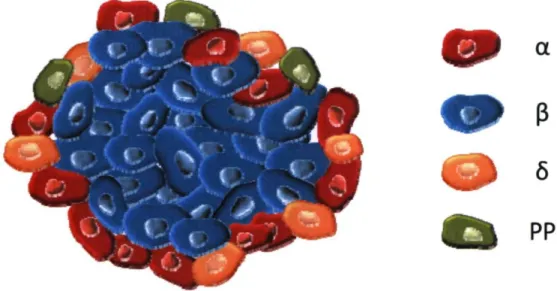
1.2.4 Le pancréas 41 1.2.4.1 Le pancréas endocrine 42
1.2.4.1.1 Modulation de la sécrétion d'insuline par les
nucleotides extracellulaires 43 1.2.4.1.2 Implication de la signalisation purinergique dans la sécrétion
des autres hormones pancréatiques 49
1.3 Hypothèse et objectifs 51 Chapitre 2 : Les ecto-nucléotidases dans le système digestif de la souris :
Attention particulière portée sur la localisation de la NTPDase3 52
2.1 Résumé 53 2.2 Abstract 54 2.3 Introduction: 55 2.4 Materials and Methods 56
2.4.1 Materials 56 2.4.2 Semi-quantitative RT-PCR 56
2.4.3 Antibodies 56 2.4.4 Immunohistochemistry, immunofluorescence and enzyme histochemistry... 57
2.4.4.1 Tissue processing 57 2.4.4.2 Enzyme histochemistry 57 2.4.4.3 Immunohistochemistry 58 2.4.4.4 Double staining immunofluorescence 58
2.4.5 Whole mount preparation and staining 58
2.5 Results 58 2.5.1 Salivary glands 59
2.5.2 Esophageal and gastric epithelia 59
2.5.3 Enteric nervous system 60
2.6 Discussion 61 2.6.1 Salivary glands 62 2.6.2 Esophagus and forestomach 63
2.6.3 Enteroendocrine cells 63 2.6.4 Enteric nervous system 64 2.7 Acknowledgements 65
2.8 Table 66 2.9 Figures and legends 67
Chapitre 3 : Identification des ecto-nucléotidases exprimées dans les îlots de Langerhans chez la souris, le rat et l'humain : fonction potentielle de la NTPDase3 dans la
sécrétion d'insuline 75
3.1 Résumé 76 3.2 Abstract: 77 3.3 Introduction: 78 3.4 Materials and Methods 79
3.4.1 Materials 79 3.4.2 Antibodies 79 3.4.3 Enzyme histochemistry, immunohistochemistry and immunofluorescence.. 80
3.4.3.1 Tissue processing 80 3.4.3.2 Enzyme histochemistry 81 3.4.3.3 Immunohistochemistry 81 3.4.3.4 Double staining immunofluorescence 81
3.4.4 Cell transfection, protein preparation and ectonucleotidase activity assays .. 82
3.4.5 Glucose-stimulated insulin secretion (GSIS) 83
3.4.6 Flow cytometry 83 3.4.7 Statistical analysis 84
3.5 Results 84 3.5.1 Langerhans islet cells express NTPDase3 84
3.5.2 NTPDase3 is expressed by all types of Langerhans islet cells 85 3.5.3 NTPDase3 modulates insulin secretion by rat beta cells 85
3.6 Discussion 87 3.7 Funding 90 3.8 Figures and legends 91
Chapitre 4 Conclusion et perspectives 102 4.1 Rôle de la NTPDase3 dans la sécrétion exocrine 102
4.2 Rôle de la NTPDase3 dans la sécrétion endocrinienne 104 4.3 Rôle de la NTPDase3 dans la transmission nerveuse entérique 107
4.4 Conclusion finale 109
Bibliographie 110 Annexe 136
Publications 136 Présentations 137
Tableau 1.1 La famille des récepteurs PI 7 Tableau 1.2 La famille des récepteurs P2X 11 Tableau 1.3 La famille des récepteurs P2Y 14 Tableau 1.4 Les ecto-nucléotidases 19 Tableau 1.5 Les récepteurs P2 présents sur les cellules P pancréatiques 47
Figure 1.1 Représentation schématique et topologie membranaire des
ecto-nucléotidases 15 Figure 1.2 Représentation schématique de l'histologie du tube digestif. 31
Figure 1.3 Représentation schématique de l'organisation cellulaire d'un îlot de
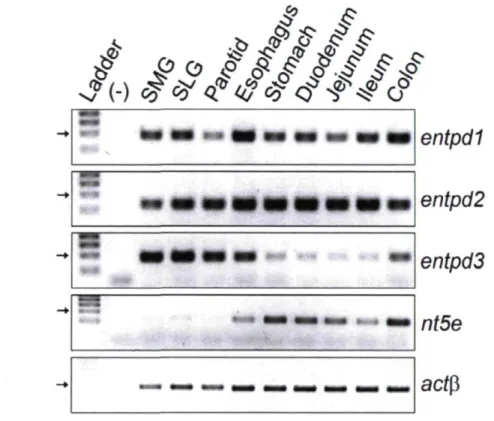
Langerhans 41 Figure 2.1 Distribution of mouse NTPDase 1 -3 and ecto-5 ' -nue leotidase mRNA by
semi-quantitative RT-PCR in the gastrointestinal tract and salivary glands 67
Figure 2.2 NTPDase3 localization on mouse salivary glands 68 Figure 2.3 Confocal analysis of NTPDase3 and aquaporin-5 double staining in mouse
salivary glands 69 Figure 2.4 NTPDase3 expressions on esophagus, forestomach and stomach epithelia 70
Figure 2.5 Expression of NTPDase2 and 3 in the mouse enteric nervous system 72
Figure 2.6 NTPDase3 immunoreactivity on myenteric neurons 74 Figure 3.1 Localization of ecto-nucleotidase activity and protein in murine
and human Langerhans islets 91 Figure 3.2 NTPDase3 is expressed by all Langerhans islet cell types 94
Figure 3.3 Ectonucleotidase expression profile and activity on INS-1 (832/13) rat
beta cell line 96 Figure 3.4 BGO136 and NF279 inhibit recombinant rat NTPDase3 97
Figure 3.5 Effet of NTPDase3 inhibition on glucose-stimulated insulin secretion 98 Figure 3.6 Supplementary Figure 1; Localization of NTPDases activity and protein
in rat Langerhans islets 99 Figure 3.6 Supplementary Figure 2; NTPDase3 expression in rat ans human
(NH»)2S sulfide d'ammonium
2MeSADP 2-méthyl-thio-adénosine 5'-diphosphate 2MeSATP 2-méthyl-thio-adénosine 5'-triphosphate 2-S-UTP 2-thio-uridine-5 ' -triphosphate
5-HT sérotonine (5-hydroxytryptamine)
ABC cassette de liaison à l'ATP («ATP binding cassette ») Ach Acetylcholine
ACR région conservée des apyrases (« apyrase conserved region ») ADA adenosine désaminase
ADN acide désoxyribonucléique ADNc ADN complémentaire ADP adenosine 5'-diphosphate ADPPS adénosine-5 '(P-thio)-diphosphate AK adenylate kinase
AMP adenosine 5'-monophosphate
AMPc adenosine 3'5'-monophosphate cyclique Ap4A diadénosine tétraphosphate
AQP-5 aquaporin-5 ARN acide ribonucléique ARNm ARN messager
ART2 ecto-ADP-rybosyltransférase-2 ATP adenosine 5'-triphosphate
ATPase adenosine 5'-triphosphatase
ATPDase adenosine 5'-triphosphate diphosphohydrolase ATPaS adénosine-5 '-(a-thio)-triphosphate
ATPyS adénosine-5 '-(y-thio)-triphosphate BBG bleu brilland-G (« brillan blue-G »)
BzATP benzoyl-benzoyl-adénosine-5 '-tri-phosphate Ca2+ cation calcium (2+)
CaCb chlorure de calcium
CFTR régulateur transmembranaire de la fibrose Kystique (« cystic fibrosis transmembrane regulator »)
Cl" ion chlore
CNT transporteur de nucleosides concentrant (« concentrative nucleoside transporter ») ConA concanavaline A
CTP cytidine 5'-triphosphate Da dalton
DAPI 4',6'-diamidino-2-phénylindole DNase désoxy-ribonucléase
dNTP déoxy nucleoside 5'-triphosphate Ecto-5'-NT ecto-5'-nucleotidase
EDTA acide ethylene diamine tétra-acétique
EGTA acide ethylene glycol-bis (2-aminoéthyléther)-N-N-N'-N'-tetra-acétique EHC enzyme histochemistry
EIA essait Immunologique de type ELISA (« ELISA Immunoassay ») E-NPP ecto-nucléotides pyrophosphatases/phosphodiesterases
ENT transporteur aux nucleosides équilibrant (« equilibrative nucleoside transporter ») E-NTPDase ecto-nucléosides 5'-triphosphates diphosphohydrolases
EPSP courant ionique post-synaptique excitateur (« excitatory post-synaptic potential ») EST séquence partielle ARNm (« Expressed Sequence Tag »)
fEPSP ESPS rapide («fast »)
gDNA ADN génomique (« genomic DNA») GDP guanosine 5'-diphosphate
GFAP protéine fibrillaire acide des cellules gliales (« glial fibrillary acidic protein ») GHIH hormone inhibitrice des hormones de croissances (« growth hormone inhibiting
hormone »)
GPI glycosylphosphatidyl inositol
GSIS stimulation de la sécrétion d'insuline au glucose (« Glucose-stimulated insulin secretion »)
GSL glande sublinguale, SLG (« sublingual salivary gland »)
GSM glande sous-mandibulaire, SMG (« submandibular salivary gland ») GTP guanosine 5'-triphosphate
H* proton
hATPDase adenosine 5'-triphosphate diphosphohydrolase hépatique HC03" ion bicarbonate
HEPES acide 4-(2-hydroxyéthyl)-l-pipérazine éthane sulfonique His histidine
HPLC chromatographie haute performance en phase liquide (« high performance liquid chromatography »)
HSP70 protéine de choc thermique 70 (« heat shock protein 70 ») IC50 concentration inhibitrice à 50% (« Inhibitory Concentration 50 ») IDP inosine 5'-diphosphate
IHC IL-10 IP3 Ip5I IUPHAR K+ K2HPO4 kb KH2P04 Km KOH LTC4, D4, E4 Li2+ LPA LPC MAP-kinase mdr MES Mg2+ MnCl2 Na+ NaCl NAD NCBI NDP NDP-kinase NECA NK NMDG NMP NO NPY NTP O.C.T. oATP immunohistochimie (« immunohistochemistry ») interleukine 10 inositol triphophate di-inosine pentaphosphate
union international de pharmacologie (« international union of pharmacology ») cation potassium
phosphate de potassium (dibasique) kilo base
phosphate de potassium (monobasique) constante de Michaelis-Menten hydroxyle de potassium cystéinyl leucotriène C4, D4, et E4 cation litium (2+) acide lysophosphatidique lysophosphatidylcholine
protéines mitogéniques activées (« mitogen-activated protein ») gène de multi résistance aux drogues (« multi drug resistance ») acide 2-(4-morpholino)-éthane sulfonique
cation magnésium (2+) chlorure de Manganèse cation sodium (1+) chlorure de sodium
nicotinamide adenine dinucléotide
centre national d'information en biotechnologie (« national center for biotechnology information »)
nucleoside 5'-diphosphate nucleoside 5'-diphospho-kinase S'-N-éthylcarboxamidoadenosine cellule tueuse « natural killer cell » N-méthyle-D-glucamine
nucleoside 5'-monophosphate oxyde nitreux (« Nitric oxyde ») neuropeptide Y
nucleoside 5'-triphosphate
température obtimal de coupe (« Optimal cutting temperature ») adenosine 5'-triphosphate oxydé
ORF PAP Pb(N03)2 PBS PGP9.5 P, PKC PLA2 PLC PMSF PP PPADS PP, PYY RB2 RNase RT-PCR SEM sEPSP TBA TM TNAP TNP-ATP TrAP Tris TSA U UDP UDPase UDPPS UMP UTP VDAC VIP
cadre de lecture ouvert (« open reading frame »)
phosphatase acide de la prostate (« prostatic acid phosphatase ») nitrate de plomb
phosphate buffered saline (Tampon saline phosphaté) protéine produite du gène 9.5 (« Protein gene product 9.5 ») phosphate inorganique
protéine kinase de type C phospholypase de type A2 phospholypase de type C 3-phénylméthanesulfonyle fluorure polypeptide pancréatique pyridoxalphosphate-6-azophenyl-2',4'-disulfonic pyrophosphate peptide YY réactif-bleu-2 ribonuc léase
réaction de polymérisation en chaîne en transcription inverse (« reverse transcriptase-polymerase chain reaction »)
erreure standard sur la moyenne (« Standard error of the mean ») EPSP lent (« slow »)
tetrabutylammonium hydrogène sulfate transmembranaire
phosphatase alcaline non-spécifique d'un tissu (« tissue-nonspecific alkaline phosphatase »)
2,,3'-0-(2,4,6-trinitrophényle)adénosine-5'-triphosphate
phosphatase acide résistante au tartrate (« tartrate-resistant acid phosphatase ») tris (hydrolxyméthyl) aminométhane
amplification du signal par la tyramide (« tyramide signal amplification ») unité uridine 5'-diphosphate uridine 5'-diphosphatase uridine 5'-(P-thio)-diphosphate uridine 5'-monophosphate uridine 5'-triphosphate
transporteur anionique dépendant du voltage (« voltage-dependant anion conductanse »)
y
' m a x VRAC VSOAC Zn2+
vitesse maximal de réaction
canal anionique de régulation du volume cellulaire (« Volume-regulated anion
channel »)
transporteur anionique et osmolite organique sensible au volume (« volume-sensitive organic osmolyte and anion conductance »)
1.1 La signalisation purinergique
Les phénomènes physiologiques s'exercent via une panoplie de mécanismes complexes, utilisant, entre autres, de nombreuses molécules transmettant aux cellules des messages variés. Notre laboratoire s'intéresse à certaines de ces molécules, les nucleotides. Nous nous intéressons plus particulièrement aux actions que les nucleotides exercent à l'extérieur des cellules via l'activation de récepteurs spécifiques situés à la membrane plasmique, ainsi qu'aux ecto-nucléotidases, enzymes de surface qui contrôlent les concentrations des nucleotides extracellulaires, et ainsi, l'activation des récepteurs.
1.1.1 Les nucleotides
Les nucleosides sont formés de la liaison d'une base azotée (purines ou pyrimidines) et d'un sucre (ribofuranose ou désoxyribofuranose). Ils sont appelés nucleotides lorsqu'il y a un ou plusieurs phosphates en position 5' du sucre. Ces nucleotides sont nommés en fonction de la base azotée qui les composent et du nombre de phosphates retrouvés. Par exemple, la liaison de l'adénine (base azotée) avec le ribofuranose (sucre) est appelée adenosine. Lorsque d'un à trois phosphates s'ajoutent à cette structure, le complexe se nomme respectivement adenosine 5'-mono-, 5'-di- ou 5'-triphosphate (AMP, ADP et ATP). Les phosphates attachés en position 5' du sucre sont identifiés selon leur proximité au ribose, dans l'ordre phosphate a (celui le plus près du sucre), P et 7*
Les nucleotides et nucleosides sont des molécules importantes dans plusieurs processus biologiques essentiels à la survie de tous les organismes vivants, des bactéries aux humains puisqu'ils sont impliqués dans plusieurs fonctions cellulaires essentielles. Ils constituent, par exemple, les structures de base de l'acide désoxyribonucléique (ADN) et de l'acide ribonucléique (ARN). L'ATP est aussi la principale source d'énergie cellulaire. De plus, les nucleotides tel que l'ATP sont les substrats de plusieurs protéines kinases et phosphatases qui, en phosphorylant ou en déphosphorylant des résidus sérine/thréonine ou tyrosine de protéines cibles, modulent leurs activités biologiques (1). Le guanosine 5'-triphosphate (GTP) et le guanosine 5'-diphosphate (GDP) sont, quant à eux, essentiels dans la signalisation dépendante des protéines G (2).
l'extérieur de la cellule remonte à la fin des années 1920. Drury et Szent-Gyôrgyi furent les premiers en 1929 à relater l'effet possible des nucleotides extracellulaires adénylés sur le cœur (3). Un second rôle de l'ATP a été proposé par Holton en 1959 (4). Il a en effet démontré que l'ATP relâché, suite à une stimulation antidromique des nerfs sensitifs, produit une vasodilatation de l'artère de l'oreille chez le lapin. Puis, en 1963, l'adénosine est identifiée en tant que régulateur physiologique du flux sanguin coronarien (5). Le Dr Geoffrey Brunstock est l'un des scientifiques ayant contribué le plus à l'étude des rôles physiologiques des nucleotides extracellulaires. En 1972, il postule que l'ATP est un neurotransmetteur impliqué dans la contraction non adrénergique et non cholinergique des nerfs des muscles lisses du tractus gastro-intestinal (6). Six ans plus tard, il pose les règles de distinction entre les différents types de récepteurs qui répondent aux nucleosides (récepteurs PI) et aux nucleotides (récepteurs P2). Depuis ce temps, plusieurs études ont été effectuées afin de caractériser divers aspects de la signalisation par les nucleotides extracellulaires c'est-à-dire les sources, les actions et la régulation des concentrations de nucleosides et nucleotides présents dans le milieu extracellulaire.
1.1.1.2 Les sources et mécanismes de relâche des nucleotides et nucleosides
Les sources de nucleotides extracellulaires sont très variées et trois modes de relâche sont décrits jusqu'à maintenant. Vues les concentrations cytoplasmique élevées en nucleotides, qui peuvent atteindre une concentration d'environ 3 à 5 mM pour l'ATP (7), le premier mode de relâche décrit est évidemment ubiquitaire. En effet, la mort cellulaire par apoptose et par nécrose mais aussi toute perte d'intégrité de la membrane plasmique libère les nucleotides cytoplasmiques dans le milieu extracellulaire. La présence de nucleotides à l'extérieur de la cellule est d'ailleurs considérée comme l'un des plus importants et des plus anciens signaux de danger de l'organisme (8).
Le deuxième mode de relâche des nucleotides est restreint aux cellules activables, excitables et/ou sécrétoires comme les cellules nerveuses, les plaquettes ou encore les cellules chromaffines. Ces cellules emmagasinent de grandes quantités de nucleotides dans leurs granules de sécrétion. Par l'exemple, l'ATP peut être retrouvé à de très grandes concentrations, soit plus de 100 mM (9), dans les granules de sécrétions des terminaisons nerveuses (10) et les plaquettes sanguines (11). Ces granules de sécrétions renferment aussi d'autres nucleotides comme l'ADP et
dans plusieurs fonctions biologiques essentielles. Par exemple, l'ATP relâché dans la fente synaptique agit comme neuromédiateur durant la transmission nerveuse (12, 13). Au cours du processus d'hémostase, la libération de l'ATP et de l'ADP emmagasinés dans les granules de sécrétion des plaquettes sanguines est essentielle à leur agrégation (14, 15). De plus, la signalisation purinergique est essentielle au processus inflammatoire en modulant, par exemple, le recrutement au site inflammatoire des cellules immunitaires (16-19).
Le troisième mode de relâche est un mécanisme non lytique et non sécrétoire par lequel les cellules épithéliales et endothéliales libèrent des nucleotides dans le milieu extracellulaire par l'action de canaux ou de transporteurs membranaires. Cependant, ce phénomène, qui semble être ubiquitaire, est moins bien caractérisé (20). Une relâche basale de nucleotides est également observée suite à un stimulus. Par exemple, l'action de forces mécaniques comme les forces de cisaillement, les conditions non physiologiques comme l'ischémie ou le stress hypoxique, ou encore la stimulation par diverses molécules bio-actives comme la bradykinine ou la sérotonine entraînent un plus grand efflux de nucleotides dans le milieu extracellulaire (21). Il est intéressant de noter que la seule manipulation mécanique de lignées cellulaires en culture est suffisante pour entraîner la relâche de grandes quantités de nucleotides (22). De plus, la stimulation par l'ATP lui-même provoque une relâche de plus grande quantités de nucleotides (23-25).
Plusieurs canaux et transporteurs membranaires ont fait l'objet d'études pour leur implication potentielle dans ces mécanismes de relâche. D'abord, le canal régulateur transmembranaire de la fibrose kystique (CFTR; cystic fibrosis transmembrane regulator) dont l'absence est responsable de la maladie du même nom (26) a longtemps été défini comme un canal responsable de la sortie de l'ATP, principalement au niveau des voies aériennes. Il semble que sa présence faciliterait la sortie d'ATP mais que le canal formé par le CFTR ne serait pas directement responsable de cette relâche (27). Bien qu'aucune différence au niveau des concentrations de nucleotides présents dans les sécrétions des voies respiratoires ne soit observée chez les patients atteints de la maladie (28), il semble que le CFTR soit impliqué dans la relâche de nucleotides au niveau des cellules gliales stimulées par le glutamate (29) et des globules rouges stimulés mécaniquement (30).
Plusieurs transporteurs et protéines possédant des cassettes de liaison à l'ATP (ABC; ATP binding cassette) ont aussi été considérés comme transporteur(s) potentiel(s). Par exemple, la
élément régulateur d'un système inconnu du transport de l'ATP vers l'extérieur de la cellule (32). Des protéines des familles de canaux sensibles au volume et au voltage semblent aussi perméables à l'ATP. Un variant du transporteur anionique dépendant du voltage (VDAC; voltage-dependant anion conductance) qui permet l'entrée d'ATP et d'ADP au niveau de la membrane mitochondriale, serait présent à la membrane plasmique et participerait ainsi à la relâche de nucleotides (33). Une étude de 2002 a montré que le transporteur anionique et osmolite organique sensible au volume (VSOAC; volume-sensitive organic osmolyte and anion conductance) exprimé dans l'aorte de bœuf serait perméable aux nucleotides en condition de stress hypoxique (34) et que cette sécrétion serait dépendante de l'activation de la cascade de signalisation impliquant les kinases Rho/RhoA et du remodelage du cytosquelette d'actine (35).
Plus récemment, les membres des familles des connexines et des pannexines sont largement étudiés pour leurs rôles dans la relâche des nucleotides. Les connexines sont des protéines essentielles à la formation des structures membranaires appelées jonctions communicantes ou canaux intercellulaires. Chaque canal est constitué de deux hémicanaux ou connexons permettant les échanges physiologiques d'ions ou de metabolites de petite taille comme l'ATP et le nicotinamide adenine dinucléotide (NAD+) entre les cellules polarisées voisines. Par contre, ces
protéines via les hémicanaux permettraient aussi les échanges entre le cytoplasme des cellules et le milieu extérieur, et par conséquent l'efflux de nucleotides (36). D'autre part, plusieurs évidences montrent plutôt que les pannexines, précisément la pannexine-1, et non pas les connexines, formeraient les hémicanaux responsables de la relâche de l'ATP (37). Ce mode de sécrétion des nucleotides et particulièrement de l'ATP, est observé, par exemple, au niveau des lymphocytes T activés (38), de l'épithélium respiratoire (39) ou des astrocytes (40).
En plus des nucleotides, on retrouve dans le milieu extracellulaire des molécules que l'on nomme dinucléotides polyphosphates, puisqu'ils sont composés de deux nucleosides lié par la même chaîne de phosphate. Les plus courants sont l'Ap4A, Ap5A et l'Ap3A. Ces dinucléotides
polyphosphates, qui peuvent aussi être relâchés dans le milieu extracellulaire par les même processus que les nucleotides, possèdent aussi des actions physiologiques.
(voir section 1.1.2). La concentration des nucleotides est contrôlée par l'hydrolyse successive des phosphates attachés au sucre par différentes familles d'enzymes que nous verrons à la section 1.1.3. Seuls les produits finaux d'hydrolyse des nucleotides, soit les nucleosides, peuvent être réabsorbés par la cellule pour servir de substrat aux protéines kinases intracellulaires pour former de nouveaux nucleotides. La réabsorption des nucleosides est d'une importance majeure sachant que plusieurs types cellulaires, comme les cellules nerveuses ou encore celle de la moelle osseuse n'ont pas l'arsenal enzymatique nécessaire à la production de novo de nucleosides (41). L'entrée des nucleosides, comme l'adénosine ou l'uridine, se fait par l'action de transporteurs spécifiques présents à la membrane plasmique (42, 43). Il existe deux types de transporteurs, soit les transporteurs passifs, ou équilibrants (ENT) et les transporteurs actifs ou concentrants (CNT).
Il existe quatre isoformes de transporteurs équilibrants (ENT 1-4), qui ne sont retrouvés que chez les eucaryotes (41). La majorité des cellules humaines, sinon toutes, possèdent au moins une des isoformes de ENT sur leurs membranes plasmiques, où ils effectuent le transport bidirectionnel des nucleosides, en fonction du gradient de concentration. Les transporteurs ENT-1 et ENT-2 sont les plus étudiés et sont perméables aux pyrimidines et purines. Le transporteur ENT-2 est également perméable aux nucléobases comme l'hypoxantine (44). Le transporteur ENT-3 est localisé au niveau intracellulaire, probablement sur les lysosomes (45) alors que le transporteur ENT-4 est situé à la membrane plasmique, mais sa fonction n'est pas encore connue. Ce dernier est spécifique à l'adénosine à pH acide, mais il est aussi perméable aux cations organiques comme les monoamines (46, 47).
Il existe trois isoformes de transporteurs actifs, qui sont exprimées chez les eucaryotes mais aussi chez les eubactéries (43). Ils sont majoritairement retrouvés sur les cellules spécialisées comme les epitheliums rénaux et intestinaux (41). Le transport des nucleosides par les transporteurs CNT est contrôlé par un gradient cationique, les transporteurs CNT-1 et 2 utilisent comme co-transporteur le sodium (Na*) alors que le co-transporteur CNT-3 peut utiliser les cations Na+ ou lithium
(Li*) ou encore les protons (FT) comme co-transporteur. On distingue les trois transporteurs concentrants par leurs préférences de nucleosides transportés. Le transporteur CNT-1 a une préférence marquée pour les nucleosides pyrimidinylés comme l'uridine. Il est aussi capable de lier fortement l'adénosine, sans toutefois laisser passer ce nucleoside (48). Le transporteur CNT-2
1.1.2 Les récepteurs à l'adénosine et aux nucleotides
Les rôles biologiques des nucleosides et des nucleotides extracellulaires s'exercent essentiellement par l'activation de deux groupes de récepteurs, les récepteurs PI et les récepteurs P2. Les mécanismes d'action de ces molécules sont d'autant plus complexes du fait que plusieurs membres de ces deux familles de récepteurs sont souvent exprimés à la surface d'une même cellule.
1.1.2.1 Les récepteurs PI : récepteurs à l'adénosine
Les récepteurs PI, ou récepteurs à l'adénosine, représentent le premier type de récepteurs purinergiques dont l'existence a été soupçonnée, suite à la découverte en 1929 de l'action de l'adénosine extracellulaire sur le cœur (3). Cette famille de récepteurs compte quatre membres que l'on nomme A-, A2A, A2B et A3. L'existence des récepteurs Ai, A2A et A2B était connue bien avant
leurs clonages en 1989 (50). Ils avaient en effet été découverts grâce à des études pharmacologiques et fonctionnelles réalisées à l'aide d'antagonistes plus ou moins spécifiques des récepteurs PI comme les xanthines, dont la caféine fait partie (51-53). Le récepteur A3 a été identifié en 1992 par
clonage (54). Les quatre types de récepteurs PI présentent la même structure, c'est-à-dire des récepteurs à sept passages transmembranaires couplés à une protéine G. La réponse physiologique provoquée par ces récepteurs se fait principalement par la modulation de l'activité de l'adénylate cyclase et est dépendante de la protéine G à laquelle ils sont couplés. L'activation des récepteurs Ai et A3, couplés à la sous-unité a des protéines Gi/Go provoque une diminution de la concentration de
l'AMP cyclique (AMPc), alors que l'activation des récepteurs A2A et A2B, qui sont couplés à la
protéine Gs, entraîne une augmentation de l'AMPc (55). Par contre, de nouvelles données montrent des effets physiologiques des récepteurs PI indépendants de l'adénylate cyclase et même certains indépendants de la signalisation par des protéines G (56). Par exemple, le récepteur A2B, en plus
d'être couplé à la protéine Gs, est aussi couplé à la protéine Gq qui entraine l'activation de la phospholipase C (PLC) (56).
L'affinité de ces récepteurs pour leur agoniste naturel, l'adénosine, varie d'une isoforme à l'autre. Le récepteur A2B est dit de faible affinité car une concentration d'adénosine de plus de
10 uM est nécessaire à son activation, les trois autres récepteurs sont activés avec des concentrations entre 0,01 nM et 1 (jM, ils sont donc de forte affinité (57). Il est à noter que certains
biologiques engendrées par l'activation de ces récepteurs sont importantes et présentes dans tous les systèmes de l'organisme, notamment au niveau des systèmes cardiovasculaire, immunitaire et nerveux. Les principaux agonistes et antagonistes ainsi que les voies de transduction de signal induites par l'activation des récepteurs PI sont résumés dans le tableau 1.1.
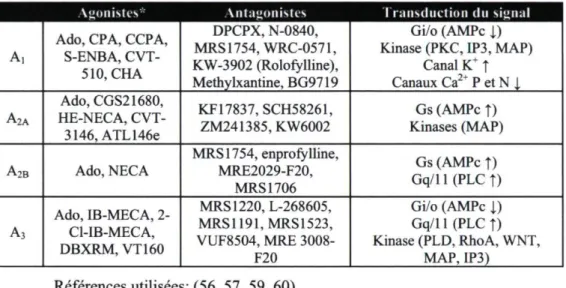
Tableau 1.1 : La famille des récepteurs PI
Agonistes-' Antagonistes Transduction du signal
A, Ado, CPA, CCPA, S-ENBA, CVT-510, CHA DPCPX, N-0840, MRS1754,WRC-0571, KW-3902 (Rolofylline), Methylxantine, BG9719 Gi/o (AMPc | ) Kinase (PKC, IP3, MAP)
Canal K+ î Canaux Ca2+ P et N 1 A2A Ado, CGS21680, HE-NECA, CVT-3146, ATL 146e KF17837,SCH58261, ZM241385,KW6002 Gs (AMPc î) Kinases (MAP) A2B Ado, NECA MRS 1754, enprofylline, MRE2029-F20, MRS 1706 Gs (AMPc î) Gq/ll(PLCî) A3 Ado, IB-MECA, 2-Cl-IB-MECA, DBXRM,VT160 MRS1220,L-268605, MRS1191,MRS1523, VUF8504, MRE 3008-F20 Gi/o (AMPc i) Gq/11 (PLC î) Kinase (PLD, RhoA, WNT, MAP, IP3) Références utilisées: (56, 57, 59, 60)
1.1.2.2 Les récepteurs P2 : récepteurs aux nucleotides
Les récepteurs P2 sont exprimés à la surface des cellules et sont activés par les nucleotides ATP, ADP, UTP et UDP. La nomenclature de cette famille de récepteurs a beaucoup évolué au cours des années avec la découverte de nouveaux membres ayant des propriétés pharmacologiques distinctes et leurs clonages tardifs. Cette nouvelle nomenclature fut proposée par Abbracchio et Burnstock en 1994. Elle classe les récepteurs en fonction de leurs structures et non plus en fonction de leurs caractéristiques pharmacologiques (61). Les récepteurs P2 sont séparés en deux sous familles, les récepteurs P2X, qui forment des canaux ioniques, et les récepteurs P2Y, qui sont des récepteurs à sept passages transmembranaires couplés aux protéines G. La famille des récepteurs P2 est distribuée de façon ubiquitaire. De plus, il est possible de retrouver plus d'un type de récepteurs P2 à la surface d'une même cellule.
d'ions à travers la membrane plasmique. C'est en 1994 que l'on rapporte le clonage du premier récepteur P2X (62), qui fut par la suite renommé P2Xi. Les récepteurs P2X2.7 ont rapidement été
clones et caractérisés entre 1994 et 1996 (63-67). L'analyse phylogénétique des sept récepteurs P2X humain montre une homologie des séquences en acides aminés d'environ 50% (68). Ce sont des récepteurs attachés à la membrane plasmique par deux domaines transmembranaires situés aux extrémités de la protéine. Ils présentent de courtes portions intracellulaires, situées en N- et C-terminal et une large boucle extracellulaire portant le site de liaison à l'agoniste. Le récepteur P2X7
se distingue cependant par la présence d'une longue queue cytoplasmique en C-terminal (69). Chaque récepteur est constitué de sous-unités qui, une fois associées, forment un canal ionique dépendant de l'ATP. L'analyse de la structure des récepteurs P2X2 et P2X4 confirme que les canaux
sont formés de trois sous-unités (70-72). Ces canaux peuvent être composés d'un (homo-oligomères) ou deux types de sous-unités (hétéro-(homo-oligomères) (68). Une étude approfondie de Torres et al. en 1999 a permis de déterminer le potentiel d'homo- et d'hétéro-oligomérisation de chacun des sept types de récepteurs P2X par immuno-précipitation (73). À l'exception du récepteur P2X6 (71), toutes les isoformes ont la capacité d'homo-oligomérisation. Plusieurs hétéro-oligomères
sont théoriquement possibles, cependant, seulement certaines de ces combinaisons se sont avérées actives : les récepteurs P2X,/2 (74), P2XM (75, 76), P2X,/4 (77), P2X4/6 (78) et P2X1/5 (79-82). La
capacité du récepteur P2X7 à former des hétéro-oligomères est controversée mais il semble qu'il
pourrait s'associer au récepteur P2X4 dans certaines conditions (83, 84).
Bien que les récepteurs P2X partagent de nombreuses caractéristiques pharmacologiques, ils possèdent également des caractéristiques propres qui permettent de les différencier (68). On distingue les P2X par leurs agonistes et antagonistes, la perméabilité des canaux aux anions, leur rapidité à désensibiliser en présence de leurs agonistes ainsi que leur sensibilité au pH et à la présence d'ions calcium (Ca2+) et zinc (Zn2+) dans le milieu (85). Ces principales caractéristiques
sont résumées dans le tableau 1.2.
L'agoniste naturel des récepteurs P2X est l'ATP. Encore une fois le récepteur P2X7 se
distingue des autres récepteurs P2X par sa faible affinité pour l'ATP. En effet, une concentration minimale de 100 \iM d'ATP est requise pour l'activer (67), alors qu'une concentration de moins de dix micromolaire(s) est suffisante pour activer les autres P2X. L'ADP et l'AMP peuvent aussi agir
cellules microgliales (86). Il est intéressant de mentionner les travaux de Seman et Koch-Nolte qui ont montré que ce récepteur est activé par de faibles concentrations de NAD (2 uM). L'effet du NAD sur le récepteur P2X7 présent à la surface des lymphocytes T matures demeure cependant
obscur. En fait, le NAD permettrait l'activation de la protéine ecto-ADP-RybosylTransférase-2 (ART2), qui possède une activité d'ADP-ribosylase. C'est donc l'ADP-ribosylation du récepteur P2X7 qui permettrait son activation (87). Des travaux récents sur le macrophage de souris montrent
que le NAD n'active pas directement P2X7 dans ce type cellulaire comme c'est le cas pour le
lymphocyte T. Par contre, une pré-stimulation au NAD augmenterait la sensibilité du récepteur à l'ATP (88).
Lors d'une exposition prolongée à un agoniste, certains récepteurs P2X deviennent désensibilisés alors que d'autres répondent par une augmentation de la taille de leurs pores. Prenons comme premier exemple le récepteur P2Xi. Ce récepteur qui a une forte affinité pour l'ATP (EC50 de 1 nM), est désensibilisé après seulement cent millisecondes (89, 90). Ce phénomène prend une importance majeure dans les cellules libérant de grandes quantités d'ATP et il faut donc des mécanismes très efficaces d'élimination des nucleotides libérés. Les récepteurs P2X3 et P2Xi/5 sont
également désensibilisés, mais moins facilement que le récepteur P2X|. Pour ce qui est des autres types comme les récepteurs P2X2 et P2X4, la présence d'un agoniste pendant quelques secondes
cause une augmentation de la perméabilité des canaux que forment ces récepteurs (91). La concentration d'ATP nécessaire pour permettre l'ouverture du pore est la même que celle qui permet l'activation initiale du récepteur (10 jj.M). L'augmentation de la perméabilité se fait progressivement, jusqu'au passage de larges cations organiques comme le Tris (tris(hydrol-xyméthyl)-aminométhane) ou le NMDG (N-Méthyle-D-Glucamine). Le récepteur P2X7, présente
encore une fois quelques différences avec les autres récepteurs P2X. L'application d'agonistes pour une durée de quelques secondes (~10 sec) provoque une augmentation de la perméabilité semblable à celle des récepteurs P2X2 et P2X4 (92). Par contre, la perméabilité de ce récepteur est plus grande,
il est perméable pour de larges molécules allant jusqu'à 900 Da comme le bromure d'éthidium ou encore l'iodure de propidium (YO-PRO-1) (69), qui sont des molécules fluorescentes utilisées comme marqueurs de l'ouverture du pore formé par le récepteur P2X7. Une exposition prolongée à
Tous les canaux formés par les récepteurs P2X sont perméables aux cations Na+, potassium
(K4) et plus particulièrement Ca2+ (93). Il est intéressant de mentionner que le récepteur P2X5 est
aussi perméable aux anions chlorure (CL) (85).
L'action physiologique des récepteurs P2X implique l'entrée d'ions Ca2+ dans la cellule via
le canal/pore formé par le récepteur. Le phénomène peut être amplifié par l'activation de canaux Ca2+ dépendant du voltage, suite à la dépolarisation de la membrane plasmique (93). Par contre, les
mécanismes signalétiques spécifiques qui entraînent les effets physiologiques de l'activation des récepteurs P2X ne sont pas bien définis et demeurent un sujet d'étude important dans le domaine de la signalisation par les nucleotides extracellulaires.
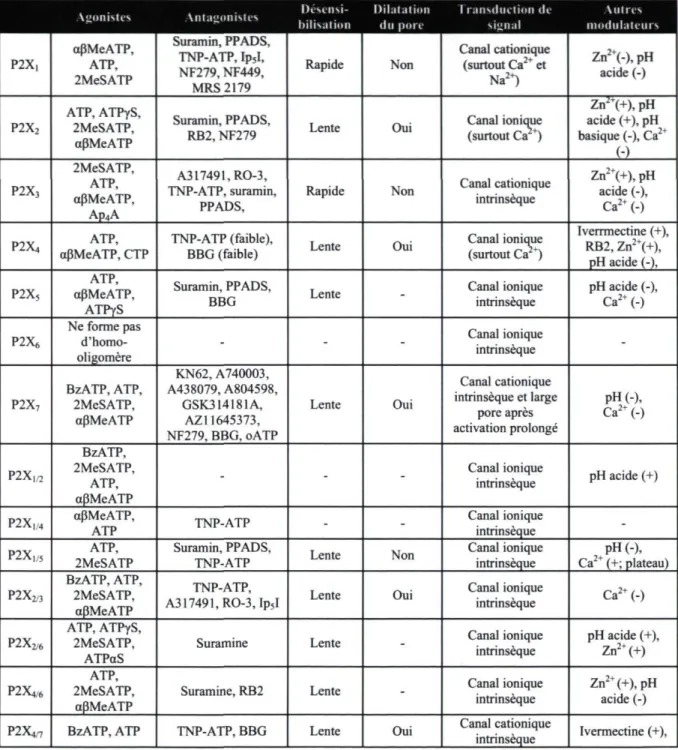
Tableau 1.2 : La famille des récepteurs P2X
IK'M'iiM- DII.II.IIIIIII 1 i ansdiu IIUII di Autres
Agonistes Antagonistes .... tnli-.nl mil du pore signal modulateurs
P2X- aPMeATP, ATP, 2MeSATP Suramin, PPADS, TNP-ATP, Ip5I, NF279, NF449, MRS 2179 Rapide Non Canal cationique (surtout Ca2+ et Na2+) Zn2+(-),pH acide (-) P2X2 ATP, ATPyS, 2MeSATP, aPMeATP Suramin, PPADS, RB2, NF279 Lente Oui Canal ionique (surtout Ca +) Zn2+(+), pH acide (+), pH basique (-), Ca2+ (-) P2X3 2MeSATP, ATP, aPMeATP, Ap4A A31749LRO-3, TNP-ATP, suramin, PPADS,
Rapide Non Canal cationique intrinsèque Zn
2+(+),pH
acide (-), Ca2+(-)
P2X4 aPMeATP, CTP ATP, TNP-ATP (faible), BBG (faible) Lente Oui Canal ionique (surtout Ca 2+) Iverrmectine (+), RB2, Zn2+(+)> pH acide (-), P2X5 ATP, aPMeATP, ATPyS Suramin, PPADS,
BBG Lente - Canal ionique intrinsèque pH acide (-), Ca2+(-)
P2X* Ne forme pas
d'homo-oligomère - - -Canal ionique intrinsèque -P2X7 BzATP, ATP, 2MeSATP, aPMeATP KN62, A740003, A438079, A804598, GSK314181A, AZ11645373, NF279, BBG, oATP Lente Oui Canal cationique intrinsèque et large pore après activation prolongé pH(-), Ca2+(-) P2X1/2 BzATP, 2MeSATP, ATP, aPMeATP
- - - Canal ionique intrinsèque pH acide (+) P2X1/4 aPMeATP, ATP TNP-ATP - - Canal ionique intrinsèque
-P2Xl/5 ATP,
2MeSATP Suramin, PPADS, TNP-ATP Lente Non Canal ionique intrinsèque Ca2+ (+; plateau) pH(-),
P2XM
BzATP, ATP, 2MeSATP,
aPMeATP
TNP-ATP,
A317491,RO-3, Ip5I Lente Oui
Canal ionique intrinsèque Ca2+(-) P2X2/6 ATP, ATPyS, 2MeSATP, ATPaS
Suramine Lente - Canal ionique intrinsèque pH acide (+), Zn2+(+)
P2X,/6
ATP, 2MeSATP,
aPMeATP
Suramine, RB2 Lente - Canal ionique intrinsèque Znacide (-) 2+(+),pH
P2Xc BzATP, ATP TNP-ATP, BBG Lente Oui Canal cationique intrinsèque Ivermectine (+),
- : inconnu, (-) : modulation négative, (+) : modulation positive. Références utilisées : (78, 83, 85, 93-98)
1.1.2.2.2 Les récepteurs P2 Y
Les récepteurs P2Y sont des récepteurs à sept passages transmembranaires couplés à des protéines G. Ils sont retrouvés sur la plupart des cellules. On compte jusqu'à maintenant huit récepteurs P2Y fonctionnels chez les mammifères : soit P2Y,, P2Y2, P2Y4, P2Y6, P2Y**, P2Y,2,
P2Y|3 et P2Yi4. La discontinuité des numéros de ces récepteurs est due à l'identification
d'homologues retrouvés chez d'autres espèces ou répondant à des agonistes autres que les nucleotides. Par exemple, le récepteur P2Y3 serait en fait l'homologue aviaire du récepteur P2Y6
(99, 100) et le récepteur P2Y8, l'homologue chez Xenopus du récepteur P2Y4 (101). Quant au
récepteur P2Y7, il est en fait activé par le leucotriène B4 (102), alors que les récepteurs P2Y5, P2Y9
et P2Y*o répondent à l'acide lysophosphatidique (LPA; Lysophosphatidic Acid) (103-105). Le récepteur P2Yi0 est de plus activé par la sphingosine-1-phosphate (105). Les premiers récepteurs
P2Y à avoir été clones sont P2Yi et P2Y2 qui correspondent respectivement aux récepteurs nommés
P2Y et P2U dans la nomenclature pharmacologique précédente. Le clonage par homologie de séquence a permis d'identifier les récepteurs P2Y4, 6d n dont l'existence n'était pas encore
soupçonnée. Par contre, il a fallu attendre en 2001 pour que le récepteur P2TAC, un récepteur des
plaquettes qui répond à l'ADP, soit clone (106). En effet, ce récepteur, maintenant appelé P2Y12,
possède une homologie de séquence réduite avec les autres récepteurs P2Y. En revanche, il présente une forte homologie avec les récepteurs P2Yi3 et P2Y*4 clones par la suite (107, 108).
Les agonistes naturels des récepteurs P2Y sont plus variés que ceux des P2X. Alors que les récepteurs P2X sont principalement activés par l'ATP et ses analogues, les récepteurs P2Y répondent à l'ATP, à l'UTP, ou encore aux nucleosides diphosphates correspondants. Les récepteurs P2Y*, u, *2> *3 répondent principalement à l'ADP, les récepteurs P2Y2 et P2Y4 aux
nucleosides triphosphates ATP et UTP, et le récepteur P2Y6 uniquement à l'UDP. L'identification
du récepteur P2Y!4 (GPR105 ou KIAA0001) ouvre les portes à de nouveaux agonistes potentiels
pour ces récepteurs puisqu'il est activé par des nucleotides liés à un sucre comme l'UDP-glucose (108). Par contre, une étude récente montre que l'UDP peut aussi être considéré comme un puissant agoniste du récepteur P2Y,4 (109). En 2004, un récepteur orphelin (GPR80/GPR99)
hypothétiquement sensible à l'AMP et à l'adénosine, avait été identifié et nommé P2Yi5 (110).
Toutefois, suite à une étude montrant que ce récepteur répond plutôt à l'a-cétoglutarate (111), le sous-comité P2Y de l'union international de pharmacologie (IUPHAR; International Union of basic and clinical Pharmacology) a déterminé que le récepteur GPR80/GPR99 n'était pas un récepteur P2 (112).
L'activation des récepteurs P2Y est associée à la mise en branle de plusieurs voies de signalisation intracellulaire dépendant de la protéine G à laquelle chaque récepteur est couplé. Les récepteurs P 2 Y1 2 4 6 et n sont couplés à la protéine Gq**, ils activent donc la PLC qui favorise la
formation d'inositol triphosphate et entraine la mobilisation des réserves de Ca2+ intracellulaire.
D'autre récepteurs modulent l'activation de l'adénylate cyclase, soit en l'inhibant via la protéine Gj/o (P2Yi2, 13 et u) ou en l'activant (P2Yn) via la protéine Gas. Certains récepteurs peuvent être
couplés à plus d'un type de protéine G, comme c'est le cas pour P2Y** (Gqn et Gcs) et pour P2Y|2,
qui, en plus d'être couplé à la protéine Gj/„, peut aussi activer les kinases phosphoinositide-3 et RhoA via la protéine G01 (113). Les principaux agonistes et antagonistes ainsi que les voies de
transduction de signal induites par l'activation des récepteurs P2Y sont résumés dans le tableau 1.3. Trois autres récepteurs couplés aux protéines G possédant une bonne homologie de séquence avec les récepteurs P2Y, répondent à l'UDP. Ce sont les récepteurs CysLTl et CysLT2 donc les agonistes principaux sont les cystéinyl leucotriènes C4 (LTC4), D4 (LTD4) et E4 (LTE4) (114, 115) ainsi que le récepteur GPR17 qui, en plus d'être activé par la molécule LTD4 et l'UDP, répond aussi à l'UDP-glucose (116). L'existence de ces récepteurs répondant en plus des nucleotides à une autre classe de molécules bio-actives, représente une nouvelle avenue de recherche sur les mécanismes de régulation simultanée impliquant plusieurs systèmes physio-logiques, incluant la signalisation purinergique.
Certains récepteurs P2Y ont la capacité de former des hétéro-dimères fonctionnels (117). En effet, il a été montré que les récepteurs P2Y- (118) et P2Y2 (119) ont la capacité de former des
hétéro-dimères avec le récepteur à l'adénosine Ai. La combinaison ArP2Yi est exprimée
notamment dans le cerveau et localisée au niveau de la région hippocampale, chez le rat (120, 121). L'existence d'hétéro-dimères composés d'un récepteur P2Y et d'un récepteur PI apporte de nombreuse questions concernant la régulation de la signalisation par les nucleotides et nucleosides extracellulaires, mais aussi de nouvelles pistes thérapeutiques potentielles (122).
L'activation de tous ces récepteurs est contrôlée, entre autres, par l'hydrolyse de leurs agonistes par des enzymes exprimées à la surface des cellules que l'on nomme ecto-nucléotidases. Ces enzymes seront décrites dans les prochaines sections.
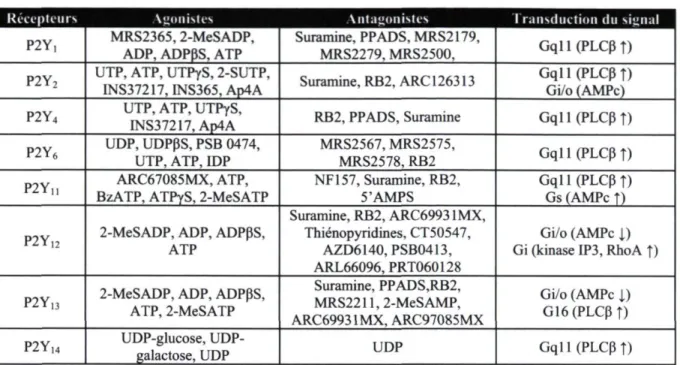
Tableau 1.3 : La famille des récepteurs P2Y
Récepteurs Agonistes Antagonistes transduction du signal
P2Y, MRS2365,2-MeSADP, ADP, ADPPS, ATP Suramine, PPADS, MRS2179,
MRS2279, MRS2500, Gqll(PLCPî) P2Y2 UTP, ATP, UTPyS, 2-SUTP,
INS37217,INS365,Ap4A Suramine, RB2, ARC 126313 Gqll(PLCPî) Gi/o (AMPc) P2Y4 UTP, ATP, UTPyS,
INS37217,Ap4A RB2, PPADS, Suramine Gqll(PLCPî) P2Y6 UDP, UDPPS, PSB 0474,
UTP, ATP, IDP MRS2567, MRS2575, MRS2578, RB2 Gqll(PLCPî) P2Y„ BzATP, ATPyS, 2-MeSATP ARC67085MX, ATP, NF157, Suramine, RB2, 5'AMPS Gql 1 (PLCP î) Gs (AMPc î) P2Y12 2-MeSADP, ADP, ADPpS,
ATP Suramine, RB2, ARC69931MX, Thiénopyridines, CT50547, AZD6140,PSB0413, ARL66096,PRT060128 Gi/o (AMPc 1) Gi (kinase IP3, RhoA î) P2Y13 2-MeSADP, ADP, ADPpS,
ATP, 2-MeSATP Suramine, PPADS,RB2, MRS2211,2-MeSAMP, ARC69931MX, ARC97085MX Gi/o (AMPc 1) G16(PLCPî) P2Y14 glucose,
UDP-galactose, UDP UDP Gqll(PLCpî)
Références utilisées : (96, 109, 123-128)
1.1.3 Ecto-enzymes impliquées dans la régulation des
concen-trations de nucleotides et nucleosides extracellulaires
1.1.3.1 Ecto-nucléotidases
Le terme ecto-nucléotidases est utilisé pour les diverses familles d'enzymes présentes à la membrane plasmique qui ont comme activité enzymatique l'hydrolyse des nucleotides extracellulaires. En contrôlant les niveaux des nucleotides extracellulaires, ces ecto-enzymes contrôlent les réponses cellulaires induites par ces molécules via l'activation des récepteurs PI et P2 tel que décrit ci-dessus. Les principales familles d'ecto-nucléotidases sont présentées dans les figures 1.1. Leurs principales caractéristiques sont aussi résumées dans le tableau 1.4. Il y a, entre autres, les ecto-nucléotides pyrophosphatases/phosphodiesterases (NPPs), les phosphatases alcalines et acides ainsi que l'ecto-5'-nucleotidase. La famille d'ecto-enzymes qui nous intéresse plus particulièrement est la famille des ecto-nucléosides triphosphates diphosphohydrolases (E-NTPDases) (129). L'action combinée de ces différentes familles d'ecto-nucléotidases permet la conversion des nucleotides tri-, di- et monophosphate en leurs nucleosides correspondant. Cette
action est physiologiquement très importante puisqu'elle permet la conversion d'un agoniste des récepteurs P2 en un agoniste des récepteurs PI.
Figure 1.1 : Représentation schématique et topologie membranaire des
e c t o - n u c l é o t i d a s e s . A) les NPP, les phosphatases et l'ecto-5'nucleotidase et B) Les NTPDases (inspirée de Zimmermann 2000 (130)).
1.1.3.1.1 Les ecto-nucléotides pyrophosphatases/phosphodiesterases : NPP
La famille des nucleotides pyrophosphatases/phosphodiesterases (NPP; Figure 1.1 A) compte sept membres, liés par leurs structures, qui sont nommés NPP 1-7 dont le site actif est retrouvé du côté extracellulaire. Comme leur nom l'indique, ces enzymes hydrolysent les liens pyrophosphates et/ou phosphodiesters de différents substrats (Tableau 1.4). On distingue deux
sous-groupes selon leurs homologies de séquences. Les NPP 1-3, les trois premiers membres identifiés, sont des ecto-enzymes de type II. En d'autres mots, ce sont des protéines qui possèdent un passage transmembranaire situé en N-terminal et une portion C-terminal extracellulaire. Par contre, la NPP2 est synthétisée sous forme de pré-pro-enzyme et, suite à une étape de maturation par une protease de type furase, sécrétée sous forme soluble dans le milieu extracellulaire (131). Les NPP4-7 sont des ecto-enzymes de type I avec un passage transmembranaire en C-terminal et une extrémité N-terminal extracellulaire. Seules les NPP1-3 ont la capacité d'hydrolyser les nucleotides extracellulaires (21, 132). Ce sont aussi ces enzymes qui hydrolysent les dinucléotides présents dans le milieu extracellulaire (133). La NPP2, aussi appelée autotaxine, bien qu'elle puisse hydrolyser les nucleotides, est d'abord considérée comme une lysophospholipase D qui catalyse l'hydrolyse des liens phosphodiesters présents dans les molécules de lysophosphatidylcholine (LPC) et de sphingophosphorylcholine (SPC) pour former respectivement du LPA et du sphingosine-1-phosphate (134, 135). La nature de l'activité biochimique des NPP4 et NPP5 n'est pas encore caractérisée puisque leurs substrats naturels ne sont pas connus. Les NPP6 et NPP7 sont des choline phosphate esterases (136). L'activité enzymatique des NPP est dépendante de la présence de cations divalents comme le Ca2+ et le magnésium (Mg2+) et optimale à pH basique. Il est intéressant de
noter que les NPP 1-3 possèdent aussi la capacité de s'auto-phosphoryler (132). Par exemple, la NPP1 peut s'auto-phosphoryler en présence de faibles concentrations d'ATP, ce qui a pour effet direct d'inhiber son activité ecto-nucléotidase (137). Donc, seules les NPP 1-3 peuvent avoir un effet sur la signalisation modulée par les nucleotides extracellulaires.
1.1.3.1.2 Les phosphatases alcalines
La famille des phosphatases alcalines sont des ecto-nucléotidases liées à la membrane plasmique par une ancre de glycosyl-phosphatidyl-inositol (GPI; Figure LIA). Elles peuvent aussi être retrouvées sous forme soluble suite à l'hydrolyse de ce lien. Ce sont des enzymes ubiquitaires qui sont retrouvées aussi bien chez les bactéries que chez les humains. Comme leur nom l'indique, les phosphatases alcalines possèdent un pH optimal basique, situé entre pH 8 et pH 11 (Tableau 1.4). Les phosphatases alcalines catalysent la libération du phosphate inorganique (Pj) d'une grande variété de substrats possédant des liens phosphomonoesters et aussi de beaucoup d'autres composés phosphorylés comme les nucleotides adénylés, le pyrophosphate (PPj) ainsi que les acides gras phosphatés (21, 138). Quatre isoformes ont été clonées et caractérisées jusqu'à maintenant. Elles sont respectivement nommées en fonction de leur localisation tissulaire. Il existe trois isoformes tissus spécifiques qui possèdent plus de 90% d'homologie de séquence protéique et sont
respectivement retrouvées dans l'intestin, dans le placenta et dans les cellules germinales. Le quatrième membre de cette famille nommé phosphatase alcaline non spécifique à un tissu (TNAP; non-specific tissue alkaline phosphatase) ne possède que 50% d'homologie avec les trois autres isoformes et est présent dans plusieurs tissus, principalement le foie, les reins et les os (21 ). Par leur capacité à hydrolyser tous les composés de la chaîne des nucléoside-5'-triphosphates en leur nucleosides correspondant, soit par exemple, l'ATP, l'ADP et l'AMP en adenosine, les phosphatases alcalines participent fort probablement à la régulation de l'activation des récepteurs PI et P2 mais aucun exemple concret n'est encore répertorié.
1.1.3.1.3 Les phosphatases acides
Les phosphatases acides, comme leur nom l'indique, possèdent un pH optimal pour leur activité d'hydrolyse situé entre pH 3 et pH 8 (139). Deux types distincts de phosphatase acide sont identifiés jusqu'à maintenant. Il y a la phosphatase acide prostatique (prostatic acid phosphatase; PAP) ainsi que la phosphatase acide résistante au tartrate (tartrate-resistant acid phosphatase; TrAP; Figure LIA).
Deux variants d'épissage de la PAP ont été identifiés, le premier est soluble (PAP) alors que le second est une ecto-enzyme membranaire de type 1 (trans-membrane-PAP; TM-PAP) (140). Les deux variants possèdent une grande variété de substrats, incluant les nucleotides à l'exception de l'ATP (139) (Tableau 1.4). Il est à noter que bien que cette enzyme fut identifiée pour la première fois au niveau de la prostate, où elle fut d'ailleurs longtemps utilisée comme marqueur de tumeur, les deux variants de la PAP sont aussi retrouvés dans d'autres tissus. Zylka et al. ont d'ailleurs montré en 2008 que la TM-PAP présente sur les neurones sensoriels dorsaux participe à la sensation de la douleur par son activité d'hydrolyse de l'AMP (141).
La TrAP est une enzyme de surface liée à la membrane plasmique par une ancre GPI et qui est principalement connue comme un marqueur des ostéoclastes. Elle est aussi exprimée par plusieurs types cellulaires dont les macrophages et les cellules dendritiques (139, 142). Suite au clivage de son ancre GPI par l'action des phospholipases endogènes, la TrAP peut être relarguée sous une forme soluble dont l'activité ATPasique est augmentée par rapport à la forme membranaire non clivée (139). Le pH optimal de la TrAP pour l'hydrolyse de l'ATP se situe aux environ de pH 5 (142). Cette enzyme a la capacité d'hydrolyser une grande variété de substrats comme l'ATP, l'ADP, le PPj et les phosphoprotéines, mais très peu l'AMP (139) (Tableau 1.4).
1.1.3.1.4 L 'ecto-5 '-nucleotidase
La famille des 5'-nucleotidase compte sept membres, six isoformes cytosoliques (cNI-III, cdN et mdN) et une membranaire, l'ecto-5'-nucleotidase ou CD73 (21, 143). L'isoforme qui nous intéresse ici est bien entendu l'ecto-5'-nucleotidase (Figure LIA). Cette enzyme est accrochée à la membrane plasmique sous forme homo-dimérique par une ancre GPI qui peut être clivée et générer une forme soluble de l'enzyme retrouvée dans le milieu extracellulaire (144). Tous les nucléosides-5'-monophosphatés retrouvés dans le milieu extracellulaire sont des substrats potentiels de l'ecto-5'-nucleotidase, mais son substrat de prédilection demeure l'AMP (Tableau 1.4). Le pH optimal de l'hydrolyse par l'ecto-5'-nucleotidase est de 7,5 (143), ce qui en fait l'AMPase majeure agissant à pH physiologique. Une caractéristique intéressante est que l'ATP et l'ADP agissent comme inhibiteurs naturels de l'ecto-5'-nucléotidase. Cette enzyme est aussi inhibée par des composés comme l'aP-MeADP et la concanavalineA (ConA) (143). Bien que l'ecto-5'-nucleotidase soit exprimée dans une majorité des tissus de l'organisme, elle se retrouve en plus grande abondance dans le côlon, les reins, le cerveau, le foie, le cœur et les poumons (21). L'ecto-5'-nucleotidase est aussi considérée comme un marqueur des cellules souches mésenchymateuses (145). Trois groupes de recherche différents ont dernièrement développé des lignées de souris déficientes pour le gène codant pour l'ecto-5'-nucléotidase dans le but d'étudier ses fonctions physiologiques, principalement attribuables à l'activation des récepteurs PI par l'adénosine générée suite à son activité enzymatique (146-148). Ces études ont, par exemple, permis de montrer le rôle de protection qu'exerce l'ecto-5'-nucleotidase contre l'hischemie/reperfusion hépatique (149)) ainsi que son implication fonctionnelle dans le contrôle de la douleur (150).
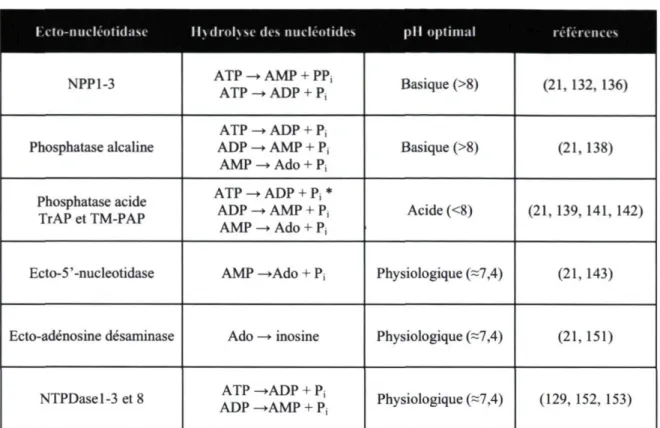
Tableau 1.4 : Les ectonucléotidases
hctonucléotidase Hydrolyse des nucleotides pli optimal references
NPP 13 ATP > AMP + PPj
ATP ♦ ADP + Pj Basique (>8) (21, 132, 136)
Phosphatase alcaline ATP > ADP + P, ADP * AMP + Pj AMP > Ado + Pj Basique (>8) (21,138) Phosphatase acide TrAP et TMPAP ATP > ADP + Pi * ADP > AMP + Pj AMP » Ado + Pj Acide (<8) (21, 139, 141, 142)
Ecto5 'nucleotidase AMP >Ado + Pi Physiologique (=7,4) (21, 143)
Ectoadénosine désaminase Ado —» inosine Physiologique (~7,4) (21,151)
NTPDasel3 et 8 ATP >ADP + Pi
ADP >AMP + Pj Physiologique (=7,4) (129, 152, 153)
Les nucleotides et nucleosides adénylés sont utilisés à titre d'exemple. *Seul la TrAP hydrolyse l'ATP
1.1.3.1.5 L'ectoadénosine désaminase (ADA)
L'adénosine désaminase est l'enzyme responsable de la conversion de la 2adénosine et de la 2déoxyadénosine en 2inosine et 2déoxyinosine (Tableau 1.4), phénomène essentiel au recyclage des nucleosides par les cellules (151). Un seul gène code pour l'ADA, par contre deux phénotypes sont décrits, soit ADA1 (le plus abondant) et ADA2. De plus, bien que l'ADA soit une protéine soluble ne comportant aucun passage ou signal de localisation membranaire, on retrouve de l'ADA à la membrane plasmique (ectoADA) en association avec diverses protéines membranaires (151). Les associations les plus courantes sont avec CD26/dipeptidyl peptidase4 ainsi qu'avec les récepteurs à l'adénosine, Ai et A2B (151, 154). L'adénosine désaminase retrouvée à la membrane
plasmique ne présente aucune variation de séquence avec l'ADAl, suggérant la présence de la même protéine aux niveaux cytosolique et membranaire. Les mécanismes qui permettent la relâche et l'association de l'ADA à la membrane ne sont pas encore connus (151). L'ectoADA est exprimée principalement par des cellules immunitaires comme les lymphocytes T et les cellules dendritiques, elle est aussi retrouvée sur les cellules endothéliales vasculaires (21, 151). Il est à
noter qu'une mutation dans le gène de l'adénosine désaminase est la cause d'une grave lymphopénie et immunodéficience chez l'humain (155). Les souris déficientes pour le gène de l'ADA présentent un phénotype semblable à celui observé chez les patients atteints de ce trouble immunitaire (156).
1.1.3.1.6 Les nucleosides triphosphates diphosphohydrolases : NTPDases 1.1.3.1.6.1 Historique
Les premières enzymes pouvant hydrolyser les nucleotides ont été découvertes chez les plantes vers la fin des années 1940 (157, 158). Les premières expériences de purification ont montré que ces enzymes, nommées apyrases, sont présentes sous forme soluble dans la plupart des organismes étudiés (159). Le terme ecto-ATPase, utilisé pour les enzymes de mammifères, est apparu pour la première fois dans la littérature en 1957 (160). Dès lors, ces ecto-enzymes ont été définies par les trois caractéristiques majeures suivantes : 1- l'activité de ces enzymes dépend des ions divalents (Ca2+ ou Mg2+); 2- l'activité ATPasique n'est pas sensible aux inhibiteurs des
ATPases de types P, F et V; et 3- elles hydrolysent les nucleosides 5'-triphosphates (NTP) et/ou les nucleosides 5'-diphosphates (NDP) mais pas les nucleosides 5'-monophosphates (NMP) ni les nucleosides présents dans le milieu extracellulaire (161), voir tableau 1.4.
Dès le début de l'étude de ces enzymes, il est démontré que les ratios d'hydrolyse de l'ATP par rapport à l'hydrolyse de l'ADP varient énormément selon le tissu ou les cellules étudiées. Par exemple, les tubules T des muscles lisses expriment une ecto-ATPase dont l'activité biochimique est caractérisée par une très forte préférence pour les tri-phosphonucléosides (162) alors que le pancréas exocrine possède une enzyme capable d'hydrolyser aussi bien les NTP que les NDP (163). Cette enzyme pancréatique a d'ailleurs été appelée adenosine triphosphate diphosphohydrolase (ATPDase). Déjà, la nomenclature de cette nouvelle catégorie d'ecto-enzymes devenait très compliquée puisqu'en plus des termes apyrase, ATPase et ATPDase, on retrouve à l'époque des noms comme ATP-DPH, adenosine diphosphatase, nucléoside-diphosphatase, phosphohydrolase pour ne nommer que ceux-là (161). De plus, ces différentes nomenclatures correspondaient à plusieurs classes d'enzymes (EC 3.6.1.3, EC 3.6.1.5, EC 3.6.1.6 et EC 3.6.1.15) (161). Une nouvelle nomenclature a donc été proposée en 1999 lors de la deuxième session internationale de travail sur les ATPases et ecto-nucléotidases à Diepenbeek en Belgique (164). Il a été convenu d'appeler dorénavant ecto-nucléoside triphosphate diphosphohydrolase (E-NTPDase, EC 3.6.1.5),