HAL Id: dumas-01347501
https://dumas.ccsd.cnrs.fr/dumas-01347501
Submitted on 21 Jul 2016HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires
Causes d’explantation d’implants intraoculaires et prise
en charge au CHNO des Quinze-Vingts : résultats d’une
cohorte historique de 2005 à 2014
Marine Legrand
To cite this version:
Marine Legrand. Causes d’explantation d’implants intraoculaires et prise en charge au CHNO des Quinze-Vingts : résultats d’une cohorte historique de 2005 à 2014. Médecine humaine et pathologie. 2016. �dumas-01347501�
AVERTISSEMENT
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance et réalisé dans le but d’obtenir le diplôme d’Etat de docteur en médecine. Ce document est mis à disposition de l’ensemble de la communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute poursuite pénale.
UNIVERSITÉ PARIS DESCARTES
Faculté de Médecine PARIS DESCARTES
Année 2016
N° 26
THÈSE
POUR LE DIPLÔME D’ÉTAT
DE
DOCTEUR EN MÉDECINE
Spécialité : Ophtalmologie
Causes d’explantation d’implants intraoculaires et
prise en charge au CHNO des Quinze-Vingts :
résultats d’une cohorte historique
de 2005 à 2014
Présentée et soutenue publiquement
le 23 mars 2016
Par
Marine LEGRAND
Née le 8 janvier 1988 à Saint-Cyr-l'École (78)
Dirigée par M. Le Docteur Jad Akesbi
Jury :
M. Le Professeur Jean-Philippe Nordmann ……….. Président M. Le Professeur Antoine Labbé
R E M E R C I E M E N T S :
A l'image du travail ayant inspiré la forme de celui-ci, ils seront brefs. Chacun pourra ainsi s'en approprier ce qu'il estime mérité.
Je me dois toutefois d'évoquer l'équipe du service du Pr NORDMANN, qui a contribué à l'écriture de ce scénario inattendu, et qui continuera à influencer ma vie personnelle et
professionnelle pendant encore quelques années.
Sommaire
1 -Introduction...6
1.1 -Généralités sur le cristallin ...6
1.1.1 -Anatomie...6
1.1.2 -Propriétés...7
1.1.2.1 -Accommodation...7 1.1.2.2 -Modification de la transparence...71.2 -Chirurgie de la cataracte...8
1.2.1 -Épidémiologie...8
1.2.2 -Historique de la prise en charge...9
1.2.3 -La phakoémulsification (PKE)...11
1.2.4 -Complications de la chirurgie...15
1.2.4.1 -Peropératoires...15
1.2.4.2 -Postopératoires...17
1.3 -Implants intraoculaires (IOL)...18
1.3.1 -Historique...20
1.3.2 -Différents types d'implants...22
1.3.2.1 -PMMA (1930)...22
1.3.2.2 -Silicone (1980)...23
1.3.2.3 -Acrylique (1990)...23
1.3.2.4 -Hydrogels...24
1.3.4 -Complications spécifiques...26
1.3.4.1 -Opacification capsulaire postérieure...26
1.3.4.2 -Opacification de l'implant et Glistening...27
1.3.4.3 -Luxations et subluxations ...29
1.3.4.4 -Kératopathie bulleuse du pseudophaque...30
1.3.4.5 -Intolérance des implants multifocaux...31
1.3.4.6 -Erreurs réfractives...31
1.3.4.7 -Post endophtalmie...32
1.4 -Techniques chirurgicales d'explantation...32
1.4.1 -Explantation ...32
1.4.2 -Réimplantation...33
1.4.2.1 -Dans le sac...33 1.4.2.2 -Dans le sulcus ...34 1.4.2.3 -Clippé à l'iris...35 1.4.2.4 -Fixé à la sclère...362 -Matériel et méthodes...38
3 -Résultats...40
3.1 -Données démographiques...40
3.2 -Délai entre implantation et explantation...40
3.3 -Causes des explantations...41
3.3.1 -Luxations (59%)...45
3.3.2 -Décompensations endothéliales (19%)...46
3.3.4 -Erreurs de calcul (5%)...48
3.3.5 -Opacification de l'implant (4%)...49
3.3.6 -Implants multifocaux mal tolérés (3%)...50
3.3.7 -Endophtalmies (1%)...51
3.4 -Chirurgie de réimplantation...52
3.4.1 -Implantation en chambre postérieure (48%)...53
3.4.2 -Implantation en chambre antérieure (16%)...54
3.4.3 -Aphaquie : pas d'implantation (20%)...55
4 -Discussion...56
5 -Conclusion...65
1 - Introduction
1.1 - Généralités sur le cristallin
1.1.1 - Anatomie
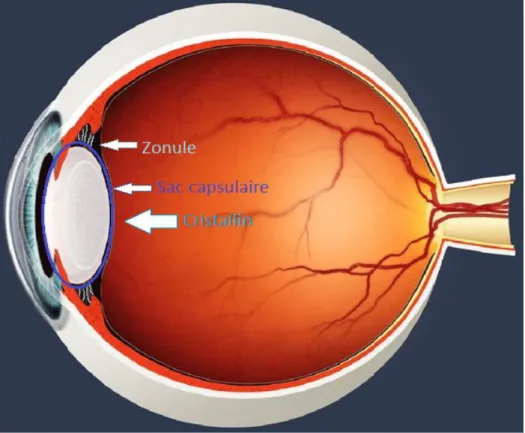
C'est une lentille biconvexe, plate en avant et bombée en arrière, constituée d'un noyau et d'un cortex, entourée d'une capsule (cristalloïde) reliée au corps ciliaire par la zonule de Zinn.
Il est avasculaire, non innervé et transparent. Son poids est d'environ 200 mg (mais celui-ci augmente avec l'âge) et il mesure 10 mm (frontal) x 4 mm (antéro-postérieur). Lors de l’accommodation, ses rayons de courbure antérieur et postérieur son modifiés. Son indice
de réfraction est de 1,42 et sa puissance optique de 21 dioptries (D).
La capsule est une membrane élastique et solide, épaisse de 13 µm en avant et 4 µm en arrière. Elle donne insertion aux fibres zonulaires, de forme triangulaire à sommet externe, qui naissent sur le corps ciliaire et s'insèrent au niveau des faces antérieure et postérieure et de l'équateur. L'espace compris entre ces fibres s'appelle le canal de Petit.
1.1.2 - Propriétés
1.1.2.1 - Accommodation
Dans la vision rapprochée, la puissance réfractive du cristallin jeune augmente jusqu'à 10D. Il s'agit de la réserve accommodative. Elle diminue progressivement, devient symptomatique vers 45 ans (presbytie), et nulle vers 60 ans suite à une perte presque complète de l'élasticité du cristallin.
1.1.2.2 - Modification de la transparence
Avec l'âge, la structure protéique du cristallin se modifie et il change de densité : il se forme des opacités et la transmission de la lumière est donc modifiée. Des perturbations nutritionnelles peuvent également être en cause (déficit en acides aminés, avitaminose, perturbation endocrinologique ou enzymatique, toxiques...). De ce fait, outre le vieillissement, les facteurs génétiques et raciaux, l'influence géographique et climatique, une malnutrition chronique, l'exposition professionnelle à des facteurs cataractogènes, certains médicaments, une prédisposition héréditaire, un diabète, les maladies générales (cardio-vasculaires) peuvent être des facteurs de risque de développer une cataracte (1).
1.2 - Chirurgie de la cataracte
1.2.1 - Épidémiologie
La cataracte correspond à l'opacification du cristallin, qui entraîne une diminution progressive de la vision.
La cataracte est la première cause de cécité dans le monde et est une conséquence physiologique du vieillissement. Des opacités cristalliniennes sont rapportées chez 57 à 74 % des personnes âgées de 65 à 74 ans et une véritable cataracte chez 18 à 29 % ; entre 75 et 84 ans, ces taux atteignent respectivement 91 à 95 % et 37 à 59 %.
Le stress oxydant photo-induit par les radiations solaires et l’exposition aux ultraviolets est la principale cause d'opacification dans le cristallin (2).
A côté des facteurs liés à l’âge, le diabète (et plus précisément la galactosémie), le tabagisme (3), l’alcool, ainsi que certains médicaments (corticothérapie, diurétiques thiazidiques, neuroleptiques majeurs de la famille des phénothiazines, amiodarone, agents cytostatiques…etc) constituent d’autres facteurs de risque de la cataracte (4). La consommation de lactose aurait un rôle cataractogène (5). Les vitamines C et E auraient par contre un effet protecteur vis à vis du vieillissement du cristallin (6).
Un traumatisme oculaire, une pathologie du segment antérieur (uvéite, glaucome aigu par fermeture de l'angle), une chirurgie pénétrante du globe oculaire (filtrante, vitrectomie), la myopie forte et la pseudo-exfoliation capsulaire (PEC) sont également des facteurs de risque de cataracte précoce...(7)
632 885 chirurgies de cataracte ont été pratiquées en 2009 en France (8). Ce nombre tend à l'augmentation compte tenu du vieillissement de la population, et de l'essor de la chirurgie du cristallin à visée réfractive (myopie / presbytie fortes, presbytie). Ainsi, de plus en plus de patients sont pseudophaques.
1.2.2 - Historique de la prise en charge
Le traitement chirurgical est actuellement la seule thérapeutique efficace, une fois la cataracte diagnostiquée. Il consiste à extraire le cristallin atteint de cataracte et à le remplacer par un implant intraoculaire (IOL) artificiel. Ce procédé a montré son efficacité sur l’acuité visuelle et sur la qualité de vie des patients (9,10).
Il y a plus de 1000 ans, on procédait déjà à l'abaissement du cristallin en Orient, qui consistait à faire basculer le cristallin en arrière, dans le vitré, à l’aide d'un instrument pointu qu'on introduisait dans le globe oculaire au niveau de la pars plana, sans anesthésie. Cette intervention est encore pratiquée en France au XIXème siècle, et dans certaines tribus d' Afrique de nos jours.
Cependant, dès 1750, le chirurgien Jacques Daviel proposa une technique plus moderne pour traiter la cataracte : suite à une luxation antérieure du cristallin d'un patient malencontreusement survenue lors d'une manœuvre d'abaissement, il dut inciser la partie inférieure de la cornée afin d'extraire celui-ci...Après une importante expérimentation chez
l'animal, il réussit à obtenir des résultats satisfaisants chez l'homme.
La division des ophtalmologistes quant à la suprématie de l'une ou de l'autre technique perdura jusqu'au milieu du XIXème siècle. Puis, de nombreuses améliorations furent apportées : incision supérieure plutôt qu'inférieure ( afin que la paupière protège l'ouverture), iridectomie (pour éviter des hernies et diminuer le taux d'infection), anesthésie générale puis locale à la cocaïne, suture de l'incision, microscope opératoire, mise en place d'un implant intraoculaire pour corriger l'aphakie, utilisation de l'alphachymotrypsine pour détruire la zonule de Zinn et faire une extraction intracapsulaire plus facile, extraction du cristallin à l'aide du froid (cryode)...(11)
En 1967, l'américain Kelman inventa la phakoémulsification (12), qui permit de réduire considérablement la taille de l'incision en utilisant un instrument à ultrasons pour fragmenter le cristallin. On laissa aussi la capsule postérieure intacte afin de conserver une barrière entre le segment antérieur et le vitré.
1.2.3 - La phakoémulsification (PKE)
Actuellement, les techniques de PKE permettent de réaliser des micro incisions (< 2mm) ne nécessitant aucune suture, et n’entraînant quasiment aucun astigmatisme.
La chirurgie se déroule le plus souvent sous anesthésie topique (collyre de tétracaïne ou d'oxybuprocaïne) en ambulatoire. Dans certaines rares indications, on peut recourir à l'anesthésie locorégionale (péribulbaire ou caronculaire de xylocaïne) ou à l'anesthésie générale (patients jeunes, déments).
L'asepsie chirurgicale est obtenue à l'aide de plusieurs badigeons de povidone iodée
ophtalmique, cutanés et dans les culs de sacs conjonctivaux. Le site opératoire est délimité par un champ stérile, les cils sont exclus par un blépharostat, qui maintient les paupières ouvertes.
L'incision principale est réalisée en cornée claire, le plus souvent en supérieur (elle sera ainsi recouverte par la paupière supérieure), à l'aide d'un couteau calibré de 1,5 à 3,2 mm selon l'appareil de PKE utilisé. Une 2ème incision plus petite est faite à environ 90° de la première, permettant l'utilisation des deux mains pendant l'intervention à l'intérieur de l’œil.
L'humeur aqueuse étant fluide comme de l'eau, on remplit la chambre antérieure de
substance viscoélastique pour en maintenir le volume. On aura pu au préalable utiliser
un colorant bleu afin de colorer la capsule antérieure (cataractes blanches) et faciliter l'étape suivante.
Le capsulorhexis consiste ensuite en l'ouverture, à l'aide d'une pince pointue, d'un cercle de 5,5 mm de diamètre environ dans la capsule antérieure, qui permettra l'accès direct au cristallin.
L'hydrodissection est l'injection de solution tamponnée (BSS) entre la capsule et le
cortex, afin que ceux-ci se séparent et que le cristallin devienne mobile à l'intérieur de son sac.
La pièce à main est insérée jusqu'à la chambre postérieure et va permettre la
fragmentation et l'aspiration du noyau cristallinien à l'aide d'ultrasons (qui vont agir
comme un marteau piqueur, par micro vibrations antéropostérieures). Plusieurs techniques existent : « Divide and Conquer » (découpe « cracking » en 3 ou 4 quartiers du noyau), « Stop and Chop » (aspiration-fragmentation de morceaux à l'aide d'un petit crochet), luxation en chambre antérieure...Elles ont toutes pour but de retirer le noyau et son cortex en préservant le sac que constitue la capsule (postérieure et antérieure).
On change ensuite d'instrument pour procéder, à l'aide de l'irrigation-aspiration (IA), au lavage des masses qui sont restées collées sur les parois du sac.
L'implant est introduit replié via l'incision principale, après ouverture du sac intact par du viscoélastique, en arrière du rhexis, dans la chambre postérieure.
Figure 7. Réalisation d'un sillon dans le noyau cristallinien à l'aide de la pièce à main (PKE bi-manuelle)
Le produit visqueux est aspiré afin d'éviter toute hypertonie post opératoire, l'incision est rendue étanche grâce à l'injection de BSS dans ses berges (hydrosuture), et la plupart des équipes injectent un antibiotique en intracamérulaire (céfuroxime) en prophylaxie de l'endophtalmie (13).
Les suites sont généralement simples avec une récupération visuelle en moins de 24 heures et l'absence de douleur. Une coque de protection et des collyres antibiocorticoïdes sont prescrits pour une durée d'environ 1 mois.
1.2.4 - Complications de la chirurgie
1.2.4.1 - Peropératoires
- Oedème de cornée : par infusion dans l'incision, par décompensation endothéliale (perte cellulaire d'origine mécanique, par frottement accidentel), par décollement
descemétique.
- Hémorragie : via une incision trop limbique, plus souvent en provenance de l'iris suite à une iridodialyse, favorisée par l'hypotonie
- Hernie irienne : particulièrement en cas de chambre antérieure étroite, d'incision trop directe, d'hypertonie provoquée. Le stroma irien peut subir une nécrose localisée du fait de l'ischémie survenant lorsqu'il reste coincé dans l'incision.
- Refend capsulaire antérieur : soit lors de la réalisation du rhexis (celui ci « file » en direction de la zonule et risque de se propager à la capsule postérieure, pouvant entraîner une chute du cristallin dans le vitré), soit lors de la phakoémulsification par aspiration du plan capsulaire antérieur dans la pièce à main. Le volet de capsule flottant pourra être coupé aux ciseaux pour ne pas qu'il s'agrandisse dans les suites de l'opération.
- Rupture de la capsule postérieure : avec ou sans issue de vitré, avec ou sans luxation de fragments cristalliniens dans le vitré. Le vitré devra être nettoyé (à l'aide d'un vitréotome ou aux ciseaux) pour ne pas qu'il s'incarcère dans l'incision ou qu'il ne déforme la pupille. Les morceaux luxés en postérieur seront nettoyés au cours d'une vitrectomie par la pars plana, soit dans le même temps si le chirurgien dispose du matériel et de l'expérience nécessaires, soit dans les jours qui suivent. L'implant pourra être mis en place dans le sac en cas d'ouverture minime de la capsule postérieure, dans le sulcus (entre la capsule antérieure et l'iris) sinon. En l'absence totale de plan capsulaire, on pourra clipper un implant à l'iris, suturer un implant à la sclère, ou laisser le patient aphaque.
- Désinsertion zonulaire : le sac sera anormalement mobile jusqu'à se détacher complètement avec risque de luxation postérieure. La chirurgie devra alors être menée avec précaution, en utilisant le moins possibles de manœuvres intra sacculaires...Un anneau de tension capsulaire pourra être mis en place pour éviter une rétraction avec décentrement ultérieur de l'implant.
- Hémorragie expulsive : il s'agit de la survenue d'un hématome choroïdien, favorisé par l'hypotonie, donc très rare au décours d'une PKE (12).
1.2.4.2 - Postopératoires
- Opacification de la capsule postérieure (cataracte secondaire, PCO) : due à la
transformation en fibroblastes des cellules épithéliales cristalliniennes, soit sous forme de fibrose (avec une rétraction précoce du sac), soit sous forme de perles d'Hirschberg-Elschnig dues à la migration et à la prolifération des cellules cristalliniennes (jusqu'à l'axe visuel, plus tardif).
- Capsulophimosis : pouvant aboutir à un décentrement de l'implant et nécessiter la
réalisation de traits de refend au laser YAG ou une reprise chirurgicale.
- Kératopathie bulleuse : la prévention consiste en la recherche minutieuse d'une cornea
guttata en préopératoire et en une chirurgie la moins traumatique possible. Son incidence était maximale dans les années 80 avec les implants de chambre antérieure (15) et est désormais d'environ 0,1% avec les techniques modernes (10). En cas d’œdème cornéen
trop important, une kératoplastie pourra être proposée, voire une greffe endothéliale (DMEK ou DSEK).
- Décollement de rétine : avec un taux estimé à 0,5 à 2%, augmenté en cas de rupture
capsulaire (16).
- Oedème maculaire cystoïde (Syndrome d'Irvine Gass) : survient dans 1,17% des cas
après une PKE, avec une augmentation de ce risque en cas de rupture capsulaire, de membrane épirétinienne, d'uvéite, d'occlusion veineuse rétinienne, d'antécédent de décollement de rétine, ainsi que chez les patients diabétiques (17). Cela correspond à la formation de cavités liquidiennes dans les couches plexiformes suite à une perméabilisation de la barrière hémato-rétinienne. Il n'y a pas de consensus sur le traitement mais on utilise fréquemment les collyres anti-inflammatoires (18), et plus récemment les implants intra-vitréens de déxaméthasone (19).
- Endophtalmie : infection intra-oculaire survenant en général dans les jours qui suivent la
chirurgie, le plus souvent à germes Cocci Gram +, nécessitant l'introduction d'une antibiothérapie à large spectre en urgence (intra vitréenne et parentérale), après réalisation de prélèvements à visée bactériologique.
- Déplacement ou luxation de l’implant : Cette complication sera détaillée dans un
paragraphe spécifique.
1.3 - Implants intraoculaires (IOL)
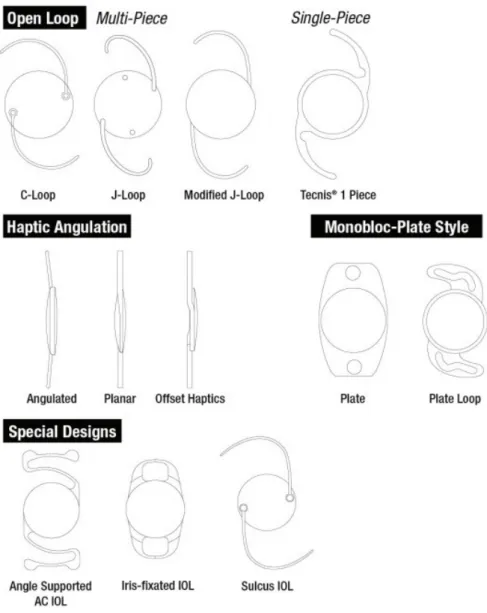
Les IOL sont majoritairement utilisés pour corriger l'aphaquie suite à une chirurgie de cataracte. Composés d'une optique centrale arrondie de diamètre de 6 mm pouvant être monofocale ou multifocale, et de pattes (haptiques) permettant son maintien et son centrage dans le sac capsulaire ou dans la chambre antérieure, de design variable
(navette, monobloc, 3 pièces).
Les premiers modèles étaient des implants de chambre antérieure (ICA) à appui angulaire, en PMMA, qui ont été pourvoyeurs de nombreuses complications (oedèmes cornéens, inflammation chronique, glaucome secondaire). Avec l'avènement de l'extraction extracapsulaire, les implants de chambre postérieure (ICP) se sont développés,avec l'apparition de matériaux souples (silicone, acrylique). Actuellement, les implants à visée réfractive (chirurgie dite « premium ») constituent un marché en plein essor : implants toriques, multifocaux (diffractifs, accomodatifs)...
Les IOL ont des propriétés physicochimiques variables :
- Température de transition vitreuse = à laquelle le matériau devient flexible (110° pour le PMMA et température ambiante pour les acryliques).
- Hydrophilie = liée à la présence de groupement (OH) et permettant d'absorber des molécules d'eau dans le réseau polymérique de l'implant. Le IOL sera ainsi plus souple en milieu aqueux (20,21)
D'autres caractéristiques ont été imaginées afin d’éviter la survenue d'une cataracte secondaire :
- Une angulation postérieure (5° à 10°) plaque l’optique contre la capsule, selon la théorie de « no space no cell » (pas d’espace pas de cellule)
- Le dessin des bords de l’optique et des haptiques doit être carré, selon la théorie de l’inhibition de contact de Nishi (22,23), le design idéal étant d’être rond devant, carré derrière et peu poli. Cette théorie est cependant contestée par certains auteurs (24).
1.3.1 - Historique
Après la chirurgie de la cataracte, l’inconfort visuel provoqué par les verres d’aphaque et les problèmes d’adaptation et de tolérance des lentilles de contact ont rendu très séduisante l’idée de corriger l’aphaquie par un cristallin artificiel.
Après la Seconde Guerre mondiale, le médecin ophtalmologiste anglais Ridley eut l’occasion d’observer, chez des pilotes de chasse ayant subi une plaie du globe par fragments de pare-brise de cockpit, l’excellente tolérance de ceux-ci par les milieux
oculaires, plusieurs années après le traumatisme. Il n’existait aucun signe d’inflammation de l’œil, ni de réaction contre le matériau qui restait parfaitement transparent. Ce matériau était le plexiglas (persplex, transpex) ou polyméthylmétacrylate-acétate (PMMA).
Le docteur Ridley eut l’idée de l’utiliser pour réaliser les premiers cristallins artificiels. C’est en novembre 1949 que fut posé le premier implant. Malheureusement, il dut être changé rapidement en raison d’une myopisation excessive due à une erreur de calcul de ses rayons de courbure. Ainsi, le premier cristallin artificiel implanté fut aussi le premier explanté…
Il faut noter que Ridley avait placé l’implant dans le sac cristallinien, position la plus naturelle, après une extraction extracapsulaire. « L’extracapsulaire moderne donne d’excellents résultats, et la capsule postérieure se comporte comme une séparation utile dans l’œil en maintenant le vitré en place, en réduisant le risque de glaucome de l’aphaque ou de décollement de rétine » (Ridley,1952).
La réalisation de cette chirurgie, difficile à l’époque, et les complications liées au poids et au dessin de l’implant, ont fait abandonner cette technique pendant plusieurs décennies. Progressivement, les techniques chirurgicales se sont modifiées, certains privilégiant l’extraction intracapsulaire avec implant de chambre antérieure, d’autres proposant la fixation de l’implant à l’iris, ou sa position dans le sulcus ou sa suture à la sclère… Parallèlement, de multiples dessins d’implants étaient imaginés dans l’espoir d’éviter les complications nombreuses rencontrées par les pionniers de la pseudophaquie (oedème de cornée, décollement de rétine, instabilité de l’implant…).
Actuellement, la technique de la phakoémulsification, l’utilisation de substances viscoélastiques et la géométrie des implants modernes ont permis de revenir à l’implantation dans le sac, idée première de Ridley.
nécessaires au calcul de la puissance de l’implant et dans le choix des formules. Les techniques de mesure et les formules les plus récentes sont à présent suffisamment fiables et performantes pour donner d’excellents résultats dans la très grande majorité des cas (7).
1.3.2 - Différents types d'implants
1.3.2.1 - PMMA (1930)
Le polyméthylmétacrylate-acétate a été le premier matériau utilisé pour la fabrication des IOL. Ce produit de référence est un dérivé polyacrylique plus connu sous le nom de « plexiglass ». Ce sont des implants rigides, transparents, amorphes avec un indice de réfraction élevé (1,49). Les propriétés de surface de ce polymère intervenant dans l’adhésion cellulaire peuvent être changées :
– soit par traitement de surface (chimique, chauffage, radiations ionisantes…), – soit par dépôt d’un polymère comme le téflon rendant la surface hydrophobe, – soit par adjonction de molécules anticoagulantes comme l’héparine.
Certaines études spécifiques menées chez l’homme et l’animal ont montré que les IOL associés à l’héparine, permettaient une réduction de l’activation du système complément, une diminution de l’adhésion cellulaire et bactérienne (Streptococcus epidermidis, Staphylococcus aureus, Pseudomonas aeruginosa) et une diminution des synéchies avec la capsule postérieure. Le principal inconvénient du PMMA est d’être rigide, ce qui oblige une large incision lors de l’acte chirurgical à l’origine d’astigmatisme résiduel postopératoire.
(Verysize® AMO, Artisan® Ophtec)
Afin de conserver le bénéfice de la petite taille de l’incision permise par la phakoémulsification, il fallait proposer la mise en place d’une lentille intraoculaire passant par le même orifice sans l’élargir. Les implants en PMMA étant trop rigides pour cela, le premier implant pliable en silicone a été proposé par Mazzocco (25) en 1984. Puis sont apparus les acryliques et les hydrogels.
1.3.2.2 - Silicone (1980)
Ces implants sont pliables, hydrophobes, possèdent d’excellentes qualités optiques et une bonne biocompatibilité. Les dernières générations sont composées de polydiméthylsiloxane, de meilleure purification chimique, d’indice de réfraction plus élevé (1,46), diminuant ainsi d’un tiers l’épaisseur de l’implant, avec adjonction de substances absorbant les UV. Comme pour le PMMA, les propriétés de surface du silicone peuvent être modifiées en vue de changer ses propriétés. Des irrégularités microscopiques ont été observées à leur surface (« molding flash »), et le silicone présenterait l’inconvénient de vieillir prématurément par la dénaturation de sa structure. Elle est caractérisée par des phénomènes de jaunissement, de calcification et d’émulsification (26).
Exemples : Implants phaques (PRL® Zeiss), Implants à clipper à l'iris (Veryflex® AMO, Artiflex® Ophtec), Implants accomodatifs (Crystalens® Bausch & Lomb)
1.3.2.3 - Acrylique (1990)
Ils sont composés de polymères et/ou copolymères réticulés d’acrylates, à contenance hydrique variable, plus ou moins perméables. Leurs propriétés physiques et mécaniques varient en fonction de leur degré de réticulation. Ils ont d’excellentes qualités optiques, et
sont flexibles. Leur indice de réfraction est très élevé, se situant entre 1,49 et 1,56 à la température corporelle. Leur surface est très fragile et on peut laisser des traces sur l'optique lors de leur manipulation.
- Hydrophobes : contenant moins de 1 % d’eau, conservés à l’état sec et stérilisés à l’oxyde d’éthylène. Leur pliage et dépliage sont dépendants de la température.
Exemples : Implants phaques (ICL® Staar), Implants de chambre postérieure
(Akreos® Bausch & Lomb, Tecnis® AMO, Acrysof® Alcon)
- Hydrophiles : contenant plus de 20% d'eau, très souples et nécessitant un conditionnement en milieu hydraté. Ils se déploient très lentement (10 min).
Exemples : Implants de chambre postérieure (Memorylens® CIBA vision, Micro+®
Physiol)
1.3.2.4 - Hydrogels
Équivalents aux acryliques hydrophiles, ils sont obtenus par réticulation de
méthylméthacrylate (MMA) et d’hydroxyéthylméthacrylate (HEMA). Le matériau le plus utilisé est ainsi le PHEMA (polyhydroxyéthylméthacrylate) qui contient 38% d'eau. Rigide en dessous de 25 °C, il devient souple au-dessus de cette température-seuil. L’implant pré-chargé peut être ainsi introduit à travers une petite incision, et se déplier progressivement à l’intérieur du sac capsulaire, à température corporelle. Son indice de réfraction augmente à 37 °C , ce qui permet également de diminuer son épaisseur. Implant très biocompatible (faible adhésion cellulaire et bactérienne, peu inflammatogène) mais qui serait plus à risque de décentrement et de PCO (27,28). Des cas de calcifications tardives ont fait retirer certains modèles du marché en 2000 (H60M Hydroview® ) (29–32).
Exemples : Implants de chambre postérieure (Hydroview® Bausch & Lomb, Memorylens® CIBA vision)
Tableau 1. Caractéristiques physico-chimiques des différents matériaux des IOL (5)
PMMA Silicone Hydrogel Acrylique
Indice de réfraction 1,49 1,41-1,46 1,41 1,55
Épaisseur pour 20D (mm)
0,73 0,87-1,40 1,10 0,82
Densité 1,19 1,03 1,16 1,16
Hydrophilie Non Non Oui Non/Oui
L’analyse des données recueillies auprès des fabricants, permet d’estimer que le marché en 2006 se répartit de la façon suivante (34) :
– Acrylique hydrophile : 40 % – Acrylique hydrophobe : 50 % – PMMA : 5 %
– Silicone : 5 %
1.3.3 - Techniques d’insertion des implants souples
- Insertion par pliage : Elle n'est plus réalisée en routine, car elle nécessitait l’agrandissement de l’incision à 3,5-4 mm. L’implant était inséré dans le sac manuellement à l'aide d'une pince adaptée.
- Insertion par injection : L’implant est placé, soit par l'opérateur, soit par le fabriquant (IOL préchargés), haptiques repliées, dans une cartouche jetable contenant un peu de viscoélastique. La cartouche est placée à l’extrémité de l’injecteur. Ce dernier est alors introduit à travers l’incision qui n’aura pas à être agrandie de façon systématique. L’implant est alors progressivement poussé dans le sac grâce au pas de vis ou au piston de l’injecteur et il se déplie progressivement dans le sac capsulaire. Ce système évite tout
contact entre l'implant et la conjonctive ou la cornée du patient. Cette technique permettrait de diminuer les risques infectieux par les germes saprophytes, ce qui n’a jamais été prouvé de manière scientifique. Les injecteurs ont évolué ces dernières années, avec apparition de modèles à usage unique (35). Certains laboratoires proposent un système « tout en un » avec implant préchargé dans une cartouche intégrée à l’injecteur (36).
1.3.4 - Complications spécifiques
1.3.4.1 - Opacification capsulaire postérieure
Sa forme la plus gênante consiste en la formation de perles d'Elschnig sur la capsule postérieure, qui font baisser l'acuité visuelle si elles atteignent l'axe visuel. Son incidence (7 à 20%) et son délai d'apparition sont extrêmement variables selon les études (3 mois à 4 ans) en raison des nombreux facteurs en cause...(7)
La prévention repose sur la réalisation d’une chirurgie la plus atraumatique possible, en évitant le contact des sondes avec l’iris, la présence de cellules inflammatoires et de sang favorisant son incidence (37).
L’implantation doit être strictement intrasacculaire, le rhexis doit être intègre. Il faut éviter particulièrement un mauvais positionnement des anses hors du sac capsulaire.
La nature du biomatériau pourrait également intervenir mais les données sont discordantes (28,38,39).
L’utilisation d’implants acryliques à bords carrés (22,40–43) avec un recouvrement de l’optique par le bord antérieur du capsulorhexis, selon la théorie du sandwich de Linnola (44) ainsi qu’un contact entre l’optique de l’implant et la capsule postérieure (grâce à une angulation postérieure de 10° environ) permettent de diminuer la migration cellulaire et
donc l’opacification de la capsule. Certains auteurs ont proposé la mise en place d’implants à haptiques circulaires, voire d’anneaux de tension capsulaires pour diminuer l’incidence de la cataracte secondaire (45).
Le traitement consiste en la réalisation d'une capsulotomie au laser Nd YAG, ou par voie chirurgicale ( vitrectomie).
1.3.4.2 - Opacification de l'implant et Glistening
Une opacification de l'ICP devra bien être différenciée à l’examen biomicroscopique d'une PCO car il sera inutile de réaliser une capsulotomie au laser YAG.
Ces phénomènes peuvent s'observer dans les heures qui suivent la chirurgie ou des années plus tard.
Plusieurs facteurs ont été identifiés :
– Par réaction avec des produits utilisés en peropératoire : dépôt de cristalline à la surface d'implants en silicone lié à l’utilisation d'un type de viscoélastique (Healon GV®) (46), interaction du colorant Bleu Trypan 0,1% utilisé pour visualiser la capsule avec des implants acryliques hydrophiles (Acqua Mediphacos®) qui en s’hydratant dans l’œil, incorporaient des pigments restants (47).
– En postopératoire précoce, des opacifications d'implants en silicone ont été largement rapportées (48–50). Quelques cas d'opacifications transitoires ont également été rapportés, avec récupération ultérieure d'une parfaite transparence du matériau, notamment à J1 avec amélioration spontanée à J2, ou durant seulement quelques heures au décours immédiat de la chirurgie (51,52) Dans ce cas, on a rattaché le phénomène à de la condensation, l'ICP ayant été conservé à 4° avant d'être introduit dans l’œil.
– En postopératoire tardif : des cas d’opacification ont été décrits dans la littérature pour de nombreux types d’implants, liées soit à des calcifications (53–56),soit à la
dégradation du matériau de l'optique (57,58), ou du filtre à ultraviolets (59), ou encore à l’adhérence de gouttelettes de silicone aux implants en silicone (60).
– Le diabète serait également un facteur favorisant (61), ainsi que la hyalopathie astéroïde (62,63).
– Des lésions survenues lors de capsulotomies au laser YAG ont été rapportées comme nécessitant un changement de l'implant, les impacts sur celui-ci étant gênants pour le patient (64).
Le « glistening » a été décrit initialement en 1996, et affecte majoritairement les ICP
acryliques hydrophobes. Ce phénomène correspond à l'apparition de micro-vacuoles d'eau (de 1 à 20 µm) au sein de toute la surface de l'optique lorsque l'ICP (ici l'Acrysof® d'Alcon) est mis en milieu aqueux à température corporelle (dans l’œil). On a réussi à reproduire cette hydratation in vitro en plongeant des implants dans du BSS à 37° pendant 48-72h (65). Les facteurs de risque identifiés sont variés : type de matériau, technique de fabrication, conditionnement et emballage, pathologie ophtalmologique sous-jacente (glaucome, rupture de la barrière hémato-aqueuse...), ou encore l'utilisation de certains collyres (66). Le principal restant le temps écoulé depuis l'implantation. Cependant, les conséquences fonctionnelles significatives restent rares (vision des contrastes, éblouissement) avec peu de cas d'explantation (67,68).
1.3.4.3 - Luxations et subluxations
Il s'agit de la dislocation d'un ICP en dehors de la chambre postérieure, d'une partie ou de la totalité de l'implant, avec le sac capsulaire ou en dehors de celui-ci : soit il existe une importante laxité zonulaire (traumatisme, PEC, myopie forte (69), rétinite pigmentaire), soit le plan capsulaire est insuffisamment solide (rupture capsulaire pendant la PKE, vitrectomie avec lésion iatrogène, cataracte mature) (70).
Le type d'implant ne serait pas un facteur de risque pour ce type de complication (71–73). La plupart des explantations (avec ou sans remplacement) d'ICP réalisées de nos jours seraient dues à des dislocations ou subluxations (74–77).
Il peut y avoir également des tableaux d'hémorragies récidivantes ou d'inflammation intraoculaire inexpliquées, dus à un mauvais positionnement d'une haptique, qui ira frotter sur un corps ciliaire ou sur la racine de l'iris. Le diagnostic peut être suspecté par un
Figure 12. Glistening sur un implant multifocal
amincissement localisé de l'iris ou une fermeture de l'angle, puis confirmé par une échographie en mode UBM. L'explantation a été nécessaire chez 40% des patients dans une étude récente (78).
La prévention de ces luxations repose sur :
– La réalisation d'un capsulorhexis intègre, de diamètre légèrement inférieur à celui de l'optique (environ 5 mm),
– En cas de laxité zonulaire, le chirurgien veillera à appliquer le moins de contraintes possible sur la zonule et le sac, et on posera éventuellement un anneau de tension afin de limiter les phénomènes de rétraction du sac survenant dans les premières semaines postopératoires,
– Si une rupture capsulaire avec plan postérieur insuffisant survient, on veillera à positionner les haptiques de l'ICP dans le sulcus, et si le plan capsulaire antérieur n’apparaît pas assez solide, on optera pour un implant clippé à l'iris ou suturé à la sclère.
1.3.4.4 - Kératopathie bulleuse du pseudophaque
Sa fréquence a considérablement diminué avec l'évolution des techniques chirurgicales : proche de 50% avec les premiers implants de chambre antérieure (ICA) à anses fermées, elle reste importante, notamment dans les pays émergents où des ICA sont encore régulièrement posés (76,79), mais est désormais < 0,1% en cas de chirurgie optimale (10,15). Elle est également à l'origine de 24% des explantations d'implants phaques mis en place à visée réfractive chez des myopes forts (80).
Un œdème cornéen va survenir dans un délai très variable, immédiatement après la chirurgie ou des dizaines d 'années plus tard. Les cellules endothéliales apparaîtront anormalement grosses et polymorphes, puis des plis de descemet se constitueront, avec
au final un épaississement cornéen puis des bulles et de la fibrose sous épithéliale.
Les facteurs de risque préopératoires sont l'existence d'une cornea guttata (dystrophie de Fuchs), ou d'une dystrophie endothélio descemétique.
Les facteurs peropératoires sont : incision cornéenne de grande taille, mouvements de chambre antérieure (aplatissement), contact (instrument, ultrasons, sang, air ou structure intraoculaire) avec l'endothélium, « burn » de l'incision par la pièce à main, décollements traumatiques de la descemet.
En postopératoire, le contact de l'implant, du vitré en cas d'aphaquie, une inflammation chronique, des synéchies antérieures vont favoriser la perte cellulaire endothéliale.
1.3.4.5 - Intolérance des implants multifocaux
Ces implants s'adressant aux presbytes, au design permettant une correction à la fois de la vision de loin et de la vision de près, connaissent une popularité croissante. Les cas d'intolérance ont donc également augmenté de façon importante, avec parfois recours à des explantations (81).
Les effets indésirables menant à cette extrémité étaient : des halos et photopsies notamment en vision nocturne, une vision floue de loin, de près ou en vision intermédiaire, une diminution de la vision des contrastes, un inconfort visuel allant jusqu’à la diplopie. Les causes pouvaient être : décentrement, anisométropie, erreur de calcul réfractif, attentes excessives du patient ou échec de neuro-adaptation (quand aucune autre cause n'était objectivée) (82).
1.3.4.6 - Erreurs réfractives
préopératoire, afin d'obtenir le résultat visuel souhaité par le patient. Le calcul repose sur une formule utilisant la kératométrie ainsi que la longueur axiale du globe oculaire.
Les méthodes de mesure de ces valeurs sont diverses et des variations peuvent survenir selon l'appareil utilisé (topographie cornéenne ou kératomètre automatique, mesure optique ou par échographie de la longueur axiale), l'examinateur (mesure de la longueur axiale en échographie mode B), les particularités anatomiques de l’œil (myopie forte, hypermétropie avec chambre antérieure très étroite) et ses modifications acquises (pathologie ou chirurgie réfractive cornéenne).
L’erreur réfractive dans le calcul de l’implant est une cause fréquente d'explantation (81). La cause le plus souvent retrouvée est l’erreur de kératométrie (23%) suivie par la mesure incorrecte de la longueur axiale(14%), et enfin par l'implantation du mauvais implant (77). L'erreur peut également venir de la chaîne de fabrication, quelques cas où la puissance affichée sur l'emballage par le laboratoire n'était pas la puissance réelle, ayant déjà été publiés (84,85).
1.3.4.7 - Post endophtalmie
L'explantation peut être nécessaire à but thérapeutique dans le cadre d'infections à germes lents, notamment fongiques tels que Candida (86,87) ou Aspergillus (88), mais également bactériens comme Propionibacterium Acnes (89).
1.4 - Techniques chirurgicales d'explantation
1.4.1 - Explantation
correspondent aux complications développées ci-dessus, en fonction de la gêne du patient.
Selon le type d'implant et la volonté de réimplantation ou non de celui-ci, ou de changement d'ICP, différentes méthodes pourront être employées :
– un ICP hydrophile souple passera par une petite incision de 2,4 mm et sera en général facile à déloger du sac capsulaire.
– un ICP acrylique hydrophobe pourra être fibrosé au sac et on devra le disséquer à l'aide de micro manipulateurs et de viscoélastique. On tentera de conserver le sac tant que possible si celui-ci s'avère réutilisable pour implantation ultérieure. L'optique devra être coupée aux 2/3 afin de permettre l'extraction de l'ICP par rotation dans l'incision (90).
– un ICP en PMMA (3 pièces ou clippé à l'iris) nécessitera une grande incision de 6 mm si on souhaite l'enlever, mais pourra éventuellement être conservé et replacé correctement le cas échéant, ou fixé à la sclère.
1.4.2 - Réimplantation
1.4.2.1 - Dans le sac
Si le sac est intact après retrait de l'ICP défectueux, ou qu'il présente une petite ouverture postérieure mais n'entravant pas la stabilité d'une réimplantation intra-sacculaire, il faut opter pour cette solution préférentiellement.
Ci-dessous, séquence chirurgicale montrant le retrait d'un ICP acrylique hydrophobe pour erreur réfractive : l'optique est coupée à l'aide de ciseaux de vannas, puis l'implant est
extrait par une incision peu élargie et un ICP 3 pièces est remis en place dans le sac, malgré l'ouverture capsulaire postérieure.
1.4.2.2 - Dans le sulcus
Si l'état du sac ne permet pas une implantation intra-sacculaire pérenne, on pourra positionner l'implant dans le sulcus (entre l'iris et le plan capsulaire antérieur), avec capture de l'optique par le rhexis antérieur pour permettre un bon centrage de celle-ci. Ci-dessous, séquence chirurgicale montrant la récupération d'un ICP 3 pièces luxé dans le
Figure 13. Explantation d'un ICP monobloc et réimplantation d'un implant 3 pièces dans le sac
vitré et réimplanté dans le sulcus.
1.4.2.3 - Clippé à l'iris
Cette technique a été initialement imaginée par Worst en 1978 (91) puis largement utilisée à visée réfractive : les implants Artisan et Verysize étaient clippés en avant de l'iris, dans la chambre antérieure, chez des patients phaques myopes ou hypermétropes (92–96).
La perte cellulaire endothéliale à long terme et le risque de cataracte précoce (97,98) limitent désormais la fixation antérieure, et on lui préfère une fixation postérieure, que ce
Figure 14. Récupération d'un implant 3 pièces luxé dans le vitré et réimplantation dans le sulcus
soit chez des patients phaques à visée réfractive ou pour corriger l'aphakie lorsqu'il n'y a pas de plan capsulaire (99,100) (après chirurgie de cataracte compliquée (101), ectopie cristallinienne de la maladie de Marfan (102,103), traumatismes (104,105) notamment chez l'enfant (106,107), uvéites (108)). La principale complication devient alors la luxation postérieure en cas de déclippage d'un ou des deux points d'ancrage .
Ci-dessous, séquence chirurgicale montrant la mise en place d'un implant artisan clippé à la face postérieure de l'iris.
1.4.2.4 - Fixé à la sclère
Si il n'y a pas de plan capsulaire et que l'iris est absent ou trop délabré, ou en cas d'ICP 3 pièces « récupérable », on peut décider de fixer l'implant à la sclère. Initialement on le suturait à l'aide de prolène 10-0, mais on a désormais plutôt tendance à simplement enfouir les haptiques à l'extérieur du globe, sous deux volets scléraux situés à 180° l'un de l'autre à 2 mm en arrière du limbe (109), avec adjonction éventuelle de colle biologique (110). Cette technique nécessite une courbe d'apprentissage de l'opérateur et est par
conséquent plus longue à réaliser que la fixation irienne (111). Elle aurait cependant l'avantage d'induire moins d'astigmatisme car l'incision peut être inférieure à 3 mm (ICP injecté plié) et ne nécessitera pas de suture cornéenne, bien qu'une étude ne retrouve pas cet avantage (112). Les complications principales sont le décentrement de l'optique et l'extériorisation des haptiques, mais les résultats visuels sont satisfaisants à moyen terme (107).
Figure 16. Récupération d'un implant 3 pièces luxé dans le vitré et fixation à la sclère par de la colle biologique
2 - Matériel et méthodes
Nous avons réalisé une étude de série rétrospective monocentrique concernant tous les patients consécutifs ayant été opérés pour retrait d'implant intra-oculaire (= explantation) de Janvier 2005 à Décembre 2014 au Centre Hospitalier National d'Ophtalmologie des Quinze-Vingts (CHNO XV XX).
Les critères d'exclusion étaient :
– retrait d'implant dans le même temps opératoire que la chirurgie de cataracte (= à la volée)
– expulsion post-traumatique de l'implant hors du globe (plaie) avant toute intervention chirurgicale
– données médicales insuffisantes (cause de l'explantation et chirurgie de réimplantation non mentionnées/accessibles)
Nous avons recueilli les données suivantes :
– caractéristiques démographiques des patients (âge, sexe)
– date d'implantation initiale (quand celle-ci était disponible), date de la chirurgie d'explantation
– cause de l'explantation – nature de l'implant retiré
– chirurgie de réimplantation éventuelle
La sélection initiale des dossiers a été effectuée grâce aux fiches de déclaration d'explantation, renseignées de manière systématique au bloc pour toute ablation de
matériel per-opératoire, et disponibles auprès de la pharmacie hospitalière du CHNO. Nous avons ensuite éliminé les fiches concernant des ablations de matériels tels que : éponges, miragel ou autre matériel d'indentation, corps étrangers intra-oculaires (CEIO), anneaux de tension capsulaire, anneaux intra-cornéens, greffons de cornée.
Puis nous avons décidé de ne pas inclure les dossiers dont les données apparaissaient comme insuffisantes (20 dossiers).
Nous avons finalement obtenu 917 dossiers correspondant aux chirurgies d'explantation d'implants intra oculaires au CHNO XV XX.
Nous avons aussi regardé l'évolution sur 10 ans des différentes causes d'explantation afin de mettre en évidence une éventuelle tendance pour l'une ou l'autre, et avons fait de même pour les techniques de réimplantation.
Quand celui-ci était disponible, nous avons relevé l'intervalle de temps (médiane) entre implantation et explantation.
Le taux d'explantation, correspondant au rapport du nombre d'explantations des 3 années suivant la date d'implantation considérée, sur le nombre de PKE au CHNO XV XX cette année là, a été calculé pour l'année 2010 (= nombre d'explantations en 2010/2011/2012 divisé par nombre de PKE en 2010).
3 - Résultats
3.1 - Données démographiques
Nous avons inclus 918 patients. Le sexe-ratio était de 1,2 hommes pour 1 femme. L'âge moyen des patients lors de la chirurgie d'explantation était de 65,3 ans (10 – 95 ans).
L'âge moyen ainsi que le sexe ratio des patients sont restés comparables tout au long des 10 années de l'étude.
3.2 - Délai entre implantation et explantation
Le délai entre la chirurgie initiale de cataracte et la chirurgie d'explantation était de 32,1 mois, soit 2 ans et demi (médiane), avec un minimum de 1 jour et un maximum de 35 ans. Il n'était pas connu dans 45,3% des cas.
Entre 2005 et 2014, on ne retrouve pas de tendance significative dans l'évolution de ces délais.
Le taux d'explantation pour l'année 2010 était de 3,27%.
Tableau 2. Caractéristiques démographiques et délai médian entre implantation et explantation
Age 65,3 ans
Sexe ratio (H/F) 1,2
3.3 - Causes des explantations
Les causes d'explantation étaient largement dominées par les luxations d'implants (59%), puis venaient les décompensations endothéliales (19%), les implants phaques mal tolérés (6%), les erreurs de calcul de puissance (5%), les opacifications d'implants (4%), les implants multifocaux non supportés (3%) et les endophtalmies (1%). Dans 3% des cas, aucune cause n'a été retrouvée dans le dossier médical.
59% 19% 6% 5% 4% 3% 1% 3%
Figure 17. Causes des explantations de 2005 à 2014
luxation décompensation endothéliale implant phaque erreur de calcul
opacification implant multifocal endophtalmie cause inconnue
Concernant les 502 patients dont on connaissait le délai entre la chirurgie initiale et la chirurgie d'explantation :
- 181 explantations (17,9%) survenaient entre 0 et 3 mois après la chirurgie initiale. On retrouvait des luxations à 68% et des erreurs de calcul à 14,9%. Les décompensations endothéliales étaient en cause dans seulement 5% des cas, avec 77% d'ICA. Les implants multifocaux représentaient 3,9% de ces explantations précoces, et les implants phaques 1%. Les endophtalmies étaient en cause dans 1% des cas.
71% 16% 5% 4% 1% 2% 1% 1%
Figure 18. Causes des explantations survenues entre M 0 et M 3
Luxations erreurs de calcul
décompensation endothéliale implants multifocaux
endophtalmie opacification
- 48 explantations (5,2%) survenaient entre 3 et 12 mois après la chirurgie initiale. On retrouvait des luxations à 56,3% et des erreurs de calcul à 14,6%. Les décompensations endothéliales étaient en cause dans 8,3% des cas. Les opacifications représentaient également 8,3% des causes d'explantation, les implants phaques 6,3% et les implants multifocaux 2,1%. Des retraits d'implant étaient pratiqués à 4,2% pour des endophtalmies.
56% 15% 8% 8% 6% 4% 2%
Figure 19. Causes des explantations survenues entre M 3 et M 12
luxation erreur de calcul
opacification décompensation endothéliale implant phaque endophtalmie
- 273 explantations (29,7%) survenaient plus d'un an après la chirurgie initiale. On retrouvait des luxations à 52,7%, puis des décompensations endothéliales à 24,9%. Les implants phaques représentaient 9,2% des causes d'explantation, les opacifications 7% et les implants multifocaux 2,6%. On retrouvait des retraits d'implant pour erreur de calcul dans 2,2% des cas et 1,5% pour des endophtalmies.
53% 25% 9% 7% 3% 2% 1%
Figure 20. Causes des explantations survenues à plus d'un an
luxation décompensation endothéliale implant phaque opacification
implant multifocal erreur de calcul endophtalmie
3.3.1 - Luxations (59%)
Les luxations représentaient la cause la plus fréquente d'explantation quel que soit le délai séparant la chirurgie initiale de la chirurgie d'explantation. Celles-ci étaient d'autant plus nombreuses que le retrait de l'implant survenait précocement.
A l'aide des données en notre possession, nous avons regardé le détail des luxations : la majorité étaient des luxations dans le vitré, en dehors du sac capsulaire, survenant suite à des ruptures capsulaires. Puis venaient les luxations en postérieur avec désinsertion du sac (problème de zonule), et enfin les décentrements où l'implant restait dans le sac au niveau de la chambre postérieure mais ne permettait plus au patient une vision de qualité suffisante (fibrose du sac, mauvais positionnement des haptiques).
Entre 2005 et 2014, le nombre de luxations ayant mené à une explantation reste stable.
2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 0 10 20 30 40 50 60 70
3.3.2 - Décompensations endothéliales (19%)
Les décompensations endothéliales étaient à l'origine d'un quart des explantations réalisées plus d'un an après la chirurgie initiale. On dénombre tout de même 5 à 8% d'implants retirés suite à une intolérance cornéenne durant la première année, majoritairement dans des cas d'implantation en chambre antérieure. Seulement 5% de ces complications cornéennes survenaient avec des ICP, tout le reste concernant des ICA. Le délai médian entre implantation et explantation était de 10,5 ans.
Entre 2005 et 2014 se dégage une tendance à la diminution de cette étiologie.
2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 0 5 10 15 20 25
Figure 22. Evolution en % des décompensations
endothéliales de 2005 à 2014
3.3.3 - Implants phaques mal tolérés (6%)
Les implants phaques étaient retirés majoritairement pour cause de cataracte capsulaire antérieure se développant en arrière de l'implant (65%). L'âge moyen des patients concernés était de 47 ans (26 à 64 ans). Ces changements d'implants étaient accompagnés dans au moins 75% des cas d'une implantation en chambre postérieure après phakoexérèse, cette chirurgie survenant en moyenne 6 ans après la chirurgie initiale.
Aucune réelle tendance évolutive ne se dégage sur les 10 années de l'étude, malgré les modifications de design et de technicité des implants phaques utilisés.
2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 0 1 2 3 4 5 6 7 8 9 10
Figure 23. Evolution en % des complications
liées aux implants phaques de 2005 à 2014
3.3.4 - Erreurs de calcul (5%)
Les erreurs de calcul d'implant étaient en cause dans 15% des cas pendant la première année, puis seulement dans 2% des cas. Le délai médian était de 5 mois.
Dans cette étude, il y a moins d 'erreurs de calcul menant au retrait de l'implant à partir de 2008. Ceci pourrait être en rapport avec une évolution des mentalités, la précision du résultat réfractif étant de plus en plus importante dans la prise en charge, même standard, de la cataracte. 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 0 2 4 6 8 10 12
3.3.5 - Opacification de l'implant (4%)
Les implants concernés étaient dans 9 cas sur 26 des HM60 Hydroview® de Bausch et Lomb, et la majorité des autres étaient aussi des acryliques hydrophiles (ou hydrogels). Un implant en silicone accommodatif était en cause ici, ainsi que 3 implants acryliques hydrophobes. Dans quelques cas la référence de l'implant n'était pas précisée, et le matériau ne pouvait par conséquent pas être connu. Le délai médian était de 56 mois (4,6 ans).
Il semblerait qu'il y ait de moins en moins de cas d'implant retiré pour cause d'opacification au cours de la dernière décennie.
2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 0 1 2 3 4 5 6 7 8
Figure 25. Evolution en % des opacifications
d'implant de 2005 à 2014
3.3.6 - Implants multifocaux mal tolérés (3%)
Les implants multifocaux étaient incriminés dans 2 à 4% des explantations, que ce soit précocement après la chirurgie d'implantation ou à plus de un an, avec un délai maximal de 7 ans (photophobie permanente invalidante) et médian de 5 mois. L'âge moyen des patients concernés était de 58 ans (37 à 83 ans). Une réimplantation dans le sac était réalisée dans 60% des cas.
On observe une augmentation ponctuelle des problèmes liés à ce type d'implant en 2011 et en 2014. 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 0 1 2 3 4 5 6 7
Figure 26. Evolution en % des complications
des implants multifocaux de 2005 à 2014
3.3.7 - Endophtalmies (1%)
Les implants retirés dans le cadre d'une infection intraoculaire post-opératoire pouvaient l'être entre M0 et M3 en cas d'endophtalmie compliquée (décollement de rétine), ou plus tardivement pour les infections à germes lents ou les inflammations chroniques.
Ces cas restaient rares tout au long de la période observée.
2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 0 0,5 1 1,5 2 2,5 3 3,5
3.4 - Chirurgie de réimplantation
La chirurgie de réimplantation consistait à remettre un implant dans la chambre postérieure dans 48% des cas (14% ICP dans le sac, 12% ICP dans le sulcus et 22% Artisan clippé en arrière de l'iris). Un ICA était utilisé dans 15,8% des cas. Le patient était laissé aphaque dans 20% des cas. Seulement 0,8% des patients ont bénéficié d'un ICP fixé à la sclère. La technique utilisée était inconnue dans 15% des dossiers.
14% 12% 22% 1% 16% 20% 15%
Figure 28. Chirurgies de réimplantation
ICP dans le sac ICP dans le sulcus Artisan postérieur
ICP suturé/collé à la sclère ICA Aphaque
3.4.1 - Implantation en chambre postérieure (48%)
On constate une nette augmentation du nombre d'artisans clippés en postérieur de l'iris (de 4,3% à 38,8%). De même pour les implants suturés à la sclère. Les implantations dans le sac ou dans le sulcus restaient quant à elles stables.
2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 0 10 20 30 40 50 60
Figure 29. Evolution des implantations en chambre postérieures
de 2005 à 2014
ICP dans le sac ICP dans le sulcus
3.4.2 - Implantation en chambre antérieure (16%)
Parallèlement à l'augmentation des implantations d'artisans clippés en postérieur, on observe une diminution drastique (de 30,4% à 0,9%) des implantations secondaires d'ICA de 2005 à 2014. 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 0 5 10 15 20 25 30 35
3.4.3 - Aphaquie : pas d'implantation (20%)
Il y avait plutôt moins de patients laissés aphaques entre 2010 et 2014 qu'entre 2005 et 2010, mais il n'y a pas de réelle tendance qui se dégage.
2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 0 5 10 15 20 25 30 35
Figure 31. Evolution du nombre de patients laissés aphaques
après explantation entre 2005 et 2014
4 - Discussion
Au début des années 1990, la majorité des explantations concernait des ICA ayant entraîné décompensation endothéliale cornéenne ou syndrome uvéite-glaucome-hyphéma (UGH) (75,115).
Puis, la chirurgie de la cataracte a beaucoup évolué avec l'avènement de la PKE : diminution de l'utilisation des ICA au profit des ICP, réalisation d'incisions toujours plus petites, modernisation des méthodes d'implantation...Les causes d'explantation ont donc elles aussi changé et seraient dominées dès 1998 par les erreurs de calcul d'implant et les luxations ou décentrements (115).
Une étude récente a cherché à identifier les raisons de ces explantations en Europe (plus précisément en Espagne) entre 2004 et 2010 (74) : les auteurs retrouvent à nouveau les luxations d'implant comme cause principale (56%), puis les erreurs de calcul d'implant (13%). Leurs résultats sont en accord avec les données de Mamalis et coll (73).
Notre effectif de cohorte est beaucoup plus important que celui de Fernandez et coll (918 patients sur 10 ans contre 257 patients sur 7 ans). Nous avons étudié en moyenne 90 patients par an. Ce chiffre est très important, le CHNO des XV XX étant un centre de référence à Paris, proposant un service d'urgences 24h/24h. De ce fait, plus de 50% des patients de l'étude avaient initialement été opérés de cataracte dans un autre établissement, et étaient adressés ou consultaient pour prise en charge chirurgicale spécialisée d'une complication liée à leur implant intraoculaire. Ceci explique le manque de données pour certains dossiers, le patient n'ayant pas toujours souvenir de son intervention initiale, ni la carte contenant les références de l'implant mis en place à cette époque...
Nous avons exclu relativement peu de dossiers pour données insuffisantes (20), car nous n'avons pas imposé de durée de suivi minimum, le but de l'étude n'étant pas de rendre compte des résultats de la procédure chirurgicale mais bien d'analyser les causes et les solutions proposées aux complications des implants intraoculaires.
Concernant les données démographiques, âge et sexe-ratio sont similaires à ceux de la littérature. Une différence notable réside cependant dans le groupe des implants multifocaux mal tolérés (« neuroadaptation failure » dans l'étude de Fernandez et coll) : nos patients sont plus jeunes (58 versus 67 ans). Ceci est également le cas dans une autre étude sur les retraits d'implants multifocaux au Japon (82) avec un âge moyen de 65 ans. La prudence au CHNO XV XX explique probablement l'exclusion des patients âgés et ayant d'autres comorbidités oculaires. Ceci expliquerait aussi le faible taux d'explantation d'implants multifocaux dans notre série.
Le taux d'explantation que nous avons calculé pour l'année 2010 est plus élevé que celui retrouvé dans la littérature (0,03 à 0,77%). L'activité chirurgicale d'urgence est en effet très importante au CHNO XV XX, et le grand nombre de patients adressés via d'autres structures doit en être à l'origine. De même, l'activité « cataracte » ne représente que 52,9% de l'activité globale du centre, ce qui doit être bien en deçà de ce que l'on peut constater ailleurs.
Le délai médian entre la première implantation et le retrait de la lentille intraoculaire est de 2,2 ans : celui-ci est court par rapport aux études récentes (entre 4 et 6 ans (76,77,116)), On retrouve des délais brefs de respectivement 2 et 5 mois pour les erreurs de calcul et
les multifocaux mal tolérés, alors que l'étude espagnole retrouve quant à elle 5 et 13 mois. Quand un implant multifocal est mal toléré, on considère que cela ne s’améliorera pas avec le temps et il est plus aisé de procéder à un échange précoce que tardif. En revanche, les opacifications d'implant surviennent tardivement (4,6 ans), ce qui est conforme aux données de la littérature (53).
Les luxations représentent la cause principale d'explantation (59%) quel que soit le délai étudié, comme dans les rapports de Mamalis et coll (71–73). Le type d'ICP en cause n'a pas été étudié ici, mais nous avons relevé que la majorité de ces luxations se faisaient en dehors du sac, en postérieur, dans le vitré. Une rupture capsulaire lors de la chirurgie initiale ou une désinsertion zonulaire (traumatique, sur œil pathologique fort myope ou PEC) était souvent identifiée comme à l'origine de la dislocation de l'implant. Dans le cas des problèmes de zonule, il était fréquent de retrouver l'implant entouré de son sac reposant dans le fond du segment postérieur. Une étude récente a spécifiquement étudié ce type de luxation et a retrouvé la myopie forte comme facteur de risque principal (69). L'autre catégorie de cette grande cause d'explantation est le décentrement de l'implant à l'intérieur même du sac capsulaire : une fibrose du sac ou un phimosis capsulaire, un problème d'haptiques, une capture irienne étaient parfois retrouvés. Ces mécanismes sont ceux décrits dans la littérature (70). Quelques luxations concernent des artisans clippés à l'iris (1,6%) dont un ou les deux points d'ancrage s'étaient décrochés. Cela reste une complication assez rare pour les implants à fixation irienne : plusieurs articles récents retrouvent un taux de luxation allant de 0 à 8% (99,117,118).
Nous constatons dans notre population un grand nombre d'explantations pour