© Mikaël Gagnon, 2019
Impact de l'avancée des arbustes sur les stocks de
carbone des sols d’Umiujaq, Nunavik.
Mémoire
Mikaël Gagnon
Maîtrise en chimie - avec mémoire
Maître ès sciences (M. Sc.)
Impact de l’avancée des arbustes sur les stocks de
carbone des sols d’Umiujaq, Nunavik.
Mémoire
Mikael Gagnon
Sous la direction de :
iii
Résumé
La respiration microbienne du carbone ancien stocké dans le pergélisol représente une rétroaction positive au réchauffement climatique. Toutefois, l’avancée récente des arbustes dans l’Arctique pourrait en partie compenser ces émissions, compte tenu de leur biomasse supérieure à celle de la végétation de la toundra et à la litière qui s’accumule. Il est cependant difficile de quantifier ce puits de carbone puisque la minéralisation concomitante du carbone ancien rend l’attribution des changements de la teneur en carbone des sols incertaine. Dans cette étude, la contribution des arbustes au réservoir de carbone terrestre est quantifiée dans un site au Nunavik, pour lequel les teneurs en carbone ancien des sols sont parmi les plus faibles de la région Arctique. Nous rapportons que l’avancée des arbustes Betula gladulosa Michx. dans la toundra lichénique augmente les stocks de carbone terrestre de 3.9 ± 1.3 kg m-2. Dans les milieux plus humides, les arbustes
massifs et le remplacement des lichens par des mousses ont induit un gain de 6.6 ± 3.6 kg m-2 de carbone. Le
puits de carbone issu de l’avancée des arbustes dans la région d’étude de 1994 à 2010 est estimé à 2.4 ± 0.8 Gg.
Des études par pyrolyse couplée à la chromatographie en phase gazeuse-spectrométrie de masse (pyGCMS) démontrent que l’avancée des arbustes modifie la nature chimique du réservoir de carbone des sols. Deux biomarqueurs potentiels ont ensuite été étudiés par pyGCMS, l’acide usnique et l’acide bétulinique, dans le but de développer une méthode pour comparer la labilité de la MO des sols de la toundra de lichens à celle de la toundra arbustive de la région.
Notre étude sur l’avancée des arbustes à Umiujaq indique que ce processus peut constituer un puits de carbone. Son intensité à l'échelle de l'Arctique mérite donc des études supplémentaires, mais les données obtenues sur un seul site ne peuvent pas être extrapolées à l'ensemble de l'Arctique pour évaluer si ce puits est susceptible de compenser les émissions de carbone ancien liées au dégel du pergélisol.
iv
Abstract
The microbial respiration of ancient carbon stored in permafrost represents a positive feedback to climate warming. However, the recent expansion of shrubs in circumpolar latitudes may partly compensate for this carbon release, due to greater biomass and litter inputs than that of tundra vegetation. Quantifying this carbon sink is challenging, as the concomitant mineralization of ancient carbon often renders the attribution of changes in soil carbon stocks uncertain. Here, we measure the contribution of shrubs to the terrestrial carbon reservoir in a Low-Arctic tundra site in Nunavik where soil ancient carbon stocks are among the lowest in the Arctic. We find that the emergence of Betula glandulosa Michx. shrubs increased the terrestrial carbon stocks by 3.9 ± 1.3 kg m-2. Further increases in carbon were mostly found along water tracks, where the more
massive shrubs and the replacement of the lichen understory by mosses resulted in an addition of 6.6 ± 3.6 kg m-2 of carbon. From 1994 to 2010, we estimate the carbon sink provided by shrub expansion in our
study area to be of 2.4 ± 0.8 Gg.
The analysis of soil organic matter (SOM) using pyrolysis-gas chromatography-mass spectrometry (pyGCMS) revealed that this recent shrub expansion has modified the chemical nature of the soil organic carbon (SOC) reservoir. Lastly, two potential biomarkers for shrub and lichen biomass, betulinic acid and usnic acid, were studied using pyGCMS in hopes of developing a method to compare the lability of the various soil carbon pools of the region.
This natural case study in Umiujaq shows that shrub expansion represents a carbon sink. However, further studies throughout the Arctic are needed to evaluate the significance of this sink with respect to permafrost ancient carbon emissions, as the result of one local study cannot be extrapolated to the entire Arctic.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... ix
Liste des abréviations ... xiii
Remerciements ... xiv Avant-propos ... xv Introduction ... 1 Le réchauffement climatique ... 1 Le Quaternaire ... 1 L’effet de serre ... 2 Le Cycle de carbone ... 2
Le cycle de carbone planétaire ... 2
Cycle de carbone de la surface de la terre ... 5
Les sols ... 6
La phase minérale ... 6
Les phases aqueuses et gazeuses ... 8
La phase organique ... 9
Les horizons de sols ... 12
Activité microbienne des sols ... 13
L’Arctique ... 17
Le Pergélisol ... 17
L’avancée de la végétation arbustive ... 21
Objectifs ... 22
Chapitre 1. Article scientifique ... 23
1.1 Résumé ... 23
1.2 Shrub growth on Arctic tundra triggers a significant carbon sink: evidence from a site in eastern Canada ... 24
Abstract ... 25
Introduction ... 26
Materials and Methods ... 27
Results ... 30
Discussion ... 34
Acknowledgements ... 36
vi
Supporting information ... 40
Chapitre 2. Étude des composés carbonés par pyrolyse flash couplée à la chromatographie en phase gazeuse et à la spectrométrie de masse (pyGCMS) ... 44
2.1 Introduction ... 44 2.1.1 Problématique ... 44 2.1.2 Théorie ... 44 2.1.3 Objectifs, partie 1 ... 47 2.1.4 Objectifs, partie 2 ... 47 2.2 Méthodes ... 48 2.2.1 Échantillonnage ... 48
2.2.2 Protocole : Analyses d’azote ... 50
2.2.3 Protocole TMAH-pyGCMS ... 51
2.3 Résultats partie 1: Nature des composés carbonés de la vallée Tasiapik (sol et végétation). ... 52
2.3.1 L’ajout du TMAH ... 52
2.3.2 : Inventaires moléculaires du lichen et du bouleau (végétation) ... 53
2.3.3 Inventaire moléculaire des sols ... 62
2.4 Discussion partie 1 : Nature des composés carbonés de la vallée Tasiapik (sol et végétation) ... 63
2.5 Résultats Partie 2 : Biomarqueurs ... 65
2.5.1 Biomarqueur du lichen ... 65
2.5.2 Biomarqueur de Betula glandulosa ... 67
2.6 Discussion partie 2: Biomarqueurs ... 70
2.7 Conclusion ... 72
Conclusion finale et perspectives ... 73
Bibliographie ... 75
vii
Liste des tableaux
Tableau I.1 – Les principaux ions des sols. ... 9 Tableau I.2 – Horizons du sol (simplifié). Les profondeurs des horizons peuvent grandement varier. ... 12 Table S1 – Chemical characterization of soil horizon Bm. Iron and aluminum pyrophosphate-extractable content (mass fraction) and soil pH measured in a 0.01 M CaCl2 solution with a soil to water mass fraction of
1:2 are reported. ... 40 Table S2 – Detailed carbon data for the 16 plots studied in the upper Tasiapik Valley in September 2017. .... 41 Table S3 – Detailed dendrochronological data for the 16 plots studied in the upper Tasiapik Valley in
September 2017. ... 42 Tableau 2.1 – Description des échantillons analysés en pyGCMS. (Site L = couvert de lichens, site BL = bouleaux + lichens, site BM = bouleaux + mousses). Les échantillons de sol en profondeur sont seulement utilisés pour l’étude de biomarqueurs (Section 2.5). ... 50 Tableau 2.2 – Identification des majeurs composés du chromatogramme TMAH-pyGCMS d’un échantillon de lichens (Cladonia stellaris). Le pic de base représente pic le plus intense du spectre de masse. Certains composés et fragments peu caractéristiques pouvant avoir plusieurs origines n’ont pas d’attribution. ... 55 Tableau 2.3 – Identification des majeurs composés du chromatogramme TMAH-pyGCMS d’une brindille de bouleau glanduleux. Le pic de base représente pic le plus intense du spectre de masse. Les composés et/ou fragments peu caractéristiques qui peuvent provenir de plusieurs familles de structures n’ont pas d’attribution. ... 57 Tableau A1 – Identification des pics majeurs du chromatogramme TMAH-pyGCMS d’un échantillon de feuilles de bouleau glanduleux. Le pic de base représente pic le plus intense du spectre de masse. Les composés et/ou fragments peu caractéristiques qui peuvent provenir de plusieurs familles de structures n’ont pas d’attribution. ... 84 Tableau A2 – Identification des pics majeurs du chromatogramme TMAH-pyGCMS d’un échantillon de bourgeons de bouleau glanduleux. Le pic de base représente pic le plus intense du spectre de masse. Les composés et/ou fragments peu caractéristiques qui peuvent provenir de plusieurs familles de structures n’ont pas d’attribution. ... 86 Tableau A2 (suite) – Identification des pics majeurs du chromatogramme TMAH-pyGCMS d’un échantillon de bourgeons de bouleau glanduleux. Le pic de base représente pic le plus intense du spectre de masse. Les composés et/ou fragments peu caractéristiques qui peuvent provenir de plusieurs familles de structures n’ont pas d’attribution. ... 87 Tableau A3 – Identification des pics majeurs du chromatogramme TMAH-pyGCMS d’un échantillon de racines de bouleau glanduleux. Le pic de base représente pic le plus intense du spectre de masse. Les composés et/ou fragments peu caractéristiques qui peuvent provenir de plusieurs familles de structures n’ont pas d’attribution. ... 89 Tableau A4 – Identification des pics majeurs du chromatogramme TMAH-pyGCMS d’un échantillon d’herbes (végétation secondaire des sites L (lichens) et BL (bouleaux + lichens). Le pic de base représente pic le plus intense du spectre de masse. Les composés et/ou fragments peu caractéristiques qui peuvent provenir de plusieurs familles de structures n’ont pas d’attribution. ... 91 Tableau A5 – Identification des pics majeurs du chromatogramme TMAH-pyGCMS d’un échantillon de mousses (végétation secondaire du site BM (bouleaux + mousses). Le pic de base représente pic le plus intense du spectre de masse. Les composés et/ou fragments peu caractéristiques qui peuvent provenir de plusieurs familles de structures n’ont pas d’attribution. ... 93
viii
Tableau A6 – Identification des pics majeurs du chromatogramme TMAH-pyGCMS d’un échantillon de sol d’une profondeur de 0 à 5 cm du site L (couvert végétal = lichens). Le pic de base représente pic le plus intense du spectre de masse. Les composés et/ou fragments peu caractéristiques qui peuvent provenir de plusieurs familles de structures n’ont pas d’attribution. ... 95 Tableau A7 – Identification des pics majeurs du chromatogramme TMAH-pyGCMS d’un échantillon de sol d’une profondeur de 0 à 5 cm du site BL (couvert végétal = bouleaux + lichens). Le pic de base représente pic le plus intense du spectre de masse. Les composés et/ou fragments peu caractéristiques qui peuvent
provenir de plusieurs familles de structures n’ont pas d’attribution. ... 97 Tableau A8 – Identification des pics majeurs du chromatogramme TMAH-pyGCMS d’un échantillon de sol d’une profondeur de 0 à 5 cm du site BM (couvert végétal = bouleaux + mousses). Le pic de base représente pic le plus intense du spectre de masse. Les composés et/ou fragments peu caractéristiques qui peuvent provenir de plusieurs familles de structures n’ont pas d’attribution. ... 99 Tableau A8 (suite) – Identification des pics majeurs du chromatogramme TMAH-pyGCMS d’un échantillon de sol d’une profondeur de 0 à 5 cm du site BM (couvert végétal = bouleaux + mousses). Le pic de base
représente pic le plus intense du spectre de masse. Les composés et/ou fragments peu caractéristiques qui peuvent provenir de plusieurs familles de structures n’ont pas d’attribution. ... 100
ix
Liste des figures
Figure I.1 – Variation de la température en Antarctique. Modifiée de Luthi et al. (2008). ... 1 Figure I.2 – Schéma simplifié du cycle de carbone (IPCC, 2013) qui indique la taille (Pg) et les flux (Pg · année-1) des réservoirs de carbone. Les chiffres noirs représentent les estimations d’avant l’ère industrielle,
tandis que les chiffres rouges indiquent les changements actuels. ... 4 Figure I.3 – Cycle de carbone terrestre simplifié. *La respiration cellulaire les sols peut également produire du méthane ainsi que plusieurs composés inorganiques autres que le CO2. ... 5 Figure I.4 – Classification granulométrique de la phase minérale d’un sol. La taille des grains est exprimée en fonction du diamètre. ... 7 Figure I.5 – Formation de charges permanentes dans la muscovite lors de substitutions isomorphiques. Les triangles et les diamants représentent des conformations tétrahédriques et octahédriques, respectivement. ... 8 Figure I.6 – Structure de la cellulose (Xiros et al., 2013). Les lignes pointillés représentent les liaisons-H. .... 10 Figure I.7 – Les trois unités de base de la lignine ainsi que leurs principales occurrences dans la nature. ... 10 Figure I.8 – Structure de la chlorophylle ... 11 Figure I.9 – Divers composés azotés, phosphorés et sulfurés retrouvés dans le sol : a) l’unité guanine d’un brin d’ADN b) la structure de base des acides aminés c) cystéine, un acide aminé sulfuré d) un phospholipide (C12) ... 12 Figure I.10 – L’échelle rédox présente les différents accepteurs d’électrons, ainsi que leurs formes réduites, qui peuvent être utilisés pour effectuer la respiration cellulaire. Les valeurs indiquées de potentiel rédox (EH)
représentent celles d’un sol à pH ≈ 7. Plusieurs types d’accepteurs d’électrons peuvent être observés dans le même milieu. ... 13 Figure I.11 – Le modèle du continuum des sols de Lehmann et Kleber (2015) décrit le processus de
dégradation de la matière organique des sols ainsi que ses mécanismes de stabilisation qui influencent son temps de résidence. Les flèches continues et pointillées représentent des transferts biotiques et abiotiques, respectivement. Les flèches plus larges représentent des processus rapides. La largeur des encadrés
représente la taille des stocks de carbone. ... 16 Figure I.12 – Stratigraphie du pergélisol : la couche active et le pergélisol. ... 17 Figure I.13 – Classification de la distribution du pergélisol, adaptée de French (2013). Les flèches pointillées représentent le mouvement de l’eau dans le sol. a) Des mares de thermokarst formées lors du dégel du pergélisol b) une mare de thermokarst asséchée. ... 18 Figure I.14 – Pergélisol discontinu près d’Umiujaq, au Nunavik. a) Buttes de pergélisol b) mare de thermokarst c) mare de thermokarst asséché. ... 18 Figure I.15 – a) Tourbe fibreuse enfouie dans le pergélisol syngénétique de l’île Bylot, Canada. b) localisation de l’horizon tourbeux à la frontière du pergélisol et de la couche active. ... 19 Figure I.16 – Dégel du pergélisol continu dans le Haut-Arctique canadien (Île Bylot, juillet 2018)... 20 Figure I.17 – Boucle de rétroaction positive du dégel du pergélisol envers le réchauffement climatique. ... 21 Figure I.18 – Boucle de rétroaction de négative envers le réchauffement climatique due à la croissance des arbustes dans l’Arctique. ... 22 Figure 1.1 – Location of the study area. (a) Map of the Tasiapik Valley region, modified from (NRCAN, 2016). (b) Illustration of the recent expansion of dwarf birch throughout the lichen tundra of the upper Tasiapik Valley, Nunavik. (c) Extent of the upper valley region studied (red), along with the main water tracks (blue). Thaw ponds can be seen further down in the valley, followed by forest-tundra with black spruce (Picea mariana) trees (Payette, 1983). The yellow star shows the location from where photograph (b) was taken. Image (c) was
x
taken in October 2017, when the dwarf birch had lost most of its foliar biomass. As a result, only the largest
shrub canopies of the upper valley can be seen, revealing the main water tracks. ... 28
Figure 1.2 – Three types of vegetation covers selected in the upper Tasiapik Valley. (a) Lichen tundra, (c) Medium shrub tundra (e) High shrub tundra. On the second row, their respective soil profiles (b, d, and f) are shown in the same order. The horizontal lines on images b, d, and f are at the 10 cm depth. ... 31
Figure 1.3 – Average soil organic carbon content according to the type of vegetation cover: Lichen tundra (n = 3), Medium shrub tundra (n = 8) and High shrub tundra (n = 5). Compared to the lichen tundra, both shrub tundra types have slightly greater SOC contents at depths (10 – 30 cm). The inserted graph shows a blown up view of SOC content from a depth of 10 cm. Error bars represent standard deviations. The colored bars are overlain and all start at 0 % carbon. ... 31
Figure 1.4 – Variation of the terrestrial carbon stocks in the upper valley. Plots are classified by their type of vegetation cover. The terrestrial carbon stocks are comprised of the following compartments: the soil (including the layer of decomposing vegetal matter), the understory (lichen and green moss tissue) and the dwarf birch shrubs (including their root biomass). The blue columns represent the average snow depth, recorded in April 2018. ... 33
Figure 1.5 – Plot of the terrestrial carbon stocks of the medium shrub tundra in the upper valley (kg m-2) as a function of the age of the oldest shrub sampled in the plot. In comparison, the lichen tundra holds an average terrestrial carbon stock of 2.2 ± 0.4 kg m-2 (Figure 1.1). ... 34
Figure S1 – A typical example of the granulometric distribution of the soils found in the upper Tasiapik Valley. (a) the surface of the A horizon from a depth of 0 to 5 cm; (b) the surface of the B horizon at a depth of 25 to 30 cm. ... 43
Figure 2.1 – Parcours des ions dans le quadrupôle. Modifiée de Skoog et al. (2007). ... 45
Figure 2.2 – Mécanisme de méthylation par TMAH ... 46
Figure 2.3 – Saponification de la matière organique suivie d’une méthylation au TMAH. ... 47
Figure 2.4 – Exemple fictif : Abondances relatives des biomarqueurs X et Y à diverses profondeurs dans un sol. ... 48
Figure 2.5 – Provenance des échantillons analysés en pyGCMS. Site L = tapis de lichens, site BL = couvert de bouleaux avec un tapis de lichens, site BM = couvert de bouleaux avec des mousses en surface. Les profils de sol sont présentés à droite. Les encadrés bleus indiquent la zone d’échantillonnage de 0 à 5 cm et de 25 à 30 cm de profondeur. Les horizons A et B sont délimités par les traits orange. ... 49
Figure 2.6 – Composantes du pyGCMS. a) Canne chauffante avec un tube vide b) composantes du py-GCMS : (1) canne chauffante (2) pyrolyseur (3) colonne chromotagraphique (GC) (4) spectromètre de masse (MS). ... 51
Figure 2.7 – Chromatrogrammes pyGCMS d’un échantillon de lichen a) sans TMAH et b) en utilisant le TMAH lors de la pyrolyse. ... 52
Figure 2.8 – Chromatogramme TMAH-pyGCMS d’un échantillon de lichens (Cladonia stellaris). Certains pics peuvent contenir plus d’un composé. ... 54
Figure 2.9 – Chromatogramme TMAH-pyGCMS d’une brindille de bouleau glanduleux. Certains pics peuvent contenir plus d’un composé. ... 56
Figure 2.10 – Formation d’acides sacchariniques permétylés à partir du glucose (Fabbri and Helleur, 1999). 58 Figure 2.11 – Signatures spectrales des composés 27 et 28 de l’échantillon de lichen analysé en pyGCMS. Les ions caractéristiques des sucres sont encadrés. ... 59
xi
Figure 2.13 – Métabolites secondaires issus de Cladonia stellaris. a) acide usnique b) acide perlatolique c) atranorine d) acide protocétrarique e) acide pulvinique f) diorcinol H g) rhodomyrtoxine B h) acide
furfuracéique. Le code de couleur indique la source bibliographique : bleu (Polovinka et al., 2012), rouge
(Fernandez-Moriano et al., 2016), vert (Millot et al., 2016). ... 60
Figure 2.14 – Acide hexadécanoïque, méthyle ester ... 61
Figure 2.15 – Identification de l’acide hexadécanoïque, méthyl ester dans de lichen. Les spectres de masse rouges et bleus représentent les spectres expérimentaux et théoriques, respectivement. ... 61
Figure 2.16 – Abondance relative des familles de composés organiques retrouvées dans les sols (0 -5 cm) de la vallée en relation au type de couvert végétal (L = lichens, BL = bouleaux + lichens, BM = bouleaux + mousses). Les dérivés ligneux représentent la somme des unités H (hydroxyphényle), G (guaïacyle) et S (syringyle). Les lipides incluent majoritairement les naphtalènes, les indènes, les acides gras et les hydrocarbures. ... 62
Figure 2.17 – Données d’azote. a) Teneurs en azote des lichens, des brindilles de bouleaux et des mousses de la vallée. Les valeurs sont exprimées en pourcentage massique des échantillons séchés. Les barres d’erreurs ne sont pas visibles. b) Rapport Corg/N des sols de 0 à 30 cm de profondeur selon le type de couvert végétal (L = lichens, BL = bouleaux + lichens, BM = bouleaux + mousses). ... 63
Figure 2.18 – Acide usnique, 344.32 g/mol. ... 65
Figure 2.19 – Spectre de masse de l’acide usnique, modifié de (Letcher, 1968). ... 65
Figure 2.20 – Deux composés non identifiés du chromatogramme TMAH-pyGCMS de Cladonia stellaris. Les composés A et B ont été enregistrés à des temps d’acquisitions de 65.491 et de 68.221 minutes, respectivement. Les ions caractéristiques de l’acide usnique sont encadrés en noir (ions non méthylés) et en bleu (ions méthylés). Les incertitudes des rapports m/z sont de ± 1. ... 66
Figure 2.21 – Abondances normalisées des composés A (65.491 min) et B (68.221 min) parmi les échantillons de végétation et de sol de surface (0 – 5 cm) analysés par TMAH-pyGCMS. Les trois sites se différencient selon le couvert végétal (L = lichens, BL = bouleaux + lichens, BM = bouleaux + mousses). L’acide hexadécanoïque est utilisé comme pic de référence. Le logiciel de traitement utilisé est le Mass-Hunter© Quantitative Analysis V B.07.00. ... 67
Figure 2.22 – a) l’acide bétulinique (456.71 g/mol) b) la bétuline (442.73 g/mol) ... 68
Figure 2.23 – Mécanisme de fragmentation de l’acide bétulinique (Ayatollahi et al., 2011). ... 68
Figure 2.24 – Spectre de masse TMAH-pyGCMS du composé C (71.027 minutes) de l’échantillon de brindilles de bouleau glanduleux. Les ions caractéristiques du profil de fragmentation de l’acide bétulinique sont indiqués (Ayatollahi et al., 2011; Razborsek et al., 2008). ... 69
Figure 2.25 – Abondance normalisée de l’acide bétulinique (composé C, 203 (m/z), à 71.027 minutes) parmi les échantillons de végétation et de sol de surface (0 – 5 cm) analysés par TMAH-pyGCMS. L’acide hexadécanoïque, méthyle ester est utilisé comme pic de référence. ... 70
Figure A1 – Chromatogramme TMAH-pyGCMS d’un échantillon de feuilles de bouleau glanduleux. ... 83
Figure A2 – Chromatogramme TMAH-pyGCMS d’un échantillon de bourgeons de bouleau glanduleux. ... 85
Figure A3 – Chromatogramme TMAH-pyGCMS d’un échantillon de racines de bouleau glanduleux. ... 88
Figure A4 – Chromatogramme TMAH-pyGCMS d’un échantillon d’herbes (végétation secondaire des sites L (lichens) et BL (bouleaux + lichens). ... 90
Figure A5 – Chromatogramme TMAH-pyGCMS d’un échantillon de mousses (végétation secondaire du site BM (bouleaux + mousses). ... 92
Figure A6 – Chromatogramme TMAH-pyGCMS d’un échantillon de sol d’une profondeur de 0 à 5 cm du site L (couvert végétal = lichens). ... 94
xii
Figure A7 – Chromatogramme TMAH-pyGCMS d’un échantillon de sol d’une profondeur de 0 à 5 cm du site BL (couvert végétal = bouleaux + lichens). ... 96 Figure A8 – Chromatogramme TMAH-pyGCMS d’un échantillon de sol d’une profondeur de 0 à 5 cm du site BM (couvert végétal = bouleaux + mousses). ... 98
xiii
Liste des abréviations
AA Acides aminés
BL Couvert végétal de bouleau et de lichens
BM Couvert végétal de bouleau et de mousses
Cinorg Carbone inorganique
Corg Carbone organique
IR Infrarouge
L Couvert végétal de lichens
MO Matière organique
pyGCMS Pyrolyse couplée à la chromatographie en gazeuse et à la spectrométrie de masse
RCP Representative concentration pathway
SOC Soil organic carbon
SOM Soil organic matter
TMAH Hydroxyde de tétraméthylammonium
xiv
Remerciements
J’aimerais d’abord remercier Florent Dominé de m'avoir consacré son temps au cours des deux dernières années. Merci pour ta critique franche qui m’a permis de progresser rapidement. Merci de m’avoir donné de la liberté dans ma recherche et de m’avoir encouragé à consulter d’autres chercheurs. Je vais me souvenir des paysages du Nord, des aurores, du soleil de minuit et des balades sur Mala.
Cette étude multidisciplinaire n’aurait pas été complétée sans l’appui de nombreux organismes. Merci au Centre d’études nordiques pour l’utilisation des stations de recherche et surtout à Denis Sarrazin pour ton aide et ton soutien moral sur le terrain. Merci à l’équipe de Géoressources pour l’accueil chaleureux à Nancy et pour tous les bons moments passés. Merci Raymond Michels, Catherine Lorgeoux et Delphine Martin de m’avoir aidé à faire un projet plus complet avec la pyGC. Un gros merci aussi à l’équipe Takuvik et également à Debbie pour l’approvisionnement en café durant ces deux années.
Merci également aux nombreux experts qui m’ont aidé au cours de ces années. Merci Stéphane Boudreau pour tes conseils et pour ton aide avec le papier. Merci Alain Brousseau d’avoir effectué des centaines d’analyses et de m’avoir donné une place dans ton labo. Merci Ann Delwaide pour l’aide en dendrochronologie et à Donald Cayer pour l’aide en granulométrie.
Un dernier merci à mes amis, à Marc-André pour tes visites à mon bureau, à Simon, Beaulieu et Cata pour les soirées dans le bloc et à Maria et Mathieu pour votre support. Finalement, merci à ma famille de m’avoir encouragé dans les moments difficiles et à Myriam pour les nombreuses lectures.
xv
Avant-propos
Le chapitre 1 est sous forme d’article scientifique, rédigé en anglais par Mikael Gagnon, Florent Dominé (coauteur) et Stéphane Boudreau (coauteur). Le format de l’article a été ajusté afin de respecter respecte les règles de mise en page du mémoire.
L’étudiant (Mikael Gagnon) a effectué la collecte de données, les analyses, l’interprétation des données et la rédaction de l’article. Le Pr Florent Dominé, directeur de maîtrise, a su conseiller Mikaël tout au long de ce travail. Le Pr Stéphane Boudreau a conseillé Mikael pour les facettes de l’étude portantes sur la biologie et l’environnement, notamment pour les études dendrochronologiques. L’article a été modifié et corrigé à plusieurs reprises par Florent Dominé et Stéphane Boudreau et n’aurait pas été complété sans leurs contributions. Nous remercions également Alain Brousseau, technicien au Centre d’étude de la forêt, Université Laval, d'avoir effectué les analyses CNS des sols.
1
Introduction
Le réchauffement climatique
Le Quaternaire
Le climat sur Terre est variable dans le temps. Depuis 2.58 millions d’années, la planète se situe dans le quaternaire, une période caractérisée par des périodes glaciaires et interglaciaires (Gradstein et al., 2005). Il est possible de connaitre les variations de température du quaternaire à l’aide d’analyses isotopiques de carottes de glace. La Figure I.1 présente les fluctuations de la température atmosphérique en Antarctique depuis 800 000 ans.
Figure I.1 – Variation de la température en Antarctique. Modifiée de Luthi et al. (2008).
Tel qu’illustré, la plus récente glaciation a eu lieu entre 110 000 et 11 700 ans BP (Before Present, Figure I.1). Le retrait des calottes glaciaires, il y a 11 700 ans, a ensuite lancé la Terre dans la période interglaciaire actuelle, l’Holocène (Wanner et al., 2008). Cette période a également connu des fluctuations climatiques. Parmi les plus récentes, on retrouve l’optimum climatique de l’Holocène (5000 – 3000 av. J.-C.), la période chaude des Romains (250 av. J.-C. – 400 apr. J.-C.), l’optimum climatique médiéval (900-1100 apr. J.-C) et le Petit Âge glaciaire (1600 – 1800 apr. J.-C), ce dernier étant une période de températures froides. Depuis le 19e siècle, on observe une période de réchauffement climatique accru. Puisque la Terre émerge du Petit Âge
glaciaire, une partie de ce réchauffement est due à la variabilité naturelle du climat. Cependant, depuis la révolution industrielle des années 1800, l’émission anthropique des gaz à effet de serre contribue également au réchauffement (Battin et al., 2009; Crowley, 2000; Vitousek et al., 1997). L’étude du climat nécessite donc une compréhension des facteurs naturels et anthropiques qui provoquent ces fluctuations.
2
L’effet de serre
Le bilan radiatif de la Terre est en grande partie gouverné par le rayonnement solaire et par le rayonnement thermique de la Terre. Avant de pénétrer l’atmosphère, le spectre solaire est composé de lumière infrarouge (IR; 53 %), visible (Vis; 39 %) et ultraviolet (UV; 8 %). Une partie de ce rayonnement est ensuite absorbé dans l’atmosphère, ce qui fait que la majorité (52 %) de la lumière qui atteint la surface de la Terre se situe dans le domaine du visible. Puisque la température de la surface terrestre est en moyenne de 288 K (15 °C) (Kitzmann et al., 2011), la Terre relâche ensuite une partie de cette énergie par rayonnement thermique IR. C’est ce rayonnement qui est l’origine de l’effet de serre.
Les gaz à effet de serre sont des molécules qui peuvent absorber un photon IR, normalement de 4 à 60 μm, d’une longueur d’onde correspondante à une transition énergétique d’un mode rotationnel ou vibrationnel moléculaire, à condition que celui-ci induise un changement du moment dipolaire (Skoog et al., 2007). Les plus communs dans l’atmosphère sont l’eau (H2O), le dioxyde de carbone (CO2), le méthane (CH4) et l’ozone
(O3). Au contraire, l’azote N2(g), l’oxygène O2(g) et l’argon Ar(g) qui, au total, composent plus de 99% de
l’atmosphère n’ont pas de moments dipolaires fluctuants et n’absorbent pas la radiation IR (Skoog et al., 2007). Les gaz à effet de serre peuvent donc absorber une partie du rayonnement thermique de la terre et empêcher l’énergie radiative d’être émise vers l’espace, créant ainsi un réchauffement. L’effet de serre peut être quantifié par la mesure du bilan radiatif, qui relie la quantité d’énergie radiative reçue par la Terre à celle qui est émise dans l’espace.
Après l’eau, le CO2 est le gaz à effet de serre le plus abondant dans l’atmosphère. Les relevés les plus
récents indiquent une concentration d’environ 410 ppm (Global Monitoring Division, 2018) qui croît présentement de 0.5 % par année (IPCC, 2013). La magnitude de ce réservoir de carbone est toutefois difficile à prévoir pour les années à venir, compte tenu de la diversité des phénomènes naturels et anthropiques qui interviennent dans le cycle du carbone. Les sections suivantes aborderont les notions du cycle de carbone, des sols et des environnements arctiques et démontreront l’importance de certains phénomènes des milieux terrestres, particulièrement dans l’Arctique, pour prévoir l’évolution des émissions de gaz à effet de serre et le réchauffement climatique résultant.
Le Cycle de carbone
Le cycle de carbone planétaire
Les stocks de carbone de la Terre peuvent être divisés en deux classes : les réservoirs lents et rapides (IPCC, 2013). Ceux-ci sont basés sur le temps de résidence du carbone, c’est-à-dire le temps requis pour qu’un atome de carbone soit remplacé dans un réservoir. On obtient le temps de résidence en divisant la masse du
3
stock de carbone par son flux d’échange, exprimé en unités de masse par unité de temps. Par exemple, un réservoir de 10 grammes de carbone ayant un flux d’échange de deux grammes par année aura un temps de résidence de 5 ans.
Sur Terre, les réservoirs rapides représentent les stocks de carbone ayant des temps de résidences inférieures à 10 000 ans. On y retrouve les réservoirs atmosphériques, océaniques et ainsi qu’une partie du réservoir terrestre (sol, faune et flore), qui contiennent au total environ 50 000 Pg de carbone (1 Pg = 1015 g)
(IPCC, 2013).
Les stocks de carbone des réservoirs lents possèdent des temps de renouvellement supérieurs à 10 000 ans (IPCC, 2013). Des exemples notables sont les réserves de combustibles fossiles, la matière végétale gelée dans les sols de l’Arctique (le pergélisol) et le carbone géologique stocké dans des sédiments profonds, dans la roche mère et dans le manteau terrestre. Le carbone du manteau terrestre est de loin le plus grand réservoir de carbone sur Terre, mais il est cependant très difficile à quantifier (Jambon, 1994; Javoy et al., 1982; Zhang and Zindler, 1993).
Il arrive que le carbone de ces deux types de réservoirs soit échangé. Par exemple, les éruptions volcaniques transfèrent le carbone géologique (lent) vers l’atmosphère, un réservoir rapide. À l’opposé, la sédimentation enfouit le carbone des sols (rapide) vers des réservoirs géologiques (lents).
Depuis le début de l’Holocène, l’équilibre entre les réservoirs lents et rapides était relativement stable, avec des flux de transfert de carbone inférieurs à 0.3 Pg par année (Raymond and Cole, 2003). Cependant, l’extraction et la combustion des matières fossiles depuis l’ère industrielle augmentent la vitesse de transfert de carbone vers les réservoirs rapides. C’est en grande partie cet effet qui est à l’origine du réchauffement climatique anthropique (IPCC, 2013). Un schéma des échanges de carbone à travers les réservoirs majeurs est présenté en Figure I.2.
4
Figure I.2 – Schéma simplifié du cycle de carbone (IPCC, 2013) qui indique la taille (Pg) et les flux (Pg · année-1) des réservoirs de carbone. Les chiffres noirs représentent les estimations d’avant l’ère industrielle, tandis que les chiffres
rouges indiquent les changements actuels.
Tel qu’illustré, le carbone océanique (40 000 Pg) est de loin le plus grand réservoir du domaine rapide. Il est largement constitué de carbone inorganique dissout (38 000 Pg), notamment des carbonates (IPCC, 2013). En comparaison, le carbone organique dissout et le biote océanique ne représentent que 700 et 3 Pg de carbone, respectivement (Hansell et al., 2009). Les réservoirs de carbone terrestres (5 000 Pg) comprennent les sols et la végétation, qui sont des réservoirs rapides, ainsi que le pergélisol et les combustibles fossiles, qui sont des réservoirs lents.Finalement, le réservoir atmosphérique ne contient que 830 Pg, mais sa taille croît actuellement de 4 Pg par année (IPCC, 2013).
5
Cycle de carbone de la surface de la terre
Le cycle de carbone de la surface de la terre (ci-après appelé le cycle de carbone terrestre), est gouverné par deux principaux facteurs : 1) lors de la production primaire, les organismes photosynthétiques absorbent le CO2(g) de l’atmosphère et le convertissent en glucides et 2) lors de la respiration cellulaire, les hétérotrophes,
tels que les mycètes, la faune et les microorganismes dégradent la matière organique (MO) et produisent du CO2. Le terme «minéralisation» réfère à la production de carbone minéral lors de l’oxydation du carbone
organique en CO2. La Figure I.3 présente une représentation simplifiée du cycle de carbone terrestre.
Figure I.3 – Cycle de carbone terrestre simplifié. *La respiration cellulaire les sols peut également produire du méthane
ainsi que plusieurs composés inorganiques autres que le CO2.
La MO des sols provient généralement de la matière déposée en surface du sol par la flore (racines, feuilles, branches, épinettes, mousses). On y retrouve également de la matière animale, des mycètes (champignons), la microflore et la microfaune du sol. La litière est la couche de MO partiellement décomposée en surface du sol. On y retrouve souvent un mélange de résidus grossiers, tels que des feuilles mortes, ainsi que de la MO hautement dégradée, dont l’origine ne peut pas être déterminée visuellement. Selon le type de sol, la litière peut s’accumuler jusqu’à plusieurs centimètres de profondeur.
6
Afin qu’un sol puisse accumuler de la MO, la vitesse de stockage de carbone provenant de la litière qui s’accumule en surface doit être supérieure à la vitesse de minéralisation du carbone par les microorganismes du sol (Paul, 2016). Il est toutefois important de noter qu’il existe également d’autres mécanismes de transfert de carbone, tels que l’érosion éolienne, le ruissellement et l’éluviation, qui peuvent complexifier les échanges de carbone d’un système. Les termes puits et sources sont utilisés pour décrire les flux de carbone. Un puits représente un stock de carbone en croissance, tandis qu’une source représente un stock en décroissance. La combustion des réserves de carbone fossile fait de celles-ci une source, tandis que l’atmosphère représente le puits. Une forêt ancienne est un exemple d’un réservoir de carbone neutre puisque l’équilibre est atteint entre la photosynthèse et la minéralisation du carbone.
Conséquence du réchauffement climatique, on observe l’avancée des arbustes dans les écosystèmes circumpolaires (Myers-Smith et al., 2011; Ropars and Boudreau, 2012). La croissance de la végétation pourrait induire un puits considérable de carbone dans le réservoir terrestre, à condition que la vitesse de minéralisation du carbone soit inférieure à la vitesse de croissance des arbustes. La section suivante présente un survol de la structure des sols et permettra de mieux comprendre les résultats d’analyses chimiques (chapitres 1 et 2) ainsi que les facteurs qui gouvernement la vitesse de minéralisation du carbone des sols vers l’atmosphère.
Les sols
Le sol possède quatre composantes majeures qui s’influencent mutuellement : la phase minérale (45% volumétrique), l’air (25%), l’eau (25%), et la phase organique (5%). Prédire la capacité d’un sol à accumuler de la MO nécessite avant tout de comprendre la somme des interactions entre ces quatre composantes.
La phase minérale
Les minéraux primaires et secondaires
La phase minérale est constituée de minéraux primaires et secondaires. Les minéraux primaires sont des composés inaltérés depuis leur formation. Des exemples sont le quartz (SiO2), les Feldspaths (CaAl2Si2O8 –
NaAlSi3O8 – KAlSi3O8), les apatites (Ca5(PO4)3(F,Cl,OH)) et certains phyllosilicates, tels que les micas (ex :
muscovite, KAl2(Si3Al)O10(OH,F)2). Les minéraux secondaires sont issus des minéraux primaires et sont
formés lors de processus d’altération. Parmi bien d'autres composés, on y retrouve des oxydes hydratés de fer, d’aluminium et de manganèse, des phosphates d’aluminium, de fer, de calcium, le gypse (CaSO4)), ainsi
que plusieurs phyllosilicates, tels que la vermiculite (Mg,Fe+2,Fe+3)3[(Al,Si)4O10]) qui est issue des micas.
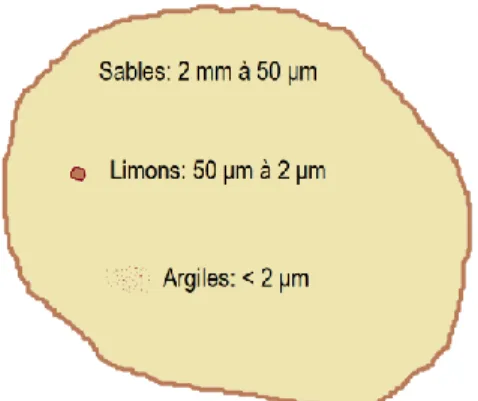
La phase minérale du sol peut également être décrite par la taille des grains (Figure I.4). La distribution granulométrique du sol consiste en graviers (> 2 mm), sables (2 mm à 50 μm), limons (50 μm à 2 μm) et
7
argiles (< 2 μm). Les graviers (> 2 mm) interagissent très peu avec le sol et contribuent peu à sa fertilité. Les minéraux primaires, tels que le quartz, possèdent souvent une texture sableuse. À l’opposé, les minéraux secondaires figurent généralement parmi les limons et les argiles. La définition granulométrique des argiles utilisée dans ce mémoire ne doit pas être confondue avec la définition minéralogique, qui les décrit comme étant des phyllosilicates d’aluminium hydratés. Ces deux définitions sont toutefois corrélées, puisque ces phyllosilicates ont généralement un diamètre < 2 μm.
Figure I.4 – Classification granulométrique de la phase minérale d’un sol. La taille des grains est exprimée en fonction du
diamètre.
Les charges permanentes et variables
Plusieurs propriétés des sols bénéfiques au maintien de la vie sont dues à la présence des charges localisées à l’intérieur des réseaux cristallins des minéraux. Ces charges sont dites «permanentes» puisqu’elles sont hors du contact de la phase aqueuse et ne sont donc pas influencées par ses fluctuations de pH. Les charges permanentes sont générées lorsqu'un réseau cristallin possède des lacunes et des irrégularités. Des cas communs sont les substitutions isomorphiques (Figure I.5), où un atome Si(IV) est remplacé par un atome Al(III) dans un réseau tétraédrique, ce qui génère une charge négative tout en maintenant la géométrie d’origine. Généralement, la somme des charges permanentes de la phase minérale est négative, ce qui explique pourquoi les anions sont plus facilement lessivés dans le sol que les cations.
8
Figure I.5 – Formation de charges permanentes dans la muscovite lors de substitutions isomorphiques. Les triangles et
les diamants représentent des conformations tétrahédriques et octahédriques, respectivement.
Les minéraux possèdent également des charges localisées en surface, souvent générées lors de la rupture du réseau cristallin. Ces charges sont dites «variables», puisqu’elles sont influencées par le pH de l’eau du sol, appelée la solution du sol. Des exemples communs sont les fonctions hydroxyles et les charges issues de l’adsorption des ions sur une surface minérale. La quantité de charges variables est proportionnelle à la surface spécifique du minéral. Un sol composé de particules fines, tels que des limons et argiles, aura une capacité d’échange ionique élevée en raison des charges variables et aura donc une influence sur la disponibilité des nutriments (des ions bénéfiques à la croissance de la flore et de la faune) dans le sol. À l’opposé, les sables et les matériaux grossiers contribueront peu à la capacité d’échange ionique du sol.
Les phases aqueuses et gazeuses
La présence de pores à travers la phase minérale facilite l’aération et la capacité de rétention d’eau du sol. Normalement, l’eau occupe les micro- et les meso-pores (en tout de 5 à 75 μm) tandis que l’air occupe les macropores (> 75 μm). La solution du sol possède un mélange d’ions bénéfiques au maintien de la vie, tels que les nitrates, les phosphates, les sulfates, le calcium, le sodium, le potassium, le magnésium, le cuivre et le fer. Une liste des ions communément retrouvés dans le sol est présentée au Tableau I.1.
9
Tableau I.1 – Les principaux ions des sols.
Cations
Anions
majeurs
mineurs
majeurs
mineurs
H
+Cd
2+HCO
3-, CO
32-MoO
42-Ca
2+Pb
2+Cl
-AsO
43-Mg
2+Hg
2+NO
3-H
3BO
3K
+Mn
2+SO
42-H
2PO
4-, HPO
42-Na
+Cu
2+CrO
42-Al
3+, AlOH
2+, Al(OH)
2+Zn
2+Fe
2+, Fe
3+Les propriétés des sols sont non seulement influencées par la nature et la concentration des ions présents, mais également par la forme sous laquelle on les retrouve. Les ions qui précipitent rapidement ou qui sont fortement adsorbés sur une surface minérale auront un effet mineur sur la fertilité du sol. D’autres ions hautement solubles, tels que les nitrates (NO3-) seront plus rapidement éluviés (transport à l’état soluble ou en
suspension). Les ions qui possèdent un potentiel ionique (densité de charge) élevé (Fe+3, Al+3, P+5)
effectueront l’hydrolyse de l’eau (Fe(OH)3, Al(OH)3, H2PO4-) et influenceront le pH du sol et la disponibilité des
ions en solution. D’autres espèces, telles que les carbonates, contribuent au pouvoir tampon de la phase aqueuse.
La phase organique
La matière organique
La MO des sols comprend la biomasse microbienne, les mycètes, la microfaune et la microflore, les racines, la matière en décomposition, la matière particulaire et les composés organiques solubles, tels que les exsudats racinaires. La MO contribue à la structure, la porosité, la capacité d’échange ionique, la disponibilité des nutriments et au potentiel de rétention d’eau (Stevenson, 1994). Tous ces facteurs sont cruciaux au maintien de la vie et de l’activité microbienne du sol, ce dernier étant la somme des réactions métaboliques effectuées par les microorganismes (Nannipieri et al., 1990). Un sol riche en MO est un sol fertile (Stevenson, 1994).
Les glucides
Les glucides sont les composés organiques les plus abondants des sols (Stevenson, 1994). Ils sont majoritairement composés d’hydrates de carbone (H-C-OH), mais certaines fonctions hydroxyles peuvent
10
parfois être substituées. Parmi les glucides, on retrouve les monosaccharides (ex. : glucose), les oligosaccharides (ex. : raffinose) et les polysaccharides (ex. : cellulose, pectines) (Tan, 2011). Les mono- et oligosaccharides sont généralement solubles dans l’eau et sont rapidement dégradés par les microorganismes. Les polysaccharides ont souvent une structure amorphe et ramifiée, ce qui peut les rendre insolubles dans l’eau. La cellulose (Figure I.6), un polysaccharide, est le biopolymère le plus abondant sur Terre. On le retrouve notamment dans les parois des cellules végétales. Bien que la cellulose soit insoluble dans l’eau, elle est tout de même rapidement dégradée par les microorganismes.
Figure I.6 – Structure de la cellulose (Xiros et al., 2013). Les lignes pointillés représentent les liaisons-H.
La lignine
La lignine est le deuxième biopolymère le plus abondant sur Terre (Tan, 2011). Ce composé hautement aromatique est insoluble dans l’eau et possède une grande résistance à la dégradation microbienne (Abbott and Jones, 2015). La structure exacte de la lignine reste inconnue (Lew, 2014). Cependant, elle possède trois unités de base, appelées monolignols. Les trois monolignols de la lignine sont les unités hydroxyphényle (H), guïacyle (G) et syringyle (S) (Figure I.7).
11
La structure des monolignols varie en fonction des groupements méthoxyles situés en position ortho de la fonction OH. L’unité H est particulièrement abondante dans les herbacées et les bambous, tandis que les alcools coniféryliques (unité G) et synapyliques (unité S) sont plus abondants dans les bois tendres (conifères) et les bois durs (feuillus), respectivement (Tan, 2011).
Les lipides
Les lipides des sols sont principalement d’origine végétale, microbienne (où ils figurent parmi 5 à 10% de la biomasse) ou fongique (10 à 25% de la biomasse). Ils comprennent les acides gras, les cires, les résines, les stérols, les terpènes et la chlorophylle (Figure I.8). Malgré la disponibilité des lipides, nous en savons encore peu sur leur influence sur la structure des sols. Il a été proposé qu’une haute teneur en lipides puisse rendre le sol hydrofuge, mais l’hypothèse n’est toujours pas confirmée (Tan, 2011). Tant que l’activité microbienne est favorisée dans des sols aérés, même les lipides les plus complexes, tels que les cires et les stérols, peuvent être dégradés (Tan, 2011). Lorsque l’activité microbienne d’un sol est faible et qu’une fraction de MO persiste pour plusieurs centaines d’années, celle-ci sera éventuellement enfouie en profondeur dans la terre, ou elle pourra subir d’autres mécanismes d’altération, tels que son incorporation dans les sédiments (kérogène).
Figure I.8 – Structure de la chlorophylle
Composés N, P, S
Le dernier compartiment majeur de la MO du sol est celui des composés azotés, phosphorés et sulfurés. Quelques exemples présentés en Figure I.9 sont les acides nucléiques (les composantes de l’ADN et l’ARN), les acides aminés (les unités de base des peptides et des protéines) et les phospholipides. Ces derniers sont notamment retrouvés dans les membranes cellulaires. La minéralisation de ces composés apporte une source de nutriments essentielle au maintien de la croissance végétale et de l’activité microbienne, tels que des nitrates, des phosphates et des sulfates (Tan, 2011).
12
Figure I.9 – Divers composés azotés, phosphorés et sulfurés retrouvés dans le sol : a) l’unité guanine d’un brin d’ADN b)
la structure de base des acides aminés c) cystéine, un acide aminé sulfuré d) un phospholipide (C12)
Les horizons de sols
La stratigraphie d’un sol minéral est composée de trois principaux horizons (Tableau I.2) qui possèdent des caractéristiques uniques dues à la nature des minéraux, aux processus d’érosion et à la présence de l’eau et de la MO.
Tableau I.2 – Horizons du sol (simplifié). Les profondeurs des horizons peuvent grandement varier.
Horizon
Profondeur (cm)
Description
A
0 - 30
Souvent riche en MO, zone éluviale.
B
30 - 100
Riche en minéraux, zone illuviale.
C
> 100
Roche mère altérée.
L’horizon A situé à la surface du sol est généralement composé d’un mélange de minéraux et de MO non décomposée et/ou en voie de décomposition. Cet horizon est une zone éluviale, où il y a migration de particules solubles ou en suspension vers l’horizon B sous-jacent. Ce dernier est souvent plus pauvre en MO que l’horizon A. Les caractéristiques de l’horizon B, la zone illuviale (qui reçoit la matière de la zone éluviale) dépendent donc des propriétés de l’horizon A. Finalement, l’horizon C possède très peu de produits issus des horizons supérieurs et sa composition minéralogique est similaire à celle de la roche mère. Les sols de cet horizon sont souvent anoxiques. La roche mère situé sous l’horizon C est rarement incluse dans lors de la description des sols, mais elle joue un rôle important dans leur genèse.
13
Activité microbienne des sols
La respiration cellulaire
La respiration cellulaire permet aux microorganismes de produire et de stocker de l’énergie sous forme d’adénosine triphosphate (ATP). Ce processus nécessite un donneur d’électrons, la MO, et un accepteur d’électrons, l’oxygène. La porosité de la phase minérale est donc un facteur crucial pour l’aération des sols. Afin de faciliter la respiration, la MO du sol doit également être aisément accessible aux microorganismes. Les sols humides facilitent la solubilisation et la mise en suspension de la MO, ce qui augmente les chances qu’un microorganisme entre en contact avec un donneur d’électrons. Cependant, un sol saturé en eau aura pour effet d’expulser l’air des macropores et en conséquence, l’oxygène dissout sera rapidement épuisé par la respiration microbienne, créant un milieu anoxique. Certains microorganismes sont des anaérobies facultatifs et peuvent toutefois effectuer la respiration cellulaire dans ces conditions. La respiration anaérobie produit moins d’ATP que la respiration aérobie et entraîne donc une diminution de l’activité microbienne (Paul, 2016). La Figure I.10 présente les différents accepteurs d’électrons que peuvent utiliser certains microorganismes en absence d’oxygène.
Figure I.10 – L’échelle rédox présente les différents accepteurs d’électrons, ainsi que leurs formes réduites, qui peuvent
être utilisés pour effectuer la respiration cellulaire. Les valeurs indiquées de potentiel rédox (EH) représentent celles d’un sol à pH ≈ 7. Plusieurs types d’accepteurs d’électrons peuvent être observés dans le même milieu.
Tel qu'illustré, les nitrates (NO3-) sont les accepteurs d’électrons les plus efficaces en milieu sub-oxique. Ce
type de respiration est connu sous le nom de dénitrification. Les produits de la dénitrification sont le diazote (N2) ainsi que des produits secondaires tels que l’oxyde nitreux (N2O) et le monoxyde d’azote (NO) (Prescott
et al., 2003). La dénitrification d’un sol mène à un appauvrissement en nitrates et une diminution de la fertilité des sols (Prescott et al., 2003). En raison de la dénitrification, les sols anoxiques sont donc souvent
14
caractérisés par un ratio Corg/N élevé (> 30) (Aitkenhead and McDowell, 2000). Certains microorganismes en
milieu oxique peuvent cependant effectuer la respiration cellulaire par nitrification, où l’ammoniaque (NH4+)
remplace la MO comme donneur d’électrons, régénérant des nitrites (NO2-) et des nitrates (NO3-).
2𝑁𝐻4++ 3𝑂2 𝐵𝑎𝑐𝑡é𝑟𝑖𝑒𝑠 → 2𝑁𝑂2−+4𝐻++ 2𝐻2𝑂 2𝑁𝑂2−+ 𝑂2 𝐵𝑎𝑐𝑡é𝑟𝑖𝑒𝑠 → 2𝑁𝑂3−
Finalement, les milieux sulfato-réducteurs et méthaniques sont très rarement retrouvés dans la surface poreuse et aérée du sol. Ils sont plutôt présents dans les horizons de sol profonds (> 1 m), dans les sols saturés en eau et dans certains environnements aquatiques anoxiques. Contrairement à la respiration aérobie, ou la MO est le donneur d’électrons, les méthanogènes utilisent la MO (ou le CO2) comme accepteur
d’électrons. Ce type de respiration génère cependant très peu d’énergie (ATP).
La température
Généralement, l’activité microbienne croît avec la température jusqu’aux alentours de 40 °C (Pietikainen et al., 2005). Certains microorganismes adaptés aux climats froids ont cependant une activité optimale à des températures bien inférieures à 30 °C (Pietikainen et al., 2005). Jansson et Tas (2014) ont même observé la croissance de microorganismes cryophiles à une température de -17 °C en présence d’eau liquide. Selon Price et Sowers (2004) il n’y aurait toujours aucune évidence d’un seuil minimal de température pour l’activité microbienne. Les particularités des climats froids seront abordées à page 17 de l’introduction.
Processus de stabilisation supramoléculaires
Tel que mentionné, la MO des sols est soumise à la dégradation microbienne à condition qu’elle soit aisément accessible aux microorganismes. Les sols sont toutefois des milieux complexes qui permettent à la MO d’effectuer de multiples associations stabilisatrices, plus résistantes contre l’oxydation enzymatique. Selon Lehmann et Kleber (2015), ces interactions stabilisatrices peuvent être séparées en deux classes : 1) la formation d’agrégats et 2) les interactions avec la phase minérale.
La formation d’agrégats est en grande partie influencée par le pH de la solution du sol. En conditions hautement acides, la protonation des fonctions carboxyliques (pKa ≈ 2.5) diminue la capacité d’échange
cationique (CEC) de la MO, ce qui augmente son hydrophobicité et favorise la formation d’agrégats. Les interactions hydrophobes (aussi appelé l'effet du solvant) dominent ce milieu (Steed et al., 2007; Tan, 2011). En conditions légèrement acides ou basiques, l’effet du solvant diminue, mais la déprotonation des fonctions carboxyliques crée une surface hydrophile qui permet à la MO de se coordonner aux cations floculants (des cations multivalents tels que Ca2+, Mg2+, Fe2+, Fe(OH)2+, Al(OH)2+) ce qui favorise la croissance des agrégats.
π-15
π Face-Face, cation-π, hydrogène-π), ce qui protège davantage la MO contre la dégradation (Steed et al., 2007). Cette hypothèse a été confirmée par Cranwell et Haworth (1975) à l’aide d’analyses de résonance paramagnétique électronique, qui ont observé la présence d’un cœur aromatique dans les extraits organiques des sols.
La seconde classe d’associations stabilisatrices de la MO est l’interaction avec la phase minérale. Ces associations sont largement dues à la présence des charges variables sur la surface minérale. Les charges variables peuvent soit interagir directement avec la MO ou indirectement, lors de l’adsorption d’ions multivalents. La surface spécifique élevée des limons et des argiles leur permet d’effectuer un grand nombre d’interactions avec la MO. Par exemple, sous conditions alcalines ou légèrement acides, les acides aminés (AA) possèdent des fonctions carboxyliques négativement chargées (R-COO-) et des groupements amines protonés (R-NH4+), créant ainsi des zwiterions libres de former des liaisons bivalentes avec la phase minérale
(Hughes, 2009). Certains AA, tels que le tryptophane, possèdent également des systèmes aromatiques qui peuvent s’associer par le recouvrement des systèmes π. Les associations qu’entreprennent les AA pourraient donc leur procurer une résistance non négligeable contre l’activité microbienne, ce qui expliquerait en partie la tendance de certains sols à avoir une certaine quantité d’azote non attribuable (Schnitzer and Hindle, 1980; Stevenson, 1994; Tan, 2011).
Le schéma de Lehmann et Kleber (2015) présenté en Figure I.11 illustre l’importance des interactions stabilisatrices de la MO et résume bien l’état actuel de la compréhension des sols, qui a beaucoup évolué depuis les années 1960 (Lehmann and Kleber, 2015; Piccolo, 2002; Schmidt et al., 2011; Stevenson, 1994; Sutton and Sposito, 2005; Whitehead and Tinsley, 1963).
16
Figure I.11 – Le modèle du continuum des sols de Lehmann et Kleber (2015) décrit le processus de dégradation de la
matière organique des sols ainsi que ses mécanismes de stabilisation qui influencent son temps de résidence. Les flèches continues et pointillées représentent des transferts biotiques et abiotiques, respectivement. Les flèches plus
larges représentent des processus rapides. La largeur des encadrés représente la taille des stocks de carbone.
Tel qu’illustré, le carbone récalcitrant entreprend des associations stabilisatrices dans le sol et possède un temps de résidence élevé. À l’opposé, le carbone labile effectue très peu d’associations stabilisatrices et possède un temps de résidence faible. Selon Lehmann et Kleber (2015), les résidus organiques grossiers de matière végétale sont rapidement dégradés dans le sol puisqu’ils réalisent très peu d’agrégats et d’interactions avec la phase minérale. L’oxydation partielle de la MO produit ensuite des plus petites molécules qui peuvent effectuer un plus grand nombre d’associations. Les fragments inférieurs à 600 Da peuvent cependant pénétrer les membranes cellulaires, où ils seront plus rapidement assimilés par les microorganismes.
En résumé, prédire la capacité d’un sol à accumuler de la MO nécessite une connaissance approfondie de la somme des interactions dans le sol (pH, salinité, sodicité, CEC, CEA, disponibilité des nutriments, teneur et
17
nature du carbone, teneur en eau et capacité de rétention d’eau, température, biomasse microbienne, teneur en oxygène, nature de la phase minérale, granulométrie). La section suivante abordera certaines particularités des climats froids et permettra d’introduire le projet d’étude, basé sur l’avancée des arbustes en Arctique et leur impact sur les réservoirs de carbone terrestres et atmosphériques.
L’Arctique
Le Pergélisol
La stratigraphie du pergélisol
Le pergélisol recouvre environ 25 % de la surface terrestre émergée. Ces sols possèdent des caractéristiques uniques issues du gel de l’eau. La stratigraphie du pergélisol est illustrée en Figure I.12.
Figure I.12 – Stratigraphie du pergélisol : la couche active et le pergélisol.
La couche superficielle du pergélisol, appelée la couche active, est sujette aux plus grandes variations de température. Son dégel durant l’été permet la croissance de la flore et la déposition de MO. La profondeur de la couche active varie entre 10 cm et plus de 3 m, selon plusieurs facteurs, tels que les propriétés du sol, la température de l’air, l’ensoleillement, le vent, les couverts nivaux et végétaux, l’eau et la température du pergélisol en profondeur. Le pergélisol est situé sous la couche active et possède une température inférieure à 0°C, même l’été.
L’influence de l’eau
L’une des plus grandes influences sur la température du pergélisol est la présence d’eau. L’eau possède une enthalpie supérieure (moins favorable) à celle de la glace, ce qui mène à la libération de la chaleur latente (énergie libre) lors du gel. Malgré les températures froides au début de l’hiver, la chaleur latente libérée permet de maintenir la surface des sols à une température autour de 0°C. Ce n’est qu’après que la majorité de l’eau de la couche active ait gelé que le sol peut se refroidir significativement.
18 Distribution du pergélisol
Le pergélisol peut être classifié selon sa distribution spatiale. La Figure I.13 présente trois types de pergélisols : le pergélisol continu, discontinu et sporadique.
Figure I.13 – Classification de la distribution du pergélisol, adaptée de French (2013). Les flèches pointillées représentent
le mouvement de l’eau dans le sol. a) Des mares de thermokarst formées lors du dégel du pergélisol b) une mare de thermokarst asséchée.
La majorité de l’Arctique canadien est constitué de pergélisol continu. Ce recouvrement complet limite l’infiltration d’eau dans le sol et favorise la formation de mares en surface, appelées mares de thermokarst. Un thermokarst est une dépression créée lors d’un phénomène thermique – le dégel du pergélisol. À l’opposé, les pergélisols discontinus et sporadiques sont retrouvés dans les régions subarctiques. L’irrégularité du pergélisol favorise le drainage de l’eau et l’assèchement des mares. La Figure I.14 présente une image d’une mare de thermokarst en cours d’assèchement dans un territoire recouvert de pergélisol discontinu.
Figure I.14 – Pergélisol discontinu près d’Umiujaq, au Nunavik. a) Buttes de pergélisol b) mare de thermokarst c) mare
19
La morphologie du pergélisol sur un territoire Arctique est souvent variable, en raison de l’hétérogénéité du sol (nature de la phase minérale, taille des grains, présence d’eau, quantité de MO). Par exemple, les buttes de pergélisol (Figure I.14 a)) sont typiquement formées lorsqu’il y a 1) migration de l’eau à travers les horizons du pergélisol, suivie 2) du gel de l’eau et 3) d’une accumulation de glace. À l’opposé un pergélisol pauvre en eau et en glace aura peu de caractéristiques morphologiques typiquement associés aux sols Arctiques.
La formation du pergélisol
Le pergélisol peut croître par voie syn- ou épi-génétique. Le pergélisol syngénétique se développe lorsque la matière végétale ou minérale déposée en surface du sol est rapidement intégrée dans le pergélisol (< 0 °C) situé sous la couche active. Cette croissance est observée lorsque la profondeur du dégel de la couche active ne peut atteindre la profondeur de l’année antérieure, compte tenu des dépôts en surface du sol et d’une faible activité microbienne. À travers le temps, le front de gel d'un pergélisol syngénétique croît en hauteur, du pergélisol vers la couche active. Ce type de pergélisol est notamment retrouvé dans le Haut-Arctique, où la température moyenne de la couche active est très basse. Afin que les sols Arctiques puissent accumuler de la MO, il suffit que la vitesse d’accumulation de MO soit supérieure à la vitesse de déposition de MO. Tel qu'illustré en Figure I.15, le pergélisol syngénétique favorise la préservation de la MO non décomposée et gelée dans le sol.
Figure I.15 – a) Tourbe fibreuse enfouie dans le pergélisol syngénétique de l’île Bylot, Canada. b) localisation de
l’horizon tourbeux à la frontière du pergélisol et de la couche active.
Le maintien d’un climat froid peut permettre au pergélisol syngénétique de croître durant des millions d’années et d’atteindre des centaines de mètres de profondeur (Jansson and Tas, 2014). À l’opposé, le pergélisol épigénétique se développe plusieurs centaines voire même plusieurs milliers d’années après la formation du sol. Cette croissance s’effectue lorsque le front de gel se propage de la surface vers les anciens horizons en profondeur dans le sol (French, 2013). Contrairement au pergélisol syngénétique, le pergélisol épigénétique
20
est généralement plus pauvre en carbone puisque la MO déposée en surface a le temps d'être minéralisée avant que le sol ne gèle en permanence.
Le dégel du pergélisol
Au total, le pergélisol contiendrait environ 1300 Pg de carbone qui est en grande partie préservé sous forme de matière végétale gelée (Hugelius et al., 2014). Ce réservoir de carbone est supérieur au réservoir de combustibles fossiles et représente environ 1.5 fois la taille du réservoir de carbone atmosphérique actuel (IPCC, 2013). Conséquence du réchauffement climatique, on observe présentement le dégel du pergélisol (Figure I.16) et la minéralisation des réserves de carbone ancien suite à l’activation de la respiration microbienne (Schuur et al., 2013).
Figure I.16 – Dégel du pergélisol continu dans le Haut-Arctique canadien (Île Bylot, juillet 2018).
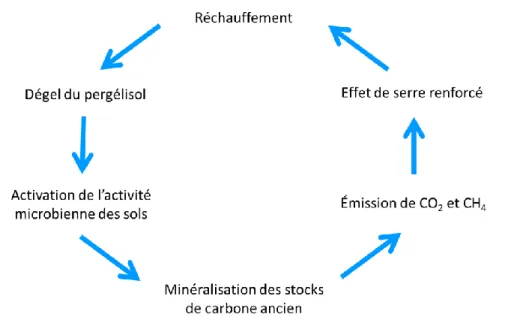
Le dégel du pergélisol et la minéralisation subséquente du carbone ancien représentent une rétroaction positive du réchauffement climatique. Cette boucle de rétroaction, présentée en Figure I.17, pourrait donc grandement affecter le réservoir de carbone atmosphérique dans le futur.
21
Figure I.17 – Boucle de rétroaction positive du dégel du pergélisol envers le réchauffement climatique.
Tel qu'indiqué, le réchauffement climatique induit le dégel du pergélisol, qui à son tour permet l’activation des microorganismes des sols et la minéralisation du carbone ancien. Les émissions de carbone dans l’atmosphère amplifient l’effet de serre et augmentent la vitesse du réchauffement global, ce qui accélère davantage le dégel du pergélisol, créant ainsi la boucle de rétroaction positive. Schuur et al. (2015) estiment qu’entre 5 et 15% du carbone stocké dans le pergélisol pourrait être minéralisé vers l’atmosphère d’ici la fin du 21e siècle, ce qui représenterait un gain d’environ 170 Pg de carbone, ou environ un tiers du réservoir de
carbone du biote terrestre (IPCC, 2013).
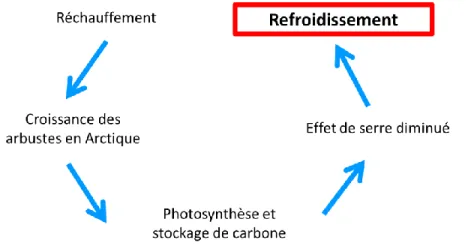
L’avancée de la végétation arbustive
En plus du dégel du pergélisol et de la transformation de carbone ancien en gaz à effet de serre, il existe une variété de phénomènes naturels pouvant influencer le climat. Également en réponse au réchauffement climatique et au dégel du pergélisol, on observe l’avancée des arbustes dans les territoires circumpolaires ((Myers-Smith et al., 2011) et références incluses). Ici, l’avancée des arbustes constitue un puits de carbone et une rétroaction négative au réchauffement grâce à la biomasse végétale supérieure à celle de la végétation primaire de la toundra et à la litière qui s’accumule (Figure I.18) (Sistla et al., 2013; Wookey et al., 2009).