HAL Id: hal-02824992
https://hal.inrae.fr/hal-02824992
Submitted on 6 Jun 2020
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Suivi de la dynamique de croissance et des changements
ontogéniques du régime alimentaire chez les larves de
corégones (Coregonus lavaretus) dans le lac d’Annecy
Aude Ponticelli
To cite this version:
Aude Ponticelli. Suivi de la dynamique de croissance et des changements ontogéniques du régime alimentaire chez les larves de corégones (Coregonus lavaretus) dans le lac d’Annecy. [Stage] Université Blaise Pascal (Clermont Ferrand 2) (UBP), Clermont-Ferrand, FRA. 2006, 55 p. �hal-02824992�
PONTICELLI Aude
Master Pro 2ème année Sciences et Technologies
Restauration et Entretien des Milieux Aquatiques Continentaux Année 2005-2006
Rapport de stage
SUIVI DE LA DYNAMIQUE DE CROISSANCE ET
DES CHANGEMENTS ONTOGÉNIQUES DU
RÉGIME ALIMENTAIRE CHEZ LES LARVES DE
CORÉGONES (
COREGONUS LAVARETUS
)
DANS LE LAC D’ANNECY
Sous la direction de : Mlle Orlane ANNEVILLE (CR2)
INRA – Station d’Hydrobiologie Lacustre 75, avenue de Corzent – BP 511
74203 Thonon Cedex
REMERCIEMENTS
La réalisation de ce stage n'aurait pas été possible sans le concours de certaines personnes que je tiens à remercier très sincèrement :
Orlane Anneville, qui a eu la gentillesse de me prendre en stage. Merci pour sa patience et son aide dans la réalisation de stage.
Michel Colon alias Lulu et Jean-Christophe Hustache alias Cri-Cri d’amour, sans qui le terrain n’aurait jamais été le même !!!
Leslie Laine pour la réalisation des comptages du zooplancton et sa compagnie pendant les longues heures de ponçage !!!
Daniel Gerdeaux pour ses conseils avisés.
L'ensemble de la Station et, plus particulièrement, l’équipe RTR pour les nombreux apéros du vendredi midi. Merci à Jean Guillard, Marie-Elodie Perga et Juan Carlos Molinero.
Merci à tous les stagiaires pour la bonne humeur qui a toujours régnée ici et pour ces barbecues inoubliables : Aurélie, Stéphanie, Morfatou, Mélanie, Miguel et Virginie (les nouveaux arrivés). Merci à ceux qui furent de véritables amis ; je pense à Caro, Yonel (Calimero), Seb (maintenant diplômé en Doctorat !!!) et Cécile (notre CaillouX préféré).
Enfin, plus que des remerciements pour mes parents, mon frère et Fred qui m'ont toujours encouragée au cours de la réalisation de mes études.
SOMMAIRE
SOMMAIRE ...- 1 -
INTRODUCTION ...- 3 -
I. CADRE GÉNÉRAL DE L’ÉTUDE ET PRINCIPES DES MÉTHODES UTILISÉES ...- 5 -
I.1. Le lac d’Annecy ...- 5 -
I.2. Le corégone...- 6 -
I.2.1. Origine ...- 6 -
I.2.2. Biologie et écologie de C.lavaretus ...- 7 -
I.2.3. Menace et mesures de conservation ...- 8 -
I.3. L’otolithométrie...- 9 -
I.4. L’approche isotopique : utilisation en écologie du poisson...- 11 -
II. DESCRIPTION DES MÉTHODES ...- 13 -
II.1. Méthodologie d’échantillonnage...- 13 -
II.1.1. Mesures physico-chimiques ...- 13 -
II.1.2. Echantillonnage du zooplancton...- 13 -
II.1.3. Echantillonnage des larves ...- 14 -
II.2. Traitement des échantillons ...- 14 -
II.2.1. Dénombrement du zooplancton ...- 14 -
II.2.2. Tri du zooplancton pour les analyses isotopiques ...- 15 -
II.2.3. Traitement des larves ...- 16 -
II.2.4. Détermination des habitudes alimentaires des larves ...- 18 -
II.2.5. Préparation des échantillons pour les analyses isotopiques...- 18 -
II.3. L’otolithométrie ...- 18 -
II.3.1. Extraction des otolithes chez les larves de corégones ...- 18 -
II.3.2. Montage des otolithes ...- 19 -
II.3.3. Ponçage progressif et polissage...- 19 -
II.3.4. Lecture des otolithes ...- 20 -
II.3.5. Rétrocalculs ...- 20 -
II. 4. Méthodes de traitement des données...- 21 -
II.4.1. Méthodes statistiques ...- 21 -
II.4.2. Représentation graphique : diagramme de Costello (Costello, 1990) ...- 21 -
III. RÉSULTATS...- 22 -
III.1. Description et évolution des conditions environnementales...- 22 -
III.1.1. Température de l’eau du lac d’Annecy ...- 22 -
III.1.2. Evolution de l’abondance et de la composition de la communauté zooplanctonique - 23 - III.2. Croissance des larves ...- 24 -
III.2.1. Structure en taille et stade de développement de la population de larves de corégone échantillonnées ...- 26 -
III.2.2. Otolithométrie ...- 31 -
III.3. Régime alimentaire : étude des contenus stomacaux ...- 34 -
III.3.1. Caractéristiques du régime alimentaire et comportement alimentaire des larves. - 34 - III.3.2. Taille des catégories zooplanctoniques ingérées ...- 39 -
III.3.2. Taille des catégories zooplanctoniques ingérées ...- 40 -
III.4. Analyses isotopiques...- 41 -
IV. DISCUSSION ...- 44 -
IV.1. Discussion des différentes méthodes utilisées...- 44 -
IV.1.1. Capture des larves par filets tractés ...- 44 -
IV.1.2. Utilisation d’isotopes stables ...- 45 -
IV.1.3. L’otolithométrie ...- 46 -
IV.2. Ecologie des larves de C. lavaretus ...- 46 -
IV.2.1. Croissance des larves ...- 46 -
IV.2.2. Evolution du comportement alimentaire des larves : influence de la disponibilité des proies...- 47 -
CONCLUSIONS ...- 49 -
BIBLIOGRAPHIE ...- 50 -
SUIVI DE LA DYNAMIQUE DE CROISSANCE ET DES CHANGEMENTS ONTOGÉNIQUES DU RÉGIME ALIMENTAIRE CHEZ LES LARVES DE CORÉGONES
(COREGONUS LAVARETUS) DANS LE LAC D’ANNECY
INTRODUCTION
Lorsque l’on cherche à en comprendre le fonctionnement, dans l’objectif d’une gestion raisonnée et optimale, les écosystèmes aquatiques nous posent, par la multitude le leurs composantes, des difficultés majeures. L’idée même d’écosystème comprend l’idée d’interactions entre espèces et d’interactions population-environnement qui intègre toutes les variables du milieu (Keith P. et Allardi J., 2001).
La gestion d’un écosystème aquatique ou d’une ressource nécessite donc de comprendre les principales variables qui le composent ou qui interagissent avec cette ressource (morphodynamisme du milieu, physico-chimie de l’eau, disponibilité en nutriments…).
Dans les grands lacs périalpins, que sont le Léman, le Bourget et le lac d’Annecy, les poissons constituent une ressource renouvelable exploitée de longue date. La présence de Salmonidés comme la truite, l’omble chevalier et le corégone, surnommées « espèces nobles », confère une bonne image à ces milieux qui ont pourtant souffert de la pollution et en particulier de l’eutrophisation.
En effet, dès le début des années 70, la notion « d’eutrophisation », qui décrit l’enrichissement des lacs en matières nutritives favorisant le développement végétal, est établi. Son impact négatif sur le réseau trophique du lac est alors reconnu. Dès lors, plusieurs travaux d’aménagement sont effectués de manière à retrouver le bon état trophique des écosystèmes aquatiques.
Le lac d’Annecy fait partie de ces lacs ayant été menacés d’eutrophisation. Aujourd’hui il entre dans la catégorie des lacs oligotrophes voire ultra-oligotrophes. Une question est aujourd’hui préoccupante pour les populations de poissons, elle concerne la capacité du lac d’Annecy à soutenir à terme la bonne production halieutique constatée jusqu’à maintenant. En effet, le lac d’Annecy est de plus en plus oligotrophe, ce qui est une bonne chose et lui confère
une qualité proche de celle du début du XXème siècle. En revanche, une diminution de la
quantité de zooplancton est à craindre. Plusieurs conséquences peuvent être envisagées sur les populations de poissons : ralentissement de la croissance, baisse de la survie des jeunes par manque de nourriture et en conséquence du nombre de poissons adultes présents.
Cet écosystème est également très sensible aux fluctuations météorologiques, et notamment au réchauffement climatique, qui se manifeste à l’échelle mondiale et locale sur la région alpine. Divers travaux montrent l’impact des changements climatiques sur les
populations de poissons (Hari et al., 2006 ; Gillet & Quétin, 2006). Ces impacts peuvent être
directs en influençant les mécanismes physiologiques des poissons ou indirects en influençant la dynamique d’autres organismes, tels que le zooplancton, qui sont également sensibles aux
variations climatiques (Straile, 2000 ; Molinero et al., 2006).
La gestion des populations de poissons nécessite donc un ajustement de l’aménagement de la ressource piscicole en fonction de l’évolution du milieu et de son fonctionnement. Peu
d’études portent sur l’écologie des larves de poissons dans les lacs alpins. Or, cette étape de la vie du poisson constitue un « goulot d’étranglement ». L’abondance du stock qui assurera le bon maintien naturel de la population dépendra du taux de survie de ces larves. Une mise au point de nos connaissances relatives au déterminisme du recrutement larvaire est donc une étape nécessaire pour établir une gestion raisonnée du patrimoine piscicole.
Dans ce contexte, nous souhaitons caractériser l’écologie des différentes phases larvaires
du corégone, Coregonus lavaretus, dans le lac d’Annecy. Le corégone est un Salmonidé exploité
de longue date pour la pêche amateur et professionnelle. Sa valeur économique en fait un modèle d’étude de « premier ordre ».
Ainsi, cette étude, conduite à la station d’hydrobiologie de l’INRA de Thonon-les-Bains, contribuera à apporter des connaissances sur la survie des jeunes corégones. Elle repose sur un suivi de la croissance des larves ainsi que l’évolution de leur régime alimentaire en fonction des caractéristiques principales du milieu (physico-chimie de l’eau, disponibilité et qualité des nutriments). L’objectif ici est d’identifier et caractériser les habitudes alimentaires des différentes phases larvaires par lesquelles passe le poisson.
L’étude de la dynamique de croissance des larves sera estimée par mesure de leur longueur, détermination du stade larvaire sous microscope droit et de leur âge par otolithométrie. L’otolithométrie sur les larves de corégone est encore peu utilisée et a été mise en place au laboratoire de la station d’hydrobiologie de l’INRA pendant ce stage. L’étude du régime alimentaire repose sur l’utilisation de deux méthodes distinctes. La première est classique et consiste en l’analyse des contenus stomacaux (comptage des espèces zooplanctoniques ingérées). La deuxième est innovante et consiste en des comparaisons des signatures isotopiques entre le zooplancton et les larves. Cette méthode devrait permettre de repérer de façon rapide et synthétique les changements de régime alimentaire des larves au cours de leur croissance.
I. CADRE GÉNÉRAL DE L’ÉTUDE ET PRINCIPES DES MÉTHODES UTILISÉES I.1. Le lac d’Annecy
Le lac d’Annecy est un lac péri-alpin d’origine glacière situé en Haute-Savoie. Il est encadré à l’est par le massif des Bornes, à l’ouest par le massif des Bauges, et au sud par la vallée de l’Eau Morte.
Le bassin du lac est formé de deux cuvettes couramment appelées le « Grand Lac » au
nord et le « Petit Lac » au sud (Cf. Photo 1 et figure 1). Sa superficie totale de 27 km2 en fait le
deuxième plus grand lac naturel de France après le lac du Bourget (exception faite de la partie française du Léman). Ses profondeurs moyennes et maximales sont respectivement de 41 m et 65 m.
Sa situation géographique et ses caractéristiques morphologiques (Cf. Tableau 1) lui
confèrent un fonctionnement thermique de type monomictique chaud ; à savoir une seule période de mélange hivernal, des températures toujours supérieures à 4°C, et proches de 4°C en hiver.
Le lac d’Annecy est alimenté par plusieurs petites rivières qui prennent leurs sources dans les montagnes environnantes (l’Ire, l’Eau morte, le Laudon, la Bornette et le Biolon), et par une puissante source sous-lacustre, le Boubioz, qui jaillit à 82 m de profondeur. Le lac déverse son trop-plein d’eau dans le Thiou et dans le canal du Vassé, qui se rejoignent et alimentent le Fier, à 1 500 m au nord-ouest d’Annecy, qui se jette lui-même dans le Rhône.
Photo 1 : Lac d’Annecy Figure 1 : Lac d’Annecy
Altitude 447 m Longueur 14,6 km Largeur de 0,8 à 3,2 km Surface 27 km2 Profondeur moyenne 41 m Profondeur maximale 65 m
Volume d’eau douce 1 124 500 000 m3
Etant déversoir naturel de toutes les eaux usées des communes riveraines, le lac d’Annecy était menacé d’eutrophisation. Dès les années 1950, une vaste prise de conscience a permis la mise en œuvre de mesures permettant de préserver le lac de l’eutrophisation.
Alertées par le docteur Paul Servettaz, huit communes décidèrent de s’engager en pionnières dans la sauvegarde de leur lac. Elles créèrent en 1957 le SILA (Syndicat
Intercommunal du Lac d’Annecy), qui s’est transformé, le 1er janvier 2001, en Syndicat Mixte du
Lac d’Annecy (toujours SILA1) et réunit actuellement 10 groupements intercommunaux,
représentant 113 communes, soit une population de 250 000 habitants. En 1957, un premier réseau complet d’assainissement est construit avec collecteurs, stations de pompage et une station d’épuration. En 1994, une nouvelle usine de dépollution est construite. À ce jour, le lac reçoit seulement les eaux de pluie et celles des sources et des cours d’eau qui l’alimentent.
Aujourd’hui, avec des concentrations moyennes en phosphore total de 5 μg/L
(Gerdeaux et al., 2005), le lac d’Annecy est classé dans la catégorie des lacs de type oligotrophe
voire même ultra-oligotrophe qui présentent une transparence élevée liée à une productivité phytoplanctonique moyenne plutôt faible.
Malgré un caractère oligotrophe, le lac d’Annecy présente une production piscicole très satisfaisante qui témoigne du bon fonctionnement du lac. Ce constat fut le point de départ de divers travaux portant sur le fonctionnement du réseau trophique, l’efficacité des transferts de la matière et la qualité nutritionnelle des microalgues.
Il existe actuellement une quinzaine d’espèces de poissons dans le lac d’Annecy, dont certaines caractéristiques des lacs alpins (ombles, corégones, truites fario lacustres). Le peuplement piscicole se compose également de brochet, lotte, gardon, ablette et autres poissons peu estimés tels que la carpe et la tanche. La ressource piscicole du lac d’Annecy est exploitée pour le profit économique mais également pour le loisir (Gerdeaux, 1996). L’omble et le corégone représentent 90% du tonnage des pêches (Caranhac, 1999). Le corégone a donc été choisi comme modèle d’étude car c’est une espèce importante d’un point de vue économique, historique mais également patrimoniale.
I.2. Le corégone I.2.1. Origine
Le genre Coregonus appartient à la famille des Salmonidés et à la sous-famille des
Coregonidés. Son aire de répartition est la zone moyenne de l’hémisphère nord (Europe centrale
et septentrionale, nord de l’Amérique et de l’Asie). Coregonus lavaretus (Linnée 1758) est
autochtone dans l’arc alpin et typique des lacs subalpins. Le corégone dans le lac d’Annecy est issu de l’introduction d’alevins provenant de différents lacs, la première introduction ayant eu lieu en 1888. La souche résultante se maintient parfaitement puisque la reproduction naturelle
suffit à elle seule à assurer chaque année un bon recrutement (Gerdeaux et al., 2005).
1 SILA : Les compétences du SILA sont la collecte et le traitement des eaux usées, le traitement des déchets
Figure 2 : Coregonus lavaretus
I.2.2. Biologie et écologie de C.lavaretus
C. lavaretus est un poisson lacustre. Dans le lac d’Annecy, la fraie débute en décembre jusqu’à début janvier dans la zone littorale sur les fonds sableux. La fécondité est relativement élevée, en effet une femelle de 400 g peut pondre jusqu’à 15 000 œufs (fécondité de 3200 œufs/kg de femelle). Les œufs sont petits (2 à 3 mm) et éclosent environ 6 semaines après la ponte, cependant la durée d’incubation dépend de la température de l’eau du lac (Salojärvi, 1982). Les éclosions peuvent donc débuter mi-février et se poursuivre jusqu’à fin mars.
La maturité sexuelle est atteinte vers l’âge de 2 à 3 ans. Comme l’alevin, l’adulte est zooplanctonophage. Il se nourrit principalement de cladocères et au début du printemps, quand le plancton est rare, il se nourrit d’organismes benthiques (larves de chironomes) (Ponton & Müller, 1988).
La vie du C. lavaretus est marquée par 5 périodes principales :
La phase embryonnaire : de la fécondation à l’éclosion.
La phase larvaire : du début de l’alimentation exogène à l’ossification de la colonne vertébrale
et la différenciation complète des nageoires. Luczynski et al. (1988) recensent 14 stades
larvaires. Les larves se nourrissent dans un premier temps des réserves nutritives du sac vitellin mais acquièrent rapidement un comportement zooplanctonophage. Le passage à la nutrition exogène est une période critique pour les alevins où on observe un fort taux de mortalité ;
La phase juvénile : de la fin de la différenciation complète des organes au début de la gamétogenèse ;
La phase adulte : dès la maturité sexuelle atteinte. Les adultes vivent dans les basses couches de l’épilimnion et ont un comportement grégaire.
La phase sénescente : dès le ralentissement important de la gamétogenèse.
L’étude des différentes phases de vie du corégone a montré que l’écologie de ce poisson évolue au cours de sa vie. De ces différentes phases, la phase larvaire semble être la plus critique avec un très fort taux de mortalité. On parle de véritable « goulot d’étranglement », dont dépend l’importance du stock d’adultes. Malgré l’importance de la phase larvaire chez les corégones,
peu d’études ont été réalisées in situ sur les facteurs influençant la mortalité larvaire, excepté
I.2.3. Menace et mesures de conservation
Les larves de corégone semblent avoir une grande sensibilité au phénomène d’eutrophisation des lacs. En effet, les œufs sont déposés sur les sédiments et, de cette manière, sensibles à la concentration en oxygène présente sur le fond des lacs. Dans les lacs eutrophes, l’œuf est menacé par la sédimentation des matières organiques, les faibles concentrations en oxygène à l’interface eaux-sédiments et par le développement du périphyton qui peut entraîner un dépôt sur les œufs, ce qui contribue à les asphyxier (Gillet, 1988). La survie des œufs dans les lacs eutrophes est, de ce fait, faible voir nulle.
Aujourd’hui, en raison des efforts de restauration pour améliorer l’état trophique des lacs
périalpins C. lavaretus n’est pas en danger cependant, l’espèce figure à l’annexe V de la directive
Habitat Faune Flore ainsi qu’à l’annexe III de la convention de Berne. Elle est également susceptible de bénéficier de mesures de protection de biotope (arrêté du 8/12/88).
Le réchauffement climatique a lui aussi un impact plus ou moins connu, ou du moins, envisagé sur les larves de corégone. En effet, une augmentation de la température de la surface de l’eau est enregistrée dans les grands lacs européens et serait liée au réchauffement climatique global (Gillet & Quétin, 2006).
Cette augmentation de la température de l’eau, de l’ordre de 1°C en 30 ans (Gerdeaux, 2004) provoque depuis quelques années un démarrage de la production primaire un mois plus tôt dans l’année (Anneville, 2001). Le zooplancton, qui se nourrit du phytoplancton et dont le taux de croissance et fortement influencé par la température, voit donc sa dynamique démarrer plus tôt dans l’année, ce qui n’est pas sans conséquences sur les larves de corégone qui peuvent tirer profit de ce surplus de nourriture tôt dans leur cycle larvaire (Gerdeaux, 2004). En effet, deux principaux paramètres semblent affecter la survie ainsi que la croissance des jeunes larves. Ces paramètres sont la température de l’eau et la quantité de nutriments disponibles à l’éclosion des larves (Eckmann & Rey, 1989). En augmentant d’1°C, la température de l’eau fournit donc un environnement de qualité pour les larves à leur éclosion (température idéale et plus de zooplancton dans le milieu).
La température des eaux étant un facteur important pour le déclenchement de la fraie des corégones (Gillet, 2001), une augmentation de 1°C aura par conséquent également un impact sur les dates de la fraie.
Le recul du début de la période de reproduction et l'augmentation de la population zooplanctonique au printemps dû au réchauffement global semblent, au moins dans le lac Léman, favoriser le recrutement des corégones en augmentant la survie larvaire et en prolongeant la saison de croissance.
I.3. L’otolithométrie
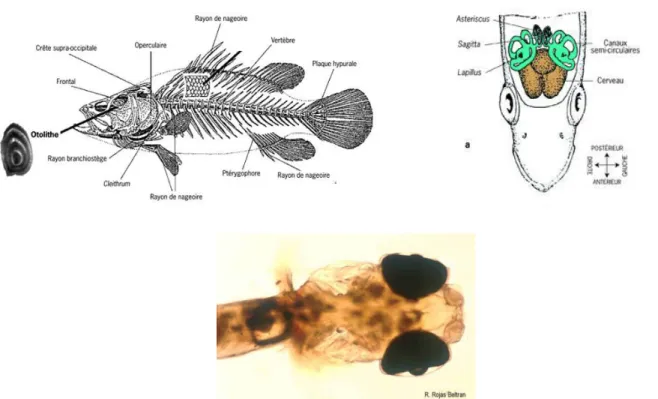
L’âge des poissons est une information biologique nécessaire pour étudier leurs dynamiques de croissance et optimiser les mesures de gestion des pêches. Cette connaissance est, le plus souvent, le résultat de l’interprétation de lecture des écailles, des arêtes, des rayons des nageoires ou des otolithes appelés communément « pierres d'oreilles ».
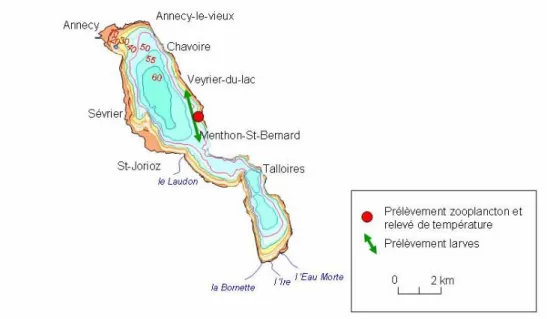
Aujourd'hui, les otolithes apportent aux scientifiques la lecture la plus complète sur certaines espèces de poisson ou pour certaines étapes de leur cycle de vie. L’otolithométrie consiste à étudier la structure des otolithes. Un otolithe est une concrétion calcaire présente dans l’oreille interne des poissons et qui leur sert à percevoir les sons et à maintenir leur
équilibre. L’oreille interne du poisson dispose de trois paires d’otolithes (sagitta, lapillus et
asteriscus) situées de part et d’autre du cerveau (Cf. Figure 3). Ces pièces minérales sont
intéressantes parce qu’elles commencent à se former dès la phase embryonnaire, leur croissance est proportionnelle à la croissance somatique et l’accroissement se fait par apposition d’un nouveau matériel à la périphérie de l’otolithe. Ce type de croissance leur confère une structure striée comparable à un tronc d’arbre où s’alternent des bandes claires et des bandes sombres.
Figure 3 : Localisation des otolithes et position à l’intérieur de l’oreille interne chez les poissons Téléostéens (photo de C.lavaretus, source : www.thonon.inra.fr)
Par transparence, il est facile d’observer cette alternance de zones concentriques ou annuli qui permettent d’estimer l’âge du poisson : chaque année produisant à la fois une partie claire et une partie sombre. On peut par ailleurs, la première année, observer des stries concentriques quotidiennes qui sont un véritable témoin de la croissance de la larve ou du poisson juvénile. L’épaisseur et le nombre de zones apparentes, ainsi que leur composition chimique, permettent de connaître aussi, avec exactitude, les différentes étapes de la croissance du poisson et les caractéristiques physico-chimiques du milieu.
Les structures d’accroissement se forment régulièrement sur une échelle de temps s’étalant d’un rythme journalier à un rythme annuel. L’estimation de l’âge des poissons dépend des changements visibles de la croissance de l’otolithe. Les patrons de croissance les plus intéressants se situent à 4 niveaux de résolution :
• Accroissements primaires : permettant une résolution des jours ;
• Zones saisonnières : permettant une résolution de plusieurs mois ou d’une saison de croissance ;
• Accroissements annuels : permettant une résolution des années ;
• Discontinuités (ultra) structurales dans l’otolithe correspondant à des stress variés qui ne sont pas nécessairement réguliers durant la vie des individus.
Les mécanismes qui produisent ces patrons reconnaissables sont légèrement différents, bien qu’au niveau opérationnel ils soient le résultat de variations dans la quantité relative de calcium
et de protéines sur les accroissements ou les zones (Panfili et al., 2002).
Dans notre étude, l’otolithométrie servira à connaître l’âge de chaque larve et à analyser leur vitesse de croissance. Nous nous intéresserons aux accroissements primaires.
Les accroissements primaires sont formés par des dépôts successifs de couches riches en minéral et de couches riches en matrice protéique autour du noyau de l’otolithe, respectivement appelées les zones-L (« L » pour « Light » désignant des zones claires) et les zones-D (« D » pour
« Dark » désignant des zones sombres) (Panfili et al., 2002). Ces différentes stries sont
dénombrées à partir d’une strie très marquée appelée « strie d’éclosion » (Cf. Figure 4). La
littérature suggère que ces accroissements primaires sont déposés quotidiennement. Ces dépôts journaliers semblent généralement s’arrêter chez l’adulte ou au cours des stades juvéniles tardifs.
e
Figure 4 : Coupe fine transversale d’un otolithe de Vinciguerria nimbaria (Photichthyidae). Marque de croissance primaires composées des zones-L et des zones-D (photos a, b,c et d) Exemple d’une strie d’éclosion (flèches noires) autour du noyau (flèche blanche) (photo e)
(D’après Panfili et al., 2002)
Les discontinuités, elles, interrompent l’arrangement régulier des accroissements primaires. Elles sont probablement induites par des troubles ou des stress affectant les individus dans leur biotope. Cependant, des recherches tentent à montrer que ces discontinuités peuvent être également liées à des évènements ontogéniques (recrutement, migrations…). Au microscope, elles apparaissent comme de larges zones-D, la matrice organique étant
Le dénombrement et les mesures des bandes permet donc de connaître l’âge d’un poisson, son histoire (date d’éclosion, taux de croissance journalier, régime alimentaire…) et son environnement.
I.4. L’approche isotopique : utilisation en écologie du poisson
Deux isotopes sont deux formes légèrement différentes d’un même élément chimique. L’élément chimique est défini par son numéro atomique Z, qui correspond au nombre de protons (ou d’électrons, l’atome étant électriquement neutre) et par son nombre de masse A, qui est la somme du nombre de protons et de neutrons du noyau. Les isotopes d’un même élément X ont le même numéro atomique mais un nombre de neutrons différent. Deux isotopes d’un même élément diffèrent essentiellement par leur masse : on parle d’isotopes «légers» et «lourds».
Certains isotopes présentent une instabilité énergétique. Le retour à une forme isotopique stable se fait par l’émission d’une particule : ce sont les isotopes radioactifs. D’autres isotopes ont une configuration constante : ce sont les isotopes stables. Pour un même élément peuvent
cohabiter des formes stables et radioactives. Le carbone, par exemple, a trois isotopes : 12C,
abondant, léger et stable ; 13C, rare, lourd et stable et 14C rare, lourd et radioactif (Pereck, 2004).
L’azote a lui 12 isotopes dont deux formes stables: 14N, abondant et léger et 15N, lourd et rare
(Pereck, 2004).
L’analyse isotopique a diverses applications en écologie. L’analyse isotopique de l’azote et du carbone permet de caractériser le régime alimentaire des organismes et de les localiser dans le réseau trophique (Dufour & Gerdeaux, 2001). L’avantage de cette approche, par rapport aux analyses des contenus stomacaux, est essentiellement dû au fait qu’elle offre une vision synthétique et globale du régime alimentaire, et permet de s’affranchir des limites rencontrées par l’analyse des contenus stomacaux (état ponctuel de l’alimentation d’un poisson, différente vitesse d’assimilation des proies). C’est pourquoi, aujourd’hui, les études isotopiques sont utilisées afin de caractériser rapidement les habitudes alimentaires globales des poissons.
L’utilisation des isotopes stables pour l’étude des régimes alimentaires repose sur le fondement suivant : les atomes constitutifs des êtres vivants proviennent des atomes de leur nourriture ; il y a par conséquent une relation entre la composition isotopique de la nourriture et celle du consommateur. Les signatures isotopiques des producteurs primaires à la base de la chaîne trophique se transmettent jusqu’au prédateur final sans grand changement pour la carbone et avec un enrichissement de 3 à 4‰ à chaque niveau trophique pour l’azote (Minagawa & Wada, 1984). Cet enrichissement trophique est une accumulation en isotopes lourds le long de la chaîne trophique, compensée par une excrétion préférentielle des isotopes légers.
La signature du carbone d’un organisme du réseau permet donc d’estimer la part des différentes sources de carbone dans son alimentation ; tandis que la signature de l’azote permet de positionner le niveau d’un organisme dans le réseau trophique (Dufour & Gerdeaux, 2001).
Une analyse isotopique donne la différence relative de rapport isotopique, qui est la concentration en isotopes lourds sur la concentration en isotopes légers, entre l’échantillon et une référence. L’unité de mesure est le δ exprimé en ‰ suivant les équations suivantes :
δ
13C = ((R
échantillon– R
standard) – 1) x 1000) avec R = [
13C] / [
12C]
δ
15N = ((R
échantillon– R
standard) – 1) x 1000) avec R = [
15N] / [
14N]
Les mesures des concentrations isotopiques sont effectuées par spectrométrie de masse
isotopique des éléments étudiés mis sous forme gazeuse (le carbone en CO2 et l’azote en N2). La
II. DESCRIPTION DES MÉTHODES II.1. Méthodologie d’échantillonnage
Les campagnes d’échantillonnage ont débuté le 22 février 2006 et se sont déroulées
jusqu’à l’arrêt des captures des larves de C. lavaretus par notre méthode d’échantillonnage
(début mai). L’échantillonnage a été réalisé avec un pas de temps hebdomadaire dans la zone
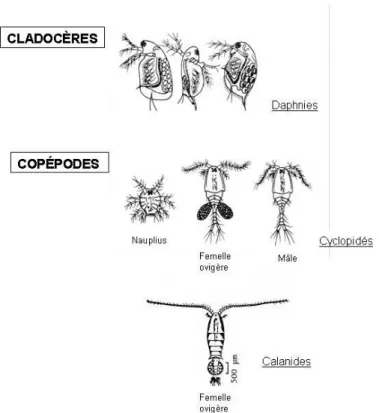
littorale Est du « Grand Lac » entre Veyrier et Menthon (Cf. Figure 5).
Chaque campagne consistait en des prélèvements de larves de corégone, de zooplancton et des enregistrements de la température du lac ainsi que d’autres paramètres physico-chimiques pour avoir des indications quant aux conditions de vie des larves.
Figure 5 : Situation de la zone de prélèvement des larves de Corégone et de la zone de prélèvement du zooplancton et d’enregistrement de la température de l’eau sur la carte du lac d’Annecy
II.1.1. Mesures physico-chimiques
La température ainsi que les principaux paramètres physico-chimiques du lac ont été
enregistrés sur toute la hauteur de la colonne d’eau, à une station littorale (Cf. Figure 5) située
dans la zone de prélèvement des larves. Ces mesures physico-chimiques ont été réalisées à l’aide d’une sonde multi-paramètres. Deux sondes thermiques enregistreuses horaires ont également été placées en zone littorale durant toute la durée de l’étude ; l’une à un mètre en dessous de la surface et l’autre placée sur le fond de la zone.
II.1.2. Echantillonnage du zooplancton
Afin de voir la relation entre le zooplancton disponible dans le milieu et le régime alimentaire des larves, les prélèvements ont été effectués dans la zone de capture des larves. Le zooplancton est recueilli à l’aide d’un filet de maille 0,2 mm lors de traits verticaux réalisés depuis 20 m de profondeur jusqu’à la surface. Un premier échantillon de zooplancton est alors conservé dans du formol (pour éviter la décomposition des organismes). Cet échantillon sera
utilisé pour la description quantitative et qualitative de la communauté zooplanctonique. Du zooplancton est stocké vivant dans une glacière. Les individus de cet échantillon seront destinés aux analyses isotopiques.
II.1.3. Echantillonnage des larves
La méthode de prélèvement a été établie grâce à la littérature et améliorée lors des campagnes réalisées les années précédentes. La capture des larves se réalise lors de transects parallèles à la côte en zone littorale, lieu où vivent les larves à cette période de leur vie. Estimant que le régime alimentaire et la dynamique de croissance des larves ne varie pas d’une zone à l’autre, nous avons limité nos campagnes à certaines zones du lac, en particulier la côte est de Veyrier à Menthon-Saint-Bernard.
L’échantillonnage s’effectue à l’aide de deux filets tractés sur les côtés du bateau. L’ouverture des filets a une forme rectangulaire de 1,5 m sur 1 m. Les filets sont constitués par une nappe en nylon de vide de maille 1mm. La longueur du filet est de 5 m. Ils se terminent par une bouteille en PVC qui permet de recueillir les larves facilement sans les abîmer. Plusieurs traits de 20 minutes en surface, voire à très faibles profondeurs, à une vitesse de 2 km/h en moyenne, permettent un échantillonnage suffisamment représentatif.
II.2. Traitement des échantillons
II.2.1. Dénombrement du zooplancton
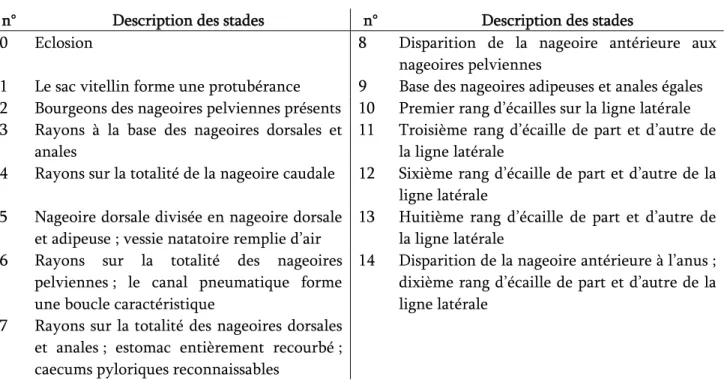
Le zooplancton constitue un compartiment essentiel du réseau trophique en milieu lacustre. Il existe des organismes herbivores (rotifères, daphniidés, bosminidés), s’alimentant de petites espèces de phytoplancton, des bactéries et de la matière organique détritique. Il existe également des organismes carnivores (cyclopidés, leptodoridés) qui se nourrissent des petites formes du zooplancton.
Le zooplancton comprend 2 groupes principaux d’organismes : les rotifères, de petite taille (entre 0,05 et 1 mm) ;
les microcrustacés : branchiopodes (ex. cladocères : daphniidés, bosminidés) et
copépodes (cyclopidés et calanidés).
Les copépodes grandissent par mue. Il existe plusieurs stades de développement : 12
stades naupliens et 5 stades copépodites (cf. Annexe 1). Ils sont segmentés et prennent un
segment de plus à chaque stade. Leur taille est comprise entre 200 et 1700 μm (Dussart, 1967). Les cladocères sont recouverts d’une carapace du thorax au pseudoabdomen dont une ouverture ventrale laisse sortir les appendices thoraciques et postabdomen. Leur taille s’échelonne de à 200 à 3000 μm (Amoros, 1984).
Notre méthode d’échantillonnage ne nous permet pas de récolter les rotifères. L’étude
porte donc sur les microcrustacés. Ils sont identifiés par espèce (Cf. Figure 6) et dénombrés en
fonction de leur stade de développement. Ce comptage se fait sous microscope sur une lame de comptage à partir d’un sous-échantillon de l’échantillon prélevé et fixé au formol. Les individus se présentant correctement (non recourbés) sont mesurés. La mesure des individus est réalisable à l’aide d’une caméra numérique branchée sur le microscope. Pour les copépodes, on mesure la taille du thorax (l’abdomen n’est pas pris en compte car en général il est déformé et compressé).
Pour les cladocères, nous mesurons l’individu entier. Pour chaque catégorie taxonomique, le nombre d’individus a été ramené à l’unité de surface selon la formule ci-dessous :
K2=(Nind x Vol. flacon x 20) / (Vol. comp x 1,923)
Nind est le nombre d’individus dénombrés dans le sous-échantillon, Vol. flacon est le volume de
l’échantillon (en ml), Vol. comp est le volume du sous-échantillon (en ml), 20 est la hauteur du
prélèvement (en m) et 1,923 est le volume filtré par le filet (en m3).
Figure 6 : Schéma des différents taxons zooplanctoniques présents dans le lac d’Annecy
II. 2.2. Tri du zooplancton pour les analyses isotopiques
Le zooplancton vivant est conservé une nuit en chambre froide. Ceci permet aux organismes de digérer pour que les analyses isotopiques ne soient pas biaisées par la signature des algues ingérées. Les organismes sont ensuite triés et séparés en fonction de leur groupe taxonomique et taille.
En posant comme hypothèse que la sélection des proies par les larves se fait en fonction de la taille des proies et du groupe taxonomique, on cherche à avoir la signature isotopique des différentes catégories de taille pour les principaux groupes taxonomiques prédatés par les larves. Des études précédentes ont montré que les calanides ne sont pas consommés par les larves de corégone (Lainé, 2005), ils sont donc retirés des échantillons. Les cyclopoïdes sont séparés en 3 catégories de taille. Les daphnies étant en quantité insuffisante pour être triées en fonction de leur taille, nous les avons regroupées en une seule catégorie.
Pour séparer les individus en fonction de leur taille, on utilise une succession de tamis de différents vides de maille.
¾ Un tamis de 0,71 mm nous permet de séparer les daphnies, les calanides et les grands stades copépodites du reste du zooplancton. L’échantillon prélevé au lac est filtré 3 fois de suite. Le filtrat obtenu est repassé sur le tamis 0,71 mm dans un souci de précision. Le filtrat A obtenu est conservé et on récupère le matériel retenu par le tamis. On refiltre ce matériel et le filtrat B est conservé. Le matériel retenu par le tamis est une dernière fois refiltré. Le filtrat C obtenu est conservé. Le matériel final récupéré correspond aux plus gros individus, c’est la
fraction 1. Les filtrats A1, B1 et C1 sont ensuite mélangés.
¾ Le mélange des filtrats précédents est filtré sur un tamis de 0,5 mm qui permet de sélectionner les copépodes de taille moyenne ainsi que quelques daphnies juvéniles. Trois filtrations du filtrat obtenu (même opération que précédemment) sont faites. On obtient
ainsi la fraction 2 correspondant aux individus de taille moyenne. Les filtrats A2, B2 et C2
obtenus sont ensuite mélangés.
¾ Le mélange des filtrats précédents est passé sur un tamis de 85 μm, utilisé pour recueillir les individus de petite taille. Le premier filtrat obtenu est refiltré 3 fois sur le tamis de manière à récupérer tous les individus de petite taille. On obtient la fraction 3.
A la suite du tri des organismes par taille, nous devons séparer les taxons dans les fractions 1 et 2, la fraction 3 ne contenant que les jeunes stades de cyclopoïdes. Les individus étant encore vivants, nous devons les endormir avant de les trier. Pour cela, nous versons de l’eau gazeuse dans les récipients contenant les fractions 1 et 2. Les cladocères remontent alors à la surface alors que les copépodes sédimentent au fond du récipient. Les cladocères sont isolés. Dans le groupe des copépodes, nous retirons les calanides (et tous les débris) sous loupe binoculaire. Une fois triées, les fractions sont ensuite égouttées et placées dans des tubes eppendorf au congélateur en attendant d’être lyophilisées.
A l’issue de ce tri sélectif, nous obtenons 4 groupes de zooplancton pour les isotopes : • Daphnies et bosmines (Cladocères herbivores), issus des fractions 1 et 2 ;
• Cyclops > à 0,71 mm, issus de la fraction 1 ;
• Cyclops compris entre 0,71 mm et 0,5 mm, issus de la fraction 2 ; • Cyclops compris entre 0,5 mm et 85 μm, issus de la fraction 3.
II.2.3. Traitement des larves
Les larves n’étant pas fixées, les mesures et l’analyse des contenus stomacaux doivent se faire le jour même du prélèvement. On détermine le stade de développement de la larve sous
loupe binoculaire d’après la table de Luczynski et al. (Cf. Figure 7 et tableau 2) ; elle est ensuite
mesurée sur papier millimétré. Les têtes sont prélevées et conservées au congélateur jusqu’à extraction des otolithes. La détermination de l’âge des larves se fait ultérieurement par l’examen des otolithes. La méthode d’otolithométrie est décrite au chapitre II.3.
Figure 7 : Stades de développement larvaire de Coregonus lavaretus (d’après Luczynski et al, 1988)
n° Description des stades n° Description des stades
0 Eclosion 8 Disparition de la nageoire antérieure aux
nageoires pelviennes
1 Le sac vitellin forme une protubérance 9 Base des nageoires adipeuses et anales égales 2 Bourgeons des nageoires pelviennes présents 10 Premier rang d’écailles sur la ligne latérale 3 Rayons à la base des nageoires dorsales et
anales
11 Troisième rang d’écaille de part et d’autre de la ligne latérale
4 Rayons sur la totalité de la nageoire caudale 12 Sixième rang d’écaille de part et d’autre de la ligne latérale
5 Nageoire dorsale divisée en nageoire dorsale et adipeuse ; vessie natatoire remplie d’air
13 Huitième rang d’écaille de part et d’autre de la ligne latérale
6 Rayons sur la totalité des nageoires pelviennes ; le canal pneumatique forme une boucle caractéristique
14 Disparition de la nageoire antérieure à l’anus ; dixième rang d’écaille de part et d’autre de la ligne latérale
7 Rayons sur la totalité des nageoires dorsales et anales ; estomac entièrement recourbé ; caecums pyloriques reconnaissables
II.2.4. Détermination des habitudes alimentaires des larves
L’analyse des contenus stomacaux est réalisée le jour de la pêche. Après avoir retiré l’estomac de la larve et vidé son contenu à l’aide d’une minutie, un balayage minutieux permet d’identifier puis dénombrer les taxons et stades de développement ingérés. L’examen est fait à l’aide d’un microscope droit à un grossissement de 10. Pour chaque proie rencontrée, on détermine l’espèce et son stade de développement. Les individus sont mesurés chaque fois que leur position ou état de décomposition le permet. Le comptage des espèces est réalisé par la technicienne de la station en charge des suivis des populations zooplanctoniques dans le lac d’Annecy de manière à ne pas introduire de biais dans l’identification des organismes.
II.2.5. Préparation des échantillons pour les analyses isotopiques
Les analyses isotopiques sont réalisées sur le corps des larves et sur les échantillons de zooplancton recueillis comme décrit précédemment. Les 4 groupes de zooplancton ainsi que les corps des larves doivent être congelés et lyophilisés. Une fois les échantillons lyophilisés, ils sont
pesés à l’aide d’une microbalance permettant de peser des masses au 10-6 g près pour une portée
de 4 g. Chaque fraction d’échantillon pesée doit faire 1 mg avec une marge acceptée comprise entre 0,9 mg et 1,1 mg. Les larves dont la masse après lyophilisation était inférieure à 1 mg, ont été associées avec une larve de la même sortie et du même stade larvaire. Des triplicats de chaque stade larvaire par sortie sont réalisés.
Les pesées sont effectuées dans des microcapsules en étain. Une fois le poids souhaité atteint, les microcapsules sont soigneusement fermées et déposées dans une boîte en plastique. Les analyses sont ensuite réalisées à Dundee en Ecosse (Scrimgeour, the Scottish Crop Research Institute).
II.3. L’otolithométrie
La préparation et la lecture des otolithes de larves de corégone sont inspirées de la méthode décrite par Eckmann et Rey (1987). Cette méthode a été mise en place au cours de ce
stage, et adaptée en fonction du matériel disponible au laboratoire (Cf. Annexe 2).
II.3.1. Extraction des otolithes chez les larves de corégones
L’extraction est réalisée dans un liquide d’immersion (eau). Les otolithes sont extraits en utilisant une loupe binoculaire avec de la lumière polarisée. Les otolithes ont en effet pour caractéristique d’être réfringents à la lumière polarisée, ce qui permet de les distinguer des tissus
avoisinants (Cf. Figure 8). Les otolithes sont séparés et prélevés avec l’aide de minuties (Cf.
Figure 8 : Vue dorsale de la face antérieure Figure 9 : Prélèvement d’otolithes avec l’aide d’une larve de Vinciguerria nimbaria (Photichthyidae) de minuties, isolement des sagitta
sous lumière polarisée (flèches jaunes) et lapillus (flèche rouge) Otolihes sagitta (S ) et lapillus (L) (D’après Panfili et al., 2002)
II.3.2. Montage des otolithes
Les otolithes sont ensuite directement montés sur une lame dans le produit d’inclusion,
une goutte de résine (Epoxy Embedding Medium Kit) (Cf. Figure 10). La résine incluant les
otolithes doit polymériser. Les lames sont alors mises à l’étuve à 60°C pendant 24h.
Figure 10 : Inclusion des otolithes de larve (flèches rouges) dans de la résine polyester (flèches jaunes) à l’aide de minuties (flèches vertes) (D’après Panfili et al., 2002)
II.3.3. Ponçage progressif et polissage
Les pièces calcifiées doivent être poncées après leur inclusion dans la résine. Le ponçage permet d’améliorer la lisibilité de l’otolithe car toutes les stries ne sont pas visibles sur la pièce entière (dû à la forme concave de l’otolithe).
Le ponçage utilise des papiers abrasifs à l’eau, de grain 12μm, et un contrôle optique permanent du plan à atteindre pour enlever le maximum d’épaisseur de la résine recouvrant les otolithes enrobés. Le polissage sert à enlever les rayures et les irrégularités introduites par les étapes préalables du ponçage. Il est réalisé progressivement à l’aide de différentes suspensions de poudre d’alumine en milieu aqueux (grains décroissants de 3 μm, 1 μm et 0,3 μm). Il est impératif d’enlever la résine sur toute la surface de l’otolithe sans toutefois supprimer les primordia (noyau) et la strie d’éclosion. Lors des préparations manuelles, les mouvements
d’usure ou de polissage doivent être faits sans direction définie de façon à conserver une
épaisseur régulière de l’otolithe (Cf. Figure 11).
Figure 11 : Ponçage (a) et polissage (b) des préparations (D’après Panfili et al., 2002)
II.3.4. Lecture des otolithes
La lecture se fait sous microscope droit avec un grossissement de 40. Après avoir défini la strie d’éclosion, les zones sombres correspondant aux dépôts de couches riches en matrice protéique sont dénombrées jusqu’à la périphérie de l’otolithe. La lecture est effectuée par deux personnes, chacune faisant deux lectures : une partant de la périphérie de l’otolithe et l’autre du noyau. Seules les otolithes pour lesquels le même nombre de stries étaient comptées d’un lecteur à l’autre (pas plus de 4 jours d’écart) serviront pour les rétrocalculs.
II.3.5. Rétrocalculs
Nous avons choisi d’appliquer la méthode de rétrocalculs décrite par Urpanen et al.
(2005) (Cf. Annexe 2). Cette méthode est basée sur la relation existante entre la taille de la larve
et le rayon de l’otolithe.
Après avoir mesuré sur le logiciel d’acquisition la taille du rayon de l’otolithe à chaque âge (en jours) de la larve depuis son éclosion, il est possible de déterminer par rétrocalculs la taille que faisait une larve à un âge i donné. Pour cela nous appliquons la formule suivante :
TLi = (Si/S)b x TL
Où TLi : taille de la larve à l’âge i, TL : taille mesurée de la larve, Si : rayon otolithe à l’age i, S :
rayon mesuré de l’otolithe. Le facteur b correspond à la pente de la relation : ln(TL) = ln(a) + b
ln(S).
Le taux de croissance G peut ensuite être calculé selon la formule : Gi = (Wi – Wi-1) / (ti-ti-1)
Le taux de croissance a été calculé en mg/j. Les poids des larves n’ayant pas été mesurés, un facteur de conversion a été appliqué aux tailles permettant d’obtenir la masse (W) de chaque
II. 4. Méthodes de traitement des données II.4.1. Méthodes statistiques
Les analyses statistiques sont des test-T ou un test non-paramétrique de Wilcoxon si les conditions de normalité ne sont pas remplies. Ceci permet de mettre en évidence l’évolution des moyennes des tailles des larves au fil du temps et par stades de développement. L’ensemble de ces tests est réalisé à l’aide du logiciel de statistiques S-Plus.
L’étude de la composition du régime alimentaire des larves de corégone a été réalisée en
appliquant la méthode proposée par De Crespin De Billy et al. (2000). Une analyse en
composantes principales (ACP) est appliquée. L’ACP une méthode statistique multidimensionnelle qui permet de synthétiser un ensemble de données. Elle permet notamment de déterminer les deux axes qui expliquent le mieux la dispersion d’un nuage de points. La méthode utilisée dans cette étude se base sur une ACP réalisée sur une table de proportion dont chaque ligne a un total égal à 1. Par la suite, on nommera cette méthode ACP%. Dans ce type d’ACP le tableau initial, ici composé des 15 variables en colonne (proies) et de 271 individus en ligne (larves), subit la transformation suivante : passage en pourcentage par ligne, suivi d’un centrage par colonne. Cette méthode nous permettra de caractériser le régime alimentaire de chaque larve et d’identifier des types de comportement alimentaire en lien avec le stade de développement des larves et de la composition zooplanctonique du milieu. Cette
analyse a été réalisée à l’aide du logiciel ADE4 (Thioulouse et al., 1997).
II.4.2. Représentation graphique : diagramme de Costello (Costello, 1990)
La méthode graphique de Costello permet une comparaison visuelle des stratégies alimentaires de chaque stade larvaire. Elle permet une description de l’importance relative d’une proie (rare ou dominante dans le régime alimentaire des larves) et le degré d’homogénéité
de la sélection des proies dans la population de larves (Cf. Figure 12). Cette méthode graphique
utilise l’abondance moyenne (%Aj) de la proie j dans les n estomacs analysés et l’occurrence de
cette proie (%Occj) dans ces n estomacs. L’abondance correspond à la contribution relative de la
proie j dans les contenus stomacaux des larves. L’occurrence d’une proie correspond au ratio entre la nombre d’estomacs dans lesquels on retrouve la proie j et le nombre d’estomacs total non vides. Cette représentation sera faite pour chaque stade larvaire et les différents résultats seront comparés entre eux.
III. RÉSULTATS
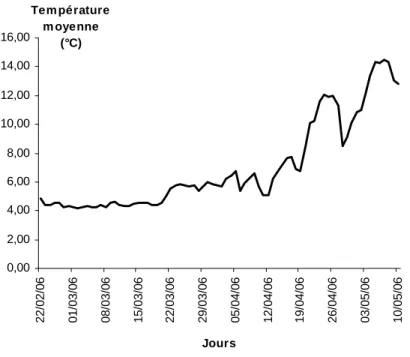
III.1. Description et évolution des conditions environnementales III.1.1. Température de l’eau du lac d’Annecy
La température moyenne de la couche de surface est calculée entre 0 et 5 mètres de profondeur, zone correspondant à la distribution verticale des larves (Ponton & Meng, 1990). La température de la couche de surface est restée relativement proche de 4°C jusqu’au 14 mars. Elle a ensuite atteint les 6°C le 28 mars et s’est maintenue à cette température jusqu’au 18 avril. Cette année, le réchauffement printanier des eaux a débuté légèrement après le 18 avril, date à laquelle les eaux de surface présentent un réchauffement rapide. Les températures atteignent alors 12°C dès le 25 avril et se maintiennent jusqu’à la fin des campagnes.
0,0 2,0 4,0 6,0 8,0 10,0 12,0 14,0 21/ 2 28/ 2 7/ 3 14/ 3 21/ 3 28/ 3 4/ 4 11/ 4 18/ 4 25/ 4 2/ 5 9/ 5 Dates de prélèvements T 0-5m (°C)
Figure 13 : Evolution de la température moyenne calculée entre 0 et 5mètres de profondeur entre le 21 février et le 10 mai 2006
0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00 16,00 22 /02 /06 01 /03 /06 08 /03 /06 15 /03 /06 22 /03 /06 29 /03 /06 05 /04 /06 12 /04 /06 19 /04 /06 26 /04 /06 03 /05 /06 10 /05 /06 Jours Tem pérature m oyenne (°C)
La sonde enregistreuse horaire placée en zone littorale nous permet d’appréhender les brusques changements de températures non visibles d’une semaine sur l’autre, comme c’est le cas entre les 26 avril et le 3 mai. En effet, à cette période la température moyenne journalière diminue d’environ 3°C, passant ainsi de 12°C à un peu moins de 9°C. Ce refroidissement est court et la température retrouve vite une augmentation progressive pour aller atteindre les 14°C.
III.1.2. Evolution de l’abondance et de la composition de la communauté zooplanctonique
A cette période de l’année, la composition zooplanctonique du lac d’Annecy est
composée de deux espèces de cyclopoïdes (Cyclops prealpinus et Mesocyclops leuckarti), d’une
espèce de calanoïdes (Mixodiaptomus laciniatus) et de deux espèces de cladocères (Daphnia
hyalina et Eubosmina longispina). Les familles majoritaires sont clairement les cyclopoïdes qui
représentent environ 80% de la communauté zooplanctonique (Cf. Figure 15). Les cladocères
voient leur contribution augmenter à la 12ème sortie (10 mai), elle reste cependant faible (30%)
en comparaison de celle des cyclopoïdes (environ 60%).
Les Cyclops prealpinus C1, C2 et C3 sont présents en majorité pendant les premières
semaines d’échantillonnage (Cf. Figure 15). Les Mesocyclops leuckarti ne deviennent dominants
dans le milieu qu’à partir de la 7ème sortie (le 5 avril). En ce qui concerne Daphnia hyalina, elles
ne représentent qu’une très faible proportion de la communauté zooplanctonique (entre 5 et 20% au maximum). Ce n’est qu’à la sortie 12 (le 10 mai), comme nous l’avons déjà dit, que la contribution des daphnies devient plus importante (environ 30%). La contribution des daphnies et des calanides à la population zooplanctonique est relativement similaire, à l’exception de la sortie du 10 mai.
Figure 15 : Evolution de la composition zooplanctonique (par classes et par stades) au cours de la période d’étude Cladocères 0 5 000 10 000 15 000 20 000 25 000 30 000 21/ 2 28/ 2 7/ 3 14/ 3 21/ 3 28/ 3 4/ 4 11/ 4 18/ 4 25/ 4 2/ 5 9/ 5
Dates de prélèvem ents Effectifs (ind/m 2) Cyclopides 0 20 000 40 000 60 000 80 000 100 000 120 000 140 000 160 000 180 000 21 /2 28 /2 7/3 14/3 21/3 28/3 4/4 11/4 18/4 25/4 2/5 9/5
Dates de prélèvem ents Effectifs
(ind/m 2)
Figure 16 : Evolution des cladocères et des cyclopidés au point de prélèvement
Les deux graphiques de la figure 16 nous montrent qu’il y a une augmentation de la population de cladocères dans le lac d’Annecy à partir de début mai. A cette période, nous remarquons une diminution du nombre de cyclopidés. Les effectifs de cyclopidés présents dans le milieu restent cependant largement supérieurs à ceux observés pour les cladocères (près de 2 fois supérieur).
III.2. Croissance des larves
La campagne d’échantillonnage a commencé le mercredi 21 février 2006, date à laquelle seulement deux larves ont été capturées. La semaine suivante aucune larve de corégone n’a été pêchée. Nous ne savons pas si cette campagne infructueuse était due aux très faibles températures qui ont amené les larves à descendre plus en profondeur dans le lac ou si c’est le fait que le début des éclosions n’avait pas encore réellement commencé. Le mercredi 7 mars, 43
larves ont été capturées. Le début des éclosions a donc eu lieu entre le 21 février et le 7 mars 2006. Cette observation est en accord avec les précédentes études faites sur les larves de Corégones dans le lac d’Annecy, qui montrent que les éclosions débutent fin février – début mars (Cretenoy & Gerdeaux, 1997 et Laine, 2005).
Nous avons pu vérifier l’importance du choix de la profondeur du filet. Comme le suggérait L. Cretenoy dans son étude de 1997, l’optimum de pêche s’est révélé être entre 0 et 1,50 mètres de profondeur en zone littorale. En effet, les larves évoluent à la proche surface de du lac, ceci probablement en raison de leur faible acuité visuelle qui les oblige à rester en surface pour chasser le zooplancton (Ponton & Meng, 1990).
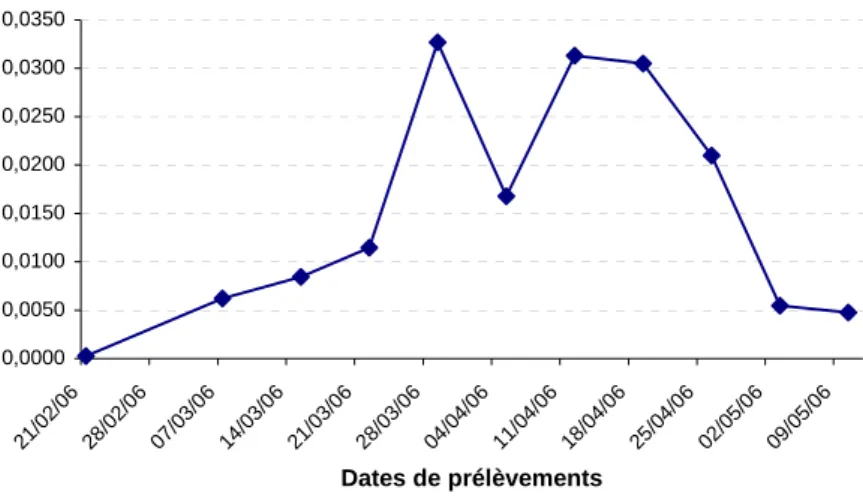
Nous avons effectué au total 12 campagnes d’échantillonnage. La dernière a eu lieu le mercredi 10 mai car notre CPUE (Capture Par Unité d’Effort), soit le rapport entre le nombre de larves pêchées et le volume d’eau total filtré par journée de prélèvement, diminuait fortement
(Cf. Figure 17). La CPUE maximale a été atteinte le 28 mars (environ 0,033 larves.m-3) et reste
élevée jusqu’à mi-avril (environ 0,030 larves.m-3, exception faite du 5 avril où elles n’est plus
que de 0,017). A partir de mi-avril, les captures par unité d’effort diminuent rapidement pour
atteindre 0,005 larves.m-3 début mai. Nous décidons alors d’arrêter les campagnes.
Au total, 1225 larves ont été capturées. Nous avons capturé essentiellement de jeunes stades larvaires, stades 0 à 4, c'est-à-dire des larves mesurant entre 9 et 20 mm. Le maximum de
prises correspondait à des larves mesurant entre 12 et 16 mm (Cf. Figure 18). Au fur et à mesure
des campagnes, les larves capturées sont de plus en plus grandes, mesurant souvent plus de 20 mm. Or, la figure 18 suggère qu’au-delà de 20 mm, notre système de capture n’est pas
efficace. C’est la raison pour laquelle notre CPUE diminue au cours du temps (Cf. Figure 17).
Nous avons très peu de stades supérieurs au stade de développement 5 (Cf. Figure 18).
0,0000 0,0050 0,0100 0,0150 0,0200 0,0250 0,0300 0,0350 21/0 2/06 28/0 2/06 07/03 /06 14/03 /06 21/03 /06 28/0 3/06 04/0 4/06 11/0 4/06 18/0 4/06 25/04 /06 02/05 /06 09/05 /06 Dates de prélèvements CPUE
0 50 100 150 200 250 300 350 400 450 0 1 2 3 4 5 6 7 8 9 Stades Effectifs 0 50 100 150 200 250 9 11 13 15 17 19 21 23 25 27 29 Tailles (mm) Effectifs
Figure 18 : Nombre total de larves pêchées par stades de développement et par taille
III.2.1. Structure en taille et stade de développement de la population de larves de corégone échantillonnées
Le figure 19 représentant le pourcentage des différents stades larvaires capturés pour chaque journée de prélèvement montre que les larves de stade 0 sont essentiellement pêchées jusqu’à la sortie 5. Les éclosions semblent donc se produire de fin février à fin mars. Les larves de stade 1 sont capturées à partir de la sortie 4, c'est-à-dire mi-mars. Ce résultat suggère un taux de croissance très faible le premier mois de vie larvaire. A partir de la sortie 9 (19 avril), ce sont les larves de stade larvaire 3 qui sont le plus présentes dans nos filets.
Figure 20 : Evolution de la distribution en taille des larves par dates de prélèvements (Représentation en Box plot)
La taille des larves capturées augmente au cours des campagnes d’échantillonnage (Cf.
Figures 20 et 21). Alors que des larves de taille de plus en plus grande sont pêchées, les larves de petite taille sont toujours représentées, ce qui explique l’étendue de la distribution des tailles de larves au fil des semaines. Malgré la forte plage de variation des tailles des larves lors de chaque
sortie, on note un accroissement significatif (Cf. Tableau 3) des tailles des larves capturées (Cf.
Figure 20).
Les tailles ont été comparées pour un intervalle d’une semaine en utilisant le test de Wilcoxon. Les résultats sont présentés dans le tableau 3.
07/03/06 30 40 50 0 10 20 07/03/06 0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100% N=43 N=43 15/03/06 0 10 20 30 40 50 N=66 15/03/06 0 10 20 30 40 50 60 70 80 90 100 N=66 22/03/06 0 10 20 30 40 50 60 70 80 90 100 N=85 22/03/06 0 10 20 30 40 50 N=85 29/03/06 0 10 20 30 40 50 N=185 29/03/06 0 10 20 30 40 50 60 70 80 90 100 N=185 05/04/06 0 10 20 30 40 50 N=125 05/04/06 0 10 20 30 40 50 60 70 80 90 100 N=124 12/04/06 0 10 20 30 40 50 N=235 12/04/06 0 10 20 30 40 50 60 70 80 90 100 N=226 19/04/06 0 10 20 30 40 50 60 70 80 90 100 N=202 19/04/06 0 10 20 30 40 50 N=203 26/04/06 0 10 20 30 40 50 N=160 26/04/06 0 10 20 30 40 50 60 70 80 90 100 N=157 03/05/06 0 10 20 30 40 50 N=61 03/05/06 0 10 20 30 40 50 60 70 80 90 100 N=61 10/05/06 0 10 20 30 40 50 9 12 14 17 19 22 24 27 29 Taile (en mm) N=51 Effectif (%) 10/05/06 0 60 70 80 90 100 0 1 2 3 4 5 6 7 8 9 10 Effe ctifs (%) 10 20 N=49 30 40 50 28
-Comparaison entre (n° de sortie) Valeur de la p-value Différence significative 7 mars / 15 mars (3/4) 0,4112 - 15 mars / 22 mars (4/5) 0 + 22 mars / 29 mars (5/6) 0 + 29 mars / 5 avril (6/7) 0,0039 + 5 avril / 12 avril (7/8) 0 + 12 avril / 19 avril (8/9) 0 + 19 avril / 26 avril (9/10) 0,0420 + 26 avril / 3 mai (10/11) 0,1686 - 3 mai / 10 mai (11/12) 0 +
Tableau 3 : Résultats du test de Wilcoxon (pour un risque α = 0,05) : comparaison des tailles à une semaine d’intervalle
Les résultats statistiques, calculés pour un intervalle d’une semaine, montrent que seules les sorties 3 et 4 et les deux avant dernières sorties (10 et 11) ont une différence de taille non significative avec un seuil de risque de 5%. Les larves grandissent donc significativement d’une
semaine sur l’autre (p<0,05, Wilcoxon). Pendant la semaine du 26 avril au 3 mai, la taille
moyenne des larves ne subit cependant pas un accroissement significatif (p>0,05, Wilcoxon). En
réalité le 3 mai, il y a eu une augmentation de l’abondance des larves de stades 2 et une
diminution de l’abondance des larves de plus grands stades (Cf. Figure 21). Ceci se traduit par un
plus grand nombre de petits individus pêchés. La taille moyenne pour cette sortie est donc plus petite que celle de la sortie précédente.
Période Différence de taille (mm) Taux de croissance (mm/j) Température moyenne du lac entre 0 et 5m (°C) 7 mars / 15 mars (3/4) 0,21 0,030 4,21 15 mars / 22 mars (4/5) 0,78 0,111 4,18 22 mars / 29 mars (5/6) 1 0,143 5,20 29 mars / 5 avril (6/7) 0,39 0,056 5,64 5 avril / 12 avril (7/8) 1,11 0,159 5,74 12 avril / 19 avril (8/9) 1,42 0,203 6,75 19 avril / 26 avril (9/10) 0,89 0,127 11,43 26 avril / 3 mai (10/11) -1 -0,143 12,48 3 mai / 10 mai (11/12) 3,16 0,451 12,28
Tableau 4 : Evolution du taux moyen de croissance journalier des larves et température moyenne de l’eau du lac
Le tableau 4 présente le taux moyen de croissance journalier des larves calculé entre deux journées de prélèvement, soit une semaine. Celui-ci est toujours positif, excepté entre les 26 avril et le 3 mai pour la raison expliquée précédemment. Aucune corrélation ne peut cependant être avancée entre le taux moyen de croissance journalier des larves et la température moyenne de l’eau.
0 1 2 3 4 5 6 7 8 9 5 10 15 20 25 30 Tailles (mm) Stades de développement
Figure 22 : Distribution de la taille des larves en fonction de leur stade de développement
On note une relation entre la taille des larves et leur stade de développement larvaire
(Cf. Figure 22). Les travaux de Luczynski et al. (1988), dont nous nous sommes servis pour la détermination des stades larvaires, confirment en effet une corrélation entre le stade de développement et la taille des larves plutôt qu’entre leur stade et leur âge.
Comparaison entre Valeur de la p-value Différence significative
stade 0 / stade 1 0 + stade 1 / stade 2 0 + stade 2 / stade 3 0,0021 + stade 3 / stade 4 0 + stade 4 / stade 5 0 + stade 5 / stade 6 0,4334 - stade 6 / stade 7 0,5822 - stade 7 / stade 8 0,3682 - stade 8 / stade 9 0,7671 -
Tableau 5 : Résultats du test de Wilcoxon (pour un risque α = 0,05)
Les résultats du test de Wilcoxon (Cf. Tableau 5) montrent que la différence de taille
entre les stades est significative (p<0,05, Wilcoxon) pour les plus jeunes stades (entre les stades 0
et 1, de même jusqu’aux stades 4 et 5). Pour les plus grands stades, les moyennes des tailles ne
sont pas significativement différentes d’un stade à l’autre (p>0,05, Wilcoxon). Le faible nombre
de larves de stades avancés dont nous disposions a cependant pu introduire un biais expliquant l’absence de différence significative entre ces stades successifs. Il se peut également que notre méthode d’échantillonnage ne permette de capturer que les petits individus de ces stades. Il est enfin possible que les larves ne grandissent plus de manière significative d’un stade à l’autre mais que leur croissance se poursuive en gagnant de la masse.
III.2.2. Otolithométrie
Lecture des otolithes
Seuls les otolithes des larves capturées à la sortie 12 (10 mai) ont été analysés. Quatre
otolithes par tête (les 2 sagitta et les 2 lapilli) ont été prélevés. Ils ont été placés par 2 (1 sagitta et
1 lapillus du même côté) sur une lame dans une goutte de résine. Au total, 134 otolithes ont été inclus appartenant à 38 larves.
L’étape la plus critique dans la préparation des otolithes est le ponçage. Seuls 68 otolithes au final ont pu être correctement dégagés de la résine sans avoir été abîmés par les mouvements d’usure (abrasion des primordia et de la strie d’éclosion). Un taux de réussite de 50% montre combien il est difficile de réussir le ponçage des otolithes. Cette difficulté vient essentiellement
du fait que les otolithes sont extrêmement petits (Cf. Figure 24).
a. b.
50μm
c.
100μm 100μm
Figure 23 : Photos d’otolithes de C. lavaretus (a. larve de stade 7 ; b. larve de stade 1 ; c. larve de stade 6)
Sur la photo a de la figure 23, nous pouvons observer l’un des deux sagittae d’une larve
de stade 7. La strie d’éclosion est relativement difficile à déterminer, les primordia sont
cependant visibles. La photo b de la figure 23 correspond à un sagittae d’une larve de stade 1.
Plusieurs primordia sont visibles et la strie d’éclosion se distingue bien mais on ne voit que
quelques stries (environ 2). En revanche, la photo c correspond à l’un des sagittae d’une larve de
stade 6. Les primordia, la strie d’éclosion et les structures d’accroissement sont ici très bien visibles.
Ces différentes photos montrent qu’il est également difficile de déterminer parfaitement les différentes structures de croissance d’un otolithe, et les résultats peuvent parfois varier d’un lecteur à un autre.
La lecture des otolithes nous a permis de définir l’âge des larves de différents stades. La relation entre l’âge et la taille de la larve apparaît linéaire (p-value < 0,005), de même pour la
relation entre l’âge et le stade de développement de la larve (p-value < 0,005) (Cf. Figure 24).
Aussi on observe que les larves de stade 1 ont un âge qui varie entre 3 et 5 jours. Les larves de stade 3 ont entre 13 et 19 jours, les larves de stade 4 entre 18 et 20 jours, les larves de stade 7 entre 21 et 31 jours et les larves de stades 9 sont âgées d’environ 40 jours.
y = 1,9028x - 19,757 R2 = 0,8672 0 10 20 30 40 50 10 15 20 25 30 35 Taille larves (mm) A g e lar ves (j o u rs) y = 3,5138x + 2,982 R2 = 0,761 0 10 20 30 40 50 0 2 4 6 8 Stade larves A g e l a rv e s ( jo u rs ) 10
Figure 24 : Relations entre l’âge des larves et leur taille et entre leur âge et leur stade de développement Relations entre taille des otolithes et taille des larves
A l’aide d’une caméra et d’un logiciel d’acquisition de l’image, nous avons mesuré la
taille de chaque otolithe (mesure de sa plus grande diagonale) (Cf. Figure 25). Des relations
entre taille de l’otolithe et taille de la larve ou stade de développement ont ensuite été tracées
(Cf. Figure 26).
y = 19,426x - 186,5 R2 = 0,8955 0 50 100 150 200 250 300 350 400 450 500 10 15 20 25 30 35 Taille larves (mm) T ai ll e sa g it tae ( µ m ) y = 37,573x + 40,161 R2 = 0,8239 0 50 100 150 200 250 300 350 400 450 500 0 2 4 6 8 1 Stade larves T ai ll e sag itt ae ( µ m ) 0
Figure 26 : Relations entre taille de l’otolithe et taille de la larve ou stade larvaire
La relation entre taille de l’otolithe et taille de la larve apparaît linéaire (p-value < 0,005), de même pour la relation entre taille de l’otolithe et stade de la larve (p-value < 0,005). Ces corrélations nous permettent alors de calculer par des rétrocalculs la taille de la larve à un jour
donné et ainsi de définir son taux de croissance pendant une période définie (Cf. Chap.III.2.3).
Mesure d’incréments journaliers et calcul du taux de croissance Les résultats apparaissent sur le graphique de la figure 27.
0 0,001 0,002 0,003 0,004 0,005 0,006 0,007 0,008 29/3 3/4 8/4 13/4 18/4 23/4 28/4 3/5 8/5 13/5 Dates Taux de croissance (m g/j) 0 2 4 6 8 10 12 14 16 Tem pérature (°C) Larve 12-1 Larve 12-41 Larve 12-19 Larve 12-3 Température moyenne
Figure 27 : Evolution du taux de croissance des larves et de la température de l’eau du lac au cours du temps
Nous comparons la dynamique de croissance de 4 larves ayant entre 26 et 40 jours. On s’aperçoit rapidement que leur taux de croissance augmente au cours du temps en fonction de l’augmentation de la température de l’eau. Les larves les plus âgées présentent des taux de croissance relativement constant en début de vie. A cette période, la température du lac était également relativement constante (6°C). Ce n’est que vers le 13 avril que le taux de croissance journalier augmente, date à laquelle on note une augmentation des températures. Chez les autres larves, nées après le 13 avril, le taux de croissance présente une tendance à