Impact des insectes du sol sur la disponibilité des
graines de pin gris et d'épinette noire après le passage
du feu
Mémoire
Francis Desjardins
Maîtrise en sciences forestières
Maître ès sciences (M.Sc.)
Résumé
Le pin gris (Pinus banksiana Lamb.) et l'épinette noire (Picea mariana Mill.) sont des conifères dominants dans le paysage forestier boréal québécois et ils possèdent des cônes adaptés leur permettant se régénérer efficacement après le passage du feu. L'impact des conditions de l'habitat après le feu sur la régénération est bien documenté, mais la consommation des graines reste peu étudiée. Afin d'évaluer la consommation des graines par les invertébrés et les vertébrés, des cages d'exclusion ont été installées dans quatre brûlis au nord de La Tuque suivant les feux de 2010. Nos résultats indiquent que les invertébrés sont responsables de la majorité de la consommation et que certaines espèces de carabes consomment les graines de pin gris ou d'épinette noire. Les résultats obtenus suggèrent que la consommation est une source importante de la mortalité des graines à un stade précoce de la régénération et peut nuire à son rétablissement.
Table des matières
Résumé ... iii
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... ix
Dédicaces ... xi Remerciements ... xiii Avant-propos ... xv Introduction générale... 1 Chapitre I ... 7 Résumé ... 9 Introduction ... 11
Matériel & méthodes ... 14
Aire d’étude ... 14
Évaluation de la consommation des graines dans les brûlis ... 14
Capture des insectes du sol ... 15
Analyses statistiques ... 16
Résultats ... 18
Évaluation de la consommation des graines dans les brûlis ... 18
Abondance relative des insectes du sol ... 18
Discussion ... 19 Remerciements ... 23 Références ... 25 Tableaux et figures ... 33 Chapitre II ... 43 Résumé ... 45 Introduction ... 47
Matériel & méthodes ... 48
Tests d’alimentation ... 48
Taille et qualité nutritive des graines de pin gris et d’épinette noire ... 48
Analyses statistiques ... 49
Résultats ... 50
vi
Références ... 57
Tableaux et figures ... 59
Conclusions ... 65
Liste des tableaux
Tableau 1.1: Identification et caractéristiques générales des brûlis à l'étude. ... 33 Tableau 1.2: Facteurs influençant la consommation des graines de pin gris et d'épinette noire par la guilde des vertébrés et des invertébrés dans quatre brûlis au nord de La Tuque. ... 34 Tableau 1.3: Effet de l'essence du peuplement d'origine et de la coupe de récupération dans quatre brûlis au nord de La Tuque sur l'abondance relative de trois familles de coléoptères et de deux sous-familles de fourmis. ... 35 Tableau 1.4: Liste des espèces de carabes capturées dans les brûlis de pin gris et d'épinette noire au nord de La Tuque aux étés 2011 et 2012. ... 36 Tableau 1.5: Résultats de l'analyse par PERMANOVA effectuée sur les communautés de carabes capturés aux étés 2011 et 2012 dans la région au nord de La Tuque. ... 37 Tableau 2.1: Taille moyenne et consommation quotidienne moyenne de graines de pin gris et d'épinette noire pour sept espèces de carabes (Coleoptera: Carabidae) en conditions contrôlées. ... 59 Tableau 2.2: Comparaison des concentrations (en ppm) de différents éléments nutritifs retrouvés dans les graines de pin gris et d'épinette noire pour des peuplements originaires du nord de la région du Saguenay-Lac-St-Jean. ... 60
Liste des figures
Figure 1.1: Localisation des quatre brûlis et des parcelles expérimentales dans la zone d'étude. ... 38 Figure 1.2: Répartition des cages d'exclusion et des pièges fosses dans une parcelle. ... 39 Figure 1.3: Comparaison du taux de consommation mensuel (30 jours) dans les brûlis attribuable aux
vertébrés et aux invertébrés par traitement et selon l'année d'exposition considérée. Les barres d'erreur illustrées sur le graphique représentent l'erreur type. ... 40 Figure 1.4: Comparaison du taux de consommation mensuel (30 jours) attribuable aux vertébrés et aux invertébrés en 2011 et 2012. Les lettres différentes représentent des différences significatives calculées avec la méthode lsmean à une valeur α=0.05. Les barres d'erreur illustrées sur le graphique représentent l'erreur type. ... 41 Figure 1.5: Abondance relative (nb insectes -nb pièges -jrs) et erreur type des familles de coléoptères et des sous-familles de fourmis considérées dans l'étude et capturées dans quatre brûlis au nord de La Tuque durant les étés 2011-2012 dans des peuplements brûlés de pin gris ou d'épinette noire récupéré ou non. Les barres d'erreur illustrées sur le graphique représentent l'erreur type. ... 42 Figure 2.1: Taux de consommation en fonction de la densité des graines d'épinette noire et de pin gris (6, 9 et 12 graines) sur une période de 24 heures pour sept espèces de carabes. Les lettres différentes représentent des différences significatives calculées avec la méthode lsmean et une valeur α=0.05. ... 61 Figure 2.2: Consommation des graines d'épinette noire et de pin gris (nb de graines)à trois densités (6, 9 et 12 graines) sur une période de 24 heures pour sept espèces de carabes. ... 62 Figure 2.3 : Quantité de graines d'épinette noire et de pin gris consommées par les individus de carabes par rapport à la médiane de leur taille selon le guide d'identification de Larochelle (1990)... 63
Dédicaces
Remerciements
Je tiens à remercier mon directeur, le Dr. Éric Bauce, pour toute la latitude qu'il m'a permis d'adopter dans l'élaboration et la réalisation de mon étude ainsi que pour tout le support logistique et financier qu'il m'a apporté durant ma maîtrise. Je souhaite également le remercier de m'avoir permis de participer et aider à l'organisation d'événements formateurs tels que les colloques iFor. Je remercie également mon co-directeur le Dr. Christian Hébert du service canadien des forêts de m'avoir ouvert les portes de son laboratoire (ÉcoDIF), ainsi que pour ses innombrables conseils, sa passion contagieuse pour la recherche et pour toutes les discussions que nous avons eues ensemble. Il est impossible de passer outre la participation du Dr. Richard Berthiaume dans la supervision de chacune des étapes de ma maîtrise, ainsi que sa présence dans les moments plus difficiles. Merci pour tes conseils, tes commentaires éclairant, nos discussions animées et ton support. Un merci spécial à Martin Charest: Merci pour tout!
Je souhaite aussi remercier tous les étudiants et les professionnels qui ont participé à la réalisation de mon projet: Maxime Brousseau, Pascal Charron, Mélanie «Nini» Couture, Julien Dessureault, Catherine Dion, Yves Dubuc, Claudie Lachance, Albert Paquet, George Pelletier, Guillaume Plante et Gabriel Roy. Je tiens spécialement à souligner et remercier Jonathan Boucher pour l'aide qu'il m'a apporté pour les analyses statistiques sur R.
Merci aussi aux employés du centre de foresterie des Laurentides pour leur aide, ainsi qu'aux étudiants du laboratoire ÉcoDIF pour l'ambiance détendue et joviale au laboratoire, ainsi que pour l'aide et les conseils: Jean-Michel Béland, Sébastien Bélanger, Jonathan Boucher, Yannick Breton, Olivier Jeffrey, Olivier Norvez et Xavier Prairie. Je garde mes derniers remerciements pour mes amours Marie-Claude et Ainhoa, ainsi que ma famille et mes amis pour m'avoir encouragé et supporté durant cette période de mon cheminement académique.
Avant-propos
Ce mémoire de maîtrise se divise en deux chapitres intitulés «La consommation des graines de pin gris et d'épinette noire par les insectes du sol dans les brûlis» et «Consommation des graines de pin gris et d'épinette noire par sept espèces de carabes (Coléoptères: Carabidae)». La sélection des sites, la mise en place du dispositif expérimental, l'échantillonnage et les expérimentations en laboratoire ont été exécutés par le candidat à la maîtrise, avec l'aide d'un auxiliaire de recherche ou d'un technicien, selon les circonstances. L'étudiant a également participé à l'identification des insectes et fait les analyses statistiques, à l'exception des données pour les tests d'alimentations qui ont nécessité l'apport du service de consultation statistique de l'Université Laval. Le candidat a tout de même analysé et interprété les données. La rédaction des chapitres a été entièrement réalisée par le candidat, avec les conseils et la collaboration des coauteurs Richard Berthiaume, Christian Hébert et Éric Bauce. L'étudiant a ainsi le statut d'auteur principal pour les deux chapitres de ce mémoire.
Cette étude a été financée par le consortium de recherche iFor et a reçu le soutien matériel et technique du service canadien des forêts, appartenant à Ressources Naturelles Canada (SCF-RNCan).
Introduction générale
La forêt boréale canadienne est soumise au régime des feux depuis des milliers d'années (Filion et al., 1991) et la récurrence des feux de forêt varie d'une décade à quelques siècles sur l'ensemble du territoire (Bergeron et al., 2001; Heinselman, 1973; Rowe et Scotter, 1973; Ryan, 2002; Wagner, 1978). Le passage du feu détruit les végétaux, favorise la transformation des éléments organiques du sol en éléments nutritifs pour les végétaux (Brais et al., 2000; Hart et Chen, 2006), fragmente le paysage forestier (Kafka et al., 2001), permet le renouvèlement des peuplements (Hart et Chen, 2006; Lesieur et al., 2002) et sa fréquence module la composition du couvert forestier (Bergeron et Dubuc, 1989; Lesieur et al., 2002). Le feu ouvre aussi le couvert forestier permettant la croissance des espèces végétales intolérantes à l'ombre (Hart et Chen, 2006). Le pin gris (Pinus banksiana Lamb.) et l'épinette noire (Picea mariana (Mill.) B.S.P.) sont des conifères dominants dans le paysage forestier boréal québécois (Rowe et Scotter, 1973) et ils ont dû s'adapter au régime des feux pour assurer leur pérennité. Le pin gris et l'épinette noire ont respectivement développé des cônes sérotineux et semi-sérotineux, permettant de conserver des graines viables dans l'arbre pendant plusieurs années et s'ouvrant sous la chaleur intense dégagée par le feu (Chai et Hansen, 1952; Chrosciewicz, 1960; Lamont et al., 1991; Wilton, 1963), ce qui permet aux arbres de régénérer un peuplement après le passage du feu (Greene et al., 1999; St-Pierre et Gagnon, 1991).
Le succès de régénération du peuplement dépend au départ de la quantité et de la viabilité des graines libérées suite au passage du feu puisqu'elles représentent le potentiel de régénération (Cavers, 1983). L'épinette noire peut débuter sa production de cônes vers l'âge de 10 ans (Burns et Honkala, 1990; Caron et Powell, 1989; Doucet et al., 2009) et atteindra sa production maximale entre 50 et 200 ans (Black et Bliss, 1980; Burns et Honkala, 1990; Doucet et al., 2009), alors que le pin gris peut commencer à produire des cônes entre 5 et 10 ans lorsqu'il se trouve en peuplement ouvert (Burns et Honkala, 1990) et sa production sera optimale après l'âge de 25 ans (Doucet et al., 2009). En plus de l'âge des arbres dans le peuplement, la quantité de graines produites et disponibles pour la dissémination par ces deux essences dépend de la densité du peuplement (Burns et Honkala, 1990; Greene et al., 1999; Johnstone et al., 2009), sa localisation sur un gradient altitudinal (Gauthier et al., 1993; Johnstone et al., 2009; Sirois, 2000), les caractéristiques du site (Simpson et Powell, 1981; Todhunter et Polk, 1981), la disponibilité en eau, la température durant la saison de croissance (Black et Bliss, 1980; Houle et Fillion, 1993) et la latitude à laquelle se trouve le peuplement (Black et Bliss, 1980; Despland et Houle, 1997; Sirois, 2000). L'année joue aussi un rôle puisqu'il existe une périodicité dans la quantité de graines produites de 3 à 4 ans chez le pin gris et de 2 à 6 ans chez
2
des graines annuellement en absence de feu, mais en moindre quantité, soit entre environ 6,6 mille à 26 mille graines par hectare (Burns et Honkala, 1990). L'épinette noire peut produire des graines jusqu'à l'âge de 200 à 250 ans (Burns et Honkala, 1990; Haavisto, 1975), alors que le pin gris atteint la sénescence vers l'âge de 150 ans (Doucet et al., 2009).
Puisque la quantité de graines disséminées dépend de plusieurs facteurs (Greene et Johnson, 1999; Johnstone et al., 2009), il est difficile de prédire la densité de graines qu'un peuplement donné libérera après le passage du feu (de Groot et al., 2004; Johnstone et al., 2009). La littérature rapporte que les peuplements d'épinette noire peuvent libérer entre un 0,5 et 4,2 millions de graines par hectare (Burns et Honkala, 1990; Greene et al., 2004; Haavisto, 1975), alors qu'un peuplement de pin gris peut disséminer entre 0,6 à 6,3 millions de graines par hectare dans les populations portant des cônes sérotineux (de Groot et al., 2004; Greene et al., 2004).
Avec plusieurs milliers à plusieurs millions de graines disséminées à l'hectare, le succès de régénération semble assuré. Toutefois les graines contenues dans les cônes ne sont pas toutes viables (Despland et Houle, 1997; Haavisto, 1975; Houle et Fillion, 1993), ce qui réduit le nombre de graines pouvant participer à la régénération. La proportion de graines viables dépend de l'âge des cônes (Haavisto, 1975; Lamont et al., 1991) et elle diminue avec l'âge de ces derniers (Chai et Hansen, 1952; Haavisto, 1975; Lamont et al., 1991). La viabilité des graines contenues dans les cônes du pin gris et de l'épinette noire varie d'une étude à l'autre, mais relativement peu de graines viables sont disponibles dans les arbres pour la dissémination. Chez l'épinette noire, la viabilité des graines varie entre 10 et 50% (Haavisto, 1975; Haavisto et al., 1988; Johnstone et al., 2009; Sirois, 2000; Stoehr et Farmer, Jr., 1986), alors que pour le pin gris, la viabilité est de 40 à 68% (de Groot et al., 2004). L'effort investit dans la reproduction (c.-à-d. la production de pollen, de graines et de cônes) engendre des coûts en terme de ressources qui ne seront plus disponibles pour la croissance et la défense des arbres. Ainsi un individu ayant accès à suffisamment de ressources pourra en investir davantage dans la reproduction (Bazzaz et al., 1987). La viabilité des graines dans les cônes est donc affectée par des facteurs influençant l'état de santé des arbres tels que des conditions météorologiques favorables (c.-à-d. températures mensuelles élevées et précipitation suffisantes) lors des phases de pollinisation et de maturation des cônes chez le pin gris (Despland et Houle, 1997; Houle et Fillion, 1993), ou des caractéristiques de site adéquates comme la pente et l'élévation (Johnstone et al., 2009; Todhunter et Polk, 1981). À la limite nordique de répartition des essences, la production de graines viables dépend davantage de la température moyenne mensuelle ou du bilan thermique puisque ces facteurs limitent la maturation des graines s'ils sont insuffisants (Black et Bliss, 1980; Despland et Houle, 1997; Sirois et Payette, 1991; Sirois, 2000).
La chaleur émise par un feu de forêt permet l'ouverture des cônes du pin gris et de l'épinette noire et libère les graines qu'ils contiennent (Chai et Hansen, 1952; Chrosciewicz, 1960; Lamont et al., 1991; Wilton, 1963). Il a été démontré pour le pin gris que la vitesse d'ouverture des cônes dépend de la température émise par le brasier (Beaufait, 1960; Johnson et Gutsell, 1993), mais qu'une exposition prolongée à des températures excédant 70°C peut enflammer les cônes (Johnson et Gutsell, 1993) et qu'une minute suffit pour brûler un cône à une température d'environ 370°C (Beaufait, 1960). L'extraction en laboratoire des graines dans les cônes de pin gris s'effectue à une température de 60°C pour une période de 12 heures (Beaufait, 1960), alors que les graines d'épinette noire sont extraites à une température de 40°C sur une période de 20 heures (Haavisto et al., 1988). Ces températures sont donc suffisantes pour permettre l'ouverture des cônes de ces deux essences. L'impact des feux de cimes sur la mortalité des graines contenues dans les cônes sérotineux n'est pas très bien documenté, mais certains auteurs attribuent en partie au brûlage des cônes la faible régénération observée après le passage du feu (Arseneault, 2001; Turner et al., 1997). Pour le pin gris, l'exposition aux flammes peut tuer les graines suite à une exposition de 10 à 30 secondes, selon la température du brasier (Beaufait, 1960; de Groot et al., 2004). Dans le cas des feux de cimes, les graines devant assurer la régénération proviendraient des branches suffisamment hautes pour éviter aux cônes d'être brûlés (de Groot et al., 2004).
La chaleur libérée par le feu n'est toutefois pas une condition sine qua non à la libération des graines du pin gris et de l'épinette noire (Gauthier et al., 1993; Haavisto, 1975). Une fraction des cônes semis-sérotineux de l'épinette noire s'ouvrent chaque année à la mi-avril (Burns et Honkala, 1990; Burns, 1983; Haavisto, 1978), alors que le pin gris possède simultanément des cônes sérotineux et non-sérotineux (Burns et Honkala, 1990; Burns, 1983; Gauthier et al., 1993). Chez le pin gris, le degré de sérotinité varie dans les populations plus au sud et augmente avec la maturité de l'arbre (Burns et Honkala, 1990; Burns, 1983; Gauthier et al., 1996, 1993). Le degré de sérotinité dépend aussi de l'exposition du peuplement aux feux sévères, puisque ce dernier est une source de sélection pour la sérotinité (Flannigan et Wotton, 1994; Gauthier et al., 1996, 1993). La dissémination de graines en l'absence de feu est donc possible, mais le passage du feu permet la libération massive et synchrone de graines dans tout le peuplement brûlé, semblable au phénomène de dissémination de masse observé chez d'autres espèces végétales (Koenig et Knops, 1998; Ostfeld et Keesing, 2000). La dissémination de masse est une stratégie permettant la libération simultanée de graines à l'échelle d'un peuplement en quantité suffisante pour assurer le rétablissement du peuplement, saturant à la fois les consommateurs et favorisant ainsi la survie d'un plus grand nombre de graines au sol (Koenig et Knops, 1998; Lamontagne et Boutin, 2007; Ostfeld et Keesing, 2000).
4
noire (Wilton, 1963). La pluie de graine se poursuit jusqu'à deux ou trois ans après le passage du feu (Charron et Greene, 2002; St-Pierre et Gagnon, 1991). Les graines libérées par le passage du feu sont dispersées aux grés du vent sur une distance dépendante de la hauteur de l'arbre et de la vitesse du vent (Greene et Johnson, 2000, 1996; Haavisto, 1975). Ainsi pour une hauteur moyenne de 14 mètres, Greene et Johnson (2000) estiment la distance médiane parcourue par les graines de pin gris à 35 mètres, alors que Haavisto (1975) estime la distance de dispersion des graines de l'épinette noire à 40 mètres en moyenne. Les graines ne survivent pas plus d'un an au sol après leur dissémination (Thomas et Wein, 1985) et l'établissement de la régénération de ces deux essences s'effectue principalement (95 à 97%) au cours des trois années suivant le passage du feu (St-Pierre et Gagnon, 1991).
Durant l'année suivant le passage du feu, la mortalité de graines (c.-à-d. la non germination des graines viables) est très importante (Charron et Greene, 2002). En effet, Sirois (1993) rapporte que sur une période de 13 mois, seulement 0,4% des graines de pin gris et 0,2% des graines d'épinette noire ont réussi à germer sur un sol minéral exposé suite à un feu expérimental dans le nord du Québec. Le sort des graines disséminées dépend beaucoup du stress hydrique (Greene et al., 1999; Herr et Duchesne, 1995; Thomas et Wein, 1985), lui même influencé par la nature du substrat dans lequel les graines atterrissent (Greene et al., 2007; Mallik et al., 2010). Le feu affecte le paysage forestier, ainsi que le sol de manière hétérogène à l'échelle du brûlis (Greene et al., 2007, 2005; Kafka et al., 2001) et crée une variété de microsites de qualité variable pour la germination des graines de pin gris et d'épinette noire (Greene et al., 2007, 2005, 2004). De manière générale, le sol minéral tel que celui exposé par un feu sévère est considéré comme un bon substrat de germination (Charron et Greene, 2002; Chrosciewicz, 1976, 1974; Fleming et Mossa, 1994; Greene et al., 2004; Herr et Duchesne, 1995; Weber et al., 1987), toutefois une mince couche de matière organique entre 0,5 et 5,0 cm d'épaisseur (Chrosciewicz, 1974; Fleming et Mossa, 1994; Greene et al., 2007) ou un lit de mousse ou de sphaigne semblent préférables ou d'égale qualité (Charron et Greene, 2002; Greene et al., 2004). Le retrait des cendres par les intempéries et la croissance d'un couvert de mousse sur le sol brûlé par un feu sévère offre de meilleurs lits de germination pour le pin gris et l'épinette noire après une période de 2 ans (Kemball et al., 2006). L'augmentation de la qualité des lits de germination deux ans après le passage du feu suggère donc que la survie et la germination des graines soient meilleures après cette période. Le succès de régénération du pin gris et de l'épinette noire dépend ainsi du passage du feu et de la manière dont il influence l'environnement forestier (Desponts et Payette, 1992; Kafka et al., 2001; Kemball et al., 2006; Sirois, 1993).
La manière dont le feu affecte l'environnement forestier dépend de sa sévérité (c.-à-d. une mesure qualitative de l'impact du feu sur l'environnement), de son intensité (c.-à-d. une mesure quantitative de l'énergie libérée par le brasier) et des caractéristiques du peuplement d'origine (Greene et al., 2004; Kafka et al., 2001; Malcom
et Hunter, 1993; Ryan, 2002). Toutefois, de manière pratique, on utilise davantage la mesure de la sévérité comme indicateur de l'impact du feu sur le paysage forestier puisqu'il s'agit d'une échelle bâtie sur l'observation des dégâts engendrés par le feu. Le feu accélère aussi le recyclage des éléments organiques en éléments absorbables pour les plantes (Brais et al., 2000). La régénération du pin gris et de l'épinette noire bénéficie aussi de l'élimination par le feu de la végétation compétitrice qui peut entraver la croissance des jeunes semis (Bell et al., 2000; Chrosciewicz, 1976; Johnston, 1975). L'ouverture du couvert avantage d'avantage le pin gris, puisqu'il s'agit d'une essence pionnière et les semis nécessitent beaucoup de lumière pour croitre (Burns, 1983; Burns et Honkala, 1990). L'action du feu sur l'habitat offre donc en principes des conditions de germination adéquates, sinon idéales, pour la régénération naturelle du pin gris et de l'épinette noire.
Les graines de pin gris germent en général en 15 à 60 jours lorsque les conditions sont favorables (Burns, 1983; Burns et Honkala, 1990), alors que les graines de l'épinette noire peuvent survivre de 10 à 16 mois (Fraser, 1976), mais leur survie diminue rapidement après la dissémination (Wilton, 1963). Une fois au sol, les graines sont susceptibles d'être consommées par divers types d'organismes et le succès de régénération peut être entravé par cette consommation (Hulme, 1998; Nystrand et Granström, 2000; Ordóñez et Retana, 2004). Il a été démontré que les rongeurs peuvent nuire à la régénération de l'épinette blanche en forêt boréale (Peters et al., 2004). Cette relation a également été observée chez d'autres conifères et dans d'autres types d'habitats (Hulme, 1998, 1994; Whelan et al., 1991; Zwolak et al., 2010). Les insectes sont aussi d'importants consommateurs des graines au niveau du sol (Hulme, 1998; Zhang et al., 1997) et certaines espèces de carabidés peuvent consommer des graines de plusieurs espèces (Honek et al., 2011, 2007). Nystrand et Granström (2000) attribuent 81% de la consommation des graines aux carabes dans les peuplements de pin sylvestre (Pinus sylvestris L.) suite à des coupes partielles ou totales en Suède. Un taux de consommation des graines d'épinette noire par les invertébrés de 9 à 19% a été obtenu dans des peuplements d'épinette noire au Québec (Côté et al., 2005). Les oiseaux sont aussi reconnus pour être des consommateurs de graines de conifères et leur contribution à la mortalité des graines peut aussi nuire au rétablissement de la régénération (Nystrand et Granström, 2000; Ordóñez et Retana, 2004). Plusieurs études ont été réalisées sur la consommation des graines post-dispersion et les oiseaux, les rongeurs, les fourmis et les carabes sont les principaux responsables de cette consommation (Côté et al., 2005; Cromar et al., 1999; Gibson, 1993; Hulme, 1998; Nystrand et Granström, 2000; Ordóñez et Retana, 2004; Reader et Beisner, 1991; Ruhren et Dudash, 1996; Zhang et al., 1997). Toutefois la recherche sur l'influence de la consommation sur la régénération des graines par divers organismes en forêt boréale québécoise reste limitée (Côté et al., 2005).
6
invertébrés de celle attribuable aux vertébrés. De plus, dans ce premier chapitre l'impact des coupes de récupération après le passage du feu sur la consommation est également testé par rapport aux brûlis non récupérés. Le deuxième chapitre vise à déterminer si les espèces de carabes capturées en forêt boréale consomment des graines de pin gris et d'épinette noire et quelle quantité de graines les individus d'une espèce donnée consomment quotidiennement en fonction de la densité de ces dernières. Les résultats obtenus permettront d'évaluer l'impact de la consommation des graines sur la régénération naturelle des peuplements de pin gris et d'épinette noire par les différentes types d'organismes en plus d'identifier des espèces de carabes capables de consommer des graines de ces deux essences.
Chapitre I
Consommation des graines de pin gris et d'épinette
noire par les vertébrés et les invertébrés dans les
brûlis.
Francis Desjardins1, Richard Berthiaume1, Christian Hébert2 et Éric Bauce1.
1. Université Laval, Faculté de foresterie, de géographie et de géomatique, Pavillon Abitibi-Price,
Québec, Québec, G1K 7P4, Canada.
2. Natural Resources Canada, Canadian Forest Service, Laurentian Forestry Centre, 1055 du
P.E.P.S., P.O. Box 10380, Stn. Sainte-Foy, Québec (Québec), G1V 4C7, Canada.
Résumé
Le pin gris (Pinus banksiana Lamb.) et l'épinette noire (Picea mariana (Mill.) B.S.P.) possèdent des cônes adaptés au passage du feu, ce qui leur permet de bien se régénérer après un incendie forestier. Malgré cette adaptation, il arrive que la régénération soit insuffisante après un feu. L'impact des différentes conditions de l'habitat après l'incendie sur l'établissement la régénération est bien documenté, mais la consommation des graines reste peu étudiée. Afin d'évaluer l'impact de la consommation des graines par les vertébrés et les invertébrés, des cages d'exclusion ont été installées en 2011 au nord de La Tuque dans quatre brûlis de 2010. Nos résultats indiquent que les invertébrés sont responsables de la majorité de la consommation des graines de pin gris et d'épinette noire. La consommation est une source importante de mortalité des graines à un stade précoce du rétablissement des peuplements et peut donc nuire à leur remise en productivité.
Introduction
Le succès d'établissement de la régénération du pin gris (Pinus banksiana Lamb.) et de l'épinette noire (Picea
mariana (Mill.) B.S.P.) après le passage du feu dépend de la quantité de graines disponibles dans le
peuplement, de leur viabilité (de Groot et al., 2004; Sirois, 2000) et de leur survie une fois libérées des cônes (Cavers, 1983; Charron et Greene, 2002). Certains insectes du sol consomment des graines après la dispersion de celles-ci et peuvent nuire au rétablissement de la régénération (Côté et al., 2005; Hulme, 1998; Louda, 1982; Nystrand et Granström, 2000; Ordóñez et Retana, 2004; Zhang et al., 1997). De plus, les coupes de récupérations effectuées après le passage des incendies forestiers diminuent l'apport en graines dans le peuplement en récoltant les tiges brûlées semencières (Greene et al., 2006; Keyser et al., 2009), bien que cet effet de la récupération puisse être mitigée en laissant sur le parterre de coupe les cimes coupées, donc des cônes (Doucet et al., 2000). La récupération du bois brûlé modifie aussi l'habitat au profit de certaines espèces d'insectes du sol (Koivula et Spence, 2006; Phillips et al., 2006) et dont l'impact sur la régénération reste méconnu en Amérique du nord (Côté et al., 2005; Hulme, 1998; Nystrand et Granström, 2000; Zhang et al., 1997). Afin de mieux comprendre la dynamique de régénération des peuplements de pin gris et d'épinette noire après le passage du feu, il est nécessaire d'évaluer l'influence de la consommation sur la mortalité des graines, ainsi que les facteurs qui pourraient l'influencer.
Le pin gris et l'épinette noire sont des conifères prédominants du paysage forestier boréal de l'est du Canada (Rowe et Scotter, 1973). Ces deux essences évoluent dans des régions souvent perturbées par le passage du feu (Bergeron et al., 2001; Filion et al., 1991; Heinselman, 1973; Rowe et Scotter, 1973; Wagner, 1978) et en conséquence, elles ont développées des stratégies pour s'adapter à cette problématique et ainsi assurer leur pérennité (Greene et al., 1999; Lamont et al., 1991; Weber et al., 1987; Wilton, 1963). Les cônes sérotineux du pin gris et les cônes semi-sérotineux de l'épinette noire permettent de conserver des graines viables plusieurs années dans la banque aérienne et de régénérer les peuplements après le passage du feu en libérant les graines sous l'effet de la chaleur (Chai et Hansen, 1952; Chrosciewicz, 1960; Lamont et al., 1991; Wilton, 1963). En plus de favoriser l'ouverture des cônes, le feu favorise la régénération du pin gris et de l'épinette noire en créant des lits de germination adéquat (Charron et Greene, 2002; Chrosciewicz, 1976, 1974; Fleming et Mossa, 1994; Greene et al., 2004; Herr et Duchesne, 1995; Weber et al., 1987), en supprimant la régénération compétitrice (Bell et al., 2000; Chrosciewicz, 1976; Johnston, 1975) et en permettant à la lumière d'atteindre le sol en brûlant le couvert forestier (Burns, 1983; Burns et Honkala, 1990;
12
Les problèmes de régénération favorisent un remplacement du couvert forestier boréale par une composition divergente à celle attendue, ainsi qu'un sous-recrutement de l'essence d'origine (Bergeron et Dansereau, 1993; Payette et Delwaide, 2003; Sirois et Payette, 1991). Pour l'aménagement forestier, une régénération naturelle insuffisante pose aussi problème, puisque le sous-recrutement impose le reboisement artificiel du territoire brûlé. Les opérations de reboisement en forêt boréale effectuées au Québec visent une densité de 2000 tiges à l'hectare et sont généralement précédées par le scarifiage du peuplement après la coupe de récupération du bois brûlé (Thiffault et al., 2003a), ce qui augmente les coûts d'exploitation du territoire d'environ 800$/ha (Greene et al., 2006). La technique de scarifiage consiste a labourer le sol après la coupe de récupération, permettant l’exposition de l'horizon minéral et l'élimination de la végétation compétitrice, offrant ainsi un lit de croissance adéquat pour les semis du pin gris et de l'épinette noire qui seront plantés par la suite (Hille et Ouden, 2004; Thiffault et al., 2003b). Les opérations de récupération suite au passage du feu permettent de limiter les pertes de matière ligneuse. Toutefois, la récupération du bois brûlé dans les peuplements de pin gris et d'épinette noire retire les tiges semencières et diminue l'apport en graines dans le brûlis, ce qui entrave le mécanisme de régénération naturelle (Greene et al., 2006; Keyser et al., 2009). Il est donc économiquement avantageux de laisser la régénération naturelle s’établir lorsque les conditions favorisent une densité de semis suffisante pour le rétablissement du peuplement d'origine. Toutefois, la décision opérationnelle d'intervenir ou de laisser la nature faire son œuvre nécessite une connaissance fine des conditions favorables à l'établissement de la régénération naturelle.
Les études réalisées afin d'expliquer le faible recrutement du pin gris et de l'épinette noire après le passage du feu ont évalué l'impact des conditions du peuplement avant le passage du feu (Greene et al., 1999; Greene et Johnson, 1999; Johnstone et al., 2009), la viabilité et la quantité de graines (Haavisto, 1975; Todhunter et Polk, 1981), les caractéristiques du feu (Weber et al., 1987) ou du lit de germination (Chrosciewicz, 1960; Greene et al., 2007, 2005, 2004), ainsi que la survie et la germination des graines (Cavers, 1983; Greene et al., 2007; Hulme, 1998; Wilton, 1963). D'autres études ont aussi permis de déterminer que la consommation des graines par les rongeurs, les oiseaux et les invertébrés augmente le taux de mortalité à un stade précoce de l’établissement et nuit au rétablissement des peuplements perturbés (Côté et al., 2005; Hulme, 1998; Nystrand et Granström, 2000; Zhang et al., 1997). L'impact de la consommation des graines par différents groupes d'organismes est donc un phénomène connu, mais reste peu étudié en Amérique du Nord.
Les fourmis et les carabes sont les principaux insectes étudiés au niveau de la consommations des semences post-dispersion (Côté et al., 2005; Cromar et al., 1999; Gibson, 1993; Hulme, 1998; Nystrand et Granström, 2000; Ordóñez et Retana, 2004; Reader et Beisner, 1991; Ruhren et Dudash, 1996; Zhang et al., 1997). Toutefois, les espèces d'insectes consommatrices des semences forestières après le passage du feu sont peu étudiées en Amérique du Nord. Pourtant, il est possible d'observer une grande variété d'insectes dans les
peuplements brûlés (Moretti et al., 2004; Muona et Rutanen, 1994) et la composition des communautés d'insectes dans les peuplements est modifiée par le passage du feu (McCullough et al., 1998; Saint-Germain et al., 2005; Wikars et Schimmel, 2001) et par les coupes de récupération du bois brûlé (Saint-Germain et al., 2005). Plusieurs taxons d’insectes du sol associés aux feux récents (Boulanger et al., 2010) peuvent être a
priori considérés comme des consommateurs potentiels de graines et de semis dans la forêt boréale (Côté et
al., 2005; Hulme, 1998). Ainsi, Côté et al. (2005) ciblent les carabes et les fourmis en se basant sur les mœurs de ces insectes dans d’autres pays (Andersen, 1991, 1987; Hulme, 1998; Nystrand et Granström, 2000; Zhang et al., 1997). La raison de la présence de ces insectes dans les brûlis reste spéculative, mais la disponibilité ponctuelle et abondante de ressources pourrait l'expliquer. Le pin gris et l'épinette noire libèrent leurs graines immédiatement après le passage du feu (Beaufait, 1960; Wilton, 1963) et la régénération s'installe principalement dans les trois années suivantes (Charron et Greene, 2002; St-Pierre et Gagnon, 1991). Il est donc probable que certaines espèces d'insectes vivants au niveau du sol profitent de l'abondance de nourriture laissée par le passage du feu. Il est donc possible que certaines espèces d'insectes du sol soient consommatrices des graines de pin gris et d'épinette noire et que ces espèces soient responsables, du moins en partie, des anomalies de régénération. Côté et al. (2005) estiment la consommation des graines d'épinette noire par les invertébrés du sol de deux à cinq ans après le passage du feu entre 9 et 19% et lient ce taux de consommation à l'abondance d'individus de Pterostichus adstrictus (Eschscholtz) et de Pterostichus
punctatissimus (Randall) (Coléoptères: Carabidae) dans différents types de peuplements incendiés d'épinette
noire. Or des individus de cette famille sont responsables d'une consommation de 81% des graines dans les peuplements de pin sylvestre, ainsi que dans les coupes partielles et totales en Suède (Nystrand et Granström, 2000).
La présente étude vise à (1) déterminer l'impact de la consommation des graines de pin gris et d'épinette noire par les insectes du sol versus les vertébrés et (2) déterminer si les coupes de récupération influencent positivement la consommation des graines par les insectes du sol en favorisant leur présence dans les parterres de coupes.
14
Matériel & méthodes
Aire d’étude
L’étude a été menée en Haute Mauricie (Figure 1.1) à la limite sud de la zone boréale, dans le domaine de la sapinière à bouleau blanc. Au début de l'été 2011, quatre peuplements brulés récupérés et non-récupérés de pins gris et d’épinettes noires ont été sélectionnés dans quatre brûlis distincts suivant les feux de 2010 afin de quantifier l’influence du type de peuplement et de la récupération sur la consommation des graines et l’abondance des insectes du sol.
Les brûlis sélectionnés étaient localisés dans des peuplements matures (plus de 70 ans) et avaient une superficie supérieure à 5 600 ha (Tableau 1.1). Des peuplements brûlés respectant les critères d'essence, d'âge, d'intensité sévère du feu et de coupe ont d'abord été identifiés à l'aide du logiciel ArcGIS et des cartes écoforestières fournies par le Ministère des Ressources Naturelles du Québec, puis validés sur le terrain. La sévérité du feu a été réévaluée sur le terrain pour chacun des sites entre sévèrement à moyennement brûlés, selon l’échelle de Key et Benson (Lutes et al., 2006). Les mêmes peuplements ont aussi été étudiés l'année suivante.
Évaluation de la consommation des graines dans les brûlis
La consommation des graines de pin gris et d’épinette noire a été évaluée dans les différents peuplements en 2011 et 2012, en exposant dans les brûlis des groupes de dix graines de pin gris ou d’épinette noire dans des plats remplis de terre. Dans chaque parcelle, 30 plats contenant 10 graines chacun de l'essence associée au brûlis ont été enfouis au niveau du le sol et disposés sur trois colonnes espacées de 5 mètres (Figure 1.2). Afin de s'assurer de la proximité génétique des graines utilisées dans l'expérimentation par rapport aux peuplements à l'étude, les graines fournies par le Centre de semences forestières de Berthier provenaient de la région du Saguenay-Lac-St-Jean.
Les plats contenant les graines ont été fabriqués à partir de tuyaux de PVC blanc de 7,5 cm de diamètre par 3 cm de hauteur et munis d’un fond de géotextile (Vitalium™). La terre utilisée pour dissimuler les graines était un mélange commercial (MPV ProMix™) de tourbe contenant 10% de perlite. Pour quantifier la consommation des graines par les vertébrés et les invertébrés, 20 plats par parcelle ont été recouverts par l'un des deux types de cages d’exclusion. Ces cages permettaient d’exclure l’accès aux graines à certains types de consommateurs en se basant sur leur taille (Auld et Denham, 1999; Hulme et Borelli, 1999; Hulme et Hunt, 1999; Ordóñez et Retana, 2004). Un premier type de cage d’exclusion limitait uniquement l’accès aux vertébrés. Ces cages de 10 cm de diamètre par 20 cm de hauteur étaient construites à partir d'un grillage de
métal galvanisé (1 cm x 1 cm). Le second type de cage d’exclusion limitait l’accès aux vertébrés ainsi qu'aux invertébrés afin d'évaluer la mortalité naturelle, mais provenant de sources autres que les consommateurs. Ce type de cage était constitué d’une cage d’exclusion pour les vertébrés (métal galvanisé de 1 cm x 1 cm), recouverte d’une moustiquaire en aluminium à mailles fines (0,1 cm). Les deux types de cages d'exclusion étaient placés au-dessus des plats contenant les graines afin de limiter l'accès à la ressource alimentaire. Afin de quantifier la consommation globale (i.e. par tous les types d'organismes), 10 plats ont été laissés sans aucune protection. L’attribution du type de protection pour chaque plat a été effectuée aléatoirement pour chacune des 16 parcelles expérimentales.
Chaque année, des graines ont été exposées durant deux périodes. En 2011, de la mi-juin à la mi-juillet (39 jours) et de la mi-juillet à la fin août (29 jours) et en 2012, de la fin mai à la mi-juillet (69 jours) et de la mi-juillet à la mi-septembre (58 jours). À la mi-juillet de chaque année, les échantillons de terre contenant les graines ont été récupérés, puis renouvelées avec de la nouvelle terre et de nouvelles graines de la même essence. Les échantillons de terre ainsi récupérés ont été ramenés au laboratoire dans des sacs Ziplock™. Le contenu des sacs a été transféré dans des plats de plastique transparents de 16 onces (DM16r-solo, les emballages L.Boucher Inc.), puis placé dans des chambres de croissance en condition de germination (humidité relative 80%; 22ºC; luminosité 16J:8N). Lors de l'arrosage quotidien, chacun des échantillons a été observé et les semis ayant germés ont été comptabilisés, puis éliminés. Les observations ont été poursuivies jusqu'à ce qu'il n'y ait plus de germination durant une période de deux semaines consécutives.
La détermination du taux de germination a permis de calculer un taux de mortalité pour les différentes essences forestières en fonction des différents traitements. Le taux de mortalité inhérent à l'expérimentation (mortalité d'origine inconnue obtenue dans les cages protégées de l'ensemble des consommateurs) a été appliqué pour corriger les taux de consommation obtenus pour chaque parcelle. De cette manière, on distingue la consommation apparente de la consommation effective (Pluke et al., 2008; Stansly et al., 1997). L'estimation des taux de consommation effectifs attribuables aux invertébrés et ceux attribuables aux vertébrés ont été calculés indépendamment pour chacune des parcelles. Le taux de consommation exprimé sur une base quotidienne a été utilisé pour effectuer les tests statistiques.
Capture des insectes du sol
L'abondance relative des insectes du sol dans les différents brûlis a été évaluée avec des pièges fosses (Multipher I) afin de détecter des variations dans la présence d'espèces potentiellement consommatrices des
16
micromammifères et d'amphibiens. Les pièges fosses contenaient 30 ml de propylène glycol en 2011 et, pour des raisons de disponibilité de produit, 150 ml d’éthanol-vinaigre (éthanol 40%; vinaigre 5%) en 2012. Afin de suivre l’évolution temporelle des assemblages d’espèces présentes, les récoltes des pièges fosses ont été effectuées à toutes les deux semaines de la mi-juin à la fin août en 2011 et de la fin mai à la mi-septembre en 2012.
Lors des récoltes, le contenu des pièges fosses a été transféré dans des pots de récoltes de 150 ml contenant une solution d’éthanol à 70%. Une fois au laboratoire, les échantillons ont été entreposées dans une chambre froide à 4ºC, avant d’être triés sous une loupe binoculaire. Lors du tri, uniquement les coléoptères et les fourmis ont été conservés et seulement les individus appartenant aux familles des élatéridés, curculionidés et carabidés ont été dénombrés. De plus, seulement les carabidés ont été identifiés au niveau de l’espèce. Les fourmis ont été identifiées au niveau de la sous-famille (Formicinae et Myrmicinae). L'ensemble des spécimens d'insectes appartenant aux groupes retenus pour l'étude a été entreposé au laboratoire ÉcoDIF au centre de foresterie des Laurentides (Ressources Naturelles Canada).
Analyses statistiques
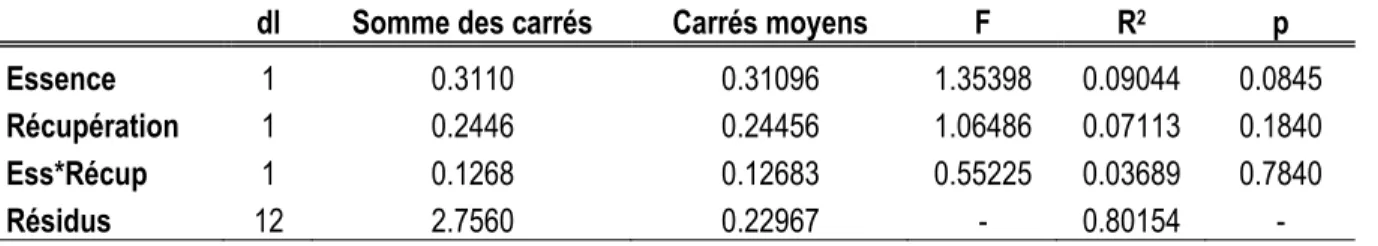
Les données de l'expérience visant à évaluer l'impact des vertébrés et des invertébrés sur la consommation des graines dans les brûlis ont été traitées avec la procédure GLIMMIX (SAS 9.3) afin de vérifier si l'essence du peuplement brûlé et la récupération de ce dernier avaient un effet sur le taux de consommation des graines. Puisque la durée des périodes d'exposition des graines dans les brûlis varie, le taux de consommation a été ramené à un taux quotidien. Le type de données suggère a priori une distribution binomiale. La procédure GLIMMIX a été utilisée puisqu'elle convient à l'analyse des données suivant une distribution de la famille des exponentielles (ex.: binomiale, poisson, bêta ou gamma) (Schabenberger, 2005). Le modèle initial programmé dans le logiciel SAS considère donc que les données suivent une distribution binomiale.
Le modèle teste les effets de l'essence du peuplement et de la coupe de récupération, du type de consommateurs et de l'année d'exposition et les possibles interactions entre les différents facteurs. Toutefois, l'observation des résidus de ce modèle a révélé une hétérogénéité des variances. Afin d'éviter la transformation des données et faciliter ainsi l'interprétation de celles-ci, la distribution Bêta a été retenue pour la modélisation des données de consommation des graines de pin gris et d'épinette noire dans les brûlis. L'énoncé de programmation LSMEANS (SAS 9.3) a ensuite permis de déterminer entre lesquels des facteurs l'écart observé était significatif (Schabenberger, 2005).
L'abondance relative des coléoptères capturés à l'aide des pièges fosse a été évaluée pour chaque famille préalablement identifiées et pour chaque sous-famille de fourmis. La moyenne d'individus capturés par piège et par jour a été utilisée pour mesurer l'abondance relative des insectes du sol. Cette mesure permet de corriger pour des pièges renversés ou détruits et les inégalités du nombre de jours entre chaque récolte. De plus, les effets de brûlis et d'année de récolte ont été contrôlés par l'énoncé de programmation "random". Les données ont été analysées avec l'aide du progiciel nlme, (Pinheiro et al., 2013) disponible avec le logiciel R 3.0.1.
À partir de ce modèle, une ANOVA a permis de déterminer s'il y avait un effet de l'essence du peuplement ou de la récupération sur l'abondance relative de chacun des groupes. Puisque cette analyse indique une hétérogénéité des variances, nous avons exécuté l'analyse des variances pour chacune des familles d'insectes à l'étude afin de cibler les facteurs responsables de cette hétérogénéité. Cette méthode nous a permis d'exécuter une nouvelle ANOVA en tenant compte qu'une variable peut avoir une plus grande variance. De cette manière, l'impact des variables ciblées sur l'abondance d'un groupe d'insectes est pris en considération dans le calcul de l'ANOVA et permet ainsi de déceler l'effet d'une variable qui aurait autrement été occulté par la variabilité trop forte d'une autre variable (Warton et al., 2012). Ainsi, la famille des Carabidae a nécessité un contrôle de la variance pour l'essence, les Curculionidae, les Formicinae et les Myrmicinae pour l'effet combiné de l'essence et de la récupération et les Elateridae pour la récupération.
L'effet de l'essence du peuplement brûlé et de la récupération sur l'assemblage des communautés de carabes capturés dans les pièges fosses a été analysé à l'aide d'une analyse de la variance par permutation (PERMANOVA; Anderson et al., 2001). La PERMANOVA a été effectuée avec l'indice de dissimilarité de Bray-Curtis du progiciel vegan (R 3.0.1). Afin de limiter l'effet des espèces rares ou surabondantes sur l'assemblage général, les données ont été normalisées par rapport au maximum de chaque espèce, puis ont subi une transformation de Hellinger (Legendre et Gallagher, 2001). Lorsque la valeur p de la PERMANOVA était significative, une Analyse d'homogénéité de groupes par permutation (PERMDISP; Anderson et al., 2006) a été effectuée avec la procédure BETADISPER du progiciel vegan.
Une analyse de régression a également été effectuée pour vérifier si l'abondance de certains groupes d'insectes dans les pièges fosse pouvait expliquer une partie de la disparition des graines exposées dans les différents traitements. L'abondance relative, telle que décrite précédemment, des carabes et des fourmis a été utilisée comme variable explicative de la consommation observée pour chaque traitement. L'analyse a été réalisée avec l'aide du progiciel nlme, (Pinheiro et al., 2013) disponible avec le logiciel R 3.0.1.
18
Résultats
Évaluation de la consommation des graines dans les brûlis
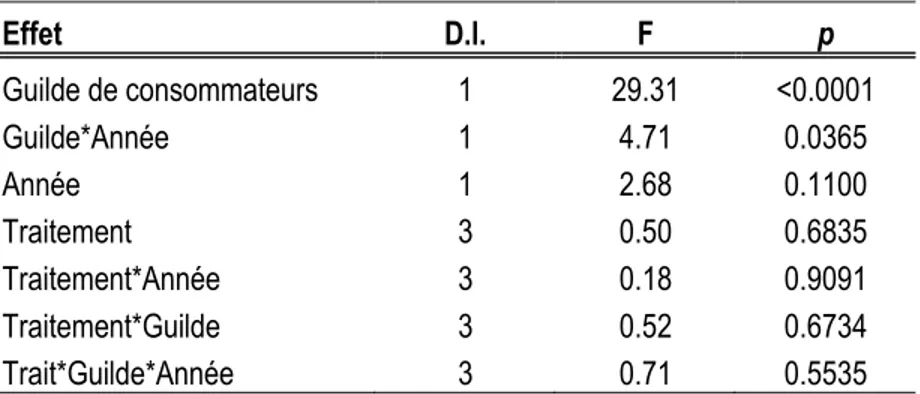
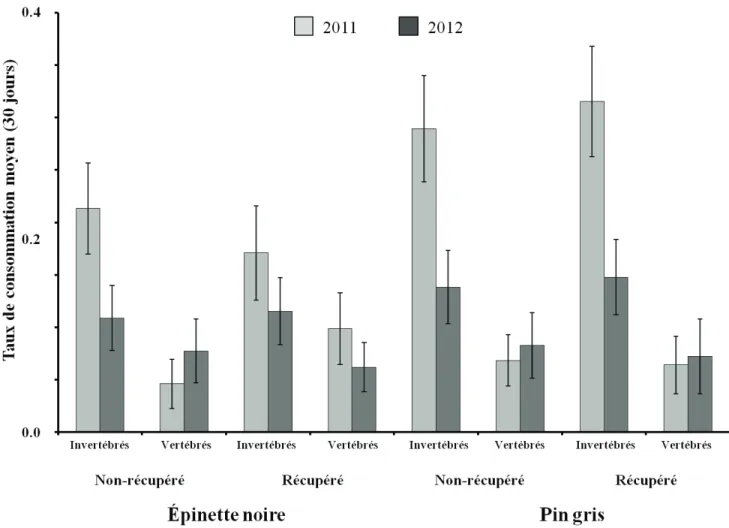
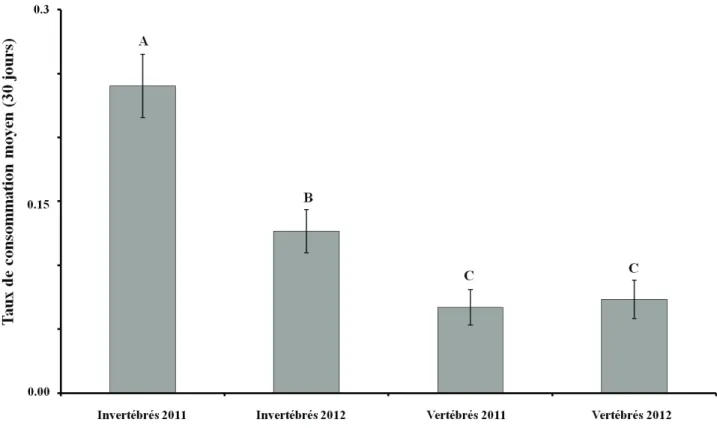
Le taux de consommation mensuel (période de 30 jours) associé aux invertébrés varie de 10.9 à 31.5% et est toujours supérieur à celui associé aux vertébrés qui varie de 4.6 à 9.9% (Figure 1.3). On observe un effet significatif du types de consommateurs sur le taux de consommation (F=29,31; dl=1; p<0.0001), ainsi qu'un effet combiné du types de consommateurs et de l'année d'exposition (F=4.71; dl=1; p=0.0365) (Tableau 1.2). En réalité, la consommation par les invertébrés est supérieure en 2011 comparativement à 2012, alors que la consommation par les vertébrés est constante entre les deux années (F=4,71; dl=1; p=0.7607) (Figure 1.4).
Abondance relative des insectes du sol
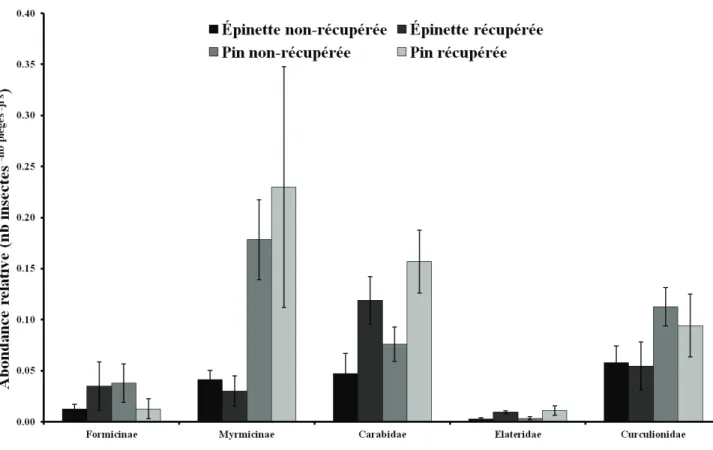
Au total, 1239 fourmis et 5191 coléoptères ont été capturés dans les pièges fosses durant les étés 2011 et 2012. Chez les fourmis, la sous-famille des Myrmicinae était la plus abondante avec 84% des captures (1041 individus), alors que la sous-famille des Formicinae représentait 16% des captures (198 individus). Seulement trois familles de coléoptères ont été conservées et dénombrées (1541 individus) pour les analyses: les Elateridae (n=54), les Curculionidae (n=661) et les Carabidae (n=826) (Figure 1.5).
Un effet significatif de la récupération a été observé pour l'abondance relative des Carabidae (F=10,41; dl=1; p=0,0073) et des Elateridae (F=6,85; dl=1; p=0,0225) (Figure 1.5 et Tableau 1.3). Chez les Carabidae et les Elateridae la récupération du peuplement favorise l'abondance de ces deux familles, alors qu'aucune tendance n'est détectée pour les Curculionidae (Figure 1.5). Pour les Myrmicinae, un effet significatif du type de peuplement forestier est observé (F=23,67; dl=1; p=0,0009) (Figure 1.5). Cette sous-famille de fourmis est nettement plus abondante dans les peuplements de pin gris que dans les peuplements d'épinette noire. Aucun effet significatif n'a été décelé pour la sous-famille des Formicinae (Tableau 1.3).
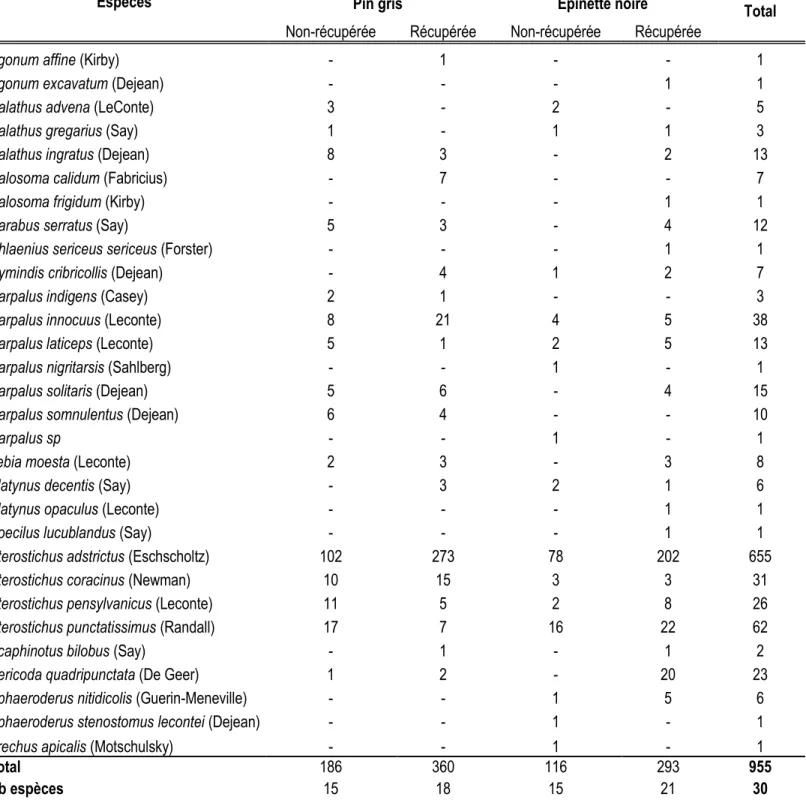
Trente espèces de carabes ont été capturées dans les différents brûlis et Pterostichus adstrictus est nettement l'espèce dominante dans la présente étude avec 79.3% des captures (Tableau 1.4). Six espèces de carabes ont été capturées dans tous les traitements (Harpalus innocuus, Harpalus laticeps, Pterostichus adstrictus,
Pterostichus coracinus, Pterostichus pensylvanicus et Pterostichus punctatissimus) et il y a toujours plus
d'espèces de carabes capturées dans les peuplements récupérés comparativement aux peuplements non-récupérés (Tableau 1.3). Par ailleurs, l'analyse PERMANOVA ne révèle aucun effet significatif entre les différents traitements sur l'assemblage des Carabidae dans les brûlis (Tableau 1.5). Toutefois, l'analyse révèle que Pterostichus adstrictus (p=0.005) et Sericoda quadripunctata (p=0.015) sont associées aux parcelles récupérées.
Discussion
Notre étude a permis de déterminer que les invertébrés peuvent consommer mensuellement près de 25% des graines de pin gris et d'épinette noire l'année suivant le passage du feu et la moitié moins (12%) l'année subséquente, alors que les vertébrés ne consomment en moyenne que 7% des graines pour les mêmes périodes. Nos résultats sont cohérents avec les résultats de Côté et al. (2005, 2003) qui ont observés des taux de consommation variant entre 9 à 19% pour les invertébrés et entre 1,4 à 6,2% pour les vertébrés des graines d'épinette noire dans les brûlis pour des périodes d'expositions d'un peu moins un mois.
La consommation par les invertébrés diminue environ de moitié le deuxième été après le passage du feu comparativement au premier été, alors que la consommation par les vertébrés demeure stable entre les deux années. La détection des graines par les vertébrés peut être ardue à cause de la couleur des graines de pin gris et d'épinette noire par rapport à celle du substrat (sol minéral ou mousse brûlée), ainsi que leur petite taille et ces facteurs pourraient expliquer l'écart de consommation observé entre les deux guildes. De plus, le gain nutritionnel apporté par la consommation des graines n'est peut-être pas suffisamment rentable pour justifier un effort de recherche plus intensif par les vertébrés. Puisque la régénération commence à s'établir rapidement après le feu (Ahlgren, 1960; Charron et Greene, 2002; Schimmel et Granström, 1996; St-Pierre et Gagnon, 1991), elle offre aux insectes des sources d'alimentation alternatives (Hart et Chen, 2006; Jonsen et Fahrig, 1997). Les carabes et les fourmis capturés dans les parcelles à l'étude ont pu diversifier leur alimentation ou délaisser les graines de pin gris ou d'épinette noire en faveur d'une ou plusieurs autres sources d'alimentation (ex. pollen, champignons ou autres invertébrés), selon leurs besoins (Behmer, 2009; Bernays et Minkenberg, 1997; Cook et al., 2010; Jonsen et Fahrig, 1997; Raubenheimer et Jones, 2006). La disponibilité de diverses sources alimentaires aurait fait diminuer le taux de consommation des graines de pin gris et d'épinette noire en faveur d'autres aliments offrant un gain nutritionnel plus intéressant.
Dans la présente étude, les graines des deux essences forestières sont consommées dans les mêmes proportions, malgré que les graines de pin gris soient environ trois fois plus grosses que celles des graines d'épinette noire. De plus, la récupération des peuplements n'affecte pas à court terme le taux de consommation des graines. Cependant, les coupes de récupération sont effectuées rapidement après le passage du feu afin d'éviter la dégradation de la qualité des tiges par les longicornes (Bélanger et al., 2013). Bien que les tiges récoltées aient libéré la plus forte densité de graines dans les jours suivant l'incendie, (Chai et Hansen, 1952; Desponts et Payette, 1992; Johnson et Gutsell, 1993), la pluie de graines se poursuit jusqu'à
20
consommation, principalement réalisée par les invertébrés, conjuguée à une réduction de l'apport en graines suite aux coupes de récupération pourrait entraver le rétablissement de la régénération naturelle du peuplement d'origine et pourrait expliquer l'occurrence de certaines anomalies de régénération (Charron et Greene, 2002; Côté et al., 2005).
Le feu a pour impact immédiat de diminuer l'abondance des carabes et des fourmis de manière importante (Andersen et Yen, 1985; Punttila et Haila, 1996; Saint-Germain et al., 2005). À court terme, le passage du feu génère des milieux ouverts favorables à certaines espèces de carabes (Punttila et Haila, 1996; Saint-Germain et al., 2005), ainsi qu'à la diversité des fourmis en éliminant les espèces de fourmis dominantes dans l'habitat d'origine et en permettant la colonisation de celui-ci par des espèces moins agressives (Andersen et Yen, 1985; Punttila et Haila, 1996). Les coupes de récupération subséquentes augmentent elles aussi l'abondance des carabes et profitent aux espèces associées aux habitats ouverts ou perturbés (Koivula et Spence, 2006; Phillips et al., 2006). Incidemment, nos résultats montrent un accroissement des populations de carabes dans les peuplements récupérés. Les coupes de récupération n'ont cependant pas affecté l'abondance des fourmis. Les Myrmicinae, la sous-famille de fourmis la plus abondante dans notre étude, sont nettement plus abondantes dans les peuplements de pin gris comparativement aux peuplements d'épinette noire. Dans la zone boréale québécoise, les fourmis s'établissent dans les sols minéral sablonneux et dans les milieux partiellement à totalement ouverts (Francœur, 2001), ce qui est caractéristique des pinèdes grises (Burns et Honkala, 1990).
Malgré les variations observées dans l'abondance relative des carabes et des fourmis dans les différents peuplements, aucune de ces variations n'a pu être corrélée avec les variations du taux de consommation des graines de pin gris ou d'épinette noire. Pourtant, ces deux familles d'insectes sont considérées comme d'importants consommateurs de graines dans divers milieux (Côté et al., 2005; Hulme et Borelli, 1999; Nystrand et Granström, 2000; Ordóñez et Retana, 2004). Par contre, toutes les espèces de carabes et de fourmis ne consomment pas nécessairement des graines de pin gris ou d'épinette noire. Sur 1055 espèces nord-américaines de carabes recensées, environ 73% seraient carnassières, 19% seraient omnivores et seulement 8% seraient phytophages (Larochelle, 1990). Parmi ces espèces de carabes phytophages, les tribus Harpalini et Zabrini dont font partie les genres Harpalus et Amara sont principalement considérées comme des granivores non-exclusifs (Arnett, 2000; Kotze et al., 2011). La sélection d'une variété de graine comme source d'alimentation par une espèce de carabe dépend de plusieurs facteurs, dont la forme de la graine, sa dureté et sa valeur nutritive (Jorgensen et Toft, 1997; Kotze et al., 2011; Lundgren et Rosentrater, 2007). Près du tiers des espèces de carabes capturées durant notre étude (9 espèces sur 30) font partie des tribus Harpalini ou Zabrini et trois autres espèces appartiennent à la tribu des Pterostichini (Poecilus
Thomas, 2001)) ont été confirmées comme des consommatrices des graines de pin gris et d'épinette noire (Chapitre II). Cependant, le manque d'information sur les habitudes alimentaires des carabes et des fourmis en forêt boréale ne permet pas d'identifier toutes les espèces consommatrices des graines de pin gris et d'épinette noire.
La consommation par la guilde des vertébrés atteint une valeur pouvant être jusqu'à quatre fois inférieure à celle observée pour les invertébrés. Le cryptisme est une stratégie permettant à un organisme d'éviter la prédation en adoptant une couleur semblable à l'environnement dans lequel il se trouve. Cette stratégie permet à environ 20% des graines de Pinus halepensis (Miller) (Saracino et al., 2004) et environ 60% des graines de P.sylvestris en forêt boréale (Nystrand et Granström, 1997) d'éviter la consommation post-dispersion par les oiseaux dans des brûlis en Suède. Les graines de P. halepensis possèdent un côté pâle et un foncé, ce qui révèle une adaptation pour la couleur des graines selon que les graines soient dispersées après le passage du feu ou non (Lev-Yadun et Ne’eman, 2013). Ainsi, puisque les graines de pin gris sont grises foncées et celles d'épinette noire pratiquement noires et que les graines des deux essences sont petites, les graines sont difficilement détectables sur un sol minéral ou sur de la mousse brûlée. De plus, les ailes des graines utilisées ont été retirées, ce qui réduit leur taille et ainsi leur détectabilité.
Les rongeurs dépendent principalement de leur odorat pour trouver leur nourriture et peuvent trouver les graines dissimulées sur et dans le sol (Howard et Cole, 1967; Vander Wall, 1998). Bien que leur l'abondance diminue drastiquement après le passage du feu (Crête et al., 1995; Sullivan et al., 1999), certaines espèces généralistes, telle que la souris sylvestre (Peromyscus maniculatus Wagner), sont retrouvées dans les brûlis (Crête et al., 1995; Fisher et Wilkinson, 2005; Nappi et al., 2011, 2010; Sullivan et al., 1999). Au Québec, on estime que la diète des souris (Peromyscus sp.) se compose jusqu'à 52% de graines d'épinette noire au début de l'été et que cette proportion atteint 35% à la fin de l'été (Côté et al., 2003). Les rongeurs utilisant les brûlis se nourrissent d'autres sources que les graines et semblent dépendre de la disponibilité de celles-ci dans le temps. De plus, il a été observé que la consommation des graines de petite taille (≤9,1mg) (Vander Wall, 2003) sont davantage consommées que les graines de plus grande taille (Moles et al., 2003; Reader, 1993; Vander Wall, 2003, 1994; Willson et Whelan, 1990). Les graines plus volumineuses seraient plus faciles à détecter et procureraient un plus grand gain nutritif, les rendant ainsi plus attrayante pour les vertébrés (Moles et al., 2003; Willson et Whelan, 1990).
Dans un contexte des brûlis, la mortalité post dispersion des graines de pin gris et d'épinette noire engendrée par la consommation attribuable aux invertébrés est deux fois plus importante que celle attribuable aux
Remerciements
Je tiens particulièrement à remercier les étudiants et les stagiaires qui m'ont aidé lors de la réalisation et de la mise en place du dispositif sur le terrain. Merci à Pascal Charron, Julien Dessureault, Yves Dubuc, Claudie Lachance, Albert Paquet et Gabriel Roy pour avoir travaillé avec autant d'enthousiasme et de célérité, même dans les moments plus difficiles.
Je souhaite aussi remercier tous les étudiants et les professionnels qui m'ont accompagné lors de mes sorties sur le terrain ou lors des longues heures de travail au laboratoire: Maxime Brousseau, Mélanie «Nini» Couture, Catherine Dion, Yves Dubuc, Albert Paquet, George Pelletier, Guillaume Plante et Gabriel Roy. Je tiens spécialement à souligner la participation et à remercier Jonathan Boucher pour l'aide qu'il m'a apporté pour les analyses statistiques sur R.
Merci aussi aux employés de soutien du centre de foresterie des Laurentides pour leur aide, ainsi qu'aux membres de l'équipe du laboratoire de génétique pour leur conseils concernant la germination des graines de pin gris et d'épinette noire. Merci aux étudiants du laboratoire ÉcoDIF pour l'ambiance détendue et joviale au laboratoire, ainsi que pour l'aide et les conseils: Jean-Michel Béland, Sébastien Bélanger, Jonathan Boucher, Yannick Breton, Olivier Jeffrey, Olivier Norvez et Xavier Prairie.
Références
Ahlgren, C.E., 1960. Some effects of fire on reproduction and growth of vegetation in northeastern Minnesota. Ecology 41, 431–45.
Andersen, A.N., 1991. Responses of ground-foraging ant communities to three experimental fire regimes in a savanna forest of tropical Australia. Biotropica 23, 575–585.
Andersen, A.N., 1987. Effects of seed predation by ants on seedling densities at a woodland site in SE Australia. Oikos 48, 171–174.
Andersen, A.N., Yen, A.L., 1985. Immediate effects of Ore on ants in the semi-arid mallee region of north-western Victoria. Aust. J. Ecol. 10, 25–30. doi:10.1111/j.1442-9993.1985.tb00860.x
Anderson, D.R., Link, W.A., Johnson, D.H., Burnham, K.P., 2001. Suggestions for presenting the results of data analysis. J. Wildl. Manag. 65, 373–378.
Anderson, M.J., Ellingsen, K.E., McArdle, B.H., 2006. Multivariate dispersion as a measure of beta diversity. Ecol. Lett. 9, 683–693. doi:10.1111/j.1461-0248.2006.00926.x
Arnett, R.H., 2000. American insects: a handbook of the insects of America north of Mexico, 2nd ed. ed. CRC Press, Boca Raton, Fla., 1003 pages.
Arnett, R.H., Thomas, M.C. (Eds.), 2001. American beetles, 1st ed. CRC Press, Boca Raton, Fla., 464 pages. Arseneault, D., 2001. Impact of fire behavior on postfire forest development in a homogeneous boreal
landscape. Can. J. For. Res. 31, 1367–1374. doi:10.1139/cjfr-31-8-1367
Auld, T.D., Denham, A., 1999. The role of ants and mammals in dispersal and post-dispersal seed predation of the shrubs Grevillea (Proteaceae). Plant Ecol. 144, 201–213.
Bazzaz, F.A., Chiariello, N.R., Coley, P.D., Pitelka, L.F., 1987. Allocating resources to reproduction and defense. BioScience 37, 58–67.
Beaufait, W.R., 1960. Some effects of high temperatures on the cones and seed of jack pine. For. Sci. 6, 194– 199.
Behmer, S.T., 2009. Insect herbivore nutrient regulation. Annu. Rev. Entomol. 54, 165–187. doi:10.1146/annurev.ento.54.110807.090537
Bélanger, S., Bauce, É., Berthiaume, R., Long, B., Labrie, J., Daigle, L.-F., Hébert, C., 2013. Effect of temperature and tree species on damage progression caused by whitespotted sawyer (Coleoptera: Cerambycidae) larvae in recently burned logs. J. Econ. Entomol. 106, 1331–1338.
doi:10.1603/EC12372
Bell, F.W., Ter-Mikaelian, M.T., Wagner, R.G., 2000. Relative competitiveness of nine early-successional boreal forest species associated with planted jack pine and black spruce seedlings. Can. J. For. Res. 30: 790–800.
Bergeron, Y., Dansereau, P.-R., 1993. Predicting the composition of Canadian southern boreal forest in different fire cycles. J. Veg. Sci. 4, 827–832. doi:10.2307/3235621
Bergeron, Y., Dubuc, M., 1989. Succession in the southern part of the Canadian boreal forest. Vegetatio 79, 51–63.
Bergeron, Y., Gauthier, S., Kafka, V., Lefort, P., Lesieur, D., 2001. Natural fire frequency for the eastern Canadian boreal forest: consequences for sustainable forestry. Can. J. For. Res. 31, 384–391. doi:10.1139/cjfr-31-3-384
Bernays, E.A., Minkenberg, O.P.J.M., 1997. Insect herbivores: different reasons for being a generalist. Ecology 78, 1157–1169.
Black, R.A., Bliss, L., 1980. Reproductive Ecology of Picea mariana (MILL.) BSP., at Tree Line near Inuvik, Northwest Territories, Canada. Ecol. Monogr. 50, 331–354.