Le CD34 dans la réactivité du système respiratoire
en contexte d’asthme allergique
Mémoire
Katherine Lortie
Maîtrise en médecine expérimentale
Maître ès sciences (M.Sc.)
Québec, Canada
III
Résumé
L’asthme allergique est caractérisé par une inflammation, un remodelage bronchique et une hyperréactivité bronchique (HRB). L’infiltration de fibrocytes, précurseurs des cellules musculaires lisses (CML) et exprimant le CD34, participe à l’hyperplasie du muscle lisse, cause potentielle de l’HRB. Cependant, l’expression du CD34 sur les CML ainsi que son rôle dans leur contraction et la réactivité du système respiratoire (SR) n’ont jamais été étudiés. L’objectif principal de ce projet était d’étudier le rôle du CD34 sur la contractilité des CML et la réactivité du SR dans l’asthme. Une perte de réactivité a été observée chez les souris Cd34-/- dans un modèle d’asthme. Celle-ci n’est pas reliée à une différence de la
capacité contractile des CML en l’absence du CD34. Elle semble plutôt influencée par une altération des éléments non-contractiles tels que la production de mucines. Bref, cette étude a permis d’étudier l’importance de l’expression du CD34 dans le développement de l’HRB.
V
Abstract
Allergic asthma is a chronic pulmonary disorder characterized by airway inflammation, airway remodeling and airway hyperresponsiveness (AHR). Hyperplasia of smooth muscle cells (SMCs) (potential mechanism of AHR) is influenced by CD34+ fibrocytes, which are known as smooth muscle precursors. However, CD34 expression on SMCs and its role on SMCs contractility have never been studied. The principal aim of this thesis was to study the role of CD34 on SMCs contractility and airway reactivity in the context of allergic asthma. In a mouse model of allergic asthma, a loss of airway reactivity was observed in sensitized Cd34-/- mice, which was not caused by alterations in the contractile capacity of
SMCs. Instead, non-contractile elements (such as mucin production) seemed to be involved in this phenotype. Briefly, this study shows the importance of CD34 expression in the development of AHR associated with asthma.
VII
Table des matières
Résumé ... III Abstract ... V Liste des tableaux ... IX Liste des figures ... XI Liste des abréviations ... XIII Remerciements ... XV Avant-propos ... XVII
INTRODUCTION ... 1
Chapitre 1 : L’asthme ... 1. Importance et définition générale ... 1
2. Facteurs de risques et différents types d’asthme ... 4
3. La cascade allergique dans l’asthme ... 6
4. Le remodelage et les changements structuraux associés à l’asthme ... 8
4.1 Altération de l’épithélium bronchique ... 9
4.2 La fibrose sous-épithéliale ... 10
4.3 L’angiogenèse vasculaire ... 11
4.4 L’augmentation de volume du muscle lisse ... 11
5. L’hyperréactivité des voies respiratoires et l’asthme allergique ... 13
Chapitre 2 : Le muscle lisse ... 15
1. Le muscle lisse en général ... 17
1.1 Les marqueurs typiques des cellules musculaires lisses ... 18
1.2 La contraction du muscle lisse ... 19
2. Le muscle lisse dans l’asthme ... 20
2.1 Différences d’expression protéique chez les CML de patients asthmatiques ... 22
2.2 Contractilité du muscle lisse chez des CML de patients asthmatiques ... 22
Chapitre 3 : Le CD34 ... 25
1. Les sialomucines et la famille du CD34 ... 27
2. La molécule du CD34 ... 27
3. Les fonctions du CD34 ... 29
VIII
2.2 Molécule d’adhésion chez les HEV ... 30
2.3 Molécule antiadhésive (téflon moléculaire) ... 30
4. Rôles du CD34 dans les pathologies inflammatoires ... 31
Chapitre 4 : Les modèles animaux et l’étude de l’asthme ... 35
1. Différentes espèces de souris ... 37
2. Différents modes d’administration de l’allergène et types d’allergène ... 37
3. Modèle d’asthme aigu versus asthme chronique ... 39
Chapitre 5 : Problématique, hypothèse et objectifs ... 41
1. Problématique ... 43
2. Hypothèse ... 45
3. Objectifs ... 45
Chapitre 6 : Insertion d’article ... 47
ABSTRACT ... 51 METHODS ... 55 RESULTS ... 59 DISCUSSION ... 63 FIGURE LEGENDS ... 67 REFERENCES ... 71 FIGURES ... 75
Chapitre 7 : Discussion et conclusion ... 81
1. L’expression du CD34 sur le muscle lisse ... 83
2. Le CD34 et la réactivité du système respiratoire ... 84
2.1 Le CD34 et la capacité contractile du muscle lisse ... 84
2.2 Le CD34 et la capacité contractile du muscle lisse en contexte inflammatoire... 85
2.3 Le CD34 et la production de mucus (élément non-contractile) ... 86
3. Conclusion ... 88
IX
Liste des tableaux
Tableau 1 4
Exemples de traitements actuellement utilisés pour contrôler l’asthme allergique
Tableau 2 6
Les différents facteurs de risque associés au développement de l’asthme
Tableau 3 21
XI
Liste des figures
Figure 1 5
Bronche saine vs bronche asthmatique
Figure 2 9
La cascade allergique dans l’asthme
Figure 3 10
L’évolution de l’asthme : de l’inflammation au remodelage
Figure 4 11
Les altérations typiques des bronches suite au remodelage dans l’asthme
Figure 5 15
Diminution du volume expiratoire maximal en 1 seconde à des doses croissantes de métacholine
Figure 6 22
La contraction du muscle lisse
Figure 7 23
Le muscle lisse participe aux trois composantes de la pathologie de l’asthme
Figure 8 29
Les membres des sialomucines : CD34
Figure 9 34
XIII
Liste des abréviations
α-sma : (Alpha) Actine du muscle lisse
Cd34-/- : Souris dont l’expression du gène CD34 a été abolie
CML : Cellules musculaires lisses
FCεR1 : Récepteur à haute affinité pour le fragment Fc des IgE GPCR : Récepteurs à protéines G
HRB : Hyperréactivité bronchique
HDM : Poudre d’acariens, Dermatophagoides pteronyssinus HEV : Veinule de l’endothélium à haute spécificité
IgE : Immunoglobuline de type E IL: Interleukine
LIF: Facteur inhibiteur de la leucémie
MLCK : Kinase de la chaîne légère de la mysosine sm22: Transgeline
sm-MHC II : Chaîne lourde de la myosine-II du muscle lisse TGF : Facteur de croissance transformant
Th : Lymphocyte T auxiliaire
TLSP : Lymphopoïétine stromale thymique TNF : Facteur de nécrose tumorale
VEGF : Facteur de croissance des cellules endothéliales vasculaires VR: Volume résiduel
XV
Remerciements
Effectuer une maîtrise a été pour moi une étape enrichissante. Elle m’a appris à être patiente, puisque ça ne fonctionne pas toujours du premier coup. Cette expérience m’a aussi permis de pousser ma compréhension au plan technique et théorique de mon sujet. Bref, mes 2 années de maîtrise ont été une démarche scientifique parsemées de hauts et de bas. Sans le soutien de plusieurs dont mes directeurs de recherche, les scientifiques du centre de recherche, les membres du laboratoire, ainsi que mes amis et ma famille, cette maîtrise n’aurait pu s’accomplir.
Je tiens tout d’abord à remercier ma directrice de recherche la Dre Marie-Renée Blanchet, pour la formation qu’elle a su m’inculquer. Au commencement j’avais tout à apprendre et elle a su être patiente en prenant le temps de m’expliquer ce que je ne comprenais pas. Je ne suis pas la même scientifique qu’au début de ma maîtrise et c’est en partie dû à son encadrement sur l’élaboration de mon projet. Je tiens aussi à remercier mon co-directeur de recherche le Dr Ynuk Bossé qui a répondu à mes questions concernant la physiologie du muscle lisse. Il m’a aussi permis de voir certains aspects de ma recherche sous un angle différent ce qui a grandement été apprécié. Bref à vous deux, vous avez su bien me diriger et vous avez cru en moi dans les moments de doute. C’est avec grand plaisir que je poursuis au doctorat sous vos directions.
J’aimerais également remercier mes assistantes de recherche sans qui je n’aurais pu réaliser ce cheminement. Marie-Josée Beaulieu, merci de m’avoir prise sous ton aile et de partager ton expertise pour ce qui concernait les bains d’organes et la culture cellulaire. Nos discussions matinales me préparaient aussi à affronter mes journées. Anick Langlois, merci
XVI
de m’avoir endurée pendant ces années, d’avoir autant rit et pleuré avec moi. Tu as été d’un tel support lorsque je n’avais plus la foi ou le moral. Tu es aussi en grande partie responsable de l’esprit scientifique que j’ai su développer. Bref, sans toi je n’aurais pas avancé autant mes résultats et tu as su réveiller ma curiosité scientifique. Également merci à tous les autres scientifiques du centre de recherche pour vos conseils même si je vous dérangeais parfois.
Je remercie aussi tous les membres de l’équipe Blanchet et Marsolais. Au début nous n’étions que trois, maintenant les équipes sont élargies et je vous considère tous comme des collègues de travail, mais aussi comme des amis. Sans nos dîners remplis de fous rires et nos sorties extra-travail je n’aurais pas su garder le moral. Bref, votre compagnie est essentielle et permet une belle ambiance de travail. Un merci particulier à David Gendron qui prenait le temps de discuter science et de remettre en question mes connaissances sur mon sujet. Tu as aussi participé à développer mon esprit scientifique et je t’en remercie.
Je tiens finalement à remercier particulièrement ma famille : mon père, ma mère, ma soeur et mon copain qui m’ont endurée pendant ces années. Ils ont su m’épauler autant lors de mes obstacles que de mes réussites. Merci d’essayer de comprendre ce que je fais et d’être les spectateurs de mes pratiques orales. Votre soutient est tout aussi important et vous répondez toujours présents.
XVII
Avant-propos
Ce mémoire est composé d’un article en préparation «CD34 expression is crucial to the
maintenance of airway reactivity following chronic antigen exposure» qui sera soumis sous
peu au Journal of Applied Physiology. Cet article aborde principalement le rôle du CD34 dans la réactivité du système respiratoire en contexte d’asthme allergique. Différentes avenues possibles de l’influence du CD34 sur la réactivité du système respiratoire ont été étudiées à savoir son expression sur le muscle lisse bronchique, son rôle dans la contractilité du muscle lisse et son rôle sur l’environnement du poumon (production de matrices extracellulaires et sécrétion de mucus). Une introduction générale portant sur les notions d’asthme, du muscle lisse, du CD34 et des modèles animaux précèdera le chapitre regroupant la problématique et les objectifs spécifiques du projet de recherche.
Cette étude a été réalisée tout au long de ma maîtrise à l’IUCPQ sous la supervision du Dre. Marie-Renée Blanchet et sous la co-supervision du Dr. Ynuk Bossé, et ainsi qu’avec l’aide d’une associée de recherche Anick Langlois (Ph.D). La planification et la réalisation des expériences ainsi que l’analyse des résultats ont été effectuées entièrement par moi-même, le Dre. Marie-Renée Blanchet et Dre. Anick Langlois. Quant à la rédaction de l’article, je l’ai en grande partie réalisée seule, avec les précieuses collaborations du Dre. Marie-Renée Blanchet, du Dr, Ynuk Bossé et d’Anick Langlois.
INTRODUCTION
Chapitre 1 : L’asthme
1
1. Importance et définition générale
Actuellement, l’asthme touche environ 300 millions de personnes dans le monde et ce nombre va assurément augmenter au cours des décennies à venir.1-3,4 Effectivement, l’industrialisation expose de plus en plus la population à divers allergènes menant à une prévalence accrue de l’atopie et du nombre de cas d’asthme. Plus précisément, en Amérique du Nord, environ 10% de la population souffre d’asthme.2,4 L’asthme touche les gens de tous âges avec une prédominance chez les femmes. Cette pathologie nécessite des recherches plus approfondies puisqu’elle a un impact important sur la qualité de vie des patients et engendre de coûteuses dépenses à l’état en termes de traitement et d’hospitalisation.4
Même si l’adoption de corticostéroïdes inhalés comme traitement principal a permis de diminuer les cas de mortalité et de morbidité associés à l’asthme, il n’y a pas encore, à ce jour, de traitement curatif connu.3 La prise de bronchodilatateurs et de corticostéroïdes permet seulement de soulager les symptômes des patients. Cependant, il arrive parfois que des personnes répondent faiblement à la médication et chez ces gens, les symptômes et exacerbations sont difficiles à contrôler.5 Actuellement, il existe plusieurs traitements, selon le continuum de traitement du Consensus canadien de l’asthme 2012, qui ciblent les différentes composantes de l’asthme tels que les bronchodilatateurs (constriction du muscle lisse) et les anti-inflammatoires (anti-IgE et anti-leukotriènes).3, 6 D’autres agents ciblent les leucotriènes associés à la contraction du muscle lisse (Tableau 1).6,7 Le problème actuel est qu’aucune de ces voies thérapeutiques ne semble suffisante pour maîtriser complètement les symptômes de la pathologie.4 Dans les cas d’asthme plus sévères, la combinaison de corticostéroïdes et d’agonistes β2-adrénergiques à longue durée d’action est adoptée.7 Par contre, dans certains cas, cette thérapie s’avère tout aussi inefficace que la prise seule de l’un ou l’autre.5,6 Il est donc important d’identifier de nouvelles cibles cellulaires et
2
moléculaires, ainsi que de développer des nouvelles médications pouvant à la fois pallier aux symptômes non-contrôlés, et aborder le problème de complexité et d’hétérogénéité de l’asthme.
Tableau 1 : Exemples de traitements actuellement utilisés 8
L'asthme se définit comme une maladie chronique des voies respiratoires dans laquelle plusieurs types cellulaires jouent un rôle important tel que les mastocytes, les éosinophiles, les lymphocytes T, les macrophages, les neutrophiles, les cellules épithéliales, les fibroblastes et les cellules musculaires lisses.4, 6 L’asthme peut se présenter sous 2 principales formes dont l’asthme éosinophilique et l’asthme non-éosinophilique (neutrophilique, paucygranulocytopique et formes mixtes). En effet, l’éosinophile est généralement le principal joueur de l’inflammation chronique retrouvée chez les asthmatiques allergiques. De plus, cette inflammation chronique est associée à une hyperréactivité des voies aériennes qui peut engendrer une obstruction bronchique réversible.1 L’asthme est donc une maladie hétérogène caractérisée par une bronchoconstriction variable, une hyperréactivité bronchique, une hyper-sécrétion de
Types de traitement Exemple de médications employées Corticostéroïdes inhalés
Budesonide (Pulmicort®), Fluticasone (Flovent®) et Mometasone (Asmanex®)
Comprimés de corticostéroïdes
Prednisone, Prednisolone (PediaPred®) et Dexamethasone (Decadron®)
Bronchodilatateurs à longue durée d’action
Salmeterol (Serevent®) et Formoterol (Foradil®, Oxeze®)
Antagonistes d’un récepteur des
leucotriènes Zafirlukast (Accolate®) et Montelukast (Singulair®) Théophylline TheoDur®, Uniphyll®, Phyllocontin®, TheoLair® Combinaison de corticostéroïdes et
de bronchodilatateurs à longue durée d’action
Budesonide(Pulmicort®) + Formoterol(Oxeze®) Fluticasone (Flovent®) + Salmeterol (Serevent®)
3
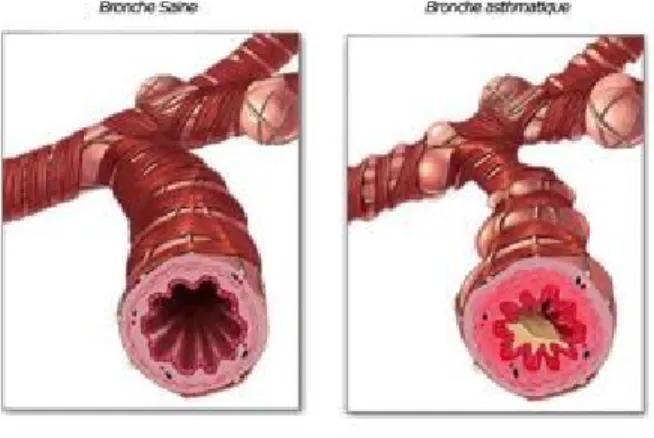
mucus, un remodelage des voies respiratoires et une inflammation chronique principalement de type Th2 (type Th1 lors d’asthme sévère).3, 5, 6 Ces éléments sont illustrés à la figure 1. Dans cette illustration, une augmentation de l’épaisseur de la membrane basale, une accumulation de mucus dans la lumière et un resserrement du muscle lisse autour de la bronche asthmatique sont observés comparativement à la bronche saine.3-6
Figure 1 : Représentation d’une bronche saine (à gauche) vs une bronche asthmatique (à droite)9
Ces caractéristiques se traduisent notamment par l’apparition de différents symptômes tels qu’une toux fréquente, une dyspnée, une respiration sifflante et un essoufflement.4, 6 Ces symptômes sont occasionnés par une contraction du muscle lisse et une inflammation des bronches qui ensembles obstruent les voies respiratoires. Par conséquent, les débits expiratoires forcés sont diminués. Le volume résiduel (VR) ainsi que la capacité résiduelle fonctionnelle sont quant à eux augmentés. Une augmentation de la résistance des voies respiratoires est aussi observée.4 Bref, tous ces éléments ont comme répercussion de diminuer grandement la qualité de vie des asthmatiques. L'hétérogénéité de la pathogénèse de l'asthme et les mécanismes associés, qui sont encore à ce jour méconnus, font en sorte qu’il est important d’étudier cette pathologie.
4
2. Facteurs de risques et différents types d’asthme
La prévalence de l’asthme est associée aux multiples facteurs de risques qui sont regroupés dans le tableau 2. Ils se divisent en deux catégories soient les facteurs relatifs à l’hôte et les facteurs environnementaux.
Facteurs reliés à l’hôte
Génétique
-Gènes prédisposant à l’atopie
-Gènes prédisposant à l’hyperréactivité des voies aériennes
Obésité Sexe
Facteurs environnementaux
Allergènes
-Intérieur : acariens domestiques, fourrures d’animaux (chat, chien, souris), moisissures
-Extérieurs : Pollen, champignons, moisissures, levures
Infections (prédominance virale)
Agents sensibilisants en milieu de travail Fumée de Tabac
-Tabagisme actif -Tabagisme passif
Pollution intérieure et extérieure Diète
5
Actuellement, il a été démontré que l’asthme est à 60% héréditaire lors d’études effectuées chez des jumeaux.5 En effet, plus d’une centaine de gènes ont été identifiés comme potentiellement impliqués dans la pathologie de l’asthme.10 L’un de ces principaux gènes candidats est le gène ORMDL3/GSDMD retrouvé sur le chromosome 17q21 et il serait associé à l’apparition de l’asthme à l’enfance.5 D’autres sont, comme l’IL33 et l’IL2RB, impliqués de façon variable.5 Il reste beaucoup à apprendre et à découvrir sur les gènes et leur implication dans l’asthme. De plus, il peut y avoir de multiples interactions entre les facteurs environnementaux et ces gènes, ce qui complique la compréhension et le traitement de la pathologie. Par contre, on sait maintenant que les composantes environnementales exacerbent le phénotype de l’asthme et c’est pourquoi plusieurs études tentent de comprendre leur impact sur la pathologie de l’asthme. À l’ère de la thérapie ciblée et individuelle, l’étude génétique permet aussi des avancées scientifiques sur les gènes associés au développement de l’asthme dans le but de trouver de nouvelles cibles thérapeutiques.
Même si les causes ou déclencheurs de cette pathologie ne sont pas toujours connus lors du diagnostic, il est tout de même possible de classifier l’asthme selon différents phénotypes d’asthme associé à: un allergène environnemental, un allergène ou un irritant occupationnel, à l’exercice et à l’aspirine.4,11 Dans ce mémoire, seulement l’asthme allergique sera abordé. Ce type d’asthme est déclenché par l’exposition à un allergène pour lequel la personne développe une réaction immunitaire qui déclenche une cascade inflammatoire et des symptômes spécifiques à l’asthme.4 Cette réponse peut aussi se classifier en fonction du phénotype inflammatoire soit éosinophilique, neutrophilique, paucygranolocytopique et de formes mixtes.3, 4,11 Bref, l’asthme peut se présenter sous différents phénotype tel que Wenzel le décrit dans son article.
6
3. La cascade allergique dans l’asthme
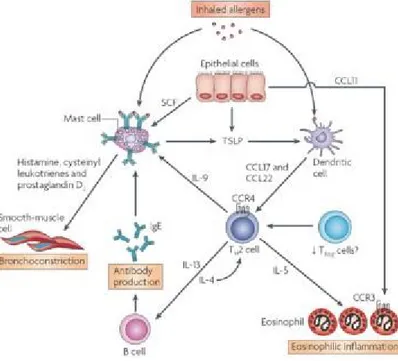
L’initiation de la cascade allergique est occasionnée par le bris de la barrière épithéliale et la captation de l’antigène par les cellules présentatrices d’antigènes (cellules dendritiques). Ces cellules activent par la suite les lymphocytes T naïfs (Figure 2). Finalement, ces lymphocytes T activés se différencient en lymphocytes de type Th2, réponse caractéristique de l’asthme.
Après l’exposition initiale à l’allergène, deux différentes étapes se succèdent lors de la cascade immune. Il y a tout d’abord une sensibilisation à l’allergène qui est initiée par le développement de la réponse immune immédiate.4 Elle consiste en une sécrétion d’IL-4 par les lymphocytes T qui permet d’activer les lymphocytes B à produire des IgE spécifiques pour l’antigène. Les IgE ainsi formés se lient au récepteur à haute affinité (FcεR1) des mastocytes ce qui constitue en l’étape de sensibilisation.12,13 La deuxième étape se produit lors de d’expositions subséquentes au même allergène. À ce moment, les mastocytes sensibilisés s’activent par les interactions croisées des IgE aux récepteurs. Il s’ensuit une dégranulation qui libèrent des médiateurs inflammatoires tels que l’histamine et la tryptase. D’autres médiateurs sont quant à eux générés et libérés de novo tels que les leucotriènes et les prostaglandines.13,14 En réponse à ces médiateurs, il y a contraction du muscle lisse des bronches (bronchoconstriction). Cette bronchoconstriction occasionne les principaux symptômes de l’asthme associés à la réponse hâtive à l’allergène. Par la suite, d’autres cytokines seront produites par les mastocytes et celles-ci seront impliquées dans le recrutement et l’activation de diverses cellules inflammatoires.13,14 Dans un deuxième temps, la réponse tardive est alors initiée. Les lymphocytes Th2 sécrètent aussi de l’IL-5 et de l’IL-9 qui entraînent respectivement une éosinophilie et une surproduction de mastocytes.13,14 L’éosinophilie est une caractéristique propre d’une réponse de type Th2. En fait, l’inflammation éosinophilique est retrouvée dans les lavages bronchoalvéolaires de la majorité des patients asthmatiques. Les éosinophiles libérèrent des protéines cationiques
7
qui sont toxiques pour l’épithélium bronchique et participent ainsi à la réaction inflammatoire chronique.4
De plus, lorsque l’inflammation chronique est installée, il y a une libération d’IL-13, qui est souvent associée à une surproduction de mucus et à l’HRB. L’IL-13 entraîne l’hyperplasie des cellules à gobelets, la prolifération du muscle lisse et la fibrose sous-épithéliale (Figure 3).13,15 Ces trois phénomènes contribuent au remodelage des bronches, qui est également une caractéristique de l’asthme (décrit en détails dans la prochaine section). Bref, l’asthme déclenche de multiples réponses, ce qui rend la pathologie complexe à étudier.
8
Figure 3 : Schéma de l’évolution de l’asthme ; de l’inflammation au remodelage 16
4. Le remodelage et les changements structuraux associés à l’asthme
L’asthme entraîne des changements structuraux importants au niveau du système respiratoire. Ces altérations touchent principalement les grosses voies aériennes.17 Les changements structuraux observés comprennent l’altération de l’épithélium bronchique, la fibrose sous-épithéliale, l’angiogenèse vasculaire et l’augmentation de la masse musculaire lisse.18 Ces changements structuraux irréversibles, ou remodelage, sont en partie occasionnés par la chronicité de l’inflammation présente aux poumons. La figure 4 ci-contre illustre bien tous les éléments qui participent au remodelage des voies respiratoires.
9
Figure 4 : Altérations dans les bronches asthmatiques remodelées 19
4.1 Altération de l’épithélium bronchique
Normalement, un épithélium bronchique intact permet d’assurer une barrière physique contre les petites particules inhalées tels les allergènes. Toutefois, lors d’une manifestation d’asthme, l’intégrité de l’épithélium est altérée. Cela se manifeste par une diminution voire une perte de l’épithélium bronchique, la perte de cellules ciliées, l’hyperplasie des cellules à gobelets et la surproduction de facteurs de croissance, de cytokines et de chimiokines initiant le recrutement de cellules inflammatoires.18 L’hyperplasie des cellules à gobelets mène, quant à elle, à la surproduction de mucus qui contribue à l’obstruction de la lumière des voies respiratoires.20,21,22,23,24 Le mucus contient plusieurs glycoprotéines incluant
10
MUC5B et MUC5AC. MUC5B est associé à la conservation de l’homéostasie des voies respiratoires alors que MUC5AC est une glycoprotéine essentielle à la composition du mucus.22,23,24 De façon intéressante, MUC5AC est drastiquement augmenté chez les patients asthmatiques tandis que MUC5B reste stable.24,25,26 MUC5ac est donc la principale mucines impliquée dans la surproduction de mucus et à l’obstruction bronchique chez les asthmatiques.
4.2 La fibrose sous-épithéliale
La fibrose sous-épithéliale a lieu dans la lamina réticulaire qui est la couche la plus profonde de la membrane basale. Cette altération est la conséquence d’une déposition accrue de protéines de la matrice extracellulaire incluant les collagènes de type I, III et IV; la fibronectine; la tenascine; le lumican et le biglycan.18 L’environnement inflammatoire retrouvé chez les asthmatiques contribue à l’activation des fibroblastes et à leur différenciation en myofibroblastes, qui sont des cellules sécrétoires et contractiles responsables de l’accumulation de ces dépôts de matrice.20 En contexte normal, les métalloprotéinases sont responsables de la dégradation du collagène et assurent ainsi l’homéostasie. Or, en contexte inflammatoire, il y a un débalancement entre la synthèse et la dégradation de la matrice extracellulaire par les métalloprotéinases et leurs inhibiteurs.18 Ainsi, chez les asthmatiques, la balance penche plutôt vers un mécanisme profibrotique. De plus, l’activation persistante des fibroblastes entraîne une réparation aberrante et la fibrose sous-épithéliale. L’accumulation de matrice extracellulaire modifie la structure et altère les propriétés mécaniques des bronches et du poumon.20 La fibrose est en effet directement reliée à l’hyperréactivité bronchique et à la sévérité de l’asthme. 18,27,28
11 4.3 L’angiogenèse vasculaire
Dans les voies respiratoires remodelées, on dénote une augmentation anormale du nombre et de la taille des microvaisseaux.18, 20 Ce phénomène a lieu principalement dans l’adventice (entre le muscle lisse et le parenchyme). Ce remodelage et angiogenèse des vaisseaux est occasionné par une sécrétion accrue du facteur de croissance vasculaire endothélial (VEGF) et de l’angiopoiétine-1.18, 20,29 Il en résulte une dilatation des vaisseaux qui favorise l’œdème par l’entrée de plasma, de cellules inflammatoires et de cytokines. De plus, plusieurs types cellulaires (éosinophiles, fibroblastes et CML) sécrètent ces facteurs angiogéniques qui participent ainsi au processus de remodelage.29
4.4 L’augmentation de volume du muscle lisse
Les cellules musculaires lisses (CML) sont principalement reconnues pour entraîner l’obstruction des voies respiratoires par leur contraction exagérée et le rétrécissement de la lumière bronchique qui en découle.20 Ultimement, il en résulte une diminution de la fonction pulmonaire. Le volume du muscle lisse est augmenté chez les patients asthmatiques, un fait établi depuis plusieurs décennies et qui est devenu une signature histologique de la pathologie.30,31-33 L’augmentation du volume du muscle lisse est attribuée à l’hyperplasie et/ou à l’hypertrophie des CML des voies respiratoires.18, 20 Ces changements structuraux des CML sont reconnus pour être induits par des divers facteurs de croissance.
En ce qui concerne l’hyperplasie des CML, on reconnaît trois mécanismes potentiels : l’augmentation du taux de prolifération cellulaire, la diminution du processus d’apoptose et la migration des myofibroblastes et/ou de cellules souches hématopoïétiques et leur
12
différenciation subséquente en cellules musculaires lisses. En effet, les CML in vitro de patients asthmatiques ont un plus haut taux de prolifération que les patients sains.31 Ce mécanisme n’est pas très bien compris, mais certaines hypothèses suggèrent l’augmentation de la biogenèse des mitochondries ou une dérégulation du Ca2+.34 Les médiateurs pro-inflammatoires sont aussi soupçonnés d’être importants pour l’augmentation de la prolifération (TNF-alpha, IL-4, IL-5, IL-13, TGF-bêta, TSLP et famille Th17). Quant au mécanisme d’apoptose, de rares études démontrent la diminution de l’apoptose des CML dans des modèles d’asthme.35 Finalement, l’hypothèse de la migration des myofibroblastes dans la couche du muscle lisse est appuyée par des études démontrant la microlocalisation de ces cellules dans le muscle lisse lors d’une insulte allergénique.36,37,38 Plusieurs hypothèses tentent d’expliquer l’origine de ces myofibroblastes, dont la différentiation des fibroblastes résidents, le changement phénotypiques des cellules épithéliales et le recrutement des précurseurs CD34+ dérivés de la moelle osseuse nommés fibrocytes.20,39 Comme l’hyperplasie, le phénomène d’hypertrophie fait encore l’objet de débats. L'hypertrophie semblerait associée à une augmentation de la kinase de la chaîne légère de la myosine qui est une protéine importante dans la contraction du muscle lisse.18
L’accumulation de protéines de la matrice extracellulaire, telles que le collagène, la laminine et la fibronectine, peut également contribuer à l’expansion du volume des CML.28,40 La production de matrice extracellulaire est constitutive chez ce type cellulaire et est augmentée en contexte inflammatoire.27 Les glycoprotéines produites peuvent altérer les fonctions des CML comme leur viabilité, leur différentiation, leur adhésion, leur prolifération et leur survie.18,28, 30 Il est à noter que leur capacité contractile peut aussi être affectée par les protéines de la matrice extracellulaire.27,40
13
5. L’hyperréactivité des voies respiratoires et l’asthme allergique
L’hyperréactivité des voies respiratoires se définit comme une diminution excessive des fonctions respiratoires en réponse à un large spectre de stimuli.41,42 Ce phénomène implique principalement les CML, qui se raccourcissent de façon exagérée en réponse à divers stimuli.43 L’hyperréactivité est en partie responsable des épisodes récurrents de sifflement et de respiration haletante.42, 43 Le niveau de réactivité des voies respiratoires se mesure à l’aide du test de bronchoprovocation.41 Le déclin du volume expiratoire maximal en 1 seconde (VEMS) est normalement utilisé comme indicateur du niveau de réactivité du système respiratoire.4 Chez un asthmatique, l’hyperréactivité se traduit par une réponse exagérée pour une même dose de stimulus tel la métacholine comparativement à un sujet sain.44,45,46 La sensibilité aussi est accrue, c’est-à-dire que les sujets asthmatiques vont générer une réponse à de plus faibles doses que les sujets sains (Figure 5).44,45,46
Figure 5: Diminution du volume expiratoire maximal en 1 seconde à des doses croissantes de métacholine chez des sujets sans asthme (A), des patients asthmatiques modérés (B) et des patients asthmatiques sévères (C) 45
14
L’HRB a grandement été étudiée. Plusieurs théories tentent d’expliquer l’hyperréactivité, incluant l’altération des propriétés contractiles du muscle lisse.43, 47 La force du muscle lisse, ainsi que d’autres propriétés du muscle lisse telles que sa vélocité de contraction, son raccourcissement maximal, sa rigidité ainsi que sa capacité à tolérer et récupérer des oscillations de longueur, peuvent participer à l’hyperréactivité.46,48,49 Il est aussi important de savoir que les composantes de l’asthme allergique (HRB, remodelage et inflammation) sont inter-reliées entre elles et participent de ce fait au développement de l’HRB.50
Le dogme de la contraction excessive du muscle lisse a longtemps été préconisé par les experts afin d’expliquer l’HRB.48 Cependant, il est important de noter que la littérature considère désormais la participation d’éléments non-contractiles à l’HRB.19,51 Effectivement, des modifications de la structure du cartilage des voies respiratoires, de la lamina propria, du parenchyme, de la membrane basale, de l’épithélium et du le liquide de surface peuvent contribuer à l’augmentation de la résistance des voies respiratoires.19,51,52 Cela ne discrédite pas l’implication du muscle lisse dans le phénomène de l’HRB. Cela suggère plutôt que ces éléments peuvent interagir avec les éléments contractiles afin de modifier la réponse du système respiratoire à l’activation du muscle lisse.44,53 Bref, il est important d’explorer les différentes avenues participant à l’HRB puisqu’elle contribue en grande partie aux symptômes de l’asthme.
15
17
1. Le muscle lisse en général
Ce tissu se retrouve dans les voies respiratoires de la trachée jusqu’aux bronchioles et se situe dans la sous-muqueuse c’est-à-dire entre la lamina propria et l’adventice.4 Le muscle lisse est présent dans la majorité des voies respiratoires sous forme de bandes. Dans les voies respiratoires centrales (trachée et bronches principales) chez l’humain, les bandes de muscle lisse sont présentes sur la portion postérieure des voies respiratoires et elles sont attachées à la face antérieure des anneaux de cartilage.4 Par contre, dans les voies intra-parenchymateuse, le muscle lisse est présent de façon circonférentielle autour des conduits.4 Le muscle lisse doit son origine à différents types de précurseurs mésenchymateux dont ceux dérivés de la moelle osseuse et de la criculation.36, 47
Le rôle de base du muscle lisse dans des conditions normales n’est pas complètement clair. Il y a plusieurs débats sur le fait qu’il pourrait participer au maintien d’un tonus minimal des voies respiratoires, au contrôle de la distribution du flux d’air dans le poumon et au processus de la toux, de la respiration profonde et de l’expiration forcée.47 Toutefois, la recherche actuelle se concentre sur l’étude des anomalies impliquant le muscle lisse dans diverses pathologies.
18
1.1 Les marqueurs typiques des cellules musculaires lisses
On peut identifier les CML qui composent le muscle lisse grâce à l’expression de différentes protéines. Ce type cellulaire exprime plusieurs protéines contractiles et structurales typiques qui ont permis leur identification. Cette caractérisation provient principalement de la culture cellulaire élaborée à partir de muscle lisse isolé de biopsies bronchiques. Lorsqu’elles sont en prolifération, ces cellules expriment en grande quantité la vimentine et en petite quantité la smooth-muscle myosin-heavy-chain II (sm-MHC-II), l’α-smooth-muscle actin (α-sma), la calponine et la desmine.30, 47, 54 Par contre, lorsqu’elles présentent un phénotype contractile, elles expriment fortement la sm-MHC-II, l’α-sma, la kinase de la chaîne légère de la myosine (MLCK), la desmine et la calponine.30, 47, 54
Même si les CML possèdent de nombreux marqueurs permettant de les identifier, plusieurs d’entre eux ne sont pas exclusifs à ce type cellulaire. De plus, l’expression de ces marqueurs est transitoire, compliquant leur identification en culture in vitro. Par exemple, les fibroblastes peuvent se différencier en myofibroblastes et possèdent aussi des capacités contractiles comme les CML. Le tableau 3 démontrent bien que les marqueurs utilisés pour identifier les CML sont communs à plusieurs types cellulaires tels que les fibroblastes qui expriment la vimentine et l’α-sma, alors que les myofibroblastes peuvent aussi exprimer la sm-MHC-II.55 Toutefois, seules les CML expriment la SM22 qui est reconnue comme le marqueur discriminatoire des CML.54,55
19
Protéines CML Fibroblastes Myofibroblastes
alpha-smooth muscle
actin X X X
calponine X X
caldesmone (h et l) X X
desmine X X X
myosin ligth chain
kinase X X smooth-muscle myosin heavy chain II X X transgeline (SM22) X tropomyosine X X X vimentine X X X
Tableau 3 : Protéines permettant d’identifier les cellules musculaires lisses
1.2 La contraction du muscle lisse
Une propriété typique du muscle lisse est sa capacité à contracter. Lors de la contraction, le muscle lisse génère une force grâce à l’interaction entre les filaments d’actine et de myosine.56,57 Cette interaction est dépendante de la phosphorylation de la chaîne légère de la myosine par sa kinase (MLC).56,57 Cette réaction peut aussi être régulée négativement par la phosphatase de la MLC. La contraction est aussi dépendante de l’augmentation du calcium cytoplasmique. Cette augmentation peut être engendrée par une entrée de calcium extracellulaire via les canaux calciques voltage dépendant qui sont entre autres stimulés par des agents qui dépolarisent la membrane plasmique.56,57, 58 L’augmentation du calcium cytoplasmique peut également être provoquée par l’activation de récepteurs couplés aux protéines G (GPCR) (Figure 6). Les récepteurs muscariniques de type M2 (jouent un rôle
20
dans la sensibilité au calcium) et de type M3 (jouent un rôle direct dans la contraction) sont les mieux documentés.47 Plus précisément, les GPCR stimulés par leurs ligands spécifiques, tels que la sérotonine, l’histamine, la bradykinine, la métacholine et l’acétycholine, activent les protéines G.47 Cela fait en sorte d’entraîner le relargage du calcium (Ca2+) présent dans le réticulum sarcoplasmique et d’augmenter la concentration cytoplasmique de Ca2+.57,58 Par la suite, ce Ca2+ se lie à la calmoduline. Le complexe Ca2+-calmoduline active la kinase de la MLC pour ainsi initier la contraction.56,58, 59 De plus, les protéines G activent la kinase Rho permettant l’inactivation de la phosphatase de la MLC et ainsi augmenter le niveau de phosphorylation de la MLC.56,58, 59 Toutefois, les mécanismes de la contraction en situation d’asthme allergique sont encore mal compris.
Figure 6 : Schéma de la contraction du muscle lisse 59
2. Le muscle lisse dans l’asthme
Le muscle lisse joue un rôle important dans la pathologie de l’asthme. Ce tissu a des répercussions sur les trois principales composantes de l’asthme. En effet, le muscle lisse joue un rôle dans l’HRB et participe aussi au processus inflammatoire, soit en sécrétant des cytokines et chimiokines pro-inflammatoires ou soit en subissant leurs actions.60
21
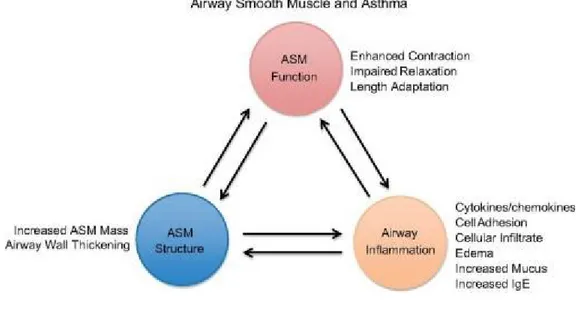
Finalement, le muscle lisse peut participer au processus de remodelage en synthétisant de la matrice extracellulaire ou bien en subissant les effets de la matrice environnante (Figure 7).43,27 Ce type cellulaire tient donc un rôle central dans cette pathologie d’où l’intérêt de l’étudier dans la présente étude.
Figure 7 : Le muscle lisse participe aux trois composantes de la pathologie de l’asthme61
La seule altération du muscle lisse qui a été rapportée de façon constante dans l’asthme est l’augmentation de son volume autour des bronches.30, 31,32,33,43,44,51, 62 En effet, la couche des CML est très mince chez les sujets sains tandis qu’elle est hypertrophiée et hyperplasique chez les sujets asthmatiques.62, 63 Tel que discuté auparavant, les mécanismes entraînant ce phénomène sont méconnus. Des études révèlent aussi des différences quant à l’expression protéique et la capacité contractile du muscle lisse chez les patients asthmatiques comparativement aux sujets sains.
22
2.1 Différences d’expression protéique chez les CML de patients asthmatiques
Plusieurs études ont été réalisées, autant sur du muscle lisse fraîchement isolé que sur des cellules musculaires lisses en culture, afin de potentiellement identifier un patron d’expression protéiques différent chez les CML de patients asthmatiques. Ces études se concentraient principalement sur les protéines de types contractiles telles que la kinase de la chaîne légère de la myosine (MLCK), la chaîne lourde de la myosine (sm-MHC-II) et l’actine (α-sma).62, 63 Une protéine de structure, la transgeline (SM22) a aussi été étudiée.63 Toutefois ces expériences n’ont pas permis d’arriver à un consensus quant au patron d’expression protéique du muscle lisse de patients asthmatiques. Certains experts rapportent une augmentation de l’expression de la MLCK, la sm-MHC-II, l’α-sma et la SM22.63, 64,65,66,67 D’autres études n’observent aucune différence d’expression protéique.68,69 Il y a donc des discordances notables quant à l’expression protéique modifiée chez les patients asthmatiques tentant d’expliquer l’HRB et l’hypercontractilité et le rôle potentiel des CML dans l’hypercontractilité. Le manque de certitude entourant ces études pourrait être occasionné par l’utilisation de différentes techniques d’échantillonnage, de différents protocoles et de différents types d’échantillons lors des études.63 Il reste encore beaucoup à confirmer concernant l’expression protéique du muscle lisse des asthmatiques et leurs possibles implications dans la contractilité ou les autres fonctions du muscle lisse.
2.2 Contractilité du muscle lisse chez des CML de patients asthmatiques
Peu d’études ont comparé la capacité contractile du muscle lisse de patients asthmatiques au muscle lisse de sujets non-asthmatiques. En effet, il n’est toujours pas clair s’il existe une différence innée dans la capacité contractile des CML d’asthmatiques qui contribue à l’hyperréactivité des voies respiratoires. Selon d’autres hypothèses, les différences contractiles pourraient être acquises au cours du développement de l’asthme. En tout, on dénombre seulement 12 études, effectuées chez l’humain, qui se sont intéressées à la
23
capacité contractile du muscle lisse.48 Parmi ces études, 7 d’entre elles démontrent aucune différence quant à la force générée par le muscle lisse des sujets asthmatiques versus les non-asthmatiques.70,71,72,73,74,75,76 Cependant, 5 autres études observent une différence quant à la force générée, le raccourcissement du muscle lisse et/ou la sensibilité à des agonistes.77,78,79,80,81 D’autres ont cependant démontré une hypocontractilité.73,74 Bref, tous ces éléments sont soupçonnés de participer au phénomène d’hyperréactivité bronchique, mais des études supplémentaires approfondies seront nécessaires à la compréhension de ces phénomènes.
En somme, les changements affectant la contractilité du muscle lisse et l’augmentation de son volume sont les principaux éléments étudiés afin de comprendre leur implication dans l’asthme allergique et leurs interactions avec les autres types cellulaires. Par contre, les mécanismes impliqués dans ces phénomènes sont encore peu compris. Dans ce mémoire, on s’intéressera précisément aux capacités contractiles du muscle lisse dans le contexte d’asthme allergique chez la souris.
25
27
1. Les sialomucines et la famille du CD34
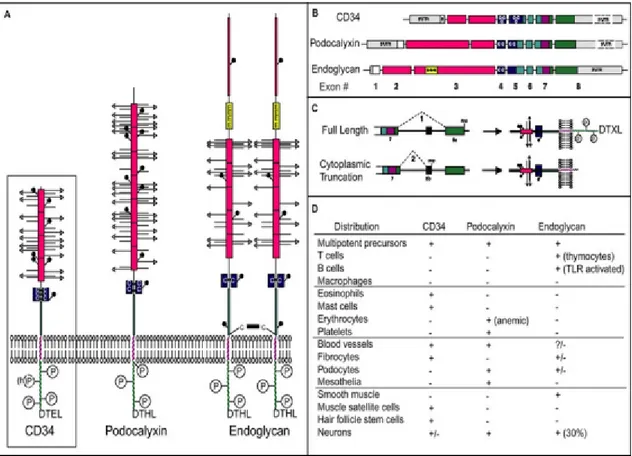
Les sialomucines sont une classe hétérogène de protéines transmembranaires de type I.82,83,84 Elles comprennent une ou plusieurs régions (domaines de mucines) qui sont riches en proline, thréonine et sérine.82,83,84 Ce sont aussi des molécules fortement glycosylées et sialylées apparentée aux mucines d’où leur appellation de sialomucine. Elles possèdent toutes un domaine globulaire riche en cystéines et un site de phosphorylation intra-membranaire. Le rôle principal reconnu des sialomucines est d’agir en tant que molécule d’adhésion.84 En effet, les sialomucines sont des molécules d’échafaudage présentant des glucides qui sont les ligands des sélectines impliquées dans le roulement des leucocytes.85 Les sialomucines de la famille du CD34 comprennent trois membres dont le CD34, la podocalyxine et l’endoglycan (Figure 8A).83,84 Ces trois molécules comportent quelques différences, mais elles possèdent toutes un domaine similaire hautement conservé. De plus, la particularité de cette famille est l’existence de plusieurs isoformes de la molécule. En ce qui concerne le CD34, il existe sous sa forme pleine longueur ou sous sa forme tronquée.83,84 D’autres sialomucines sont aussi apparentées à cette famille. Il s’agit du CD43, PSGL-1, GlyCAM-1, MAdCAM-1 et la famille des mucines.82
2. La molécule du CD34
Le CD34 est principalement reconnu pour être un marqueur des cellules souches hématopoïétiques/progénitrices de cellules.82,83, 84 Malgré le grand intérêt (> 15 000 citations) porté à l’expression du CD34 sur les cellules souches, il y a peu d’information concernant son rôle sur ces cellules. En plus d’être un marqueur typique des cellules souches du système hématopoïétique, le CD34 est retrouvé chez les cellules vasculaires endothéliales et sur les cellules mésenchymateuses et stromales.84 De plus, le CD34 a été observé chez les cellules satellites ainsi que chez une population de progéniteurs fibro-adipogéniques retrouvé dans le muscle.86 Il est aussi retrouvé à la surface de plusieurs
28
cellules matures (Figure 8D) dont les mastocytes87, les éosinophiles88, les cellules de la microglie89, les cellules de Langerhans90, les cellules dendritiques91 et les fibrocytes (différenciation en myofibroblastes et insertion dans le muscle lisse dans l’asthme)36,37. Bref, le CD34 est présent à la surface de plusieurs types cellulaires, mais son rôle et ses fonctions sont encore méconnus d’où l’intérêt de l’étudier de plus près. En fait le CD34 est une molécule d’intérêt dans l’étude des mécanismes influençant le remodelage du muscle lisse ainsi que la contractilité de ce tissu dans l’asthme.
29
3. Les fonctions du CD34
Jusqu’à tout récemment, le CD34 était seulement utilisé en tant que marqueur de cellules souches hématopoïétiques afin d’enrichir les transplantations de moelle osseuse de cellules CD34+ et comme indicateur de l’efficacité de la reconstitution.92 Toutefois, des études chez des souris ont démontré que l’expression du CD34 est réversible et dépendante du statut d’activation des cellules.93 En effet, les cellules souches hématopoïétiques CD34- sont en état de quiescence, alors que les CD34+ sont en état d’activation.84 Cela suggère que le CD34 pourrait être impliqué soit dans l’activation ou la mobilisation des cellules souches hématopoïétiques.84
Par la suite, trois fonctions ont été découvertes. En effet, on le connaît maintenant comme 1) un inhibiteur de différenciation et promoteur de prolifération chez les cellules souches hématopoïétiques ; 2) une molécule d’adhésion et de signalisation dans une lignée cellulaire hautement spécialisée (high endothelial veinules (HEV)) et 3) une molécule anti-adhésion chez plusieurs leucocytes facilitant la migration cellulaire.83, 84,83, 91, 94, 95
2.1 Inhibition de la différenciation des cellules souches hématopoïétiques
La première fonction (inhibition de la différenciation) a été démontrée à l’aide d’un modèle de souris dépourvues du gène Cd34 (Cd34-/-).90 En effet, en présence du CD34 à leur surface, les cellules souches embryonnaires ont un taux de prolifération élevé. Cette observation est basée sur le fait que les précurseurs de cellules hématopoïétiques des souris
Cd34-/- prolifèrent moins bien que celles des souris sauvages (wild type (wt)).90 De plus, le phénotype peut être renversé par la transfection de CD34 pleine longueur, ce qui confirme
30
son rôle dans le phénomène. Le CD34 est donc important pour la prolifération, la différenciation et la maturation des précurseurs des cellules souches hématopoïétiques.84 Cependant, lorsque le rôle du CD34 a été étudié sur une lignée cellulaire de myoblastes M1, on lui a plutôt trouvé un rôle d’inhibition de la différenciation.83 En effet, les myoblastes se différencient en macrophages suite à une exposition à certaines cytokines telles que l’IL-6 ou LIF.84,96 Par contre, leur différentiation en macrophages est inhibée suivant l’ajout de CD34 ectopique.83,96 Cette fonction est toutefois mitigée puisqu’elle n’a été observée que chez cette lignée cellulaire et en contexte plus ou moins « naturel » (ajout de CD34 ectopique).
2.2 Molécule d’adhésion chez les HEV
La deuxième fonction du CD34 (molécule d’adhésion) a aussi été observée chez une lignée cellulaire hautement spécialisée, soit les HEV. En effet, ces cellules, via une modification post-transcriptionnelle, expriment une structure de glycan rare, le sialyl Lewis-X, qui permet au CD34 d’agir comme ligand adhésif de la L-Sélectine.83,84 Cette liaison permet l’adhérence et le roulement des lymphocytes sur ces cellules exprimées dans les ganglions lymphatiques.84 Quant à la signalisation induite par le CD34, elle pourrait être assurée par le site de phosphorylation juxta-membranaire de cette molécule.84
2.3 Molécule antiadhésive (téflon moléculaire)
Finalement, le troisième rôle (molécule d’anti-adhésion facilitant la migration cellulaire (téflon moléculaire)) est celui qui est de loin le mieux caractérisé. Son identification a d’abord été démontrée chez des mastocytes dérivés de la moelle osseuse de souris Cd34
-/-31
qui, in vitro, ont tendance à former des amas. De plus, en l’absence du CD34, les mastocytes ne sont plus aptes à repeupler les niches périphériques (telles que le péritoine)
in vivo.84, 97 Le rôle d’anti-adhésion du CD34 pourrait donc être important pour permettre aux précurseurs hématopoïétiques de migrer de la moelle osseuse vers la niche appropriée.84 De plus, l’expression du CD34 à la surface de l’endothélium vasculaire permet de diminuer les adhésions non-spécifiques avec les cellules hématopoïétiques circulantes. Le principe de cette fonction est basé sur la répulsion de charges négatives du CD34, prévenant ainsi la liaison aux molécules d’adhésion.83 En effet, ce phénomène a été observé dans plusieurs modèles inflammatoires dans lesquels la migration de cellules est importante, notamment au poumon.83, 91,94 Les mastocytes, éosinophiles et cellules dendritiques matures (CD34+), doivent l’exprimer afin de permettre un trafic cellulaire efficace dans le développement de l’inflammation pulmonaire dans l’asthme et d’autres pathologies inflammatoires.98,83, 91, 95
En résumé, le CD34 joue plusieurs rôle dépendamment du type cellulaire l’exprimant, son rôle comme téflon moléculaire étant celui qui est le mieux décrit et récemment accepté dans la littérature. Le CD34 semble aussi exercer des fonctions spécifiques dans un contexte inflammatoire tel qu’abordé dans la prochaine section.
4. Rôles du CD34 dans les pathologies inflammatoires
Plusieurs évidences démontrent que le CD34 aurait un rôle à jouer dans les pathologies inflammatoires. En effet, de nombreuses cellules inflammatoires telles que les éosinophiles, les mastocytes et les cellules dendritiques sont reconnues pour exprimer le CD34 et jouer un rôle important dans le développement de certaines pathologies.
32
Par exemple, dans l’alvéolite allergique extrinsèque, le CD34 permet la migration des cellules dendritiques des poumons aux ganglions lymphatiques.91 En effet, chez les souris
Cd34-/-, les cellules dendritiques sont retenues dans les poumons ce qui empêche la
présentation de l’antigène aux lymphocytes et ainsi le développement d’une réponse adaptative des lymphocytes. Dans l’arthrite, le CD34 exacerbe plutôt l’inflammation en augmentant la perméabilité vasculaire.99 Bref, le rôle du CD34 dans l’inflammation peut être différent d’une pathologie à l’autre dépendamment des mécanismes impliqués.
Dans l’asthme allergique, le CD34 permet la migration des éosinophiles et des mastocytes dans les voies respiratoires. Il pourrait aussi contribuer à la production continue d’éosinophiles matures dans l’asthme et à la chronicité de la pathologie.100 Une autre étude a démontré que les cellules circulantes CD34+ peuvent agir telles des cellules effectrices pro-inflammatoires et ainsi contribuer à l’inflammation allergique.98 Ainsi, la délétion du gène protège contre le développement de l'asthme allergique.91 Toutefois, une étude sur le rôle du CD34 dans l’asthme allergique a suscité beaucoup d’intérêt et de questionnements à la suite des conclusions dévoilées. Cette étude est parue dans Blood en 2007. De façon intrigante, une perte de la réactivité du système respiratoire en réponse à la métacholine suivant l’exposition à l’allergène a été observée chez les souris Cd34-/- (comparativement
aux souris Cd34-/- naïves).95 Ce résultat est très surprenant et c’est principalement de cette figure que découle l’hypothèse de travail et les objectifs de ce mémoire (Figure 9).
33
Figure 9 : Réactivité du système respiratoire à des doses croissantes de métacholine, chez des souris ayant développé l’asthme allergique expérimental à l’ovalbumine (OVA). Une réactivité de base similaire est observée chez les souris naïves sauvages et Cd34-/- (carrés et
losanges). Tel qu’attendu, le gain de résistance du système respiratoire en réponse à la métacholine est augmentée chez les souris sauvages (wt) exposées à l’OVA (triangles). Cependant, les souris Cd34-/- exposées à l’OVA (cercles) démontrent une perte de réactivité
du système respiratoire en réponse à la métacholine, qui est même statistiquement inférieure à la réactivité du système respiratoire des souris naïves exposées au véhicule (carrés). Ceci indique un rôle crucial pour le CD34 dans la réactivité pulmonaire dans un contexte inflammatoire allergique.95
35
37
L’utilisation des animaux de laboratoire est une alternative dans le but d’étudier les multiples mécanismes complexes de la pathologie de l’asthme. En effet, pour des raisons éthiques ces études ne peuvent pas être réalisées chez l’humain. De plus, ces modèles permettent d’étudier différentes composantes de la pathologie. Les animaux de laboratoire les plus utilisés pour l’étude de l’asthme sont le cobaye, le rat et la souris.101 Cette dernière est la plus employée puisqu’il existe plusieurs variétés de souris modifiées génétiquement. Une plus grande gamme d’anticorps est également disponible sur le marché pour étudier cette espèce. La souris constitue aussi un excellent modèle pour l’étude immunologique puisque son système immunitaire s’apparente grandement à celui de l’être humain. 101,102
1. Différentes espèces de souris
Les espèces de souris les plus souvent utilisées pour mimer les réponses allergiques sont les BALB/c et les C57BL/6j. Les BALB/c sont les plus utilisées, car elles sont prédisposées à développer une réponse de type Th2 qui est à la base du développement de l’asthme. Elles sont aussi plus sensibles au développement de l’HRB.101, 103 Toutefois, dans ce mémoire, les C57BL/6j ont été employées, car le ‘backgound’ génétique des souris Cd34-/- avait été
fait avec les C57BL/6j. Le seul inconvénient, c’est qu’elles développent une plus faible HRB que les BALB/c, mais elles développent tout de même une réponse de type Th2.101,104
2. Différents modes d’administration de l’allergène et types d’allergène
Différents types d’allergènes peuvent être employés pour mener au développement de l’asthme chez la souris. L’ovalbumine (OVA) est une protéine dérivée des œufs de poules qui a longtemps et qui est encore utilisée comme allergène pour étudier l’asthme allergique.
38
La réponse allergique à l’OVA nécessite une période de sensibilisation en présence d’un adjuvant (hydroxyde d’aluminium). Cette sensibilisation peut s’effectuer par une injection intrapéritonéale ou par une administration intranasale de l’antigène. Par la suite, l’animal est soumis à une provocation allergénique répétée, directement dans les voies respiratoires (nébulisation ou intranasal). L’OVA a permis de comprendre le processus du développement de la réaction inflammatoire par l’étude des différentes cellules et médiateurs inflammatoires qui orchestrent la réponse de type Th2 dans un modèle aigu d’asthme.101, 105 Toutefois l’OVA est rarement impliquée dans l’asthme chez l’humain. Les chercheurs se sont donc tournés vers des protéines ayant plus de pertinence clinique comme les acariens (House Dust Mite : HDM) et les extrait de blattes.105
L’HDM est un allergène commun. On le retrouve un peu partout comme dans les lits, les tapis et les meubles rembourrés. Des chercheurs ont même démontré que 60% à 100% des asthmatiques sont sensibilisés au HDM et que cet antigène participerait au développement de l’hyperréactivité bronchique.105 Cela en fait donc un bon candidat pour l’étude de l’asthme. Cet allergène possède aussi une activité protéolytique intrinsèque (protéase riche en sérines et cystéines) le rendant plus efficace pour engendrer une réponse allergénique que l’OVA.105 En effet, l’HDM crée un microenvironnement au poumon qui est propice à une sensibilisation aux allergènes inhalés en augmentant la perméabilité bronchique et le détachement de cellules épithéliales. Il engendre aussi une augmentation du recrutement des éosinophiles et le développement d’une réponse de type Th2.105 Contrairement à l’OVA qui induit seulement une inflammation accrue et une hyperréactivité qui s’estompent rapidement, l’HDM occasionne une inflammation persistante, une hyperréactivité et un remodelage des voies respiratoires (augmentation du volume du muscle lisse, la déposition de matrice extracellulaire, la fibrose sous-épithéliale, l’hyperplasie des cellules épithéliales et l’hypersécrétion de mucus).102, 103, 105 La réponse engendrée par l’HDM se rapproche donc plus de la pathologie observée chez les patients asthmatiques.
39
3. Modèle d’asthme aigu versus asthme chronique
Le modèle aigu d’asthme allergique consiste en une courte période de provocation allergénique. Pour l’OVA et l’HDM, il s’agit d’une période d’exposition à l’allergène pour moins d’un mois.101 Tel que mentionné plus haut, ce type de modèle permet d’étudier l’éosinophilie et l’hyperréactivité des voies respiratoires. Cependant, les changements associés à ces deux caractéristiques sont maintenus sur une très brève période après la dernière sensibilisation et sont réversibles. Or, l’asthme est souvent défini comme une obstruction bronchique variable qu’on attribue à l’hyperréactivité causée par l’inflammation chronique. Le modèle chronique d’asthme allergique, récemment développé, consiste en une plus longue période de provocation allergénique. Pour l’OVA, cela nécessite une période supérieure à 12 semaines alors que pour l’HDM, 5 à 7 semaines sont suffisantes.101-103 Dans ce type de modèle, on observe tous les changements structuraux reliés au remodelage typique de la réponse asthmatique et qui sont considérés comme irréversibles. Le modèle chronique permet de prendre en compte toutes les composantes de l’asthme et leur interaction avec les cellules inflammatoires et structurales. Il permet certainement une meilleure compréhension du phénomène de remodelage et ses conséquences. C’est aussi un modèle qui est plus représentatif de la réalité et qui permet de faire des avancées quant au traitement de certains symptômes. Dans ce mémoire, le modèle chronique au HDM est utilisé.
41
43
1. Problématique
Le CD34 est une molécule qui est exprimé à la surface de différents types de cellules dont les cellules souches hématopoïétiques et les principales cellules inflammatoires impliquées dans l’asthme soient les éosinophiles et les mastocytes. En effet, au cours des dernières années, le CD34 a été reconnu pour être impliqué dans le développement de l’inflammation dans diverses pathologies inflammatoires en affectant le trafic des cellules inflammatoires jusqu’aux poumons. En absence du CD34, le trafic des cellules inflammatoires au sein du poumon est altéré ce qui entraîne une diminution de l’inflammation. En plus de jouer un rôle dans l’inflammation, une étude95 a récemment suggéré un rôle du CD34 dans la réactivité du système respiratoire en contexte d’asthme allergique expérimental. Une hyperréactivité est observée chez les souris wt exposées à l’allergène comparativement aux souris wt saline. En revanche, une perte de réactivité du système respiratoire est observée chez les souris Cd34-/- exposées à l’allergène comparativement aux souris wt et Cd34
-/-salines. L’expression du CD34 semble donc importante au maintien de la réactivité du système respiratoire. (Figure 9)
Le muscle lisse est le principal acteur de la réponse du système respiratoire. En contexte d’asthme allergique, il se contracte sous l’influence de spasmogènes sécrétés par les cellules inflammatoires et mène au développement d’une hyperréactivité bronchique. Toutefois, aucune étude n’a démontré l’expression du CD34 sur le muscle lisse et son implication potentielle sur les fonctions du muscle lisse. La littérature démontre l’expression du CD34 sur les précurseurs circulatoires du muscle lisse qui sont présents en grande quantité chez les asthmatiques. Ces précurseurs ont aussi été identifiés en périphérie du muscle lisse bronchique ou bien retrouvés intercalés au muscle lisse.
44
Ces observations révèlent un questionnement quant à l’expression potentielle du CD34 par le muscle lisse. En effet, une altération de la capacité contractile du muscle lisse ou un mauvais processus de réparation du muscle lisse à la suite d’une insulte allergique pourraient être à l’origine du phénotype de perte de réactivité du système respiratoire observé chez les souris Cd34-/- suivant l’exposition à l’allergène. Bref, le CD34 est-il
45
2. Hypothèse
L’hypothèse principale de cette étude est que le CD34 est exprimé à la surface du muscle lisse et qu’il joue un rôle dans la contractilité du muscle lisse, impliquée dans l’hyperréactivité du système respiratoire dans un modèle d’asthme allergique chez la souris.
3. Objectifs
1) Confirmer l’expression du CD34 sur des cellules musculaires lisses primaires (in
vitro) et sur des coupes histologiques de poumons.
2) Déterminer le rôle du CD34 dans la réactivité du système respiratoire dans un modèle d’asthme allergique au House Dust Mite (HDM).
3) Déterminer le rôle du CD34 dans la contractilité du muscle lisse par des études ex
vivo en bain d’organes.
4) Déterminer le rôle du CD34 sur les éléments non-contractiles participant à l’hyperréactivité du système respiratoire tels que la composition de la matrice extracellulaire et la production de mucus.
47