REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET
POPULAIRE
MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA
RECHERCHE SCIENTIFIQUE
UNIVERSITE BATNA 1
INSTITUT DES SCIENCES VETERINAIRES
ET DES SCIENCES AGRONOMIQUES
MEMOIRE
Pour l’obtention du diplôme de
Filière
Sciences vétérinaires
Option
Histologie et histopathologie des animaux domestiques
Présenté par :
BENREZAK Sara
THEME
JURY
Grade et université
Président : MEZIANE Toufik Prof- Université BATNA1
Examinateur : BENHAMZA-MANSAR Louiza Prof- Université de CONSTANTINE
Examinateur : HELEILI Nouzha MCA- Université BATNA1
Rapporteur : BENNOUNE Omar Prof- Université BATNA1
Année universitaire: 2017/ 2018
MAGISTER
Influence de certaines méthodes traditionnelles
de conservation sur la structure des viandes
I
REMERCIEMENTS:
Je tiens tout d’abord à remercier ALLAH le tout puissant, qui m’a accordé la force, le courage et la patience pour accomplir ce modeste travail, atteindre mon but et réaliser ainsi un
rêve,
Mes vifs remerciements et ma profonde gratitude s’adressent à mon promoteur monsieur, le professeur BENNOUNE Omar, de l’institut des sciences vétérinaires et agronomiques de
l’université de Batna, pour avoir accepté de diriger ce travail, pour son dévouement, ses précieux conseils, ses encouragements, sa patience, sa disponibilité et sa gentillesse,
J’exprime toute ma gratitude aux membres du jury :
Monsieur, le professeur MEZIANE Toufik, pour l’honneur qu’il m’a fait en acceptant de présider le jury : hommage respectueux,
Madame, BENHAMZA-MANSAR Louiza, pour avoir bien voulu examiner ce travail, Madame, HELEILI Nouzha, pour avoir bien voulu examiner ce travail,
Mes vifs remerciements vont plus particulièrement à messieurs les professeurs ALLOUI Nadir, AYACHI Amar et AISSI Adel, à monsieur ADILI Nezar, Maitre de conférences A,
et à monsieur NOUICER Ferhat, pour leurs aide et conseils si précieux,
Je remercie également madame KADRINE Naima, technicienne du laboratoire d’histologie du département vétérinaire, pour sa patience et son aide, pendant la réalisation de ce travail,
Je souhaite également présenter mes plus vifs remerciements à madame LOUCIF Asma et son mari monsieur Lotfi pour leurs précieux conseils et aide morale,
Je remercie tous ceux qui m’ont rendu service et qui ont contribué de près ou de loin pour accomplir ce travail.
II
DEDICACES :
Je dédie ce modeste travail à :
A mes très chers parents, pour tout ce que vous avez fait et faîtes encore pour moi aujourd’hui. Merci pour votre amour, votre soutien et vos sacrifices qui m’ont permis de
grandir et de réaliser mon rêve. Je vous aime très fort.
A la lumière de mes jours, la source de mes efforts, la flamme de mon cœur, ma vie et mon bonheur ; maman que j’adore,
A l’homme de ma vie, mon exemple éternel, mon soutien moral et source de joie et de bonheur, à toi mon père,
A mes chères sœurs : Loubna et Meriem,
A mon petit frère : Kamel Eddine,
A mes grands-parents,
A toute ma famille: Très chers oncles et leurs femmes, Tantes surtout Nounou qui m’a toujours bien accueilli,
A tous mes cousins et cousines: Nassim, Hani, Walid, Imen, Wafa, Marwa, Amira , Hadjer, Chaima, Samy, Mehdi, Majda, Maissa, Chemsou, Lydia et Badri...
A toutes mes amies : Rabiaa, Narimene, Sabrine, Romaissa et Bouchra
A mes camarades de promo : Meriem, Hadjira, Rahma, Saliha et Mounia, Sans oublier mes camarades doctorantes : Ismahene, Dalila, Safia et Leila qui m’ont
côtoyées dans le laboratoire, au fil des jours.
III
SOMMAIRE:
REMERCIEMENTS I
DEDICACE II
TABLES DES ILLUSTRATIONS VI
LISTE DES ABREVIATIONS IX
INTRODUCTION 1
CHAPITRE I : ETUDE BIBLIOGRAPHIQUE :
1. STRUCTURE ET COMPOSITION 3
1.1.Définition 3
1.2.Importance 3
1.3.Structure histologique 3
1.3.1. Tissu musculaire 4
1.3.1.1.Description de la cellule musculaire 5
1.3.1.1.1. Sarcolemme 5
1.3.1.1.2. Sarcoplasme 6
1.3.1.1.3. Mitochondries 6
1.3.1.1.4. Myofibrilles 7
1.3.1.2.Contraction musculaire 10
1.3.1.3.Typologie des fibres musculaires 11
1.3.2. Tissu conjonctif intramusculaire 13
1.3.2.1.Composition 13
1.3.2.1.1. Cellules 13
1.3.2.1.2. Matrice extracellulaire 13
a. Les fibres 13
b. La substance fondamentale 16
1.3.2.2.Organisation du tissu conjonctif dans le muscle 17
1.3.3. Tissu adipeux et lipides intramusculaires 19
1.3.4. Relation entre les différents composants tissulaires 20
2. EVOLUTION DU MUSCLE EN VIANDE 21
2.1.Les phases de transformation du muscle en viande 22
2.1.1. Mort cellulaire programmée 22
2.1.2. Etat pantelant 23
2.1.3. Etat rigide 23
2.1.4. Etat mature 24
2.2.Evolution des paramètres physico-chimiques et biochimiques au cours de la transformation du muscle en viande
25
2.2.1. La température 25
2.2.2. Le pH 25
2.2.3. La capacité de rétention d’eau (CRE) 26
2.2.4. La pression osmotique 26
2.3.Evolution structurale 27
2.3.1. Evolution de la structure myofibrillaire 27
2.3.2. Evolution de la structure collagénique 29
2.4.Les qualités organoleptiques de la viande 29
2.4.1. La couleur 30
2.4.2. La tendreté 31
2.4.3. La flaveur 31
2.4.4. La jutosité 32
IV
2.5.1. Facteurs intrinsèques 32
2.5.2. Facteurs extrinsèques 32
2.6.Evolution post-mortem anormale : principaux défauts qualitatifs de la viande rouge
32
2.6.1. Viandes exsudatives (PSE) 32
2.6.2. Viandes à coupe sombre (DFD) 33
3. ALTERATION DE LA VIANDE 34
3.1.Causes d’altération de la viande 34
3.1.1. La détérioration microbienne 35
3.1.2. L’oxydation des lipides 36
3.1.3. L’autolyse enzymatique 36
3.2.Les signes d’altération de la viande 36
4. CONSERVATION DE LA VIANDE 37
4.1.Bases de la conservation de la viande 37
4.2.Les méthodes traditionnelles 38
4.2.1. Le salage 38
4.2.1.1. Le sel 38
4.2.1.2. Les nitrites 39
4.2.2. Le séchage 39
4.2.3. Le fumage 40
4.3.Les procédés technologiques 41
4.3.1. Conservation par le froid 41
4.3.1.1.La réfrigération 41
4.3.1.2.La congélation 41
4.3.1.3.La surgélation 42
4.3.2. Conservation par la chaleur 42
4.3.2.1.Techniques 42
4.3.2.1.1. Pasteurisation 42
4.3.2.1.2. Stérilisation 42
4.3.3. Conservation par les radiations ionisantes 43
4.3.4. Conservation par les agents chimiques 44
4.3.4.1.Les acides organiques 44
4.3.4.1.1. L’acide lactique 44
4.3.4.1.2. L’acide ascorbique 44
4.3.4.1.3. L’acide benzoïque 44
4.3.4.1.4. L’acide sorbique 44
4.3.4.2.Les antioxydants 45
4.3.5. La conservation par la haute pression hydrostatique 45
4.3.6. L’emballage 46
CHAPITRE II : MATERIEL ET METHODES
1. Préparation des viandes 47
1.1.Viande salée et séchée : « Guedid » 47
1.2.Viande salée, épicée et cuite : « Khliaa ezir » 49
2. Etude de certains paramètres 51
2.1.Choix des morceaux 51
2.2.Mesure de l’activité de l’eau 51
2.3.Détermination de la teneur en eau 52
2.4.Détermination de la structure histologique 53
2.4.1. Fixation et préparation des échantillons 53
V
2.4.2.1.Déshydratation 54
2.4.2.2.Clarification 54
2.4.2.3.Imprégnation 54
2.4.3. Inclusion et mise en bloc 55
2.4.4. Confection des coupes et montage sur lames 56
2.4.5. Coloration 56
2.4.6. Montage des lames 58
2.4.7. Observation microscopique et analyse des images 58
2.4.8. Analyse des résultats 61
CHAPITRE III : RESULTATS ET DISCUSSION
1. Activité de l’eau 62
2. Teneur en eau 66
3. Etude histologique 68
3.1.Le diamètre des fibres 68
3.2.La surface de l’espace extracellulaire 74
3.3.Les proportions du tissu conjonctif intramusculaire 78
3.4.Evaluation histologique du « Guedid commercial » 84
CONCLUSION 87
REFERENCES 88
VI
TABLE DES ILLUSTRATIONS :
1. LISTE DES FIGURES :
Figure 01 : Muscle en coupe transversale (Guo et Greaser, 2017). 4 Figure 02: Diagramme des tubules T et le réticulum sarcoplasmique en vue
longitudinale du muscle squelettique (Pearson et Young, 1989).
6
Figure 03: section longitudinale du muscle psoas du lapin, observé sous microscope à transmission électronique, qui montre des parties de 7 myofibrilles (Pearson et Young, 1989).
8
Figure 04 : Microstructure d’une fibre musculaire (Guo et Greaser, 2017). 9 Figure 05: Les filaments d’actine et myosine (Lefaucheur, 1989). 10 Figure 06: Série de sections de 3 muscles majeurs: (X100) (Hwang et al.,
2010).
12
Figure 07: Organisation des différents niveaux de tissu conjonctif dans le muscle squelettique (Maunier-Sifre, 2005).
17
Figure 08 : coupes histologiques du muscle droit de l'abdomen colorées avec H&E et Trichrome de Masson (Calvi et al., 2012)
18
Figure 09 : Caractérisation des différents types de faisceaux à l’intérieur d’un faisceau principal (Maunier-Sifre, 2005).
19
Figure 10: Etapes de transformation du muscle en viande (Ouali et al., 2006). 22 Figure 11: Couleur et texture de la viande (Dave et Ghaly, 2011). 34 Figure 12: Principales techniques de conservation des aliments (Rahman,
2007).
37
Figure13 : Quelques produits carnés traditionnels. (http:// allnigerianrecipes.com/snacks/nigerian-suya-recipe.html.,
http://arewadaily.com/interesting-easy-ways-make-spicy-northern-nigerian-kilishi-meat/ , https://fr.wikipedia.org/wiki/Carne_seca,
https://fr.wikipedia.org/wiki/Biltong) visités le 14/02/2018, (Benkerroum, 2013) (Gagaoua et Boudechicha, 2018)
40
Figure 14: étapes de préparation du Guedid 47
Figure 15: Diagramme de préparation du Guedid (Bennani et al., 1995) 48
Figure 16 : étapes de préparation de Khliaa ezir 49
VII
Figure 18: Guedid commercial. 51
Figure 19: mesure de l’activité de l’eau du Guedid commercial par le Rotronic. 52 Figure20: Etuve utilisée pour la déssication des échantillons 52
Figure21: échantillon coupé et mis en cassette. 53
Figure 22: Automate. 54
Figure23: Les deux appareils utilisés pour l’inclusion et la mise en bloc 55 Figure24: Appareillage pour la confection et le montage des coupes. 56
Figure 25 : Diagramme des 2 colorations utilisées. 57
Figure 26 : Montage et Collage des lamelles. 58
Figure 27 : Calcul du diamètre moyen des fibres musculaires du Guedid 60 Figure 28 : Détermination des proportions du tissu conjonctif intramusculaire
de la viande bovine
60
Figure 29 : Calcul de l’espace extracellulaire 61
Figure 30: Valeurs de l’aw des produits carnés préparés. 62
Figure 31: Effet des deux méthodes traditionnelles « Khliaa ezir » et « Guedid » sur la teneur en eau de la viande.
66
Figure32: Evolution du diamètre des fibres musculaires des viandes bovine et ovine en fonction des différents traitements.
70
Figure33: Changements du diamètre des fibres musculaires sous l’effet des différents traitements, (HE, X400).
71
Figure34: Infestation de la viande ovine par des parasites de Sarcocystis spp. (HE, X400)
72
Figure35: Evolution de la surface occupée par l’espace extracellulaire dans les viandes transformées
76
Figure36: Modification de la surface occupée par l’espace extracellulaire dans les produits préparés (HE, X100)
77
Figure37: Evolution de la proportion du tissu conjonctif intramusculaire des différents produits carnés
80
Figure38: Modification des proportions du TCIM par l’effet des différents traitements, (Trichrome de Masson, X100).
81
Figure39: Les changements structuraux du Guedid commercial observés avec différents grossissements et colorations.
85
VIII
2. LISTE DES TABLEAUX :
Tableau 01: Caractéristiques biologiques des principaux types de fibres musculaires (Lefaucheur, 2010).
12
Tableau 02 : Structure et localisation des différents types de collagènes présents dans le muscle squelettique (Maunier-Sifre, 2005).
16
Tableau 03: Etapes pour effectuer les mesures histomorphométriques. 59 Tableau 04: Les valeurs de l’activité de l’eau des viandes fraiches et préparées. 62 Tableau05: Les valeurs minimales de l’activité de l’eau pour la multiplication
des micro-organismes associés aux aliments (Rodel, 2001).
64
Tableau 06: Valeurs minimales de l’aw pour la production des toxines (Rodel,
2001).
65
Tableau 07: Effet des deux méthodes traditionnelles sur la teneur en eau de la viande.
66
Tableau08: Evolution du diamètre des fibres de la viande bovine en fonction des différents traitements.
68
Tableau09: Evolution du diamètre des fibres de la viande ovine en fonction des différents traitements.
69
Tableau10: Evolution des proportions du tissu conjonctif intramusculaire de la viande bovine.
74
Tableau11: Evolution des proportions du tissu conjonctif intramusculaire de la viande ovine.
75
Tableau12: Modification de la surface occupée par l’espace extracellulaire dans les produits issus de la viande bovine.
78
Tableau13: Modification de la surface occupée par l’espace extracellulaire dans les produits issus de la viande ovine.
79
Tableau14: Tableau récapitulatif des résultats obtenus. 83
Tableau15: Mesures histomorphométriques des différents paramètres du Guedid commercial.
IX
LISTE DES ABBREVIATIONS :
RS : Réticulum sarcoplasmiqueADP : Adénosine DiPhosphate ATP : Adénosine TriPhosphate
TCIM : Tissu conjonctif intramusculaire CL : cross links
MEC : Matrice extracellulaire PG : protéoglycanne
GAG : GlycoAminoGlycanne LIM : Lipides intra musculaire MMP : Matrix Metalloproteinsase H&E : Hématoxyline-Eosine TM : Trichrome de Masson Aw: Activité de l’eau
1
INTRODUCTION
La viande occupe une place de choix dans notre alimentation en raison de son niveau de consommation dans le monde qui reste très important et, sa composition permettant de couvrir une proportion importante des apports nutritionnels conseillés en certains nutriments : vitamines B 3, B 6 et B 12, fer, zinc (Bauchart et Gandemer, 2010), des protéines de haute qualité, et des matières grasses tel que l’oméga-3 (Williams, 2007).
Cependant, sa richesse en eau et en protéines fait d’elle un aliment hautement périssable et un milieu favorable à la prolifération microbienne. Sa contamination a lieu juste après l’abattage, dès les premières étapes de dépeçage et d’éviscération. En effet, les micro-organismes présents sur le cuir et dans le tractus digestif constituent la source principale de contamination de la surface des muscles, les étapes ultérieures de découpe et de transformation révéleront autant d’étapes de contamination possibles par les microorganismes présents dans l’environnement des ateliers : l’air, les surfaces, les équipements et les manipulateurs (Vergès et al., 2010). Pour cela, les processus de la conservation sont basés sur l’inhibition de la croissance des microorganismes pathogènes, en agissant sur les différents facteurs qui influent leur développement, y compris les températures de réfrigération et congélation, l’addition des agents conservateurs (Rahman, 2007), les traitements
thermiques, les procédés à hautes pressions, et les radiations ionisantes, bien qu’ils existent d’autres méthodes qui visent à minimiser les changements de la viande (couleur, phénomène d’oxydation)
(Zhou et al., 2010).
Avant l’apparition de ces technologies, l’homme a toujours cherché des procédés pour conserver la viande afin d’assurer son approvisionnement en période de disette, en utilisant les outils les plus simples et qui sont disponibles à tout moment.
En Algérie, les méthodes traditionnelles de conservation de la viande sont peu nombreuses et ne sont pas tous recensées. Malheureusement, plusieurs d’entre eux sont en voie de disparition, pour différentes raisons dont l’indisponibilité fourragère qui influe sur le prix de la viande, l’exode rurale et le changement des habitudes alimentaires (Boudechicha, 2014).
Notre étude se concentre sur les deux méthodes traditionnelles les plus connues « Khliaa ezir » et « Guedid », qui à notre connaissance, n’ont pas fait l’objet d’études histologiques, puisqu’en Algérie, d’après Bennoune et al. (2017), les techniques histologiques ne sont pas encore utilisées dans le secteur de la fabrication, et surtout, pour le contrôle de la qualité des produits carnés.
2 Notre étude a pour objectifs :
• De caractériser les méthodes traditionnelles de conservation les plus utilisées en Algérie. • De déceler les différentes modifications physico-chimiques et sous-jacentes subies par ces
viandes, et leurs effets sur sa qualité.
• De montrer l’intérêt de l’histologie dans le domaine du contrôle de qualité des aliments. Pour cela, notre travail s’est déroulé en plusieurs étapes :
- La préparation traditionnelle des viandes :
o Salée et séchée par l’exposition au soleil : Guedid o Salée et marinée dans les épices puis cuite : Khliaa-Ezir - La mesure de l’activité de l’eau,
- Le calcul de la teneur en eau, - L’étude histologique.
CHAPITRE I :
ETUDE
3
CHAPITRE I: ETUDE BIBLIOGRAPHIQUE
1. STRUCTURE ET COMPOSITION :1.1. Définition de la viande :
Selon l’organisation mondiale de la santé animale, la viande désigne toutes les parties comestibles d’un animal. C’est la matière alimentaire composée du tissu musculaire squelettique (muscles striés) obtenue après la mise à mort des mammifères domestiques
(Craplet, 1966), les animaux pris en considération selon Williams (2007) sont : les bovins, les ovins, les caprins, les buffles, les chameaux, les chevreuils, les lièvres, les porcs, les volailles et les lapins.
1.2. Importance de la viande dans l’alimentation :
La viande nous apporte beaucoup de nutriments essentiels pour une alimentation équilibrée, tels que les sels minéraux (zinc, le fer, le sélénium), les vitamines (B12, B6, B3), les protéines de haute qualité, et une gamme de lipides, surtout l’oméga-3 et les acides gras polyinsaturés (Williams, 2007).
1.3. Structure histologique :
Le tissu musculaire représente le tissu noble des animaux domestiques élevés pour la production de viande (Jurie et Listrat, 2010). La masse musculaire des animaux de rente, destinée à l’alimentation humaine, représente 35 à 60 % de leur poids vif. Elle est composée, pour les animaux terrestres, de plus de 600 muscles dont environ 570 sont des muscles striés squelettiques, par opposition aux muscles lisses et au myocarde. Les muscles squelettiques montrent une grande diversité en forme, taille, localisations anatomiques et fonctions physiologiques. Ceux attachés à la colonne vertébrale sont impliqués dans les mouvements volontaires, et facilitent la locomotion et maintiennent la posture des animaux (Listrat et al., 2015).Ils sont à l’origine de la transformation de l’énergie des nutriments en force motrice
(Jurie et Listrat, 2010).Le muscle est caractérisé par une structure composée, car, en plus des fibres musculaires, il contient le tissu conjonctif, adipeux, vasculaire, et le tissu nerveux
(Listrat et al., 2015).
La couleur de la viande est liée à la présence de la myoglobine. Le sang résiduel apporte, quant à lui, une très faible quantité d’hémoglobine. La quantité de la myoglobine dépend entre autres facteurs, de la race et de la nature du muscle, elle augmente avec l’âge de l’animal. Chez l’animal vivant, la myoglobine assure le relais de l’hémoglobine pour le transport de l’oxygène. Après la mort de l’animal, cette protéine conserve, tant qu’elle n’a pas
4
été dénaturée par la chaleur ou le séchage, la propriété de s’oxyder ou de se réduire et de s’oxygéner (fixation d’oxygène sans oxydation) (Durand, 2005)
1.3.1. Le Tissu musculaire :
Le tissu musculaire strié est composé d’une centaine de muscles dont le poids varie chez les gros bovins, de quelques grammes à plus de 10kg (Craplet, 1966).
Les muscles squelettiques sont colorés en rouge ou en rose, par les pigments musculaires et sanguins. La variation dans la quantité des pigments présents dans le muscle, nous permet de distinguer deux types de muscles : Les muscles blancs et les muscles rouges
(Pearson et Young, 1989).
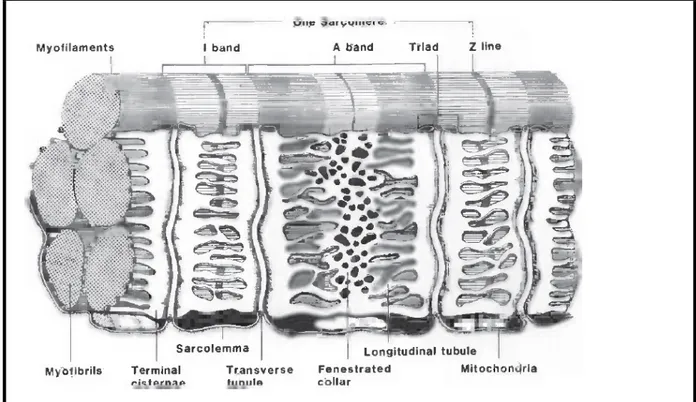
Le muscle squelettique, qui constitue la plus grande partie de la masse corporelle, est composé de milliers de fibres musculaires striées allongées et liées entre elles par le tissu conjonctif contenant les nerfs et les vaisseaux (Kadim et Mahgoub, 2007). La figure 01 représente une section transversale du muscle en coupe histologique et en schéma.
(a) (b)
Figure 01:Muscle en coupe transversale, (Eronschenko, 2008 ; Guo et Greaser, 2017) (a) : schéma illustrant les différents éléments constitutifs du muscle
5 1.3.1.1. Description de la cellule musculaire :
C’est une cellule très différenciée appelée fibre musculaire ayant la forme d’un prisme polygonal très allongé : le diamètre varie de 10 µm à 100 µm, la longueur varie de 3 à 20 cm voire plus (Craplet, 1966). Chez toutes les espèces, la taille de la fibre musculaire augmente avec l’âge, constituant ainsi un paramètre important de la croissance musculaire postnatale
(Listrat et al., 2015).
Une fibre musculaire est entourée et supportée par une couche fine du tissu conjonctif, formé par les fibres de collagène, réticulaires et des fibres élastiques fines. Elle permet même le passage des capillaires sanguins, et des filets nerveux qui fournissent la nourriture et le contrôle nerveux au tissu musculaire (Pearson et Young, 1989).
Chaque fibre musculaire est plurinucléée, avec des noyaux en périphérie de la cellule juste en dessous du sarcolemme. Le nombre élevé des noyaux et leur localisation, caractérisent la fibre musculaire squelettique (Pearson et Young, 1989).
1.3.1.1.1. Le sarcolemme,
La membrane plasmique de la fibre musculaire s’appelle : le sarcolemme (Listrat et al., 2015), c’est une membrane mince et transparente, constituée de deux membranes :
• la membrane plasmatique : la couche la plus interne,
• la membrane basale : la couche externe, qui se compose d’une lame basale interne et une lame réticulaire externe (Pearson et Young, 1989).
Cette membrane plasmique joue un rôle dans le maintien de la structure, et de la fonction du muscle squelettique. En plus des fonctions d’entretien de la cellule musculaire, le sarcolemme est directement impliqué dans la transmission synaptique et la propagation du potentiel d’action (Campbell et Stull, 2003).
Les invaginations du sarcolemme, augmentent la surface de la membrane, et forment un réseau de tubules, le long de la fibre musculaire, se dirigeant transversalement à travers le sarcomère à la jonction A-I, appelés tubules transverses ou tubules T (figure 02).
Le réticulum sarcoplasmique (RS) contient de petits tubules longitudinaux (tubules L), orientés parallèlement à l’axe de la fibre, qui se convergent dans la jonction A-I pour former des citernes terminales. Le tubule T divise la citerne terminale en deux éléments (Pearson et Young, 1989). Une TRIADE est égale à deux éléments de la citerne terminale plus un tubule T.
6
Figure 02:Diagramme des tubules T et le réticulum sarcoplasmique en vue longitudinale du muscle squelettique (Pearson et Young, 1989)
Le réticulum sarcoplasmique est estimé à 3% du volume total de la fibre musculaire. Il est impliqué dans la contraction musculaire, étant donné que les triades représentent le site de liaison et libération du Ca2+ pendant la relaxation et après stimulation (Pearson et Young, 1989).
Le rôle biologique du sarcolemme est le maintien de la différence des concentrations ioniques, avec une solution extracellulaire riche en Na+ et Cl- et une solution intracellulaire riche en K+ (Craplet, 1966).
1.3.1.1.2. Le sarcoplasme :
Le sarcolemme limite le sarcoplasme : homogène ou finement grenu, imprégné du pigment responsable de la coloration rouge du muscle : le myoglobine, c’est ici où baignent les myofibrilles, les mitochondries, le noyau, et les autres éléments structuraux de la cellule musculaire. Les gouttelettes lipidiques et les granules glycogéniques sont aussi présents au niveau du sarcoplasme de la cellule musculaire (Craplet, 1966 ; Pearson et Young, 1989).
1.3.1.1.3. Les mitochondries :
La mitochondrie, dans le muscle squelettique, est facilement reconnaissable par sa forme, sa taille et sa distribution (Pearson et Young, 1989). Elle est ronde, ovale ou cylindrique, avec une surface externe lisse. Elle est caractérisée par un diamètre d’environ 1µm, et une
7
longueur de 3 à 4 µm, et est beaucoup plus nombreuse dans les fibres rouges que dans les fibres blanches.
La mitochondrie joue un rôle majeur dans le métabolisme énergétique : elle génère des ATP en consommant de l’oxygène et des substrats (Peterson et al., 2012) en contenant les éléments nécessaires pour l’oxydation, le transport des électrons, et la synthèse des ATP (Pearson et Young, 1989).
1.3.1.1.4. Les myofibrilles :
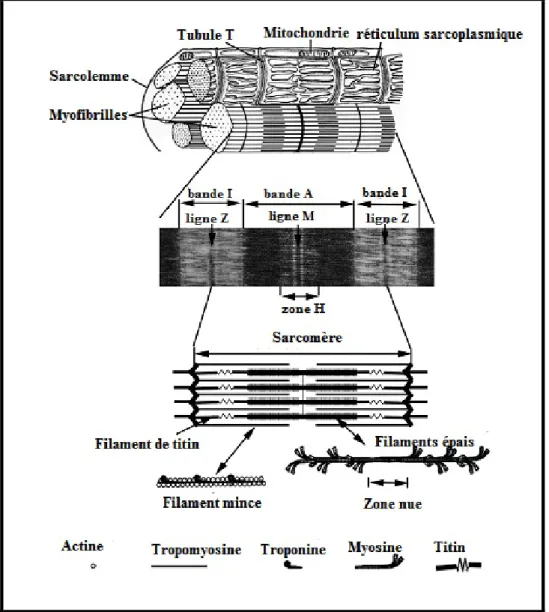
La fibre musculaire est l’unité fondamentale du muscle. Même isolée mais stimulée, elle peut se contracter, et maintenir toutes les fonctions du muscle, bien qu’elle fonctionne dans de larges unités. Elle est constituée de petites sous unités appelées : les myofibrilles, regroupées en faisceaux formant des colonnettes, qui en coupe transversale apparaissent comme des aires polygonales finement pointillés, ayant approximativement un diamètre de 1𝜇𝜇m, leurs propriétés expliquent la physiologie musculaire ; le groupement des myofibrilles en faisceaux donne à la fibre sa « striation longitudinale » tandis que « la striation transversale » est due à la structure hétérogène très particulière, et au fait que les éléments de même nature de toutes les fibrilles d’une même fibre sont situés à des niveaux correspondants ce qui fait dire que la striation est concordante (Craplet, 1966 ; Pearson et Young, 1989).
Chaque myofibrille contient un certain nombre de filaments longs et minces : les myofilaments qui représentent 80-87% du volume de la fibre musculaire (Pearson et Young, 1989).
Les myofibrilles ont un aspect strié caractéristique facilement observable par la microscopie optique en tant que bandes claires I (Isotropes) et sombres A (anisotropes ou biréfringentes) (Ertbjerg et Puolanne, 2017 ; Pearson et Young, 1989).
Chaque bande I est partagée en deux par la strie Z. L’unité répétitive comprise entre deux stries Z constitue le sarcomère, l’unité fonctionnelle contractile de la myofibrille, et qui est composé d’au moins une trentaine de protéines différentes dont les plus abondantes sont la myosine et l’actine (Listrat et al, 2015)(figure 03)
8
Figure 03: section longitudinale du muscle psoas du lapin, observé sous microscope à transmission électronique, qui montre des parties de 7 myofibrilles (Pearson et Young, 1989)
La bande (A), La bande (I), La line (Z), La zone (H), et la line (M) sont mentionnées.
La bande sombre A est composée de filaments fins et épais et elle est partagée en son milieu par la ligne M, alors que la bande claire I ne contient que des filaments fins (Listrat et al, 2015) (figure 04).
La ligne Z est constituée de protéines appelées « Desmines » qui servent de ponts entre les filaments minces des sarcomères adjacents, elles relient, donc, les myofibrilles adjacentes à ce niveau (Toldrá et Reig, 2015).
9
Figure 04 : Microstructure d’une fibre musculaire (Guo et Greaser, 2017)
• Les protéines myofibrillaires majeures: Ce sont les constituants principaux des myofibrilles, Elles constituent le squelette de la myofibrille.
1. La myosine : C’est une grosse molécule qui se présente sous une forme très allongée. Ses principales propriétés sont : forte charge électrique, activité ATPasique catalyse la dégradation de l'ATP en ADP et fournit l'énergie chimique nécessaire à la contraction musculaire (Craplet 1966, Listrat et al., 2015).Il existe de nombreux types de myosine selon leur vitesse d’hydrolyse d’ATP, mais le plus abondant dans le muscle strié est la myosineII (Swartz et al., 2009).
2. L’actine : Elle constitue la protéine la plus abondante dans le muscle, en terme de quantité molaire, étant presque 600µM (Swartz et al., 2009). Elle existe sous plusieurs formes (Actine G, F…)(Craplet, 1966) (figure 05).
10
• Autres protéines : Ce sont des protéines ayant des fonctions de, régulation comme la tropomyosine et les troponines impliqués dans la contraction musculaire et la relaxation, de liaison, entre les sarcomères adjacents (Desmines), et entre les fibres pour assurer la continuité longitudinale (Titine et Nébuline) (Toldráet Reig, 2015).
Figure 05 : Les filaments d’actine et myosine (Lefaucheur, 1989)
1.3.1.2. Contraction musculaire :
C’est au niveau de la fibre que s’opère la transformation de l’énergie chimique en énergie mécanique lors de la contraction. Dans la plupart des muscles squelettiques de mammifère adulte, chaque fibre musculaire reçoit une seule terminaison nerveuse au niveau de la plaque motrice (Changeux et Mikostiba, 1978; Lefaucheur, 1989).
Chaque neurone moteur peut se ramifier et innerver plusieurs fibres, cet ensemble neuromusculaire constitue l’unité motrice. L’excitation de la fibre, initiée au niveau de la plaque motrice, se propage sur toute la surface de la cellule et le long des tubules transverses sous forme d’un potentiel d’action. Cette excitation est transmise au réticulum sarcoplasmique (RS) selon un mécanisme encore obscur. Le réticulum sarcoplasmique répond en relarguant des ions Ca++ dans le sarcoplasme où la concentration en Ça++ passe de 10-7 à 10-5. Les ions se lient à la troponine C, stimulent l’ATPase myofibrillaire et déclenchent la contraction. C’est au niveau des têtes de la myosine que s’opère l’interaction avec l’actine et l’hydrolyse de l’ATP. La relaxation survient dès que la concentration sarcoplasmique des ions Ca++ retrouve le niveau de repos (10 -7 M). Dans ce processus, les ions Ca++ sont re-pompés par le réticulum sarcoplasmique et les mitochondries selon un mécanisme de transport actif consommateur d’ATP (Lefaucheur, 1989). La contraction musculaire est assurée par le glissement des filaments
11
d’actine par rapport aux filaments de myosine, au sein d’un sarcomère. Elle se traduit par un raccourcissement des sarcomères, donc de la fibre (Coibion, 2008).
1.3.1.3. Typologie des fibres musculaires :
La classification des fibres musculaires repose sur un critère fonctionnel (la vitesse de contraction) et sur un critère métabolique (le type de métabolisme énergétique) correspondant respectivement à la vitesse d’utilisation de l’énergie au cours de la contraction et à la source principale d’énergie (Jurie et Listrat, 2010).
Deux voies majeures de régénération de l’ATP sont utilisées dans le muscle : la voie oxydative (aérobie) par laquelle le pyruvate issu de la dégradation du glycogène et du glucose, les acides gras, les corps cétoniques et certains acides aminés sont oxydés au niveau de la mitochondrie, et la voie glycolytique (anaérobie) dans laquelle le pyruvate est fermenté de façon anaérobie en acide lactique dans le sarcoplasme (Listrat et al., 2015).
L’histochimie permet la distinction entre les différents types de fibres (figure 06). Leur nombre dépend de la méthode utilisée (Totland et Kryvi., 1991). En général, trois principaux types de fibres sont distingués, elles sont classées en SO (slow oxidative), FOG (fast
oxido-glycolytic) et FG (fast oxido-glycolytic) selon la classification de Peter et al.(1972) basée à la fois sur
leurs propriétés contractiles et métaboliques (Picard, 2003). Les caractéristiques contractiles dépendent principalement des isoformes de chaînes lourdes de myosine (MyHC) présentes au sein des filaments épais. Dans les muscles squelettiques matures de mammifères, 4 types de MyHC sont exprimées (I, IIa, IIx et IIb). Les trois derniers ne sont pas présents dans les muscles squelettiques matures de toutes les espèces. L’importance relative des deux voies de régénération d’ATP détermine le type métabolique des fibres : oxydatifs (rouges : riches en myoglobine, transporteur d’oxygène, et en mitochondries, ce qui va de pair avec une capacité aérobie augmentée) et glycolytiques (blanches : presque dépourvues de myoglobine car les besoins en oxygène sont très limités) (Jurie et Listrat, 2010 ; Listrat et al, 2015).
Brièvement, les fibres de type I, à vitesse de contraction lente, possèdent une faible activité ATPasique et une activité glycolytique moins élevée que celle des fibres à contraction rapide : elles présentent un plus faible taux de glycogène et de glucose que les fibres II, elles sont surtout riches en lipides, c’est pourquoi elles sont plus juteuses que les fibres blanches. La vitesse de contraction des fibres rapides est trois fois plus grande que dans les fibres lentes. Les fibres rapides de type IIA et IIX présentent une vitesse de contraction similaire, mais plus lente que celle des fibres de type IIB. De toute façon, les fibres rapides utilisent
12
préférentiellement le glucose comme source énergétique (Joo et al., 2013 ; Jurie et Listrat, 2010 ; Talmant et Monin, 1986).
La composition en type de fibres musculaires varie d’un muscle à l’autre selon sa fonction et sa localisation anatomique, en particulier chez le bovin entre les muscles de l’avant et ceux de l’arrière (Jurie et Listrat, 2010). Le tableau 01 montre les propriétés contractiles et métaboliques des différents types de fibres.
Tableau 01:Caractéristiques biologiques des principaux types de fibres musculaires (1)
(Lefaucheur, 2010).
Caractéristiques biologiques I IIA IIX IIB
Vitesse de contraction + +++ ++++ +++++ Résistance à la fatigue +++++ ++++ ++ + Métabolisme oxydatif +++++ ++++, +++++ +, ++ + Métabolisme glycolytique + ++++ ++++ +++++ Vascularisation +++++ +++ +, ++ + Glycogène + +++++ ++++ +++++ Triglycérides +++++ ++ + + Phospholipides +++++ ++++ +++ + Myoglobine +++++ +++ +, ++ +
(1) + : très faible; ++ : faible; +++ : moyen; ++++ : élevé; +++++ : très élevé.
(a) (b) (c)
Figure 06: Série de sections de 3 muscles majeurs: (X100) (Hwang et al., 2010)
13 1.3.2. Le tissu conjonctif intramusculaire :
La structure, la composition et la quantité de tissu conjonctif intramusculaire (TCIM) varient énormément entre les muscles, les espèces et les races, et contribuent certainement à la texture de la viande (Nishimura et al., 2010). Il joue un rôle très important dans la détermination des qualités organoleptiques de la viande notamment la tendreté. Les fonctions du tissu conjonctif sont multiples et très importantes :
- Fonction mécanique : en réunissant les divers tissus et organes entre eux et à la paroi du corps,
- Fonction de protection : en jouant le rôle du tissu d’emballage,
- Fonction de nutrition : car imbibé de liquide interstitiel, il est impliqué dans la nutrition cellulaire (Craplet, 1966)
Le tissu conjonctif qui entoure les fibres musculaires et les faisceaux de fibres est un tissu conjonctif lâche. Il est constitué de cellules et d’une matrice extracellulaire (MEC), composée principalement d’un réseau composite de fibres de collagène enveloppées dans une matrice de protéoglycanes (Listrat et al., 2015).
1.3.2.1. Composition du tissu conjonctif intramusculaire : 1.3.2.1.1. Cellules:
Les cellules les plus communément observées dans le tissu conjonctif musculaire sont les fibroblastes. Ces cellules sont fusiformes. Des histiocytes (macrophages présents dans les tissus) et des mastocytes (granulocytes basophiles des tissus) sont aussi présents dans les tissus musculaires striés, les mastocytes étant le plus souvent observés autour des vaisseaux sanguins. On trouve également des cellules adipeuses, ou adipocytes, qui se regroupent en lobules et stockent les lipides intramusculaires (Jurie et Listrat, 2010).
1.3.2.1.2. Matrice extracellulaire :
Les éléments qui constituent la matrice extracellulaire du conjonctif musculaire sont les fibres et les molécules solubles.
a. Les fibres :
Il existe deux types de fibres de tissu conjonctif, à savoir collagène et élastique. Bien qu'un troisième type de fibre connu sous le nom de réticuline soit reconnu par les histologistes en raison de son affinité pour la coloration à l'argent, il s’agit d'une autre forme de collagène
14 Les collagènes :
Les collagènes appartiennent à une famille de glycoprotéines fibreuses synthétisées et
sécrétées par les cellules des tissus conjonctifs et divers autres types cellulaires. Ils représentent 25 % des protéines totales de l’organisme (Jurie et Listrat, 2010).
Le collagène est la protéine la plus abondante chez les vertébrés, il représente la majeure partie des protéines de la matrice extracellulaire du muscle, constitue le composant le plus fort du tissu musculaire, et participe à la dureté de base. Il est caractérisé par la diversité en taille et en forme d’où la différenciation en plusieurs types. Cependant, quelque soit le type de collagène, la structure générale des molécules de collagène est une triple hélice polypeptidique, appelée tropocollagène, composée de trois polypeptides constitués de répétitions Gly-X-Y, où X est un acide aminé quelconque, et Y est fréquemment la proline ou l'hydroxyproline. Les molécules de tropocollagène s'assemblent entre elles par des liaisons covalentes pour former des fibrilles de 50 nm de diamètre. Ces fibrilles sont stabilisées par des liaisons intra moléculaires (ponts disulfures ou hydrogènes) ou inter moléculaires (dont la pyridinoline et la déoxypyridinoline) qui sont appelées liaisons de réticulation ou «
Cross-Links » (CL) (Bailey, 1972 ; Hulmes, 2008 ; Maunier-Sifre, 2005 ; Sato et al., 2002).
La molécule du collagène varie selon la taille et la composition, résultant ainsi plusieurs types de collagène, ayant des fonctions et des localisations différentes. Vingt-neuf isoformes, dont 7 existent dans le muscle strié, ont été identifiés jusqu’à présent : Collagène I, III, IV, V, VI, XII et XIV. Les collagènes I et III sont les principaux types retrouvés dans le muscle squelettique (Bailey et Light, 1989 ; Listrat et al., 1998 ; McCormick, 2009 ; Sato et al., 2002).
Ils sont le produit de plus de 35 gènes différents et présentent une grande diversité de propriétés structurales et fonctionnelles. La localisation et les caractéristiques des sept collagènes du muscle strié sont rappelées dans le tableau 02 (Maunier-Sifre, 2005).
La proportion des différents types de collagène varie, dès le développement embryonnaire chez les bovins, d’un muscle à l’autre et pourrait donc contribuer aux variations de la résistance mécanique du muscle (Light, 1987 ; Listrat et al., 2000 ; Maunier-Sifre, 2005).
15
Les collagènes sont répartis en différentes catégories, localisés dans les différents niveaux d’organisation :
• Des collagènes fibrillaires types I, III, V
- Le collagène de type I: flexible et très résistant, il permet le maintien de la structure de la MEC (Maunier-Sifre, 2005)
- Le collagène de type III : forme des fibres réticulaires qui régulent la formation des fibres de type I et assure la liaison entre l’endomysium et le périmysium (Maunier-Sifre, 2005).
- Le collagène de type V: participe à la formation du réseau collagénique par sa quantité mineure, et forme avec le type III les fibres de réticuline. Le collagène V joue également un rôle sur la régulation du diamètre des fibres de collagène I (Fichard et al., 1995 ; Maunier-Sifre, 2005 ; Sun et al., 2011).
• Des FACIT (fibril-associated collagens with interrupted triple helice) ou Collagènes non fibrillaires: types XII et XIV, se lient à la surface des collagènes fibrillaires pour faciliter leur glissement en diminuant les interactions entre elles (Hulmes, 2008 ; Van Der Rest et Dublet., 1996).
- Le collagène de type XII : intervient dans la différenciation des adipocytes, et dans la régulation de l'organisation et des propriétés mécaniques des faisceaux de fibrilles de collagène (Chiquet et al., 2014 ; Tahara et al., 2004).
- Le type XIV : joue, quant à lui, un rôle dans le développement et la régénération musculaire (Tono-Oka et al., 1996).
• Des collagènes formant des feuillets : dont le collagène IV, qui forme un réseau fin de cordes assemblées et piègeun ensemble de grosses molécules telles que la laminine et les protéoglycannes (Van Der Rest et Garrone, 1991).
• Des collagène en filaments perlés :
- Collagène VI : C’est un collagène ubiquitaire ayant un rôle de maintien de l’intégrité du tissu. Il possède un site de fixation de la décorine pour réguler l’organisation structurale de la MEC. De plus, Il sert d’interface entre les fibres de collagène et les cellules (Hulmes, 2008 ; Bidanset et al., 1992 ; Van Der Rest et Garrone, 1991).
16
Tableau 02 : Structure et localisation des différents types de collagènes présents dans le muscle squelettique (Maunier-Sifre, 2005)
* Fibril-associated collagen with interrupted triple helix. Type de
collagène Structure
Localisation
Périmysium Endomysium Vaisseaux
I Fibrillaire ++ + ++ III Fibrillaire + + + IV Feuillet + - Membrane basale ++ V Fibrillaire + + ++ VI Collier de perles + + +++
XII FACIT* + - (bovin)
XIV FACIT* + - (bovin)
L’élastine :
Les fibres élastiques diffèrent des fibres de collagène en composition chimique, apparence et comportement (Pearson et Young, 1989). Le constituant majeur est l’élastine. C’est une protéine, de coloration jaunâtre, présentant une composition en acides aminés proche de celle du collagène avec une forte proportion de glycine, proline et alanine. En effet, elle se présente sous forme d'un réseau de chaînes moléculaires organisées de façon aléatoire lui conférant une structure amorphe. L’élastine est également très hydrophobe car 75% de sa séquence est composé d’acides aminés hydrophobes (Vrhovski et Weiss, 1998 ; Watkins, 2009).
Les fibres élastiques, hautement extensibles et élastiques, pouvant être étirées jusqu’à 200% de leur longueur initiale, et plus minces que les fibres de collagène, sont formées par les fibroblastes d'une manière similaire au collagène (Pearson et Young, 1989, Watkins, 2009).
L’élastine est présente en faible quantité dans la majorité des muscles, et par conséquent elle a peu d’influence sur la dureté de la viande. Cependant, puisque l’élastine est difficile à dénaturer par chauffage, elle semble contribuer à la dureté de la viande cuite provenant de muscles riches en élastine, comme le Semitendinosus (Bendall, 1967 ; Dransfield, 1977).
b. La substance fondamentale:
Elle est définie comme un espace contenant les fibres et les cellules, occupé par une substance visqueuse et amorphe produite par les fibroblastes. Cette substance est constituée de plusieurs molécules, dont les plus importantes sont les protéoglycanes (PGs). Ce sont des
17
molécules complexes et multifonctionnelles, constituées d’une protéine de poids moléculaire compris entre 40 et 350 kDa, liée par liaisons covalentes à plusieurs dizaines de chaînes de glycosaminoglycanes (GAGs) qui sont des polymères dissacharidiques fortement sulfatés et chargés négativement : chondroitin sulfate, dermatan sulfate, heparan sulfate et keratan sulfate. Les PGs forment de grands complexes, en se liant à d’autres PGs ainsi qu’aux protéines fibreuses de la matrice (telles que le collagène) et l’eau (Listrat et al., 2015 ; Nishimura, 2010 ; Praillet et al, 1998).
Ils jouent un rôle important dans la fonction et la stabilité de la matrice extracellulaire et dans le développement musculaire. En plus de leur fonction hydrodynamique et l’hydratation des tissus, ils assurent la résistance aux forces de compression, et sont impliqués dans la régulation de la prolifération cellulaire et la présentation des facteurs de croissance aux cellules (Perrimon et Bernfield, 2001 ; Purslow, 2017 ; Yanagishita, 1993).
1.3.2.2. Organisation du tissu conjonctif dans le muscle : Il s’organise en 3 niveaux (Figure 07).
Figure 07: Organisation des différents niveaux de tissu conjonctif dans le muscle squelettique. (Maunier-Sifre, 2005)
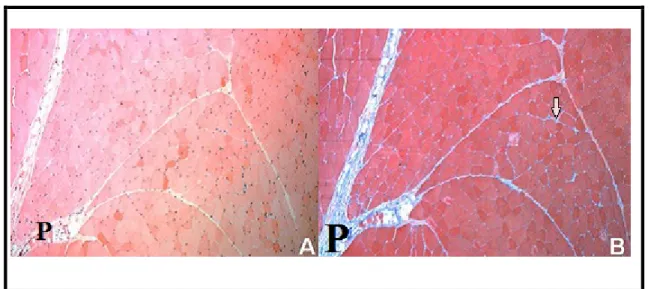
L’épimysium est l’enveloppe externe du muscle, qui le sépare des muscles adjacents. C’est une enveloppe fibreuse de tissu conjonctif (figure 08). Dans la plupart des muscles, il est continu avec le tendon qui lie le muscle à l’os (Jurie et Listrat, 2010 ; Purslow, 2005).
Le second niveau de tissu conjonctif intramusculaire est connu sous le nom de périmysium. Selon McCormick (1994), plus de 90% du collagène intramusculaire est situé à ce niveau. Il regroupe les fibres musculaires en faisceaux. Il présente plusieurs niveaux d’organisation. Le niveau le plus grossier correspond à ce qu’il est convenu d’appeler le périmysium primaire. C’est celui qui est le plus éloigné de la fibre musculaire. Le périmysium
18
se divise ensuite en trames secondaire et tertiaire de plus en plus fines et formant un réseau plus ou moins régulier (Jurie et Listrat, 2010).Il est formé par un réseau aréolaire de fibres de collagène dont le diamètre et la composition sont variables (Passerieux et al., 2006): Collagène type I associé aux types III, VI (Listrat et al., 1999), et XII (Listrat et al., 2000).
Le dernier niveau d’organisation du tissu conjonctif intramusculaire est l’endomysium. Il individualise chaque fibre musculaire et il assure la continuité entre le périmysium et la membrane plasmique (sarcolemme) de la cellule musculaire. Il est formé d’une fine membrane basale (environ 50 nm) appelée Basal lamina, qui est directement liée à la membrane plasmique, et d’une couche réticulaire (0,2-1 μm) appelée Reticular lamina, qui est externe (Jurie et Listrat, 2010). Il est constitué d’un réseau de fibres de collagène minces, qui sont principalement collagène type IV, III, VI, et XII dans une moindre mesure (Listrat et al., 1999 ; Listrat et al., 2000 ; Passerieux et al., 2006).
Figure 08 : coupes histologiques du muscle droit de l'abdomen colorées avec (A):H&E; (B) : Trichrome de Masson (Calvi et al., 2012)
P : Perimysium, flèche: Endomysium
- L’épaisseur du périmysium :
C’est le résultat de l’entassement de plusieurs couches de fibres de collagène organisées en faisceaux. Celui-ci qui augmente avec le nombre et la dimension de ces couches (Liu et al., 1995 ; Nakamura et al., 2003).
- La taille des faisceaux :
Il n’existe pas dans la littérature de définition précise du faisceau de fibres. Cependant, l’organisation hiérarchique suivante est couramment admise. Les faisceaux primaires sont le niveau élémentaire d’organisation des fibres. Ils sont regroupés en faisceaux secondaires puis tertiaires et ainsi de suite jusqu’à l’épimysium qui enveloppe le muscle entier (Figure 09)
19
Figure 09 :Caractérisation des différents types de faisceaux à l’intérieur d’un faisceau principal (Maunier-Sifre, 2005).
Faisceaux primaires (b), faisceaux secondaires (c), faisceaux tertiaires (d), faisceaux quaternaires (e) et enfin faisceau principal (f).
Une fois le faisceau primaire défini, il est alors possible de définir les ordres supérieurs par référence aux faisceaux primaires. La taille des faisceaux de fibres musculaires varie d’un muscle à l’autre : elle est probablement liée à la distribution des forces que le muscle développe in vivo.
1.3.3. Le tissu adipeux et les lipides intramusculaires :
Le tissu gras peut être considéré comme une forme spécialisée du tissu conjonctif apparaissant tardivement dans le développement de l’organisme, lorsque les nutriments excèdent les besoins de l’organisme (Craplet, 1966). La quantité de lipide dans le muscle squelettique dépend fortement du degré d'engraissement, allant de 1 à 13% du muscle total, qui peut conduire, à la fois, à l’hyperplasie et à l’hypertrophie de ces adipocytes. Les lipides sont principalement intramusculaires ou se trouvent sous forme d’un tissu adipeux (Toldrá et Reig, 2015).
Les lipides intramusculaires sont majoritairement des lipides de structure (les phospholipides) et des lipides de réserve (les triglycérides et le cholestérol). Les triglycérides sont stockés pour une part mineure (5-20%) dans le cytoplasme des fibres musculaires sous forme de gouttelettes lipidiques (lipides intramyocellulaires), l’essentiel (80% environ) étant stocké dans les adipocytes qui sont soit isolés entre les fibres soit regroupés le long des
20
vaisseaux sanguins au niveau du périmysium ou autour des muscles dans l’épimysium. Ces adipocytes intra et intermusculaires respectivement sont les acteurs majeurs du métabolisme lipidique dans le muscle. Elles sont enveloppées par une fine enveloppe de collagène à proximité des vaisseaux sanguins. Dans les premiers stades d’engraissement, le diamètre des cellules est généralement faible (40 à 60μm). Pour être visibles, les amas adipeux doivent regrouper au moins 10 à 15 cellules (Bonnet et al., 2010 ; Listrat et al., 2015 ; Maunier-Sifre, 2005 ; Sorland et al., 2004 ; Tume, 2004).
Les différences de teneurs en lipides entre muscles et entre animaux sont principalement dues aux variations de quantités de triglycérides. En effet, la teneur en phospholipides varie peu puisque dépendant seulement de la densité de structures membranaires, cellulaires et intracellulaires. Le type métabolique des fibres musculaires, influence donc la teneur en phospholipides, alors que la quantité de triglycérides est le résultat à plus ou moins long terme de l’état nutritionnel de l’animal, autrement dit de son état d’engraissement (Maunier-Sifre, 2005).
La teneur en lipides intramusculaires (LIM) dépend fortement de la taille et du nombre des adipocytes intramusculaires. Ainsi, lorsque ces deux paramètres augmentent, les proportions du tissu adipeux s’accroissent. Plusieurs facteurs influent sur la quantité en LIM : l’origine anatomique du muscle, l’âge, la race, le génotype, l’alimentation et les conditions d’élevage des animaux de rente (Bonnet et al., 2010 ; Bonnet et al., 2015 ; Damon et al., 2006 ; Gondret et Lebret., 2002 ; Listrat et al., 2015).
L'incidence des lipides sur la qualité de la viande porte principalement sur la flaveur et à un degré moindre sur la jutosité. Son rôle sur la tendreté est cependant beaucoup plus controversé. Toutefois, un état d'engraissement très poussé comme c'est le cas dans les systèmes de production de viande au Japon conduit à une modification de la structure et donc de la résistance mécanique du tissu conjonctif (Maunier-Sifre, 2005).
1.3.4. Relations entre les différents composants tissulaires :
Selon Hwang et al. (2010), le taux de LIM est positivement corrélé avec le pourcentage de
surface et le nombre des fibres oxydatives, alors qu’il est négativement corrélé avec les proportions des fibres glycolytiques. Cependant, même si les fibres à métabolisme oxydatif, en particulier les fibres lentes, sont souvent plus riches en LIM que les fibres rapides glycolytiques, de nombreux travaux suggèrent une absence de relation stricte entre la teneur totale en LIM et la composition en fibres du muscle (Listrat et al., 2015).
21 2. EVOLUTION DU MUSCLE EN VIANDE:
La maturation est le nom donné au processus d’attendrissage de la viande, qui se produit, sous l’action des enzymes musculaires endogènes déjà présentes à l’état vivant de l’animal, et jouant un autre rôle dans la viande post-mortem (Durand, 2005).
Après la mort des animaux de boucherie, la transformation du muscle en viande fait appel à un ensemble de processus très complexes, de nature à la fois enzymatique (protéases endogènes) et physicochimique (force ionique élevée). Cette transformation s’accompagne de modifications plus ou moins importantes de la composition et de la structure du tissu musculaire qui contribuent à l’élaboration et à la définition des qualités de la viande (Ouali, 1991).
Les réactions mises en jeu, essentiellement des réactions hydrolytiques, dissipent dans un premier temps les réserves énergétiques du muscle (ATP, phosphocréatine, glycogène) au cours de l’installation de la rigor mortis, puis affectent l’organisation des protéines musculaires de structure au cours de la phase dite de maturation. La cinétique et l’intensité de ces réactions définissent en dernier ressort les qualités technologiques, organoleptiques, hygiéniques et nutritionnelles des viandes (Valin, 1988). La tendreté de la viande est donc, déterminée par les propriétés des myofibrilles et du TCIM et est améliorée avec la maturation
post-mortem (Young et Gregory, 2001; Nishimura, 2010).
La nature et l’amplitude des modifications et, par voie de conséquence, les qualités de la viande, sont fortement influencées par l’espèce animale et par les caractéristiques physiologiques et biochimiques des muscles. Elles dépendent aussi étroitement des technologies mises en œuvre tout au long de la filière, y compris les différents traitements auxquels sont soumis les animaux entre le départ de la ferme et l’abattage. Selon les cas, ces technologies vont donc moduler de façon favorable ou défavorable le cours de cette transformation (Ouali, 1991).
Après l’abattage, la viande est généralement stockée en chambre froide à 4 °C pour des durées allant de 2 à 30 jours selon l’espèce et le mode de conditionnement. Les durées de stockage les plus élevées sont appliquées à la viande bovine (une à deux semaines pour les carcasses, jusqu’à un mois pour des pièces de viande sous vide) dans le but de subir un attendrissage naturel (maturation) (Listrat et al., 2015).
22
2.1.Les phases de transformation du muscle en viande :
La conversion du muscle en viande passe par plusieurs étapes principales, qui ont une influence sur la structure et la tendreté de la viande. La figure 10, illustre la chronologie d’intervention de ces différentes étapes au cours du temps post mortem et leur influence sur la dureté de la viande (Ouali et al., 2006).
Ouali et al. (2013) pensent qu’il existe une relation entre la nature multienzymatique de l'attendrissage de la viande, et le début de l'apoptose comme première étape dans la conversion du muscle en viande.
Figure 10: Etapes de transformation du muscle en viande (Ouali et al., 2006).
2.1.1. Mort cellulaire programmée :
Lors de l’abattage, l’exsanguination de la carcasse fait entrer les cellules dans un état d’anoxie en les privant d’oxygène et de nutriments. Face à cet environnement extrême, les fibres musculaires s’engagent dans le processus de la mort cellulaire programmée ou apoptose
(Ouali et al., 2006 ; Becila et al., 2010). C’est un processus contrôlé à une ou plusieurs étapes cruciales impliquant les mitochondries, rapide qui dure quelques minutes à quelques heures
(Green, 2005).D’après Kemp et Parr (2012), l’apoptose est précocement impliqué dans la mise en
place de la tendreté.
L’apoptose est une mort cellulaire très bien organisée, caractérisée par des changements biochimiques et morphologiques faisant entrer les cellules dans un processus de dissociation des cellules voisines par une rétraction cellulaire. La réduction du volume des cellules est due à une déshydratation de ces dernières, la perte de l’eau intracellulaire conduit à la condensation du cytoplasme. Il est également caractérisé par une dépolarisation mitochondriale, une condensation de la chromatine, une fragmentation de l’ADN (surtout utilisée pour l’estimation de l’apoptose), une formation de corps apoptotiques et une
23
dégradation des protéines structurales du cytoplasme tel que l’actine. Au niveau de la membrane plasmique, les phosphatidylsérines de la membrane interne passent vers la membrane externe ce qui cause une altération de la perméabilité membranaire (Kemp et Parr, 2012; Smili, 2014; Taylor et al., 2008). Cependant, Green (2011) précise que durant ce processus, la décharge des composants cellulaires et les dommages des cellules adjacentes sont empêchés.
2.1.2. Etat pantelant:
L’état pantelant est également une phase précédant la rigor. C’est une courte période après l’abattage entre 20 à 30 minutes (Maltin et al.,2003). Malgré l'interruption du courant sanguin, on observe une succession de contractions et relaxations musculaires, probablement causées par des excitations nerveuses. Sa durée coïncide en effet avec la durée de survie du système nerveux et n’excède pas 20 à 30 minutes. Le muscle continue de vivre. Il y a donc épuisement des réserves énergétiques (glycogène), puis une mise en place de la glycolyse anaérobie. L'accumulation d'acide lactique qui s'en suit provoque ainsi une baisse du pH qui passe de 7 à 5,5 (Ouali, 1991).
2.1.3. Etat rigide :
L’état rigide est l’aboutissement de la phase d’installation de la rigidité cadavérique ou
rigor mortis (Ouali, 1991). Au moment de la mort, le muscle est flasque et très extensible, il devient inextensible et relativement rigide dans les heures qui suivent l’abattage (Pearson et Young, 1989).
Après l’abattage, du fait de l’arrêt de la circulation sanguine, le muscle se trouve privé d’oxygène. La synthèse d’ATP, composé essentiel à la survie de la cellule qui du vivant de l’animal est assurée par la respiration, va désormais être moins efficace. Cette synthèse d’ATP repose alors essentiellement sur la dégradation de la phosphocréatine dont les stocks sont limités puis du glycogène qui est la principale forme de réserves glucidiques du tissu musculaire (Ouali, 1991).
Le processus de rigor est caractérisé par une phase de latence et une phase de contraction rapide.
• Durant la période de latence, le niveau d’ATP est constant, il est assuré par la dégradation de la phosphocréatine qui diminue rapidement (Smili, 2014).
• Lorsque sa concentration est suffisamment faible, une chute rapide de l’ATP est initiée : phase rapide (Tornberg, 1996) et la rigidité cadavérique s’installe progressivement, la production d’ATP à partir du glycogène (glycolyse) ne permettant pas, à elle seule, de contrebalancer son hydrolyse. En effet, l’ATP qui fournit l’énergie
24
au muscle lors de la contraction joue également le rôle de plastifiant puisque c’est lui qui permet au muscle de se relaxer (Ouali, 1991). L’absence de l’ATP nécessaire pour séparer les têtes de myosines attachées à l’actine donne lieu à un maximum de dureté
(Smili, 2014).
L’hydrolyse de l’ATP libère des protons dans le milieu cellulaire à raison d’un proton par molécule d’acide lactique produite par la glycolyse. Le muscle s’acidifie et le pH décroît pour atteindre, chez des animaux en bon état physiologique, des valeurs finales (pH final ou pH ultime) comprises entre 5,4 et 6,0 selon le type de muscle. Le pH final est ainsi plus élevé pour les muscles rouges à contraction lente en raison de l’inactivation, lorsque le pH est inférieur à 6,0, des ATPases qui sont à l’origine de cette acidification. La glycolyse s’arrêtera donc soit quand le pH ultime est atteint (cas normal), soit par épuisement prématuré des réserves de glycogène anormalement basses au moment de l’abattage (Ouali, 1991).
2.1.4. Etat maturé :
La phase de maturation est de loin la plus importante puisqu’elle conduit à une augmentation de la tendreté de la viande (Ouali, 1991).
Elle est caractérisée par une série de modifications ultra-structurales et conduit, entre autres, à la fragmentation des fibres musculaires :
• L’action des différents systèmes protéolytiques entraine des ruptures myofibrillaires caractéristiques le long des stries Z (Listrat et al., 2015).
• La déformation des mitochondries et l’altération de leurs membranes (Abbot et al., 1977).
• La dégradation des costamères (protéines filamenteuses servant de jonction entre les myofibrilles et le sarcolemme), conduisant ainsi à leur détachement (Taylor et al., 1995).
D’après Ouali et al., (2013), le processus enzymatique commence dès l’abattage, par l’activation des caspases qui dégradent les composants cellulaires lors de l’apoptose, alors que d’autres enzymes protéolytiques prennent le relais pour poursuivre la destruction des cellules et du tissu (Terlouw et al., 2015) causant ainsi un relâchement des liens entre les fibres
musculaires . La protéolyse post mortem provoque donc l’affaiblissement des structures myofibrillaires et des protéines associées. La dureté est réduite de 80%. Le muscle peut à nouveau être étiré à la même longueur que celle en pré-rigor, mais l’étirement n’est plus réversible (Smili, 2014).
25
Le collagène n’étant pas ou très peu affecté par ces protéases, la teneur en collagène du muscle définit une dureté de base qui limite la tendreté maximale de la viande crue (Guillemin et al., 2009).
2.2.Evolution des paramètres physico-chimiques et biochimiques au cours de la transformation du muscle en viande :
La mort de l'animal bouleverse le métabolisme musculaire. L'arrêt de la circulation sanguine supprime l'apport d'oxygène et de substrats énergétiques exogènes (glucose, acides aminés et acides gras). Toutefois, les mécanismes de maintien de l’homéostasie continuent de fonctionner dans la cellule pendant un certain temps. La privation d'oxygène, diminue très rapidement le pouvoir d'oxydation cellulaire, et seules les réactions qui suivent des voies anaérobies persistent, essentiellement la glycolyse (El Rammouz, 2005).
2.2.1. Température :
Après la mort de l’animal, la température du muscle n'est plus régulée : au fur et à mesure que le métabolisme se poursuit, il peut y avoir une légère augmentation initiale de la température, quand les mécanismes homéostatiques ne peuvent plus y faire face, la température dans le muscle commence à diminuer de 38°C jusqu'à 4°C, température de stockage de la carcasse (Cassens, 1994 ; Harketi, 2007).
Une variabilité importante de son évolution est observée à une heure post mortem qui pourrait être la combinaison de trois facteurs : la température de l’animal au moment de l’abattage, la température de l’environnement et la résistance du muscle à la chute de température par effet de masse (Smili, 2014) : la cinétique de refroidissement sera d'autant plus rapide que la carcasse sera plus maigre, car le tissu adipeux joue un rôle isolant. De plus, Cette cinétique de refroidissement est différente pour chaque muscle selon son emplacement sur la carcasse (Harketi, 2007).
2.2.2. Le pH :
Le pH musculaire avant l’abattage est à peu près constant et proche de la neutralité (7,0 à 7,2). L’acide lactique provenant de la glycolyse s’accumule dans le muscle. Pour chaque molécule de lactate produite, le système libère un proton. Il s’ensuit une acidification progressive traduite par la diminution du pH jusqu’à sa stabilisation, par l’épuisement des réserves énergétiques, à une valeur dite « pH ultime » proche de 5,5 (Monin, 1988 ; Clinquart et al., 2000).
26
• La vitesse de chute est déterminée principalement par l’activité ATPasique,
• alors que l’amplitude est proportionnelle, pour un muscle donné, à la quantité totale de lactate ou encore du glycogène dégradé (réserves énergétiques) (Monin, 1988).
2.2.3. La capacité de rétention d’eau (CRE):
La capacité de rétention d’eau (CRE) est le pouvoir de la viande à retenir toute ou une partie de son propre eau. Elle dépend de la manipulation et de l’état de la viande (Honikel, 2009).
Le tissu musculaire maigre contient environ 75% d'eau, dont presque 95% est intracellulaire. Elle est immobilisée par des chaînes latérales chargées ou hydrophiles des acides aminés, et des forces capillaires. Environ 80% de l'eau est immobilisée par les protéines myofibrillaires et cytosquelettiques formant l’eau intrafilamentaire, tandis que 15% est partiellement liée au niveau du sarcoplasme constituant l’eau interfibrillaire, qui est immobilisée par les surfaces des protéines, les interactions soluté et les interactions eau-eau. L’autre partie de cette eau est libre, et retenue grâce à la bicouche lipidique des membranes cellulaires (Honikel, 2009).
Les protéines sont des molécules amphotères, leur charge nette dépend du pH. Au point isoélectrique, c’est à dire vers 5 pour les protéines myofibrillaires, les groupes chargés négativement et positivement sont égaux et se neutralisent : la charge nette est donc nulle. Lorsque le pH s’écarte du point isoélectrique, les protéines se chargent (positivement ou négativement) et de ce fait se repoussent : le réseau protéique s’écarte, ce qui augmente la place disponible pour les molécules d’eau, et la CRE augmente (Monin, 1988). Donc, la CRE décroit avec la chute du pH post mortem proche du point isoélectrique des protéines myofibrillaires qui se resserrent, ayant pour conséquence l’expulsion de l’eau vers l’extérieur.
2.2.4. La pression osmotique :
Après abattage, l’absence de l’ATP dans les cellules provoque l’arrêt de la pompe à calcium et de ce fait les ions ne peuvent plus être contenus dans les compartiments cellulaires et sont libérés dans le sarcoplasme (Harketi, 2007).
Parallèlement à l’acidification du muscle, on observe une augmentation de la pression osmotique des tissus qui devient deux fois plus sa valeur dans un muscle vivant. Il a été suggéré que la baisse du pH était probablement la principale cause de la forte augmentation de la pression osmotique due à l'altération des protéines auxquelles les ions (principalement Na+,
K+, Ca2+ et Mg2+) sont normalement liés. Cette élévation participe à l’altération des structures contractiles par une solubilisation des protéines myofibrillaires, et à l’augmentation de