UNIVERSITE TOULOUSE III - PAUL SABATIER
U.F.R SVT
THESE
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE TOULOUSE Délivré par l’université de Toulouse III-Paul Sabatier
Spécialité Immunologie
Présentée et soutenue publiquement Par
Julie GERTNER-DARDENNE
Le 13 Février 2008
Optimisation de l’activité antitumorale des
lymphocytes T Vγ9Vδ2 humains
Directeur de thèse : Dr Jean Jacques FOURNIE
JURY
Guy Laurent,………..Président Jean Jacques Fournié, ………Directeur de thèse Julie Deschanet-Merville,………. Rapporteur Catherine Thieblemont,……….Rapporteur Marc Bonneville,………. Examinateur Virginie Laffont,…... ………Examinateur
A mon mari avec tout mon amour
A notre fils, Louis
Ce n'est pas le but de la promenade qui est important mais les
petits pas qui y mènent.
Je remercie,
Le professeur Guy LAURENT qui m’a fait l’honneur de présider le jury
Le docteur Julie DESCHANET-MERVILLE et le docteur catherine THIEBLEMONT pour avoir accepté d’être rapporteur de cette thèse
Le professeur BONNEVILLE et le Docteur Virginie LAFFONT pour avoir accepté d’en être les examinateurs
Le docteur Jean Jacques FOURNIE, « the Boss », pour m’avoir accueillie dans son équipe, donné gout à ce métier de passion, pour m’avoir soutenue (et supportée !!!) durant ces 4 années, pour la confiance qu’il m’a témoignée, tout simplement pour avoir cru en moi.
Toute l’équipe « Immunité innée, hémopathie maligne et thérapie ant-cancéreuse » : Ludo, Séverine, Rémy, Mary, charlotte, Damdam, Nicolas, Raphael, Samar, ludi, les Emilie, Fred sans qui j’aurais engagé une guerre avec mon ordinateur, tout particulièrement Del pour son amitié et son trop plein d’énergie stimulant, Guy laurent pour sa confiance, Anne, les deux chris pour leur bonne humeur constante et l’excellente collaboration au cour de ce travail.
Tous ceux qui m’ont accompagnée en dehors de la recherche, ma famille bien sur, qui constitue pour moi une source d’énergie intarrissable, papa, maman sans qui je n’en serais probablement pas là aujourd’hui, Bigjo, Mouti et papi. Mes amis, Pilou, Cyril, Zanot, Pascu, 4 paires d’épaules solides et fidèles, et ma Pigue, tous témoins de mes coups durs et de mes joies … comme on dit des amis pour la vie !
Et puis surtout les deux hommes de ma vie, mon mari, mon amour, et le fruit de notre union, notre plus grande réussite, Louis, en espérant que beaucoup d’autres suivront !!!
SOMMAIRE
ABREVATIONS ET ANGLICISMES
LISTE DES FIGURES
INTRODUCTION
I. Introduction générale : l’Immunité
II. Immunité anti-tumorale
II-1. Les antigènes de tumeurs
II-1-1. Mise en évidence
II-1-2. Les antigènes de tumeur chez l’homme II-2. Les effecteurs de l’immunité anti-tumorale
II-2-1. Les cytokines
II-2-2. Les effecteurs de l’immunité adaptative
II-2-2-a. Les lymphocytes T CD8+
II-2-2-b. Les lymphocytes T CD4+ II-2-3-c. Les cellules NKT
II-2-3. Les effecteurs de l’immunité innée II-2-3-a. Les cellules dendritiques
II-2-3-b. Les cellules NK
II-2-3-d. Les lymphocytes T γδ
II-3. Dynamique de la réponse immunitaire anti-tumorale normale II-4. L’échappement tumoral
II-4-1. Résistance des cellules malignes aux effecteurs immuns II-4-2. Inefficacité ou absence de l’induction de réponse immune
III. Immunothérapie des cancers
III-1. Immunothérapie passive par transfert adoptif de lymphocytes III-2. Immunothérapies passives par des anticorps anti-tumoraux III-3. Immunothérapie active non spécifique
III-4-1. Les vaccins cellulaires III-4-2. Les vaccins peptidiques
III-4-3. Les vaccins avec protéines ou peptides présentés par DC III-4-4. Les vaccins recombinants / les vaccins avec l’ADN nu
IV. les lymphocytes T
γδ
IV-1. Ontogénie
IV-2. Les différentes sous populations des lymphocytes T Vγ9Vδ2 IV-3. Réactivité des lymphocytes T Vγ9Vδ2
IV-3-1. Les ligands des lymphocytes T Vγ9Vδ2
IV-3-2. Biosynthèse des PAg par les voies MVA et DOXP IV-3-3. Mécanismes de reconnaissance
IV-4. Interaction cellule cytotoxique – cellule cible IV-4-1. Chimiotaxie et diapédèse IV-4-2. La synapse immunologique
IV-4-3. La trogocytose
IV-4-3a. Mécanismes
IV-4-3b. Conséquences fonctionnelles
IV-4-4. La cytotoxicité
IV-4-5. Le contrôle de l’activation IV-5. Cellules T γδ et surveillance anti-tumorale IV-6. Cellules T γδ et immunothérapies
IV-6-1. Approches impliquant l’administration de PAg synthétiques IV-6-2. Approches impliquant l’administration d’ABP
IV-6-2. Approches impliquant le transfert adoptif de cellules T Vγ9Vδ2 IV-6-2. Approches impliquant l’utilisation concomitante de DC et de cellules T Vγ9Vδ2
OBJECTIF DU TRAVAIL
RESULTATS
PARTIE 1
: Etude de l’activité moléculaire à la synapse des
lymphocytes T V
γ9Vδ2 humains
- Gertner J, Poupot M, Gray B, Fournié JJ. “lipophile fluorochrome trackers of membrane transfers between immune cells” Immunological Investigations, 36:1–21,2007
- Gertner J, Wiedemann A, Poupot M, Fournié JJ. “Human γδ T lymphocytes strip and kill tumor cells simultaneously.” Immunol letter 2007
PARTIE 2 : Etude de l’effet de la combinaison de phosphoantigène et
d’anticorps monoclonaux à usage thérapeutique.
- Gertner J., Bezombes C., Laurent G., Fournié JJ. Brevet Europeen n°EP 06291146-8
INSERM (2006). “Methods and compositions for increasing the efficiency of therapeutic
antibodies using γδ cell activator compounds”
- Gertner-Dardenne J., Cecile Bonnafous, Christine Bezombes, Virginie Scaglione, Emilie
Gross, Jean-François Lepage, Anne Quillet Mary, Helene Sicard, Guy Laurent and Jean Jacques Fournié “Gamma delta lymphocyte stimulation with phosphoantigens increase the efficiency of therapeutic antibodies” Manuscript in prep.
CONCLUSION
ANNEXES
- Poupot M., Gertner J., Fournié JJ. «Molecular transfers through transient lymphoid cell-cell channel». in: Cell-Cell Channels 2006,editors: Frantisek Baluska, Dieter Volkmann and Peter W. Barlow. Landes Biosciences, Springer, New York, USA
- Fournié JJ., Gertner J., Poupot M., Wiedemann A. « Single cell monitoring of trogocytosis and killing in lytic synapse between anaplastic large cell lymphoma and activated human γδ T lymphocytes » Haematologica Reports 2006, 2: 35-36.
- Gertner J., Scotet E., Poupot M., Bonneville M., Fournié JJ. (July 2007) “Lymphocytes: gamma delta”. in: Encyclopedia of Life Sciences. John Wiley & Sons, Ltd: Chichester http://www.els.net.gate1.inist.fr/ [doi: 10.1002/9780470015902.a0001195.pub2]
- Thedrez A., Sabourdin C., Gertner J., Devilder MC., Alain-Maillet S., Fournié JJ., Scotet E., Bonneville M. «Self/non self discrimination by human γδ T cells: simple solutions for a complex issue?» Immunological review 2007, 215 :123-135.
- Gertner-Dardenne J., Pont Frederic, Fournié Jean-Jacques “The MVA pathway transcriptome as predictive tool for biosynthesis of phosphoantigen activating anticancer human γδ T lymphocytes”. Manuscript in prep.
Julie GERTNER-DARDENNE
Optimisation de l’activité anti-tumorale des lymphocytes T Vγ9Vδ2 humains
Directeur de thèse : Jean Jacques FOURNIE Toulouse, 13 Février 2008
Si tous les vertébrés possèdent des lymphocytes T γδ, seuls les primates ont une sous-population sanguine exprimant un récepteur de type TCR Vγ9Vδ2. Cette dernière réagit à des phosphoantigènes non-peptidiques d’origine bactérienne et tumorale, déclenchant ainsi son activité anti-infectieuse et anti-cancéreuse. Cette thèse traite de l’optimisation de son potentiel thérapeutique anti-cancéreux. Ces lymphocytes cytotoxiques capturent des fragments membranaires de leurs cellules cibles et sécrètent leurs granules cytolytiques, à travers leur synapse immunologique. L’étude par vidéo-microscopie de l’activité moléculaire à la synapse des lymphocytes T γδ révèle la simultanéité de ces deux processus. Ainsi, le renforcement de l’attachement des lymphocytes T γδ à leurs cibles par la combinaison de phosphoantigène et d’anticorps thérapeutiques permet d’optimiser leur efficacité anti-tumorale.
Cette thèse présente donc les bases moléculaires d’une nouvelle approche thérapeutique anti-cancéreuse.
Mots-Clefs : Lymphocytes T γδ, Phosphoantigène, Anticorps monoclonaux, Membrane,
Cytotoxicité, ADCC, Vidéo-microscopie, Cancer, Thérapie.
Discipline : Immunophysiopathologie
ABREVIATIONS ET ANGLICISMES
ABP, aminobiphosphonate ;
ADCA, Antibody dependant cell Attachment ; ADCC, Antibody dependant cell cytotoxicity ; Ac, anticorps ;
Ag, antigen ;
AICD , activation-induced cell death ; AML, Acute Myeloid Lymphoma ; ApoA1, apolipoprotein A1 ; ATPS, ATP synthase ; BCR, B cell receptor ;
BrHPP, bromohydrine pyrophosphate ;
CDC, cytotoxicité dépendante du complément ; CDR(1-3), complementary determine region (1-3) ;
CMH-I / II, complexe majeur d’histocompatibilité de classe I / II ; CPA, cellules présentatrices d’antigène ;
CTL, lymphocytes T cytotoxiques ; DC, dendritic cell ;
DMAPP, dimethylallyl pyrophosphate ; DOXP, deoxy-d-xylulose-5-phosphate ; Fc, Fragment constant ;
FcR, Récepteur au Fragment constant ;
HDMAPP, 4-hydroxy-3-dimethylallyl pyrophosphate ; HMB-PP, (E)-4-hydroxy-3-methyl-but-2-enyl pyrophosphate HSP, heat shock protein ;
IDC, Immature Dendritic Cell ; IFN, interferon ;
Ig, Immunoglobuline ;
IKDC, IFN-produced Killer Dendritic Cell ; IL, interleukine ;
LF, lymphomes folliculaires ;
LLC, leucémie lymphoïde chronique ; LMC, leucémie myéloïde chronique ; LPS, Lipopolysaccharide ;
mAb, monoclonal antibody ;
MICA /B, MHC class I related chain ; MVA, mevalonate ;
NHL, non-Hodgkins lymphoma ; NK, natural killer ;
PAg, phosphoantigène ;
PAMP, pathogen-associated molecular pattern ; PBL, periferal blood lymphocyte ;
pDC, plasmacytoïd Dendritic Cell ; PGE 2, Prostaglandine E 2;
PRR, Pattern Recognition Receptor ; RTX, Rituximab ;
TCR, T cell receptor ;
TIL, Tumor infiltrating lymphocytes ; TGF, tumor growth factor ;
TLR, Toll Like Receptor ; TNF, Tumor Necrosis Factor ;
TRAIL, tumour-necrosis factor (TNF)-Related Apoptosis-Inducing Ligand ; ULBP(1-4), UL16 Binding Protein.
LISTES DES FIGURES
Figure 1 : Obtention de clones CTL anti-tumoraux autologues dirigés contre MAGE Figure 2 : Activation des cellules T CD4+
Figure 3 : Les IKDC, un nouveau type de cellule immunitaire Figure 4 : Régulation de l’activation des cellules NK
Figure 5 : Cellules NKT et immunothérapie
Figure 6 : Dynamique de la réponse antitumorale « normale »
Figure 7 : Structure des différents anticorps monoclonaux thérapeutiques Figure 8 : Structure du Rituximab
Figure 9 : Modes d’action du Rituximab
Figure 10 : Les stades de différentiation des lymphocytes T
Figure 11 : Modèle d’intensité du signal Notch et de synergie entre les signaux Notch et TCR Figure 12 : Etapes développementales de génération des lymphocytes T γδ murins.
Figure 13 : Les sous populations de lymphocytes T γδ humains Figure 14 : Les premiers phosphoantigènes identifiés
Figure 15 : Structure générale des phosphoantigènes
Figure 16 : Les différents phosphoantigènes et leur bioactivité pour les cellules T γδ Figure 17 : Structure générale des Alkylamines
Figure 18 : Les aminobisphosphonates thérapeutiques et leurs bioactivités pour les Tγδ Figure 19 : Biosynthèse des phosphoantigènes
Figure 20 : Pharmacophore des phosphoantigènes naturels et synthétiques Figure 21 : Modèle mécanistique de la trogocytose
Figure 22 : Trogocytose associée au relargage de perforine dans la synapse lytique Figure 23 : Bilan de l’effet de la combinaison RTX-PAg
Table 1 : Les Ag de tumeurs uniques
Table 2 : Les Ag de tumeurs partagés spécifiques de tumeur Table 3 : Les Ag de tumeurs de différentiation
Table 4 : Les Ag surexprimés dans les tumeurs
Table 5 : Expression des granzymes et de la perforine par les sous-populations de PBMCs Table 6 : Les principaux récepteurs au fragment constant des immunoglobulines
Table 7 : Les différents types de cellules NKT
INTRODUCTION
I- INTRODUCTION GENERALE : L’IMMUNITE
L’immunité est « la science de la défense contre le non-soi dans le respect de soi» (Jean Dausset, immunologiste français, prix Nobel en 1980 pour sa découverte en 1958 du complexe majeur d’histocompatibilité).
Ainsi, le fonctionnement physiologique du système immunitaire repose sur différents concepts que sont : la discrimination soi/non-soi, la reconnaissance du soi altéré, la théorie du danger, et la mémoire immunitaire.
Depuis les années 1950, la théorie qui domine en immunologie est celle de la reconnaissance du "soi" et du "non-soi" par le système immunitaire adaptatif. Cependant, ce modèle ne permet pas d'expliquer de manière satisfaisante les phénomènes de tolérance, de rejet de greffe, ni la nécessité de la présentation de l'antigène. Ainsi, en 1989, Charlie Janeway propose un modèle selon lequel l'immunité innée serait la véritable gardienne des clefs du déclenchement d'une réponse immunitaire. La décision de réagir ou non, face à un agent étranger reposerait sur la reconnaissance de motifs par des récepteurs putatifs qu'il nomme les PRR (pour l'anglais Pattern Recognition Receptor). Ce modèle est approfondi à partir de 1994 par Polly Matzinger, qui développe la théorie du danger 1. D'après elle, le déclenchement de la réponse immunitaire se ferait sur la base de motifs moléculaires associés aux organismes pathogènes (PAMP, de l'anglais pathogen-associated molecular pattern) par les PRR.
La discrimination entre le soi et le non-soi reste fondamentale en immunologie. Les clones de cellules immunitaires qui sont capables de reconnaître les antigènes (Ag) du soi, et qui risqueraient de les attaquer, sont en fait éliminés rapidement (habituellement dans leur phase néonatale) au cours du développement des animaux. Cette délétion clonale, aboutit à l’apparition de la tolérance du système immunitaire envers les Ag du soi.
En revanche, le système immunitaire reste capable d’identifier les cellules tumorales qui, bien qu’appartenant au soi, portent à leur surface des Ag caractéristiques de leur transformation (le « soi modifié »).
Un autre dogme de l’immunologie est la dichotomie du système immunitaire en deux pans de l’immunité : l’inné et l’adaptatif.
D’une part, l’immunité innée qui est présente très tôt au cours de l’évolution des espèces, représente une première barrière de défense contre les agents pathogènes, et est immédiatement activée par la rencontre de l’agent infectieux. Elle fait intervenir de divers types de cellules hématopoïétiques (polynucléaires, macrophages, mastocytes, cellules dendritiques, lymphocytes Natural Killer) mais également épithéliales et stromales. La réponse immunitaire innée est rapide, sans mémoire et indépendante de l'antigène.
D’autre part l’immunité spécifique développe une réponse plus lente (en quelques jours) et spécifique d’un antigène donné avec persistance d’une mémoire immunologique à l’Ag. Ce système est apparu avec les espèces animales plus évoluées. Il est constitué des lymphocytes T et B. Cette réponse est adaptative vis-à-vis d’une spécificité moléculaire : l’antigène, et consiste en la sélection progressive de clones de lymphocytes capables de le cibler. Cette réponse adaptative est lente, strictement dépendante des antigènes, et possède une mémoire immunologique. Cette notion de mémoire immunologique correspond à la capacité des cellules immunocompétentes à répondre de façon accélérée, particulièrement intense, à une nouvelle stimulation par un Ag déjà rencontré. La mémoire immunitaire repose sur (i) un nombre de lymphocytes spécifiques plus important après l’expansion du premier clone dans la réponse primaire, (ii) une meilleure adaptation des récepteurs à l’Ag, (iii) la survie prolongée de ces lymphocytes, et enfin (iv) l’entretien de cette mémoire par une exposition antigénique persistante ou répétée.
A la frontière entre immunité innée et adaptative cependant, certains lymphocytes tels les lymphocytes NKT et Tγδ, sont munis de récepteurs spécifiques à l’antigène quoique sans avérer de capacité adaptative post-natale.
Cette dichotomie immunité innée versus immunité adaptative, ne correspond pas totalement à la réalité. En effet, les récepteurs caractéristiques de l’immunité innée et de l’immunité acquise s’organisent probablement en un réseau bien plus intriqué qu’on ne l’aurait initialement pensé. À l’évidence, il s’agit là de cibles particulièrement intéressantes pour le développement de nouvelles stratégies thérapeutiques.
II- L’IMMUNITE ANTI TUMORALE
Une tumeur ou néoplasie est actuellement définie comme une prolifération cellulaire excessive, ne répondant plus aux mécanismes de régulation normaux, aboutissant à une néoformation tissulaire, ressemblant plus ou moins à un tissu normal, mais ayant tendance à persister et à s’accroître sans contrôle.
Une tumeur échappe aux mécanismes normaux de régulation car il s'agit d'un tissu dont la croissance est autonome. Cette autonomie n'est toutefois que relative et incomplète. Pour exemple, le stroma, et notamment la vascularisation des cancers, dépend de l’hôte. Cependant alors qu’il s’agit de cellules du soi, le système immunitaire est capable de les reconnaître et de diriger des réponses cytotoxiques contre ces dernières. Dans ce cas le système immunitaire reconnaît un « soi altéré » grâce à l’expression par les cellules tumorales d’Ag particulier ou de molécules membranaires induite par la transformation néoplasique.
Ainsi le problème de l’immunité antitumorale ne se positionne pas totalement différemment de la définition de l’immunité anti-infectieuse, mais plutôt comme une version utile de l’auto-immunité.
L’existence de réponses immunitaires dirigées contre les tumeurs ne fait aucun doute. De multiples observations, parfois très anciennes, l’attestent comme la découverte, au cours d’autopsies, de tumeurs cliniquement silencieuses ou encore l’observation confirmée par des données anatomopathologiques, de régressions spontanées de tumeurs. Par ailleurs, au cours de la vie il y a deux périodes où le système immunitaire serait moins efficace : la période néonatale et chez les sujets âgés, et c’est précisément durant ces deux périodes que l’apparition de cancer est la plus fréquente.
De manière corrélée, les cancers sont plus fréquents chez les sujets immunodéprimés comme les patients atteints du SIDA ou les tumeurs associées à des virus chez des patients traités par immunosuppresseurs. De plus, une infiltration de cellules lymphoïdes (lymphocytes T et cellules NK) a été constatée dans certaines tumeurs ce qui est d’ailleurs considéré indicateur de pronostic plutôt favorable dans la majorité des cas, même si on connaît aussi des exemples du contraire 2. Mais c’est dans les années 90 que cette immuno-surveillance est réellement mise en exergue. En effet, l’oncogénèse est favorisée par l’invalidation des gènes RAG-1, codant pour les protéines d’activation de la recombinaison V(D)J nécessaires à l’expression des récepteurs des cellules T (TCR) et B (BCR) 3, du
récepteur à l’interféron gamma (IFNγ), cytokine centrale de l’immunité tant adaptative qu’innée et de STAT-1, transducteur de l’effet de l’IFNγ, qui s’accompagnent d’une augmentation claire de l’incidence des cancers chez l’animal.
Il est maintenant établi que deux conditions majeures sont nécessaires pour qu’une immunité anti-cancéreuse spécifique puisse se développer : d’une part, l’existence d’antigènes (Ag) restreints aux tumeurs et, d’autre part, la reconnaissance de ces Ag par les effecteurs de l’immunité.
II-1/ Les Ag de tumeurs
II-1-1. Mise en évidenceL’approche génétique qui consiste à identifier les gènes qui codent pour un Ag reconnu par un clone de lymphocytes T anti-tumoraux à permis de surmonter chez l’Homme
4 et chez la souris 5 le problème de l’identification de ces Ag.
Il faut rappeler alors les travaux expérimentaux de l’équipe de T Boon qui consistaient à cultiver in vitro des cellules issues d’une biopsie de tumeur primaire, en présence de lymphocytes périphériques du même sujet 4. Ces travaux ont permis la mise en évidence de la reconnaissance par le système immunitaire des tumeurs humaines. En effet, au cours de cette culture mixte, les lymphocytes reconnaissant des antigènes tumoraux, prolifèrent et se différencient en lymphocytes T cytotoxiques (CTL), qui ont pu être clonés.
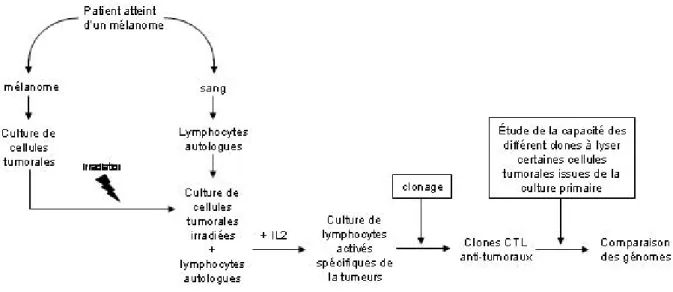
Les clones obtenus furent utilisés pour sélectionner des sous populations de cellules tumorales dont les génomes pouvaient alors être comparés. C’est ainsi que les gènes codant pour ces antigènes dits « de tumeur » ont été identifiés. Et c’est précisément dans ces conditions que les gènes MAGE (mélanome antigen) ont été identifiés (Figure 1) 6.
Figure 1 : Obtention de clones CTL anti-tumoraux autologues dirigés contre L’Ag de tumeur MAGE.
II-1-2. Les Ag de tumeur chez l’Homme
Chez l’Homme, les Ag de tumeur ont été classés en quatre grands groupes sur la base de leur modèle d’expression. Cette classification arbitraire présente l’intérêt d’être pratique. En effet le modèle d’expression des Ag est le facteur critique déterminant leur utilité potentielle pour l’immunothérapie des cancers.
Une première distinction peut être faite entre les Ag uniques (Table 1) qui résultent de mutations ponctuelles des gènes exprimés ubiquitairement, et les Ag partagés qui sont présents sur plusieurs tumeurs indépendantes. Les Ag partagés peuvent être ensuite divisés en 3 catégories : les Ag spécifiques de tumeur (Table 2), les Ag de différentiation (Table 3) et les Ag surexprimés (Table 4).
Cette liste n’est pas exhaustive, en effet un grand éventail de peptides additionnels a été décrit mais n’ont pas encore été inclus dans l’une ou l’autre de ces différentes catégories. En effet, des protéines cellulaires anormales (et antigéniques) peuvent également provenir de gènes viraux intégrés dans le génome de la cellule tumorale. Certains virus comme le virus d’Epstein Barr 7, de l’hépatite B 8 ou encore des papillomes 9, 10 jouent un rôle initiateur dans la cancérogenèse.
II-1-2-a. Les antigènes uniques
Les Ag uniques résultent de mutations ponctuelles des gènes exprimés ubiquitairement. La mutation affecte souvent la région codante du gène et est unique à la
tumeur d’un patient ou restreinte à une très petite quantité de patients. Certaines de ces mutations peuvent être impliquées dans la transformation tumorale. De tels Ag, lesquels sont strictement spécifiques de tumeurs, peuvent jouer un rôle important dans la réponse immune anti-tumorale des patients, mais la plupart d’entre eux ne peuvent pas être facilement utilisés comme cibles immunothérapeutiques parce qu’ils ne sont pas partagés par les tumeurs de différents patients.
Table 1: Ag exclusivement tumoraux
Gène / protéine Tumeur
alpha-actinin-4 Carcinome du poumon
ARTC1 mélanome
BCR-ABL Leucémie myéloïde chronique
B-RAF mélanome
CASP-5 carcinome colorectal, gastrique
CASP-8 carcinome des cellules squameuses
beta-catenin mélanome
Cdc27 mélanome
CDK4 mélanome
CDKN2A mélanome
COA-1 colorectal carcinome
dek-can Leucémie myéloïde
EFTUD2 mélanome
Elongation factor 2 Carcinome du poumon
ETV6-AML1 Leucémie lymphoblastique aigue
FN1 mélanome
GPNMB mélanome
LDLR-fucosyltransferaseAS mélanome
HLA-A2d carcinome des cellules rénales
HLA-A11d mélanome
hsp70-2 Carcinome des cellules rénales
KIAAO205 Tumeur de la vessie
MART2 mélanome
ME1 Carcinoma du poumon
MUM-1 mélanome
MUM-2 mélanome
MUM-3 mélanome
neo-PAP mélanome
Myosin class I mélanome
NFYC carcinome du poumon
OGT colorectal carcinome
OS-9 mélanome
pml-RARalpha Leucémie promyélocytaire
PRDX5 mélanome
PTPRK mélanome
K-ras Adénocarcinome pancréatique
N-ras mélanome
RBAF600 mélanome
SIRT2 mélanome
SNRPD1 mélanome
SYT-SSX1 or -SSX2 sarcome
II-1-2-b. Les antigènes partagés
Les Ag partagés sont présents sur plusieurs tumeurs indépendantes. Ils peuvent être ensuite divisés en trois groupes.
• Les antigènes spécifiques de tumeur
Ils sont habituellement le produit d’un gène normalement présent dans le génome, mais qui ne s’exprime pas dans les cellules normales adultes. C’est le cas de la famille des gènes MAGE (mélanome antigen), BAGE (bladder antigen) 11, GAGE (gastric antigen) 12, 13,
RAGE (renal antigen) ou encore de l’α−foetoprotéine. Aucune expression des gènes MAGE
n’est détectable dans les tissus normaux, à l’exception des testicules et du placenta, mais 75 % des mélanomes expriment au moins un des quatre gènes MAGE.
On peut citer également des Ag partagés par plusieurs types de tumeurs et résultant d’un défaut de glycosylation. Dans les tumeurs mammaires, de l’ovaire ou du pancréas, une glycosylation anormale de la mucine MUC1 engendre des déterminants antigéniques nouveaux 14. Dans 80 % des cellules tumorales mammaires, le gène MUC1 est surexprimé ou amplifié. La protéine Muc1 peut être clivée et son fragment soluble devient l’antigène circulant Ca 15.3. Cet Ag constitue un marqueur très utilisé pour le suivi du cancer du sein.
Les seules cellules normales dans lesquelles une expression significative de tels gènes a été détectée sont les trophoblastes placentaires. Parce que ces cellules n’expriment pas les molécules de CMH de classe I, l’expression génique ne résulte pas dans l’expression de peptides antigéniques, et de tels Ag peuvent donc être considéré comme strictement spécifique de tumeurs.
Table 2 : Les Ag partagés spécifiques de tumeur Gène / protéine BAGE-1 GAGE-1,2,3,4,5,6,7,8 GnTVf HERV-K-MEL KK-LC-1 KM-HN-1 LAGE-1 MAGE-A1,A2,A3,A4,A6,A9,A10,A12,C2, mucin NA-88 NY-ESO-1 / LAGE-2 SAGE Sp17 SSX-2 SSX-4 TRAG-3 TRP2-INT2 • Les Ag de différentiation
Un second groupe d’Ag de tumeur partagés sont aussi exprimés dans le tissu normal. Ces Ag peuvent être les produits de gènes de différenciation exprimés de façon limitée par les tissus sains, mais surexprimés ou amplifiés dans les tissus cancéreux correspondants. Le paradigme est la tyrosinase, laquelle est exprimée dans les mélanocytes normaux et dans la plupart des mélanomes. Les Ag de ce groupe ne sont pas spécifiques de tumeurs, et leur utilisation comme cible pour l’immunothérapie des cancers peut résulter dans l’auto-immunité autour des tissus normaux correspondant.
Dans le cas des mélanocytes, le risque d’induire des effets secondaires sévères, apparaît minime, et pourrait être limité à l’apparition de vitiligo. Des effets secondaires d’auto-immunité plus sérieux concernent l’Ag carcinoembryonique (ACE), une protéine oncofoetale exprimée dans l’épithélium du colon sain et dans la plupart des carcinomes de l’intestin. Des CTL dirigés contre un peptide de l’ACE ont été trouvés chez des patients immunisés avec un poxvirus recombinant contenant le gène de l’ACE 15. Il s’agit par exemple de protéines spécifiques des mélanocytes comme la tyrosinase 16, la gp100 17, Melan-A/MART1 18, gp75 19, 20.
Table 3 : Ag de différentiation
Gène / protéine Tumeur
ACE carcinome de l’intestin
gp100 / Pmel17 mélanome
Kallikrein 4 carcinome de la prostate
mammaglobin-A cancer du sein
Melan-A / MART-1 mélanome
NY-BR-1 cancer du sein
OA1 mélanome
PSA carcinome de la prostate
RAB38 / NY-MEL-1 mélanome
TRP-1 / gp75 mélanome
TRP-2 mélanome
tyrosinase mélanome
• Ag normaux surexprimés par les cellules tumorales
Il est beaucoup plus difficile de faire prédictions concernant la sécurité du ciblage des Ag partagés du troisième groupe, lesquels sont exprimés dans une large variété de tissus normaux et surexprimés dans les tumeurs. Parce que une faible quantité de peptide est requise pour la reconnaissance par les CTL, un faible niveau d’expression dans les tissus normaux peut signifier qu’il n’y a pas eu de dommages liés à la mise en place d’une réponse auto-immune. Cependant, ce seuil est difficile à définir.
L’équipe de Boone T a également mis en évidence l’existence d’un seuil d’expression du gène en dessous duquel il n’y a pas assez de protéines et donc de peptides antigéniques présentés pour permettre une reconnaissance par un CTL 21. C’est la raison pour laquelle les CTL anti-tumoraux reconnaissent parfois des Ag codés par des gènes qui sont exprimés dans beaucoup de tissus, mais qui sont plus fortement exprimés dans des tumeurs.
Par exemple, une seule copie du proto-oncogène HER-2/neu est présente dans les cellules normales, mais le gène est amplifié dans certaines cellules tumorales 22. La protéine
HER-2/neu, à peine détectable en immuno-histochimie dans les tissus adultes, est surexprimée dans environ 30 % des cancers du sein et de l’ovaire 23. Il en va de même pour le gène suppresseur p53 24. C’est le cas également des gènes RU2 dans les cellules rénales, à ceci près que certains transcrits de RU2 (RU2A) ne sont exprimés que dans les cellules tumorales où ils sont antigéniques 25.
Table 4 : Ag surexprimés par les tumeurs
Gène Expression dans les tissus Normaux
adipophilin adipocytes, macrophages
AIM-2 Ubiquitaire (faible niveau)
BING-4 Ubiquitaire (faible niveau)
CPSF Ubiquitaire (faible niveau)
cyclin D1 Ubiquitaire (faible niveau)
Ep-CAM Cellules épithéliales
EphA3 plusieurs
FGF5 Cerveau, reins
G250 / MN / CAIX Estomac, foie, pancréas
HER-2 / neu Ubiquitaire (faible niveau)
IL13Ralpha2
Intestinal carboxyl esterase Foie, intestin, reins
alpha-foetoprotein foie
M-CSF Foie, reins
mdm-2 ubiquitaire (cerveau, muscles, poumons))
MMP-2 ubiquitaire
MUC1 Epithélia glandulaires
p53 Ubiquitaire (faible niveau)
PBF Ovaires, pancréas, rate, foie
PSMA prostate, foie
RAGE-1 rétine
RNF43
RU2AS Testicules, reins, bladder
secernin 1 ubiquitaire
SOX10 Ubiquitaire (faible niveau)
STEAP1 prostate
survivin Ubiquitaire
Telomerase testicules, thymus, moelle osseuse noeuds lymphatiques
WT1 Testicules, ovaires, moelle osseuse, rate
II-2/ Les effecteurs de l’immunité anti-tumorale
L'immunité cellulaire anti-tumorale fait intervenir différents partenaires que sont les cellules hématopoïétiques et les médiateurs solubles qu’elles produisent.
D'abord se sont les lymphocytes T cytotoxiques (CTLαβ, γδ, cellules NK) qui reconnaissent des Ag spécifiques des tumeurs directement (cas des cellules NK) ou dans un contexte CMH restreint (cas des CTLαβ). Cette dernière possibilité implique une présentation de l’Ag tumoral par des cellules présentatrice d’Ag (CPA) telles que les macrophages, les cellules dendritiques ou les cellules B, des virus inducteurs ou des Ag normaux hyper ou anormalement exprimés par les cellules tumorales.
Ensuite, sous l'influence de lymphokines produites spécifiquement par les lymphocytes T (αβ et γδ), les cellules NKT, et NK ou les macrophages vont aider à détruire
les cellules néoplasiques. Ainsi, les interférons (notamment l'IFNγ synthétisé par les lymphocytes T) et l'interleukine 2 (IL2) augmentent la lyse des cellules cibles cancéreuses sensibles et font apparaître une cytotoxicité pour d'autres cellules cancéreuses normalement résistantes. De plus, les cellules NK et les lymphocytes T γδ, lorsqu'ils rencontrent leurs cellules cibles, produisent de l'IFNγ et de l'IL2 (dont la production par les cellules T γδ est plus faible que celle des cellules NK). Les fonctions de cytotoxicité (mort cellulaire) et de cytostase (arrêt du cycle cellulaire) des macrophages pour les cellules tumorales sont également accrues après activation des macrophages sous l'influence de l'IFNγ.
II-2-1. Les cytokines
Les cytokines sont de petites protéines qui participent à l’activation et à la désactivation du système immunitaire en permettant la communication intercellulaire. Elles agissent seules ou plus souvent de manière coordonnée et interviennent dans la mise en place et le fonctionnement de mécanismes qui luttent contre les agents infectieux, l’allergie, la greffe, l’auto-immunité ou encore contre la prolifération des cellules cancéreuses.
Les cytokines sont les outils et les cibles privilégiées de l’immuno-intervention anti-tumorale chez l’Homme puisque c’est par leur intermédiaire que les effecteurs de cette immunité agissent en grande partie.
L’IL2, L’IFNγ, L’IL12, l’IL15 et l’IL18 sont parmi les principales cytokines qui stimulent le développement de la réponse immune lymphocytaire T, et parallèlement, l’IL4, l’IL13, l’IL10 et l’IL6 participent à la réponse humorale médiée par les lymphocytes B. Certaines d’entre elles ont d’ailleurs un fort potentiel anti-tumoral telles que l’IL2, l’IL12, l’IFNγ et le facteur de nécrose tumoral (TNF pour tumor necrosis factor).
L’IL2 est une des cytokines les plus anciennement identifiées pour son activité comme facteur de prolifération des lymphocytes. Produite exclusivement par les lymphocytes T, elle a une action principalement lymphocytaire puisque ce sont les lymphocytes T B et NK qui en possèdent le récepteur. Ce récepteur extrêmement peu représenté sur les lymphocytes au repos est surexprimé après leur activation.
L’IFNγ est sécrété par les lymphocytes T CD4, T cytotoxiques, les cellules NK et les
induit l’expression des molécules d’HLA, est un puissant activateur des macrophages, stimule la cytotoxicité anti-tumorale des cellules NK et des macrophages en stimulant la production par ces derniers de radicaux libres oxygénés et du monoxyde d’azote. L’IFNγ stimule également la production d’immunoglobuline G (IgG) par les lymphocytes B et inhibe la prolifération des lymphocytes producteurs d’IL4.
L’IL12, produite par les monocytes/macrophages activés, possède une activité synergique avec l’IL2 pour induire la sécrétion d’IFNγ par les cellules NK. L’IL12 favorise le développement d’un certain type de lymphocytes T CD4 que sont les Th1 qui produisent les cytokines favorisant le développement les lymphocytes cytotoxiques. L’administration de l’IL12 à des souris porteuses de tumeurs peut prolonger leur survie en inhibant de manière significative la progression tumorale. De plus, l’IL12 possède une activité anti-angiogénique qui fait de cette cytokine un agent anti-tumoral potentiel avec un effet direct sur la vascularisation tumorale 26.
Le TNF a un large spectre d’activités biologiques mais suscite un intérêt particulier pour ses propriétés immuno-régulatrices et son action cytotoxique directe dirigée contre certaines tumeurs humaines 27.
II-2-2. Les effecteurs de l’immunité adaptative
L’immunité anti-tumorale adaptative est dépendante des lymphocytes T αβ CD8+,
mais également les CD4+, qui ont une activité cytotoxique sur la tumeur. En effet des LT CD8+ ne permet pas à elle seule d’éliminer la tumeur. Il existe d’autres mécanismes de défense. Il faut en effet tenir compte du rôle des lymphocytes T CD4+ : ils « aident » les LT CD8+ grâce à la production d’IFNγ et de TNF (pour Tumor Necrosis Factor) qui augmente l’expression des molécules HLA de classe I, molécules qui permettent la présentation de peptides tumoraux spécifiques aux LT CD8+.
II-2-2-a. Les différents stades de la maturation fonctionnelle des lymphocytes T
C’est au cours de leur développement intra thymique que les lymphocytes acquièrent la capacité de reconnaître une grande variété d’Ag associés aux molécules d’histocompatibilité du Soi. Cette propriété est d’une part liée à l’acquisition de récepteurs de reconnaissance de l’antigène, les récepteurs T, dont la biosynthèse s’opère à un stade précoce
du développement intra thymique. Elle est d’autre part la conséquence de processus sélectifs intra thymiques, qui favoriseront l’émergence de lymphocytes capables de reconnaître les produits d’histocompatibilité du Soi tout en prévenant la production de thymocytes auto-réactifs.
Les lymphocytes T αβ sont issus des cellules souches hématopoïétiques qui colonisent le thymus. La phase précoce du développement est indépendante des molécules du CMH. Les réarrangements sont en premier lieu déclenchés au niveau du locus β. L’expression du pré-TCR constitué d’une chaîne β et de la chaîne pTα permet la réception d’un signal anti-apoptotique et la progression des cellules au stade de développement suivant (la sélection β). La transition au stade CD4+CD8+ (double positif) s’accompagne de réarrangements V-J au niveau du locus α. En cas de réarrangement productif, un TCR αβ se substitue au pré-TCR. Dès lors, le développement des thymocytes est subordonné aux interactions du TCR avec les complexes peptides-CMH exprimés à la surface des cellules stromales thymiques. L’intégration des signaux délivrés lors de l’interaction thymocytes/ cellules stromales conduit à la sélection positive (cette phase est dépendante des cellules épithéliales corticales) et éventuellement, à la délétion des thymocytes (ou sélection négative) qui assure l’établissement de la tolérance aux Ag du soi exprimés par cellules d’origine hématopoïétique. Les thymocytes sélectionnés positivement achèvent leur maturation au sein de la médulla. Ces thymocytes deviennent alors des CD4+ CD8- ou CD4- CD8+ et gagnent les organes lymphoïdes périphériques au sein desquels ils constituent respectivement les précurseurs des lymphocytes cytotoxiques (CD8+) et auxiliaires (CD4+).
II-2-2-b. Les cellules T « helper » (CD4+)
Ces cellules sont des intermédiaires de la réponse immunitaire et prolifèrent pour activer quantité d’autres types cellulaires qui agiront de manière plus directe sur la réponse. En effet, les cellules CD4+ régulent ou « aident » à la réalisation d'autres fonctions lymphocytaires. Elles se différencient en cellules Th2 productrices d’IL4, IL5, IL6, IL9, IL10 et IL13 impliquées dans l’activation de la réponse humorale et en cellules Th1 productrices d’IL2, d’IFNγ, de TNFα, de GM-CSF et de M-CSF. L’IL2 et l’IFNγ sont essentiellement impliquées dans la réponse cellulaire avec notamment l’activation des cellules cytotoxiques CD8+.
Après leur développement, les cellules T naïves quittent le thymus pour coloniser le reste de l’organisme. Comme toutes les cellules T, elles expriment le récepteur à l’Ag des cellules T (TCR) couplé au module de transduction CD3. Le TCR des cellules CD4+ a une affinité pour le CMH II exprimé à la surface de toutes les cellules présentatrices d’Ag (CPA).
L’activation des cellules T CD4+ par les CPA se fait à travers une synapse immunologique. Le terme de « synapse immunologique » est apparu récemment 28, 29. Il désigne la zone de contact entre une cellule du système immunitaire à vocation effectrice et une cellule présentant l’antigène. Il n’existe pas « une » synapse immunologique unique et canonique, mais « des » synapses immunologiques distinctes, compte tenu des caractéristiques moléculaires des différents acteurs cellulaires mis en jeu, et des différentes fonctions assurées : détecter la présence d’un antigène à la surface d’une APC, pour une cellule T naïve, pour être « activée » et proliférer ; détecter la présence d’un antigène à la surface d’une cible et la tuer, pour une cellule T CD8 activée ; délivrer des cytokines localement à une cellule B pour provoquer sa différenciation, dans le cas d’une cellule T CD4 activée, etc. La synapse immunologique la plus étudiée est celle formée par une cellule T et une APC 30-32.
L’activation des cellules T CD4+ nécessite deux signaux (Figure 2)
(1) Après endocytose et apprêtement de l’Ag, la CPA migre au site de l’infection dans les ganglions lymphatiques, où elle présente les peptides antigéniques liés au MHC de classe II, permettant l’activation sélective des cellules T CD4+ exprimant le TCR spécifique de ce peptide. Cette activation est « permise » grâce à la liaison TCR/CD3-CMHII/peptide stabilisée par le co-récepteur CD4 ainsi qu’à l’interaction de la protéine LFA-1 (cellule T) avec la protéine ICAM (CPA) qui sont les molécules primaires de l'adhérence. La cellule T CD4 établit alors un contact plus étroit permettant aux protéines kinases intracellulaires présentes sur le TCR, le CD3 et le CD4 de s'activer par phosphorylation. Les voies activées correspondent au signal de pro activation dans une cellule de Th.
(2) Après avoir reçu ce premier signal, la cellule T naïve doit recevoir un deuxième signal d’activation pendant l'exposition initiale à l'Ag. Sans cela la cellule T devient anergique, état correspondant à la perte de la propriété à réagir spécifiquement à un Ag auquel elle est sensibilisée. Ce deuxième signal implique une interaction entre CD28 sur la cellule T CD4+ et les protéines CD80 (B7.1) ou CD86 (B7.2) sur la CPA CD80 et CD86 activent le récepteur CD28. Ces protéines sont également connues en tant que molécules de co-stimulation. Une fois que les deux signaux stimulateurs sont déclenchés dans la cellule T
helper, la cellule commence à proliférer, notamment grâce à sa propre libération d’IL2 (stimulation autocrine).
Figure 2 : Activation des cellules T CD4
Les cellules T mémoires seront réactivées en utilisant les mêmes voies dépendantes du TCR, consécutivement à de nouvelles rencontres avec l'Ag.
II-2-2-c. Les cellules T cytotoxiques (CD8+)
Les cellules cytotoxiques ont la capacité de lyser les cellules consécutivement à la reconnaissance spécifique d’un Ag. Cette cytotoxicité nécessite un contact cellulaire entre le lymphocyte T et sa cible. Ce contact est initié par l’interaction du TCR avec le complexe peptide-CMH de classe I. Il est renforcé par la molécule CD8 et également par des molécules d’adhésion cellulaire. La lyse repose sur 3 grands mécanismes que sont :
- Le plus rapide (quelques minutes) et efficace met en jeu des protéines secrétées par le CTL au point de contact entre le CTL et sa cible : il s’agit de la perforine et des granzymes (A, B, K et M) contenues dans des vésicules acides 33. La perforine va s’insérer dans la membrane de la cellule cible et y créer des pores. La formation de ces pores n’est pas suffisante pour entraîner la mort de la cellule cible mais permet l’entrée des granzymes dans la cellule. A ce jour, 5 granzymes humaines ont été identifiées (A, B, H, K et M). Les
granzymes sont des sérines protéases qui sont libérées par les granules cytoplasmiques présentes dans les CTL et les cellules NK (Table 5).
Table 5 : Expression des granzymes A, B, K et M (Gzm) et de la perforine dans les PBMCs humains (d’après34)
sous-populations lymphocytaires Gzm A/B Gzm K Gzm M perforine
Cellules B – – – – Cellules T (CD3+) + + + + cellules Th (CD4+) –/+ –/+ –/+ – cellules TC (CD8+) ++ + ++ + cellules Tγδ (γδ-TCR+) ++++ ++ ++++ ++++ cellules NKT (CD56+) ++++ ++ ++++ ++++ cellules NK (CD3–CD56+CD16+) ++++ –/+ ++++ ++++ cellules CD56bright ++++ +++ +++ ++++
Les symboles représentent le pourcentage de cellules positives pour les différentes granzymes (Gzm) (–, <1% ; –/+, 1–10% ; +, 25–50% ; +++, 50–75% ; ++++, >75% ; *perforinbright).
Les granzymes induisent l'apoptose des cellules cibles. Ces protéases clivent diverses protéines intracellulaires telles que les caspases (particulièrement la caspase-3), la protéine Bid et les protéines Smac/Diablo et Omi/HtrA2 entre autres. Les caspases activent des DNases qui dégradent l'ADN, et de ce fait induisent des cascades apoptotiques 35. La protéine Bid, recrute les protéines Bax et Bak qui modifient la perméabilité de la membrane des mitochondries, causant le relargage du cytochrome c (qui est l'une des pièces requises pour former la caspase-9) 36, les protéines Smac/Diablo et Omi/HtrA2 suppriment des protéines inhibitrices d'apoptose 37.
- Un second mécanisme met en jeu la protéine FasL membranaire 38 ou sécrétée par le CTL qui va se fixer sur un récepteur Fas situé sur la cible. La liaison de FasL à son récepteur va déclencher une mort par apoptose de la cellule cible. Ce mode de lyse est plus lent (plusieurs heures) et quantitativement souvent moins efficace que la lyse dépendante du couple perforine/granzyme.
- Enfin le TNFα sécrété par le CTL va pouvoir se fixer sur le récepteur au TNF situé sur la cellule cible ce qui conduit aux même types de conséquences que l’interaction FasL/Fas. Dans ces deux derniers cas, la cellule cible meure par apoptose.
II-2-3. Les effecteurs de l’immunité innée
II-2-3-a. Les cellules dendritiques (DC)
En 1968 Paul Langerhans a observé le premier des cellules qui allaient être identifiées comme cellules dendritiques (DC) à l’intérieur de l’épithélium de la peau. Cinq ans plus tard Steinman et Cohn ont identifié un type cellulaire rare présentant des prolongements appelés dendrites, dans la rate de souris, et qui était impliqué dans l’induction de réponses immunes
39. Ces DC sont les cellules présentatrices d’antigènes (CPA) les plus puissantes et jouent un
rôle central dans l’initiation de la réponse immune 40.
Dans les tissus périphériques, les DC sont présentes dans un état « immature » qui autorise une capture efficace des antigènes à travers la macro-pinocytose, la phagocytose et l’internalisation médiée par les récepteurs 41. Une fois que les DC ont capturé l’antigène dans les tissus périphériques, elles acquièrent la capacité à migrer vers les organes lymphoïdes secondaires drainant. C’est là qu’elles vont présenter les peptides aux cellules T, et compléter leur maturation après avoir reçu les signaux provenant des cellules T spécifiques de l’antigène présenté 42. Elles se différencient en DC « matures » lesquelles se caractérisent par une activité phagocytaire faible et un potentiel de présentation antigénique élevé 43. Alors que d’autres CPA professionnelles (tels que les macrophages) ou non professionnelles (telles que les cellules B) peuvent seulement stimuler des cellules T activées ou mémoire, les DC ont la capacité unique de stimuler les lymphocytes T quiescents et naïfs. En effet, la présence d’un large éventail de molécules de co-stimulation et d’adhésion (comme B7-1, B7-2, CD40, LFA3 ICAM1, ICAM3) sur la membrane des DC facilite les interactions cellulaires, optimise la présentation antigénique et fournit aux cellules T un second signal, lequel est essentiel dans la prévention de cellules T anergiques 43. Les DC sont également importantes pour induire un état de tolérance immunitaire 44.
Des sous-populations distinctes de DC régulent différentiellement les effecteurs immuns tels les lymphocytes T CD4+, T CD8+ ou les cellules T régulatrices. C’est la raison pour laquelle certains patients n’établissent pas de réponses immunes, et ne montrent pas de réponses cliniques. On peut avancer l’hypothèse de l’implication de la nature des DC utilisées. En effet la ou les sous populations de DC utilisées lors des protocoles de vaccination, pourraient ne pas être adaptées à la pathologie considérée. Ainsi les patients
considérés pourraient avoir un défaut dans la stimulation, par les cellules DC, des lymphocytes T CD4+, ce qui empêcherait une activation efficace des cellules T CD8+. Alternativement, la progression de la maladie pourrait être associée à l’expansion des cellules régulatrices telles que les cellules NKT ou les cellules Tr1.
Chez la souris, il a récemment été avéré que la source principale d'IFNγ, composant essentiel de l’immunosurveillance antitumorale, n'est pas la cellule NK conventionnelle mais plutôt un sous-ensemble de DC B220+ Ly6C-/- 45,46. Ces DC sont atypiques dans le sens où elles expriment des molécules de surface de cellule NK (NK1.1)47. Lors du contact avec une variété de cellules tumorales qui sont mal reconnues par des cellules NK conventionnelles, les cellules dendritiques NK1.1+ B220+ sécrètent des niveaux élevés d'IFNγ et provoquent une lyse des cellules tumorales dépendante de TRAIL (TNF-related apoptosis-inducing ligand), cytokine appartenant à la famille du TNF. Le transfert adoptif de ces DC tueuses productrices d’IFNγ ou IKDC (IFNγ-producing Killer Dendritic Cells) dans des souris Rag2 (-/-) IL2rγ (-/-)
prévient la croissance de la tumeur, ce qui n’est pas le cas avec le transfert de cellules NK conventionnelles. C’est ainsi qu’a été mise en évidence cette nouvelle sous-population de DC impliquée dans l’immuno-surveillance des tumeurs (Figure 3).
Figure 3 : les IKDC, un nouveau type de cellule immunitaire (d’après 48)
Les interactions entre les DC et les NK se produisent à divers stades de la réponse immune dirigée contre les pathogènes ou les tumeurs (panel A). Les cellules NK peuvent tuer des cellules cibles après leur identification. Les cellules dendritiques répondent alors à la mort de ces cellules cibles en partie en reconnaissant les débris de cellules mortes grâce à des récepteurs reconnaissant des structures conservées (pattern-recognition receptors ou PRR), incluant les toll-like receptors (TLRs). Par la suite les cellules dendritiques activent la réponse immune adaptatrice incluant des cellules de CD4+. Il existe donc une voie alternative à l'immunité adaptative impliquant les IKDC capables de tuer la cellule infectée et d’activer les cellules T CD4+ (panel B). Les études réalisées par le groupe de L. Zitvogel montrent que l'imatinib mesylate active les IKDC dans un modèle de cancer de souris, qui pourrait expliquer l'effet thérapeutique du glivec dans certaines tumeurs stromales gastro-intestinales résistantes à son effet anti-prolifératif.
CpG = motif d’ADN bactérien ; LPS = Lipopolysaccharide ; MHC II = Complexe Majeur d’Histocompatibilité de classe II
Pour leurs propriétés originales, les DC représentent un outil immuno-thérapeutique permettant d’augmenter l’immunité contre les agents infectieux et l’efficacité des vaccinations anti-cancéreuses (mélanomes 49-53, prostate 54, 55, colon 56, lymphomes B 57). Dans ces diverses stratégies, les DC sont chargées avec l’Ag tumoral sous différentes formes : peptide 50, 52, 56, lysat de plusieurs peptides 51ou de la cellule tumorale 49, idiotype spécifique de la tumeur 57 ou ARN de l’Ag tumoral 55. Enfin, les DC sont désormais utilisées comme vecteurs en immunothérapie anticancéreuse car elles représentent des adjuvants naturels 58.
II-2-3-b. Les cellules Natural killer (NK)
La découverte des cellules NK remonte au début des années 1970 au cours d’une étude sur la répartition des lymphocytes du sang périphérique aussi bien de sujet sain que de patients atteints de polyarthrite rhumatoïde, le lupus érythémateux disséminé, et de la tuberculose. Dans cette étude l’équipe du professeur Yvan Roitt a observé un type cellulaire ni T ni B, capable de tuer d’autres cellules. Ces cellules ont alors été appelées « cellules nulles » 59. Ce n’est qu’en 1975 que ce phénomène a été à nouveau observé par deux équipes indépendantes 60, 61, au cours de recherches sur la capacité des lymphocytes T à lyser des cellules tumorales contre lesquelles elles avaient été préalablement immunisées. Durant ces expériences, les chercheurs ont observé ce qu’ils ont appelé la « réactivité naturelle » : certaines cellules pouvaient lyser des cellules tumorales sans sensibilisation préalable, et c’est Kiessling qui leur donna le nom de cellules « Natural Killer » (NK).
Ces cellules NK sont des lymphocytes cytotoxiques qui constituent un composant majeur du système immunitaire inné. Ils jouent un rôle majeur dans le rejet des cellules tumorales et des cellules infectées par un virus et ont été appelés « Natural Killer » à cause du fait qu’ils n’ont besoin d’aucune activation préalable pour tuer des cellules qui sont « missing-self ». Ce modèle de reconnaissance « d’absence du soi » ou « missing missing-self » proposé en 1990 par Ljunggren et Karre permet de décrire la reconnaissance des cellules qui ont une absence ou un faible niveau d’expression des molécules qui caractérisent le « soi » : les molécules de de CMH I. Cette situation pourrait être due à une infection virale ou dans les tumeurs sous une forte pression de sélection des cellules T tueuses.
Etant donné leur forte activité cytolytique et leur potentiel pour l’autoréactivité, l’activité des cellules NK est étroitement régulée. Elles sont activées par des signaux de différentes natures :
(i) les cytokines : les IFNα/β jouent un rôle crucial dans l’activation des cellules NK. Comme ces molécules sont des molécules de stress, relarguées par les cellules après infection virale, elles servent à signaler aux cellules NK la présence de pathogènes viraux. Il a été démontré que l’IL2 et l’IFNγ peuvent activer les cellules NK. Ainsi l’action des cellules NK est potentialisée par certaines cytokines comme le TNFα et IL-2 (libérée par les LT CD4+) et
l’IL-12 sécrétée par les macrophages. Cette action nécessite donc l'activation concomitante des LT CD4+ et des macrophages, mais le rôle des cellules NK est surtout potentialisé par l'IL-2.
(ii) Les récepteurs au fragment constant des IgG (FcγR) : Il existe 3 classes de FcγR : FcγRI (CD64), FcgRII (CD32), and FcγRIII (CD16). Les FcγRIa, FcγRIIa, FcγRIIc, et FcγRIII sont des récepteurs activateurs due à la présence de motif ITAM. Le Cross-linking des FcγR activateurs avec des cellules recouvertes d’IgG ou de complexes immuns IgG induit la phosphorylation des ITAM par les tyrosines kinases Src. Les évènements de signalisation en aval aboutissent à différentes réponses cellulaires telles que la phagocytose, l’exocytose de granules, l’ADCC ou la synthèse de cytokine. Le seul récepteur inhibiteur, FcγRIIb, contient un motif ITIM (pour immunoreceptor tyrosine-based inhibitory motif) dans leurs domaines cytoplasmiques.
Les cellules NK, ainsi que les macrophages et plusieurs autres types cellulaires, expriment des FcR (Table 6). La plupart des FcγR, incluant le FcγRIIb, sont exprimés par les macrophages. Donc, les complexes immuns peuvent engager à la fois les FcγR activateurs et inhibiteurs sur la même cellule. Cependant, les NK expriment uniquement les récepteurs activateurs, FcγRIII et FcγRIIc. L’interaction du fragment constant d’une IgG avec le CD16 active les cellules NK qui vont diriger leur activité cytolytique vers la cellule contre laquelle une réponse humorale a été mobilisée, et à la lyser au travers d’une réaction d’ADCC (Antibody Dependant Cellular Cytotoxicity).
Table 6 : Récepteurs des fragments constants des Ig
Ligand dénomination fonction Expression cellulaire
IgG FcγRI (CD64) FcγRII-A (CD32) FcγRII-B1 (CD32) FcγRII-B2 (CD32) FcγRII-C (CD32) FcγRIII (CD16) Activateur Activateur Inhibiteur Inhibiteur activateur Activateur Macrophages Neutrophiles DC Eosinophiles Macrophages Neutrophiles Eosinophiles Plaquettes Cellules de Langerhans DC Lymphocyte B Mastocytes DC Macrophages Neutrophiles Eosinophiles Cellule NK Macrophages Lymphocytes T DC
IgA FcαRI (CD89) Macrophages
Neutrophiles Eosinophiles Lymphocytes T Lymphocytes B IgE FcεRI FcεRII (CD23) Eosinophiles Mastocytes Basophiles DC Macrophages Eosinophiles Mastocytes Basophiles DC Lymphocytes T Lymphocytes B
(iii) Les récepteurs activateurs et inhibiteurs : en plus du récepteur Fc, les cellules NK expriment une variété de récepteurs qui servent soit à activer ou à inhiber leur activité cytolytique. Ces récepteurs lient divers ligands sur les cellules cibles et ont un rôle important dans la régulation de la réponse des cellules NK. En effet, dans le but de défendre l’organisme
contre les virus et autres pathogènes, les NK requièrent des récepteurs capables de déterminer si une cellule est infectée ou non (Figure 4). Ces récepteurs ne sont pas tous propres aux cellules NK et peuvent être présents dans d’autres sous-populations de cellules T.
Les récepteurs de la superfamille des immunoglobulines : KIR
Initialement ce terme signifiait « Killer inhibitory receptor » mais la découverte progressive, de molécules homologues et aux fonctions activatrices a conduit à conserver l'acronyme KIR pour désigner « un killer immunoglobulin-like receptor ». Parmi les 12 gènes KIR fonctionnels identifiés chez l'homme, le nombre de ceux-ci présents sur chaque haplotype (entre 7 et 10 gènes) est variable. Comme ces gènes sont exprimés indépendamment du CMH, un individu possède des KIR correspondants à ses propres allèles de CMH-I mais également à des spécificités allogéniques qui ne lui sont d'aucun usage physiologique. En effet, si chaque clone NK peut potentiellement exprimer plusieurs récepteurs inhibiteurs, en règle générale il n'en possède qu'un seul. Cette distribution clonale des KIR est importante puisqu'elle permet à un clone NK donné de percevoir l'absence isolée d'un allèle HLA. Comme d'autres protéines à fonctions inhibitrices (CTLA-4, CD22, FcγRIIB), les KIR inhibiteurs possèdent deux séquences ITIM intracellulaires. Les récepteurs KIR activateurs ne possèdent pas de séquences ITIM mais au contraire, des séquences ITAM. Les séquences ITAM transmettent un signal activateur.
Les récepteurs de type lectine, CD94-NKG2
La famille de molécules de type C lectines NKG2 associées à CD94 constituent des récepteurs présents sur la grande majorité des lymphocytes NK ainsi que des lymphocytes T γδ et certains lymphocytes T αβ CD8 mémoires. Fonctionnellement, 2 complexes interviennent, NKG2A-CD94 inhibiteur et NKG2C-CD94 activateur. La sollicitation du récepteur NKG2A permet, via la partie intra-cytoplasmique de la molécule qui contient 2 ITIM, de transmettre un signal inhibiteur de la lyse. Le principal ligand de cet hétérodimère est la molécule HLA-E (vue avec le CMH). Présentant des peptides issus de la séquence leader des molécules HLA-A, B, C, G, la molécule HLA-E n'aura un déficit d'expression qu'en cas de défaillance globale de synthèse de molécules HLA de classe I. Le récepteur homologue, NKG2C, ne possède pas de séquences ITIM, s'associe à KARAP/DAP12 porteur d'un ITAM et se comporte comme un activateur après interaction avec HLA-E via l'activation de tyrosines kinases comme Syk.
Récepteurs activateurs dénommés NCR
L’acronyme NCR signifie « Natural Cytotoxicity Receptors ». Ces récepteurs sont : NKp30, NKp44, NKp46 et NKp80 ; ils appartiennent à la super-famille des Ig et sont très spécifiques
des lymphocytes NK62. Les ligands des NCR ne sont pas des produits du CMH, et leur identification reste à faire.
NKG2D
En 1999 le produit du gène NKG2D a été caractérisé comme associé en cluster sur le chromosome 12 mais sans homologie de séquence avec NKG2A, C, E, F. NKG2D est un homodimère dépourvu de séquence ITIM et non associé à CD94. Il est exprimé par la plupart des lymphocytes NK mais aussi des lymphocytes T γδ et T CD8. Il constitue un récepteur pour des protéines de stress, MICA et MICB, (MHC class I chain-related A/B) produits HLA-like dont les gènes très peu polymorphes, sont codés dans le CMH. Le stress, une infection virale, une transformation maligne, augmentent fortement leur expression 63-67. Il existe d'autres protéines humaines reconnues par NKG2D. Il s’agit des ULBP-1, 2, 3 et 4 (UL16 Binding Protein, structure de type HLA-I-like également) 65, 68-70 qui sont induites par l’infection virale (CMV notamment) dans de nombreux types cellulaires.
Figure 4 : Régulation de l’activation des cellules NK.
Ainsi grâce à leur récepteur KIR les cellules NK sont capables de faire la distinction entre des cellules normales et d'autres cellules qui vont devenir leur cible. Lorsque les CMH de classe I est identifié par les récepteurs KIR, l'action de ces cellules tueuses est inhibée. En revanche, les cellules étrangères, caractérisées par une densité CMH très faible et surtout
différente de celle des cellules du soi, ne sont pas reconnues par ces récepteurs. Et en l'absence de message inhibiteur, le mécanisme de destruction est déclenché.
Néanmoins, l’équipe d'Éric Vivier a montré que ce les récepteurs des cellules NK ne reconnaissent pas les molécules du CMH de classe 1 spontanément 71 : Les cellules NK semblent ne pas tuer leurs cellules cibles aussi « naturellement » qu'on le pensait. Il s'agirait en fait d'un « apprentissage» au cours de leur maturation.En effet dans cette étude les auteurs montrent qu’il existe dans le sang périphérique des cellules NK négatives en termes d’expression des KIR inhibiteurs. Ces cellules présentent un phénotype de cellule NK mature mais sont hyporépondeuses à différents stimuli, même à des cellules cibles CMH de classe I-déficientes. Au contraire les cellules NK exprimant un seul KIR inhibiteur spécifique pour le CMH de classe I du soi, sont fonctionnellement compétentes lorsqu’elles sont exposées aux même stimuli. Ces résultats montrent l’implication des interactions KIR-CMH de classe I dans la calibration des capacités effectrices des cellules NK. Ainsi, les mêmes auteurs ont mis en évidence, dans le fonctionnement de ce type de lymphocytes, un mécanisme qui ouvre des perspectives thérapeutiques intéressantes, notamment dans les greffes. En effet, l'éducation des cellules NK par le biais des récepteurs KIR permet d'envisager de contrôler l'activité de ces cellules et ouvre ainsi la voie à des applications thérapeutiques importantes. Par exemple lors des transplantations hématopoïétiques, l'éducation des cellules NK pourrait permettre de diriger les cellules NK de manière efficace contre les cellules que l'on veut et de laisser en vie celles que l'on veut garder.
II-2-3-c. Les lymphocytes NKT
Les lymphocytes NKT forment un groupe hétérogène de lymphocytes T. La plupart de ces cellules reconnaissent la molécule non polymorphique CD1d, une molécule présentatrice des antigènes lipidiques et glycolipidiques, analogue aux protéines du CMH de classe I. Les NKT constituent 0,2% environ des lymphocytes T du sang périphérique. Le terme NKT fut utilisé en premier lieu pour qualifier une sous-population particulière de lymphocytes T murins exprimant le marqueur NK 1.1 (CD161, auparavant considéré comme caractéristique unique des cellules NK). Il est maintenant admis que l’acronyme NKT fait référence aux lymphocytes T humains et murins CD1d-restreints, co-exprimant un TCR semi-invariant et des marqueurs NK. Ils se différentient des cellules T αβ par leur TCR peu diversifié et une
spécificité vis-à-vis d’Ag lipidiques et glycolipides CD1d-dépendants. Il a été proposé une classification des NKT en trois groupes (Table 7).
Table 7 : Les différents types de cellules NKT
NKT de type 1 NKT de type 2 NKT-Like
Autres noms NKT classiques
NKT invariant (iNKT) Vα14i NKT (souris) Vα24i NKT (humain) NKT non-classiques Cellules T NK1.1+ Cellules T CD3+CD56+ Restriction CD1d CD1d CMH, autres ? Réactivité α-GalCer + - - TCR répertoire Vα14-Jα18:Vβ8.2,7,2 (souris)
Vα24-Jα18:Vβ11 (humain) Divers Divers
La sous-population de NKT restreints au CD1d la mieux connue exprime une chaîne invariante du TCR alpha (NKT de type 1 ou iNKT). Ces cellules sont conservées des rongeurs aux humains et sont impliquées dans de nombreux processus immunologiques. Elles forment donc un lien entre le système immunitaire inné et le système immunitaire adaptatif en jouant un rôle clé dans la réponse innée et l’induction de la réponse adaptative 72. Contrairement aux lymphocytes T conventionnels, dont le TCR reconnaît un peptide présenté par une molécule de CMH, les NKT reconnaissent un glycolipide, dont le plus connu est l’α-galactosylceramide (α-GalCer) présenté par CD1d 73-75.
Bien que l'effet anti-tumoral de l'IL-12 soit essentiellement médié par les cellules NK et les cellules T, les cellules Vα14 NKT se sont avérées une cible essentielle de l’IL-12, et leur cytotoxicité se fait par un mécanisme semblable à celui des cellules NK après activation par l’IL-12 76. Une fois activées, les NKT sont capables de lyser les cibles tumorales tout comme les NK puisqu’elles expriment le co-récepteurs activateurs de lyse que sont NKG2D et CD244 et de sécréter des cytokines pro- (TNFα ou IFNγ) ou anti-inflammatoires (IL4 ou IL13) 77. Elles peuvent donc activer les effecteurs du système immunitaire adaptatif 78. Elles peuvent potentialiser ou inhiber l’immunité à médiation cellulaire dans les cas de surveillance tumorale 79. Les cellules NKT sont également capables d’activer les DC grâce à la sécrétion d’un cocktail de médiateurs solubles (Figure 5). Les DC produisent en retour de l’IL12 permettant de favoriser la réponse CTL et NK 80. Les cellules NKT permettent également la maturation et la différenciation des monocytes en DC 81.