Université de Sherbrooke
Le 4-fluoro-llp-méthoxy-[1
8
F]fluoroestradiol
(4FMFES) pour l'imagerie des récepteurs
.d'œstrogènes par tomographie par émission de
positrons
par
Jean-Mathieu Beauregard
Département de médecine nucléaire et radiobiologie
Mémoire présenté à la Faculté de médecine et des
sciences de la santé en vue de l'obtention du grade
de maître ès sciences (M.Sc.) en radiobiologie
l+I
NOTICE:
Library and Archives Canada
Published Heritage Branch
395 Wellington Street Ottawa ON K1A ON4 Canada
The author has granted a
non-exclusive license allowing Library and Archives Canada to reproduce, publish, archive, preserve, conserve, communicate to the public by
telecommunication or on the Internet, loan, distribute and sell theses worldwide, for commercial or non-commercial purposes, in microform, paper, electronic and/or any other formats.
The author retains copyright ownership and moral rights in this thesis. Neither the thesis nor substantial extracts from it may be printed or otherwise reproduced without the author's permission.
ln compliance with the Canadian Privacy Act some supporting forms may have been removed from this thesis.
While these forms may be included in the document page count, their removal does not represent any loss of content from the thesis.
.
....
Bibliothèque et Archives Canada Direction du Patrimoine de l'édition 395, rue Wellington Ottawa ON K1A ON4 CanadaAVIS:
Your file Votre référence ISBN: 978-0-494-53371-0 Our file Notre référence ISBN: 978-0-494-53371-0
L'auteur a accordé une licence non exclusive permettant à la Bibliothèque et Archives Canada de reproduire, publier, archiver, sauvegarder, conserver, transmettre au public par télécommunication ou par l'Internet, prêter, distribuer et vendre des thèses partout dans le monde, à des fins commerciales ou autres, sur support microforme, papier, électronique et/ou autres formats.
L'auteur conserve la propriété du droit d'auteur et des droits moraux qui protège cette thèse. Ni la thèse ni des extraits substantiels de celle-ci ne doivent être imprimés ou autrement
reproduits sans son autorisation.
Conformément à la loi canadienne sur la protection de la vie privée, quelques formulaires secondaires ont été enlevés de cette thèse.
Bien que ces formulaires aient inclus dans la pagination, il n'y aura aucun contenu manquant.
Table des matières
LISTE DES ABRÉVIATIONS ... V RÉSUMÉ ... VI
I. INTRODUCTION ... 1
CANCER DU SEIN ...•...•... 2
ŒsTROGÈNES ... 4
RÉCEPTEURS D'ŒSTROGÈNES ... 5
RÔLE DES RÉCEPTEURS D'ŒSTROGÈNES DANS LE CANCER DU SEIN ... 6
IMAGERIE MOLÉCULAIRE ... 8
TRACEURS POUR L'IMAGERIE DES RÉCEPTEURS D'ŒSTROGÈNES ... 10
RÔLE DE LA SEX HORMONE-BINDING GLOBULIN ... 14
ACTIVITÉ SPÉCIFIQUE EFFECTIVE... 16
DOSIMÉTRIE ...•... 18
II. ARTICLES ... 21
ARTICLE l : STEROID RECEPTOR IMAGING IN BREAST CANCER ... 21
Avant-propos ... 21
Résumé ... 22
Manuscrit ... 23
Summary ... 24
Introduction ... 25
Molecular biology of the estrogen and progesterone receptors ... 26
Transport and delivery of steroid hormones in plasma ... 29
Prognostic value of ER and PR expression in breast cancer ... 30
Current treatment strategies for ER/PR+ breast cancers ... 32
Role of ER/PR expression imaging in the management of breast cancer ... 37
Radioligands for steroid receptor imaging ... .40
Estrogen receptors ... .40
Progesterone receptors ... 50
Clinical imaging studies with 18F-FES ... 51
Conclusion ... 60
Acknowledgement ... 60
References ... 61
ARTICLE 2: EFFECTIVE SPECIFIC ACTIVITIES DETERMINED BY SCINTILLATION PROXIMITY COUNTING FORPRODUCTIONRUNSOF [18F]FES AND4F-M[18F]FES ... 72
Avant-propos ... 72
Résumé ... 73
Manuscrit ... 74
Abstract ... 75
Introduction ... 76
Material and methods ... 77
Effective specific activity determination ... 77
Relative binding affinity ... 79
Filtration experiments ... 79
Results ... 80
Effective specific activity ... 80
Relative binding affinity ... 82
Filtration experiments ... 83
Discussion ... 84
Conclusion ... 87
Acknowledgment ... 87
ARTICLE 3: [18F]FLUORINATED ESTRADIOL DERIVATIVES FOR OESTROGEN RECEPTOR IMAGING: IMPACT OF SUBSTITUENTS, FORMULATION AND SPECIFIC ACTIVITY ON THE BIODISTRIBUTION IN BREAST
TUMOUR-BEARING MICE ...•... 90 Avant-propos ... 90 Résumé ... 91 Manuscrit ... 93 Abstract ... 94 Introduction ... 96
Materials and methods ... 97
Radiochemistry ... 97
Tumour models ... 98
In vitro receptor saturation studies ... 98
Animais ... 99
Biodistribution studies ... 99
In vivo competition assay ... 101
Statistical analysis ... I 02 Results ... 102 Discussion ... 109 Conclusion ... 112 Acknowledgements ... 112 References ... 113
ARTICLE 4 : ASSESSMENT OF HUMAN BIO DISTRIBUTION AND DOSIMETRY OF 4-FLUOR0-11 B-METHOXY-l 6A-[l 8F]-FLUOROESTRADIOL USING SERIAL WHOLE-BODY PET/CT ACQUISffiONS ... 115
Avant-propos ... 115
Résumé ... 116
Manuscrit ... 118
Abstract ... 119
Introduction ... 12 I Materials and methods ... 121
Subjects ... 12 I Radiopharmaceutical ... 122 Imaging ... 123 Data analysis ... 123 Biologie samples ... 125 Safety monitoring ... 126 Statistical methods ... 126 Results ... 126 Biodistribution ... 126 Dosimetry ... 133 Safety ... 137 Discussion ... 138 Dosimetry ... 140 Safety ... 140 Conclusion ... 14 I Acknowledgements ... 141 References ... 142 III. DISCUSSIONS ... 145
DÉTERMINATION DEL' ACTIVITÉ SPÉCIFIQUE EFFECTIVE ... 146
SATURATION DES RÉCEPTEURS D'ŒSTROGÈNES ... 148
BIODISTRIBUTION DU 4FMFES ... 150
DOSIMÉTRIE DU 4FMFES ... 152
IV. CONCLUSIONS ... 155
Liste des abréviations
4FMFES ASE PFMOX FDG FES RO RO+ RO-RP RP+ RP-SERM SHBG TDM TEP Z-MIVE4-fluoro-11P-méthoxy-l6a-[18F]fluoro-l 7P-estradiol
ou 4,16a-(16a-[18F])-difluoro-l 1P-méthoxy-l 7P-estradiol
Activité spécifique effective
[ 18F]fluoromoxestrol ['8F]fluorodéoxyglucose
16a-[18F]fluoroestradiol
Récepteur d' œstrogènes
Exprimant des récepteurs d'œstrogènes N'exprimant pas de récepteurs d'œstrogènes Récepteur de progestérone
Exprimant des récepteurs de progestérone N'exprimant pas de récepteurs de progestérone Selective estrogen receptor modulators
Sex hormone-binding globulin Tomodensitométrie
Tomographie par émission de positrons
Résumé
Le 4-fluoro-llP-méthoxy-[
18F]fluoroestradiol ( 4FMFES)
pour l'imagerie des récepteurs d'œstrogènes par tomographie
par émission de positrons
La majorité des cancers du sein surexpriment des récepteurs d'œstrogènes (RO) et/ou de progestérone. Connaître le statut en RO est primordial pour déterminer le meilleur traitement à offrir aux patientes. Ce statut est habituellement déterminé par biopsie, une technique invasive et limitée aux sites accessibles, en plus d'être sujette à l'hétérogénéité de l'expression des RO au sein d'une même lésion tumorale et entre les lésions (lésion primaire et métastases). L'imagerie des RO est une alternative non-invasive pour déterminer in vivo le statut en RO des tumeurs. Parmi les nombreux traceurs des RO radiomarqués développés durant les 3 dernières décennies, le l 6a-['8F]-fluoroestradiol (FES), un traceur pour la tomographie par émission de positrons (TEP), est celui ayant connu le plus de succès. Cependant, il est métabolisé rapidement in vivo, ce qui limite son accumulation optimale au niveau des tumeurs exprimant les RO (RO+).
Parmi une série de nouveaux traceurs des RO, le 4-fluoro-11~-méthoxy-l6a [18F]fluoroestradiol (4FMFES) a démontré des résultats précliniques prometteurs. Comparativement au FES, le 4FMFES à une très faible affinité pour la sex
hormone-binding globulin (SHBG). Certains auteurs ont suggéré qu'une bonne affinité pour la
SHBG est souhaitable en imagerie des RO chez l'humain.
L'activité spécifique effective (ASE), ou la quantité de radioactivité par quantité de masse biologiquement active, est un paramètre important en imagerie des RO, un système saturable. Dans nos expériences de saturation in vivo chez la souris, un effet de masse fut observé au niveau de l'utérus et de tumeurs murines RO+ implantées à partir d'une masse équivalente d'estradiot d'environ 100 pmol. Nous avons développé une méthode simple et efficace pour mesurer de routine l' ASE des traceurs des RO, qui utilise la scintillation par proximité lors d'un essai compétitif de liaison sur des RO purifiés.
Nous avons évalué la biodistribution et la dosimétrie du 4FMFES lors d'une étude de phase I chez dix femmes saines. Après avoir été injecté avec du 4FMFES, chaque participante a subi 4 acquisitions TEP rapides sériées, couplées à 2 acquisitions tomodensitométriques (TOM) à faible dose, durant 2 heures, sur une caméra TEPffDM. Le logiciel OLINDA fut utilisé pour calculer les courbes temps-activité, les temps de résidence et la dosimétrie. L'activité sanguine et plasmatique fut mesurée par des prises de sang sériées. La sûreté du 4FMFES a été évaluée par le monitoring des signes vitaux et de certains paramètres sanguins et urinaires.
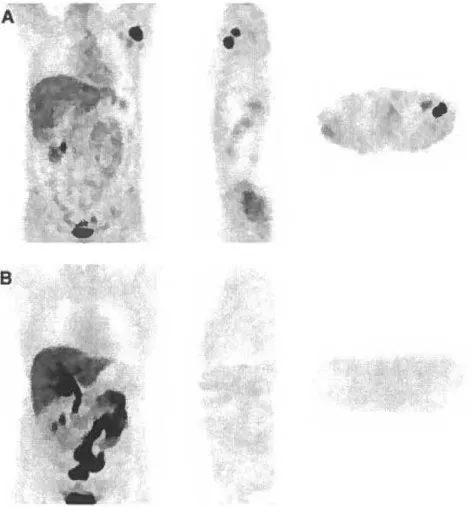
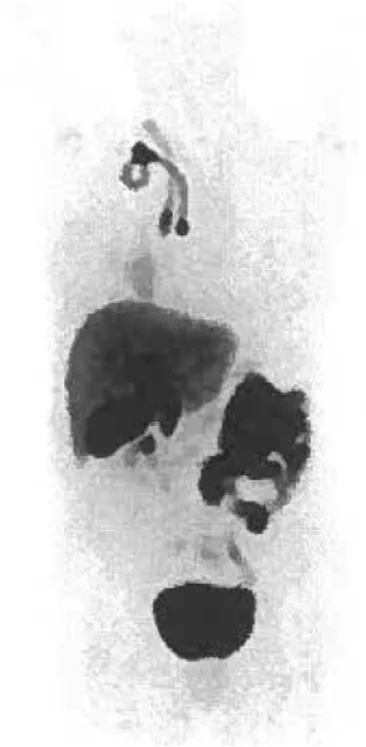
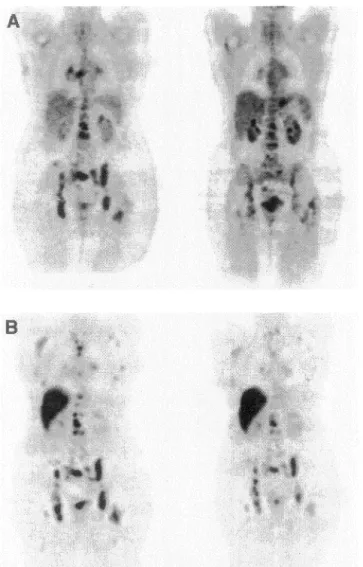
Le 4FMFES fut bien toléré chez toutes les participantes. Le foie a démontré une captation intense, associée à une excrétion hépatobiliaire massive, et relativement peu d'excrétion urinaire. Les demi-vies de clairance de l'activité sanguine et plasmatique, entre 30-150 minutes post-injection, étaient d'environ 110 minutes. La captation
utérine fut visualisée chez toutes les participantes et est demeurée relativement constante en fonction du temps. L'activité de bruit de fond était faible et décroissante en fonction du temps, résultant en un ratio utérus-sur-bruit croissant. L'organe critique fut la vésicule biliaire (0.80 ± 0.51 mGy/MBq), suivie par le côlon proximal, l'intestin grêle et le foie. Pour une dose typique de 185 MBq, la dose effective (DE) fut calculée
à 4.82 ± 0.70 mSv.
·Le 4FMFES est considéré sécuritaire pour usage chez l'humain et sa DE demeure dans des limites acceptables. Le 4FMFES a démontré une captation utérine significative tant chez les participantes préménopausées que ménopausées, qui est probablement médiée par les RO, i.e. spécifique. Aussi, ces résultats suggèrent que la liaison à la SHBG n'est pas nécessaire pour imager les RO in vivo chez l'humain. Une comparaison directe entre le FES et le 4FMFES chez des patientes atteintes du cancer du sein sera nécessaire pour déterminer quel est le traceur optimal pour l'imagerie TEP des RO.
Mots clés: Cancer du sein - Récepteurs d'œstrogènes - Tomographie par émission de positrons - Dosimétrie - Activité spécifique effective
1. Introduction
L'objectif général de mes travaux de recherche dans le cadre de cette maîtrise en radiobiologie était de poursuivre l'étude préclinique d'un nouveau traceur des récepteurs d' œstrogènes (RO) pour la tomographie par émission de positrons (TEP), le
4-fluoro-11~-méthoxy-16a-[18F]fluoroestradiol (4FMFES). Cette molécule, qui a été
développée à l'Université de Sherbrooke dans le laboratoire du professeur Johan E. van Lier, a démontré des résultats prometteurs chez des modèles animaux et a ainsi été sélectionnée pour poursuivre vers des études cliniques. L'une des premières étapes d'un nouveau traceur en médecine nucléaire est l'évaluation de sa biodistribution et sa dosimétrie chez l'humain, ce que nous avons entrepris dans une étude clinique de phase I.
Un objectif secondaire était de développer une nouvelle méthode simple et efficace pour déterminer l'activité spécifique effective (ASE) des productions de traceurs des RO. L' ASE est un paramètre important de contrôle de qualité de ceux-ci. Un autre objectif secondaire, étroitement lié, était de déterminer la limite inférieure d' ASE acceptable afin d'éviter un effet de masse (saturation des RO) chez l'animal.
Ces trois objectifs ont fait l'objet de trois articles de recherche originale présentés dans ce mémoire. De plus, un article de revue portant sur l'imagerie des récepteurs stéroïdiens vient complémenter l'introduction du mémoire.
Cancer du sein
Le cancer du sein est le cancer le plus fréquent chez les femmes canadiennes. Une femme sur neuf en sera atteinte au cours de sa vie. Le cancer du sein est aussi la deuxième cause la plus fréquente de mortalité par cancer chez celles-ci, après le cancer du poumon. Chaque année au Canada, 22400 femmes sont nouvellement diagnostiquées porteuses d'un cancer du sein et 5300 d'entre elles en mourront (2008). L'évènement menant au décès par cancer du sein est le plus souvent l'atteinte métastatique.
L'incidence du cancer du sein augmente avec l'âge. Une histoire familiale et l'exposition aux œstrogènes (par exemple, ménarche précoce ou ménopause tardive) sont d'autres facteurs de risque importants, de même que l'exposition a des carcinogènes spécifiques. Des facteurs diététiques, ou un style de vie sédentaire sont aussi des facteurs de risque reconnus (WOOD et al., 2005).
Le développement et la progression du cancer sont complexes et multifactoriels. Ils impliquent la suppression de l'apoptose et du vieillissement cellulaire, le dérèglement des facteurs de signalement de la prolifération, l'activation d'oncogènes, le dérèglement des facteurs inhibant la croissance et la perte de gènes de suppression tumorale (DICKSON et al., 2005). Comme la plupart des cancers, l'étiologie du cancer du sein comprend des facteurs héréditaires et environnementaux résultant en des mutations génétiques permettant aux cellules tumorales malignes de se multiplier indéfiniment, d'envahir les tissus adjacents et d'essaimer vers d'autres
génétiques ont été identifiées dans le cancer du sein familial, comptant pour environ 5 à 10% des cas de cancers du sein, dont des mutations héréditaires des gènes p53,
BRCAJ et BRAC2 (DICKSON et al., 2005). Le cancer du sein sporadique est aussi lié à
des altérations génétiques. Rarement le résultat d'une altération directe de l'ADN par un agent environnemental comme les radiations, il est plus souvent le résultat d'effets indirects d'une exposition à des espèces réactives de l'oxygène ou aux œstrogènes et divers facteurs de croissance. Une série de mutations génétiques (gènes suppresseurs et proto-oncogènes) sont ainsi responsables du passage du tissu mammaire normal, puis hyperplasique, au carcinome in situ, et finalement au cancer invasif (DICKSON et al., 2005). Les mécanismes de la carcinogenèse mammaire sont encore loin d'être complètement élucidés.
Le cancer du sein invasif se divise en 2 sous-groupes principaux: le carcinome canalaire (65-80%) et le carcinome lobulaire (5-10%). Le carcinome canalaire compte aussi plusieurs autres sous-types histologique (environ 10%) (WOOD et al., 2005). Il est le plus souvent diagnostiqué grâce à une biopsie radioguidée, suite à une mammographie de dépistage suspecte.
Une fois diagnostiqué, l'évaluation de l'étendue du cancer (le staging) comprend
l'évaluation de la tumeur primaire, des ganglions (principalement les ganglions axillaires, supra-claviculaires et mammaires internes) et la présence de métastases à distance (les sites de métastases principaux étant les os, les poumons, le foie et le cerveau). Le stade (I a IV) est ensuite déterminé, selon les critères de l'American Joint Committee on Cancer (AJCC), dépendant son étendue. Le stade IV, le plus avancé, est
un cancer avec métastases à distance. Le stade est une donnée pronostique importante qui, avec les autres données histopathologiques (incluant le statut en récepteurs hormonaux), est très important dans l'élaboration du plan de traitement. En particulier, la présence de ganglions atteints est un facteur de mauvais pronostic qui augmente grandement le risque de métastases à distances occultes. Le volume de la tumeur primaire est le deuxième facteur pronostique en importance. Le grade histologique et l'âge sont 2 autres facteurs de risque indépendants (WOOD et al., 2005). La positivité en récepteurs hormonaux est aussi un facteur de meilleur pronostic chez les patientes avec un cancer métastatique (WOOD et al., 2005).
Le traitement du cancer du sein comprend plusieurs modalités, les principales étant la chirurgie, la radiothérapie, l'hormonothérapie et la chimiothérapie. Le plus souvent, une combinaisons d'au moins 2 modalités sont administrées (WOOD et al., 2005).
Œstrogènes
Les principales hormones stéroïdiennes sexuelles chez la femme sont les œstrogènes et la progestérone. L'estradiot et le principal et le plus puissant des œstrogènes. Il y a aussi l' estrone et l'es triol. Ils sont principalement synthétisés et secrétés par les ovaires durant la période de fertilité (pré-ménopause), sous l'effet d'une stimulation par les hormones hypophysaires. Ils sont responsables de l'expression des caractères sexuels primaires et secondaires féminins. Les variations cycliques de leur sécrétion sont responsables des cycles menstruels et de la fertilité.
Durant la ménopause, la production ovarienne diminue fortement, mais l'aromatisation périphérique des androgènes produits par les surrénales fournit une source non négligeable d'œstrogènes.
Les œstrogènes, tel que mentionné plus tôt, jouent un rôle important dans la carcinogenèse et dans l'évolution du cancer du sein. Il n'est donc pas surprenant que leurs récepteurs soient une cible thérapeutique de choix.
Récepteurs d'œstrogènes
Les récepteurs d'œstrogènes (RO) et les récepteurs de progestérone (RP) sont des protéines dimériques régulant la transcription de gènes cibles. Ils sont membres d'une superfamille de récepteurs nucléaires (DICKSON et al., 2005). Il existe deux sous-types de RO: a et ~- Divers organes expriment physiologiquement un ou les deux sous-types selon divers ratios. Par exemple, le tissu mammaire normal exprime les ROa et RO~, avec une prédominance de RO~. Cependant, dans le cas du cancer du sein exprimant ou surexprimant les RO (RO+ ), c'est le sous-type a qui prédomine, ce qui en fait une cible thérapeutique de choix.
Une discussion plus approfondie sur la biologie des RO fait l'objet d'une section du premier article présenté (Molecular biology of the estrogen and
Rôle des récepteurs d'œstrogènes dans le cancer du sein
Les œstrogènes jouent un rôle important dans la carcinogénèse du cancer du sein. Par exemple, les œstrogènes induisent la transcription de molécules anti-apoptotiques (Bcl-2 et Bel-X) (DICKSON et al., 2005). Les RO sont surexprimés (RO+) dans 60 à 80 % des cancers du sein (OSBORNE, 1998). Par ailleurs, l'expression des PR est étroitement reliée à la présence de RO car elle est induite par les œstrogènes (HENRY et al., 1989). La concentration cellulaire des RO et des RP est déterminée de routine 'sur les spécimens de biopsie des tumeurs mammaires, par immunohistochimie.
Il est généralement reconnu que le statut en RO a une certaine valeur pronostique. Les tumeurs RO+ ont tendance à être mieux différenciées (plus bas grade), à avoir un taux de croissance plus faible, et à métastasier aux os plutôt qu'au cerveau ou au foie, en comparaison avec les tumeurs RO-. Dans les premières années après le traitement primaire, le taux de rechute est moindre pour les tumeurs RO+. Cependant, le statut en RO n'est pas relié au potentiel métastatique (OSBORNE, 1998).
Le statut en récepteurs stéroïdiens (RO et en RP) est le plus important facteur prédictif de réponse a l'hormonothérapie. Environ 60 % des cancers du sein RO+ répondent a l'hormonothérapie, contre 5 à 10 % des cancers RO-. Comme les RP sont régulés par la présence de RO, les cas de cancers su sein RO-/RP+ sont peu fréquents (<5 %). Cependant, ceux-ci ont un meilleur taux de réponse à l'hormonothérapie que
sein est moindre (meilleur pronostic) non seulement pour les patientes avec une tumeur RO+/PR+, mais aussi RO-/PR+ (DICKSON et al., 2005).
La non-réponse ou la désensibilisation à l'hormonothérapie peut être le résultat de plusieurs facteurs. Par exemple, certaines isoformes des RO sont continuellement actives, sans nécessiter de liaison aux œstrogènes. Également, la cellule peut devenir hypersensible à l'effet œstrogénique faible du tamoxitène. L'aromatase peut aussi jouer un rôle (DICKSON et al., 2005). Chez les patientes qui ont eu initialement un cancer RO+/RP+, il est préférable de confirmer par biopsie une lésion récurrente afin de déterminer si la patiente pourrait bénéficier d'hormonothérapie (WOOD et al., 2005).
L'expression des RO et des RP par les cancers du sein est hétérogène. En effet, il se peut que l'expression de ces récepteurs varie entre les cellules d'une même tumeur, ou entre les lésions entre elles, comme par exemple entre la lésion primaire et ses métastases, ou entre les métastases (FISHER et al., 2008).
L'agent d'hormonothérapie le plus souvent administré était le tamoxitène, un membre de la famille des SERM (selective estrogen receptor modulators), qui est l'agent ayant démontré la plus grande efficacité chez les patientes avec une tumeur RO+ et/ou RP+. Le tamoxitène, lorsque donné en traitement adjuvant chez ces patientes, réduit le risque annuel de rechute (35%) et de mortalité ( 40% ). Le raloxitène, un autre SERM, est rarement utilisé lorsqu'il y a résistance au tamoxitène. Les inhibiteurs de l'aromatase sont généralement utilisés comme traitement hormonal de deuxième ligne, en changeant de classe au besoin (entre stéroïdiens et non stéroïdiens) (WOOD et al., 2005).
Imagerie moléculaire
La médecine nucléaire est une spécialité d'imagerie médicale dite fonctionnelle, car elle permet l'imagerie d'une multitude de phénomènes biochimiques, métaboliques ou mécaniques, dans des conditions physiologiques ou pathologiques. Lorsque le phénomène étudié est au niveau cellulaire, on emploie souvent le terme « imagerie
moléculaire». De façon générale, la médecine nucléaire emploie des radiopharmaceutiques, c'est-à-dire des molécules ayant certaines propriétés pharmacologiques reliées au phénomène à étudier, contenant un atome radioactif. C'est la radiation émise par ce dernier qui, lorsque détectée par un équipement spécialisé (caméra), permettra la génération d'images représentant le phénomène étudié. La plupart des procédures diagnostiques en médecine nucléaire impliquent l'injection intraveineuse d'un radiopharmaceutique suivie plus ou moins longtemps après d'une ou plusieurs séances d'imagerie à l'aide d'une caméra spécialisée.
Les radiopharmaceutiques sont utilisés le plus souvent en quantités trace pour des fins diagnostiques. Le terme traceur sera employé des le présent texte pour désigner un radiopharmaceutique utilisé à des fins diagnostiques. À haute dose, certains radiopharmaceutiques peuvent être utilisés à des fins thérapeutiques, pour traiter des tumeurs (le plus souvent malignes), ou des organes dysfonctionnels.
Deux principales technologies existent en médecine nucléaire. Tout d'abord, la scintigraphie monophotonique emploie une caméra gamma pour détecter les radiations (photons) émises. Cette caméra est généralement conçue et configurée pour détecter les
une infime fraction de tous les photons émis par la dose de radiopharmaceutique administrée sont ainsi détectés et contribuent à l'image, appelée scintigraphie. Celle-ci est bidimensionnelle (planaire), mais l'équipement moderne permet aussi la reconstruction tridimensionnelle d'images tomographiques à partir d'une série de projection planaires angulaires. Les atomes émettant des photons d'une énergie d'environ 100 - 400 keV sont les mieux adaptés à cette technologie (THRALL et al., 2001). Un exemple de procédure de médecine nucléaire couramment utilisée en cancer du sein est la scintigraphie osseuse, où on injecte à la patiente un diphosphonate radiomarqué au technétium-99m, ce qui permet de détecter les métastases osseuses qui causent des anomalies du métabolisme osseux.
Vers la fin des années 1970, une nouvelle technique d'imagerie a été développée : la tomographie par émission de positrons (TEP). Cette dernière nécessite des traceurs radiomarqués avec des atomes émetteurs de positrons. Le positron, une fois émis, s'annihile presqu'immédiatement avec un électron dans la matière, ce qui génère deux photons de 511 ke V voyageant en directions opposées. La géométrie cylindrique du détecteur de la caméra TEP permet de détecter ces deux photons simultanément. La compilation de tous les événements détectés durant l'acquisition permet de reconstruire une image tridimensionnelle (tomographique) de la distribution du radiopharmaceutique dans le corps. La TEP présente plusieurs avantages sur la scintigraphie monophotonique (tant planaire que tomographique), dont une plus grande sensibilité, une meilleure résolution et la capacité de quantifier précisément l'accumulation du radiopharmaceutique dans une région donnée (CHERRY et al.,
2003). La vaste majorité des caméras TEP contemporaines sont des caméras hybrides combinant la caméra TEP à une caméra de tomodensitométrie (TDM), ce qui permet d'obtenir des images tomographiques anatomiques qu'on peut superposer aux images fonctionnelles afin de localiser avec une grande précision les anomalies de signal TEP.
Le traceur le plus couramment employé en TEP est un analogue du glucose, le 18
F-fluorodéoxyglucose (FDG). Il permet de détecter et caractériser les tumeurs présentant un métabolisme glucosé augmenté (surexpression des transporteurs de glucose membranaires). La TEP-FDG a un rôle potentiel dans l'évaluation du cancer du sein avancé ou récidivant, et dans l'évaluation de la réponse thérapeutique (BENARD et al., 2005).
Traceurs pour l'imagerie des récepteurs d'œstrogènes
Parmi les principales limitations de la détermination du statut en RO et RP par biopsie, il y a l'hétérogénéité de l'expression des RO et des RP entre les lésions métastatiques, l'impossibilité de biopsier toutes les lésions et l'inaccessibilité de certaines lésions métastatiques. Ces limitations sont encore plus fréquentes dans le cancer du sein récidivant. C'est pourquoi l'imagerie des RO est très attrayante pour surmonter ces limitations. Au cours des trois dernières décennies, de nombreux traceurs des RO ont été développés pour la médecine nucléaire, tant pour la scintigraphie monophotonique que pour la TEP. Certains d'entre eux sont discutés dans la présente section. Ceux-ci sont illustrés à la figure 1 de l'article 1 (page 39) et leurs principaux paramètres sont résumés dans le tableau 1 de l'article 1 (page 48).
Le 16a-iodoestradiol fut l'un des premiers composés d'intérêt pour l'imagerie des RO par scintigraphie monophotonique, à cause de la possibilité de le radio-marquer
à l'aide d'iode-123 ou d'iode-131. Une étude chez 21 patientes a montré des résultats encourageants: la scintigraphie au 16a-[123I]iodoestradiol était positive chez 7 des 9 patientes avec tumeurs de cancer du sein RO+ (SCHOBER et al., 1990). Le résultats avec le 16a-[131I]iodoestradiol furent plus décevants à cause des moins bonnes propriétés physiques de l'iode-131 pour l'imagerie. Aussi, le 16a-[131I]iodoestradiol a démontré un métabolisme rapide chez l'humain, causant la présence de radiométabolites circulants (SYMES et al., 1985). Ceci est également une limitation potentielle du 16a-[123I]iodoestradiol.
Le 11 ~-méthoxy-(17a,20E/Z)-[125I]iodoestradiol a été synthétisé à l'Université de Sherbrooke par l'équipe du Dr van Lier (ALI et al., 1991). Le groupe de Rijks et al. a étudié l'isomère 20Z, marqué à l'iode-123 (l l~-méthoxy-(17a,20Z) [123I]iodoestradiol; Z-MIVE) chez 25 patientes atteintes de cancer du sein et a trouvé une bonne concordance entre les résultats de la tomographie monophotonique et le statut en RO, tant au niveau des tumeurs primaires (concordance = 90%) que des récidives et métastases (concordance
=
82%) (RIJKS et al., 1997). L'équipe de Sherbrooke a aussi obtenu de bons résultats (concordance=
80%) en employant la technique de scintimammographie avec le Z-MIVE pour évaluer les tumeurs primaires (NACHAR et al., 2000). Le Z-MIVE a le potentiel de prédire la réponse àl'hormonothérapie en démontrant le blocage le des RO à un mois après le début de l'hormonothérapie (BENNINK et al., 2004).
L'iodoestradiol et surtout le Z-MIVE furent les traceurs monophotoniques des RO les plus étudiés chez l'humain. De nombreux autres traceurs des RO pour la scintigraphie monophotonique ont aussi vu le jour, mais parmi ceux étudiés chez l'humain, aucun ne fut aussi prometteur que le Z-MIVE. Certains autres de ces traceurs sont présentés plus en détail dans l'article 1 (Radioligandfor steroid receptor imaging,
page 40).
Parmi les traceurs des RO pour la TEP (i.e. radiomarqués avec un émetteur de positron), le 16a-['8F]-fluoroestradiol (FES) est celui ayant connu le plus de succès à
ce jour. Mintun et al. ont été les premiers à rapporter son utilisation chez l'humain (MINTUN et al., 1988). Ils ont trouvé une bonne corrélation entre la captation de FES et la concentration de RO mesurés in vitro (r
=
0,96) chez 13 femmes évaluées pour masse mammaire suspecte (12/13 masses étaient malignes), en plus de détecter plusieurs métastases axillaires et une métastase à distance. Le même groupe a aussi obtenu des résultats encourageants chez 16 patientes avec cancer du sein métastatique (TEP-FES positive chez 14/16 patientes et dans 53/57 lésions) (MCGUIRE et al., 1991). La captation du FES a diminué significativement après l'initiation de l'hormonothérapie chez ces patientes, confirmant la spécificité de la captation du FES. D'autres ont confirmé la bonne corrélation entre la captation de FES et la mesure in vitro de la concentration de RO (PETERSON et al., 2008). Mortimer et al. ont démontré à nouveau la possibilité d'évaluer l'occupation des RO par l'agent d'hormonothérapie (diminution de la captation de FES suite à l'initiation du traitement) (MORTIMER et al., 2001). Enfin, d'autres ont mis en évidence que lacaptation de FES prétraitement prédisait la réponse à l'hormonothérapie (LINDEN et al., 2006).
À l'instar de l'iodoestradiol, le FES a démontré un métabolisme rapide et l'apparition de métabolites conjugués radiomarqués circulants chez l'animal (MATHIAS et al., 1987) et chez l'humain (MANKOFF et al., 1997). Ces radiométabolites ne se lient pas aux RO et contribuent à augmenter l'activité de fond (bruit). Il est donc probable que ceci limite la captation maximale atteignable in vivo dans les tumeurs RO+.
Le l 7a-ethynyl-11P-méthoxy-l6p-[18F]fluoroestradiol
06P-[18F]fluoromoxestrol; PFMOX) fut le traceur le plus prometteur d'une série de
nouveaux dérivés de l'estradiol fluorés (V ANBROCKLIN et al., 1993; V ANBROCKLIN et al., 1993). Il a une très bonne affinité de liaison relative au RO in vitro, une haute captation utérine et un ratio utérus/sang élevé. Par ailleurs, le PFMOX a une très faible affinité de liaison à la sex hormone-binding globulin (SHBG; voir
prochaine section). Les caractéristiques améliorées du PFMOX comparativement au FES, attribuable à sa plus grande stabilité métabolique, ont motivé l'étude de ce traceur chez l'humain. Sur 12 femmes ayant une masse au sein, seulement 3 d'entre elles furent diagnostiquées porteuses d'une tumeur maligne RO+. Le TEP-PFMOX fut négative chez deux de ces dernières, et équivoque (probablement négative) chez Ïa troisième (JONSON et al., 1999).
Une série d'autres dérivés fluorés de l'estradiol ont été synthétisés à l'Université de Sherbrooke par l'équipe du Dr van Lier, dans l'espoir d'améliorer la stabilité
métabolique du FES. Il s'agit des dérivés 2-fluoro et 4-fluoro du FES, avec ou sans groupe méthoxy en position 11
p
(SEIMBILLE et al., 2002). Le plus prometteur de ceux-ci fut le 4-fluoro-l 1P-méthoxy-16a-[18F]fluoro-17P-estradiol (ou 4,16a-(16a-[18F])-difluoro-l l P-méthoxy- l 7P-estradiol; 4FMFES). Malgré une affinité quatre fois moindre du 4FMFES pour les RO (ROa isolés et cellules MCF7) comparativement au FES, le 4FMFES a montré la plus haute captation utérine et les ratios utérus/sang et utérus/non-cible les plus élevés à une heure post-injection (SEIMBILLE et al., 2002). Une meilleure sélectivité de liaison, une plus grande facilité à traverser les membranes cellulaires et un métabolisme enzymatique limité peuvent expliquer les meilleures propriétés du 4FMFES. Ce traceur a été sélectionné pour poursuivre son évaluation chez l'humain. Une étude clinique de phase I chez des femmes saines fait l'objet de l'article 4 (page 115).D'autres traceurs des RO pour la TEP sont présentés dans l'article 1
(Radiologands for steroid receptor imaging, page 40). Aucun d'eux n'a été autant
étudié et utilisé que le FES, qui demeure le traceur des RO de choix à ce jour. Considérant les avantages de la TEP sur la scintigraphie monophotonique, le FES est aussi préféré au Z-MIVE malgré les résultats prometteurs de ce dernier.
Rôle de la sex hormone-binding globulin
Suite à leur synthèse et leur relâche, les œstrogènes et la progestérone sont acheminés à leurs organes cible par le sang. Étant lipophiles, ils diffusent à travers la membrane cellulaire pour se rendre aux noyaux, où se trouves leurs récepteurs
(SHBG), une glycoprotéine plasmatique synthétisée par le foie, et aussi à l'albumine.
Le rôle de la SHBG dans le transport et le métabolisme des stéroïdes n'est pas encore bien connu. Elle permettrait de solubiliser ces stéroïdes et de les protéger contre leur métabolisme (TAIT et al., 1991). D'autre part, elle pourrait aussi réguler la biodisponibilité de ces stéroïdes, puisque seule la fraction non liée est généralement considérée disponible pour sa diffusion dans la cellule (SIITERI et al., 1982). Finalement, la découverte d'un récepteur membranaire de SHBG (HRYB et al., 1990) dont la fonction n'est pas encore élucidée complexifie davantage le rôle potentiel de la SHBG, particulièrement en ce qui concerne les traceurs des RO. Une section de l'article 1 est consacrée au transport des stéroïdes (Transport and delivery of steroid hormones in plasma, page 29).
Comme la SHBG semble jouer un certain rôle dans le transport et la protection contre le métabolisme des stéroïdes chez l'humain, et que la SHBG n'est pas exprimée chez le rongeur, il est possible que la biodistribution d'une même molécule stéroïdienne soit différente entre ces espèces à cause, entre autres, de son affinité pour la SHBG. D'ailleurs, certains auteurs ont attribué l'insuccès du PFMOX à sa faible affinité de liaison à la SHBG (JONSON et al., 1999). Ils ont comparé le taux de métabolisme du PFMOX avec celui du FES chez le rat, le primate et des hépatocytes humains (de femme) isolés et leurs résultats supportaient l'hypothèse d'un effet protecteur de la SHBG (JONSON et al., 1999). Cependant, les activités spécifiques rapportées étaient basses dans deux de ces trois cas, ce qui pourrait aussi avoir contribué aux résultats décevants (voir prochaine section sur l'activité spécifique
effective). Malgré ceci et le très petit nombre de cas étudiés, ces auteurs ont émis l'hypothèse que l'affinité pour la SHBG était une propriété importante imager les RO in vivo chez l'humain.
Cependant, comme le rôle de la SHBG n'est pas encore totalement élucidé, il
est difficile de prédire l'impact de la faible affinité du 4FMFES pour cette protéine, lors de l'éventuelle étude de ce traceur chez l'humain. Une étude de biodistribution chez l'humain peut aider à évaluer ceci. Chez la femme saine, l'organe cible est, en l'absence de tumeur RO+, l'utérus. Un des objectifs de l'article 4 fut d'évaluer la capacité du 4FMFES à imager les RO chez l'humain.
Activité spécifique effective
L'activité spécifique d'un radiopharmaceutique est l'activité (nombre de désintégrations par unité de temps) par unité de masse (poids ou quantité de molécules). Lorsqu'il n'y a aucune molécule porteuse (molécule identique mais non radioactive, comme par exemple une molécule identique au traceur marquée d'un fluor-19 au lieu d'un fluor-18), l'activité spécifique est maximale, et égale à l'activité spécifique de l'isotope radioactif (par exemple, celle du fluor-18 est 63360 GBq/µmol) dans le cas où la molécule est marquée d'un seul atome radioactif. Pour les traceurs des RO, l'activité spécifique est typiquement calculée en faisant le ratio de l'activité d'une production donnée de traceur sur la masse de cette production estimée par absorbance des rayons ultraviolets. Cette dernière mesure est cependant peu précise pour mesurer des quantités trace de composés.
D'autre part, il est possible que des composés non radiomarqués autres que la molécule porteuse, mais ayant une certaine affinité pour les RO, viennent contaminer la solution finale du traceur des RO. Ces composés, si présents en trop grande quantité, peuvent résulter en une saturation des sites spécifiques de liaisons (les RO) et ainsi résulter en une diminution de la captation spécifique du traceur. Ceci se traduit alors par une sous-estimation de la concentration des RO au sein d'une tumeur, ou encore à
sa non détection si la captation est abaissée à un point tel qu'elle ne dépasse pas l'activité de fond (bruit) des tissus environnants.
Le concept d'activité spécifique effective (ASE) a été évoqué pour la première fois par Katzenellenbogen (KATZENELLENBOGEN et al., 1982). Il s'agit de l'activité (désintégrations par unité de temps) par quantité d'activité biologique (exprimée en quantité d'un ligand de référence). Par exemple, pour les traceurs des RO, l'ASE est exprimée en activité par quantité d'estradiol. Par exemple, pour une production donnée d'un traceur des RO, une ASE de 100 GBq/µmol reviendrait à dire que 100 GBq de cette production, au temps où l' ASE a été calculée (en effet, l' ASE décroît avec même constante que l'activité), est équivalent à une rnicromole d' estradiol, en termes de capacité de liaison aux RO. L' ASE est estimée in vitro par essai de liaison compétitif sur les RO. Cette procédure implique une séparation du compétiteur radiomarqué (dans ce cas, de l'estradiol tritié) lié aux RO de la fraction libre. Ceci se fait habituellement par adsorption, lavage ou filtration. Une méthode plus simple et plus rapide serait souhaitable pour effectuer de routine la mesure de l' ASE. Ceci fait l'objet du deuxième article présenté dans ce mémoire (page 72).
Une ASE minimale de 37 GBq/µmol (1000 Ci/mmol) est souvent citée comme l' ASE minimale pour l'imagerie des RO dans le cancer du sein chez l'humain. Katzenellenbogen (KA TZENELLENBOGEN et al., 1982) a estimé de 1667 à 16667 Ci/mmol (62-617 GBq/µmol) l' ASE minimale d'un traceur des RO pour obtenir une concentration de 1 µCi/g dans la tumeur (avec un taux d'occupation des RO de 20%), ce qui est souhaitable pour l'imagerie.
Contrairement à la définition stricte de l'activité spécifique, l' ASE tient compte de tout contaminant non radiomarqué qui a une affinité pour les RO. Effectivement, tout composé ayant une affinité pour les RO contenu dans la solution finale du traceur, i.e. co-injecté avec le traceur, est susceptible de déplacer le traceur de sa cible, les RO. L'inverse de l' ASE est la quantité totale d'activité œstrogénique de la solution de traceur par unité de radioactivité. En multipliant par la dose injectée, on obtient la quantité d'activité œstrogénique injectée, exprimée en quantité équivalente d'estradiol. La quantité équivalente d' estradiol exacte à partir de laquelle une saturation est observée in vivo n'est pas connue. Ceci est l'un des objectifs de l'article 3 (page 90).
Dosimétrie
L'absorption d'énergie déposée par les radiations peut causer des dommages aux tissus sains. L'utilisation de radiopharmaceutiques à des fins diagnostiques chez l'humain résulte inévitablement en l'absorption par les tissus d'une partie des radiations émises par l'atome radioactif au sein du radiopharmaceutique. Le risque relié aux procédures diagnostiques demeure faible (HALL et al., 2006).
L'énergie absorbée par chaque organe dépendra en grande partie de la distribution du radiopharmaceutique dans le corps en fonction du temps, de son élimination biologique (voies et constantes d'élimination) et de la décroissance physique de l'atome radioactif en question. La dosimétrie interne est l'estimation de la dose de radiation absorbée pour chacun des principaux organes (CHERRY et al., 2003). La méthode MIRD (Medical Internai Radiation Dose) est une méthode bien
établie pour le calcul de la dosimétrie interne des radiopharmaceutiques, et il existe un code informatique, OLINDA (Université Vanderbilt, États-Unis) permettant de l'appliquer facilement, avec un choix de plusieurs modèles et options (STABIN et al., 2003).
Lorsqu'un nouveau radiopharmaceutique est utilisé chez l'humain, il est d'usage d'effectuer une étude de dosimétrie. Cette estimation peut se faire chez l'animal, et être extrapolée à l'humain. Cependant, il peut exister des différences de cinétique et de métabolisme du traceur entre les espèces qui résultent en une biodistribution substantiellement différente et, par conséquent, une dosimétrie différente, entre les espèces.
La dose effective est une dose absorbée au corps entier qui comporterait le même risque global que la dose non uniforme reçue suite à l'administration d'un radiopharmaceutique (CHERRY et al., 2003). Cette valeur est donc une estimation du risque global relié à l'injection d'un radiopharmaceutique lors d'une procédure diagnostique en médecine nucléaire, et qui peut être comparée à celle d'autres procédures diagnostiques.
Mankoff et al. ont publié les données de dosimétrie humaines pour le FES (MANKOFF et al., 2001). La dosimétrie du 4FMFES est présentée dans l'article 4 (page 115) et comparée à celle du FES.
Il. Articles
Article 1 : Steroid Receptor /maging in Breast Cancer
Avant-propos
Référence:
Type d'article :
Statut:
Rédaction:
Jean-Mathieu Beauregard, Éric Turcotte, François Bénard
(2006). "Steroid Receptor Imaging in Breast Cancer." PET Clinics of North America; 1(1):51-70.
Article de revue
Publié
50% de l'article
Sections:
• Molecular biology of the estrogen and progesterone receptors
• Transport and delivery of steroid hormones in plasma • Radioligands for steroid receptor imaging
Figures : 1 et 2 Tableau: 1
Résumé
Une grande proportion des cancers du sein expriment des récepteurs d' œstrogènes et de progestérone. Cette information guide les oncologistes sur la pertinence de l'hormonothérapie pour le cancer du sein. Avec les agents d'hormonothérapie de deuxième ligne tels que les inhibiteurs de l'aromatase et les antagonistes purs, les méthodes d'imagerie pourraient éventuellement jouer un rôle critique dans l'évaluation de la présence des récepteurs d'œstrogènes ou de progestérone. Plusieurs radiopharmaceutiques ont été développés pour l'imagerie des récepteurs d'œstrogènes ou de progestérone. L'imagerie des récepteurs d'œstrogènes pourrait être utile dans la prédiction de la réponse du cancer du sein à
l'hormonothérapie. Des études à grande échelle détermineront les rôles respectifs du tamoxifène, des inhibiteurs de l' aromatase, et du fulvestrant, ainsi que la séquence optimale d'administration de ces médicaments. L'identification précoce et non-invasive des patients qui seront susceptibles d'échouer à toute forme d'hormonothérapie pourrait être réalisée par la tomographie par émission de positrons.
Manuscrit
Steroid receptor imaging in breast cancer
Authors: Jean-Mathieu Beauregard, M.D., Éric Turcotte, M.D., François Bénard,
M.D.
Institution: Metabolic and Functional Imaging Center
Clinical research Center, Centre hospitalier universitaire de Sherbrooke
Corresponding author:
François Bénard, MD
Metabolic and Functional Imaging Center
Clinicalresearch Center, Centre hospitalier universitaire de Sherbrooke 3001, 12th Ave N.
Sherbrooke, QC, JlH 5N4 Canada
Tel. (819) 346-1110 ext. 11865 Fax. (819) 829-3238
'SUMMARY
A high proportion of breast cancers express estrogen and progesterone receptors. The presence of these receptors bas critical value to guide oncologists on the suitability of hormonal therapy as adjuvant or systernic therapy for newly diagnosed or recurrent breast cancer. With the development of second-line hormonal therapy agents such as aromatase inhibitors and pure antagonists, imaging methods could play a critical role to assess the presence of estrogen or progesterone receptors in recurrent or metastatic breast cancer. Several radiopharmaceuticals were developed for SPECT and PET imaging of estrogen or progesterone receptors. 18F-Fluoroestradiol uptake bas
been shown to correlate well with in vitro receptor density estimates, and new fluorinated analogs are still under development. Sorne studies suggest that estrogen receptor imaging could play a useful role in predicting the response of breast cancer to hormone therapy. With large scale trials underway to determine the respective roles of tamoxifen, aromatase inhibitors and fulvestrant, the optimal sequence of drug administration is still debated. While there are currently no indications for estrogen receptor imaging in primary breast cancers, the early non-invasive identification of patients who are likely to fail all forms of hormonal therapy could be achieved by positron emission tomography.
INTRODUCTION
Many breast cancers express high levels of estrogen (ER) and/or progesterone receptors (PR), which have both been linked with the pathogenesis of this disease. Estrogen acts as a stimulant on the growth of ER-positive breast tumors, and the reduction of this stimulatory effect remains the key strategy in the treatment of ER and/or PR positive breast cancers, either by reducing estrogen production or by antagonizing the eff ects of estrogens on the ER.
Hormone therapy bas shown promise in the prevention of breast cancer, and is routinely used as an adjuvant treatment to complement surgery and radiation therapy in the treatment of primary breast cancer. About 50 to 60% [l] patients will respond to hormone therapy. Tamoxifen, a partial estrogen antagonist, remains the most widely used pharmacological agent in routine clinical use, but aromatase inhibitors and pure anti-estrogens are increasingly being used as first or second line agents. As these drugs are relatively well tolerated by patients, with low toxicity compared to most chemotherapy regimen, hormone therapy is recommended to all post-menopausal women with ER or PR positive breast cancer.
Since ER and PR are overexpressed in 60-80% of breast cancers, these proteins were identified many years ago as excellent targets for imaging breast cancer with radiopharmaceuticals. There have been several efforts undertaken over the past 25 years to identify suitable agents for imaging ER or PR expression in breast cancers, with the goal of providing non invasive characterization of breast cancers to guide hormone therapy. Sorne highly effective ligands have been identified and well
characterized but ER imaging is still not yet used as a routine clinical procedure due to the limited number of available clinical trials.
MOLECULAR BIOLOGV OF THE ESTROGEN AND PROGESTERONE RECEPTORS
Estrogen receptors (ER) are nuclear proteins, members of the nuclear superfamily of transcription factors that mediate cell response to estrogens (or anti-estrogens) by the regulation of the synthesis of specific RNAs and proteins [2]. Estrogens regulate, via ER, the development and fonction of the reproductive system, and also affect many other organs. ER was first identified in rat uterus in 1966 [3]. In 1986, the human ER was cloned and sequenced from MCF-7 human cancer cells [4]. This ER is now known as ERa since the discovery of a second ER subtype, named ERP in 1996 [5].
ERa is 595 amino acids long (66 kDa), while ERP is 530 amino acids long. Other isoforms of both ER subtypes have been described [6, 7]. ERa and ERP have the same structure, composed of six fonctional domains that are responsible for specific fonctions. The AIB domain is the least conserved between ERa and ERp, and only ERa AIB domain contains the activation fonction 1 (AFl). The C domain, or DNA binding domain (DBD) is the most conserved between the two subtypes, suggesting they internet with the same genes. D domain is called "hinge region" and contains the nuclear localization signal. E/F domain (ligand binding domain, LBD) contains AF2, which is found in both ER subtypes [2, 6].
ER
a
and j3 have slightly different affinities for their natural endogenous or exogenous ligands. Affinity is often expressed as relative binding affinity (RBA), which is 100 times the ratio between the quantities of the reference ligand ( e.g. estradiol in the case of ER) and the tested ligand needed to displace 50% of the activity of radioactive reference ligand (e.g. tritiated estradiol) in a competitive binding assay on ER (either isolated receptors, cell extracts or cell culture). The estradiol RBA is, by default, 100 for both ER subtypes. The potency of different ER ligands will depend, in part, on their RBA.The binding of a ligand to the LBD of ER causes dissociation of protection proteins (called heat shock proteins) from ER, dimerization and conformational change of ER, resulting in increased affinity of its DBD for the estrogen response elements (ERE). ERE are short DNA sequences located in the promoter region on genes, near the transcriptional sequence, that enhance the transcriptional potential of a gene [2]. This is not sufficient to activate transcription, which is the role of activation fonctions AFl and AF2. The activity of each AF is dependent on the target gene promoter context, cellular environment and ligand [2, 8]. ER DNA binding affinity and transcriptional activation are also modulated by the state of phosphorylation of ER, which is influenced by ligand binding [2].
Ligands can be classified as pure agonists, (e.g. estradiol), pure antagonists (e.g. fulvestrant) or mixed agonist-antagonists, also called selective ER modulators, or SERMs (e.g. tamoxifen or raloxifene). Pure agonist and antagonist ligands activate or block (via conformational change in ER) both AFl and AF2, whereas SERMs have
different effects on each AF. The ability of a ligand to initiate or block gene transcription in a specific cell type depends on the dominance of ERa versus ER~ and AFl versus AF2. Initiation of transcription is much more complex, as it involves the interaction of many proteins that act as coregulators (general transcription factors, coactivators, corepressors, cointegrators, histone acetyltransferases, and histone deacetylases), further refining this process and making it even more cell-specific [8]. The complete review of these coregulators is beyond the scope of the present article. Moreover, other nonclassical pathways of gene regulation by ER (at different DNA sites and with other coactivators) and nongenomic ER actions (involving membrane ER outside the nucleus) are studied and these could provide some explanations in drug resistance mechanisms, particularly in the case of SERMs [9].
Both ER subtypes are found in brain, cardiovascular system, urogenital tract and bone, in various ratios. ERa predominates in the liver, white ER~ is the main ER subtype in the colon [2, 6]. In normal breast tissue, both ERa and ER~ are expressed, but ER~ predominates. In premalignant lesions, however, there is an increase in ERa, which promotes cell proliferation under estrogen stimulation, and a decrease in ER~ expression, which is associated with lower proliferation and pathological grade, and thought to down regulate ERa, acting as a tumor suppressor [7, 8, 10]. Thus, ERa is the therapeutic target of choice in breast cancer. ERa is routinely dosed in vitro by immunohistochemistry on breast cancer biopsy specimens for treatment planning, as will be discussed later. The clinicat value of ER~, however, is not established [7, 10].
Progesterone receptors (PR) are, like ER, members of the nuclear receptor superfamily. Like ER, they are ligand-activated nuclear proteins that regulate expression of specific subset of genes [8, 11]. PR are found in the uterus and many other organs including the brain. One of the main roles of progesterone is to prepare the uterus for pregnancy. Two isoforms of PR are known: PRA and PRB. They are encoded by the same gene. PRB is a longer version of PRA containing 164 additional amino acids. Both subtypes are normally found in the normal breast [8]. In malignant transformation, there is an alteration of the PRA:PRB ratio, and both PRA and PRB dominance have been reported [8, 11, 12]. Loss of PR expression in breast cancer is associated with more aggressive tumors and worse prognosis [8].
TRANSPORT AND DELIVERY OF STEROID HORMONES IN PLASMA
In women, progestins (progesterone and 17-hydroxy-progesterone) and estrogens ( estrone, estradiol-17~ and estriol) are synthesized from cholesterol, mainly by the ovaries and, during pregnancy, by the placenta. These hormones, as other steroids, are delivered to target organs by the blood. Because they are lipophilic, they enter the cell and reach the nucleus by passive diffusion. In blood, they are bound to plasma proteins, mainly albumin and sex hormone-binding globulin (SHBG). Sex steroids bind with low affinity to albumin. Nevertheless, this non specific binding is significant because of the high concentration of albumin in plasma.
Like albumin, SHBG is synthesized mostly by the liver. This glycoprotein plays a role in the transport of sex steroids in plasma by allowing solubilization of these lipophilic hormones and by protecting them against metabolic inactivation [13]. SHBG
might also regulate the bioavailability of sex steroids because only the free (unbound) fraction is generally considered available for cellular uptake [14].
More recently, a cell membrane SHBG receptor bas been discovered. This receptor is thought to participate in the delivery of estrogens into cells. Two mechanisms have been proposed: (1) the steroid-SHBG complex binds to the SHBG receptor and then the steroid enters the cell [15], or (2) SHBG binds toits receptor and then the free estrogen binds to the SHBG-receptor complex [16]. Thereafter, either the estrogen diffuses passively inside the cell to reach ER in the nucleus, as mentioned above or, alternatively, the estrogen-SHBG-receptor complex is internalized. It is still not clear how SHBG influences the delivery of steroids to their receptors. It is currently difficult to ascertain whether the affinity of estrogens and progestins for SHBG influences their biodistribution in human. SHBG is not expressed in small rodents used for pre-clinical biodistribution studies of radiolabeled estrogens. As it will be discussed later, this limits the extrapolation of results from animal studies to humans.
PROGNOSTIC VALUE OF ER AND PR EXPRESSION IN BREAST CANCER
The hormone receptor status is one of the few well established prognostic indicators in breast cancer, along with the nodal status, tumor size, patient age and pathologie grade[l 7]. Although other prognostic indicators, such as p53, HER2/neu status, angiogenesis and proliferation indices have also shown potential, the value of these parameters bas not been as clearly established. Breast tumors that express ER
differentiated phenotype than ER-negative tumors[18]. The prevalence of ER-positive tumors increases with patient age[l 9, 20], and is significantly higher in post-menopausal women (where 80% of patients have ER positive tumors) than pre-menopausal women (approximately 50% of ER-positive tumors) [17]. The short term recurrence rate is also much lower in ER-positive than negative breast tumors.
Conversely, the ER status does not correlate with 'the absence of nodal and distant metastases, and some studies have questioned whether the long term survival of women with ER-positive tumors is really lower than those with ER-negative cancers[l 7]. Thus, the presence of estrogen receptors does not correlate with the metastatic potential of breast tumors, but rather with their growth rate. The predictive value of ER therefore more accurately reflects the short-term outcome of these patients rather than the absolute disease-free survival.
However, the real value of measuring the expression of steroid hormone receptors in breast cancers lies in their ability to predict a successful response to hormonal therapy. A meta-analysis of the available evidence published in 1998 from 55 studies that included 37 000 women showed that 5 years of adjuvant therapy with tamoxifen reduced recurrences by 47% in women with ER-positive primary tumors[21]. No significant benefit could be proven in women with ER-negative tumors.
Approximately 60% of previously untreated patients with ER-positive tumors will respond to hormonal therapy, while a response is observed in only 5 to 10% of patients with ER-negative tumors[17].
CURRENT TREATMENT STRATEGIES FOR ER/PR+ BREAST CANCERS
Surgery and radiation therapy play an important role of breast cancer treatment. Many reports have shown that radiotherapy can significantly reduce the locoregional recurrence rate but does not significantly improve the long-term survival of the patient [22, 23]. Systemic adjuvant therapy, such as chemotherapy and hormonal therapy, has been proven useful to reduce the rate of recurrence of breast cancers.
When compared with hormone negative tumors, hormone receptor-positive breast cancers exhibit stronger clinical responses to hormonal treatment. Adjuvant tamoxifen prolonged both disease-free and overall survival in patients with ER-rich tumors but had little benefit in patients who had ER-negative neoplasms [21]. According to Harvey et al. [24], patients with breast cancers containing as few as
1-10% of cells staining for ER respond to hormone therapy. Patients who were ER-negative but PR-positive can also benefit from tamoxifen but the role of the progesterone status in selecting therapy remains controversial. Bardou et al. showed in 2003 that the combined measurement of ER and PR is superior to ER alone in predicting benefit from adjuvant hormone therapy since the presence of PR enhance the ER predictive value in both pre- and post-menopausal patients [25].
Tamoxifen is accepted as the standard treatment for patients whose tumors express the estrogen and/or progesterone receptors [26] regardless of age, menopausal status, axillary node involvement, or tumor size [21, 27, 28] to increase recurrence-free survival and overall survival irrespective of whether chemotherapy has been given
years of treatment. The beneficial effect of 5 years of adjuvant tamoxifen was demonstrated in both receptor positive post-menopausal patients [29] and pre-menopausal patients under 50 years [21]. Currently, there is no data justifying the use of tamoxifen for a longer period than 5 years [21, 30, 31] but trials are still ongoing to address this question. Tamoxifen combined with chemotherapy further reduces the risk of disease recurrence, particularly in premenopausal women [21, 30].
According to Colleoni, CMF given concurrently (early, delayed or both) with tamoxifen was more effective than tamoxifen alone for patients with node-positive, endocrine-responsive breast cancer, supporting late administration of chemotherapy even after initiation of tamoxifen. In contrast, sequential CMF and tamoxifen for patients with node-negative, endocrine-responsive breast cancer, was ineffective [32]. Thus, all patients with hormone-receptor positive tumors receiving adjuvant chemotherapy should also receive tamoxifen but the optimal timing between chemotherapy and tamoxifen (during or after chemotherapy) is still under investigation [21, 30]
Based on results from multiple large randomized trials, postmenopausal women with hormone receptor-positive breast cancer can also benefit from aromatase inhibitors as adjuvant therapy. Anastrozole and letrozole are nonsteroidal aromatase inhibitors compared to Exemestane which is a steroidal aromatase inactivator. The main effect of aromatase inhibitors is to decrease the concentration of circulating estrogen levels in postmenopausal women. Aromatase inhibitors should not be employed as monotherapy in premenopausal women since estrogen suppression
increases gonadotrophin release by feedback mechanism increasing, in retum, the production estrogen by the ovaries. Both Anastrozole and letrozole have been shown to be equivalent or superior to tamoxifen in a variety of clinical parameters including the treatment of metastatic breast cancer [33, 34]. In a randomized unblinded trial comparing anastrozole and letrozole in patients with metastatic breast cancer, there was no significant difference between the two agents even if letrozole was known to have a more pronounced effect on reducing estrogen levels [35]. Letrozole was associated with a higher overall response rate, but this was not statistically significant. The two agents did not differ significantly in terms of clinical benefit rate or overall survival. Both aromatase inhibitors anastrozole and exemestane were associated with significantly fewer endometrial cancers, as well as venous and arterial vascular events compared to tamoxifen [36, 37]. Although this was not statistically significant, both anastrozole and letrozole were associated with a higher incidence of cardiovascular disease[37, 38].
Results of the Arimidex, Tamoxifen, Al one or in Combination (AT AC) trîal after completion of 5 years' adjuvant treatment for breast cancer have been published recently and propose anastrozole (for 5 years) to be the preferred initial adjuvant treatment over tamoxifen for postmenopausal women having localized, hormone receptor-positive breast cancer. This recommendation is based on a significantly increase disease-free survival (hazard ratio (HR) 0.87), greater time to recurrence (HR 0.79), greater time to distant recurrence (HR 0.86), and reduced distant metastases (HR
0.86). However, overall survival rates were similar in the 2 groups despite a death reduction by 12% in the anastrozole group that was not statistically significant. Aromatase inhibitors have not been evaluated in the adjuvant setting in women whose tumors lack hormone receptors. The Canadian MA-17 trial is so far the only study which could demonstrate a survival benefit for node positive disease by extending 5 years adjuvant therapy of tamoxifen with letrozole in ER-positive postmenopausal women. Postmenopausal women concluding 2 to 3 years of tamoxifen therapy may consider crossover to an aromatase inhibitor and should plan a total of 5 years of adjuvant endocrine therapy. The optimal timing of transition between tamoxifen to the aromatase inhibitor and the optimal duration of aromatase inhibition are still under investigation. According to the ASC0[39], there are no data on the use of tamoxifen after an aromatase inhibitor in the adjuvant setting. Patients intolerant to aromatase inhibitors should receive tamoxifen as adjuvant therapy, and women with hormone receptor-negative tumors should not receive adjuvant endocrine therapy.
Fulvestrant (Faslodex) is a new type of ER antagonists that bind to estrogen receptor monomers, inhibit receptor dimerization [40], disable activating fonction AFl and AF2 [41], reduce translocation of receptor to the nucleus, accelerate degradation of the ER, ultimately resulting in a reduction in cellular ER [42, 43]. This results in pure antiestrogenic effects [44] and, unlike· Tamoxifen, Fulvestrant is devoid of any known agonist activity [43]. Fulvestrant bas a steroidal structure that competitively binds to the ER with an affinity much greater than that of Tamoxifen (-100 times) [43]. Many trials are ongoing to evaluate the clinical efficacy of fulvestrant after recurrence or
progression on a nonsteroidal aromatase inhibitor. Current results suggest that fulvestrant is at least as effective as Anastrozole [45]. Fulvestrant has been approved for clinical use in the United States for the treatment of ER-positive metastatic breast cancer that fails to respond to Tamoxifen. The efficacy of Fulvestrant in sequential endocrine therapy and in combination with other agents appears promising and active investigations are ongoing to explore the clinical potential of this medication.
New markers to predict response to tamoxifen are continuously being evaluated and several investigators have focused their attention on HER-2/neu [46-50]. In breast cell lines and in model tumor systems, overexpression of the HER-2/neu gene has been associated with increased mitogenesis, malignant transformation, increased cell motility, invasion, and metastasis [51]. In human breast cancer, amplification of the HER-2/neu gene is found in 15-30% of primary invasive tumors. For patients with both early and advanced disease, overexpression of HER-2/neu correlates with either relative resistance or adverse outcome after treatment with hormonal therapy [52, 53]. The relationship between HER-2/neu expression and response to chemotherapy in breast cancers appears to depend on the type of drug administered. With adjuvant CMF, the majority of studies showed a reduced benefit in HER-2/neu positive compared with negative patients [53-55]. However, patients with cancers overexpressing HER-2/neu are likely to derive benefit from treatment with CMF-based regimes compared with no treatment. Several studies suggest that overexpression of this gene may predict enhanced sensitivity to anthracycline-based regimens in the adjuvant setting [52-54]. Thus, the available data suggests that patients with






![TABLE 1. Effective specific activities (ESA) estimated for a several productions of [1 8 F]FES and 4F-M[1 8 F]FES](https://thumb-eu.123doks.com/thumbv2/123doknet/2585026.56791/89.897.296.622.220.724/table-effective-specific-activities-esa-estimated-productions-fes.webp)