Rôle de la NTPDase8 et du récepteur P2Y6 dans
l’inflammation intestinale
Thèse
Mabrouka Salem
Doctorat en microbiologie-immunologie
Philosophiae Doctor (Ph.D.)
Québec, Canada
© Mabrouka Salem, 2018
Rôle de la NTPDase8 et du récepteur P2Y6 dans
l’inflammation intestinale
Thèse
Mabrouka Salem
Sous la direction de :
iii
Résumé
Les maladies inflammatoires de l'intestin (MII) sont caractérisées par le dysfonctionnement de l'épithélium intestinal et la dérégulation de l'équilibre du système immunitaire. L'inflammation liée aux MII pourrait être déclenchée et / ou exacerbée par des signaux de danger tels que les nucléotides. Les nucléotides activent les récepteurs P2 et leurs niveaux sont modulés par des ectonucléotidases dont la famille des ecto-nucléosides triphosphates diphosphohydrolases (E-NTPDases). Nous avons identifié le dernier membre de cette famille d'enzymes que nous avons nommé NTPDase8. Nous avons observé que cette enzyme est exprimée par peu de tissus dont les intestins.
Dans cette thèse, nous démontrons que la NTPDase8 est exprimée à la surface apicale des cellules épithéliales intestinales (CEI) au niveau du colon. Nos résultats indiquent que la NTPDase8 est un protecteur clé de l'inflammation intestinale. En effet, elle prévient l'activation du récepteur P2Y6. Nous résultats proposent aussi que l’injection intra-rectale de la NTPDase8 protège totalement les souris de la colite induite par un modèle chimique.
Le deuxième aspect abordé dans ma thèse est le rôle régulateur du récepteur P2Y6 dans l'inflammation intestinale. Nos résultats in vivo montrent l'importance de bloquer ce récepteur pharmacologiquement afin d’éviter le développement de l'inflammation et ainsi éviter une boucle inflammatoire. Nous avons également démontré que le récepteur P2Y6 joue un rôle clé dans la régulation de l'activité d'autres récepteurs à nucléotides in vitro, ce qui influence l'homéostasie des cellules épithéliales intestinales.
Notre travail décrypte l'importance de la signalisation associée aux nucléotides dans la pathogenèse de la colite expérimentale et met en évidence des propriétés qui pourraient être appliquées à d’autres troubles gastro-intestinaux outre la colite. En extension, ces données suggèrent que l'axe NTPDase8-P2Y6 pourrait être une cible thérapeutique dans le traitement des maladies inflammatoires de l’intestin.
iv
Abstract
Inflammatory bowel diseases (IBD) are characterized by a dysfunction of the intestinal epithelium and a dysregulation of the immune system balance. The inflammation underlying IBD could be triggered and/or exacerbated by danger signals such as nucleotides. The nucleotides activate P2 receptors and their level is modulated by ectonucleotidases which include members of the ecto-nucleoside triphosphate diphosphohydrolases (E-NTPDases) family. We identified the last member of this family of enzymes, the NTPDase8. We originally found its expression in the intestine at the RNA level.
In this work, we demonstrate that NTPDase8 is expressed at the apical surface of intestinal epithelial cells (IEC) in the colon. Our results indicate that NTPDase8 is a key protector of intestinal inflammation by regulating the activation of P2Y6 receptor as the administration of the enzyme protects totally from the intestinal inflammation. In agreement, the deletion of NTPDase8 gene leads to a dramatic increase of inflammation is a murine model of colitis.
The second aspect addressed in my thesis is the regulatory role of the P2Y6 receptor in intestinal inflammation. We found that this receptor expressed on IEC is pro-inflammatory and that blocking it pharmacologically prevented the intestinal inflammation triggered in a colitis model. We have also demonstrated that the P2Y6 receptor plays a key role in regulating the activity of other nucleotide receptors in vitro, which influences the homeostasis of intestinal epithelial cells. Our work deciphers the importance of nucleotide signaling in the pathogenesis of experimental colitis and highlights properties that could be applied to other gastrointestinal disorders. In extension, these data suggest that NTPDase8-P2Y6 axis could be a therapeutic target in the treatment of IBD.
v
Table des matières
Résumé ... iii Abstract ... iv Table des matières ... v Liste des tableaux ... ix Listes des figures ... x Liste des abréviations ... xii Remerciements ... xvi Avant-propos ... xviii Chapitre 1. Introduction ... 1 1.1 L’intestin ... 1 1.1.1 Anatomie et physiologie de l’intestin ... 1 1.1.2 Structure de l’intestin ... 2 1.1.3 L’épithélium intestinal ... 3 1.1.3.1 La différentiation des cellules épithéliales ... 4 1.1.3.1.1 Les entérocytes absorbants ... 5 1.1.3.1.2 Les cellules caliciformes (cellules de Goblet) ... 6 1.1.3.1.3 Les cellules de Paneth ... 7 1.1.3.1.4 Les cellules entéro-endocrines ... 7 1.1.3.2 Les jonctions épithéliales ... 8 1.2 Le microbiote intestinal ... 9 1.3 Les récepteurs de type Toll (TLR) ... 11 1.4 Rôle immunitaire des cellules épithéliales ... 12 1.5 Les peptides antimicrobiens ... 12 1.6 Les maladies inflammatoires de l’intestin ... 13 1.6.1 Définition et épidémiologie ... 13 1.6.1.1 Définition ... 13 1.6.1.2 Épidémiologie ... 13 1.6.2 Symptômes ... 14 1.6.3 Étiologie des maladies inflammatoires de l’intestin ... 15 1.6.4 La pathogenèse des MII ... 16 1.7 Les modèles animaux d’étude des maladies inflammatoires de l’intestin ... 17 1.7.1 Généralités ... 17 1.7.2 Le modèle de dextran sodium sulfate (DSS) ... 18 1.8 La signalisation purinergique ... 19 1.8.1 Les nucléotides et nucléosides extracellulaires ... 20 1.8.1.1 Origine des nucléotides ... 20 1.8.1.2 Mécanisme de relâche et recapture des nucléosides ... 21 1.8.1.2.1 Les mécanismes de relâche des nucléotides ... 21 1.8.1.2.2 Les mécanismes de recapture (régénération) des nucléotides) ... 23 1.8.2 Les récepteurs aux nucléotides et nucléosides ... 24
vi 1.8.2.1 Les récepteurs aux nucléotides nommés P1 ... 24 1.8.2.2 Les récepteurs aux nucléotides nommés P2 ... 25 1.8.2.2.1 Les récepteurs P2X ... 25 1.8.2.2.2 Les récepteurs P2Y ... 28 1.8.3 Régulation des nucléotides par les ecto-enzymes ... 29 1.8.3.1 Hydrolyse des nucléotides par les ectonucléotidases ... 30 1.8.3.1.1 Les ecto-nucléosides triphosphates diphosphohydrolases : E-NTPDases ... 30 1.8.3.1.2 Les ecto-nucléotides pyrophosphatases/phosphodiesterases : NPP ... 33 1.8.3.1.3 Les phosphatases alcalines (ALP) et Les phosphatases acides (ACP) ... 33 1.8.3.1.4 L’ecto-5’-nucléotidase (CD73) ... 34 1.8.3.1.5 L'ecto-adénosine désaminase (ecto-ADA) ... 34 1.8.3.2 Métabolisme des nucléotides par les ecto-kinases ... 35 1.9 Implication de la signalisation purinergique dans les maladies inflammatoires de l’intestin ... 36 1.10 Problématique ... 39 Chapitre 2. La NTPDase8 protège contre l’inflammation intestinale via la régulation de l’activation du récepteur P2Y6. ... 41 2.1 Avant-propos ... 41 2.2 Résumé ... 42 2.3 Abstract ... 44 2.4 Introduction ... 44 2.5 Materials and methods ... 46 2.5.1 Materials ... 46 2.5.2 Generation of Entpd8 deficient mice ... 46 2.5.3 Animals ... 47 2.5.4 Induction and clinical assessment of experimental (acute) colitis ... 47 2.5.5 Histological assessment of colitis ... 47 2.5.6 Colonic myeloperoxidase activity assay ... 48 2.5.7 Enzyme histochemistry and immunohistochemistry ... 48 2.5.8 Intestinal epithelial cell isolation ... 49 2.5.9 Ectonucleotidase activity ... 49 2.5.10 PCR and Quantitative Real time PCR (qRT-PCR) ... 50 2.5.11 Western blots ... 50 2.5.12 Bone marrow transplantation ... 51 2.5.13 Intrarectal injection of P2Y6 receptor antagonist ... 51 2.5.14 In vivo intestinal permeability assay ... 52 2.5.15 Statistical Analysis ... 52 2.6 Results ... 52 2.6.1 NTPDase8 is expressed at the apical surface of mouse colon ... 52 2.6.2 Generation and characterization of Entpd8-/- mice ... 52 2.6.3 Exacerbated acute dextran sulfate sodium (DSS)-induced colitis in NTPDase8 deficient mice ... 53 2.6.4 DSS treatment increases the infiltration of immune cells in colon of Entpd8-/- more than in WT mice ... 54 2.6.5 Distinct expression of cytokines in Entpd8-/- mice treated with DSS ... 54 2.6.6 Characterization of IEC ... 55 2.6.7 Mice deficient in P2Y6 receptor in IEC are protected from DSS-induced colitis ... 55
vii 2.6.8 Intra-rectal injection of a P2Y6 antagonist ameliorates DSS-induced colitis ... 57 2.7 Discussion ... 58 2.8 Conclusion ... 60 2.9 Acknowledgments ... 60 2.10 Conflict of interest ... 60 2.11 Figures ... 61 2.12 References ... 74
Chapitre 3. Le récepteur P2Y6 régule l’expression et la sécrétion de la chimiokine CXCL10 dans les cellules épithéliales intestinales de souris ... 77 3.1 Avant-propos ... 77 3.2 Résumé ... 78 3.3 Abstract ... 80 3.4 Introduction ... 80 3.5 Materials and methods ... 82 3.5.1 Reagents and chemicals ... 82 3.5.2 Animals ... 83 3.5.3 Intestinal epithelial cell isolation ... 84 3.5.4 IEC stimulation ... 84 3.5.5 Quantitative Real-Time PCR (qRT-PCR) and ELISA ... 85 3.5.6 Isolation and preparation of murine bone marrow macrophages ... 85 3.5.7 In vitro chemotaxis assay ... 86 3.5.8 Statistical analysis ... 86 3.6 Results ... 87 3.6.1 P2Y6 receptor is the major nucleotide receptor expressed in IEC ... 87 3.6.2 Characterization of P2ry6-/- IEC ... 87 3.6.3 CXCL10 expression and secretion expression and secretion are augmented in P2ry6-/- IEC stimulated by Poly(I:C) ... 88 3.6.4 Extracellular nucleotides are involved in poly(I:C)-induced CXCL10 release by IEC ... 90 3.6.5 Supernatants from poly(I:C)-stimulated IEC induce macrophage migration in vitro .... 90
3.6.6 Several P2 receptors are involved in CXCL10 expression and secretion induced by poly(I:C) in P2ry6-/- IEC ... 91 3.6.7 FGF2 signaling pathway is upregulated in P2ry6-/- IEC ... 93 3.7 Discussion ... 93 3.8 Conclusion ... 97 3.9 Acknowledgments ... 97 3.10 Conflict of interest ... 98 3.11 Figures ... 100 3.12 References ... 108 Chapitre 4. Exacerbation de l’inflammation intestinale chez des souris déficientes en P2Y6 traitées au DSS ... 113 4.1 Avant-propos ... 113 4.2 Résumé ... 114 4.3 Abstract ... 117 4.4 Introduction ... 117 4.5 Material and methods ... 119
viii 4.5.1 Reagents ... 119 4.5.2 Animals ... 120 4.5.3 DSS induced acute-colitis ... 120 4.5.4 Myeloperoxidase activity assay ... 120 4.5.5 Immunohistochemistry ... 121 4.5.6 Evaluation of lymphocyte subset infiltration ... 121 4.5.7 Cytokine and chemokine expression in colon ... 122 4.5.8 Statistical analysis ... 122 4.6 Results ... 122 4.6.1 Increased inflammation in DSS-treated P2Y6 deficient mice ... 122 4.6.2 Colonic crypts of DSS-treated P2ry6-/- mice show decreased proliferation and decreased mucus production ... 123 4.6.3 Increased number of infiltrated immune cells in the colons of P2ry6-/- mice. ... 124 4.6.4 Th17/Th1 is the most accumulated lymphocyte subset in P2ry6-/- DSS-treated colon 124 4.6.5 Cytokine and chemokine expression profile in DSS-treated P2ry6-/- mice ... 125 4.7 Discussion ... 125 4.8 Conclusion ... 130 4.9 Conflict of interest ... 130 4.10 Figures ... 131 4.11 References ... 136 Chapitre 5. Discussion générale et conclusion ... 144 5.1 Discussion générale ... 144 5.2 Conclusion ... 151 Bibliographie ... 153 Chapitre 6. Annexes ... 177 Annexe 1 ... 177 Annexe 2 ... 185 Articles publiés ... 185 Articles soumis ... 185 Articles en preparation ... 185 Brevet ... 186 Présentations orales ... 186 Présentations par affiche ... 186
ix
Liste des tableaux
Tableau 1-1. La famille des récepteurs P1 ... 24
Tableau 1-2. La famille des récepteurs P2X ... 27
Tableau 1-3. La famille des récepteurs P2Y ... 29
Tableau 1-4. La famille des NTPDases ... 32
x
Listes des figures
Figure 1-1. Anatomie et physiologie de l’intestin. ... 2
Figure 1-2. Structure cellulaire des intestins. ... 3
Figure 1-3. Génération de l’épithélium intestinal à partir des cellules souche. ... 4
Figure 1-4. Représentation schématique de la composition de la barrière intestinale en jonctions. ... 9
Figure 1-5. Représentation schématique de la structure des nucléotides. ... 21
Figure 1-6. Les mécanismes de relâche des nucléotides. ... 22
Figure 1-7.Les récepteurs du système purinergique. ... 25
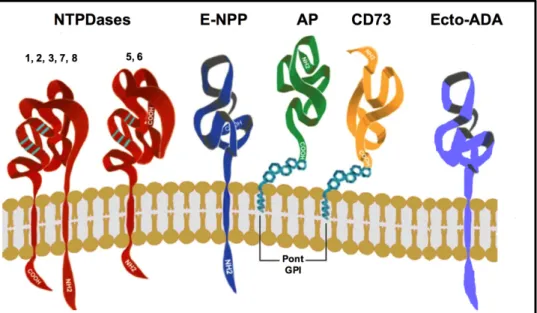
Figure 1-8.Représentation schématique et topologie membranaire des ectonucléotidases. . 30
Figure 1-9. Métabolisme des nucléotides extracellulaires. ... 35
Figure 2-1. NTPDase8 is expressed at the apical surface of mouse colon. ... 61
Figure 2-2. Generation and characterization of Entpd8-/- mice. ... 62
Figure 2-3. NTPDase8 deficient mice show exacerbated inflammation in the DSS-induced colitis model. ... 64
Figure 2-4. Increased apoptosis in colonic crypts of DSS-treated Entpd8-/- mice. ... 65
Figure 2-5. Increased infiltration of immune cells in colon of DSS treated Entpd8-/- mice. . 66
Figure 2-6. The presence of NTPDase8 affects the profile of cytokine and chemokines in DSS treated colons. ... 67
Figure 2-7. Characterization of primary IEC cultures. ... 68
Figure 2-8. Mice deficient in P2Y6 receptor in IEC are protected from DSS-induced colitis. ... 69
Figure 2-9. P2ry2-/- mice are partially protected from DSS-induced colitis. ... 71
Figure 2-10. Blocking P2Y6 receptor results in amelioration of DSS-induced colitis. ... 72
Figure 3-1. Characterization of primary IEC cultures. ... 100
Figure 3-2. CXCL10 expression and secretion are increased in primary P2ry6-/- IEC stimulated by a TLR3 ligand. ... 101
Figure 3-3. The TLR3 ligand poly(I:C) induces CXCL10 expression and secretion from IEC in a nucleotide-dependent manner. ... 102
Figure 3-4. Supernatants from poly(I:C) stimulated IEC induce macrophage migration in a nucleotide-dependant manner. ... 103
Figure 3-5. P2Y6 modulates nucleotide signaling-dependent CXCL10 expression and secretion from IEC. ... 105
Figure 3-6. MMP9 gene expression induced by FGF2 is increased in P2ry6-/- IEC. ... 107
Figure 4-1. P2ry6-/- mice are more susceptible to DSS-induced colitis. ... 131
Figure 4-2. DSS-treated P2ry6-/- mice show a decrease of proliferation and Goblet cell number in colonic crypts. ... 132
Figure 4-3. Increased infiltration of immune cells in the colons of DSS-treated P2ry6-/- mice. ... 133
Figure 4-4. Accumulation of Th1, Th17 and Th17/Th1 in the gut of DSS-treated P2ry6-/- mice. ... 134
xi
Figure 5-1. Role de la NTPDase8 et du récepteur P2Y6 dans la colite ulcéreuse induite par le
DSS. ... 150
Figure 5-2. Perspectives à long terme sur les mécanismes d’action de la NTPDase8 et du recepteur P2Y6 au niveau cellulaire dans la colite ulcéreuse. ... 152
Figure 6-1. L’hydrolyse des nucléotides extracellulaires protège contre l’inflammation intestinale. ... 177
Figure 6-2. La NTPDase8 régule l’expression et la sécrétion de la chimiokine KC en limitant l’activation des récepteurs P2Y2 et P2Y6. ... 178
Figure 6-3. La NTPDase8, en contrôlant l’activation du récepteur P2Y6 et P2Y2, régule la
chimiotaxie et la transmigration des neutrophiles à travers un épithélium intestinal in vitro. ... 179
Figure 6-4. La NTPDase8 est importante dans la fonction barrière de l’épithélium intestinal en conditions inflammatoires. ... 180
Figure 6-5. La NTPDase8 est importante dans l’expression des peptides antimicrobiens par l’épithélium intestinal en conditions inflammatoires... 182
Figure 6-6. La NTPDase8 est exprimée à la face apicale du colon humain. ... 183
xii
Liste des abréviations
5-HT : 5-hydroxytryptamine
ABC : Cassette de liaison à l'ATP (« ATP-binding cassette ») ACP : Phosphatase acide (« Acid Phosphatase »)
ACR : Région conservée des apyrases (« Apyrase Conserved Region ») ADN : Acide désoxyribonucléique
ADP : Adénosine diphosphate Ecto-AK : Ecto-adénylate kinase
ALP : Phosphatase alcaline (« Alkaline Phosphatase ») AMP : Adénosine monophosphate
AMPc : Adénosine monophosphate cyclique APC : Cellule présentatrice d’antigène ARN : Acide ribonucléique
ATP : Adénosine triphosphate
ATPgS : Adénosine-5'-(g-thio)-triphosphate BB : Brodure en brosse
Ca2+ : Cation calcium (2+)
Caco-2/15 : Lignée de cellules intestinale tumorale humaine isolée d'un adénocarcinome colique
CBC : « Crypt Base Columnar » CD : Cellule dendritique CD73 : Ecto-5’-nucléotidase
CEI : Cellule épithéliale intestinale
CFTR : Régulateur transmembranaire de la fibrose Kystique (« Cystic Fibrosis
Transmembrane »)
CMH : Complexe Majeur d’histocompatibilité
CNT : Transporteur à nucléosides concentrant (« Concentrative Nucleoside
Transporter »)
Co2+ : Cation cobalt (2+) Cu2+ : Cation Cuivre Cx26 : Connexine 26
DSS : Dextrane sulfate sodium
E-NPP : Ecto-nucléotides pyrophosphatases/phosphodiesterases Ecto-ADA : Ecto-adénosine désaminase
ENT : Transporteur aux nucléosides équilibrant (« Equilibrative Nucleoside
Transporter »)
xiii Fe2+ : Cation fer (2+)
FLI : Follicule lymphoïde isolé
GALT : Tissu lymphoïde associé au tube digestif (« Gut-associated lymphoid tissue ») GLUT2 : Transporteur de glucose 2 (« Glucose transporter 2 »)
GWAS : « Genome-wide association study » Hg1+ : Cation mercure (1+)
IBD : « Inflammatory Bowel disease »
IEC-6 : Lignée de cellules épithéliales intestinales de rat IFN-g : Interferon-g
IgA : Immunoglobuline A IL-6 : Interleukine 6
InsP3 : Inositol 1,4,5-trisphosphate JA : Jonctions adhérentes
JAM : « Junctional Adhesion Molecules » K+ : Cation potassium (1+)
Li+ : Cation lithium
LPA : Acide lysophosphatidique (« Lysophosphatidic acide ») LPS : Lipopolysaccharide
MC : Maladie de Crohn Mg2+ : Magnésium (2+)
MII : Maladie inflammatoire de l’intestin
MLN : Ganglions lymphatiques mésentériques (« Mesenteric lymphnodes ») Mn2+ : Manganèse (2+)
MUC2 : Mucine 2
Na+ : Cation sodium (1+)
Ecto-NDK : Ectonucléoside diphosphokinase NDP : Nucleoside 5’-diphosphate NF-kB : « Nuclear factor-kappa B »
NK : Cellule tueuse « Natural Killer cell »
NLR : Les récepteurs de types NOD « Nod Like Receptor » NMP : Nucleoside 5’-monophosphate
NO : Oxyde d’azote (« Nitric oxyde »)
NOD2 : « Nucleotide-binding oligomerization domain 2 » NTP : Nucleoside 5’-triphosphate
xiv
PAM3CSK4 : «
N-Palmitoyl-S-[2,3-bis(palmitoyloxy)-(2RS)propyl]-[R]-cysteinyl-[S]-seryl-[S]-lysyl-[S]-lysyl-[S]-lysyl-[S]-lysine »
PAM : Peptide antimicrobien
PAMP : Motifs moléculaires associés aux pathogènes (« Pathogen-associated molecular
pattern »)
Panx1 : Pannexine1
Pi : Phosphate inorganique PKA : Protéine Kinase A
PMN : Neutrophiles « Polymorphonuclear neutrophil » PP : Plaque de Peyer
PPAD : Pyridoxalphosphate-6-azophenyl-2',4'-disulfonic PPi : Pyrophosphate
PRR : Récepteurs de reconnaissance de motifs moléculaires « Pattern Recognition
Receptors »
Rag-/- : « Recombination-activating gene deficient mice » RCH : Rétro-colite hémorragique
RCPG : Récepteur couplé aux protéines G RIG : Retinoicacid–induciblegene
RLR : Les récepteurs de type RIG « RIG Like Receptor » S-IgA : Anticorps sécrétoires de l’Immunoglobuline A
Scid-/- : « Severe combined immunodeficient mice »
STAT3 : « Signal transducer and activator of transcription 3 » TFF3 : Facteur de trefle intestinal 3 (« Trefoil factor 3 »)
TGF-beta : Facteur de croissance transformant (« Transforming growth factor beta ») Th17 : Lymphocyte Th17
TJ : : Jonctions serrées (« Tight junction ») TLR : « Toll Like Receptor »
TLS : Tissu lymphoïde secondaire
TNF-a : Facteur nécrosant de tumeurs alpha (« Tumor Necrosis Factor-alpha ») Treg : Lymphocytes T régulatrices
UDP : Uridine 5’-diphosphate UMP : Uridine 5’-monophosphate UTP : Uridine triphosphate
UTPgS : « Dihydroxyphosphinothioyl [[(2R,3S,4R,5R)-5-(2,4-dioxopyrimidin-1-yl)-3,4-
dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] hydrogen phosphate »
Zn2+ : Cation zinc (2+) ZO-1 : Zonula Occludens-1
xv
A dream doesn’t become reality through
magic : it takes sweat, determination
and hard work.
xvi
Remerciements
La thèse, étant un défi intellectuel et personnel, ne peut pas être entamée sans l’encadrement et le soutien des personnes du milieu du travail ainsi que de mes proches. Mes sincères remerciements leur seront adressés à travers ces quelques paragraphes.
Je tiens à remercier tout d’abord mon encadreur, Dr Jean Sévigny, de m’avoir donné l’opportunité de mener et travailler sur ce projet depuis ma maîtrise et de le continuer au cours de mon doctorat. Ce projet, qui m’a beaucoup intéressé et passionné, nous a permis de publier un brevet dont je suis fière. La NTPDase8 est notre « bébé du labo », nous nous sommes habitués à le dire. Ce fut une expérience très enrichissante dans ma carrière scientifique. Je le remercie également pour la formation scientifique de qualité qu’il m’a permis d’acquérir et pour tous ses conseils tout au long de ces dernières années. Merci aussi de m’avoir donné toute l’autonomie dont j’ai bénéficié durant ma thèse.
J’aimerais aussi souligner ma reconnaissance à Dr Joanna Lecka. Elle était toujours présente à mes côtés et prête à m’aider depuis mon premier jour au laboratoire. Au-delà d’être ma codirectrice, elle était aussi mon amie et ma mère québécoise. Je la remercie pour son aide continue, sans oublier nos sorties et nos discussions profondes sur tous les sujets.
Je souhaite témoigner toute ma gratitude à tous les membres de l’équipe, et plus spécifiquement Julie et Alain, sans oublier les anciens étudiants de notre laboratoire et le personnel de l’étage et de l’animalerie.
Je terminerai par un immense merci à ma famille, ma raison d’être. Nul mot n’est suffisant pour exprimer ma reconnaissance vers mon papa, ma maman et mes deux frères qui n’ont pas cessé de me soutenir, et ce, malgré la distance qui nous séparait. Votre amour pour moi est une source d’inspiration. Merci d’avoir toujours été présents dans ma vie dans les bons moments comme dans les moments les plus difficiles. Je vous adresse toute mon affection et mon amour. Le mérite de cette thèse vous revient en grande partie. Je vous dois une partie considérable de tout ce que je suis et tout ce que j’ai réussi. Sans vous, je ne serai pas la personne que je suis aujourd’hui.
xvii
Pour terminer, j’aimerais remercier mon chéri. Merci pour ton aide, tes encouragements continus, ton soutien quotidien et surtout pour ta patience. Merci de m’avoir aidée à rester toujours forte. Quel immense privilège que j’ai de partager tous ces moments avec toi.
xviii
Avant-propos
Décrites à partir des années 1950 en Europe et en Amérique du Nord, les maladies inflammatoires de l’intestin (MII) ont vu leur fréquence augmenter durant une période de 20 ans (1). Les premières publications autour des patients atteints de maladies inflammatoires chroniques de l’intestin datent du début du XXe siècle (2).
La pertinence des nucléotides / nucléosides dans le contrôle physiologique des fonctions digestives a été initialement abordée au début des années 1970 lorsque le Dr Geoffrey Burnstock a mis en évidence que l'adénosine triphosphate (ATP) et ses nucléotides / nucléosides dérivés (le diphosphate d'adénosine (ADP), l'adénosine monophosphate (AMP) et l'adénosine), précédemment considérés exclusivement comme des sources d'énergies biochimiques omniprésentes, pourraient se comporter comme des médiateurs intercellulaires dans le domaine gastro-intestinal (3). Par la suite, en dépit de critiques sévères, l'existence de récepteurs spécifiques nommés les récepteurs purinergiques et classés en récepteurs P1 et P2 (pour l'adénosine et l'ATP / ADP, respectivement) a été démontrée, contribuant ainsi à la reconnaissance de ce système comme un pilier de la physiologie du tractus gastro-intestinal (4-6).
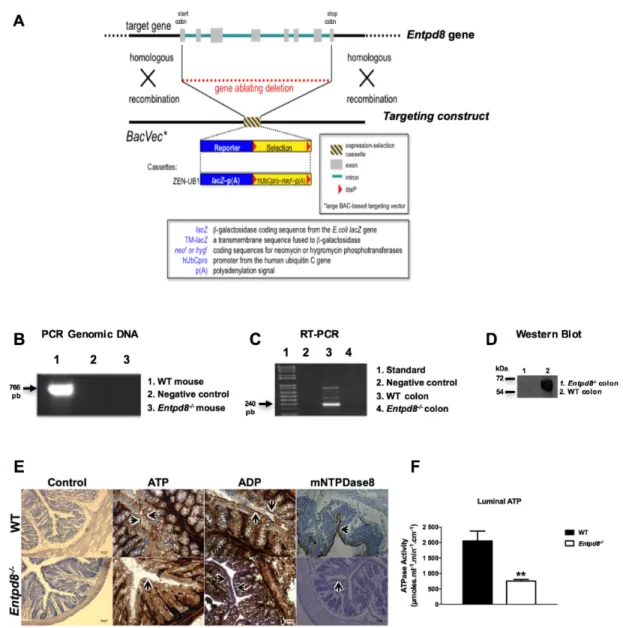
Les ectonucléotidases, enzymes qui hydrolysent les nucléotides et régulent leur concentration, ont été évoquées dans plusieurs aspects de la biologie. Notre laboratoire a identifié et cloné la NTPDas8, le dernier membre de la famille des NTPDases en 2004. Bien que cette ectonucléotidase ait été identifiée dans notre laboratoire depuis 2004, il n’existait pas encore d’outils commerciaux sur le marché pour l’étudier quand j’ai commencé mon projet de maîtrise en 2011. La première étude publiée par notre laboratoire portait sur le clonage et la caractérisation biochimique de la NTPDase8 (7). Ensuite, un doctorant a travaillé sur l’expression de la NTPDase8 dans le foie du rat à l’aide d’un anticorps contre la NTPDase8 du rat généré par notre laboratoire (8). À cette époque, des résultats de notre laboratoire montrent qu’en dehors du foie, le gène de la NTPDase8 est aussi exprimé dans l'intestin et les reins (7). Nous avons donc commencé par produire les outils nécessaires pour étudier la NTPDase8 chez la souris et l’humain (anticorps et souris déficientes) afin de déterminer son rôle dans les tissus où elle est exprimée.
xix
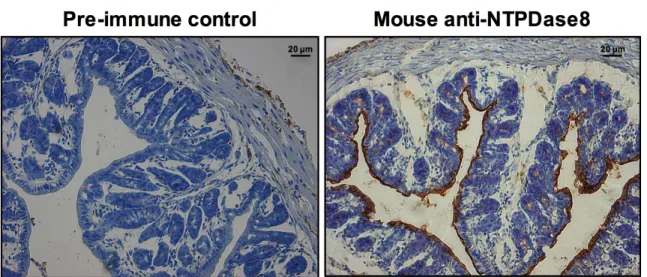
Durant ma maîtrise, j’ai caractérisé les anticorps dirigés contre la NTPDase8 humaine et la NTPDase8 de souris en utilisant comme tissus les intestins. À l’aide de cet outil, nous avons montré que la NTPDase8 est l’ectonucléotidase majeure exprimée à la face apicale des cellules épithéliales du colon chez la souris et l’humain. De ce fait, nous avons posé les questions suivantes : est-ce que la NTPDase8 joue un rôle dans l’inflammation intestinale ? Si oui, par quel mécanisme ?
Dans cette thèse de doctorat sous forme d’articles, nous répondrons à ces questions dans le chapitre 2 et présenterons les résultats qui ont mené à la publication d’un brevet.
Les nucléotides extracellulaires activent une panoplie de récepteurs purinergiques dont l’activité dépend des ectonucléotidases. Parmi ces récepteurs, le récepteur P2Y6 est connu pour son profil pro-inflammatoire (422, 461, 471). De plus, nos résultats antérieurs ont montré que le récepteur P2Y6 est impliqué dans la sécrétion de la chimiokine CXCL8 par les monocytes ainsi que dans la migration des neutrophiles in vivo et in vitro (372). Par contre, ce récepteur est très peu étudié au niveau du système gastro-intestinal et plus spécifiquement dans les maladies inflammatoires de l’intestin. Le récepteur P2Y6, étant pro-inflammatoire, a été étudié in vitro à l’aide de lignées cellulaires (9) mais aucune étude n’a évoqué son rôle dans l’homéostasie et l’inflammation intestinale in vivo et plus spécifiquement avec des souris déficientes. Nous nous sommes donc demandé quel est le rôle de ce récepteur dans l’inflammation intestinale in vivo et in
vitro à l’aide de cellules primaires ? Les réponses à ces questions seront dévoilées dans les chapitres
3 et 4.
Plusieurs projets scientifiques développés dans le laboratoire durant mon doctorat ont amené de nouvelles connaissances sur les NTPDases. J’ai contribué à quelques résultats publiés dans ces articles. Ces travaux n’étant pas en lien direct avec mon projet de doctorat, ils ne seront pas insérés dans mon manuscrit et seront énumérés en annexe 2.
1
Chapitre 1. Introduction
1.1 L’intestin
1.1.1 Anatomie et physiologie de l’intestin
L’intestin est une partie du tractus gastro-intestinal qui représente l’un des organes clés pour l’organisme. Il assure plusieurs fonctions, dont l’absorption des nutriments, la digestion et l’excrétion. Protégé par l’épithélium, l’intestin forme une interface critique entre le milieu intérieur et l’environnement externe puisque la lumière intestinale est contiguë à celui-ci. Ainsi, l’intestin forme une barrière pour empêcher le passage d’agents toxiques présents à la lumière intestinale. De plus, grâce à sa perméabilité sélective, l’intestin forme une barrière hautement régulée face à la digestion et l’absorption des nutriments, des électrolytes et de l’eau.
Une attention accrue a été consacrée à la fonction immunitaire de l’intestin et à son rôle physiologique en tant que barrière physique, chimique ainsi qu’immunitaire. En effet, ce dernier représente un site potentiel pour l’absorption des antigènes et de pathogènes nuisibles qui devraient être en symbiose avec la flore commensale connue sous le nom de microbiote.
L’intestin humain est divisé en plusieurs segments distincts qui possèdent des fonctions communes et complémentaires. L’intestin grêle, qui mesure 3 à 5 mètres, est divisé à son tour en 3 régions : le duodénum, le jéjunum et l’iléon (10). Le duodénum, caractérisé par une structure en brosse, est responsable de 90 % de l’absorption grâce aux enzymes digestives présentes à sa surface luminale (11). Le jéjunum est le site principal de l’absorption du sodium lié aux monosaccharides ainsi que les acides aminés et les acides gras. L’iléon est chargé de l’absorption des sels biliaires et de la vitamine B12 (10), et dont l’extrémité se joint au colon au niveau du cæcum.
Le colon mesure un mètre de longueur et est subdivisé en 4 segments : le côlon ascendant, transverse, descendant et le sigmoïde. Le colon est responsable principalement de
2
l’absorption du sodium, du chlorure et de l’eau ainsi que la sécrétion du potassium et du bicarbonate (12, 13). L’extrémité du colon débouche sur le rectum et l’anus (Figure 1-1).
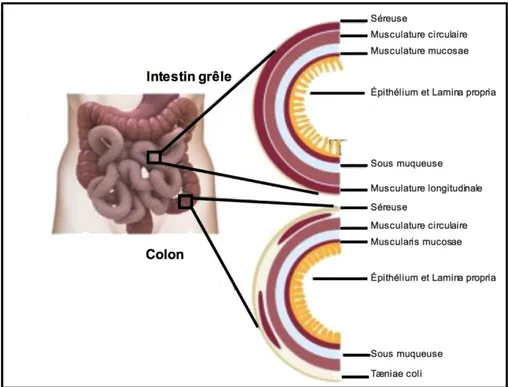
Figure 1-1. Anatomie et physiologie de l’intestin. 1.1.2 Structure de l’intestin
D’un point de vue histologique, la paroi intestinale est constituée de tuniques successives disposées de façon conservée de l’intestin grêle jusqu’au colon. Ces dernières sont bien organisées de la lumière intestinale vers la couche extérieure comme suit : la muqueuse intestinale (composée de l’épithélium et de la lamina propria), la muscularis mucosae qui sépare la muqueuse de la sous-muqueuse (constituée de muscles lisses dont la contraction favorise le contact de l’épithélium avec la lumière intestinale), la sous-muqueuse (constituée de tissus conjonctifs portant les vaisseaux sanguins et la lymphe) et finalement la séreuse (joue un rôle protecteur pour l’organe) (Figure 1-2). La lamina propria, en plus de jouer le rôle de support pour la structure des villosités, représente le compartiment principal où se déroule la réponse immunitaire (10, 14).
3
Figure 1-2. Structure cellulaire des intestins. Modifiée à partir de Jonathan C Howell and
James M Wells; 2011 (14).
1.1.3 L’épithélium intestinal
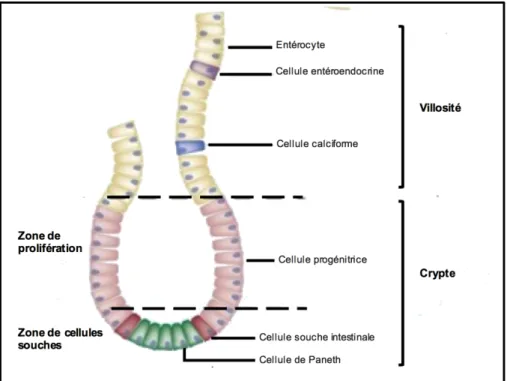
L’épithélium intestinal est la plus grande surface mucosale du corps humain couvrant à peu près 400 m2 de surface. Ce dernier est organisé selon des unités répétées composées chacune de cryptes invaginées dans la lamina propria suivie de leur prolongement en villosités (10, 14, 15) (Figure 1-3). Ces unités fonctionnelles régulières sont arrangées de façon à augmenter la surface absorbante de trois fois la surface disponible, en particulier dans l’intestin grêle. Au niveau du colon, les villosités sont absentes.
4
Figure 1-3. Génération de l’épithélium intestinal à partir des cellules souche. Modifiée à partir de Jonathan C Howell and James M Wells, 2011 (14).
1.1.3.1 La différentiation des cellules épithéliales
Face aux dommages quotidiens auxquels il peut faire face (inflammation, irradiation, mort cellulaire), l’épithélium intestinal est en remodelage continu. Ce processus de renouvellement est assuré par les cellules souches et les progéniteurs présents dans la partie inférieure des cryptes (16). En effet, l’épithélium est composé de cellules souches qui assurent le renouvellement de l’épithélium et de cellules différenciées qui sont responsables des fonctions digestives et protectrices ainsi que la sécrétion du mucus (17) (Figure 1-3).
Les cellules souches situées au fond des cryptes sont intercalées avec les cellules de Paneth nommées aussi « Crypt Base Columnar » (CBC). Ces 2 types de cellules sont caractérisées par des marqueurs spécifiques, soient le Lgr5 (18, 19) et le Bmi1(20, 21).
Sur une durée de vie de 3 à 5 jours, en fonction de l’espèce, les cellules souches épithéliales situées au fond des cryptes émergent de la zone proliférative et migrent vers le sommet des villosités en se différenciant en 2 principales lignées : une lignée absorbante
5
donnant naissance aux entérocytes et aux cellules M, et une lignée sécrétrice englobant les cellules caliciformes (cellules de Goblet) et les cellules entéro-endocrines (22). Seules les cellules de Paneth font l’exception. Celles-ci ne migrent pas le long de l’axe crypte-villosité et restent dans la partie inférieure des cryptes (21). La cellule souche peut se différencier aussi en un autre type cellulaire, nommé les cellules « tuft », mais ces cellules sont beaucoup moins représentées et leur rôle est encore mal connu (23).
Une fois que la cellule épithéliale différenciée atteint le sommet des villosités (dans le cas de l’intestin grêle) ou la partie supérieure des cryptes (dans le cas du colon), l’anoïkise, ou la mort cellulaire programmée (apoptose) s’ensuit. Ce processus a été caractérisé morphologiquement par l’élimination ordonnée des cellules apoptotiques avec le maintien des jonctions cellule-cellule et la fonction barrière de l’épithélium. Les cellules de Paneth sont éliminées par phagocytose assurée par les macrophages. Ces derniers, présents dans la lamina propria, sont en étroite communication avec l’épithélium (24).
1.1.3.1.1 Les entérocytes absorbants
Les entérocytes absorbantes représentent le type cellulaire le plus important et abondant au niveau de l’épithélium. Tel que leur nom l’indique, ces cellules sont connues pour leur rôle dans l’absorption des nutriments. Elles sont nommées des entérocytes au niveau de l’intestin grêle et des colonocytes au niveau du colon (22).
Les entérocytes et les colonocytes sont des cellules colonnaires bien cohésives, polarisées et bordées à leur face apicale par de grandes microvillosités appelées bordure en brosse (BB) dont la taille diminue selon l’axe proximal-distal (du duodénum vers le colon distal). Ces microvillosités ont pour rôle d’augmenter la surface d’échange avec la lumière digestive. La face apicale des villosités est enrichie en enzymes digestives dont l’expression augmente progressivement au fur et à mesure que les entérocytes migrent tout au long de l’axe crypte-villosité (25). Contrairement à la membrane rigide des microvillosités apicales (26), la membrane basolatérale est plus flexible ce qui permet aux cellules de s’imbriquer entre elles d’où la plasticité de ces cellules. En conséquence, les dimensions de l’espace
6
latéral peuvent être nettement augmentées en cas d’absorption des nutriments actifs, ce qui suggère des rôles critiques des entérocytes dans la fonction nutritive.
1.1.3.1.2 Les cellules caliciformes (cellules de Goblet)
Les cellules caliciformes, appelées aussi cellules de Goblet, sont les cellules productrices de mucine, présentes à la fois au niveau des villosités de l’intestin grêle (5%) et des cryptes du colon. Elles augmentent de nombre en atteignant l'épithélium recouvrant les cryptes du colon distal (environ 15%). Comme tous les autres types de cellules épithéliales de l’intestin, les cellules caliciformes dérivent de la différenciation des cellules souches situées au fond des cryptes (22).
La partie apicale des cellules caliciformes, en forme de bulbe, est remplie de granules denses contenant les mucines déshydratés (17). Cette partie inclut l’appareil de Golgi et le réticulum endoplasmique dans lesquels les mucines sont synthétisées en tant que glycoprotéines fortement glycosylées. Ensuite, les mucines sont sécrétées formant ainsi une couche de mucus qui tapisse et protège la face luminale de l’épithélium intestinal (27). Les mucines sont caractérisées par une partie protéique qui, par des liaisons covalentes, s’attache à la partie glucidique hydrophile de l’épithélium (28, 29).
La sécrétion de mucines hautement glycosylées dans la lumière intestinale par les cellules caliciformes crée la première ligne de défense de l’épithélium contre l’invasion microbienne. En effet, le gel muqueux apical (mucus) forme une barrière semi-perméable qui protège l'épithélium des contenus abrasifs et toxiques de la lumière intestinale. Le mucus peut également interagir avec les bactéries luminales en les piégeant et les empêchant d'entrer en contact avec l'épithélium (30). Par conséquent, les mucines peuvent servir de site de colonisation pour les bactéries commensales. En effet, les sites de liaison de glucides présents sur les mucines peuvent permettre aux bactéries pathogènes d'être piégées par l'immunoglobuline sécrétée A (IgA) dans le gel muqueux et éliminées de la lumière intestinale. En l'absence de la couche de mucus, les réponses inflammatoires aux différents stimuli sont favorisées et renforcées.
7
1.1.3.1.3 Les cellules de Paneth
Les cellules de Paneth sont présentes au niveau des cryptes de l'épithélium des intestins grêles et du côlon proximal (22). Ces cellules sont restreintes à la partie inférieure des cryptes et ne migrent pas tout au long de l’axe crypte-villosité. Il s’agit d’un type cellulaire différencié de manière terminale, dérivé de la cellule souche des cryptes et qui n’est pas actif au niveau de la mitose. Comme les cellules caliciformes, la face apicale des cellules de Paneth est occupée par des granules sécrétoires semblables à des lysosomes modifiés. Ces granules contiennent les lysozymes et les peptides antimicrobiens (31).
La fonction principale des cellules de Paneth est la sécrétion des peptides antimicrobiens (PAM), raison pour laquelle le nombre de cellules de Paneth peut augmenter en fonction de la charge bactérienne présente à la lumière intestinale (32). Cette sécrétion permet ainsi de contribuer à la défense mucosale de l’intestin (33). En effet, la sécrétion des PAM peut protéger l'épithélium d’effets potentiellement mortels tel qu’une infection microbienne aiguë ou chronique. De plus, elle peut influencer la composition du microbiote commensal résident dans la lumière intestinale en exerçant des effets bactéricides sélectifs sur les différentes espèces bactériennes. Un changement au niveau de la flore microbienne peut altérer les fonctions des cellules de Paneth et influencer l’aptitude de l’organisme à contrôler la composition de la lumière intestinale, d’où l’augmentation de la susceptibilité aux maladies inflammatoires intestinales et les infections entériques (34-36).
1.1.3.1.4 Les cellules entéro-endocrines
Les cellules entéro-endocrines se trouvent à faible proportion au niveau de la muqueuse intestinale (0,4 à 1%). Elles sont intercalées par les autres types de cellules épithéliales et proviennent des mêmes cellules souches que les entérocytes et les cellules caliciformes. Ces cellules sont relativement déficientes en microvillosités et leurs apex sont typiquement minces ce qui leur permettent de former des jonctions intercellulaires avec les cellules adjacentes (22, 37).
La caractéristique morphologique distincte de ces cellules est la présence de nombreuses granules sécrétoires cytoplasmiques qui sont concentrées dans le cytoplasme
8
basal sous-jacent au noyau. Ces cellules représentent un lien entre le système neuro-endocrinien central et le système entérique. En effet, les cellules entéro-endocrines sécrètent de nombreux régulateurs hormonaux des fonctions digestives (38, 39). Dans certaines conditions, ces neuromédiateurs sont sécrétés dans la lamina propria, où ils agissent aussi bien sur les populations cellulaires locales que sur d’autres organes par diffusion dans le sang. Il a été suggéré que le nombre de cellules entéro-endocrines est augmenté dans les maladies intestinales comme la colite ulcéreuse (40, 41).
1.1.3.2 Les jonctions épithéliales
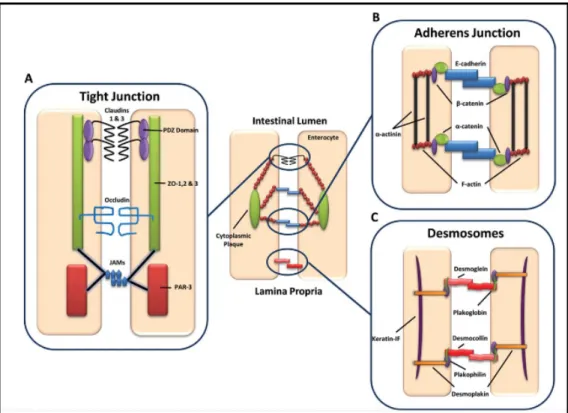
Afin de se défendre contre les agressions provenant de la lumière intestinale, l’épithélium joue le rôle d’une barrière physique étanche qui est assurée par la présence des jonctions très cohésives entre les cellules épithéliales. La présence de ces jonctions confère à l’épithélium la possibilité de se charger du transport vectoriel, à la fois sécrétoire et absorbant, modulant ainsi la perméabilité de la muqueuse intestinale (42). En effet, la voie d’absorption majeure est para-cellulaire dont la vitesse dépend des jonctions présentes entre les cellules épithéliales (43, 44).
Les jonctions intercellulaires établies entre les cellules épithéliales sont de trois types majeurs : les desmosomes, les jonctions adhérentes (JA) et les jonctions serrées (TJ : « Tight
junction ») (45) (Figure 1-4). L’hétérogénéité de ces jonctions assure la polarité des cellules
épithéliales, la communication intercellulaire et la régulation de la perméabilité épithéliale (46, 47).
9
Figure 1-4. Représentation schématique de la composition de la barrière intestinale en jonctions. Adapté de Henderson P et al. (45).
1.2 Le microbiote intestinal
Le tractus gastro-intestinal supérieur, englobant l’estomac, le duodénum, le jéjunum et l’iléon supérieur, héberge une microflore éparse composée en grande partie de 105 d’espèces bactériennes facultatives et anaérobies (48). Le microbiote intestinal a une distribution longitudinale et transversale spécifique qui est remarquablement stable. Ces organismes permettent l’absorption des aliments diététiques. L’iléon inférieur montre une augmentation des agents microbiens jusqu’à 107. Il s’agit d’une zone de translation entre la flore éparse de l’intestin supérieur et les populations luxuriantes du côlon.
Le côlon est un écosystème complexe avec une concentration élevée de micro-organismes (1014) et une grande variété d’espèces (49-51). Cette quantité de bactéries dans la lumière intestinale est en contact direct avec la couche de mucus qui couvre l’épithélium. La plupart des bactéries qui constituent le microbiote résident de l’intestin sont des organismes commensaux qui, par définition, coexistent avec les cellules épithéliales
10
intestinales (CEI) et se nourrissent des composés non assimilables par les cellules de l’organisme. D’autre part, la flore intestinale protège l’hôte contre le développement et l’invasion des pathogènes (52).
L’épithélium intestinal doit maintenir une hypo-sensibilité vis-à-vis des bactéries commensales qui sont constamment présentes dans la lumière (53). Il a été démontré que les bactéries commensales et leurs constituants non pathogènes peuvent directement désactiver les voies de signalisation pro-inflammatoires afin de maintenir l’homéostasie mucosale et prévenir les réponses inflammatoires excessives (54, 55). Néanmoins, l’agent pathogène est capable de détourner la barrière chimique intestinale sans la lésion de l’épithélium pour faire face ensuite à différents mécanismes de transport dont l’endocytose médiée par des récepteurs spécifiques, l’endocytose non sélective assurée par les cellules M, le passage direct des membranes cellulaires et le passage à travers les jonctions intercellulaires (56-58). Ces derniers sont assurés par la cellule épithéliale intestinale. Au terme de ces processus, le pathogène est éliminé par les cellules immunitaires tels que les macrophages et les cellules dendritiques (CD) évitant ainsi le déclenchement d’une inflammation et assurant le retour à l’homéostasie.
Outre les mécanismes cités ci-dessus, les bactéries pathogènes peuvent envahir directement la muqueuse épithéliale intestinale et produire des toxines qui endommagent les cellules épithéliales. Elles sont également capables de libérer directement leurs constituants toxiques ou pro-inflammatoires tels que les motifs moléculaires associés aux pathogènes (PAMP : « pathogen associated molecular pattern ») à la surface apicale intestinale (59). La communication de ces agents pathogènes avec les cellules épithéliales est assurée par un système de reconnaissance spécifique constitué par des récepteurs présents à la surface des cellules intestinales épithéliales appelés les récepteurs de reconnaissance de motifs moléculaires (PRR : « Pattern Recognition Receptors ») (60, 61).
Cependant, le transport excessif d’antigènes bactériens à travers l’épithélium intestinal peut prédisposer à des réactions immunologiques menant à un certain nombre de maladies gastro-intestinales. Cette partie sera discutée dans les prochains paragraphes.
11
1.3 Les récepteurs de type Toll (TLR)
La famille des récepteurs PRR comprend les récepteurs de type Toll (TLR) (62), les récepteurs de type NOD (NLR) (63) et les récepteurs de type RIG (RLR) (64). Ces récepteurs offrent des voies distinctes pour la reconnaissance de ligands microbiens ou de signaux endogènes associés aux pathogènes (59, 65).
Les récepteurs TLR sont exprimés à la surface apicale des CEI face à la lumière gastro-intestinale et à la face basolatérale des CEI polarisées (62). Leur activation induit la sécrétion des cytokines pro-inflammatoires et des chimiokines (66). D’autre part, la signalisation induite suite à l’activation des récepteurs TLR déclenche les mécanismes de la défense innée (61, 67, 68).
Le génome humain contient 10 récepteurs TLR qui diffèrent selon leurs localisations et leurs agonistes. Les récepteurs TLR1/2 (dont l’agoniste est Pam3CSK4) et TLR4 (lipopolysaccharide : LPS) sont présents à la face apicale des CEI différenciées. Leur rôle est de contrôler l’interaction des CEI avec le contenu de la lumière intestinale (62, 67). En revanche, le TLR5 (la flagelline bactérienne) semble être préférentiellement exprimé au niveau du pôle basolatérale (69, 70) alors que le TLR3 (l’ARN double brins) est principalement intracellulaire (71, 72). Le TLR9 est activé par l’ADN bactérien contenant les groupements CpG non-méthylés (73-75). Les cellules non-différenciées ne montrent pas de polarisation apicale, d’où l’absence des récepteurs TLR à leur surface suggérant ainsi que l’expression de ces récepteurs est dépendante de la différenciation des cellules (71). L’expression des récepteurs TLR par les cellules épithéliales intestinales peut être dynamiquement influencée par la présence de leurs ligands spécifiques. Par exemple, le lipopolysaccharide augmente l’expression du récepteur TLR4 et induit sa redistribution de la face apicale vers les compartiments intra-cytoplasmiques près de la membrane basolatérale (60, 76).
12
1.4 Rôle immunitaire des cellules épithéliales
En plus de recevoir des signaux provenant de bactéries commensales et de sécréter du mucus et des substances antimicrobiennes dans la lumière, les cellules épithéliales modulent également la réponse immunitaire (66, 77). Les CEI, agissant comme des cellules présentatrices d’antigène (APC), sont capables de sécréter des cytokines et des chimiokines du côté basolatéral (78), ce qui induit le recrutement et l’activation des cellules immunitaires vers la muqueuse (43, 79). Cet aspect immuno-physiologique est dû à la localisation des CEI à l’interface entre la plus grande charge antigénique du corps (la lumière intestinale) et la plus grande population des leucocytes présents dans la lamina propria intestinale (79).
En plus de l’expression constitutive des molécules classiques de classe I et II du complexe majeur d’histocompatibilité (CMH) (80), les CEI expriment aussi plusieurs molécules co-stimulatrices de façon constitutive ou induite lors des conditions inflammatoires, permettant ainsi leur interaction avec les autres cellules présentatrices d’antigènes telles que les cellules dendritiques (80) et les lymphocytes intraépithéliaux présentes au niveau de l’épithélium à la face basolatérale (81, 82).
1.5 Les peptides antimicrobiens
Les cellules épithéliales intestinales, principalement les entérocytes et les cellules de Paneth, outre leur implication dans la réponse immunitaire innée, sécrètent des peptides antimicrobiens (PAM) qui participent à leur protection contre l’invasion des pathogènes (83, 84). Ces peptides renforcent également la fonction barrière de l’épithélium (43, 46, 85). En effet, l’interaction des PAM avec la couche de mucine permet la concentration de l’activité antimicrobienne à la surface apicale de l’épithélium (85, 86). Ainsi, les fonctions combinées des CEI semblent limiter la quantité et la diversité des bactéries vivantes qui peuvent atteindre la surface épithéliale et interagir avec le système immunitaire sous-jacent de la muqueuse (87).
Certains peptides antimicrobiens sont exprimés et libérés de façon constitutive, d’autres sont induits après l’exposition de la cellule à un agent pathogène. Il existe aussi d’autres
13
peptides antimicrobiens qui sont accumulés dans des granules sécrétoires pour être libérés ultérieurement par exocytose (32, 83, 88).
1.6 Les maladies inflammatoires de l’intestin
1.6.1 Définition et épidémiologie 1.6.1.1 Définition
Les maladies inflammatoires de l’intestin (MII) sont connues sous la forme de deux troubles majeurs, la maladie de Crohn (MC) et la rectocolite hémorragique (RCH) (connue aussi sous le nom de la colite ulcéreuse : CU), qui diffèrent selon leur aspect clinique et morphologique. Ces maladies se manifestent par des réponses immunitaires mal régulées contre une inflammation d’étiologie inconnuesuivie par des phases de rémission. De plus, la durée et la sévérité des crises varient entre les patients (89-91).
Ces deux pathologies ne sont pas des maladies mortelles, mais, parfois chroniques, peuvent nuire à la vie quotidienne. Elles touchent différemment le tube digestif : la rectocolite hémorragique est typiquement une maladie mucosale qui se manifeste exclusivement au niveau du colon et du rectum (92) alors que la maladie de Crohn touche tout le tube digestif avec une affection plus particulière à la région iléo-cæcale. Cette dernière se manifeste par une inflammation chronique avec la présence d’agrégats lymphoïdes transmuraux (91, 93).
1.6.1.2 Épidémiologie
Au cours des dernières décennies, l’incidence des deux phénotypes des MII a profondément changé. Les incidences les plus élevées des deux pathologies ont été notées en Europe du Nord (94-96) et en Amérique du Nord (97-99). Plusieurs études ont suggéré que le risque des MII est lié au développement socio-économique et à l’industrialisation (97, 98, 100). Aujourd’hui, en moyenne, une personne parmi 250 souffre de MII durant sa vie (MC : 1/670 ; RCH : 1/330) (95). Dans les pays industrialisés et à revenu élevé, l’incidence des MII est comparable à celle de la polyarthrite rhumatoïde, le diabète de type I et la sclérose en plaques (101). La MC et la RCH apparaissent chez les deux sexes à partir de l’âge de 15 ans avec des fréquences différentes (99, 102, 103).
14
Dans les sociétés occidentales, l’augmentation du nombre de cas des individus atteints des maladies chroniques semble être liée à des changements dans le style de vie (moins d’exposition au sol et aux animaux, aux polluants et aux antibiotiques) qui a un impact profond sur l’immunité intestinale ainsi que le microbiome (104).
1.6.2 Symptômes
L’apparition des MII se caractérise par un développement progressif et insidieux d’affections chroniques telles qu’une diarrhée épisodique, des douleurs abdominales coliques accompagnées de crampes, la perte de poids et la présence de sang dans les selles.
Les premiers symptômes de la maladie de Crohn peuvent se manifester sous forme de complication gastro-intestinale telle que l’obstruction, la perforation, l’abcès, l’hémorragie ou la péritonite avec une apparition progressive des selles molles. Ceci peut aboutir à une atteinte péri-anale ce qui cause la perte de la rigidité du sphincter anal et à la formation de fistule et d’abcès périrectal. Des carences en vitamines liposolubles et une perte importante de protéines peuvent se produire, ce qui conduit ensuite à la formation d’un œdème. Bien que pratiquement tous les patients atteints de la maladie de Crohn souffrent dès le début de la maladie de la diarrhée et des douleurs abdominales, les saignements ne se produisent que chez la moitié des patients. La perte de poids est également une caractéristique commune et est généralement aux alentours de 10 à 20 % du poids corporel (105, 106).
La rectocolite ulcéreuse est caractérisée par une inflammation aiguë qui peut s’aggraver rapidement et se transforme en une atteinte chronique. Elle se manifeste par des diarrhées sanglantes apparaissant les premiers jours, accompagnées de crampes abdominales et suivies de phases de rémission. L’atteinte rectale est évoquée aussi dans cette maladie entraînant parfois la constipation. Plus le côlon est endommagé, plus les symptômes systémiques sont probables. Lors d’une attaque aiguë, les symptômes dépendent aussi de l’étendue et de la gravité de l’atteinte colique. La fièvre, la déshydratation et l’hypotension apparaissent à un stade avancé et sévère de la maladie (107, 108).
Malheureusement, pour les deux atteintes, un laps de temps significatif peut s’écouler entre l’apparition des premiers symptômes et le diagnostic définitif. Seulement 40 % des
15
patients sont diagnostiqués après la première année de l’apparition des symptômes de la maladie (109).
Les manifestations extradigestives ou extra-intestinales, aussi bien pour la MC que pour la RCH, ont un impact clinique majeur et peuvent aboutir à la perte de certains organes touchés tels que les yeux et le foie (106, 110). Elles sont souvent dues à la circulation de complexes immuns (formés suite à l’interaction entre certaines bactéries infiltrées dans l’intestin et les auto-anticorps formés par le corps) et leur dépôt sur les tissus (111-113). Ces symptômes incluent des troubles articulaires et osseux (114-116), cutanés (116-118), oculaires (119, 120), hépatiques (121-123) et thromboemboliques (111, 124). Toutefois, la fréquence et l’intensité des douleurs peuvent nuire à la qualité de vie.
1.6.3 Étiologie des maladies inflammatoires de l’intestin
En dépit des études sur les maladies inflammatoires de l’intestin soient en progrès continu, les causes de ces maladies complexes restent, à ce jour, inconnues et mal cernées. Plusieurs études ont rapporté que ces pathologies peuvent être influencées par de multiples facteurs à savoir environnementaux et alimentaires, une prédisposition génétique, la dérégulation de la réponse immunitaire et de la flore microbienne (125-127) d’où la définition des MII comme étant des maladies multifactorielles polygéniques.
De nombreux facteurs de risque environnementaux ont été identifiés dans la physiopathologie des MII (128) tels que le régime alimentaire (129), l’hygiène, le stress et le tabagisme (130, 131).
Les études génétiques basées sur l’analyse de polymorphisme et l’association des gènes ont montré que la prédisposition héréditaire augmente les fréquences des MII. En effet, les risques des MC et RCH augmentent respectivement de 30 et 10 fois quand le patient a déjà un membre de sa famille atteint de l’une de ces pathologies (132-135). Les premières analyses du génome humain ont identifié 3 polymorphismes sur le gène NOD2 qui sont associés à la maladie de Crohn (136). Ce dernier a été, dès lors, considéré comme le premier gène candidat pour la maladie de Crohn. Les avancées académiques dans les études d’association du génome entier (GWAS : « Genome-wide association study ») ont révélé
16
ensuite environ 217 gènes de prédisposition aux MII impliqués notamment dans la réponse immunitaire innée ou adaptative. Il faut bien noter que la contribution génétique à l’étiopathogénie des MII est limitée à 50 % pour la MC et à 25 % pour la RCH (137, 138).
Le microbiote joue un rôle important dans les fonctions intestinales principalement le métabolisme des nutriments digérés. Outre sa fonction digestive, le microbiote a des répercussions souvent bénéfiques pour l’hôte tel que son rôle barrière contre la colonisation des pathogènes, le développement et la maturation du système immunitaire intestinal (139). En revanche, une perte de la tolérance du système immunitaire intestinale envers les bactéries commensales induit une dysbiose intestinale entraînant ainsi le développement des MII. Pendant de nombreuses années, plusieurs études ont démontré le rôle possible des microbes commensaux dans l’initiation de maladies inflammatoires de l’intestin (91, 140, 141). Des traitements aux antibiotiques et probiotiques ont été envisagés pour les MII et ont abouti dans certains cas à l’amélioration de l’état de santé des patients (142-145).
1.6.4 La pathogenèse des MII
L’épithélium intestinal est une barrière importante contre l’invasion des populations
bactériennes présentes dans la lumière intestinale. Cependant, en conditions inflammatoires, la fonction des jonctions serrées est perturbée (146, 147). La défaillance de la barrière physique et biochimique induit le déclenchement d’une réponse inflammatoire qui entraîne souvent une lésion épithéliale continue et provoque des érosions et des ulcérations (36, 148-150). À ce stade, les cellules épithéliales intestinales expriment divers types de récepteurs tels que les PRR. L’activation de ces récepteurs conditionnent les cellules immunitaires à induire des mécanismes de tolérance afin de maintenir l’homéostasie intestinale (45, 107, 108, 151-153). À leur tour, les CEI se transforment en cellules fortement pro-inflammatoires et libèrent de nombreux médiateurs pro-inflammatoires tels que les chimiokines, les cytokines, les nucléotides extracellulaires et les médiateurs lipidiques (43, 148, 154, 155). Ces molécules sont responsables du recrutement des cellules immunitaires de la réponse innée, dont les neutrophiles, à la surface épithéliale. Ces dernières transmigrent, à travers l’épithélium, vers la lumière intestinale afin de neutraliser les pathogènes (156). Les
17
neutrophiles sont capables d’induire le transport ionique épithéliale et la sécrétion de chlorure par les CEI qui constituent la force motrice du déclenchement de la diarrhée (157). En effet, les neutrophiles activés sécrètent de l'adénosine monophosphate (AMP) qui est régulée par l’ectonucléotidase CD73 exprimée dans les cellules épithéliales. Suite à la conversion de l’AMP en adénosine par la CD73, l’adénosine active son récepteur A2b exprimé par les CEI ce qui induit la sécrétion du chlorure. En cas où l'inflammation intestinale aiguë s'aggrave, de grandes quantités de neutrophiles activés s'accumulent dans les cryptes épithéliales du côlon et favorisent la formation d'abcès cryptiques, ce qui cause des dommages au niveau des cryptes (158).
En cas d’insuffisance de mécanismes de défense immunitaire innée envers les pathogènes, la génération d’une réponse immunitaire adaptative cellulaire (avec les lymphocytes T) et humorale (avec les lymphocytes B) ne se manifeste que quelques jours après l’invasion des agents pathogènes (139, 159). Les lymphocytes T, différenciées en plusieurs sous-populations, sécrètent à leur tour une panoplie de cytokines pro - ou anti-inflammatoires d’où leur rôle crucial dans la modulation de l’inflammation (107, 160, 161). Une réponse immunitaire orchestrée par les lymphocytes de type Th17/Th1 induit la sécrétion des cytokines pro-inflammatoires telles que le facteur nécrosant de tumeurs (TNF-a), l’interféron gamma (IFN-g) et l’IL-1b. D’autre part, les lymphocytes T régulatrices (Treg) sécrètent les cytokines anti-inflammatoires telles que l’IL-10 et TGF-b dont le rôle est de freiner la réponse des lymphocytes Th1 (162-164). Ainsi, les Treg sont capables de réguler la réponse immunitaire et de favoriser la réparation tardive de l’épithélium (165).
1.7 Les modèles animaux d’étude des maladies inflammatoires de
l’intestin
1.7.1 Généralités
L’obscure étiologie des MII a abouti à de nombreuses tentatives de développer des modèles expérimentaux afin d’étudier ces maladies. Un modèle expérimental qui mime la pathologie chez l’humain permettrait grandement l’étude de l’épidémiologie, des divers agents étiologiques, des mécanismes immunitaires, de l’évolution de l’inflammation
18
mucosale et transmurale et des diverses formes des traitements disponibles (91, 166, 167). Ces modèles se répartissent en quatre catégories principales et chacune offre la possibilité d’étudier la maladie sous différents aspects.
La première catégorie consiste en l’étude de la colite expérimentale où l’inflammation de la muqueuse se développe spontanément. Ces modèles offrent la meilleure possibilité de définir des facteurs génétiques prédisposant à l’inflammation de la muqueuse. La deuxième catégorie implique l’étude de l’inflammation induite par un agent exogène qui déclenche une réponse immunitaire (168). La troisième catégorie de modèles expérimentaux englobe l’utilisation des animaux modifiés génétiquement par l’insertion ou la délétion d’un gène en particulier. La dernière catégorie comprend des « modèles de transfert » dans lesquels l’inflammation est induite par le transfert de populations cellulaires particulières vers un hôte « neutre » dépourvu de tissus lymphoïdes, par exemple des souris immunodéficientes (Scid
-/- « severe combined immunodeficient mice » ou Rag -/- « Recombination-activating gene
deficient mice ») (169).
Dans ma thèse, je m’intéresse à l’utilisation d’un modèle animal qui mime la colite ulcéreuse induite de façon chimique soit le modèle induit par le dextran sodium sulfate (DSS).
1.7.2 Le modèle de dextran sodium sulfate (DSS)
Le modèle de colite induite par le dextran sodium sulfate est un modèle bien établi utilisé dans l’étude de la pathogenèse des MII (170-173) et des études précliniques (168). Ce modèle présente des avantages par rapport à d’autres modèles animaux de la colite. Par exemple, il s’agit d’un modèle qui mime l’inflammation aiguë ou chronique et peut être produit facilement en modifiant la concentration de DSS administré ainsi que le cycle d’administration. En outre, plusieurs études ont validé la pertinence du modèle de DSS en utilisant différents agents thérapeutiques utilisés chez les patients atteints des maladies intestinales (174).
Le DSS est un polysaccharide sulfaté capable de provoquer la perturbation de l’intégrité de la barrière épithéliale, ce qui augmente la perméabilité de la muqueuse colique
19
et favorise le passage du contenu de la lumière intestinale à travers l’épithélium intestinal, induisant ainsi une réponse immunitaire au niveau de la lamina propria. Les premiers changements liés au traitement avec le DSS, observés à partir du 3e jour de traitement, sont la perte de l’expression des jonctions serrées (175-177), l’augmentation significative de l’expression des cytokines pro-inflammatoires dans le côlon et l’infiltration accrue des cellules inflammatoires (178).
Plusieurs études ont proposé que la colite induite par le DSS était un modèle indépendant des lymphocytes T, car cette pathologie a été observée chez des souris immunodéficientes combinées sévères (SCID) dépourvues de lymphocytes T et B (170, 173) ce qui suggère que le développement de la colite dépend de l'activation des macrophages. Cependant, d'autres rapports ont montré que la colite induite par le DSS était plus grave chez les souris déficientes en lymphocytes T et B (173, 176) proposant que la régulation de la réponse immunitaire par les lymphocytes T régulateurs pourrait être essentielle au développement de la colite induite par ce modèle. Ainsi, les réponses des macrophages et des cellules T, en particulier la réponse Th1, jouent un rôle central dans le processus de la maladie.
1.8 La signalisation purinergique
Les interactions entre les cellules de l’organisme sont assurées par le biais de molécules qualifiées de « médiateurs biologiques » dont les nucléotides. Ces derniers sont impliqués dans plusieurs fonctions, y compris la biosynthèse des acides nucléiques, la production d’énergie pour le fonctionnement des cellules, la respiration cellulaire et l’activation des voies de signalisation.
L’existence d’une signalisation par l’intermédiaire des nucléotides à la surface des cellules dans le milieu extracellulaire se confirme de plus en plus, suite à l’identification de plusieurs récepteurs qui sont activés par les nucléotides ainsi que des enzymes qui les hydrolysent. Une faible concentration des nucléotides est physiologiquement présente dans les fluides interstitiels, mais elle peut subir des variations rapides, en fonction de la demande métabolique tissulaire et des pathologies (5, 179, 180). En conséquence, les nucléotides